Zestoretic 5/12.5g/mg Lisinopril Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Zestoretic on ja miten sitä käytetään?
Zestoretic on reseptilääke, jota käytetään verenpainetaudin (korkean verenpaineen) ja nesteretention oireiden hoitoon. Zestoretic 5mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Ei tiedetä, onko Zestoretic 5 mg turvallinen ja tehokas lapsille.
Mitkä ovat Zestoretic 5mg:n mahdolliset sivuvaikutukset?
Zestoretic voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- huima olo,
- silmäkipu tai näköhäiriöt,
- vähän tai ei ollenkaan virtsaamista,
- heikkous,
- uneliaisuus,
- levoton olo,
- kuume ,
- vilunväristykset,
- kipeä kurkku,
- suun haavaumat,
- nielemisvaikeuksia,
- ihon ja silmien keltaisuus (keltatauti),
- pahoinvointi,
- oksentelua,
- kihelmöivä tunne,
- rintakipu,
- epäsäännölliset sydämenlyönnit tai lepatus rinnassa,
- liikkeen menetys,
- jalkakrampit,
- ummetus,
- äärimmäinen jano,
- lisääntynyt virtsaaminen,
- tunnottomuus tai pistely,
- lihas heikkous,
- päänsärky,
- menetys tai koordinaatio, ja
- epävakaa olo
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Zestoreticin yleisimmät sivuvaikutukset ovat:
- yskä
- päänsärky
- huimaus
- väsynyt olo
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikki Zestoreticin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
SIKIÖN MYRKYLLISYYS
- Kun raskaus havaitaan, lopeta ZESTORETIC-hoito mahdollisimman pian.
- Lääkkeet, jotka vaikuttavat suoraan reniini-angiotensiinijärjestelmään, voivat aiheuttaa vammoja ja kuoleman kehittyvälle sikiölle. Katso VAROITUKSET Sikiön toksisuus.
KUVAUS
ZESTORETIC® (lisinopriili ja hydroklooritiatsidi) yhdistää angiotensiinia konvertoivan entsyymin estäjän, lisinopriilin, ja diureetin, hydroklooritiatsidin.
Lisinopriili, synteettinen peptidijohdannainen, on suun kautta otettava pitkävaikutteinen angiotensiinikonvertaasin estäjä. Sitä kuvataan kemiallisesti (S)-1-[N2-(1-karboksi-3-fenyylipropyyli)-L-lysyyli]-L-proliinidihydraattina. Sen empiirinen kaava on C21H31N3O5. 2H2O ja sen rakennekaava on:
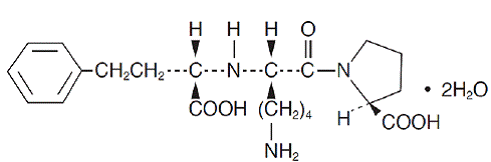
Lisinopriili on valkoinen tai luonnonvalkoinen, kiteinen jauhe, jonka molekyylipaino on 441,53. Se liukenee veteen, liukenee niukasti metanoliin ja käytännössä liukenematon etanoliin.
Hydroklooritiatsidi on 6-kloori-3,4-dihydro-2H-1,2,4-bentsotiadiatsiini-7-sulfonamidi-1,1-dioksidi. Sen empiirinen kaava on C7H8ClN3O4S2 ja sen rakennekaava on:
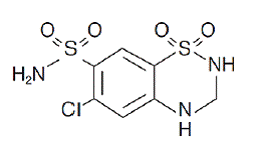
Hydroklooritiatsidi on valkoinen tai käytännöllisesti katsoen valkoinen kiteinen jauhe, jonka molekyylipaino on 297,72 ja joka liukenee heikosti veteen, mutta liukenee vapaasti natriumhydroksidiliuokseen.
ZESTORETIC 5 mg on saatavana suun kautta käytettäväksi kolmessa lisinopriilin ja hydroklooritiatsidin tablettiyhdistelmässä: ZESTORETIC 10-12,5, joka sisältää 10 mg lisinopriilia ja 12,5 mg hydroklooritiatsidia; ZESTORETIC 20Reference 12.5, joka sisältää 20 mg lisinopriilia ja 12,5 mg hydroklooritiatsidia; ja ZESTORETIC 20-25, joka sisältää 20 mg lisinopriilia ja 25 mg hydroklooritiatsidia.
Inaktiiviset ainesosat
10-12,5 Tablettia - kalsiumfosfaatti, magnesiumstearaatti, mannitoli, punainen rautaoksidi, maissitärkkelys, keltainen rautaoksidi.
20-12,5 tablettia - kalsiumfosfaatti, magnesiumstearaatti, mannitoli, maissitärkkelys.
20-25 tablettia - kalsiumfosfaatti, magnesiumstearaatti, mannitoli, punainen rautaoksidi, maissitärkkelys, keltainen rautaoksidi.
INDIKAATIOT
ZESTORETIC on tarkoitettu verenpainetaudin hoitoon, verenpaineen alentamiseen. Verenpaineen alentaminen vähentää kuolemaan johtavien ja ei-kuolemaan johtavien sydän- ja verisuonitapahtumien, pääasiassa aivohalvausten ja sydäninfarktien, riskiä. Nämä edut on havaittu kontrolloiduissa tutkimuksissa, joissa on käytetty monia erilaisia farmakologisia lääkkeitä, mukaan lukien lisinopriili ja hydroklooritiatsidi.
Korkean verenpaineen hallinnan tulee olla osa kattavaa sydän- ja verisuoniriskin hallintaa, mukaan lukien tarvittaessa lipidien hallinta, diabeteksen hallinta, antitromboottinen hoito, tupakoinnin lopettaminen, liikunta ja rajoitettu natriumin saanti. Monet potilaat tarvitsevat enemmän kuin yhden lääkkeen verenpainetavoitteiden saavuttamiseksi. Tarkempia neuvoja tavoitteista ja hallinnasta on julkaistuissa ohjeissa, kuten kansallisen korkean verenpaineen koulutusohjelman kansallisen korkean verenpaineen ehkäisy-, havaitsemis-, arviointi- ja hoitokomitean (JNC) ohjeissa.
Lukuisten verenpainetta alentavien lääkkeiden, eri farmakologisista luokista ja eri vaikutusmekanismeista, on osoitettu satunnaistetuissa kontrolloiduissa tutkimuksissa vähentävän sydän- ja verisuonisairauksien sairastuvuutta ja kuolleisuutta, ja voidaan päätellä, että se on verenpainetta alentavaa, eikä muuta lääkettä. lääkkeet, jotka ovat suurelta osin vastuussa näistä eduista. Suurin ja johdonmukaisin kardiovaskulaarinen tulos on ollut aivohalvauksen riskin väheneminen, mutta myös sydäninfarktin ja sydän- ja verisuoniperäisen kuolleisuuden on havaittu vähenevän säännöllisesti.
Kohonnut systolinen tai diastolinen paine lisää kardiovaskulaarista riskiä, ja absoluuttinen riskin nousu mmHg:tä kohti on suurempi korkeammilla verenpaineilla, joten jopa vaatimattomasta vaikean verenpaineen alenemisesta voi olla huomattavaa hyötyä. Suhteellinen riskin pieneneminen verenpaineen laskusta on samanlainen kaikissa populaatioissa, joissa absoluuttinen riski vaihtelee, joten absoluuttinen hyöty on suurempi potilailla, joilla on suurempi riski verenpaineesta riippumatta (esimerkiksi potilaat, joilla on diabetes tai hyperlipidemia), ja tällaisia potilaita odotetaan olevan hyötyä aggressiivisemmasta hoidosta alhaisemman verenpainetavoitteen saavuttamiseksi.
Joillakin verenpainelääkkeillä on pienemmät verenpainevaikutukset (monoterapiana) mustaihoisilla potilailla, ja monilla verenpainelääkkeillä on muita hyväksyttyjä käyttöaiheita ja vaikutuksia (esim. angina pectoris, sydämen vajaatoiminta tai diabeettinen munuaissairaus). Nämä näkökohdat voivat ohjata hoidon valintaa.
Näitä kiinteäannoksisia yhdistelmiä ei ole tarkoitettu aloitushoitoon (ks ANNOSTELU JA HALLINNOINTI ).
ZESTORETIC-valmistetta käytettäessä on otettava huomioon, että angiotensiinikonvertaasientsyymin estäjä, kaptopriili, on aiheuttanut agranulosytoosia, erityisesti potilailla, joilla on munuaisten vajaatoiminta tai kollageeniverisuonitauti, ja että saatavilla olevat tiedot eivät ole riittäviä osoittamaan, ettei lisinopriililla ole samanlainen riski (katso VAROITUKSET ).
Harkittaessa ZESTORETIC mg:n käyttöä on otettava huomioon, että ACE:n estäjiin on liittynyt useammin angioedeeman esiintymistä mustaihoisilla kuin muilla potilailla (ks. VAROITUKSET , Lisinopriili ).
ANNOSTELU JA HALLINNOINTI
Lisinopriilimonoterapia on tehokas verenpaineen hoito 10–80 mg:n kerran vuorokaudessa, kun taas hydroklooritiatsidimonoterapia on tehokas annoksina 12,5–50 mg päivässä. Lisinopriilin ja hydroklooritiatsidin yhdistelmähoitoa koskevissa kliinisissä tutkimuksissa, joissa käytettiin lisinopriiliannoksia 10–80 mg ja hydroklooritiatsidia 6,25–50 mg, verenpainevaste lisääntyi yleensä jommankumman komponentin annosta suurennettaessa.
Sivuvaikutukset (ks VAROITUKSET ) ovat yleensä harvinaisia ja ilmeisesti riippumattomia annoksesta; hydroklooritiatsidin lääkkeet ovat sekoitus annoksesta riippuvia ilmiöitä (pääasiassa hypokalemia) ja annoksesta riippumattomia ilmiöitä (esim. haimatulehdus), joista ensimmäinen on paljon yleisempi kuin jälkimmäinen. Hoitoon millä tahansa lisinopriilin ja hydroklooritiatsidin yhdistelmällä voi liittyä jompaakumpaa tai molempia annoksesta riippumattomia tai annoksesta riippuvaisia sivuvaikutuksia, mutta lisinopriilin lisääminen kliinisissä tutkimuksissa heikensi diureetteilla normaalisti havaittua hypokalemiaa.
Annosriippuvaisten sivuvaikutusten minimoimiseksi on yleensä tarkoituksenmukaista aloittaa yhdistelmähoito vasta sen jälkeen, kun potilas ei ole saavuttanut haluttua vaikutusta monoterapialla.
Annoksen titraus kliinisen vaikutuksen ohjaamana
Potilas, jonka verenpainetta ei saada riittävästi hallintaan lisinopriili- tai hydroklooritiatsidimonoterapialla, voidaan vaihtaa lisinopriili/HCTZ 10/12,5- tai lisinopril/HCTZ 20/12,5 -hoitoon riippuen nykyisestä monoterapiaannoksesta. Jommankumman tai molempien komponenttien lisäkorotusten tulisi riippua kliinisestä vasteesta, jossa verenpaine mitataan annosten välillä, jotta varmistetaan riittävä verenpainetta alentava vaikutus tuolloin. Hydroklooritiatsidiannosta ei yleensä saa suurentaa ennen kuin 2-3 viikkoa on kulunut. Diureetin lisäämisen jälkeen lisinopriilin annosta voi olla mahdollista pienentää. Potilaat, joiden verenpaine saadaan riittävästi hallintaan 25 mg:lla päivittäistä hydroklooritiatsidia, mutta joilla on merkittävää kaliumin menetystä tällä hoito-ohjelmalla, voidaan saavuttaa samanlainen tai parempi verenpaineen hallinta ilman elektrolyyttihäiriöitä, jos heidät vaihdetaan lisinopriili/HCTZ 10/12,5 -valmisteeseen.
Potilailla, joita hoidetaan parhaillaan diureetilla, saattaa toisinaan esiintyä oireenmukaista hypotensiota lisinopriilin aloitusannoksen jälkeen. Diureetin käyttö tulee mahdollisuuksien mukaan lopettaa kahdeksi tai kolmeksi päiväksi ennen lisinopriilihoidon aloittamista hypotension todennäköisyyden vähentämiseksi (ks. VAROITUKSET ). Jos potilaan verenpainetta ei saada hallintaan pelkällä lisinopriililla, diureettihoitoa voidaan jatkaa.
Jos diureetin käyttöä ei voida keskeyttää, aloitusannos 5 mg lisinopriilia tulee käyttää lääkärin valvonnassa vähintään kahden tunnin ajan ja kunnes verenpaine on tasaantunut vähintään tunnin ajan (ks. VAROITUKSET ja VAROTOIMENPITEET , HUUMEIDEN VUOROVAIKUTUKSET ).
ZESTORETICin samanaikainen käyttö kaliumlisien, kaliumsuolankorvikkeiden tai kaliumia säästävien diureettien kanssa voi johtaa seerumin kaliumpitoisuuden nousuun (ks. VAROTOIMENPITEET ).
Korvausterapia
Yhdistelmällä voidaan korvata titratut yksittäiset komponentit.
Käyttö munuaisten vajaatoiminnassa
Lisinopriili/HCTZ-hoito-ohjelmissa ei tarvitse ottaa huomioon munuaisten toimintaa niin kauan kuin potilaan kreatiniinipuhdistuma on >30 ml/min/1,7 m2 (seerumin kreatiniini noin ≤3 mg/dl tai 265 μmol/l). Potilailla, joilla on vaikeampi munuaisten vajaatoiminta, loop-diureetit ovat parempia kuin tiatsidit, joten lisinopriili/HCTZ-valmistetta ei suositella (ks. VAROITUKSET , Anafylaktoidireaktiot kalvoaltistuksen aikana ).
MITEN TOIMITETAAN
ZESTORETIC 10-12,5 tabletit: Persikanväriset, pyöreät, kaksoiskuperat, päällystämättömät tabletit, joiden toiselle puolelle on kaiverrettu "141" ja toiselle puolelle "ZESTORETIC", toimitetaan 90 tabletin pulloissa ( NDC 52427-435-90) ja 100 tabletin pullot ( NDC 52427-435-01).
ZESTORETIC 20-12,5 tablettia : Valkoiset, pyöreät, kaksoiskuperat, päällystämättömät tabletit, joiden toiselle puolelle on kaiverrettu "142" ja toiselle puolelle "ZESTORETIC", toimitetaan 90 tabletin pulloissa ( NDC 52427-436-90) ja 100 tabletin pullot ( NDC 52427-436-01).
ZESTORETIC 20-25 tablettia Persikanväriset, pyöreät, kaksoiskuperat, päällystämättömät tabletit, joiden toiselle puolelle on kaiverrettu "145" ja toiselle puolelle "ZESTORETIC", toimitetaan 90 tabletin pulloissa ( NDC 52427-43790) ja 100 tabletin pullot ( NDC 52427-437-01).
Varastointi
Säilytä kontrolloidussa huoneenlämmössä, 20-25 °C (68-77 °F) [katso USP]. Suojaa liialliselta valolta ja kosteudelta.
Jakelija: Almatica Pharma, Inc. Pine Brook, NJ 07058 USA. Tarkistettu: heinäkuuta 2017.
SIVUVAIKUTUKSET
ZESTORETIC 12,5 mg:n turvallisuutta on arvioitu 930 potilaalla, mukaan lukien 100 potilasta, joita hoidettiin 50 viikkoa tai kauemmin.
ZESTORETIC-valmisteella tehdyissä kliinisissä tutkimuksissa ei ole havaittu tälle yhdistelmälääkkeelle ominaisia haittavaikutuksia. Haittakokemukset ovat rajoittuneet niihin, joita on raportoitu aiemmin lisinopriilin tai hydroklooritiatsidin yhteydessä.
Yleisimmät kliiniset haittavaikutukset kontrolloiduissa tutkimuksissa (mukaan lukien avoimet jatkotutkimukset) millä tahansa lisinopriilin ja hydroklooritiatsidin yhdistelmällä olivat: huimaus (7,5 %), päänsärky (5,2 %), yskä (3,9 %), väsymys (3,7 %) ja ortostaattiset vaikutukset (3,2 %), jotka kaikki olivat yleisempiä kuin lumelääkettä saaneilla potilailla. Yleensä haitalliset kokemukset olivat luonteeltaan lieviä ja ohimeneviä, mutta katso VAROITUKSET angioedeeman ja liiallisen hypotension tai pyörtymisen suhteen. Hoidon lopettaminen haittavaikutusten vuoksi joutui 4,4 %:lla potilaista pääasiassa huimauksen, yskän, väsymyksen ja lihaskrampin vuoksi.
Haittakokemukset, joita esiintyi yli yhdellä prosentilla potilaista, joita hoidettiin kontrolloiduissa kliinisissä tutkimuksissa lisinopriililla ja hydroklooritiatsidilla, on esitetty alla.
Prosenttiosuus kontrolloiduissa tutkimuksissa olevista potilaista
Kliiniset haittavaikutukset, joita esiintyi 0,3–1,0 %:lla potilaista kontrolloiduissa tutkimuksissa, sekä harvinaisemmat, vakavat, mahdollisesti lääkkeeseen liittyvät tapahtumat, jotka on raportoitu markkinointikokemuksessa, on lueteltu alla:
Keho kokonaisuutena: Rintakipu, vatsakipu, pyörtyminen, epämukavuus rinnassa, kuume, trauma, virusinfektio. Sydän: Sydämentykytys, ortostaattinen hypotensio. Ruoansulatus: Ruoansulatuskanavan kouristukset, suun kuivuminen, ummetus, närästys. Tuki- ja liikuntaelimistö: Selkäkipu, olkapääkipu, polvikipu, selkäkipu, lihaskipu, jalkakipu. Hermosto/psykiatrinen: Vähentynyt libido, huimaus, masennus, uneliaisuus. Hengitys: Nuhakuume, nenän tukkoisuus, influenssa, keuhkoputkentulehdus, nielukipu, hengenahdistus, keuhkojen tukkoisuus, krooninen poskiontelotulehdus, allerginen nuha, nielun epämukavuus. Iho: Punoitus, kutina, ihotulehdus, hikoilu, ihon pseudolymfooma. Erityiset aistit: Näön hämärtyminen, tinnitus, otalgia. Urogenitaaliset: Virtsatieinfektio.
Angioedeema: Kasvojen, raajojen, huulten, kielen, äänihuulen ja/tai kurkunpään angioedeemaa on raportoitu (ks. VAROITUKSET ).
Harvinaisissa tapauksissa suolen angioedeemaa on raportoitu markkinoille tulon jälkeen.
Hypotensio: Kliinisissä tutkimuksissa hypotensioon liittyviä haittavaikutuksia esiintyi seuraavasti: hypotensio (1,4 %), ortostaattinen hypotensio (0,5 %), muut ortostaattiset vaikutukset (3,2 %). Lisäksi pyörtymistä esiintyi 0,8 %:lla potilaista (ks VAROITUKSET ).
Yskä: Katso VAROTOIMENPITEET - Yskä .
Kliiniset laboratoriotutkimukset
Seerumin elektrolyytit
(Katso VAROTOIMENPITEET ).
Kreatiniini, veren ureatyppi
Veren ureatypen ja seerumin kreatiniinin vähäistä palautuvaa nousua havaittiin potilailla, joilla oli essentiaalinen hypertensio ja joita hoidettiin ZESTORETIC-valmisteella. Merkittävämpää lisääntymistä on myös raportoitu, ja niitä esiintyi todennäköisemmin potilailla, joilla on munuaisvaltimon ahtauma (ks. VAROTOIMENPITEET ).
Seerumin virtsahappo, glukoosi, magnesium, kolesteroli, triglyseridit ja kalsium
(Katso VAROTOIMENPITEET ).
Hemoglobiini ja hematokriitti
Hemoglobiinin ja hematokriitin pientä laskua (keskimääräinen lasku noin 0,5 g % ja hematokriitti 1,5 tilavuusprosenttia) esiintyi usein hypertensiivisillä potilailla, joita hoidettiin ZESTORETIC 5 mg:lla, mutta niillä oli harvoin kliinistä merkitystä, ellei samanaikaisesti esiintynyt muuta anemian syytä. Kliinisissä tutkimuksissa 0,4 % potilaista keskeytti hoidon anemian vuoksi.
Maksan toimintatestit
Maksaentsyymiarvojen ja/tai seerumin bilirubiinin nousua on esiintynyt harvoin. (Katso VAROITUKSET , Maksan vajaatoiminta ).
Muut yksittäisten komponenttien yhteydessä raportoidut haittavaikutukset on lueteltu alla:
Lisinopriili
Kliinisissä tutkimuksissa haittavaikutuksia, joita esiintyi lisinopriilin yhteydessä, havaittiin myös ZESTORETIC-valmisteen yhteydessä. Lisäksi, ja koska lisinopriilia on markkinoitu, seuraavia haittavaikutuksia on raportoitu lisinopriilin yhteydessä, ja niitä tulee pitää mahdollisina ZESTORETIC-valmisteen haittavaikutuksina: Keho kokonaisuutena: Anafylaktoidiset reaktiot (ks VAROITUKSET , Anafylaktoidireaktiot kalvoaltistuksen aikana ), huonovointisuus, turvotus, kasvojen turvotus, kipu, lantion kipu, kylkikipu, vilunväristykset; Sydän: Sydämenpysähdys, sydäninfarkti tai aivoverenkiertohäiriö, mahdollisesti toissijaisena liiallisesta hypotensiosta suuren riskin potilailla (ks. VAROITUKSET , Hypotensio ), keuhkoembolia ja -infarkti, sydämen vajaatoiminnan paheneminen, rytmihäiriöt (mukaan lukien takykardia, kammiotakykardia, eteistakykardia, eteisvärinä, bradykardia ja ennenaikaiset kammioiden supistukset), angina pectoris, ohimenevät iskeemiset kohtaukset, kohtauksellinen yöllinen verenpaine, alentunut periferaalinen dysp turvotus, vaskuliitti; Ruoansulatus: Haimatulehdus, hepatiitti (hepatosellulaarinen tai kolestaattinen keltaisuus) (ks VAROITUKSET , Maksan vajaatoiminta ), gastriitti, anoreksia, ilmavaivat, lisääntynyt syljeneritys; Endokriiniset: Diabetes mellitus, epäasianmukainen antidiureettisen hormonin eritys; Hematologinen: Harvoissa tapauksissa on raportoitu luuytimen lamaa, hemolyyttistä anemiaa, leukopeniaa/neutropeniaa ja trombosytopeniaa, joissa syy-yhteyttä lisinopriiliin ei voida sulkea pois. Metabolinen: Kihti, laihtuminen, nestehukka, nesteen ylikuormitus, painonnousu; Tuki- ja liikuntaelimistö: Niveltulehdus, nivelkipu, niskakipu, lonkkakipu, nivelkipu, jalkakipu, käsivarsikipu, lumbago; Hermosto/psykiatriset: Ataksia, muistin heikkeneminen, vapina, unettomuus, aivohalvaus, hermostuneisuus, sekavuus, perifeerinen neuropatia (esim. parestesia, dysestesia), kouristukset, hypersomnia, ärtyneisyys; mielialan muutokset (mukaan lukien masennusoireet); hallusinaatiot; Hengitys: Pahanlaatuiset keuhkokasvaimet, verenvuoto, keuhkopöhö, keuhkoinfiltraatit, bronkospasmi, astma, keuhkopussin effuusio, keuhkokuume, eosinofiilinen pneumoniitti, hengityksen vinkuminen, ortopnea, kivulias hengitys, nenäverenvuoto, kurkunpäätulehdus, poskiontelotulehdus, nielutulehdus, riniitti, nielutulehdus tai nuha; Iho: Nokkosihottuma, hiustenlähtö, herpes zoster, valoherkkyys, ihovauriot, ihoinfektiot, pemfigus, eryteema, psoriaasi, harvoin muita vakavia ihoreaktioita, mukaan lukien toksinen epidermaalinen nekrolyysi ja Stevens-Johnsonin oireyhtymä (syy-yhteyttä ei ole varmistettu); Erityiset aistit: Näön menetys, diplopia, valonarkuus, makuaistin muutokset, hajuaisti; Urogenitaaliset: Akuutti munuaisten vajaatoiminta, oliguria, anuria, uremia, etenevä atsotemia, munuaisten vajaatoiminta (ks. VAROTOIMENPITEET ja ANNOSTELU JA HALLINNOINTI ), pyelonefriitti, dysuria, rintakipu.
Sekalaista
On raportoitu oireyhtymä, johon voi sisältyä positiivinen ANA, kohonnut erytrosyyttien sedimentaationopeus, nivelkipu/niveltulehdus, lihaskipu, kuume, vaskuliitti, eosinofilia ja leukosytoosi. Ihottumaa, valoherkkyyttä tai muita dermatologisia oireita voi esiintyä yksinään tai yhdessä näiden oireiden kanssa.
Hydroklooritiatsidi
Keho kokonaisuutena: Heikkous; Ruoansulatus: Anoreksia, mahalaukun ärsytys, kouristukset, keltaisuus (intrahepaattinen kolestaattinen keltaisuus) (ks. VAROITUKSET , Maksan vajaatoiminta ), haimatulehdus, sialoadeniitti, ummetus; Hematologinen: Leukopenia, agranulosytoosi, trombosytopenia, aplastinen anemia, hemolyyttinen anemia; Tuki- ja liikuntaelimistö: Lihaskouristus; Hermosto/psykiatriset: Levottomuus; Munuaiset: Munuaisten vajaatoiminta, munuaisten vajaatoiminta, interstitiaalinen nefriitti (ks VAROITUKSET ); Iho: Erythema multiforme mukaan lukien Stevens-Johnsonin oireyhtymä, eksfoliatiivinen ihotulehdus, mukaan lukien toksinen epidermaalinen nekrolyysi, hiustenlähtö; Erityiset aistit: ksanthopsia; Yliherkkyys: Purppura, valoherkkyys, nokkosihottuma, nekrotisoiva angiiitti (vaskuliitti ja ihovaskuliitti), hengitysvaikeudet mukaan lukien keuhkotulehdus ja keuhkopöhö, anafylaktiset reaktiot.
HUUMEIDEN VUOROVAIKUTUKSET
Lisinopriili
Hypotensio - Diureettihoitoa saavat potilaat
Diureetteja käyttävillä potilailla ja erityisesti niillä, joille diureettihoito on äskettäin aloitettu, saattaa toisinaan kokea liiallista verenpaineen laskua lisinopriilihoidon aloittamisen jälkeen. Lisinopriilin hypotensiivisten vaikutusten mahdollisuus voidaan minimoida joko lopettamalla diureetin käyttö tai lisäämällä suolan saantia ennen lisinopriilihoidon aloittamista. Jos diureetin käyttöä on jatkettava, aloita lisinopriilihoito 5 mg:n vuorokausiannoksella ja huolehdi tiivistä lääkärin valvonnasta aloitusannoksen jälkeen vähintään kahden tunnin ajan ja kunnes verenpaine on tasaantunut vielä vähintään tunnin ajan (ks. VAROITUKSET , ja ANNOSTELU JA HALLINNOINTI ). Kun diureetti lisätään lisinopriilia saavan potilaan hoitoon, havaitaan yleensä ylimääräinen verenpainetta alentava vaikutus (ks. ANNOSTELU JA HALLINNOINTI ).
Ei-steroidiset tulehduskipulääkkeet, mukaan lukien selektiiviset syklo-oksigenaasi-2-estäjät (COX-2-estäjät)
Iäkkäillä potilailla, joilla on nestevajaus (mukaan lukien diureettihoitoa saavat) tai heikentynyt munuaisten toiminta, tulehduskipulääkkeiden, mukaan lukien selektiiviset COX-2-estäjät, ja ACE:n estäjien, mukaan lukien lisinopriili, samanaikainen käyttö voi heikentää munuaisten toimintaa. mukaan lukien mahdollinen akuutti munuaisten vajaatoiminta. Nämä vaikutukset ovat yleensä palautuvia. Lisinopriili- ja NSAID-hoitoa saavien potilaiden munuaisten toimintaa on seurattava säännöllisesti.
Tulehduskipulääkkeet voivat heikentää ACE:n estäjien, mukaan lukien lisinopriilin, verenpainetta alentavaa vaikutusta.
Reniini-angiotensiinijärjestelmän (RAS) kaksoisesto
RAS:n kaksoissalpaus angiotensiinireseptorin salpaajilla, ACE:n estäjillä tai aliskireenilla liittyy lisääntyneeseen hypotension, hyperkalemian ja munuaisten toiminnan muutosten riskiin (mukaan lukien akuutti munuaisten vajaatoiminta) verrattuna monoterapiaan.
VA NEPHRON -tutkimukseen otettiin mukaan 1448 potilasta, joilla oli tyypin 2 diabetes, kohonnut virtsan albumiini-kreatiniinisuhde ja alentunut arvioitu glomerulussuodatusnopeus (GFR 30–89,9 ml/min). keskimäärin 2,2 vuotta. Potilaat, jotka saivat losartaanin ja lisinopriilin yhdistelmää, eivät saaneet lisähyötyä monoterapiaan verrattuna yhdistetyn päätetapahtuman eli GFR:n heikkenemisen, lopputilan munuaissairauden tai kuoleman vuoksi, mutta hyperkalemian ja akuutin munuaisvaurion ilmaantuvuus lisääntyi monoterapiaryhmään verrattuna. .
Vältä yleensä RAS-estäjien yhteiskäyttöä, seuraa tarkasti verenpainetta, munuaisten toimintaa ja elektrolyyttejä potilailla, jotka saavat ZESTORETIC-hoitoa ja muita RAS:iin vaikuttavia aineita.
Älä anna aliskireenia samanaikaisesti ZESTORETICin kanssa diabeetikoille. Vältä aliskireenin käyttöä ZESTORETIC 5 mg:n kanssa potilailla, joilla on munuaisten vajaatoiminta (GFR
Muut agentit
Lisinopriilia on käytetty samanaikaisesti nitraattien ja/tai digoksiinin kanssa ilman näyttöä kliinisesti merkittävistä haittavaikutuksista. Merkittäviä kliinisesti merkittäviä farmakokineettisiä yhteisvaikutuksia ei ilmennyt, kun lisinopriilia käytettiin samanaikaisesti propranololin, digoksiinin tai hydroklooritiatsidin kanssa. Ruoan läsnäolo mahalaukussa ei muuta lisinopriilin biologista hyötyosuutta.
Seerumin kaliumia lisäävät aineet
Lisinopriili vähentää tiatsidityyppisten diureettien aiheuttamaa kaliumhukkaa. Lisinopriilin käyttö kaliumia säästävien diureettien (esim. spironolaktonin, eplerenonin, triamtereenin tai amiloridin), kaliumlisäaineiden tai kaliumia sisältävien suolan korvikkeiden kanssa voi johtaa seerumin kaliumpitoisuuden merkittävään nousuun. Siksi, jos näiden aineiden samanaikainen käyttö on aiheellista todetun hypokalemian vuoksi, niitä tulee käyttää varoen ja seerumin kaliumpitoisuutta säännöllisesti seuraten.
Litium
Litiumtoksisuutta on raportoitu potilailla, jotka ovat saaneet litiumia samanaikaisesti natriumin eliminaatiota aiheuttavien lääkkeiden kanssa, mukaan lukien ACE:n estäjät. Litiumtoksisuus korjaantui yleensä litiumin ja ACE:n estäjän käytön lopettamisen jälkeen. On suositeltavaa, että seerumin litiumpitoisuutta seurataan usein, jos lisinopriilia annetaan samanaikaisesti litiumin kanssa.
mTOR-inhibiittorit (nisäkäsrapamysiinin kohde).
Potilailla, jotka saavat samanaikaisesti ACE-estäjää ja mTOR-estäjää (esim. temsirolimuusi, sirolimuusi, everolimuusi), voi olla suurentunut angioedeeman riski. (katso VAROITUKSET )
Neprilysiinin estäjät
Potilailla, jotka käyttävät samanaikaisesti neprilysiinin estäjiä, voi olla lisääntynyt angioedeeman riski. (katso VAROITUKSET )
Hydroklooritiatsidi
Seuraavilla lääkkeillä voi olla yhteisvaikutuksia tiatsididiureettien kanssa, kun niitä käytetään samanaikaisesti.
Alkoholi, barbituraatit tai huumeet -ortostaattinen hypotensio voi voimistua.
Diabeteslääkkeet (suun kautta otettavat lääkkeet ja insuliini) - Diabeteslääkkeen annoksen muuttaminen saattaa olla tarpeen.
Muut verenpainelääkkeet -additiivinen vaikutus tai tehostaminen.
Kolestyramiini ja kolestipolihartsit -Hydroklooritiatsidin imeytyminen heikkenee anioninvaihtohartsien läsnä ollessa. Joko kolestyramiinin tai kolestipolihartsin kerta-annokset sitovat hydroklooritiatsidin ja vähentävät sen imeytymistä maha-suolikanavasta jopa 85 % ja 43 %.
Kortikosteroidit, ACTH - tehostunut elektrolyyttivajaus, erityisesti hypokalemia.
Painetta aiheuttavat amiinit (esim. norepinefriini) - mahdollinen heikentynyt vaste paineamiineille, mutta se ei riitä estämään niiden käyttöä.
Luuston lihasrelaksantit, ei-depolarisoivat (esim. tubokurariini) - mahdollinen lisääntynyt vaste lihasrelaksantille.
Litium - Ei yleensä pidä antaa diureettien kanssa. Diureetit vähentävät litiumin munuaispuhdistumaa ja lisäävät litiumtoksisuuden riskiä. Katso litiumvalmisteiden pakkausseloste ennen tällaisten valmisteiden käyttöä ZESTORETICin kanssa.
Ei-steroidiset tulehduskipulääkkeet Joillakin potilailla ei-steroidisen tulehduskipulääkkeen antaminen voi vähentää loop-, kaliumia säästävien ja tiatsididiureettien diureettisia, natriureettisia ja verenpainetta alentavia vaikutuksia. Siksi, kun ZESTORETIC-valmistetta ja ei-steroidisia tulehduskipulääkkeitä käytetään samanaikaisesti, potilasta on tarkkailtava tarkasti sen määrittämiseksi, saavutetaanko ZESTORETIC 5 mg:n haluttu vaikutus.
Kulta
Nitritoidireaktioita (oireita ovat kasvojen punoitus, pahoinvointi, oksentelu ja hypotensio) on raportoitu harvoin potilailla, jotka ovat saaneet injektoitavaa kultaa (natriumaurotiomalaattia) ja samanaikaista ACE:n estäjähoitoa, mukaan lukien ZESTORETIC.
VAROITUKSET
Lisinopriili
Anafylaktoidi ja mahdollisesti siihen liittyvät reaktiot
Oletettavasti koska angiotensiinia konvertoivan entsyymin estäjät vaikuttavat eikosanoidien ja polypeptidien, mukaan lukien endogeenisen bradykiniinin, metaboliaan, ACE:n estäjiä (mukaan lukien ZESTORETIC) saavat potilaat voivat altistua erilaisille haittavaikutuksille, joista osa on vakavia.
Pään ja kaulan angioedeema
Kasvojen, raajojen, huulten, kielen, äänihuulen ja/tai kurkunpään angioedeemaa on raportoitu potilailla, joita on hoidettu angiotensiinikonvertaasin estäjillä, mukaan lukien lisinopriili. Tämä voi tapahtua milloin tahansa hoidon aikana. ACE:n estäjiin on liittynyt useammin angioedeeman esiintymistä mustaihoisilla kuin muilla potilailla. ZESTORETIC 12,5 g:n käyttö on lopetettava välittömästi ja asianmukaista hoitoa ja seurantaa on järjestettävä, kunnes merkit ja oireet ovat hävinneet täydellisesti ja pysyvästi. Jopa niissä tapauksissa, joissa on vain kielen turvotusta, ilman hengitysvaikeutta, potilaat saattavat tarvita pitkiä aikoja, koska antihistamiini- ja kortikosteroidihoito ei välttämättä riitä. Hyvin harvoin on raportoitu kuolemantapauksia, jotka johtuvat kurkunpään turvotukseen tai kielen turvotukseen liittyvästä angioödeemasta. Potilailla, joilla on kielen, kielen tai kurkunpään tulehdus, on todennäköisesti hengitysteiden tukkeuma, erityisesti niillä, joilla on aiemmin ollut hengitystieleikkaus. Jos kieli, äänihuuli tai kurkunpää on vaurioituneena, mikä todennäköisesti aiheuttaa hengitysteiden tukkeutumista, ihonalainen epinefriiniliuos 1:1000 (0,3 ml - 0,5 ml) ja/tai tarvittavat toimenpiteet hengitysteiden avoimien varmistamiseksi on annettava viipymättä (katso HAITTAVAIKUTUKSET) .
Potilailla, jotka saavat samanaikaisesti ACE-estäjää ja mTOR-inhibiittoria (rapamysiinin nisäkäskohde) (esim. temsirolimuusi, sirolimuusi, everolimuusi) tai neprilysiini-inhibiittorihoitoa, voi olla suurentunut angioedeeman riski (ks. VAROTOIMENPITEET ).
Suolen angioedeema
Suoliston angioedeemaa on raportoitu potilailla, joita on hoidettu ACE:n estäjillä. Näillä potilailla oli vatsakipua (pahoinvoinnin tai oksentelun kanssa tai ilman); joissakin tapauksissa kasvojen angioedeemaa ei ollut aiemmin esiintynyt ja C-1-esteraasitasot olivat normaaleja. Angioödeema diagnosoitiin toimenpiteillä, mukaan lukien vatsan TT-skannaus tai ultraääni, tai leikkauksessa, ja oireet hävisivät ACE-estäjän lopettamisen jälkeen. Suoliston angioödeema tulee sisällyttää ACE:n estäjiä käyttävien potilaiden erotusdiagnostiikkaan, jos vatsakipuja esiintyy.
Potilailla, joilla on aiemmin ollut angioedeemaa, joka ei liity ACE:n estäjähoitoon, voi olla suurentunut angioedeeman riski ACE:n estäjähoidon aikana (ks. INDIKAATIOT ja VASTA-AIHEET ).
Anafylaktoidireaktiot desensibilisoinnin aikana
Kaksi potilasta, jotka saivat herkkyyttä vähentävää hoitoa hymenoptera myrkkyllä ja saivat ACE:n estäjiä, saivat hengenvaarallisia anafylaktoidisia reaktioita.
Samoilla potilailla nämä reaktiot välttyivät, kun ACE:n estäjien käyttö keskeytettiin väliaikaisesti, mutta ne ilmaantuivat uudelleen, kun niitä vahingossa annettiin uudelleen.
Anafylaktoidireaktiot kalvoaltistuksen aikana
Tiatsideja sisältäviä yhdistelmävalmisteita ei suositella potilaille, joilla on vaikea munuaisten vajaatoiminta. Äkillisiä ja mahdollisesti hengenvaarallisia anafylaktoidisia reaktioita on raportoitu joillakin potilailla, jotka on dialysoitu korkeavirtauskalvoilla (esim. AN69®**) ja joita on hoidettu samanaikaisesti ACE:n estäjällä. Tällaisten potilaiden dialyysi on lopetettava välittömästi ja aggressiivinen hoito anafylaktoidisten reaktioiden varalta on aloitettava. Näissä tilanteissa antihistamiinit eivät ole lieventäneet oireita. Näillä potilailla on harkittava erityyppisen dialyysikalvon tai eri luokan verenpainetta alentavan aineen käyttöä. Anafylaktisia reaktioita on raportoitu myös potilailla, joille tehdään matalatiheyksisten lipoproteiinien afereesi dekstraanisulfaatin imeytyessä.
Hypotensio ja siihen liittyvät vaikutukset
Liiallista hypotensiota havaittiin harvoin komplisoitumattomilla hypertensiivisillä potilailla, mutta se on mahdollinen seuraus lisinopriilin käytöstä potilailla, joilla on suola-/volyymisvajaus, kuten potilailla, joita hoidettiin voimakkaasti diureetteilla tai dialyysipotilailla (ks. HUUMEIDEN VUOROVAIKUTUKSET ja HAITTAVAIKUTUKSET ).

Pyörtymistä on raportoitu 0,8 prosentilla ZESTORETIC-hoitoa saaneista potilaista. Pelkästään lisinopriilia saavilla verenpainepotilailla pyörtymisen ilmaantuvuus oli 0,1 prosenttia. Pyörtymisen yleistä ilmaantuvuutta voidaan vähentää yksittäisten komponenttien oikealla titrauksella (katso HUUMEIDEN VUOROVAIKUTUKSET , HAITTAVAIKUTUKSET ja ANNOSTELU JA HALLINNOINTI ).
Potilailla, joilla on vaikea sydämen vajaatoiminta, johon liittyy munuaisten vajaatoimintaa tai ei, on havaittu liiallista hypotensiota, ja siihen voi liittyä oliguriaa ja/tai etenevää atsotemiaa ja harvoin akuuttia munuaisten vajaatoimintaa ja/tai kuolemaa. Koska näiden potilaiden verenpaine voi laskea, hoito tulee aloittaa erittäin tiiviissä lääkärin valvonnassa. Tällaisia potilaita tulee seurata tarkasti kahden ensimmäisen hoitoviikon ajan ja aina, kun lisinopriilin ja/tai diureetin annosta suurennetaan. Samanlaiset näkökohdat koskevat potilaita, joilla on iskeeminen sydän- tai aivoverisuonisairaus ja joiden verenpaineen liiallinen lasku voi johtaa sydäninfarktiin tai aivoverisuonionnettomuuteen.
Jos hypotensiota ilmenee, potilas on asetettava makuuasentoon ja hänelle on tarvittaessa annettava normaalia suolaliuosta suonensisäisenä infuusiona. Ohimenevä hypotensiivinen vaste ei ole vasta-aihe lisäannoksille, jotka voidaan yleensä antaa ilman vaikeuksia, kun verenpaine on noussut tilavuuden lisäämisen jälkeen.
Leukopenia/neutropenia/agranulosytoosi
Toisen angiotensiinia konvertoivan entsyymin estäjän, kaptopriilin, on osoitettu aiheuttavan agranulosytoosia ja luuytimen lamaa, harvoin potilailla, joilla ei ole komplikaatioita, mutta useammin potilailla, joilla on munuaisten vajaatoiminta, erityisesti jos heillä on myös kollageeniverisuonisairaus. Lisinopriilia koskevista kliinisistä tutkimuksista saatavilla olevat tiedot eivät riitä osoittamaan, että lisinopriili ei aiheuta agranulosytoosia yhtä usein. Myyntikokemus on paljastanut harvinaisia leukopeniaa/neutropeniaa ja luuydindepression tapauksia, joissa syy-yhteyttä lisinopriiliin ei voida sulkea pois. Valkosolujen määrän säännöllistä seurantaa tulee harkita potilailla, joilla on kollageeniverisuonisairaus ja munuaissairaus.
Maksan vajaatoiminta
ACE:n estäjiin on harvoin liitetty oireyhtymää, joka alkaa kolestaattisella keltatuksella tai hepatiitilla ja etenee fulminanttiin maksanekroosiin ja (joskus) kuolemaan. Tämän oireyhtymän mekanismia ei tunneta. ACE:n estäjähoitoa saavien potilaiden, joille kehittyy keltaisuutta tai huomattavaa maksaentsyymiarvojen nousua, tulee keskeyttää ACE:n estäjähoito ja saada asianmukaista lääketieteellistä seurantaa.
Sikiön toksisuus
Raskausluokka D
Reniini-angiotensiinijärjestelmään vaikuttavien lääkkeiden käyttö raskauden toisen ja kolmannen kolmanneksen aikana vähentää sikiön munuaisten toimintaa ja lisää sikiön ja vastasyntyneen sairastuvuutta ja kuolemaa. Tuloksena olevat oligohydramnionit voivat liittyä sikiön keuhkojen hypoplasiaan ja luuston epämuodostumiin. Mahdollisia vastasyntyneiden haittavaikutuksia ovat kallon hypoplasia, anuria, hypotensio, munuaisten vajaatoiminta ja kuolema. Kun raskaus havaitaan, lopeta ZESTORETIC-hoito mahdollisimman pian. Nämä haittavaikutukset liittyvät yleensä näiden lääkkeiden käyttöön raskauden toisen ja kolmannen kolmanneksen aikana. Useimmat epidemiologiset tutkimukset, joissa tutkittiin sikiön poikkeavuuksia verenpainetta alentaville lääkkeille ensimmäisen raskauskolmanneksen aikana, eivät ole erottaneet reniini-angiotensiinijärjestelmään vaikuttavia lääkkeitä muista verenpainetta alentavista aineista. Äidin verenpainetaudin asianmukainen hoito raskauden aikana on tärkeää sekä äidin että sikiön tulosten optimoimiseksi.
Siinä epätavallisessa tapauksessa, että reninangiotensiinijärjestelmään vaikuttavilla lääkkeillä ei ole sopivaa vaihtoehtoa tietylle potilaalle, kerro äidille mahdollisista riskeistä sikiölle. Suorita sarja ultraäänitutkimuksia lapsivesiympäristön arvioimiseksi. Jos havaitaan oligohydramnionia, lopeta ZESTORETIC-hoito, ellei sitä pidetä äidin hengenpelastajana. Sikiötestaus voi olla asianmukaista raskausviikon perusteella. Potilaiden ja lääkäreiden tulee kuitenkin olla tietoisia siitä, että oligohydramnionit saattavat ilmaantua vasta sen jälkeen, kun sikiö on saanut peruuttamattoman vaurion. Tarkkaile tarkasti lapsia, jotka ovat altistuneet kohdussa ZESTORETICille hypotension, oligurian ja hyperkalemian vuoksi. (Katso VAROTOIMET, Lastenkäyttö ).
Lisinopriilin teratogeenisiä vaikutuksia ei havaittu tiineillä rotilla, hiirillä ja kaniineilla tehdyissä tutkimuksissa. Mg/kg:n perusteella käytetyt annokset olivat jopa 625-kertaisia (hiirillä), 188-kertaisia (rotilla) ja 0,6-kertaisia (kaneissa) ihmisille suositeltuihin enimmäisannoksiin verrattuna.
Lisinopriili ja hydroklooritiatsidi
Teratogeenisuustutkimukset suoritettiin hiirillä ja rotilla, joissa lisinopriilia annettiin enintään 90 mg/kg/vrk (56 kertaa suurin suositeltu ihmisannos) yhdistettynä 10 mg/kg/vrk hydroklooritiatsidiin (2,5 kertaa suurin suositeltu ihmisannos). Hiirillä ei havaittu emolle tai sikiötoksisia vaikutuksia yhdistelmällä. Rotilla emon painonnousu väheni ja sikiön paino laski 3/10 mg/kg/vrk (pienin testattu annos). Sikiön painon laskuun liittyi sikiön luutumisen viivästyminen. Sikiön painon laskua ja sikiön luutumisen viivästymistä ei havaittu suolaliuosta saaneilla eläimillä, joille annettiin 90/10 mg/kg/vrk.
ACE:n estäjät voivat raskauden aikana toisen ja kolmannen raskauskolmanneksen aikana aiheuttaa vammoja ja jopa kuoleman kehittyvälle sikiölle. Kun raskaus havaitaan, lopeta ZESTORETIC 5 mg -hoito mahdollisimman pian ( Katso Lisinopril, Fetal Toxicity ).
Hydroklooritiatsidi
Akuutti likinäköisyys ja toissijainen kulmaglaukooma
Hydroklooritiatsidi, sulfonamidi, voi aiheuttaa idiosynkraattisen reaktion, joka johtaa akuuttiin ohimenevään likinäköisyyteen ja akuuttiin sulkeutumiskulmaglaukoomaan. Oireita ovat akuutti näöntarkkuuden heikkeneminen tai silmäkipu, ja ne ilmenevät tyypillisesti tunneista viikkoihin lääkkeen aloittamisen jälkeen. Hoitamaton akuutti kulmaglaukooma voi johtaa pysyvään näön menetykseen. Ensisijainen hoito on hydroklooritiatsidin käytön lopettaminen mahdollisimman nopeasti. Nopeaa lääketieteellistä tai kirurgista hoitoa voidaan joutua harkitsemaan, jos silmänpaine pysyy hallitsemattomana. Akuutin sulkukulmaglaukooman kehittymisen riskitekijöihin voi kuulua aiempi sulfonamidi- tai penisilliiniallergia.
Teratogeeniset vaikutukset
Lisääntymistutkimukset kanilla, hiirillä ja rotilla annoksilla 100 mg/kg/vrk asti (50 kertaa ihmisen annos) eivät osoittaneet merkkejä hydroklooritiatsidista johtuvista sikiön ulkoisista poikkeavuuksista. Kahden pentueen tutkimuksessa rotille annettu hydroklooritiatsidi annoksina 4 mg/kg/vrk - 5,6 mg/kg/vrk (noin 1-2 kertaa tavallinen päivittäinen annos ihmiselle) ei heikentänyt hedelmällisyyttä tai aiheuttanut poikkeavuuksia jälkeläisissä. Tiatsidit läpäisevät istukan ja näkyvät napanuoraveressä.
Ei-teratogeeniset vaikutukset
Näitä voivat olla sikiön tai vastasyntyneen keltaisuus, trombosytopenia ja mahdollisesti muita haittavaikutuksia aikuisilla.
Hydroklooritiatsidi
Tiatsideja tulee käyttää varoen vaikeassa munuaissairaudessa. Munuaissairauspotilailla tiatsidit voivat aiheuttaa atsotemiaa. Lääkkeen kumulatiiviset vaikutukset voivat kehittyä potilailla, joilla on munuaisten vajaatoiminta.
Tiatsideja tulee käyttää varoen potilailla, joilla on maksan vajaatoiminta tai etenevä maksasairaus, koska pienet neste- ja elektrolyyttitasapainon muutokset voivat aiheuttaa maksakooman.
Herkkyysreaktioita voi esiintyä potilailla, joilla on tai ei ole aiemmin ollut allergiaa tai keuhkoastmaa.
Systeemisen lupus erythematosuksen pahenemisen tai aktivoitumisen mahdollisuudesta on raportoitu.
Litiumia ei yleensä tule antaa tiatsidien kanssa (ks HUUMEIDEN VUOROVAIKUTUKSET , Lisinopriili ja hydroklooritiatsidi ).
VAROTOIMENPITEET
Kenraali
Lisinopriili
Aorttastenoosi/hypertrofinen kardiomyopatia
Kuten kaikkia verisuonia laajentavia lääkkeitä, lisinopriilia tulee antaa varoen potilaille, joilla on tukos vasemman kammion ulosvirtauskanavassa.
Munuaisten vajaatoiminta
Reniini-angiotensiini-aldosteronijärjestelmän estämisen seurauksena munuaisten toiminnan muutoksia voidaan odottaa herkillä yksilöillä. Potilailla, joilla on vaikea kongestiivinen sydämen vajaatoiminta ja joiden munuaisten toiminta saattaa riippua reniini-angiotensiini-aldosteronijärjestelmän aktiivisuudesta, hoitoon angiotensiinia konvertoivan entsyymin estäjillä, mukaan lukien lisinopriili, voi liittyä oliguriaa ja/tai etenevää atsotemiaa ja harvoin akuuttia munuaisten vajaatoimintaa. epäonnistuminen ja/tai kuolema.
Veren ureatypen ja seerumin kreatiniinipitoisuuden nousua saattaa esiintyä hypertensiivisillä potilailla, joilla on toispuolinen tai molempien munuaisvaltimon ahtauma. Toisesta angiotensiinia konvertoivan entsyymin inhibiittorista saadut kokemukset viittaavat siihen, että nämä lisääntymiset ovat yleensä palautuvia, kun lisinopriili- ja/tai diureettihoito lopetetaan. Tällaisten potilaiden munuaisten toimintaa tulee seurata muutaman ensimmäisen hoitoviikon aikana.
Joillakin hypertensiivisillä potilailla, joilla ei ole ilmeistä aiempaa munuaisten verisuonisairautta, on kehittynyt veren urea- ja seerumin kreatiniinipitoisuuden nousu, joka on yleensä vähäistä ja ohimenevää, varsinkin kun lisinopriilia on annettu samanaikaisesti diureetin kanssa. Tämä on todennäköisempää potilailla, joilla on ennestään munuaisten vajaatoiminta. Lisinopriilin annoksen pienentäminen ja/tai diureetin käytön lopettaminen saattaa olla tarpeen.
Hypertensiivisen potilaan arviointiin tulee aina sisältyä munuaisten toiminnan arviointi (katso ANNOSTUS JA ANNOSTUS).
Hyperkalemia
Kliinisissä tutkimuksissa hyperkalemiaa (seerumin kalium yli 5,7 meq/l) esiintyi noin 1,4 prosentilla verenpainepotilaista, joita hoidettiin lisinopriililla ja hydroklooritiatsidilla. Useimmissa tapauksissa nämä olivat yksittäisiä arvoja, jotka hävisivät hoidon jatkumisesta huolimatta. Hyperkalemia ei ollut syy hoidon keskeyttämiseen. Hyperkalemian kehittymisen riskitekijöitä ovat munuaisten vajaatoiminta, diabetes mellitus ja samanaikainen kaliumia säästävien diureettien, kaliumlisäaineiden ja/tai kaliumia sisältävien suolan korvikkeiden käyttö. Hyperkalemia voi aiheuttaa vakavia, joskus kuolemaan johtavia rytmihäiriöitä. ZESTORETIC-valmistetta tulee käyttää varoen, jos ollenkaan, näiden aineiden kanssa ja seerumin kaliumpitoisuutta säännöllisesti seuraten (ks. HUUMEIDEN VUOROVAIKUTUKSET ).
Yskä
Oletettavasti endogeenisen bradykiniinin hajoamisen estämisen vuoksi kaikkien ACE:n estäjien yhteydessä on raportoitu jatkuvaa tuottamatonta yskää, joka lähes aina häviää hoidon lopettamisen jälkeen. ACE-estäjän aiheuttama yskä tulee ottaa huomioon yskän erotusdiagnoosissa.
Leikkaus / anestesia
Potilailla, joille tehdään suuri leikkaus tai anestesian aikana hypotensiota aiheuttavilla aineilla, lisinopriili saattaa estää angiotensiini II:n muodostumisen kompensoivan reniinin vapautumisen seurauksena. Jos hypotensiota esiintyy ja sen katsotaan johtuvan tästä mekanismista, se voidaan korjata tilavuuden lisäämisellä.
Hydroklooritiatsidi
Seerumin elektrolyytit on määritettävä säännöllisin väliajoin mahdollisen elektrolyyttitasapainon havaitsemiseksi.
Kaikkia tiatsidihoitoa saavia potilaita tulee tarkkailla neste- tai elektrolyyttitasapainohäiriön kliinisten oireiden varalta: hyponatremia, hypokloreeminen alkaloosi ja hypokalemia. Seerumin ja virtsan elektrolyyttimääritykset ovat erityisen tärkeitä, kun potilas oksentaa liikaa tai saa parenteraalisia nesteitä. Neste- ja elektrolyyttitasapainohäiriön varoitusmerkit tai -oireet syystä riippumatta, ovat suun kuivuminen, jano, heikkous, letargia, uneliaisuus, levottomuus, sekavuus, kouristukset, lihaskivut tai -krampit, lihasväsymys, hypotensio, oliguria, takykardia ja ruoansulatuskanavan häiriöt kuten pahoinvointi ja oksentelu.
Hypokalemia voi kehittyä, erityisesti nopean diureesin yhteydessä, kun on olemassa vaikea kirroosi tai pitkäaikaisen hoidon jälkeen.
Riittävän suun elektrolyyttien saannin häiriintyminen edistää myös hypokalemiaa. Hypokalemia voi aiheuttaa sydämen rytmihäiriöitä ja voi myös herkistää tai liioitella sydämen vastetta digitaliksen toksisiin vaikutuksiin (esim. lisääntynyt kammioiden ärtyneisyys). Koska lisinopriili vähentää aldosteronin tuotantoa, samanaikainen lisinopriilihoito heikentää diureettien aiheuttamaa kaliumhäviötä (ks. HUUMEIDEN VUOROVAIKUTUKSET , Seerumin kaliumia lisäävät aineet ).
Vaikka mikä tahansa kloridivaje on yleensä lievä eikä vaadi erityistä hoitoa, paitsi poikkeuksellisissa olosuhteissa (kuten maksasairaudessa tai munuaissairaudessa), kloridikorvaus saattaa olla tarpeen metabolisen alkaloosin hoidossa.
Laimennushyponatremiaa voi esiintyä edematoottisilla potilailla kuumalla säällä; sopiva hoito on veden rajoittaminen suolan antamisen sijaan paitsi harvoissa tapauksissa, joissa hyponatremia on hengenvaarallinen. Varsinaisessa suolavajeessa sopiva korvaus on valinnanvarainen hoito.
Tietyillä tiatsidihoitoa saavilla potilailla saattaa esiintyä hyperurikemiaa tai kihtiä.
Diabeettisilla potilailla insuliinin tai oraalisten hypoglykeemisten aineiden annoksen muuttaminen saattaa olla tarpeen. Tiatsididiureettien käytön yhteydessä voi esiintyä hyperglykemiaa. Siten piilevä diabetes mellitus voi ilmaantua tiatsidihoidon aikana.
Lääkkeen verenpainetta alentavat vaikutukset voivat voimistua postsympathectomy-potilailla.
Jos etenevä munuaisten vajaatoiminta ilmenee selvästi, harkitse diureettihoidon keskeyttämistä tai lopettamista.
Tiatsidien on osoitettu lisäävän magnesiumin erittymistä virtsaan; tämä voi johtaa hypomagnesemiaan.
Tiatsidit voivat vähentää kalsiumin erittymistä virtsaan. Tiatsidit voivat aiheuttaa ajoittaista ja lievää seerumin kalsiumpitoisuuden nousua ilman tunnettuja kalsiumaineenvaihdunnan häiriöitä. Merkittävä hyperkalsemia voi olla todiste piilotetusta hyperparatyreoosista. Tiatsidihoito tulee lopettaa ennen lisäkilpirauhasen toimintakokeiden suorittamista.
Kolesteroli- ja triglyseridipitoisuuksien nousu saattaa liittyä tiatsididiureettihoitoon.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Lisinopriili ja hydroklooritiatsidi
Lisinopriili yhdistelmänä hydroklooritiatsidin kanssa ei ollut mutageeninen mikrobiperäisessä mutageenitestissä, jossa käytettiin Salmonella typhimurium -bakteeria (Ames-testi) tai Escherichia colia metabolisen aktivaation kanssa tai ilman sitä, tai eteenpäin suunnatussa mutaatiomäärityksessä, jossa käytettiin kiinanhamsterin keuhkosoluja. Lisinopriili ja hydroklooritiatsidi eivät aiheuttaneet DNA:n yksijuostekatkoja in vitro emäksisessä eluutiossa rotan hepatosyyttimäärityksessä. Lisäksi se ei lisännyt kromosomipoikkeavuuksia kiinanhamsterin munasarjasoluilla tehdyssä in vitro -testissä eikä hiiren luuytimellä tehdyssä in vivo -tutkimuksessa.
Lisinopriili
Tuumorigeenisestä vaikutuksesta ei havaittu näyttöä, kun lisinopriilia annettiin 105 viikon ajan uros- ja naarasrotille annoksina 90 mg/kg/vrk (noin 56 tai 9 kertaa* ihmisen enimmäisvuorokausiannos, ruumiinpainon ja kehon pinnan perusteella). alueella). Ei ollut näyttöä karsinogeenisuudesta, kun lisinopriilia annettiin 92 viikon ajan (uros- ja naarashiirille) annoksina 135 mg/kg/vrk (noin 84 kertaa* ihmiselle suositeltuun enimmäisannostukseen verrattuna). Tämä annos oli 6,8 kertaa suurempi kuin ihmisen enimmäisannos hiirten kehon pinta-alan perusteella.
*Laskelmissa oletetaan ihmisen painoksi 50 kg ja kehon pinta-alaksi 1,62 m2.
Lisinopriili ei ollut mutageeninen Amesin mikrobimutageenitestissä metabolisen aktivaation kanssa tai ilman sitä. Se oli myös negatiivinen eteenpäin suuntautuvassa mutaatiomäärityksessä, jossa käytettiin kiinanhamsterin keuhkosoluja. Lisinopriili ei aiheuttanut yksijuosteisia DNA-katkoja in vitro emäksisessä rotan hepatosyyttimäärityksessä. Lisinopriili ei myöskään lisännyt kromosomipoikkeavuuksia kiinanhamsterin munasarjasoluilla tehdyssä in vitro -testissä eikä hiiren luuytimellä tehdyssä in vivo -tutkimuksessa.
Uros- ja naarasrotilla, joita hoidettiin enintään 300 mg/kg/vrk lisinopriililla, ei havaittu haitallisia vaikutuksia lisääntymiskykyyn. Tämä annos on 188-kertainen ja 30-kertainen ihmisen enimmäisvuorokausiannos laskettuna mg/kg ja mg/m2.
Hydroklooritiatsidi
Kansallisen toksikologiaohjelman (NTP) alaisuudessa tehdyt kaksivuotiset ruokintatutkimukset hiirillä ja rotilla eivät paljastaneet näyttöä hydroklooritiatsidin syöpää aiheuttavasta potentiaalista naarashiirillä (annoksilla enintään noin 600 mg/kg/vrk) tai uroksilla. ja naarasrotilla (annoksilla enintään noin 100 mg/kg/vrk). Nämä annokset ovat 150-kertaiset ja 12-kertaiset hiirille ja 25-kertaiset ja 4-kertaiset rotille ihmisen enimmäisvuorokausiannokseen verrattuna mg/kg:n ja mg/m2:n perusteella. NTP löysi kuitenkin kiistanalaisia todisteita hepatokarsinogeenisuudesta uroshiirillä.
Hydroklooritiatsidi ei ollut genotoksinen in vitro Salmonella typhimurium -kantojen TA 98, TA 100, TA 1535, TA 1537 ja TA 1538 Amesin mutageenisuuskokeessa eikä kiinalaisen hamsterin munasarjan (CHO) testissä kromosomien in vivoation tai aberation in aberration hiiren itusolujen kromosomit, kiinanhamsterin luuytimen kromosomit ja Drosophilan sukupuoleen liittyvä resessiivinen tappava piirregeeni. Positiivisia testituloksia saatiin vain in vitro CHO Sister Chromatid Exchange (klastogeenisuus) ja hiiren lymfoomasolutesteissä (mutageenisuus), joissa käytettiin hydroklooritiatsidin pitoisuuksia 43 mcg/ml - 1300 mcg/ml, ja Aspergillus nijujunnction assays nossays. määrittelemättömällä pitoisuudella.
Hydroklooritiatsidilla ei ollut haitallisia vaikutuksia kummankaan sukupuolen hiirten ja rottien hedelmällisyyteen tutkimuksissa, joissa nämä lajit altistettiin ruokavalionsa kautta annoksille, jotka olivat 100 mg/kg ja 4 mg/kg, vastaavasti ennen hedelmöittymistä ja koko tiineyden ajan. . Hiirillä tämä annos on 25-kertainen ja 2-kertainen ihmisen enimmäisvuorokausiannos laskettuna mg/kg ja mg/m2, vastaavasti. Rotilla tämä annos on 1-kertainen ja 0,2-kertainen ihmisen enimmäisvuorokausiannokseen laskettuna mg/kg ja mg/m2, vastaavasti.
Imettävät äidit
Ei tiedetä, erittyykö lisinopriili äidinmaitoon. Imettävien rottien maito sisältää kuitenkin radioaktiivisuutta 14C-lisinopriilin antamisen jälkeen. Toisessa tutkimuksessa lisinopriilia oli rotan maidossa samankaltaisina pitoisuuksina kuin emojen plasmatasot. Tiatsideja erittyy äidinmaitoon. Koska ACE:n estäjät ja hydroklooritiatsidi voivat aiheuttaa vakavia haittavaikutuksia imeväisille, on päätettävä, lopetetaanko imetys ja/tai lopetetaanko ZESTORETIC 12,5 mg -hoito ottaen huomioon lääkkeen merkitys äidille.
Käyttö lapsille
Vastasyntyneet, jotka ovat aiemmin altistuneet ZESTORETICille
Jos esiintyy oliguriaa tai hypotensiota, kiinnitä huomiota verenpaineen ja munuaisten perfuusion tukemiseen. Vaihtosiirtoja tai dialyysiä voidaan tarvita keinona vähentää hypotensiota ja/tai korvata häiriintynyttä munuaisten toimintaa. Lisinopriili, joka läpäisee istukan, on poistettu vastasyntyneen verenkierrosta peritoneaalidialyysillä, josta on jonkin verran kliinistä hyötyä, ja teoriassa se voidaan poistaa vaihtosiirrolla, vaikka viimeksi mainitusta menettelystä ei ole kokemusta.
Turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
ZESTORETIC mg:n kliiniset tutkimukset eivät sisältäneet riittävää määrää 65-vuotiaita ja sitä vanhempia, jotta voitaisiin määrittää, reagoivatko he eri tavalla kuin nuoremmat. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa. Yleensä iäkkään potilaan annoksen valinnassa tulee olla varovainen, yleensä alkaen annosalueen alimmasta päästä, mikä heijastaa maksan, munuaisten tai sydämen toiminnan heikkenemisen sekä samanaikaisen sairauden tai muun lääkehoidon yleisyyttä.
Tämän lääkkeen tiedetään erittyvän olennaisesti munuaisten kautta, ja tämän lääkkeen toksisten reaktioiden riski voi olla suurempi potilailla, joilla on heikentynyt munuaisten toiminta. Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, annoksen valinnassa on oltava varovainen. Hypertensiivisen potilaan arviointiin tulee aina sisältyä munuaisten toiminnan arviointi.
YLIANNOSTUS
ZESTORETICin yliannostuksen hoidosta ei ole saatavilla erityistä tietoa. Hoito on oireenmukaista ja tukevaa. Hoito ZESTORETIC 12,5 mg:lla tulee keskeyttää ja potilasta tarkkailla tarkasti. Ehdotettuja toimenpiteitä ovat oksentelun ja/tai mahahuuhtelun aiheuttaminen sekä nestehukka, elektrolyyttitasapainon ja hypotension korjaaminen vakiintunein menetelmin.
Lisinopriili
Rotilla ei esiintynyt kuolleisuutta 20 g/kg:n kerta-annoksen jälkeen, ja yksi 20 hiirestä, jotka saivat saman annoksen, kuoli. Yliannostuksen todennäköisin ilmentymä olisi hypotensio, jonka tavanomainen hoito on normaalin suolaliuoksen suonensisäinen infuusio.
Lisinopriili voidaan poistaa hemodialyysillä (ks VAROITUKSET , Anafylaktinen reaktio kalvoaltistuksen aikana ).
Hydroklooritiatsidi
Suun kautta annettu kerta-annos 10 g/kg hiirille ja rotille ei ollut tappavaa. Yleisimmät havaitut merkit ja oireet ovat elektrolyyttivajauksesta (hypokalemia, hypokloremia, hyponatremia) ja liiallisesta diureesista johtuvasta nestehukasta johtuvat oireet. Jos myös digitalista on annettu, hypokalemia voi pahentaa sydämen rytmihäiriöitä.
VASTA-AIHEET
ZESTORETIC 12,5 g on vasta-aiheinen potilaille, jotka ovat yliherkkiä tälle tuotteelle, ja potilaille, joilla on aiemmin ollut angioedeema, joka liittyy aikaisempaan angiotensiinikonvertaasin estäjähoitoon, sekä potilaille, joilla on perinnöllinen tai idiopaattinen angioedeema. Hydroklooritiatsidikomponentin vuoksi tämä tuote on vasta-aiheinen potilaille, joilla on anuria tai yliherkkyys muille sulfonamidijohdannaisille.
ZESTORETIC 12,5 g on vasta-aiheinen yhdessä neprilysiinin estäjän (esim. sacubitril) kanssa. Älä anna ZESTORETIC 5 mg:aa 36 tunnin kuluessa vaihtamisesta sacubitril/valsartaaniin, neprilysiinin estäjään, tai siitä pois (ks. VAROITUKSET ).
Älä anna aliskireenia samanaikaisesti ZESTORETICin kanssa diabetespotilaille (ks HUUMEIDEN VUOROVAIKUTUKSET ).
KLIININEN FARMAKOLOGIA
Lisinopriili ja hydroklooritiatsidi
Diureettisten vaikutustensa seurauksena hydroklooritiatsidi lisää plasman reniiniaktiivisuutta, lisää aldosteronin eritystä ja alentaa seerumin kaliumpitoisuutta. Lisinopriilin antaminen estää reninangiotensiini-aldosteroniakselin ja pyrkii kääntämään diureettiin liittyvän kaliumhäviön.
Kliinisissä tutkimuksissa lisinopriilin ja hydroklooritiatsidin yhdistelmällä havaittu verenpaineen lasku oli suunnilleen additiivista. ZESTORETIC 10-12.5 -yhdistelmä toimi yhtä hyvin mustavalkoisilla potilailla. ZESTORETIC 20-12.5 ja ZESTORETIC 20-25 yhdistelmät vaikuttivat hieman tehottomammilta mustilla potilailla, mutta mustia potilaita tutkittiin suhteellisen vähän. Useimmilla potilailla ZESTORETICin verenpainetta alentava vaikutus säilyi vähintään 24 tuntia.
Satunnaistetussa, kontrolloidussa vertailussa ZESTORETIC 20-12.5:n ja ZESTORETIC 20-25:n keskimääräiset verenpainetta alentavat vaikutukset olivat samanlaiset, mikä viittaa siihen, että monet potilaat, jotka reagoivat riittävästi jälkimmäiseen yhdistelmään, voidaan saada hallintaan ZESTORETIC 20-12.5:llä (ks. ANNOSTELU JA HALLINNOINTI ).
Lisinopriilin ja hydroklooritiatsidin samanaikainen anto vaikuttaa vain vähän tai ei ollenkaan kummankaan lääkkeen hyötyosuuteen. Yhdistelmätabletti on bioekvivalentti erillisten kokonaisuuksien samanaikaisen annon kanssa.
Lisinopriili
Toimintamekanismi
Lisinopriili estää angiotensiinia konvertoivaa entsyymiä (ACE) ihmisillä ja eläimillä. ACE on peptidyylidipeptidaasi, joka katalysoi angiotensiini I:n konversiota verisuonia supistavaksi aineeksi, angiotensiini II:ksi. Angiotensiini II stimuloi myös aldosteronin eritystä lisämunuaiskuoressa. ACE:n esto johtaa plasman angiotensiini II:n vähenemiseen, mikä johtaa vasopressoriaktiivisuuden ja aldosteronin erityksen vähenemiseen. Jälkimmäinen lasku voi johtaa seerumin kaliumpitoisuuden vähäiseen nousuun. Angiotensiini II:n reniinin eritystä koskevan negatiivisen palautteen poistaminen johtaa plasman reniiniaktiivisuuden lisääntymiseen. Verenpainepotilailla, joiden munuaisten toiminta oli normaali ja joita hoidettiin pelkällä lisinopriililla enintään 24 viikon ajan, seerumin kaliumpitoisuuden keskimääräinen nousu oli alle 0,1 mekvivalentti/l. kuitenkin noin 15 prosentilla potilaista oli yli 0,5 mekvivalentti/l nousua ja noin kuudella prosentilla suurempi kuin 0,5 mekvivalentti/l. Samassa tutkimuksessa lisinopriililla ja tiatsididiureetilla hoidettujen potilaiden seerumin kaliumpitoisuudessa ei havaittu oleellisesti muutoksia (ks. VAROTOIMENPITEET ).
ACE on identtinen kininaasin kanssa, entsyymin kanssa, joka hajottaa bradykiniiniä. Vielä on selvitettävä, onko bradykiniinin, voimakkaan vasodepressoripeptidin, kohonneilla tasoilla merkitystä lisinopriilin terapeuttisissa vaikutuksissa.
Vaikka mekanismin, jolla lisinopriili alentaa verenpainetta, uskotaan ensisijaisesti reniini-angiotensiini-aldosteronijärjestelmän suppressioon, lisinopriili on verenpainetta alentava myös potilailla, joilla on matala reniinipitoisuus. Vaikka lisinopriili oli verenpainetta alentava kaikissa tutkituissa roduissa, mustaihoisilla hypertensiivisillä potilailla (yleensä matalan reniinin verenpainepotilailla) keskimääräinen vaste lisinopriilimonoterapiaan oli pienempi kuin ei-mustaihoisilla potilailla.
Farmakokinetiikka ja aineenvaihdunta
Lisinopriilin oraalisen annon jälkeen huippupitoisuudet seerumissa saavutetaan noin 7 tunnin kuluessa. Alenevilla seerumipitoisuuksilla on pitkittynyt terminaalinen vaihe, joka ei edistä lääkkeiden kertymistä. Tämä terminaalinen vaihe edustaa todennäköisesti tyydyttävää sitoutumista ACE:hen, eikä se ole verrannollinen annokseen. Lisinopriili ei näytä sitoutuvan muihin seerumin proteiineihin.
Lisinopriili ei metaboloidu, vaan se erittyy muuttumattomana kokonaan virtsaan. Virtsan erittymisen perusteella lisinopriilin keskimääräinen imeytymisaste on noin 25 prosenttia, ja yksilöiden välinen vaihtelu on suuri (6 % - 60 %) kaikilla testatuilla annoksilla (5 mg - 80 mg). Ruoan läsnäolo ruoansulatuskanavassa ei vaikuta lisinopriilin imeytymiseen.
Lisinopriilin tehokas kumuloitumisen puoliintumisaika on 12 tunnin toistuvan annostelun jälkeen.
Munuaisten vajaatoiminta vähentää lisinopriilin eliminaatiota, joka erittyy pääasiassa munuaisten kautta, mutta tämä väheneminen tulee kliinisesti merkittäväksi vasta, kun glomerulussuodatusnopeus on alle 30 ml/min. Tämän glomerulaarisen suodatusnopeuden yläpuolella eliminaation puoliintumisaika ei muutu juurikaan. Suuremmalla heikkenemisellä lisinopriilin huippu- ja alintasot kuitenkin nousevat, huippupitoisuuden saavuttamiseen kuluva aika pitenee ja vakaan tilan saavuttamiseen kuluva aika pitenee. Vanhemmilla potilailla on keskimäärin (noin kaksinkertaistunut) korkeammat veren tasot ja plasman pitoisuusaikakäyrän alla oleva pinta-ala (AUC) kuin nuoremmilla potilailla (ks. ANNOSTELU JA HALLINNOINTI ). Toistuvan annoksen farmakokineettisessä tutkimuksessa iäkkäillä ja nuorilla hypertensiivisillä potilailla, jotka käyttivät lisinopriili/hydroklooritiatsidi-yhdistelmää, AUC suureni noin 120 % lisinopriilin ja noin 80 % hydroklooritiatsidin iäkkäillä potilailla. Lisinopriili voidaan poistaa hemodialyysillä.
Rotilla tehdyt tutkimukset osoittavat, että lisinopriili läpäisee heikosti veri-aivoesteen. Lisinopriilin useat annokset rotilla eivät aiheuta kertymistä mihinkään kudoksiin; imettävien rottien maito sisältää kuitenkin radioaktiivisuutta 14C-lisinopriilin antamisen jälkeen. Koko kehon autoradiografialla radioaktiivisuutta havaittiin istukasta sen jälkeen, kun tiineille rotille oli annettu leimattua lääkettä, mutta sikiöistä ei havaittu yhtään.
Farmakodynamiikka
Lisinopriilin antaminen hypertensiopotilaille johtaa verenpaineen laskuun makuuasennossa ja seistessä suunnilleen samassa määrin ilman kompensoivaa takykardiaa. Oireista posturaalista hypotensiota ei yleensä havaita, vaikka sitä voi esiintyä, ja se tulee ennakoida tilavuus- ja/tai suolavajauspotilailla (ks. VAROITUKSET ).
Useimmilla tutkituilla potilailla verenpainetta alentava vaikutus havaittiin tunnin kuluttua yksittäisen lisinopriiliannoksen oraalisen annon jälkeen, ja verenpaineen alenemisen huippu saavutettiin kuudessa tunnissa.
Joillakin potilailla optimaalisen verenpaineen laskun saavuttaminen voi vaatia kahdesta neljään viikkoa hoitoa.
Suositelluilla kerta-annoksilla verenpainetta alentavat vaikutukset ovat säilyneet vähintään 24 tunnin ajan annoksen ottamisen jälkeen, vaikka vaikutus 24 tunnin kohdalla oli huomattavasti pienempi kuin vaikutus kuuden tunnin kuluttua annostelusta.
Lisinopriilin verenpainetta alentavat vaikutukset ovat jatkuneet pitkäaikaisen hoidon aikana. Lisinopriilin äkilliseen lopettamiseen ei ole liittynyt nopeaa verenpaineen nousua. eikä hoitoa edeltävän verenpaineen merkittävän ylityksen kanssa.
Hemodynaamisissa tutkimuksissa essentiaalista hypertensiota sairastavilla potilailla verenpaineen laskuun liittyi perifeeristen valtimoiden vastuksen aleneminen, ja sydämen minuuttitilavuus ja syke muuttuivat vain vähän tai ei ollenkaan. Yhdeksällä verenpainepotilaalla tehdyssä tutkimuksessa lisinopriilin annon jälkeen keskimääräinen munuaisten verenvirtaus lisääntyi, mikä ei ollut merkitsevää. Useista pienistä tutkimuksista saadut tiedot ovat ristiriidassa lisinopriilin vaikutuksen suhteen glomerulusten suodatusnopeuteen hypertensiivisillä potilailla, joilla on normaali munuaisten toiminta, mutta viittaavat siihen, että mahdolliset muutokset eivät ole suuria.
Potilailla, joilla on renovaskulaarinen hypertensio, lisinopriilin on osoitettu olevan hyvin siedetty ja tehokas verenpaineen hallinnassa (ks. VAROTOIMENPITEET ).
Hydroklooritiatsidi
Tiatsidien verenpainetta alentavan vaikutuksen mekanismia ei tunneta. Tiatsidit eivät yleensä vaikuta normaaliin verenpaineeseen.
Hydroklooritiatsidi on diureetti ja verenpainetta alentava aine. Se vaikuttaa elektrolyyttien takaisinabsorption distaaliseen munuaisten tubulusmekanismiin. Hydroklooritiatsidi lisää natriumin ja kloridin erittymistä suunnilleen vastaavina määrinä. Natriureesiin voi liittyä jonkin verran kaliumin ja bikarbonaatin menetystä.
Suun kautta tapahtuvan käytön jälkeen diureesi alkaa kahden tunnin kuluessa, saavuttaa huippunsa noin neljässä tunnissa ja kestää noin 6-12 tuntia.
Hydroklooritiatsidi ei metaboloidu, vaan eliminoituu nopeasti munuaisten kautta. Kun plasman pitoisuuksia on seurattu vähintään 24 tuntia, plasman puoliintumisajan on havaittu vaihtelevan 5,6 ja 14,8 tunnin välillä. Vähintään 61 prosenttia suun kautta otetusta annoksesta eliminoituu muuttumattomana 24 tunnin kuluessa. Hydroklooritiatsidi läpäisee istukan mutta ei veri-aivoestettä.
POTILASTIEDOT
Angioedeema
Angioedeemaa, mukaan lukien kurkunpään turvotus, voi esiintyä milloin tahansa hoidon aikana angiotensiinia konvertoivan entsyymin estäjillä, mukaan lukien ZESTORETIC. Potilaita tulee neuvoa ja neuvoa ilmoittamaan välittömästi kaikista angioedeemaan viittaavista merkeistä tai oireista (kasvojen, raajojen, silmien, huulten, kielen turvotus, nielemis- tai hengitysvaikeudet) ja olemaan ottamatta enempää lääkettä ennen kuin he ovat neuvotelleet lääkkeen määräävän lääkärin kanssa.
Oireellinen hypotensio
Potilaita tulee varoittaa ilmoittamaan huimauksesta erityisesti muutaman ensimmäisen hoitopäivän aikana. Jos todellista pyörtymistä ilmenee, potilaita tulee kehottaa lopettamaan lääkkeen käyttö, kunnes he ovat neuvotelleet lääkkeen määräävän lääkärin kanssa.
Kaikkia potilaita tulee varoittaa siitä, että liiallinen hikoilu ja nestehukka voivat johtaa verenpaineen liialliseen laskuun nestetilavuuden vähenemisen vuoksi. Muut tilavuuden vähenemisen syyt, kuten oksentelu tai ripuli, voivat myös johtaa verenpaineen laskuun; potilaita tulee neuvoa ottamaan yhteyttä lääkäriin.
Hyperkalemia
Potilaita tulee neuvoa olemaan käyttämättä kaliumia sisältäviä suolankorvikkeita neuvottelematta lääkärinsä kanssa.
Leukopenia/neutropenia
Potilaita tulee kehottaa ilmoittamaan viipymättä kaikista infektion viitteistä (esim. kurkkukipu, kuume), jotka voivat olla merkki leukopeniasta/neutropeniasta.
Raskaus
Hedelmällisessä iässä oleville naispotilaille tulee kertoa ZESTORETIC-altistuksen seurauksista raskauden aikana. Keskustele hoitovaihtoehdoista raskautta suunnittelevien naisten kanssa. Potilaita tulee pyytää ilmoittamaan raskaudesta lääkärilleen mahdollisimman pian.
MERKINTÄ: Kuten monien muidenkin lääkkeiden kohdalla, ZESTORETIC 12,5 gmg:lla hoidettaville potilaille on annettava tiettyjä neuvoja. Nämä tiedot on tarkoitettu auttamaan tämän lääkkeen turvallisessa ja tehokkaassa käytössä. Se ei ole kaikkien mahdollisten haitallisten tai suunniteltujen vaikutusten paljastaminen.
