Catapres 100mcg Clonidine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Catapres on ja miten sitä käytetään?
Catapres on reseptilääke, jota käytetään korkean verenpaineen, tarkkaavaisuushäiriön (ADHD) ja syöpäkivun oireiden hoitoon. Catapres 100mcg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Catapres 100mcg kuuluu lääkeluokkaan nimeltä Alpha2 Agonists, Central-Acting, ADHD Agents.
Ei tiedetä, onko Catapres 100mcg turvallinen ja tehokas alle 12-vuotiaille lapsille.
Mitkä ovat Catapresin mahdolliset sivuvaikutukset?
Catapres voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- vieroitusoireet,
- hermostuneisuus,
- agitaatio,
- päänsärky,
- vapina ja
- nopea verenpaineen nousu
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Catapres 100mcg:n yleisimmät sivuvaikutukset ovat:
- kuiva suu,
- huimaus,
- uneliaisuus,
- väsymys,
- ummetus,
- päänsärky,
- pahoinvointi ja
- unihäiriöt (unettomuus)
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Catapresin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
Catapres® (klonidiinihydrokloridi, USP) on keskushermostoon vaikuttava alfa-agonisti, verenpainetta alentava aine, joka on saatavana tabletteina suun kautta annettavaksi kolmessa annosvahvuudessa: 0,1 mg, 0,2 mg ja 0,3 mg. 0,1 mg:n tabletti vastaa 0,087 mg:aa vapaata emästä.
Inaktiivisia aineosia ovat kolloidinen piidioksidi, maissitärkkelys, kaksiemäksinen kalsiumfosfaatti, FD&C Yellow No. 6, gelatiini, glyseriini, laktoosi ja magnesiumstearaatti. Catapres 0,1 mg tabletti sisältää myös FD&C Blue No.1 ja FD&C Red No.3.
Klonidiinihydrokloridi on imidatsoliinijohdannainen ja esiintyy mesomeerisenä yhdisteenä. Kemiallinen nimi on 2-(2,6-dikloorifenyyliamino)-2-imidatsoliinihydrokloridi. Seuraava on rakennekaava:
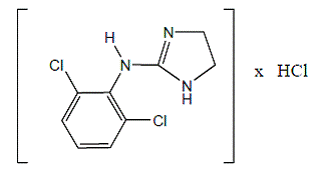 C9H9Cl2N3 HCI Mol. Wt. 266,56
C9H9Cl2N3 HCI Mol. Wt. 266,56 Klonidiinihydrokloridi on hajuton, karvas, valkoinen, kiteinen aine, joka liukenee veteen ja alkoholiin.
INDIKAATIOT
CATAPRES-tabletit on tarkoitettu verenpainetaudin hoitoon. CATAPRES-tabletteja voidaan käyttää yksinään tai samanaikaisesti muiden verenpainetta alentavien aineiden kanssa.
ANNOSTELU JA HALLINNOINTI
Aikuiset
Catapres® (klonidiinihydrokloridi, USP) -tablettien annos on säädettävä potilaan yksilöllisen verenpainevasteen mukaan. Seuraavassa on yleinen opas sen hallinnointiin.
Aloitusannos
0,1 mg tabletti kahdesti vuorokaudessa (aamulla ja nukkumaan mennessä). Iäkkäät potilaat voivat hyötyä pienemmästä aloitusannoksesta.
Ylläpitoannos
Lisälisäyksiä 0,1 mg päivässä voidaan tehdä tarvittaessa viikoittain, kunnes haluttu vaste saavutetaan. Suuremman annoksen ottaminen suun kautta otettavasta vuorokausiannoksesta ennen nukkumaanmenoa voi minimoida suun kuivumisen ja uneliaisuuden ohimenevät säätövaikutukset. Yleisimmin käytetyt terapeuttiset annokset ovat vaihdelleet välillä 0,2 mg - 0,6 mg vuorokaudessa jaettuina annoksina. Tutkimukset ovat osoittaneet, että 2,4 mg on suurin tehokas päiväannos, mutta näin suuria annoksia on käytetty harvoin.
Munuaisten vajaatoiminta
Potilaat, joilla on munuaisten vajaatoiminta, voivat hyötyä pienemmästä aloitusannoksesta. Potilaita tulee seurata huolellisesti. Koska vain pieni määrä klonidiinia poistuu rutiininomaisen hemodialyysin aikana, ei ole tarvetta antaa lisäklonidiinia dialyysin jälkeen.
MITEN TOIMITETAAN
Catapres® (klonidiinihydrokloridi, USP) tabletit toimitetaan seuraavasti:
Säilytä 25°C (77°F); retket sallittu 15°-30°C (59°-86°F) [katso USP-ohjattu huonelämpötila ].
Annostele tiiviiseen, valonkestävään astiaan.
Jakelija: Boehringer Ingelheim Pharmaceuticals, Inc., Ridgefield, CT 06877 USA. Valmistaja: Boehringer Ingelheim Promeco SA de CV, Mexico City, Meksiko. Lisenssi: Boehringer Ingelheim, International GmbH,Lääketieteelliset tiedustelut numeroon (800) 542-6257 tai (800) 459-9906. Tarkistettu: toukokuuta 2012
SIVUVAIKUTUKSET
Useimmat haittavaikutukset ovat lieviä ja yleensä vähenevät hoidon jatkuessa. Yleisimmät (jotka näyttävät riippuvan annoksesta) ovat suun kuivuminen, jota esiintyy noin 40:llä 100 potilaasta; uneliaisuus, noin 33/100; huimaus, noin 16:100; ummetus ja sedaatio, kumpikin noin 10/100.
Seuraavia harvinaisempia haittavaikutuksia on raportoitu myös potilailla, jotka ovat saaneet CATAPRES 100 mikrogramman tabletteja, mutta monissa tapauksissa potilaat saivat samanaikaista lääkitystä, eikä syy-yhteyttä ole osoitettu.
Keho kokonaisuutena: Väsymys, kuume, päänsärky, kalpeus, heikkous ja vieroitusoireyhtymä. Myös heikosti positiivinen Coombsin testi ja lisääntynyt herkkyys alkoholille raportoitiin.
Sydän: Bradykardia, kongestiivinen sydämen vajaatoiminta, elektrokardiografiset poikkeavuudet (esim. sinussolmukkeen pysähtyminen, liitos bradykardia, korkea-asteinen AV-katkos ja rytmihäiriöt), ortostaattiset oireet, sydämentykytys, Raynaud'n ilmiö, pyörtyminen ja takykardia. Sinusbradykardiaa ja eteiskammiokatkostapauksia on raportoitu sekä käytettäessä digitaalista että ilman sitä.
Keskushermosto: Agitaatio, ahdistuneisuus, delirium, harhaluulo, hallusinaatiot (mukaan lukien näkö- ja kuulo), unettomuus, henkinen masennus, hermostuneisuus, muut käyttäytymismuutokset, parestesia, levottomuus, unihäiriöt ja elävät unet tai painajaiset.
Ihotauti: Hiustenlähtö, angioneuroottinen turvotus, nokkosihottuma, kutina, ihottuma ja urtikaria.
Ruoansulatuskanava: Vatsakipu, ruokahaluttomuus, ummetus, hepatiitti, huonovointisuus, lievät ohimenevät poikkeavuudet maksan toimintakokeissa, pahoinvointi, parotiitti, pseudotukokset (mukaan lukien paksusuolen pseudotukokset), sylkirauhaskipu ja oksentelu.
Sukuelimet: Vähentynyt seksuaalinen aktiivisuus, virtsaamisvaikeudet, erektiohäiriöt, libidon menetys, nokturia ja virtsan kertymä.
Hematologinen: Trombosytopenia.
Metabolinen: Gynekomastia, ohimenevä verensokerin tai seerumin kreatiinifosfokinaasitason nousu ja painonnousu.
Tuki- ja liikuntaelimistö: Jalkakrampit ja lihas- tai nivelkipu.
Suun ja kurkunpään: Nenän limakalvon kuivuus.
Oftalmologinen: Akkomodaatiohäiriö, näön hämärtyminen, silmien kirvely, vähentynyt kyyneleritys ja silmien kuivuus.
HUUMEIDEN VUOROVAIKUTUKSET
Klonidiini voi voimistaa alkoholin, barbituraattien tai muiden rauhoittavien lääkkeiden keskushermostoa lamaavia vaikutuksia. Jos klonidiinihydrokloridia saava potilas käyttää myös trisyklisiä masennuslääkkeitä, klonidiinin verenpainetta alentava vaikutus saattaa heikentyä, jolloin klonidiiniannosta on nostettava. Jos klonidiinia saava potilas käyttää myös neuroleptejä, ortostaattisen säätelyn häiriöt (esim. ortostaattinen hypotensio, huimaus, väsymys) voivat aiheuttaa tai pahentua.
Seuraa sykettä potilailla, jotka saavat klonidiinia samanaikaisesti sinussolmukkeen toimintaan tai AV-solmukkeen johtumiseen vaikuttavien aineiden, esim. digitalis, kalsiumkanavasalpaajien ja beetasalpaajien, kanssa. Sinusbradykardiaa, joka on johtanut sairaalahoitoon ja sydämentahdistimen asettamiseen, on raportoitu, kun klonidiinia on käytetty samanaikaisesti diltiatseemin tai verapamiilin kanssa.

Amitriptyliini yhdessä klonidiinin kanssa tehostaa sarveiskalvovaurioiden ilmenemistä rotilla (ks. Toksikologia ).
Alkoholipitoisessa deliriumissa olevista potilaista tehtyjen havaintojen perusteella on ehdotettu, että suuret suonensisäiset klonidiiniannokset voivat lisätä suurten suonensisäisten haloperidoliannosten rytmihäiriöpotentiaalia (QT-ajan piteneminen, kammiovärinä). Syy-yhteyttä ja merkitystä oraalisten klonidiinitablettien kohdalla ei ole osoitettu.
VAROITUKSET
Nosto
Potilaita tulee neuvoa olemaan keskeyttämättä hoitoa neuvottelematta lääkärinsä kanssa. Klonidiinihoidon äkillinen lopettaminen on joissakin tapauksissa johtanut oireisiin, kuten hermostuneisuuteen, kiihtyneisyyteen, päänsärkyyn ja vapinaan, joihin on liittynyt nopea verenpaineen nousu ja plasman katekoliamiinipitoisuuksien nousu. Tällaisten reaktioiden todennäköisyys klonidiinihoidon lopettamisen yhteydessä näyttää olevan suurempi suurempien annosten antamisen tai samanaikaisen beetasalpaajahoidon jatkamisen jälkeen, ja siksi näissä tilanteissa on noudatettava erityistä varovaisuutta. Harvoissa tapauksissa on raportoitu hypertensiivistä enkefalopatiaa, aivoverenkiertohäiriöitä ja kuolemantapauksia klonidiinin lopettamisen jälkeen. Kun lopetat CATAPRES-tablettien käytön, lääkärin tulee pienentää annosta asteittain 2-4 päivän aikana vieroitusoireiden välttämiseksi.
Liiallinen verenpaineen nousu CATAPRES 100 mikrogramman tablettien käytön lopettamisen jälkeen voidaan kumota antamalla oraalista klonidiinihydrokloridia tai suonensisäistä fentolamiinia. Jos hoito lopetetaan potilailla, jotka saavat samanaikaisesti beetasalpaajaa ja klonidiinia, beetasalpaaja on keskeytettävä useita päiviä ennen CATAPRES 100 mikrog -tablettien asteittaista lopettamista.
Koska lapsilla on usein maha-suolikanavan sairauksia, jotka johtavat oksenteluun, he voivat olla erityisen alttiita verenpainetautiin, jotka johtuvat äkillisestä kyvyttömyydestä ottaa lääkkeitä.
VAROTOIMENPITEET
Kenraali
Potilailla, joille on kehittynyt paikallinen kosketusherkistys Catapres-TTS®:lle (klonidiini), Catapres-TTS:n jatkaminen tai oraalisen klonidiinihydrokloridihoidon korvaaminen voi liittyä yleistyneen ihottuman kehittymiseen.
Potilailla, joille kehittyy allerginen reaktio Catapres-TTS:stä, oraalisen klonidiinihydrokloridin korvaaminen voi myös aiheuttaa allergisen reaktion (mukaan lukien yleistynyt ihottuma, nokkosihottuma tai angioedeema).
Klonidiinin sympatolyyttinen vaikutus voi pahentaa sinussolmukkeen toimintahäiriötä ja eteiskammio-salpausta erityisesti potilailla, jotka käyttävät muita sympatolyyttisiä lääkkeitä. Markkinoille tulon jälkeen on raportoitu potilaista, joilla on johtumishäiriöitä ja/tai jotka käyttävät muita sympatolyyttisiä lääkkeitä ja joille kehittyi vaikea bradykardia, joka vaati IV atropiinia, IV isoproterenolia ja tilapäistä sydämen tahdistusta klonidiinin käytön aikana.
Feokromosytooman aiheuttamassa verenpaineessa CATAPRES 100 mikrogramman tablettien terapeuttista vaikutusta ei voida odottaa.
Perioperatiivinen käyttö
Catapres®-tablettien (klonidiinihydrokloridi, USP) antoa tulee jatkaa 4 tunnin kuluessa leikkauksesta ja sitä on jatkettava mahdollisimman pian sen jälkeen. Verenpainetta tulee seurata huolellisesti leikkauksen aikana, ja lisätoimenpiteitä verenpaineen hallitsemiseksi tulee olla saatavilla tarvittaessa.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Klonidiinin krooninen ruokavalion antaminen ei ollut syöpää aiheuttavaa rotille (132 viikkoa) tai hiirille (78 viikkoa), joille annettiin vastaavasti enintään 46 tai 70 kertaa suurin suositeltu päivittäinen annos mg/kg (9 tai 6 kertaa MRDHD). mg/m² perusteella). Amesin mutageenisuustestissä tai hiiren mikrotumatestissä klastogeenisuuden määrittämisessä ei ollut näyttöä genotoksisuudesta.
Uros- tai naarasrottien hedelmällisyyteen eivät vaikuttaneet klonidiiniannokset, jotka olivat jopa 150 µg/kg (noin 3 kertaa MRDHD). Erillisessä kokeessa naarasrottien hedelmällisyyteen vaikutti annostasot 500–2000 μg/kg (10–40 kertaa suun kautta otettava MRDHD mg/kg:n perusteella; 2–8 kertaa MRDHD mg/m²:n perusteella). ).
Raskaus
Teratogeeniset vaikutukset
Raskausluokka C
Kaneilla tehdyt lisääntymistutkimukset annoksilla, jotka olivat noin 3 kertaa suuremmat kuin Catapres® (klonidiinihydrokloridi, USP) tablettien suun kautta otettava suurin suositeltu päivittäinen annos (MRDHD), ei tuottanut näyttöä teratogeenisesta tai embryotoksisesta potentiaalista kaneissa. Rotilla kuitenkin niinkin pienet annokset kuin 1/3 oraalisesta MRDHD:stä (1/15 MRDHD:stä mg/m²:n perusteella) klonidiinia liittyivät lisääntyneeseen resorptioon tutkimuksessa, jossa emoja hoidettiin jatkuvasti 2 kuukauden ajan ennen parittelua. . Lisääntynyt resorptio ei liittynyt hoitoon samanaikaisesti tai suuremmilla annostasoilla (jopa 3 kertaa suun kautta otettavaa MRDHD:tä), kun emoja hoidettiin raskauspäivinä 6–15. Resorption lisääntymistä havaittiin paljon suuremmilla annostasoilla (40 kertaa). suun kautta annettu MRDHD mg/kg perusteella; 4–8 kertaa MRDHD mg/m²-perusteisesti) hiirillä ja rotilla, joita hoidettiin raskauspäivinä 1–14 (pienin tutkimuksessa käytetty annos oli 500 µg/kg).
Raskaana olevilla naisilla ei ole tehty riittäviä, hyvin kontrolloituja tutkimuksia. Klonidiini läpäisee istukan esteen (ks KLIININEN FARMAKOLOGIA , Farmakokinetiikka ). Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, tätä lääkettä tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Imettävät äidit
Koska klonidiinihydrokloridi erittyy äidinmaitoon, on noudatettava varovaisuutta, kun CATAPRES 100 mikrogrammaa tabletteja annetaan imettäville naisille.
Käyttö lapsille
Turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu riittävissä ja hyvin kontrolloiduissa tutkimuksissa (ks VAROITUKSET , Nosto ).
YLIANNOSTUS
Hypertensio voi kehittyä varhain ja sitä voi seurata hypotensio, bradykardia, hengityslama, hypotermia, uneliaisuus, refleksien heikkeneminen tai puuttuminen, heikkous, ärtyneisyys ja mioosi. Keskushermoston laman esiintymistiheys voi olla suurempi lapsilla kuin aikuisilla. Suuret yliannostukset voivat johtaa palautuviin sydämen johtumishäiriöihin tai rytmihäiriöihin, apneaan, koomaan ja kouristuskohtauksiin. Yliannostuksen merkit ja oireet ilmaantuvat yleensä 30 minuutin - kahden tunnin kuluessa altistumisesta. Jo 0,1 mg klonidiinia on aiheuttanut toksisuuden merkkejä lapsilla.
Klonidiinin yliannostukselle ei ole spesifistä vastalääkettä. Klonidiinin yliannostus voi johtaa keskushermoston laman nopeaan kehittymiseen; siksi oksentamista ipecac-siirapin avulla ei suositella. Mahahuuhtelu voi olla aiheellista äskettäin ja/tai suurten nielemisen jälkeen. Aktiivihiilen ja/tai katarsisen anto voi olla hyödyllistä. Tukihoito voi sisältää atropiinisulfaattia bradykardian hoitoon, suonensisäisiä nesteitä ja/tai verisuonia supistavia aineita hypotensioon ja verisuonia laajentavia aineita kohonneen verenpaineen hoitoon. Naloksoni voi olla käyttökelpoinen apuaine klonidiinin aiheuttaman hengityslaman, hypotension ja/tai kooman hoidossa; verenpainetta tulee seurata, koska naloksonin antaminen on toisinaan johtanut paradoksaaliseen verenpaineeseen. Dialyysi ei todennäköisesti lisää merkittävästi klonidiinin eliminaatiota.
Suurin tähän mennessä raportoitu yliannostus oli 28-vuotias mies, joka nieli 100 mg klonidiinihydrokloridijauhetta. Tälle potilaalle kehittyi kohonnut verenpaine, jota seurasi hypotensio, bradykardia, apnea, hallusinaatiot, semikooma ja ennenaikaiset kammioiden supistukset. Potilas toipui täysin intensiivisen hoidon jälkeen. Plasman klonidiinitasot olivat 60 ng/ml 1 tunnin kuluttua, 190 ng/ml 1,5 tunnin kuluttua, 370 ng/ml 2 tunnin kuluttua ja 120 ng/ml 5,5 ja 6,5 tunnin kuluttua. Hiirillä ja rotilla oraalinen klonidiinin LD50 on 206 ja 465 mg/kg.
VASTA-AIHEET
Catapres® (klonidiinihydrokloridi, USP) tabletteja ei tule käyttää potilailla, joiden tiedetään olevan yliherkkiä klonidiinille (ks. VAROTOIMENPITEET ).
KLIININEN FARMAKOLOGIA
Klonidiini stimuloi aivorungon alfa-adrenoreseptoreita. Tämä vaikutus vähentää sympaattista ulosvirtausta keskushermostosta ja vähentää perifeeristä vastusta, munuaisten verisuonten vastusta, sydämen sykettä ja verenpainetta. CATAPRES 100mcg tabletit vaikuttavat suhteellisen nopeasti. Potilaan verenpaine laskee 30–60 minuutin kuluessa suun kautta otetun annoksen jälkeen, ja suurin lasku tapahtuu 2–4 tunnin kuluessa. Munuaisten verenkierto ja glomerulusten suodatusnopeus pysyvät olennaisesti ennallaan. Normaalit asennon refleksit ovat ehjät; siksi ortostaattiset oireet ovat lieviä ja harvinaisia.
Akuutit tutkimukset klonidiinihydrokloridilla ihmisillä ovat osoittaneet sydämen minuuttitilavuuden kohtalaisen pienenemisen (15–20 %) makuuasennossa ilman muutosta perifeerisessä resistanssissa: 45°:n kallistuskulmassa sydämen minuuttitilavuus vähenee vähemmän ja se pienenee. reunavastus. Pitkäaikaisen hoidon aikana sydämen minuuttitilavuus palaa kontrolliarvoihin, kun taas perifeerinen vastus pysyy pienentyneenä. Useimmilla klonidiinia saaneilla potilailla on havaittu pulssin hidastuvan, mutta lääke ei muuta normaalia hemodynaamista vastetta harjoitteluun.
Joillakin potilailla saattaa kehittyä toleranssi verenpainetta alentavalle vaikutukselle, mikä edellyttää hoidon uudelleenarviointia.
Muut potilailla tehdyt tutkimukset ovat osoittaneet plasman reniiniaktiivisuuden ja aldosteronin ja katekoliamiinien erittymisen vähenemisen. Näiden farmakologisten vaikutusten tarkkaa yhteyttä klonidiinin verenpainetta alentavaan vaikutukseen ei ole täysin selvitetty.
Klonidiini stimuloi akuutisti kasvuhormonin vapautumista sekä lapsilla että aikuisilla, mutta ei tuota kroonista kasvuhormonin nousua pitkäaikaisessa käytössä.
Farmakokinetiikka
Klonidiinin farmakokinetiikka on suhteessa annokseen 100-600 µg. Suun kautta annetun klonidiinin absoluuttinen biologinen hyötyosuus on 70-80 %. Plasman klonidiinin huipputasot saavutetaan noin 1-3 tunnissa.
Laskimonsisäisen annon jälkeen klonidiinilla on kaksivaiheinen jakautuminen, jakaantumisen puoliintumisaika on noin 20 minuuttia ja eliminaation puoliintumisaika 12-16 tuntia. Puoliintumisaika pitenee jopa 41 tuntiin potilailla, joilla on vaikea munuaisten vajaatoiminta. Klonidiini läpäisee istukan esteen. Sen on osoitettu ylittävän veri-aivoesteen rotilla.
Oraalisen annon jälkeen noin 40–60 % imeytyneestä annoksesta erittyy virtsaan muuttumattomana lääkkeenä 24 tunnissa. Noin 50 % imeytyneestä annoksesta metaboloituu maksassa. Ruoka tai potilaan rotu eivät vaikuta klonidiinin farmakokinetiikkaan.
Verenpainetta alentava vaikutus saavutetaan plasmapitoisuuksilla, jotka ovat noin 0,2-2,0 ng/ml potilailla, joilla on normaali erittymistoiminto. Plasman pitoisuuksien lisääminen ei lisää verenpainetta alentavaa vaikutusta.
Toksikologia
Useissa oraalisella klonidiinihydrokloridilla tehdyissä tutkimuksissa havaittiin annoksesta riippuvaa verkkokalvon spontaanin rappeutumisen ilmaantuvuuden ja vakavuuden lisääntymistä albiinorotilla, joita hoidettiin kuusi kuukautta tai pidempään. Koirilla ja apinoilla tehdyt kudosjakaumatutkimukset osoittivat klonidiinipitoisuuden suonikalvossa.
Rotilla havaitun verkkokalvon rappeuman vuoksi silmätutkimukset suoritettiin kliinisissä kokeissa 908 potilaalle ennen klonidiinihoidon aloittamista ja ajoittain sen jälkeen. Näistä 908 potilaasta 353:lla silmätutkimukset suoritettiin 24 kuukauden ajan tai kauemmin. Silmien jonkin verran kuivumista lukuun ottamatta lääkkeisiin liittyviä poikkeavia oftalmologisia löydöksiä ei kirjattu, ja erikoistestien, kuten elektroretinografian ja silmänpohjan häikäisyn, mukaan verkkokalvon toiminta pysyi muuttumattomana.
Yhdessä amitriptyliinin kanssa klonidiinihydrokloridin antaminen johti sarveiskalvovaurioiden kehittymiseen rotilla 5 päivän kuluessa.
POTILASTIEDOT
Potilaita tulee varoittaa keskeyttämästä CATAPRES 100 mcg -tablettihoitoa ilman lääkärin neuvoja.
Koska potilaat voivat kokea mahdollista rauhoittavaa vaikutusta, huimausta tai akkomodaatiohäiriötä klonidiinin käytön yhteydessä, varo potilaita ryhtymästä toimiin, kuten ajoneuvon ajamiseen tai koneiden tai koneiden käyttämiseen. Kerro myös potilaille, että alkoholin, barbituraattien tai muiden rauhoittavien lääkkeiden samanaikainen käyttö voi voimistaa tätä rauhoittavaa vaikutusta.
Piilolinssejä käyttäviä potilaita tulee varoittaa siitä, että CATAPRES-tabletit voivat aiheuttaa silmien kuivumista.
