Cozaar 25mg, 50mg, 100mg Losartan Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Cozaar 50mg on ja miten sitä käytetään?
Cozaar on reseptilääke, jota käytetään korkean verenpaineen (hypertension) oireiden hoitoon, alentamaan aivohalvauksen riskiä tietyillä ihmisillä, joilla on sydänsairaus ja diabeettinen hermokipu (neuropatia). Cozaar 100 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Cozaar 25 mg kuuluu lääkeryhmään, jota kutsutaan angiotensiini II -reseptorin antagonistiksi (ARB).
Ei tiedetä, onko Cozaar 25 mg turvallinen ja tehokas alle 6-vuotiaille lapsille.
Mitkä ovat Cozaar 100mg:n mahdolliset sivuvaikutukset?
Cozaar 100mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- huimaus,
- kipua tai polttamista virtsatessa,
- pahoinvointi,
- heikkous,
- kihelmöivä tunne,
- rintakipu,
- epäsäännölliset sydämenlyönnit,
- liikkeiden menetys,
- vähän tai ei ollenkaan virtsaamista,
- nopea painonnousu ja
- turvotusta käsissäsi, jaloissasi tai nilkoissasi
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Cozaarin yleisimpiä sivuvaikutuksia ovat:
- huimaus,
- selkäkipuja ja
- vilustumisoireet (nenän tukkoisuus, aivastelu, kurkkukipu)
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikki Cozaarin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
SIKIÖN MYRKYLLISYYS
Kun raskaus havaitaan, lopeta COZAAR-hoito mahdollisimman pian. Lääkkeet, jotka vaikuttavat suoraan reniini-angiotensiinijärjestelmään, voivat aiheuttaa vammoja ja kuoleman kehittyvälle sikiölle [ks. VAROITUKSET JA VAROTOIMET ].
KUVAUS
COZAAR (losartaanikalium) on angiotensiini II -reseptorin salpaaja, joka vaikuttaa AT1-reseptorin alatyyppiin. Losartaanikalium, ei-peptidimolekyyli, kuvataan kemiallisesti 2-butyyli-4-kloori-1-[p-(o-1H-tetratsol-5-yylifenyyli)bentsyyli]imidatsoli-5-metanolimonokaliumsuolaa.
Sen empiirinen kaava on C22H22ClKN6O ja sen rakennekaava on:
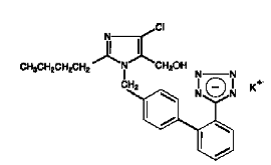
Losartan kalium on valkoinen tai luonnonvalkoinen vapaasti valuva kiteinen jauhe, jonka molekyylipaino on 461,01. Se liukenee vapaasti veteen, liukenee alkoholeihin ja liukenee hieman tavallisiin orgaanisiin liuottimiin, kuten asetonitriiliin ja metyylietyyliketoniin. Imidatsolirenkaan 5-hydroksimetyyliryhmän hapettuminen johtaa losartaanin aktiiviseen metaboliittiin.
COZAAR 100mg on saatavana tabletteina suun kautta annettavina, jotka sisältävät joko 25 mg, 50 mg tai 100 mg losartaanikaliumia ja seuraavia inaktiivisia aineosia: mikrokiteinen selluloosa, vesipitoinen laktoosi, esigelatinoitu tärkkelys, magnesiumstearaatti, hydroksipropyyliselluloosa, hypromelloniumdioksidi ja ti.
COZAAR 25 mg, 50 mg ja 100 mg tabletit sisältävät kaliumia seuraavina määrinä: 2,12 mg (0,054 mEq), 4,24 mg (0,108 mEq) ja 8,48 mg (0,216 mEq). COZAAR 25 mg, COZAAR 50 mg ja COZAAR 100 mg voivat myös sisältää karnaubavahaa.
INDIKAATIOT
Hypertensio
COZAAR® on tarkoitettu korkean verenpaineen hoitoon aikuisilla ja vähintään 6-vuotiailla lapsipotilailla verenpaineen alentamiseksi. Verenpaineen alentaminen alentaa kuolemaan johtavien ja ei-kuolemaan johtavien kardiovaskulaaristen (CV) tapahtumien, pääasiassa aivohalvausten ja sydäninfarktin, riskiä. Nämä edut on havaittu kontrolloiduissa tutkimuksissa, joissa on käytetty monia erilaisia farmakologisia lääkkeitä, mukaan lukien losartaania.
Korkean verenpaineen hallinnan tulee olla osa kattavaa sydän- ja verisuoniriskin hallintaa, mukaan lukien tarvittaessa lipidien hallinta, diabeteksen hallinta, antitromboottinen hoito, tupakoinnin lopettaminen, liikunta ja rajoitettu natriumin saanti. Monet potilaat tarvitsevat enemmän kuin yhden lääkkeen verenpainetavoitteiden saavuttamiseksi. Tarkempia tavoitteita ja hallintaa koskevia neuvoja on julkaistuissa ohjeissa, kuten kansallisen korkean verenpaineen koulutusohjelman yhteisen kansallisen korkean verenpaineen ehkäisy-, havaitsemis-, arviointi- ja hoitokomitean (JNC) ohjeissa.
Lukuisten verenpainetta alentavien lääkkeiden, eri farmakologisista luokista ja eri vaikutusmekanismeista, on osoitettu satunnaistetuissa kontrolloiduissa tutkimuksissa vähentävän sydän- ja verisuonisairauksien sairastuvuutta ja kuolleisuutta, ja voidaan päätellä, että se on verenpaineen alenemista, ei muuta verenpaineen alenemista. huumeet, se on suurelta osin vastuussa näistä eduista. Suurin ja johdonmukaisin kardiovaskulaarinen tulos on ollut aivohalvauksen riskin väheneminen, mutta myös sydäninfarktin ja sydän- ja verisuoniperäisen kuolleisuuden on havaittu vähenevän säännöllisesti.
Kohonnut systolinen tai diastolinen paine lisää sydän- ja verisuoniriskiä, ja absoluuttinen riskin nousu mmHg:tä kohti on suurempi korkeammilla verenpaineilla, joten vaikean verenpaineen vaatimattomastakin laskusta voi olla huomattavaa hyötyä. Suhteellinen riskin pieneneminen verenpaineen laskusta on samanlainen kaikissa populaatioissa, joissa absoluuttinen riski vaihtelee, joten absoluuttinen hyöty on suurempi potilailla, joilla on korkeampi riski verenpaineesta riippumatta (esimerkiksi potilaat, joilla on diabetes tai hyperlipidemia), ja tällaisten potilaiden odotetaan hyötyvän. aggressiivisemmasta hoidosta alhaisempaan verenpainetavoitteeseen.
Joillakin verenpainelääkkeillä on pienemmät verenpainevaikutukset (monoterapiana) mustaihoisilla potilailla, ja monilla verenpainelääkkeillä on muita hyväksyttyjä indikaatioita ja vaikutuksia (esim. angina pectoris, sydämen vajaatoiminta tai diabeettinen munuaissairaus). Nämä näkökohdat voivat ohjata hoidon valintaa.
COZAAR-valmistetta voidaan antaa muiden verenpainelääkkeiden kanssa.
Hypertensiiviset potilaat, joilla on vasemman kammion hypertrofia
COZAAR 25 mg on tarkoitettu vähentämään aivohalvauksen riskiä potilailla, joilla on verenpainetauti ja vasemman kammion liikakasvu, mutta on näyttöä siitä, että tämä etu ei koske mustia potilaita [ks. Käyttö tietyissä populaatioissa ja KLIININEN FARMAKOLOGIA ] .
Nefropatia tyypin 2 diabeetikoilla
COZAAR on tarkoitettu diabeettisen nefropatian, kohonneen seerumin kreatiniinin ja proteinurian (virtsan albumiinin ja kreatiniinin suhde ≥300 mg/g) hoitoon potilaille, joilla on tyypin 2 diabetes ja joilla on aiemmin ollut verenpainetauti. Tässä populaatiossa COZAAR 50 mg hidastaa nefropatian etenemisnopeutta mitattuna seerumin kreatiniinin kaksinkertaistumisesta tai loppuvaiheen munuaissairaudesta (dialyysin tai munuaisensiirron tarve) [ks. Kliiniset tutkimukset ] .
ANNOSTELU JA HALLINNOINTI
Hypertensio
Aikuisten hypertensio
COZAAR 50 mg:n tavallinen aloitusannos on 50 mg kerran vuorokaudessa. Annosta voidaan nostaa enimmäisannokseen 100 mg kerran vuorokaudessa tarpeen mukaan verenpaineen hallitsemiseksi [katso Kliiniset tutkimukset ] . 25 mg:n aloitusannosta suositellaan potilaille, joilla on mahdollinen intravaskulaarinen vajaus (esim. diureettihoitoa saavilla).
Lasten hypertensio
Tavallinen suositeltu aloitusannos on 0,7 mg/kg kerran vuorokaudessa (enintään 50 mg yhteensä) tablettina tai suspensiona (ks. Suspension valmistus (200 ml:lle 2,5 mg/ml suspensiota) ] .Annosta tulee säätää verenpainevasteen mukaan. Yli 1,4 mg/kg (tai yli 100 mg) päivittäisiä annoksia ei ole tutkittu lapsipotilailla [ks. KLIININEN FARMAKOLOGIA , Kliiniset tutkimukset ja VAROITUKSET JA VAROTOIMET ] .
COZAARia ei suositella alle 6-vuotiaille lapsipotilaille tai lapsipotilaille, joiden arvioitu glomerulussuodatusnopeus on alle 30 ml/min/1,73 m 2 [ks. Käyttö tietyissä populaatioissa , KLIININEN FARMAKOLOGIA ja Kliiniset tutkimukset ] .
Hypertensiiviset potilaat, joilla on vasemman kammion hypertrofia
Tavallinen aloitusannos on 50 mg COZAARia kerran vuorokaudessa. Hydroklooritiatsidia 12,5 mg päivässä tulee lisätä ja/tai COZAAR-annosta nostaa 100 mg:aan kerran vuorokaudessa, minkä jälkeen hydroklooritiatsidi nostetaan 25 mg:aan kerran vuorokaudessa verenpainevasteen perusteella [ks. Kliiniset tutkimukset ] .
Nefropatia tyypin 2 diabeetikoilla
Tavallinen aloitusannos on 50 mg kerran vuorokaudessa. Annos tulee suurentaa 100 mg:aan kerran vuorokaudessa verenpainevasteen perusteella [katso Kliiniset tutkimukset ] .
Annoksen muuttaminen potilailla, joilla on maksan vajaatoiminta
Potilaille, joilla on lievä tai keskivaikea maksan vajaatoiminta, suositeltu COZAAR-aloitusannos on 25 mg kerran vuorokaudessa. COZAARia ei ole tutkittu potilailla, joilla on vaikea maksan vajaatoiminta (ks Käyttö tietyissä populaatioissa ja KLIININEN FARMAKOLOGIA ] .
Suspension valmistus (200 ml:lle 2,5 mg/ml suspensiota)
Lisää 10 ml puhdistettua vettä USP 8 unssin (240 ml) ruskeaan polyeteenitereftalaattipulloon (PET), joka sisältää kymmenen 50 mg:n COZAAR-tablettia. Ravista välittömästi vähintään 2 minuuttia. Anna konsentraatin seistä 1 tunnin ajan ja ravista sitten 1 minuutin ajan, jotta tabletin sisältö hajoaa. Valmista erikseen 50/50 tilavuusseos Ora-Plus™:sta ja Ora-Sweet SF™:stä. Lisää 190 ml 50/50 Ora-Plus™/Ora-Sweet SF™-seosta PET-pullossa olevaan tablettiin ja vesilietteeseen ja ravista 1 minuutti ainesosien hajottamiseksi. Suspensio tulee säilyttää jääkaapissa 2–8 °C:ssa ja sitä voidaan säilyttää enintään 4 viikkoa. Ravista suspensiota ennen jokaista käyttöä ja palauta se välittömästi jääkaappiin.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
- COZAAR 100 mg, 25 mg ovat valkoisia, soikeita, kalvopäällysteisiä tabletteja, joiden toisella puolella on koodi 951.
- COZAAR, 50 mg, ovat valkoisia, soikeita, kalvopäällysteisiä tabletteja, joiden toisella puolella on koodi 952 ja toisella puolella jakouurre.
- COZAAR 25 mg, 100 mg ovat valkoisia, pisaranmuotoisia, kalvopäällysteisiä tabletteja, joiden toisella puolella on koodi 960.
Varastointi ja käsittely
COZAAR on valkoinen kalvopäällysteinen tabletti, joka toimitetaan seuraavasti:
Säilytä 25°C (77°F); retket sallitaan 15-30 °C:seen (59-86 °F) [katso USP Controlled Room Temperature]. Pidä säiliö tiiviisti suljettuna. Suojaa valolta.
Valmistettu Organon LLC:lle, ORGANON & Co:n tytäryhtiölle, Jersey City, NJ 07302, USA. Tarkistettu: lokakuuta 2021.
SIVUVAIKUTUKSET
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Hypertensio
COZAARin turvallisuutta on arvioitu yli 3 300 aikuispotilaalla, joita hoidettiin essentiaalisen verenpaineen vuoksi, ja yhteensä 4 058 potilaalla/henkilöllä. Yli 1 200 potilasta hoidettiin yli 6 kuukautta ja yli 800 yli vuoden.
Hoito COZAAR 25 mg:lla oli hyvin siedetty, ja haittavaikutusten yleinen ilmaantuvuus oli samanlainen kuin lumelääkkeellä. Kontrolloiduissa kliinisissä tutkimuksissa haittavaikutusten vuoksi hoidon lopettaminen tapahtui 2,3 %:lla potilaista, jotka saivat COZAAR 25 mg:lla ja 3,7 %:lla potilaista, jotka saivat lumelääkettä. Neljässä kliinisessä tutkimuksessa, joihin osallistui yli 1000 potilasta eri annoksilla (10-150 mg) losartaanikaliumia ja yli 300 potilasta, jotka saivat lumelääkettä, haittatapahtumat, joita esiintyi ≥ 2 %:lla COZAAR 25 mg:lla hoidetuista potilaista ja yleisemmin kuin lumelääkettä saaneista potilaista, olivat: huimaus (3 % vs. 2 %), ylempien hengitysteiden infektio (8 % vs. 7 %), nenän tukkoisuus (2 % vs. 1 %) ja selkäkipu (2 % vs. 1 %).
Seuraavia vähemmän yleisiä haittavaikutuksia on raportoitu:
Veri- ja imukudosjärjestelmän häiriöt: Anemia.
Psyykkiset häiriöt: Masennus.
Hermoston häiriöt: Uneliaisuus, päänsärky, unihäiriöt, parestesia, migreeni.
Korvan ja labyrintin häiriöt: Huimaus, tinnitus.
Sydämen häiriöt: Sydämentykytys, pyörtyminen, eteisvärinä, CVA.
Hengityselimet, rintakehä ja välikarsina: Hengenahdistus.
Ruoansulatuskanavan häiriöt: Vatsakipu, ummetus, pahoinvointi, oksentelu.
Ihon ja ihonalaisen kudoksen häiriöt: Urtikaria, kutina, ihottuma, valoherkkyys.
Tuki- ja liikuntaelimistön ja sidekudoksen häiriöt: Myalgia, nivelkipu.
Sukuelinten ja rintojen häiriöt: Impotenssi.
Yleiset häiriöt ja antopaikan haitat: Turvotus.
Yskä
Jatkuva kuiva yskä (muutaman prosentin ilmaantuvuus) on liitetty ACE:n estäjien käyttöön ja voi käytännössä olla syynä ACE:n estäjähoidon keskeyttämiseen. Kaksi prospektiivista, rinnakkaisryhmien kaksoissokkoutettua, satunnaistettua, kontrolloitua tutkimusta suoritettiin arvioimaan losartaanin vaikutusta yskän aiheuttamiin verenpainepotilaisiin, jotka olivat kokeneet yskää ACE:n estäjähoidon aikana. Potilaat, joilla oli tyypillistä ACE-estäjän yskää lisinopriililla ja joiden yskä hävisi lumelääkkeellä, satunnaistettiin saamaan 50 mg losartaania, 20 mg lisinopriilia tai joko lumelääkettä (yksi tutkimus, n=97) tai 25 mg hydroklooritiatsidia (n=135). Kaksoissokkohoitojakso kesti jopa 8 viikkoa. Yskän ilmaantuvuus on esitetty alla olevassa taulukossa 1.
Nämä tutkimukset osoittavat, että losartaanihoitoon liittyvän yskän ilmaantuvuus populaatiossa, jolla kaikilla oli ACE:n estäjähoitoon liittyvää yskää, on samanlainen kuin hydroklooritiatsidi- tai lumelääkehoitoon liittyvän yskän ilmaantuvuus.
Losartaanin käytön yhteydessä on raportoitu yskätapauksia, mukaan lukien positiiviset uusintahaasteet, markkinoille tulon jälkeen.
Hypertensiiviset potilaat, joilla on vasemman kammion hypertrofia
Losartan Intervention for Endpoint (LIFE) -tutkimuksessa COZAAR 100 mg:n haittavaikutukset olivat samanlaisia kuin aiemmin raportoidut verenpainepotilailla.
Nefropatia tyypin 2 diabeetikoilla
NIDDM:n päätepisteiden vähentäminen Angiotensiini II -reseptoriantagonisti losartaanilla (RENAAL) -tutkimuksessa, johon osallistui 1513 potilasta, joita hoidettiin COZAAR 100 mg orplasebolla, raportoitujen haittavaikutusten kokonaisilmaantuvuus oli samanlainen kahdessa ryhmässä. COZAAR-hoidon lopettaminen sivuvaikutusten vuoksi oli samanlaista kuin lumelääke (19 % COZAAR 100 mg:n ja 24 % lumelääkkeen osalta). Lääkesuhteesta riippumatta ilmoitetut haittatapahtumat, joiden ilmaantuvuus oli ≥4 % COZAAR 50 mg:lla hoidetuista potilaista ja joita esiintyi ≥2 % erolla losartaaniryhmässä verrattuna lumelääkeryhmään tavanomaisen verenpainelääkityksen taustalla, olivat voimattomuus/väsymys, rintakipu. , hypotensio, ortostaattinen hypotensio, ripuli, anemia, hyperkalemia, hypoglykemia, selkäkipu, lihasheikkous ja virtsatieinfektio.
Markkinoinnin jälkeinen kokemus
Seuraavia muita haittavaikutuksia on raportoitu COZAARin markkinoille tulon jälkeen. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisista populaatioista, ei ole aina mahdollista arvioida luotettavasti niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeille altistumiseen:
Ruoansulatus: Hepatiitti.
Yleiset häiriöt ja hallintosivuston ehdot: huonovointisuus.
Hematologinen: Trombosytopenia.
Yliherkkyys: Angioedeemaa, mukaan lukien kurkunpään ja äänihuuman turvotus, joka aiheuttaa hengitysteiden tukkeutumista ja/tai kasvojen, huulten, nielun ja/tai kielen turvotusta, on raportoitu harvoin losartaanilla hoidetuilla potilailla. joillakin näistä potilaista on aiemmin esiintynyt angioedeemaa muiden lääkkeiden, mukaan lukien ACE:n estäjien, käytön yhteydessä. Vaskuliittia, mukaan lukien Henoch-Schönleinin purppura, on raportoitu. Anafylaktisia reaktioita on raportoitu.
Aineenvaihdunta ja ravitsemus: Hyponatremia.
Tuki- ja liikuntaelimistö: Rabdomyolyysi.
Hermoston häiriöt: Dysgeusia.
Iho: Erytroderma.
HUUMEIDEN VUOROVAIKUTUKSET
Seerumin kaliumia lisäävät aineet
Losartaanin samanaikainen käyttö muiden seerumin kaliumpitoisuutta nostavien lääkkeiden kanssa voi johtaa hyperkalemiaan. Seuraa seerumin kaliumarvoa tällaisilla potilailla.
Litium
Seerumin litiumpitoisuuksien nousua ja litiumtoksisuutta on raportoitu käytettäessä litiumia samanaikaisesti angiotensiini II -reseptorin salpaajien kanssa. Tarkkaile seerumin litiumpitoisuutta samanaikaisen käytön aikana.
Ei-steroidiset tulehduskipulääkkeet (NSAID), mukaan lukien selektiiviset syklo-oksigenaasi-2-estäjät (COX-2-estäjät)
Iäkkäillä, nestevajautuneilla potilailla (mukaan lukien diureettihoitoa saavat) tai munuaisten vajaatoiminnalla tulehduskipulääkkeiden, mukaan lukien selektiivisten COX-2:n estäjien, samanaikainen käyttö angiotensiini II -reseptorin salpaajien (mukaan lukien losartaani) kanssa voi heikentää munuaisten toimintaa. mukaan lukien mahdollinen akuutti munuaisten vajaatoiminta. Nämä vaikutukset ovat yleensä palautuvia. Seuraa munuaisten toimintaa säännöllisesti potilailla, jotka saavat losartaania ja NSAID-hoitoa.
Tulehduskipulääkkeet, mukaan lukien selektiiviset COX-2-estäjät, voivat heikentää angiotensiini II -reseptoriantagonistien, mukaan lukien losartaanin, verenpainetta alentavaa vaikutusta.
Reniini-angiotensiinijärjestelmän (RAS) kaksoisesto
RAS:n kaksoissalpaus angiotensiinireseptorin salpaajilla, ACE:n estäjillä tai aliskireenilla liittyy lisääntyneeseen hypotension, pyörtymisen, hyperkalemian ja munuaisten toiminnan muutosten (mukaan lukien akuutin munuaisten vajaatoiminnan) riskiin verrattuna monoterapiaan.
Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) -tutkimukseen otettiin mukaan 1448 potilasta, joilla oli tyypin 2 diabetes, kohonnut virtsan albumiini-kreatiniinisuhde ja alentunut arvioitu glomerulussuodatusnopeus (GFR 30–89,9 ml/min). tai lumelääkettä losartaanihoidon taustalla ja seurasi niitä keskimäärin 2,2 vuoden ajan. Potilaat, jotka saivat losartaanin ja lisinopriilin yhdistelmää, eivät saaneet lisähyötyä monoterapiaan verrattuna GFR:n heikkenemisen, loppuvaiheen munuaissairauden tai kuoleman yhdistettyyn päätetapahtumaan, mutta hyperkalemian ja akuutin munuaisvaurion ilmaantuvuus lisääntyi monoterapiaryhmään verrattuna.
Useimmille potilaille ei ole yhdistetty kahden RAS-estäjän samanaikaiseen käyttöön mitään hyötyä. Vältä yleensä RAS-estäjien yhteiskäyttöä. Seuraa tarkasti verenpainetta, munuaisten toimintaa ja elektrolyyttejä potilailla, jotka saavat COZAAR 100 mg:aa ja muita RAS:aan vaikuttavia aineita.
Älä anna aliskireenia samanaikaisesti COZAAR 100 mg:n kanssa diabeetikoille. Vältä aliskireenin käyttöä COZAARin kanssa potilailla, joilla on munuaisten vajaatoiminta (GFR
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Sikiön toksisuus
COZAAR voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. Reniini-angiotensiinijärjestelmään vaikuttavien lääkkeiden käyttö raskauden toisen ja kolmannen kolmanneksen aikana heikentää sikiön munuaisten toimintaa ja lisää sikiön ja vastasyntyneen sairastuvuutta ja kuolemaa. Tuloksena olevat oligohydramnionit voivat liittyä sikiön keuhkojen hypoplasiaan ja luuston epämuodostumiin. Mahdollisia vastasyntyneiden haittavaikutuksia ovat kallon hypoplasia, anuria, hypotensio, munuaisten vajaatoiminta ja kuolema. Kun raskaus havaitaan, lopeta COZAAR 100 mg:n käyttö mahdollisimman pian [katso Käyttö tietyissä populaatioissa ] .
Hypotensio volyymi- tai suolavajauspotilailla
Potilailla, joilla on aktivoitunut reniini-angiotensiinijärjestelmä, kuten neste- tai suolavajaus (esim. suurilla diureetiannoksilla hoidetuilla potilailla), COZAAR-hoidon aloittamisen jälkeen voi ilmetä oireenmukaista hypotensiota. Korjaa tilavuuden tai suolan väheneminen ennen COZAARin antamista [katso ANNOSTELU JA HALLINNOINTI ] .
Munuaisten toiminnan heikkeneminen
Muutoksia munuaisten toiminnassa, mukaan lukien akuutti munuaisten vajaatoiminta, voivat aiheuttaa lääkkeet, jotka estävät reniini-angiotensiinijärjestelmää, ja diureetit. Potilailla, joiden munuaisten toiminta saattaa riippua osittain reniini-angiotensiinijärjestelmän aktiivisuudesta (esim. potilaat, joilla on munuaisvaltimon ahtauma, krooninen munuaissairaus, vaikea sydämen vajaatoiminta tai volyymivaje), voi olla erityinen riski akuutin munuaisten vajaatoiminnan kehittymiselle COZAAR-hoidon aikana. Seuraa näiden potilaiden munuaisten toimintaa säännöllisesti. Harkitse hoidon keskeyttämistä tai lopettamista potilailla, joille kehittyy kliinisesti merkittävä munuaistoiminnan heikkeneminen COZAAR-hoidon aikana [ks. HUUMEIDEN VUOROVAIKUTUKSET ja Käyttö tietyissä populaatioissa ] .
Hyperkalemia
Tarkkaile seerumin kaliumtasoa säännöllisesti ja käsittele asianmukaisesti. COZAAR 25 mg:n annoksen pienentäminen tai hoidon lopettaminen saattaa olla tarpeen [ks HAITTAVAIKUTUKSET ] .
Muiden lääkkeiden, jotka voivat lisätä seerumin kaliumpitoisuutta, samanaikainen käyttö voi johtaa hyperkalemiaan [katso HUUMEIDEN VUOROVAIKUTUKSET ] .
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä (potilastiedot).
Raskaus
Neuvo hedelmällisessä iässä oleville naispotilaille COZAAR 100 mg:lle altistumisen seurauksista raskauden aikana. Keskustele hoitovaihtoehdoista raskaaksi tulemista suunnittelevien naisten kanssa. Kerro potilaille ilmoittamaan raskaudesta lääkärilleen mahdollisimman pian [katso VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ] .
Kaliumlisät
Neuvo COZAAR-hoitoa saavia potilaita olemaan käyttämättä kaliumlisäaineita tai kaliumia sisältäviä suolan korvikkeita neuvottelematta terveydenhuollon tarjoajansa kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ] .
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Losartaanikalium ei ollut karsinogeeninen, kun sitä annettiin rotille maksimi siedetyillä annoksilla 105 ja hiirille 92 viikon ajan. Naarasrotilla, joille annettiin suurin annos (270 mg/kg/vrk), haiman akinaariadenooman ilmaantuvuus oli hieman suurempi. Suurin siedetyt annokset (270 mg/kg/vrk rotilla, 200 mg/kg/vrk hiirillä) saivat losartaanille ja sen farmakologisesti aktiiviselle metaboliitille noin 160- ja 90-kertaiset (rotat) ja 30- ja 15-kertaiset (hiiret) systeemiset altistukset. 50 kg painavan ihmisen altistuminen 100 mg vuorokaudessa.
Losartaanikalium oli negatiivinen mikrobimutageneesi- ja V-79-nisäkässolumutageneesimäärityksissä sekä in vitro alkalisella eluutiolla ja in vitro ja in vivo kromosomipoikkeavuusmäärityksissä. Lisäksi aktiivinen metaboliitti ei osoittanut genotoksisuutta mikrobimutageneesissä, in vitro alkalisessa eluutiossa ja in vitro kromosomipoikkeavuusmäärityksissä.
Hedelmällisyyteen ja lisääntymiskykyyn ei vaikuttanut tutkimuksissa urosrotilla, joille annettiin losartaanikaliumia suun kautta noin 150 mg/kg/vrk. Myrkyllisten annostasojen antaminen naisilla (300/200 mg/kg/vrk) liittyi merkitsevästi (p
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
COZAAR voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. Reniini-angiotensiinijärjestelmään vaikuttavien lääkkeiden käyttö raskauden toisen ja kolmannen kolmanneksen aikana heikentää sikiön munuaisten toimintaa ja lisää sikiön ja vastasyntyneen sairastuvuutta ja kuolemaa. Useimmat epidemiologiset tutkimukset, joissa tutkittiin sikiön poikkeavuuksia verenpainetta alentaville lääkkeille ensimmäisen raskauskolmanneksen aikana, eivät ole erottaneet reniini-angiotensiinijärjestelmään vaikuttavia lääkkeitä muista verenpainetta alentavista aineista. Kun raskaus havaitaan, lopeta COZAAR-hoito mahdollisimman pian (ks Kliiniset näkökohdat ).
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Kaikilla raskauksilla on taustariski synnynnäisille epämuodostumille, menetyksille tai muille haitallisille seurauksille. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia.
Kliiniset näkökohdat
Äidin ja/tai alkion/sikiön sairauteen liittyvä riski
Raskaudenaikainen hypertensio lisää äidin riskiä pre-eklampsialle, raskausdiabetekselle, ennenaikaisille synnytyksille ja synnytyskomplikaatioille (esim. keisarileikkauksen tarve, synnytyksen jälkeinen verenvuoto). Hypertensio lisää sikiön riskiä kohdunsisäiseen kasvun rajoittumiseen ja kohdunsisäiseen kuolemaan. Raskaana olevia naisia, joilla on verenpainetauti, on seurattava huolellisesti ja hoidettava sen mukaisesti.
Sikiön/vastasyntyneen haittavaikutukset

Oligohydramnionit raskaana olevilla naisilla, jotka käyttävät reniini-angiotensiinijärjestelmään vaikuttavia lääkkeitä raskauden toisella ja kolmannella kolmanneksella, voivat johtaa seuraaviin: sikiön munuaisten toiminnan heikkeneminen, mikä johtaa anuriaan ja munuaisten vajaatoimintaan, sikiön keuhkojen hypoplasia, luuston epämuodostumat, mukaan lukien kallon hypoplasia, hypotensio , ja kuolema. Epätavallisessa tapauksessa, että reniini-angiotensiinijärjestelmään vaikuttavilla lääkkeillä ei ole sopivaa vaihtoehtoa tietylle potilaalle, kerro äidille mahdollisesta riskistä sikiölle.
Potilaille, jotka käyttävät COZAARia raskauden aikana, suorita sarja ultraäänitutkimuksia lapsivesiympäristön arvioimiseksi. Sikiön testaus voi olla tarkoituksenmukaista raskausviikon perusteella. Jos havaitaan oligohydramnionia, lopeta COZAAR 50 mg:n käyttö, ellei sitä pidetä äidin hengenpelastajana. Potilaiden ja lääkäreiden tulee kuitenkin olla tietoisia siitä, että oligohydramnionit saattavat ilmaantua vasta sen jälkeen, kun sikiö on saanut peruuttamattoman vamman.
Tarkkaile tarkasti vastasyntyneitä, jotka ovat altistuneet kohdussa COZAAR:lle hypotension, oligurian ja hyperkalemian vuoksi. Jos vastasyntynyt on altistunut kohdussa COZAAR 100 mg:lle, jos esiintyy oliguriaa tai hypotensiota, tue verenpainetta ja munuaisten perfuusiota. Vaihtosiirtoja tai dialyysiä voidaan tarvita keinona vähentää hypotensiota ja korvata munuaisten toiminta.
Data
Eläinten tiedot
Losartaanikaliumia annettiin rotille suun kautta myöhäisen tiineyden jakson aikana imetyksen välisenä aikana (raskauspäivä 15 - imetyspäivä 20) annoksina 10, 25 ja 100 mg/kg/vrk. Losartaanikaliumin on osoitettu aiheuttavan haittavaikutuksia rotan sikiöille ja vastasyntyneille, mukaan lukien painon aleneminen, fyysisen ja käyttäytymisen kehityksen viivästyminen, kuolleisuus ja munuaistoksisuus. Lukuun ottamatta vastasyntyneen painonnousua (johon vaikuttivat niinkin pienet annokset kuin 10 mg/kg/vrk), näihin vaikutuksiin liittyvät annokset ylittivät 25 mg/kg/vrk (noin kolme kertaa suurempi kuin ihmiselle suositeltu enimmäisannos 100 mg/mg /m perusteella). Nämä havainnot johtuvat lääkkeiden altistumisesta raskauden loppuvaiheessa ja imetyksen aikana. Merkittäviä losartaanin ja sen aktiivisen metaboliitin määriä havaittiin olevan rotan sikiön plasmassa myöhään tiineyden aikana ja rotan maidossa.
Imetys
Riskien yhteenveto
Ei tiedetä, erittyykö losartaani äidinmaitoon, mutta merkittäviä määriä losartaania ja sen aktiivista metaboliittia on osoitettu olevan rotan maidossa. Imevälle mahdollisesti aiheutuvien haittavaikutusten vuoksi on tehtävä päätös, lopetetaanko imetys vai lääkkeen käyttö, ottaen huomioon lääkkeen merkitys äidille.
Käyttö lapsille
COZAARin verenpainetta alentavat vaikutukset on osoitettu 6–16-vuotiailla hypertensiivisillä lapsipotilailla. Turvallisuutta ja tehokkuutta ei ole osoitettu alle 6-vuotiailla lapsipotilailla tai lapsipotilailla, joiden glomerulussuodatusnopeus ANNOSTELU JA HALLINNOINTI , KLIININEN FARMAKOLOGIA ja Kliiniset tutkimukset ] .
Geriatrinen käyttö
Potilaiden kokonaismäärästä, jotka saivat COZAAR 25 mg:aa kontrolloiduissa kliinisissä verenpainetutkimuksissa, 391 potilasta (19 %) oli vähintään 65-vuotiaita ja 37 potilasta (2 %) 75-vuotiaita tai vanhempia. Kontrolloidussa kliinisessä tutkimuksessa munuaisten suojaamiseksi tyypin 2 diabeetikoilla, joilla oli proteinuria, 248 potilasta (33 %) oli vähintään 65-vuotiaita. Kontrolloidussa kliinisessä tutkimuksessa sydän- ja verisuoniperäisen kuoleman, aivohalvauksen ja sydäninfarktin yhteisriskin vähentämiseksi hypertensiivisillä potilailla, joilla oli vasemman kammion hypertrofia, 2857 potilasta (62 %) oli vähintään 65-vuotiaita ja 808 potilasta (18 %) 75 vuotta täyttäneitä. . Näiden potilaiden ja nuorempien potilaiden välillä ei havaittu yleisiä eroja tehokkuudessa tai turvallisuudessa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
Rotu
LIFE-tutkimuksessa mustaihoisilla potilailla, joilla oli hypertensio ja vasemman kammion hypertrofia, joita hoidettiin atenololilla, oli pienempi riski saada ensisijainen yhdistetty päätepiste kuin mustaihoisilla potilailla, joita hoidettiin COZAARilla (molempia hoidettiin samanaikaisesti hydroklooritiatsidilla suurimmalla osalla potilaista). Ensisijainen päätetapahtuma oli aivohalvauksen, sydäninfarktin tai sydän- ja verisuoniperäisen kuoleman ensimmäinen esiintyminen, joka analysoitiin intentio-to-treat (ITT) -lähestymistapaa käyttäen. Mustaihoisten potilaiden alaryhmässä (n = 533, 6 % LIFE-tutkimuksen potilaista) oli 29 ensisijaista päätetapahtumaa 263 atenololia saaneen potilaan joukossa (11 %, 26 per 1000 potilasvuotta) ja 46 ensisijaista päätetapahtumaa 270 potilaalla (17 % 42 per 1000 potilasvuotta) COZAARissa. Tätä havaintoa ei voitu selittää muiden populaatioiden kuin rodun eroilla tai hoitoryhmien välisillä epätasapainoilla. Lisäksi verenpaineen lasku molemmissa hoitoryhmissä oli yhdenmukainen mustien ja muiden potilaiden välillä. Koska suurissa kokeissa on vaikea tulkita osajoukkojen eroja, ei voida tietää, johtuuko havaittu ero sattumasta. LIFE-tutkimus ei kuitenkaan tarjoa näyttöä siitä, että COZAAR 100 mg:n edut sydän- ja verisuonitapahtumien riskin vähentämisessä verenpainepotilailla, joilla on vasemman kammion hypertrofia, pätevät mustaihoisille potilaille [ks. Kliiniset tutkimukset ] .
Munuaisten vajaatoiminta
Munuaisten vajaatoimintaa sairastavilla potilailla losartaanin ja sen aktiivisen metaboliitin pitoisuus plasmassa on kohonnut verrattuna potilaisiin, joiden munuaisten toiminta on normaali. Annosta ei tarvitse muuttaa potilailla, joilla on munuaisten vajaatoiminta, ellei munuaisten vajaatoimintaa sairastavan potilaan tilavuus ole myös heikentynyt [ks. ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ] .
Maksan vajaatoiminta
Suositeltu COZAAR-aloitusannos on 25 mg potilailla, joilla on lievä tai keskivaikea maksan vajaatoiminta. Suun kautta antamisen jälkeen potilaille, joilla on lievä tai keskivaikea maksan vajaatoiminta, losartaanin ja sen aktiivisen metaboliitin pitoisuudet plasmassa olivat vastaavasti 5-kertaiset ja 1,7-kertaiset terveillä vapaaehtoisilla havaittuun verrattuna. COZAAR-valmistetta ei ole tutkittu potilailla, joilla on vaikea maksan vajaatoiminta [ks. ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ] .
YLIANNOSTUS
Merkittävää kuolleisuutta havaittiin hiirillä ja rotilla, kun suun kautta annettiin 1000 mg/kg ja 2000 mg/kg, vastaavasti noin 44 ja 170 kertaa suurin suositeltu ihmisannos mg/m2:n perusteella.
Yliannostuksista ihmisillä on saatavilla rajoitetusti tietoa. Yliannostuksen todennäköisin ilmentymä olisi hypotensio ja takykardia; bradykardia voi johtua parasympaattisesta (vagaalisesta) stimulaatiosta. Jos oireista hypotensiota ilmenee, tukihoitoa tulee aloittaa.
Losartaania tai sen aktiivista metaboliittia ei voida poistaa hemodialyysillä.
VASTA-AIHEET
COZAAR 50mg on vasta-aiheinen:
- Potilaille, jotka ovat yliherkkiä jollekin tämän tuotteen aineosalle.
- Yhteiseen käyttöön aliskireenin kanssa diabeetikoille.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Angiotensiini II [muodostuu angiotensiini I:stä angiotensiiniä konvertoivan entsyymin (ACE, kininaasi II) katalysoimassa reaktiossa] on voimakas vasokonstriktori, reniini-angiotensiinijärjestelmän primaarinen vasoaktiivinen hormoni ja tärkeä komponentti kohonneen verenpaineen patofysiologiassa. Se stimuloi myös lisämunuaiskuoren aldosteronin eritystä. Losartaani ja sen pääasiallinen aktiivinen metaboliitti estävät angiotensiini II:n vasokonstriktori- ja aldosteronia erittävät vaikutukset estämällä selektiivisesti angiotensiini II:n sitoutumisen monissa kudoksissa (esim. verisuonten sileässä lihaksessa, lisämunuaisessa) esiintyviin AT1-reseptoriin. Monissa kudoksissa on myös AT1-reseptoria, mutta sen ei tiedetä liittyvän kardiovaskulaariseen homeostaasiin. Losartaanilla tai sen pääasiallisella aktiivisella metaboliitilla ei ole osittaista agonistivaikutusta AT1-reseptoriin, ja molemmilla on paljon suurempi affiniteetti (noin 1000-kertainen) AT1-reseptoriin kuin AT1-reseptoriin. In vitro -sitoutumistutkimukset osoittavat, että losartaani on palautuva, kilpaileva AT1-reseptorin estäjä. Aktiivinen metaboliitti on 10–40 kertaa voimakkaampi painon mukaan kuin losartaani, ja se näyttää olevan palautuva, ei-kilpaileva AT1-reseptorin estäjä.
Losartaani tai sen aktiivinen metaboliitti eivät estä ACE:tä (kininaasi II, entsyymi, joka muuttaa angiotensiini I:n angiotensiini II:ksi ja hajottaa bradykiniiniä), eivätkä ne sitoudu tai estä muita hormonireseptoreja tai ionikanavia, joiden tiedetään olevan tärkeitä kardiovaskulaarisessa säätelyssä.
Farmakodynamiikka
Losartaani estää angiotensiini II:n (sekä angiotensiini I:n) infuusioiden painetta alentavaa vaikutusta. 100 mg:n annos estää painetta aiheuttavan vaikutuksen huipussaan noin 85 %, ja 25-40 % esto jatkuu 24 tuntia. Angiotensiini II:n negatiivisen palautteen poistaminen kaksin- tai kolminkertaistaa plasman reniiniaktiivisuuden ja lisää sen seurauksena inangiotensiini II:n plasmapitoisuutta verenpainepotilailla. Losartaani ei vaikuta bradykiniinivasteeseen, kun taas ACE:n estäjät lisäävät vastetta tobradykiniinille. Plasman aldosteronipitoisuudet laskevat losartaanin annon jälkeen. Huolimatta losartaanin vaikutuksesta aldosteronin eritykseen, havaittiin hyvin vähän vaikutusta seerumin kaliumiin.
Losartaanin vaikutus ilmenee olennaisesti viikossa, mutta joissakin tutkimuksissa maksimaalinen vaikutus saavutettiin 3-6 viikossa. Pitkäaikaisissa seurantatutkimuksissa (ilman plasebokontrollia) losartaanin vaikutus näytti jatkuvan jopa vuoden ajan. Losartaanin äkillisen lopettamisen jälkeen ei ole ilmeistä rebound-vaikutusta. Kontrolloiduissa tutkimuksissa losartaanihoitoa saaneiden potilaiden keskimääräisessä sykkeessä ei havaittu periaatteessa muutoksia.
Farmakokinetiikka
Imeytyminen
Oraalisen annon jälkeen losartaani imeytyy hyvin ja käy läpi merkittävän ensikierron metabolian. Losartaanin systeeminen hyötyosuus on noin 33 %. Losartaanin ja sen aktiivisen metaboliitin keskimääräiset huippupitoisuudet saavutetaan 1 tunnissa ja vastaavasti 3-4 tunnissa. Vaikka losartaanin ja sen aktiivisen metaboliitin maksimipitoisuudet plasmassa ovat suunnilleen samat, metaboliitin AUC (käyrän alla oleva pinta-ala) on noin 4 kertaa niin suuri kuin oflosartaanin. Ateria hidastaa losartaanin imeytymistä ja alentaa sen Cmax-arvoa, mutta sillä on vain vähäinen vaikutus losartaanin AUC-arvoon tai metaboliitin AUC-arvoon (noin 10 %:n lasku). Losartaanin ja sen aktiivisen metaboliitin farmakokinetiikka on lineaarinen oraalisilla losartaaniannoksilla aina 200 mg:aan asti, eivätkä ne muutu ajan myötä.
Jakelu
Losartaanin ja aktiivisen metaboliitin jakautumistilavuus on noin 34 litraa ja vastaavasti 12 litraa. Sekä losartaani että sen aktiivinen metaboliitti sitoutuvat voimakkaasti plasman proteiineihin, pääasiassa albumiiniin, ja plasman vapaat fraktiot ovat 1,3 % ja 0,2 %. Sitoutuminen plasman proteiineihin on vakio suositelluilla annoksilla saavutetulla pitoisuusalueella. Rotilla tehdyt tutkimukset osoittavat, että losartaani läpäisee veri-aivoesteen huonosti, jos ollenkaan.
Aineenvaihdunta
Losartaani on oraalisesti vaikuttava aine, joka metaboloituu merkittävästi sytokromi P450 -entsyymien kautta. Se muuttuu osittain aktiiviseksi karboksyylihappometaboliitiksi, joka on vastuussa suurimmasta osasta losartaanihoidon jälkeisestä angiotensiini II -reseptoriantagonismista. Noin 14 % suun kautta annetusta losartaaniannoksesta muuttuu aktiiviseksi metaboliitiksi. Aktiivisen karboksyylihappometaboliitin lisäksi muodostuu useita inaktiivisia metaboliitteja. In vitro -tutkimukset osoittavat, että sytokromi P450 2C9 ja 3A4 osallistuvat losartaanin biotransformaatioon sen metaboliiteiksi.
Eliminointi
Losartaanin kokonaispuhdistuma plasmasta on noin 600 ml/min ja aktiivisen metaboliitin noin 50 ml/min. Munuaispuhdistuma on noin 75 ml/min ja 25 ml/min. Losartaanin terminaalinen puoliintumisaika on noin 2 tuntia ja metaboliitin noin 6-9 tuntia. Kun losartaania on annettu kerta-annoksina suun kautta, noin 4 % annoksesta erittyy muuttumattomana virtsaan ja noin 6 % erittyy virtsaan aktiivisena metaboliittina. Sappien erittyminen edistää losartaanin ja sen metaboliittien eliminaatiota. Oraalisen 14C-leimatun losartaanin jälkeen noin 35 % radioaktiivisuudesta erittyy virtsaan ja noin 60 % ulosteeseen. Suonensisäisen 14C-leimatun losartaaniannoksen jälkeen noin 45 % radioaktiivisuudesta erittyy virtsaan ja 50 % ulosteeseen. Losartaani tai sen metaboliitti eivät kerry plasmaan toistuvan kerran vuorokaudessa annettaessa.
Tietyt populaatiot
Pediatriset
Alla olevassa taulukossa 4 on esitetty farmakokineettiset parametrit useiden losartaaniannosten (keskimääräinen annos 0,7 mg/kg, vaihteluväli 0,36-0,97 mg/kg) tablettina 25 6-16-vuotiaalle verenpainepotilaalle. Losartaanin ja sen aktiivisen metaboliitin farmakokinetiikka oli yleensä samanlainen kaikissa tutkituissa ikäryhmissä ja samankaltainen kuin historialliset farmakokineettiset tiedot aikuisilla. Tärkeimmät farmakokineettiset parametrit aikuisilla ja lapsilla on esitetty alla olevassa taulukossa.
Suspensioformulaation biologista hyötyosuutta verrattiin losartaanitabletteihin terveillä aikuisilla. Suspension ja tabletin biologinen hyötyosuus on samanlainen sekä losartaanin että aktiivisen metaboliitin suhteen [ks. ANNOSTELU JA HALLINNOINTI ] .
Geriatria ja sukupuoli
Losartaanin farmakokinetiikkaa on tutkittu vanhuksilla (65-75-vuotiailla) ja molemmilla sukupuolilla. Losartaanin ja sen aktiivisen metaboliitin pitoisuudet plasmassa ovat samanlaiset vanhuksilla ja nuorilla verenpainepotilailla. Losartaanin pitoisuudet plasmassa olivat noin kaksi kertaa korkeammat naisilla verenpainepotilailla kuin miehillä, mutta aktiivisen metaboliitin pitoisuudet olivat samanlaiset miehillä ja naisilla. Annoksen muuttaminen ei ole tarpeen [katso ANNOSTELU JA HALLINNOINTI ] .
Rotu
Rodusta johtuvia farmakokineettisiä eroja ei ole tutkittu [katso Käyttö tietyissä populaatioissa ] .
Munuaisten vajaatoiminta
Suun kautta antamisen jälkeen losartaanin ja sen aktiivisen metaboliitin plasmapitoisuudet ja AUC-arvot suurenevat 50–90 % potilailla, joilla on lievä (kreatiniinipuhdistuma 50–74 ml/min) tai kohtalainen (kreatiniinipuhdistuma 30–49 ml/min) munuaisten vajaatoiminta. . Tässä tutkimuksessa sekä losartaanin että sen aktiivisen metaboliitin munuaispuhdistuma pieneni 55-85 % potilailla, joilla oli lievä tai kohtalainen munuaisten vajaatoiminta. Losartaania tai sen aktiivista metaboliittia ei voida poistaa hemodialyysillä [katso VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ] .
Maksan vajaatoiminta
Kun losartaania annettiin suun kautta potilaille, joilla on lievä tai kohtalainen alkoholiperäinen maksakirroosi, plasman losartaanin ja sen aktiivisen metaboliitin pitoisuudet olivat vastaavasti 5-kertaiset ja noin 1,7-kertaiset verrattuna nuoriin vapaaehtoisiin miehiin. Maksan vajaatoimintaa sairastavien losartaanin plasmapuhdistuma oli noin 50 % pienempi ja oraalinen hyötyosuus noin kaksinkertainen verrattuna normaaleihin koehenkilöihin. Käytä 25 mg:n aloitusannosta potilaille, joilla on lievä tai kohtalainen maksan vajaatoiminta. COZAAR 50 mg:aa ei ole tutkittu potilailla, joilla on vaikea maksan vajaatoiminta (ks ANNOSTELU JA HALLINNOINTI ja Käyttö tietyissä populaatioissa ] .
Huumeiden vuorovaikutukset
Kliinisesti merkittäviä yhteisvaikutuksia losartaanikaliumilla ei ole havaittu tutkimuksissa hydroklooritiatsidin, digoksiinin, varfariinin, simetidiinin ja fenobarbitaalin kanssa. Rifampiinin on kuitenkin osoitettu pienentävän losartaanin ja sen aktiivisen metaboliitin AUC-arvoa 30 % ja 40 %. Flukonatsoli, sytokromiP450 2C9:n estäjä, pienensi aktiivisen metaboliitin AUC-arvoa noin 40 %, mutta lisäsi losartaanin AUC-arvoa noin 70 % toistuvien annosten jälkeen. Ketokonatsoli ei vaikuta losartaanin muuttumiseen aktiiviseksi metaboliitiksi laskimonsisäisen annon jälkeen. P450 3A4:n estäjä. Erytromysiini, P450 3A4:n estäjä, ei vaikuttanut oraalisen losartaanin jälkeisen aktiivisen metaboliitin AUC-arvoon, mutta losartaanin AUC suureni 30 %.
Losartaanin ja P450 2C9:n estäjien samanaikaisen käytön farmakodynaamisia seurauksia ei ole tutkittu. Potilailla, jotka eivät metaboloi losartaania aktiiviseksi metaboliitiksi, on osoitettu olevan spesifinen, harvinainen sytokromi P450 2C9 -vika. Nämä tiedot viittaavat siihen, että losartaanin muuttuminen sen aktiiviseksi metaboliitiksi tapahtuu ensisijaisesti P450 2C9:n eikä P450 3A4:n välityksellä.
Kliiniset tutkimukset
Hypertensio
Aikuisten hypertensio
COZAAR 25 mg:n verenpainetta alentavat vaikutukset osoitettiin pääasiassa neljässä lumekontrolloidussa 6–12 viikkoa kestäneessä tutkimuksessa 10–150 mg:n vuorokausiannoksilla potilailla, joiden diastolinen verenpaine lähtötilanteessa oli 95–115. Tutkimukset mahdollistivat kahden annoksen (50-100 mg/vrk) vertailun kerran vuorokaudessa tai kahdesti vuorokaudessa, huippu- ja alin vaikutusten vertailut sekä vasteiden vertailut sukupuolen, iän ja rodun mukaan. Kolmessa lisätutkimuksessa tutkittiin losartaanin ja hydroklooritiatsidin yhdistelmän verenpainetta alentavia vaikutuksia.
Neljässä losartaanimonoterapiatutkimuksessa oli yhteensä 1075 potilasta, jotka satunnaistettiin saamaan useita losartaaniannoksia ja 334 lumelääkettä. 10 mg:n ja 25 mg:n annokset tuottivat jonkin verran vaikutusta huipussaan (6 tuntia annoksen ottamisen jälkeen), mutta pienet ja epäyhtenäiset vasteet (24 tuntia). Annokset 50, 100 ja 150 mg kerran vuorokaudessa laskivat tilastollisesti merkitsevää keskimääräistä systolista/diastolista verenpaineen laskua verrattuna lumelääkkeeseen välillä 5,5-10,5/3,5-7,5 mmHg, jolloin 150 mg:n annos ei antanut suurempaa vaikutusta kuin 50- 100 mg. Annostelu kahdesti vuorokaudessa annoksella 50-100 mg/vrk antoi johdonmukaisesti suuremmat minimivasteet kuin kerran vuorokaudessa annettu annos samalla kokonaisannoksella. Huippuvaikutukset (6 tuntia) olivat tasaisesti, mutta kohtalaisesti, suuremmat kuin alimmat vaikutukset, ja systolisen vasteen alimman ja huipputason välinen suhde oli 50-95 % ja vastaavasti 60-90 %.
Pienen hydroklooritiatsidiannoksen (12,5 mg) lisääminen losartaanin 50 mg:aan kerran vuorokaudessa johti lumelääkkeeseen mukautetun verenpaineen laskuun 15,5/9,2 mmHg.
Potilaiden iän, sukupuolen ja rodun alaryhmien analyysi osoitti, että miehillä ja naisilla sekä yli ja alle 65-vuotiailla potilailla oli yleensä samanlaiset vasteet. COZAAR 25 mg alensi tehokkaasti verenpainetta rodusta riippumatta, vaikka vaikutus oli hieman vähäisempi mustaihoisilla potilailla (yleensä alhainen reniinipopulaatio).
Lasten hypertensio
Losartaanin verenpainetta alentavaa vaikutusta tutkittiin yhdessä tutkimuksessa, johon osallistui 177 hypertensiivistä 6–16-vuotiasta lapsipotilasta. Lapset, jotka painoivat ANNOSTELU JA HALLINNOINTI . Suurimmalla osalla lapsista oli verenpainetauti, joka liittyy munuaisten ja urogenitaalisiin sairauksiin. Istuvan diastolinen verenpaine (SiDBP) oli tutkimukseen tullessa korkeampi kuin potilaan iän, sukupuolen ja pituuden 95. persentiilitaso. Kolmen viikon lopussa losartaani alensi systolista ja diastolista verenpainetta, mitattuna alimmillaan, annoksesta riippuvalla tavalla. Kaiken kaikkiaan kaksi suurempaa annosta (25 - 50 mg potilailla
Hypertensiiviset potilaat, joilla on vasemman kammion hypertrofia
LIFE-tutkimus oli monikansallinen kaksoissokkotutkimus, jossa verrattiin COZAAR 50 mg:aa ja atenololia 9 193 verenpainepotilaalla, joilla oli EKG-dokumentoitu vasemman kammion hypertrofia. Potilaat, joilla oli sydäninfarkti tai aivohalvaus kuuden kuukauden aikana ennen satunnaistamista, suljettiin pois. Potilaat satunnaistettiin saamaan kerran päivässä 50 mg COZAARia tai 50 mg atenololia. Jos tavoiteverenpainetta (
Satunnaistetuista potilaista 4963 (54 %) oli naisia ja 533 (6 %) mustia. Keski-ikä oli 67 vuotta ja 5704 (62 %) ikä ≥65. Lähtötilanteessa 1195:llä (13 %) oli diabetes, 1326:lla (14 %) oli eristetty systolinen verenpaine, 1469:llä (16 %) sepelvaltimotauti ja 728:lla (8 %) aivoverisuonitauti. Lähtötason keskimääräinen verenpaine oli 174/98 mmHg molemmissa hoitoryhmissä. Keskimääräinen seuranta-aika oli 4,8 vuotta. Tutkimuksen lopussa tai viimeisellä käynnillä ennen ensisijaista päätetapahtumaa 77 % ryhmästä, jota hoidettiin COZAAR 50 mg:lla ja 73 % ryhmästä, jota hoidettiin atenololia, käytti edelleen tutkimuslääkitystä. Tutkimuslääkitystä edelleen käyttävistä potilaista COZAARin ja atenololin keskimääräiset annokset olivat molemmat noin 80 mg/vrk, ja 15 % käytti atenololia tai losartaania monoterapiana, kun taas 77 % sai myös hydroklooritiatsidia (keskimääräisenä annoksena 20 mg/vrk jokainen ryhmä). Alimmalla tasolla mitattu verenpaineen lasku oli samanlainen molemmissa hoitoryhmissä, mutta verenpainetta ei mitattu mihinkään muuhun aikaan päivästä. Tutkimuksen lopussa tai viimeisellä käynnillä ennen ensisijaista päätetapahtumaa keskimääräiset verenpaineet olivat 144,1/81,3 mmHg COZAAR-hoitoa saaneella ryhmällä ja 145,4/80,9 mmHg atenololilla hoidetulla ryhmällä; ero systolisessa verenpaineessa (SBP) 1,3 mmHg oli merkitsevä (p
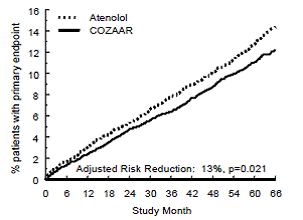
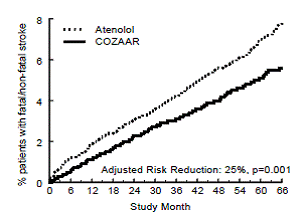
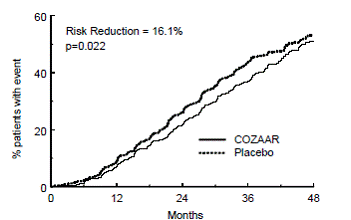
Ensisijainen päätetapahtuma oli ensimmäinen sydän- ja verisuoniperäinen kuolemantapaus, ei-kuolemaan johtanut aivohalvaus tai ei-fataali sydäninfarkti. Potilaat, joilla oli ei-fataalisia tapahtumia, jäivät tutkimukseen, joten jokaisen tyypin ensimmäinen tapahtuma tutkittiin, vaikka se ei olisikaan ensimmäinen tapahtuma (esim. aivohalvauksen jälkeinen aivohalvaus laskettaisiin aivohalvauksen analyysiin). Hoito COZAAR 50 mg:lla johti 13 %:n laskuun (p=0,021) ensisijaisen päätetapahtuman riskissä atenololiryhmään verrattuna (katso kuva 1 ja taulukko 3); tämä ero johtui ensisijaisesti vaikutuksesta kohtalokkaaseen ja ei-fataalliseen aivohalvaukseen. COZAAR-hoito vähensi aivohalvauksen riskiä 25 % suhteessa atenololiin (p=0,001) (katso kuvio 2 ja taulukko 3).
Kuva 1: Kaplan-Meier-arviot ensisijaisesta päätetapahtumasta kardiovaskulaariseen kuolemaan, ei-kuolemaan johtavaan aivohalvaukseen tai ei-kuolemaan johtaneeseen sydäninfarktiin ryhmissä, joita hoidettiin COZAAR 100 mg:lla ja atenololilla. Riskivähennys on mukautettu Framinghamin riskipistemäärän ja elektrokardiografisen vasemman kammion hypertrofian tason mukaan.
Kuva 2: Kaplan-Meier arviot ajasta kohtalokkaaseen/ei-kuolemaan johtavaan aivohalvaukseen ryhmissä, joita hoidettiin COZAAR 50 mg:lla ja atenololilla. Riskivähennys on säädetty Framinghamin perusriskipisteiden ja elektrokardiografisen vasemman kammion hypertrofian tason mukaan
Taulukossa 3 esitetään tulokset ensisijaiselle yhdistetylle päätepisteelle ja yksittäisille päätepisteille. Ensisijainen päätetapahtuma oli ensimmäinen aivohalvauksen, sydäninfarktin tai sydän- ja verisuoniperäisen kuoleman esiintyminen, analysoituna ITT-lähestymistapaa käyttäen. Taulukossa näkyy kunkin komponentin tapahtumien määrä kahdella eri tavalla. Ensisijaisen päätepisteen komponentit (ensimmäisenä tapahtumana) laskevat vain tapahtumat, jotka määrittävät ensisijaisen päätepisteen, kun taas toissijaiset päätepisteet laskevat kaikki tietyn tyyppiset ensimmäiset tapahtumat riippumatta siitä, edelsikö niitä erityyppinen tapahtuma.
Vaikka LIFE-tutkimus suosi COZAARia atenololin sijaan ensisijaisen päätepisteen suhteen (p=0,021), tämä tulos on yhdestä tutkimuksesta ja on siksi vähemmän vakuuttava kuin ero COZAARin ja lumelääkkeen välillä. Vaikka sitä ei mitata suoraan, ero COZAARin ja lumelääkkeen välillä on vakuuttava, koska on näyttöä siitä, että atenololi itsessään on tehokas (verrattuna lumelääkkeeseen) vähentämään sydän- ja verisuonitapahtumia, mukaan lukien aivohalvaus, verenpainepotilailla.
Muita LIFE-tutkimuksen kliinisiä päätepisteitä olivat: kokonaiskuolleisuus, sairaalahoito sydämen vajaatoiminnan tai angina pectoriksen vuoksi, sepelvaltimon tai perifeerinen revaskularisaatiotoimenpiteet ja elvytys sydämenpysähdys. COZAAR- ja atenololiryhmien välillä ei ollut merkittäviä eroja näiden päätepisteiden osuuksissa.
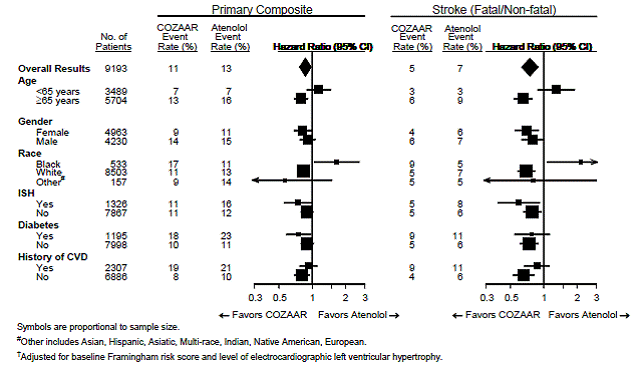
Ensisijaisen päätetapahtuman ja aivohalvauksen osalta COZAAR 25 mg:n vaikutukset potilasalaryhmiin, jotka on määritelty iän, sukupuolen, rodun ja yksittäisen systolisen hypertension (ISH), diabeteksen ja aiemman sydän- ja verisuonitaudin (CVD) esiintymisen tai puuttumisen perusteella, on esitetty alla olevassa kuvassa 3. . Alaryhmäanalyysit voivat olla vaikeasti tulkittavia, eikä tiedetä, edustavatko ne todellisia eroja vai sattumanvaraisia vaikutuksia.
Kuva 3: Ensisijaiset päätepistetapahtumat† demografisissa alaryhmissä
Nefropatia tyypin 2 diabeetikoilla
RENAAL-tutkimus oli satunnaistettu, lumekontrolloitu, kaksoissokkoutettu, monikeskustutkimus, joka suoritettiin maailmanlaajuisesti 1513 potilaalla, joilla oli tyypin 2 diabetes ja joilla oli nefropatia (määritelty seerumin kreatiniinitasoksi 1,3-3,0 mg/dl naisilla tai miehillä ≤60 kg ja 1,5-3,0 mg). /dl miehillä > 60 kg ja proteinuria [virtsan albumiini/kreatiniinisuhde ≥300 mg/g]).
Potilaat satunnaistettiin saamaan COZAARia 50 mg kerran vuorokaudessa tai lumelääkettä tavanomaisen verenpainetta alentavan hoidon yhteydessä, lukuun ottamatta ACE-estäjiä ja angiotensiini II -antagonisteja. Kuukauden kuluttua tutkijoita kehotettiin titraamaan tutkimuslääke 100 mg:aan kerran päivässä, jos alin verenpainetavoite (140/90 mmHg) ei saavutettu. Kaiken kaikkiaan 72 % potilaista sai 100 mg:n vuorokausiannoksen yli 50 % ajasta, jolloin he käyttivät tutkimuslääkettä. Koska tutkimus suunniteltiin saavuttamaan yhtäläinen verenpaineen hallinta molemmissa ryhmissä, muita verenpainetta alentavia aineita (diureetteja, kalsiumkanavasalpaajia, alfa- tai beetasalpaajia ja keskushermostoon vaikuttavia aineita) voitiin lisätä tarpeen mukaan molemmissa ryhmissä. Potilaita seurattiin keskimäärin 3,4 vuoden ajan.
Tutkimuspopulaatio oli erilainen rodun suhteen (aasialainen 16,7 %, musta 15,2 %, latinalaisamerikkalainen 18,3 %, valkoinen 48,6 %). Kaiken kaikkiaan 63,2 % potilaista oli miehiä ja 66,4 % oli alle 65-vuotiaita. Melkein kaikilla potilailla (96,6 %) oli aiemmin ollut verenpainetauti, ja potilaat osallistuivat tutkimukseen keskimääräisellä seerumin kreatiniiniarvolla 1,9 mg/dl ja keskimääräisellä proteinurialla (virtsan albumiini/kreatiniini) 1808 mg/g lähtötasolla.
Tutkimuksen ensisijainen päätetapahtuma oli aika minkä tahansa seuraavan tapahtuman ensimmäiseen esiintymiseen: seerumin kreatiniiniarvon kaksinkertaistuminen, loppuvaiheen munuaissairaus (ESRD) (dialyysin tai elinsiirron tarve) tai kuolema. COZAAR-hoito johti 16 %:n riskin pienenemiseen tässä päätepisteessä (katso kuva 4 ja taulukko 4). COZAAR-hoito vähensi myös seerumin kreatiniinin jatkuvan kaksinkertaistumisen esiintymistä 25 % ja loppuvaiheen sairauden muodostumista 29 % erillisinä päätepisteinä, mutta sillä ei ollut vaikutusta kokonaiskuolleisuuteen (katso taulukko 4).
Keskimääräiset lähtötason verenpaineet olivat 152/82 mmHg COZAAR- ja tavanomaisen verenpainetta alentavan hoidon yhteydessä ja 153/82 mmHg lumelääkityksen ja tavanomaisen verenpainetta alentavan hoidon yhteydessä. Tutkimuksen lopussa keskimääräiset verenpaineet olivat 143/76 mmHg COZAARilla 100 mg hoidetulla ryhmällä ja 146/77 mmHg lumelääkettä saaneella ryhmällä.
Kuva 4: Kaplan-Meier-käyrä ensisijaiselle yhdistetylle päätepisteelle, joka on seerumin kreatiniinin kaksinkertaistuminen, loppuvaiheen munuaissairaus (dialyysin tai transplantaation tarve) tai kuolema
Tutkimuksen toissijaisia päätepisteitä olivat muutos proteinuriassa, muutos munuaissairauden etenemisnopeudessa ja sydän- ja verisuonisairauksien (sairaalahoito sydämen vajaatoiminnan, sydäninfarkti, revaskularisaatio, aivohalvaus, sairaalahoito epästabiilin angina pectoris tai sydän- ja verisuonisairauksien vuoksi) aiheuttaman sairastavuuden ja kuolleisuuden yhdistelmä. kuolema).Plaseboon verrattuna COZAAR vähensi merkitsevästi proteinuriaa keskimäärin 34 %, mikä oli ilmeistä 3 kuukauden kuluessa hoidon aloittamisesta, ja vähensi merkittävästi glomerulussuodatusnopeuden laskua tutkimuksen aikana 13 % mitattuna seerumin kreatiniinipitoisuuden käänteisluku. Kardiovaskulaarisen sairastuvuuden ja kuolleisuuden yhdistetyn päätetapahtuman esiintyvyydessä ei ollut merkittävää eroa.
COZAARin suotuisat vaikutukset havaittiin potilailla, jotka käyttivät myös muita verenpainelääkkeitä (angiotensiini II -reseptoriantagonistit ja angiotensiinikonvertaasin estäjät eivät olleet sallittuja), suun kautta otettavia hypoglykeemisiä aineita ja lipidejä alentavia aineita.
Ensisijaisen päätetapahtuman ja ESRD:n osalta COZAARin vaikutukset iän, sukupuolen ja rodun mukaan määriteltyihin potilasalaryhmiin on esitetty alla olevassa taulukossa 5. Alaryhmäanalyysit voivat olla vaikeasti tulkittavia, eikä tiedetä, edustavatko ne todellisia eroja vai sattumanvaraisia vaikutuksia.
POTILASTIEDOT
COZAAR® (CO-zar) (losartaanikaliumtabletit) 25 mg, 50 mg, 100 mg
Lue COZAARin mukana tulevat potilastiedot ennen kuin aloitat sen ottamisen ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Tämä pakkausseloste ei korvaa sitä, että keskustelet lääkärisi kanssa tilastasi ja hoidostasi.
Mikä on tärkein tieto, joka minun pitäisi tietää COZAARista?
- COZAAR voi aiheuttaa vahinkoa tai kuoleman sikiölle.
- Keskustele lääkärisi kanssa muista tavoista alentaa verenpainettasi, jos suunnittelet raskautta.
- Jos tulet raskaaksi COZAAR-hoidon aikana, kerro siitä heti lääkärillesi.
Mikä on COZAAR 100mg?
COZAAR 100mg on reseptilääke, jota kutsutaan angiotensiinireseptorin salpaajaksi (ARB). Sitä käytetään:
- yksin tai muiden verenpainelääkkeiden kanssa korkean verenpaineen (hypertensio) alentamiseksi.
- alentaa aivohalvauksen mahdollisuutta potilailla, joilla on korkea verenpaine ja sydänongelma, jota kutsutaan vasemman kammion hypertrofiaksi. COZAAR ei ehkä auta mustaihoisia potilaita tämän ongelman kanssa.
- hidastaa diabeettisen munuaissairauden (nefropatian) pahenemista tyypin 2 diabetesta sairastavilla potilailla, joilla on tai on ollut korkea verenpaine.
COZAAR 25 mg:aa ei ole tutkittu alle 6-vuotiailla lapsilla tai lapsilla, joilla on tiettyjä munuaisongelmia.
Korkea verenpaine (hypertensio) Verenpaine on voima verisuonissasi, kun sydämesi lyö ja kun sydämesi lepää. Sinulla on korkea verenpaine, kun voimaa on liikaa. COZAAR 25 mg voi auttaa verisuonia rentoutumaan, jolloin verenpaineesi laskee.
Vasemman kammion hypertrofia (LVH) on sydämen vasemman kammion (sydämen pääpumppauskammion) seinämien laajennus. LVH voi johtua useista asioista. Korkea verenpaine on LVH:n yleisin syy.
Tyypin 2 diabetes ja nefropatia . Tyypin 2 diabetes on diabeteksen tyyppi, jota esiintyy pääasiassa aikuisilla. Jos sinulla on diabeettinen nefropatia, se tarkoittaa, että munuaisesi eivät toimi kunnolla diabeteksen aiheuttaman vaurion vuoksi.
Kuka ei saa ottaa COZAAR 100 mg -valmistetta?
- Älä ota COZAAR 25 mg -valmistetta, jos olet allerginen jollekin COZAARin aineosalle . Katso tämän pakkausselosteen lopusta täydellinen luettelo COZAARin ainesosista.
- Älä käytä COZAARia, jos sinulla on diabetes ja käytät aliskireeni-nimistä lääkettä verenpaineen alentamiseksi.
Mitä minun tulee kertoa lääkärilleni ennen kuin otat COZAAR 50 mg -valmistetta?
Kerro lääkärillesi kaikista sairauksistasi, mukaan lukien jos:
- olet raskaana tai suunnittelet raskautta. Katso " Mikä on tärkein tieto, joka minun pitäisi tietää COZAAR 25 mg:sta? "
- imettävät . Ei tiedetä, erittyykö COZAAR 50 mg rintamaitoon. Sinun tulee valita joko COZAAR 50 mg:n ottaminen tai imetys, mutta ei molempia.
- oksentelet paljon tai sinulla on paljon ripulia
- sinulla on maksaongelmia
- on munuaisongelmia
Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät. COZAARilla ja tietyillä muilla lääkkeillä voi olla yhteisvaikutuksia toistensa kanssa. Kerro lääkärillesi erityisesti, jos käytät:
- kaliumlisät
- kaliumia sisältävät suolan korvikkeet
- muut lääkkeet, jotka voivat lisätä seerumin kaliumpitoisuutta
- vesipillerit (diureetit)
- litium (tietynlaisen masennuksen hoitoon käytettävä lääke)
- lääkkeet, joita käytetään kivun ja niveltulehduksen hoitoon, joita kutsutaan ei-steroidisiksi tulehduskipulääkkeiksi (NSAID), mukaan lukien COX-2-estäjät
- muut verenpainetta alentavat lääkkeet
Miten minun pitäisi ottaa COZAAR 25 mg?
- Ota COZAAR 100 mg juuri sen verran kuin lääkärisi on määrännyt. Lääkärisi voi muuttaa annostasi tarvittaessa.
- COZAAR 50 mg voidaan ottaa ruoan kanssa tai ilman.
- Jos unohdat ottaa annoksen, ota se heti kun muistat. Jos se on lähellä seuraavaa annostasi, älä ota unohtunutta annosta. Ota vain seuraava annos normaaliin aikaan.
- Jos otat liikaa COZAARia, soita heti lääkärillesi tai Myrkytystietokeskukseen tai mene lähimmän sairaalan ensiapuun.
Mitkä ovat COZAARin mahdolliset sivuvaikutukset?
COZAAR 25 mg voi aiheuttaa seuraavia haittavaikutuksia, jotka voivat olla vakavia:
- Syntymättömän vauvan loukkaantuminen tai kuolema. Katso "Mikä on tärkein tieto, joka minun pitäisi tietää COZAARista?"
- Allerginen reaktio Allergisen reaktion oireita ovat kasvojen, huulten, kurkun tai kielen turvotus. Hae heti ensiapua ja lopeta COZAARin käyttö.
- Matala verenpaine (hypotensio) . Matala verenpaine voi aiheuttaa pyörtymistä tai huimausta. Makaa makuulle, jos tunnet pyörrytystä tai huimausta. Soita lääkärillesi välittömästi.
- Ihmisillä, joilla on jo munuaisongelmia, saatat huomata munuaistesi toiminnan huononevan. Soita lääkärillesi, jos saat turvotusta jaloissasi, nilkoissasi tai käsissäsi tai selittämätöntä painonnousua.
- Korkea veren kaliumpitoisuus
COZAAR 50 mg:n yleisimmät sivuvaikutukset ihmisillä, joilla on korkea verenpaine, ovat:
- "vilustuminen" (ylempien hengitysteiden infektio)
- huimaus
- tukkoinen nenä
- selkäkipu
COZAAR 50 mg:n yleisimmät sivuvaikutukset ihmisillä, joilla on tyypin 2 diabetes ja joilla on diabeettinen munuaissairaus, ovat:
- ripuli
- väsymys
- matala verensokeri
- rintakipu
- korkea veren kalium
- alhainen verenpaine
Kerro lääkärillesi, jos saat haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät katoa.
Tämä on ei täydellinen luettelo sivuvaikutuksista. Täydellisen luettelon saat lääkäriltä tai apteekista.
Kuinka säilytän COZAAR 100mg?
- Säilytä COZAAR-tabletit 59 °F - 86 °F (15 °C - 30 °C) lämpötilassa.
- Säilytä COZAAR tiiviisti suljetussa astiassa, joka suojaa lääkettä valolta.
- Pidä COZAAR ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa COZAARista
Lääkkeitä määrätään joskus sairauksiin, joita ei ole mainittu potilasohjeissa. Älä käytä COZAARia sairauteen, johon sitä ei ole määrätty. Älä anna COZAARia muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tämä pakkausseloste sisältää yhteenvedon tärkeimmistä COZAAR-tiedoista. Jos haluat lisätietoja, keskustele lääkärisi kanssa. Voit kysyä apteekista tai lääkäriltäsi tietoa COZAARista, joka on kirjoitettu terveydenhuollon ammattilaisille.
Mitä ainesosia COZAAR 25mg sisältää?
Aktiiviset ainesosat: losartaanikalium
Inaktiiviset ainesosat:
mikrokiteinen selluloosa, vesipitoinen laktoosi, esigelatinoitu tärkkelys, magnesiumstearaatti, hydroksipropyyliselluloosa, hypromelloosi ja titaanidioksidi. COZAAR 25 mg, COZAAR 50 mg ja COZAAR 100 mg voivat myös sisältää karnaubavahaa.
