Minipress 1mg, 2mg Prazosin Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Minipress on ja miten sitä käytetään?
Minipress (pratsosiinihydrokloridi) on alfa-adrenerginen salpaaja, jota käytetään verenpainetaudin (korkean verenpaineen) hoitoon.
Mitkä ovat Minipress 2mg:n sivuvaikutukset?
Minipress 1mg:n yleisiä sivuvaikutuksia ovat:
- päänsärky,
- uneliaisuus,
- väsymys,
- heikkous,
- näön hämärtyminen,
- pahoinvointi,
- oksentelua,
- ripuli tai
- ummetus, kun kehosi tottuu lääkkeeseen
Muita Minipress 2mg:n sivuvaikutuksia ovat:
- huimaus tai huimaus seistessä, erityisesti ensimmäisen annoksen jälkeen ja pian lääkeannoksen ottamisen jälkeen ensimmäisen hoitoviikon aikana.
Kerro lääkärillesi, jos koet Minipress 1mg:n vakavia sivuvaikutuksia, mukaan lukien nopeat tai jyskyttävät sydämenlyönnit tai lepatus rinnassa, tunne, että saatat pyörtyä, hengitysvaikeudet, käsien tai jalkojen turvotus tai erektio, joka on kivulias tai kestää 4 tuntia. tai pidempään.
KUVAUS
MINIPRESS® (pratsosiinihydrokloridi), kinatsoliinijohdannainen, on ensimmäinen uudesta verenpainelääkkeiden kemiallisesta luokasta. Se on 1-(4-amino-6,7-dimetoksi-2-kinatsolinyyli)-4-(2-furoyyli)piperatsiinin hydrokloridisuola ja sen rakennekaava on:
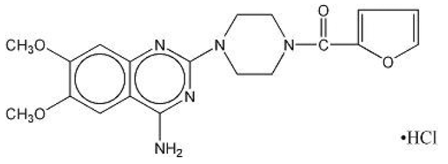
Molekyylikaava C19H21N5O4•HCl
Se on valkoinen, kiteinen aine, liukenee heikosti veteen ja isotoniseen suolaliuokseen, ja sen molekyylipaino on 419,87. Jokainen 1 mg:n MINIPRESS-kapseli suun kautta käytettäväksi sisältää lääkettä, joka vastaa 1 mg vapaata emästä.
Formulaatioiden inertit aineosat ovat: kovat gelatiinikapselit (jotka voivat sisältää Blue 1, Red 3, Red 28, Red 40 ja muita inerttejä aineosia); magnesiumstearaatti; natriumlauryylisulfaatti; tärkkelys; sakkaroosia.
INDIKAATIOT
MINIPRESS 1mg on tarkoitettu verenpainetaudin hoitoon, verenpaineen alentamiseen. Verenpaineen alentaminen vähentää kuolemaan johtavien ja ei-kuolemaan johtavien sydän- ja verisuonitapahtumien, erityisesti aivohalvausten ja sydäninfarktien, riskiä. Nämä edut on havaittu kontrolloiduissa tutkimuksissa, joissa on käytetty monia erilaisia farmakologisia lääkkeitä, mukaan lukien tämä lääke.
Korkean verenpaineen hallinnan tulee olla osa kattavaa sydän- ja verisuoniriskin hallintaa, mukaan lukien tarvittaessa lipidien hallinta, diabeteksen hallinta, antitromboottinen hoito, tupakoinnin lopettaminen, liikunta ja rajoitettu natriumin saanti. Monet potilaat tarvitsevat useamman kuin yhden lääkkeen saavuttaakseen verenpainetavoitteensa. Tarkempia neuvoja tavoitteista ja hallinnasta on julkaistuissa ohjeissa, kuten kansallisen korkean verenpaineen koulutusohjelman kansallisen korkean verenpaineen ehkäisy-, havaitsemis-, arviointi- ja hoitokomitean (JNC) ohjeissa.
Lukuisten verenpainetta alentavien lääkkeiden, eri farmakologisista luokista ja eri vaikutusmekanismeista, on osoitettu satunnaistetuissa kontrolloiduissa tutkimuksissa vähentävän sydän- ja verisuonisairauksien sairastuvuutta ja kuolleisuutta, ja voidaan päätellä, että se on verenpainetta alentavaa, eikä muuta lääkettä. lääkkeet, jotka ovat suurelta osin vastuussa näistä eduista. Suurin ja johdonmukaisin kardiovaskulaarinen tulos on ollut aivohalvauksen riskin väheneminen, mutta myös sydäninfarktin ja sydän- ja verisuoniperäisen kuolleisuuden on havaittu vähenevän säännöllisesti.
Kohonnut systolinen tai diastolinen paine lisää kardiovaskulaarista riskiä, ja absoluuttinen riskin nousu mmHg:tä kohti on suurempi korkeammilla verenpaineilla, joten jopa vaatimattomasta vaikean verenpaineen alenemisesta voi olla huomattavaa hyötyä. Suhteellinen riskin pieneneminen verenpaineen laskusta on samanlainen kaikissa populaatioissa, joissa absoluuttinen riski vaihtelee, joten absoluuttinen hyöty on suurempi potilailla, joilla on suurempi riski verenpaineesta riippumatta (esimerkiksi potilaat, joilla on diabetes tai hyperlipidemia), ja tällaisia potilaita odotetaan olevan hyötyä aggressiivisemmasta hoidosta alhaisemman verenpainetavoitteen saavuttamiseksi.
Joillakin verenpainelääkkeillä on pienemmät verenpainevaikutukset (monoterapiana) mustaihoisilla potilailla, ja monilla verenpainelääkkeillä on muita hyväksyttyjä käyttöaiheita ja vaikutuksia (esim. angina pectoris, sydämen vajaatoiminta tai diabeettinen munuaissairaus). Nämä näkökohdat voivat ohjata hoidon valintaa.
MINIPRESSiä voidaan käyttää yksinään tai yhdessä muiden verenpainetta alentavien lääkkeiden, kuten diureettien tai beetasalpaajien, kanssa.
ANNOSTELU JA HALLINNOINTI
MINIPRESS 1 mg:n annos tulee säätää potilaan yksilöllisen verenpainevasteen mukaan. Seuraavassa on opas sen hallinnointiin:
Aloitusannos
1 mg kaksi tai kolme kertaa päivässä (ks VAROITUKSET .)
Ylläpitoannos
Annosta voidaan nostaa hitaasti 20 mg:n vuorokausiannokseen jaettuna jaettuna. Yleisimmin käytetyt terapeuttiset annokset ovat vaihdelleet välillä 6 mg - 15 mg vuorokaudessa jaettuina annoksina. Yli 20 mg:n annokset eivät yleensä lisää tehoa, mutta muutamat potilaat voivat hyötyä lisäkorotuksista jopa 40 mg:n vuorokausiannokseen jaettuna jaettuna annoksina. Alkutitrauksen jälkeen jotkut potilaat voivat jatkaa riittävästi kahdesti vuorokaudessa annettavalla annostuksella.
Käytä muiden lääkkeiden kanssa
Kun lisätään diureettia tai muuta verenpainetta alentavaa ainetta, MINIPRESS 1mg:n annosta tulee pienentää 1 mg:aan tai 2 mg:aan kolme kertaa vuorokaudessa ja sen jälkeen on tehtävä uudelleen annostelu.
MINIPRESS 1 mg:n samanaikainen anto PDE-5-estäjän kanssa voi johtaa additiivisiin verenpainetta alentaviin vaikutuksiin ja oireenmukaiseen hypotensioon; siksi PDE-5-inhibiittorihoito tulee aloittaa pienimmällä annoksella potilailla, jotka käyttävät MINIPRESSiä.
MITEN TOIMITETAAN
Jakelija: Pfizer Labs, Pfizer Inc:n osasto, NY, NY 10017. Tarkistettu: helmikuu 2015
SIVUVAIKUTUKSET
Kliiniset tutkimukset suoritettiin yli 900 potilaalla. Näiden tutkimusten ja myöhemmän markkinointikokemuksen aikana yleisimmät MINIPRESS-hoitoon liittyvät reaktiot ovat: huimaus 10,3 %, päänsärky 7,8 %, uneliaisuus 7,6 %, energian puute 6,9 %, heikkous 6,5 %, sydämentykytys 5,3 % ja pahoinvointi 4,9 %. Useimmissa tapauksissa sivuvaikutukset ovat hävinneet hoidon jatkuessa tai ne ovat siedettyjä ilman, että lääkeannosta on pienennetty.
Harvempia haittavaikutuksia, joita on raportoitu esiintyvän 1-4 %:lla potilaista, ovat:
Ruoansulatuskanava: oksentelu, ripuli, ummetus.
Sydän: turvotus, ortostaattinen hypotensio, hengenahdistus, pyörtyminen.
Keskushermosto: huimaus, masennus, hermostuneisuus.
Ihotauti: ihottuma.
Sukuelimet: virtsaamistiheys.
EENT: näön hämärtyminen, kovakalvon punoitus, nenäverenvuoto, suun kuivuminen, nenän tukkoisuus.
Lisäksi alle 1 % potilaista on raportoinut seuraavista (joissakin tapauksissa tarkkaa syy-yhteyttä ei ole vahvistettu):
Ruoansulatuskanava: vatsakipu ja/tai vatsakipu, maksan toimintahäiriöt, haimatulehdus.
Sydän: takykardia.
Keskushermosto: parestesia, hallusinaatiot.
Ihotauti: kutina, hiustenlähtö, lichen planus.
Sukuelimet: inkontinenssi, impotenssi, priapismi.
EENT: tinnitus.
Muuta: diaforeesi, kuume, positiivinen ANA-tiitteri, nivelkipu.
On raportoitu yksittäisiä raportteja pigmenttilaikkuista ja seroosista retinopatiasta sekä muutamasta kaihien kehittymisestä tai katoamisesta. Näissä tapauksissa tarkkaa syy-yhteyttä ei ole vahvistettu, koska lähtötilanteen havainnot olivat usein riittämättömiä.
Tarkemmissa rakolamppu- ja funduskooppisissa tutkimuksissa, joihin sisältyi riittävät perustutkimukset, ei ole raportoitu lääkkeisiin liittyviä poikkeavia oftalmologisia löydöksiä.
On olemassa kirjallisuusraportteja, joissa MINIPRESS 1 mg -hoito on yhdistetty olemassa olevan narkolepsian pahenemiseen. Syy-yhteys on näissä tapauksissa epävarma.
Markkinoille tulon jälkeen on raportoitu seuraavia haittavaikutuksia:
Autonominen hermosto: punoitus.

Keho kokonaisuutena: allerginen reaktio, voimattomuus, huonovointisuus, kipu.
Sydän, yleistä: angina pectoris, hypotensio.
Endokriiniset: gynekomastia.
Syke/rytmi: bradykardia.
Psykiatrinen: unettomuus.
Iho/lisäkkeet: urtikaria.
Verisuonet (ekstrakardiaalinen): vaskuliitti.
Näkemys: silmän kipu.
Erityiset aistit: Kaihileikkauksen aikana alfa-1-salpaajahoidon yhteydessä on raportoitu pienten pupillien oireyhtymän muunnelmaa, joka tunnetaan nimellä Intraoperative Floppy Iris Syndrome (IFIS) (ks. VAROTOIMENPITEET ).
HUUMEIDEN VUOROVAIKUTUKSET
MINIPRESS 2 mg:aa on annettu ilman haitallisia lääkevuorovaikutuksia tähän mennessä rajoitetun kliinisen kokemuksen mukaan seuraavien lääkkeiden kanssa: (1) sydämen glykosidit-digitalis ja digoksiini; (2) hypoglykeemiset aineet - insuliini, klooripropamidi, fenformiini, tolatsamidi ja tolbutamidi; (3) rauhoittavat aineet ja rauhoittavat aineet - klooridiatsepoksidi, diatsepaami ja fenobarbitaali; (4) kihti-allopurinoli, kolkisiini ja probenesidi; (5) rytmihäiriölääkkeet - prokaiinamidi, propranololi (katso VAROITUKSET kuitenkin) ja kinidiini; ja (6) analgeetit, antipyreetit ja tulehduskipulääkkeet - propoksifeeni, aspiriini, indometasiini ja fenyylibutatsoni.
Diureetin tai muun verenpainetta alentavan aineen lisäämisen MINIPRESS 2 mg:aan on osoitettu lisäävän verenpainetta alentavaa vaikutusta. Tämä vaikutus voidaan minimoida pienentämällä MINIPRESS-annosta 1–2 mg:aan kolme kertaa vuorokaudessa, ottamalla käyttöön muita verenpainelääkkeitä varovasti ja poistamalla MINIPRESS uudelleen kliinisen vasteen perusteella. MINIPRESSin samanaikainen anto fosfodiesteraasi-5:n (PDE-5) estäjän kanssa voi johtaa additiivisiin verenpainetta alentaviin vaikutuksiin ja oireiseen hypotensioon (ks. ANNOSTELU JA HALLINNOINTI ).
Lääke/laboratoriotestien vuorovaikutukset
Tutkimuksessa viidellä potilaalla, joille annettiin 12–24 mg pratsosiinia päivässä 10–14 päivän ajan, virtsan norepinefriinin metaboliitin määrä lisääntyi keskimäärin 42 % ja virtsan VMA lisääntyi keskimäärin 17 %. Siksi pratsosiinihoitoa saavien potilaiden feokromosytooman seulontatesteissä voi esiintyä vääriä positiivisia tuloksia. Jos kohonnut VMA todetaan, pratsosiinihoito tulee lopettaa ja potilas testata uudelleen kuukauden kuluttua.
Laboratoriotestit
Kliinisissä tutkimuksissa, joissa seurattiin lipidiprofiileja, ei yleensä havaittu haitallisia muutoksia ennen hoitoa ja sen jälkeen lipiditasojen välillä.
VAROITUKSET
Kuten kaikki alfasalpaajat, MINIPRESS voi aiheuttaa pyörtymistä ja äkillistä tajunnanmenetystä. Useimmissa tapauksissa tämän uskotaan johtuvan liiallisesta asentoa alentavasta vaikutuksesta, vaikka joskus synkopalepis-ododia on edeltänyt vakava takykardia, jonka syke on 120-160 lyöntiä minuutissa. Syncopalepis-oireet ovat yleensä ilmaantuneet 30-90 minuutin kuluessa lääkkeen ensimmäisestä annoksesta; toisinaan niitä on raportoitu iän nopean annostuksen nostamisen tai toisen verenpainelääkkeen käyttöönoton yhteydessä potilaille, jotka käyttävät suuria MINIPRESS-annoksia. Synkopalepis-ododien ilmaantuvuus on noin 1 % potilaista, joille on annettu 2 mg:n tai suurempi aloitusannos. Tämän lääkkeen tutkimusvaiheen aikana tehdyt kliiniset tutkimukset viittaavat siihen, että pyörtymiskohtauksia voidaan minimoida rajoittamalla lääkkeen aloitusannos 1 mg:aan, lisäämällä sen jälkeen annosta hitaasti ja lisäämällä muita verenpainelääkkeitä potilaan hoitoon. varoen (ks. ANNOSTUS JA ANTOTAPA). Hypotensio voi kehittyä MINIPRESSiä saaville potilaille, jotka saavat myös beetasalpaajaa, kuten propranololia.
Jos pyörtyminen ilmenee, potilas tulee asettaa makuuasentoon ja häntä tulee hoitaa tarvittaessa. Tämä haittavaikutus on itsestään rajoittuva, eikä useimmissa tapauksissa toistu hoidon aloitusjakson tai myöhemmän annoksen titrauksen jälkeen.
Potilaiden hoito tulee aina aloittaa 1 mg:n MINIPRESS-kapseleilla. 2 ja 5 mg:n kapselit eivät ole tarkoitettu alkuhoitoon.
Tajunnan menetystä yleisempiä ovat verenpaineen laskuun usein liittyvät oireet, nimittäin huimaus ja huimaus. Potilasta tulee varoittaa näistä mahdollisista haittavaikutuksista ja neuvoa, mihin toimenpiteisiin niiden ilmaantuessa. Potilasta tulee myös varoittaa välttämään tilanteita, joissa voi aiheutua vammoja, jos pyörtyminen tapahtuu MINIPRESS 2 mg -hoidon aloituksen aikana.
Priapismi
Pitkittynyttä erektiota ja priapismia on raportoitu alfa-1-salpaajien, mukaan lukien pratsosiinin, käytön yhteydessä markkinoille tulon jälkeen. Jos erektio kestää yli 4 tuntia, hakeudu välittömästi lääkärin hoitoon. Jos priapismia ei hoideta välittömästi, seurauksena voi olla peniksen kudosvaurio ja pysyvä tehon menetys.
VAROTOIMENPITEET
Kenraali
Intraoperative Floppy Iris Syndrome (IFIS) on havaittu kaihileikkauksen aikana joillakin alfa-1-salpaajilla hoidetuilla potilailla. Tälle pienen pupillin oireyhtymän variantille on tunnusomaista yhdistelmä veltto iiris, joka kumpuaa vasteena leikkauksen sisäisille huuhteluvirroille, etenevä intraoperatiivinen mioosi huolimatta leikkausta edeltävästä laajenemisesta tavallisilla mydriaattisilla lääkkeillä, ja iiriksen mahdollinen prolapsi kohti fakoemulsifikaatioviiltoja. Potilaan silmälääkärin tulee varautua mahdollisiin leikkaustekniikan muutoksiin, kuten iiriskoukkujen, iiriksen laajennusrenkaiden tai viskoelastisten aineiden käyttöön. Alfa-1-salpaajahoidon lopettamisesta ennen kaihileikkausta ei näytä olevan hyötyä.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Rotilla tehdyssä 18 kuukautta kestäneessä tutkimuksessa MINIPRESS 1 mg:n annoksella ei osoitettu karsinogeenista potentiaalia yli 225-kertaisella annoksella, joka on yli 225-kertainen normaaliin ihmiselle suositeltuun enimmäisannokseen 20 mg päivässä. MINIPRESS 2 mg ei ollut mutageeninen in vivo geneettisissä toksikologisissa tutkimuksissa. Rotilla tehdyssä hedelmällisyyttä ja yleistä lisääntymiskykyä koskevassa tutkimuksessa sekä urokset että naaraat, joita hoidettiin annoksella 75 mg/kg (225 kertaa tavallinen suurin suositeltu ihmisannos), osoittivat heikentyneen hedelmällisyyden, kun taas rotilla, joita hoidettiin annoksella 25 mg/kg (75 kertaa tavallinen annos). suurin suositeltu ihmisannos) ei.
MINIPRESSin kroonisissa tutkimuksissa (yhden vuoden tai kauemmin) rotilla ja koirilla kivesten muutoksia, jotka koostuivat atrofiasta ja nekroosista, ilmeni annoksella 25 mg/kg/vrk (75 kertaa tavallinen suurin suositeltu ihmisannos). Rotilla tai koirilla ei havaittu kivesten muutoksia annoksella 10 mg/kg/vrk (30 kertaa tavallinen suurin suositeltu ihmisannos). Eläimillä havaittujen kivesten muutosten vuoksi 105 pitkäaikaista MINIPRESS-hoitoa saaneelta potilaalta seurattiin 17-ketosteroidin erittymistä, eikä lääkkeen vaikutukseen viittaavia muutoksia havaittu. Lisäksi 27 miehellä, jotka saivat MINIPRESS 1 mg enintään 51 kuukauden ajan, ei aiheuttanut lääkkeen vaikutukseen viittaavia muutoksia siittiöiden morfologiassa.
Käyttö raskauden aikana
Raskausluokka C. MINIPRESS 1 mg:n on osoitettu liittyvän pienentyneeseen pentueen koon syntymähetkellä, 1, 4 ja 21 päivän iässä rotilla, kun annokset ovat yli 225 kertaa suuremmat kuin tavalliset ihmisille suositellut enimmäisannokset. Lääkkeisiin liittyviä ulkoisia, sisäelinten tai luuston sikiön poikkeavuuksia ei havaittu. Lääkkeisiin liittyviä ulkoisia, sisäelinten tai luuston poikkeavuuksia ei havaittu raskaana olevien kanien sikiöillä ja tiineillä apinoilla yli 225-kertaisilla annoksilla ja 12-kertaisilla annoksilla, jotka ylittivät ihmisen tavanomaisen suositusannoksen.
Pratsosiinin ja beetasalpaajan käyttö vaikean verenpainetaudin hallintaan 44 raskaana olevalla naisella ei paljastanut lääkkeisiin liittyviä sikiön poikkeavuuksia tai haittavaikutuksia. Pratsosiinihoitoa jatkettiin 14 viikon ajan.1
Muut tutkijat ovat myös käyttäneet pratsosiinia yksinään tai yhdessä muiden verenpainetta alentavien aineiden kanssa raskauden vaikeassa verenpaineessa. Pratsosiinin käytön yhteydessä ei ole raportoitu sikiön tai vastasyntyneen poikkeavuuksia.2
Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia, jotka osoittaisivat MINIPRESSin turvallisuuden raskaana oleville naisille. MINIPRESSiä tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa mahdollisen riskin äidille ja sikiölle.
Imettävät äidit
MINIPRESS 1 mg:n on osoitettu erittyvän pieninä määrinä äidinmaitoon. Varovaisuutta tulee noudattaa, kun MINIPRESS 2 mg -valmistetta annetaan imettävälle naiselle.
Käyttö Lapsilla
Turvallisuutta ja tehoa lapsilla ei ole osoitettu.
VIITTEET
1. Lubbe, WF ja Hodge, JV: New Zealand Med J, 94 (691) 169-172, 1981.
2. Davey, DA ja Dommisse, J: SA Med J, 4. lokakuuta 1980 (551-556).
YLIANNOSTUS
Vähintään 50 mg:n MINIPRESSin vahingossa nauttiminen kaksivuotiaalla lapsella aiheutti syvää uneliaisuutta ja masentuneita refleksejä. Verenpaineen laskua ei havaittu. Toipuminen sujui ongelmitta.
Jos yliannostus johtaa hypotensioon, sydän- ja verisuonijärjestelmän tukeminen on ensiarvoisen tärkeää. Verenpaineen palautuminen ja sydämen sykkeen normalisoituminen voidaan saada aikaan pitämällä potilas makuuasennossa. Jos tämä toimenpide ei ole riittävä, isku tulee ensin käsitellä tilavuuden laajentajilla. Tarvittaessa tulee käyttää vasopressoreita. Munuaisten toimintaa tulee seurata ja tukea tarvittaessa. Laboratoriotiedot osoittavat, että MINIPRESS ei ole dialysoitavissa, koska se on sitoutunut proteiineihin.
VASTA-AIHEET
MINIPRESS on vasta-aiheinen potilailla, joiden tiedetään olevan herkkiä kinatsoliinille, pratsosiinille tai jollekin inertille aineosalle.
KLIININEN FARMAKOLOGIA
Pratsosiinin verenpainetta alentavan vaikutuksen tarkkaa mekanismia ei tunneta. Pratsosiini vähentää perifeeristä kokonaisvastusta, ja sen uskottiin alun perin olevan suora rentouttava vaikutus verisuonten sileään lihakseen. Viimeaikaiset eläintutkimukset ovat kuitenkin osoittaneet, että pratsosiinin verisuonia laajentava vaikutus liittyy myös postsynaptisten alfa-adrenoseptoreiden salpaukseen. Koiran eturaajakokeiden tulokset osoittavat, että pratsosiinin perifeerinen verisuonia laajentava vaikutus rajoittuu pääasiassa vastustussuonten (arteriolien) tasoon. Toisin kuin tavanomaiset alfasalpaajat, pratsosiinin verenpainetta alentavaan vaikutukseen ei yleensä liity refleksitakykardiaa. Toleranssin ei ole havaittu kehittyvän pitkäaikaisessa hoidossa.
Hemodynaamisia tutkimuksia on tehty ihmisillä akuutin kerta-annoksen antamisen jälkeen ja pitkäaikaisen ylläpitohoidon aikana. Tulokset vahvistavat, että terapeuttinen vaikutus on verenpaineen lasku, johon ei liity kliinisesti merkittävää muutosta sydämen minuuttimäärässä, sydämen sykkeessä, munuaisten verenkierrossa ja glomerulussuodatusnopeudessa. Mitään mitattavissa olevaa negatiivista kronotrooppista vaikutusta ei ole.
Tähän mennessä tehdyissä kliinisissä tutkimuksissa pratsosiinihydrokloridi ei ole lisännyt plasman reniiniaktiivisuutta.
Ihmisellä verenpaine laskee sekä makuu- että seisoma-asennossa. Tämä vaikutus on selkein diastolisessa verenpaineessa.
Suun kautta antamisen jälkeen plasman pitoisuudet saavuttavat huippunsa noin kolmessa tunnissa ja puoliintumisaika plasmassa on 2-3 tuntia. Lääke sitoutuu voimakkaasti plasman proteiineihin. Biosaatavuustutkimukset ovat osoittaneet, että lääkkeen kokonaisabsorptio 20 % alkoholiliuoksessa on 90 %, mikä johtaa noin 65 %:iin liuoksessa olevan lääkkeen huippupitoisuuksista. Eläintutkimukset osoittavat, että pratsosiinihydrokloridi metaboloituu laajalti, pääasiassa demetylaation ja konjugoinnin kautta, ja erittyy pääasiassa sapen ja ulosteiden kautta. Vähemmän kattavat ihmistutkimukset viittaavat samanlaiseen aineenvaihduntaan ja erittymiseen ihmisellä.
Kliinisissä tutkimuksissa, joissa seurattiin lipidiprofiileja, ei yleensä havaittu haitallisia muutoksia ennen hoitoa ja sen jälkeen lipiditasojen välillä.
POTILASTIEDOT
Huimausta tai uneliaisuutta voi esiintyä tämän lääkkeen ensimmäisen annoksen jälkeen. Vältä ajamista tai vaarallisten tehtävien suorittamista ensimmäisten 24 tunnin aikana tämän lääkkeen ottamisen jälkeen tai kun annosta suurennetaan. Huimausta, huimausta tai pyörtymistä voi esiintyä, etenkin noustessa makuu- tai istuma-asennosta. Hidas nouseminen voi auttaa vähentämään ongelmaa. Näitä vaikutuksia voi esiintyä myös, jos juot alkoholia, seisot pitkiä aikoja, harjoittelet tai jos sää on kuuma. Kun otat MINIPRESSiä, ole varovainen juomasi alkoholimäärän suhteen. Ole myös erityisen varovainen harjoituksen tai kuuman sään aikana tai jos seisot pitkiä aikoja. Tarkista lääkäriltäsi, jos sinulla on kysyttävää.
