Prinivil 2.5mg, 5mg, 10mg Lisinopril Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Prinivil 2,5 mg on ja miten sitä käytetään?
Prinivil on reseptilääke, jota käytetään korkean verenpaineen (hypertension) oireiden hoitoon sydänkohtauksen tai sydämen vajaatoiminnan jälkeen. Prinivilia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
- Prinivil kuuluu lääkeryhmään, jota kutsutaan ACE:n estäjiksi.
- Ei tiedetä, onko Prinivil turvallinen ja tehokas alle 6-vuotiaille lapsille.
Mitkä ovat Prinivilin mahdolliset sivuvaikutukset?
Prinivil voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- huimaus,
- kuume,
- kipeä kurkku,
- pahoinvointi,
- heikkous,
- kihelmöivä tunne,
- rintakipu,
- epäsäännölliset sydämenlyönnit,
- liikkeen menetys,
- vähän tai ei ollenkaan virtsaamista,
- turvotus jaloissasi tai nilkoissasi,
- väsynyt olo,
- hengästynyt,
- ylävatsakipu,
- kutina,
- väsynyt tunne,
- ruokahalun menetys,
- tumma virtsa,
- savenväriset ulosteet ja
- ihon tai silmien keltaisuus (keltatauti)
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Prinivil 5mg:n yleisimmät sivuvaikutukset ovat:
- päänsärky,
- huimaus,
- yskä ja
- rintakipu
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Prinivilin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
SIKIÖN MYRKYLLISYYS
- Kun raskaus havaitaan, lopeta PRINIVIL-hoito mahdollisimman pian (ks. VAROITUKSET JA VAROTOIMET].
- Lääkkeet, jotka vaikuttavat suoraan reniini-angiotensiinijärjestelmään, voivat aiheuttaa vamman ja kuoleman kehittyvälle sikiölle [katso VAROITUKSET JA VAROTOIMET].
KUVAUS
PRINIVIL sisältää lisinopriilia, synteettistä peptidijohdannaista, ja suun kautta otettavaa pitkävaikutteista angiotensiinikonvertaasin estäjää. Lisinopriili kuvataan kemiallisesti (S)-1-[N2-(1-karboksi-3-fenyylipropyyli)-Llysyyli]-L-proliinidihydraattina. Sen empiirinen kaava on C21H31N3O5•2H2O ja sen rakennekaava on:
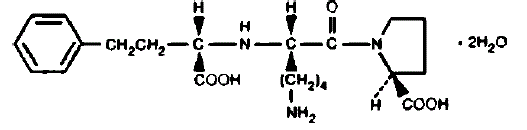
Lisinopriili on valkoinen tai luonnonvalkoinen, kiteinen jauhe, jonka molekyylipaino on 441,52. Se liukenee veteen ja niukkaliukoinen metanoliin ja käytännössä liukenematon etanoliin.
PRINIVIL 10mg toimitetaan 5 mg:n, 10 mg:n ja 20 mg:n tabletteina suun kautta annettavaksi. Jokaisessa tabletissa on vaikuttavan aineen, lisinopriilin, lisäksi seuraavat inaktiiviset aineosat: kalsiumfosfaatti, mannitoli, magnesiumstearaatti ja tärkkelys. 10 mg ja 20 mg tabletit sisältävät myös rautaoksidia.
INDIKAATIOT
Hypertensio
PRINIVIL on tarkoitettu korkean verenpaineen hoitoon aikuispotilailla ja vähintään 6-vuotiailla lapsipotilailla verenpaineen alentamiseksi. Verenpaineen alentaminen vähentää kuolemaan johtavien ja ei-kuolemaan johtavien sydän- ja verisuonitapahtumien, pääasiassa aivohalvausten ja sydäninfarktien, riskiä. Nämä edut on havaittu kontrolloiduissa tutkimuksissa, joissa on käytetty monia erilaisia farmakologisia lääkkeitä.
Korkean verenpaineen hallinnan tulee olla osa kattavaa sydän- ja verisuoniriskin hallintaa, mukaan lukien tarvittaessa lipidien hallinta, diabeteksen hallinta, antitromboottinen hoito, tupakoinnin lopettaminen, liikunta ja rajoitettu natriumin saanti. Monet potilaat tarvitsevat enemmän kuin yhden lääkkeen verenpainetavoitteiden saavuttamiseksi. Tarkempia neuvoja tavoitteista ja hallinnasta on julkaistuissa ohjeissa, kuten National High Blood Pressure Education Programin kansallisen korkean verenpaineen ehkäisy-, havaitsemis-, arviointi- ja hoitokomitean (JNC) ohjeissa.
Lukuisten verenpainetta alentavien lääkkeiden, eri farmakologisista luokista ja eri vaikutusmekanismeista, on osoitettu satunnaistetuissa kontrolloiduissa tutkimuksissa vähentävän sydän- ja verisuonisairauksien sairastuvuutta ja kuolleisuutta, ja voidaan päätellä, että se on verenpainetta alentavaa, eikä muuta lääkettä. lääkkeet, jotka ovat suurelta osin vastuussa näistä eduista. Suurin ja johdonmukaisin kardiovaskulaarinen tulos on ollut aivohalvauksen riskin väheneminen, mutta myös sydäninfarktin ja sydän- ja verisuoniperäisen kuolleisuuden on havaittu vähenevän säännöllisesti.
Kohonnut systolinen tai diastolinen paine lisää kardiovaskulaarista riskiä, ja absoluuttinen riskin nousu mmHg:tä kohti on suurempi korkeammilla verenpaineilla, joten jopa vaatimattomasta vaikean verenpaineen alenemisesta voi olla huomattavaa hyötyä. Suhteellinen riskin pieneneminen verenpaineen laskusta on samanlainen kaikissa populaatioissa, joissa absoluuttinen riski vaihtelee, joten absoluuttinen hyöty on suurempi potilailla, joilla on suurempi riski verenpaineesta riippumatta (esimerkiksi potilaat, joilla on diabetes tai hyperlipidemia), ja tällaisia potilaita odotetaan olevan hyötyä aggressiivisemmasta hoidosta alhaisemman verenpainetavoitteen saavuttamiseksi.
Joillakin verenpainelääkkeillä on pienemmät verenpainevaikutukset (monoterapiana) mustaihoisilla potilailla, ja monilla verenpainelääkkeillä on muita hyväksyttyjä käyttöaiheita ja vaikutuksia (esim. angina pectoris, sydämen vajaatoiminta tai diabeettinen munuaissairaus). Nämä näkökohdat voivat ohjata hoidon valintaa.
PRINIVIL voidaan antaa yksinään tai muiden verenpainetta alentavien aineiden kanssa (ks Kliiniset tutkimukset ].
Sydämen vajaatoiminta
PRINIVIL on tarkoitettu vähentämään sydämen vajaatoiminnan merkkejä ja oireita potilailla, jotka eivät reagoi riittävästi diureetteille ja digitalikselle [ks. Kliiniset tutkimukset ].
Akuutti sydäninfarkti
PRINIVIL on tarkoitettu kuolleisuuden vähentämiseen hemodynaamisesti vakaiden potilaiden hoidossa 24 tunnin sisällä akuutista sydäninfarktista. Potilaiden tulee saada tarvittaessa tavanomaisia suositeltuja hoitoja, kuten trombolyyttejä, aspiriinia ja beetasalpaajia [ks. Kliiniset tutkimukset ].
ANNOSTELU JA HALLINNOINTI
Hypertensio
Aloitushoito aikuisilla: Suositeltu aloitusannos on 10 mg kerran vuorokaudessa. Säädä annosta verenpainevasteen mukaan. Tavallinen annosalue on 20-40 mg vuorokaudessa yhtenä vuorokautisena annoksena. Enintään 80 mg:n annoksia on käytetty, mutta ne eivät näytä antavan suurempaa vaikutusta.
Käytä diureettien kanssa aikuisille
Jos verenpainetta ei saada hallintaan pelkällä PRINIVIL 10 mg:lla, voidaan lisätä pieni annos diureettia (esim. hydroklooritiatsidia 12,5 mg).
Suositeltu aloitusannos aikuisille hypertensiopotilaille, jotka käyttävät diureetteja, on 5 mg kerran päivässä [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Yli 6-vuotiaat ja sitä vanhemmat lapsipotilaat, joilla on hypertensio
Lapsipotilaille, joiden glomerulussuodatusnopeus >30 ml/min/1,73 m², suositeltu aloitusannos on 0,07 mg/kg kerran vuorokaudessa (enintään 5 mg yhteensä). Annostus tulee säätää verenpainevasteen mukaan enintään 0,61 mg/kg (enintään 40 mg) kerran vuorokaudessa. Yli 0,61 mg/kg (tai yli 40 mg) annoksia ei ole tutkittu lapsipotilailla [ks. KLIININEN FARMAKOLOGIA ].
PRINIVIL 2,5 mg:n käyttöä ei suositella alle 6-vuotiaille lapsipotilaille tai lapsipotilaille, joiden glomerulussuodatusnopeus Käyttö tietyissä populaatioissa ja Kliiniset tutkimukset ].
Sydämen vajaatoiminta
PRINIVIL 2,5 mg:n suositeltu aloitusannos, kun sitä käytetään diureettien ja (yleensä) digitaliksen kanssa lisähoitona, on 5 mg kerran vuorokaudessa. Suositeltu aloitusannos näille potilaille, joilla on hyponatremia (seerumin natrium
Diureettiannosta voidaan joutua säätämään hypovolemian minimoimiseksi, mikä voi edistää hypotensiota [katso VAROITUKSET JA VAROTOIMET ja HUUMEIDEN VUOROVAIKUTUKSET ]. Hypotension ilmaantuminen PRINIVIL-alkuannoksen jälkeen ei estä myöhempää huolellista annoksen titrausta lääkkeen kanssa hypotension tehokkaan hoidon jälkeen.
Akuutti sydäninfarkti
Hemodynaamisesti stabiileille potilaille 24 tunnin kuluessa akuutin sydäninfarktin oireiden alkamisesta annetaan PRINIVIL 5 mg suun kautta, sen jälkeen 5 mg 24 tunnin kuluttua, 10 mg 48 tunnin kuluttua ja sitten 10 mg kerran vuorokaudessa. Annostelua tulee jatkaa vähintään 6 viikkoa.
Aloita hoito 2,5 mg:lla potilailla, joilla on matala systolinen verenpaine (100-120 mmHg) ensimmäisten kolmen päivän aikana infarktin jälkeen [ks. VAROITUKSET JA VAROTOIMET ]. Jos hypotensiota ilmenee (systolinen verenpaine ≤100 mmHg), harkitse 2,5 tai 5 mg:n annoksia. Jos pitkittynyttä hypotensiota ilmenee (systolinen verenpaine
Annos munuaisten vajaatoimintaa sairastaville potilaille
PRINIVIL 2,5 mg:n annosta ei tarvitse muuttaa potilailla, joiden kreatiniinipuhdistuma >30 ml/min. Potilailla, joiden kreatiniinipuhdistuma on 10-30 ml/min, pienennä PRINIVIL-alkuannos puoleen tavallisesta suositellusta annoksesta (eli verenpainetauti, 5 mg; sydämen vajaatoiminta tai akuutti MI, 2,5 mg). Potilaille, jotka saavat hemodialyysihoitoa tai joiden kreatiniinipuhdistuma Käyttö tietyissä populaatioissa ja KLIININEN FARMAKOLOGIA ].
Suspension valmistelu
Valmistaaksesi 200 ml suspensiota, jonka pitoisuus on 1,0 mg/ml, lisää 10 ml puhdistettua vettä USP polyeteenitereftalaattipulloon (PET), joka sisältää kymmenen 20 mg:n PRINIVIL 5 mg -tablettia, ja ravista vähintään minuutin ajan. Lisää 30 ml natriumsitraattia ja sitruunahappoa oraaliliuosta tai Cytra-2-laimennusainetta ja 160 ml Ora-Sweet SF™:aa PET-pullon konsentraattiin ja ravista kevyesti useiden sekuntien ajan, jotta ainekset hajoavat. Suspensio tulee säilyttää 25 °C:ssa tai sen alle, ja sitä voidaan säilyttää enintään neljä viikkoa. Ravista suspensiota ennen jokaista käyttöä.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Tabletit PRINIVIL, 5 mg, ovat valkoisia, soikeita puristettuja tabletteja, joiden toisella puolella on koodi MSD 19 ja toisella puolella jakouurre.
Tabletit PRINIVIL, 10 mg, ovat vaaleankeltaisia, soikeita puristettuja tabletteja, joiden toisella puolella on koodi MSD 106 ja toisella puolella jakouurre.
Tabletit PRINIVIL, 20 mg, ovat persikanvärisiä, soikeita puristettuja tabletteja, joiden toisella puolella on koodi MSD 207 ja toisella puolella jakouurre.
Varastointi ja käsittely
PRINIVIL 10 mg toimitetaan soikeina puristetuina tabletteina, joiden toisella puolella on jakouurre.
Varastointi
Säilytä valvotussa huoneenlämmössä, 15-30°C (59-86°F) ja suojaa kosteudelta.
Annostele tiiviiseen astiaan, jos tuotepakkaus on jaettu.
Jakelija: Merck Sharp & Dohme Corp., MERCK & CO., INC.:n tytäryhtiö, Whitehouse Station, NJ 08889, USA. Tarkistettu: marraskuuta 2021
SIVUVAIKUTUKSET
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Hypertensio
Seuraavia haittavaikutuksia (tapahtumia 2 % enemmän PRINIVIL 5 mg:lla kuin lumelääkkeellä) havaittiin käytettäessä PRINIVIL 2,5 mg:aa plaseboon verrattuna: päänsärky (5,7 % vs 1,9 %), huimaus (5,4 % vs 1,9 %), yskä (3,5 % vs 1,0 %) ).
Sydämen vajaatoiminta
Kontrolloiduissa tutkimuksissa potilailla, joilla oli sydämen vajaatoiminta, hoito keskeytettiin 8,1 %:lla potilaista, joita hoidettiin PRINIVIL 10 mg:lla 12 viikon ajan, verrattuna 7,7 %:iin potilaista, jotka saivat lumelääkettä 12 viikon ajan.
Seuraavia haittavaikutuksia (tapahtumia 2 % enemmän PRINIVIL 2,5 mg:lla kuin lumelääkkeellä) havaittiin käytettäessä PRINIVILiä plaseboon verrattuna: hypotensio (4,4 % vs 0,6 %), rintakipu (3,4 % vs 1,3 %).
ATLAS-tutkimuksessa [katso Kliiniset tutkimukset ] sydämen vajaatoimintapotilailla haittavaikutusten vuoksi keskeytykset olivat samanlaisia pieni- ja suuriannosryhmissä. Seuraavia haittavaikutuksia, jotka liittyvät enimmäkseen ACE:n estoon, raportoitiin useammin suuria annoksia saaneiden ryhmässä:
Akuutti sydäninfarkti
GISSI-3-tutkimuksen potilailla, joita hoidettiin PRINIVIL 10 mg:lla, oli korkeampi hypotension (9,0 % vs 3,7 %) ja munuaisten vajaatoiminnan (2,4 % vs. 1,1 %) ilmaantuvuus verrattuna potilaisiin, jotka eivät käyttäneet PRINIVILIä.
Muut kliiniset haittavaikutukset, joita esiintyi 1 %:lla tai useammalla potilaista, joilla on hypertensio tai sydämen vajaatoiminta, joita hoidettiin PRINIVIL 2,5 mg:lla kontrolloiduissa kliinisissä tutkimuksissa ja joita ei esiinny muissa merkintöjen osissa, on lueteltu alla:
Runko kokonaisuudessaan: Väsymys, voimattomuus, ortostaattiset vaikutukset.
Ruoansulatus: Haimatulehdus, ummetus, ilmavaivat, suun kuivuminen, ripuli.
Hematologinen: Harvinaisissa tapauksissa luuydinlama, hemolyyttinen anemia, leukopenia/neutropenia ja trombosytopenia.
Endokriiniset: Diabetes mellitus, epäasianmukainen antidiureettisen hormonin eritys.
Metabolinen: Kihti
Iho: Urtikaria, hiustenlähtö, valoherkkyys, punoitus, punoitus, hikoilu, ihon pseudolymfooma, toksinen epidermaalinen nekrolyysi, Stevens-Johnsonin oireyhtymä ja kutina.
Erityiset aistit: Näön menetys, diplopia, näön hämärtyminen, tinnitus, valonarkuus, makuhäiriöt, hajuhäiriöt.
Urogenitaaliset: Impotenssi
Sekalaista: On raportoitu oireyhtymä, johon voi sisältyä positiivinen ANA, kohonnut erytrosyyttien sedimentaationopeus, nivelkipu/niveltulehdus, lihaskipu, kuume, vaskuliitti, eosinofilia, leukosytoosi, parestesia ja huimaus. Ihottumaa, valoherkkyyttä tai muita dermatologisia oireita voi esiintyä yksinään tai yhdessä näiden oireiden kanssa.
Kliiniset laboratoriotutkimukset
Seerumin kalium
Kliinisissä tutkimuksissa hyperkalemiaa (seerumin kalium > 5,7 mekv/l) esiintyi 2,2 %:lla ja 4,8 %:lla PRINIVILilla hoidetuista potilaista, joilla oli verenpainetauti ja sydämen vajaatoiminta (ks. VAROITUKSET JA VAROTOIMET ].
Kreatiniini, veren ureatyppi
Pieniä veren ureatypen ja seerumin kreatiniinitason nousuja, jotka korjaantuivat hoidon lopettamisen jälkeen, havaittiin noin 2 %:lla hypertensiopotilaista, joita hoidettiin pelkällä PRINIVIL 5 mg:lla. Lisääntyminen oli yleisempää potilailla, jotka saivat samanaikaisesti diureetteja ja potilailla, joilla oli munuaisvaltimon ahtauma [ks. VAROITUKSET JA VAROTOIMET ]. Palautuvaa lievää veren ureatypen ja seerumin kreatiniinipitoisuuden nousua havaittiin 11,6 %:lla sydämen vajaatoimintaa sairastavista potilaista, jotka saivat samanaikaisesti diureettihoitoa. Usein nämä poikkeavuudet hävisivät, kun diureetin annosta pienennettiin.
GISSI-3-tutkimuksessa PRINIVILilla hoidetuilla potilailla, joilla oli akuutti sydäninfarkti, munuaisten vajaatoiminnan ilmaantuvuus oli korkeampi (2,4 % vs. 1,1 % lumeryhmässä) sairaalassa ja 6 viikon kohdalla (kreatiniinipitoisuuden nostaminen yli 3 mg/dl:aan tai kaksinkertaistuminen) tai enemmän seerumin kreatiniinipitoisuuden perustasosta).
Hemoglobiini ja hematokriitti
Pieniä hemoglobiinin (keskiarvo 0,4 mg/dl) ja hematokriitin (keskiarvo 1,3 %) laskuja esiintyi usein PRINIVIL 5 mg:lla hoidetuilla potilailla, mutta niillä oli harvoin kliinistä merkitystä potilailla, joilla ei ollut muuta anemian syytä. Kliinisissä tutkimuksissa alle 0,1 % potilaista keskeytti hoidon anemian vuoksi.
Maksan entsyymit
Harvoin maksaentsyymien ja/tai seerumin bilirubiinin kohoamista on esiintynyt [katso VAROITUKSET JA VAROTOIMET ].
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu lisinopriilin hyväksymisen jälkeisen käytön aikana, joita ei ole sisällytetty muihin pakkausmerkintöihin. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen. Muita reaktioita ovat:
Aineenvaihdunta- ja ravitsemushäiriöt
Hyponatremia [katso VAROITUKSET JA VAROTOIMET ], hypoglykemiatapaukset diabeetikoilla, jotka käyttävät suun kautta otettavia diabeteslääkkeitä tai insuliinia [katso HUUMEIDEN VUOROVAIKUTUKSET ]
Hermosto ja psykiatriset häiriöt
Mielialan muutokset (mukaan lukien masennusoireet), henkinen sekavuus
HUUMEIDEN VUOROVAIKUTUKSET
Diureetit
PRINIVIL-hoidon aloittaminen diureetteja käyttävillä potilailla voi johtaa liialliseen verenpaineen laskuun. PRINIVIL-valmisteen hypotensiivisten vaikutusten mahdollisuus voidaan minimoida joko vähentämällä tai lopettamalla diureetin käyttöä tai lisäämällä suolan saantia ennen PRINIVIL-hoidon aloittamista. Jos tämä ei ole mahdollista, pienennä PRINIVIL-aloitusannosta [katso ANNOSTELU JA HALLINNOINTI ja VAROITUKSET JA VAROTOIMET ].
PRINIVIL 2,5 mg vähentää tiatsidityyppisten diureettien aiheuttamaa kaliumhukkaa. Kaliumia säästävät diureetit (spironolaktoni, amiloridi, triamtereeni ja muut) tai muut lääkkeet, jotka voivat lisätä seerumin kaliumpitoisuutta, voivat lisätä hyperkalemian riskiä. Siksi, jos tällaisten aineiden samanaikainen käyttö on aiheellista, tarkkaile potilaan seerumin kaliumpitoisuutta usein.
Diabeteslääkkeet
PRINIVIL 10 mg:n ja diabeteslääkkeiden (insuliinit, suun kautta otettavat hypoglykeemiset aineet) samanaikainen käyttö voi lisätä verensokeria alentavaa vaikutusta ja aiheuttaa hypoglykemian riskin.
Ei-steroidiset tulehduskipulääkkeet, mukaan lukien selektiiviset syklo-oksigenaasi-2-estäjät (COX-2-estäjät)
Iäkkäillä potilailla, joilla on nestevajaus (mukaan lukien diureettihoitoa saavat) tai heikentynyt munuaisten toiminta, tulehduskipulääkkeiden, mukaan lukien selektiivisten COX-2-estäjien, ja ACE:n estäjien, mukaan lukien lisinopriili, samanaikainen käyttö voi heikentää munuaisten toimintaa, mukaan lukien mahdollinen akuutti munuaisten vajaatoiminta. Nämä vaikutukset ovat yleensä palautuvia. Lisinopriili- ja NSAID-hoitoa saavien potilaiden munuaisten toimintaa on seurattava säännöllisesti.
Tulehduskipulääkkeet voivat heikentää ACE:n estäjien, mukaan lukien lisinopriilin, verenpainetta alentavaa vaikutusta.
Reniini-angiotensiinijärjestelmän (RAS) kaksoisesto
RAS:n kaksoissalpaus angiotensiinireseptorin salpaajilla, ACE:n estäjillä tai suorilla reniinin estäjillä (kuten aliskireenilla) liittyy lisääntyneeseen hypotension, pyörtymisen, hyperkalemian ja munuaisten toiminnan muutosten (mukaan lukien akuutin munuaisten vajaatoiminnan) riskiin verrattuna monoterapiaan.
Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) -tutkimukseen otettiin mukaan 1448 potilasta, joilla oli tyypin 2 diabetes, kohonnut virtsan albumiini-kreatiniinisuhde ja laskenut arvioitu glomerulussuodatusnopeus (GFR 30-89,9 ml/min). lisinopriilia tai lumelääkettä losartaanihoidon taustalla ja seurasi niitä keskimäärin 2,2 vuoden ajan. Potilaat, jotka saivat losartaanin ja lisinopriilin yhdistelmää, eivät saaneet lisähyötyä monoterapiaan verrattuna yhdistetyn päätetapahtuman, GFR:n heikkenemisen, loppuvaiheen munuaissairauden tai kuoleman vuoksi, mutta hyperkalemian ja akuutin munuaisvaurion ilmaantuvuus lisääntyi monoterapiaryhmään verrattuna. .
Vältä yleensä RAS-estäjien yhteiskäyttöä. Seuraa verenpainetta, munuaisten toimintaa ja elektrolyyttejä potilailla, jotka saavat PRINIVIL 5 mg:aa ja muita RAS:aan vaikuttavia aineita.
Älä anna aliskireenia samanaikaisesti PRINIVILIN kanssa diabeetikoille. Vältä aliskireenin käyttöä PRINIVIL 2,5 mg:n kanssa potilailla, joilla on munuaisten vajaatoiminta (GFR
Litium
Litiumtoksisuutta on raportoitu potilailla, jotka ovat saaneet litiumia samanaikaisesti lääkkeiden kanssa, jotka aiheuttavat natriumin eliminaatiota, mukaan lukien ACE:n estäjät. Litiumtoksisuus korjaantui yleensä litiumin ja ACE:n estäjän käytön lopettamisen jälkeen. Seuraa seerumin litiumpitoisuutta samanaikaisen käytön aikana.
Kulta
Nitritoidireaktioita (oireita ovat kasvojen punoitus, pahoinvointi, oksentelu ja hypotensio) on raportoitu harvoin potilailla, jotka ovat saaneet injektoitavaa kultaa (natriumaurotiomalaattia) ja samanaikaista ACE:n estäjähoitoa, mukaan lukien PRINIVIL.
Rapamysiinin (mTOR) estäjien nisäkäskohde
Potilailla, jotka käyttävät samanaikaisesti mTOR-estäjää (esim. temsirolimuusi, sirolimuusi, everolimuusi), voi olla suurentunut angioedeeman riski [ks. VAROITUKSET JA VAROTOIMET ].
Neprilysiinin estäjät
Potilailla, jotka käyttävät samanaikaisesti neprilysiini-inhibiittoria (esim. sacubitriiliä), voi olla lisääntynyt angioedeeman riski [ks. VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.

VAROTOIMENPITEET
Sikiön toksisuus
PRINIVIL voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. Reninangiotensiinijärjestelmään vaikuttavien lääkkeiden käyttö raskauden toisen ja kolmannen kolmanneksen aikana heikentää sikiön munuaisten toimintaa ja lisää sikiön ja vastasyntyneen sairastuvuutta ja kuolemaa. Tuloksena olevat oligohydramnionit voivat liittyä sikiön keuhkojen hypoplasiaan ja luuston epämuodostumiin. Mahdollisia vastasyntyneiden haittavaikutuksia ovat kallon hypoplasia, anuria, hypotensio, munuaisten vajaatoiminta ja kuolema. Kun raskaus havaitaan, lopeta PRINIVIL-hoito mahdollisimman pian [katso Käyttö tietyissä populaatioissa ].
Angioödeema ja anafylaktoidireaktiot
Angioedeema
Pään ja kaulan angioedeema
Kasvojen, raajojen, huulten, kielen, äänihuulten ja/tai kurkunpään angioedeemaa, mukaan lukien joitakin kuolemaan johtaneita reaktioita, on esiintynyt potilailla, joita on hoidettu angiotensiinikonvertaasin estäjillä, mukaan lukien PRINIVIL, milloin tahansa hoidon aikana. Potilailla, joilla on kielen, kielen tai kurkunpään tulehdus, on todennäköisesti hengitysteiden tukkeuma, erityisesti niillä, joilla on aiemmin ollut hengitystieleikkaus. PRINIVIL 5 mg -valmisteen käyttö on lopetettava välittömästi ja asianmukaista hoitoa ja seurantaa on järjestettävä, kunnes angioedeeman merkit ja oireet ovat hävinneet täydellisesti ja pysyvästi.
Potilailla, joilla on aiemmin ollut angioedeemaa, joka ei liity ACE:n estäjähoitoon, saattaa olla suurentunut angioedeeman riski ACE:n estäjähoidon aikana (ks. VASTA-AIHEET ]. ACE:n estäjiin on liittynyt useammin angioedeeman esiintymistä mustaihoisilla kuin muilla potilailla.
Potilailla, jotka saavat samanaikaisesti ACE:n estäjä- ja mTOR- (rapamysiinin nisäkäskohde) estäjähoitoa (esim. temsirolimuusi, sirolimuusi, everolimuusi), voi olla suurentunut angioedeeman riski [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Potilailla, jotka saavat samanaikaisesti ACE-estäjää ja neprilysiinin estäjähoitoa, voi olla lisääntynyt angioedeeman riski [ks. VASTA-AIHEET ja HUUMEIDEN VUOROVAIKUTUKSET ].
Suolen angioedeema
Suolen angioedeemaa on esiintynyt potilailla, joita on hoidettu ACE:n estäjillä. Näillä potilailla oli vatsakipua (pahoinvoinnin tai oksentelun kanssa tai ilman); joissakin tapauksissa kasvojen angioedeemaa ei ollut aiemmin esiintynyt ja C-1-esteraasitasot olivat normaaleja. Joissakin tapauksissa angioödeema diagnosoitiin toimenpiteillä, mukaan lukien vatsan CT-skannaus tai ultraääni, tai leikkauksessa, ja oireet hävisivät ACE-estäjän lopettamisen jälkeen.
Anafylaktoidiset reaktiot
Anafylaktoidireaktiot desensibilisoinnin aikana
Kaksi potilasta, jotka saivat herkkyyttä vähentävää hoitoa Hymenoptera myrkkyllä ja saivat ACE:n estäjiä, saivat hengenvaarallisia anafylaktoidisia reaktioita.
Anafylaktoidireaktiot dialyysin aikana
Äkillisiä ja mahdollisesti hengenvaarallisia anafylaktoidisia reaktioita on esiintynyt joillakin potilailla, jotka on dialysoitu korkeavirtauskalvoilla ja joita on hoidettu samanaikaisesti ACE:n estäjällä. Tällaisten potilaiden dialyysi on lopetettava välittömästi ja aggressiivinen hoito anafylaktoidisten reaktioiden varalta on aloitettava. Näissä tilanteissa antihistamiinit eivät ole lieventäneet oireita. Näillä potilailla on harkittava erityyppisen dialyysikalvon tai eri luokan verenpainetta alentavan aineen käyttöä. Anafylaktisia reaktioita on raportoitu myös potilailla, joille tehdään matalatiheyksisten lipoproteiinien afereesi dekstraanisulfaatin imeytyessä.
Munuaisten vajaatoiminta
Tarkkaile munuaisten toimintaa säännöllisesti PRINIVIL-hoitoa saavilla potilailla. Muutoksia munuaisten toiminnassa, mukaan lukien akuutti munuaisten vajaatoiminta, voivat aiheuttaa lääkkeet, jotka estävät reniini-angiotensiinijärjestelmää. Potilailla, joiden munuaisten toiminta saattaa riippua osittain reniini-angiotensiinijärjestelmän aktiivisuudesta (esim. potilaat, joilla on munuaisvaltimon ahtauma, krooninen munuaissairaus, vaikea sydämen vajaatoiminta, sydäninfarktin jälkeinen tai tilavuusvaje), voi olla erityinen riski sairastua akuutti munuaisten vajaatoiminta PRINIVIL-hoidon aikana. Harkitse hoidon keskeyttämistä tai lopettamista potilailla, joille kehittyy kliinisesti merkittävä munuaisten toiminnan heikkeneminen PRINIVIL-hoidon aikana [ks. HAITTAVAIKUTUKSET ja HUUMEIDEN VUOROVAIKUTUKSET ].
Hypotensio
PRINIVIL voi aiheuttaa oireenmukaista hypotensiota, jota joskus komplisoi oliguria, etenevä atsotemia, akuutti munuaisten vajaatoiminta tai kuolema. Potilaita, joilla on riski saada liiallinen hypotensio, ovat potilaat, joilla on seuraavat sairaudet tai ominaisuudet: sydämen vajaatoiminta, jonka systolinen verenpaine on alle 100 mmHg, iskeeminen sydänsairaus, aivoverisuonitauti, hyponatremia, suuriannoksinen diureettihoito, munuaisdialyysi tai vaikea neste- ja/tai suolavajaus mistä tahansa etiologiasta.
Aloita näillä potilailla PRINIVIL lääkärin valvonnassa ja seuraa näitä potilaita kahden ensimmäisen hoitoviikon ajan ja aina, kun PRINIVILin ja/tai diureetin annosta suurennetaan. Vältä PRINIVIL 2,5 mg:n käyttöä potilailla, jotka ovat hemodynaamisesti epävakaita akuutin sydäninfarktin jälkeen.
Oireinen hypotensio on myös mahdollista potilailla, joilla on vaikea aorttastenoosi tai hypertrofinen kardiomyopatia.
Leikkaus / anestesia
Potilailla, joille tehdään suuri leikkaus tai anestesian aikana hypotensiota aiheuttavilla aineilla, PRINIVIL voi estää angiotensiini II:n muodostumisen kompensoivan reniinin vapautumisen seurauksena. Jos hypotensiota esiintyy ja sen katsotaan johtuvan tästä mekanismista, se voidaan korjata tilavuuden lisäämisellä.
Hyperkalemia
Tarkkaile seerumin kaliumia ajoittain PRINIVILia saavilla potilailla. Reninangiotensiinijärjestelmää estävät lääkkeet voivat aiheuttaa hyperkalemiaa. Hyperkalemian kehittymisen riskitekijöitä ovat munuaisten vajaatoiminta, diabetes mellitus ja samanaikainen kaliumia säästävien diureettien, kaliumlisäaineiden, kaliumia sisältävien suolan korvikkeiden tai muiden lääkkeiden käyttö, jotka voivat lisätä seerumin kaliumpitoisuutta [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Maksan vajaatoiminta
ACE:n estäjiin on liitetty oireyhtymä, joka alkaa kolestaattisella keltatuksella tai hepatiitilla ja etenee fulminanttiin maksanekroosiin ja joskus kuolemaan. Tämän oireyhtymän mekanismia ei tunneta. ACE:n estäjähoitoa saavien potilaiden, joille kehittyy keltaisuutta tai huomattavaa maksaentsyymiarvojen nousua, tulee keskeyttää ACE:n estäjähoito ja saada asianmukaista lääketieteellistä hoitoa.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Tuumorigeenisestä vaikutuksesta ei havaittu näyttöä, kun lisinopriilia annettiin 105 viikon ajan uros- ja naarasrotille annoksina 90 mg/kg/vrk tai 92 viikon ajan uros- ja naarashiirille annoksina 135 mg/kg/vrk. Nämä annokset ovat 10 kertaa ja 7 kertaa MRHDD verrattuna kehon pinta-alaan.
Lisinopriili ei ollut mutageeninen Amesin mikrobimutageenitestissä metabolisen aktivaation kanssa tai ilman sitä. Se oli myös negatiivinen eteenpäin suuntautuvassa mutaatiomäärityksessä, jossa käytettiin kiinanhamsterin keuhkosoluja. Lisinopriili ei aiheuttanut yksijuosteisia DNA-katkoja in vitro emäksisessä rotan hepatosyyttimäärityksessä. Lisinopriili ei myöskään lisännyt kromosomipoikkeavuuksia kiinanhamsterin munasarjasoluilla tehdyssä in vitro -testissä eikä hiiren luuytimellä tehdyssä in vivo -tutkimuksessa.
Ei havaittu haitallisia vaikutuksia lisääntymiskykyyn uros- ja naarasrotilla, joita hoidettiin enintään 300 mg/kg/vrk lisinopriiliannoksella (33 kertaa MRHDD verrattuna kehon pinta-alaan).
Rotilla tehdyt tutkimukset osoittavat, että lisinopriili läpäisee heikosti veri-aivoesteen. Lisinopriilin useat annokset rotilla eivät aiheuta kertymistä kudoksiin. Imettävien rottien maito sisältää radioaktiivisuutta 14C-lisinopriilin antamisen jälkeen. Koko kehon autoradiografialla radioaktiivisuutta havaittiin istukasta sen jälkeen, kun tiineille rotille oli annettu leimattua lääkettä, mutta sikiöistä ei havaittu yhtään.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
PRINIVIL voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. Reninangiotensiinijärjestelmään vaikuttavien lääkkeiden käyttö raskauden toisen ja kolmannen kolmanneksen aikana heikentää sikiön munuaisten toimintaa ja lisää sikiön ja vastasyntyneen sairastuvuutta ja kuolemaa. Useimmat epidemiologiset tutkimukset, joissa tutkittiin sikiön poikkeavuuksia verenpainetta alentavan käytön jälkeen ensimmäisen raskauskolmanneksen aikana, eivät ole erottaneet reninangiotensiinijärjestelmään vaikuttavia lääkkeitä muista verenpainetta alentavista aineista. Kun raskaus havaitaan, lopeta PRINIVIL 5 mg -valmisteen käyttö mahdollisimman pian.
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Kliiniset näkökohdat
Äidin ja/tai alkion/sikiön sairauteen liittyvä riski
Raskaudenaikainen hypertensio lisää äidin riskiä pre-eklampsialle, raskausdiabetekselle, ennenaikaisille synnytyksille ja synnytyskomplikaatioille (esim. keisarileikkauksen tarve ja synnytyksen jälkeinen verenvuoto). Hypertensio lisää sikiön riskiä kohdunsisäiseen kasvun rajoittumiseen ja kohdunsisäiseen kuolemaan. Verenpainetautia sairastavia raskaana olevia naisia tulee seurata huolellisesti ja hoitaa sen mukaisesti.
Sikiön/vastasyntyneen haittavaikutukset
Oligohydramnionit raskaana olevilla naisilla, jotka käyttävät reniini-angiotensiinijärjestelmään vaikuttavia lääkkeitä raskauden toisella ja kolmannella kolmanneksella, voivat johtaa seuraaviin: sikiön munuaisten toiminnan heikkeneminen, mikä johtaa anuriaan ja munuaisten vajaatoimintaan, sikiön keuhkojen hypoplasiaa ja luuston epämuodostumia, mukaan lukien kallon hypoplasia, hypotensio , ja kuolema. Siinä epätavallisessa tapauksessa, että reniini-angiotensiinijärjestelmään vaikuttaville lääkkeille ei ole sopivaa vaihtoehtoista hoitoa tietylle potilaalle, kerro äidille mahdollisista riskeistä sikiölle.
Potilaille, jotka käyttävät PRINIVIL-valmistetta raskauden aikana, suorita sarja ultraäänitutkimuksia lapsivesiympäristön arvioimiseksi. Sikiön testaus voi olla tarkoituksenmukaista raskausviikon perusteella. Jos havaitaan oligohydramnionia, lopeta PRINIVIL 10 mg:n käyttö, ellei sitä pidetä äidin hengenpelastajana. Potilaiden ja lääkäreiden tulee kuitenkin olla tietoisia siitä, että oligohydramnionit saattavat ilmaantua vasta sen jälkeen, kun sikiö on saanut peruuttamattoman vaurion.
Tarkkaile tarkasti lapsia, jotka ovat altistuneet PRINIVILille kohdussa hypotension, oligurian ja hyperkalemian vuoksi. Jos vastasyntyneillä on aiemmin ollut PRINIVIL-altistus kohdussa, jos esiintyy oliguriaa tai hypotensiota, tue verenpainetta ja munuaisten perfuusiota. Vaihtosiirtoja tai dialyysiä voidaan tarvita keinona vähentää hypotensiota ja/tai korvata häiriintynyttä munuaisten toimintaa.
Imetys
Riskien yhteenveto
Tietoja lisinopriilin erittymisestä äidinmaitoon tai lisinopriilin vaikutuksista imetettävään lapseen tai maidontuotantoon ei ole saatavilla. Lisinopriilia on rotan maidossa. Koska monet lääkkeet erittyvät äidinmaitoon ja koska ACE:n estäjät voivat aiheuttaa vakavia haittavaikutuksia imetettäville lapsille, lopeta imetys tai lopeta PRINIVIL-hoito.
Käyttö lapsille
PRINIVILIN verenpainetta alentavat vaikutukset ja turvallisuus on osoitettu 6–16-vuotiailla lapsipotilailla [ks. ANNOSTELU JA HALLINNOINTI ja Kliiniset tutkimukset ]. Lapsipotilaiden ja aikuispotilaiden haittavaikutusprofiilin välillä ei havaittu merkittäviä eroja.
PRINIVILIN turvallisuutta ja tehokkuutta ei ole varmistettu alle 6-vuotiailla lapsipotilailla tai lapsipotilailla, joiden glomerulussuodatusnopeus KLIININEN FARMAKOLOGIA ja Kliiniset tutkimukset ].
Geriatrinen käyttö
PRINIVIL 2,5 mg:n annosta ei tarvitse muuttaa iäkkäillä potilailla. Kliinisessä tutkimuksessa PRINIVIL 10 mg:lla sydäninfarktipotilailla (GISSI-3-tutkimus) 4 413 (47 %) oli 65-vuotiaita ja sitä vanhempia ja 1 656 (18 %) 75-vuotiaita tai vanhempia. Tässä tutkimuksessa 4,8 % 75-vuotiaista ja sitä vanhemmista potilaista keskeytti PRINIVIL 5 mg -hoidon munuaisten vajaatoiminnan vuoksi ja 1,3 % alle 75-vuotiaista potilaista. Muita eroja turvallisuudessa tai tehokkuudessa ei havaittu iäkkäiden ja nuorempien potilaiden välillä, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
Rotu
ACE:n estäjät, mukaan lukien PRINIVIL, vaikuttavat verenpaineeseen vähemmän mustaihoisilla potilailla kuin muilla.
Munuaisten vajaatoiminta
PRINIVIL-annosta on muutettava potilailla, jotka saavat hemodialyysihoitoa tai joiden kreatiniinipuhdistuma on ≤30 ml/min. PRINIVIL 5 mg:n annosta ei tarvitse muuttaa potilailla, joiden kreatiniinipuhdistuma > 30 ml/min [ks. ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Kun kerta-annos oli 20 g/kg suun kautta, rotilla ei esiintynyt kuolleisuutta ja yksi 20 hiirestä, jotka saivat saman annoksen, kuoli. Yliannostuksen todennäköisin ilmentymä olisi hypotensio, jonka tavanomainen hoito on normaalin suolaliuoksen suonensisäinen infuusio.
Lisinopriili voidaan poistaa hemodialyysillä [katso VAROITUKSET JA VAROTOIMET ].
VASTA-AIHEET
PRINIVIL 10mg on vasta-aiheinen potilailla, joilla on:
- aiempi angiotensiinikonvertaasin estäjähoitoon liittyvä angioödeema tai yliherkkyys
- perinnöllinen tai idiopaattinen angioödeema.
Älä anna aliskireenia samanaikaisesti PRINIVIL 5 mg:n kanssa potilailla, joilla on diabetes [ks HUUMEIDEN VUOROVAIKUTUKSET ]. PRINIVIL on vasta-aiheinen yhdessä neprilysiinin estäjän (esim. sacubitril) kanssa. Älä anna PRINIVIL 2,5 mg:aa 36 tunnin kuluessa vaihtamisesta sacubitril/valsartaaniin, neprilysiini-inhibiittoria sisältävään valmisteeseen tai siitä pois (ks. VAROITUKSET JA VAROTOIMET ja HUUMEIDEN VUOROVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Lisinopriili estää angiotensiiniä konvertoivan entsyymin (ACE) toimintaa ihmisillä ja eläimillä. ACE on peptidyylidipeptidaasi, joka katalysoi angiotensiini I:n konversiota verisuonia supistavaksi aineeksi, angiotensiini II:ksi. Angiotensiini II stimuloi myös aldosteronin eritystä lisämunuaiskuoressa. Lisinopriilin hyödylliset vaikutukset verenpainetautiin ja sydämen vajaatoimintaan näyttävät johtuvan pääasiassa reniini-angiotensiini-aldosteronijärjestelmän suppressiosta. ACE:n esto johtaa plasman angiotensiini II:n vähenemiseen, mikä johtaa vasopressoriaktiivisuuden ja aldosteronin erityksen vähenemiseen. Jälkimmäinen lasku voi johtaa seerumin kaliumpitoisuuden vähäiseen nousuun. Verenpainepotilailla, joiden munuaisten toiminta oli normaali ja joita hoidettiin pelkällä PRINIVIL 10 mg:lla enintään 24 viikon ajan, seerumin kaliumpitoisuuden keskimääräinen nousu oli noin 0,1 mekvivalentti/l. kuitenkin noin 15 %:lla potilaista lisääntyminen oli suurempi kuin 0,5 mekv/l ja noin 6 %:lla yli 0,5 mekvivalentti/l. Samassa tutkimuksessa potilailla, joita hoidettiin PRINIVIL 2,5 mg:lla ja hydroklooritiatsidilla enintään 24 viikon ajan, seerumin kaliumpitoisuus laski keskimäärin 0,1 mekvivalenttia/l; noin 4 %:lla potilaista oli yli 0,5 mekv/l nousua ja noin 12 %:lla yli 0,5 mekv/l [ks. VAROITUKSET JA VAROTOIMET ]. Angiotensiini II:n reniinin eritystä koskevan negatiivisen palautteen poistaminen johtaa plasman reniiniaktiivisuuden lisääntymiseen.
ACE on identtinen kininaasin kanssa, entsyymin kanssa, joka hajottaa bradykiniiniä. Vielä on selvitettävä, onko bradykiniinin, voimakkaan vasodepressoripeptidin, kohonneilla tasoilla merkitystä PRINIVIL 5 mg:n terapeuttisissa vaikutuksissa.
Vaikka mekanismin, jolla PRINIVIL 2,5 mg alentaa verenpainetta, uskotaan ensisijaisesti reniini-angiotensiini-aldosteronijärjestelmän suppressioon, PRINIVIL on verenpainetta alentava myös potilailla, joilla on matala reniinipitoisuus. Vaikka PRINIVIL 10 mg oli verenpainetta alentava kaikissa tutkituissa roduissa, mustaihoisilla hypertensiivisillä potilailla (yleensä matalan reniinin verenpainepotilailla) oli pienempi keskimääräinen vaste monoterapiaan kuin ei-mustaihoisilla potilailla.
PRINIVIL 5 mg:n ja hydroklooritiatsidin samanaikainen anto alensi edelleen verenpainetta mustaihoisilla ja muilla potilailla, eikä verenpainevasteessa enää havaittu rotueroa.
Farmakodynamiikka
Hypertensio
Aikuiset potilaat
PRINIVIL-valmisteen antaminen hypertensiopotilaille johtaa verenpaineen laskuun makuulla ja seistessä suunnilleen samassa määrin ilman kompensoivaa takykardiaa. Oireista posturaalista hypotensiota ei yleensä havaita, vaikka sitä voi esiintyä, ja se tulee ennakoida tilavuus- ja/tai suolavajauspotilailla [ks. VAROITUKSET JA VAROTOIMET ]. Kun näitä kahta lääkettä käytetään yhdessä tiatsidityyppisten diureettien kanssa, niiden verenpainetta alentavat vaikutukset ovat suunnilleen additiivisia.
Useimmilla tutkituilla potilailla verenpainetta alentava vaikutus havaittiin tunnin kuluttua yksittäisen PRINIVIL-annoksen oraalisen annon jälkeen, ja verenpaineen alenemisen huippu saavutettiin 6 tunnin kuluttua. Vaikka verenpainetta alentava vaikutus havaittiin 24 tuntia suositeltujen kerta-annosten annostelun jälkeen, vaikutus oli johdonmukaisempi ja keskimääräinen vaikutus oli huomattavasti suurempi joissakin tutkimuksissa 20 mg:n tai suuremmilla annoksilla kuin pienemmillä annoksilla. Kaikilla tutkituilla annoksilla keskimääräinen verenpainetta alentava vaikutus oli kuitenkin huomattavasti pienempi 24 tuntia annostuksen jälkeen kuin 6 tuntia annostuksen jälkeen.
PRINIVILIN verenpainetta alentavat vaikutukset säilyvät pitkäaikaisen hoidon aikana. PRINIVIL 10 mg:n äkilliseen lopettamiseen ei ole liittynyt nopeaa verenpaineen nousua tai merkittävää verenpaineen nousua hoitoa edeltäviin tasoihin verrattuna.
Farmakokinetiikka
Aikuiset potilaat
PRINIVILIN oraalisen annon jälkeen lisinopriilin huippupitoisuudet seerumissa saavutetaan noin 7 tunnin kuluessa, vaikkakin akuutti sydäninfarktipotilailla oli suuntaus, että seerumin huippupitoisuuksien saavuttamiseen kului hieman viivettä. Alenevilla seerumipitoisuuksilla on pitkittynyt terminaalinen vaihe, joka ei edistä lääkkeiden kertymistä. Tämä terminaalinen vaihe edustaa todennäköisesti tyydyttävää sitoutumista ACE:hen, eikä se ole verrannollinen annokseen. Lisinopriilin tehokas puoliintumisaika toistuvasti annosteltuna on 12 tuntia.
Lisinopriili ei näytä sitoutuvan muihin seerumin proteiineihin. Lisinopriili ei metaboloidu, vaan se erittyy muuttumattomana kokonaan virtsaan. Virtsan erittymisen perusteella lisinopriilin keskimääräinen imeytymisaste on noin 25 prosenttia, ja potilaiden välinen vaihtelu on suuri (6–60 prosenttia) kaikilla testatuilla annoksilla (5–80 mg). Ruoan läsnäolo ruoansulatuskanavassa ei vaikuta lisinopriilin imeytymiseen. Lisinopriilin absoluuttinen hyötyosuus on laskenut noin 16 prosenttiin potilailla, joilla on stabiili NYHA-luokkien II-IV sydämen vajaatoiminta, ja jakautumistilavuus näyttää olevan hieman pienempi kuin normaaleilla koehenkilöillä.
Lisinopriilin oraalinen hyötyosuus potilailla, joilla on akuutti sydäninfarkti, on samanlainen kuin terveillä vapaaehtoisilla.
Munuaisten vajaatoiminta vähentää lisinopriilin eliminaatiota, joka erittyy pääasiassa munuaisten kautta, mutta tämä väheneminen tulee kliinisesti merkittäväksi vasta, kun glomerulussuodatusnopeus on alle 30 ml/min. Tämän glomerulaarisen suodatusnopeuden yläpuolella eliminaation puoliintumisaika ei muutu juurikaan. Suuremmalla heikkenemisellä lisinopriilin huippu- ja alintasot kuitenkin nousevat, huippupitoisuuden saavuttamiseen kuluva aika pitenee ja vakaan tilan saavuttamiseen kuluva aika pitenee. Vanhemmilla potilailla on keskimäärin (noin kaksinkertaistunut) korkeammat veren tasot ja plasman pitoisuusaikakäyrän alla oleva pinta-ala (AUC) kuin nuoremmilla potilailla [ks. ANNOSTELU JA HALLINNOINTI ]. Lisinopriili voidaan poistaa hemodialyysillä.
Rotilla tehdyt tutkimukset osoittavat, että lisinopriili läpäisee heikosti veri-aivoesteen. Lisinopriilin useat annokset rotilla eivät aiheuta kertymistä kudoksiin. Imettävien rottien maito sisältää radioaktiivisuutta 14C-lisinopriilin antamisen jälkeen. Koko kehon autoradiografialla radioaktiivisuutta havaittiin istukasta sen jälkeen, kun tiineille rotille oli annettu leimattua lääkettä, mutta sikiöistä ei havaittu yhtään.
Pediatriset potilaat
Lisinopriilin farmakokinetiikkaa tutkittiin 29 hypertensiivisellä lapsipotilaalla, iältään 6–16 vuotta ja joiden glomerulussuodatusnopeus >30 ml/min/1,73 m². 0,1–0,2 mg/kg annoksilla lisinopriilin vakaan tilan huippupitoisuudet plasmassa saavutettiin 6 tunnin kuluessa ja imeytymisen määrä virtsan erittymisen perusteella oli noin 28 %. Nämä arvot ovat samanlaiset kuin aiemmin aikuisilla saadut arvot. Lisinopriilin oraalisen puhdistuman tyypillinen arvo (systeeminen puhdistuma/absoluuttinen hyötyosuus) 30 kg painavalla lapsella on 10 l/h, mikä kasvaa suhteessa munuaisten toimintaan.
Kliiniset tutkimukset
Hypertensio
Aikuiset potilaat
Kaksi annos-vastetutkimusta, joissa käytettiin kerran vuorokaudessa annettua hoitoa, suoritettiin 438:lla lievää tai kohtalaista verenpainetautia sairastavalla potilaalla, jotka eivät saaneet diureettia. Verenpaine mitattiin 24 tuntia annostelun jälkeen. Joillakin potilailla PRINIVILin verenpainetta alentava vaikutus havaittiin 5 mg:n annoksella. Molemmissa tutkimuksissa verenpaineen lasku kuitenkin tapahtui aikaisemmin ja oli suurempi potilailla, joita hoidettiin 10, 20 tai 80 mg:lla PRINIVILia. Kontrolloiduissa kliinisissä tutkimuksissa potilailla, joilla on lievä tai kohtalainen verenpainetauti, PRINIVIL 20-80 mg:aa on verrattu hydroklooritiatsidiin 12,5-50 mg ja atenololiin 50-500 mg ja potilailla, joilla on kohtalainen tai vaikea verenpainetauti, verrattiin metoprololiin 100-200 mg. Se oli hydroklooritiatsidia parempi vaikutukseltaan systoliseen ja diastoliseen verenpaineeseen populaatiossa, josta 75 % oli valkoihoisia. PRINIVIL 10 mg vastasi suunnilleen atenololia ja metoprololia vaikutukseltaan diastoliseen verenpaineeseen, ja sillä oli jonkin verran suurempi vaikutus systoliseen verenpaineeseen.
PRINIVILilla oli samanlainen tehokkuus ja haittavaikutukset nuoremmilla ja vanhemmilla (>65-vuotiailla) potilailla. Se oli vähemmän tehokas mustilla kuin valkoihoisilla.
Hemodynaamisissa tutkimuksissa PRINIVIL 5 mg:lla potilailla, joilla oli essentiaalinen hypertensio, verenpaineen laskuun liittyi perifeeristen valtimoiden vastuksen lasku, mutta sydämen minuuttitilavuus ja syke muuttuivat vain vähän tai ei ollenkaan. Yhdeksällä verenpainepotilaalla tehdyssä tutkimuksessa PRINIVIL 5 mg:n annon jälkeen keskimääräinen munuaisten verenvirtaus lisääntyi, mikä ei ollut merkitsevää. Useista pienistä tutkimuksista saadut tiedot ovat ristiriidassa lisinopriilin vaikutuksen suhteen glomerulusten suodatusnopeuteen hypertensiivisillä potilailla, joilla on normaali munuaisten toiminta, mutta viittaavat siihen, että mahdolliset muutokset eivät ole suuria.
Potilailla, joilla on renovaskulaarinen hypertensio PRINIVILIN on osoitettu olevan hyvin siedetty ja tehokas verenpainetta alentamassa [ks. VAROITUKSET JA VAROTOIMET ].
Pediatriset potilaat
Kliinisessä tutkimuksessa, johon osallistui 115 hypertensiivistä 6–16-vuotiasta lapsipotilasta, potilaat, jotka painoivat alle 50 kg, saivat joko 0,625, 2,5 tai 20 mg lisinopriilia päivässä ja potilaat, jotka painoivat ≥ 50 kg, saivat joko 1,25, 5 tai 40 mg lisinopriiliä päivittäin. Kahden viikon kuluttua kerran vuorokaudessa annettu lisinopriili alensi alin verenpainetta annoksesta riippuvalla tavalla, ja jatkuva verenpainetta alentava teho osoitettiin annoksilla >1,25 mg (0,02 mg/kg). Tämä vaikutus vahvistettiin vieroitusvaiheessa, jossa diastolinen paine nousi noin 9 mmHg enemmän lumelääkettä saaneilla potilailla kuin potilailla, jotka satunnaistettiin jatkamaan keskimääräisiä ja suuria lisinopriiliannoksia. Lisinopriilin annoksesta riippuva verenpainetta alentava vaikutus oli johdonmukainen useissa demografisissa alaryhmissä: ikä, Tanner-aste, sukupuoli ja rotu. Tässä tutkimuksessa lisinopriili oli yleensä hyvin siedetty.
Yllä olevissa lapsitutkimuksissa lisinopriilia annettiin joko tabletteina tai suspensiona niille lapsille ja imeväisille, jotka eivät kyenneet nielemään tabletteja tai jotka tarvitsivat pienemmän annoksen kuin tablettimuodossa on saatavilla [ks. ANNOSTELU JA HALLINNOINTI ].
Sydämen vajaatoiminta
Kahdessa lumekontrolloidussa, 12 viikkoa kestäneessä kliinisessä tutkimuksessa verrattiin PRINIVIL 2,5 mg:n 20 mg:aan vuorokaudessa lisäämistä pelkkään digitalikseen ja diureetteihin. PRINIVILIN, digitaliksen ja diureettien yhdistelmä vähensi seuraavia sydämen vajaatoiminnan merkkejä ja oireita: turvotus, kohinat, kohtauksellinen yöllinen hengenahdistus ja kaulalaskimon turvotus. Yhdessä tutkimuksessa PRINIVIL 2,5 mg:n, digitaliksen ja diureettien yhdistelmä vähensi ortopneaa, kolmannen sydämen äänen esiintymistä ja NYHA-luokkiin III ja IV luokiteltujen potilaiden määrää sekä paransi rasituksen sietokykyä. Laaja (yli 3000 potilasta) eloonjäämistutkimus, ATLAS Trial, jossa verrattiin 2,5 ja 35 mg lisinopriilia potilailla, joilla oli systolinen sydämen vajaatoiminta, osoitti, että suuremmalla lisinopriiliannoksella oli vähintään yhtä suotuisa tulos kuin pienemmällä annoksella. Lähtötasoon kontrolloiduissa kliinisissä tutkimuksissa potilailla, jotka saivat digitalista ja diureetteja, kerta-annokset PRINIVIL 5 mg johtivat keuhkokapillaarien kiilapaineen, systeemisen verisuonten vastuksen ja verenpaineen laskuun, johon liittyi sydämen minuuttitilavuuden nousu, eikä sydämen sykkeen muutosta.
Akuutti sydäninfarkti
Gruppo Italiano per lo Studio della Sopravvienza nell’Infarto Miocardico (GISSI-3) -tutkimus oli monikeskus, kontrolloitu, satunnaistettu, sokkoutettu kliininen tutkimus, joka suoritettiin 19 394 potilaalla, joilla oli akuutti sydäninfarkti (MI) ja jotka otettiin sepelvaltimoiden hoitoon. Se suunniteltiin tutkimaan lyhytaikaisen (6 viikkoa) lisinopriilin, nitraattien, niiden yhdistelmän tai hoidon puuttumisen vaikutuksia lyhytaikaiseen (6 viikkoa) kuolleisuuteen ja pitkäaikaiseen kuolemaan ja merkittävästi heikentyneeseen sydämen toimintaan. Hemodynaamisesti vakaat potilaat, jotka ilmaantuivat 24 tunnin sisällä oireiden alkamisesta, satunnaistettiin 2 x 2 tekijämallilla 6 viikon ikäisille joko 1) pelkkä PRINIVIL (n=4841), 2) pelkkä nitraatti (n=4869), 3 ) PRINIVIL 2,5 mg plus nitraatit (n=4841) tai 4) avoin kontrolli (n=4843). Kaikki potilaat saivat tarvittaessa rutiinihoitoja, mukaan lukien trombolyyttiset lääkkeet (72 %), aspiriini (84 %) ja beetasalpaaja (31 %), joita tavallisesti käytettiin akuutin sydäninfarktin (MI) potilailla.
Protokollasta poistettiin potilaat, joilla oli hypotensio (systolinen verenpaine ≤100 mmHg), vaikea sydämen vajaatoiminta, kardiogeeninen sokki ja munuaisten vajaatoiminta (seerumin kreatiniini > 2 mg/dl ja/tai proteinuria > 500 mg/24 tuntia). Potilaat, jotka satunnaistettiin saamaan PRINIVIL 5 mg, saivat 5 mg 24 tunnin kuluessa oireiden alkamisesta, 5 mg 24 tunnin kuluttua ja sen jälkeen 10 mg vuorokaudessa. Potilaat, joiden systolinen verenpaine oli alle 120 mmHg lähtötilanteessa, saivat 2,5 mg PRINIVILIä. Jos hypotensiota esiintyi, PRINIVIL 10 mg annosta pienennettiin tai jos vaikea hypotensio ilmaantui, PRINIVIL lopetettiin [ks. ANNOSTELU JA HALLINNOINTI ].
Tutkimuksen ensisijaiset tulokset olivat kokonaiskuolleisuus 6 viikon kohdalla ja yhdistetty päätetapahtuma 6 kuukautta sydäninfarktin jälkeen, joka koostui niiden potilaiden määrästä, jotka kuolivat, joilla oli myöhäinen (päivä 4) kliininen kongestiivinen sydämen vajaatoiminta tai laaja vasen kammio vaurio, joka määritellään ejektiofraktioksi ≤35 % tai akineettis-dyskineettiseksi [AD]-pisteeksi ≥45 %. Potilailla, jotka saivat PRINIVILIä yksin tai nitraattien kanssa, oli 11 % pienempi kuoleman riski (p = 0,04) verrattuna potilaisiin, jotka eivät saaneet PRINIVILIä (n = 9672) (6,4 % vs. 7,2 %). 6 viikon kohdalla. Vaikka potilaat, jotka satunnaistettiin saamaan PRINIVIL-hoitoa enintään 6 viikoksi, menestyivät myös numerollisesti paremmin yhdistetyssä päätepisteessä 6 kuukauden kohdalla, sydämen vajaatoiminnan arvioinnin avoin luonne, merkittävä seurannan kaikukuvauksen menetys ja PRINIVIL 10 mg:n huomattava liikakäyttö 6 viikkoa ja 6 kuukautta ryhmässä, joka satunnaistettiin saamaan 6 viikkoa lisinopriilia, sulkee pois kaikki johtopäätökset tästä päätetapahtumasta.
Potilailla, joilla oli akuutti sydäninfarkti ja joita hoidettiin PRINIVIL 10 mg:lla, esiintyi korkeampi (9,0 % vs. 3,7 %) jatkuva hypotensio (systolinen verenpaine HAITTAVAIKUTUKSET ].
POTILASTIEDOT
HUOMAA: Nämä tiedot on tarkoitettu auttamaan tämän lääkkeen turvallisessa ja tehokkaassa käytössä. Se ei ole kaikkien mahdollisten haitallisten tai suunniteltujen vaikutusten paljastaminen.
Raskaus
Kerro hedelmällisessä iässä oleville naispotilaille PRINIVIL 10 mg:n raskaudenaikaisen altistuksen seurauksista. Keskustele hoitovaihtoehdoista raskautta suunnittelevien naisten kanssa. Pyydä potilaita ilmoittamaan raskaudesta lääkärilleen mahdollisimman pian.
Angioedeema
Angioedeemaa, mukaan lukien kurkunpään turvotus, voi ilmaantua milloin tahansa hoidon aikana angiotensiinikonvertaasin estäjillä, mukaan lukien PRINIVIL. Pyydä potilaita ilmoittamaan välittömästi kaikista angioedeemaan viittaavista merkeistä tai oireista (kasvojen, raajojen, silmien, huulten, kielen turvotus, nielemis- tai hengitysvaikeudet) ja olemaan ottamatta enää lääkettä ennen kuin he ovat neuvotelleet lääkkeen määräävän lääkärin kanssa.
Oireellinen hypotensio
Kerro potilaille, että he ilmoittavat pyörrytyksestä erityisesti hoidon ensimmäisten päivien aikana. Jos todellinen pyörtyminen ilmenee, kehota potilasta lopettamaan lääkkeen käyttö, kunnes hän on neuvotellut lääkkeen määräävän lääkärin kanssa.
Kerro potilaille, että liiallinen hikoilu ja nestehukka voivat johtaa verenpaineen liialliseen laskuun nestetilavuuden vähenemisen vuoksi. Muut tilavuuden vähenemisen syyt, kuten oksentelu tai ripuli, voivat myös johtaa verenpaineen laskuun; neuvoa potilaita vastaavasti.
Hyperkalemia
Kerro potilaille, etteivät he käytä kaliumia sisältäviä suolankorvikkeita neuvottelematta lääkärin kanssa.
Hypoglykemia
Kerro diabeetikoille, joita hoidetaan suun kautta otetuilla diabeteslääkkeillä tai insuliinilla ja jotka aloittavat ACE:n estäjälääkityksen, että he tarkkailevat tarkasti hypoglykemiaa, erityisesti yhdistelmähoidon ensimmäisen kuukauden aikana [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Leukopenia/neutropenia
Pyydä potilaita ilmoittamaan viipymättä kaikista infektion viitteistä (esim. kurkkukipu, kuume), jotka voivat olla merkki leukopeniasta/neutropeniasta.
