Vasotec 2.5mg, 5mg, 10mg Enalapril Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Vasotec on ja miten sitä käytetään?
Vasotec on reseptilääke, jota käytetään korkean verenpaineen (hypertension), vasemman kammion toimintahäiriön ja kongestiivisen sydämen vajaatoiminnan oireiden hoitoon. Vasotecia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
- Vasotec kuuluu ACE:n estäjien lääkeryhmään.
- Ei tiedetä, onko Vasotec turvallinen ja tehokas alle 1 kuukauden ikäisille lapsille.
Mitkä ovat Vasotecin 2,5 mg:n mahdolliset sivuvaikutukset?
Vasotec 2,5 mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- huimaus,
- rintakipu,
- ihon tai silmien keltaisuus (keltatauti),
- vähän tai ei ollenkaan virtsaamista,
- kuume,
- vilunväristykset,
- kipeä kurkku,
- pahoinvointi,
- heikkous,
- kihelmöivä tunne,
- epäsäännölliset sydämenlyönnit ja
- liikkeen menetys
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Vasotecin yleisimpiä sivuvaikutuksia ovat:
- huimaus,
- väsymys ja
- huimaus
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Vasotecin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
SIKIÖN MYRKYLLISYYS
- Kun raskaus havaitaan, lopeta VASOTEC®-hoito mahdollisimman pian.
- Lääkkeet, jotka vaikuttavat suoraan reniini-angiotensiinijärjestelmään, voivat aiheuttaa vammoja ja kuoleman kehittyvälle sikiölle. Katso VAROITUKSET: Sikiön toksisuus
KUVAUS
VASOTEC® (Enalapril Maleate) on enalapriilin maleaattisuola, pitkävaikutteisen angiotensiinia konvertoivan entsyymin estäjän, enalaprilaatin, etyyliesteri. Enalapriilimaleaatti kuvataan kemiallisesti nimellä (S)-1 [N-[1-(etoksikarbonyyli)-3-fenyylipropyyli]-L-alanyyli]-L-proliini, (Z)-2-buteenidioaattisuola (1:1). Sen empiirinen kaava on C20H28N2O5•C4H4O4 ja sen rakennekaava on:
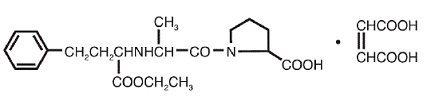
Enalapriilimaleaatti on valkoinen tai luonnonvalkoinen, kiteinen jauhe, jonka molekyylipaino on 492,53. Se liukenee niukasti veteen, liukenee etanoliin ja liukenee vapaasti metanoliin.
Enalapriili on aihiolääke; oraalisen annon jälkeen se bioaktivoituu etyyliesterin hydrolyysillä enalaprilaatiksi, joka on aktiivinen angiotensiinia konvertoivan entsyymin estäjä.
Enalapriilimaleaattia toimitetaan 2,5 mg:n, 5 mg:n, 10 mg:n ja 20 mg:n tabletteina suun kautta annettavaksi. Vaikuttavan aineen enalapriilimaleaatin lisäksi jokainen tabletti sisältää seuraavat inaktiiviset aineosat: laktoosi, magnesiumstearaatti, natriumbikarbonaatti ja tärkkelys. 10 mg ja 20 mg tabletit sisältävät myös rautaoksideja.
INDIKAATIOT
Hypertensio
VASOTEC on tarkoitettu verenpainetaudin hoitoon.
VASOTEC on tehokas yksinään tai yhdessä muiden verenpainetta alentavien aineiden, erityisesti tiatsidityyppisten diureettien, kanssa. VASOTEC 10mg:n ja tiatsidien verenpainetta alentavat vaikutukset ovat suunnilleen additiivisia.
Sydämen vajaatoiminta
VASOTEC on tarkoitettu oireisen sydämen vajaatoiminnan hoitoon, yleensä yhdessä diureettien ja digitaliksen kanssa. Näillä potilailla VASOTEC 5 mg parantaa oireita, lisää eloonjäämistä ja vähentää sairaalahoitoa (ks. KLIININEN FARMAKOLOGIA , Sydämen vajaatoiminta , Kuolleisuuskokeet selviytymiskokeiden yksityiskohdista ja rajoituksista ).
Oireeton vasemman kammion toimintahäiriö
Kliinisesti stabiileilla oireettomilla potilailla, joilla on vasemman kammion toimintahäiriö (ejektiofraktio ≤ 35 prosenttia), VASOTEC 5 mg hidastaa sydämen vajaatoiminnan kehittymisnopeutta ja vähentää sairaalahoitoon sydämen vajaatoiminnan vuoksi (ks. KLIININEN FARMAKOLOGIA , Sydämen vajaatoiminta , Kuolleisuuskokeet selviytymiskokeiden yksityiskohdista ja rajoituksista ).
Käytettäessä VASOTEC 2,5 mg -valmistetta on otettava huomioon, että toinen angiotensiinikonvertaasin estäjä, kaptopriili, on aiheuttanut agranulosytoosia, erityisesti potilailla, joilla on munuaisten vajaatoiminta tai kollageeniverisuonitauti, ja että saatavilla olevat tiedot eivät ole riittäviä osoittamaan, että VASOTEC 2,5 mg ei on samanlainen riski (katso VAROITUKSET ).
Harkittaessa VASOTECin käyttöä on huomioitava, että kontrolloiduissa kliinisissä tutkimuksissa ACE:n estäjät vaikuttavat verenpaineeseen vähemmän mustaihoisilla kuin muilla. Lisäksi on huomattava, että ACE:n estäjiä saavilla mustaihoisilla potilailla on raportoitu olevan suurempi angioedeeman ilmaantuvuus kuin ei-mustaihoisilla (ks. VAROITUKSET , Pään ja kaulan angioödeema ).
ANNOSTELU JA HALLINNOINTI
Hypertensio
Potilailla, joita hoidetaan parhaillaan diureetilla, saattaa toisinaan esiintyä oireenmukaista hypotensiota VASOTECin aloitusannoksen jälkeen. Diureetin käyttö tulee mahdollisuuksien mukaan lopettaa kahdeksi kolmeksi päiväksi ennen VASOTEC-hoidon aloittamista hypotension todennäköisyyden vähentämiseksi (ks. VAROITUKSET ). Jos potilaan verenpainetta ei saada hallintaan pelkällä VASOTECilla, diureettihoitoa voidaan jatkaa.
Jos diureetin käyttöä ei voida keskeyttää, 2,5 mg:n aloitusannosta tulee käyttää lääkärin valvonnassa vähintään kahden tunnin ajan ja kunnes verenpaine on tasaantunut vähintään tunnin ajan (ks. VAROITUKSET ja VAROTOIMENPITEET , HUUMEIDEN VUOROVAIKUTUKSET ).
Suositeltu aloitusannos potilaille, jotka eivät käytä diureetteja, on 5 mg kerran vuorokaudessa. Annostus tulee säätää verenpainevasteen mukaan. Tavallinen annosalue on 10-40 mg vuorokaudessa yhtenä annoksena tai jaettuna kahteen annokseen. Joillakin potilailla, joita hoidetaan kerran vuorokaudessa, verenpainetta alentava vaikutus saattaa heiketä annosvälin loppua kohti. Tällaisilla potilailla tulee harkita annoksen suurentamista tai antoa kahdesti vuorokaudessa. Jos verenpainetta ei saada hallintaan pelkällä VASOTEC 2,5 mg:lla, diureetti voidaan lisätä. VASOTEC 5 mg:n samanaikainen käyttö kaliumlisäaineiden, kaliumsuolankorvikkeiden tai kaliumia säästävien diureettien kanssa voi johtaa seerumin kaliumpitoisuuden nousuun (ks. VAROTOIMENPITEET ).
Annoksen säätäminen hypertensiivisillä potilailla, joilla on munuaisten vajaatoiminta
Tavallista enalapriiliannosta suositellaan potilaille, joiden kreatiniinipuhdistuma on yli 30 ml/min (seerumin kreatiniini enintään noin 3 mg/dl). Potilaille, joiden kreatiniinipuhdistuma on enintään 30 ml/min (seerumin kreatiniini suurempi tai yhtä suuri kuin 3 mg/dl), ensimmäinen annos on 2,5 mg kerran vuorokaudessa. Annosta voidaan titrata ylöspäin, kunnes verenpaine on hallinnassa, tai enintään 40 mg:aan vuorokaudessa.
Sydämen vajaatoiminta
VASOTEC on tarkoitettu oireisen sydämen vajaatoiminnan hoitoon, yleensä yhdessä diureettien ja digitaliksen kanssa. Plasebokontrolloiduissa tutkimuksissa, jotka osoittivat parantuneen eloonjäämisen, potilaiden annokset titrattiin siedetyksi 40 mg:aan asti, jaettuna kahteen annokseen.
Suositeltu aloitusannos on 2,5 mg. Suositeltu annosalue on 2,5–20 mg kahdesti vuorokaudessa. Annoksia tulee titrata ylöspäin siedetyksi ajaksi muutaman päivän tai viikon aikana. Kliinisissä tutkimuksissa suurin vuorokausiannos oli 40 mg jaettuna annoksiin.
VASOTECin aloitusannoksen jälkeen potilasta tulee tarkkailla lääkärin valvonnassa vähintään kahden tunnin ajan ja kunnes verenpaine on tasaantunut vielä vähintään tunnin ajan (ks. VAROITUKSET ja HUUMEIDEN VUOROVAIKUTUKSET ). Jos mahdollista, minkä tahansa samanaikaisen diureetin annosta tulee pienentää, mikä voi vähentää hypotension todennäköisyyttä. Hypotension ilmaantuminen VASOTEC-alkuannoksen jälkeen ei estä myöhempää huolellista annoksen titrausta lääkkeellä hypotension tehokkaan hoidon jälkeen.
Oireeton vasemman kammion toimintahäiriö
Tehokkuuden osoittaneessa tutkimuksessa potilaat aloitettiin annoksella 2,5 mg kahdesti vuorokaudessa ja titrattiin siedettävän vuorokausiannoksen mukaisesti tavoiteannokseen 20 mg (jaettuina annoksina).
VASOTEC 10 mg:n aloitusannoksen jälkeen potilasta tulee tarkkailla lääkärin valvonnassa vähintään kahden tunnin ajan ja kunnes verenpaine on tasaantunut vielä vähintään tunnin ajan (ks. VAROITUKSET ja HUUMEIDEN VUOROVAIKUTUKSET ). Jos mahdollista, minkä tahansa samanaikaisen diureetin annosta tulee pienentää, mikä voi vähentää hypotension todennäköisyyttä. Hypotension ilmaantuminen VASOTEC 5 mg:n aloitusannoksen jälkeen ei estä myöhempää huolellista annoksen titrausta lääkkeen kanssa hypotension tehokkaan hoidon jälkeen.
Annoksen säätäminen potilailla, joilla on sydämen vajaatoiminta ja munuaisten vajaatoiminta tai hyponatremia
Sydämen vajaatoimintapotilailla, joilla on hyponatremia (seerumin natrium alle 130 mekv/l) tai seerumin kreatiniini on yli 1,6 mg/dl, hoito tulee aloittaa annoksella 2,5 mg/vrk tarkassa lääkärin valvonnassa (ks. Sydämen vajaatoiminta , VAROITUKSET ja HUUMEIDEN VUOROVAIKUTUKSET ). Annosta voidaan nostaa 2,5 mg:aan kahdesti kahdesti, sitten 5 mg:aan kahdesti kahdesti ja enemmänkin tarpeen mukaan, yleensä vähintään neljän päivän välein, jos annosta säädettäessä ei esiinny liiallista hypotensiota tai merkittävää munuaisten toiminnan heikkenemistä. Suurin vuorokausiannos on 40 mg.
Hypertensiiviset lapsipotilaat
Tavallinen suositeltu aloitusannos on 0,08 mg/kg (enintään 5 mg) kerran vuorokaudessa. Annostus tulee säätää verenpainevasteen mukaan. Yli 0,58 mg/kg (tai yli 40 mg) annoksia ei ole tutkittu lapsipotilailla (ks. KLIININEN FARMAKOLOGIA , Kliininen farmakologia lapsipotilailla ).
VASOTEC 5 mg:n käyttöä ei suositella vastasyntyneille eikä lapsipotilaille, joiden glomerulussuodatusnopeus on alle 30 ml/min/1,73 m², koska tietoja ei ole saatavilla.
Suspension valmistus (200 ml:lle 1,0 mg/ml suspensiota)
Lisää 50 ml Bicitra®:a polyeteenitereftalaatti (PET) -pulloon, joka sisältää kymmenen 20 mg:n VASOTEC 10 mg -tablettia, ja ravista vähintään 2 minuuttia. Anna tiivisteen seistä 60 minuuttia. 60 minuutin pitoajan jälkeen ravista konsentraattia vielä minuutin ajan. Lisää 150 ml Ora-Sweet SF™2:ta PET-pullossa olevaan konsentraattiin ja ravista suspensiota ainesten dispergoimiseksi. Suspensio tulee säilyttää jääkaapissa 2–8 °C:ssa ja sitä voidaan säilyttää enintään 30 päivää. Ravista suspensiota ennen jokaista käyttöä.
MITEN TOIMITETAAN
Varastointi
Säilytä 25°C (77°F); retket sallitaan 15-30°C:een (59-86°F) [katso USP-ohjattu huonelämpötila ].
Pidä säiliö tiiviisti suljettuna.
Suojaa kosteudelta.
Annostele tiiviiseen astiaan USP:n mukaisesti, jos tuotepakkaus on jaettu.
Valmistettu: Valeant Pharmaceuticals North America LLC Bridgewater, NJ 08807 USA. Valmistaja: Valeant Pharmaceuticals International, Inc. Steinbach, MB R5G 1Z7 Kanada. Versio: heinäkuuta 2017.
SIVUVAIKUTUKSET
VASOTECin turvallisuutta on arvioitu yli 10 000 potilaalla, mukaan lukien yli 1 000 potilasta, joita on hoidettu vähintään vuoden ajan. VASOTEC 10 mg:n on todettu olevan yleisesti hyvin siedetty kontrolloiduissa kliinisissä tutkimuksissa, joihin osallistui 2987 potilasta. Suurimmaksi osaksi haitalliset kokemukset olivat luonteeltaan lieviä ja ohimeneviä. Kliinisissä tutkimuksissa hoidon keskeyttäminen kliinisten haittavaikutusten vuoksi vaadittiin 3,3 prosentilla verenpainepotilaista ja 5,7 prosentilla sydämen vajaatoimintaa sairastavista potilaista. Haittavaikutusten esiintymistiheys ei liittynyt päivittäiseen kokonaisannokseen tavanomaisten annosten rajoissa. Verenpainepotilailla VASOTEC-hoitoa saaneiden potilaiden kokonaisprosenttiosuus, jotka ilmoittivat haittavaikutuksista, oli verrattavissa lumelääkkeeseen.
Hypertensio
Haittakokemukset, joita esiintyi yli yhdellä prosentilla verenpainepotilaista, joita hoidettiin VASOTEC 2,5 mg:lla kontrolloiduissa kliinisissä tutkimuksissa, on esitetty alla. VASOTECilla hoidetuilla potilailla hoidon enimmäiskesto oli kolme vuotta; lumelääkettä saaneilla potilailla hoidon enimmäiskesto oli 12 viikkoa.
Sydämen vajaatoiminta
Haittakokemukset, joita esiintyy useammalla kuin yhdellä prosentilla VASOTEC 5 mg:lla hoidetuista sydämen vajaatoimintaa sairastavista potilaista, on esitetty alla. Ilmaantuvuus edustaa sekä kontrolloiduista että kontrolloimattomista kliinisistä tutkimuksista saatuja kokemuksia (hoidon enimmäiskesto oli noin yksi vuosi). Lumelääkettä saaneilla potilailla raportoidut esiintyvuudet ovat peräisin kontrolloiduista tutkimuksista (hoidon enimmäiskesto on 12 viikkoa). Vaikeaa sydämen vajaatoimintaa (NYHA-luokka IV) sairastavien potilaiden prosenttiosuus oli 29 prosenttia ja 43 prosenttia potilaista, joita hoidettiin VASOTEC 2,5 mg:lla ja lumelääke.
Muut vakavat kliiniset haittavaikutukset, joita on ilmennyt lääkkeen markkinoille tulon jälkeen, tai haitalliset kokemukset, joita esiintyi 0,5–1,0 prosentilla potilaista, joilla on korkea verenpaine tai sydämen vajaatoiminta kliinisissä tutkimuksissa, on lueteltu alla ja kunkin luokan sisällä alenevassa järjestyksessä.
Keho Kokonaisuutena
Anafylaktoidiset reaktiot (ks VAROITUKSET , Anafylaktoidi ja mahdollisesti liittyvät reaktiot ).
Kardiovaskulaarinen
Sydämenpysähdys; sydäninfarkti tai aivoverenkiertohäiriö, mahdollisesti toissijainen liiallisesta hypotensiosta suuren riskin potilailla (ks. VAROITUKSET , Hypotensio ); keuhkoembolia ja -infarkti; keuhkopöhö; rytmihäiriöt, mukaan lukien eteistakykardia ja bradykardia; eteisvärinä; sydämentykytys, Raynaudin ilmiö.
Ruoansulatus
Ileus, haimatulehdus, maksan vajaatoiminta, hepatiitti (hepatosellulaarinen [todistetusti uudelleenhoidon yhteydessä] tai kolestaattinen keltaisuus) (ks. VAROITUKSET , Maksan vajaatoiminta ), melena, anoreksia, dyspepsia, ummetus, glossiitti, stomatiitti, suun kuivuminen.
Hematologinen
Harvinaisissa tapauksissa neutropeniaa, trombosytopeniaa ja luuytimen lamaa.
Tuki- ja liikuntaelimistön
Lihaskrampit.
Hermosto/Psykiatrinen
Masennus, sekavuus, ataksia, uneliaisuus, unettomuus, hermostuneisuus, perifeerinen neuropatia (esim. parestesia, dysestesia), unen poikkeavuus.
Hengitys
Bronkospasmi, nuha, kurkkukipu ja käheys, astma, ylempien hengitysteiden infektio, keuhkoinfiltraatit, eosinofiilinen pneumoniitti.
Iho
Eksfoliatiivinen ihotulehdus, toksinen epidermaalinen nekrolyysi, Stevens-Johnsonin oireyhtymä, pemfigus, herpes zoster, erythema multiforme, urtikaria, kutina, hiustenlähtö, punoitus, hikoilu, valoherkkyys.
Erityiset aistit
Näön hämärtyminen, makuaistin muutokset, anosmia, tinnitus, sidekalvotulehdus, silmien kuivuminen, kyyneleet.
Urogenitaalinen
Munuaisten vajaatoiminta, oliguria, munuaisten vajaatoiminta (ks VAROTOIMENPITEET ja ANNOSTELU JA HALLINNOINTI ), kylkikipu, gynekomastia, impotenssi.
Sekalaista
On raportoitu oireyhtymä, johon voi sisältyä jotkin tai kaikki seuraavista: positiivinen ANA, kohonnut erytrosyyttien sedimentaationopeus, nivelsärky/niveltulehdus, lihaskipu/lihastulehdus, kuume, serosiitti, vaskuliitti, leukosytoosi, eosinofilia, valoherkkyys, ihottuma ja muut dermatologiset ilmenemismuotoja.
Angioedeema
Angioedeemaa on raportoitu potilailla, jotka ovat saaneet VASOTEC 2,5 mg, ja ilmaantuvuus on suurempi mustaihoisilla kuin muilla potilailla. Kurkunpään turvotukseen liittyvä angioödeema voi olla kohtalokas. Jos kasvojen, raajojen, huulten, kielen, äänihuulen ja/tai kurkunpään angioödeema ilmenee, VASOTEC-hoito tulee lopettaa ja asianmukainen hoito aloitettava välittömästi (ks. VAROITUKSET ).
Hypotensio
Hypertensiivisistä potilaista hypotensiota esiintyi 0,9 prosentilla ja pyörtymistä 0,5 prosentilla potilaista aloitusannoksen jälkeen tai pidennetyn hoidon aikana. Hypotensio tai pyörtyminen johti hoidon keskeyttämiseen 0,1 prosentilla verenpainepotilaista. Sydämen vajaatoimintapotilailla hypotensiota esiintyi 6,7 prosentilla ja pyörtymistä 2,2 prosentilla potilaista. Hypotensio tai pyörtyminen johti hoidon keskeyttämiseen 1,9 prosentilla potilaista, joilla oli sydämen vajaatoiminta (ks. VAROITUKSET ).
Yskä
Katso VAROTOIMENPITEET , Yskä .
Pediatriset potilaat
Lapsipotilaiden haittakokemusprofiili näyttää olevan samanlainen kuin aikuispotilailla.
Kliiniset laboratoriotutkimukset
Seerumin elektrolyytit
Hyperkalemia (katso VAROTOIMENPITEET ), hyponatremia.
Kreatiniini, veren ureatyppi
Kontrolloiduissa kliinisissä tutkimuksissa veren ureatypen ja seerumin kreatiniinin vähäistä nousua, joka korjaantui hoidon lopettamisen jälkeen, havaittiin noin 0,2 prosentilla potilaista, joilla oli essentiaalinen hypertensio ja joita hoidettiin pelkällä VASOTECilla. Lisääntymistä esiintyy todennäköisemmin potilailla, jotka saavat samanaikaisesti diureetteja tai potilailla, joilla on munuaisvaltimon ahtauma (ks. VAROTOIMENPITEET ). Sydämen vajaatoimintaa sairastavilla potilailla, jotka saivat myös diureetteja digitaliksen kanssa tai ilman, veren ureatypen tai seerumin kreatiniinipitoisuuden nousua, joka yleensä korjaantui VASOTEC 5 mg:n ja/tai muun samanaikaisen diureettihoidon lopettamisen jälkeen, havaittiin noin 11 prosentilla potilaista. Veren ureatypen tai kreatiniinin nousu johti hoidon keskeyttämiseen 1,2 prosentilla potilaista.
Hematologia
Hemoglobiinin ja hematokriitin pientä laskua (keskimääräinen lasku noin 0,3 g ja 1,0 tilavuusprosenttia) esiintyy usein joko verenpainepotilailla tai kongestiivista sydämen vajaatoimintaa sairastavilla potilailla, joita hoidetaan VASOTEC 5 mg:lla, mutta niillä on harvoin kliinistä merkitystä, ellei muita anemian aiheuttajia ole rinnakkain. Kliinisissä tutkimuksissa alle 0,1 prosenttia potilaista keskeytti hoidon anemian vuoksi. Hemolyyttistä anemiaa, mukaan lukien hemolyysitapaukset potilailla, joilla on G6PD-puutos, on raportoitu; syy-yhteyttä enalapriiliin ei voida sulkea pois.
Maksan toimintatestit
Maksaentsyymiarvojen ja/tai seerumin bilirubiinin nousua on esiintynyt (ks VAROITUKSET , Maksan vajaatoiminta ).
Jos haluat ilmoittaa EPÄILLEISTÄ HAITTAVAIKUTUKSISTA, ota yhteyttä Valeant Pharmaceuticals North America LLC:hen numeroon 1-800-321-4576 tai FDA:han numeroon 1-800-FDA-1088 tai www.fda.gov/medwatch.
HUUMEIDEN VUOROVAIKUTUKSET
Neprilysiinin estäjät
Potilailla, jotka käyttävät samanaikaisesti neprilysiinin estäjiä, voi olla lisääntynyt angioedeeman riski. (katso VAROITUKSET )
Reniini-angiotensiinijärjestelmän (RAS) kaksoisesto
RAS:n kaksoissalpaus angiotensiinireseptorin salpaajilla, ACE:n estäjillä tai aliskireenilla liittyy lisääntyneeseen hypotension, hyperkalemian ja munuaisten toiminnan muutosten riskiin (mukaan lukien akuutti munuaisten vajaatoiminta) verrattuna monoterapiaan. Useimmat potilaat, jotka saavat kahden RAS-estäjän yhdistelmää, eivät saa mitään lisähyötyä monoterapiaan verrattuna. Vältä yleensä RAS-estäjien yhteiskäyttöä. Seuraa tarkasti verenpainetta, munuaisten toimintaa ja elektrolyyttejä potilailla, jotka käyttävät VASOTEC 2,5 mg:aa ja muita RAS:aan vaikuttavia aineita.
Älä anna aliskireenia samanaikaisesti VASOTEC 5 mg:n kanssa diabeetikoille. Vältä aliskireenin käyttöä VASOTECin kanssa potilailla, joilla on munuaisten vajaatoiminta (GFR
Hypotensio - Diureettihoitoa saavat potilaat
Diureetteja käyttävillä potilailla ja erityisesti niillä, joille diureettihoito on äskettäin aloitettu, saattaa toisinaan kokea liiallista verenpaineen laskua enalapriilihoidon aloittamisen jälkeen. Enalapriilin hypotensiivisten vaikutusten mahdollisuus voidaan minimoida joko lopettamalla diureetin käyttö tai lisäämällä suolan saantia ennen enalapriilihoidon aloittamista. Jos diureetin käyttöä on jatkettava, on huolehdittava tiiviistä lääkärin valvonnasta aloitusannoksen jälkeen vähintään kahden tunnin ajan ja kunnes verenpaine on tasaantunut vielä vähintään tunnin ajan (ks. VAROITUKSET ja ANNOSTELU JA HALLINNOINTI ).
Reniinin vapautumista aiheuttavat aineet
VASOTEC 10mg:n verenpainetta alentavaa vaikutusta tehostavat verenpainetta alentavat aineet, jotka aiheuttavat reniinin vapautumista (esim. diureetit).
Ei-steroidiset tulehduskipulääkkeet, mukaan lukien selektiiviset syklo-oksigenaasi-2:n estäjät (COX-2-estäjät)
Iäkkäillä potilailla, joilla on nestevajaus (mukaan lukien diureettihoitoa saavat) tai heikentynyt munuaisten toiminta, tulehduskipulääkkeiden, mukaan lukien selektiivisten COX-2:n estäjien, samanaikainen käyttö ACE:n estäjien, mukaan lukien enalapriili, kanssa voi heikentää munuaisten toimintaa, mukaan lukien mahdollinen akuutti munuaisten vajaatoiminta. Nämä vaikutukset ovat yleensä palautuvia. Seuraa munuaisten toimintaa säännöllisesti potilailla, jotka saavat enalapriili- ja NSAID-hoitoa.
Kliinisfarmakologisessa tutkimuksessa indometasiinia tai sulindakia annettiin VASOTECia saaville verenpainepotilaille. Tässä tutkimuksessa ei ollut näyttöä VASOTECin verenpainetta alentavan vaikutuksen heikkenemisestä. Raportit viittaavat kuitenkin siihen, että tulehduskipulääkkeet voivat heikentää ACE:n estäjien verenpainetta alentavaa vaikutusta.
Muut sydän- ja verisuonilääkkeet
VASOTEC 10 mg:aa on käytetty samanaikaisesti beetasalpaajien, metyylidopan, nitraattien, kalsiumia salpaavien aineiden, hydralatsiinin, pratsosiinin ja digoksiinin kanssa ilman näyttöä kliinisesti merkittävistä haitallisista yhteisvaikutuksista.
Seerumin kaliumia lisäävät aineet
VASOTEC vähentää tiatsidityyppisten diureettien aiheuttamaa kaliumhukkaa. Kaliumia säästävät diureetit (esim. spironolaktoni, triamtereeni tai amiloridi), kaliumlisät tai kaliumia sisältävät suolan korvikkeet voivat johtaa seerumin kaliumpitoisuuden merkittävään nousuun. Siksi, jos näiden aineiden samanaikainen käyttö on aiheellista todetun hypokalemian vuoksi, niitä tulee käyttää varoen ja seerumin kaliumpitoisuutta on seurattava säännöllisesti. Kaliumia säästäviä aineita ei yleensä tule käyttää potilailla, joilla on sydämen vajaatoiminta ja jotka saavat VASOTECia.
Litium
Litiumtoksisuutta on raportoitu potilailla, jotka ovat saaneet litiumia samanaikaisesti natriumin eliminaatiota aiheuttavien lääkkeiden kanssa, mukaan lukien ACE:n estäjät. Muutamat litiumtoksisuustapaukset on raportoitu potilailla, jotka ovat saaneet samanaikaisesti VASOTECia ja litiumia, ja ne korjaantuivat molempien lääkkeiden käytön lopettamisen jälkeen. On suositeltavaa, että seerumin litiumpitoisuutta seurataan usein, jos enalapriilia annetaan samanaikaisesti litiumin kanssa.

Kulta
Nitritoidireaktioita (oireita ovat kasvojen punoitus, pahoinvointi, oksentelu ja hypotensio) on raportoitu harvoin potilailla, jotka ovat saaneet injektoitavaa kultaa (natriumaurotiomalaattia) ja samanaikaista ACE:n estäjähoitoa, mukaan lukien VASOTEC.
mTOR (Mammalian Target Of Rapamycin) estäjät
Potilailla, jotka saavat samanaikaisesti ACE-estäjää ja mTOR-estäjää (esim. temsirolimuusi, sirolimuusi, everolimuusi), voi olla suurentunut angioedeeman riski (ks. VAROITUKSET ).
VAROITUKSET
Anafylaktoidi ja mahdollisesti siihen liittyvät reaktiot
Oletettavasti koska angiotensiinia konvertoivan entsyymin estäjät vaikuttavat eikosanoidien ja polypeptidien, mukaan lukien endogeenisen bradykiniinin, metaboliaan, ACE:n estäjiä (mukaan lukien VASOTEC) saavat potilaat voivat altistua erilaisille haittavaikutuksille, joista osa on vakavia.
Pään ja kaulan angioedeema
Kasvojen, raajojen, huulten, kielen, äänihuulen ja/tai kurkunpään angioedeemaa on raportoitu potilailla, joita on hoidettu angiotensiinikonvertaasin estäjillä, mukaan lukien VASOTEC. Tämä voi tapahtua milloin tahansa hoidon aikana. Tällaisissa tapauksissa VASOTEC 2,5 mg -valmisteen käyttö on lopetettava välittömästi ja asianmukaista hoitoa ja seurantaa on järjestettävä, kunnes merkit ja oireet ovat hävinneet täydellisesti ja pysyvästi. Tapauksissa, joissa turvotus on rajoittunut kasvoihin ja huulille, tila on yleensä parantunut ilman hoitoa, vaikka antihistamiinit ovat olleet hyödyllisiä oireiden lievittämisessä. Kurkunpään turvotukseen liittyvä angioödeema voi olla kohtalokas. Jos kielen, kielen tai kurkunpään kosketus saattaa aiheuttaa hengitysteiden tukkeutumisen, asianmukainen hoito, esim. ihonalainen epinefriiniliuos 1:1000 (0,3 ml - 0,5 ml) ja/tai toimenpiteet, jotka ovat välttämättömiä hengitysteiden avoimuuden varmistamiseksi tarjotaan (katso HAITTAVAIKUTUKSET ).
Potilailla, jotka saavat samanaikaisesti ACE-estäjää ja mTOR-inhibiittoria (rapamysiinin nisäkäskohde) (esim. temsirolimuusi, sirolimuusi, everolimuusi) tai neprilysiini-inhibiittorihoitoa, voi olla suurentunut angioedeeman riski (ks. VAROTOIMENPITEET ).
Suolen angioedeema
Suoliston angioedeemaa on raportoitu potilailla, joita on hoidettu ACE:n estäjillä. Näillä potilailla oli vatsakipua (pahoinvoinnin tai oksentelun kanssa tai ilman); joissakin tapauksissa kasvojen angioedeemaa ei ollut aiemmin esiintynyt ja C-1-esteraasitasot olivat normaaleja. Angioödeema diagnosoitiin toimenpiteillä, mukaan lukien vatsan TT-skannaus tai ultraääni, tai leikkauksessa, ja oireet hävisivät ACE-estäjän lopettamisen jälkeen. Suoliston angioödeema tulee sisällyttää ACE:n estäjiä käyttävien potilaiden erotusdiagnostiikkaan, jos vatsakipuja esiintyy.
Potilailla, joilla on aiemmin ollut angioedeemaa, joka ei liity ACE:n estäjähoitoon, saattaa olla suurentunut angioedeeman riski ACE:n estäjähoidon aikana (katso myös KÄYTTÖAIHEET JA KÄYTTÖ ja VASTA-AIHEET ).
Anafylaktoidireaktiot desensibilisoinnin aikana
Kaksi potilasta, jotka saivat herkkyyttä vähentävää hoitoa hymenoptera myrkkyllä ja saivat ACE:n estäjiä, saivat hengenvaarallisia anafylaktoidisia reaktioita. Samoilla potilailla nämä reaktiot välttyivät, kun ACE:n estäjien käyttö keskeytettiin väliaikaisesti, mutta ne ilmaantuivat uudelleen, kun niitä vahingossa annettiin uudelleen.
Anafylaktoidireaktiot kalvoaltistuksen aikana
Anafylaktoidisia reaktioita on raportoitu potilailla, jotka on dialysoitu korkeavirtauskalvoilla ja joita on hoidettu samanaikaisesti ACE:n estäjällä. Anafylaktisia reaktioita on raportoitu myös potilailla, joille tehdään matalatiheyksisten lipoproteiinien afereesi dekstraanisulfaatin imeytyessä.
Hypotensio
Liiallinen hypotensio on harvinainen komplisoitumattomilla hypertensiivisillä potilailla, joita hoidetaan pelkällä VASOTEC 5 mg:lla. VASOTEC-valmistetta saaneiden sydämen vajaatoimintaa sairastavien potilaiden verenpaine laskee yleensä jonkin verran, etenkin ensimmäisen annoksen yhteydessä, mutta hoidon lopettaminen oireisen hypotension jatkumisen vuoksi ei yleensä ole tarpeen, jos annostusohjeita noudatetaan. varovaisuutta tulee noudattaa hoidon alussa (ks ANNOSTELU JA HALLINNOINTI ). Potilaisiin, joilla on riski saada liiallinen hypotensio, johon joskus liittyy oliguriaa ja/tai etenevää atsotemiaa ja harvoin akuutti munuaisten vajaatoiminta ja/tai kuolema, ovat potilaat, joilla on seuraavat sairaudet tai ominaisuudet: sydämen vajaatoiminta, hyponatremia, suuriannoksinen diureettihoito, viimeaikainen intensiivinen hoito diureesi tai diureettiannoksen suurentaminen, munuaisdialyysi tai minkä tahansa syyn vakava tilavuus- ja/tai suolavaje. Voi olla suositeltavaa poistaa diureetti (paitsi sydämen vajaatoimintapotilailla), pienentää diureetin annosta tai lisätä suolan saantia varovasti ennen VASOTEC 10 mg -hoidon aloittamista potilailla, joilla on liiallisen hypotension riski ja jotka sietävät tällaisia muutoksia (ks. HUUMEIDEN VUOROVAIKUTUKSET ja HAITTAVAIKUTUKSET ). Potilailla, joilla on liiallisen hypotension riski, hoito tulee aloittaa erittäin tiiviissä lääkärin valvonnassa, ja tällaisia potilaita tulee seurata tarkasti kahden ensimmäisen hoitoviikon ajan ja aina, kun enalapriilin ja/tai diureetin annosta suurennetaan. Samanlaisia näkökohtia voidaan soveltaa potilaisiin, joilla on iskeeminen sydän- tai aivoverisuonitauti ja joiden verenpaineen liiallinen lasku voi johtaa sydäninfarktiin tai aivoverisuonionnettomuuteen.
Jos liiallista hypotensiota ilmenee, potilas on asetettava makuuasentoon ja hänelle on tarvittaessa annettava normaalia suolaliuosta suonensisäisenä infuusiona. Ohimenevä hypotensiivinen vaste ei ole vasta-aihe uusille VASOTEC 2,5 mg -annoksille, jotka voidaan yleensä antaa ilman vaikeuksia, kun verenpaine on vakiintunut. Jos oireinen hypotensio kehittyy, VASOTECin tai samanaikaisen diureetin annoksen pienentäminen tai lopettaminen saattaa olla tarpeen.
Neutropenia/agranulosytoosi
Toisen angiotensiinia konvertoivan entsyymin estäjän, kaptopriilin, on osoitettu aiheuttavan agranulosytoosia ja luuytimen lamaa, harvoin potilailla, joilla ei ole komplikaatioita, mutta useammin potilailla, joilla on munuaisten vajaatoiminta, erityisesti jos heillä on myös kollageeniverisuonisairaus. Enalapriilia koskevista kliinisistä tutkimuksista saatavilla olevat tiedot eivät riitä osoittamaan, että enalapriili ei aiheuta agranulosytoosia yhtä usein. Markkinointikokemus on paljastanut neutropenia- tai agranulosytoositapauksia, joissa syy-yhteyttä enalapriiliin ei voida sulkea pois. Valkosolujen määrän säännöllistä seurantaa tulee harkita potilailla, joilla on kollageeniverisuonisairaus ja munuaissairaus.
Maksan vajaatoiminta
ACE:n estäjiin on harvoin liitetty oireyhtymää, joka alkaa kolestaattisella keltatuksella ja etenee fulminanttiksi maksanekroosiksi ja (joskus) kuolemaan. Tämän oireyhtymän mekanismia ei tunneta. ACE:n estäjähoitoa saavien potilaiden, joille kehittyy keltaisuutta tai huomattavaa maksaentsyymiarvojen nousua, tulee keskeyttää ACE:n estäjähoito ja saada asianmukaista lääketieteellistä seurantaa.
Sikiön toksisuus
Reniini-angiotensiinijärjestelmään vaikuttavien lääkkeiden käyttö raskauden toisen ja kolmannen kolmanneksen aikana vähentää sikiön munuaisten toimintaa ja lisää sikiön ja vastasyntyneen sairastuvuutta ja kuolemaa. Tuloksena olevat oligohydramnionit voivat liittyä sikiön keuhkojen hypoplasiaan ja luuston epämuodostumiin. Mahdollisia vastasyntyneiden haittavaikutuksia ovat kallon hypoplasia, anuria, hypotensio, munuaisten vajaatoiminta ja kuolema. Kun raskaus havaitaan, lopeta VASOTEC 10mg -hoito mahdollisimman pian. Nämä haittavaikutukset liittyvät yleensä näiden lääkkeiden käyttöön raskauden toisen ja kolmannen kolmanneksen aikana. Useimmat epidemiologiset tutkimukset, joissa tutkittiin sikiön poikkeavuuksia verenpainetta alentaville lääkkeille ensimmäisen raskauskolmanneksen aikana, eivät ole erottaneet reniini-angiotensiinijärjestelmään vaikuttavia lääkkeitä muista verenpainetta alentavista aineista. Äidin verenpainetaudin asianmukainen hoito raskauden aikana on tärkeää sekä äidin että sikiön tulosten optimoimiseksi.
Siinä epätavallisessa tapauksessa, että reninangiotensiinijärjestelmään vaikuttavilla lääkkeillä ei ole sopivaa vaihtoehtoa tietylle potilaalle, kerro äidille mahdollisista riskeistä sikiölle. Suorita sarja ultraäänitutkimuksia lapsivesiympäristön arvioimiseksi. Jos havaitaan oligohydramnionia, lopeta VASOTEC-hoito, ellei sitä pidetä hengenpelastavana äidille. Sikiötestaus voi olla asianmukaista raskausviikon perusteella. Potilaiden ja lääkäreiden tulee kuitenkin olla tietoisia siitä, että oligohydramnionit saattavat ilmaantua vasta sen jälkeen, kun sikiö on saanut peruuttamattoman vaurion. Tarkkaile tarkasti pikkulapsia, jotka ovat altistuneet kohdussa VASOTECille hypotension, oligurian ja hyperkalemian vuoksi (ks. VAROTOIMENPITEET , Lasten käyttö ).
Enalapriilin teratogeenisiä vaikutuksia ei havaittu tiineillä rotilla ja kaneilla tehdyissä tutkimuksissa. Kehon pinta-alan perusteella käytetyt annokset olivat 57-kertaisia ja 12-kertaisia ihmisille suositeltuun enimmäisannostukseen (MRHDD) nähden.
VAROTOIMENPITEET
Kenraali
Aorttastenoosi/hypertrofinen kardiomyopatia
Kuten kaikkia verisuonia laajentavia lääkkeitä, enalapriilia tulee antaa varoen potilaille, joilla on tukos vasemman kammion ulosvirtauskanavassa.
Munuaisten vajaatoiminta
Reniini-angiotensiini-aldosteronijärjestelmän estämisen seurauksena munuaisten toiminnan muutoksia voidaan odottaa herkillä yksilöillä. Potilailla, joilla on vaikea sydämen vajaatoiminta ja joiden munuaisten toiminta saattaa riippua reniini-angiotensiini-aldosteronijärjestelmän aktiivisuudesta, hoitoon angiotensiinikonvertaasin estäjillä, mukaan lukien VASOTEC, voi liittyä oliguriaa ja/tai etenevää atsotemiaa ja harvoin akuuttia munuaisten vajaatoimintaa ja /tai kuolema (ks HUUMEIDEN VUOROVAIKUTUKSET ).
Kliinisissä tutkimuksissa hypertensiivisillä potilailla, joilla oli tois- tai molemminpuolinen munuaisvaltimon ahtauma, veren ureatypen ja seerumin kreatiniinipitoisuuden nousua havaittiin 20 prosentilla potilaista. Nämä nousut olivat lähes aina palautuvia, kun enalapriili- ja/tai diureettihoito lopetettiin. Tällaisten potilaiden munuaisten toimintaa tulee seurata muutaman ensimmäisen hoitoviikon aikana.
Joillekin potilaille, joilla on verenpainetauti tai sydämen vajaatoiminta, joilla ei ole ilmeistä aiempaa munuaisverisuonisairauksia, on kehittynyt veren urea- ja seerumin kreatiniinipitoisuuden nousu, joka on yleensä vähäistä ja ohimenevää, etenkin kun VASOTECia on annettu samanaikaisesti diureetin kanssa. Tämä on todennäköisempää potilailla, joilla on ennestään munuaisten vajaatoiminta. Annosta pienennetään ja/tai diureetin ja/tai VASOTEC 5 mg:n käyttö on ehkä lopetettava.
Verenpainetautia tai sydämen vajaatoimintaa sairastavien potilaiden arviointiin tulee aina sisällyttää munuaisten toiminnan arviointi (katso ANNOSTELU JA HALLINNOINTI ).
Hyperkalemia
Kliinisissä tutkimuksissa kohonnutta seerumin kaliumpitoisuutta (yli 5,7 mekv/l) havaittiin noin yhdellä prosentilla verenpainepotilaista. Useimmissa tapauksissa nämä olivat yksittäisiä arvoja, jotka hävisivät hoidon jatkumisesta huolimatta. Hyperkalemia johti hoidon keskeyttämiseen 0,28 prosentilla verenpainepotilaista. Sydämen vajaatoimintaa koskevissa kliinisissä tutkimuksissa hyperkalemiaa havaittiin 3,8 prosentilla potilaista, mutta se ei ollut syy hoidon keskeyttämiseen.
Hyperkalemian kehittymisen riskitekijöitä ovat munuaisten vajaatoiminta, diabetes mellitus ja samanaikainen kaliumia säästävien diureettien, kaliumlisäaineiden ja/tai kaliumia sisältävien suolan korvikkeiden käyttö, joita tulee käyttää varoen, jos ollenkaan, VASOTECin kanssa (ks. HUUMEIDEN VUOROVAIKUTUKSET ).
Yskä
Oletettavasti endogeenisen bradykiniinin hajoamisen estämisen vuoksi kaikkien ACE:n estäjien yhteydessä on raportoitu jatkuvaa tuottamatonta yskää, joka häviää aina hoidon lopettamisen jälkeen. ACE-estäjän aiheuttama yskä tulee ottaa huomioon yskän erotusdiagnoosissa.
Leikkaus / anestesia
Potilailla, joille tehdään suuri leikkaus tai anestesian aikana hypotensiota aiheuttavilla aineilla, enalapriili saattaa estää angiotensiini II:n muodostumisen kompensoivan reniinin vapautumisen seurauksena. Jos hypotensiota esiintyy ja sen katsotaan johtuvan tästä mekanismista, se voidaan korjata tilavuuden lisäämisellä.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Tuumorigeenisestä vaikutuksesta ei havaittu näyttöä, kun enalapriilia annettiin 106 viikon ajan uros- ja naarasrotille annoksina 90 mg/kg/vrk tai 94 viikon ajan uros- ja naarashiirille annoksilla 90 ja 180 mg/kg/vrk. päivä vastaavasti. Nämä annokset ovat 26-kertaisia (rotilla ja naarashiirillä) ja 13-kertaisia (uroshiirillä) ihmisen enimmäisvuorokausiannoksen (MRHDD) kanssa verrattuna kehon pinta-alaan.
Enalapriilimaleaatti tai aktiivinen dihappo eivät olleet mutageenisia Amesin mikrobimutageenitestissä metabolisen aktivaation kanssa tai ilman sitä. Enalapriili oli negatiivinen myös seuraavissa genotoksisuustutkimuksissa: uudelleenmääritys, käänteismutaatiomääritys E. colilla, sisarkromatidivaihto viljellyillä nisäkässoluilla ja mikrotumatesti hiirillä sekä in vivo sytogeenisessa tutkimuksessa, jossa käytettiin hiiren luuydintä .
Ei havaittu haitallisia vaikutuksia lisääntymiskykyyn uros- ja naarasrotilla, joita hoidettiin enintään 90 mg/kg/vrk enalapriiliannoksella (26 kertaa MRHDD verrattuna kehon pinta-alaan).
Raskaus
Imettävät äidit
Enalapriilia ja enalaprilaattia on havaittu ihmisen rintamaidossa. Koska enalapriili saattaa aiheuttaa vakavia haittavaikutuksia imeväisille, on päätettävä, lopetetaanko imetys vai VASOTEC 2,5 mg -hoito ottaen huomioon lääkkeen merkitys äidille.
Käyttö lapsille
Vastasyntyneet, jotka ovat altistuneet kohdussa VASOTECille
Jos esiintyy oliguriaa tai hypotensiota, kiinnitä huomiota verenpaineen ja munuaisten perfuusion tukemiseen. Vaihtosiirtoja tai dialyysiä voidaan tarvita keinona vähentää hypotensiota ja/tai korvata häiriintynyttä munuaisten toimintaa. Enalapriili, joka läpäisee istukan, on poistettu vastasyntyneen verenkierrosta peritoneaalidialyysillä, josta on jonkin verran kliinistä hyötyä, ja teoriassa se voidaan poistaa vaihtosiirrolla, vaikka viimeksi mainitusta menettelystä ei ole kokemusta.
VASOTECin verenpainetta alentavat vaikutukset on osoitettu hypertensiivisillä lapsipotilailla, joiden ikä on 1 kuukausi - 16 vuotta. VASOTEC 5 mg:n käyttöä näissä ikäryhmissä tukevat riittävät ja hyvin kontrolloidut VASOTEC 2,5 mg:n tutkimukset lapsi- ja aikuispotilailla sekä julkaistu kirjallisuus lapsipotilailla (ks. KLIININEN FARMAKOLOGIA , Kliininen farmakologia lapsipotilailla ja ANNOSTELU JA HALLINNOINTI ).
VASOTECia ei suositella vastasyntyneille eikä lapsipotilaille, joiden glomerulussuodatusnopeus on
YLIANNOSTUS
Yliannostuksista ihmisillä on saatavilla rajoitetusti tietoa.
Enalapriilin kerta-annokset suun kautta yli 1 000 mg/kg ja ≥ 1 775 mg/kg liittyivät kuolleisuuteen hiirillä ja rotilla, vastaavasti.
Yliannostuksen todennäköisin ilmentymä olisi hypotensio, jonka tavanomainen hoito on normaalin suolaliuoksen suonensisäinen infuusio.
Enalaprilaatti voidaan poistaa yleisestä verenkierrosta hemodialyysillä ja vastasyntyneen verenkierrosta peritoneaalidialyysillä (ks. VAROITUKSET , Anafylaktoidireaktiot kalvoaltistuksen aikana ).
VASTA-AIHEET
VASOTEC 2,5 mg on vasta-aiheinen potilaille, jotka ovat yliherkkiä tälle tuotteelle, ja potilaille, joilla on aiemmin ollut angioedeemaa, joka liittyy aikaisempaan angiotensiinikonvertaasin estäjähoitoon, sekä potilaille, joilla on perinnöllinen tai idiopaattinen angioedeema.
Älä anna aliskireenia samanaikaisesti VASOTECin kanssa diabeetikoille (ks HUUMEIDEN VUOROVAIKUTUKSET ).
VASOTEC 10mg on vasta-aiheinen yhdessä neprilysiinin estäjän (esim. sacubitril) kanssa. Älä anna VASOTECia 36 tunnin sisällä vaihtamisesta sacubitril/valsartaaniin, neprilysiinin estäjään, tai siitä pois (ks. VAROITUKSET ).
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Enalaprilaatiksi hydrolysoitumisen jälkeen enalapriili estää angiotensiiniä konvertoivan entsyymin (ACE) toimintaa ihmisillä ja eläimillä. ACE on peptidyylidipeptidaasi, joka katalysoi angiotensiini I:n konversiota verisuonia supistavaksi aineeksi, angiotensiini II:ksi. Angiotensiini II stimuloi myös aldosteronin eritystä lisämunuaiskuoressa. Enalapriilin suotuisat vaikutukset verenpainetautiin ja sydämen vajaatoimintaan näyttävät johtuvan ensisijaisesti reniini-angiotensiini-aldosteronijärjestelmän suppressiosta. ACE:n esto johtaa plasman angiotensiini II:n vähenemiseen, mikä johtaa vasopressoriaktiivisuuden ja aldosteronin erityksen vähenemiseen. Vaikka jälkimmäinen lasku on pieni, se johtaa vähäiseen seerumin kaliumpitoisuuden nousuun. Verenpainepotilailla, joita hoidettiin pelkällä VASOTECilla enintään 48 viikon ajan, seerumin kaliumpitoisuuden havaittiin nousevan keskimäärin noin 0,2 mekvivalenttia/l. Potilailla, joita hoidettiin VASOTEC 5 mg:lla ja tiatsididiureetilla, seerumin kaliumpitoisuudessa ei käytännössä tapahtunut muutoksia (ks. VAROTOIMENPITEET ). Angiotensiini II:n reniinin eritystä koskevan negatiivisen palautteen poistaminen johtaa plasman reniiniaktiivisuuden lisääntymiseen.
ACE on identtinen kininaasin kanssa, entsyymin kanssa, joka hajottaa bradykiniiniä. Vielä on selvitettävä, onko bradykiniinin, voimakkaan vasodepressoripeptidin, kohonneilla tasoilla merkitystä VASOTECin terapeuttisissa vaikutuksissa.
Vaikka mekanismin, jolla VASOTEC 5 mg alentaa verenpainetta, uskotaan ensisijaisesti estävän reniini-angiotensiini-aldosteronijärjestelmää, VASOTEC 10 mg on verenpainetta alentava myös potilailla, joilla on matala reniinipitoisuus. Vaikka VASOTEC oli verenpainetta alentava kaikissa tutkituissa roduissa, mustaihoisilla hypertensiivisillä potilailla (yleensä matalan reniinin verenpainepotilailla) keskimääräinen vaste enalapriilimonoterapiaan oli pienempi kuin ei-mustaihoisilla potilailla.
Farmakokinetiikka ja aineenvaihdunta
VASOTECin oraalisen annon jälkeen enalapriilin huippupitoisuudet seerumissa saavutetaan noin tunnin kuluessa. Virtsan erittymisen perusteella enalapriilin imeytyminen on noin 60 prosenttia. Ruoan läsnäolo maha-suolikanavassa ei vaikuta enalapriilin imeytymiseen. Imeytymisen jälkeen enalapriili hydrolysoituu enalaprilaatiksi, joka on voimakkaampi angiotensiinikonvertaasin estäjä kuin enalapriili. enalaprilaatti imeytyy huonosti suun kautta otettuna. Enalaprilaatin huippupitoisuudet seerumissa saavutetaan kolmesta neljään tuntia suun kautta otetun enalapriilimaleaattiannoksen jälkeen. VASOTEC erittyy pääasiassa munuaisten kautta. Noin 94 prosenttia annoksesta erittyy virtsaan ja ulosteeseen enalaprilaattina tai enalapriilina. Virtsan pääkomponentit ovat enalaprilaatti, jonka osuus annoksesta on noin 40 prosenttia, ja ehjä enalapriili. Enalapriilin metaboliiteista ei ole näyttöä muista kuin enalaprilaatista.
Enalaprilaatin seerumin pitoisuusprofiilissa on pitkittynyt terminaalinen vaihe, joka ilmeisesti edustaa pientä osaa annetusta annoksesta, joka on sitoutunut ACE:hen. Sitoutunut määrä ei kasva annoksen myötä, mikä osoittaa kyllästyvän sitoutumiskohdan. Enalaprilaatin kumuloitumisen tehokas puoliintumisaika useiden enalapriilimaleaattiannosten jälkeen on 11 tuntia. Enalapriilin ja enalaprilaatin jakautuminen munuaisten vajaatoimintaa sairastavilla potilailla on samanlainen kuin potilailla, joilla on normaali munuaisten toiminta, kunnes glomerulusten suodatusnopeus on 30 ml/min tai vähemmän. Kun glomerulaarinen suodatusnopeus on ≤ 30 ml/min, enalaprilaatin huippu- ja alintasot suurenevat, huippupitoisuuden saavuttamiseen kuluva aika pitenee ja vakaan tilan saavuttaminen saattaa viivästyä. Enalaprilaatin tehokas puoliintumisaika useiden enalapriilimaleaattiannosten jälkeen pitenee tällä munuaisten vajaatoiminnan tasolla (ks. ANNOSTELU JA HALLINNOINTI ). Enalaprilaatti on dialysoituva nopeudella 62 ml/min.
Koirilla tehdyt tutkimukset osoittavat, että enalapriili läpäisee veri-aivoesteen huonosti, jos ollenkaan; enalaprilaatti ei pääse aivoihin. Usein enalapriilimaleaatin antaminen rotilla ei aiheuta kertymistä kudoksiin. Imettävien rottien maito sisältää radioaktiivisuutta 14C-enalapriilimaleaatin antamisen jälkeen. Radioaktiivisuuden havaittiin läpäisevän istukan, kun leimattua lääkettä annettiin raskaana oleville hamstereille.
Farmakodynamiikka ja kliiniset vaikutukset
Hypertensio
VASOTECin antaminen potilaille, joilla on vaikeusaste lievästä vaikeaan kohonnut verenpaine, johtaa verenpaineen laskuun sekä selässä että seistessä, yleensä ilman ortostaattista komponenttia. Oireinen posturaalinen hypotensio on siksi harvinainen, vaikka se saattaa olla odotettavissa potilailla, joilla on nestevajaus (ks. VAROITUKSET ).
Suurimmalla osalla tutkituista potilaista, kun enalapriilia kerta-annoksena oli annettu suun kautta, verenpainetta alentava vaikutus havaittiin tunnin kuluttua ja verenpaineen alenemisen huippu saavutettiin 4–6 tunnissa.
Suositelluilla annoksilla verenpainetta alentavat vaikutukset ovat säilyneet vähintään 24 tunnin ajan. Joillakin potilailla vaikutukset voivat heiketä annosteluvälin loppua kohti (ks ANNOSTELU JA HALLINNOINTI ).
Joillakin potilailla optimaalisen verenpaineen laskun saavuttaminen voi vaatia useita viikkoja hoitoa.
VASOTECin verenpainetta alentavat vaikutukset ovat jatkuneet pitkäaikaisen hoidon aikana. VASOTEC 10 mg:n äkillinen lopettaminen ei ole liittynyt nopeaan verenpaineen nousuun.
Hemodynaamisissa tutkimuksissa essentiaalista hypertensiota sairastavilla potilailla verenpaineen laskuun liittyi perifeeristen valtimoiden vastuksen aleneminen, sydämen minuuttitilavuuden lisääntyminen ja vähäinen tai ei lainkaan muutosta sydämen sykkeessä. VASOTECin antamisen jälkeen munuaisten verenkierto lisääntyy; glomerulusten suodatusnopeus on yleensä muuttumaton. Vaikutukset näyttävät olevan samanlaisia potilailla, joilla on renovaskulaarinen hypertensio.
VASOTEC 5 mg:n verenpainetta alentavat vaikutukset ovat suunnilleen additiivisia, kun sitä annetaan yhdessä tiatsidityyppisten diureettien kanssa.
Kliinisfarmakologisessa tutkimuksessa indometasiinia tai sulindakia annettiin VASOTECia saaville verenpainepotilaille. Tässä tutkimuksessa ei havaittu näyttöä VASOTECin verenpainetta alentavan vaikutuksen heikkenemisestä (ks HUUMEIDEN VUOROVAIKUTUKSET ).
Sydämen vajaatoiminta
Digitaliksella ja diureeteilla hoidetuilla potilailla tehdyissä tutkimuksissa enalapriilihoito johti systeemisen verisuonten vastuksen, verenpaineen, keuhkokapillaarin kiilapaineen ja sydämen koon alenemiseen sekä sydämen minuuttitilavuuden ja rasituksen sietokyvyn lisääntymiseen. Syke pysyi muuttumattomana tai hieman hidastui, ja keskimääräinen ejektiofraktio pysyi muuttumattomana tai lisääntyi. Sillä oli myönteinen vaikutus sydämen vajaatoiminnan vaikeusasteeseen New York Heart Associationin (NYHA) luokituksen mukaan sekä hengenahdistuksen ja väsymyksen oireisiin. Hemodynaamisia vaikutuksia havaittiin ensimmäisen annoksen jälkeen, ja ne näyttivät säilyvän kontrolloimattomissa tutkimuksissa, jotka kestivät jopa neljä kuukautta. Vaikutuksia rasituksen sietokykyyn, sydämen kokoon sekä sydämen vajaatoiminnan vakavuuteen ja oireisiin havaittiin lumekontrolloiduissa tutkimuksissa, jotka kestivät kahdeksasta viikosta yli vuoteen.
Sydämen vajaatoiminta, kuolleisuuskokeet
Monikeskustutkimuksessa lumekontrolloidussa kliinisessä tutkimuksessa 2 569 potilasta, joilla oli kaikenasteinen oireinen sydämen vajaatoiminta ja ejektiofraktio ≤ 35 prosenttia, satunnaistettiin saamaan lumelääkettä tai enalapriilia ja heitä seurattiin 55 kuukauden ajan (SOLVD-hoito). Enalapriilin käyttöön liittyi 11 prosentin vähennys kaikista syistä johtuvassa kuolleisuudesta ja 30 prosentin vähentymiseen sydämen vajaatoiminnan vuoksi. Sairauksia, joiden vuoksi potilaat jätettiin tutkimukseen mukaan, olivat vaikea stabiili angina pectoris (> 2 kohtausta/vrk), hemodynaamisesti merkittävä läppä- tai ulosvirtausteiden tukos, munuaisten vajaatoiminta (kreatiniini > 2,5 mg/dl), aivoverisuonitauti (esim. merkittävä kaulavaltimotauti) , pitkälle edennyt keuhkosairaus, pahanlaatuiset kasvaimet, aktiivinen sydänlihastulehdus ja supistava perikardiitti. Enalapriiliin liittyvä kuolleisuushyöty ei näytä riippuvan digitaliksen esiintymisestä.
Toisessa monikeskustutkimuksessa käytettiin SOLVD-protokollaa oireettomien tai vähäoireisten potilaiden tutkimiseen. SOLVD-ehkäisypotilaat, joilla vasemman kammion ejektiofraktio oli ≤ 35 % ja joilla ei ollut aiemmin ollut oireista sydämen vajaatoimintaa, satunnaistettiin saamaan lumelääkettä (n=2117) tai enalapriilia (n=2111), ja heitä seurattiin enintään 5 vuoden ajan. Suurimmalla osalla SOLVD-prevention -tutkimuksen potilaista oli ollut iskeeminen sydänsairaus. 80 prosentilla potilaista oli sydäninfarkti, 34 prosentilla nykyinen angina pectoris ja 37 prosentilla verenpainetauti. Tässä populaatiossa ei osoitettu tilastollisesti merkitsevää kuolleisuusvaikutusta. Enalapriililla hoidetuilla potilailla oli 32 % vähemmän ensihoitoa sydämen vajaatoiminnan vuoksi ja 32 % vähemmän kokonaissydämen vajaatoiminnan sairaalahoitoja. Verrattuna lumelääkkeeseen 32 prosenttia vähemmän enalapriilia saaneilla potilailla kehittyi ilmeisen sydämen vajaatoiminnan oireita. Myös kardiovaskulaarisista syistä johtuvia sairaalahoitoja vähennettiin. Enalapriilihoitoryhmässä mistä tahansa syystä johtuvien sairaalahoitojen määrä väheni merkityksettömästi (enalapriili vs. lumelääke, vastaavasti 1166 vs. 1201 ensimmäistä sairaalahoitoa, 2649 vs. 2840 sairaalahoitoa yhteensä), vaikka tutkimuksessa ei ollutkaan aihetta etsiä tällaista vaikutus.
SOLVD-Prevention -tutkimusta ei suunniteltu määrittämään, olisiko oireettomien potilaiden, joilla on alhainen ejektiofraktio, hoito parempi sairaalahoidon estämisen kannalta kuin tiiviimpi seuranta ja enalapriilin käyttö sydämen vajaatoiminnan varhaisimpien merkkien yhteydessä. Kuitenkin SOLVD-prevention -tutkimuksen seurantaolosuhteissa (4 kuukauden välein tutkimusklinikalla; henkilökohtainen lääkäri tarpeen mukaan) 68 %:lla lumelääkettä saaneista potilaista, jotka joutuivat sairaalaan sydämen vajaatoiminnan vuoksi, ei ollut kirjattu aiempia oireita, jotka olisivat olleet ilmoitti hoidon aloittamisesta.
SOLVD-Prevention -tutkimusta ei myöskään suunniteltu osoittamaan, muuttiko enalapriili taustalla olevan sydänsairauden etenemistä.
Toisessa plasebokontrolloidussa monikeskustutkimuksessa (CONSENSUS), joka rajoittui potilaisiin, joilla oli NYHA-luokan IV kongestiivista sydämen vajaatoimintaa ja radiologisia todisteita kardiomegaliasta, enalapriilin käyttö paransi eloonjäämistä. Tulokset on esitetty seuraavassa taulukossa.
Sekä CONSENSUS- että SOLVD-Treatment-tutkimuksissa potilaat saivat yleensä myös digitalista, diureetteja tai molempia.
Kliininen farmakologia lapsipotilailla
Toistuvan annoksen farmakokineettinen tutkimus suoritettiin 40 hypertensiivisellä mies- ja naispuolisella lapsipotilaalla, jotka olivat iältään 2 kuukauden ja ≤ 16 vuoden ikäisiä, kun enalapriilimaleaattia annettiin päivittäin suun kautta 0,07 - 0,14 mg/kg. Vakaassa tilassa enalaprilaatin kumuloitumisen keskimääräinen tehokas puoliintumisaika oli 14 tuntia, ja enalapriilin ja enalaprilaatin kokonaismäärä virtsaan erittyi keskimäärin 24 tunnissa 68 % annetusta annoksesta. Enalapriilin konversio enalaprilaatiksi oli välillä 63-76 %. Tämän tutkimuksen kokonaistulokset osoittavat, että enalapriilin farmakokinetiikka 2 kuukauden–≤ 16-vuotiailla verenpainetautia sairastavilla lapsilla on yhdenmukainen kaikissa tutkituissa ikäryhmissä ja yhdenmukainen terveillä aikuisilla saatujen farmakokineettisten tietojen kanssa.
Kliinisessä tutkimuksessa, johon osallistui 110 hypertensiivistä 6–16-vuotiasta lapsipotilasta, potilaat, jotka painoivat alle 50 kg, saivat joko 0,625, 2,5 tai 20 mg enalapriilia päivässä ja potilaat, jotka painoivat ≥ 50 kg, saivat joko 1,25, 5 tai 40 mg enalapriilia. enalapriilia päivittäin. Kerran vuorokaudessa annettu enalapriili alensi alin verenpainetta annoksesta riippuvalla tavalla. Enalapriilin annoksesta riippuva verenpainetta alentava teho oli yhdenmukainen kaikissa alaryhmissä (ikä, Tanner-aste, sukupuoli, rotu). Pienimmät tutkitut annokset, 0,625 mg ja 1,25 mg, jotka vastaavat keskimäärin 0,02 mg/kg kerran vuorokaudessa, eivät kuitenkaan näyttäneet tarjoavan jatkuvaa verenpainetta alentavaa tehoa. Tässä tutkimuksessa VASOTEC 2,5 mg oli yleensä hyvin siedetty.
Yllä olevissa lapsitutkimuksissa enalapriilimaleaattia annettiin VASOTEC-tableteina, ja niille lapsille ja imeväisille, jotka eivät kyenneet nielemään tabletteja tai jotka tarvitsivat pienemmän annoksen kuin tablettimuodossa, enalapriilia annettiin suspensiomuodossa (ks. ANNOSTELU JA HALLINNOINTI , Suspension valmistelu ).
POTILASTIEDOT
Angioedeema
Angioedeemaa, mukaan lukien kurkunpään turvotus, voi esiintyä milloin tahansa hoidon aikana angiotensiinikonvertaasin estäjillä, mukaan lukien enalapriili. Potilaita tulee neuvoa ja neuvoa ilmoittamaan välittömästi kaikista angioedeemaan viittaavista merkeistä tai oireista (kasvojen, raajojen, silmien, huulten, kielen turvotus, nielemis- tai hengitysvaikeudet) ja olemaan ottamatta enempää lääkettä ennen kuin he ovat neuvotelleet lääkkeen määräävän lääkärin kanssa.
Hypotensio
Potilaita tulee varoittaa ilmoittamaan huimauksesta, erityisesti muutaman ensimmäisen hoitopäivän aikana. Jos todellista pyörtymistä ilmenee, potilaita tulee kehottaa lopettamaan lääkkeen käyttö, kunnes he ovat neuvotelleet lääkkeen määräävän lääkärin kanssa. Kaikkia potilaita tulee varoittaa siitä, että liiallinen hikoilu ja nestehukka voivat johtaa verenpaineen liialliseen laskuun nestetilavuuden vähenemisen vuoksi. Muut tilavuuden vähenemisen syyt, kuten oksentelu tai ripuli, voivat myös johtaa verenpaineen laskuun; potilaita tulee neuvoa ottamaan yhteyttä lääkäriin.
Hyperkalemia
Potilaita tulee neuvoa olemaan käyttämättä kaliumia sisältäviä suolankorvikkeita neuvottelematta lääkärinsä kanssa.
Neutropenia
Potilaita tulee kehottaa ilmoittamaan viipymättä kaikista infektion viitteistä (esim. kurkkukipu, kuume), jotka voivat olla merkki neutropeniasta.
Raskaus
Hedelmällisessä iässä oleville naispotilaille tulee kertoa VASOTEC-altistuksen seurauksista raskauden aikana. Keskustele hoitovaihtoehdoista raskautta suunnittelevien naisten kanssa. Potilaita tulee pyytää ilmoittamaan raskaudesta lääkärilleen mahdollisimman pian.
HUOMAA: Kuten monien muidenkin lääkkeiden kohdalla, tietyt neuvot enalapriilihoitoa saaville potilaille ovat perusteltuja. Nämä tiedot on tarkoitettu auttamaan tämän lääkkeen turvallisessa ja tehokkaassa käytössä. Se ei ole kaikkien mahdollisten haitallisten tai suunniteltujen vaikutusten paljastaminen.
