Avapro 150mg, 300mg Irbesartan Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Avapro 300mg on ja miten sitä käytetään?
Avapro 300mg on reseptilääke, jota käytetään korkean verenpaineen (hypertension), tyypin 2 diabeteksen aiheuttaman hermokivun, oireiden hoitoon. Avaproa voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Avapro 300mg kuuluu ARB-lääkkeiden luokkaan.
Ei tiedetä, onko Avapro 150 mg turvallinen ja tehokas alle 6-vuotiaille lapsille.
Mitkä ovat Avapro 300mg:n mahdolliset sivuvaikutukset?
Avapro voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- selittämätön lihaskipu,
- arkuus tai heikkous,
- kuume,
- epätavallinen väsymys,
- tumma virtsa,
- huimaus,
- vähän tai ei ollenkaan virtsaamista,
- turvotus,
- nopea painonnousu,
- hämmennystä,
- ruokahalun menetys,
- oksentelua ja
- kipu kyljessäsi tai alaselässäsi
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Avapron yleisimpiä sivuvaikutuksia ovat:
- ripuli,
- närästys,
- vatsavaivat ja
- väsynyt tunne
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Avapron mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
SIKIÖN MYRKYLLISYYS
- Kun raskaus havaitaan, lopeta AVAPRO-hoito mahdollisimman pian.
- Lääkkeet, jotka vaikuttavat suoraan reniini-angioteeneihin järjestelmässä, voivat aiheuttaa vamman ja kuoleman kehittyvälle sikiölle [katso VAROITUKSET JA VAROTOIMET].
KUVAUS
AVAPRO (irbesartaani) on angiotensiini II -reseptorin (AT1-alatyyppi) antagonisti.
Irbesartaani on ei-peptidiyhdiste, kemiallisesti kuvattu 2-butyyli-3-[p-(o-1H-tetratsol-5-yylifenyyli)bentsyyli]-1,3-diatsaspiro[4.4]non-1-en-4 -yksi.
Sen empiirinen kaava on C25H28N6O ja rakennekaava:
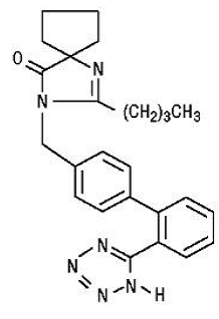
Irbesartaani on valkoinen tai luonnonvalkoinen kiteinen jauhe, jonka molekyylipaino on 428,5. Se on ei-polaarinen yhdiste, jonka jakaantumiskerroin (oktanoli/vesi) on 10,1 pH:ssa 7,4. Irbesartaani liukenee heikosti alkoholiin ja metyleenikloridiin ja on käytännössä liukenematon veteen.
AVAPRO on saatavana suun kautta annettavissa jakouurteisissa tableteissa, jotka sisältävät 75 mg, 150 mg tai 300 mg irbesartaania. Inaktiivisia aineita ovat: laktoosi, mikrokiteinen selluloosa, esigelatinoitu tärkkelys, kroskarmelloosinatrium, poloksameeri 188, piidioksidi ja magnesiumstearaatti.
INDIKAATIOT
Hypertensio
AVAPRO® on tarkoitettu verenpainetaudin hoitoon, verenpaineen alentamiseen. Verenpaineen alentaminen pienentää kuolemaan johtavien ja ei-kuolemaan johtavien sydän- ja verisuonitapahtumien, pääasiassa aivohalvausten ja sydäninfarktin, riskiä. Nämä edut on havaittu kontrolloiduissa tutkimuksissa verenpainetta alentavilla lääkkeillä useista eri farmakologisista luokista, mukaan lukien tämä lääke.
Korkean verenpaineen hallinnan tulee olla osa kattavaa sydän- ja verisuoniriskin hallintaa, mukaan lukien tarvittaessa lipidien hallinta, diabeteksen hallinta, antitromboottinen hoito, tupakoinnin lopettaminen, liikunta ja rajoitettu natriumin saanti. Monet potilaat tarvitsevat enemmän kuin yhden lääkkeen verenpainetavoitteiden saavuttamiseksi. Tarkempia tavoitteita ja hallintaa koskevia neuvoja on julkaistuissa ohjeissa, kuten National High Blood Pressure Education Programin kansallisen korkean verenpaineen ehkäisy-, havaitsemis-, arviointi- ja hoitokomitean (JNC) ohjeissa.
Lukuisten verenpainetta alentavien lääkkeiden, eri farmakologisista luokista ja eri vaikutusmekanismeista, on osoitettu satunnaistetuissa kontrolloiduissa tutkimuksissa vähentävän sydän- ja verisuonisairauksien sairastuvuutta ja kuolleisuutta, ja voidaan päätellä, että se on verenpainetta alentavaa, eikä muuta lääkettä. lääkkeet, jotka ovat suurelta osin vastuussa näistä eduista. Suurin ja johdonmukaisin kardiovaskulaarinen tulos on ollut aivohalvauksen riskin väheneminen, mutta myös sydäninfarktin ja sydän- ja verisuoniperäisen kuolleisuuden on havaittu vähenevän säännöllisesti.
Kohonnut systolinen tai diastolinen paine lisää kardiovaskulaarista riskiä, ja absoluuttinen riskin nousu mmHg:tä kohti on suurempi korkeammilla verenpaineilla, joten jopa vaatimattomasta vaikean verenpaineen alenemisesta voi olla huomattavaa hyötyä. Suhteellinen riskin pieneneminen verenpaineen laskusta on samanlainen kaikissa populaatioissa, joissa absoluuttinen riski vaihtelee, joten absoluuttinen hyöty on suurempi potilailla, joilla on suurempi riski verenpaineesta riippumatta (esimerkiksi potilaat, joilla on diabetes tai hyperlipidemia), ja tällaisia potilaita odotetaan olevan hyötyä aggressiivisemmasta hoidosta alhaisemman verenpainetavoitteen saavuttamiseksi.
Joillakin verenpainelääkkeillä on pienemmät verenpainevaikutukset (monoterapiana) mustaihoisilla potilailla, ja monilla verenpainelääkkeillä on muita hyväksyttyjä käyttöaiheita ja vaikutuksia (esim. angina pectoris, sydämen vajaatoiminta tai diabeettinen munuaissairaus). Nämä näkökohdat voivat ohjata hoidon valintaa.
AVAPRO 300 mg voidaan käyttää yksinään tai yhdessä muiden verenpainetta alentavien aineiden kanssa.
Nefropatia tyypin 2 diabeetikoilla
AVAPRO on tarkoitettu diabeettisen nefropatian hoitoon potilailla, joilla on tyypin 2 diabetes ja verenpainetauti, kohonnut seerumin kreatiniini ja proteinuria (> 300 mg/vrk). Tässä populaatiossa AVAPRO vähentää nefropatian etenemisnopeutta mitattuna seerumin kreatiniinin kaksinkertaistumisesta tai loppuvaiheen munuaissairaudesta (dialyysin tai munuaisensiirron tarve) [ks. Kliiniset tutkimukset ].
ANNOSTELU JA HALLINNOINTI
Yleisiä huomioita
AVAPRO voidaan antaa muiden verenpainetta alentavien aineiden kanssa ja ruoan kanssa tai ilman.
Hypertensio
AVAPRO 300 mg:n suositeltu aloitusannos on 150 mg kerran vuorokaudessa. Annosta voidaan nostaa enimmäisannokseen 300 mg kerran vuorokaudessa tarpeen mukaan verenpaineen hallitsemiseksi [katso Kliiniset tutkimukset ].
Nefropatia tyypin 2 diabeetikoilla
Suositeltu annos on 300 mg kerran päivässä [katso Kliiniset tutkimukset ].
Annoksen säätäminen tilavuuden ja suolan puutteesta kärsivillä potilailla
Suositeltu aloitusannos on 75 mg kerran vuorokaudessa potilailla, joilla on vähentynyt suonensisäinen tilavuus tai suola (esim. potilaat, joita hoidetaan voimakkaasti diureeteilla tai hemodialyysihoidossa) [ks. VAROITUKSET JA VAROTOIMET ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
AVAPRO 75 mg on valkoinen tai luonnonvalkoinen, kaksoiskupera soikea, kalvopäällysteinen tabletti, jonka toiselle puolelle on kaiverrettu sydän ja toisella puolella "2871".
AVAPRO 150 mg on valkoinen tai luonnonvalkoinen, kaksoiskupera soikea, kalvopäällysteinen tabletti, jonka toiselle puolelle on kaiverrettu sydän ja toisella puolella "2872".
AVAPRO 300 mg on valkoinen tai luonnonvalkoinen, kaksoiskupera soikea, kalvopäällysteinen tabletti, jonka toiselle puolelle on kaiverrettu sydän ja toisella puolella "2873".
Varastointi ja käsittely
AVAPRO (irbesartaani) on saatavana valkoisina tai luonnonvalkoisina, kaksoiskuperina soikeina kalvopäällysteisinä tabletteina, joiden toisella puolella on sydämen muotoinen kaiverrus ja toisella koodi (ks. taulukko alla). Käyttöyksikköpullot sisältävät 30 tai 90 kalvopäällysteistä tablettia seuraavasti:
Säilytä 25°C (77°F); retket sallitaan 15°C–30°C (59°F–86°F) [katso USP-ohjattu huonelämpötila ].
sanofi-aventis US LLC, Bridgewater, NJ 08807, SANOFI-YHTIÖ. Tarkistettu: syyskuussa 2021
SIVUVAIKUTUKSET
Seuraavat tärkeät haittavaikutukset on kuvattu muualla merkinnöissä:
- Hypotensio tilavuus- tai suolavajauspotilailla [katso VAROITUKSET JA VAROTOIMET ]
- Munuaisten vajaatoiminta [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia. Kliinisistä tutkimuksista saadut haittavaikutustiedot tarjoavat kuitenkin perustan niiden haittatapahtumien tunnistamiselle, jotka näyttävät liittyvän huumeiden käyttöön, ja arvioida niiden esiintymistiheyttä.
Hypertensio
AVAPRO:n turvallisuutta on arvioitu yli 4 300 verenpainepotilaalla ja yhteensä noin 5 000 henkilöllä. Tämä kokemus sisältää 1 303 potilasta, joita hoidettiin yli 6 kuukautta, ja 407 potilasta yhden vuoden tai kauemmin.
Lumekontrolloiduissa kliinisissä tutkimuksissa seuraavia haittavaikutuksia raportoitiin vähintään 1 %:lla AVAPRO:lla hoidetuista potilaista (n = 1965) ja suurempi ilmaantuvuus verrattuna lumelääkkeeseen (n = 641), lukuun ottamatta niitä, jotka olivat liian yleisiä ollakseen informatiivisia, ja eivät kohtuudella liity lääkkeen käyttöön, koska ne liittyivät hoidettavaan sairauteen tai ovat hyvin yleisiä hoidetussa väestössä, mukaan lukien: ripuli (3 % vs 2 %), dyspepsia/närästys (2 % vs 1 %) ja väsymys (4 % vs 3 %).
Irbesartaanin käyttöön ei liittynyt lisääntynyttä kuivan yskän ilmaantuvuutta, kuten ACE-estäjien käyttöön tyypillisesti liittyy. Lumekontrolloiduissa tutkimuksissa yskän ilmaantuvuus irbesartaanilla hoidetuilla potilailla oli 2,8 % ja lumelääkettä saaneiden potilaiden 2,7 %.
Nefropatia tyypin 2 diabeetikoilla
Hyperkalemia
Irbesartan Diabetic Nephropathy Trial (IDNT) -tutkimuksessa (proteinuria ≥ 900 mg/vrk ja seerumin kreatiniini 1,0-3,0 mg/dl) potilaiden prosenttiosuus, joiden kalium oli > 6 mekv/l, oli 18,6 % AVAPRO 300 mg:n ryhmässä. 6,0 % lumeryhmässä. Hyperkalemiasta johtuvia keskeytyksiä AVAPRO 150 mg -ryhmässä oli 2,1 % ja lumelääkeryhmässä 0,4 %.
IDNT-tutkimuksessa haittavaikutukset olivat samanlaisia kuin verenpainepotilailla, lukuun ottamatta ortostaattisten oireiden lisääntymistä, joita esiintyi useammin AVAPRO 150 mg:n ryhmässä plaseboryhmään verrattuna: huimaus (10,2 % vs 6,0 %), ortostaattinen huimaus (5,4) % vs 2,7 %) ja ortostaattinen hypotensio (5,4 % vs 3,2 %).
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu AVAPRO:n hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoiselta populaatiolta, ei aina ole mahdollista arvioida luotettavasti niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Urtikaria; angioödeema (johon liittyy kasvojen, huulten, nielun ja/tai kielen turvotus); anafylaktinen reaktio, mukaan lukien anafylaktinen sokki; kohonneet maksan toimintakokeet; keltaisuus; hepatiitti; hyperkalemia; anemia; trombosytopenia; lisääntynyt CPK; tinnitus; ja hypoglykemia diabeetikoilla.
HUUMEIDEN VUOROVAIKUTUKSET
Seerumin kaliumia lisäävät aineet
AVAPRO:n samanaikainen käyttö muiden seerumin kaliumpitoisuutta nostavien lääkkeiden kanssa voi johtaa hyperkalemiaan, joskus vakavaan. Seuraa seerumin kaliumarvoa tällaisilla potilailla.
Litium
Irbesartaanin ja litiumin samanaikaisen käytön yhteydessä on raportoitu seerumin litiumpitoisuuksien nousua ja litiumtoksisuutta. Seuraa litiumpitoisuutta potilailla, jotka saavat irbesartaania ja litiumia.
Ei-steroidiset tulehduskipulääkkeet (NSAID:t), mukaan lukien selektiiviset syklo-oksigenaasi-2:n estäjät (COX-2-estäjät)
Iäkkäillä, nestevajautuneilla (myös diureettihoitoa saavilla) tai munuaisten vajaatoimintaa sairastavilla potilailla tulehduskipulääkkeiden, mukaan lukien selektiivisten COX-2:n estäjien, samanaikainen käyttö angiotensiini II -reseptorin salpaajien (mukaan lukien irbesartaani) kanssa voi johtaa munuaisten toiminnan heikkenemiseen. mukaan lukien mahdollinen akuutti munuaisten vajaatoiminta. Nämä vaikutukset ovat yleensä palautuvia. Irbesartaani- ja NSAID-hoitoa saavien potilaiden munuaisten toimintaa on seurattava säännöllisesti.
Tulehduskipulääkkeet, mukaan lukien selektiiviset COX-2-estäjät, voivat heikentää angiotensiini II -reseptorin antagonistien, mukaan lukien irbesartaanin, verenpainetta alentavaa vaikutusta.
Reniini-angiotensiinijärjestelmän (RAS) kaksoisesto
RAS:n kaksoissalpaus angiotensiinireseptorin salpaajilla, ACE:n estäjillä tai aliskireenilla liittyy lisääntyneeseen hypotension, hyperkalemian ja munuaisten toiminnan muutosten riskiin (mukaan lukien akuutti munuaisten vajaatoiminta) verrattuna monoterapiaan. Useimmat potilaat, jotka saavat kahden RAS-estäjän yhdistelmää, eivät saa mitään lisähyötyä monoterapiaan verrattuna. Vältä yleensä RAS-estäjien yhteiskäyttöä. Seuraa tarkasti verenpainetta, munuaisten toimintaa ja elektrolyyttejä potilailla, jotka saavat AVAPRO 150 mg:aa ja muita RAS:aan vaikuttavia aineita.
Älä anna aliskireenia samanaikaisesti AVAPRO:n kanssa diabeetikoilla. Vältä aliskireenin käyttöä AVAPRO:n kanssa potilailla, joilla on munuaisten vajaatoiminta (GFR
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Sikiön toksisuus
AVAPRO 150mg voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. Reninangiotensiinijärjestelmään vaikuttavien lääkkeiden käyttö raskauden toisen ja kolmannen kolmanneksen aikana heikentää sikiön munuaisten toimintaa ja lisää sikiön ja vastasyntyneen sairastuvuutta ja kuolemaa. Tuloksena olevat oligohydramnionit voivat liittyä sikiön keuhkojen hypoplasiaan ja luuston epämuodostumiin. Mahdollisia vastasyntyneiden haittavaikutuksia ovat kallon hypoplasia, anuria, hypotensio, munuaisten vajaatoiminta ja kuolema. Kun raskaus havaitaan, lopeta AVAPRO mahdollisimman pian [katso Käyttö tietyissä populaatioissa ].
Hypotensio volyymi- tai suolavajauspotilailla
Potilailla, joilla on aktivoitunut reniini-angiotensiinijärjestelmä, kuten neste- tai suolavaje (esim. potilailla, joita hoidetaan suurilla diureetiannoksilla), AVAPRO-hoidon aloittamisen jälkeen saattaa ilmetä oireenmukaista hypotensiota. Korjaa tilavuus- tai suolavaje ennen AVAPRO 300 mg:n antamista tai käytä pienempää aloitusannosta [ks. ANNOSTELU JA HALLINNOINTI ].
Munuaisten vajaatoiminta
Muutoksia munuaisten toiminnassa, mukaan lukien akuutti munuaisten vajaatoiminta, voivat aiheuttaa lääkkeet, jotka estävät reniini-angiotensiinijärjestelmää. Potilailla, joiden munuaisten toiminta saattaa riippua osittain reniini-angiotensiinijärjestelmän aktiivisuudesta (esim. potilaat, joilla on munuaisvaltimon ahtauma, krooninen munuaissairaus, vaikea sydämen vajaatoiminta tai tilavuusvaje), voi olla erityinen riski akuutin munuaisten vajaatoiminnan tai kuoleman kehittymiselle. AVAPRO:ssa. Seuraa näiden potilaiden munuaisten toimintaa säännöllisesti. Harkitse hoidon keskeyttämistä tai lopettamista potilailla, joille kehittyy kliinisesti merkittävä munuaisten toiminnan heikkeneminen AVAPRO:lla [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeenisuudesta ei havaittu näyttöä, kun irbesartaania annettiin annoksina 500/1000 mg/kg/vrk (urokset/naaraat) rotille ja 1000 mg/kg/vrk hiirille enintään 2 vuoden ajan. Uros- ja naarasrotilla 500 mg/kg/vrk sai aikaan keskimääräisen systeemisen altistuksen irbesartaanille (AUC 0–24 tuntia, sitoutunut plus sitoutumaton) noin 3 ja 11-kertainen keskimääräiseen systeemiseen altistukseen ihmisillä, jotka saivat ihmisille suositeltua enimmäismäärää. Annos (MRHD) oli 300 mg irbesartaania/vrk, kun taas 1000 mg/kg/vrk (annettiin vain naisille) sai aikaan keskimääräisen systeemisen altistuksen, joka oli noin 21 kertaa suurempi kuin ihmisillä raportoitu MRHD:ssä. Uros- ja naarashiirillä 1 000 mg/kg/vrk altistui irbesartaanille noin 3-kertaiseksi ja 5-kertainen ihmisen altistukseen verrattuna annoksella 300 mg/vrk.
Irbesartaani ei ollut mutageeninen useissa in vitro -testeissä (Amesin mikrobitesti, rotan maksasolujen DNA:n korjaustesti, V79-nisäkässolujen eteenpäin suuntautuva geenimutaatiomääritys). Irbesartaani oli negatiivinen useissa kromosomipoikkeavuuksien induktiotesteissä (in vitro -ihmisen lymfosyyttimääritys; in vivo -hiiren mikrotumatutkimus).
Irbesartaanilla ei ollut haitallisia vaikutuksia uros- tai naarasrottien hedelmällisyyteen tai pariutumiseen oraalisilla annoksilla ≤ 650 mg/kg/vrk. Suurin annos sai aikaan systeemisen irbesartaanialtistuksen (AUC 0–24 tuntia, sitoutunut plus sitoutumaton) noin 5 kertaa enemmän kuin ihmisillä, jotka saavat MRHD:tä 300 mg/vrk.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
AVAPRO voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. Reninangiotensiinijärjestelmään vaikuttavien lääkkeiden käyttö raskauden toisen ja kolmannen kolmanneksen aikana vähentää sikiön munuaisten toimintaa ja lisää sikiön ja vastasyntyneen sairastuvuutta ja kuolemaa [ks. Kliiniset näkökohdat ]. Useimmat epidemiologiset tutkimukset, joissa tutkittiin sikiön poikkeavuuksia verenpainetta alentaville lääkkeille ensimmäisen raskauskolmanneksen aikana, eivät ole erottaneet reniini-angiotensiinijärjestelmään vaikuttavia lääkkeitä muista verenpainetta alentavista aineista. Kun raskaus havaitaan, lopeta AVAPRO 150 mg:n käyttö mahdollisimman pian.
Kaikilla raskauksilla on taustariski synnynnäisten epämuodostumien, menetyksen tai muiden haittavaikutusten kehittymiseen lääkealtistuksesta riippumatta. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia.
Kliiniset näkökohdat
Äidin ja/tai alkio-sikiön sairauteen liittyvä riski
Raskaudenaikainen hypertensio lisää äidin riskiä preeklampsialle, raskausdiabetekselle, ennenaikaisille synnytyksille ja synnytyskomplikaatioille (esim. keisarileikkauksen tarve ja synnytyksen jälkeinen verenvuoto). Hypertensio lisää sikiön riskiä kohdunsisäiseen kasvun rajoittumiseen ja kohdunsisäiseen kuolemaan. Verenpainetautia sairastavia raskaana olevia naisia tulee seurata huolellisesti ja hoitaa sen mukaisesti.
Sikiön/vastasyntyneen haittavaikutukset

Oligohydramnionit raskaana olevilla naisilla, jotka käyttävät reniini-angiotensiinijärjestelmään vaikuttavia lääkkeitä raskauden toisen ja kolmannen kolmanneksen aikana, voivat aiheuttaa seuraavia seurauksia: sikiön munuaisten toiminnan heikkeneminen, mikä johtaa anuriaan ja munuaisten vajaatoimintaan, sikiön keuhkojen hypoplasia, luuston epämuodostumat, mukaan lukien kallon hypoplasia, hypotensio , ja kuolema.
Siinä epätavallisessa tapauksessa, että reniini-angiotensiinijärjestelmään vaikuttavilla lääkkeillä ei ole sopivaa vaihtoehtoa tietylle potilaalle, kerro äidille mahdollisesta riskistä sikiölle.
Suorita sarja ultraäänitutkimuksia lapsivesiympäristön arvioimiseksi. Sikiötestaus voi olla asianmukaista raskausviikon perusteella. Potilaiden ja lääkäreiden tulee kuitenkin olla tietoisia siitä, että oligohydramnionit saattavat ilmaantua vasta sen jälkeen, kun sikiö on saanut peruuttamattoman vaurion. Jos havaitaan oligohydramnionia, harkitse vaihtoehtoista hoitoa. Tarkkaile tarkasti vauvoja, jotka ovat altistuneet kohdussa AVAPRO:lle hypotension, oligurian ja hyperkalemian ja muiden munuaisten vajaatoiminnan oireiden varalta. Jos vastasyntynyt on altistunut kohdussa AVAPRO 300 mg:lle, jos ilmenee oliguriaa tai hypotensiota, kiinnitä huomiota verenpaineen ja munuaisten perfuusion tukemiseen. Vaihtosiirto tai dialyysi saattaa olla tarpeen hypotension kumoamiseksi ja/tai munuaisten häiriön korvaamiseksi.
Data
Eläinten tiedot
Irbesartaani läpäisee istukan rotilla ja kaniineilla. Naarasrotilla, joille annettiin irbesartaania ennen parittelua tiineyden ja imetyksen aikana suun kautta 50, 180 tai 650 mg/kg/vrk (1,6-21,1 kertaa suurin suositeltu ihmisannos (MRHD) kehon pinta-alan perusteella), sikiöt tutkittiin Raskauspäivä 20 osoitti lisääntynyttä virtsanjohtimen ja munuaisen lantion kavitaation ja/tai munuaisten papillan puuttumisen ilmaantuvuutta kaikissa irbesartaanilla hoidetuissa ryhmissä. Ihonalaista turvotusta esiintyi myös sikiöillä äidin annoksilla ≥ 180 mg/kg/vrk (5,8 kertaa MRHD). Näitä poikkeavuuksia esiintyi, kun naarasrotat saivat irbesartaania ennen parittelua tiineyspäivään 20, mutta niitä ei havaittu pennuilla postnataalisesti samassa tutkimuksessa, tai kun irbesartaania annettiin tiineille rotille vain organogeneesin aikana (raskauspäivä 6 - tiineyspäivä 15) klo. suun kautta 50-450 mg/kg/vrk (jopa 14,6 kertaa MRHD). Lisäksi ei havaittu haitallisia vaikutuksia munuaisten kehitykseen emojen pentuilla, joille annettiin irbesartaania tiineyspäivästä 15. imetyspäivään 24 asti annoksilla 50, 180 tai 650 mg/kg/vrk (jopa 21,1 kertaa MRHD). Havaittujen vaikutusten uskotaan olevan lääkkeen myöhäisiä raskausvaikutuksia. Tiineillä kaniineilla, joille annettiin irbesartaania suun kautta 30 mg/kg/vrk (1,9 kertaa MRHD kehon pinta-alan perusteella), emojen kuolleisuus ja abortti oli korkea. Selviytyneillä naarailla oli hieman lisääntynyt varhainen resorptio ja vastaavasti elävien sikiöiden määrä.
Radioaktiivisuutta esiintyi rotan ja kanin sikiöissä myöhään tiineyden aikana radioaktiivisesti leimatun irbesartaanin oraalisten annosten jälkeen.
Imetys
Irbesartaanin erittymisestä äidinmaitoon, vaikutuksista maidontuotantoon tai imetettävään lapseen ei ole saatavilla tietoja. Irbesartaani tai jokin irbesartaanin metaboliitti erittyy imettävien rottien maitoon [ks. KLIININEN FARMAKOLOGIA ]. AVAPRO 150 mg:n käyttöä imettäville naisille ei suositella, koska sillä voi olla haitallisia vaikutuksia imetettävään lapseen.
Käyttö lapsille
Irbesartaani ei näyttänyt alentavan verenpainetta tehokkaasti 6–16-vuotiailla lapsipotilailla tutkimuksessa annoksella 4,5 mg/kg/vrk kerran vuorokaudessa.
AVAPRO:ta ei ole tutkittu alle 6-vuotiailla lapsipotilailla.
Geriatrinen käyttö
925 koehenkilöstä, jotka saivat AVAPRO:ta kontrolloiduissa kliinisissä verenpainetutkimuksissa, 911 (18,5 %) oli vähintään 65-vuotiaita ja 150 (3,0 %) 75 vuotta täyttäneitä. Yleisiä eroja tehokkuudessa tai turvallisuudessa ei havaittu näiden ja nuorempien koehenkilöiden välillä, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois. [Katso KLIININEN FARMAKOLOGIA ja Kliiniset tutkimukset ]
YLIANNOSTUS
Tietoja ei ole saatavilla yliannostuksesta ihmisillä. Kuitenkin 900 mg:n päivittäiset annokset 8 viikon ajan olivat hyvin siedettyjä. Yliannostuksen todennäköisimpiä oireita ovat hypotensio ja takykardia; bradykardia voi myös ilmetä yliannostuksesta. Irbesartaani ei poistu hemodialyysillä.
Irbesartaanilla tehdyt akuutin oraalisen toksisuuden tutkimukset hiirillä ja rotilla osoittivat, että akuutit tappavat annokset olivat yli 2000 mg/kg eli noin 25-kertaiset ja 50-kertaiset MRHD:ään (300 mg) kehon pinta-alan perusteella laskettuna.
VASTA-AIHEET
AVAPRO 150mg on vasta-aiheinen potilaille, jotka ovat yliherkkiä jollekin tämän tuotteen aineosalle.
Älä anna aliskireenia samanaikaisesti AVAPRO 300 mg:n kanssa diabeetikoille.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Angiotensiini II on voimakas vasokonstriktori, joka muodostuu angiotensiini I:stä angiotensiiniä konvertoivan entsyymin (ACE, kininaasi II) katalysoimassa reaktiossa. Angiotensiini II on reninangiotensiinijärjestelmän ensisijainen vasoaktiivinen hormoni ja tärkeä komponentti verenpainetaudin patofysiologiassa. Se myös stimuloi aldosteronin eritystä lisämunuaiskuoressa. Irbesartaani estää angiotensiini II:n verisuonia supistavia ja aldosteronia erittävät vaikutukset sitoutumalla selektiivisesti monissa kudoksissa (esim. verisuonten sileässä lihaksessa, lisämunuaisessa) esiintyviin AT1 angiotensiini II -reseptoriin. Monissa kudoksissa on myös AT2-reseptori, mutta se ei osallistu kardiovaskulaariseen homeostaasiin.
Irbesartaani on spesifinen kilpaileva AT1-reseptorien antagonisti, jolla on paljon suurempi affiniteetti (yli 8500-kertainen) AT1-reseptoriin kuin AT2-reseptoriin eikä agonistiaktiivisuutta.
AT1-reseptorin salpaus poistaa angiotensiini II:n negatiivisen palautteen reniinin erittymiseen, mutta sen seurauksena lisääntynyt plasman reniiniaktiivisuus ja verenkierrossa oleva angiotensiini II eivät voita irbesartaanin vaikutuksia verenpaineeseen.
Irbesartaani ei estä ACE:tä tai reniiniä tai vaikuta muihin hormonireseptoreihin tai ionikanaviin, joiden tiedetään osallistuvan verenpaineen ja natriumin homeostaasin kardiovaskulaariseen säätelyyn.
Farmakodynamiikka
Terveillä koehenkilöillä jopa 300 mg:n irbesartaanin kerta-annos esti annoksesta riippuvaisen angiotensiini II -infuusioiden painetta alentavan vaikutuksen. Esto oli täydellinen (100 %) 4 tuntia oraalisten 150 mg:n tai 300 mg:n annosten jälkeen, ja osittainen esto jatkui 24 tuntia (60 % ja 40 % annoksella 300 mg ja 150 mg, vastaavasti).
Hypertensiivisillä potilailla angiotensiini II -reseptorin esto irbesartaanin pitkäaikaisen annon jälkeen aiheuttaa 1,5-2-kertaisen plasman angiotensiini II -pitoisuuden ja 2-3-kertaisen nousun plasman reniinipitoisuuksissa. Plasman aldosteronipitoisuudet pienenevät yleensä irbesartaanin annon jälkeen, mutta seerumin kaliumpitoisuudet eivät vaikuta merkitsevästi suositusannoksilla.
Hypertensiivisillä potilailla pitkäaikaisilla oraalisilla irbesartaaniannoksilla (300 mg:aan asti) ei ollut vaikutusta glomerulusten suodatusnopeuteen, munuaisten plasman virtaukseen tai suodatusfraktioon. Hypertensiivisillä potilailla tehdyissä useiden annosten tutkimuksissa ei havaittu kliinisesti merkittäviä vaikutuksia paastotriglyseridien, kokonaiskolesterolin tai HDL-kolesterolipitoisuuksiin. Kroonisen oraalisen annon aikana ei ollut vaikutusta seerumin virtsahappoon, eikä urikosurista vaikutusta.
Farmakokinetiikka
Imeytyminen
Irbesartaanin oraalinen imeytyminen on nopeaa ja täydellistä, ja sen keskimääräinen absoluuttinen hyötyosuus on 60–80 %. AVAPRO:n oraalisen annon jälkeen irbesartaanin huippupitoisuudet plasmassa saavutetaan 1,5–2 tunnin kuluttua annostelusta. Ruoka ei vaikuta irbesartaanin biologiseen hyötyosuuteen.
Irbesartaanin farmakokinetiikka on lineaarinen terapeuttisella annosalueella.
Jakelu
Irbesartaani sitoutuu 90-prosenttisesti seerumin proteiineihin (pääasiassa albumiiniin ja happamaan α-glykoproteiiniin), mutta vain merkityksettömästi veren solukomponentteihin. Keskimääräinen jakautumistilavuus on 53-93 litraa.
Eläintutkimukset osoittavat, että radioaktiivisesti merkitty irbesartaani läpäisee heikosti veri-aivoesteen ja istukan. Irbesartaani erittyy imettävien rottien maitoon.
Eliminointi
Plasman kokonaispuhdistuma on 157-176 ml/min ja munuaispuhdistuma 3,0-3,5 ml/min. Irbesartaanin terminaalinen eliminaation puoliintumisaika on keskimäärin 11-15 tuntia. Vakaan tilan pitoisuudet saavutetaan 3 päivässä. Irbesartaanin rajoitettua kertymistä plasmaan (
Aineenvaihdunta
Irbesartaani on oraalisesti vaikuttava aine, joka ei vaadi biotransformaatiota aktiiviseen muotoon. Irbesartaani metaboloituu glukuronidikonjugaation ja hapettumisen kautta. Kun leimattua irbesartaania on annettu suun kautta tai suonensisäisesti, yli 80 % verenkierrossa olevasta plasman radioaktiivisuudesta johtuu muuttumattomasta irbesartaanista. Pääasiallinen kiertävä metaboliitti on inaktiivinen irbesartaaniglukuronidikonjugaatti (noin 6 %). Loput oksidatiiviset metaboliitit eivät lisää merkittävästi irbesartaanin farmakologista aktiivisuutta.
In vitro -tutkimukset osoittavat, että irbesartaani hapettuu ensisijaisesti CYP2C9:n vaikutuksesta; CYP3A4-metabolia on mitätön.
Erittyminen
Irbesartaani ja sen metaboliitit erittyvät sekä sapen että munuaisten kautta. 14C-leimatun irbesartaanin oraalisen tai suonensisäisen annon jälkeen noin 20 % radioaktiivisuudesta erittyy virtsaan ja loput ulosteisiin irbesartaanina tai irbesartaaniglukuronidina.
Tietyt populaatiot
Seksiä
Terveillä vanhuksilla (65–80-vuotiaat) tai terveillä nuorilla (18–40-vuotiaat) ei ole havaittu sukupuoleen liittyviä farmakokinetiikassa. Hypertensiivisillä potilailla tehdyissä tutkimuksissa puoliintumisajassa tai kumulaatiossa ei havaittu sukupuolieroja, mutta irbesartaanin plasmapitoisuudet havaittiin jonkin verran korkeammiksi naisilla (11–44 %). Sukupuoleen liittyvää annostusta ei tarvitse muuttaa.
Geriatria
Iäkkäillä (65–80-vuotiaat) irbesartaanin eliminaation puoliintumisaika ei muutu merkittävästi, mutta AUC- ja Cmax-arvot ovat noin 20–50 % suuremmat kuin nuorilla (18–40-vuotiaat). Annosta ei tarvitse muuttaa vanhuksilla.
Rotu/etnisyys
Terveillä mustilla koehenkilöillä irbesartaanin AUC-arvot ovat noin 25 % suuremmat kuin valkoisilla. Cmax-arvoissa ei ole eroa.
Munuaisten vajaatoiminta
Irbesartaanin farmakokinetiikka ei muutu munuaisten vajaatoimintaa sairastavilla tai hemodialyysipotilailla. Irbesartaani ei poistu hemodialyysillä. Annoksen muuttaminen ei ole tarpeen potilailla, joilla on lievä tai vaikea munuaisten vajaatoiminta, ellei munuaisten vajaatoimintaa sairastavalla potilaalla ole myös tilavuusvaje [ks. VAROITUKSET JA VAROTOIMET ja ANNOSTELU JA HALLINNOINTI ].
Maksan vajaatoiminta
Irbesartaanin farmakokinetiikka toistuvan oraalisen annon jälkeen ei vaikuta merkittävästi potilailla, joilla on lievä tai keskivaikea maksakirroosi. Annosta ei tarvitse muuttaa potilailla, joilla on maksan vajaatoiminta.
Huumeiden väliset vuorovaikutukset
In vitro -tutkimukset osoittavat, että tunnetut sytokromi CYP2C9-substraatit/estäjät sulfenatsoli, tolbutamidi ja nifedipiini estävät merkittävästi hapettuneiden irbesartaanin metaboliittien muodostumista. Kliinisissä tutkimuksissa samanaikaisen irbesartaanin vaikutukset varfariinin farmakodynamiikkaan olivat kuitenkin mitättömät. In vitro -tietojen perusteella ei ole odotettavissa yhteisvaikutuksia sellaisten lääkkeiden kanssa, joiden metabolia on riippuvainen sytokromi P450:n isoentsyymeistä 1A1, 1A2, 2A6, 2B6, 2D6, 2E1 tai 3A4.
Erillisissä tutkimuksissa potilailla, jotka saivat ylläpitoannoksia varfariinia, hydroklooritiatsidia tai digoksiinia, irbesartaanin antaminen 7 päivän ajan ei vaikuttanut varfariinin farmakodynamiikkaan (protrombiiniaikaan) tai digoksiinin farmakokinetiikkaan. Nifedipiinin tai hydroklooritiatsidin samanaikainen käyttö ei vaikuta irbesartaanin farmakokinetiikkaan.
Kliiniset tutkimukset
Hypertensio
AVAPRO:n verenpainetta alentavia vaikutuksia tutkittiin seitsemässä lumekontrolloidussa 8–12 viikkoa kestäneessä tutkimuksessa potilailla, joiden diastolinen verenpaine oli lähtötilanteessa 95–110 mmHg. Näihin tutkimuksiin sisällytettiin 1–900 mg:n annoksia irbesartaanin annosalueen täydelliseksi tutkimiseksi. Nämä tutkimukset mahdollistivat kerran tai kahdesti vuorokaudessa annettujen annosten vertailun annoksella 150 mg/vrk, huippu- ja alin vaikutusten vertailut sekä vasteiden vertailut sukupuolen, iän ja rodun mukaan. Kahdessa seitsemästä yllä mainitusta lumekontrolloidusta tutkimuksesta tutki irbesartaanin ja hydroklooritiatsidin yhdistelmän verenpainetta alentavia vaikutuksia.
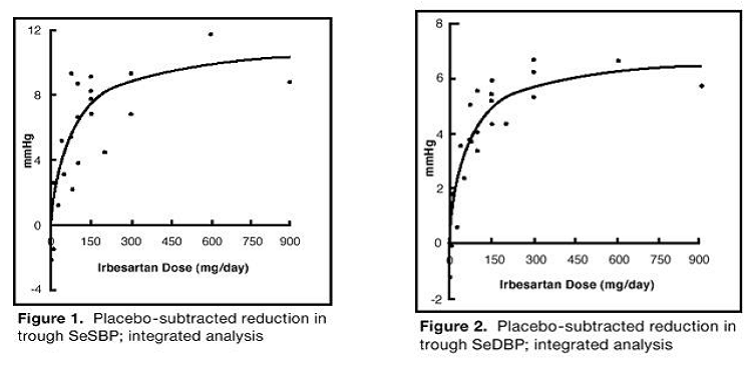
Seitsemään irbesartaanimonoterapiatutkimukseen sisältyi yhteensä 1 915 potilasta, jotka satunnaistettiin saamaan irbesartaania (1–900 mg) ja 611 potilasta, jotka satunnaistettiin saamaan lumelääkettä. Kerran vuorokaudessa annetut 150 mg:n ja 300 mg:n annokset laskivat tilastollisesti ja kliinisesti merkitsevää systolista ja diastolista verenpainetta sekä alimmillaan (24 tuntia annoksen ottamisesta) 6–12 viikon hoidon jälkeen lumelääkkeeseen verrattuna, noin 8–10/ 5–6 mmHg ja 8–12/5–8 mmHg. Yli 300 mg:n annoksilla ei havaittu tehon lisääntymistä. Annos-vastesuhteet systoliseen ja diastoliseen paineeseen kohdistuville vaikutuksille on esitetty kuvissa 1 ja 2.
Kuva 1: Plasebo-vähennetty SeSBP:n aleneminen; integroitu analyysi
Kuva 2: Plasebo-vähennetty SeSBP:n aallonpituus; integroitu analyysi
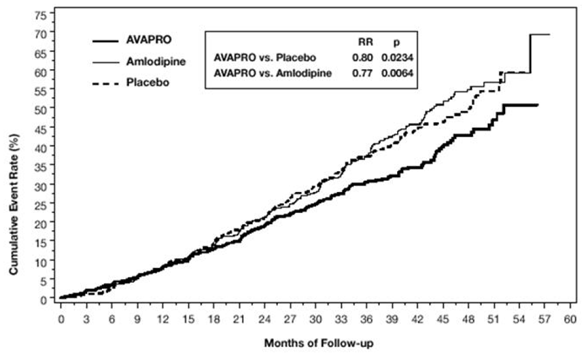
Terapeuttisten irbesartaaniannosten antaminen kerran päivässä antoi huippuvaikutuksen noin 3–6 tunnin kohdalla ja yhdessä ambulatorisessa verenpaineen seurantatutkimuksessa taas noin 14 tunnin kuluttua. Tämä havaittiin sekä kerran vuorokaudessa että kahdesti vuorokaudessa annettaessa. Systolisen ja diastolisen vasteen minimi-huippusuhteet olivat yleensä 60–70 %. Jatkuvassa ambulatorisessa verenpaineen seurantatutkimuksessa 150 mg:n kerran vuorokaudessa annostelu antoi 24 tunnin vähimmäisvasteen ja keskimääräisen vasteen, joka oli samanlainen kuin potilailla, jotka saivat kahdesti vuorokaudessa samalla kokonaisannoksella.
Kontrolloiduissa tutkimuksissa irbesartaanin lisääminen 6,25 mg:n, 12,5 mg:n tai 25 mg:n hydroklooritiatsidiannoksiin aiheutti annoksesta riippuvaisia verenpaineen laskua, joka oli samanlainen kuin samalla irbesartaanin monoterapiaannoksella. HCTZ:llä oli myös suunnilleen additiivinen vaikutus.
Potilaiden iän, sukupuolen ja rodun alaryhmien analyysi osoitti, että miehillä ja naisilla sekä yli ja alle 65-vuotiailla potilailla oli yleensä samanlaiset vasteet. Irbesartaani alensi tehokkaasti verenpainetta rodusta riippumatta, vaikka vaikutus oli hieman vähäisempi mustilla (yleensä matalareniinipitoisuuksissa).
Irbesartaanin vaikutus on ilmeinen ensimmäisen annoksen jälkeen, ja se on lähellä täydellistä havaittuaan 2 viikon kohdalla. 8 viikkoa kestäneen altistuksen lopussa noin 2/3 verenpainetta alentavasta vaikutuksesta oli vielä voimassa viikon kuluttua viimeisestä annoksesta. Rebound-hypertensiota ei havaittu. Kontrolloiduissa tutkimuksissa irbesartaanilla hoidetuilla potilailla keskimääräisessä sykkeessä ei havaittu oleellisesti muutoksia.
Nefropatia tyypin 2 diabeetikoilla
Irbesartan Diabetic Nephropathy Trial (IDNT) oli satunnaistettu, lume- ja aktiivikontrolloitu kaksoissokkoutettu monikeskustutkimus, joka suoritettiin maailmanlaajuisesti 1715 potilaalla, joilla oli tyypin 2 diabetes, verenpainetauti (SeSBP >135 mmHg tai SeDBP >85 mmHg) ja nefropatia (seerumi). kreatiniini 1,0-3,0 mg/dl naisilla tai 1,2-3,0 mg/dl miehillä ja proteinuria ≥900 mg/vrk). Potilaat satunnaistettiin saamaan AVAPRO:ta 75 mg, amlodipiinia 2,5 mg tai vastaavaa lumelääkettä kerran päivässä. Potilaat titrattiin ylläpitoannokseen AVAPRO 300 mg tai amlodipiinia 10 mg siedettyjen potilaiden mukaan. Muita verenpainetta alentavia aineita (lukuun ottamatta ACE-estäjiä, angiotensiini II -reseptorin salpaajia ja kalsiumkanavasalpaajia) lisättiin tarpeen mukaan verenpainetavoitteen saavuttamiseksi (≤135/85 tai 10 mmHg systolisen verenpaineen lasku, jos se on yli 160 mmHg) kaikissa ryhmissä. .
Tutkimuspopulaatiosta 66,5 % oli miehiä, 72,9 % alle 65-vuotiaita ja 72 % valkoisia (aasialaiset/tyynenmeren saarten asukkaat 5,0 %, mustat 13,3 %, latinalaisamerikkalaiset 4,8 %). Istuvien systolinen ja diastolinen verenpaineen keskiarvo oli 159 mmHg ja 87 mmHg. Potilaat osallistuivat tutkimukseen keskimääräisellä seerumin kreatiniiniarvolla 1,7 mg/dl ja keskimääräisellä proteinurialla 4144 mg/vrk.
Keskimääräinen verenpaine oli AVAPRO:lla 142/77 mmHg, amlodipiinilla 142/76 mmHg ja lumelääkkeellä 145/79 mmHg. Kaiken kaikkiaan 83,0 % potilaista sai tavoiteannoksen irbesartaania yli 50 % ajasta. Potilaita seurattiin keskimäärin 2,6 vuoden ajan.
Ensisijainen yhdistetty päätetapahtuma oli aika minkä tahansa seuraavan tapahtuman esiintymiseen: seerumin kreatiniinin lähtötason kaksinkertaistuminen, loppuvaiheen munuaissairaus (ESRD; määritellään seerumin kreatiniiniarvona ≥6 mg/dl, dialyysi tai munuaisensiirto) tai kuolema. . Hoito AVAPRO 150 mg:lla johti 20 %:n riskin pienenemiseen lumelääkkeeseen verrattuna (p=0,0234) (katso kuva 3 ja taulukko 1). Hoito AVAPRO 150 mg:lla vähensi myös seerumin kreatiniinin jatkuvan kaksinkertaistumisen esiintymistä erillisenä päätetapahtumana (33 %), mutta sillä ei ollut merkittävää vaikutusta pelkkään ESRD:hen eikä kokonaiskuolleisuuteen (katso taulukko 1).
Kuva 3: IDNT: Kaplan-Meierin arviot ensisijaisesta päätepisteestä (seerumin kreatiniinin kaksinkertaistuminen, loppuvaiheen munuaissairaus tai kokonaiskuolleisuus)
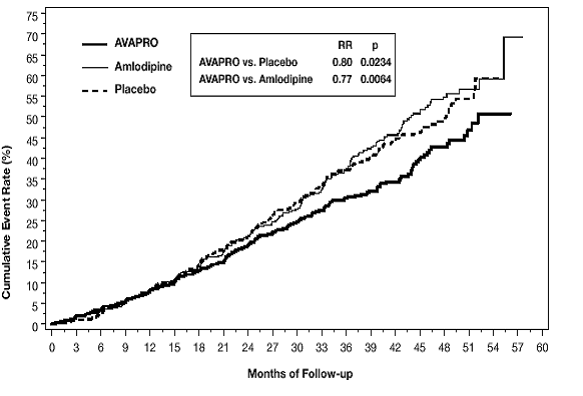
Niiden potilaiden prosenttiosuudet, jotka kokevat tapahtuman tutkimuksen aikana, näkyvät alla olevassa taulukossa 1:
Tutkimuksen toissijainen päätetapahtuma oli sydän- ja verisuoniperäisen kuolleisuuden ja sairastuvuuden yhdistelmä (sydäninfarkti, sairaalahoito sydämen vajaatoiminnan vuoksi, aivohalvaus, johon liittyy pysyvä neurologinen vajaatoiminta, amputaatio). Näissä päätepisteissä ei ollut tilastollisesti merkitseviä eroja hoitoryhmien välillä. Plaseboon verrattuna AVAPRO 150 mg vähensi proteinuriaa merkitsevästi noin 27 %, mikä vaikutus oli ilmeinen 3 kuukauden kuluessa hoidon aloittamisesta. AVAPRO vähensi merkittävästi munuaisten toiminnan heikkenemisnopeutta (glomerulusten suodatusnopeutta), mitattuna seerumin kreatiniinipitoisuuden käänteisarvolla, 18,2 %.
Taulukossa 2 esitetään demografisten alaryhmien tulokset. Alaryhmäanalyysejä on vaikea tulkita, eikä tiedetä, edustavatko nämä havainnot todellisia eroja vai sattumanvaraisia vaikutuksia. Ensisijaisen päätetapahtuman osalta AVAPRO:n suotuisat vaikutukset havaittiin potilailla, jotka käyttivät myös muita verenpainelääkkeitä (angiotensiini II -reseptorin salpaajia, angiotensiinia konvertoivan entsyymin estäjiä ja kalsiumkanavasalpaajia ei sallittu), suun kautta otettavia hypoglykeemisiä aineita ja lipidi- alentavat aineet.
POTILASTIEDOT
Raskaus
Neuvo hedelmällisessä iässä oleville naispotilaille AVAPRO-altistuksen seurauksista raskauden aikana. Keskustele hoitovaihtoehdoista raskautta suunnittelevien naisten kanssa. Potilaita tulee pyytää ilmoittamaan raskaudesta lääkärilleen mahdollisimman pian.
Kaliumlisät
Neuvo AVAPRO:ta saavia potilaita olemaan käyttämättä kaliumlisäaineita tai kaliumia sisältäviä suolan korvikkeita neuvottelematta terveydenhuollon tarjoajansa kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
