Hyzaar 12.5mg Hydrochlorothiazide Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Hyzaar on ja miten sitä käytetään?
Hyzaar 12,5 mg on reseptilääke, jota käytetään korkean verenpaineen (hypertension) oireiden hoitoon. Hyzaaria voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Hyzaar kuuluu lääkeryhmään nimeltä ARB/HCTZ Combos.
Ei tiedetä, onko Hyzaar turvallinen ja tehokas lapsille.
Mitkä ovat Hyzaar 12,5 mg:n mahdolliset sivuvaikutukset?
Hyzaar voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- huimaus,
- epäsäännölliset sydämenlyönnit,
- silmäkipu,
- näköongelmia,
- vähän tai ei ollenkaan virtsaamista,
- nopea painonnousu,
- turvotus käsissäsi, jaloissasi tai nilkoissasi,
- nivelkipu,
- ihottuma poskissa tai käsivarsissa, joka pahenee auringonvalossa,
- lisääntynyt jano,
- lisääntynyt virtsaaminen,
- hämmennystä,
- oksentelua,
- ummetus,
- lihaskipu,
- jalkakrampit,
- vakava heikkous,
- tunnottomuus tai pistely,
- liikkeen menetys ja
- hermostunut tai epävakaa olo
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Hyzaarin yleisimpiä sivuvaikutuksia ovat:
- huimaus,
- selkäkipuja ja
- vilustumisoireet (nenän tukkoisuus, aivastelu, kurkkukipu)
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Hyzaarin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
SIKIÖN MYRKYLLISYYS
Kun raskaus havaitaan, lopeta HYZAAR-hoito mahdollisimman pian. Lääkkeet, jotka vaikuttavat suoraan reniini-angiotensiinijärjestelmään, voivat aiheuttaa vammoja ja kuoleman kehittyvälle sikiölle [ks. VAROITUKSET JA VAROTOIMET ].
KUVAUS
HYZAAR 50/12.5 (losartaanikaliumhydroklooritiatsidi), HYZAAR 100/12.5 (losartaanikaliumhydroklooritiatsidi) ja HYZAAR 100/25 (losartaanikaliumhydroklooritiatsidi) -tabletit yhdistävät angiotensiini II -reseptoriin vaikuttavan klooriatsidireseptorin, diklooriatsidireseptorin salpaajan.
Losartaanikalium, ei-peptidimolekyyli, kuvataan kemiallisesti 2-butyyli-4-kloori-1-[p-(o-1H-tetratsol-5-yylifenyyli)bentsyyli]imidatsoli-5-metanolimonokaliumsuolaa. Sen empiirinen kaava on C22H22ClKN6O ja sen rakennekaava on:
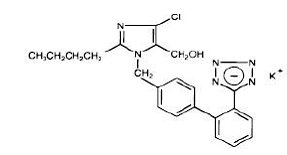
Losartan kalium on valkoinen tai luonnonvalkoinen vapaasti valuva kiteinen jauhe, jonka molekyylipaino on 461,01. Se liukenee vapaasti veteen, liukenee alkoholeihin ja liukenee hieman tavallisiin orgaanisiin liuottimiin, kuten asetonitriiliin ja metyylietyyliketoniin.
Imidatsolirenkaan 5-hydroksimetyyliryhmän hapettuminen johtaa losartaanin aktiiviseen metaboliittiin.
Hydroklooritiatsidi on 6-kloori-3,4-dihydro-2H-1,2,4-bentsotiadiatsiini-7-sulfonamidi-1,1-dioksidi. Sen empiirinen kaava on C7H8ClN3O4S2 ja sen rakennekaava on:
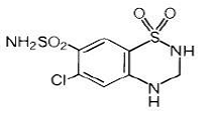
Hydroklooritiatsidi on valkoinen tai käytännöllisesti katsoen valkoinen kiteinen jauhe, jonka molekyylipaino on 297,74 ja joka liukenee heikosti veteen, mutta liukenee vapaasti natriumhydroksidiliuokseen.
HYZAAR on saatavana suun kautta annettavana kolmena losartaanin ja hydroklooritiatsidin tablettiyhdistelmänä. HYZAAR 50/12,5 sisältää 50 mg losartaanikaliumia ja 12,5 mg hydroklooritiatsidia. HYZAAR 100/12,5 sisältää 100 mg losartaanikaliumia ja 12,5 mg hydroklooritiatsidia. HYZAAR 100/25 sisältää 100 mg losartaanikaliumia ja 25 mg hydroklooritiatsidia. Inaktiivisia aineosia ovat mikrokiteinen selluloosa, vesipitoinen laktoosi, esigelatinoitu tärkkelys, magnesiumstearaatti, hydroksipropyyliselluloosa, hypromelloosi ja titaanidioksidi.
HYZAAR 50/12.5 ja HYZAAR 100/25 sisältävät myös D&C keltaisen nro 10 alumiinilakan. HYZAAR 50/12.5, HYZAAR 100/12.5 ja HYZAAR 100/25 voivat sisältää myös karnaubavahaa.
HYZAAR 50/12.5 sisältää 4,24 mg (0,108 mEq) kaliumia, HYZAAR 100/12,5 sisältää 8,48 mg (0,216 mEq) kaliumia ja HYZAAR 100/25 sisältää 8,48 mg (0,216 mEq) kaliumia
INDIKAATIOT
Hypertensio
HYZAAR® on tarkoitettu verenpainetaudin hoitoon, verenpaineen alentamiseen. Verenpaineen alentaminen vähentää kuolemaan johtavien ja ei-kuolemaan johtavien sydän- ja verisuonitapahtumien, pääasiassa aivohalvausten ja sydäninfarktin, riskiä. Nämä edut on havaittu kontrolloiduissa tutkimuksissa, joissa on käytetty monia erilaisia farmakologisia lääkkeitä, mukaan lukien losartaani ja hydroklooritiatsidi.
Korkean verenpaineen hallinnan tulee olla osa kattavaa sydän- ja verisuoniriskin hallintaa, mukaan lukien tarvittaessa lipidien hallinta, diabeteksen hallinta, antitromboottinen hoito, tupakoinnin lopettaminen, liikunta ja rajoitettu natriumin saanti. Monet potilaat tarvitsevat enemmän kuin yhden lääkkeen verenpainetavoitteiden saavuttamiseksi. Tarkempia tavoitteita ja hallintaa koskevia neuvoja on julkaistuissa ohjeissa, kuten National High Blood Pressure Education Programin kansallisen korkean verenpaineen ehkäisy-, havaitsemis-, arviointi- ja hoitokomitean (JNC) ohjeissa.
Lukuisten verenpainetta alentavien lääkkeiden, eri farmakologisista luokista ja eri vaikutusmekanismeista, on osoitettu satunnaistetuissa kontrolloiduissa tutkimuksissa vähentävän sydän- ja verisuonisairauksien sairastuvuutta ja kuolleisuutta, ja voidaan päätellä, että se on verenpainetta alentavaa, eikä muuta lääkettä. lääkkeet, jotka ovat suurelta osin vastuussa näistä eduista. Suurin ja johdonmukaisin kardiovaskulaarinen tulos on ollut aivohalvauksen riskin väheneminen, mutta myös sydäninfarktin ja sydän- ja verisuoniperäisen kuolleisuuden on havaittu vähenevän säännöllisesti.
Kohonnut systolinen tai diastolinen paine lisää kardiovaskulaarista riskiä, ja absoluuttinen riskin nousu mmHg:tä kohti on suurempi korkeammilla verenpaineilla, joten jopa vaatimattomasta vaikean verenpaineen alenemisesta voi olla huomattavaa hyötyä. Suhteellinen riskin pieneneminen verenpaineen laskusta on samanlainen kaikissa populaatioissa, joissa absoluuttinen riski vaihtelee, joten absoluuttinen hyöty on suurempi potilailla, joilla on suurempi riski verenpaineesta riippumatta (esimerkiksi potilaat, joilla on diabetes tai hyperlipidemia), ja tällaisia potilaita odotetaan olevan hyötyä aggressiivisemmasta hoidosta alhaisemman verenpainetavoitteen saavuttamiseksi.
Joillakin verenpainelääkkeillä on pienemmät verenpainevaikutukset (monoterapiana) mustaihoisilla potilailla, ja monilla verenpainelääkkeillä on muita hyväksyttyjä käyttöaiheita ja vaikutuksia (esim. angina pectoris, sydämen vajaatoiminta tai diabeettinen munuaissairaus). Nämä näkökohdat voivat ohjata hoidon valintaa.
Tätä kiinteän annoksen yhdistelmää ei ole tarkoitettu hypertension alkuhoitoon, paitsi jos verenpainetauti on niin vakava, että nopea verenpaineen hallinta ylittää riskin aloittaa yhdistelmähoito näillä potilailla [ks. Kliiniset tutkimukset ja ANNOSTELU JA HALLINNOINTI ].
HYZAAR-valmistetta voidaan antaa muiden verenpainelääkkeiden kanssa.
Hypertensiiviset potilaat, joilla on vasemman kammion hypertrofia
HYZAAR on tarkoitettu vähentämään aivohalvauksen riskiä potilailla, joilla on korkea verenpaine ja vasemman kammion liikakasvu, mutta on näyttöä siitä, että tämä hyöty ei koske mustaihoisia potilaita. [Katso Käyttö tietyissä populaatioissa , KLIININEN FARMAKOLOGIA , ja ANNOSTELU JA HALLINNOINTI .]
ANNOSTELU JA HALLINNOINTI
Hypertensio
Tavallinen HYZAAR-aloitusannos on 50/12,5 (losartaani 50 mg/hydroklooritiatsidi 12,5 mg) kerran vuorokaudessa. Annosta voidaan suurentaa 3 viikon hoidon jälkeen enintään annokseen 100/25 (losartaani 100 mg/hydroklooritiatsidi 25 mg) kerran vuorokaudessa tarpeen mukaan verenpaineen hallitsemiseksi (ks. Kliiniset tutkimukset ].
Aloita potilaalle, jonka verenpainetta ei saada riittävästi hallintaan Losartilla, 50 mg:n monoterapia HYZAAR 50/12,5 -valmisteella kerran vuorokaudessa. Jos verenpaine pysyy hallinnassa noin 3 viikon hoidon jälkeen, annosta voidaan suurentaa kahteen HYZAAR 50/12,5 tablettiin kerran vuorokaudessa tai yhteen HYZAAR 100/25 tablettiin kerran vuorokaudessa.
Aloita potilas, jonka verenpainetta ei saada riittävästi hallintaan losartaanin 100 mg monoterapialla ja HYZAAR 100/12,5 (losartaani 100 mg/hydroklooritiatsidi 12,5 mg) kerran vuorokaudessa. Jos verenpaine ei pysy hallinnassa noin 3 viikon hoidon jälkeen, nosta annos kahteen HYZAAR 50/12,5 tablettiin kerran vuorokaudessa tai yhteen HYZAAR 100/25 tablettiin kerran vuorokaudessa.
Aloita potilas, jonka verenpainetta ei saada riittävästi hallintaan hydroklooritiatsidilla 25 mg kerran vuorokaudessa tai joka on hallinnassa, mutta jolla on hypokalemia tällä hoito-ohjelmalla, HYZAAR 50/12,5 -annoksella kerran vuorokaudessa, pienentämällä hydroklooritiatsidiannosta heikentämättä odotettua verenpainetta alentavaa kokonaisvastetta. Arvioi kliininen vaste HYZAAR 50/12,5:lle ja jos verenpaine ei pysy hallinnassa noin 3 viikon hoidon jälkeen, nosta annos kahteen HYZAAR 50/12,5 tablettiin kerran vuorokaudessa tai yhteen HYZAAR 100/25 tablettiin kerran vuorokaudessa.
Hypertensiiviset potilaat, joilla on vasemman kammion hypertrofia
Aloita hoito HYZAAR 50/12,5 -valmisteella potilaille, joiden verenpainetta ei saada riittävästi hallintaan 50 mg:lla losartaanikaliumia. Jos verenpainetta tarvitaan lisää, nosta annosta HYZAAR 100/12,5:een ja sen jälkeen HYZAAR 100/25:een. Lisää muita verenpainelääkkeitä verenpaineen alentamiseksi [katso Kliiniset tutkimukset ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
- HYZAAR 50/12,5 ovat keltaisia, soikeita, kalvopäällysteisiä tabletteja, joiden toisella puolella on koodi 717.
- HYZAAR 100/12,5 ovat valkoisia, soikeita, kalvopäällysteisiä tabletteja, joiden toisella puolella on koodi 745.
- HYZAAR 100/25 ovat vaaleankeltaisia, soikeita, kalvopäällysteisiä tabletteja, joiden toisella puolella on koodi 747.
Varastointi ja käsittely
HYZAAR toimitetaan kalvopäällysteisenä tablettina.
Säilytä 25°C (77°F); retket sallitaan 15-30°C:een (59-86°F) [katso USP-ohjattu huonelämpötila ]. Pidä säiliö tiiviisti suljettuna. Suojaa valolta.
Valmistettu Organon LLC:lle, ORGANON & Co:n tytäryhtiölle, Jersey City, NJ 07302, USA. Tarkistettu: kesäkuuta 2021
SIVUVAIKUTUKSET
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Losartaanikaliumhydroklooritiatsidin turvallisuutta on arvioitu 858 potilaalla, joita hoidettiin essentiaalisen verenpaineen vuoksi, ja 3 889 potilaalla, joita hoidettiin verenpaineen ja vasemman kammion hypertrofian vuoksi. Useimmat haittavaikutukset ovat olleet lieviä ja ohimeneviä, eivätkä ne ole vaatineet hoidon lopettamista. Kontrolloiduissa kliinisissä tutkimuksissa kliinisten haittatapahtumien vuoksi hoidon lopettamista vaadittiin vain 2,8 %:lla ja lumelääkettä saaneista potilaista 2,3 %:lla.
Näissä kaksoissokkoutetuissa kontrolloiduissa kliinisissä tutkimuksissa haittavaikutukset, joita esiintyi yli 2 %:lla losartaanihydroklooritiatsidilla ja useammin kuin lumelääkettä saaneista potilaista, olivat selkäkipu (2,1 % vs 0,6 %), huimaus (5,7 % vs 2,9 %). ja ylempien hengitysteiden infektio (6,1 % vs 4,6 %).
Seuraavia muita haittavaikutuksia on raportoitu kliinisissä tutkimuksissa HYZAARilla ja/tai sen yksittäisillä aineilla:
Veren ja imunestejärjestelmän häiriöt: Anemia, aplastinen anemia, hemolyyttinen anemia, leukopenia, agranulosytoosi.
Aineenvaihdunta- ja ravitsemushäiriöt: Anoreksia, hyperglykemia, hyperurikemia, elektrolyyttitasapainohäiriö mukaan lukien hyponatremia ja hypokalemia.
Psyykkiset häiriöt: Unettomuus, levottomuus.
Hermoston häiriöt: Dysgeusia, päänsärky, migreeni, parestesia.
Silmäsairaudet: Ksanthopsia, ohimenevä näön hämärtyminen.
Sydämen häiriöt: Sydämentykytys, takykardia.
Verisuonihäiriöt: Annoksesta riippuvaiset ortostaattiset vaikutukset, nekrotisoiva angiiitti (vaskuliitti, ihon vaskuliitti).
Hengityselimet, rintakehä ja välikarsina: Nenän tukkoisuus.
Ruoansulatuskanavan häiriöt: Dyspepsia, vatsakipu, mahalaukun ärsytys, kouristukset, pahoinvointi, oksentelu, haimatulehdus, sialoadeniitti.
Maksa-sappihäiriöt: Keltaisuus (intrahepaattinen kolestaattinen keltaisuus).
Ihon ja ihonalaisen kudoksen häiriöt: Ihottuma, kutina, purppura, toksinen epidermaalinen nekrolyysi, urtikaria, valoherkkyys, ihon lupus erythematosus.
Tuki- ja liikuntaelimistön ja sidekudoksen häiriöt: Lihaskrampit, lihasspasmit.
Munuaisten ja virtsateiden häiriöt: Glykosuria, munuaisten vajaatoiminta, interstitiaalinen nefriitti, munuaisten vajaatoiminta.
Sukuelinten ja rintojen häiriöt: Erektiohäiriö/impotenssi.
Yleiset häiriöt ja antopaikan haitat: Rintakipu, huonovointisuus, heikkous.
Tutkimukset: Maksan toiminnan poikkeavuudet.
Yskä
Jatkuva kuiva yskä on liitetty ACE-estäjien käyttöön ja voi käytännössä olla syynä ACE-estäjähoidon keskeyttämiseen. Kaksi prospektiivista, rinnakkaisten ryhmien, kaksoissokkoutettua, satunnaistettua, kontrolloitua tutkimusta suoritettiin arvioimaan losartaanin vaikutuksia yskän esiintyvyyteen hypertensiivisillä potilailla, jotka olivat kokeneet yskää ACE:n estäjähoidon aikana. Potilaat, joilla oli tyypillistä ACE-estäjän yskää lisinopriililla ja joiden yskä hävisi lumelääkkeellä, satunnaistettiin saamaan 50 mg losartaania, 20 mg lisinopriilia tai joko lumelääkettä (yksi tutkimus, n=97) tai 25 mg hydroklooritiatsidia (n=135). Kaksoissokkohoitojakso kesti jopa 8 viikkoa. Yskän ilmaantuvuus on esitetty alla olevassa taulukossa 1.
Nämä tutkimukset osoittavat, että losartaanihoitoon liittyvän yskän ilmaantuvuus populaatiossa, jolla kaikilla oli ACE:n estäjähoitoon liittyvää yskää, on samanlainen kuin hydroklooritiatsidi- tai lumelääkehoitoon liittyvän yskän ilmaantuvuus.
Losartaanin käytön yhteydessä on raportoitu yskätapauksia, mukaan lukien positiiviset uusintahaasteet, markkinoille tulon jälkeen.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu HYZAARin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista arvioida luotettavasti niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Ruoansulatus: Hepatiittia on raportoitu harvoin losartaanilla hoidetuilla potilailla.
Hematologinen: Trombosytopenia.
Yliherkkyys: Angioedeemaa, mukaan lukien kurkunpään ja äänihuulen turvotus, joka aiheuttaa hengitysteiden tukkeutumista ja/tai kasvojen, huulten, nielun ja/tai kielen turvotusta, on raportoitu harvoin losartaanilla hoidetuilla potilailla. joillakin näistä potilaista on aiemmin esiintynyt angioedeemaa muiden lääkkeiden, mukaan lukien ACE:n estäjien, käytön yhteydessä. Vaskuliittia, mukaan lukien Henoch-Schönleinin purppura, on raportoitu losartaanin käytön yhteydessä. Anafylaktisia reaktioita on raportoitu.
Tuki- ja liikuntaelimistö: Rabdomyolyysi.
Iho: Erytroderma.
Ei-melanooma-ihosyöpä: Hydroklooritiatsidi liittyy suurentuneeseen ei-melanooma-ihosyövän riskiin. Sentinel-järjestelmässä tehdyssä tutkimuksessa lisääntynyt riski oli pääasiassa okasolusyöpään (SCC) ja valkoihoisilla potilailla, jotka ottivat suuria kumulatiivisia annoksia. SCC:n lisääntynyt riski koko populaatiossa oli noin 1 lisätapaus 16 000 potilasta kohti vuodessa, ja valkoihoisilla potilailla, jotka ottivat ≥50 000 mg:n kumulatiivisen annoksen, riskin kasvu oli noin 1 ylimääräinen SCC-tapaus jokaista 6 700 potilasta kohden vuodessa.
HUUMEIDEN VUOROVAIKUTUKSET
Seerumin kaliumia lisäävät aineet
Losartaanin samanaikainen käyttö muiden seerumin kaliumpitoisuutta nostavien lääkkeiden kanssa voi johtaa hyperkalemiaan. Seuraa seerumin kaliumarvoa tällaisilla potilailla.
Litium
Seerumin litiumpitoisuuksien nousua ja litiumtoksisuutta on raportoitu käytettäessä samanaikaisesti angiotensiini II -reseptorin salpaajia tai tiatsididiureetteja. Seuraa litiumpitoisuutta potilailla, jotka saavat HYZAAR 12,5 mg ja litiumia.
Ei-steroidiset tulehduskipuaineet mukaan lukien selektiiviset syklo-oksigenaasi-2:n estäjät
Losartaanikalium
Iäkkäillä potilailla, joilla on nestevajaus (mukaan lukien diureettihoitoa saavat) tai heikentynyt munuaisten toiminta, tulehduskipulääkkeiden, mukaan lukien selektiivisten COX-2-estäjien, samanaikainen käyttö angiotensiini II -reseptorin salpaajien (mukaan lukien losartaani) kanssa voi heikentää munuaisten toiminta, mukaan lukien mahdollinen akuutti munuaisten vajaatoiminta. Nämä vaikutukset ovat yleensä palautuvia. Seuraa munuaisten toimintaa säännöllisesti potilailla, jotka saavat losartaania ja NSAID-hoitoa.
Tulehduskipulääkkeet, mukaan lukien selektiiviset COX-2-estäjät, voivat heikentää angiotensiini II -reseptoriantagonistien, mukaan lukien losartaanin, verenpainetta alentavaa vaikutusta.
Hydroklooritiatsidi
Ei-steroidisen anti-inflammatorisen aineen, mukaan lukien selektiivisen COX-2-estäjän, antaminen voi vähentää loop-, kaliumia säästävien ja tiatsididiureettien diureettisia, natriureettisia ja verenpainetta alentavia vaikutuksia. Siksi, kun HYZAARia ja ei-steroidisia tulehduskipulääkkeitä, mukaan lukien selektiiviset COX-2-estäjät, käytetään samanaikaisesti, tarkkaile tarkasti, saavutetaanko diureetin haluttu vaikutus.
Diureettihoitoa saavilla potilailla tulehduskipulääkkeiden samanaikainen käyttö angiotensiinireseptorin salpaajien, mukaan lukien losartaanin, kanssa voi johtaa munuaisten toiminnan heikkenemiseen, mukaan lukien mahdollinen akuutti munuaisten vajaatoiminta. Nämä vaikutukset ovat yleensä palautuvia. Seuraa munuaisten toimintaa määräajoin potilailla, jotka saavat hydroklooritiatsidia, losartaania ja NSAID-hoitoa.
Reniini-angiotensiinijärjestelmän (RAS) kaksoisesto
RAS:n kaksoissalpaus angiotensiinireseptorin salpaajilla, ACE:n estäjillä tai aliskireenilla liittyy lisääntyneeseen hypotension, pyörtymisen, hyperkalemian ja munuaisten toiminnan muutosten (mukaan lukien akuutti munuaisten vajaatoiminta) riskiin verrattuna monoterapiaan.
Veterans Affairs Nephropathy in Diabetes (VA NEPHRON-D) -tutkimukseen otettiin mukaan 1448 potilasta, joilla oli tyypin 2 diabetes, kohonnut virtsan albumiini-kreatiniinisuhde ja laskenut arvioitu glomerulussuodatusnopeus (GFR 30-89,9 ml/min). lisinopriilia tai lumelääkettä losartaanihoidon taustalla ja seurasi niitä keskimäärin 2,2 vuoden ajan. Potilaat, jotka saivat losartaanin ja lisinopriilin yhdistelmää, eivät saaneet lisähyötyä monoterapiaan verrattuna yhdistetyn päätetapahtuman eli GFR:n heikkenemisen, loppuvaiheen munuaissairauden tai kuoleman vuoksi, mutta hyperkalemian ja akuutin munuaisvaurion ilmaantuvuus lisääntyi monoterapiaan verrattuna. ryhmä.
Seuraa tarkasti verenpainetta, munuaisten toimintaa ja elektrolyyttejä potilailla, jotka käyttävät HYZAAR 12,5 mg:aa ja muita RAS:aan vaikuttavia aineita.
Älä anna aliskireenia samanaikaisesti HYZAAR 12,5 mg:n kanssa diabeetikoille. Vältä aliskireenin käyttöä HYZAAR 12,5 mg:n kanssa potilailla, joilla on munuaisten vajaatoiminta (GFR
Hydroklooritiatsidin käyttö muiden lääkkeiden kanssa
Seuraavilla lääkkeillä voi olla yhteisvaikutuksia tiatsididiureettien kanssa samanaikaisesti annettuna [ks. KLIININEN FARMAKOLOGIA ]:
Diabeteslääkkeet (oraaliset lääkkeet ja insuliini) - Diabeteslääkkeen annoksen muuttaminen saattaa olla tarpeen.
Kolestyramiini ja kolestipolihartsit - Hydroklooritiatsidin imeytyminen heikkenee anioninvaihtohartsien läsnä ollessa. Joko kolestyramiini- tai kolestipolihartsien kerta-annokset sitovat hydroklooritiatsidin ja vähentävät sen imeytymistä maha-suolikanavasta jopa 85 ja 43 prosenttia, vastaavasti.
Porrastetaan hydroklooritiatsidin ja hartsin annostusta siten, että hydroklooritiatsidi annetaan vähintään 4 tuntia ennen tai 4–6 tuntia hartsin annon jälkeen.
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Sikiön toksisuus
Reniini-angiotensiinijärjestelmään vaikuttavien lääkkeiden käyttö raskauden toisen ja kolmannen kolmanneksen aikana vähentää sikiön munuaisten toimintaa ja lisää sikiön ja vastasyntyneen sairastuvuutta ja kuolemaa. Tuloksena olevat oligohydramnionit voivat liittyä sikiön keuhkojen hypoplasiaan ja luuston epämuodostumiin. Mahdollisia vastasyntyneiden haittavaikutuksia ovat kallon hypoplasia, anuria, hypotensio, munuaisten vajaatoiminta ja kuolema. Kun raskaus havaitaan, lopeta HYZAAR 12,5 mg -valmisteen käyttö mahdollisimman pian.
Tiatsidit läpäisevät istukan ja näkyvät napanuoraveressä. Haittavaikutuksia ovat sikiön tai vastasyntyneen keltaisuus, trombosytopenia [katso Käyttö tietyissä populaatioissa ].
Hypotensio volyymi- tai suolavajauspotilailla
Potilailla, joilla on aktivoitunut reniini-angiotensiinijärjestelmä, kuten neste- tai suolavajaus (esim. suurilla diureetiannoksilla hoidetuilla), oireenmukaista hypotensiota voi esiintyä HYZAAR-hoidon aloittamisen jälkeen. Korjaa neste- tai suolavaje ennen HYZAARin antamista. Älä käytä HYZAARia aloitushoitona potilailla, joilla on suonensisäinen tilavuusvajaus.
Munuaisten vajaatoiminta
Muutoksia munuaisten toiminnassa, mukaan lukien akuutti munuaisten vajaatoiminta, voivat aiheuttaa reninangiotensiinijärjestelmää estävät lääkkeet ja diureetit. Potilailla, joiden munuaisten toiminta saattaa riippua osittain reniini-angiotensiinijärjestelmän aktiivisuudesta (esim. potilaat, joilla on munuaisvaltimon ahtauma, krooninen munuaissairaus, vaikea sydämen vajaatoiminta tai tilavuusvaje), voi olla erityinen riski saada akuutti munuaisten vajaatoiminta HYZAAR. Seuraa näiden potilaiden munuaisten toimintaa säännöllisesti. Harkitse hoidon keskeyttämistä tai lopettamista potilailla, joille kehittyy kliinisesti merkittävä munuaistoiminnan heikkeneminen HYZAAR-hoidon aikana [ks. HUUMEIDEN VUOROVAIKUTUKSET ja Käyttö tietyissä populaatioissa ].
Yliherkkyys
Yliherkkyysreaktioita hydroklooritiatsidille voi esiintyä potilailla, joilla on tai ei ole aiemmin ollut allergiaa tai keuhkoastmaa, mutta ne ovat todennäköisempiä potilailla, joilla on ollut tällainen allergia.
Elektrolyytti- ja aineenvaihduntavaikutukset
Eri losartaanikalium- ja hydroklooritiatsidiannoksilla tehdyissä kaksoissokkotutkimuksissa hypertensiivisten potilaiden ilmaantuvuus, joille kehittyi hypokalemia (seerumin kalium 5,7 mekv/l) ilmaantuvuus oli 0,4 % verrattuna lumelääkkeeseen 0 %.
HYZAAR sisältää hydroklooritiatsidia, joka voi aiheuttaa hypokalemiaa, hyponatremiaa ja hypomagnesemiaa. Hypomagnesemia voi johtaa hypokalemiaan, jota voi olla vaikea hoitaa kaliumin lisääntymisestä huolimatta. HYZAAR 12,5 mg sisältää myös losartaania, joka voi aiheuttaa hyperkalemiaa. Tarkkaile seerumin elektrolyyttejä säännöllisesti [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Muiden lääkkeiden, jotka voivat lisätä seerumin kaliumpitoisuutta, samanaikainen käyttö voi johtaa hyperkalemiaan [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Hydroklooritiatsidi voi muuttaa glukoosinsietokykyä ja nostaa seerumin kolesteroli- ja triglyseridipitoisuuksia.
Tiatsidihoitoa saavilla potilailla saattaa esiintyä hyperurikemiaa tai kihtiä. Koska losartaani vähentää virtsahappoa, losartaani yhdessä hydroklooritiatsidin kanssa heikentää diureettien aiheuttamaa hyperurikemiaa.
Hydroklooritiatsidi vähentää kalsiumin erittymistä virtsaan ja voi aiheuttaa seerumin kalsiumpitoisuuden nousua. Tarkkaile kalsiumtasoja.
Akuutti likinäköisyys ja toissijainen kulmaglaukooma
Hydroklooritiatsidi, sulfonamidi, voi aiheuttaa idiosynkraattisen reaktion, joka johtaa akuuttiin ohimenevään likinäköisyyteen ja akuuttiin sulkeutumiskulmaglaukoomaan. Oireita ovat akuutti näöntarkkuuden heikkeneminen tai silmäkipu, ja ne ilmenevät tyypillisesti tunneista viikkoihin lääkkeen aloittamisen jälkeen. Hoitamaton akuutti kulmaglaukooma voi johtaa pysyvään näön menetykseen. Ensisijainen hoito on hydroklooritiatsidin käytön lopettaminen mahdollisimman nopeasti. Nopeaa lääketieteellistä tai kirurgista hoitoa voidaan joutua harkitsemaan, jos silmänpaine pysyy hallitsemattomana. Akuutin sulkukulmaglaukooman kehittymisen riskitekijöihin voi kuulua aiempi sulfonamidi- tai penisilliiniallergia.
Systeeminen lupus erythematosus
Tiatsididiureettien on raportoitu aiheuttavan systeemisen lupus erythematosuksen pahenemista tai aktivoitumista.
Postsympathectomy potilaat
Lääkkeen verenpainetta alentavat vaikutukset voivat voimistua postsympathectomy-potilailla.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ).
Raskaus
Neuvo hedelmällisessä iässä oleville naispotilaille raskauden aikana HYZAAR 12,5 mg:lle altistumisen seurauksista. Keskustele hoitovaihtoehdoista raskautta suunnittelevien naisten kanssa. Kerro potilaille ilmoittamaan raskaudesta lääkärilleen mahdollisimman pian [katso VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].

Oireellinen hypotensio
Neuvo potilaita, että huimausta voi esiintyä, erityisesti hoidon ensimmäisten päivien aikana, ja ilmoittaa tästä oireesta terveydenhuollon tarjoajalle. Kerro potilaille, että riittämättömästä nesteen saannista, liiallisesta hikoilusta, oksentelusta tai ripulista johtuva kuivuminen voi johtaa liialliseen verenpaineen laskuun. Jos pyörtymistä ilmenee, neuvo potilaita ottamaan yhteyttä terveydenhuollon tarjoajaan [katso VAROITUKSET JA VAROTOIMET ].
Kaliumlisät
Neuvo potilaita olemaan käyttämättä kaliumlisäaineita tai kaliumia sisältäviä suolan korvikkeita neuvottelematta terveydenhuollon tarjoajansa kanssa [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Akuutti likinäköisyys ja toissijainen kulmaglaukooma
Neuvo potilaita lopettamaan HYZAAR 12,5 mg -valmisteen käyttö ja hakeutumaan välittömästi lääkärin hoitoon, jos heillä on akuutin likinäköisyyden tai toissijaisen kulmaglaukooman oireita [ks. VAROITUKSET JA VAROTOIMET ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Losartaanikaliumhydroklooritiatsidi
Losartaanikaliumhydroklooritiatsidiyhdistelmällä ei ole tehty karsinogeenisuustutkimuksia.
Losartaanikaliumhydroklooritiatsidi testattiin painosuhteella 4:1, ja se oli negatiivinen Amesin mikrobien mutageneesimäärityksessä ja V-79 kiinanhamsterin keuhkosolujen mutageneesimäärityksessä. Lisäksi ei havaittu suoraa genotoksisuutta in vitro alkalisella eluutiolla rotan maksasoluilla ja in vitro kromosomipoikkeavuusmäärityksessä kiinanhamsterin munasarjasoluilla sytotoksisilla pitoisuuksilla.
Losartaanikalium, annettuna yhdessä hydroklooritiatsidin kanssa, ei vaikuttanut urosrottien hedelmällisyyteen tai parittelukäyttäytymiseen losartaanin annoksilla 135 mg/kg/vrk ja hydroklooritiatsidin annoksilla 33,75 mg/kg/vrk. Näiden annosten on osoitettu antavan losartaanille, sen aktiiviselle metaboliitille ja hydroklooritiatsidille vastaavat systeemiset altistukset (AUC-arvot), jotka ovat noin 60, 60 ja 30 kertaa suuremmat kuin ihmisillä 100 mg:lla losartaanikaliumia yhdessä 25 mg:n kanssa hydroklooritiatsidia. Kuitenkin naarasrotilla losartaanin 10 mg/kg/vrk ja 2,5 mg/kg/vrk hydroklooritiatsidiannosten samanaikainen antaminen liittyi vähäiseen mutta tilastollisesti merkitsevään hedelmällisyyden ja hedelmällisyyden indeksien laskuun. Losartaanin, sen aktiivisen metaboliitin ja hydroklooritiatsidin AUC-arvot, jotka on ekstrapoloitu tiedoista, jotka on saatu rotille annetulla losartaanilla annoksella 50 mg/kg/vrk yhdessä 12,5 mg/kg/vrk hydroklooritiatsidin kanssa, olivat noin 6, 2 ja 2 kertaa suurempi kuin ihmisillä saavutettu 100 mg:lla losartaania yhdessä 25 mg:n kanssa hydroklooritiatsidia.
Losartaanikalium
Losartaanikalium ei ollut karsinogeeninen, kun sitä annettiin rotille maksimi siedetyillä annoksilla 105 ja hiirille 92 viikon ajan. Naarasrotilla, joille annettiin suurin annos (270 mg/kg/vrk), haiman akinaarisen adenooman ilmaantuvuus oli hieman suurempi. Suurin siedetyt annokset (270 mg/kg/vrk rotilla, 200 mg/kg/vrk hiirillä) saivat losartaanille ja sen farmakologisesti aktiiviselle metaboliitille systeemisen altistuksen, joka oli noin 160- ja 90-kertainen (rotilla) ja 30- ja 15-kertainen (hiirillä). ) altistuminen 50 kg painavalle ihmiselle annettuna 100 mg päivässä.
Losartaanikalium oli negatiivinen mikrobimutageneesi- ja V-79-nisäkässolumutageneesimäärityksissä sekä in vitro alkalisella eluutiolla ja in vitro ja in vivo kromosomipoikkeavuusmäärityksissä. Lisäksi aktiivinen metaboliitti ei osoittanut genotoksisuutta mikrobimutageneesissä, in vitro alkalisessa eluutiossa ja in vitro kromosomipoikkeavuusmäärityksissä.
Hedelmällisyyteen ja lisääntymiskykyyn ei vaikuttanut tutkimuksissa urosrotilla, joille annettiin losartaanikaliumia suun kautta noin 150 mg/kg/vrk. Toksisten annostasojen antaminen naisille (300/200 mg/kg/vrk) liittyi merkitsevästi (p
Hydroklooritiatsidi
Kansallisen toksikologiaohjelman (NTP) alaisuudessa tehdyt kaksivuotiset ruokintatutkimukset hiirillä ja rotilla eivät paljastaneet näyttöä hydroklooritiatsidin syöpää aiheuttavasta potentiaalista naarashiirillä (annoksilla enintään noin 600 mg/kg/vrk) tai uroksilla. ja naarasrotilla (annoksilla enintään noin 100 mg/kg/vrk). NTP löysi kuitenkin kiistanalaisia todisteita hepatokarsinogeenisuudesta uroshiirillä.
Hydroklooritiatsidi ei ollut genotoksinen in vitro Salmonella typhimurium -kantojen TA 98, TA 100, TA 1535, TA 1537 ja TA 1538 Amesin mutageenisuuskokeessa eikä kiinalaisen hamsterin munasarjan (CHO) testissä kromosomien in vivoation tai aberation in aberration hiiren itusolujen kromosomit, kiinanhamsterin luuytimen kromosomit ja Drosophilan sukupuoleen liittyvä resessiivinen tappava piirregeeni. Positiivisia testituloksia saatiin vain in vitro CHO Sister Chromatid Exchange (klastogeenisuus) ja hiiren lymfoomasolutesteissä (mutageenisuus), joissa käytettiin hydroklooritiatsidin pitoisuuksia 43 - 1300 mcg/ml, ja Aspergillus nidulans non-disjunktion -määrityksessä. määrittelemätön pitoisuus.
Hydroklooritiatsidilla ei ollut haitallisia vaikutuksia kummankaan sukupuolen hiirten ja rottien hedelmällisyyteen tutkimuksissa, joissa nämä lajit altistettiin ruokavalionsa kautta annoksille, jotka olivat 100 ja 4 mg/kg, vastaavasti ennen parittelua ja koko tiineyden ajan.
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka D
Reniini-angiotensiinijärjestelmään vaikuttavien lääkkeiden käyttö raskauden toisen ja kolmannen kolmanneksen aikana vähentää sikiön munuaisten toimintaa ja lisää sikiön ja vastasyntyneen sairastuvuutta ja kuolemaa. Tuloksena olevat oligohydramnionit voivat liittyä sikiön keuhkojen hypoplasiaan ja luuston epämuodostumiin. Mahdollisia vastasyntyneiden haittavaikutuksia ovat kallon hypoplasia, anuria, hypotensio, munuaisten vajaatoiminta ja kuolema. Kun raskaus havaitaan, lopeta losartaanihoito mahdollisimman pian. Nämä haittavaikutukset liittyvät yleensä näiden lääkkeiden käyttöön raskauden toisen ja kolmannen kolmanneksen aikana. Useimmat epidemiologiset tutkimukset, joissa tutkittiin sikiön poikkeavuuksia verenpainetta alentaville lääkkeille ensimmäisen raskauskolmanneksen aikana, eivät ole erottaneet reniini-angiotensiinijärjestelmään vaikuttavia lääkkeitä muista verenpainetta alentavista aineista. Äidin verenpainetaudin asianmukainen hoito raskauden aikana on tärkeää sekä äidin että sikiön tulosten optimoimiseksi.
Siinä epätavallisessa tapauksessa, että reninangiotensiinijärjestelmään vaikuttavilla lääkkeillä ei ole sopivaa vaihtoehtoa tietylle potilaalle, kerro äidille mahdollisista riskeistä sikiölle. Suorita sarja ultraäänitutkimuksia lapsivesiympäristön arvioimiseksi. Jos havaitaan oligohydramnionia, lopeta HYZAAR-hoito, ellei sitä pidetä hengenpelastavana äidille. Sikiötestaus voi olla asianmukaista raskausviikon perusteella. Potilaiden ja lääkäreiden tulee kuitenkin olla tietoisia siitä, että oligohydramnionit saattavat ilmaantua vasta sen jälkeen, kun sikiö on saanut peruuttamattoman vaurion. Tarkkaile tarkasti pikkulapsia, jotka ovat altistuneet kohdussa HYZAAR 12,5 mg:lle hypotension, oligurian ja hyperkalemian vuoksi [ks. Käyttö lapsille ].
Ei havaittu teratogeenisyyttä rotilla tai kaniineilla, joita hoidettiin losartaanikaliumin maksimiannoksella 10 mg/kg/vrk yhdessä 2,5 mg/kg/vrk hydroklooritiatsidin kanssa. Näillä annoksilla losartaanin, sen aktiivisen metaboliitin ja hydroklooritiatsidin vastaavat altistukset (AUC-arvot) kaneissa olivat noin 5, 1,5 ja 1,0 kertaa suuremmat kuin ihmisillä, jotka saavutetaan käyttämällä 100 mg losartaania yhdessä 25 mg:n hydroklooritiatsidin kanssa. Losartaanin, sen aktiivisen metaboliitin ja hydroklooritiatsidin AUC-arvot, jotka on ekstrapoloitu tiedoista, jotka on saatu rotille annetulla losartaanilla annoksella 50 mg/kg/vrk yhdessä 12,5 mg/kg/vrk hydroklooritiatsidin kanssa, olivat noin 6, 2 ja 2 kertaa suurempi kuin ihmisillä saavutettu 100 mg:lla losartaania yhdessä 25 mg:n kanssa hydroklooritiatsidia. Rotilla havaittiin sikiötoksisuutta, joka osoitti ylimääräisten kylkiluiden lievää lisääntymistä, kun naaraita hoidettiin ennen tiineyttä ja koko tiineyden ajan losartaanilla 10 mg/kg/vrk yhdessä 2,5 mg/kg/vrk hydroklooritiatsidin kanssa. Kuten myös pelkällä losartaanilla tehdyissä tutkimuksissa havaittiin, haitallisia vaikutuksia sikiöön ja vastasyntyneeseen, mukaan lukien painon lasku, munuaistoksisuus ja kuolleisuus, ilmeni, kun tiineitä rottia hoidettiin myöhäisen tiineyden ja/tai imetyksen aikana losartaanilla 50 mg/kg/vrk yhdessä 12,5 mg/kg/vrk hydroklooritiatsidia. Losartaanin, sen aktiivisen metaboliitin ja hydroklooritiatsidin vastaavat AUC-arvot olivat näillä annoksilla rotilla noin 35, 10 ja 10 kertaa suuremmat kuin ihmisillä, jotka saavutetaan annettaessa 100 mg losartaania yhdessä 25 mg:n hydroklooritiatsidin kanssa. Kun hydroklooritiatsidia annettiin ilman losartaania raskaana oleville hiirille ja rotille niiden merkittävien organogeneesijaksojen aikana annoksina 3 000 ja 1 000 mg/kg/vrk, sikiölle aiheutuvaa haittaa ei havaittu.
Tiatsidit läpäisevät istukan ja näkyvät napanuoraveressä. On olemassa sikiön tai vastasyntyneen keltaisuuden, trombosytopenian ja mahdollisesti muiden aikuisilla esiintyneiden haittavaikutusten riski.
Imettävät äidit
Ei tiedetä, erittyykö losartaani äidinmaitoon, mutta merkittäviä määriä losartaania ja sen aktiivista metaboliittia on osoitettu olevan rotan maidossa. Tiatsideja erittyy äidinmaitoon. Imettävälle lapselle mahdollisesti kohdistuvien haittavaikutusten vuoksi on päätettävä, lopetetaanko imetys vai lääkkeen käyttö, ottaen huomioon lääkkeen merkitys äidille.
Käyttö lapsille
HYZAARin turvallisuutta ja tehoa lapsipotilailla ei ole varmistettu.
Vastasyntyneet, jotka ovat aiemmin altistuneet HYZAARille
Jos esiintyy oliguriaa tai hypotensiota, kiinnitä huomiota verenpaineen ja munuaisten perfuusion tukemiseen. Vaihtosiirto tai dialyysi saattaa olla tarpeen hypotension kumoamiseksi ja/tai munuaisten häiriön korvaamiseksi.
Geriatrinen käyttö
Kontrolloidussa kliinisessä tutkimuksessa sydän- ja verisuoniperäisen kuoleman, aivohalvauksen ja sydäninfarktin yhteisriskin vähentämiseksi hypertensiivisillä potilailla, joilla oli vasemman kammion liikakasvua, 2857 potilasta (62 %) oli vähintään 65-vuotiaita ja 808 potilasta (18 %) 75-vuotiaita. ja yli. Verenpaineen hallitsemiseksi tässä tutkimuksessa potilaille annettiin samanaikaisesti losartaania ja hydroklooritiatsidia 74 % tutkimuslääkkeen kokonaisajasta. Näiden potilaiden ja nuorempien potilaiden välillä ei havaittu yleisiä eroja tehokkuudessa. Haittatapahtumat olivat jonkin verran yleisempiä vanhuksilla kuin ei-iäkkäillä potilailla sekä losartaanihydroklooritiatsidi- että kontrolliryhmissä [ks. KLIININEN FARMAKOLOGIA ].
Rotu
Losartan Intervention For Endpoint Reduction in hypertension (LIFE) -tutkimuksessa mustaihoisilla potilailla, joilla oli hypertensio ja vasemman kammion hypertrofia ja joita hoidettiin atenololilla, oli pienempi aivohalvauksen riski, joka on ensisijainen yhdistetty päätetapahtuma, verrattuna mustaihoisilla potilailla, joita hoidettiin losartaanilla (molempia hoidettiin samanaikaisesti hydroklooritiatsidilla). suurimmalla osalla potilaista). Mustaihoisten potilaiden alaryhmässä (n=533, 6 % LIFE-tutkimuksen potilaista) oli 29 ensisijaista päätetapahtumaa 263 atenololia saaneen potilaan joukossa (11 %, 26 per 1000 potilasvuotta) ja 46 ensisijaista päätetapahtumaa 270 potilaan joukossa (17). %, 42/1000 potilasvuotta) losartaanilla. Tätä havaintoa ei voitu selittää muiden populaatioiden kuin rodun eroilla tai hoitoryhmien välisillä epätasapainoilla. Lisäksi verenpaineen lasku molemmissa hoitoryhmissä oli yhdenmukainen mustien ja muiden potilaiden välillä. Koska suurissa kokeissa on vaikea tulkita alajoukkojen eroja, ei voida tietää, johtuuko havaittu ero sattumasta. LIFE-tutkimus ei kuitenkaan tarjoa näyttöä siitä, että losartaanin edut sydän- ja verisuonitapahtumien riskin vähentämisessä verenpainepotilailla, joilla on vasemman kammion liikakasvu, pätevät mustaihoisille potilaille [ks. KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
HYZAAR 12,5 mg -hoidon aloittamista ei suositella potilaille, joilla on maksan vajaatoiminta, koska sopivaa losartaanin aloitusannosta, 25 mg, ei ole saatavilla.
Munuaisten vajaatoiminta
Muutoksia munuaisten toiminnassa on raportoitu herkillä yksilöillä [ks ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET , ja KLIININEN FARMAKOLOGIA ]. HYZAARin turvallisuutta ja tehoa potilailla, joilla on vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma
YLIANNOSTUS
Losartaanikalium
Merkittävää kuolleisuutta havaittiin hiirillä ja rotilla, kun suun kautta annettiin 1000 mg/kg ja 2000 mg/kg, vastaavasti, noin 44 ja 170 kertaa suurin suositeltu ihmisannos mg/m-pohjalta.
Yliannostuksista ihmisillä on saatavilla rajoitetusti tietoa. Yliannostuksen todennäköisin ilmentymä olisi hypotensio ja takykardia; bradykardia voi johtua parasympaattisesta (vagaalisesta) stimulaatiosta. Jos oireista hypotensiota ilmenee, tukihoitoa tulee aloittaa.
Losartaania tai sen aktiivista metaboliittia ei voida poistaa hemodialyysillä.
Hydroklooritiatsidi
Hydroklooritiatsidin oraalinen LD on yli 10 g/kg sekä hiirillä että rotilla. Yleisimmät havaitut merkit ja oireet ovat elektrolyyttivajauksesta (hypokalemia, hypokloremia, hyponatremia) ja liiallisesta diureesista johtuvasta nestehukasta johtuvat oireet. Jos myös digitalista on annettu, hypokalemia voi pahentaa sydämen rytmihäiriöitä. Sitä, missä määrin hydroklooritiatsidi poistuu hemodialyysillä, ei ole varmistettu.
VASTA-AIHEET
HYZAAR 12,5 mg on vasta-aiheinen:
- Potilaille, jotka ovat yliherkkiä jollekin tämän tuotteen aineosalle.
- Anuriasta kärsivillä potilailla
- Yhteiseen käyttöön aliskireenin kanssa diabetespotilaille
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Losartaanikalium
Angiotensiini II [muodostuu angiotensiini I:stä angiotensiiniä konvertoivan entsyymin (ACE, kininaasi II) katalysoimassa reaktiossa], on voimakas verisuonia supistava aine, reniini-angiotensiinijärjestelmän primaarinen vasoaktiivinen hormoni ja tärkeä komponentti verenpainetaudin patofysiologiassa. Se myös stimuloi aldosteronin eritystä lisämunuaiskuoressa. Losartaani ja sen pääasiallinen aktiivinen metaboliitti estävät angiotensiini II:n verisuonia supistavia ja aldosteronia erittävät vaikutukset estämällä selektiivisesti angiotensiini II:n sitoutumisen AT1-reseptoriin, jota esiintyy monissa kudoksissa (esim. verisuonten sileässä lihaksessa, lisämunuaisessa). Monissa kudoksissa on myös AT2-reseptoria, mutta sen ei tiedetä liittyvän kardiovaskulaariseen homeostaasiin. Losartaanilla tai sen pääasiallisella aktiivisella metaboliitilla ei ole osittaista agonistivaikutusta AT1-reseptoriin, ja molemmilla on paljon suurempi affiniteetti (noin 1000-kertainen) AT1-reseptoriin kuin AT2-reseptoriin. In vitro -sitoutumistutkimukset osoittavat, että losartaani on palautuva, kilpaileva AT1-reseptorin estäjä. Aktiivinen metaboliitti on 10–40 kertaa voimakkaampi painon mukaan kuin losartaani, ja se näyttää olevan palautuva, ei-kilpaileva AT1-reseptorin estäjä.
Losartaani tai sen aktiivinen metaboliitti eivät estä ACE:tä (kininaasi II, entsyymi, joka muuttaa angiotensiini I:n angiotensiini II:ksi ja hajottaa bradykiniiniä), eivätkä ne sitoudu tai estä muita hormonireseptoreja tai ionikanavia, joiden tiedetään olevan tärkeitä kardiovaskulaarisessa säätelyssä.
Hydroklooritiatsidi
Hydroklooritiatsidi on tiatsididiureetti. Tiatsidit vaikuttavat elektrolyyttien takaisinabsorption munuaisten tubulusmekanismeihin ja lisäävät suoraan natriumin ja kloridin erittymistä suunnilleen vastaavina määrinä. Hydroklooritiatsidin diureettinen vaikutus vähentää epäsuorasti plasman tilavuutta, minkä seurauksena plasman reinaktiivisuus lisääntyy, aldosteronin eritys lisääntyy, virtsan kaliumhäviö lisääntyy ja seerumin kaliumpitoisuus vähenee. Angiotensiini II välittää reniini-aldosteroniyhteyttä, joten angiotensiini II -reseptorin antagonistin samanaikainen antaminen pyrkii kumoamaan näihin diureetteihin liittyvän kaliumhäviön. Tiatsidien verenpainetta alentavan vaikutuksen mekanismia ei tunneta.
Farmakodynamiikka
Losartaanikalium
Losartaani estää angiotensiini II:n (sekä angiotensiini I:n) infuusioiden painetta alentavaa vaikutusta. 100 mg:n annos estää painetta aiheuttavan vaikutuksen huipussaan noin 85 %, ja 25-40 % esto jatkuu 24 tuntia. Angiotensiini II:n negatiivisen palautteen poistaminen aiheuttaa plasman reniiniaktiivisuuden kaksin- tai kolminkertaistamisen ja sen seurauksena angiotensiini II:n plasmapitoisuuden nousun hypertensiivisillä potilailla. Losartaani ei vaikuta bradykiniinivasteeseen, kun taas ACE:n estäjät lisäävät vastetta tobradykiniinille. Plasman aldosteronipitoisuudet laskevat losartaanin annon jälkeen. Huolimatta losartaanin vaikutuksesta aldosteronin eritykseen, havaittiin hyvin vähän vaikutusta seerumin kaliumpitoisuuteen.
Losartaanin vaikutus ilmenee olennaisesti viikossa, mutta joissakin tutkimuksissa maksimaalinen vaikutus saavutettiin 3-6 viikossa. Pitkäaikaisissa seurantatutkimuksissa (outplacebo-kontrollilla) losartaanin vaikutus näytti jatkuvan jopa vuoden ajan. Losartaanin äkillisen lopettamisen jälkeen ei ole ilmeistä rebound-vaikutusta. Kontrolloiduissa tutkimuksissa losartaanilla hoidetuilla potilailla keskimääräisessä sykkeessä ei havaittu oleellisesti muutoksia.
Hydroklooritiatsidi
Hydroklooritiatsidin oraalisen annon jälkeen diureesi alkaa 2 tunnin kuluessa, saavuttaa huippunsa noin 4 tunnissa ja kestää noin 6-12 tuntia.
Huumeiden vuorovaikutukset
Hydroklooritiatsidi
Alkoholi, barbituraatit tai huumeet - ortostaattinen hypotensio voi voimistua.
Muut verenpainelääkkeet - lisävaikutusta tai tehostamista.
Luuston lihasrelaksantit, ei-depolarisoivat (esim. tubokurariini) - mahdollinen lisääntynyt vaste lihasrelaksantille.
Kortikosteroidit, ACTH tai glysyrritsiini (löytyy lakritsista) - lisääntynyt elektrolyyttivajaus, erityisesti hypokalemia.
Painetta aiheuttavat amiinit (esim. norepinefriini) - mahdollinen heikentynyt vaste paineamiineille, mutta se ei riitä estämään niiden käyttöä.
Farmakokinetiikka
Losartaanikalium
Imeytyminen
Oraalisen annon jälkeen losartaani imeytyy hyvin ja käy läpi merkittävän ensikierron metabolian. Losartaanin systeeminen hyötyosuus on noin 33 %. Losartaanin ja sen aktiivisen metaboliitin keskimääräiset huippupitoisuudet saavutetaan 1 tunnissa ja vastaavasti 3-4 tunnissa. Vaikka losartaanin ja sen aktiivisen metaboliitin plasman maksimipitoisuudet ovat suunnilleen samat, metaboliitin AUC (käyrän alla oleva pinta-ala) on noin 4 kertaa losartaanin vastaava. Ateria hidastaa losartaanin imeytymistä ja alentaa sen Cmax max -arvoa, mutta sillä on vain vähäinen vaikutus losartaanin AUC-arvoon tai metaboliitin AUC-arvoon (noin 10 %:n lasku). Losartaanin ja sen aktiivisen metaboliitin farmakokinetiikka on lineaarinen oraalisilla losartaaniannoksilla aina 200 mg:aan asti, eivätkä ne muutu ajan myötä.
Jakelu
Losartaanin ja aktiivisen metaboliitin jakautumistilavuus on noin 34 litraa ja vastaavasti 12 litraa. Sekä losartaani että sen aktiivinen metaboliitti sitoutuvat voimakkaasti plasman proteiineihin, pääasiassa albumiiniin, ja plasman vapaat fraktiot ovat 1,3 % ja 0,2 %. Sitoutuminen plasman proteiineihin on vakio suositelluilla annoksilla saavutetulla pitoisuusalueella. Rotilla tehdyt tutkimukset osoittavat, että losartaani läpäisee veri-aivoesteen huonosti, jos ollenkaan.
Aineenvaihdunta
Losartaani on oraalisesti vaikuttava aine, joka metaboloituu merkittävästi sytokromi P450 -entsyymien kautta. Se muuttuu osittain aktiiviseksi karboksyylihappometaboliitiksi, joka on vastuussa suurimmasta osasta losartaanihoidon jälkeisestä angiotensiini II -reseptoriantagonismista. Noin 14 % suun kautta annetusta losartaaniannoksesta muuttuu aktiiviseksi metaboliitiksi. Aktiivisen karboksyylihappometaboliitin lisäksi muodostuu useita inaktiivisia metaboliitteja. In vitro -tutkimukset osoittavat, että sytokromi P450 2C9 ja 3A4 osallistuvat losartaanin biotransformaatioon sen metaboliiteiksi.
Eliminointi
Losartaanin kokonaispuhdistuma plasmasta on noin 600 ml/min ja aktiivisen metaboliitin noin 50 ml/min. Munuaispuhdistuma on noin 75 ml/min ja 25 ml/min. Losartaanin terminaalinen puoliintumisaika on noin 2 tuntia ja metaboliitin noin 6-9 tuntia. Suun kautta annetun losartaanin kerta-annosten jälkeen noin 4 % annoksesta erittyy muuttumattomana virtsaan ja noin 6 % erittyy virtsaan aktiivisena metaboliittina. Sappien erittyminen edistää losartaanin ja sen metaboliittien eliminaatiota. Oraalisen 14C-leimatun losartaanin jälkeen noin 35 % radioaktiivisuudesta erittyy virtsaan ja noin 60 % ulosteeseen. Suonensisäisen 14C-leimatun losartaaniannoksen jälkeen noin 45 % radioaktiivisuudesta erittyy virtsaan ja 50 % ulosteeseen. Losartaani tai sen metaboliitti eivät kerry plasmaan toistuvan kerran vuorokaudessa otettaessa.
Hydroklooritiatsidi
Hydroklooritiatsidi ei metaboloidu, vaan eliminoituu nopeasti munuaisten kautta. Kun plasman pitoisuuksia on seurattu vähintään 24 tuntia, plasman puoliintumisajan on havaittu vaihtelevan 5,6 ja 14,8 tunnin välillä. Vähintään 61 prosenttia suun kautta otetusta annoksesta eliminoituu muuttumattomana 24 tunnin kuluessa. Hydroklooritiatsidi läpäisee istukan mutta ei veri-aivoestettä ja erittyy äidinmaitoon.
Tietyt populaatiot
Geriatria ja sukupuoli
Losartaanin farmakokinetiikkaa on tutkittu vanhuksilla (65-75-vuotiailla) ja molemmilla sukupuolilla. Losartaanin ja sen aktiivisen metaboliitin pitoisuudet plasmassa ovat samankaltaisia iäkkäillä ja nuorilla verenpainepotilailla. Losartaanin pitoisuudet plasmassa olivat noin kaksi kertaa korkeammat verenpainepotilailla naisilla kuin miehillä, mutta aktiivisen metaboliitin pitoisuudet olivat samanlaiset miehillä ja naisilla.
Rotu
Rodusta johtuvia farmakokineettisiä eroja ei ole tutkittu [katso myös Käyttö tietyissä populaatioissa ].
Maksan vajaatoiminta
Kun losartaania annettiin suun kautta potilaille, joilla on lievä tai kohtalainen alkoholiperäinen maksakirroosi, plasman losartaanin ja sen aktiivisen metaboliitin pitoisuudet olivat vastaavasti 5-kertaiset ja noin 1,7 kertaa suuremmat kuin nuorilla vapaaehtoisilla miehillä. Normaaliin koehenkilöihin verrattuna losartaanin plasman kokonaispuhdistuma maksan vajaatoimintaa sairastavilla potilailla oli noin 50 % pienempi ja oraalinen hyötyosuus noin kaksinkertainen. Maksan vajaatoimintapotilaille suositeltua pienempää losartaanin aloitusannosta ei voida antaa HYZAARilla. Sen käyttöä tällaisilla potilailla losartaanin titrauskeinona ei siksi suositella [ks VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Munuaisten vajaatoiminta
Losartaani
Oraalisen annon jälkeen losartaanin ja sen aktiivisen metaboliitin plasmapitoisuudet ja AUC-arvot suurenevat 50–90 % potilailla, joilla on lievä (kreatiniinipuhdistuma 50–74 ml/min) tai kohtalainen (kreatiniinipuhdistuma 30–49 ml/min) munuaisten vajaatoiminta. Tässä tutkimuksessa sekä losartaanin että sen aktiivisen metaboliitin munuaispuhdistuma pieneni 55-85 % potilailla, joilla oli lievä tai kohtalainen munuaisten vajaatoiminta. Losartaania tai sen aktiivista metaboliittia ei voida poistaa hemodialyysillä.
Hydroklooritiatsidi
Oraalisen annon jälkeen hydroklooritiatsidin AUC kasvaa 70 % ja 700 % potilailla, joilla on lievä ja kohtalainen munuaisten vajaatoiminta. Tässä tutkimuksessa hydroklooritiatsidin munuaispuhdistuma pieneni 45 % ja 85 % potilailla, joilla oli lievä ja kohtalainen munuaisten vajaatoiminta.
Käytä tavallisia HYZAAR-hoito-ohjelmia, kunhan potilaan kreatiniinipuhdistuma on yli 30 ml/min. Vaikeaa munuaisten vajaatoimintaa (kreatiniinipuhdistuma alle 30 ml/min) sairastavien potilaiden HYZAAR 12,5 mg:n turvallisuutta ja tehokkuutta ei ole varmistettu [ks. Käyttö tietyissä populaatioissa ].
Huumeiden vuorovaikutukset
Losartaanikalium
Kliinisesti merkittäviä yhteisvaikutuksia losartaanikaliumilla ei ole havaittu tutkimuksissa hydroklooritiatsidin, digoksiinin, varfariinin, simetidiinin ja fenobarbitaalin kanssa. Rifampiinin on kuitenkin osoitettu pienentävän losartaanin ja sen aktiivisen metaboliitin AUC-arvoa 30 % ja 40 %. Flukonatsoli, sytokromiP450 2C9:n estäjä, pienensi aktiivisen metaboliitin AUC-arvoa noin 40 %, mutta lisäsi losartaanin AUC-arvoa noin 70 % toistuvien annosten jälkeen. Ketokonatsoli, joka on P450 3A4:n estäjä, ei vaikuta losartaanin muuttumiseen aktiiviseksi metaboliitiksi suonensisäisen annon jälkeen. Erytromysiini, P450 3A4:n estäjä, ei vaikuttanut aktiivisen metaboliitin AUC-arvoon suun kautta annetun losartaanin jälkeen, mutta losartaanin AUC nousi 30 %.
Losartaanin ja P450 2C9:n estäjien samanaikaisen käytön farmakodynaamisia seurauksia ei ole tutkittu. Potilailla, jotka eivät metaboloi losartaania aktiiviseksi metaboliitiksi, on osoitettu olevan spesifinen, harvinainen sytokromi P450 2C9 -vika. Nämä tiedot viittaavat siihen, että losartaanin muuttuminen aktiiviseksi metaboliitiksi tapahtuu ensisijaisesti P450 2C9:n eikä P450 3A4:n välityksellä.
Kliiniset tutkimukset
Losartaanimonoterapia
Aivohalvauksen riskin vähentäminen
LIFE-tutkimus oli monikansallinen kaksoissokkotutkimus, jossa verrattiin losartaania ja atenololia 9 193 verenpainepotilaalla, joilla oli EKG-dokumentoitu vasemman kammion hypertrofia. Potilaat, joilla oli sydäninfarkti tai aivohalvaus kuuden kuukauden aikana ennen satunnaistamista, suljettiin pois. Potilaat satunnaistettiin saamaan kerran vuorokaudessa 50 mg losartaania tai 50 mg atenololia. Jos tavoiteverenpainetta (
Verenpaineen kontrolloimiseksi LIFE-tutkimuksen molempien ryhmien potilaille annettiin samanaikaisesti hydroklooritiatsidia suurimman osan ajasta, jolloin he käyttivät tutkimuslääkettä (73,9 % ja 72,4 % päivistä losartaani- ja atenololihaaroissa, vastaavasti).
Satunnaistetuista potilaista 4963 (54 %) oli naisia ja 533 (6 %) mustia. Keski-ikä oli 67 vuotta ja 5704 (62 %) ikä ≥65. Lähtötilanteessa 1195:llä (13 %) oli diabetes, 1326:lla (14 %) oli eristetty systolinen verenpaine, 1469:llä (16 %) sepelvaltimotauti ja 728:lla (8 %) aivoverisuonitauti. Lähtötason keskimääräinen verenpaine oli 174/98 mmHg molemmissa hoitoryhmissä. Keskimääräinen seuranta-aika oli 4,8 vuotta. Tutkimuksen lopussa tai viimeisellä käynnillä ennen ensisijaista päätetapahtumaa 77 % losartaanilla hoidetusta ryhmästä ja 73 % atenololilla hoidetusta ryhmästä käytti edelleen tutkimuslääkitystä. Tutkimuslääkitystä edelleen käyttävistä potilaista losartaanin ja atenololin keskimääräiset annokset olivat molemmat noin 80 mg/vrk ja 15 % käytti atenololia tai losartaania monoterapiana, kun taas 77 % sai myös hydroklooritiatsidia (keskimääräisenä annoksena 20 mg/vrk jokainen ryhmä). Alimmalla tasolla mitattu verenpaineen lasku oli samanlainen molemmissa hoitoryhmissä, mutta verenpainetta ei mitattu mihinkään muuhun aikaan päivästä. Tutkimuksen lopussa tai viimeisellä käynnillä ennen ensisijaista päätetapahtumaa keskimääräiset verenpaineet olivat 144,1/81,3 mmHg losartaanilla hoidetulla ryhmällä ja 145,4/80,9 mmHg atenololilla hoidetulla ryhmällä [ero verenpaineessa 1,3 mmHg merkitsevä (p
Ensisijainen päätetapahtuma oli ensimmäinen sydän- ja verisuoniperäinen kuolemantapaus, ei-kuolemaan johtanut aivohalvaus tai ei-fataali sydäninfarkti. Potilaat, joilla oli ei-kuolemaan johtavia tapahtumia, jäivät tutkimukseen, joten jokaisen tyypin ensimmäinen tapahtuma tutkittiin, vaikka se ei olisi ensimmäinen tapahtuma (esim. aivohalvauksen analyysissä laskettaisiin aivohalvaus ensimmäisen sydäninfarktin jälkeen) . Losartaanihoito pienensi ensisijaisen päätetapahtuman riskiä 13 % (p=0,021) atenololiryhmään verrattuna; tämä ero johtui ensisijaisesti vaikutuksesta kohtalokkaaseen ja ei-kuolemaan johtavaan aivohalvaukseen. Losartaanihoito vähensi aivohalvauksen riskiä 25 % verrattuna atenololiin (p=0,001).
Losartaanikaliumhydroklooritiatsidi
Kolmessa kontrolloidussa losartaanin ja hydroklooritiatsidin tutkimuksessa yli 1 300 potilasta arvioi eri losartaaniannosten (25, 50 ja 100 mg) ja samanaikaisen hydroklooritiatsidin (6,25, 12,5 ja 25 mg) verenpainetta alentavaa tehoa. Tekijätutkimuksessa verrattiin losartaanin/hydroklooritiatsidin 50/12,5 mg yhdistelmää sen aineosien ja lumelääkkeen kanssa. Losartaanin/hydroklooritiatsidin yhdistelmä 50/12,5 mg johti suunnilleen additiiviseen lumelääkekorjattuun systoliseen/diastoliseen vasteeseen (15,5/9,0 mmHg yhdistelmällä verrattuna 8,5/5,0 mmHg pelkkää losartaania ja 7,0/3,0 mmHg hydroklooritiatsidia yksinään). Toisessa tutkimuksessa tutkittiin eri hydroklooritiatsidiannosten (6,25, 12,5 ja 25 mg) tai lumelääkkeen annos-vastesuhdetta losartaanin (50 mg) taustalla potilailla, joita ei saatu riittävästi hallintaan (istuva diastolinen verenpaine [SiDBP] 93-120 mmHg) losartaania (50 mg) yksinään. Kolmannessa tutkimuksessa tutkittiin eri losartaaniannosten (25, 50 ja 100 mg) tai lumelääkkeen annos-vastesuhdetta hydroklooritiatsidin (25 mg) taustalla potilailla, jotka eivät saaneet riittävästi hallintaa (SiDBP93-120 mmHg) hydroklooritiatsidilla (25 mg). yksin. Nämä tutkimukset osoittivat lisätyn verenpainetta alentavan vasteen alimmillaan (24 tuntia annostelun jälkeen), kun hydroklooritiatsidia 12,5 tai 25 mg lisättiin 50 mg:aan losartaania 5,5/3,5 ja 10,0/6,0 mmHg. Vastaavasti lisääntyi verenpainetta alentava vaste, kun losartaania 50 mg tai 100 mg lisättiin 25 mg:aan hydroklooritiatsidia 9,0/5,5 ja 12,5/6,5 mmHg. Sykeen ei ollut merkittävää vaikutusta.
Vasteessa ei ollut eroa miehillä ja naisilla tai yli 65-vuotiailla tai alle 65-vuotiailla potilailla.
Mustaihoisten potilaiden vaste hydroklooritiatsidille oli suurempi kuin ei-mustaihoisilla ja pienempi vaste losartaanilla. Yleinen vaste yhdistelmälle oli samanlainen mustaihoisilla ja muilla potilailla.
Vaikea verenpaine (SiDBP ≥ 110 mmHg)
HYZAARin turvallisuutta ja tehoa vaikean verenpainetaudin alkuhoitona (määritelty keskimääräiseksi SiDBP:ksi ≥ 110 mmHg, joka vahvistettiin kahdessa eri yhteydessä koko verenpainelääkityksen jälkeen) tutkittiin kuuden viikon kaksoissokkoutetussa, satunnaistetussa monikeskustutkimuksessa. Potilaat satunnaistettiin saamaan joko losartaania ja hydroklooritiatsidia (50/12,5 mg, kerran vuorokaudessa) tai losartaania (50 mg, kerran vuorokaudessa), ja niitä seurattiin verenpainevasteen suhteen. Potilaat titrattiin 2 viikon välein, jos heidän SiDBP:nsä ei saavuttanut tavoitetta (
Tutkimukseen osallistui 585 potilasta, joista 264 (45 %) naista, 124 (21 %) mustaa ja 21 (4 %) yli 65-vuotiasta. Keskimääräinen verenpaine lähtötilanteessa koko väestölle oli 171/113 mmHg. Keski-ikä oli 53 vuotta. Neljän viikon hoidon jälkeen keskimääräinen SiDBP oli 3,1 mmHg pienempi ja keskimääräinen SiSBP 5,6 mmHg heleämpi HYZAARilla hoidetussa ryhmässä. Tämän seurauksena suurempi osa potilaista, jotka saivat HYZAAR 12,5 mg:n, saavutti tavoitediastolisen verenpaineen (17,6 % HYZAAR 12,5 mg:lla, 9,4 % losartaanilla; p = 0,006). Samanlaisia suuntauksia havaittiin, kun potilaat ryhmiteltiin sukupuolen, rodun tai iän mukaan (
Kuuden viikon hoidon jälkeen useammat yhdistelmähoitoa saaneet potilaat saavuttivat tavoitediastolisen verenpaineen kuin monoterapiahoitoa saaneet (29,8 % vs. 12,5 %).
POTILASTIEDOT
HYZAAR® (HY-zar) (losartaanikalium- ja hydroklooritiatsiditabletit) 50/12,5 mg, 100/12,5 mg, 100/25 mg
Lue HYZAAR ® -valmisteen mukana tulevat potilastiedot ennen kuin aloitat sen ottamisen ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Tämä pakkausseloste ei korvaa sitä, että keskustelet lääkärisi kanssa tilastasi ja hoidostasi.
Mikä on tärkein tieto, joka minun pitäisi tietää HYZAARista?
- HYZAAR voi aiheuttaa vahinkoa tai kuoleman sikiölle.
- Keskustele lääkärisi kanssa muista tavoista alentaa verenpainettasi, jos suunnittelet raskautta.
- Jos tulet raskaaksi HYZAAR 12,5 mg -hoidon aikana, kerro siitä heti lääkärillesi.
Mikä on HYZAAR 12,5 mg?
HYZAAR 12,5 mg sisältää 2 reseptilääkettä, angiotensiinireseptorin salpaajan (ARB) ja diureetin (vesipilleri). Sitä käytetään:
- alentaa korkeaa verenpainetta (hypertensio). HYZAAR ei yleensä ole ensimmäinen korkean verenpaineen hoitoon käytettävä lääke.
- vähentää aivohalvauksen mahdollisuutta potilailla, joilla on korkea verenpaine ja sydänongelma, jota kutsutaan vasemman kammion hypertrofiaksi (LVH). HYZAAR ei ehkä auta mustia potilaita tämän ongelman kanssa.
HYZAARia ei ole tutkittu alle 18-vuotiailla lapsilla.
Korkea verenpaine (hypertensio). Verenpaine on voima verisuonissasi, kun sydämesi lyö ja kun sydämesi lepää. Sinulla on korkea verenpaine, kun voimaa on liikaa. HYZAAR 12,5 mg:n losartaaniaine voi auttaa verisuonia rentoutumaan, jolloin verenpaineesi laskee. Gredientin HYZAARin sisältämä hydroklooritiatsidi vaikuttaa saamalla munuaisesi kuljettamaan enemmän vettä ja suolaa.
Vasemman kammion hypertrofia (LVH) on sydämen vasemman kammion (sydämen pääpumppauskammion) seinämien laajennus. LVH voi johtua useista asioista. Korkea verenpaine on LVH:n yleisin syy.
Kuka ei saa ottaa HYZAARia?
Älä ota HYZAAR 12,5 mg -valmistetta, jos:
- olet allerginen jollekin HYZAARin ainesosalle. Katso täydellinen luettelo HYZAARin ainesosista tämän pakkausselosteen lopusta.
- eivät virtsaa.
- sinulla on diabetes ja käytät aliskireeni-nimistä lääkettä alentamaan verenpainetta.
Mitä minun pitäisi kertoa lääkärilleni ennen HYZAARin ottamista?
Kerro lääkärillesi kaikista sairauksistasi, mukaan lukien jos:
- olet raskaana tai suunnittelet raskautta. Katso "Mikä on tärkein tieto, joka minun pitäisi tietää HYZAARista?"
- imetät tai aiot imettää. HYZAAR voi erittyä maitoon ja vahingoittaa vauvaasi. Sinun ja lääkärisi tulee päättää, otatko HYZAARia vai imetätkö. Sinun ei pitäisi tehdä molempia.
- olet oksentanut (oksennut), sinulla on ripuli, hikoillut paljon tai juonut liian vähän nesteitä. Nämä voivat aiheuttaa verenpaineen laskua.
- sinulla on maksaongelmia
- on munuaisongelmia
- sinulla on systeeminen lupus erythematosus (SLE)
- on diabetes
- on kihti
- onko allergioita
- sinulla on ollut ihosyöpä tai jos sinulle kehittyy uusi ihovaurio hoidon aikana. Hydroklooritiatsidihoito saattaa lisätä joidenkin ihosyöpien (ei-melanooma-ihosyöpä) riskiä. Keskustele lääkärisi kanssa, kuinka suojata ihoasi auringolta ja kuinka usein sinun tulee käydä ihosyövän seulonnassa.
Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät.
HYZAAR 12,5 mg ja tietyt muut lääkkeet voivat olla yhteisvaikutuksia keskenään. Kerro lääkärillesi erityisesti, jos käytät:
- kaliumlisät
- kaliumia sisältävät suolan korvikkeet
- muut lääkkeet, jotka voivat lisätä seerumin kaliumpitoisuutta
- vesipillerit (diureetit)
- litium (tietynlaisen masennuksen hoitoon käytettävä lääke)
- lääkkeet, joita käytetään kivun ja niveltulehduksen hoitoon, joita kutsutaan ei-steroidisiksi tulehduskipulääkkeiksi (NSAID), mukaan lukien COX-2-estäjät
- muut verenpainetta alentavat lääkkeet.
Tunne käyttämäsi lääkkeet. Pidä luetteloa lääkkeistäsi ja näytä se lääkärillesi ja apteekkiin, kun hankit uuden lääkkeen.
Miten minun pitäisi ottaa HYZAAR 12,5 mg?
- Ota HYZAAR 12,5 mg juuri sen verran kuin lääkärisi on määrännyt. Lääkärisi voi muuttaa annostasi tarvittaessa.
- HYZAAR voidaan ottaa ruuan kanssa tai ilman.
- Jos unohdat ottaa annoksen, ota se heti kun muistat. Jos se on lähellä seuraavaa annostasi, älä ota unohtunutta annosta. Ota vain seuraava annos normaaliin aikaan.
- Jos otat liikaa HYZAAR 12,5 mg -valmistetta, ota välittömästi yhteyttä lääkäriin tai Myrkytystietokeskukseen tai mene lähimmän sairaalan ensiapuun.
- Lääkärisi saattaa tehdä verikokeita ajoittain HYZAAR-hoidon aikana.
Mitkä ovat HYZAARin mahdolliset sivuvaikutukset?
HYZAAR voi aiheuttaa seuraavia haittavaikutuksia, jotka voivat olla vakavia:
- Syntymättömän vauvan loukkaantuminen tai kuolema. Katso "Mikä on tärkein tieto, joka minun pitäisi tietää HYZAARista?"
- Allerginen reaktio. Allergisen reaktion oireita ovat kasvojen, huulten, kurkun tai kielen turvotus. Hae heti ensiapua ja lopeta HYZAARin käyttö.
- Matala verenpaine (hypotensio). Matala verenpaine voi aiheuttaa pyörtymistä tai huimausta. Makaa makuulle, jos tunnet pyörrytystä tai huimausta. Soita lääkärillesi välittömästi.
- Jos sinulla on munuaisongelmia, saatat huomata munuaistesi toiminnan huononevan. Soita lääkärillesi, jos saat turvotusta jaloissasi, nilkoissasi tai käsissäsi tai selittämätöntä painonnousua.
- Uusi tai paheneva tila, jota kutsutaan systeemiseksi lupus erythematosukseksi (Lupus; SLE)
- Silmäongelmat. Yksi HYZAAR 12,5 mg:n lääkkeistä voi aiheuttaa silmäongelmia, jotka voivat johtaa näön menettämiseen, jos niitä ei hoideta. Silmäongelmien oireet voivat ilmaantua tunneista viikkoihin HYZAAR-hoidon aloittamisen jälkeen. Kerro heti lääkärillesi, jos sinulla on:
- näön heikkeneminen
- silmän kipu
- Ihon herkkyys auringolle ja ihosyövän riski.
HYZAAR 12,5 mg:n yleisimmät sivuvaikutukset korkeasta verenpaineesta kärsivillä ovat:
- "vilustuminen" (ylempien hengitysteiden infektio)
- huimaus
- tukkoinen nenä
- selkäkipu
Kerro lääkärillesi, jos saat haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät katoa. Tämä ei ole täydellinen luettelo sivuvaikutuksista. Täydellisen luettelon saat lääkäriltä tai apteekista.
Kuinka minun pitäisi säilyttää HYZAAR 12,5 mg?
- Säilytä HYZAAR huoneenlämmössä 59°F - 86°F (15°C - 30°C).
- Säilytä HYZAAR tiiviisti suljetussa astiassa ja pidä HYZAAR poissa valolta.
- Pidä HYZAAR 12,5 mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa HYZAARista
Lääkkeitä määrätään joskus sairauksiin, joita ei ole mainittu potilasohjeissa. Älä käytä HYZAARia sairauksiin, joihin sitä ei ole määrätty. Älä anna HYZAARia muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tässä pakkausselosteessa on yhteenveto tärkeimmistä HYZAAR-tiedoista. Jos haluat lisätietoja, keskustele lääkärisi kanssa. Voit kysyä apteekista tai lääkäriltäsi tietoja, jotka on kirjoitettu terveydenhuollon ammattilaisille.
Mitä ainesosia HYZAAR sisältää?
Aktiiviset ainesosat: losartaanikalium, hydroklooritiatsidi
Inaktiiviset ainesosat:
mikrokiteinen selluloosa, vesipitoinen laktoosi, esigelatinoitu tärkkelys, magnesiumstearaatti, hydroksipropyyliselluloosa, hypromelloosi, titaanidioksidi. HYZAAR 50/12.5 ja HYZAAR 100/25 sisältävät myös D&C keltaisen nro 10 alumiinilakan.
HYZAAR 50/12.5, HYZAAR 100/12.5 ja HYZAAR 100/25 voivat sisältää myös karnaubavahaa.
