Benicar 10mg, 20mg, 40mg Olmesartan Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Benicar 40mg on ja miten sitä käytetään?
Benicar on reseptilääke, jota käytetään korkean verenpaineen (hypertension) oireiden hoitoon. Benicar 10 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Benicar on angiotensiini II -reseptorin salpaaja tai ARB.
Ei tiedetä, onko Benicar turvallinen ja tehokas alle 6-vuotiaille lapsille.
Mitkä ovat Benicar 40mg:n mahdolliset sivuvaikutukset?
Benicar voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- huimaus
- vähän tai ei ollenkaan virtsaamista
- turvotusta käsissäsi tai jaloissasi
- pahoinvointi
- heikkous
- kihelmöivä tunne
- rintakipu
- nopea tai epäsäännöllinen syke
- liikkeen menetys
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Benicarin yleisimpiä sivuvaikutuksia ovat:
- huimaus
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Benicarin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
SIKIÖN MYRKYLLISYYS
- Kun raskaus havaitaan, lopeta Benicar 40 mg:n käyttö mahdollisimman pian (ks. VAROITUKSET JA VAROTOIMET]
- Lääkkeet, jotka vaikuttavat suoraan reniini-angioteeneihin järjestelmässä, voivat aiheuttaa vamman ja kuoleman kehittyvälle sikiölle [katso VAROITUKSET JA VAROTOIMET]
KUVAUS
Olmesartaanimedoksomiili, aihiolääke, hydrolysoituu olmesartaaniksi imeytyessään maha-suolikanavasta. Olmesartaani on selektiivinen AT1-alatyypin angiotensiini II -reseptorin salpaaja.
Olmesartaanimedoksomiili kuvataan kemiallisesti 2,3-dihydroksi-2-butenyyli-4-(1-hydroksi-1-metyylietyyli)-2-propyyli-1-[p-(o-1H-tetratsol-5-yylifenyyli)bentsyyli]imidatsoli- 5-karboksylaatti, syklinen 2,3-karbonaatti.
Sen empiirinen kaava on C29H30N6O6 ja sen rakennekaava on:
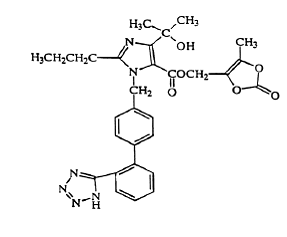
Olmesartaanimedoksomiili on valkoinen tai vaalean kellertävänvalkoinen jauhe tai kiteinen jauhe, jonka molekyylipaino on 558,59. Se on käytännössä liukenematon veteen ja niukkaliukoinen metanoliin. Benicar 20mg on saatavana suun kautta kalvopäällysteisinä tabletteina, jotka sisältävät 5 mg, 20 mg tai 40 mg olmesartaanimedoksomiilia ja seuraavia inaktiivisia aineosia: hydroksipropyyliselluloosa, hypromelloosi, laktoosimonohydraatti, vähän substituoitu hydroksipropyyliselluloosa, magnesiumstearaatti, mikrokrossaaliselluliini , talkki, titaanidioksidi ja (vain 5 mg) keltainen rautaoksidi.
INDIKAATIOT
Benicar 40mg on tarkoitettu korkean verenpaineen hoitoon aikuisille ja yli 6-vuotiaille lapsille verenpaineen alentamiseksi. Verenpaineen alentaminen vähentää kuolemaan johtavien ja ei-kuolemaan johtavien sydän- ja verisuonitapahtumien, erityisesti aivohalvausten ja sydäninfarktien, riskiä. Nämä edut on havaittu kontrolloiduissa tutkimuksissa, joissa on tehty verenpainelääkkeitä useista eri farmakologisista luokista, mukaan lukien luokka, johon tämä lääke pääasiallisesti kuuluu. Ei ole olemassa kontrolloituja tutkimuksia, jotka osoittaisivat riskin vähentämisen Benicarilla.
Korkean verenpaineen hallinnan tulee olla osa kattavaa sydän- ja verisuoniriskin hallintaa, mukaan lukien tarvittaessa lipidien hallinta, diabeteksen hallinta, antitromboottinen hoito, tupakoinnin lopettaminen, liikunta ja rajoitettu natriumin saanti. Monet potilaat tarvitsevat useamman kuin yhden lääkkeen saavuttaakseen verenpainetavoitteensa. Tarkempia neuvoja tavoitteista ja hallinnasta on julkaistuissa ohjeissa, kuten kansallisen korkean verenpaineen koulutusohjelman kansallisen korkean verenpaineen ehkäisy-, havaitsemis-, arviointi- ja hoitokomitean (JNC) ohjeissa.
Lukuisten verenpainetta alentavien lääkkeiden, eri farmakologisista luokista ja eri vaikutusmekanismeista, on osoitettu satunnaistetuissa kontrolloiduissa tutkimuksissa vähentävän sydän- ja verisuonisairauksien sairastuvuutta ja kuolleisuutta, ja voidaan päätellä, että se on verenpainetta alentavaa, eikä muuta lääkettä. lääkkeet, jotka ovat suurelta osin vastuussa näistä eduista. Suurin ja johdonmukaisin kardiovaskulaarinen tulos on ollut aivohalvauksen riskin väheneminen, mutta myös sydäninfarktin ja sydän- ja verisuoniperäisen kuolleisuuden on havaittu vähenevän säännöllisesti.
Kohonnut systolinen tai diastolinen paine lisää kardiovaskulaarista riskiä, ja absoluuttinen riskin nousu mmHg:tä kohti on suurempi korkeammilla verenpaineilla, joten jopa vaatimattomasta vaikean verenpaineen alenemisesta voi olla huomattavaa hyötyä. Suhteellinen riskin pieneneminen verenpaineen laskusta on samanlainen kaikissa populaatioissa, joissa absoluuttinen riski vaihtelee, joten absoluuttinen hyöty on suurempi potilailla, joilla on suurempi riski verenpaineesta riippumatta (esimerkiksi potilaat, joilla on diabetes tai hyperlipidemia), ja tällaisia potilaita odotetaan olevan hyötyä aggressiivisemmasta hoidosta alhaisemman verenpainetavoitteen saavuttamiseksi.
Joillakin verenpainelääkkeillä on pienemmät verenpainevaikutukset (monoterapiana) mustaihoisilla potilailla, ja monilla verenpainelääkkeillä on muita hyväksyttyjä käyttöaiheita ja vaikutuksia (esim. angina pectoris, sydämen vajaatoiminta tai diabeettinen munuaissairaus). Nämä näkökohdat voivat ohjata hoidon valintaa.
Sitä voidaan käyttää yksinään tai yhdessä muiden verenpainetta alentavien aineiden kanssa.
ANNOSTELU JA HALLINNOINTI
Aikuisten hypertensio
Annostus on yksilöitävä. Tavallinen suositeltu Benicar 20 mg:n aloitusannos on 20 mg kerran vuorokaudessa, kun sitä käytetään monoterapiana potilailla, joilla ei ole tilavuussupistusta. Potilaille, jotka tarvitsevat edelleen verenpaineen alentamista 2 viikon hoidon jälkeen, Benicar-annosta voidaan suurentaa 40 mg:aan. Yli 40 mg:n annoksilla ei näytä olevan suurempaa vaikutusta. Annostelu kahdesti vuorokaudessa ei tarjoa etua verrattuna samaan kokonaisannokseen kerran päivässä annettuna.
Potilaille, joiden suonensisäinen tilavuus on mahdollisesti heikentynyt (esim. potilaat, joita hoidetaan diureeteilla, erityisesti munuaisten vajaatoimintaa sairastavat), aloita Benicar-hoito tarkassa lääkärin valvonnassa ja harkitse pienemmän aloitusannoksen käyttöä [ks. VAROITUKSET JA VAROTOIMET ].
Lasten hypertensio (6-vuotiaat ja sitä vanhemmat)
Annostus on yksilöitävä. Lapsille, jotka voivat niellä tabletteja, tavallinen suositeltu Benicar-aloitusannos on 10 mg kerran vuorokaudessa potilaille, jotka painavat 20-
Benicar 10 mg:n käyttöä alle 1-vuotiaille lapsille ei suositella [katso VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Lapsille, jotka eivät pysty nielemään tabletteja, voidaan antaa sama annos käyttämällä ekstemporaalista suspensiota alla kuvatulla tavalla [ks. KLIININEN FARMAKOLOGIA ]. Noudata alla olevia suspension valmistusohjeita antaaksesi Benicar suspensiona.
Suspension valmistus (200 ml:lle 2 mg/ml suspensiota)
Lisää 50 ml puhdistettua vettä kullanruskeaan polyeteenitereftalaatti (PET) -pulloon, joka sisältää kaksikymmentä Benicar 20 mg tablettia ja anna seistä vähintään 5 minuuttia. Ravista säiliötä vähintään 1 minuutin ajan ja anna suspension seistä vähintään 1 minuutin ajan. Toista 1 minuutin ravistelu ja 1 minuutin seisominen vielä neljä kertaa. Lisää 100 ml ORA-Sweet® ja 50 ml ORA-Plus®* suspensioon ja ravista hyvin vähintään 1 minuutin ajan. Suspensio tulee säilyttää jääkaapissa 2–8 °C:ssa ja sitä voidaan säilyttää enintään 4 viikkoa. Ravista suspensiota hyvin ennen jokaista käyttöä ja palauta se välittömästi jääkaappiin.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
- 5 mg keltaisia, pyöreitä, kalvopäällysteisiä, jakouurteettomia tabletteja, joiden toisella puolella on kaiverrus Sankyo ja toisella puolella C12
- 20 mg valkoiset, pyöreät, kalvopäällysteiset, jakouurteiset tabletit, joiden toisella puolella on Sankyo ja toisella puolella C14
- 40 mg valkoinen, soikea, kalvopäällysteinen, jakouurteellinen tabletti, jonka toisella puolella on kaiverrus Sankyo ja toisella puolella C15
Varastointi ja käsittely
Benicar toimitetaan keltaisina, pyöreinä, kalvopäällysteisinä, jakouurteettomana tabletteina, jotka sisältävät 5 mg olmesartaanimedoksomiilia, valkoisina, pyöreinä, kalvopäällysteisinä, uurrettamattomina tabletteina, jotka sisältävät 20 mg olmesartaanimedoksomiilia, ja valkoisina, soikeina tabletteina. , kalvopäällysteiset, jakouurteettomat tabletit, jotka sisältävät 40 mg olmesartaanimedoksomiilia. Tableteissa on 5, 20 ja 40 mg:n tablettien toisella puolella merkintä Sankyo ja toisella puolella C12, C14 tai C15.
Tabletit toimitetaan seuraavasti:
Varastointi
Säilytä 20–25 °C:ssa (68–77 °F) [katso USP:n valvoma huonelämpötila].
Valmistettu Daiichi Sankyo, Inc:lle, Basking Ridge, NJ 07920. Tarkistettu: lokakuu 2019
SIVUVAIKUTUKSET
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset tehdään hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutusten määrää ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Aikuisten hypertensio
Benicarin turvallisuutta on arvioitu yli 3 825 potilaalla/henkilöllä, mukaan lukien yli 3 275 potilasta, joita hoidettiin verenpaineen vuoksi kontrolloiduissa tutkimuksissa. Tämä kokemus sisälsi noin 900 potilasta, joita hoidettiin vähintään 6 kuukautta ja yli 525 potilasta vähintään vuoden ajan. Tapahtumat olivat yleensä lieviä, ohimeneviä eikä niillä ollut yhteyttä Benicar-annokseen.
Sukupuoli-, ikä- ja roturyhmien analyysi ei osoittanut eroja Benicar 40 mg:n ja lumelääkettä saaneiden potilaiden välillä. Haittavaikutuksista johtuvien keskeytysten määrä oli kaikissa hypertensiopotilailla tehdyissä tutkimuksissa 2,4 % (eli 79/3278) Benicar 40 mg:lla hoidetuista potilaista ja 2,7 % (ts. 32/1179) vertailupotilaista. Lumekontrolloiduissa tutkimuksissa ainoa haittavaikutus, joka esiintyi yli 1 %:lla Benicar 20 mg:lla hoidetuista potilaista ja suurempi esiintyvyys kuin lumelääkettä saaneilla, oli huimaus (3 % vs. 1 %).
Kasvojen turvotus raportoitiin viidellä Benicaria saaneella potilaalla. Angioedeemaa on raportoitu angiotensiini II -antagonistien käytön yhteydessä.
Lasten hypertensio
Merkittäviä eroja ei havaittu 1–16-vuotiaiden lapsipotilaiden haittakokemusprofiilin ja aikuispotilaiden aiemmin raportoitujen haittavaikutusten profiilin välillä.
Markkinoinnin jälkeinen kokemus
Seuraavia haittavaikutuksia on raportoitu markkinoille tulon jälkeen. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Keho kokonaisuutena: Astenia, angioödeema, anafylaktiset reaktiot
Ruoansulatuskanava: Oksentelu, spruen kaltainen enteropatia [katso VAROITUKSET JA VAROTOIMET ]
Aineenvaihdunta- ja ravitsemushäiriöt: Hyperkalemia
Tuki- ja liikuntaelimistö: Rabdomyolyysi
Urogenitaaljärjestelmä: Akuutti munuaisten vajaatoiminta, kohonnut veren kreatiniinipitoisuus
Iho ja lisäkkeet: Hiustenlähtö, kutina, urtikaria
Tiedot yhdestä kontrolloidusta tutkimuksesta ja epidemiologisesta tutkimuksesta ovat osoittaneet, että suuriannoksinen olmesartaani saattaa lisätä sydän- ja verisuonisairauksien riskiä diabeetikoilla, mutta kokonaistiedot eivät ole vakuuttavia. Satunnaistetussa, lumekontrolloidussa kaksoissokkoutetussa ROADMAP-tutkimuksessa (Randomized Olmesartan And Diabetes MicroAlbuminuria Prevention trial, n=4447) tarkasteltiin olmesartaanin käyttöä 40 mg päivässä vs. lumelääke potilailla, joilla oli tyypin 2 diabetes, normoalbuminuria ja vähintään yksi lisäriskitekijä CV-sairaudelle. Tutkimus saavutti ensisijaisen päätetapahtumansa, viivästyneen mikroalbuminurian alkamisen, mutta olmesartaanilla ei ollut suotuisaa vaikutusta glomerulusfiltraationopeuden (GFR) laskuun. Olmesartaaniryhmässä havaittiin kohonnut sydän- ja verisuonitautikuolleisuus (arvioitu äkillinen sydänkuolema, kuolemaan johtava sydäninfarkti, kuolemaan johtava aivohalvaus, revaskularisaatiokuolema) plaseboryhmään verrattuna (15 olmesartaania vs. 3 lumelääkettä, HR 4,9, 95 %:n luottamusväli [CI ], 1,4, 17), mutta ei-kuolemaan johtavan sydäninfarktin riski oli pienempi olmesartaanilla (HR 0,64, 95 % CI 0,35, 1,18).
Epidemiologiseen tutkimukseen osallistui 65-vuotiaita ja sitä vanhempia potilaita, joiden kokonaisaltistus oli > 300 000 potilasvuotta. Diabeettisten potilaiden alaryhmässä, jotka saivat suuria annoksia olmesartaania (40 mg/d) yli 6 kuukauden ajan, kuolinriski näytti olevan lisääntynyt (HR 2,0, 95 % CI 1,1, 3,8) verrattuna vastaaviin potilaisiin, jotka käyttivät muita angiotensiinireseptorin salpaajat. Sitä vastoin suurten olmesartaaniannosten käyttöön ei-diabeettisilla potilailla näytti liittyvän pienempään kuolinriskiin (HR 0,46, 95 % CI 0,24, 0,86) verrattuna vastaaviin potilaisiin, jotka käyttivät muita angiotensiinireseptorin salpaajia. Eroja ei havaittu ryhmien välillä, jotka saivat pienempiä olmesartaaniannoksia verrattuna muihin angiotensiinisalpaajiin tai jotka saivat hoitoa
Kaiken kaikkiaan nämä tiedot herättävät huolta mahdollisesta lisääntyneestä sydän- ja verisuonitautiriskistä, joka liittyy suurten olmesartaaniannosten käyttöön diabeetikoilla. Lisääntyneen sydän- ja verisuonitautiriskin löydön uskottavuus herättää kuitenkin huolta, varsinkin laajassa epidemiologisessa tutkimuksessa havaittu havainto, jonka mukaan ei-diabeetikoilla on samansuuruisia eloonjäämishyötyjä kuin diabeetikoilla.
HUUMEIDEN VUOROVAIKUTUKSET
Seerumin kaliumia lisäävät aineet
Olmesartaanin samanaikainen käyttö muiden reniini-angiotensiinijärjestelmää estävien aineiden, kaliumia säästävien diureettien (esim. spironolaktoni, triamtereeni, amiloridi), kaliumlisäaineiden, kaliumia sisältävien suolan korvikkeiden tai muiden lääkkeiden kanssa, jotka voivat nostaa kaliumpitoisuutta (esim. hepariini), voi johtaa seerumin kaliumpitoisuuden nousuun. Jos samanaikainen lääkitys katsotaan tarpeelliseksi, seerumin kaliumpitoisuuden seuranta on suositeltavaa.
Ei-steroidiset tulehduskipulääkkeet, mukaan lukien selektiiviset syklo-oksigenaasi-2-estäjät (COX-2-estäjät)
Iäkkäillä potilailla, joilla on nestevajaus (mukaan lukien diureettihoitoa saavat) tai heikentynyt munuaisten toiminta, tulehduskipulääkkeiden, mukaan lukien selektiivisten COX-2:n estäjien, samanaikainen anto angiotensiini II -reseptorin salpaajien, mukaan lukien olmesartaanimedoksomiilin, kanssa voi johtaa tilan heikkenemiseen. munuaisten toimintaan, mukaan lukien mahdollinen akuutti munuaisten vajaatoiminta. Nämä vaikutukset ovat yleensä palautuvia. Seuraa munuaisten toimintaa määräajoin potilailla, jotka saavat olmesartaanimedoksomiili- ja NSAID-hoitoa.
Angiotensiini II -reseptorin salpaajien, mukaan lukien olmesartaanimedoksomiilin, verenpainetta alentava vaikutus voi heikentyä tulehduskipulääkkeillä, mukaan lukien selektiiviset COX-2-estäjät.
Reniini-angiotensiinijärjestelmän (RAS) kaksoisesto
RAS:n kaksoissalpaus angiotensiinireseptorin salpaajilla, ACE:n estäjillä tai aliskireenilla liittyy lisääntyneeseen hypotension, hyperkalemian ja munuaisten toiminnan muutosten riskiin (mukaan lukien akuutti munuaisten vajaatoiminta) verrattuna monoterapiaan. Useimmat potilaat, jotka saavat kahden RAS-estäjän yhdistelmää, eivät saa mitään lisähyötyä monoterapiaan verrattuna. Vältä yleensä RAS-estäjien yhteiskäyttöä. Seuraa tarkasti verenpainetta, munuaisten toimintaa ja elektrolyyttejä potilailla, jotka saavat Benicaria ja muita RAS:iin vaikuttavia aineita.
Älä anna aliskireenia samanaikaisesti Benicarin kanssa potilailla, joilla on diabetes [katso VASTA-AIHEET ]. Vältä aliskireenin käyttöä Benicar 40 mg:n kanssa potilailla, joilla on munuaisten vajaatoiminta (GFR
Litium
Seerumin litiumpitoisuuksien nousua ja litiumtoksisuutta on raportoitu, kun litiumia on annettu samanaikaisesti angiotensiini II -reseptorin salpaajien, mukaan lukien BENICAR, kanssa. Seuraa seerumin litiumpitoisuutta samanaikaisen käytön aikana.
Kolesevelaamihydrokloridi
Sappihappoa sitovan aineen kolesevelaamihydrokloridin samanaikainen anto vähentää olmesartaanin systeemistä altistusta ja huippupitoisuutta plasmassa. Olmesartaanin antaminen vähintään 4 tuntia ennen kolesevelaamihydrokloridia heikensi lääkkeiden yhteisvaikutusta. Harkitse olmesartaanin antamista vähintään 4 tuntia ennen kolesevelaamihydrokloridin annosta [ks. KLIININEN FARMAKOLOGIA ].
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Sikiön toksisuus
Benicar 10 mg voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. Reniini-angiotensiinijärjestelmään (RAS) vaikuttavien lääkkeiden käyttö raskauden toisen ja kolmannen kolmanneksen aikana heikentää sikiön munuaisten toimintaa ja lisää sikiön ja vastasyntyneen sairastuvuutta ja kuolemaa. Tuloksena olevat oligohydramnionit voivat liittyä sikiön keuhkojen hypoplasiaan ja luuston epämuodostumiin. Mahdollisia vastasyntyneiden haittavaikutuksia ovat kallon hypoplasia, anuria, hypotensio, munuaisten vajaatoiminta ja kuolema. Kun raskaus havaitaan, lopeta Benicar mahdollisimman pian [katso Käyttö tietyissä populaatioissa ].
Imeväisten sairastuvuus
Benicarin käyttöä alle 1-vuotiaille lapsille ei suositella. Lääkkeet, jotka vaikuttavat suoraan reniini-angiotensiini-aldosteronijärjestelmään (RAAS), voivat vaikuttaa epäkypsien munuaisten kehittymiseen [ks. Käyttö tietyissä populaatioissa ].
Hypotensio volyymi- tai suolapuutteellisilla potilailla
Potilailla, joilla on aktivoitunut reniini-angiotensiini-aldosteronijärjestelmä, kuten neste- ja/tai suolavajaus (esim. suurilla diureetiannoksilla hoidetuilla), voidaan odottaa oireenmukaista hypotensiota Benicar-hoidon aloittamisen jälkeen. Aloita hoito tarkassa lääkärin valvonnassa ja harkitse aloittamista pienemmällä annoksella. Jos hypotensiota ilmenee, aseta potilas makuuasentoon ja anna tarvittaessa suonensisäinen infuusio normaalia suolaliuosta [ks. ANNOSTELU JA HALLINNOINTI ]. Ohimenevä hypotensiivinen vaste ei ole vasta-aihe jatkohoidolle, jota voidaan yleensä jatkaa ilman vaikeuksia, kun verenpaine on vakiintunut.
Munuaisten vajaatoiminta
Reniini-angiotensiini-aldosteronijärjestelmän estämisen seurauksena Benicar-hoitoa saavilla herkillä henkilöillä voidaan odottaa muutoksia munuaisten toiminnassa. Potilailla, joiden munuaisten toiminta saattaa riippua reniini-angiotensiinialdosteronijärjestelmän aktiivisuudesta (esim. potilaat, joilla on vaikea sydämen vajaatoiminta), hoitoon angiotensiinikonvertaasin (ACE) estäjillä ja angiotensiinireseptorin salpaajilla on liittynyt oliguriaa ja/tai etenevää atsotemiaa. ja harvoin akuutti munuaisten vajaatoiminta ja/tai kuolema. Samanlaisia tuloksia voidaan odottaa potilailla, joita hoidetaan Benicarilla [katso ANNOSTELU JA HALLINNOINTI , HUUMEIDEN VUOROVAIKUTUKSET , Käyttö tietyissä populaatioissa ja KLIININEN FARMAKOLOGIA ].
ACE-estäjillä tehdyissä tutkimuksissa potilailla, joilla on toispuolinen tai molempien munuaisvaltimon ahtauma, seerumin kreatiniini- tai veren ureatyppipitoisuuden (BUN) on raportoitu lisääntyneen. Benicaria ei ole käytetty pitkäaikaisesti potilailla, joilla on toispuolinen tai molemminpuolinen munuaisvaltimon ahtauma, mutta samanlaisia tuloksia voidaan odottaa.
Spruen kaltainen enteropatia
Vaikeaa, kroonista ripulia ja huomattavaa painonlaskua on raportoitu potilailla, jotka ovat saaneet olmesartaania kuukausia tai vuosia lääkkeen aloittamisen jälkeen. Potilaiden suolistobiopsiat osoittivat usein villosatrofiaa. Jos potilaalle ilmaantuu näitä oireita olmesartaanihoidon aikana, muut syyt on suljettava pois. Harkitse vaihtoehtoista verenpainetta alentavaa hoitoa tapauksissa, joissa muuta etiologiaa ei tunnisteta.

Hyperkalemia
Benicaria saavien potilaiden seerumin kaliumpitoisuutta tulee seurata. Reniini-angiotensiinijärjestelmää estävät lääkkeet voivat aiheuttaa hyperkalemiaa. Hyperkalemian kehittymisen riskitekijöitä ovat munuaisten vajaatoiminta, diabetes mellitus ja samanaikainen kaliumia säästävien diureettien, kaliumlisäaineiden ja/tai kaliumia sisältävien suolan korvikkeiden käyttö [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Olmesartaanimedoksomiili ei ollut karsinogeeninen, kun sitä annettiin rotille ruokavalion kautta enintään 2 vuoden ajan. Suurin testattu annos (2000 mg/kg/vrk) oli mg/m2:n perusteella noin 480 kertaa suurin suositeltu ihmisannos (MRHD) 40 mg/vrk. Kaksi karsinogeenisuustutkimusta, jotka suoritettiin hiirillä, 6 kuukautta kestänyt letkuruokintatutkimus p53-poistohiirellä ja 6 kuukauden mittainen ruokavalion annostelututkimus siirtogeenisellä Hras2-hiirellä annoksilla 1000 mg/kg/vrk (noin 120 kertaa MRHD) , ei paljastanut todisteita olmesartaanimedoksomiilin karsinogeenisesta vaikutuksesta.
Sekä olmesartaanimedoksomiili että olmesartaani osoittautuivat negatiivisiksi in vitro Syyrianhamsterin alkiosolutransformaatiokokeessa, eivätkä ne osoittaneet merkkejä geneettisestä toksisuudesta Amesin (bakteerin mutageenisuus) testissä. Molempien osoitettiin kuitenkin indusoivan kromosomipoikkeavuuksia viljellyissä soluissa in vitro (kiinanhamsterin keuhko) ja testattiin positiivisiksi tymidiinikinaasimutaatioiden suhteen in vitro hiiren lymfoomatestissä. Olmesartaanimedoksomiili testattiin negatiiviseksi in vivo mutaatioiden suhteen MutaMousen suolistossa ja munuaisissa ja klastogeenisyydestä hiiren luuytimessä (mikronukleustesti) oraalisilla annoksilla 2000 mg/kg asti (olmesartaania ei testattu).
Rottien hedelmällisyyteen ei vaikuttanut olmesartaanimedoksomiilin antaminen jopa 1 000 mg/kg/vrk (240 kertaa MRHD) annoksilla tutkimuksessa, jossa annostelu aloitettiin 2 (naaras) tai 9 (uros) viikkoa ennen parittelua.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Benicar 10 mg voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. Reniini-angiotensiinijärjestelmään vaikuttavien lääkkeiden käyttö raskauden toisen ja kolmannen kolmanneksen aikana vähentää sikiön munuaisten toimintaa ja lisää sikiön ja vastasyntyneen sairastuvuutta ja kuolemaa. Useimmat epidemiologiset tutkimukset, joissa tutkittiin sikiön poikkeavuuksia verenpainetta alentaville lääkkeille ensimmäisen raskauskolmanneksen aikana, eivät ole erottaneet reniini-angiotensiinijärjestelmään vaikuttavia lääkkeitä muista verenpainetta alentavista aineista. Eläinten lisääntymistutkimuksissa Benicar-hoito organogeneesin aikana johti lisääntyneeseen alkio- ja sikiötoksisuuteen rotilla annoksilla, jotka olivat pienempiä kuin emolle toksiset annokset.
Kun raskaus havaitaan, lopeta Benicar-hoito mahdollisimman pian. Harkitse vaihtoehtoista verenpainetta alentavaa hoitoa raskauden aikana.
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. USA:n väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 % ja 15–20 %.
Kliiniset näkökohdat
Äidin ja/tai alkion/sikiön sairauteen liittyvä riski
Raskaudenaikainen hypertensio lisää äidin riskiä pre-eklampsialle, raskausdiabetekselle, ennenaikaisille synnytyksille ja synnytyskomplikaatioille (esim. keisarileikkauksen tarve ja synnytyksen jälkeinen verenvuoto). Hypertensio lisää sikiön riskiä kohdunsisäiseen kasvun rajoittumiseen ja kohdunsisäiseen kuolemaan. Verenpainetautia sairastavia raskaana olevia naisia tulee seurata huolellisesti ja hoitaa sen mukaisesti.
Sikiön/vastasyntyneen haittavaikutukset
Oligohydramnionit raskaana olevilla naisilla, jotka käyttävät reniini-angiotensiinijärjestelmään vaikuttavia lääkkeitä raskauden toisen ja kolmannen kolmanneksen aikana, voivat aiheuttaa seuraavia seurauksia: sikiön munuaisten toiminnan heikkeneminen, mikä johtaa anuriaan ja munuaisten vajaatoimintaan, sikiön keuhkojen hypoplasia, luuston epämuodostumat, mukaan lukien kallon hypoplasia, hypotensio ja kuolema. Potilaille, jotka käyttävät Benicar 20 mg raskauden aikana, suorita sarja ultraäänitutkimuksia lapsivesiympäristön arvioimiseksi. Sikiön testaus voi olla tarkoituksenmukaista raskausviikon perusteella. Potilaiden ja lääkäreiden tulee kuitenkin olla tietoisia siitä, että oligohydramnionit saattavat ilmaantua vasta sen jälkeen, kun sikiö on saanut peruuttamattoman vaurion.
Tarkkaile tarkasti lapsia, jotka ovat altistuneet kohdussa Benicar 40 mg:lle hypotension, oligurian ja hyperkalemian vuoksi. Jos vastasyntynyt on altistunut Benicarille kohdussa, jos esiintyy oliguriaa tai hypotensiota, käytä toimenpiteitä riittävän verenpaineen ja munuaisperfuusion ylläpitämiseksi. Vaihtosiirtoja tai dialyysiä voidaan tarvita keinona vähentää hypotensiota ja tukea munuaisten toimintaa.
Data
Eläinten tiedot
Teratogeenisia vaikutuksia ei havaittu, kun olmesartaanimedoksomiilia annettiin tiineille rotille suun kautta enintään 1000 mg/kg/vrk (240 kertaa suurin suositeltu ihmisannos (MRHD) mg/m2:n perusteella) tai tiineille kaneille suun kautta annetuilla annoksilla enintään 1 mg/kg/vrk (puolet MRHD:stä mg/m2:n perusteella; suurempien annosten vaikutuksia sikiön kehitykseen ei voitu arvioida, koska ne olivat tappavia eläimille). Rotilla havaittiin merkittävää poikasten syntymäpainon laskua ja painonnousua annoksilla ≥ 1,6 mg/kg/vrk ja kehitysvaiheiden viivästymistä (korvan korvan viivästynyt erottuminen, alempien etuhampaiden puhkeaminen, vatsan karvojen ilmaantuminen, kivesten laskeutuminen, ja silmäluomien irtoaminen) ja annoksesta riippuvaa lisääntymistä munuaisaltaan laajenemisessa havaittiin annoksilla ≥ 8 mg/kg/vrk. Annos, jolla ei havaittu vaikutusta kehitystoksisuuteen rotilla, on 0,3 mg/kg/vrk, mikä on noin kymmenesosa 40 mg:n MRHD:stä.
Imetys
Riskien yhteenveto
Ei ole tietoa olmesartaanin esiintymisestä äidinmaidossa, vaikutuksista imetettävään lapseen tai vaikutuksista maidontuotantoon. Olmesartaania erittyy pieninä pitoisuuksina imettävien rottien maitoon (ks Data ). Imettävälle lapselle mahdollisesti kohdistuvien haittavaikutusten vuoksi on päätettävä, lopetetaanko imetys vai lääkkeen käyttö, ottaen huomioon lääkkeen merkitys äidille.
Data
Olmesartaanin esiintymistä maidossa havaittiin sen jälkeen, kun imettäville rotille annettiin kerran suun kautta 5 mg/kg [14C]-olmesartaanimedoksomiilia.
Käyttö lapsille
Benicarin verenpainetta alentavat vaikutukset arvioitiin yhdessä satunnaistetussa, kaksoissokkoutetussa kliinisessä tutkimuksessa 1–16-vuotiailla lapsipotilailla [ks. Kliiniset tutkimukset ]. Benicarin farmakokinetiikka arvioitiin 1–16-vuotiailla lapsipotilailla [ks. KLIININEN FARMAKOLOGIA ]. Benicar 10 mg oli yleensä hyvin siedetty lapsipotilailla, ja haittakokemusprofiili oli samanlainen kuin aikuisilla kuvattu.
Benicar 20 mg:n ei ole osoitettu olevan tehokas alle 6-vuotiaiden lasten verenpainetaudissa.
Benicarin käyttöä alle 1-vuotiaille lapsille ei suositella [katso VAROITUKSET JA VAROTOIMET ]. Reniini-angiotensiini-aldosteronijärjestelmällä (RAAS) on ratkaiseva rooli munuaisten kehityksessä. RAAS-salpauksen on osoitettu johtavan epänormaaliin munuaisten kehitykseen hyvin nuorilla hiirillä. Suoraan reninangiotensiini-aldosteronijärjestelmään (RAAS) vaikuttavien lääkkeiden antaminen voi muuttaa normaalia munuaisten kehitystä.
Geriatrinen käyttö
Kliinisissä tutkimuksissa Benicaria saaneiden verenpainepotilaiden kokonaismäärästä yli 20 % oli vähintään 65-vuotiaita, kun taas yli 5 % oli 75-vuotiaita tai vanhempia. Yleisiä eroja tehossa tai turvallisuudessa ei havaittu iäkkäiden potilaiden ja nuorempien potilaiden välillä. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois [ks. KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
Keskivaikeaa maksan vajaatoimintaa sairastavilla potilailla havaittiin AUC0-∞- ja Cmax-arvojen nousua vastaaviin verrokkeihin verrattuna, ja AUC-arvo kasvoi noin 60 %. Alkuannoksen muuttamista ei suositella potilaille, joilla on kohtalainen tai merkittävä maksan vajaatoiminta [ks KLIININEN FARMAKOLOGIA ].
Munuaisten vajaatoiminta
Potilailla, joilla on munuaisten vajaatoiminta, seerumin olmesartaanipitoisuudet ovat kohonneet verrattuna potilaisiin, joiden munuaisten toiminta on normaali. Toistuvan annostelun jälkeen AUC noin kolminkertaistui potilailla, joilla oli vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
Mustat potilaat
Benicar 10 mg:n verenpainetta alentava vaikutus oli pienempi mustaihoisilla potilailla (yleensä vähän reniiniä sisältävillä potilailla), kuten on havaittu ACE:n estäjillä, beetasalpaajilla ja muilla angiotensiinireseptorin salpaajilla.
YLIANNOSTUS
Yliannostuksesta ihmisillä on saatavilla rajoitetusti tietoa. Yliannostuksen todennäköisimpiä oireita ovat hypotensio ja takykardia; bradykardia voi kohdata, jos parasympaattinen (vagal) stimulaatio tapahtuu. Jos oireista hypotensiota ilmenee, aloita tukihoito. Olmesartaanin dialysoitavuutta ei tunneta.
VASTA-AIHEET
Älä anna aliskireenia samanaikaisesti Benicar 20 mg:n kanssa potilailla, joilla on diabetes [ks HUUMEIDEN VUOROVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Angiotensiini II muodostuu angiotensiini I:stä angiotensiiniä konvertoivan entsyymin (ACE, kininaasi II) katalysoimassa reaktiossa. Angiotensiini II on pääasiallinen reniini-angiotensiinijärjestelmän painetta aiheuttava aine, jonka vaikutuksia ovat verisuonten supistuminen, synteesin ja aldosteronin vapautumisen stimulaatio, sydämen stimulaatio ja natriumin uudelleenabsorptio. Olmesartaani estää angiotensiini II:n verisuonia supistavia vaikutuksia estämällä selektiivisesti angiotensiini II:n sitoutumisen AT1-reseptoriin verisuonten sileässä lihaksessa. Sen vaikutus on siksi riippumaton angiotensiini II -synteesin reiteistä.
AT2-reseptoria löytyy myös monista kudoksista, mutta tämän reseptorin ei tiedetä liittyvän kardiovaskulaariseen homeostaasiin. Olmesartaanilla on yli 12 500 kertaa suurempi affiniteetti AT1-reseptoriin kuin AT2-reseptoriin.
Reniini-angiotensiinijärjestelmän estäminen ACE:n estäjillä, jotka estävät angiotensiini II:n biosynteesiä angiotensiini I:stä, on monien verenpaineen hoitoon käytettävien lääkkeiden mekanismi. ACE-estäjät estävät myös bradykiniinin hajoamista, reaktiota, jota myös ACE katalysoi. Koska olmesartaanimedoksomiili ei estä ACE:ta (kininaasi II), se ei vaikuta bradykiniinivasteeseen. Vielä ei tiedetä, onko tällä erolla kliinistä merkitystä.
Angiotensiini II -reseptorin salpaus estää angiotensiini II:n negatiivisen säätelyn takaisinkytkennän reniinin erittymiseen, mutta sen seurauksena lisääntynyt plasman reniiniaktiivisuus ja verenkierron angiotensiini II -tasot eivät voita olmesartaanin vaikutusta verenpaineeseen.
Farmakodynamiikka
Benicar-annokset 2,5–40 mg estävät angiotensiini I -infuusion painevaikutuksia. Estovaikutuksen kesto oli suhteessa annokseen, ja Benicarin annokset >40 mg aiheuttivat >90 %:n eston 24 tunnin kohdalla.
Plasman angiotensiini I:n ja angiotensiini II:n pitoisuudet ja plasman reniiniaktiivisuus (PRA) suurenevat, kun Benicar 10 mg kerta- tai toistuvasti annettiin terveille koehenkilöille ja verenpainepotilaille. Toistuvalla 80 mg:n Benicar-annoksella oli vähäinen vaikutus aldosteronitasoihin, eikä se vaikutusta seerumin kaliumpitoisuuteen.
Farmakokinetiikka
Imeytyminen
Olmesartaanimedoksomiili bioaktivoituu nopeasti ja täydellisesti esterihydrolyysillä olmesartaaniksi imeytyessään maha-suolikanavasta.
Benicar-tabletit ja Benicar-tableteista valmistettu suspensioformulaatio ovat bioekvivalentteja [katso ANNOSTELU JA HALLINNOINTI ].
Olmesartaanin absoluuttinen hyötyosuus on noin 26 %. Oraalisen annon jälkeen olmesartaanin huippupitoisuus plasmassa (Cmax) saavutetaan 1-2 tunnin kuluttua. Ruoka ei vaikuta olmesartaanin biologiseen hyötyosuuteen. Benicar voidaan antaa ruoan kanssa tai ilman.
Jakelu
Olmesartaanin jakautumistilavuus on noin 17 l. Olmesartaani sitoutuu voimakkaasti plasman proteiineihin (99 %) eikä tunkeudu punasolujen läpi. Sitoutuminen proteiineihin on vakio, kun plasman olmesartaanipitoisuus ylittää selvästi suositelluilla annoksilla saavutettavan alueen.
Rotilla olmesartaani läpäisi veri-aivoesteen huonosti, jos ollenkaan. Olmesartaani läpäisi istukan esteen rotilla ja jakautui sikiöön. Olmesartaania jaettiin pieninä määrinä rottien maitoon.
Aineenvaihdunta ja erittyminen
Kun olmesartaanimedoksomiili muuttuu nopeasti ja täydellisesti olmesartaaniksi imeytymisen aikana, olmesartaanin metabolia ei käytännössä tapahdu. Olmesartaanin plasman kokonaispuhdistuma on 1,3 l/h ja munuaispuhdistuma 0,6 l/h. Noin 35–50 % imeytyneestä annoksesta erittyy virtsaan, kun taas loppuosa eliminoituu ulosteiden mukana sapen kautta.
Olmesartaani näyttää eliminoituvan kaksivaiheisesti, ja sen terminaalinen eliminaation puoliintumisaika on noin 13 tuntia. Olmesartaanin farmakokinetiikka on lineaarinen enintään 320 mg:n kerta-annosten ja 80 mg:n useiden suun kautta otettavien annosten jälkeen. Olmesartaanin vakaan tilan pitoisuudet saavutetaan 3–5 päivässä, eikä kerrytystä plasmaan tapahdu kerran vuorokaudessa otettaessa.
Tietyt populaatiot
Geriatriset potilaat
Olmesartaanin farmakokinetiikkaa tutkittiin iäkkäillä (≥65-vuotiailla). Kaiken kaikkiaan olmesartaanin huippupitoisuudet plasmassa olivat samanlaiset nuorilla aikuisilla ja vanhuksilla. Olmesartaanin vähäistä kertymistä havaittiin vanhuksilla toistuvien annosten yhteydessä; AUCss, τ oli 33 % suurempi iäkkäillä potilailla, mikä vastaa noin 30 %:n laskua CLR:ssä [ks. ANNOSTELU JA HALLINNOINTI ja Käyttö tietyissä populaatioissa ].
Pediatriset potilaat
Olmesartaanin farmakokinetiikkaa tutkittiin 1–16-vuotiailla hypertensiivisillä lapsipotilailla. Olmesartaanin puhdistuma lapsipotilailla oli samanlainen kuin aikuispotilailla, kun sitä säädettiin ruumiinpainon mukaan [ks. Käyttö tietyissä populaatioissa ].
Olmesartaanin farmakokinetiikkaa ei ole tutkittu alle 1-vuotiailla lapsipotilailla [ks. VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Mies- ja naispotilaat
Pieniä eroja havaittiin olmesartaanin farmakokinetiikassa naisilla ja miehillä. AUC ja Cmax olivat 10-15 % korkeammat naisilla kuin miehillä.
Potilaat, joilla on maksan vajaatoiminta
Kohtalaista maksan vajaatoimintaa sairastavilla potilailla havaittiin kohonneita AUC0-∞- ja Cmax-arvoja verrattuna vastaaviin verrokkeihin, ja AUC nousi noin 60 % [ks. ANNOSTELU JA HALLINNOINTI ja Käyttö tietyissä populaatioissa ].
Potilaat, joilla on munuaisten vajaatoiminta
Munuaisten vajaatoimintaa sairastavilla potilailla seerumin olmesartaanipitoisuudet olivat kohonneet verrattuna potilaisiin, joilla oli normaali munuaisten toiminta. Toistuvan annostelun jälkeen AUC noin kolminkertaistui potilailla, joilla oli vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Huumeiden vuorovaikutustutkimukset
Sappihappoa sitova aine Colesevelam
40 mg olmesartaanimedoksomiilin ja 3750 mg kolesevelaamihydrokloridin samanaikainen anto terveille koehenkilöille johti 28 %:n laskuun olmesartaanin Cmax-arvossa ja 39 %:n laskussa AUC-arvossa. Pienemmät vaikutukset, Cmax:n ja AUC:n pieneneminen 4 % ja 15 %, havaittiin, kun olmesartaanimedoksomiilia annettiin 4 tuntia ennen kolesevelaamihydrokloridia [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Muut opinnot
Merkittäviä lääkkeiden yhteisvaikutuksia ei raportoitu tutkimuksissa, joissa olmesartaanimedoksomiilia annettiin yhdessä digoksiinin tai varfariinin kanssa terveillä vapaaehtoisilla.
Antasidien [Al(OH)3/Mg(OH)2] samanaikainen anto ei merkittävästi muuttanut olmesartaanin biologista hyötyosuutta.
Olmesartaanimedoksomiili ei metaboloidu sytokromi P450 -järjestelmässä, eikä sillä ole vaikutusta P450-entsyymeihin. näin ollen ei odoteta vuorovaikutuksia lääkkeiden kanssa, jotka estävät, indusoivat tai metaboloivat näitä entsyymejä.
Kliiniset tutkimukset
Aikuisten hypertensio
Benicar 10 mg:n verenpainetta alentavat vaikutukset on osoitettu seitsemässä lumekontrolloidussa tutkimuksessa annoksilla 2,5 mg - 80 mg 6 - 12 viikon ajan, joista jokainen osoitti tilastollisesti merkitsevää laskua huippu- ja alimmassa verenpaineessa. Yhteensä 2 693 potilasta (2 145 Benicar; 548 lumelääkettä) tutkittiin, joilla oli essentiaalinen hypertensio. Benicar 40 mg kerran vuorokaudessa alensi diastolista ja systolista verenpainetta. Vaste oli annoksesta riippuvainen, kuten seuraavassa kaaviossa näkyy. Benicar-annos 20 mg päivässä alentaa alin verenpainetta (BP) plaseboon verrattuna noin 10/6 mmHg ja 40 mg:n päiväannos laskee istuvan verenpainetta noin 12/7 mmHg plaseboon verrattuna. Yli 40 mg:n Benicar 10 mg:n annoksilla oli vain vähän lisävaikutusta. Verenpainetta alentava vaikutus alkoi 1 viikon sisällä ja ilmeni suurelta osin 2 viikon kuluttua.
Benicar 40 mg annosvasteen lumelääkettä mukautettu verenpaineen lasku (mmHg) 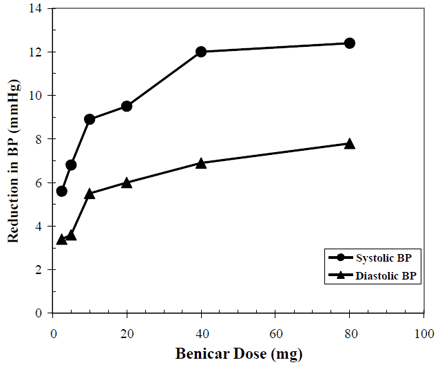
Yllä olevat tiedot ovat seitsemästä lumekontrolloidusta tutkimuksesta (2145 Benicar-potilasta, 548 lumelääkepotilasta). Verenpainetta alentava vaikutus säilyi koko 24 tunnin ajan Benicarilla kerran vuorokaudessa, ja systolisen ja diastolisen vasteen alimman ja huipputason suhteet olivat 60–80 %.
Benicar 40 mg:n verenpainetta alentava vaikutus sekä hydroklooritiatsidin kanssa että ilman sitä säilyi potilailla, joita hoidettiin enintään 1 vuoden ajan. Pitkäaikaisen Benicar-hoidon aikana ei havaittu takyfylaksiaa eikä rebound-vaikutusta olmesartaanimedoksomiilin äkillisen lopettamisen jälkeen 1 vuoden hoidon jälkeen.
Benicarin verenpainetta alentava vaikutus oli samanlainen miehillä ja naisilla sekä yli 65-vuotiailla ja nuoremmilla potilailla. Vaikutus oli pienempi mustaihoisilla potilailla (yleensä alhainen reniinipitoisuus), kuten on havaittu ACE:n estäjillä, beetasalpaajilla ja muilla angiotensiinireseptorin salpaajilla. Benicarilla oli lisäksi verenpainetta alentava vaikutus, kun se lisättiin hydroklooritiatsidiin.
Benicarilla ei ole tehty tutkimuksia, jotka osoittaisivat kardiovaskulaarisen riskin pienenemistä verenpainepotilailla, mutta ainakin yksi farmakologisesti samanlainen lääke on osoittanut tällaisia etuja.
Lasten hypertensio
Benicar 40 mg:n verenpainetta alentavat vaikutukset lapsiväestössä arvioitiin satunnaistetussa kaksoissokkotutkimuksessa, johon osallistui 302 verenpainepotilasta iältään 6–16 vuotta. Tutkimuspopulaatio koostui täysin mustasta 112 potilaan kohortista ja 190 potilaan sekarotuisesta kohortista, joista 38 oli mustaihoista potilasta. Verenpainetaudin etiologia oli pääosin essentiaalinen hypertensio (87 % mustasta kohortista ja 67 % sekakohortista). Potilaat, jotka painoivat 20–
Samassa tutkimuksessa 59 1–5-vuotiasta potilasta, jotka painoivat ≥5 kg, saivat 0,3 mg/kg Benicaria 10 mg kerran päivässä kolmen viikon ajan avoimessa vaiheessa, minkä jälkeen ne satunnaistettiin saamaan Benicaria tai lumelääkettä kaksoissokkotutkimuksessa. vaihe. Toisen vieroitusviikon lopussa keskimääräinen systolinen/diastolinen verenpaine oli 3/3 mmHg alhaisempi Benicariin satunnaistetussa ryhmässä; tämä verenpaineero ei ollut tilastollisesti merkitsevä (95 % CI -2 - 7/-1 - 7).
POTILASTIEDOT
Raskaus
Neuvo hedelmällisessä iässä oleville naispotilaille Benicar 20 mg:n raskauden aikana altistumisen seurauksista. Keskustele hoitovaihtoehdoista raskautta suunnittelevien naisten kanssa. Kerro potilaille ilmoittamaan raskaudesta lääkärilleen mahdollisimman pian [katso VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Imetys
Neuvo imettäviä naisia olemaan imettämättä BENICAR-hoidon aikana [katso Käyttö tietyissä populaatioissa ].
Hyperkalemia
Neuvo potilaita olemaan käyttämättä kaliumlisäaineita tai suolan korvikkeita, jotka sisältävät kaliumia neuvottelematta terveydenhuollon tarjoajansa kanssa [katso HUUMEIDEN VUOROVAIKUTUKSET ].
