Aceon 2mg, 4mg, 8mg Perindopril Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Aceon 4mg on ja miten sitä käytetään?
Aceon 8mg on reseptilääke, jota käytetään korkean verenpaineen (hypertension) ja vakaan sepelvaltimotaudin (CAD) oireiden hoitoon. Aceonia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Aceon kuuluu lääkeryhmään, jota kutsutaan ACE:n estäjiksi.
Ei tiedetä, onko Aceon turvallinen ja tehokas lapsille.
Mitkä ovat Aceon 4mg:n mahdolliset sivuvaikutukset?
Aceon voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nokkosihottuma,
- vaikeuksia hengittää,
- kasvojen, huulten, kielen tai kurkun turvotus,
- heikkous,
- hidas tai epäsäännöllinen sydämen syke,
- pyörtyminen,
- pahoinvointi,
- oksentelua,
- ruokahalun menetys,
- vatsakipu,
- silmien tai ihon keltaisuus (keltaisuus),
- tumma virtsa ja
- vaikea huimaus
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Aceon 2mg:n yleisimmät sivuvaikutukset ovat:
- huimaus,
- huimaus,
- väsymys ja
- kuiva yskä
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Aceonin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
SIKIÖN MYRKYLLISYYS
- Kun raskaus havaitaan, lopeta ACEON 4mg -hoito mahdollisimman pian. VAROITUKSET JA VAROTOIMET
- Lääkkeet, jotka vaikuttavat suoraan reniini-angiotensiinijärjestelmään, voivat aiheuttaa vammoja ja kuoleman kehittyvälle sikiölle. VAROITUKSET JA VAROTOIMET
KUVAUS
ACEON® (perindopriilierbumiini) -tabletit sisältävät perindopriilin tert-butyyliamiinisuolaa, joka on ei-sulfhydryyli-angiotensiinia konvertoivan entsyymin (ACE) estäjän etyyliesteri. Perindopriilierbumiinia kuvataan kemiallisesti nimellä (2S,3DS,7DS)-1-[(S)-N-[(S)-1-karboksibutyyli]alanyyli]heksahydro-2-indoliinikarboksyylihappo, 1-etyyliesteri, yhdiste tert-butyyliamiini (1:1). Sen molekyylikaava on C19H32N2O5C4H11N. Sen rakennekaava on:
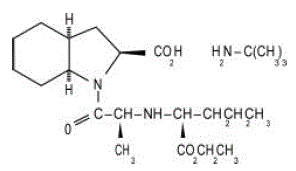
Perindopriilierbumiini on valkoinen, kiteinen jauhe, jonka molekyylipaino on 368,47 (vapaa happo) tai 441,61 (suolan muoto). Se liukenee vapaasti veteen (60 % w/w), alkoholiin ja kloroformiin.
Perindopriili on perindopriilierbumiinin vapaa happomuoto, aihiolääke ja metaboloituu in vivo esteriryhmän hydrolyysin kautta perindoprilaatiksi, biologisesti aktiiviseksi metaboliitiksi.
ACEONia on saatavana 2 mg, 4 mg ja 8 mg vahvuuksina suun kautta annettavaksi. Perindopriilierbumiinin lisäksi jokainen tabletti sisältää seuraavia inaktiivisia aineita: kolloidinen piidioksidi (hydrofobinen), laktoosi, magnesiumstearaatti ja mikrokiteinen selluloosa. 4 mg:n ja 8 mg:n tabletit sisältävät myös rautaoksidia.
INDIKAATIOT
Hypertensio
ACEON on tarkoitettu essentiaalista hypertensiota sairastavien potilaiden hoitoon. ACEONia voidaan käyttää yksinään tai muiden verenpainelääkkeiden, erityisesti tiatsididiureettien, kanssa.
Stabiili sepelvaltimotauti
ACEON 8mg on tarkoitettu potilaiden hoitoon, joilla on stabiili sepelvaltimotauti sydän- ja verisuoniperäisen kuolleisuuden tai ei-fataalin sydäninfarktin riskin vähentämiseksi. ACEONia voidaan käyttää sepelvaltimotaudin tavanomaisen hoidon, kuten verihiutaleiden estämiseen, verenpainetta alentaviin tai lipidejä alentaviin hoitoihin.
ANNOSTELU JA HALLINNOINTI
Hypertensio
Käyttö komplisoitumattomilla hypertensiivisillä potilailla
Potilaille, joilla on essentiaalinen hypertensio, suositeltu aloitusannos on 4 mg kerran vuorokaudessa. Annosta voidaan titrata tarvittaessa enintään 16 mg:aan vuorokaudessa. Tavallinen ylläpitoannosalue on 4–8 mg kerta-annoksena tai kahteen annokseen jaettuna.
Käyttö iäkkäillä potilailla
Vanhuksille suositeltu ACEON 4 mg:n vuorokausiannos on 4 mg vuorokaudessa jaettuna yhteen tai kahteen annokseen. Kokemus ACEONin käytöstä vanhuksilla yli 8 mg:n annoksilla on rajallinen. Yli 8 mg:n annokset tulee antaa tarkkaan verenpainetta seuraten ja annosta titraamalla [katso Käyttö tietyissä populaatioissa ].
Käytä diureettien kanssa
Potilailla, joita parhaillaan hoidetaan diureetilla, ACEONin aloitusannoksen jälkeen voi ilmetä oireenmukaista hypotensiota. Harkitse diureetin annoksen pienentämistä ennen ACEON-hoidon aloittamista [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Stabiili sepelvaltimotauti
Potilaille, joilla on stabiili sepelvaltimotauti, ACEON 4 mg tulee antaa aloitusannoksena 4 mg kerran vuorokaudessa 2 viikon ajan, minkä jälkeen annosta suurennetaan siedetyn annoksen mukaan ylläpitoannokseen 8 mg kerran vuorokaudessa. Iäkkäillä potilailla (yli 70-vuotiaat) ACEONia tulee antaa 2 mg kerran vuorokaudessa ensimmäisen viikon aikana, sen jälkeen 4 mg kerran vuorokaudessa toisella viikolla ja 8 mg kerran vuorokaudessa ylläpitoannoksena, jos potilas sietää.
Annoksen säätäminen munuaisten vajaatoiminnassa ja dialyysissä
Perindoprilaatin eliminaatio on hidastunut munuaisten vajaatoimintaa sairastavilla potilailla. ACEONia ei suositella potilaille, joiden kreatiniinipuhdistuma
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Tabletit ovat pitkulaisia, ja niiden toisella puolella on jakouurre.
2 mg:n tabletti on valkoinen, ja sen toiselle puolelle on kaiverrettu "ACN 2".
4 mg:n tabletti on vaaleanpunainen, ja sen toiselle puolelle on kaiverrettu "ACN 4".
8 mg:n tabletti on lohta, ja sen uurteettomalla puolella on merkintä "ACN 8".
Varastointi ja käsittely
Tabletit ovat pitkulaisia, ja niiden toisella puolella on jakouurre.
Pidä poissa lasten ulottuvilta.
Säilytä kontrolloidussa huoneenlämmössä 20–25 °C (68–77 °F) [katso USP]. Suojaa kosteudelta.
Lisätietoja saat soittamalla lääketieteellisen viestintäosastomme maksuttomaan numeroon 888-985-7657.
Valmistaja: Patheon Pharmaceuticals, Inc. Cincinnati, OH 45237 USA. Tarkistettu: syyskuuta 2017
SIVUVAIKUTUKSET
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittatapahtumia ei voida verrata suoraan toisen lääkkeen kliinisissä tutkimuksissa havaittuihin tapauksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja määriä.
Kokemus kliinisistä kokeista
Seuraavia haittavaikutuksia käsitellään muualla merkinnöissä:
- Anafylaktoidiset reaktiot, mukaan lukien angioödeema [katso VAROITUKSET JA VAROTOIMET ]
- Hypotensio [katso VAROITUKSET JA VAROTOIMET ]
- Neutropenia ja agranulosytoosi [katso VAROITUKSET JA VAROTOIMET ]
- Munuaisten vajaatoiminta [ks VAROITUKSET JA VAROTOIMET ]
- Hyperkalemia [katso VAROITUKSET JA VAROTOIMET ]
- Yskä [katso VAROITUKSET JA VAROTOIMET ]
Hypertensio
ACEON 4mg:n turvallisuutta on arvioitu noin 3 400 verenpainepotilaalla Yhdysvalloissa ja ulkomaisissa kliinisissä tutkimuksissa. Tässä esitetyt tiedot perustuvat tuloksiin 1 417 ACEON-hoitoa saaneelta potilaalta, jotka osallistuivat Yhdysvaltojen kliinisiin tutkimuksiin. Yli 220 näistä potilaista hoidettiin ACEON®:lla (perindopriilierbumiinilla) vähintään vuoden ajan.
Lumekontrolloiduissa Yhdysvalloissa tehdyissä kliinisissä tutkimuksissa hoidon ennenaikaisen keskeyttämisen ilmaantuvuus haittatapahtumien vuoksi oli 6,5 %:lla potilaista, joita hoidettiin ACEON 2 mg:lla ja 6,7 %:lla lumelääkettä saaneilla potilailla. Yleisimmät syyt olivat yskä, päänsärky, voimattomuus ja huimaus.
Lumekontrolloiduissa USA:n tutkimuksissa 1 012 potilaalla raportoitujen haittavaikutusten yleinen esiintymistiheys oli samanlainen ACEONilla hoidetuilla potilailla ja lumelääkettä saaneilla potilailla (noin 75 % kussakin ryhmässä). Ainoat haittatapahtumat, joiden ilmaantuvuus ACEON 4 mg:lla oli vähintään 2 % suurempi kuin lumelääkkeellä, olivat yskä (12 % vs. 4,5 %) ja selkäkipu (5,8 % vs. 3,1 %).
Huimausta ei raportoitu useammin perindopriiliryhmässä (8,2 %) kuin lumeryhmässä (8,5 %), mutta sen todennäköisyys lisääntyi annoksen myötä, mikä viittaa syy-yhteyteen perindopriiliin.
Stabiili sepelvaltimotauti
Perindopriilin turvallisuutta on arvioitu EUROPAssa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa 12 218 potilaalla, joilla oli stabiili sepelvaltimotauti. Lääkkeen ja lumelääkkeen keskeyttäneiden osuus oli noin 22 %. Yleisimmät lääketieteelliset syyt lopettamiseen, joita esiintyi perindopriililla kuin lumelääkettä saaneella, olivat yskä, lääke-intoleranssi ja hypotensio.
Markkinoinnin jälkeinen kokemus
Vapaaehtoiset raportit haittavaikutuksista ACEONia käyttävillä potilailla, joita on saatu markkinoille tulon jälkeen ja joiden syy-yhteyttä ACEON 8 mg:aan ei tunneta, ovat: sydämenpysähdys, eosinofiilinen pneumoniitti, neutropenia/agranulosytoosi, pansytopenia, anemia (mukaan lukien hemolyyttinen ja aplastinen), akuutti trombosytopenia munuaisten vajaatoiminta, nefriitti, maksan vajaatoiminta, keltaisuus (maksasellulaarinen tai kolestaattinen), oireinen hyponatremia, rakkula pemfigoidi, pemfigus, akuutti haimatulehdus, kaatumiset, psoriaasi, eksfoliatiivinen ihotulehdus ja oireyhtymä, johon voi kuulua: nivelkipu/niveltulehdus, vaskuliitti, serosiitti, myalgia, kuume , ihottuma tai muut dermatologiset oireet, positiivinen antinukleaarinen vasta-aine (ANA), leukosytoosi, eosinofilia tai kohonnut erytrosyyttien sedimentaationopeus (ESR).
Kliiniset laboratoriotutkimukset
Hematologia
Hemoglobiinin ja hematokriitin pientä laskua esiintyy usein hypertensiivisillä potilailla, joita hoidetaan 8 mg ACEONilla, mutta niillä on harvoin kliinistä merkitystä. Kontrolloiduissa kliinisissä tutkimuksissa yksikään potilas ei keskeyttänyt hoitoa anemian kehittymisen vuoksi. Leukopeniaa (mukaan lukien neutropenia) havaittiin 0,1 %:lla potilaista Yhdysvalloissa tehdyissä kliinisissä tutkimuksissa [ks. VAROITUKSET JA VAROTOIMET ].
Maksan toimintatestit
ALAT-arvojen (1,6 % ACEON vs. 0,9 % lumelääke) ja ASAT (0,5 % ACEON 2 mg vs. 0,4 % lumelääke) kohoamista on havaittu lumekontrolloiduissa kliinisissä tutkimuksissa. Kohonneet olivat yleensä lieviä ja ohimeneviä ja hävisivät hoidon lopettamisen jälkeen.
HUUMEIDEN VUOROVAIKUTUKSET
Diureetit
Potilailla, jotka käyttävät diureetteja, ja erityisesti niillä, jotka ovat aloittaneet hoidon äskettäin, verenpaine voi joskus laskea liikaa ACEON-hoidon aloittamisen jälkeen. Verenpainetta alentavien vaikutusten mahdollisuus voidaan minimoida joko pienentämällä diureetin annosta tai lopettamalla sen käyttö tai lisäämällä suolan saantia ennen perindopriilihoidon aloittamista. Jos diureettihoitoa ei voida muuttaa, huolehdi tarkoin lääkärin valvonnasta ensimmäisellä ACEON-annoksella vähintään kahden tunnin ajan ja kunnes verenpaine on tasaantunut vielä tunnin ajan [ks. VAROITUKSET JA VAROTOIMET ].
Samanaikainen diureetit eivät vaikuta perindopriilin imeytymisen ja eliminaation nopeuteen ja laajuuteen. Perindoprilaatin biologinen hyötyosuus kuitenkin väheni diureettien vaikutuksesta, ja tämä liittyi plasman ACE:n eston vähenemiseen.
Kaliumlisät ja kaliumia säästävät diureetit
ACEON 8 mg voi lisätä seerumin kaliumpitoisuutta, koska se voi vähentää aldosteronin tuotantoa. Kaliumia säästävien diureettien (spironolaktoni, amiloridi, triamtereeni ja muut), kaliumlisäaineiden tai muiden seerumin kaliumpitoisuutta lisäävien lääkkeiden (indometasiini, hepariini, syklosporiini ja muut) käyttö voi lisätä hyperkalemian riskiä. Siksi, jos tällaisten aineiden samanaikainen käyttö on aiheellista, potilaan seerumin kaliumpitoisuutta tulee seurata usein.
Litium
Seerumin litiumpitoisuuden nousua ja litiumtoksisuuden oireita on raportoitu potilailla, jotka ovat saaneet samanaikaisesti litiumia ja ACE:n estäjähoitoa. Seerumin litiumpitoisuuden säännöllistä seurantaa suositellaan. Diureetin käyttö voi edelleen lisätä litiumtoksisuuden riskiä.
Kulta
Nitritoidireaktioita (oireita ovat kasvojen punoitus, pahoinvointi, oksentelu ja hypotensio) on raportoitu harvoin potilailla, jotka ovat saaneet injektoitavaa kultaa (natriumaurotiomalaattia) ja samanaikaista ACE:n estäjähoitoa, mukaan lukien ACEONia.
Digoksiini
Kontrolloidussa farmakokineettisessä tutkimuksessa ei ole osoitettu vaikutusta plasman digoksiinipitoisuuksiin, kun sitä annettiin samanaikaisesti ACEONin kanssa, mutta digoksiinin vaikutusta plasman perindopriilin/perindoprilaatin pitoisuuteen ei ole suljettu pois.
Gentamysiini
Eläintutkimukset viittaavat mahdolliseen yhteisvaikutukseen perindopriilin ja gentamysiinin välillä. Tätä ei kuitenkaan ole tutkittu ihmistutkimuksissa.
Ei-steroidiset tulehduskipulääkkeet, mukaan lukien selektiiviset syklo-oksigenaasi-2-estäjät (COX-2-estäjät)
Iäkkäillä potilailla, joilla on nestevajaus (mukaan lukien diureettihoitoa saavat) tai heikentynyt munuaisten toiminta, tulehduskipulääkkeiden, mukaan lukien selektiiviset COX-2-estäjät, ja ACE:n estäjien, mukaan lukien perindopriili, samanaikainen käyttö voi heikentää munuaisten toimintaa. mukaan lukien mahdollinen akuutti munuaisten vajaatoiminta. Nämä vaikutukset ovat yleensä palautuvia. Seuraa munuaisten toimintaa säännöllisesti potilailla, jotka saavat perindopriili- ja NSAID-hoitoa.
Tulehduskipulääkkeet, mukaan lukien selektiiviset COX-2-estäjät, voivat heikentää ACE:n estäjien, perindopriilin, verenpainetta alentavaa vaikutusta.
Reniini-angiotensiinijärjestelmän (RAS) kaksoisesto
RAS:n kaksoissalpaus angiotensiinireseptorin salpaajilla, ACE:n estäjillä tai aliskireenilla liittyy lisääntyneeseen hypotension, hyperkalemian ja munuaisten toiminnan muutosten riskiin (mukaan lukien akuutti munuaisten vajaatoiminta) verrattuna monoterapiaan. Useimmat potilaat, jotka saavat kahden RAS-estäjän yhdistelmää, eivät saa mitään lisähyötyä monoterapiaan verrattuna. Vältä yleensä RAS-estäjien yhteiskäyttöä. Seuraa tarkasti verenpainetta, munuaisten toimintaa ja elektrolyyttejä potilailla, jotka saavat ACEON 2 mg:aa ja muita RAS:iin vaikuttavia aineita.
Älä anna aliskireenia samanaikaisesti ACEON 8 mg:n kanssa diabeetikoille. Vältä aliskireenin käyttöä ACEON 2 mg:n kanssa potilailla, joilla on munuaisten vajaatoiminta (GFR
mTOR-estäjät
Potilailla, jotka käyttävät samanaikaisesti mTOR-inhibiittorihoitoa (rapamysiinin nisäkäskohde), voi olla lisääntynyt angioedeeman riski [ks. VAROITUKSET JA VAROTOIMET ].
Neprilysiinin estäjä
Potilailla, jotka käyttävät samanaikaisesti neprilysiinin estäjiä, voi olla lisääntynyt angioedeeman riski. [katso VAROITUKSET JA VAROTOIMET ]
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Anafylaktoidi ja mahdollisesti siihen liittyvät reaktiot
Oletettavasti koska angiotensiinia konvertoivan entsyymin estäjät vaikuttavat eikosanoidien ja polypeptidien, mukaan lukien endogeenisen bradykiniinin, metaboliaan, ACE:n estäjiä (mukaan lukien ACEON) saavat potilaat voivat altistua erilaisille haittatapahtumille, joista osa on vakavia. Mustaihoisilla potilailla, jotka saavat ACE:n estäjiä, on suurempi angioedeeman ilmaantuvuus kuin muilla potilailla.
Pään ja kaulan angioedeema
Kasvojen, raajojen, huulten, kielen, äänihuulten tai kurkunpään angioedeemaa on raportoitu potilailla, joita on hoidettu ACE:n estäjillä, mukaan lukien ACEONilla (0,1 % ACEONilla hoidetuista potilaista Yhdysvalloissa tehdyissä kliinisissä tutkimuksissa). Angioödeema, joka liittyy kielen, äänihuuman tai kurkunpään kosketukseen, voi olla kohtalokas. Tällaisissa tapauksissa lopeta ACEON-hoito välittömästi ja tarkkaile, kunnes turvotus häviää. Jos kielen, kielen tai kurkunpään kosketus vaikuttaa todennäköisesti aiheuttavan hengitysteiden tukkeutumista, anna sopiva hoito, kuten ihonalainen epinefriiniliuos 1:1000 (0,3–0,5 ml), viipymättä.
Potilailla, jotka käyttävät samanaikaisesti mTOR-estäjää (esim. temsirolimuusi) tai neprilysiini-inhibiittoria, voi olla suurentunut angioedeeman riski [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Suolen angioedeema
Suoliston angioedeemaa on raportoitu potilailla, joita on hoidettu ACE:n estäjillä. Näillä potilailla oli vatsakipua (pahoinvoinnin tai oksentelun kanssa tai ilman); joissakin tapauksissa kasvojen angioedeemaa ei ollut aiemmin esiintynyt ja C-1-esteraasitasot olivat normaaleja. Angioödeema diagnosoitiin toimenpiteillä, mukaan lukien vatsan TT-skannaus tai ultraääni, tai leikkauksessa, ja oireet hävisivät ACE-estäjän lopettamisen jälkeen. Suoliston angioödeema tulee sisällyttää ACE:n estäjiä käyttävien potilaiden erotusdiagnostiikkaan, jos vatsakipuja esiintyy.
Hypotensio
ACEON 4 mg voi aiheuttaa oireenmukaista hypotensiota. ACEONin on yhdistetty hypotensioon 0,3 %:lla komplisoitumattomista hypertensiopotilaista Yhdysvalloissa lumekontrolloiduissa tutkimuksissa. Ortostaattiseen hypotensioon liittyviä oireita raportoitiin toisella 0,8 %:lla potilaista.
Oireista hypotensiota esiintyy todennäköisimmin potilailla, joilla on ollut neste- tai suolavajaus pitkittyneen diureettihoidon, ruokavalion suolarajoituksen, dialyysin, ripulin tai oksentelun seurauksena [ks. ANNOSTELU JA HALLINNOINTI ].
ACE:n estäjät voivat aiheuttaa liiallista hypotensiota, ja niihin voi liittyä oliguriaa tai atsotemiaa ja harvoin akuuttia munuaisten vajaatoimintaa ja kuolemaa. Potilailla, joilla on iskeeminen sydänsairaus tai aivoverisuonisairaus, liiallinen verenpaineen lasku voi johtaa sydäninfarktiin tai aivoverisuonionnettomuuteen.
Potilailla, joilla on liiallisen hypotension riski, ACEON-hoito tulee aloittaa erittäin tarkassa lääkärin valvonnassa. Potilaita tulee seurata tarkasti kahden ensimmäisen hoitoviikon ajan ja aina, kun ACEON 2 mg:n ja/tai diureetin annosta suurennetaan.
Jos liiallista hypotensiota ilmaantuu, potilas on asetettava välittömästi makuuasentoon ja häntä on tarvittaessa hoidettava fysiologisen suolaliuoksen suonensisäisellä infuusiolla. ACEON 4 mg -hoitoa voidaan yleensä jatkaa tilavuuden ja verenpaineen palautumisen jälkeen.

Neutropenia/agranulosytoosi
ACE-estäjät on yhdistetty agranulosytoosiin ja luuytimen lamaan, useimmiten potilailla, joilla on munuaisten vajaatoiminta, erityisesti potilailla, joilla on kollageeniverisuonitauti, kuten systeeminen lupus erythematosus tai skleroderma.
Sikiön toksisuus
Raskausluokka D
Reniini-angiotensiinijärjestelmään vaikuttavien lääkkeiden käyttö raskauden toisen ja kolmannen kolmanneksen aikana vähentää sikiön munuaisten toimintaa ja lisää sikiön ja vastasyntyneen sairastuvuutta ja kuolemaa. Tuloksena olevat oligohydramnionit voivat liittyä sikiön keuhkojen hypoplasiaan ja luuston epämuodostumiin. Mahdollisia vastasyntyneiden haittavaikutuksia ovat kallon hypoplasia, anuria, hypotensio, munuaisten vajaatoiminta ja kuolema. Kun raskaus havaitaan, lopeta ACEON 4 mg:n käyttö mahdollisimman pian [katso Käyttö tietyissä populaatioissa ].
Munuaisten vajaatoiminta
Reniini-angiotensiini-aldosteronijärjestelmän estämisen seurauksena munuaisten toiminnan muutoksia voidaan odottaa herkillä yksilöillä. Munuaisten toimintaa tulee seurata säännöllisesti potilailla, jotka saavat ACEONia [katso ANNOSTELU JA HALLINNOINTI ], [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Potilailla, joilla on vaikea sydämen vajaatoiminta ja munuaisten toiminta saattaa riippua reniini-angiotensiinialdosteronijärjestelmän aktiivisuudesta, ACE:n estäjien, mukaan lukien ACEON, hoitoon voi liittyä oliguriaa, etenevää atsotemiaa ja harvoin akuuttia munuaisten vajaatoimintaa ja kuolemaa.
Veren ureatypen ja seerumin kreatiniinipitoisuuden nousua saattaa esiintyä hypertensiivisillä potilailla, joilla on toispuolinen tai molempien munuaisvaltimon ahtauma. yleensä palautuu, kun ACE-estäjän käyttö lopetetaan. Tällaisten potilaiden munuaisten toimintaa tulee seurata muutaman ensimmäisen hoitoviikon aikana.
Joillekin ACEON-hoitoa saaneille potilaille on kehittynyt vähäistä ja ohimenevää veren ureatyppi- ja seerumin kreatiniinipitoisuuden nousua, erityisesti niillä, joita on hoidettu samanaikaisesti diureetilla.
Hyperkalemia
Seerumin kaliumpitoisuuden nousua on havaittu joillakin ACE:n estäjillä, mukaan lukien ACEONilla, hoidetuilla potilailla. Useimmat tapaukset olivat yksittäisiä yksittäisiä arvoja, jotka eivät vaikuttaneet kliinisesti merkityksellisiltä ja olivat harvoin syynä lopettamiseen. Hyperkalemian kehittymisen riskitekijöitä ovat munuaisten vajaatoiminta, diabetes mellitus ja samanaikainen käyttö kaliumia säästävien diureettien, kaliumlisien ja/tai kaliumia sisältävien suolan korvikkeiden kaltaisten aineiden kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Seerumin kaliumpitoisuutta tulee seurata säännöllisesti potilailla, jotka saavat ACEONia.
Yskä
Oletettavasti endogeenisen bradykiniinin hajoamisen estämisen vuoksi kaikkien ACE:n estäjien yhteydessä on raportoitu jatkuvaa tuottamatonta yskää, joka yleensä häviää hoidon lopettamisen jälkeen. Harkitse ACE-estäjän aiheuttamaa yskää yskän erotusdiagnoosissa.
Maksan vajaatoiminta
ACE:n estäjiin on harvoin liitetty oireyhtymää, joka alkaa kolestaattisella keltatuksella ja etenee fulminanttiksi maksanekroosiksi ja joskus kuolemaan. Tämän oireyhtymän mekanismia ei tunneta. ACE:n estäjähoitoa saavien potilaiden, joille kehittyy keltaisuutta tai huomattavaa maksaentsyymiarvojen nousua, tulee keskeyttää ACE:n estäjähoito ja saada asianmukaista lääketieteellistä seurantaa.
Leikkaus / anestesia
Potilailla, joille tehdään leikkaus tai anestesian aikana hypotensiota aiheuttavilla aineilla, ACEON voi estää angiotensiini II:n muodostumisen, joka muuten tapahtuisi kompensoivan reniinin vapautumisen seurauksena. Tästä mekanismista johtuva hypotensio voidaan korjata tilavuuden lisäämisellä.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeenisuus
Rotilla ja hiirillä tehdyissä tutkimuksissa ei havaittu todisteita karsinogeenisestä vaikutuksesta, kun perindopriilia annettiin annoksina, jotka olivat jopa 20-kertaisia (mg/kg) tai 2-4-kertaisia (mg/m2) verrattuna kliinisiin enimmäisannoksiin (16 mg/vrk). 104 viikkoa.
Mutageneesi
ACEONille, perindoprilaatille ja muille metaboliiteille ei havaittu genotoksisuutta useissa in vitro ja in vivo -tutkimuksissa, mukaan lukien Ames-testi, Saccharomyces cerevisiae D4 -testi, viljellyt ihmisen lymfosyytit, TK ± hiiren lymfoomamääritys, hiiren ja rotan mikrotumatestit ja kiinanhamsteri luuydinmääritys.
Hedelmällisyyden heikkeneminen
Rotilla ei ollut merkittävää vaikutusta lisääntymiskykyyn tai hedelmällisyyteen, kun annettiin enintään 30 kertaa (mg/kg) tai 6 kertaa (mg/m2) ehdotettua ACEONin kliinistä enimmäisannostusta 2 mg urosten spermatogeneesin tai oogeneesin ja tiineyden aikana. naisilla.
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka D [katso LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ].
Reniini-angiotensiinijärjestelmään vaikuttavien lääkkeiden käyttö raskauden toisen ja kolmannen kolmanneksen aikana vähentää sikiön munuaisten toimintaa ja lisää sikiön ja vastasyntyneen sairastuvuutta ja kuolemaa. Tuloksena olevat oligohydramnionit voivat liittyä sikiön keuhkojen hypoplasiaan ja luuston epämuodostumiin. Mahdollisia vastasyntyneiden haittavaikutuksia ovat kallon hypoplasia, anuria, hypotensio, munuaisten vajaatoiminta ja kuolema. Kun raskaus havaitaan, lopeta ACEON-hoito mahdollisimman pian. Nämä haittavaikutukset liittyvät yleensä näiden lääkkeiden käyttöön raskauden toisen ja kolmannen kolmanneksen aikana. Useimmat epidemiologiset tutkimukset, joissa tutkittiin sikiön poikkeavuuksia verenpainetta alentaville lääkkeille ensimmäisen raskauskolmanneksen aikana, eivät ole erottaneet reniini-angiotensiinijärjestelmään vaikuttavia lääkkeitä muista verenpainetta alentavista aineista.
Äidin verenpainetaudin asianmukainen hoito raskauden aikana on tärkeää sekä äidin että sikiön tulosten optimoimiseksi.
Siinä epätavallisessa tapauksessa, että reniini-angiotensiinijärjestelmään vaikuttavilla lääkkeillä ei ole sopivaa vaihtoehtoa tietylle potilaalle, kerro äidille mahdollisesta riskistä sikiölle. Suorita sarja ultraäänitutkimuksia lapsivesiympäristön arvioimiseksi. Jos havaitaan oligohydramnionia, lopeta ACEON 2 mg:n käyttö, ellei sitä pidetä äidin hengenpelastajana. Sikiötestaus voi olla asianmukaista raskausviikon perusteella. Potilaiden ja lääkäreiden tulee kuitenkin olla tietoisia siitä, että oligohydramnionit saattavat ilmaantua vasta sen jälkeen, kun sikiö on saanut peruuttamattoman vaurion. Tarkkaile tarkasti pikkulapsia, jotka ovat altistuneet kohdussa ACEONille hypotension, oligurian ja hyperkalemian vuoksi [ks. Käyttö lapsille ].
Radioaktiivisuutta havaittiin sikiöissä sen jälkeen, kun 14C-perindopriilia annettiin raskaana oleville rotille.
Imettävät äidit
Imettävien rottien maito sisälsi radioaktiivisuutta 14C-perindopriilin antamisen jälkeen. Ei tiedetä, erittyykö perindopriili äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon, on noudatettava varovaisuutta, kun ACEONia annetaan imettäville äideille.
Käyttö lapsille
Vastasyntyneet, jotka ovat aiemmin altistuneet kohdussa ACEONille
Jos esiintyy oliguriaa tai hypotensiota, kiinnitä huomiota verenpaineen ja munuaisten perfuusion tukemiseen. Vaihtosiirtoja tai dialyysiä voidaan tarvita keinona vähentää hypotensiota ja/tai korvata häiriintynyttä munuaisten toimintaa. Perindopriili, joka läpäisee istukan, voidaan teoriassa poistaa vastasyntyneen verenkierrosta näillä tavoilla, mutta rajallinen kokemus ei ole osoittanut, että tällainen poistaminen olisi keskeistä näiden imeväisten hoidossa.
ACEON 8 mg:n turvallisuutta ja tehoa lapsipotilailla ei ole osoitettu.
Geriatrinen käyttö
Perindopriilin keskimääräinen verenpainevaikutus oli hieman pienempi yli 60-vuotiailla kuin nuoremmilla potilailla, vaikka ero ei ollutkaan merkitsevä. Sekä perindopriilin että perindoprilaatin pitoisuudet plasmassa olivat suurentuneet iäkkäillä potilailla verrattuna nuorempien potilaiden pitoisuuksiin. Mikään haittavaikutus ei selvästi lisääntynyt iäkkäillä potilailla huimausta ja mahdollisesti ihottumaa lukuun ottamatta.
Aloita pienellä annoksella ja titraa hitaasti tarpeen mukaan. Tarkkaile huimausta kaatumisvaaran vuoksi.
Kokemukset ACEON 8 mg:n käytöstä iäkkäillä potilailla yli 8 mg:n vuorokausiannoksilla ovat rajalliset.
Munuaisten vajaatoiminta
Annoksen muuttaminen voi olla tarpeen munuaisten vajaatoimintapotilailla [ks ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
Perindoprilaatin hyötyosuus lisääntyy potilailla, joilla on heikentynyt maksan toiminta [ks KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Eläimillä perindopriiliannokset 2 500 mg/kg asti hiirillä, 3 000 mg/kg rotilla ja 1 600 mg/kg koirilla eivät olleet tappavia. Aikaisemmat kokemukset olivat niukat, mutta viittasivat siihen, että ihmiset sietävät myös muiden ACE-estäjien yliannostusta melko hyvin. Todennäköisin ilmentymä on hypotensio, ja hoidon tulee olla oireenmukaista ja tukevaa. ACE:n estäjähoito on lopetettava ja potilasta on tarkkailtava. Kuivumista, elektrolyyttitasapainoa ja hypotensiota tulee hoitaa vakiintuneiden menetelmien mukaisesti.
Raportoiduista perindopriilin yliannostustapauksista potilaat, joiden tiedettiin nauttineen 80–120 mg:n annoksen, tarvitsivat avustettua ventilaatiota ja verenkiertoa. Yhdelle potilaalle kehittyi hypotermia, verenkiertopysähdys ja hän kuoli otettuaan enintään 180 mg perindopriilia. Perindopriilin yliannostuksen hoito saattaa vaatia voimakasta tukea.
Perindopriilin ja sen metaboliittien seerumipitoisuuksien laboratoriomäärityksiä ei ole laajalti saatavilla, eikä tällaisilla määrityksillä ole missään tapauksessa vahvistettu roolia perindopriilin yliannostuksen hoidossa.
Ei ole saatavilla tietoja, jotka viittaavat fysiologisiin liikkeisiin (esim. virtsan pH:n muuttamiseen), jotka voisivat nopeuttaa perindopriilin ja sen metaboliittien eliminaatiota. Perindopriili voidaan poistaa hemodialyysillä, ja perindopriilin puhdistuma on 52 ml/min ja perindoprilaatin 67 ml/min.
Angiotensiini II voisi oletettavasti toimia spesifisenä antagonistina vastalääkkeenä perindopriilin yliannostuksen selvittämisessä, mutta angiotensiini II:ta ei käytännössä ole saatavilla hajallaan olevien tutkimuslaitosten ulkopuolella. Koska perindopriilin verenpainetta alentava vaikutus saavutetaan verisuonia laajentamalla ja tehokkaalla hypovolemialla, perindopriilin yliannostusta on järkevää hoitaa infuusiona normaalia suolaliuosta.
VASTA-AIHEET
ACEON® (perindopriilierbumiini) on vasta-aiheinen potilaille, joiden tiedetään olevan yliherkkiä (mukaan lukien angioedeema) tälle tuotteelle tai muille ACE:n estäjille. ACEON 4mg on myös vasta-aiheinen potilailla, joilla on perinnöllinen tai idiopaattinen angioedeema.
Älä anna aliskireenia samanaikaisesti ACEONin kanssa diabeetikoille. [katso HUUMEIDEN VUOROVAIKUTUKSET ]
ACEON on vasta-aiheinen yhdessä neprilysiinin estäjän (esim. sacubitril) kanssa. Älä anna ACEON 8mg 36 tunnin kuluessa vaihtamisesta sacubitril/valsartaaniin, neprilysiinin estäjään, tai siitä pois (ks. VAROITUKSET JA VAROTOIMET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
ACEON® (perindopriilierbumiini) on perindoprilaatin aihiolääke, joka estää ACE:tä ihmisillä ja eläimillä. Perindoprilaatin verenpainetta alentavan mekanismin uskotaan ensisijaisesti estävän ACE:n aktiivisuutta. ACE on peptidyylidipeptidaasi, joka katalysoi inaktiivisen dekapeptidin, angiotensiini I:n, konversiota vasokonstriktoriksi, angiotensiini II:ksi. Angiotensiini II on voimakas perifeerinen vasokonstriktori, joka stimuloi aldosteronin eritystä lisämunuaiskuoressa ja antaa negatiivista palautetta reniinin erittymisestä. ACE:n esto johtaa plasman angiotensiini II:n vähenemiseen, mikä vähentää vasokonstriktiota, lisää plasman reniiniaktiivisuutta ja vähentää aldosteronin eritystä. Jälkimmäinen johtaa diureesiin ja natriureesiin, ja se voi liittyä seerumin kaliumpitoisuuden vähäiseen nousuun.
ACE on identtinen kininaasi II:n kanssa, entsyymin, joka hajottaa bradykiniiniä. Vielä on selvitettävä, onko bradykiniinin, voimakkaan vasodepressoripeptidin, kohonneilla tasoilla merkitystä ACEON 4 mg:n terapeuttisissa vaikutuksissa.
Vaikka perindopriilin pääasiallisen verenpainetta alentavan mekanismin uskotaan tapahtuvan reniini-angiotensiini-aldosteronijärjestelmän kautta, ACE:n estäjillä on jonkin verran vaikutusta jopa näennäisesti matalareniinipitoiseen verenpaineeseen. Perindopriilia on tutkittu suhteellisen harvoilla mustaihoisilla potilailla, yleensä matalareniinipitoisilla potilailla, ja diastolisen verenpaineen keskimääräinen vaste perindopriiliin oli noin puolet ei-mustaihoisilla potilailla havaitusta vasteesta, mikä on yhtäpitävä muiden ACE:n estäjien aiemman kokemuksen kanssa.
Farmakodynamiikka
Perindopriilin annon jälkeen ACE estyy annoksesta ja veren pitoisuudesta riippuvaisella tavalla, ja maksimaalinen 80-90 %:n esto saavutetaan 8 mg:n annoksella 10-12 tunnin ajan. 24 tunnin ACE:n esto on noin 60 % näiden annosten jälkeen. Tietyllä annoksella saavutettu ACE:n eston aste näyttää heikkenevän ajan myötä (ID50 kasvaa). Perindopriili vähentää angiotensiini I -infuusion painevastetta, mutta tämä vaikutus ei ole yhtä pysyvä kuin vaikutus ACE:hen; 24 tunnin kuluttua 12 mg:n annoksesta on noin 35 %:n esto.
Farmakokinetiikka
Imeytyminen
ACEONin oraalinen antaminen johtaa huippupitoisuuksiin plasmassa, joka saavutetaan noin tunnin kuluttua. Perindopriilin absoluuttinen oraalinen hyötyosuus on noin 75 %. Imeytymisen jälkeen noin 30–50 % systeemisesti saatavilla olevasta perindopriilistä hydrolysoituu aktiiviseksi metaboliitiksi, perindoprilaatiksi, jonka keskimääräinen hyötyosuus on noin 25 %. Perindoprilaatin huippupitoisuudet plasmassa saavutetaan 3–7 tunnin kuluttua perindopriilin annosta. ACEON 8 mg:n oraalinen antaminen ruoan kanssa ei merkittävästi vähennä perindopriilin imeytymisnopeutta tai laajuutta verrattuna paastotilaan. Perindopriilin biotransformaatio aktiiviseksi metaboliitiksi perindoprilaatiksi vähenee kuitenkin noin 43 %, mikä johtaa plasman ACE:n estokäyrän pienenemiseen noin 20 %, mikä on todennäköisesti kliinisesti merkityksetöntä. Kliinisissä tutkimuksissa perindopriilia annettiin yleensä ei-paastotilassa.
ACEONin 4 mg, 8 mg ja 16 mg annoksilla perindopriilin ja perindoprilaatin Cmax ja AUC suurenevat suhteessa annokseen sekä kerta-annoksen jälkeen suun kautta että vakaassa tilassa kerran vuorokaudessa toistuvan annostelun aikana.
Jakelu
Noin 60 % verenkierrossa olevasta perindopriilistä sitoutuu plasman proteiineihin ja vain 10-20 % perindoprilaatista. Siksi proteiinien sitoutumiseen liittyvien vaikutusten välittämiä lääkevuorovaikutuksia ei odoteta.
Aineenvaihdunta ja eliminaatio
Suun kautta annetun perindopriilin farmakokinetiikka on moniosastoinen, mukaan lukien syväkudososasto (ACE-sitoutumiskohdat). Perindopriilin keskimääräinen puoliintumisaika, johon liittyy suurin osa sen eliminaatiosta, on noin 0,8-1 tuntia.
Perindopriili metaboloituu laajalti suun kautta annetun annon jälkeen, ja vain 4–12 % annoksesta erittyy muuttumattomana virtsaan. On tunnistettu kuusi metaboliittia, jotka johtuvat hydrolyysistä, glukuronidaatiosta ja dehydraation kautta tapahtuvasta syklisaatiosta. Näitä ovat aktiivinen ACE:n estäjä, perindoprilaatti (hydrolysoitu perindopriili), perindopriili- ja perindoprilaattiglukuronidit, dehydratoitu perindopriili ja dehydratoidun perindoprilaatin diastereoisomeerit. Ihmisillä maksaesteraasi näyttää olevan vastuussa perindopriilin hydrolyysistä.
Aktiivisella metaboliitilla, perindoprilaatilla, on myös moniosastoinen farmakokinetiikka ACEONin oraalisen annon jälkeen. Perindoprilaatin muodostuminen tapahtuu asteittain ja huippupitoisuudet plasmassa saavutetaan 3–7 tunnin kuluttua. Myöhempi plasmapitoisuuden lasku osoittaa suurimman osan eliminaation näennäisestä keskimääräisestä puoliintumisajasta 3–10 tuntia, ja terminaalinen eliminaation puoliintumisaika pitenee 30–120 tuntia, mikä johtuu perindoprilaatin hitaasta dissosiaatiosta plasman/kudosten ACE:n sitoutumisesta. sivustoja. Kun perindopriilia annetaan toistuvasti suun kautta kerran vuorokaudessa, perindoprilaatti kumuloituu noin 1,5-2-kertaiseksi ja saavuttaa vakaan tilan plasmapitoisuuden 3-6 päivässä. Perindoprilaatin ja sen metaboliittien puhdistuma tapahtuu lähes yksinomaan munuaisten kautta.
Vanhukset
Sekä perindopriilin että perindoprilaatin pitoisuudet plasmassa iäkkäillä potilailla (yli 70-vuotiailla) ovat noin kaksinkertaiset nuoremmilla potilailla havaittuun verrattuna, mikä heijastaa sekä perindopriilin lisääntynyttä muuttumista perindoprilaatiksi että perindoprilaatin vähentynyttä erittymistä munuaisten kautta [ks. ANNOSTELU JA HALLINNOINTI ja Käyttö tietyissä populaatioissa ].
Sydämen vajaatoiminta
Perindoprilaatin puhdistuma vähenee kongestiivista sydämen vajaatoimintaa sairastavilla potilailla, mikä johtaa 40 % korkeampaan annosväliin AUC:tä.
Munuaisten vajaatoiminta
Perindopriiliannoksilla 2–4 mg perindoprilaatin AUC suurenee munuaisten toiminnan heikkenemisen myötä. Kun kreatiniinipuhdistuma on 30–80 ml/min, AUC on noin kaksinkertainen nopeudella 100 ml/min. Kun kreatiniinipuhdistuma laskee alle 30 ml/min, AUC kasvaa selvemmin.
Pienellä määrällä tutkittuja potilaita perindopriilin puhdistuma dialyysillä oli noin 40-80 ml/min. Perindoprilaatin puhdistuma dialyysillä vaihteli välillä noin 40-90 ml/min [ks. ANNOSTELU JA HALLINNOINTI ].
Maksan vajaatoiminta
Perindoprilaatin hyötyosuus on suurentunut potilailla, joilla on maksan vajaatoiminta. Perindoprilaatin pitoisuudet plasmassa maksan vajaatoimintaa sairastavilla potilailla olivat noin 50 % korkeammat kuin terveillä koehenkilöillä tai verenpainepotilailla, joilla on normaali maksan toiminta.
Kliiniset tutkimukset
Hypertensio
Lumekontrolloiduissa tutkimuksissa perindopriilin monoterapialla (2 mg - 16 mg kerran vuorokaudessa) potilailla, joiden keskimääräinen verenpaine oli noin 150/100 mm Hg, 2 mg:lla oli vain vähän vaikutusta, mutta annokset 4 mg - 16 mg alensivat verenpainetta. 8 mg:n ja 16 mg:n annoksia ei voitu erottaa toisistaan, ja molemmilla oli suurempi vaikutus kuin 4 mg:n annoksella. Näissä tutkimuksissa 8 mg:n ja 16 mg:n vuorokausiannokset laskivat selällään verenpainetta 9–15/5–6 mm Hg. Kun verrattiin annostusta kerran päivässä ja kahdesti päivässä, kahdesti vuorokaudessa annettu annostusohjelma oli yleensä hieman parempi, mutta ei enempää kuin noin 0,5 mm Hg - 1 mm Hg. Perindopriilia 2–16 mg:n annosten jälkeen systolisen ja diastolisen verenpaineen alimmat vaikutukset olivat noin 75–100 % huippuvaikutuksista.
Perindopriilin vaikutukset verenpaineeseen olivat samankaltaisia, kun sitä annettiin yksinään tai yhdessä 25 mg:n hydroklooritiatsidiannoksen kanssa. Yleensä perindopriilin vaikutus ilmaantui nopeasti, ja vaikutukset lisääntyivät hieman useiden viikkojen aikana.
ACEON®:n (perindopriilierbumiinin) muodollisia yhteisvaikutustutkimuksia ei ole tehty muiden verenpainetta alentavien aineiden kuin tiatsideilla. Rajoitettu kokemus kontrolloiduista ja kontrolloimattomista tutkimuksista, joissa ACEON 2 mg annettiin samanaikaisesti kalsiumkanavasalpaajan, loop-diureetin tai kolmoishoidon (beetasalpaaja, vasodilataattori ja diureetti) kanssa, ei viittaa odottamattomiin yhteisvaikutuksiin. Yleensä ACE:n estäjillä on vähemmän kuin additiivinen vaikutus, kun niitä annetaan yhdessä beetasalpaajien kanssa, oletettavasti siksi, että molemmat toimivat osittain reniini-angiotensiinijärjestelmän kautta.
Kontrolloimattomissa tutkimuksissa potilailla, joilla on insuliinista riippuvainen diabetes, perindopriili ei näyttänyt vaikuttavan sokeritasapainoon. Pitkäaikaisessa käytössä näillä potilailla ei havaittu vaikutusta proteiinin erittymiseen virtsaan.
Sukupuoli ei vaikuttanut ACEON 4 mg:n tehoon, ja se oli vähemmän tehokas mustaihoisilla potilailla kuin muilla potilailla. Iäkkäillä potilailla (yli tai yhtä suuri kuin 60 vuotta) keskimääräinen verenpainevaikutus oli hieman pienempi kuin nuoremmilla potilailla, vaikka ero ei ollutkaan merkitsevä.
Stabiili sepelvaltimotauti
Eurooppalainen tutkimus Sydäntapahtumien vähentämisestä perindopriililla stabiilissa sepelvaltimotaudissa (EUROPA) oli monikeskustutkimus, satunnaistettu, kaksoissokkoutettu ja lumekontrolloitu tutkimus, johon osallistui 12 218 potilasta, joilla oli todisteita stabiilista sepelvaltimotaudista ilman kliinistä sydämen vajaatoimintaa. Potilailla oli todisteita sepelvaltimotaudista aiemman sydäninfarktin vuoksi yli 3 kuukautta ennen seulontaa, sepelvaltimoiden revaskularisaatiota yli 6 kuukautta ennen seulontaa, angiografisia todisteita ahtautumisesta (vähintään 70 %:n yhden tai useamman suuren sepelvaltimoiden kapeneminen) tai positiivista stressiä testi miehillä, joilla on ollut rintakipuja. Neljän viikon sisäänajojakson jälkeen, jonka aikana kaikki potilaat saivat perindopriilia 2–8 mg, potilaat jaettiin satunnaisesti 8 mg perindopriiliin kerran vuorokaudessa (n=6110) tai vastaavaan lumelääkettä (n=6108). Keskimääräinen seuranta-aika oli 4,2 vuotta. Tutkimuksessa tarkasteltiin perindopriilin pitkäaikaisvaikutuksia ajoissa ensimmäiseen kardiovaskulaariseen kuolleisuuteen, ei-kuolemaan johtaneeseen sydäninfarktiin tai sydämenpysähdykseen potilailla, joilla oli vakaa sepelvaltimotauti.
Potilaiden keski-ikä oli 60 vuotta; 85 % oli miehiä, 92 % käytti verihiutaleiden estäjiä, 63 % β-salpaajia ja 56 % lipidejä alentavaa hoitoa. EUROPA-tutkimus osoitti, että perindopriili vähensi merkittävästi ensisijaisen päätetapahtuman suhteellista riskiä (taulukko 1). Tämä hyödyllinen vaikutus johtuu suurelta osin ei-fataalin sydäninfarktin riskin vähenemisestä. Tämä perindopriilin suotuisa vaikutus ensisijaiseen tulokseen oli ilmeinen noin vuoden hoidon jälkeen (kuva 1). Tulos oli samanlainen kaikissa ennalta määritellyissä alaryhmissä iän, perussairauden tai samanaikaisen lääkityksen mukaan (kuva 2).
Kuva 1. Aika ensisijaisen päätepisteen ensimmäiseen esiintymiseen 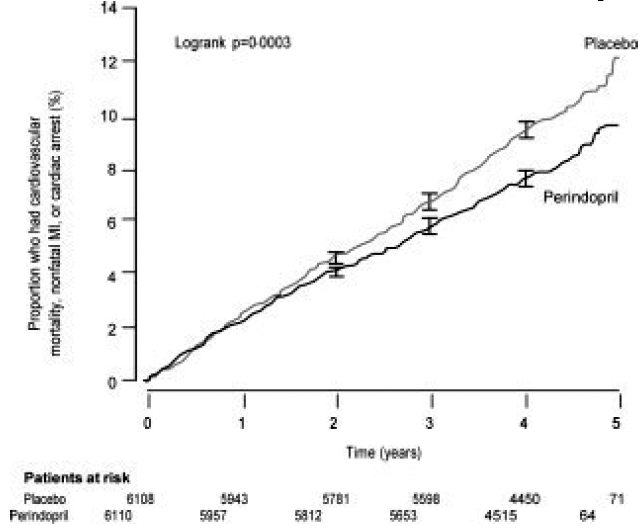
Kuva 2. Perindopriilihoidon edullinen vaikutus ensisijaiseen päätepisteeseen ennalta määritellyissä alaryhmissä 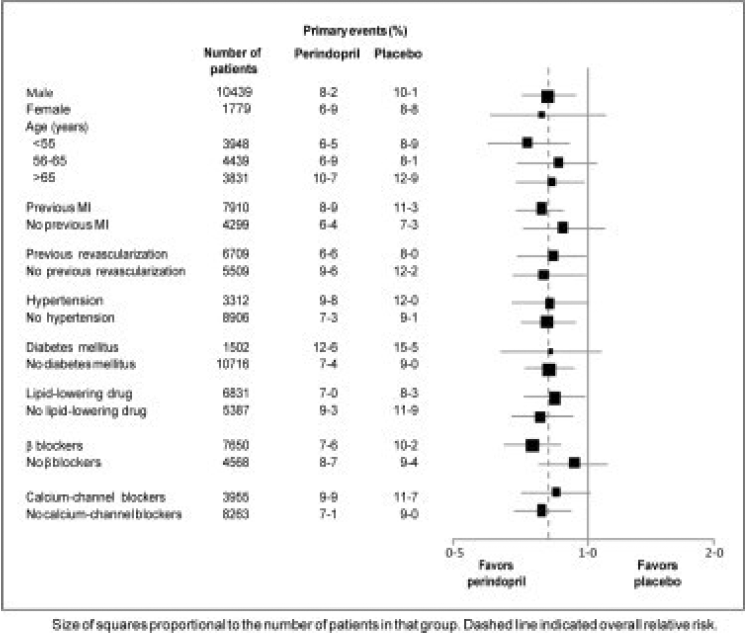
POTILASTIEDOT
Hedelmällisessä iässä oleville naispotilaille tulee kertoa raskaudenaikaisen ACEON 2mg -altistuksen seurauksista. Keskustele hoitovaihtoehdoista raskautta suunnittelevien naisten kanssa. Potilaita tulee pyytää ilmoittamaan raskaudesta lääkärilleen mahdollisimman pian.
Pyydä potilaita ilmoittamaan viipymättä kaikista infektion viitteistä (esim. kurkkukipu, kuume), jotka voivat olla merkki neutropeniasta.
