Coreg 3.12mg, 6.25mg, 12.5mg, 25mg Carvedilol Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Coreg 25mg on ja miten sitä käytetään?
Coreg on reseptilääke, jota käytetään sydämen vajaatoiminnan ja korkean verenpaineen (hypertension) oireiden hoitoon. Coreg 25 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Coreg kuuluu lääkeryhmään nimeltä beetasalpaajat, Alpha Activity.
Ei tiedetä, onko Coreg 25 mg turvallinen ja tehokas lapsille.
Mitkä ovat Coregin mahdolliset sivuvaikutukset?
Coreg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- huimaus,
- hitaat tai epätasaiset sydämenlyönnit,
- kylmyyden tunne tai tunnottomuus sormissa tai varpaissa,
- rintakipu,
- kuiva yskä,
- hengityksen vinkuminen,
- puristava tunne rinnassa,
- turvotus,
- nopea painonnousu,
- hengenahdistuksen tunne,
- lisääntynyt jano,
- lisääntynyt virtsaaminen,
- suun kuivuminen ja
- hedelmäinen hengityksen tuoksu
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Coreg 6,25 mg:n yleisimmät sivuvaikutukset ovat:
- huimaus,
- hitaat sydämenlyönnit,
- ripuli,
- painonnousu,
- kuivat silmät ja
- vaikeuksia käyttää piilolinssejä
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Coregin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
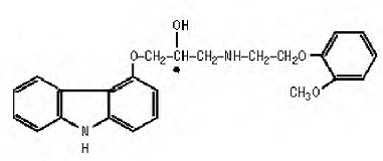
Karvediloli on ei-selektiivinen β-adrenerginen salpaaja, jolla on α1-salpaaja. Se on (±)-1(karbatsol-4-yylioksi)-3-[[2-(o-metoksifenoksi)etyyli]amino]-2-propanoli. Karvediloli on raseeminen seos, jolla on seuraava rakenne:
COREG 6,25 mg on valkoinen, soikea, kalvopäällysteinen tabletti, joka sisältää 3,125 mg, 6,25 mg, 12,5 mg tai 25 mg karvedilolia. 6,25 mg:n, 12,5 mg:n ja 25 mg:n tabletit ovat TILTAB-tabletteja. Inaktiiviset aineet koostuvat kolloidisesta piidioksidista, krospovidonista, hypromelloosista, laktoosista, magnesiumstearaatista, polyetyleeniglykolista, polysorbaatti 80:stä, povidonista, sakkaroosista ja titaanidioksidista.
Karvediloli on valkoinen tai luonnonvalkoinen jauhe, jonka molekyylipaino on 406,5 ja molekyylikaava C24H26N2O4. Se liukenee vapaasti dimetyylisulfoksidiin; liukenee metyleenikloridiin ja metanoliin; niukkaliukoinen 95 % etanoliin ja isopropanoliin; liukenee hieman etyylieetteriin; ja käytännössä liukenematon veteen, mahanesteeseen (simuloitu, TS, pH 1,1) ja suoliston nesteeseen (simuloitu, TS ilman pankreatiinia, pH 7,5).
INDIKAATIOT
Sydämen vajaatoiminta
COREG on tarkoitettu lievästä vaikeaan kroonisen iskeemisen tai kardiomyopaattisen sydämen vajaatoiminnan hoitoon, yleensä diureettien, ACE:n estäjien ja digitaliksen lisäksi eloonjäämisen lisäämiseksi ja myös sairaalahoidon riskin vähentämiseksi [ks. HUUMEIDEN VUOROVAIKUTUKSET , Kliiniset tutkimukset ].
Sydäninfarktin jälkeinen vasemman kammion toimintahäiriö
COREG on tarkoitettu vähentämään kardiovaskulaarista kuolleisuutta kliinisesti vakailla potilailla, jotka ovat selvinneet sydäninfarktin akuutista vaiheesta ja joiden vasemman kammion ejektiofraktio on enintään 40 % (oireisen sydämen vajaatoiminnan kanssa tai ilman) [ks. Kliiniset tutkimukset ].
Hypertensio
COREG 25 mg on tarkoitettu essentiaalisen hypertension hoitoon [katso Kliiniset tutkimukset ]. Sitä voidaan käyttää yksinään tai yhdessä muiden verenpainetta alentavien aineiden, erityisesti tiatsidityyppisten diureettien, kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
ANNOSTELU JA HALLINNOINTI
COREG tulee ottaa ruoan kanssa imeytymisnopeuden hidastamiseksi ja ortostaattisten vaikutusten vähentämiseksi.
Sydämen vajaatoiminta
Lääkärin ON TÄYTYY YKSILÖLLISTÄ ANNOSTUS JA SEURAA TÄYSIN TITRAAMISEN AIKANA. Ennen COREG 12,5 mg -hoidon aloittamista on suositeltavaa minimoida nesteen kertyminen. Suositeltu COREG-aloitusannos on 3,125 mg kahdesti vuorokaudessa 2 viikon ajan. Jos potilas sietää, annosta voidaan suurentaa 6,25, 12,5 ja 25 mg:aan kahdesti vuorokaudessa peräkkäisinä vähintään 2 viikon välein. Potilaiden tulee käyttää pienempiä annoksia, jos ne eivät siedä suurempia annoksia. Suurin annos 50 mg kahdesti vuorokaudessa on annettu potilaille, joilla on lievä tai keskivaikea sydämen vajaatoiminta ja jotka painavat yli 85 kg (187 lbs).
Potilaita tulee kertoa, että hoidon aloittamiseen ja (vähemmässä määrin) annoksen suurentamiseen saattaa liittyä ohimeneviä huimauksen tai huimauksen oireita (ja harvoin pyörtymistä) ensimmäisen tunnin kuluessa annostelusta. Tänä aikana potilaiden tulee välttää tilanteita, kuten ajamista tai vaarallisia tehtäviä, joissa oireet voivat johtaa loukkaantumiseen. Verisuonia laajentavat oireet eivät usein vaadi hoitoa, mutta voi olla hyödyllistä erottaa COREG 6,25 mg:n antoaika ACE:n estäjän annostelusta tai pienentää tilapäisesti ACE-estäjän annosta. COREG 12,5 mg:n annosta ei saa suurentaa, ennen kuin sydämen vajaatoiminnan pahenemisen tai verisuonten laajenemisen oireet ovat vakiintuneet.
Nesteretentiota (johon liittyy tai ei ole ohimeneviä sydämen vajaatoiminnan oireita) tulee hoitaa suurentamalla diureettien annosta.
COREG-annosta tulee pienentää, jos potilaalla on bradykardia (syke alle 55 lyöntiä minuutissa).
Huimaus- tai nesteretentiojaksot COREG 3,12 mg -hoidon aloituksen aikana voidaan yleensä hoitaa ilman hoidon keskeyttämistä, eivätkä ne estä myöhempää onnistunutta karvedilolin titrausta tai suotuisaa vastetta karvedilolille.
Sydäninfarktin jälkeinen vasemman kammion toimintahäiriö
ANNOSTUS ON YKSILÖLLISETTÄVÄ JA VALVOTTAVA KOOSTAMUKSEN AIKANA. COREG-hoito voidaan aloittaa laitoshoidossa tai avohoidossa, ja se tulee aloittaa, kun potilas on hemodynaamisesti vakaa ja nesteretentio on minimoitu. On suositeltavaa, että COREG 3,12 mg aloitetaan annoksella 6,25 mg kahdesti vuorokaudessa ja nostetaan 3–10 päivän kuluttua siedettävyyden perusteella 12,5 mg:aan kahdesti vuorokaudessa ja sitten taas tavoiteannokseen 25 mg kahdesti vuorokaudessa. Voidaan käyttää pienempää aloitusannosta (3,125 mg kahdesti vuorokaudessa) ja/tai titrausnopeutta voidaan hidastaa, jos se on kliinisesti aiheellista (esim. alhaisen verenpaineen tai sydämen sykkeen tai nesteretention vuoksi). Potilaiden tulee käyttää pienempiä annoksia, jos ne eivät siedä suurempia annoksia. Suositeltua annostusta ei tarvitse muuttaa potilailla, jotka saivat IV-hoitoa tai oraalista beetasalpaajaa sydäninfarktin akuutin vaiheen aikana.
Hypertensio
ANNOSTUS TÄYTYY PERUSTAA. COREGin suositeltu aloitusannos 6,25 mg on 6,25 mg kahdesti vuorokaudessa. Jos tämä annos siedetään, annosta tulee säilyttää noin 1 tunti annostelun jälkeen mitattuna seisovassa systolisessa paineessa 7–14 päivän ajan, minkä jälkeen annosta nostetaan tarvittaessa 12,5 mg:aan kahdesti vuorokaudessa alimman verenpaineen perusteella. seisova systolinen paine 1 tunti annostelun jälkeen toleranssin ohjeena. Tätä annosta tulee myös säilyttää 7–14 päivän ajan, minkä jälkeen sitä voidaan nostaa 25 mg:aan kahdesti vuorokaudessa, jos se siedetään ja tarvitaan. COREG 6,25 mg:n täysi verenpainetta alentava vaikutus havaitaan 7–14 päivässä. Päivittäinen kokonaisannos ei saa ylittää 50 mg.
Samanaikaisen antamisen diureetin kanssa voidaan odottaa aiheuttavan additiivisia vaikutuksia ja voimistavan karvedilolin vaikutuksen ortostaattista komponenttia.
Maksan vajaatoiminta
COREG 25 mg:aa ei tule antaa potilaille, joilla on vaikea maksan vajaatoiminta (ks VASTA-AIHEET ].
MITEN TOIMITETAAN
Annostus ja vahvuudet
Valkoisia, soikeita, kalvopäällysteisiä tabletteja on saatavana seuraavina vahvuuksina:
- 3,125 mg - kaiverrettu "39" ja "SB"
- 6,25 mg – kaiverrettu "4140" ja "SB"
- 12,5 mg – kaiverrettu "4141" ja "SB"
- 25 mg – kaiverrettu "4142" ja "SB"
Varastointi ja käsittely
Valkoisia, soikeita, kalvopäällysteisiä tabletteja on saatavana seuraavina vahvuuksina:
- 3,125 mg - kaiverrettu "39" ja "SB"
- 6,25 mg – kaiverrettu "4140" ja "SB"
- 12,5 mg – kaiverrettu "4141" ja "SB"
- 25 mg – kaiverrettu "4142" ja "SB"
6,25 mg:n, 12,5 mg:n ja 25 mg:n tabletit ovat TILTAB-tabletteja.
- 3,125 mg:n 100:n pullot: NDC 0007-4139-20
- 6,25 mg:n 100:n pullot: NDC 0007-4140-20
- 12,5 mg:n 100:n pullot: NDC 0007-4141-20
- 25 mg:n 100:n pullot: NDC 0007-4142-20
Säilytä alle 30°C (86°F). Suojaa kosteudelta. Annostele tiiviiseen, valonkestävään astiaan.
Valmistettu: GlaxoSmithKline Research Triangle Park, NC 27709. Tarkistettu: syyskuu 2017.
SIVUVAIKUTUKSET
Kokemus kliinisistä tutkimuksista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
COREG 25 mg:n turvallisuutta on arvioitu potilailla, joilla on sydämen vajaatoiminta (lievä, keskivaikea ja vaikea), potilailla, joilla on sydäninfarktin jälkeinen vasemman kammion toimintahäiriö, ja verenpainepotilailla. Havaittu haittavaikutusprofiili oli yhdenmukainen lääkkeen farmakologian ja koehenkilöiden terveydentilan kanssa kliinisissä tutkimuksissa. Alla on lueteltu kullekin näistä potilaspopulaatioista raportoidut haittatapahtumat. Poissuljettu ovat haittatapahtumat, joiden katsotaan olevan liian yleisiä ollakseen informatiivisia, ja sellaiset, jotka eivät kohtuudella liity lääkkeen käyttöön, koska ne liittyivät hoidettavaan sairauteen tai ovat hyvin yleisiä hoidetussa väestössä. Haittavaikutusten määrät olivat yleensä samanlaisia kaikissa väestöryhmissä (miehet ja naiset, vanhukset ja muut kuin iäkkäät, mustat ja muut kuin mustaihoiset).
Sydämen vajaatoiminta
COREG 12,5 mg:n turvallisuutta sydämen vajaatoiminnassa on arvioitu yli 4 500 potilaalla maailmanlaajuisesti, joista yli 2 100 osallistui lumelääkekontrolloituihin kliinisiin tutkimuksiin. Noin 60 % lumekontrolloiduissa kliinisissä tutkimuksissa hoidetusta kokonaisväestöstä sai COREG:ää 3,12 mg vähintään 6 kuukauden ajan ja 30 % COREG:tä vähintään 12 kuukauden ajan. COMET-tutkimuksessa 1 511 potilasta, joilla oli lievä tai keskivaikea sydämen vajaatoiminta, hoidettiin COREG:llä enintään 5,9 vuoden ajan (keskiarvo: 4,8 vuotta). Sekä yhdysvaltalaisissa kliinisissä tutkimuksissa lievästä keskivaikeaan sydämen vajaatoimintaan, joissa verrattiin COREG 3,12 mg:aa vuorokausiannoksina 100 mg asti (n = 765) lumelääkkeeseen (n = 437), että monikansallisessa kliinisessä tutkimuksessa vaikeaa sydämen vajaatoimintaa (COPERNICUS) ), jossa verrattiin COREGiä 50 mg:n päivittäisillä annoksilla (n = 1 156) lumelääkkeeseen (n = 1 133), ja haittavaikutusten keskeyttämisprosentti oli samanlainen karvediloli- ja lumelääkepotilailla. Lumekontrolloiduissa kliinisissä tutkimuksissa ainoa yli 1 %:n ja useammin karvedilolin käytön lopettamisen syy oli huimaus (COPERNICUS-tutkimuksessa 1,3 % karvedilolilla ja 0,6 % lumelääke).
Taulukossa 1 esitetään haittatapahtumat, jotka on raportoitu koehenkilöillä, joilla oli lievä tai keskivaikea sydämen vajaatoiminta, jotka osallistuivat yhdysvaltalaisiin lumekontrolloituihin kliinisiin tutkimuksiin ja joilla oli vaikea sydämen vajaatoiminta, jotka osallistuivat COPERNICUS-tutkimukseen. Näytetään haittatapahtumat, joita esiintyi useammin lääkkeillä hoidetuilla kuin lumelääkettä saaneilla henkilöillä, joiden ilmaantuvuus oli yli 3 % karvedilolilla hoidetuilla henkilöillä syy-yhteydestä riippumatta. Tutkimuslääkitysaltistuksen mediaani oli 6,3 kuukautta sekä karvediloli- että lumelääkepotilailla lievää tai keskivaikeaa sydämen vajaatoimintaa koskevissa tutkimuksissa ja 10,4 kuukautta vaikeaa sydämen vajaatoimintaa sairastavien koehenkilöiden tutkimuksessa. COREG 3,12 mg:n haittavaikutusprofiili, joka havaittiin pitkäaikaisessa COMET-tutkimuksessa, oli yleensä samanlainen kuin Yhdysvaltain sydämen vajaatoimintatutkimuksissa.
Näissä tutkimuksissa raportoitiin myös sydämen vajaatoimintaa ja hengenahdistusta, mutta esiintyvyys oli yhtä suuri tai suurempi lumelääkettä saaneilla koehenkilöillä.
Seuraavien haittatapahtumien esiintymistiheys oli yli 1 %, mutta pienempi tai yhtä suuri kuin 3 % ja useammin COREG-annoksella 3,12 mg joko Yhdysvalloissa tehdyissä lumekontrolloiduissa tutkimuksissa koehenkilöillä, joilla oli lievä tai keskivaikea sydämen vajaatoiminta. vaikea sydämen vajaatoiminta COPERNICUS-tutkimuksessa.
Ilmaantuvuus suurempi kuin 1 % tai vähemmän kuin 3 %
Keho kokonaisuutena: Allergia, huonovointisuus, hypovolemia, kuume, jalkojen turvotus.
Sydän: Nesteylimäärä, posturaalinen hypotensio, pahentunut angina pectoris, AV-katkos, sydämentykytys, verenpainetauti.
Keskus- ja ääreishermosto: Hypestesia, huimaus, parestesia.
Ruoansulatuskanava: Melena, parodontiitti.
Maksa ja sappijärjestelmä: SGPT kasvoi, SGOT kasvoi.
Aineenvaihdunta ja ravitsemus: Hyperurikemia, hypoglykemia, hyponatremia, lisääntynyt alkalinen fosfataasi, glykosuria, hypervolemia, diabetes mellitus, kohonnut GGT, painonpudotus, hyperkalemia, lisääntynyt kreatiniini.
Tuki- ja liikuntaelimistö: Lihaskrampit.
Verihiutaleet, verenvuoto ja hyytyminen: Protrombiinin lasku, purppura, trombosytopenia.
Psykiatrinen: Uneliaisuus.
Lisääntyvä, uros: Impotenssi.
Erityiset aistit: Näön hämärtyminen.
Virtsajärjestelmä: Munuaisten vajaatoiminta, albuminuria, hematuria.
Sydäninfarktin jälkeinen vasemman kammion toimintahäiriö
COREGin turvallisuutta on arvioitu akuutista sydäninfarkista, johon liittyy vasemman kammion toimintahäiriö, selviytyneillä CAPRICORN-tutkimuksessa, johon osallistui 969 henkilöä, jotka saivat 6,25 mg COREG:ää ja 980 lumelääkettä. Noin 75 % potilaista sai COREG 25 mg vähintään 6 kuukauden ajan ja 53 % sai COREG 12,5 mg vähintään 12 kuukauden ajan. Koehenkilöitä hoidettiin keskimäärin 12,9 kuukautta ja 12,8 kuukautta COREG-annoksella 12,5 mg ja lumelääkettä vastaavasti.
Yleisimmät CAPRICORN-tutkimuksessa raportoidut COREG 25 mg:n haittatapahtumat olivat yhdenmukaisia lääkkeen profiilin kanssa Yhdysvaltain sydämen vajaatoimintatutkimuksissa ja COPERNICUS-tutkimuksessa. Ainoat lisähaittatapahtumat, jotka ilmoitettiin CAPRICORNissa yli 3 %:lla ja yleisemmin karvedilolia saaneista, olivat hengenahdistus, anemia ja keuhkopöhö. Seuraavia haittavaikutuksia raportoitiin yli 1 %, mutta alle 3 % ja useammin COREG-hoidon yhteydessä: flunssaoireyhtymä, aivoverenkiertohäiriö, perifeerinen verisuonihäiriö, hypotonia, masennus, maha-suolikanavan kipu, niveltulehdus ja kihti. Haittavaikutuksista johtuvien hoidon keskeytysten kokonaismäärä oli samanlainen molemmissa koehenkilöryhmissä. Tässä tietokannassa ainoa yli 1 %:n ja useammin karvedilolin käytön lopettamisen syy oli hypotensio (1,5 % karvedilolilla ja 0,2 % lumelääkeryhmällä).
Hypertensio
COREGin turvallisuutta verenpainetaudissa on arvioitu yli 2 193 potilaalla Yhdysvalloissa tehdyissä kliinisissä tutkimuksissa ja 2 976 henkilöllä kansainvälisissä kliinisissä tutkimuksissa. Noin 36 % hoidetusta kokonaisväestöstä sai COREG-hoitoa vähintään 6 kuukauden ajan. Useimmat COREG 25 mg -hoidon aikana raportoidut haittatapahtumat olivat vaikeusasteeltaan lieviä tai kohtalaisia. Yhdysvalloissa kontrolloiduissa kliinisissä tutkimuksissa, joissa verrattiin suoraan COREG 12,5 mg:n annoksia enintään 50 mg:n annoksina (n = 1 142) lumelääkkeeseen (n = 462), 4,9 % COREG 6,25 mg:n saaneista potilaista keskeytti haittavaikutusten vuoksi ja 5,2 % lumelääkettä saaneista. Vaikka hoidon keskeyttämisasteessa ei ollut yleistä eroa, hoidon keskeytykset olivat yleisempiä karvediloliryhmässä posturaalisen hypotension vuoksi (1 % vs. 0). Haittavaikutusten yleinen ilmaantuvuus Yhdysvalloissa lumekontrolloiduissa tutkimuksissa lisääntyi COREG-annoksen kasvaessa. Yksittäisten haittatapahtumien osalta tämä voitiin erottaa vain huimauksesta, jonka esiintymistiheys lisääntyi 2 %:sta 5 %:iin päivittäisen kokonaisannoksen noustessa 6,25 mg:sta 50 mg:aan.
Taulukossa 2 esitetään haittatapahtumat Yhdysvalloissa lumekontrolloiduissa kliinisissä verenpainetutkimuksissa, joiden ilmaantuvuus oli suurempi tai yhtä suuri kuin 1 % riippumatta syy-yhteydestä ja jotka olivat yleisempiä lääkehoitoa saaneilla kuin lumelääkettä saaneilla.
Näissä tutkimuksissa raportoitiin myös hengenahdistusta ja väsymystä, mutta esiintyvyys oli yhtä suuri tai suurempi lumelääkettä saaneilla koehenkilöillä.
Seuraavien haittatapahtumien, joita ei ole kuvattu yllä, ilmoitettiin mahdollisesti tai todennäköisesti liittyen COREG 25 mg:aan maailmanlaajuisissa avoimissa tai kontrolloiduissa COREG 12,5 mg:n tutkimuksissa kohonneesta verenpaineesta tai sydämen vajaatoiminnasta kärsivillä koehenkilöillä.
Ilmaantuvuus suurempi kuin 0,1 % - pienempi tai yhtä suuri kuin 1 %
Sydän: Perifeerinen iskemia, takykardia.
Keskus- ja ääreishermosto m: Hypokinesia.
Ruoansulatuskanava: Bilirubinemia, kohonneet maksaentsyymiarvot (0,2 % verenpainepotilaista ja 0,4 % sydämen vajaatoimintapotilaista keskeytettiin hoito maksaentsyymiarvojen nousun vuoksi) [ks. Markkinoinnin jälkeinen kokemus ].
Psykiatrinen: Hermostuneisuus, unihäiriöt, pahentunut masennus, keskittymiskyvyn heikkeneminen, poikkeava ajattelu, paroniria, emotionaalinen labilisuus.
Hengitysjärjestelmä: Astma [katso VASTA-AIHEET ].
Lisääntyvä, uros: Vähentynyt libido.
Iho ja lisäkkeet: Kutina, erytematoottinen ihottuma, makulopapulaarinen ihottuma, psoriaasin muotoinen ihottuma, valoherkkyysreaktio.
Erityiset aistit: Tinnitus.
Virtsajärjestelmä: Virtsaaminen lisääntynyt.
Autonominen hermosto: Suun kuivuminen, lisääntynyt hikoilu.
Aineenvaihdunta ja ravitsemus: Hypokalemia, hypertriglyseridemia.
Hematologinen: Anemia, leukopenia.
Seuraavia tapahtumia raportoitiin enintään 0,1 %:lla tutkimushenkilöistä ja ne ovat mahdollisesti tärkeitä: täydellinen AV-katkos, haarakatkos, sydänlihasiskemia, aivoverenkiertohäiriö, kouristukset, migreeni, neuralgia, pareesi, anafylaktoidinen reaktio, hiustenlähtö, eksfoliatiivinen ihotulehdus, muistinmenetys, GI-verenvuoto, bronkospasmi, keuhkoödeema, kuulon heikkeneminen, hengitysalkaloosi, lisääntynyt BUN, alentunut HDL, pansytopenia ja epätyypilliset lymfosyytit.
Laboratoriohäiriöt
Seerumin transaminaasiarvojen (ALAT tai ASAT) palautuvia nousuja on havaittu COREG-hoidon aikana. Kontrolloiduissa kliinisissä tutkimuksissa havaittu transaminaasiarvojen nousu (2–3 kertaa normaalin yläraja) on yleensä ollut samanlainen COREG-hoitoa saaneiden ja lumelääkettä saaneiden potilaiden välillä. COREG-hoidon yhteydessä on kuitenkin havaittu transaminaasiarvojen nousua, joka on vahvistettu uudelleenaltistamisella. Pitkäaikaisessa, lumekontrolloidussa vaikeaa sydämen vajaatoimintaa koskevassa tutkimuksessa COREG 25 mg:lla hoidetuilla koehenkilöillä oli alhaisemmat maksan transaminaasiarvot kuin lumelääkettä saaneilla, mahdollisesti siksi, että COREG 6,25 mg:n aiheuttamat sydämen toiminnan parannukset johtivat maksan tukkoisuuden vähenemiseen ja/ tai parantunut maksan verenkierto.
COREG 25 mg:n käyttöön ei ole yhdistetty kliinisesti merkittäviä muutoksia seerumin kaliumissa, kokonaistriglyseridien, kokonaiskolesterolin, HDL-kolesterolin, virtsahapon, veren ureatypen tai kreatiniinin määrässä. Ei havaittu kliinisesti merkittäviä muutoksia seerumin paastoglukoosissa hypertensiivisillä potilailla; seerumin paastoglukoosia ei arvioitu sydämen vajaatoimintaa koskevissa kliinisissä tutkimuksissa.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu COREGin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Veri- ja imukudosjärjestelmän häiriöt
Aplastinen anemia.
Immuunijärjestelmän häiriöt
Yliherkkyys (esim. anafylaktiset reaktiot, angioödeema, urtikaria).
Munuaisten ja virtsateiden häiriöt
Virtsankarkailu.
Hengityselinten, rintakehän ja välikarsinahäiriöt
Interstitiaalinen pneumoniitti.
Ihon ja ihonalaisten kudosten häiriöt
Stevens-Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi, erythema multiforme.
HUUMEIDEN VUOROVAIKUTUKSET
CYP2D6:n estäjät ja huonot metaboloijat
Karvedilolin yhteisvaikutuksia CYP2D6-isoentsyymin voimakkaiden estäjien (kuten kinidiini, fluoksetiini, paroksetiini ja propafenoni) kanssa ei ole tutkittu, mutta näiden lääkkeiden odotetaan lisäävän karvedilolin R(+)-enantiomeerin pitoisuuksia veressä [ks. KLIININEN FARMAKOLOGIA ]. Sivuvaikutusten retrospektiivinen analyysi kliinisissä kokeissa osoitti, että huonoilla 2D6-metaboliatekijöillä oli korkeampi huimausnopeus ylöstitrauksen aikana, mikä johtui oletettavasti a-salpaavan R(+)-enantiomeerin suurempien pitoisuuksien verisuonia laajentavista vaikutuksista.
Hypotensiiviset aineet
Potilaita, jotka käyttävät beetasalpaajaa ja lääkettä, joka voi heikentää katekoliamiinien määrää (esim. reserpiinin ja monoamiinioksidaasin estäjät), tulee tarkkailla huolellisesti hypotension ja/tai vaikean bradykardian oireiden varalta.
Klonidiinin ja beetasalpaajan samanaikainen käyttö voi aiheuttaa hypotensiota ja bradykardiaa. Kun beetasalpaajan ja klonidiinin samanaikainen hoito on lopetettava, beetasalpaajan käyttö tulee lopettaa ensin. Klonidiinihoito voidaan sitten lopettaa useita päiviä myöhemmin pienentämällä annosta asteittain.
Syklosporiini
Keskimääräisten syklosporiinipitoisuuksien vähäistä nousua havaittiin karvedilolihoidon aloittamisen jälkeen 21 munuaisensiirtopotilaalla, jotka kärsivät kroonisesta verisuonten hylkimisreaktiosta. Noin 30 %:lla koehenkilöistä siklosporiiniannosta jouduttiin pienentämään, jotta siklosporiinipitoisuudet pysyisivät terapeuttisella alueella, kun taas muilla potilailla säätöä ei tarvittu. Ryhmän keskimäärin siklosporiiniannosta pienennettiin noin 20 % näissä koehenkilöissä. Koska tarvittava annoksen säätö vaihtelee suuresti yksilöiden välillä, on suositeltavaa, että siklosporiinipitoisuuksia seurataan tarkasti karvedilolihoidon aloittamisen jälkeen ja siklosporiinin annosta muutetaan tarvittaessa.
Digitalis-glykosidit
Sekä digitalisglykosidit että β-salpaajat hidastavat eteiskammioiden johtumista ja hidastavat sykettä. Samanaikainen käyttö voi lisätä bradykardian riskiä. Digoksiinipitoisuudet suurenevat noin 15 %, kun digoksiinia ja karvedilolia annetaan samanaikaisesti. Siksi digoksiinin tehostettua seurantaa suositellaan aloitettaessa, säädettäessä tai lopetettaessa COREG-hoitoa [ks. KLIININEN FARMAKOLOGIA ].
Maksaaineenvaihdunnan indusoijat/inhibiittorit
Rifampiini alensi karvedilolin plasmapitoisuuksia noin 70 % [katso KLIININEN FARMAKOLOGIA ]. Simetidiini lisäsi AUC:tä noin 30 %, mutta ei aiheuttanut muutosta Cmax:ssa [katso KLIININEN FARMAKOLOGIA ].
Amiodaroni
Amiodaroni ja sen metaboliitti desetyyliamiodaroni, CYP2C9:n estäjät ja P-glykoproteiini lisäsivät karvedilolin S(-)-enantiomeerin pitoisuuksia vähintään kaksinkertaiseksi [ks. KLIININEN FARMAKOLOGIA ]. Amiodaronin tai muiden CYP2C9:n estäjien, kuten flukonatsolin, samanaikainen käyttö COREG:n kanssa voi lisätä beetasalpaavaa aktiivisuutta, mikä johtaa sykkeen tai sydämen johtumisen edelleen hidastumiseen. Potilaita tulee tarkkailla bradykardian tai sydäntukoksen merkkien varalta, erityisesti silloin, kun yhtä lääkettä lisätään olemassa olevaan hoitoon toisen kanssa.
Kalsiumkanavan salpaajat
Johtamishäiriötä (harvoin hemodynaamisen häiriön kanssa) on havaittu, kun COREG 25 mg:aa on annettu samanaikaisesti diltiatseemin kanssa. Kuten muitakin beetasalpaajia, jos COREG 25 mg:aa annetaan verapamiili- tai diltiatseemityyppisten kalsiumkanavasalpaajien kanssa, EKG:n ja verenpaineen seurantaa suositellaan.
Insuliini tai suun kautta otettavat hypoglykemiat
Beetasalpaajat voivat tehostaa insuliinin ja oraalisten hypoglykeemisten lääkkeiden verensokeria alentavaa vaikutusta. Siksi potilailla, jotka käyttävät insuliinia tai oraalisia hypoglykeemisiä lääkkeitä, suositellaan verensokerin säännöllistä seurantaa [ks VAROITUKSET JA VAROTOIMET ].
Anestesia
Jos COREG-hoitoa jatketaan perioperatiivisesti, on noudatettava erityistä varovaisuutta käytettäessä sydänlihaksen toimintaa heikentäviä anestesia-aineita, kuten eetteriä, syklopropaania ja trikloorietyleeniä [ks. YLIANNOSTUS ].
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Hoidon lopettaminen
COREG-hoitoa saavia sepelvaltimotautia sairastavia potilaita tulee neuvoa lopettamaan hoidon äkillinen lopettaminen. Angina pectoriksen vakavaa pahenemista sekä sydäninfarktin ja kammiorytmihäiriöiden esiintymistä on raportoitu angina pectoris-potilailla beetasalpaajien hoidon äkillisen lopettamisen jälkeen. Kaksi viimeistä komplikaatiota voivat ilmetä angina pectoriksen edeltävän pahenemisen kanssa tai ilman sitä. Kuten muitakin beetasalpaajia käytettäessä, potilaita on tarkkailtava huolellisesti, kun COREG-hoidon lopettamista suunnitellaan, ja heitä tulee neuvoa rajoittamaan fyysistä aktiivisuutta minimiin. COREG-hoito tulee lopettaa 1-2 viikon kuluessa aina kun mahdollista. Jos angina pectoris pahenee tai akuutti sepelvaltimon vajaatoiminta kehittyy, on suositeltavaa, että COREG otetaan välittömästi uudelleen käyttöön, ainakin väliaikaisesti. Koska sepelvaltimotauti on yleinen ja sitä ei ehkä tunnisteta, voi olla järkevää olla keskeyttämättä COREG 3,12 mg -hoitoa äkillisesti edes potilailla, joita hoidetaan vain kohonneen verenpaineen tai sydämen vajaatoiminnan vuoksi.
Bradykardia
Kliinisissä tutkimuksissa COREG 25 mg aiheutti bradykardiaa noin 2 %:lle verenpainepotilaista, 9 %:lle potilaista, joilla oli sydämen vajaatoiminta, ja 6,5 %:lle potilaista, joilla oli sydäninfarkti ja vasemman kammion toimintahäiriö. Jos pulssi laskee alle 55 lyöntiä minuutissa, annosta tulee pienentää.
Hypotensio
Pääasiassa lievää tai kohtalaista sydämen vajaatoimintaa koskevissa kliinisissä tutkimuksissa hypotensiota ja posturaalista hypotensiota esiintyi 9,7 %:lla ja pyörtymistä 3,4 %:lla COREG-hoitoa saaneista potilaista verrattuna 3,6 %:iin ja 2,5 %:iin lumelääkettä saaneista potilaista. Näiden tapahtumien riski oli suurin ensimmäisten 30 annostuspäivän aikana, mikä vastasi titrausjaksoa ja johti hoidon keskeyttämiseen 0,7 %:lla potilaista, jotka saivat 12,5 mg COREG:a, verrattuna 0,4 %:iin lumelääkettä saaneista. Pitkäaikaisessa lumekontrolloidussa vaikeaa sydämen vajaatoimintaa (COPERNICUS) koskevassa tutkimuksessa hypotensiota ja posturaalista hypotensiota esiintyi 15,1 %:lla ja pyörtymistä 2,9 %:lla COREG-hoitoa saaneista potilaista verrattuna 8,7 %:iin ja 2,3 %:iin lumelääkettä saaneista potilaista. Nämä tapahtumat johtivat hoidon keskeyttämiseen 1,1 %:lla COREG-hoitoa saaneista potilaista, kun taas lumelääkettä saaneista 0,8 %:lla.
Posturaalista hypotensiota esiintyi 1,8 %:lla verenpainepotilaista ja pyörtymistä 0,1 %:lla verenpainepotilaista, pääasiassa aloitusannoksen jälkeen tai annoksen nostamisen yhteydessä, ja se oli syy hoidon keskeyttämiseen 1 %:lla potilaista.
CAPRICORN-tutkimuksessa akuutista sydäninfarkista selvinneille hypotensiota tai posturaalista hypotensiota esiintyi 20,2 %:lla COREG-hoitoa saaneista potilaista, kun taas lumelääkettä saaneista 12,6 %:lla. Pyörtymistä raportoitiin 3,9 %:lla ja 1,9 %:lla tutkimushenkilöistä. Nämä tapahtumat johtivat hoidon keskeyttämiseen 2,5 %:lla COREG-hoitoa saaneista potilaista, kun taas lumelääkettä saaneista 0,2 %:lla.
Alkaen pienellä annoksella, antamisen ruoan kanssa ja asteittaisen titrauksen pitäisi vähentää pyörtymisen tai liiallisen hypotension todennäköisyyttä [ks. ANNOSTELU JA HALLINNOINTI ]. Hoidon aloittamisen aikana potilasta tulee varoittaa välttämään tilanteita, kuten ajamista tai vaarallisia tehtäviä, joissa pyörtyminen voi aiheuttaa vammoja.
Sydämen vajaatoiminta/nesteen kertyminen
Sydämen vajaatoiminnan pahenemista tai nesteen kertymistä voi esiintyä karvedilolin titrauksen aikana. Jos tällaisia oireita ilmaantuu, diureettien käyttöä tulee lisätä eikä karvedilolin annosta saa suurentaa ennen kuin kliininen vakaus palautuu [ks. ANNOSTELU JA HALLINNOINTI ]. Joskus on tarpeen pienentää karvedilolin annosta tai keskeyttää se tilapäisesti. Tällaiset jaksot eivät estä myöhempää onnistunutta karvedilolin titrausta tai suotuisaa vastetta karvedilolille. Lumekontrolloidussa tutkimuksessa potilailla, joilla oli vaikea sydämen vajaatoiminta, sydämen vajaatoiminnan pahenemisen ilmoitettiin ensimmäisten 3 kuukauden aikana samalla tavalla karvedilolin ja lumelääkkeen yhteydessä. Kun hoitoa jatkettiin yli 3 kuukautta, sydämen vajaatoiminnan pahenemista raportoitiin harvemmin karvedilolilla hoidetuilla potilailla kuin lumelääkettä saaneilla. Pitkäaikaisen hoidon aikana havaittu sydämen vajaatoiminnan paheneminen liittyy todennäköisemmin potilaan perussairauteen kuin karvedilolihoitoon.
Ei-allerginen bronkospasmi
Potilaiden, joilla on bronkospastinen sairaus (esim. krooninen keuhkoputkentulehdus, emfyseema), ei yleensä tulisi saada beetasalpaajia. COREGiä voidaan kuitenkin käyttää varoen potilailla, jotka eivät reagoi muihin verenpainelääkkeisiin tai eivät siedä niitä. Jos COREGiä käytetään, on järkevää käyttää pienintä tehokasta annosta, jotta endogeenisten tai eksogeenisten β-agonistien esto minimoidaan.
Kliinisissä tutkimuksissa potilailla, joilla oli sydämen vajaatoiminta, otettiin mukaan keuhkoputken spastista sairautta sairastavia henkilöitä, jos he eivät tarvinneet oraalista tai inhaloitavaa lääkitystä bronkospastisen sairautensa hoitoon. Tällaisille potilaille suositellaan, että karvedilolia käytetään varoen. Annossuosituksia on noudatettava tarkasti ja annosta on pienennettävä, jos titrauksen aikana havaitaan merkkejä bronkospasmista.
Glykeeminen hallinta tyypin 2 diabeteksessa
Yleensä beetasalpaajat voivat peittää joitain hypoglykemian oireita, erityisesti takykardiaa. Epäselektiiviset beetasalpaajat voivat voimistaa insuliinin aiheuttamaa hypoglykemiaa ja viivästyttää seerumin glukoositasojen palautumista. Potilaita, jotka ovat alttiita spontaanille hypoglykemialle tai diabeetikoita, jotka saavat insuliinia tai oraalisia hypoglykeemisiä aineita, tulee varoittaa näistä mahdollisuuksista.
Sydämen vajaatoimintaa ja diabetesta sairastavilla potilailla karvedilolihoito voi johtaa hyperglykemian pahenemiseen, mikä reagoi hypoglykeemisen hoidon tehostumiseen. On suositeltavaa seurata verensokeria, kun karvedilolin annostusta aloitetaan, sitä muutetaan tai lopetetaan. Kokeita, joiden tarkoituksena on tutkia karvedilolin vaikutuksia sokeritasapainoon diabeetikoilla ja sydämen vajaatoiminnalla, ei ole suoritettu.
Kokeessa, jonka tarkoituksena oli tutkia karvedilolin vaikutuksia verensokerin hallintaan populaatiossa, jolla oli lievä tai kohtalainen verenpainetauti ja hyvin hallinnassa oleva tyypin 2 diabetes, karvedilolilla ei ollut haitallista vaikutusta verensokeritasapainoon HbA1c-mittausten perusteella [ks. Kliiniset tutkimukset ].
Perifeerinen verisuonisairaus
Beetasalpaajat voivat aiheuttaa tai pahentaa valtimoiden vajaatoiminnan oireita potilailla, joilla on ääreisverisuonisairaus. Varovaisuutta tulee noudattaa tällaisissa henkilöissä.
Munuaisten toiminnan heikkeneminen
Harvoin karvedilolin käyttö sydämen vajaatoimintaa sairastavilla potilailla on johtanut munuaisten toiminnan heikkenemiseen. Riskipotilaita näyttävät olevan matala verenpaine (systolinen verenpaine alle 100 mmHg), iskeeminen sydänsairaus ja diffuusi verisuonisairaus ja/tai taustalla oleva munuaisten vajaatoiminta. Munuaisten toiminta on palautunut lähtötasolle, kun karvedilolin käyttö lopetettiin. Potilailla, joilla on näitä riskitekijöitä, suositellaan, että munuaisten toimintaa seurataan karvedilolin annosta suurennettaessa ja lääkkeen käyttö keskeytetään tai annosta pienennetään, jos munuaisten toiminta heikkenee.
Iso leikkaus
Kroonisesti annettua beetasalpaajahoitoa ei pidä keskeyttää rutiininomaisesti ennen suurta leikkausta. Kuitenkin sydämen heikentynyt kyky vastata refleksi-adrenergisiin ärsykkeisiin voi lisätä yleisanestesian ja kirurgisten toimenpiteiden riskejä.
Tyreotoksikoosi
β-adrenerginen salpaus voi peittää kilpirauhasen liikatoiminnan kliinisiä oireita, kuten takykardiaa. Beetasalpauksen äkillistä lopettamista voi seurata kilpirauhasen liikatoiminnan oireiden paheneminen tai se voi aiheuttaa kilpirauhasmyrskyn.
Feokromosytooma
Potilailla, joilla on feokromosytooma, α-salpaaja on aloitettava ennen minkään beetasalpaajan käyttöä. Vaikka karvedilolilla on sekä α- että β-salpaavia farmakologisia vaikutuksia, sen käytöstä tässä tilassa ei ole kokemusta. Siksi on noudatettava varovaisuutta annettaessa karvedilolia potilaille, joilla epäillään olevan feokromosytooma.
Prinzmetalin variantti angina
Aineet, joilla on ei-selektiivinen beetasalpaaja, voivat aiheuttaa rintakipua potilailla, joilla on Prinzmetalin variantti angina pectoris. Karvedilolin käytöstä näillä potilailla ei ole kliinistä kokemusta, vaikka α-salpaus saattaa estää tällaisia oireita. Varovaisuutta tulee kuitenkin noudattaa annettaessa karvedilolia potilaille, joilla epäillään olevan Prinzmetalin angina pectoris.
Anafylaktisen reaktion riski
Beetasalpaajia käyttäessään potilaat, joilla on aiemmin ollut vaikea anafylaktinen reaktio useille allergeeneille, voivat reagoida paremmin toistuvaan altistukseen, joko vahingossa tapahtuvalle, diagnostiselle tai terapeuttiselle altistukselle. Tällaiset potilaat eivät välttämättä reagoi tavanomaisiin allergisen reaktion hoitoon käytettäviin adrenaliiniannoksiin.
Intraoperatiivinen Floppy Iris -oireyhtymä
Intraoperative Floppy Iris Syndrome (IFIS) on havaittu kaihileikkauksen aikana joillakin potilailla, joita on hoidettu alfa-1-salpaajilla (COREG on alfa/beetasalpaaja). Tälle pienen pupillin oireyhtymän variantille on tunnusomaista yhdistelmä veltto iiris, joka kumpuaa vasteena leikkauksen sisäisille huuhteluvirroille, etenevä intraoperatiivinen mioosi huolimatta leikkausta edeltävästä laajenemisesta tavallisilla mydriaattisilla lääkkeillä, ja iiriksen mahdollinen prolapsi kohti fakoemulsifikaatioviiltoja. Potilaan silmälääkärin tulee olla varautunut mahdollisiin leikkaustekniikan muutoksiin, kuten iiriskoukkujen, iiriksen laajentamisrenkaiden tai viskoelastisten aineiden käyttöön. Alfa-1-salpaajahoidon lopettamisesta ennen kaihileikkausta ei näytä olevan hyötyä.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ).
COREGiä käyttäville potilaille tulee kertoa seuraavista:
- Potilaiden tulee ottaa COREG ruoan kanssa.
- Potilaiden ei tule keskeyttää tai lopettaa COREG 25 mg -hoidon käyttöä ilman lääkärin neuvoja.
- Sydämen vajaatoimintaa sairastavien potilaiden tulee kääntyä lääkärin puoleen, jos heillä on merkkejä tai oireita sydämen vajaatoiminnan pahenemisesta, kuten painonnousu tai lisääntyvä hengenahdistus.
- Potilaat voivat kokea verenpaineen laskua seisoessaan, mikä voi aiheuttaa huimausta ja harvoin pyörtymistä. Potilaiden tulee istua tai makuulle, kun näitä verenpaineen laskun oireita ilmaantuu.
- Jos potilas kokee huimausta tai väsymystä, hänen tulee välttää ajamista tai vaarallisia tehtäviä.
- Potilaiden tulee kääntyä lääkärin puoleen, jos heillä on huimausta tai pyörtymistä, jos annosta on muutettava.
- Diabeetikoiden tulee ilmoittaa kaikista verensokeritason muutoksista lääkärilleen.
- Piilolinssien käyttäjillä voi olla vähentynyttä kyyneleritystä.
COREG 25mg, COREG 3.12mg CR ja TILTAB ovat GSK-yritysryhmän omistamia tai niille lisensoituja tavaramerkkejä.
Toinen luettelossa oleva tuotemerkki on tavaramerkki, jonka omistaa tai lisensoi omistajansa, eikä GSK-yritysryhmän omistaa tai ole lisensoitu sille. Tämän tuotemerkin valmistaja ei ole sidoksissa GSK-yritysryhmään tai sen tuotteisiin eikä tue sitä.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
2 vuotta kestäneissä tutkimuksissa rotilla, joille annettiin karvedilolia annoksina enintään 75 mg/kg/vrk (12 kertaa MRHD mg/m2) tai hiirillä annettiin enintään 200 mg/kg/vrk (16 kertaa MRHD mg/m2). m2), karvedilolilla ei ollut syöpää aiheuttavaa vaikutusta.
Karvediloli oli negatiivinen testattaessa useita genotoksisuusmäärityksiä, mukaan lukien Ames- ja CHO/HGPRT-määritykset mutageenisuuden suhteen sekä in vitro hamsterin mikrotuma- ja in vivo ihmisen lymfosyyttisolutestit klastogeenisuuden suhteen.
Yhdistetyssä hedelmällisyys/kehitys/postnataalitoksisuustutkimuksessa rotille annettiin karvedilolia (12, 60, 300 mg/kg/vrk) suun kautta letkulla 2 viikon ajan ennen parittelua sekä parittelun, tiineyden ja vieroituksen aikana naaraille ja 62 vuodelle. päivää ennen parittelua ja sen aikana uroksille. Annoksella 300 mg/kg/vrk (suurempi tai yhtä suuri kuin 50 kertaa MRHD mg/m2) karvediloli oli myrkyllistä aikuisille rotille (sedaatio, vähentynyt painonnousu) ja siihen liittyi onnistuneiden parittelujen vähentyminen, pitkittynyt paritteluaika, vähemmän keltasoluja ja implantteja per emä, vähemmän eläviä pentuja per pentue ja viivästykset fyysisessä kasvussa/kehityksessä. Ilmeisen toksisuuden ja hedelmällisyyden heikkenemisen vaikutuston taso oli 60 mg/kg/vrk (10 kertaa MRHD mg/m2).
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Saatavilla olevat tiedot COREG 12,5 mg:n käytöstä raskaana oleville naisille eivät riitä määrittämään, onko lääkkeisiin liittyviä haitallisten kehitysvaikutusten riskejä. Raskauden aikana huonosti hallittu verenpainetauti aiheuttaa riskejä äidille ja sikiölle. Beetasalpaajien käyttö raskauden kolmannen kolmanneksen aikana voi lisätä hypotension, bradykardian, hypoglykemian ja hengityslaman riskiä vastasyntyneellä. katso Kliiniset huomiot ]. Eläinten lisääntymistutkimuksissa ei havaittu haitallisia kehitystuloksia kliinisesti merkittävillä annoksilla [ katso Tiedot ]. Karvedilolin oraalinen antaminen tiineille rotille organogeneesin aikana johti implantaation jälkeiseen menettämiseen, sikiön painon laskuun ja sikiön luuston kehityksen viivästymisen lisääntymiseen emolle toksisilla annoksilla, jotka olivat 50 kertaa ihmiselle suositeltuja enimmäisannoksia (MRHD). Lisäksi karvedilolin oraalinen antaminen tiineille kaniineille organogeneesin aikana johti lisääntyneeseen implantaation jälkeiseen menetykseen annoksilla, jotka olivat 25 kertaa MRHD:tä. katso Tiedot ].
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski mainituilla väestöryhmillä ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia.

Kliiniset näkökohdat
Äidin ja/tai alkion/sikiön sairauteen liittyvä riski
Raskaudenaikainen hypertensio lisää äidin riskiä pre-eklampsialle, raskausdiabetekselle, ennenaikaisille synnytyksille ja synnytyskomplikaatioille (esim. keisarileikkauksen tarve ja synnytyksen jälkeinen verenvuoto). Hypertensio lisää sikiön riskiä kohdunsisäiseen kasvun rajoittumiseen ja kohdunsisäiseen kuolemaan. Verenpainetautia sairastavia raskaana olevia naisia tulee seurata huolellisesti ja hoitaa sen mukaisesti.
Sikiön/vastasyntyneen haittavaikutukset
Verenpainetautia sairastavien naisten vastasyntyneillä, joita hoidetaan beetasalpaajilla raskauden kolmannen kolmanneksen aikana, saattaa olla lisääntynyt hypotension, bradykardian, hypoglykemian ja hengityslaman riski. Tarkkaile vastasyntyneitä hypotension, bradykardian, hypoglykemian ja hengityslaman oireiden varalta ja hallitse niiden mukaisesti.
Data
Eläinten tiedot
Rotilla ja kaniineilla, joille annettiin karvedilolia sikiön organogeneesin aikana, tehdyt tutkimukset osoittivat lisääntynyttä implantaation jälkeistä menetystä rotilla emolle toksisella annoksella 300 mg/kg/vrk (50-kertainen MRHD mg/m2) ja kaniineilla (ilman emoa). myrkyllisyys) annoksilla 75 mg/kg/vrk (25 kertaa MRHD mg/m2). Rotilla myös sikiön ruumiinpaino laski annoksella 300 mg/kg/vrk (50 kertaa MRHD mg/m2), johon liittyi lisääntynyt sikiöiden, joilla on viivästynyt luuston kehitys, ilmaantuvuus. Rotilla alkio-sikiötoksisuuden vaikutukseton taso oli 60 mg/kg/vrk (10 kertaa MRHD mg/m2); kaneilla se oli 15 mg/kg/päivä (5 kertaa MRHD mg/m2). Pre- ja postnataalisessa kehitystutkimuksessa rotilla, joille annettiin karvedilolia myöhäisestä tiineydestä imetykseen, havaittiin lisääntynyttä alkiokuolleisuutta emolle toksisella annoksella 200 mg/kg/vrk (noin 32 kertaa MRHD mg/m2). ja pentujen kuolleisuutta ja fyysisen kasvun/kehityksen viivästymistä havaittiin annoksella 60 mg/kg/vrk (10 kertaa MRHD mg/m2) ilman emolle toksisuutta. Ei-vaikutustaso oli 12 mg/kg/vrk (2 kertaa MRHD mg/m2). Karvedilolia oli rotan sikiön kudoksessa.
Imetys
Riskien yhteenveto
Karvedilolin erittymisestä äidinmaitoon, vaikutuksista imetettävään lapseen tai vaikutuksista maidontuotantoon ei ole tietoa. Karvedilolia on imettävien rottien maidossa. Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon, äidin kliininen COREG-tarve ja COREG 3,12 mg:n mahdolliset haitalliset vaikutukset imetettävään lapseen tai äidin taustalla oleva tila.
Käyttö lapsille
COREG 3,12 mg:n tehokkuutta alle 18-vuotiailla potilailla ei ole osoitettu.
Kaksoissokkotutkimuksessa 161 lasta (keski-ikä: 6 vuotta; vaihteluväli: 2 kuukautta - 17 vuotta; 45 % alle 2 vuotta), joilla oli krooninen sydämen vajaatoiminta [NYHA-luokka II-IV, vasemman kammion ejektiofraktio alle 40 % lapsille, joilla oli systeeminen vasen kammio (LV) ja keskivaikea kammion toimintahäiriö kvalitatiivisesti kaiun perusteella niille, joiden systeeminen kammio ei ollut LV], jotka saivat tavanomaista taustahoitoa, satunnaistettiin saamaan lumelääkettä tai 2 karvedilolin annostasoa. Nämä annostasot saivat aikaan lumekorjatun sykkeen laskun 4–6 sykettä minuutissa, mikä viittaa beetasalpaamiseen. Altistuminen näytti olevan pienempi lapsipotilailla kuin aikuisilla. 8 kuukauden seurannan jälkeen hoidolla ei ollut merkittävää vaikutusta kliinisiin tuloksiin. Tämän tutkimuksen haittavaikutuksia, joita esiintyi yli 10 %:lla COREG-hoitoa saaneista potilaista ja kaksi kertaa lumelääkettä saaneisiin verrattuna, olivat rintakipu (17 % vs. 6 %), huimaus (13 % vs. 2 %) ja hengenahdistus ( 11 % vs. 0 %).
Geriatrinen käyttö
765:stä sydämen vajaatoimintaa sairastavasta potilaasta, jotka satunnaistettiin saamaan 6,25 mg:n COREG-annoksen yhdysvaltalaisissa kliinisissä tutkimuksissa, 31 % (235) oli vähintään 65-vuotiaita ja 7,3 % (56) 75-vuotiaita tai vanhempia. Pitkäaikaisessa, lumekontrolloidussa vaikeassa sydämen vajaatoiminnassa COREG-annokseen 3,12 mg:n tutkimuksessa satunnaistetuista 1 156 koehenkilöstä 47 % (547) oli 65-vuotiaita tai vanhempia ja 15 % (174) oli 75-vuotiaita tai vanhempia. 3 025 potilaasta, jotka saivat COREG 6,25 mg:aa sydämen vajaatoimintatutkimuksissa maailmanlaajuisesti, 42 % oli 65-vuotiaita tai vanhempia.
CAPRICORN-tutkimuksessa COREG-ryhmään satunnaistetuista 975 sydäninfarktin saaneesta potilaasta 48 % (468) oli 65-vuotiaita tai vanhempia ja 11 % (111) oli 75-vuotiaita tai vanhempia.
Yhdysvalloissa tehdyissä kliinisissä tehoa tai turvallisuutta koskevissa tutkimuksissa 2065 verenpainepotilaasta, joita hoidettiin COREG 25 mg:lla, 21 % (436) oli 65-vuotiaita tai vanhempia. Maailmanlaajuisesti tehdyissä verenpainetautitutkimuksissa COREG-hoitoa saaneesta 3 722 koehenkilöstä 24 % oli 65-vuotiaita tai vanhempia.
Lukuun ottamatta huimausta hypertensiivisillä koehenkilöillä (esiintyvyys 8,8 % vanhuksilla vs. 6 % nuoremmilla koehenkilöillä), yleisiä eroja turvallisuudessa tai tehokkuudessa (ks. kuvat 2 ja 4) ei havaittu vanhempien ja nuorempien koehenkilöiden välillä. nämä populaatiot. Vastaavasti muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja vasteissa iäkkäiden ja nuorempien koehenkilöiden välillä, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
YLIANNOSTUS
Yliannostus voi aiheuttaa vakavaa hypotensiota, bradykardiaa, sydämen vajaatoimintaa, kardiogeenistä sokkia ja sydämenpysähdystä. Myös hengitysvaikeuksia, bronkospasmeja, oksentelua, tajunnanmenetyksiä ja yleistyneitä kohtauksia voi esiintyä.
Potilas on asetettava makuuasentoon ja tarvittaessa tarkkailtava ja hoidettava tehohoito-olosuhteissa. Seuraavia aineita voidaan antaa:
Liialliseen bradykardiaan : Atropiini, 2 mg IV.
Sydämen toiminnan tukemiseen glukagoni, 5-10 mg IV nopeasti 30 sekunnissa, jonka jälkeen jatkuva infuusio 5 mg tunnissa; sympatomimeetit (dobutamiini, isoprenaliini, adrenaliini) painon ja vaikutuksen mukaisina annoksina.
Jos perifeerinen verisuonten laajeneminen hallitsee, voi olla tarpeen antaa adrenaliinia tai noradrenaliinia ja seurata jatkuvasti verenkiertoa. Hoitoresistentissä bradykardiassa tulee suorittaa sydämentahdistinhoitoa. Bronkospasmiin tulee antaa β-sympatomimeettejä (aerosolina tai IV) tai aminofylliiniä IV. Kouristuskohtauksissa suositellaan diatsepaamin tai klonatsepaamin hidasta IV-injektiota.
HUOMAUTUS: Jos ilmenee vakava myrkytys, jossa on sokin oireita, vastalääkehoitoa on jatkettava riittävän pitkään karvedilolin 7-10 tunnin puoliintumisajan mukaisesti.
Yliannostustapauksia COREG 3,12 mg:n yksinään tai yhdessä muiden lääkkeiden kanssa on raportoitu. Joissakin tapauksissa nautitut määrät ylittivät 1 000 milligrammaa. Kokettuja oireita olivat alhainen verenpaine ja syke. Tavanomaista tukihoitoa annettiin ja yksilöt toipuivat.
VASTA-AIHEET
COREG 25mg on vasta-aiheinen seuraavissa olosuhteissa:
- Bronkiaalinen astma tai siihen liittyvät bronkospastiset tilat. Statusasthmaticus-kuolemia on raportoitu yksittäisten COREG-annosten jälkeen.
- Toisen tai kolmannen asteen AV-katkos.
- Sairas sinus-oireyhtymä.
- Vaikea bradykardia (ellei pysyvä sydämentahdistin ole paikallaan).
- Potilaat, joilla on kardiogeeninen sokki tai joilla on dekompensoitunut sydämen vajaatoiminta, joka vaatii suonensisäistä inotrooppista hoitoa. Tällaiset potilaat tulee ensin vierottaa suonensisäisestä hoidosta ennen COREG-hoidon aloittamista.
- Potilaat, joilla on vaikea maksan vajaatoiminta.
- Potilaat, joilla on ollut vakava yliherkkyysreaktio (esim. Stevens-Johnsonin oireyhtymä, anafylaktinen reaktio, angioedeema) jollekin tämän lääkkeen aineosalle tai muille karvedilolia sisältäville lääkkeille.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
COREG 3,12 mg on raseeminen seos, jossa S(-)-enantiomeerissä on ei-selektiivistä β-adrenoreseptoreita salpaavaa aktiivisuutta ja sekä R(+)- että S(-)-enantiomeerien α1-adrenerginen salpausvaikutus on läsnä yhtä suurella teholla. COREG 6,25 mg:lla ei ole luontaista sympatomimeettistä aktiivisuutta.
Farmakodynamiikka
Sydämen vajaatoiminta
COREGin hyödyllisten vaikutusten perustaa sydämen vajaatoimintaan ei ole vahvistettu.
Kahdessa lumekontrolloidussa tutkimuksessa verrattiin COREG:n akuutteja hemodynaamisia vaikutuksia lähtötilanteen mittauksiin 59 ja 49 koehenkilöllä, joilla oli NYHA-luokan II-IV sydämen vajaatoiminta ja jotka saivat diureetteja, ACE:n estäjiä ja digitalista. Systeeminen verenpaine, keuhkovaltimon paine, keuhkokapillaarin kiilapaine ja syke laskivat merkittävästi. Alkuvaikutukset sydämen minuuttitilavuuteen, aivohalvauksen tilavuusindeksiin ja systeemiseen verisuonivastukseen olivat pieniä ja vaihtelevia.
Näissä kokeissa mitattiin hemodynaamisia vaikutuksia uudelleen 12-14 viikon kohdalla. COREG 25 mg alensi merkittävästi systeemistä verenpainetta, keuhkovaltimon painetta, oikean eteisen painetta, systeemistä verisuonivastusta ja sykettä, kun taas aivohalvauksen tilavuusindeksi nousi.
839 NYHA-luokkien II-III sydämen vajaatoimintaa sairastavan henkilön joukossa, joita hoidettiin 26–52 viikkoa neljässä lumekontrolloidussa tutkimuksessa Yhdysvalloissa, radionuklidiventrikulografialla mitattu keskimääräinen vasemman kammion ejektiofraktio (EF) lisääntyi 9 EF-yksikköä (%) COREG 6,25:tä saaneilla koehenkilöillä. mg ja 2 EF-yksikköä lumelääkepotilailla tavoiteannoksella 25-50 mg kahdesti vuorokaudessa. Karvedilolin vaikutukset ejektiofraktioon liittyivät annokseen. Annokset 6,25 mg kahdesti vuorokaudessa, 12,5 mg kahdesti vuorokaudessa ja 25 mg kahdesti vuorokaudessa liittyivät plasebokorjattuihin EF-yksiköiden kasvuun 5 EF-yksiköllä, 6 EF-yksiköllä ja 8 EF-yksiköllä, vastaavasti; jokainen näistä vaikutuksista oli nimellisesti tilastollisesti merkitsevä.
Sydäninfarktin jälkeinen vasemman kammion toimintahäiriö
COREG 25 mg:n suotuisten vaikutusten perustaa potilailla, joilla on akuutin sydäninfarktin seurauksena vasemman kammion toimintahäiriö, ei ole vahvistettu.
Hypertensio
Mekanismia, jolla beetasalpaus tuottaa verenpainetta alentavan vaikutuksen, ei ole varmistettu.
β-adrenoreseptoreja estävä vaikutus on osoitettu eläin- ja ihmistutkimuksissa, jotka osoittavat, että karvediloli (1) vähentää sydämen minuuttitilavuutta normaaleilla koehenkilöillä, (2) vähentää rasituksen ja/tai isoproterenolin aiheuttamaa takykardiaa ja (3) vähentää refleksiortostaattista takykardiaa. Merkittävä β-adrenoreseptoreita salpaava vaikutus havaitaan yleensä tunnin sisällä lääkkeen antamisesta.
α1-adrenoreseptoreita salpaava vaikutus on osoitettu ihmis- ja eläintutkimuksissa, mikä osoittaa, että karvediloli (1) heikentää fenyyliefriinin paineita, (2) aiheuttaa verisuonten laajentumista ja (3) vähentää perifeeristä verisuonten vastusta. Nämä vaikutukset osaltaan alentavat verenpainetta, ja ne havaitaan yleensä 30 minuutin kuluessa lääkkeen antamisesta.
Karvedilolin α1-reseptoreita salpaavan vaikutuksen vuoksi verenpaine laskee enemmän seistessä kuin makuuasennossa, ja posturaalisen hypotension oireita (1,8 %), mukaan lukien harvoin pyörtymistä, voi esiintyä. Oraalisen annon jälkeen, kun posturaalista hypotensiota on esiintynyt, se on ollut ohimenevää ja on harvinaista, kun COREGia annetaan ruoan kanssa suositellulla aloitusannoksella ja titrauslisäyksiä seurataan tarkasti [ks. ANNOSTELU JA HALLINNOINTI ].
Hypertensiivisillä potilailla, joilla on normaali munuaisten toiminta, terapeuttiset COREG-annokset vähensivät munuaisten verisuonivastusta ilman muutoksia munuaiskerästen suodatusnopeudessa tai munuaisten plasman virtauksessa. Muutokset natriumin, kaliumin, virtsahapon ja fosforin erittymisessä hypertensiivisillä potilailla, joilla on normaali munuaisten toiminta, olivat samanlaisia COREG-hoidon ja lumelääkkeen jälkeen.
COREG 3,12 mg:lla on vähän vaikutusta plasman katekoliamiinien, plasman aldosteroni- tai elektrolyyttitasoihin, mutta se vähentää merkittävästi plasman reniiniaktiivisuutta, kun sitä annetaan vähintään 4 viikon ajan. Se lisää myös eteisen natriureettisen peptidin tasoa.
Farmakokinetiikka
COREG imeytyy nopeasti ja laajasti oraalisen annon jälkeen, ja sen absoluuttinen hyötyosuus on noin 25–35 % merkittävän ensikierron metabolian vuoksi. Oraalisen annon jälkeen karvedilolin näennäinen keskimääräinen terminaalinen eliminaation puoliintumisaika on yleensä 7-10 tuntia. Saavutetut plasmapitoisuudet ovat verrannollisia suun kautta annettuun annokseen. Ruoan kanssa annettuna imeytymisnopeus hidastuu, mikä on osoituksena plasman huippupitoisuuksien saavuttamisen viivästymisestä, eikä biologisen hyötyosuuden laajuudessa ole merkittävää eroa. COREGin ottaminen ruoan kanssa minimoi ortostaattisen hypotension riskin.
Karvediloli metaboloituu laajalti. Kun radioaktiivisesti merkittyä karvedilolia annettiin suun kautta terveille vapaaehtoisille, karvedilolin osuus plasman kokonaisradioaktiivisuudesta oli käyrän alla (AUC) mitattuna. Alle 2 % annoksesta erittyi muuttumattomana virtsaan. Karvediloli metaboloituu pääasiassa aromaattisen renkaan hapettumisen ja glukuronidoinnin kautta.
Oksidatiiviset metaboliitit metaboloituvat edelleen konjugoimalla glukuronidaation ja sulfaation kautta. Karvedilolin metaboliitit erittyvät pääasiassa sapen kautta ulosteeseen. Demetylaatio ja hydroksylaatio fenolirenkaassa tuottavat 3 aktiivista metaboliittia, joilla on β-reseptoreita estävä vaikutus. Prekliinisten tutkimusten perusteella 4'-hydroksifenyylimetaboliitti on noin 13 kertaa tehokkaampi beetasalpaaja kuin karvediloli.
Karvediloliin verrattuna kolmella aktiivisella metaboliitilla on heikko verisuonia laajentava vaikutus. Aktiivisten metaboliittien pitoisuudet plasmassa ovat noin kymmenesosa karvedilolilla havaituista pitoisuuksista, ja niiden farmakokinetiikka on samanlainen kuin emoaineen.
Karvediloli läpäisee stereoselektiivisen ensikierron metabolian, jolloin R(+)-karvedilolin pitoisuudet plasmassa ovat noin 2–3 kertaa korkeammat kuin S(-)-karvedilolin oraalisen annon jälkeen terveille koehenkilöille. R(+)-karvedilolin keskimääräinen näennäinen terminaalinen eliminaation puoliintumisaika on 5-9 tuntia, kun taas S(-)-enantiomeerin 7-11 tuntia.
Ensisijaiset P450-entsyymit, jotka vastaavat sekä R(+)- että S(-)-karvedilolin metaboliosta ihmisen maksan mikrosomeissa, olivat CYP2D6 ja CYP2C9 ja vähäisemmässä määrin CYP3A4, 2C19, 1A2 ja 2E1. CYP2D6:n uskotaan olevan tärkein entsyymi karvedilolin 4'- ja 5'-hydroksylaatiossa, ja 3A4:n potentiaalisesti myötävaikuttaa siihen. CYP2C9:n uskotaan olevan ensisijainen merkitys S(-)-karvedilolin O-metylaatioreitillä.
Karvediloli on alttiina geneettisen polymorfismin vaikutuksille, kun debrisokiinin (sytokromi P450 2D6:n markkeri) metaboloijat ovat 2–3 kertaa korkeammat plasmassa R(+)-karvedilolin pitoisuudet nopeisiin metaboloijiin verrattuna. Sitä vastoin S(-)-karvedilolin plasmapitoisuudet nousevat vain noin 20–25 % hitailla metaboloijilla, mikä osoittaa, että sytokromi P450 2D6 metaboloi tätä enantiomeeriä vähemmän kuin R(+)-karvediloli. Karvedilolin farmakokinetiikka ei näytä olevan erilainen S-mefenytoiinin heikoilla metaboloijilla (potilailla, joilla on sytokromi P450 2C19 -puutos).
Karvediloli sitoutuu yli 98 % plasman proteiineihin, pääasiassa albumiiniin. Plasman proteiineihin sitoutuminen on riippumaton pitoisuudesta terapeuttisella alueella. Karvediloli on emäksinen, lipofiilinen yhdiste, jonka vakaan tilan jakautumistilavuus on noin 115 l, mikä viittaa huomattavaan jakautumiseen suonen ulkopuolisiin kudoksiin. Plasman puhdistuma on 500-700 ml/min.
Tietyt populaatiot
Sydämen vajaatoiminta
Karvedilolin ja sen enantiomeerien vakaan tilan pitoisuudet plasmassa nousivat suhteessa 6,25–50 mg:n annosalueella sydämen vajaatoimintaa sairastavilla potilailla. Verrattuna terveisiin koehenkilöihin, sydämen vajaatoimintaa sairastavilla koehenkilöillä oli kohonneet keskimääräiset AUC- ja Cmax-arvot karvedilolin ja sen enantiomeerien osalta, ja jopa 50–100 % korkeammat arvot havaittiin kuudella NYHA-luokan IV sydämen vajaatoimintaa sairastavalla henkilöllä. Karvedilolin keskimääräinen näennäinen terminaalinen eliminaation puoliintumisaika oli samanlainen kuin terveillä koehenkilöillä.
Geriatric
Plasman karvedilolipitoisuudet ovat keskimäärin noin 50 % korkeammat vanhuksilla kuin nuorilla. Maksan vajaatoiminta Terveisiin koehenkilöihin verrattuna potilailla, joilla on vaikea maksan vajaatoiminta (kirroosi), karvedilolitasot kohoavat 4-7-kertaisesti. Karvediloli on vasta-aiheinen potilailla, joilla on vaikea maksan vajaatoiminta.
Munuaisten vajaatoiminta
Vaikka karvediloli metaboloituu pääasiassa maksassa, plasman karvedilolin pitoisuuksien on raportoitu kohonneen potilailla, joilla on munuaisten vajaatoiminta. Keskimääräisten AUC-tietojen perusteella plasman karvedilolin pitoisuudet havaittiin noin 40–50 % korkeampia verenpainetautia sairastavilla ja kohtalaista tai vaikeaa munuaisten vajaatoimintaa sairastavilla potilailla verrattuna verrokkiryhmään, jossa oli verenpainetauti ja normaali munuaisten toiminta. AUC-arvojen vaihteluvälit olivat kuitenkin samanlaiset molemmissa ryhmissä. Muutokset plasman keskimääräisissä huippupitoisuuksissa olivat vähemmän selkeitä, noin 12–26 % suurempia potilailla, joilla oli munuaisten vajaatoiminta.
Koska karvediloli sitoutuu voimakkaasti plasman proteiineihin, se ei näytä puhdistuvan merkittävästi hemodialyysillä.
Huumeiden väliset vuorovaikutukset
Koska karvediloli käy läpi huomattavan oksidatiivisen metabolian, sytokromi P450 -entsyymien induktio tai esto voi vaikuttaa karvedilolin metaboliaan ja farmakokinetiikkaan.
Amiodaroni
Farmakokineettisessä tutkimuksessa, johon osallistui 106 japanilaista sydämen vajaatoimintaa sairastavaa henkilöä, pienten amiodaroniannosten ja ylläpitoannosten samanaikainen anto karvedilolin kanssa johti vähintään kaksinkertaiseen S(-)-karvedilolin vakaan tilan alimman pitoisuuden nousuun [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Simetidiini
10 terveellä mieshenkilöllä tehdyssä farmakokineettisessä tutkimuksessa simetidiini (1 000 mg päivässä) suurensi karvedilolin vakaan tilan AUC-arvoa 30 % ilman Cmax:n muutoksia [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Digoksiini
Karvedilolin (25 mg kerran vuorokaudessa) ja digoksiinin (0,25 mg kerran vuorokaudessa) samanaikaisen annon jälkeen 14 päivän ajan, vakaan tilan AUC nousi 14 % ja digoksiinin pienimmät pitoisuudet 16 % 12 verenpainepotilaalla [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Glyburidi
12 terveellä koehenkilöllä karvedilolin (25 mg kerran vuorokaudessa) ja kerta-annoksen glyburidia yhdistetty anto ei johtanut kliinisesti merkitykselliseen farmakokineettiseen yhteisvaikutukseen kummallekaan yhdisteelle.
Hydroklooritiatsidi
Karvedilolin 25 mg:n kerta-annos suun kautta ei muuttanut hydroklooritiatsidin 25 mg:n kerta-annoksen farmakokinetiikkaa 12 verenpainepotilaalla. Hydroklooritiatsidilla ei myöskään ollut vaikutusta karvedilolin farmakokinetiikkaan.
Rifampiini
Farmakokineettisessä tutkimuksessa, joka tehtiin 8 terveellä miespuolisella koehenkilöllä, rifampiini (600 mg päivässä 12 päivän ajan) pienensi karvedilolin AUC- ja Cmax-arvoja noin 70 % [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Torsemide
12 terveellä koehenkilöllä tehdyssä tutkimuksessa karvedilolin 25 mg kerran vuorokaudessa ja torsemidin 5 mg kerran vuorokaudessa yhdistelmä 5 päivän ajan ei aiheuttanut merkittäviä eroja niiden farmakokinetiikassa verrattuna lääkkeiden yksin antamiseen.
Varfariini
Karvedilolilla (12,5 mg kahdesti vuorokaudessa) ei ollut vaikutusta vakaan tilan protrombiiniaikasuhteisiin eikä se muuttanut R(+)- ja S(-)-varfariinin farmakokinetiikkaa samanaikaisen varfariinin antamisen jälkeen 9 terveellä vapaaehtoisella.
Kliiniset tutkimukset
Sydämen vajaatoiminta
Yhteensä 6 975 potilasta, joilla oli lievä tai vaikea sydämen vajaatoiminta, arvioitiin lumekontrolloiduissa karvedilolitutkimuksissa.
Lievä tai keskivaikea sydämen vajaatoiminta
Karvedilolia tutkittiin viidessä lumekontrolloidussa monikeskustutkimuksessa ja yhdessä aktiivikontrolloidussa tutkimuksessa (COMET-tutkimus), joihin osallistui koehenkilöitä, joilla oli lievä tai kohtalainen sydämen vajaatoiminta.
Neljässä yhdysvaltalaisessa monikeskustutkimuksessa, kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa otettiin mukaan 1 094 henkilöä (696 satunnaistettiin karvediloliin), joilla oli NYHA-luokan II-III sydämen vajaatoiminta ja ejektiofraktio, joka oli pienempi tai yhtä suuri kuin 0,35. Suurin osa käytti digitalista, diureetteja ja ACE-estäjää tutkimukseen tullessa. Potilaat jaettiin kokeisiin liikuntakyvyn perusteella. Australian ja Uuden-Seelannin kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa otettiin mukaan 415 henkilöä (puolet satunnaistettiin karvediloliin), joilla oli lievempi sydämen vajaatoiminta. Kaikista protokollista suljettiin pois koehenkilöt, joille odotettiin sydämensiirtoa 7,5–15 kuukauden kaksoissokkoutetun seurannan aikana. Kaikki satunnaistetut henkilöt olivat sietäneet 2 viikon karvedilolihoitoa 6,25 mg kahdesti vuorokaudessa.
Jokaisessa tutkimuksessa oli ensisijainen päätepiste, joko sydämen vajaatoiminnan eteneminen (1 koe Yhdysvalloissa) tai rasitustoleranssi (2 USA:n tutkimusta, jotka täyttivät ilmoittautumistavoitteet ja Australia-Uusi-Seelanti -tutkimus). Näissä kokeissa määriteltiin monia toissijaisia päätepisteitä, mukaan lukien NYHA-luokitus, potilaiden ja lääkärien yleisarvioinnit ja sydän- ja verisuonihoitoon liittyvät sairaalahoidot. Muihin analyyseihin, joita ei ole suunniteltu tulevaisuuteen, sisältyivät kuolemien ja sydän- ja verisuonisairauksien sairaalahoitojen kokonaismäärä. Tilanteissa, joissa tutkimuksen ensisijaiset päätepisteet eivät osoita merkittävää hyötyä hoidosta, merkitsevyysarvojen määrittäminen muille tuloksille on monimutkaista, ja tällaisia arvoja on tulkittava varoen.
Yhdysvaltojen ja Australian ja Uuden-Seelannin kokeiden tulokset olivat seuraavat:
Sydämen vajaatoiminnan etenemisen hidastuminen
Yhdessä yhdysvaltalaisen monikeskustutkimuksen (366 koehenkilöä) ensisijaisena päätepisteenä oli sydän- ja verisuoniperäisen kuolleisuuden, kardiovaskulaarisen sairaalahoidon ja sydämen vajaatoimintalääkkeiden jatkuvan lisääntymisen summa. Sydämen vajaatoiminnan eteneminen väheni keskimäärin 7 kuukauden seurannan aikana 48 % (P = 0,008).
Australian ja Uuden-Seelannin välisessä tutkimuksessa kuolemantapaukset ja sairaalahoidon kokonaismäärät vähenivät noin 25 % 18-24 kuukauden aikana. Kolmessa suurimmassa Yhdysvalloissa tehdyssä tutkimuksessa kuolemat ja sairaalahoitojen kokonaismäärät vähenivät 19 %, 39 % ja 49 %, mikä oli nimellisesti tilastollisesti merkitsevää kahdessa viimeisessä tutkimuksessa. Australian ja Uuden-Seelannin tulokset olivat tilastollisesti rajallisia.
Toiminnalliset toimenpiteet
Yhdessäkään monikeskustutkimuksessa ei ollut NYHA-luokitusta ensisijaisena päätepisteenä, mutta kaikissa tällaisissa kokeissa se oli toissijainen päätepiste. Kaikissa kokeissa NYHA-luokassa oli ainakin suuntaus parantumiseen. Harjoituksen sietokyky oli ensisijainen päätepiste 3 kokeessa; yhdessäkään ei havaittu tilastollisesti merkitsevää vaikutusta.
Subjektiiviset toimenpiteet
Karvediloli ei vaikuttanut terveyteen liittyvään elämänlaatuun, joka mitattiin tavanomaisella kyselylomakkeella (ensisijainen päätepiste yhdessä tutkimuksessa). Potilaiden ja tutkijoiden yleisarvioinnit osoittivat kuitenkin merkittävää parannusta useimmissa tutkimuksissa.
Kuolleisuus
Kuolema ei ollut ennalta määritelty päätepiste missään tutkimuksessa, mutta se analysoitiin kaikissa kokeissa. Kaiken kaikkiaan näissä neljässä yhdysvaltalaisessa tutkimuksessa kuolleisuus väheni, nimellisesti merkittävästi kahdessa tutkimuksessa.
COMET oikeudenkäynti
Tässä kaksoissokkotutkimuksessa 3 029 potilasta, joilla oli NYHA-luokan II-IV sydämen vajaatoiminta (vasemman kammion ejektiofraktio enintään 35 %), satunnaistettiin saamaan joko karvedilolia (tavoiteannos: 25 mg kahdesti vuorokaudessa) tai välittömästi vapautuvaa metoprololia. tartraatti (tavoiteannos: 50 mg kahdesti vuorokaudessa). Tutkittavien keski-ikä oli noin 62 vuotta, 80 % oli miehiä ja keskimääräinen vasemman kammion ejektiofraktio lähtötilanteessa oli 26 %. Noin 96 %:lla koehenkilöistä oli NYHA-luokan II tai III sydämen vajaatoiminta. Samanaikaiseen hoitoon kuuluivat diureetit (99 %), ACE:n estäjät (91 %), digitalis (59 %), aldosteroniantagonistit (11 %) ja "statiinit" lipidejä alentavat aineet (21 %). Keskimääräinen seuranta-aika oli 4,8 vuotta. Keskimääräinen karvedilolin annos oli 42 mg vuorokaudessa.
Kokeessa oli 2 ensisijaista päätepistettä: kaikista syistä johtuva kuolleisuus ja kuoleman ja sairaalahoidon yhdistelmä mistä tahansa syystä. COMETin tulokset on esitetty alla olevassa taulukossa 3. Kaikesta syystä kuolleilla oli suurin osa tilastollisesta painoarvosta ja se oli pääasiallinen kokeen koon määräävä tekijä. Kuolleisuus kaikista syistä oli 34 % karvedilolilla hoidetuista koehenkilöistä ja 40 % välittömästi vapautuvaa metoprololiryhmässä (P = 0,0017; riskisuhde = 0,83, 95 % CI: 0,74 - 0,93). Vaikutus kuolleisuuteen johtui ensisijaisesti sydän- ja verisuoniperäisten kuolemien vähenemisestä. Kahden ryhmän välinen ero yhdistettyyn päätepisteeseen ei ollut merkitsevä (P = 0,122). Arvioitu keskimääräinen eloonjäämisaika oli 8,0 vuotta karvedilolilla ja 6,6 vuotta välittömästi vapautuvalla metoprololilla.
Ei tiedetä, onko tällä metoprololin valmisteella millä tahansa annoksella tai tällä pienellä metoprololin annoksella mitään vaikutusta eloonjäämiseen tai sairaalahoitoon potilailla, joilla on sydämen vajaatoiminta. Näin ollen tämä tutkimus pidentää aikaa, jonka kuluessa karvediloli vaikuttaa eloonjäämiseen sydämen vajaatoiminnassa, mutta se ei ole todiste siitä, että karvediloli parantaisi tulosta verrattuna metoprololin (TOPROL-XL) formulaatioon ja hyödyttäisi sydämen vajaatoimintaa.
Vaikea sydämen vajaatoiminta (COPERNICUS)
Kaksoissokkotutkimuksessa (COPERNICUS) 2 289 potilaalla, joilla oli sydämen vajaatoiminta levossa tai vähäisessä rasituksessa ja vasemman kammion ejektiofraktio alle 25 % (keskiarvo 20 %) huolimatta digitaliksesta (66 %), diureetteista (99 %) ja ACE:n estäjät (89 %) satunnaistettiin saamaan lumelääkettä tai karvedilolia. Karvedilolia titrattiin aloitusannoksesta 3,125 mg kahdesti vuorokaudessa suurimman siedettyyn annokseen tai 25 mg:aan kahdesti vuorokaudessa vähintään 6 viikon ajan. Useimmat koehenkilöt saavuttivat tavoiteannoksen 25 mg. Kokeilu suoritettiin Itä- ja Länsi-Euroopassa, Yhdysvalloissa, Israelissa ja Kanadassa. Samanlainen määrä koehenkilöitä ryhmää kohden (noin 100) vetäytyi titrausjakson aikana.
Kokeen ensisijainen päätepiste oli kaikista syistä johtuva kuolleisuus, mutta myös syyspesifistä kuolleisuutta ja kuoleman tai sairaalahoidon riskiä (kokonais-, kardiovaskulaarinen [CV] tai sydämen vajaatoiminta [HF]) tutkittiin. Kehittyviä koetietoja seurasi tiedonseurantakomitea, ja kuolleisuusanalyysejä mukautettiin näihin moninkertaisiin katseisiin. Tutkimus keskeytettiin 10 kuukauden mediaaniseurannan jälkeen, koska kuolleisuus väheni 35 % (19,7 %:sta potilasvuotta kohden lumelääkettä saaneiden 12,8 %:iin karvedilolia saaneiden; riskisuhde 0,65, 95 %:n luottamusväli: 0,52-0,81, P = 0,0014, säädetty) (katso kuva 1). COPERNICUS-tutkimuksen tulokset on esitetty taulukossa 4.
Kuva 1. COPERNICUS (Intent-to-Treat) selviytymisanalyysi 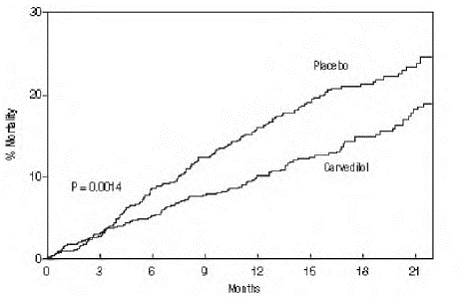
Vaikutus kuolleisuuteen johtui pääasiassa koehenkilöiden äkillisen kuoleman määrän vähenemisestä ilman sydämen vajaatoiminnan pahenemista.
Potilaiden yleisarvioinnit, joissa karvedilolilla hoidettuja koehenkilöitä verrattiin lumelääkkeeseen, perustuivat ennalta määriteltyihin, säännöllisin väliajoin potilaan itsearviointeihin sen suhteen, osoittiko kliininen tila hoidon jälkeen paranemista, huononemista vai ei muutosta lähtötasoon verrattuna. Karvedilolilla hoidetut koehenkilöt osoittivat merkittäviä parannuksia maailmanlaajuisissa arvioissa verrattuna lumelääkettä saaneisiin COPERNICUS-tutkimuksessa.
Pöytäkirjassa määrättiin myös, että sairaalahoidot arvioidaan. Harvempi 6,25 mg:n COREG-annoksella kuin lumelääkettä saaneita potilaita joutui sairaalaan mistä tahansa syystä (372 vs. 432, P = 0,0029), kardiovaskulaarisista syistä (246 vs. 314, P = 0,0003) tai sydämen vajaatoiminnan pahenemisen vuoksi (198 vs. 268, P = 0,001). ).
COREG 6,25 mg:lla oli johdonmukainen ja suotuisa vaikutus kaikista syistä kuolleisuuteen sekä kaikista syistä johtuvan kuolleisuuden ja sairaalahoidon yhdistettyihin päätepisteisiin (kokonaisarvo, CV tai sydämen vajaatoiminta) koko tutkimusväestössä ja kaikissa tutkituissa alaryhmissä, mukaan lukien miehet ja naiset, vanhukset ja ei-vanhukset, mustat ja ei-mustat sekä diabeetikot ja ei-diabeetikot (ks. kuva 2).
Kuva 2. Vaikutukset kuolleisuuteen COPERNICUS-lajin alaryhmissä 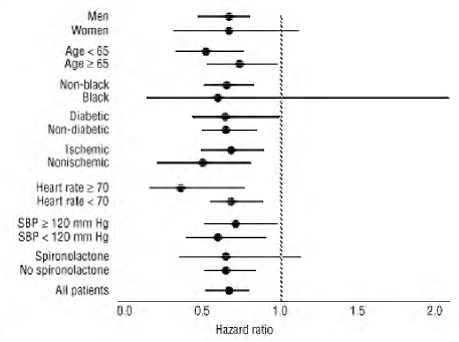
Sydäninfarktin jälkeinen vasemman kammion toimintahäiriö
CAPRICORN oli kaksoissokkotutkimus, jossa verrattiin karvedilolia ja lumelääkettä 1 959 potilaalla, joilla oli äskettäin sydäninfarkti (21 päivän sisällä) ja vasemman kammion ejektiofraktio oli enintään 40 % ja joilla oli (47 %) tai ilman sydämen vajaatoiminnan oireita. Koehenkilöt, joille annettiin karvedilolia, saivat 6,25 mg kahdesti vuorokaudessa, titrattu siedetyksi 25 mg:aan kahdesti vuorokaudessa. Tutkittavien systolisen verenpaineen piti olla yli 90 mm Hg, sykkeen istuessa yli 60 lyöntiä minuutissa, eikä beetasalpaajien käytölle ollut vasta-aiheita. Indeksiinfarktin hoitoon sisältyi aspiriini (85 %), IV tai oraaliset beetasalpaajat (37 %), nitraatit (73 %), hepariini (64 %), trombolyytit (40 %) ja akuutti angioplastia (12 %). Taustahoitoon kuuluivat ACE:n estäjät tai angiotensiinireseptorin salpaajat (97 %), antikoagulantit (20 %), lipidejä alentavat aineet (23 %) ja diureetit (34 %). Peruspopulaatioon sisältyi keski-ikä 63 vuotta, 74 % miehiä, 95 % valkoihoisia, keskimääräinen verenpaine 121/74 mm Hg, 22 % diabeetikko ja 54 % kohonnut verenpaine. Keskimääräinen karvedilolin annos oli 20 mg kahdesti vuorokaudessa; seurannan keskimääräinen kesto oli 15 kuukautta.
Kokonaiskuolleisuus oli lumelääkeryhmässä 15 % ja karvediloliryhmässä 12 %, mikä viittaa 23 %:n riskin pienenemiseen karvedilolilla hoidetuilla koehenkilöillä (95 % CI: 2 % - 40 %, P = 0,03), kuten kuvasta näkyy. 3. Vaikutukset kuolleisuuteen eri alaryhmissä on esitetty kuvassa 4. Lähes kaikki kuolemat olivat sydän- ja verisuonisairauksia (karvediloli vähensi niitä 25 %), ja suurin osa näistä kuolemista oli äkillisiä tai liittyi pumpun toimintahäiriöön (molemmat kuolemat vähenivät karvedilolilla). Toinen kokeen päätepiste, kokonaiskuolleisuus ja kaikista syistä johtuva sairaalahoito, ei osoittanut merkittävää parannusta.
Karvedilolilla hoidetussa ryhmässä havaittiin myös kuolemaan johtaneiden tai ei-kuolemaan johtavien sydäninfarktien merkittävä 40 %:n väheneminen (95 % CI: 11 % - 60 %, P = 0,01). Samanlainen sydäninfarktin riskin pieneneminen havaittiin myös plasebokontrolloiduissa tutkimuksissa sydämen vajaatoimintaan liittyvissä karvedilolitutkimuksissa.
Kuva 3. KAURIN selviytymisanalyysi (Intent-to-Treat) 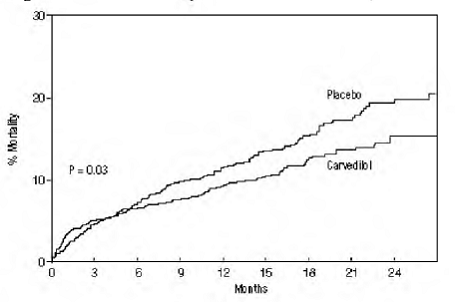
Kuva 4. Vaikutukset kuolleisuuteen KAURIN alaryhmissä 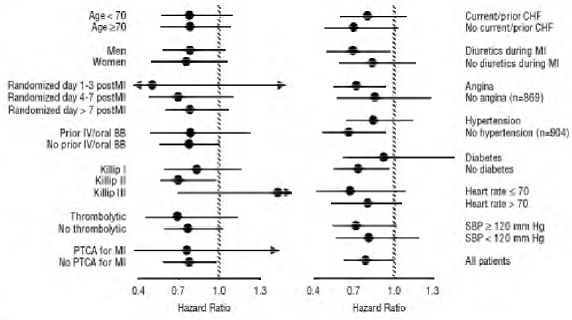
Hypertensio
COREG 25 mg:aa tutkittiin kahdessa lumekontrolloidussa tutkimuksessa, joissa käytettiin kahdesti vuorokaudessa annettavaa annosta 12,5–50 mg:n päivittäisillä kokonaisannoksilla. Näissä ja muissa tutkimuksissa aloitusannos ei ylittänyt 12,5 mg:aa. 50 mg:lla vuorokaudessa COREG alensi istumakohtaista (12 tunnin) verenpainetta noin 9/5,5 mmHg; 25 mg:lla päivässä vaikutus oli noin 7,5/3,5 mmHg. Verenpaineen alimman ja huippuarvon vertailu osoitti, että verenpainevasteen alimman ja huippuarvon välinen suhde oli noin 65 %. Syke laski noin 7,5 lyöntiä minuutissa 50 mg:lla päivässä. Yleisesti ottaen, kuten muiden β-salpaajien kohdalla, vasteet olivat pienempiä mustilla kuin ei-mustilla koehenkilöillä. Vastauksessa ei ollut ikään tai sukupuoleen liittyviä eroja.
Verenpainetta alentavan vaikutuksen huippu saavutettiin 1-2 tunnin kuluttua annoksesta. Annosriippuvaiseen verenpainevasteeseen liittyi annoksesta riippuvainen haittavaikutusten lisääntyminen [katso HAITTAVAIKUTUKSET ].
Hypertensio ja tyypin 2 diabetes
Kaksoissokkotutkimuksessa (GEMINI) COREG 25 mg lisättynä ACE:n estäjään tai angiotensiinireseptorin salpaajaan arvioitiin populaatiossa, jolla oli lievä tai kohtalainen verenpainetauti ja hyvin hallinnassa oleva tyypin 2 diabetes. Keskimääräinen HbA1c lähtötilanteessa oli 7,2 %. COREG titrattiin keskimääräiseen annokseen 17,5 mg kahdesti vuorokaudessa ja pidettiin 5 kuukauden ajan. COREG:llä ei ollut haitallista vaikutusta glukoositasapainoon HbA1c-mittausten perusteella (keskimääräinen muutos lähtötasosta 0,02 %, 95 % luottamusväli: -0,06 - 0,10, P = NS) [ks. VAROITUKSET JA VAROTOIMET ].
POTILASTIEDOT
COREG (Co-REG) (karvediloli) Tabletit
Lue COREGin mukana tulevat potilastiedot ennen kuin aloitat sen käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa sitä, että keskustelet lääkärisi kanssa terveydentilastasi tai hoidostasi. Jos sinulla on kysyttävää COREG 3,12 mg:sta, käänny lääkärin tai apteekkihenkilökunnan puoleen.
Mikä on COREG 3.12mg?
COREG on reseptilääke, joka kuuluu "beetasalpaajiksi" kutsuttujen lääkeaineiden ryhmään. COREG 6,25 mg:aa käytetään usein muiden lääkkeiden kanssa seuraaviin sairauksiin:
- potilaiden hoitoon, joilla on tietyntyyppinen sydämen vajaatoiminta
- potilaiden hoitoon, joilla on ollut sydänkohtaus, joka pahensi sydämen pumppauskykyä
- potilaiden hoitoon, joilla on korkea verenpaine (hypertensio)
COREGiä ei ole hyväksytty alle 18-vuotiaille lapsille.
Kuka ei saa ottaa COREGiä?
Älä ota COREG 6,25 mg:aa, jos:
- sinulla on vaikea sydämen vajaatoiminta ja he ovat sairaalahoidossa tehohoidossa tai tarvitsevat tiettyjä suonensisäisiä lääkkeitä, jotka tukevat verenkiertoa (inotrooppiset lääkkeet).
- ovat alttiita astmalle tai muille hengitysvaikeuksille.
- sinulla on hidas syke tai sydän, joka jättää lyönnin väliin (epäsäännöllinen syke).
- sinulla on maksaongelmia.
- ovat allergisia jollekin COREGin aineosalle. Vaikuttava aine on karvediloli. Katso tämän pakkausselosteen lopusta luettelo kaikista COREGin ainesosista.
Mitä minun pitäisi kertoa lääkärilleni ennen COREGin ottamista?
Kerro lääkärillesi kaikista sairauksistasi, mukaan lukien jos:
- sinulla on astma tai muita keuhko-ongelmia (kuten keuhkoputkentulehdus tai emfyseema).
- sinulla on verenkiertoongelmia jaloissasi (perifeerinen verisuonisairaus). COREG 3,12 mg voi pahentaa joitain oireitasi.
- on diabetes.
- sinulla on kilpirauhasen ongelmia.
- sinulla on tila nimeltä feokromosytooma.
- on ollut vakavia allergisia reaktioita.
- olet raskaana tai yrität tulla raskaaksi. Ei tiedetä, onko COREG turvallinen syntymättömälle lapsellesi. Sinun ja lääkärisi tulee keskustella parhaasta tavasta hallita korkeaa verenpainettasi raskauden aikana.
- imettävät. Ei tiedetä, erittyykö COREG äidinmaitoon. Keskustele lääkärisi kanssa parhaasta tavasta ruokkia vauvasi, jos käytät COREGiä.
- on määrä leikkaukseen ja heille annetaan anestesia-aineita.
- sinulle suunnitellaan kaihileikkausta ja olet käyttänyt tai käytät parhaillaan COREGiä.
- käytät resepti- tai käsikauppalääkkeitä, vitamiineja ja rohdosvalmisteita. COREG ja tietyt muut lääkkeet voivat vaikuttaa toisiinsa ja aiheuttaa vakavia sivuvaikutuksia. COREG 3,12 mg voi vaikuttaa muiden lääkkeiden tehoon. Myös muut lääkkeet voivat vaikuttaa COREG 25 mg:n tehoon.
Pidä luettelo kaikista käyttämistäsi lääkkeistä. Näytä tämä luettelo lääkärillesi ja apteekkiin ennen kuin aloitat uuden lääkkeen.
Miten minun pitäisi ottaa COREG?
On tärkeää, että otat lääkkeesi joka päivä lääkärisi ohjeiden mukaan. Jos lopetat COREGin käytön äkillisesti, sinulla voi olla rintakipua ja/tai sydänkohtaus. Jos lääkärisi päättää, että sinun tulee lopettaa COREG 6,25 mg:n käyttö, lääkärisi saattaa pienentää annostasi hitaasti tietyn ajan kuluessa ennen kuin lopetat sen kokonaan.
- Ota COREG juuri niin kuin on määrätty. Lääkärisi kertoo sinulle, kuinka monta tablettia sinun tulee ottaa ja kuinka usein. Mahdollisten sivuvaikutusten minimoimiseksi lääkärisi voi aloittaa pienellä annoksella ja lisätä sitten annosta hitaasti.
- Älä lopeta COREGin käyttöä äläkä muuta ottamasi COREG-määrää keskustelematta asiasta lääkärisi kanssa.
- Kerro lääkärillesi, jos painosi nousee tai sinulla on hengitysvaikeuksia COREG-hoidon aikana.
- Ota COREG ruoan kanssa.
- Jos unohdat ottaa COREG 3,12 mg -annoksen, ota se heti kun muistat, ellei ole seuraavan annoksen aika. Ota seuraava annos tavalliseen aikaan. Älä ota 2 annosta samanaikaisesti.
- Jos otat liikaa COREG 25 mg -valmistetta, ota heti yhteys lääkäriin tai myrkytystietokeskukseen.
Mitä minun pitäisi välttää COREG 3,12mg:n käytön aikana?
- COREG voi aiheuttaa huimausta, väsymystä tai pyörtymistä. Älä aja autoa, käytä koneita tai tee mitään, mikä vaatii sinulta valppautta, jos sinulla on näitä oireita.
Mitkä ovat COREGin mahdolliset sivuvaikutukset?
- Matala verenpaine (joka voi aiheuttaa huimausta tai pyörtymistä noustessa ylös). Jos näitä tapahtuu, istu heti tai mene makuulle ja kerro asiasta lääkärillesi.
- Väsymys. Jos tunnet itsesi väsyneeksi tai huimaukseksi, sinun ei tule ajaa, käyttää koneita tai tehdä mitään, mikä vaatii sinulta valppautta.
- Hidas syke.
- Muutokset verensokerisi. Jos sinulla on diabetes, kerro lääkärillesi, jos sinulla on muutoksia verensokeritasoissasi.
- COREG saattaa piilottaa joitain alhaisen verensokerin oireita, erityisesti nopean sydämen sykkeen.
- COREG saattaa peittää hypertyreoosin (kilpirauhasen liikatoiminnan) oireet.
- Vakavien allergisten reaktioiden paheneminen.
- Harvinaisia mutta vakavia allergisia reaktioita (mukaan lukien nokkosihottuma tai kasvojen, huulten, kielen ja/tai kurkun turvotus, joka voi aiheuttaa hengitys- tai nielemisvaikeuksia) on esiintynyt COREG-hoitoa saaneilla potilailla. Nämä reaktiot voivat olla hengenvaarallisia.
Muita COREGin sivuvaikutuksia ovat hengenahdistus, painonnousu, ripuli ja vähemmän kyyneleitä tai silmien kuivumista, joista tulee häiritseviä, jos käytät piilolinssejä.
Soita lääkärillesi, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai eivät mene pois.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA1088.
Kuinka minun pitäisi säilyttää COREG 6,25 mg?
- Säilytä COREGiä alle 30 °C:ssa. Pidä tabletit kuivina.
- Turvallisesti hävitä COREG, joka on vanhentunut tai jota ei enää tarvita.
- Pidä COREG 6,25 mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä COREG:stä
Lääkkeitä määrätään joskus muihin kuin potilasohjeissa kuvattuihin sairauksiin. Älä käytä COREG 3,12 mg:aa sairauteen, johon sitä ei ole määrätty. Älä anna COREGiä muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tässä esitteessä on yhteenveto tärkeimmistä COREG-tiedoista. Jos haluat lisätietoja, keskustele lääkärisi kanssa. Voit kysyä lääkäriltäsi tai apteekista tietoja COREG 6,25 mg:sta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Mitkä ovat COREGin ainesosat?
Vaikuttava aine: karvediloli.
Inaktiiviset ainesosat: kolloidinen piidioksidi, krospovidoni, hypromelloosi, laktoosi, magnesiumstearaatti, polyetyleeniglykoli, polysorbaatti 80, povidoni, sakkaroosi ja titaanidioksidi.
Karvedilolitabletteja on saatavana seuraavina vahvuuksina: 3,125 mg, 6,25 mg, 12,5 mg, 25 mg.
Mikä on korkea verenpaine (hypertensio)?
Verenpaine on veren voimaa verisuonissasi, kun sydämesi lyö ja kun sydämesi lepää. Sinulla on korkea verenpaine, kun voimaa on liikaa. Korkea verenpaine saa sydämen työskentelemään kovemmin pumppaamaan verta kehon läpi ja vahingoittaa verisuonia. COREG voi auttaa verisuoniasi rentoutumaan, jolloin verenpaineesi laskee. Verenpainetta alentavat lääkkeet voivat vähentää aivohalvauksen tai sydänkohtauksen riskiä.
