Zyvox 600mg Linezolid Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Zyvox 600mg on ja miten sitä käytetään?
Zyvox on reseptilääke, jota käytetään bakteeri-infektioiden, kuten keuhkokuumeen, ihoinfektioiden ja muille antibiooteille vastustuskykyisten infektioiden oireiden hoitoon. Zyvox 600 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Zyvox kuuluu lääkeryhmään nimeltä Antibiootit, Muut; Oksatsolidinonit.
Ei tiedetä, onko Zyvox turvallinen ja tehokas lapsille.
Mitkä ovat Zyvoxin mahdolliset sivuvaikutukset?
Zyvox voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nokkosihottuma,
- vaikeuksia hengittää,
- turvotus kasvoissasi tai kurkussasi,
- vakava ihoreaktio,
- kuume,
- kipeä kurkku,
- palavat silmät,
- ihokipu,
- punainen tai violetti ihottuma, johon liittyy rakkuloita ja hilseilyä,
- näköongelmia,
- muutoksia näkössäsi,
- kova vatsakipu,
- vetistä tai veristä ripulia,
- kohtaukset,
- hikoilu,
- ahdistuneisuus tai vapina,
- agitaatio,
- hallusinaatiot,
- kuume,
- vapina,
- nopea syke,
- lihasten jäykkyys,
- nykiminen,
- koordinaation menetys,
- pahoinvointi,
- oksentelua,
- ripuli,
- epätavallinen lihaskipu,
- vaikeuksia hengittää,
- vatsakipu,
- epäsäännöllinen syke,
- huimaus,
- kylmä olo,
- hyvin heikko tai väsynyt olo,
- hämmennystä,
- suun haavaumat,
- ihohaavat,
- helppo mustelma,
- epätavallinen verenvuoto,
- kalpea iho,
- kylmät kädet ja jalat,
- huimaus ja
- hengenahdistus
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Zyvoxin yleisimpiä sivuvaikutuksia ovat:
- pahoinvointi,
- oksentelua,
- ripuli,
- lievä ihottuma,
- anemia (alhaiset punasolut),
- päänsärkyä ja
- huimaus
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Zyvoxin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
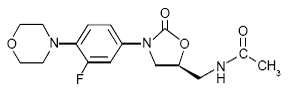
ZYVOX 600mg IV-injektio, ZYVOX-tabletit ja ZYVOX oraalisuspensioon sisältävät linetsolidia, joka on synteettinen oksatsolidinoniluokkaan kuuluva antibakteerinen aine. Linetsolidin kemiallinen nimi on (S)-N-[[3-[3-fluori-4-(4-morfolinyyli)fenyyli]-2-okso-5-oksatsolidinyyli]metyyli]asetamidi.
Empiirinen kaava on C16H20FN3O4. Sen molekyylipaino on 337,35, ja sen kemiallinen rakenne on esitetty alla:
ZYVOX 600mg IV Injection toimitetaan käyttövalmiina steriilinä isotonisena liuoksena suonensisäistä infuusiota varten. Jokainen ml sisältää 2 mg linetsolidia. Inaktiiviset ainesosat ovat natriumsitraatti, sitruunahappo ja dekstroosi vesipitoisessa vehikkelissä suonensisäistä antoa varten. Natrium (Na+) -pitoisuus on 0,38 mg/ml (5 mEq/300 ml pussi ja 1,7 mekv/100 ml pussi).
Suun kautta annettava ZYVOX-tabletti sisältää 600 mg linetsolidia kalvopäällysteisenä puristettuna tablettina. Ei-aktiiviset aineet ovat maissitärkkelys, mikrokiteinen selluloosa, hydroksipropyyliselluloosa, natriumtärkkelysglykolaatti, magnesiumstearaatti, hypromelloosi, polyetyleeniglykoli, titaanidioksidi ja karnaubavaha. Natrium (Na+) -pitoisuus on 2,92 mg 600 mg:n tabletissa (0,1 mekv/tabletti).
ZYVOX 600mg oraalisuspensiota varten toimitetaan appelsiinin makuisena rakeina/jauheena, joka voidaan valmistaa suspensioksi oraalista antoa varten. Valmistuksen jälkeen jokainen 5 ml sisältää 100 mg linetsolidia. Inaktiivisia aineosia ovat sakkaroosi, sitruunahappo, natriumsitraatti, mikrokiteinen selluloosa ja karboksimetyyliselluloosanatrium, aspartaami, ksantaanikumi, mannitoli, natriumbentsoaatti, kolloidinen piidioksidi, natriumkloridi ja aromit [ks. POTILASTIEDOT ]. Natrium (Na+) -pitoisuus on 8,52 mg/5 ml (0,4 mekv./5 ml).
INDIKAATIOT
Nosokomiaalinen keuhkokuume
ZYVOX on tarkoitettu Staphylococcus aureuksen (metisilliinille herkät ja resistentit isolaatit) tai Streptococcus pneumoniaen aiheuttaman sairaalakeuhkokuumeen hoitoon [ks. Kliiniset tutkimukset ].
Yhteisön hankkima keuhkokuume
ZYVOX 600mg on tarkoitettu Streptococcus pneumoniaen aiheuttaman yhteiskunnan aiheuttaman keuhkokuumeen hoitoon, mukaan lukien tapaukset, joissa on samanaikainen bakteremia tai Staphylococcus aureus (vain metisilliinille herkät isolaatit) [ks. Kliiniset tutkimukset ].
Monimutkaiset iho- ja ihorakenteen infektiot
ZYVOX 600mg on tarkoitettu monimutkaisten iho- ja ihorakenteen infektioiden hoitoon, mukaan lukien diabeettiset jalkainfektiot, ilman samanaikaista osteomyeliittiä, jotka ovat aiheuttaneet Staphylococcus aureus (metisilliinille herkät ja resistentit isolaatit), Streptococcus pyogenes tai Streptococcus agalactiae. ZYVOXia ei ole tutkittu decubitus-haavojen hoidossa [katso Kliiniset tutkimukset ].
Komplisoitumattomat iho- ja ihorakenteen infektiot
ZYVOX 600mg on tarkoitettu Staphylococcus aureuksen (vain metisilliinille herkät isolaatit) tai Streptococcus pyogenesin aiheuttamien komplisoitumattomien iho- ja ihorakenteen infektioiden hoitoon [ks. Kliiniset tutkimukset ].
Vankomysiiniresistentit Enterococcus faecium -infektiot
ZYVOX 600mg on tarkoitettu vankomysiiniresistenttien Enterococcus faecium -infektioiden hoitoon, mukaan lukien tapaukset, joissa on samanaikainen bakteremia [ks. Kliiniset tutkimukset ].
Käyttörajoitukset
- ZYVOX 600 mg ei ole tarkoitettu gramnegatiivisten infektioiden hoitoon. On erittäin tärkeää, että spesifinen gramnegatiivinen hoito aloitetaan välittömästi, jos samanaikainen gramnegatiivinen patogeeni on dokumentoitu tai sitä epäillään [ks. VAROITUKSET JA VAROTOIMET ].
- Yli 28 päivän ajan annettujen ZYVOX 600 mg formulaatioiden turvallisuutta ja tehoa ei ole arvioitu kontrolloiduissa kliinisissä tutkimuksissa [ks. Kliiniset tutkimukset ].
Käyttö
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja ZYVOX 600mg:n ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi ZYVOXia tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden todistetaan tai epäillään olevan herkkien bakteerien aiheuttamia. Kun viljely- ja herkkyystiedot ovat saatavilla, ne tulee ottaa huomioon valittaessa tai muuttaessa antibakteerista hoitoa. Tällaisten tietojen puuttuessa paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa hoidon empiiriseen valintaan.
ANNOSTELU JA HALLINNOINTI
Yleinen annostus ja antotapa
Suositeltu annostus ZYVOX 600 mg -valmisteille infektioiden hoitoon on kuvattu taulukossa 1.
Annosta ei tarvitse muuttaa, kun siirrytään suonensisäisestä antamisesta suun kautta.
Suonensisäinen anto
ZYVOX 600mg IV Injection toimitetaan kerta-annoskäyttövalmiissa infuusiopusseissa. Parenteraaliset lääkevalmisteet tulee tarkastaa silmämääräisesti hiukkasten varalta ennen antoa. Tarkista vuodot puristamalla pussia lujasti. Jos havaitset vuotoja, hävitä liuos, koska steriiliys voi heikentyä. Säilytä infuusiopussit päällyskääreessä, kunnes olet valmis käyttämään. Säilytä huoneenlämmössä. Suojaa jäätymiseltä. ZYVOX 600mg IV -injektiolla voi olla keltaista väriä, joka voi voimistua ajan myötä vaikuttamatta haitallisesti tehoon.
ZYVOX IV -injektio tulee antaa suonensisäisenä infuusiona 30–120 minuutin aikana. Älä käytä tätä suonensisäistä infuusiopussia sarjaliitännöissä. Tähän liuokseen ei saa lisätä lisäaineita. Jos ZYVOX 600mg IV -injektio annetaan samanaikaisesti toisen lääkkeen kanssa, jokainen lääke tulee antaa erikseen kullekin tuotteelle suositellun annoksen ja antoreitin mukaisesti. Hävitä käyttämätön osa.
Jos samaa suonensisäistä linjaa käytetään useiden lääkkeiden peräkkäiseen infuusioon, linja tulee huuhdella ennen ZYVOX IV -infuusiota ja sen jälkeen infuusioliuoksella, joka on yhteensopiva ZYVOX 600 mg IV -injektion kanssa ja minkä tahansa muun tämän yhteisen linjan kautta annettavan lääkkeen kanssa. .
Yhteensopivuus
Yhteensopivia suonensisäisiä liuoksia ovat 0,9 % natriumkloridi-injektio, USP, 5 % dekstroosiinjektio, USP ja Ringerin laktaattiruiske, USP.
Yhteensopimattomuudet
Fyysinen yhteensopimattomuus johtui, kun ZYVOX 600mg IV -injektio yhdistettiin seuraavien lääkkeiden kanssa simuloidun Y-kohdan antamisen aikana: amfoterisiini B, klooripromatsiini HCl, diatsepaami, pentamidiini-isotionaatti, erytromysiinilaktobionaatti, fenytoiininatrium ja sulfaamitoksatsoli. Lisäksi seurasi kemiallinen yhteensopimattomuus, kun ZYVOX IV Injection yhdistettiin keftriaksoninatriumin kanssa.
Suullisen keskeytyksen perustuslaki
ZYVOX oraalisuspensiota varten toimitetaan jauheena/rakeina valmistusta varten. Napauta pulloa kevyesti jauheen irtoamiseksi. Lisää yhteensä 123 ml tislattua vettä kahdessa erässä. Kun olet lisännyt ensimmäisen puoliskon, ravista voimakkaasti, jotta kaikki jauhe kastuu. Lisää sitten toinen puolikas vedestä ja ravista voimakkaasti, jotta saadaan tasainen suspensio. Valmistamisen jälkeen jokainen 5 ml suspensiota sisältää 100 mg linetsolidia. Ennen käyttöä, sekoita varovasti kääntämällä pulloa 3–5 kertaa. Älä ravista. Säilytä valmis suspensio huoneenlämmössä. Käytä 21 päivän kuluessa valmistamisesta.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
ZYVOX 600mg IV-injektio: 200 mg/100 ml (2 mg/ml) ja 600 mg/300 ml (2 mg/ml) linetsolidia, kerta-annos, käyttövalmiit joustavat muoviset infuusiopussit kalvolaminaattikääreessä.
ZYVOX 600 mg tabletti:
valkoinen, kapselin muotoinen kalvopäällysteinen tabletti, jonka toisella puolella on merkintä "ZYV" ja toisella puolella "600". ZYVOX 600 mg oraalisuspensiota varten: kuiva, valkoinen tai luonnonvalkoinen, oranssin makuinen rake/jauhe. Ohjeiden mukaisesti valmistettuna jokainen pullo sisältää 150 ml suspensiota, joka vastaa 100 mg linetsolidia jokaista 5 ml:aa kohti.
Varastointi ja käsittely
Injektio
ZYVOX 600 mg IV Injektio on saatavana kerta-annoksisissa, käyttövalmiissa taipuisissa muovisissa infuusiopusseissa, jotka on pakattu kalvolaminaattikääreeseen. Infuusiopussit ja -portit eivät ole valmistettu luonnonkumilateksista. Infuusiopusseja on saatavana seuraavissa pakkauskokoissa:
200 mg/100 ml (2 mg/ml) linetsolidia x 10 - NDC 0009-5137-04 600 mg/300 ml (2 mg/ml) linetsolidi x 10 - NDC 0009-5140-04
Tabletit
ZYVOX 600 mg tabletit ovat saatavilla seuraavasti:
600 mg (valkoinen, kapselin muotoinen, kalvopäällysteinen tabletti, jonka toisella puolella on merkintä "ZYV" ja toisella puolella "600")
20 tablettia HDPE-pullossa - NDC 0009-5138-02 30 tabletin yksikköannospakkaukset - NDC 0009-5138-03
Oraalinen suspensio
ZYVOX oraalisuspensiota varten on saatavana kuivana, valkoisena tai luonnonvalkoisena, appelsiinin makuisena rakeina/jauheena. Ohjeiden mukaisesti valmistettuna jokainen pullo sisältää 150 ml suspensiota, joka vastaa 100 mg linetsolidia jokaista 5 ml:aa kohti. ZYVOX oraalisuspensiota varten toimitetaan seuraavasti:
100 mg/5 ml 240 ml:n lasipulloissa - NDC 0009-5136-01
Varastointi ja käsittely
Säilytä 25°C:ssa (77°F). Suojaa valolta. Pidä pullot tiiviisti suljettuina kosteudelta suojaamiseksi. On suositeltavaa, että infuusiopussit säilytetään päällyskääreessä, kunnes ne ovat käyttövalmiita. Suojaa infuusiopussit jäätymiseltä.
Jakelija: Pharmacia & Upjohn Co Division of Pfizer Inc, NY, NY 10017. Tarkistettu: marraskuu 2021.
SIVUVAIKUTUKSET
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Aikuiset
ZYVOX 600 mg -valmisteiden turvallisuutta arvioitiin 2 046 aikuispotilaalla, jotka otettiin mukaan seitsemään faasin 3 vertailukontrolloituun kliiniseen tutkimukseen ja joita hoidettiin enintään 28 päivää.
Komplisoitumattomien iho- ja ihorakenneinfektioiden (uSSSI) vuoksi hoidetuista potilaista 25,4 %:lla ZYVOX-hoitoa saaneista ja 19,6 %:lla vertailuvalmistetta saaneista potilaista esiintyi vähintään yksi lääkkeeseen liittyvä haittatapahtuma. Kaikissa muissa käyttöaiheissa 20,4 %:lla ZYVOX-hoitoa saaneista ja 14,3 %:lla vertailuvalmisteella hoidetuista potilaista esiintyi vähintään yksi lääkkeeseen liittyvä haittatapahtuma.
Taulukossa 2 esitetään ZYVOX-annoksilla kaikkien kausaalisten hoitoon liittyvien haittavaikutusten ilmaantuvuus vähintään 1 %:lla aikuispotilaista näissä tutkimuksissa.
USSSI:n vuoksi hoidetuista potilaista 3,5 % ZYVOXilla hoidetuista ja 2,4 % vertailuvalmisteilla hoidetuista potilaista keskeytti hoidon lääkkeisiin liittyvien haittatapahtumien vuoksi. Kaikissa muissa käyttöaiheissa lääkkeeseen liittyvistä haittavaikutuksista johtuvia keskeytyksiä esiintyi 2,1 %:lla ZYVOX-hoitoa saaneista ja 1,7 %:lla vertailuvalmistetta saaneista potilaista. Yleisimmät raportoidut lääkkeeseen liittyvät haittatapahtumat, jotka johtivat hoidon lopettamiseen, olivat pahoinvointi, päänsärky, ripuli ja oksentelu.
Pediatriset potilaat
ZYVOX-valmisteiden turvallisuutta arvioitiin 215:llä lapsipotilaalla, joiden ikä vaihteli syntymästä 11 vuoteen, ja 248:lla 5–17-vuotiaalla lapsipotilaalla (146 näistä 248:sta oli 5–11-vuotiaita ja 102 12–17-vuotiaita). Nämä potilaat otettiin mukaan kahteen faasin 3 vertailuvalmisteella kontrolloituun kliiniseen tutkimukseen, ja heitä hoidettiin enintään 28 päivää. Tutkimuksessa sairaalassa olevilla lapsipotilailla (syntyvistä 11-vuotiaisiin), joilla oli grampositiivisia infektioita ja jotka satunnaistettiin 2-1 (linetsolidi: vankomysiini), kuolleisuus oli 6,0 % (13/215) linetsolidihaarassa ja 3,0 % (3/101). vankomysiinihaarassa. Potilasväestön vakavan perussairauden vuoksi syy-yhteyttä ei kuitenkaan voitu osoittaa.
USSSI-tautien vuoksi hoidetuista lapsipotilaista 19,2 %:lla ZYVOX-hoitoa saaneista ja 14,1 %:lla vertailuvalmistetta saaneista potilaista esiintyi vähintään yksi lääkkeeseen liittyvä haittatapahtuma. Kaikissa muissa käyttöaiheissa 18,8 %:lla ZYVOX-hoitoa saaneista ja 34,3 %:lla vertailuvalmisteella hoidetuista potilaista esiintyi vähintään yksi lääkkeeseen liittyvä haittatapahtuma.
Taulukossa 3 on esitetty kausaalisten, hoitoon liittyvien haittavaikutusten ilmaantuvuus, joita raportoitiin yli 1 %:lla lapsipotilaista (ja useammalla kuin yhdellä potilaalla) kummassakin hoitoryhmässä vertailuvalmisteella kontrolloiduissa 3. vaiheen tutkimuksissa.
USSSI-tautien vuoksi hoidetuista lapsipotilaista 1,6 % ZYVOX-hoitoa saaneista ja 2,4 % vertailuvalmisteilla hoidetuista potilaista keskeytti hoidon lääkkeisiin liittyvien haittatapahtumien vuoksi. Kaikissa muissa käyttöaiheissa lääkkeeseen liittyvistä haittavaikutuksista johtuvia keskeytyksiä esiintyi 0,9 %:lla ZYVOX-hoitoa saaneista ja 6,1 %:lla vertailuvalmistetta saaneista potilaista.
Laboratoriohäiriöt
ZYVOXiin on liittynyt trombosytopeniaa, kun sitä on käytetty enintään 600 mg:n annoksina 12 tunnin välein 28 päivän ajan. Vaiheen 3 vertailukontrolloiduissa tutkimuksissa aikuisten potilaiden prosenttiosuus, joille kehittyi huomattavasti alhainen verihiutaleiden määrä (määritelty alle 75 %:ksi normaalin alarajasta ja/tai lähtötasosta), oli 2,4 % (tutkimusten vaihteluväli: 0,3–10,0 %). ZYVOX 600 mg ja 1,5 % (tutkimusten vaihteluväli: 0,4-7,0 %) vertailuvalmisteella. Sairaalahoidossa olevilla lapsipotilailla tehdyssä tutkimuksessa, jonka ikä vaihteli syntymästä 11-vuotiaaseen, potilaiden prosenttiosuus, joille kehittyi huomattavasti alhainen verihiutaleiden määrä (määritelty alle 75 %:ksi normaalin alarajasta ja/tai lähtötilanteesta), oli 12,9 % ZYVOX 600 mg:lla. ja 13,4 % vankomysiinin kanssa. 5–17-vuotiailla lapsipotilailla tehdyssä avohoitotutkimuksessa potilaiden prosenttiosuus, joille kehittyi huomattavasti alhainen verihiutaleiden määrä, oli 0 % ZYVOXia käytettäessä ja 0,4 % kefadroksiilia käytettäessä. ZYVOXin käyttöön liittyvä trombosytopenia näyttää riippuvan hoidon kestosta (yleensä yli 2 viikkoa). Useimpien potilaiden verihiutaleiden määrä palautui normaalille alueelle/lähtötasolle seurantajakson aikana. Vaiheen 3 kliinisissä tutkimuksissa potilailla, joille kehittyi trombosytopenia, ei havaittu asiaan liittyviä kliinisiä haittavaikutuksia. Verenvuototapahtumia havaittiin trombosytopeniapotilailla ZYVOXin erityiskäyttöohjelmassa; linetsolidin roolia näissä tapahtumissa ei voida määrittää [ks VAROITUKSET JA VAROTOIMET ].
Muissa laboratorioparametreissa havaitut muutokset, ottamatta huomioon lääkesuhdetta, eivät paljastaneet olennaisia eroja ZYVOX 600 mg:n ja vertailuvalmisteiden välillä. Nämä muutokset eivät yleensä olleet kliinisesti merkittäviä, ne eivät johtaneet hoidon keskeyttämiseen ja olivat palautuvia. Taulukoissa 4, 5, 6 ja 7 on esitetty sellaisten aikuisten ja lapsipotilaiden ilmaantuvuus, joilla on vähintään yksi olennaisesti epänormaali hematologinen tai seerumikemiallinen arvo.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu ZYVOXin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoiselta populaatiolta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeille altistumiseen:
- Myelosuppressio (mukaan lukien anemia, leukopenia, pansytopenia ja trombosytopenia) [ks. VAROITUKSET JA VAROTOIMET ]; sideroblastinen anemia.
- Perifeerinen neuropatia ja optinen neuropatia, jotka joskus etenevät näön menettämiseen [katso VAROITUKSET JA VAROTOIMET ].
- Maitohappoasidoosi [katso VAROITUKSET JA VAROTOIMET ]. Vaikka näitä raportteja on pääasiassa esiintynyt potilailla, joita on hoidettu pidempään kuin suositeltu enimmäiskesto 28 päivää, näitä tapahtumia on raportoitu myös potilailla, jotka ovat saaneet lyhyempiä hoitojaksoja.
- Serotoniinioireyhtymää on raportoitu potilailla, jotka saavat samanaikaisesti serotonergisiä aineita, mukaan lukien masennuslääkkeet, kuten selektiiviset serotoniinin takaisinoton estäjät (SSRI) ja opioidit ja ZYVOX [ks. VAROITUKSET JA VAROTOIMET ].
- Kouristukset [katso VAROITUKSET JA VAROTOIMET ].
- Anafylaksia, angioödeema, rakkulaiset ihosairaudet, mukaan lukien vakavat ihohaittavaikutukset (SCAR), kuten toksinen epidermaalinen nekrolyysi ja Stevens-Johnsonin oireyhtymä, ja yliherkkyysvaskuliitti.
- Pintallista hampaiden värjäytymistä ja kielen värjäytymistä on raportoitu linetsolidin käytön yhteydessä. Hampaiden värjäys oli poistettavissa ammattimaisella hammaspuhdistuksella (manuaalinen kalkinpoisto) tapauksissa, joiden lopputulos oli tiedossa.
- Hypoglykemia, mukaan lukien oireenmukaiset jaksot [katso VAROITUKSET JA VAROTOIMET ].
- Hyponatremia ja/tai sopimattoman antidiureettisen hormonin erityksen oireyhtymä (SIADH) [ks. VAROITUKSET JA VAROTOIMET ].
HUUMEIDEN VUOROVAIKUTUKSET
Monoamiinioksidaasin estäjät
Linetsolidi on palautuva, ei-selektiivinen monoamiinioksidaasin estäjä [katso VASTA-AIHEET ja KLIININEN FARMAKOLOGIA ].
Adrenergiset ja serotonergiset aineet
Linetsolidilla on mahdollisuus yhteisvaikutukseen adrenergisten ja serotonergisten aineiden kanssa [katso VAROITUKSET JA VAROTOIMET ja KLIININEN FARMAKOLOGIA ].
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Myelosuppressio
Myelosuppressiota (mukaan lukien anemiaa, leukopeniaa, pansytopeniaa ja trombosytopeniaa) on raportoitu linetsolidia saavilla potilailla. Tapauksissa, joissa tulos on tiedossa, kun linetsolidin käyttö lopetettiin, hematologiset parametrit ovat nousseet hoitoa edeltävälle tasolle. Täydellistä verenkuvaa tulee seurata viikoittain linetsolidia saavilla potilailla, erityisesti niillä, jotka saavat linetsolidia yli kaksi viikkoa, potilailla, joilla on ennestään myelosuppressio, jotka saavat samanaikaisesti luuydinsuppressiota aiheuttavia lääkkeitä tai joilla on krooninen infektio. saanut aikaisempaa tai samanaikaista antibakteerista lääkehoitoa. Linetsolidihoidon lopettamista tulee harkita potilailla, joille kehittyy tai pahenee myelosuppressio.
Perifeerinen ja optinen neuropatia
Perifeerisiä ja optisia neuropatioita on raportoitu potilailla, joita on hoidettu ZYVOX 600 mg:lla, pääasiassa potilailla, joita on hoidettu pidempään kuin suositeltu 28 päivän enimmäiskesto. Näköneuropatian tapauksissa, jotka etenivät näönmenetykseksi, potilaita hoidettiin pidempiä aikoja yli suositellun enimmäiskeston. Näön hämärtymistä on raportoitu joillakin potilailla, joita on hoidettu ZYVOXilla alle 28 päivää. Lapsilla on myös raportoitu perifeeristä ja optista neuropatiaa.
Jos potilaat kokevat näön heikkenemisen oireita, kuten muutoksia näöntarkkuudessa, muutoksia värinäössä, näön hämärtymistä tai näkökenttävirheitä, suositellaan nopeaa oftalmologista arviointia. Näkötoimintoa tulee seurata kaikilla potilailla, jotka käyttävät ZYVOXia pitkiä aikoja (≥ 3 kuukautta) ja kaikkia uusia näköoireita ilmoittavia potilaita ZYVOX-hoidon pituudesta riippumatta. Jos perifeeristä tai optista neuropatiaa ilmenee, ZYVOX 600 mg:n käytön jatkamista näillä potilailla on punnittava mahdollisia riskejä vastaan.
Serotoniinin oireyhtymä
On raportoitu spontaaneja raportteja serotoniinioireyhtymästä, mukaan lukien kuolemaan johtaneet tapaukset, jotka liittyvät ZYVOXin ja serotonergisten aineiden, mukaan lukien masennuslääkkeiden, kuten selektiivisten serotoniinin takaisinoton estäjien (SSRI) samanaikaiseen käyttöön.
Ellei se ole kliinisesti tarkoituksenmukaista ja potilaita tarkkaillaan huolellisesti serotoniinioireyhtymän tai malignin neuroleptisyndrooman kaltaisten (NMS:n kaltaisten) reaktioiden varalta, linetsolidia ei tule antaa potilaille, joilla on karsinoidioireyhtymä ja/tai potilaille, jotka käyttävät jotakin seuraavista lääkkeistä. : serotoniinin takaisinoton estäjät, trisykliset masennuslääkkeet, bupropioni, buspironi, serotoniinin 5-HT1-reseptorin agonistit (triptaanit) ja opioidit, mukaan lukien meperidiini [ks. HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA ].
Joissakin tapauksissa potilas, joka jo saa serotonergistä masennuslääkettä tai buspironia, saattaa tarvita kiireellistä linetsolidihoitoa. Jos linetsolidin vaihtoehtoja ei ole saatavilla ja linetsolidin mahdolliset hyödyt ovat suuremmat kuin serotoniinioireyhtymän tai NMS-tyyppisten reaktioiden riskit, serotonergisen masennuslääkkeen käyttö on lopetettava välittömästi ja linetsolidia tulee antaa. Potilasta tulee seurata kahden viikon ajan (5 viikkoa, jos fluoksetiinia otettiin) tai 24 tunnin ajan viimeisen linetsolidiannoksen jälkeen sen mukaan, kumpi tulee ensin. Serotoniinioireyhtymän tai NMS:n kaltaisten reaktioiden oireita ovat hypertermia, jäykkyys, myoklonus, autonominen epävakaus ja mielentilan muutokset, joihin kuuluu äärimmäinen kiihtymys, joka etenee deliriumiin ja koomaan. Potilasta tulee myös tarkkailla masennuslääkkeen käytön lopettamiseen liittyvien oireiden varalta (katso määritellyn lääkkeen/aineiden pakkausseloste, jossa on kuvaus niihin liittyvistä lopetusoireista).
Kuolleisuuden epätasapaino tutkimustutkimuksessa potilailla, joilla on katetriin liittyviä verenkiertoinfektioita, mukaan lukien ne, joilla on katetrin aiheuttamia infektioita
Kuolleisuuden epätasapaino havaittiin linetsolidilla hoidetuilla potilailla verrattuna vankomysiiniin/dikloksasilliiniin/oksasilliiniin avoimessa tutkimuksessa vakavasti sairailla potilailla, joilla oli intravaskulaarisiin katetriin liittyviä infektioita [78/363 (21,5 %) vs. 58/363 (16,0 %) ); todennäköisyyssuhde 1,426, 95 % CI 0,970, 2,098]. Vaikka syy-yhteyttä ei ole osoitettu, tämä havaittu epätasapaino esiintyi ensisijaisesti linetsolidilla hoidetuilla potilailla, joilla joko gramnegatiivisia patogeenejä, gramnegatiivisia ja grampositiivisia taudinaiheuttajia ei tunnistettu lähtötilanteessa tai taudinaiheuttajia ei havaittu lähtötilanteessa, mutta sitä ei havaittu potilailla, joilla oli Vain grampositiiviset infektiot.
Linetsolidia ei ole hyväksytty, eikä sitä tule käyttää potilaiden hoitoon, joilla on katetriin liittyviä verenkiertoinfektioita tai katetrin aiheuttamia infektioita.
Linetsolidilla ei ole kliinistä aktiivisuutta gramnegatiivisia patogeenejä vastaan, eikä sitä ole tarkoitettu gramnegatiivisten infektioiden hoitoon. On erittäin tärkeää, että spesifinen gramnegatiivinen hoito aloitetaan välittömästi, jos samanaikainen gramnegatiivinen patogeeni on dokumentoitu tai sitä epäillään [ks. INDIKAATIOT ].
Clostridioides Difficile -bakteeriin liittyvä ripuli
Clostridioides difficile -bakteeriin liittyvää ripulia (CDAD) on raportoitu käytettäessä lähes kaikkia antibakteerisia aineita, mukaan lukien ZYVOX 600 mg, ja sen vaikeusaste voi vaihdella lievästä ripulista kuolemaan johtavaan paksusuolentulehdukseen. Hoito antibakteerisilla aineilla muuttaa paksusuolen normaalia kasvillisuutta, mikä johtaa C. difficilen liikakasvuun.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CDAD:n kehittymistä. Hypertoksiinia tuottavat C. difficilen kannat lisäävät sairastuvuutta ja kuolleisuutta, koska nämä infektiot voivat olla vastustuskykyisiä antimikrobiselle hoidolle ja saattavat vaatia kolektomiaa. CDAD on otettava huomioon kaikilla potilailla, joilla on ripuli antibakteeristen lääkkeiden käytön jälkeen.
Huolellinen sairaushistoria on tarpeen, koska CDAD:n on raportoitu esiintyvän yli kaksi kuukautta antibakteeristen aineiden annon jälkeen.
Jos CDAD:ta epäillään tai varmistetaan, jatkuva antibakteeristen lääkkeiden käyttö, joka ei ole suunnattu C. difficileä vastaan, saattaa olla tarpeen lopettaa. Asianmukainen neste- ja elektrolyyttihallinta, proteiinilisä, C. difficilen antibakteerinen lääkehoito ja kirurginen arviointi tulee aloittaa kliinisen tarpeen mukaan.
Mahdolliset verenpaineen nousua aiheuttavat vuorovaikutukset
Ellei potilaita seurata mahdollisen verenpaineen nousun varalta, linetsolidia ei tule antaa potilaille, joilla on hallitsematon verenpainetauti, feokromosytooma, tyrotoksikoosi ja/tai potilaille, jotka käyttävät jotakin seuraavista lääkkeistä: suoraan tai epäsuorasti vaikuttavat sympatomimeettiset aineet (esim. pseudoefedriini), vasopressiiviset aineet (esim. epinefriini, norepinefriini), dopaminergiset aineet (esim. dopamiini, dobutamiini) [ks. HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA ].
Maitohappoasidoosi
Maitohappoasidoosia on raportoitu ZYVOXin käytön yhteydessä. Raportoiduissa tapauksissa potilaat kokivat toistuvia pahoinvointi- ja oksentelujaksoja. Potilaille, joille ilmaantuu toistuvaa pahoinvointia tai oksentelua, selittämätöntä asidoosia tai alhainen bikarbonaattipitoisuus ZYVOX-hoidon aikana, on suoritettava välitön lääkärintarkastus.
Kouristukset
Kouristuksia on raportoitu linetsolidilla hoidetuilla potilailla. Joissakin näistä tapauksista on raportoitu kouristuskohtauksia tai kohtausten riskitekijöitä.
Hypoglykemia
Markkinoille tulon jälkeen on raportoitu oireenmukaista hypoglykemiaa potilailla, joilla on insuliinia tai oraalisia hypoglykeemisiä aineita, kun niitä on hoidettu linetsolidilla, reversiibelillä, ei-selektiivisellä MAO:n estäjällä. Jotkut MAO-estäjät on liitetty hypoglykeemisiin jaksoihin diabeetikoilla, jotka saavat insuliinia tai hypoglykeemisiä aineita. Vaikka syy-yhteyttä linetsolidin ja hypoglykemian välillä ei ole osoitettu, diabeetikoita tulee varoittaa mahdollisista hypoglykeemisistä reaktioista linetsolidilla hoidettaessa.
Jos hypoglykemiaa ilmaantuu, insuliinin tai suun kautta otettavan hypoglykeemisen aineen annoksen pienentäminen tai suun kautta otettavan hypoglykeemisen aineen, insuliinin tai linetsolidin käyttö saattaa olla tarpeen.
Hyponatremia ja/tai sopimattoman antidiureettisen hormonin erityksen oireyhtymä (SIADH)
Markkinoille tulon jälkeen linetsolidilla hoidetuilla potilailla on havaittu hyponatremiaa ja/tai epäasianmukaisen antidiureettisen hormonin erittymisen oireyhtymää (SIADH). Raportoiduissa tapauksissa merkkejä ja oireita olivat sekavuus, uneliaisuus, yleinen heikkous, ja vaikeissa tapauksissa ne johtivat hengitysvajaukseen ja jopa kuolemaan. Seuraa seerumin natriumpitoisuutta säännöllisesti vanhuksilla, diureetteja käyttävillä potilailla ja muilla potilailla, joilla on hyponatremia- ja/tai SIADH-riski ZYVOXin käytön aikana. Jos hyponatremian ja/tai SIADH:n merkkejä ja oireita ilmaantuu, lopeta ZYVOX 600mg -hoito ja aloita asianmukaiset tukitoimenpiteet.
Riskit potilailla, joilla on fenyyliketonuria
Fenyylialaniini voi olla haitallista potilaille, joilla on fenyyliketonuria (PKU). ZYVOX oraalisuspensiolle sisältää fenyylialaniinia, joka on aspartaamin komponentti. Jokainen 5 ml 100 mg/5 ml oraalisuspensiota sisältää 20 mg fenyylialaniinia. Ennen kuin määräät ZYVOX 600 mg oraalisuspensiota potilaalle, jolla on PKU, harkitse fenyylialaniinin yhdistettyä päivittäistä määrää kaikista lähteistä, mukaan lukien ZYVOX oraalisuspensiosta.
Muut ZYVOX-valmisteet eivät sisällä fenyylialaniinia.
Lääkeresistenttien bakteerien kehittäminen
ZYVOXin määrääminen ilman todistettua tai vahvasti epäiltyä bakteeri-infektiota tai profylaktista indikaatiota ei todennäköisesti hyödytä potilasta ja lisää lääkeresistenttien bakteerien kehittymisen riskiä.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Eläimillä ei ole tehty elinikäisiä tutkimuksia linetsolidin karsinogeenisuuden arvioimiseksi. Mutageenisia tai klastogeenisiä potentiaalia ei havaittu useissa testeissä, mukaan lukien: mutageenisuusmääritykset (Amesin bakteerireversio ja CHO-solumutaatio), in vitro unscheduled DNA synthesis (UDS) -määritys, in vitro kromosomipoikkeavuusmääritys ihmisen lymfosyyteissä ja in vivo hiiren mikrotumamääritys.
Linetsolidi ei vaikuttanut aikuisten naarasrottien hedelmällisyyteen tai lisääntymiskykyyn, kun sitä annettiin suun kautta enintään 100 mg/kg/vrk 14 päivän ajan ennen parittelua tiineyspäivään 7 asti. Se heikensi palautuvasti aikuisten urosrottien hedelmällisyyttä ja lisääntymiskykyä, kun sitä annettiin annokset ≥ 50 mg/kg/vrk, jolloin altistuminen on suunnilleen yhtä suuri tai suurempi kuin odotettu ihmisen altistustaso (altistusvertailut perustuvat AUC-arvoihin). Palautuvat hedelmällisyyteen vaikuttavat vaikutukset välittyivät muuttuneen spermatogeneesin kautta. Vaikuttavat spermatidit sisälsivät epänormaalisti muodostuneita ja suuntautuneita mitokondrioita, eivätkä ne olleet elinkelpoisia. Epiteelisolujen hypertrofiaa ja hyperplasiaa lisäkivesessä havaittiin yhdessä heikentyneen hedelmällisyyden kanssa. Samanlaisia lisäkiveksen muutoksia ei havaittu koirilla.
Sukukypsillä urosrotilla, jotka altistettiin lääkkeelle nuorina, havaittiin lievästi heikentynyt hedelmällisyys linetsolidihoidon jälkeen suurimman osan sukupuolikehitysjaksosta (50 mg/kg/vrk 7.-36. iän välillä ja 100 mg/kg/vrk) päivät 37–55), jolloin altistuminen oli jopa 1,7 kertaa suurempi kuin keskimääräiset AUC-arvot, jotka havaittiin 3 kuukauden - 11 vuoden ikäisillä lapsipotilailla. Hedelmällisyyden heikkenemistä ei havaittu lyhyemmillä hoitojaksoilla, mikä vastaisi altistusta kohdussa varhaisen vastasyntyneen ajan (raskauspäivä 6 - postnataalinen päivä 5), vastasyntyneen altistus (postnataalipäivät 5-21) tai nuorten altistus (postnataalipäivät 22-35) ). Siittiöiden liikkuvuuden palautuvaa vähenemistä ja siittiöiden morfologian muutosta havaittiin rotilla, joita hoidettiin synnytyksen jälkeisenä päivänä 22–35.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Saatavilla olevat tiedot julkaistuista ja markkinoille tulon jälkeisistä tapausraporteista linetsolidin käytöstä raskaana oleville naisille eivät ole osoittaneet lääkkeeseen liittyvää vakavien synnynnäisten epämuodostumien, keskenmenon tai haitallisten äitien tai sikiöiden riskiä. Kun linetsolidi annettiin organogeneesin aikana, se ei aiheuttanut epämuodostumia hiirillä, rotilla tai kaniineilla, kun emon altistustaso oli noin 6,5-kertainen (hiiret) tai 0,06-kertainen (kanit) kliiniseen terapeuttiseen altistukseen verrattuna AUC-arvojen perusteella. Alkion ja sikiön kuolleisuutta havaittiin kuitenkin hiirillä 6,5 kertaa ihmisen arvioituun altistukseen verrattuna. Kun naarasrotille annettiin annosta organogeneesin aikana imetyksen aikana, pentujen syntymän jälkeinen eloonjäänti väheni annoksilla, jotka vastaavat suunnilleen ihmisen arvioitua altistusta AUC-arvojen perusteella (ks. Data ).
Vakavien synnynnäisten epämuodostumien ja keskenmenon taustariskiä mainituilla väestöryhmillä ei tunneta. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Data
Eläinten tiedot
Hiirillä alkio-sikiötoksisuutta havaittiin vain annoksilla, jotka aiheuttivat toksisuutta emolle (kliiniset oireet ja vähentynyt painonnousu). Oraalinen annos 450 mg/kg/vrk, joka annettiin raskauspäivästä (GD) 6-16 (6,5 kertaa arvioitu ihmisen altistus AUC-arvojen perusteella) korreloi lisääntyneen postimplantaation jälkeisen alkiokuoleman kanssa, mukaan lukien koko poikuemenetys, vähentynyt sikiön paino ja lisääntynyt kylkiruston fuusion ilmaantuvuus. Ei havaittu emolle eikä alkio-sikiölle toksisuutta annoksilla 150 mg/kg/vrk. Sikiön epämuodostumia ei havaittu.
Rotilla havaittiin sikiötoksisuutta 15 ja 50 mg/kg/vrk, kun niitä annettiin suun kautta GD 6-17:stä (altistuminen 0,22-kertaisesti ja suunnilleen vastaavasti ihmisen arvioitua altistusta AUC-arvojen perusteella). Vaikutukset koostuivat alentuneesta sikiön painosta ja vähentyneestä rintakehän luutumisesta, mikä on usein havaittu yhdistettynä sikiön painon laskuun. Sikiön epämuodostumia ei havaittu. Emotoksisuutta, joka ilmeni vähentyneen painonnousun muodossa, havaittiin annoksella 50 mg/kg/vrk.
Kaneilla sikiön painon laskua esiintyi vain emolle toksisuuden (kliiniset oireet, vähentynyt painonnousu ja ruuankulutus) esiintyessä, kun niitä annettiin suun kautta annoksella 15 mg/kg/vrk GD 6-20 (0,06-kertainen arvioitu ihmisen altistuminen AUC-arvojen perusteella). Sikiön epämuodostumia ei havaittu.
Kun naarasrottia hoidettiin linetsolidin annoksella 50 mg/kg/vrk (suunnilleen ihmisen arvioitua altistusta AUC-arvojen perusteella) tiineyden ja laktaation aikana (GD 6 - imetyspäivä 20), pentujen eloonjäämisaika väheni syntymän jälkeisinä päivinä 1–4. Uros- ja naaraspennut, joiden annettiin kypsyä lisääntymisikään, osoittivat pariutettuna lisääntynyttä preimplantaatiota.
Imetys
Riskien yhteenveto
Linetsolidi erittyy äidinmaitoon. Saatavilla olevien julkaistujen tapausraporttien tietojen perusteella linetsolidin päivittäinen annos, jonka vauva saisi äidinmaidosta, olisi noin 6–9 % suositellusta terapeuttisesta annoksesta vauvalle (10 mg/kg 8 tunnin välein). Ei ole tietoa linetsolidin vaikutuksista imetettävään lapseen. ripuli ja oksentelu olivat kuitenkin yleisimmät haittavaikutukset, joita raportoitiin kliinisissä tutkimuksissa pikkulapsilla, jotka saivat linetsolidia terapeuttisesti [ks. HAITTAVAIKUTUKSET ja (katso Kliiniset huomiot). Linetsolidin vaikutuksista maidontuotantoon ei ole tietoa. Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon sekä äidin kliininen linetsolidin tarve ja mahdolliset linetsolidin tai äidin taustalla olevan sairauden aiheuttamat haitalliset vaikutukset imetettävään lapseen.
Kliiniset näkökohdat
Neuvo imettäviä naisia tarkkailemaan rintaruokittua vauvaa ripulin ja oksentamisen varalta.
Naaraat ja urokset, joilla on lisääntymispotentiaali
Hedelmättömyys
Miehet
Rotilla tehtyjen tutkimusten tulosten perusteella ZYVOX voi heikentää palautuvasti urospotilaiden hedelmällisyyttä [ks. Ei-kliininen toksikologia )].
Käyttö lapsille
ZYVOX 600 mg:n turvallisuutta ja tehokkuutta lapsipotilaiden hoidossa, joilla on seuraavat infektiot, tukevat todisteet riittävistä ja hyvin kontrolloiduista aikuisilla tehdyistä tutkimuksista, farmakokineettiset tiedot lapsipotilaista ja lisätiedot vertailuvalmisteella kontrolloidusta grampositiivisten infektioiden tutkimuksesta. infektiot lapsipotilailla, joiden ikä vaihtelee syntymästä 11 vuoteen [katso INDIKAATIOT , KLIININEN FARMAKOLOGIA ja Kliiniset tutkimukset ]:
- sairaalakeuhkokuume
- monimutkaiset iho- ja ihorakenteen infektiot
- yhteisössä hankittu keuhkokuume (myös todisteet kontrolloimattomasta tutkimuksesta potilailla, joiden ikä vaihtelee 8 kuukauden ja 12 vuoden välillä)
- vankomysiiniresistentit Enterococcus faecium -infektiot
ZYVOX 600 mg:n turvallisuus ja tehokkuus hoidettaessa lapsipotilaita, joilla on seuraava infektio, on osoitettu vertailuvalmisteella kontrolloidussa tutkimuksessa 5–17-vuotiailla lapsipotilailla [ks. Kliiniset tutkimukset ]:
- komplisoitumattomat iho- ja ihorakenteen infektiot, jotka ovat aiheuttaneet Staphylococcus aureus (vain metisilliinille herkät kannat) tai Streptococcus pyogenes
Farmakokineettiset tiedot, jotka on saatu lapsipotilaista, joilla oli ventriculoperitoneaalisia shuntteja, osoittivat vaihtelevia aivo-selkäydinnesteen (CSF) linetsolidipitoisuuksia linetsolidin kerta- ja toistuvan annostelun jälkeen; terapeuttisia pitoisuuksia ei saavutettu johdonmukaisesti tai säilytetty CSF:ssä. Sen vuoksi linetsolidin käyttöä keskushermoston infektioita sairastavien lapsipotilaiden empiiriseen hoitoon ei suositella.
Linetsolidin farmakokinetiikkaa on arvioitu lapsipotilailla syntymästä 17 vuoden ikään. Yleensä linetsolidin painoon perustuva puhdistuma pienenee asteittain lapsipotilaiden iän myötä. Ennenaikaisilla (raskausikä ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
Rajallisen kliinisen kokemuksen mukaan 5/6 (83 %) lapsipotilaasta, joilla oli grampositiivisten patogeenien aiheuttamia infektioita ja joiden vähimmäisinhiboiva pitoisuus (MIC) oli 4 mikrog/ml ja joita hoidettiin ZYVOX 600 mg:lla, parani kliinisesti. Lapsipotilaiden linetsolidin puhdistuma ja systeeminen altistus (AUC) vaihtelevat kuitenkin enemmän kuin aikuisilla. Lapsipotilailla, joiden kliininen vaste ei ole optimaalinen, erityisesti niillä, joilla on patogeenejä, joiden MIC on 4 mcg/ml, pienempi systeeminen altistus, infektion paikka ja vaikeusaste sekä taustalla oleva lääketieteellinen tila on otettava huomioon kliinistä vastetta arvioitaessa [ks. KLIININEN FARMAKOLOGIA ja ANNOSTELU JA HALLINNOINTI ].
Geriatrinen käyttö
Niistä 2 046 potilaasta, joita hoidettiin ZYVOX 600 mg:lla faasin 3 vertailukontrolloiduissa kliinisissä tutkimuksissa, 589 (29 %) oli 65-vuotiaita tai vanhempia ja 253 (12 %) 75-vuotiaita tai vanhempia. Näiden potilaiden ja nuorempien potilaiden välillä ei havaittu yleisiä eroja turvallisuudessa tai tehokkuudessa, ja muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin iäkkäiden potilaiden suurempaa herkkyyttä ei voida sulkea pois.
YLIANNOSTUS
Yliannostustapauksissa suositellaan tukihoitoa ja glomerulussuodatuksen ylläpitämistä. Hemodialyysi saattaa helpottaa linetsolidin nopeampaa eliminaatiota. Vaiheen 1 kliinisessä tutkimuksessa noin 30 % linetsolidin annoksesta poistui 3 tunnin hemodialyysijakson aikana, joka alkoi 3 tuntia linetsolidiannoksen annon jälkeen. Tietoja linetsolidin poistamisesta peritoneaalidialyysillä tai hemoperfuusiolla ei ole saatavilla. Akuutin toksisuuden kliiniset merkit eläimillä olivat vähentynyt aktiivisuus ja ataksia rotilla sekä oksentelu ja vapina koirilla, joita hoidettiin annoksella 3 000 mg/kg/vrk ja 2 000 mg/kg/vrk.
VASTA-AIHEET
Yliherkkyys
ZYVOX-valmisteet ovat vasta-aiheisia potilaille, joiden tiedetään olevan yliherkkiä linetsolidille tai jollekin muulle tuotteen aineosalle.
Monoamiinioksidaasin estäjät
Linetsolidia ei saa käyttää potilailla, jotka käyttävät lääkevalmisteita, jotka estävät monoamiinioksidaaseja A tai B (esim. feneltsiini, isokarboksatsidi) tai kahden viikon sisällä minkään sellaisen lääkkeen ottamisesta.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
ZYVOX on antibakteerinen lääke [katso Mikrobiologia ].
Farmakodynamiikka
Satunnaistetussa, positiivisesti ja lumelääkekontrolloidussa risteävässä perusteellisessa QT-tutkimuksessa 40 terveelle henkilölle annettiin yksi ZYVOX 600 mg -annos 1 tunnin laskimonsisäisenä infuusiona, yksi ZYVOX 1 200 mg -annos 1 tunnin IV-infuusiona, lumelääkettä ja yksi oraalinen annos positiivista kontrollia. Sekä 600 mg:n että 1 200 mg:n ZYVOX 600 mg:n annoksilla ei havaittu merkittävää vaikutusta QTc-väliin plasman huippupitoisuuksilla tai muina aikoina.
Farmakokinetiikka
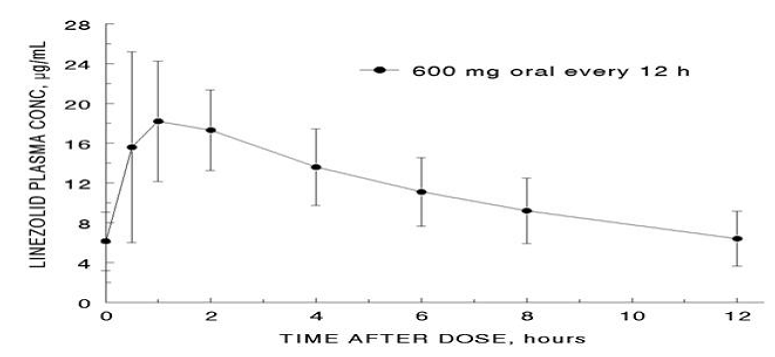
Linetsolidin keskimääräiset farmakokineettiset parametrit aikuisilla kerta-annosten ja toistuvien oraalisten ja suonensisäisten annosten jälkeen on esitetty taulukossa 8. Linetsolidin plasmapitoisuudet vakaassa tilassa 600 mg:n suun kautta 12 tunnin välein annettujen annosten jälkeen on esitetty kuvassa 1.
Kuva 1. Plasman linetsolidin pitoisuudet aikuisilla vakaassa tilassa oraalisen annostelun jälkeen 12 tunnin välein (keskiarvo ± keskihajonta, n=16)
Imeytyminen
Linetsolidi imeytyy laajasti suun kautta otetun annoksen jälkeen. Plasman huippupitoisuudet saavutetaan noin 1-2 tunnin kuluttua annostelusta, ja absoluuttinen hyötyosuus on noin 100 %. Siksi linetsolidia voidaan antaa suun kautta tai suonensisäisesti ilman annosta muuttamalla.
Linetsolidia voidaan antaa ruokailuajasta riippumatta. Aika huippupitoisuuden saavuttamiseen viivästyy 1,5 tunnista 2,2 tuntiin ja Cmax pienenee noin 17 %, kun linetsolidin kanssa annetaan runsaasti rasvaa ruokaa. Kokonaisaltistus mitattuna AUC0-∞ on kuitenkin samanlainen molemmissa olosuhteissa.
Jakelu
Eläimillä ja ihmisillä tehdyt farmakokineettiset tutkimukset ovat osoittaneet, että linetsolidi jakautuu helposti hyvin perfusoituihin kudoksiin. Linetsolidin sitoutuminen plasman proteiineihin on noin 31 % ja on pitoisuudesta riippumaton. Linetsolidin jakautumistilavuus vakaassa tilassa oli keskimäärin 40-50 litraa terveillä aikuisilla vapaaehtoisilla.
Linetsolidipitoisuudet on määritetty useista eri nesteistä rajoitetuilta potilailta vaiheen 1 vapaaehtoistutkimuksissa linetsolidin toistuvan annostelun jälkeen. Syljessä olevan linetsolidin suhde plasmaan oli 1,2:1 ja hien linetsolidin suhde plasmaan oli 0,55:1.
Aineenvaihdunta
Linetsolidi metaboloituu ensisijaisesti morfoliinirenkaan hapettumisen kautta, mikä johtaa kahteen inaktiiviseen renkaaseen avautuneeseen karboksyylihappometaboliittiin: aminoetoksietikkahappometaboliitiksi (A) ja hydroksietyyliglysiinimetaboliitiksi (B). Metaboliitin A muodostumisen oletetaan muodostuvan entsymaattista reittiä pitkin, kun taas metaboliitti B välittyy ei-entsymaattisen kemiallisen hapetusmekanismin kautta in vitro. In vitro -tutkimukset ovat osoittaneet, että linetsolidi metaboloituu minimaalisesti ja että sitä saattaa välittää ihmisen sytokromi P450. Linetsolidin metaboliaa ei kuitenkaan täysin ymmärretä.
Erittyminen
Ei-renaalinen puhdistuma muodostaa noin 65 % linetsolidin kokonaispuhdistumasta. Vakaan tilan olosuhteissa noin 30 % annoksesta erittyy virtsaan linetsolidina, 40 % metaboliittina B ja 10 % metaboliittina A. Linetsolidin keskimääräinen munuaispuhdistuma on 40 ml/min, mikä viittaa nettotubulusreabsorptioon. Käytännössä linetsolidia ei esiinny ulosteessa, kun taas noin 6 % annoksesta näkyy ulosteessa metaboliittina B ja 3 % metaboliittina A.
Pieni epälineaarisuus puhdistumassa havaittiin linetsolidin annoksia kasvatettaessa, mikä näyttää johtuvan linetsolidin pienemmistä munuaispuhdistumasta korkeammilla pitoisuuksilla. Ero puhdistumassa oli kuitenkin pieni, eikä se näkynyt näennäisessä eliminaation puoliintumisajassa.
Tietyt populaatiot
Geriatriset potilaat
Linetsolidin farmakokinetiikka ei muutu merkittävästi iäkkäillä potilailla (65-vuotiaat tai sitä vanhemmat). Sen vuoksi annosta ei tarvitse muuttaa iäkkäille potilaille.
Pediatriset potilaat
Linetsolidin farmakokinetiikkaa suonensisäisen kerta-annoksen jälkeen tutkittiin lapsipotilailla syntymästä 17 vuoteen (mukaan lukien keskoset ja täysiaikaiset vastasyntyneet), terveillä nuorilla 12-17-vuotiailla ja lapsipotilailla iässä 1 viikosta 12 vuoteen. Linetsolidin farmakokineettiset parametrit on koottu taulukkoon 9 tutkituille lapsipopulaatioille ja terveille aikuisille kerta-annosten laskimonsisäisen annon jälkeen.
Linetsolidin Cmax ja jakautumistilavuus (Vss) ovat samanlaiset iästä riippumatta lapsipotilailla. Linetsolidin plasmapuhdistuma vaihtelee kuitenkin iän mukaan. Lukuun ottamatta alle viikon ikäisiä ennenaikaisia vastasyntyneitä, painoon perustuva puhdistuma on nopein nuorimmissa ikäryhmissä, jotka vaihtelevat alle 1 viikon ikäisistä 11-vuotiaisiin, mikä johtaa pienempään kerta-annoksen systeemiseen altistukseen (AUC) ja lyhyempi puoliintumisaika aikuisiin verrattuna. Lapsipotilaiden iän kasvaessa linetsolidin painoon perustuva puhdistuma pienenee vähitellen, ja nuorten iässä keskimääräiset puhdistuma-arvot lähestyvät aikuisväestöllä havaittuja. Linetsolidin puhdistuman ja systeemisen lääkealtistuksen (AUC) välinen vaihtelu on lisääntynyt kaikissa lasten ikäryhmissä aikuisiin verrattuna.
Samanlaisia keskimääräisiä päivittäisiä AUC-arvoja havaittiin lapsipotilailla syntymästä 11-vuotiaaksi 8 tunnin välein verrattuna nuoriin tai aikuisiin, jotka saivat annoksen 12 tunnin välein. Siksi annoksen alle 11-vuotiaille lapsipotilaille tulee olla 10 mg/kg 8 tunnin välein. 12-vuotiaiden ja sitä vanhempien lapsipotilaiden tulee saada 600 mg 12 tunnin välein [katso ANNOSTELU JA HALLINNOINTI ].
Sukupuoli
Naisilla linetsolidin jakautumistilavuus on hieman pienempi kuin miehillä. Plasman pitoisuudet ovat naisilla korkeammat kuin miehillä, mikä johtuu osittain ruumiinpainoeroista. 600 mg:n annoksen jälkeen keskimääräinen oraalinen puhdistuma on naisilla noin 38 % pienempi kuin miehillä. Kuitenkaan ei ole merkittäviä sukupuolten välisiä eroja näennäisen eliminaationopeuden vakiovakiossa tai puoliintumisajassa. Siten naisten lääkealtistuksen ei odoteta lisääntyvän merkittävästi yli tasojen, joiden tiedetään olevan hyvin siedettyjä. Siksi annoksen muuttaminen sukupuolen mukaan ei näytä olevan tarpeen.
Munuaisten vajaatoiminta
Alkuperäisen lääkkeen, linetsolidin, farmakokinetiikka ei muutu potilailla, joilla on minkäänasteinen munuaisten vajaatoiminta; linetsolidin kaksi ensisijaista metaboliittia kuitenkin kerääntyvät munuaisten vajaatoimintaa sairastaville potilaille, ja kumuloitumisen määrä lisääntyy munuaisten vajaatoiminnan vaikeusasteella (ks. taulukko 10). Linetsolidin ja sen kahden metaboliitin farmakokinetiikkaa on myös tutkittu hemodialyysihoitoa saavilla potilailla, joilla on loppuvaiheen munuaissairaus (ESRD). ESRD-tutkimuksessa 14 potilaalle annettiin linetsolidia 600 mg 12 tunnin välein 14,5 päivän ajan (katso taulukko 11). Koska plasmassa saavutetaan samanlaiset linetsolidin pitoisuudet munuaisten toiminnasta riippumatta, annoksen muuttamista ei suositella potilaille, joilla on munuaisten vajaatoiminta. Koska primaaristen metaboliittien kertymisen kliinisestä merkityksestä ei kuitenkaan ole tietoa, linetsolidin käyttöä munuaisten vajaatoimintaa sairastavilla potilailla tulee punnita näiden metaboliittien kertymisen mahdollisiin riskeihin nähden. Sekä linetsolidi että kaksi metaboliittia eliminoituvat hemodialyysillä. Peritoneaalidialyysin vaikutuksesta linetsolidin farmakokinetiikkaan ei ole tietoa. Noin 30 % annoksesta eliminoitui 3 tunnin hemodialyysijaksossa, joka alkoi 3 tuntia linetsolidiannoksen antamisen jälkeen; siksi linetsolidia tulee antaa hemodialyysin jälkeen.
Maksan vajaatoiminta
Linetsolidin farmakokinetiikka ei muutu potilailla (n=7), joilla on lievä tai keskivaikea maksan vajaatoiminta (Child-Pugh-luokka A tai B). Saatavilla olevien tietojen perusteella annoksen muuttamista ei suositella potilaille, joilla on lievä tai keskivaikea maksan vajaatoiminta. Linetsolidin farmakokinetiikkaa potilailla, joilla on vaikea maksan vajaatoiminta, ei ole arvioitu.
Huumeiden vuorovaikutukset
Sytokromi P450:n metaboloimat lääkkeet
Linetsolidi ei indusoi sytokromi P450:tä (CYP450) rotilla. Lisäksi linetsolidi ei estä kliinisesti merkittävien ihmisen CYP-isoformien (esim. 1A2, 2C9, 2C19, 2D6, 2E1, 3A4) aktiivisuutta. Siksi linetsolidin ei odoteta vaikuttavan muiden näiden tärkeimpien entsyymien kautta metaboloituvien lääkkeiden farmakokinetiikkaan. Linetsolidin samanaikainen anto ei muuta olennaisesti CYP2C9:n kautta laajalti metaboloituvan (S)-varfariinin farmakokineettisiä ominaisuuksia. Lääkkeitä, kuten varfariinia ja fenytoiinia, jotka ovat CYP2C9-substraatteja, voidaan antaa linetsolidin kanssa muuttamatta annostusohjelmaa.
Antibakteeriset lääkkeet
Atstreonaami: Linetsolidin tai atstreonaamin farmakokinetiikka ei muutu, kun niitä annetaan yhdessä.
Gentamysiini: Linetsolidin tai gentamysiinin farmakokinetiikka ei muutu, kun niitä annetaan yhdessä.
Antioksidantit
Mahdollisia lääkeaineiden yhteisvaikutuksia linetsolidin ja antioksidanttien C- ja E-vitamiinin kanssa tutkittiin terveillä vapaaehtoisilla. Koehenkilöille annettiin 600 mg:n annos linetsolidia suun kautta päivänä 1 ja toinen 600 mg:n annos linetsolidia päivänä 8. Päivinä 2-9 koehenkilöille annettiin joko C-vitamiinia (1000 mg/vrk) tai E-vitamiinia (800 IU/vrk) päivä). Linetsolidin AUC0-∞ nousi 2,3 %, kun sitä annettiin samanaikaisesti C-vitamiinin kanssa ja 10,9 %, kun sitä annettiin samanaikaisesti E-vitamiinin kanssa. Linetsolidin annoksen muuttamista ei suositella, kun sitä annettiin samanaikaisesti C- tai E-vitamiinin kanssa.
Vahvat CYP3A4-induktorit
Rifampiini
Rifampiinin vaikutusta linetsolidin farmakokinetiikkaan arvioitiin 16 terveen aikuisen miehen tutkimuksessa. Vapaaehtoisille annettiin suun kautta linetsolidia 600 mg kahdesti vuorokaudessa 5 annosta rifampiinin kanssa ja ilman rifampiinia 600 mg kerran päivässä 8 päivän ajan. Rifampiinin ja linetsolidin samanaikainen käyttö pienensi linetsolidin Cmax-arvoa 21 % [90 % CI, 15 % - 27 %] ja 32 % linetsolidin AUC0-12:ta [90 % CI, 27 % - 37 %]. Tämän yhteisvaikutuksen kliinistä merkitystä ei tunneta. Tämän yhteisvaikutuksen mekanismia ei täysin ymmärretä, ja se voi liittyä maksaentsyymien induktioon. Muut voimakkaat maksaentsyymien indusoijat (esim. karbamatsepiini, fenytoiini, fenobarbitaali) voivat vähentää linetsolidialtistusta vastaavasti tai vähemmän.
Monoamiinioksidaasin esto
Linetsolidi on reversiibeli, ei-selektiivinen monoamiinioksidaasin estäjä. Siksi linetsolidilla on mahdollisuus yhteisvaikutukseen adrenergisten ja serotonergisten aineiden kanssa.
Adrenergiset aineet
Joillakin ZYVOX 600 mg:aa saavilla henkilöillä saattaa ilmetä palautuva paineenvaste voimistua epäsuorasti vaikuttaville sympatomimeettisille aineille, vasopressoreille tai dopaminergisille aineille. Yleisesti käytettyjä lääkkeitä, kuten fenyylipropanoliamiinia ja pseudoefedriiniä, on tutkittu erityisesti. Adrenergisten aineiden, kuten dopamiinin tai epinefriinin, alkuannoksia tulee pienentää ja titrata halutun vasteen saavuttamiseksi.
Tyramiini
Merkittävä painevaste on havaittu normaaleilla aikuisilla henkilöillä, jotka ovat saaneet linetsolidia ja tyramiinia yli 100 mg:n annoksilla. Siksi linetsolidia saavien potilaiden on vältettävä nauttimasta suuria määriä elintarvikkeita tai juomia, joissa on korkea tyramiinipitoisuus [ks. POTILASTIEDOT ].
Pseudoefedriini HCl tai fenyylipropanoliamiini HCl
Pseudoefedriini HCl:n (PSE) tai fenyylipropanoliamiiniHCl:n (PPA) painevasteen palautuva paraneminen havaitaan, kun linetsolidia annetaan terveille normaalipaineisille henkilöille [ks. VAROITUKSET JA VAROTOIMET ja HUUMEIDEN VUOROVAIKUTUKSET ]. Vastaavaa tutkimusta ei ole tehty hypertensiivisillä potilailla. Normotensiivisillä koehenkilöillä tehdyissä yhteisvaikutustutkimuksissa arvioitiin lumelääkkeen, pelkän PPA:n tai PSE:n, pelkän linetsolidin sekä vakaan tilan linetsolidin (600 mg 12 tunnin välein 3 päivän ajan) ja kahden PPA-annoksen yhdistelmän verenpaine- ja sykevaikutuksia. 25 mg) tai PSE (60 mg) annettuna 4 tunnin välein. Mikään hoito ei vaikuttanut sykkeeseen. Verenpaine nousi molemmilla yhdistelmähoidoilla. Verenpaineen maksimitasot havaittiin 2–3 tuntia toisen PPA- tai PSE-annoksen jälkeen, ja ne palautuivat lähtötasolle 2–3 tunnin kuluttua huipusta. Seuraavat PPA-tutkimuksen tulokset osoittavat keskimääräisen (ja vaihteluvälin) maksimaalisen systolisen verenpaineen mm Hg:nä: lumelääke = 121 (103 - 158); linetsolidi yksin = 120 (107 - 135); PPA yksin = 125 (106 - 139); PPA linetsolidin kanssa = 147 (129 - 176). PSE-tutkimuksen tulokset olivat samanlaisia kuin PPA-tutkimuksessa. Systolisen verenpaineen keskimääräinen enimmäisnousu lähtötasoon verrattuna oli 32 mm Hg (vaihteluväli: 20-52 mm Hg) ja 38 mm Hg (vaihteluväli: 18-79 mm Hg), kun linetsolidia annettiin yhdessä pseudoefedriinin tai fenyylipropanoliamiinin kanssa.
Serotonergiset aineet
Dekstrometorfaani
Mahdollisia lääkeaineiden yhteisvaikutuksia dekstrometorfaanin kanssa tutkittiin terveillä vapaaehtoisilla. Koehenkilöille annettiin dekstrometorfaania (kaksi 20 mg:n annosta 4 tunnin välein) linetsolidin kanssa tai ilman sitä. Serotoniinioireyhtymävaikutuksia (sekaisuus, delirium, levottomuus, vapina, punastuminen, hikoilu, hyperpyreksia) ei ole havaittu normaaleilla koehenkilöillä, jotka saavat linetsolidia ja dekstrometorfaania.
Mikrobiologia
Toimintamekanismi
Linetsolidi on oksatsolidinoniluokkaan kuuluva synteettinen antibakteerinen aine, jolla on kliinistä käyttöä aerobisten grampositiivisten bakteerien aiheuttamien infektioiden hoidossa. Linetsolidin in vitro -aktiivisuusspektri sisältää myös tietyt gramnegatiiviset bakteerit ja anaerobiset bakteerit. Linetsolidi sitoutuu bakteerien 50S-alayksikön ribosomaalisen RNA:n 23S-kohtaan ja estää toiminnallisen 70S-aloituskompleksin muodostumisen, mikä on välttämätöntä bakteerien lisääntymiselle. Aikatappamistutkimusten tulokset ovat osoittaneet, että linetsolidi on bakteriostaattinen enterokokkeja ja stafylokokkeja vastaan. Streptokokkien osalta linetsolidin havaittiin olevan bakteereja tappava useimmille isolaateille.
Resistanssi
In vitro -tutkimukset ovat osoittaneet, että pistemutaatiot 23S-rRNA:ssa liittyvät linetsolidiresistenssiin. On julkaistu raportteja vankomysiiniresistenttien Enterococcus faeciumin muuttumisesta resistentiksi linetsolidille kliinisen käytön aikana. On raportoitu Staphylococcus aureuksen (metisilliiniresistentti) kehittymisestä linetsolidille kliinisen käytön aikana. Näiden organismien linetsolidiresistenssi liittyy organismin 23S-rRNA:n pistemutaatioon (guaniinin korvaaminen tymiinillä asemassa 2576). Organismit, jotka ovat resistenttejä oksatsolidinoneille 23S-rRNA:ta tai ribosomaalisia proteiineja (L3 ja L4) koodaavien kromosomigeenien mutaatioiden kautta, ovat yleensä ristiresistenttejä linetsolidille. Myös metyylitransferaasientsyymin välittämää linetsolidiresistenssiä on raportoitu stafylokokeissa. Tätä vastustuskykyä välittää cfr (kloramfenikoli-florfenikoli) -geeni, joka sijaitsee plasmidissa, joka on siirrettävissä stafylokokkien välillä.
Vuorovaikutus muiden mikrobilääkkeiden kanssa
In vitro -tutkimukset ovat osoittaneet linetsolidin ja vankomysiinin, gentamysiinin, rifampiinin, imipeneemi-silastatiinin, atstreonaamin, ampisilliinin tai streptomysiinin välistä additiivisuutta tai välinpitämättömyyttä.
Linetsolidin on osoitettu olevan aktiivinen useimpia seuraavien mikro-organismien isolaatteja vastaan sekä in vitro että kliinisissä infektioissa [ks. INDIKAATIOT ].
Gram-positiiviset bakteerit
Enterococcus faecium (vain vankomysiiniresistentit isolaatit) Staphylococcus aureus (mukaan lukien metisilliiniresistentit isolaatit) Streptococcus agalactiae Streptococcus pneumoniae Streptococcus pyogenes
Seuraavat in vitro -tiedot ovat saatavilla, mutta niiden kliinistä merkitystä ei tunneta. Yli 90 %:lla seuraavista bakteereista on in vitro MIC, joka on pienempi tai yhtä suuri kuin linetsolidille herkkä raja-arvo samanlaisille organismeille. Linetsolidin turvallisuutta ja tehokkuutta näiden bakteerien aiheuttamien kliinisten infektioiden hoidossa ei ole osoitettu riittävissä ja hyvin kontrolloiduissa kliinisissä tutkimuksissa.
Gram-positiiviset bakteerit
Enterococcus faecalis (mukaan lukien vankomysiiniresistentit isolaatit) Enterococcus faecium (vankomysiinille herkät isolaatit) Staphylococcus epidermidis (mukaan lukien metisilliiniresistentit isolaatit) Staphylococcus haemolyticus Viridans ryhmän streptokokit
Gram-negatiiviset bakteerit
Pasteurella multocida
Herkkyystestaus
Tarkempia tietoja herkkyystestin tulkintakriteereistä ja niihin liittyvistä testimenetelmistä ja laadunvalvontastandardeista, jotka FDA on tunnustanut tälle lääkkeelle, on osoitteessa https://www.fda.gov/STIC.
Eläinten toksikologia ja/tai farmakologia
Linetsolidin toksisuuden kohde-elimet olivat samanlaisia nuorilla ja aikuisilla rotilla ja koirilla. Eläintutkimuksissa on havaittu annoksesta ja ajasta riippuvaa myelosuppressiota, josta on osoituksena luuytimen hyposellulaarisuus/hematopoieesin heikentyminen, vähentynyt ekstramedullaarinen hematopoieesi pernassa ja maksassa sekä verenkierrossa olevien punasolujen, leukosyyttien ja verihiutaleiden pitoisuudet. Lymfaattinen ehtyminen tapahtui kateenkorvassa, imusolmukkeissa ja pernassa. Yleensä lymfoidilöydökset liittyivät anoreksiaan, painon laskuun ja painonnousun tukahdutukseen, mikä saattoi vaikuttaa havaittuihin vaikutuksiin.
Rotilla, joille annettiin linetsolidia suun kautta 6 kuukauden ajan, havaittiin iskiashermojen ei-reversiibeli, minimaalisesta lievään aksonaalista rappeutumista annoksella 80 mg/kg/vrk. iskiashermon minimaalinen rappeutuminen havaittiin myös yhdellä miehellä tällä annostasolla 3 kuukauden väliaikaisessa ruumiinavauksessa. Perfuusiokiinnittyneiden kudosten herkkä morfologinen arviointi suoritettiin todisteiden tutkimiseksi näköhermon rappeutumisesta. Minimaalinen tai kohtalainen näköhermon rappeutuminen oli ilmeistä kahdella urosrotalla 6 kuukauden annostelun jälkeen, mutta suora yhteys lääkkeeseen oli epäselvä johtuen löydön akuutista luonteesta ja sen epäsymmetrisestä jakautumisesta. Havaittu hermon rappeuma oli mikroskooppisesti verrattavissa spontaaniin yksipuoliseen näköhermon rappeutumiseen, joka on raportoitu ikääntyneillä rotilla, ja se voi olla yleisen taustamuutoksen pahenemista.
Näitä vaikutuksia havaittiin altistustasoilla, jotka ovat verrattavissa joillakin ihmisillä havaittuihin altistustasoihin. Hematopoieettiset ja lymfaattiset vaikutukset olivat palautuvia, vaikka joissakin tutkimuksissa palautuminen oli epätäydellistä toipumisjakson aikana.
Kliiniset tutkimukset
Aikuiset
Nosokomiaalinen keuhkokuume
Aikuiset potilaat, joilla oli kliinisesti ja radiologisesti dokumentoitu nosokomiaalinen keuhkokuume, otettiin mukaan satunnaistettuun, monikeskustutkimukseen, kaksoissokkotutkimukseen. Potilaita hoidettiin 7-21 päivää. Yksi ryhmä sai ZYVOX IV -injektiota 600 mg 12 tunnin välein ja toinen ryhmä sai vankomysiiniä 1 g 12 tunnin välein suonensisäisesti. Molemmat ryhmät saivat samanaikaisesti atstreonaamia (1–2 g 8 tunnin välein suonensisäisesti), jota voitiin jatkaa, jos kliinisesti aihetta. Tutkimukseen osallistui 203 linetsolidilla hoidettua ja 193 vankomysiinihoitoa saanutta potilasta. Kliinisesti arvioitavissa oli 122 (60 %) linetsolidilla hoidettua potilasta ja 103 (53 %) vankomysiinihoitoa. Kliinisesti arvioitavissa olevien potilaiden paranemisaste oli 57 % linetsolidilla hoidetuista potilaista ja 60 % vankomysiinihoitoa saaneista potilaista. Kliinisesti arvioitavissa olevilla potilailla, joilla oli ventilaattoriin liittyvä keuhkokuume, paranemisaste oli 47 % linetsolidilla hoidetuista potilaista ja 40 % vankomysiinihoitoa saaneista potilaista. 94 linetsolidilla hoidetun potilaan ja 83 vankomysiinihoitoa saaneen potilaan modifioituun intent-to-treat (MITT) -analyysiin sisältyi koehenkilöitä, joilla oli taudinaiheuttaja eristetty ennen hoitoa. MITT-analyysissä paranemisaste oli 57 % linetsolidilla hoidetuista potilaista ja 46 % vankomysiinihoitoa saaneista potilaista. Taulukossa 12 on esitetty mikrobiologisesti arvioitavien potilaiden paranemisasteet taudinaiheuttajittain.
Monimutkaiset iho- ja ihorakenteen infektiot
Aikuiset potilaat, joilla oli kliinisesti dokumentoituja monimutkaisia iho- ja ihorakenteen infektioita, otettiin mukaan satunnaistettuun monikeskustutkimukseen, kaksoissokkoutettuun kaksoisnukketutkimukseen, jossa verrattiin suonensisäisesti annettuja tutkimuslääkkeitä ja sen jälkeen suun kautta annettuja lääkkeitä yhteensä 10–21 hoitopäivän ajan. Yksi potilasryhmä sai ZYVOX IV -injektion 600 mg 12 tunnin välein ja sen jälkeen ZYVOX 600 mg tabletteja 600 mg 12 tunnin välein; toinen ryhmä sai oksasilliinia 2 g joka 6. tunti suonensisäisesti ja sen jälkeen dikloksasilliinia 500 mg joka 6. tunti suun kautta. Potilaat voivat saada samanaikaisesti atstreonaamia, jos se on kliinisesti aiheellista. Tutkimukseen osallistui 400 linetsolidilla ja 419 oksasilliinilla hoidettua potilasta. Kliinisesti arvioitavissa oli 245 (61 %) linetsolidilla hoidettua potilasta ja 242 (58 %) oksasilliinilla hoidettua potilasta. Kliinisesti arvioitavissa olevien potilaiden paranemisaste oli 90 % linetsolidilla hoidetuilla potilailla ja 85 % oksasilliinilla hoidetuilla potilailla. Modifioitu intent-to-treat (MITT) -analyysi 316 linetsolidilla hoidetusta potilaasta ja 313 oksasilliinilla hoidetusta potilaasta sisälsi koehenkilöitä, jotka täyttivät kaikki tutkimukseen pääsyn kriteerit. MITT-analyysin paranemisaste oli 86 % linetsolidilla hoidetuista potilaista ja 82 % oksasilliinilla hoidetuista potilaista. Taulukossa 13 on esitetty mikrobiologisesti arvioitavien potilaiden paranemisasteet taudinaiheuttajittain.
Erillinen tutkimus antoi lisäkokemuksia ZYVOXin käytöstä metisilliiniresistenttien Staphylococcus aureus (MRSA) -infektioiden hoidossa. Tämä oli satunnaistettu, avoin tutkimus sairaalahoidossa olevilla aikuisilla potilailla, joilla oli dokumentoitu tai epäilty MRSA-infektio.
Yksi potilasryhmä sai ZYVOX IV -injektion 600 mg 12 tunnin välein ja sen jälkeen 600 mg ZYVOX-tabletteja 12 tunnin välein. Toinen potilasryhmä sai vankomysiiniä 1 g 12 tunnin välein suonensisäisesti. Molempia ryhmiä hoidettiin 7–28 päivää, ja ne voivat saada samanaikaisesti atstreonaamia tai gentamysiiniä, jos se oli kliinisesti aiheellista. Paranemisaste mikrobiologisesti arvioitavissa olevilla potilailla, joilla oli MRSA-iho- ja ihorakenteen infektio, oli 26/33 (79 %) linetsolidilla hoidetuilla potilailla ja 24/33 (73 %) vankomysiinihoitoa saaneilla potilailla.
Diabeettiset jalkatulehdukset
Aikuiset diabeettiset potilaat, joilla oli kliinisesti dokumentoituja monimutkaisia iho- ja ihorakenteen infektioita ("diabeettiset jalkainfektiot"), otettiin mukaan satunnaistettuun (suhde 2:1), monikeskukseen, avoimeen tutkimukseen, jossa verrattiin suonensisäisesti tai suun kautta annettuja tutkimuslääkkeitä yhteensä 14-28 päivää hoitoa. Yksi potilasryhmä sai ZYVOXia 600 mg 12 tunnin välein laskimoon tai suun kautta; toinen ryhmä sai ampisilliinia/sulbaktaamia 1,5–3 g suonensisäisesti tai amoksisilliinia/klavulanaattia 500–875 mg suun kautta 8–12 tunnin välein. Maissa, joissa ampisilliinia/sulbaktaamia ei markkinoida, suonensisäiseen hoitoon käytettiin amoksisilliini/klavulanaattia 500 mg - 2 g 6 tunnin välein. Vertailuryhmän potilaita voitiin myös hoitaa 1 g:lla vankomysiiniä 12 tunnin välein suonensisäisesti, jos MRSA eristettiin jalkainfektiosta. Jommankumman hoitoryhmän potilaat, joiden infektiopaikasta oli eristetty gramnegatiivisia basilleja, voivat myös saada atstreonaamia 1–2 g 8–12 tunnin välein suonensisäisesti. Kaikki potilaat olivat oikeutettuja saamaan asianmukaisia lisähoitomenetelmiä, kuten debridement ja offloading, kuten tyypillisesti vaaditaan diabeettisten jalkainfektioiden hoidossa, ja useimmat potilaat saivat näitä hoitoja. Intent-to-treat (ITT) -tutkimuspopulaatiossa oli 241 linetsolidilla hoidettua potilasta ja 120 vertailuvalmisteella hoidettua potilasta. Kaksisataa kaksitoista (86 %) linetsolidilla hoidettua potilasta ja 105 (85 %) vertailuvalmisteella hoidettua potilasta oli kliinisesti arvioitavissa. ITT-populaatiossa parantumisaste oli 68,5 % (165/241) linetsolidilla hoidetuista potilaista ja 64 % (77/120) vertailuvalmisteella hoidetuista potilaista, joissa epäselviä tai puuttuvia tuloksia pidettiin epäonnistuneina. Kliinisesti arvioitavissa olevien potilaiden parantumisaste (lukuun ottamatta potilaita, joiden lopputulos on epäselvä ja puuttuva) oli 83 % (159/192) ja 73 % (74/101) linetsolidilla hoidetuilla potilailla ja vertailuvalmisteella hoidetuilla potilailla. Kriittinen post hoc -analyysi keskittyi 121 linetsolidilla hoidettuun ja 60 vertailuvalmisteella hoidettuun potilaaseen, joilla oli grampositiivinen patogeeni eristetty infektiopaikasta tai verestä ja joilla oli vähemmän näyttöä taustalla olevasta osteomyeliitistä kuin koko tutkimuspopulaatiolla ja jotka eivät saaneet kiellettyjä mikrobilääkkeitä. Tämän analyysin perusteella paranemisaste oli 71 % (86/121) linetsolidilla hoidetuilla potilailla ja 63 % (38/60) vertailuvalmisteella hoidetuilla potilailla. Yhtään yllä olevista analyyseistä ei mukautettu lisähoitojen käyttöön. Taulukossa 14 on esitetty mikrobiologisesti arvioitavien potilaiden paranemisasteet taudinaiheuttajittain.
Vankomysiiniresistentit enterokokki-infektiot
Aikuiset potilaat, joilla oli dokumentoitu tai epäilty vankomysiiniresistentti enterokokki-infektio, otettiin mukaan satunnaistettuun, monikeskustutkimukseen, kaksoissokkotutkimukseen, jossa verrattiin suurta ZYVOX-annosta (600 mg) pieneen ZYVOX-annokseen (200 mg), joka annettiin 12 tunnin välein joko suonensisäisesti (IV) tai suun kautta 7-28 päivän ajan. Potilaat voivat saada samanaikaisesti atstreonaamia tai aminoglykosideja. 79 potilasta satunnaistettiin saamaan suuria linetsoliannoksia ja 66 potilasta pieniannoksiseen linetsolidiin. Intent-to-treat (ITT) -populaatio, jolla oli dokumentoitu vankomysiiniresistentti enterokokki-infektio lähtötilanteessa, koostui 65 potilaasta suuren annoksen ryhmässä ja 52 potilaasta pieniannoksisessa ryhmässä.
Taulukossa 15 on esitetty infektion lähteiden mukaan ITT-populaation parantumisasteet, joilla on dokumentoitu vankomysiiniresistentti enterokokki-infektio lähtötasolla. Nämä paranemisasteet eivät sisällä potilaita, joiden tulokset puuttuvat tai joiden tulokset ovat epämääräisiä. Paranemisaste oli korkeampi suuren annoksen ryhmässä kuin pienen annoksen ryhmässä, vaikka ero ei ollut tilastollisesti merkitsevä tasolla 0,05.
Pediatriset potilaat
Gram-positiivisista bakteereista johtuvat infektiot
Turvallisuus- ja tehotutkimus antoi kokemusta ZYVOX 600 mg:n käytöstä lapsipotilailla sairaalakeuhkokuumeen, monimutkaisten iho- ja ihorakenteen infektioiden sekä muiden grampositiivisten bakteeripatogeenien aiheuttamien infektioiden hoitoon, mukaan lukien metisilliiniresistentti ja -herkkä Staphylococcus aureus. ja vankomysiiniresistentti Enterococcus faecium. Lapsipotilaat, joiden ikä vaihteli syntymästä 11-vuotiaaseen, ja joilla oli dokumentoitujen tai epäiltyjen grampositiivisten bakteerien aiheuttamia infektioita, otettiin mukaan satunnaistettuun, openPage label -vertailukontrolloituun tutkimukseen. Yksi potilasryhmä sai ZYVOX 600 mg IV -injektion 10 mg/kg joka 8. tunti, minkä jälkeen ZYVOX 600 mg oraalisuspensiota 10 mg/kg 8 tunnin välein. Toinen ryhmä sai vankomysiiniä 10-15 mg/kg suonensisäisesti 6-24 tunnin välein iästä ja munuaispuhdistumasta riippuen. Potilaat, joilla oli varmistettu VRE-infektio, sijoitettiin tutkimuksen kolmanteen haaraan, ja he saivat ZYVOXia 10 mg/kg joka 8. tunti laskimoon ja/tai suun kautta. Kaikkia potilaita hoidettiin yhteensä 10–28 päivää, ja he voivat saada samanaikaisesti gramnegatiivisia antibakteerisia lääkkeitä, jos se oli kliinisesti aiheellista. Intent-to-treat (ITT) -populaatiossa 206 potilasta satunnaistettiin linetsolidiin ja 102 potilasta vankomysiiniin. ITT-, MITT- ja kliinisesti arvioitavien potilaiden paranemisasteet on esitetty taulukossa 16. Tutkimuksen päätyttyä 13 muuta potilasta, joiden ikä vaihteli 4 päivän ja 16 vuoden välillä, otettiin mukaan avoimeen VRE-haaraan. opiskella. Taulukossa 17 esitetään kliiniset paranemisasteet patogeenien mukaan mikrobiologisesti arvioitaville potilaille, mukaan lukien mikrobiologisesti arvioitavissa olevat potilaat, joilla on vankomysiiniresistentti Enterococcus faecium tämän tutkimuksen laajennuksen jälkeen.
POTILASTIEDOT
Tärkeät hallintaohjeet
Kerro potilaille, että ZYVOX voidaan ottaa ruoan kanssa tai ilman.
Perifeerinen ja optinen neuropatia
Neuvo potilaita ilmoittamaan lääkärilleen, jos he kokevat näkömuutoksia ZYVOXin käytön aikana [katso VAROITUKSET JA VAROTOIMET ].
Serotoniinin oireyhtymä
Neuvo potilaita ilmoittamaan lääkärilleen, jos he käyttävät serotonergisiä aineita, mukaan lukien serotoniinin takaisinoton estäjät tai muut masennuslääkkeet ja opioidit [ks. VAROITUKSET JA VAROTOIMET ].
Mahdolliset verenpaineen nousua aiheuttavat vuorovaikutukset
- Neuvo potilaita ilmoittamaan lääkärilleen, jos heillä on aiemmin ollut verenpainetauti.
- Neuvo potilaita välttämään suuria määriä runsaasti tyramiinia sisältäviä ruokia tai juomia ZYVOXin käytön aikana. Runsaasti tyramiinipitoisia elintarvikkeita ovat ne, jotka ovat saaneet läpikäydä proteiinimuutoksia ikääntymisen, käymisen, peittauksen tai tupakoinnin seurauksena makua parantamaan, kuten vanhentuneet juustot, fermentoitu tai ilmakuivattu liha, hapankaali, soijakastike, hanaoluet ja punaviinit. Minkä tahansa proteiinipitoisen ruoan tyramiinipitoisuus voi nousta, jos sitä säilytetään pitkiä aikoja tai jos niitä ei jäähdytetä kunnolla.
- Neuvo potilaita ilmoittamaan lääkärilleen, jos he käyttävät pseudoefedriinihydrokloridia tai fenyylipropanoliamiiniHCl:a sisältäviä lääkkeitä, kuten vilustumislääkkeitä ja dekongestantteja [ks. VAROITUKSET JA VAROTOIMET ].
Maitohappoasidoosi
Neuvo potilaita ilmoittamaan lääkärilleen, jos he kokevat toistuvia pahoinvointi- tai oksentelujaksoja ZYVOX-hoidon aikana [ks. VAROITUKSET JA VAROTOIMET ].
Kouristukset
Neuvo potilaita ilmoittamaan lääkärilleen, jos heillä on ollut kohtauksia tai kouristuksia [katso VAROITUKSET JA VAROTOIMET ].
Hypoglykemia
Neuvo potilaita ilmoittamaan lääkärilleen, jos heillä on diabetes mellitus. Hypoglykeemisiä reaktioita, kuten hikoilua ja vapinaa, sekä alhaisia verensokeriarvoja saattaa esiintyä linetsolidilla hoidettaessa. Jos tällaisia reaktioita ilmenee, potilaiden tulee ottaa yhteyttä lääkäriin tai muuhun terveydenhuollon ammattihenkilöön oikean hoidon saamiseksi [katso VAROITUKSET JA VAROTOIMET ].
Hyponatremia ja/tai SIADH
Neuvo potilaita, joilla on hyponatremiariski, ilmoittamaan lääkärilleen, jos heillä on hyponatremian ja/tai SIADH:n merkkejä ja oireita, mukaan lukien sekavuus, uneliaisuus, yleinen heikkous ja hengitysvaikeus [ks. VAROITUKSET JA VAROTOIMET ].
Fenyyliketonuria
Kerro potilaille, joilla on fenyyliketonuria (PKU), että jokainen 5 ml 100 mg/5 ml ZYVOX oraalisuspensiota sisältää 20 mg fenyylialaniinia. Muut ZYVOX 600 mg -valmisteet eivät sisällä fenyylialaniinia. Fenyylialaniini voi olla haitallista potilaille, joilla on fenyyliketonuria. Ota yhteyttä lääkäriisi tai apteekkiin, kun sinulle on määrätty ZYVOX 600mg oraalisuspensiota varten [ks. VAROITUKSET JA VAROTOIMET ].
Antibakteerinen vastustuskyky
Potilaita tulee neuvoa, että antibakteerisia lääkkeitä, mukaan lukien ZYVOX, tulee käyttää vain bakteeri-infektioiden hoitoon. Ne eivät hoida virusinfektioita (esim. flunssaa). Kun ZYVOX 600mg on määrätty bakteeri-infektion hoitoon, potilaille tulee kertoa, että vaikka on yleistä, että olo paranee hoidon alkuvaiheessa, lääke tulee ottaa täsmälleen ohjeiden mukaan. Annosten väliin jättäminen tai koko hoitojakson suorittamatta jättäminen saattaa heikentää välittömän hoidon tehokkuutta ja lisätä todennäköisyyttä, että bakteerit kehittävät resistenssiä ja että niitä ei voida hoitaa ZYVOXilla tai muilla antibakteerisilla lääkkeillä tulevaisuudessa.
Ripuli
Ripuli on yleinen bakteerilääkkeiden aiheuttama ongelma, joka yleensä päättyy, kun antibakteerinen lääke lopetetaan. Joskus bakteerilääkehoidon aloittamisen jälkeen potilaille voi ilmaantua vetisiä ja verisiä ulosteita (vatsakouristuksella ja kuumeella tai ilman) jopa kahden tai useamman kuukauden kuluttua viimeisen antibakteerisen lääkkeen ottamisen jälkeen. Jos näin tapahtuu, potilaiden tulee ottaa yhteyttä lääkäriin mahdollisimman pian [katso VAROITUKSET JA VAROTOIMET ].
Hedelmättömyys
Kerro miespotilaille, että ZYVOX voi heikentää hedelmällisyyttä palautuvasti [katso Käyttö tietyissä populaatioissa ].
Tämän tuotteen merkintä on saatettu päivittää. Uusimmat reseptitiedot ovat osoitteessa www.pfizer.com.
