Biaxin 250mg, 500mg Clarithromycin Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Biaxin 500mg on ja miten sitä käytetään?
Biaxin on reseptilääke, jota käytetään monien erilaisten bakteeri-infektioiden, mukaan lukien mahahaavan ja Helicobacter pylorin, oireiden hoitoon. Biaxin-valmistetta voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Biaxin 500mg on antibiootti.
Ei tiedetä, onko Biaxin turvallinen ja tehokas alle 6 kuukauden ikäisille lapsille.
Mitkä ovat Biaxin 250mg:n mahdolliset sivuvaikutukset?
Biaxin 500mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- kova vatsakipu,
- verta sisältävä ripuli,
- nopeat tai jyskyttävät sydämenlyönnit,
- lepattaa rinnassasi,
- hengenahdistus,
- äkillinen huimaus,
- hämmennystä,
- pyörivä tunne,
- ruokahalun menetys,
- ylävatsakipu,
- väsymys,
- tumma virtsa,
- savenvärinen jakkara,
- silmien ja ihon keltaisuus (keltaisuus),
- vähän tai ei ollenkaan virtsaa,
- turvotus jaloissasi tai nilkoissasi,
- väsynyt olo,
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Biaxinin yleisimmät sivuvaikutukset ovat:
- vatsakipu,
- pahoinvointi,
- oksentelua,
- ripuli,
- epätavallinen tai epämiellyttävä maku suussa,
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Biaxinin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
Klaritromysiini on puolisynteettinen makrolidiantimikrobinen lääke suun kautta käytettäväksi. Kemiallisesti se on 6-0-metyylierytromysiini. Molekyylikaava on C38H69NO13 ja molekyylipaino on 747,96. Rakennekaava on:
Kuva 1: Klaritromysiinin rakenne
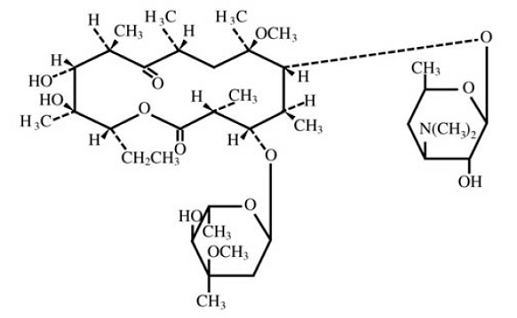
Klaritromysiini on valkoinen tai luonnonvalkoinen kiteinen jauhe. Se liukenee asetoniin, liukenee heikosti metanoliin, etanoliin ja asetonitriiliin ja on käytännössä liukenematon veteen.
BIAXIN on saatavana välittömästi vapautuvina tabletteina, depottabletteina ja rakeina oraalisuspensiota varten.
Jokainen keltainen soikea kalvopäällysteinen välittömästi vapauttava BIAXIN Filmtab -tabletti (klaritromysiinitabletit, USP) sisältää 250 mg tai 500 mg klaritromysiiniä ja seuraavia inaktiivisia aineosia:
- 250 mg tabletit: hypromelloosi, hydroksipropyyliselluloosa, kroskarmelloosinatrium, D&C Yellow No. 10, FD&C Blue No. 1, magnesiumstearaatti, mikrokiteinen selluloosa, povidoni, esigelatinoitu tärkkelys, propyleeniglykoli, piidioksidi, sorbitaanisorbiinihappo, piidioksidi, sorbiinihappo, sorbiinihappo talkki, titaanidioksidi ja vanilliini.
- 500 mg:n tabletit: hypromelloosi, hydroksipropyyliselluloosa, kolloidinen piidioksidi, kroskarmelloosinatrium, D&C Yellow No. 10, magnesiumstearaatti, mikrokiteinen selluloosa, povidoni, propyleeniglykoli, sorbiinihappo, sorbitaanimono-oleaatti, titaanillinidioksidi.
Jokainen keltainen soikea kalvopäällysteinen BIAXIN XL Filmtab tabletti (klaritromysiini-pitkävaikutteiset tabletit) sisältää 500 mg klaritromysiiniä ja seuraavia inaktiivisia aineosia: selluloosapolymeerit, D&C Yellow No. 10, laktoosimonohydraatti, magnesiumstearaatti, propyleeniglykoli, sorbiinihappo. monooleaatti, talkki, titaanidioksidi ja vanilliini.
Jokainen 5 ml BIAXIN 500 mg käyttövalmiiksi saatettua suspensiota (klaritromysiini oraalisuspensiota varten, USP) sisältää 125 mg tai 250 mg klaritromysiiniä. Jokainen BIAXIN-rakeiden pullo sisältää 1250 mg (50 ml:n koko), 2500 mg (50 ja 100 ml:n koot) tai 5000 mg (100 ml:n koko) klaritromysiiniä ja seuraavia inaktiivisia aineosia: karbomeeri, risiiniöljy, sitruunahappo, hypromelloosiftalaatti, maltodekstriini, kaliumsorbaatti, povidoni, piidioksidi, sakkaroosi, ksantaanikumi, titaanidioksidi ja hedelmäpunssi-aromi.
INDIKAATIOT
Kroonisen keuhkoputkentulehduksen akuutti bakteerien paheneminen
BIAXIN (Filmtab, rakeet) ja BIAXIN XL Filmtab on tarkoitettu aikuisille lievien tai keskivaikeiden infektioiden hoitoon, jotka ovat aiheuttaneet Haemophilus influenzae-, Haemophilus parainfluenzae-, Moraxella catarrhalis- tai Streptococcus pneumoniae -bakteerin aiheuttamat herkät isolaatit [ks. KÄYTTÖAIHEET JA KÄYTTÖ ].
Akuutti poskiontelotulehdus
BIAXIN (Filmtab, rakeet) ja BIAXIN 500mg XL Filmtab (aikuisille) on tarkoitettu lievien tai kohtalaisten infektioiden hoitoon, jotka ovat aiheuttaneet Haemophilus influenzaen, Moraxella catarrhalisin tai Streptococcus pneumoniaen aiheuttamat herkät isolaatit [ks. KÄYTTÖAIHEET JA KÄYTTÖ ].
Yhteisön hankkima keuhkokuume
BIAXIN (Filmtab, Granules) ja BIAXIN XL Filmtab on merkitty [katso KÄYTTÖAIHEET JA KÄYTTÖ ] herkkien isolaattien aiheuttamien lievien tai kohtalaisten infektioiden hoitoon:
- Haemophilus influenzae (aikuisilla)
- Haemophilus parainfluenzae (BIAXIN 500mg XL Filmtab aikuisilla)
- Moraxella catarrhalis (BIAXIN 250mg XL Filmtab aikuisille)
- Mycoplasma pneumoniae, Streptococcus pneumoniae, Chlamydophila pneumoniae (BIAXIN 500 mg XL Filmtab [aikuisilla]; BIAXIN Filmtab ja BIAXIN-rakeet [aikuisilla ja lapsipotilailla])
Nielutulehdus/tonsilliitti
BIAXIN 500mg Filmtab ja BIAXIN 500mg -rakeet on tarkoitettu lievien tai kohtalaisten Streptococcus pyogenes -bakteerin aiheuttamien herkkien isolaattien aiheuttamien infektioiden hoitoon vaihtoehtona henkilöille, jotka eivät voi käyttää ensilinjan hoitoa.
Komplisoitumattomat iho- ja ihorakenteen infektiot
BIAXIN Filmtab ja BIAXIN Granules on tarkoitettu Staphylococcus aureuksen tai Streptococcus pyogenesin aiheuttamien herkkien isolaattien aiheuttamien lievien tai kohtalaisten infektioiden hoitoon.
Akuutti välikorvatulehdus
BIAXIN Filmtab ja BIAXIN 250 mg rakeet on tarkoitettu lapsipotilaille Haemophilus influenzaen, Moraxella catarrhalisin tai Streptococcus pneumoniaen aiheuttamien herkkien isolaattien aiheuttamien lievien tai kohtalaisten infektioiden hoitoon [ks. Kliiniset tutkimukset ].
Levyjen mykobakteeri-infektioiden hoito ja ennaltaehkäisy
BIAXIN 500 mg Filmtab ja BIAXIN 250 mg rakeet on tarkoitettu Mycobacterium aviumin tai Mycobacterium intracellularen aiheuttamien herkkien isolaattien aiheuttamien lievien tai kohtalaisten infektioiden hoitoon potilailla, joilla on edennyt HIV-infektio (ks. Kliiniset tutkimukset ].
Helicobacter pylori -infektio ja pohjukaissuolihaava
BIAXIN 250 mg Filmtab annetaan aikuisille yhdessä muiden lääkkeiden kanssa alla kuvatulla tavalla H. pylorin hävittämiseksi. H. pylorin hävittämisen on osoitettu vähentävän pohjukaissuolihaavan uusiutumisen riskiä [ks. Kliiniset tutkimukset ].
- BIAXIN Filmtab yhdistelmänä amoksisilliinin ja PREVACIDin (lansopratsoli) tai PREVACIDin (omepratsoli) viivästyneen vapautumisen kapseleiden kanssa kolmoishoitona on tarkoitettu potilaiden hoitoon, joilla on helikobakteeri-infektio ja pohjukaissuolihaava (aktiivinen tai viisi vuotta pohjukaissuolen sairaus). haava) H. pylorin hävittämiseksi.
- BIAXIN 250 mg Filmtab yhdessä PRILOSEC (omepratsoli) -kapseleiden kanssa on tarkoitettu potilaiden hoitoon, joilla on H. pylori -infektioon liittyvä aktiivinen pohjukaissuolihaava. Hoito-ohjelmat, jotka sisältävät BIAXIN 250 mg Filmtabia ainoana antibakteerisena aineena, liittyvät todennäköisemmin klaritromysiiniresistenssin kehittymiseen potilailla, joiden hoito epäonnistuu. Klaritromysiiniä sisältäviä hoito-ohjelmia ei pidä käyttää potilailla, joilla tiedetään tai epäillään olevan klaritromysiiniresistenttejä isolaatteja, koska hoidon teho on heikentynyt tässä tilanteessa.
Käyttörajoitukset
BIAXIN 500mg XL Filmtab on tarkoitettu vain aikuisten akuuttiin poskiontelotulehdukseen, kroonisen keuhkoputkentulehduksen akuuttiin bakteeriperäiseen pahenemiseen ja yhteiskunnan aiheuttamaan keuhkokuumeeseen. BIAXIN 500mg XL Filmtabin tehoa ja turvallisuutta muiden infektioiden hoidossa, joihin BIAXIN Filmtab ja BIAXIN Granules on hyväksytty, ei ole osoitettu.
Makrolideille on vastustuskykyä tietyissä Streptococcus pneumoniaen ja Staphylococcus aureuksen aiheuttamissa bakteeri-infektioissa. Herkkyystesti tulee tehdä, kun se on kliinisesti aiheellista.
Käyttö
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja BIAXINin ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi BIAXINia tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden on todistettu tai epäillään aiheuttavan herkkiä bakteereja. Kun viljely- ja herkkyystiedot ovat saatavilla, ne tulee ottaa huomioon valittaessa tai muuttaessa antibakteerista hoitoa. Tällaisten tietojen puuttuessa paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa hoidon empiiriseen valintaan.
ANNOSTELU JA HALLINNOINTI
Tärkeät hallintaohjeet
BIAXIN Filmtab ja BIAXIN 250 mg rakeita voidaan antaa ruoan kanssa tai ilman.
BIAXIN XL Filmtab tulee ottaa ruoan kanssa. Niele BIAXIN 500mg XL Filmtab kokonaisena; älä pureskele, riko tai murskaa BIAXIN 500mg XL Filmtabia.
Aikuisten annostus
BIAXIN 250mg Filmtab- ja BIAXIN 250mg XL Filmtab -valmisteiden suositellut annokset aikuisten lievien tai kohtalaisten infektioiden hoitoon on lueteltu taulukossa 1.
Yhdistelmäannostusohjelmat H. pylori -infektiolle
- Kolmoishoito: BIAXIN 500 mg Filmtab/lansopratsoli/amoksisilliini Suositeltu aikuisten annos on 500 mg BIAXIN 500 mg Filmtab, 30 mg lansopratsolia ja 1 gramma amoksisilliinia, kaikki annetaan 12 tunnin välein 10 tai 14 päivän ajan [ks. KÄYTTÖAIHEET JA KÄYTTÖ ja Kliiniset tutkimukset ].
- Kolmoishoito: BIAXIN Filmtab/omepratsoli/amoksisilliini Suositeltu aikuisten annos on 500 mg BIAXIN 250 mg Filmtab, 20 mg omepratsolia ja 1 gramma amoksisilliinia; kaikki annetaan 12 tunnin välein 10 päivän ajan. Potilaille, joilla on haavauma hoidon aloitushetkellä, suositellaan vielä 18 päivän ajan omepratsolia 20 mg kerran vuorokaudessa haavan paranemiseksi ja oireiden lievittämiseksi [ks. KÄYTTÖAIHEET JA KÄYTTÖ ja Kliiniset tutkimukset ].
- Kaksoishoito: BIAXIN 500 mg Filmtab/omepratsoli Suositeltu aikuisten annos on 500 mg BIAXIN 250 mg Filmtab 8 tunnin välein ja 40 mg omepratsolia kerran joka aamu 14 päivän ajan. Haavojen paranemiseen ja oireiden lievittämiseen suositellaan vielä 14 päivää omepratsolia 20 mg kerran vuorokaudessa [ks. KÄYTTÖAIHEET JA KÄYTTÖ ja Kliiniset tutkimukset ].
Lasten annostus
Suositeltu päiväannos on 15 mg/kg/vrk jaettuna 12 tunnin välein 10 päivän ajan (aikuisen annokseen asti). Katso lisäannostustiedot lapsipotilaiden mykobakteeri-infektioiden annostusohjelmista [ks. Annostusohjelmat mykobakteeri-infektioille ].
Annostusohjelmat mykobakteeri-infektioille
Mycobacterium avium -kompleksin (MAC) aiheuttaman levinneen infektion hoitoon suositellaan ensisijaisesti BIAXIN Filmtab- ja BIAXIN 500 mg -rakeita. BIAXIN Filmtab- ja BIAXIN-rakeita tulee käyttää yhdessä muiden antimykobakteerilääkkeiden (esim. etambutolin) kanssa, jotka ovat osoittaneet in vitro aktiivisuutta MAC:tä vastaan tai kliinistä hyötyä MAC-hoidossa [ks. Kliiniset tutkimukset ].
Aikuiset potilaat
Mykobakteeri-infektioiden hoitoon ja ennaltaehkäisyyn aikuisilla suositeltu BIAXIN-annos on 500 mg 12 tunnin välein.
Pediatriset potilaat
Mykobakteeri-infektioiden hoitoon ja ennaltaehkäisyyn lapsipotilailla suositeltu annos on 7,5 mg/kg 12 tunnin välein, enintään 500 mg 12 tunnin välein. [Katso Käyttö tietyissä populaatioissa ja Kliiniset tutkimukset ].
BIAXIN 250 mg -hoitoa tulee jatkaa, jos kliinistä vastetta havaitaan. BIAXIN-hoito voidaan lopettaa, jos potilaalla katsotaan olevan alhainen leviävän infektion riski.
Annoksen säätäminen potilailla, joilla on munuaisten vajaatoiminta
Katso taulukko 2 annoksen muuttamisesta potilailla, joilla on kohtalainen tai vaikea munuaisten vajaatoiminta, atatsanaviiria tai ritonaviiria sisältävien hoito-ohjelmien kanssa tai ilman niitä [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Annoksen säätäminen lääkevuorovaikutusten vuoksi
Pienennä BIAXIN 500 mg annosta 50 %, kun sitä annetaan yhdessä atatsanaviirin kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ]. Muiden lääkkeiden annoksen muuttamista, kun niitä annetaan samanaikaisesti BIAXIN 250 mg:n kanssa, voidaan suositella lääkkeiden yhteisvaikutusten vuoksi [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
BIAXIN-rakeiden liuottaminen
Mukana toimitetut BIAXIN 250 mg -rakeet on saatettava käyttövalmiiksi veteen ennen BIAXIN-oraalisuspension antamista. Alla olevassa taulukossa 3 on esitetty uudelleen liuottamisen yhteydessä lisättävän vesimäärä. Uudelleenmuodostaminen:
Ravista hyvin ennen jokaista käyttöä. Säilytä sekoittamisen jälkeen 15–30 °C:ssa (59–86 °F) ja käytä 14 päivän kuluessa. Älä jäähdytä.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
BIAXIN 500mg on saatavana seuraavasti:
- BIAXIN 250mg Filmtab (keltainen soikea kalvopäällysteinen tabletti):
- 250 mg: painettu sinisellä logolla "a" ja KT
- 500 mg: toisella puolella "a"-logo ja toisella puolella KL
- BIAXIN XL Filmtab (keltainen soikea kalvopäällysteinen pitkävaikutteinen tabletti):
- 500 mg: kaiverrettu "a"-logolla ja KJ
- BIAXIN-rakeet (valkoisia tai luonnonvalkoisia rakeita ennen käyttövalmiiksi saattamista; valkoinen tai luonnonvalkoinen läpinäkymätön suspensio käyttövalmiiksi saattamisen jälkeen):
- 125 mg/5 ml pitoisuus saatavilla 50 ml ja 100 ml pulloissa
- 250 mg/5 ml pitoisuus saatavilla 50 ml ja 100 ml pulloissa
Varastointi ja käsittely
BIAXIN 250mg Filmtab (klaritromysiinitabletit, USP) toimitetaan keltaisina soikeina kalvopäällysteisinä tabletteina seuraavissa pakkauskokoissa: 250 mg:n tabletit: (sinisellä painettu "a"-logolla ja KT)
Pullot 60 ( NDC 0074-3368-60) ja 100 ( NDC 0074-3368-11).
Säilytä BIAXIN Filmtab 250 mg valvotussa huoneenlämpötilassa 15–30 °C (59–86 °F) hyvin suljetussa astiassa. Suojaa valolta.
500 mg tabletit : (toisella puolella "a"-logo ja toisella puolella KL)
Pullot 60 (NDC 0074-2586-60) ja yksikköannosliuskapakkaukset 100 ( NDC 0074-2586-11).
Säilytä BIAXIN Filmtab 500 mg valvotussa huoneenlämpötilassa 20–25 °C (68–77 °F) hyvin suljetussa astiassa.
BIAXIN XL Filmtab (klaritromysiini-pitkävaikutteiset tabletit) toimitetaan keltaisina soikeina kalvopäällysteisinä tabletteina seuraavissa pakkauskokoissa:
500 mg tabletit : (kaiverrettu "a"-logolla ja KJ)
Pullot 60 (NDC 0074-3165-60), yksikköannosliuskapakkaukset 100 ( NDC 0074-3165-11) ja BIAXIN XL PAC-pakkaus, jossa on 4 läpipainopakkausta, joissa kussakin 14 tablettia ( NDC 0074-3165-41).
Säilytä BIAXIN 500 mg XL Filmtab 20–25 °C:ssa (68–77 °F). Retket sallitaan 15° - 30°C (59° - 86°F). [Katso USP-ohjattu huonelämpötila .]
BIAXIN 500 mg rakeita (klaritromysiini oraalisuspensiota varten, USP) toimitetaan valkoisina tai luonnonvalkoisina rakeina seuraavina vahvuuksina ja koossa:
Säilytä BIAXIN 500 mg rakeita alle 25 °C (77 °F) hyvin suljetussa astiassa. Älä säilytä käyttövalmiiksi valmistettuja BIAXIN 500 mg rakeita jääkaapissa.
BIAXIN Filmtab 250 mg ja 500 mg ja BIAXIN 250 mg XL Filmtab 500 mg Mfd. kirjoittanut AbbVie LTD, Barceloneta, PR 00617. BIAXIN-rakeet, 125 mg/5 ml ja 250 mg/5 ml Mfd. kirjoittanut AbbVie Inc., North Chicago, IL 60064, AbbVie Inc., North Chicago, IL 60064, USA Tarkistettu: marraskuu 2018.
SIVUVAIKUTUKSET
Seuraavat vakavat haittavaikutukset on kuvattu alla ja muualla merkinnöissä:
- Akuutit yliherkkyysreaktiot [katso VAROITUKSET JA VAROTOIMET ]
- QT-ajan pidentyminen [katso VAROITUKSET JA VAROTOIMET ]
- Maksatoksisuus [katso VAROITUKSET JA VAROTOIMET ]
- Vakavat haittavaikutukset, jotka johtuvat samanaikaisesta käytöstä muiden lääkkeiden kanssa [katso VAROITUKSET JA VAROTOIMET ]
- Clostridium difficilen liittyvä ripuli [katso VAROITUKSET JA VAROTOIMET ]
- Myasthenia Gravisin paheneminen [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset tehdään hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutusten määrää ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Kaikkia käyttöaiheita koskevien yhdistettyjen tietojen perusteella yleisimmät kliinisissä tutkimuksissa havaitut haittavaikutukset sekä aikuisilla että lapsilla ovat vatsakipu, ripuli, pahoinvointi, oksentelu ja dysgeusia. Myös dyspepsiaa, poikkeavia maksan toimintakokeista, anafylaktisia reaktioita, kandidiaasia, päänsärkyä, unettomuutta ja ihottumaa raportoitiin.
Seuraavissa alaosissa luetellaan yleisimmät haittavaikutukset mykobakteeri-infektioiden ja H. pylori -infektioon liittyvien pohjukaissuolihaavojen ehkäisyssä ja hoidossa. Yleensä nämä profiilit ovat yhdenmukaisia edellä kuvattujen yhdistettyjen tietojen kanssa.
Mykobakteeri-infektioiden ehkäisy
AIDS-potilailla, joita hoidettiin BIAXIN-valmisteella pitkiä aikoja M. aviumin ehkäisyyn, oli usein vaikeaa erottaa BIAXINin antamiseen mahdollisesti liittyviä haittavaikutuksia taustalla olevasta HIV-sairaudesta tai välivaiheen sairaudesta. Hoidon keston mediaani oli 10,6 kuukautta BIAXIN-ryhmässä ja 8,2 kuukautta lumeryhmässä.
Laboratorioarvojen muutokset
Taulukossa 5 on esitetty valikoidut laboratoriotutkimukset, jotka raportoitiin hoidon aikana yli 2 %:lla aikuispotilaista, joita hoidettiin BIAXIN-valmisteella satunnaistetussa kaksoissokkoutetussa kliinisessä tutkimuksessa, johon osallistui 682 potilasta.
Immuunivajautuneilla potilailla, jotka saivat profylaksia M. aviumia vastaan, laboratorioarvojen arvioinnit tehtiin analysoimalla ne arvot, jotka olivat määritetyn testin vakavasti epänormaalin arvon (eli äärimmäisen korkean tai matalan rajan) ulkopuolella.
Mykobakteeri-infektioiden hoito
Haittavaikutusprofiilit sekä 500 mg:n että 1000 mg:n kahdesti vuorokaudessa annosteluohjelmissa olivat samanlaiset.
AIDS-potilailla ja muilla immuunipuutteisilla potilailla, joita hoidettiin mykobakteeri-infektioiden vuoksi pitkiä aikoja suuremmilla BIAXIN-annoksilla, oli usein vaikeaa erottaa BIAXIN 250 mg:n antamiseen mahdollisesti liittyviä haittavaikutuksia HIV-sairauden tai muun sairauden taustalla olevista oireista.
Seuraavassa analyysissä on yhteenveto BIAXIN-hoidon ensimmäisten 12 viikon aikana saaduista kokemuksista. Tiedot raportoidaan erikseen kokeesta 1 (satunnaistettu, kaksoissokkoutettu) ja tutkimuksesta 2 (avoin merkitty, myötätuntoinen käyttö) ja myös yhdistetty. Haittavaikutuksia raportoitiin harvemmin tutkimuksessa 2, mikä saattaa johtua osittain seurannan eroista näiden kahden tutkimuksen välillä.
Aikuisilla potilailla, jotka saavat BIAXINia 500 mg kahdesti vuorokaudessa, alla on lueteltu yleisimmin raportoidut haittavaikutukset, joiden katsotaan mahdollisesti tai mahdollisesti liittyvän tutkimuslääkkeeseen ja joiden ilmaantuvuus on 5 % tai enemmän (taulukko 6). Noin 8 % potilaista, jotka saivat 500 mg kahdesti vuorokaudessa, ja 12 % potilaista, jotka saivat 1000 mg kahdesti vuorokaudessa, keskeytti hoidon lääkkeeseen liittyvien haittavaikutusten vuoksi 12 ensimmäisen hoitoviikon aikana; Vähintään kahdella potilaalla hoidon lopettamiseen johtaneita haittavaikutuksia olivat pahoinvointi, oksentelu, vatsakipu, ripuli, ihottuma ja voimattomuus.
Rajoitettu määrä lasten AIDS-potilaita on hoidettu BIAXIN-suspensiolla mykobakteeri-infektioiden hoitoon. Yleisimmin raportoidut haittavaikutukset, lukuun ottamatta potilaan samanaikaisista tiloista johtuvia haittavaikutuksia, olivat yhdenmukaisia aikuispotilailla havaittujen haittavaikutusten kanssa.
Laboratorioarvojen muutokset
Ensimmäisen 12 viikon aikana, kun BIAXIN 500 mg kahdesti vuorokaudessa aloitettiin, 3 %:lla potilaista SGOT lisääntyi ja 2 %:lla potilaista SGPT kohoaa > 5 kertaa normaalin ylärajaan verrattuna tutkimuksessa 2 (469 osallistunutta aikuista potilasta), kun taas tutkimuksessa 1 (154 potilasta) transaminaasiarvot eivät kohonneet. Tämä koskee vain potilaita, joiden lähtöarvot ovat normaalilla alueella tai raja-arvoltaan matalalla.
H. pylori -infektioon liittyvä pohjukaissuolihaava
Kliinisissä tutkimuksissa, joissa käytettiin yhdistelmähoitoa BIAXIN 500 mg:n sekä omepratsolin ja amoksisilliinin kanssa, ei ole havaittu näiden lääkkeiden yhdistelmälle spesifisiä haittavaikutuksia. Haittavaikutukset ovat rajoittuneet niihin, joita on raportoitu aiemmin BIAXIN 250 mg:n, omepratsolin tai amoksisilliinin yhteydessä.
Haittavaikutusten profiilit on esitetty alla (taulukko 7) neljässä satunnaistetussa kaksoissokkoutetussa kliinisessä tutkimuksessa, joissa potilaat saivat yhdistelmänä BIAXIN 500 mg kolme kertaa vuorokaudessa ja omepratsolia 40 mg päivässä 14 päivän ajan ja sen jälkeen omepratsolia 20 mg kerran päivässä. vuorokaudessa (kolme tutkimusta) tai 40 mg kerran päivässä (yksi tutkimus) vielä 14 päivän ajan. Niistä 346 potilaasta, jotka saivat yhdistelmää, 3,5 % potilaista keskeytti lääkkeen haittavaikutusten vuoksi.
Laboratorioarvojen muutokset
Muutokset laboratorioarvoissa, joilla on mahdollista kliinistä merkitystä, BIAXINia ja omepratsolia saaneilla potilailla neljässä satunnaistetussa kaksoissokkotutkimuksessa 945 potilaalla ovat seuraavat:
Maksa kohonnut suora bilirubiini
Harvemmin havaittuja haittavaikutuksia klaritromysiinin kliinisissä tutkimuksissa
Kaikkia käyttöaiheita koskevien yhdistettyjen tietojen perusteella seuraavia haittavaikutuksia havaittiin kliinisissä tutkimuksissa klaritromysiinillä alle 1 %:n esiintymistiheydellä:
Veri- ja imusolmukkeiden häiriöt: Leukopenia, neutropenia, trombosytemia, eosinofilia
Sydänhäiriöt: Elektrokardiogrammin QT-ajan piteneminen, sydämenpysähdys, eteisvärinä, ekstrasystolat, sydämentykytys
Korva- ja labyrinttihäiriöt: Huimaus, tinnitus, kuulovamma
Ruoansulatuskanavan häiriöt: Stomatiitti, glossiitti, ruokatorven tulehdus, gastroesofageaalinen refluksitauti, gastriitti, proktalgia, vatsan turvotus, ummetus, suun kuivuminen, punoitus, ilmavaivat
Yleiset häiriöt ja hallintosivuston ehdot: Pahoinvointi, kuume, voimattomuus, rintakipu, vilunväristykset, väsymys
Maksan ja sappien häiriöt: Kolestaasi, hepatiitti
Immuunijärjestelmän häiriöt: Yliherkkyys
Infektiot ja infektiot: Selluliitti, gastroenteriitti, infektio, emätintulehdus
Tutkimukset: Veren bilirubiinipitoisuus kohonnut, veren alkalinen fosfataasiarvo kohonnut, veren laktaattidehydrogenaasiarvo kohonnut, albumiiniglobuliinisuhde epänormaali
Aineenvaihdunta- ja ravitsemushäiriöt: Anoreksia, vähentynyt ruokahalu
Tuki- ja liikuntaelimistön ja sidekudosten häiriöt: Myalgia, lihasspasmit, niskan jäykkyys
Hermoston häiriöt: Huimaus, vapina, tajunnan menetys, dyskinesia, uneliaisuus
Psyykkiset häiriöt: Ahdistus, hermostuneisuus
Munuaisten ja virtsateiden häiriöt: Veren kreatiniini nousi, veren urea lisääntyi
Hengityselinten, rintakehän ja välikarsinan häiriöt: Astma, nenäverenvuoto, keuhkoembolia
Ihon ja ihonalaisten kudosten häiriöt: Urtikaria, rakkula-ihottuma, kutina, liikahikoilu, makulopapulaarinen ihottuma
Ruoansulatuskanavan haittavaikutukset
Kroonisen keuhkoputkentulehduksen ja akuutin poskiontelotulehduksen akuutin pahenemisen tutkimuksissa maha-suolikanavan haittavaikutuksia raportoitu samanlainen osuus potilaista, jotka käyttivät joko BIAXIN 250 mg Filmtabia tai BIAXIN 500 mg XL Filmtabia; BIAXIN 500 mg XL Filmtabia saaneet potilaat ilmoittivat kuitenkin huomattavasti vähemmän vakavista maha-suolikanavan oireista kuin BIAXIN 250 mg Filmtabia saaneet potilaat. Lisäksi potilailla, jotka käyttivät BIAXIN 500 mg XL Filmtabia, oli huomattavasti vähemmän ennenaikaista lopettamista lääkkeeseen liittyvien maha-suolikanavan haittavaikutusten tai epänormaalin makuaistin vuoksi verrattuna BIAXIN Filmtabiin.
Sepelvaltimotautia sairastavien potilaiden kokonaiskuolleisuus 1–10 vuotta BIAXIN-altistuksen jälkeen
Yhdessä kliinisessä tutkimuksessa, jossa arvioitiin klaritromysiinihoidon tuloksia sepelvaltimotautia sairastavilla potilailla, havaittiin yleisen kuolleisuuden lisääntyminen potilailla, jotka satunnaistettiin saamaan klaritromysiiniä. Klaritromysiini sepelvaltimotaudin hoitoon ei ole hyväksytty käyttöaihe. Potilaita hoidettiin klaritromysiinillä tai lumelääkettä 14 päivän ajan, ja niitä tarkkailtiin useiden vuosien ajan primaaristen tulostapahtumien osalta (esim. kuolleisuus kaikista syistä tai ei-kuolemaan johtaneet sydäntapahtumat).1 Klaritromysiiniä saaville satunnaistetuilla potilailla oli numeerisesti suurempi määrä ensisijaisia seurauksia. havaittiin riskisuhteella 1,06 (95 %:n luottamusväli 0,98-1,14). Kuitenkin seurannassa 10 vuotta hoidon jälkeen 866 (40 %) kuolemaa oli klaritromysiiniryhmässä ja 815 (37 %) plaseboryhmässä, mikä edusti kaikista syistä johtuvan kuolleisuuden riskisuhdetta 1,10 (95 %). luottamusväli 1,00 - 1,21). Ero kuolemien määrässä ilmeni vuoden tai useamman hoidon päättymisen jälkeen.
Kaiken aiheuttaman kuolleisuuden eron syytä ei ole selvitetty. Muut epidemiologiset tutkimukset, jotka arvioivat tätä riskiä, ovat osoittaneet vaihtelevia tuloksia [katso VAROITUKSET JA VAROTOIMET ].
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu BIAXINin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Veri ja lymfaattinen järjestelmä: Trombosytopenia, agranulosytoosi
Sydämen: Ventrikulaarinen rytmihäiriö, kammiotakykardia, torsades de pointes
Korva ja labyrintti: Kuuroutta raportoitiin pääasiassa iäkkäillä naisilla, ja se oli yleensä palautuva.
Ruoansulatuskanava: Akuutti haimatulehdus, kielen värjäytymistä ja hampaiden värjäytymistä raportoitiin, ja ne yleensä korjaantuivat ammattimaisella puhdistuksella lääkkeen käytön lopettamisen jälkeen.
On raportoitu BIAXIN 250 mg XL Filmtabin esiintymistä ulosteessa, ja monet niistä ovat ilmenneet potilailla, joilla on anatomisia (mukaan lukien ileostomia tai kolostomia) tai toiminnallisia maha-suolikanavan häiriöitä, joilla on lyhentynyt maha-suolikanavan kulkuaika. Useissa raporteissa tablettijäämiä on esiintynyt ripulin yhteydessä. On suositeltavaa, että potilaat, joiden ulosteessa on tablettijäämiä ja joiden tila ei parane, vaihdetaan toiseen klaritromysiiniformulaatioon (esim. suspensioon) tai muuhun antibakteeriseen lääkkeeseen.
Maksa-sappi: Maksan vajaatoiminta, hepatosellulaarinen keltaisuus. Maksan toimintahäiriöihin liittyviä haittavaikutuksia on raportoitu klaritromysiinin käytön yhteydessä [katso VAROITUKSET JA VAROTOIMET ].
Infektiot ja infektiot: Pseudomembranoottinen koliitti [katso VAROITUKSET JA VAROTOIMET ]
Immuunijärjestelmä: Anafylaktiset reaktiot, angioödeema
Tutkimukset: Protrombiiniaika pidentynyt, valkosolujen määrä laski, kansainvälinen normalisoitu suhde lisääntyi. Virtsan epänormaalia väriä on raportoitu maksan vajaatoiminnan yhteydessä.
Aineenvaihdunta ja ravitsemus: Hypoglykemiaa on raportoitu potilailla, jotka käyttävät suun kautta otettavia hypoglykeemisiä aineita tai insuliinia.
Tuki- ja liikuntaelimistö ja sidekudos: Myopatian rabdomyolyysiä raportoitiin, ja joissakin raporteissa klaritromysiiniä annettiin samanaikaisesti statiinien, fibraattien, kolkisiinin tai allopurinolin kanssa [ks. VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
Hermosto: Parosmia, anosmia, ageusia, parestesia ja kouristukset
Psykiatrinen: Epänormaali käyttäytyminen, sekavuustila, depersonalisaatio, desorientaatio, hallusinaatiot, masennus, maaninen käyttäytyminen, epänormaali uni, psykoottinen häiriö. Nämä häiriöt häviävät yleensä lääkkeen käytön lopettamisen jälkeen.
Munuaiset ja virtsatie: Interstitiaalinen nefriitti, munuaisten vajaatoiminta
Iho ja ihonalainen kudos: Stevens-Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi, lääkeihottuma, johon liittyy eosinofiliaa ja systeemisiä oireita (DRESS), Henoch-Schonleinin purppura, akne, akuutti yleistynyt eksantematoottinen pustuloosi
Verisuoni: Verenvuoto
HUUMEIDEN VUOROVAIKUTUKSET
BIAXIN 250 mg:n samanaikaisen antamisen tiedetään estävän CYP3A:ta, ja ensisijaisesti CYP3A:n kautta metaboloituvaan lääkkeeseen saattaa liittyä lääkepitoisuuksien nousua, mikä voi lisätä tai pidentää samanaikaisen lääkkeen sekä terapeuttisia että haittavaikutuksia.
BIAXINia tulee käyttää varoen potilailla, jotka saavat hoitoa muilla lääkkeillä, joiden tiedetään olevan CYP3A-entsyymin substraatteja, varsinkin jos CYP3A-substraatilla on kapea turvallisuusmarginaali (esim. karbamatsepiini) ja/tai substraatti metaboloituu laajalti tämän entsyymin vaikutuksesta. Säädä annosta tarvittaessa ja seuraa tarkasti CYP3A:n kautta metaboloituvien lääkkeiden pitoisuutta seerumissa potilailla, jotka saavat samanaikaisesti klaritromysiiniä.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Akuutit yliherkkyysreaktiot
Jos ilmenee vakavia akuutteja yliherkkyysreaktioita, kuten anafylaksia, Stevens-Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi, lääkeihottuma, johon liittyy eosinofiliaa ja systeemisiä oireita (DRESS), Henoch-Schonleinin purppura ja akuutti yleistynyt eksantematoottinen pustuloosi, lopeta BIAXIN-hoito välittömästi250 aloittaa asianmukainen hoito.
QT-ajan pidentyminen
BIAXIN 500 mg on yhdistetty QT-ajan pidentymiseen ja harvoin rytmihäiriötapauksiin. Torsades de pointes -tapauksia on raportoitu spontaanisti markkinoille tulon jälkeisen seurannan aikana potilailla, jotka ovat saaneet BIAXINia. Kuolemantapauksia on raportoitu.
Vältä BIAXINia seuraavilla potilailla:
- potilaat, joilla tiedetään pidentynyt QT-aika, kammioperäinen sydämen rytmihäiriö, mukaan lukien torsades de pointes
- potilaat, jotka saavat lääkkeitä, joiden tiedetään pidentävän QT-aikaa [katso myös VASTA-AIHEET ]
- potilaat, joilla on meneillään olevia rytmihäiriöitä, kuten korjaamaton hypokalemia tai hypomagnesemia, kliinisesti merkittävä bradykardia ja potilaat, jotka saavat luokan IA (esim. kinidiini, prokaiiniamidi, disopyramidi) tai luokan III (esim. dofetilidi, amiodaroni, sotaloli) rytmihäiriölääkkeitä.
Iäkkäät potilaat voivat olla herkempiä lääkkeisiin liittyville vaikutuksille QT-välissä [katso Käyttö tietyissä populaatioissa ].
Maksatoksisuus
Klaritromysiinin käytön yhteydessä on raportoitu maksan toimintahäiriöitä, mukaan lukien maksaentsyymiarvojen nousua, ja hepatosellulaarista ja/tai kolestaattista hepatiittia, johon liittyy tai ei ole keltaisuutta. Tämä maksan toimintahäiriö voi olla vakava ja yleensä palautuva. Joissakin tapauksissa on raportoitu kuolemaan johtanutta maksan vajaatoimintaa, ja se on yleensä yhdistetty vakaviin perussairauksiin ja/tai samanaikaisiin lääkkeisiin. Hepatiitin oireita voivat olla anoreksia, keltaisuus, tumma virtsa, kutina tai arka vatsa. Lopeta BIAXIN 500 mg -hoito välittömästi, jos hepatiitin merkkejä ja oireita ilmaantuu.
Vakavat haittavaikutukset, jotka johtuvat samanaikaisesta käytöstä muiden lääkkeiden kanssa
CYP3A4:n metaboloimat lääkkeet
Vakavia haittavaikutuksia on raportoitu potilailla, jotka ovat käyttäneet BIAXINia samanaikaisesti CYP3A4-substraattien kanssa. Näitä ovat kolkisiinin toksisuus kolkisiinin kanssa; rabdomyolyysi simvastatiinilla, lovastatiinilla ja atorvastatiinilla; hypoglykemia ja sydämen rytmihäiriöt (esim. torsades de pointes) disopyramidilla; hypotensio ja akuutti munuaisvaurio CYP3A4:n kautta metaboloituvien kalsiumkanavasalpaajien (esim. verapamiili, amlodipiini, diltiatseemi, nifedipiini) kanssa. Useimmat raportit akuuteista munuaisvaurioista CYP3A4:n kautta metaboloituvien kalsiumkanavasalpaajien aiheuttamista iäkkäistä, vähintään 65-vuotiaista potilaista. Käytä BIAXIN 500 mg varoen, kun sitä annetaan samanaikaisesti sytokromi CYP3A4-entsyymiä indusoivien lääkkeiden kanssa. BIAXIN 250 mg:n käyttö simvastatiinin, lovastatiinin, ergotamiinin tai dihydroergotamiinin kanssa on vasta-aiheista [ks. VASTA-AIHEET ja HUUMEIDEN VUOROVAIKUTUKSET ].
Kolkisiini
Henkeä uhkaavia ja kuolemaan johtavia lääkkeiden yhteisvaikutuksia on raportoitu potilailla, joita on hoidettu BIAXINilla ja kolkisiinilla. Klaritromysiini on vahva CYP3A4:n estäjä, ja tämä yhteisvaikutus saattaa ilmetä käytettäessä molempia lääkkeitä niiden suositelluilla annoksilla. Jos BIAXINin ja kolkisiinin samanaikainen käyttö on välttämätöntä potilaille, joilla on normaali munuaisten ja maksan toiminta, pienennä kolkisiinin annosta. Seuraa potilaita kolkisiinin toksisuuden kliinisten oireiden varalta. BIAXIN 500 mg:n ja kolkisiinin samanaikainen anto on vasta-aiheista potilailla, joilla on munuaisten tai maksan vajaatoiminta (ks. VASTA-AIHEET ja HUUMEIDEN VUOROVAIKUTUKSET ].
HMG-CoA-reduktaasin estäjät (statiinit)
BIAXINin samanaikainen käyttö lovastatiinin tai simvastatiinin kanssa on vasta-aiheista [katso VASTA-AIHEET ], koska nämä statiinit metaboloituvat laajalti CYP3A4:n vaikutuksesta, ja samanaikainen BIAXIN-hoito lisää niiden pitoisuutta plasmassa, mikä lisää myopatian, mukaan lukien rabdomyolyysin, riskiä. Rabdomyolyysitapauksia on raportoitu potilailla, jotka ovat käyttäneet BIAXINia samanaikaisesti näiden statiinien kanssa. Jos BIAXIN-hoitoa ei voida välttää, lovastatiini- tai simvastatiinihoito on keskeytettävä hoidon ajaksi.
Noudata varovaisuutta, kun määräät BIAXIN 250 mg:aa yhdessä atorvastatiinin tai pravastatiinin kanssa. Tilanteissa, joissa BIAXINin samanaikaista käyttöä atorvastatiinin tai pravastatiinin kanssa ei voida välttää, atorvastatiinin vuorokausiannos ei saa ylittää 20 mg:aa ja pravastatiiniannos ei saa ylittää 40 mg vuorokaudessa. Sellaisen statiinin käyttöä, joka ei ole riippuvainen CYP3A-metaboliasta (esim. fluvastatiini), voidaan harkita. On suositeltavaa määrätä pienin rekisteröity annos, jos samanaikaista käyttöä ei voida välttää.
Suun kautta otettavat hypoglykeemiset aineet/insuliini
BIAXIN 500 mg:n samanaikainen käyttö oraalisten hypoglykeemisten aineiden ja/tai insuliinin kanssa voi johtaa merkittävään hypoglykemiaan. Tietyt hypoglykeemiset lääkkeet, kuten nateglinidi, pioglitatsoni, repaglinidi ja rosiglitatsoni, voivat aiheuttaa CYP3A-entsyymin estoa klaritromysiinin toimesta ja voivat aiheuttaa hypoglykemiaa, jos niitä käytetään samanaikaisesti. Glukoosin huolellista seurantaa suositellaan [ks HUUMEIDEN VUOROVAIKUTUKSET ].
Ketiapiini
Käytä ketiapiinia ja klaritromysiiniä samanaikaisesti varoen. Samanaikainen käyttö voi lisätä ketiapiinialtistusta ja ketiapiiniin liittyviä toksisuusvaikutuksia, kuten uneliaisuutta, ortostaattista hypotensiota, tajunnantilan muutoksia, maligni neuroleptisyndroomaa ja QT-ajan pidentymistä. Katso ketiapiinin määräämistä koskevista tiedoista suosituksia annoksen pienentämiseksi, jos sitä annetaan samanaikaisesti CYP3A4-estäjien, kuten klaritromysiinin kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Oraaliset antikoagulantit
Vakavan verenvuodon ja INR:n ja protrombiiniajan merkittävän nousun riski on olemassa, kun BIAXINia annetaan samanaikaisesti varfariinin kanssa. Seuraa INR- ja protrombiiniaikoja usein, kun potilaat saavat samanaikaisesti BIAXINia ja oraalisia antikoagulantteja [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Bentsodiatsepiinit
Lisääntynyttä sedaatiota ja sedaation pidentymistä on raportoitu BIAXIN 250 mg:n ja triatsolobentsodiatsepiinien, kuten triatsolaamin ja midatsolaamin, samanaikaisen käytön yhteydessä [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Sepelvaltimotautia sairastavien potilaiden kokonaiskuolleisuus 1–10 vuotta BIAXIN-altistuksen jälkeen
Yhdessä kliinisessä tutkimuksessa, jossa arvioitiin klaritromysiinihoidon tuloksia sepelvaltimotautia sairastavilla potilailla, kokonaiskuolleisuuden riskin lisääntyminen vähintään vuoden kuluttua hoidon päättymisestä havaittiin potilailla, jotka satunnaistettiin saamaan klaritromysiiniä.1 Klaritromysiini sepelvaltimotautien hoitoon valtimotauti ei ole hyväksytty käyttöaihe. Lisääntyneen riskin syytä ei ole selvitetty. Muut epidemiologiset tutkimukset, jotka arvioivat tätä riskiä, ovat osoittaneet vaihtelevia tuloksia [katso HAITTAVAIKUTUKSET ]. Harkitse tämän mahdollisen riskin ja hoidon hyötyjen tasapainottamista, kun määräät BIAXINia potilaille, joilla on epäilty tai vahvistettu sepelvaltimotauti.
Clostridium Difficilen liittyvä ripuli
Clostridium difficileen liittyvää ripulia (CDAD) on raportoitu käytettäessä lähes kaikkia antibakteerisia aineita, mukaan lukien BIAXIN, ja sen vaikeusaste voi vaihdella lievästä ripulista kuolemaan johtavaan paksusuolentulehdukseen. Hoito antibakteerisilla aineilla muuttaa paksusuolen normaalia kasvillisuutta, mikä johtaa C. difficilen liikakasvuun.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CDAD:n kehittymistä. Hypertoksiinia tuottavat C. difficilen kannat lisäävät sairastuvuutta ja kuolleisuutta, koska nämä infektiot voivat olla vastustuskykyisiä antimikrobiselle hoidolle ja saattavat vaatia kolektomiaa. CDAD on otettava huomioon kaikilla potilailla, joilla on ripulia antibakteeristen lääkkeiden käytön jälkeen. Huolellinen sairaushistoria on tarpeen, koska CDAD:n on raportoitu esiintyvän yli kaksi kuukautta antibakteeristen aineiden annon jälkeen.
Jos CDAD epäillään tai varmistetaan, jatkuva antibakteerinen käyttö, joka ei ole suunnattu C. difficileä vastaan, saattaa olla tarpeen lopettaa. Asianmukainen neste- ja elektrolyyttihallinta, proteiinilisä, C. difficilen antibakteerinen hoito ja kirurginen arviointi tulee aloittaa kliinisen tarpeen mukaan.
Alkion ja sikiön myrkyllisyys
Klaritromysiiniä ei tule käyttää raskaana oleville naisille paitsi kliinisissä olosuhteissa, joissa vaihtoehtoinen hoito ei ole sopiva. Jos BIAXIN 500mg -valmistetta käytetään raskauden aikana tai jos potilas tulee raskaaksi, kun potilas käyttää tätä lääkettä, potilasta on informoitava mahdollisesta vaarasta sikiölle. Klaritromysiini on osoittanut haitallisia vaikutuksia raskauden lopputulokseen ja/tai alkion ja sikiön kehitykseen apinoilla, rotilla, hiirillä ja kaniineilla annoksilla, jotka tuottivat plasman pitoisuudet 2-17 kertaa ihmisillä saavutettuihin seerumipitoisuuksiin verrattuna ihmisille suositelluilla enimmäisannoksilla [ks. Käyttö tietyissä populaatioissa ].
Myasthenia Gravisin paheneminen
Myasthenia graviksen oireiden pahenemista ja uusia myasteenisen oireyhtymän oireita on raportoitu potilailla, jotka ovat saaneet BIAXIN 250 mg -hoitoa.
Lääkeresistenttien bakteerien kehittäminen
BIAXIN-valmisteen määrääminen ilman todistettua tai vahvasti epäiltyä bakteeri-infektiota tai profylaktista indikaatiota ei todennäköisesti hyödytä potilasta ja lisää lääkeresistenttien bakteerien kehittymisen riskiä.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Seuraavat in vitro mutageenisuustestit on suoritettu klaritromysiinillä:
- Salmonella/nisäkkään mikrosomitesti
- Bakteerien aiheuttaman mutaatiotaajuustesti
- In vitro kromosomipoikkeamatesti
- Rotan hepatosyyttien DNA-synteesimääritys
- Hiiren lymfoomamääritys
- Mouse Dominant Lethal Study
- Hiiren mikronukleustesti
Kaikista testeistä saatiin negatiiviset tulokset paitsi in vitro kromosomipoikkeamatestissä, joka oli positiivinen yhdessä ja negatiivinen toisessa. Lisäksi klaritromysiinimetaboliiteille on tehty bakteerien käänteismutaatiotesti (Ames-testi) negatiivisin tuloksin.
Hedelmällisyyden heikkeneminen
Hedelmällisyys- ja lisääntymistutkimukset ovat osoittaneet, että uros- ja naarasrotilla jopa 160 mg/kg/kg/vrk annokset eivät aiheuttaneet haitallisia vaikutuksia kiimakiertoon, hedelmällisyyteen, synnytykseen tai jälkeläisten lukumäärään ja elinkykyyn. Rottien plasmatasot annoksen 150 mg/kg/vrk jälkeen olivat kaksi kertaa ihmisen seerumipitoisuudet.
Kivesatrofiaa esiintyi rotilla 7-kertaisilla annoksilla, koirilla 3-kertaisilla annoksilla ja apinoilla 8 kertaa suuremmilla annoksilla kuin ihmisen enimmäisvuorokausiannos (kehon pinta-alan perusteella).
Käyttö tietyissä populaatioissa
Raskaus
Teratogeeniset vaikutukset
Raskausluokka C
Klaritromysiiniä ei tule käyttää raskaana oleville naisille paitsi kliinisissä olosuhteissa, joissa vaihtoehtoinen hoito ei ole sopiva. Jos raskaus tulee tämän lääkkeen käytön aikana, potilaalle on kerrottava mahdollisesta vaarasta sikiölle [katso VAROITUKSET JA VAROTOIMET ].
Neljä teratogeenisuustutkimusta rotilla (kolme oraalisilla annoksilla ja yksi laskimonsisäisillä annoksilla, jotka annettiin korkeintaan 160 mg/kg/vrk suuren organogeneesin aikana) ja kaksi kaniineilla suun kautta annetuilla annoksilla enintään 125 mg/kg/vrk (noin kaksinkertainen ihmisille suositeltu enimmäisannos, joka perustuu mg/m²) tai suonensisäiset annokset 30 mg/kg/vrk raskauspäivinä 6–18, eivät osoittaneet klaritromysiinin teratogeenisuutta. Kaksi muuta oraalista tutkimusta eri rottakannassa samanlaisilla annoksilla ja samanlaisilla olosuhteilla osoittivat kardiovaskulaaristen poikkeavuuksien vähäisen ilmaantuvuuden annoksilla 150 mg/kg/vrk 6-15 raskauspäivinä.
Plasman tasot annoksen 150 mg/kg/vrk jälkeen olivat kaksi kertaa ihmisen seerumipitoisuudet. Neljä hiirillä tehtyä tutkimusta osoitti suulakihalkeamaa vaihtelevan 1000 mg/kg/vrk (2 ja 4 kertaa ihmisen suositeltu enimmäisannos mg/m2:n perusteella) tiineyspäivien 6–15 aikana. annoksella 500 mg/kg/vrk. Altistus 1000 mg/kg/vrk johti 17 kertaa ihmisen seerumipitoisuuteen verrattuna. Apinoilla oraalinen annos 70 mg/kg/vrk aiheutti sikiön kasvun hidastumista plasmassa, joka oli kaksinkertainen ihmisen seerumipitoisuuteen verrattuna.
Imettävät äidit
Varovaisuutta on noudatettava, kun BIAXINia annetaan imettäville naisille. Äidinmaidon ruokinnan kehitys- ja terveyshyötyjä tulee harkita sekä äidin kliinistä BIAXIN-tarvetta ja mahdollisia haitallisia vaikutuksia äidinmaidolla ruokittavaan lapseen lääkkeestä tai äidin taustalla olevasta tilasta.
Klaritromysiini ja sen aktiivinen metaboliitti 14-hydroksiklaritromysiini erittyvät äidinmaitoon. Seerumi- ja maitonäytteet otettiin kolmen päivän hoidon jälkeen vakaassa tilassa yhdestä julkaistusta tutkimuksesta, jossa oli 12 imettävää naista, jotka ottivat BIAXINia 250 mg suun kautta kahdesti päivässä. Tämän tutkimuksen rajallisten tietojen perusteella ja olettaen maidon kulutuksen olevan 150 ml/kg/vrk, yksinomaan äidinmaidolla ruokittu pikkulapsi saisi arviolta keskimäärin 136 mcg/kg/vrk klaritromysiiniä ja sen aktiivista metaboliittia tällä äidin annoksella. hoito-ohjelma. Tämä on alle 2 % äidin painon mukaan mukautetusta annoksesta (7,8 mg/kg/vrk, äidin keskimääräisen painon 64 kg perusteella) ja alle 1 % lasten annoksesta (15 mg/kg/vrk) yli 6 kuukauden ikäiset lapset.
Prospektiivista havainnointitutkimusta, jossa oli 55 rintaruokittua vauvaa, joiden äidit käyttivät makrolidiantibakteerilääkettä (6 altistettiin klaritromysiinille), verrattiin 36 amoksisilliiniä saaneiden äitien imetettyyn lapseen. Haittavaikutukset olivat vertailukelpoisia molemmissa ryhmissä. Haittavaikutuksia esiintyi 12,7 %:lla makrolideille altistuneista imeväisistä, ja niihin kuuluivat ihottuma, ripuli, ruokahaluttomuus ja uneliaisuus.
Käyttö lapsille
BIAXIN Filmtab ja BIAXIN 500 mg rakeiden turvallisuus ja tehokkuus on osoitettu seuraavien tilojen tai sairauksien hoitoon 6 kuukauden ikäisillä ja sitä vanhemmilla lapsipotilailla. Käyttö näissä käyttöaiheissa perustuu kliinisiin tutkimuksiin lapsipotilailla tai riittäviin ja hyvin kontrolloituihin aikuisilla tehtyihin tutkimuksiin, joissa on lisää farmakokineettisiä ja turvallisuustietoja lapsipotilailla:
- Nielutulehdus/tonsilliitti
- Yhteisön hankkima keuhkokuume
- Akuutti poskiontelotulehdus
- Akuutti välikorvantulehdus [katso Kliiniset tutkimukset ]
- Komplisoitumattomat iho- ja ihorakenteen infektiot
BIAXIN 500 mg Filmtab- ja BIAXIN 500 mg rakeiden turvallisuus ja tehokkuus on osoitettu levinneen Mycobacterium avium complex (MAC) -taudin ehkäisyyn 20 kuukauden ikäisillä ja sitä vanhemmilla lapsipotilailla, joilla on pitkälle edennyt HIV-infektio. BIAXIN-valmisteesta ei ole tehty tutkimuksia MAC-profylaksiaa varten lapsipotilailla, ja ennaltaehkäisyyn suositellut annokset on johdettu MAC-lasten hoitotutkimuksista.
BIAXIN 500 mg XL Filmtabin turvallisuutta ja tehokkuutta lapsipotilaiden hoidossa ei ole osoitettu.
BIAXIN 250 mg:n turvallisuutta ja tehokkuutta alle 6 kuukauden ikäisillä lapsipotilailla ei ole osoitettu. BIAXIN 500 mg:n turvallisuutta ei ole tutkittu alle 20 kuukauden ikäisillä MAC-potilailla.
Geriatrinen käyttö
Vakaan tilan tutkimuksessa, jossa terveille iäkkäille koehenkilöille (65-81-vuotiaat) annettiin 500 mg BIAXINia 12 tunnin välein, klaritromysiinin ja 14-OH-klaritromysiinin maksimipitoisuudet seerumissa ja käyrien alla oleva pinta-ala kasvoivat verrattuna jotka saavutetaan terveillä nuorilla aikuisilla. Nämä farmakokinetiikan muutokset ovat rinnakkain ikääntymiseen liittyvien munuaisten toiminnan heikkenemisen kanssa. Kliinisissä tutkimuksissa iäkkäillä potilailla ei esiintynyt enemmän haittavaikutuksia kuin nuoremmilla potilailla. Harkitse annoksen muuttamista iäkkäillä potilailla, joilla on vaikea munuaisten vajaatoiminta. Iäkkäät potilaat voivat olla alttiimpia torsades de pointes -rytmihäiriöille kuin nuoremmat potilaat [ks. VAROITUKSET JA VAROTOIMET ].
Useimmat raportit akuuteista munuaisvaurioista CYP3A4:n kautta metaboloituvien kalsiumkanavasalpaajien (esim. verapamiili, amlodipiini, diltiatseemi, nifedipiini) aiheuttamista iäkkäistä, vähintään 65-vuotiaista potilaista [ks. VAROITUKSET JA VAROTOIMET ].
Erityisesti iäkkäillä potilailla on raportoitu kolkisiinitoksisuutta klaritromysiinin ja kolkisiinin samanaikaisen käytön yhteydessä, joista osa esiintyi potilailla, joilla on munuaisten vajaatoiminta. Joillakin potilailla on raportoitu kuolemantapauksia [katso VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
Munuaisten ja maksan vajaatoiminta
BIAXIN 500 mg erittyy pääasiassa maksan ja munuaisten kautta. BIAXIN-valmistetta voidaan antaa ilman annosmuutosta potilaille, joilla on maksan vajaatoiminta ja normaali munuaisten toiminta. Kuitenkin, jos kyseessä on vaikea munuaisten vajaatoiminta, johon liittyy tai ei ole samanaikaisesti maksan vajaatoimintaa, annoksen pienentäminen tai annosteluvälien pidentäminen voi olla tarkoituksenmukaista [ks. ANNOSTELU JA HALLINNOINTI ].
VIITTEET
1. Winkel P, Hilden J, Hansen JF, Kastrup J, Kolmos HJ, Kjøller E, et ai. Klaritromysiini stabiilin sepelvaltimotaudin hoitoon lisää kaikista syistä johtuvaa ja sydän- ja verisuoniperäistä kuolleisuutta ja aivoverisuonisairautta yli 10 vuoden ajan satunnaistetussa, sokkoutetussa kliinisessä CLARICOR-tutkimuksessa. Int J Cardiol 2015;182:459-65.
YLIANNOSTUS
BIAXINin yliannostus voi aiheuttaa maha-suolikanavan oireita, kuten vatsakipua, oksentelua, pahoinvointia ja ripulia.
Hoida yliannostukseen liittyviä haittavaikutuksia eliminoimalla nopeasti imeytymätön lääke ja tukitoimenpiteillä. Kuten muidenkin makrolidien, hemodialyysin tai peritoneaalidialyysin ei odoteta vaikuttavan merkittävästi BIAXINin seerumipitoisuuksiin.
VASTA-AIHEET
Yliherkkyys
BIAXIN on vasta-aiheinen potilailla, jotka ovat yliherkkiä klaritromysiinille, erytromysiinille tai jollekin makrolidiantibakteeriselle lääkkeelle (ks. VAROITUKSET JA VAROTOIMET ].
Sydämen rytmihäiriöt
BIAXINin samanaikainen anto sisapridin ja pimotsidin kanssa on vasta-aiheista (ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Markkinoille tulon jälkeen on raportoitu lääkkeiden yhteisvaikutuksista, kun klaritromysiiniä on annettu yhdessä sisapridin tai pimotsidin kanssa, mikä on johtanut sydämen rytmihäiriöihin (QT-ajan pidentyminen, kammiotakykardia, kammiovärinä ja torsades de pointes), mikä johtuu todennäköisimmin BIAXINin aiheuttamasta näiden lääkkeiden metaboliasta. . Kuolemantapauksia on raportoitu.
Kolestaattinen keltaisuus / maksan toimintahäiriö
BIAXIN on vasta-aiheinen potilailla, joilla on aiemman klaritromysiinin käytön yhteydessä esiintynyt kolestaattinen keltaisuus tai maksan toimintahäiriö.
Kolkisiini
BIAXINin ja kolkisiinin samanaikainen käyttö on vasta-aiheista potilailla, joilla on munuaisten tai maksan vajaatoiminta.
HMG-CoA-reduktaasin estäjät
Älä käytä BIAXINia samanaikaisesti HMG-CoA-reduktaasin estäjien (statiinien) kanssa, jotka metaboloituvat laajalti CYP3A4:n (lovastatiini tai simvastatiini) kautta, koska myopatian, mukaan lukien rabdomyolyysi, riski on lisääntynyt (ks. VAROITUKSET JA VAROTOIMET ja HUUMEIDEN VUOROVAIKUTUKSET ].
Ergot-alkaloidit
Klaritromysiinin ja ergotamiinin tai dihydroergotamiinin samanaikainen anto on vasta-aiheista (ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Vasta-aiheet samanaikaisesti käytettäville lääkkeille
Lisätietoja muiden BIAXINin kanssa yhdistettyjen lääkkeiden vasta-aiheista on niiden täydellisissä ohjetiedoissa (vasta-aiheet-osiossa).
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Klaritromysiini on makrolidiantimikrobinen lääke [katso Mikrobiologia ].
Farmakokinetiikka
Imeytyminen
BIAXIN 250 mg Filmtab välittömästi vapautuvat tabletit
250 mg:n klaritromysiinitablettien absoluuttinen hyötyosuus oli noin 50 %. 500 mg:n kerta-annoksella klaritromysiiniä ruoka hidastaa hieman klaritromysiinin imeytymisen alkamista, mikä pidentää huippuaikaa noin 2 tunnista 2,5 tuntiin. Ruoka myös lisää klaritromysiinin huippupitoisuutta plasmassa noin 24 %, mutta ei vaikuta klaritromysiinin hyötyosuuteen. Ruoka ei vaikuta aktiivisen metaboliitin, 14-OH-klaritromysiinin, muodostumisen alkamiseen tai sen huippupitoisuuteen plasmassa, mutta se vähentää hieman metaboliitin muodostumisen laajuutta, mitä osoittaa 11 %:n pieneneminen plasman pitoisuus-aikakäyrän alla (AUC) . Siksi BIAXIN Filmtab voidaan antaa ruokailusta riippumatta. Terveillä ihmisillä, jotka eivät olleet paastonneet (miehet ja naiset), huippupitoisuudet plasmassa saavutettiin 2–3 tunnin kuluessa suun kautta ottamista.
BIAXIN 500mg XL Filmtab pitkittyneesti vapauttavat tabletit
Klaritromysiini-pitkävaikutteiset tabletit mahdollistavat klaritromysiinin pidennetyn imeytymisen maha-suolikanavasta oraalisen annon jälkeen. Suhteessa yhtä suureen päivittäiseen kokonaisannokseen välittömästi vapautuvia klaritromysiinitabletteja, klaritromysiini-depottabletit tarjoavat alhaisemmat ja myöhemmin vakaan tilan huippupitoisuudet plasmassa, mutta vastaavat 24 tunnin AUC-arvoja sekä klaritromysiinille että sen mikrobiologisesti aktiiviselle metaboliitille, 14-OH-klaritromysiinille. Vaikka ruoka ei vaikuta 14-OH-klaritromysiinin muodostumiseen BIAXIN 500 mg XL Filmtabin (2 x 500 mg tablettia kerran vuorokaudessa) annon jälkeen, paasto-olosuhteissa antoon liittyy noin 30 % pienempi klaritromysiinin AUC verrattuna ruoan kanssa annettuun. . Siksi BIAXIN 250mg XL Filmtab tulee ottaa ruoan kanssa.
Kuva 2: Vakaan tilan klaritromysiiniplasman pitoisuus-aikaprofiilit 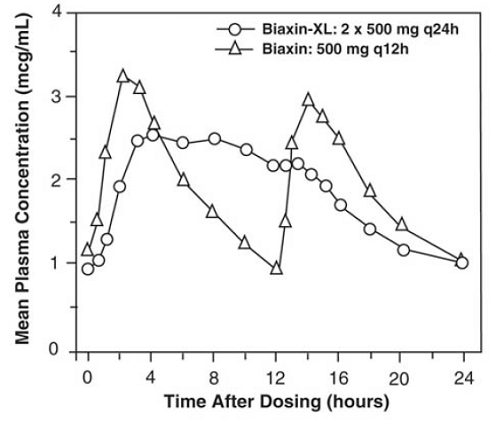
BIAXIN-rakeet oraalisuspensiota varten
Kun 250 mg:n annoksia klaritromysiiniä BIAXIN-valmisteena oraalisuspensiona annettiin terveille aikuisille paastohenkilöille, huippupitoisuudet plasmassa saavutettiin noin 3 tunnin kuluttua annostelusta.
Aikuisilla potilailla 10 ml:n 125 mg/5 ml suspensiota tai 10 ml:n 250 mg/5 ml suspensiota biologinen hyötyosuus on samanlainen kuin 250 mg:n tai 500 mg:n tabletilla.
Aikuisilla, joille annettiin 250 mg klaritromysiiniä suspensiona (n = 22), ruoka näytti pienentävän plasman klaritromysiinin huippupitoisuuksia 1,2 (± 0,4) mcg/ml:sta 1,0 (± 0,4) mikrogrammaan/ml ja imeytymisastetta 7,2:sta (± 0,4) mikrogrammaan/ml. 2,5) h•mcg/ml - 6,5 (± 3,7) h•mcg/ml.
Jakelu
Klaritromysiini ja 14-OH-klaritromysiinin metaboliitti jakautuvat helposti kehon kudoksiin ja nesteisiin. Tietoja aivo-selkäydinnesteen tunkeutumisesta ei ole saatavilla. Korkeiden solunsisäisten pitoisuuksien vuoksi kudospitoisuudet ovat korkeampia kuin seerumipitoisuudet. Esimerkkejä kudos- ja seerumipitoisuuksista on esitetty alla.
Aineenvaihdunta ja eliminaatio
BIAXIN 500 mg Filmtab välittömästi vapautuvat tabletit
Vakaan tilan huippuplasman klaritromysiinipitoisuudet saavutettiin 3 vuorokaudessa ja olivat noin 1 mcg/ml - 2 mcg/ml 250 mg:n annoksella 12 tunnin välein ja 3 mcg/ml - 4 mcg/ml 500 mg:n annoksella joka kerta. 8 tunnista 12 tuntiin. Klaritromysiinin eliminaation puoliintumisaika oli noin 3 tunnista 4 tuntiin, kun 250 mg annettiin 12 tunnin välein, mutta piteni 5 tunnista 7 tuntiin, kun 500 mg annettiin 8-12 tunnin välein. Klaritromysiinin farmakokinetiikan epälineaarisuus on vähäistä suositelluilla annoksilla 250 mg ja 500 mg annettuna 8–12 tunnin välein. Kun annostus on 250 mg 12 tunnin välein, päämetaboliitti, 14-OH-klaritromysiini, saavuttaa vakaan tilan huippupitoisuuden noin 0,6 mcg/ml ja sen eliminaation puoliintumisaika on 5-6 tuntia. Käytettäessä 500 mg 8–12 tunnin välein 14-OH-klaritromysiinin vakaan tilan huippupitoisuus on hieman korkeampi (jopa 1 mcg/ml), ja sen eliminaation puoliintumisaika on noin 7–9 tuntia. Millä tahansa näistä annosteluohjelmista tämän metaboliitin vakaan tilan pitoisuus saavutetaan yleensä 3–4 päivässä.
Kun 250 mg:n tabletti on otettu 12 tunnin välein, noin 20 % annoksesta erittyy virtsaan klaritromysiininä, kun taas 500 mg:n tabletin jälkeen 12 tunnin välein klaritromysiinin erittyminen virtsaan on jonkin verran suurempi, noin 30 %. Vertailun vuoksi, oraalisen 250 mg:n (125 mg/5 ml) suspension annoksen jälkeen 12 tunnin välein noin 40 % erittyy virtsaan klaritromysiininä. Klaritromysiinin munuaispuhdistuma on kuitenkin suhteellisen riippumaton annoksen koosta ja vastaa suunnilleen normaalia glomerulussuodatusnopeutta. Pääasiallinen virtsasta löydetty metaboliitti on 14-OH-klaritromysiini, jonka osuus annoksesta on lisäksi 10–15 %, kun joko 250 mg:n tai 500 mg:n tabletti annetaan 12 tunnin välein.
BIAXIN 250 mg XL Filmtab pitkittyvästi vapauttavat tabletit
Terveillä ihmisillä plasman vakaan tilan huippupitoisuudet, noin 2 mcg/ml - 3 mcg/ml, saavutettiin noin 5 - 8 tunnin kuluttua 1000 mg BIAXIN 250 mg XL Filmtab -annoksen oraalisen annon jälkeen kerran vuorokaudessa; 14-OH-klaritromysiinin vakaan tilan huippupitoisuudet plasmassa, noin 0,8 mcg/ml, saavutettiin noin 6-9 tunnin kuluttua annostelusta. Vakaan tilan huippuplasman klaritromysiinipitoisuudet, noin 1 mcg/ml - 2 mcg/ml, saavutettiin noin 5 - 6 tunnin kuluttua kerta-annoksen 500 mg BIAXIN XL Filmtab suun kautta kerran vuorokaudessa; 14-OH-klaritromysiinin vakaan tilan huippupitoisuudet plasmassa, noin 0,6 mcg/ml, saavutettiin noin 6 tunnin kuluttua annostelusta.
Vakaan tilan huippupitoisuudet plasmassa saavutettiin 2–3 päivässä ja olivat noin 2 mcg/ml klaritromysiinillä ja 0,7 mcg/ml 14-OH-klaritromysiinillä, kun 250 mg:n annoksia klaritromysiinisuspensiota annettiin 12 tunnin välein. Klaritromysiinin eliminaation puoliintumisaika (3 tuntia - 4 tuntia) ja 14-OH-klaritromysiinin eliminaation puoliintumisaika (5 tuntia - 7 tuntia) olivat samanlaiset kuin vakaassa tilassa vastaavien BIAXIN Filmtab -annosten antamisen jälkeen.
Tietyt populaatiot BIAXIN Filmtab-, BIAXIN 500 mg XL Filmtab- ja BIAXIN 250 mg raevalmisteille
BIAXIN-rakeet oraalisuspensioon lapsipotilaille
Klaritromysiini tunkeutuu välikorvan nesteeseen lapsipotilailla, joilla on erittävä välikorvatulehdus.
Kun lapsipotilaille (n = 10) annettiin kerta-annos 7,5 mg/kg BIAXIN 500 mg oraalisuspensiona, ruoka nosti plasman klaritromysiinin keskimääräisiä huippupitoisuuksia 3,6 (± 1,5) mikrogrammasta/ml arvoon 4,6 (± 2,8) mikrogrammaa/ml. ml ja absorption laajuus 10,0 (± 5,5) h•mcg/ml arvoon 14,2 (± 9,4) h•mcg/ml.
Lapsipotilailla, jotka tarvitsevat antibakteerista hoitoa, 7,5 mg/kg BIAXINin antaminen 12 tunnin välein oraalisuspensiona johti yleensä vakaan tilan huippupitoisuuksiin plasmassa 3 mcg/ml - 7 mcg/ml klaritromysiinille ja 1 mcg/ml - 2 mcg/ml 14-OH-klaritromysiinille.
HIV-tartunnan saaneilla lapsipotilailla, jotka ottivat 15 mg/kg BIAXINia oraalisuspensiona 12 tunnin välein, vakaan tilan klaritromysiinin huippupitoisuudet vaihtelivat yleensä välillä 6 mcg/ml - 15 mcg/ml.
HIV-infektio
Klaritromysiinin ja 14-OH-klaritromysiinin vakaan tilan pitoisuudet, jotka havaittiin annettaessa 500 mg:n klaritromysiiniannoksia 12 tunnin välein HIV-infektiota sairastaville aikuispotilaille, olivat samanlaiset kuin terveillä vapaaehtoisilla. Aikuisilla HIV-tartunnan saaneilla potilailla, jotka ottivat 500 mg:n tai 1000 mg:n annoksia klaritromysiiniä 12 tunnin välein, vakaan tilan Cmax-arvot vaihtelivat välillä 2 mcg/ml-4 mcg/ml ja 5 mcg/ml-10 mcg/ml. .
Maksan vajaatoiminta
Klaritromysiinin vakaan tilan pitoisuudet potilailla, joilla oli maksan vajaatoiminta, eivät eronneet normaaleista koehenkilöistä; 14-OH-klaritromysiinipitoisuudet olivat kuitenkin alhaisemmat maksan vajaatoimintapotilailla. 14-OH-klaritromysiinin muodostumisen vähentymistä tasoitti ainakin osittain klaritromysiinin munuaispuhdistuman lisääntyminen potilailla, joilla oli maksan vajaatoiminta terveisiin koehenkilöihin verrattuna.
Munuaisten vajaatoiminta
Klaritromysiinin farmakokinetiikka muuttui myös potilailla, joilla oli heikentynyt munuaisten toiminta [ks. Käyttö tietyissä populaatioissa ja ANNOSTELU JA HALLINNOINTI ].
Huumeiden vuorovaikutukset
Flukonatsoli
Kun 21 terveelle vapaaehtoiselle annettiin flukonatsolia 200 mg vuorokaudessa ja klaritromysiiniä 500 mg kahdesti vuorokaudessa, vakaan tilan klaritromysiinin Cmin nousi 33 % ja AUC 18 %. Klaritromysiinialtistus suureni, eikä flukonatsolin samanaikainen anto vaikuttanut merkittävästi 14-OH-klaritromysiinin vakaan tilan pitoisuuksiin.
Kolkisiini
Kun kerta-annos 0,6 mg kolkisiinia annettiin yhdessä klaritromysiinin kanssa 250 mg kahdesti vuorokaudessa 7 päivän ajan, kolkisiinin Cmax nousi 197 % ja AUC0-∞ nousi 239 % verrattuna pelkän kolkisiinin antamiseen.
Atatsanaviiri
Kun klaritromysiiniä (500 mg kahdesti vuorokaudessa) annettiin yhdessä atatsanaviirin (400 mg kerran vuorokaudessa) kanssa, klaritromysiinin AUC kasvoi 94 %, 14-OH-klaritromysiinin AUC pieneni 70 % ja atatsanaviirin AUC kasvoi 28 %.
Ritonaviiri
Klaritromysiinin ja ritonaviirin (n = 22) samanaikainen anto johti klaritromysiinin AUC-arvon nousuun 77 % ja 14-OH-klaritromysiinin AUC-arvon pienenemiseen 100 %.
Sakinaviiri
Kun 12 terveelle vapaaehtoiselle annettiin klaritromysiiniä (500 mg kahdesti) ja sakinaviiria (pehmeät gelatiinikapselit, 1200 mg tid) 12 terveelle vapaaehtoiselle, sakinaviirin vakaan tilan AUC nousi 177 % ja Cmax 187 % verrattuna pelkän sakinaviirin käyttöön. Klaritromysiinin AUC suureni 45 % ja Cmax 39 %, kun taas 14-OH-klaritromysiinin AUC pieneni 24 % ja Cmax 34 % verrattuna pelkkään klaritromysiinin käyttöön.
Didanosiini
Klaritromysiinitablettien ja didanosiinin samanaikainen antaminen 12 HIV-tartunnan saaneelle aikuispotilaalle ei aiheuttanut tilastollisesti merkitseviä muutoksia didanosiinin farmakokinetiikassa.
Zidovudiini
Kun 500 mg:n klaritromysiinitabletteja annettiin kahdesti vuorokaudessa yhdessä 100 mg:n tsidovudiinin kanssa 4 tunnin välein, vakaan tilan tsidovudiinin AUC pieneni 12 % verrattuna pelkän tsidovudiinin käyttöön (n=4). Yksittäiset arvot vaihtelivat 34 prosentin laskusta 14 prosentin nousuun. Kun klaritromysiinitabletit annettiin 2–4 tuntia ennen tsidovudiinia, vakaan tilan Cmax nousi 100 %, kun taas AUC ei muuttunut (n=24).
Omepratsoli
Terveille aikuisille koehenkilöille annettiin 500 mg klaritromysiiniä 8 tunnin välein yhdessä omepratsolin 40 mg:n kanssa päivässä. Omepratsolin vakaan tilan pitoisuudet plasmassa suurentuvat (Cmax, AUC0-24 ja t½ nousi 30 %, 89 % ja 34 %, vastaavasti), kun klaritromysiiniä annettiin samanaikaisesti.
Klaritromysiinin ja 14-OH-klaritromysiinin pitoisuudet plasmassa nousivat, kun omepratsolia annettiin samanaikaisesti. Klaritromysiinin keskimääräinen Cmax oli 10 % suurempi, keskimääräinen Cmin oli 27 % suurempi ja keskimääräinen AUC0-8 oli 15 % suurempi, kun klaritromysiiniä annettiin yhdessä omepratsolin kanssa, kuin silloin, kun klaritromysiiniä annettiin yksinään. Samanlaisia tuloksia havaittiin 14-OH-klaritromysiinillä, keskimääräinen Cmax oli 45 % suurempi, keskimääräinen Cmin oli 57 % suurempi ja keskimääräinen AUC0-8 oli 45 % suurempi. Myös klaritromysiinipitoisuudet mahakudoksessa ja limassa lisääntyivät, kun omepratsolia annettiin samanaikaisesti.
Klaritromysiinikudospitoisuudet 2 tuntia annoksen jälkeen (mcg/ml)/(mcg/g)
Teofylliini
Kahdessa tutkimuksessa, joissa teofylliiniä annettiin klaritromysiinin kanssa (teofylliiniä hitaasti vapauttavaa formulaatiota annettiin joko 6,5 mg/kg tai 12 mg/kg yhdessä 250 tai 500 mg q12h klaritromysiinin kanssa), vakaan tilan Cmax, Cmin, ja teofylliinin seerumin pitoisuusaikakäyrän (AUC) alla oleva pinta-ala kasvoi noin 20 %.
Midatsolaami
Kun kerta-annos midatsolaamia annettiin yhdessä klaritromysiinitablettien kanssa (500 mg kahdesti vuorokaudessa 7 päivän ajan), midatsolaamin AUC suureni 174 % laskimonsisäisen midatsolaamin antamisen jälkeen ja 600 % oraalisen annon jälkeen.
Lisätietoja muista lääkkeistä, jotka on tarkoitettu käytettäväksi yhdessä BIAXINin kanssa, katso niiden täydelliset reseptitiedot, KLIININEN FARMAKOLOGIA osio.
Mikrobiologia
Toimintamekanismi
Klaritromysiini saa aikaan antibakteerisen vaikutuksensa sitoutumalla herkkien bakteerien ribosomaaliseen 50S-alayksikköön, mikä estää proteiinisynteesiä.
Resistanssi
Tärkeimmät resistenssin reitit ovat ribosomaalisen 50S-alayksikön 23S-rRNA:n modifiointi herkkyyteen tai lääkkeen ulosvirtauspumppuihin. Beetalaktamaasin tuotannolla ei pitäisi olla vaikutusta klaritromysiinin aktiivisuuteen.
Useimmat metisilliiniresistenttien ja oksasilliiniresistenttien stafylokokkien isolaatit ovat resistenttejä klaritromysiinille.
Jos H. pyloria ei hävitetä klaritromysiiniä sisältävien yhdistelmähoitojen jälkeen, potilaille saattaa kehittyä klaritromysiiniresistenssi H. pylori -isolaateissa. Siksi potilaille, joiden hoito epäonnistuu, tulee tehdä klaritromysiiniherkkyystesti, jos mahdollista. Potilaita, joilla on klaritromysiiniresistentti H. pylori, ei tule hoitaa millään seuraavista: omepratsoli/klaritromysiini-kaksoishoito; omepratsoli/klaritromysiini/amoksisilliini kolmoishoito; lansopratsoli/klaritromysiini/amoksisilliini kolmoishoito; tai muut hoito-ohjelmat, jotka sisältävät klaritromysiinin ainoana antibakteerisena aineena.
Antimikrobinen aktiivisuus
Klaritromysiinin on osoitettu olevan aktiivinen useimpia seuraavien mikro-organismien isolaatteja vastaan sekä in vitro että kliinisissä infektioissa [ks. KÄYTTÖAIHEET JA KÄYTTÖ ].
Gram-positiiviset bakteerit
- Staphylococcus aureus
- Streptococcus pneumoniae
- Streptococcus pyogenes
Gram-negatiiviset bakteerit
- Haemophilus influenzae
- Haemophilus parainfluenzae
- Moraxella catarrhalis
Muut mikro-organismit
- Chlamydophila pneumoniae
- Helicobacter pylori
- Mycobacterium avium -kompleksi (MAC), joka koostuu M. aviumista ja M. intracellularesta
- Mycoplasma pneumoniae
Vähintään 90 prosentilla alla luetelluista mikro-organismeista on in vitro -minimi estopitoisuudet (MIC), jotka ovat pienempiä tai yhtä suuria kuin klaritromysiinille herkkä MIC-raja-arvo samantyyppisille organismeille kuin taulukossa 11 esitetyt. Klaritromysiinin tehokkuus kliinisten infektioiden hoidossa näiden mikro-organismien vuoksi ei ole osoitettu riittävissä ja hyvin kontrolloiduissa kliinisissä tutkimuksissa.
Gram-positiiviset bakteerit
- Streptococcus agalactiae
- Streptokokit (ryhmät C, F, G)
- Viridans-ryhmän streptokokit
Gram-negatiiviset bakteerit
- Legionella pneumophila
- Pasteurella multocida
Anaerobiset bakteerit
- Clostridium perfringens
- Peptococcus niger
- Prevotella melaninogenica
- Propionibacterium acnes
Herkkyystestaus
Tarkempia tietoja herkkyystestin tulkintakriteereistä ja niihin liittyvistä testimenetelmistä ja laadunvalvontastandardeista, jotka FDA on tunnustanut tälle lääkkeelle, on osoitteessa http://www.fda.gov/STIC.
Eläinten toksikologia ja/tai farmakologia
Sarveiskalvon sameutta esiintyi koirilla 12-kertaisilla annoksilla ja apinoilla 8-kertaisilla annoksilla, jotka olivat suurempia kuin ihmisen enimmäisvuorokausiannos (kehon pinta-alan perusteella). Lymfaattien väheneminen tapahtui koirilla annoksilla, jotka olivat 3 kertaa suurempia kuin annoksilla, ja apinoilla annoksilla, jotka olivat 2 kertaa suurempia kuin ihmisen enimmäisvuorokausiannos (kehon pinta-alan perusteella).
Kliiniset tutkimukset
Mykobakteeri-infektiot
Mykobakteeri-infektioiden ehkäisy
Satunnaistetussa kaksoissokkoutetussa kliinisessä tutkimuksessa (tutkimus 3) verrattiin klaritromysiiniä 500 mg kahdesti vuorokaudessa lumelääkkeeseen potilailla, joilla oli CDC:n määrittelemä AIDS ja CD4-solujen määrä alle 100 solua/μl. Tähän tutkimukseen osallistui 682 potilasta marraskuusta 1992 tammikuuhun 1994, ja CD4-solumäärän mediaani oli 30 solua/mcL. BIAXIN 500 mg:n mediaanikesto oli 10,6 kuukautta verrattuna lumelääkkeeseen 8,2 kuukautta. Plaseboryhmässä enemmän potilaita kuin BIAXIN-ryhmässä keskeytyi tutkimuksesta ennenaikaisesti (75,6 % ja 67,4 %). Jos Mycobacterium avium -kompleksin (MAC) tai kuoleman aiheuttamat ennenaikaiset keskeytykset kuitenkin suljetaan pois, suunnilleen yhtä suuri prosenttiosuus potilaista kummassakin haarassa (54,8 %) BIAXINia saaneista ja 52,5 % lumelääkettä saaneista potilaista keskeytti tutkimuslääkkeen käytön aikaisin muista syistä. Kokeilu suunniteltiin seuraavien päätepisteiden arvioimiseksi:
MAC Bakteremia
BIAXIN-hoitoon satunnaistetuilla potilailla MAC-bakteremian riski pieneni 69 % lumelääkkeeseen verrattuna. Ryhmien välinen ero oli tilastollisesti merkitsevä (p
Eloonjääminen
BIAXINilla havaittiin tilastollisesti merkitsevä eloonjäämishyöty lumelääkkeeseen verrattuna (katso kuva 3 ja taulukko 13). Koska analyysi 18 kuukauden kohdalla sisältää potilaita, jotka eivät enää saa ennaltaehkäisyä, BIAXIN 250 mg:n eloonjäämishyöty voidaan aliarvioida.
Kuva 3: Kaikkien satunnaistettujen AIDS-potilaiden eloonjääminen ajan mittaan kokeessa 3 
Kliinisesti merkittävä levinnyt MAC-tauti
MAC-bakteremian vähentyneen esiintyvyyden vuoksi BIAXIN-hoitoon satunnaistetun ryhmän potilailla havaittiin vähentyneet levinneen MAC-taudin merkit ja oireet, mukaan lukien kuume, yöhikoilu, laihtuminen ja anemia.
Mykobakteeri-infektioiden hoito
Annosvaihteluiden monoterapiatutkimukset aikuisilla AIDS-potilailla, joilla on MAC
Kahdessa satunnaistetussa kliinisessä tutkimuksessa (tutkimukset 1 ja 2) verrattiin erilaisia BIAXIN-annoksia potilaille, joilla oli CDC:n määrittelemä AIDS ja CD4-määrät alle 100 solua/mcL. Näissä tutkimuksissa potilaita kertyi toukokuusta 1991 maaliskuuhun 1992. Tutkimus 500 oli satunnaistettu kaksoissokkotutkimus; koe 577 oli avoin erityiskäyttötutkimus. Molemmissa tutkimuksissa käytettiin 500 mg ja 1 000 mg kahdesti vuorokaudessa BIAXINia; tutkimuksessa 1 oli myös 2000 mg kahdesti päivässä BIAXIN 500 mg ryhmä. Tutkimukseen 1 osallistui 154 aikuispotilasta ja tutkimukseen 2 469 aikuispotilasta. Suurimmalla osalla potilaista CD4-solujen määrä oli alle 50 solua/mcL tutkimukseen tullessa. Kokeilut suunniteltiin seuraavien päätepisteiden arvioimiseksi:
Kokeen 1 tulokset on kuvattu alla. Kokeen 2 tulokset olivat samanlaisia kuin kokeen 1 tulokset.
MAC Bakteremia
MAC-bakteremian tai negatiivisten veriviljelmien vähenemistä havaittiin suurimmalla osalla potilaista kaikissa BIAXIN 500 mg -annosryhmissä. MAC-pesäkkeitä muodostavien yksiköiden (CFU) keskimääräinen lasku lähtötasosta 4 viikon hoidon jälkeen 1000 mg:n (n=32) kahdesti vuorokaudessa ja 2000 mg:n (n=26) kahdesti vuorokaudessa annoksella oli 2,3 log CFU verrattuna 1,5 log CFU:hun vuonna BIAXIN 500 mg kahdesti vuorokaudessa (n = 35). Erillisessä tutkimuksessa, jossa käytettiin neljän lääkkeen hoito-ohjelmaa2 (siprofloksasiini, etambutoli, rifampisiini ja klofatsimiini), keskimääräinen vähennys oli 1,4 log CFU.
Klaritromysiinimonoterapian eri annostusohjelmilla arvioidut kliiniset tulokset on esitetty taulukossa 14. Annokset 1000 mg ja 2000 mg kahdesti vuorokaudessa osoittivat merkittävästi paremman bakteremian hallinnan neljän ensimmäisen hoitoviikon aikana. Sen jälkeen ei havaittu merkittäviä eroja. Kaikilla isolaateilla MIC oli alle 8 mcg/ml esikäsittelyssä. Relapsiin liittyi lähes aina MIC:n nousu.
Kliinisesti merkittävä levinnyt MAC-tauti
Potilaista, jotka kokivat yöhikoilua ennen hoitoa, 84 %:lla havaittiin ero tai paraneminen jossain vaiheessa BIAXIN-hoidon 12 viikon aikana annoksilla 500–2000 mg kahdesti vuorokaudessa. Samoin 77 % potilaista ilmoitti kuumeen häviämisestä tai paranemisesta jossain vaiheessa. MAC:n kliinisten oireiden vastemäärät on annettu alla olevassa taulukossa 15.
Keskimääräinen vastekesto, joka määritellään kliinisten merkkien ja oireiden paranemisena tai häviämisenä, oli 2 viikosta 6 viikkoon.
Koska tutkimusta ei suunniteltu määrittämään monoterapian hyötyä yli 12 viikon ajan, vasteen kesto voidaan aliarvioida niillä 25–33 prosentilla potilaista, joilla kliininen vaste jatkui 12 viikon jälkeen.
Eloonjääminen
Keskimääräinen eloonjäämisaika tutkimukseen osallistumisesta (tutkimus 1) oli 249 päivää annoksella 500 mg kahdesti vuorokaudessa, kun taas 215 päivää annoksella 1000 mg kahdesti vuorokaudessa. Ensimmäisen 12 hoitoviikon aikana 500 mg kahdesti vuorokaudessa saaneessa ryhmässä kuoli kuitenkin 2 53 potilaalla verrattuna 13 kuolemaan 51 potilaalla 1000 mg kahdesti vuorokaudessa saaneessa ryhmässä. Syytä tähän ilmeiseen kuolleisuuseroon ei tiedetä. Eloonjääminen kahdessa ryhmässä oli samanlainen yli 12 viikkoa. Keskimääräiset eloonjäämisajat näillä annoksilla olivat samanlaiset kuin viimeaikaisissa historiallisissa MAC-kontrolleissa, kun niitä hoidettiin yhdistelmähoidoilla.2
Keskimääräinen eloonjäämisaika tutkimukseen 2 osallistumisesta oli 199 päivää annoksella 500 mg kahdesti vuorokaudessa ja 179 päivää annoksella 1000 mg kahdesti vuorokaudessa. Ensimmäisen neljän hoitoviikon aikana, kun potilaat pysyivät alun perin määrätyllä annoksella, kuoli 11 ihmistä 255 potilaalla, jotka ottivat 500 mg kahdesti vuorokaudessa ja 18 kuolemaa 214 potilaalla, jotka ottivat 1000 mg kahdesti vuorokaudessa.
Annokselle vaihtelevat monoterapiatutkimukset lasten AIDS-potilailla, joilla on MAC
Koe 4 oli pediatrinen tutkimus, jossa BIAXINia annettiin 3,75 mg/kg, 7,5 mg/kg ja 15 mg/kg kahdesti vuorokaudessa potilailla, joilla oli CDC:n määrittelemä AIDS ja CD4-määrät olivat alle 100 solua/mcL. Tutkimukseen osallistui 25 1–20-vuotiasta potilasta. Tutkimuksessa arvioitiin samat päätepisteet kuin aikuisten tutkimuksissa 1 ja 2. Tulokset 7,5 mg/kg kahdesti vuorokaudessa annetulla annoksella lapsitutkimuksessa olivat verrattavissa 500 mg:n tuloksiin. kahdesti vuorokaudessa aikuisten kokeissa.
Yhdistelmähoito AIDS-potilailla, joilla on levinnyt MAC
Kokeessa 5 verrattiin BIAXIN 250 mg:n turvallisuutta ja tehoa yhdessä etambutolin kanssa verrattuna BIAXIN 250 mg:aan yhdessä etambutolin ja klofatsimiinin kanssa levinneen MAC-infektion (dMAC) hoidossa. Tähän 24 viikkoa kestäneeseen tutkimukseen otettiin mukaan 106 AIDS- ja dMAC-potilasta, joista 55 potilasta satunnaistettiin saamaan 500 mg BIAXINia ja etambutolia, ja 51 potilasta satunnaistettiin saamaan klaritromysiiniä, etambutolia ja klofatsiimia. Lähtötilanteen ominaisuudet hoitoryhmien välillä olivat samankaltaisia, paitsi että CFU-lukujen mediaanit olivat vähintään 1 logarit korkeammat BIAXIN 500 mg, etambutoli ja klofatsiimihaarassa.
Verrattuna aikaisempiin kokemuksiin klaritromysiinimonoterapiasta, kahden lääkkeen, klaritromysiinin ja etambutolin, hoito pidensi aikaa mikrobiologiseen uusiutumiseen, suurelta osin estämällä klaritromysiiniresistenttien kantojen syntymistä. Klofatsimiinin lisääminen hoito-ohjelmaan ei kuitenkaan lisännyt mikrobiologista tai kliinistä hyötyä. Molempien useiden lääkehoitojen siedettävyys oli verrattavissa yleisimpiin haittavaikutuksiin, jotka olivat luonteeltaan maha-suolikanavan aiheuttamia. Potilaiden, jotka saivat klofatsamiinia sisältävää hoito-ohjelmaa, eloonjäämisaste oli alentunut; kuitenkin niiden perustason mykobakteeripesäkkeiden määrät olivat korkeammat. Tämän kokeen tulokset tukevat etambutolin lisäämistä klaritromysiiniin ensimmäisten dMAC-infektioiden hoitoon, mutta eivät tue klofatsimiinin lisäämistä kolmantena aineena.
Välikorvatulehdus
Otitis Media -tutkimus BIAXIN vs. oraalinen kefalosporiini
Yhdysvalloissa tehdyssä kontrolloidussa kliinisessä tutkimuksessa lapsipotilailla, joilla oli akuutti välikorvatulehdus, jossa havaittiin merkittäviä määriä beetalaktamaasia tuottavia organismeja, BIAXIN 500 mg verrattiin suun kautta otettavaan kefalosporiiniin. Tässä tutkimuksessa kliinisen vasteen määrittämiseen käytettiin tiukkoja arvioitavuuskriteerejä. Niillä 223 potilaalla, joiden kliininen teho arvioitiin, kliininen onnistumisprosentti (eli parantuminen ja paraneminen) hoidon jälkeisellä käynnillä oli 88 % BIAXIN 500 mg:n ja 91 % kefalosporiinin kohdalla.
Pienemmillä potilailla mikrobiologiset määritykset tehtiin hoitoa edeltävällä käynnillä. Taulukossa 16 esitetään oletetut bakteerien hävittämis-/kliiniset paranemistulokset (eli kliininen menestys).
BIAXINin vs. antimikrobinen/beetalaktamaasi-inhibiittori
Kahdessa muussa Yhdysvalloissa suoritetussa akuutin välikorvantulehduksen kontrolloidussa kliinisessä tutkimuksessa, joissa havaittiin merkittäviä määriä beetalaktamaasia tuottavia organismeja, BIAXINia verrattiin oraaliseen antimikrobiseen aineeseen, joka sisälsi spesifistä beetalaktamaasin estäjää. Näissä tutkimuksissa kliinisten vasteiden määrittämiseen käytettiin tiukkoja arvioitavuuskriteerejä. Niillä 233 potilaalla, joiden kliininen teho arvioitiin, yhdistetty kliininen onnistumisprosentti (eli parantuminen ja paraneminen) hoidon jälkeisellä käynnillä oli 91 % sekä BIAXIN 500 mg:n että kontrollin osalta.
Potilaiden, joille tehtiin mikrobiologiset määritykset hoitoa edeltävällä käynnillä, oletetut bakteerien hävittämis-/kliiniset paranemistulokset (eli kliininen menestys) on esitetty taulukossa 17.
H. pylorin hävittäminen pohjukaissuolihaavan uusiutumisen riskin vähentämiseksi
BIAXIN + Lansopratsoli ja amoksisilliini
Kahdessa yhdysvaltalaisessa satunnaistetussa, kaksoissokkoutetussa kliinisessä tutkimuksessa (tutkimus 6 ja tutkimus 7) potilailla, joilla oli helikobakteeri ja pohjukaissuolen haavauma (määritelty aktiiviseksi haavaksi tai aktiiviseksi haavaksi vuoden sisällä), arvioitiin BIAXIN 500 mg kahdesti tehoa. päivittäin yhdessä lansopratsolin 30 mg kahdesti vuorokaudessa ja amoksisilliinin 1 g kahdesti vuorokaudessa kanssa 14 päivän kolmoishoitona H. pylorin hävittämiseksi.
H. pylorin hävittäminen määriteltiin kahdeksi negatiiviseksi kokeeksi (viljely ja histologia) 4 - 6 viikon kuluttua hoidon päättymisestä.
BIAXINin sekä lansopratsolin ja amoksisilliinin yhdistelmä kolmoishoitona oli tehokas H. pylorin hävittämisessä (katso tulokset taulukosta 18). H. pylorin hävittämisen on osoitettu vähentävän pohjukaissuolihaavan uusiutumisen riskiä.
Yhdysvalloissa suoritetussa satunnaistetussa kaksoissokkoutetussa kliinisessä tutkimuksessa (tutkimus 8) potilailla, joilla oli H. pylori ja pohjukaissuolihaava (määritelty aktiiviseksi haavaksi tai haavaksi anamneesissa vuoden sisällä), verrattiin BIAXIN 250 mg:n tehoa yhdessä lansopratsoli ja amoksisilliini kolmoishoitona 10 päivän ja 14 päivän ajan. Tämä tutkimus vahvisti, että 10 päivän kolmoishoito vastasi 14 päivän kolmoishoitoa H. pylorin hävittämisessä (katso tulokset taulukosta 18).
BIAXIN + omepratsoli ja amoksisilliinihoito
Kolmessa Yhdysvalloissa tehdyssä satunnaistetussa kaksoissokkoutetussa kliinisessä tutkimuksessa potilailla, joilla oli helikobakteeri-infektio ja pohjukaissuolihaava (n = 558), verrattiin BIAXINia plus omepratsolia ja amoksisilliinia BIAXIN 250 mg plus amoksisilliiniin. Kaksi tutkimusta (tutkimukset 9 ja 10) suoritettiin potilailla, joilla oli aktiivinen pohjukaissuolihaava, ja kolmas tutkimus (tutkimus 11) suoritettiin potilailla, joilla oli pohjukaissuolihaava viimeisten 5 vuoden aikana, mutta joilla ei ollut haavaumaa ilmoittautumisajankohtana. . Annostusohjelma tutkimuksissa oli BIAXIN 500 mg kahdesti vuorokaudessa plus omepratsoli 20 mg kahdesti päivässä sekä amoksisilliini 1 gramma kahdesti päivässä 10 päivän ajan. Kokeissa 9 ja 10 potilaat, jotka käyttivät omepratsolihoitoa, saivat lisäksi 18 päivän ajan omepratsolia 20 mg kerran päivässä. Tutkitut päätepisteet olivat H. pylorin hävittäminen ja pohjukaissuolihaavan paraneminen (vain kokeet 9 ja 10). H. pylori -status määritettiin CLOtest®:llä, histologialla ja viljelmällä kaikissa kolmessa kokeessa. Tietyllä potilaalla H. pylori katsottiin hävinneeksi, jos vähintään kaksi näistä testeistä oli negatiivinen, eikä yksikään ollut positiivinen. BIAXINin sekä omepratsolin ja amoksisilliinin yhdistelmä oli tehokas H. pylorin hävittämisessä (katso tulokset taulukosta 19).
BIAXIN + omepratsolihoito
Neljässä satunnaistetussa, kaksoissokkoutetussa, monikeskustutkimuksessa (tutkimukset 12, 13, 14 ja 15) arvioitiin BIAXIN 500 mg kolmesti päivässä plus omepratsoli 40 mg kerran päivässä 14 päivän ajan, minkä jälkeen omepratsoli 20 mg kerran päivässä ( tutkimukset 12, 13 ja 15) tai omepratsolia 40 mg kerran vuorokaudessa (tutkimus 14) vielä 14 päivän ajan potilailla, joilla on aktiivinen pohjukaissuolihaava, johon liittyy H. pylori. Kokeet 12 ja 13 suoritettiin Yhdysvalloissa ja Kanadassa, ja niihin osallistui 242 ja 256 potilasta. H. pylori -infektio ja pohjukaissuolihaava varmistettiin 219 potilaalla tutkimuksessa 12 ja 228 potilaalla tutkimuksessa 13. Näissä tutkimuksissa yhdistelmähoitoa verrattiin omepratsoli- ja BIAXIN-monoterapiaan. Tutkimukset 14 ja 15 suoritettiin Euroopassa, ja niihin osallistui 154 ja 215 potilasta. H. pylori -infektio ja pohjukaissuolihaava varmistettiin 148 potilaalla tutkimuksessa 14 ja 208 potilaalla tutkimuksessa 15. Näissä tutkimuksissa yhdistelmähoitoa verrattiin omepratsolin monoterapiaan. Näiden kokeiden tehokkuusanalyysien tulokset on kuvattu taulukoissa 20, 21 ja 22.
Pohjukaissuolihaavan paraneminen
BIAXIN 250 mg:n ja omepratsolin yhdistelmä oli yhtä tehokas kuin omepratsoli yksinään pohjukaissuolihaavan parantamisessa (katso taulukko 20).
Pohjukaissuolihaavaan liittyvän H. pylorin hävittäminen
BIAXIN 500 mg:n ja omepratsolin yhdistelmä oli tehokas H. pylorin hävittämisessä (katso taulukko 21). H. pylori -hävitys määriteltiin positiiviseksi testiksi (viljelmä tai histologia) 4 viikon kuluttua hoidon päättymisestä, ja kaksi negatiivista testiä vaadittiin katsottavaksi hävitetyksi. Protokollakohtaisessa analyysissä suljettiin pois seuraavat potilaat: keskeyttäneet potilaat, potilaat, joilla oli merkittäviä protokollarikkomuksia, potilaat, joilta puuttuivat H. pylori -testit hoidon jälkeen, ja potilaat, joilta ei arvioitu H. pylorin hävitystä 4 viikon kuluttua hoidon päättymisestä. hoitoon, koska heillä havaittiin parantumaton haava hoidon lopussa.
Pohjukaissuolihaavan uusiutuminen
Haavojen uusiutuminen 6 kuukauden ja 12 kuukauden kuluttua hoidon päättymisestä arvioitiin potilailla, joilla haavat paranivat hoidon jälkeen (katso tulokset taulukosta 22). Siten potilailla, joilla oli H. pylori -infektioon liittyvä pohjukaissuolihaava, H. pylorin hävittäminen vähensi haavan uusiutumista.
VIITTEET
2.Kemper CA, et ai. Mycobacterium avium -kompleksin bakteremian hoito AIDSissa neljän lääkkeen suun kautta annettavalla hoito-ohjelmalla. Ann Intern Med. 1992; 116:466-472.
POTILASTIEDOT
Anna potilaille seuraavat ohjeet tai tiedot BIAXIN 250 mg:sta:
- Neuvo potilaita, että antibakteerisia lääkkeitä, mukaan lukien BIAXIN (klaritromysiini), tulisi käyttää vain bakteeri-infektioiden hoitoon. Ne eivät hoida virusinfektioita (esim. flunssaa). Kun BIAXIN 250mg on määrätty bakteeri-infektion hoitoon, potilaille tulee kertoa, että vaikka on yleistä, että olo paranee hoidon alussa, lääke tulee ottaa täsmälleen ohjeiden mukaan. Annosten väliin jättäminen tai koko hoitojakson suorittamatta jättäminen voi (1) heikentää välittömän hoidon tehokkuutta ja (2) lisätä todennäköisyyttä, että bakteerit kehittävät resistenssiä ja että niitä ei voida hoitaa BIAXIN 250 mg:lla tai muilla antibakteerisilla lääkkeillä tulevaisuudessa.
- Kerro potilaille, että ripuli on yleinen ongelma, jonka aiheuttavat antibakteeriset lääkkeet, mukaan lukien BIAXIN (klaritromysiini), joka yleensä päättyy, kun antibakteerinen lääke lopetetaan. Joskus bakteerilääkehoidon aloittamisen jälkeen potilaille voi kehittyä vetisiä ja verisiä ulosteita (vatsakouristuksella ja kuumeella tai ilman) jopa kahden tai useamman kuukauden kuluttua viimeisen antibakteerisen annoksen ottamisen jälkeen. Jos näin tapahtuu, kehota potilaita ottamaan yhteyttä terveydenhuollon tarjoajaan mahdollisimman pian.
- Kerro potilaille, että BIAXIN (klaritromysiini) voi olla vuorovaikutuksessa joidenkin lääkkeiden kanssa; siksi kehota potilaita ilmoittamaan terveydenhuollon tarjoajalle muiden lääkkeiden käytöstä.
- Kerro potilaille, että BIAXIN (klaritromysiini) Filmtab ja oraalisuspensio voidaan ottaa ruoan kanssa tai ilman ja maidon kanssa; BIAXIN 250mg XL Filmtab (klaritromysiini-pitkävaikutteiset tabletit) tulee kuitenkin ottaa ruoan kanssa. Älä jäähdytä suspensiota.
- BIAXINin (klaritromysiini) vaikutuksesta ajokykyyn tai koneiden käyttökykyyn ei ole tietoa. Neuvo kuitenkin potilaita koskien huimausta, huimausta, sekavuutta ja desorientaatiota, joita voi esiintyä lääkkeen yhteydessä. Näiden haittavaikutusten mahdollisuus tulee ottaa huomioon ennen kuin potilas ajaa autoa tai käyttää koneita.
- Neuvo potilaita, että jos raskaus tapahtuu tämän lääkkeen käytön aikana, sikiölle on mahdollinen vaara [katso VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
- Neuvo potilaita, joilla on sepelvaltimotauti, jatkamaan lääkkeitä ja elämäntapamuutoksia sepelvaltimotautinsa vuoksi, koska BIAXIN 500 mg:aan saattaa liittyä lisääntynyt kuolleisuusriski vuosia BIAXIN-hoidon päättymisen jälkeen.
