Trecator-SC 250mg Ethionamide Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Trecator on ja miten sitä käytetään?
Trecator on reseptilääke, jota käytetään aktiivisen tuberkuloosin oireiden hoitoon. Trecatoria voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Trecator kuuluu tuberkuloosilääkkeiden luokkaan.
Mitkä ovat Trecatorin mahdolliset sivuvaikutukset?
Trecator voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nokkosihottuma,
- vaikeuksia hengittää,
- kasvojen, huulten, kielen tai kurkun turvotus,
- tunnottomuus, pistely tai polttava tunne käsissäsi tai jaloissasi,
- hämmennystä,
- epätavallisia ajatuksia tai käyttäytymistä,
- silmäkipu,
- näön hämärtyminen,
- Tuplanäkö,
- huimaus,
- kohtaus,
- ylävatsakipu,
- tumma virtsa,
- savenväriset ulosteet ja
- ihon tai silmien keltaisuus (keltatauti)
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Trecatorin yleisimpiä sivuvaikutuksia ovat:
- pahoinvointi,
- oksentelua,
- ripuli,
- vatsakipu,
- ruokahalun menetys,
- lisääntynyt syljeneritys,
- metallin maku suussa,
- rakkuloita tai haavaumia suussasi,
- punaiset tai turvonneet ikenet,
- nielemisvaikeuksia,
- päänsärky,
- huimaus,
- uneliaisuus,
- masentunut mieliala ja
- levoton tunne
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikki Trecatorin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
Trecator® (etionamiditabletit, USP) käytetään tuberkuloosin hoidossa. Etionamidin kemiallinen nimi on 2-etyylitioisonikotiiniamidi, jolla on seuraava rakennekaava:
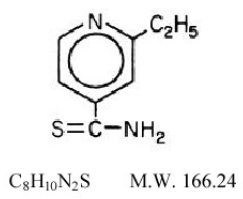
Etionamidi on keltainen kiteinen, ei-hygroskooppinen yhdiste, jolla on heikko tai kohtalainen sulfidihaju ja jonka sulamispiste on 162 °C. Se on käytännössä liukenematon veteen ja eetteriin, mutta liukenee metanoliin ja etanoliin. Sen jakaantumiskerroin (oktanoli/vesi) Log P -arvo on 0,3699. Trecator-tabletit sisältävät 250 mg etionamidia. Läsnä olevat inaktiiviset aineosat ovat kroskarmelloosinatrium, FD&C Yellow #6, magnesiumstearaatti, mikrokiteinen selluloosa, polyetyleeniglykoli, polyvinyylialkoholi, povidoni, piidioksidi, talkki ja titaanidioksidi.
INDIKAATIOT
Trecator on tarkoitettu ensisijaisesti aktiivisen tuberkuloosin hoitoon potilailla, joilla on isoniatsidille tai rifampiinille resistentti M. tuberculosis tai jos potilas ei siedä muita lääkkeitä. Sen käyttö yksinään tuberkuloosin hoidossa johtaa resistenssin nopeaan kehittymiseen. Siksi on välttämätöntä antaa sopiva seuralääke tai -lääkkeet, jonka valinta perustuu herkkyystestien tuloksiin. Jos herkkyystestit osoittavat, että potilaan organismi on resistentti jollekin ensilinjan tuberkuloosilääkkeelle (esim. isoniatsidille tai rifampiinille), mutta silti herkkä etionamidille, etionamidin mukana tulee olla vähintään yksi lääke, jolle M. tuberculosis-isolaatin tiedetään olevan herkkä.3 Jos tuberkuloosi on resistentti sekä isoniatsidille että rifampiinille, mutta kuitenkin herkkä etionamidille, etionamidin rinnalle tulee antaa vähintään kaksi muuta lääkettä, joille M. tuberculosis -isolaatin tiedetään olevan herkkä.3
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja Trecatorin ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi Trecatoria tulee käyttää vain sellaisten infektioiden hoitoon, joiden on todistettu tai epäillään aiheuttavan herkkiä bakteereja. Kun viljely- ja herkkyystiedot ovat saatavilla, ne tulee ottaa huomioon valittaessa tai muuttaessa antibakteerista hoitoa. Tällaisten tietojen puuttuessa paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa hoidon empiiriseen valintaan.
Jos potilas ei noudata määrättyä hoitoa, se voi johtaa hoidon epäonnistumiseen ja lääkeresistentin tuberkuloosin kehittymiseen, mikä voi olla hengenvaarallinen ja johtaa muihin vakaviin terveysriskeihin. Siksi on olennaista, että potilaat noudattavat lääkehoitoa koko hoidon ajan. Suoraan tarkkailtavaa hoitoa suositellaan kaikille tuberkuloosihoitoa saaville potilaille. Potilaita, joilta on eristetty lääkeresistenttejä M. tuberculosis -organismeja, tulee hoitaa neuvotellen lääkeresistentin tuberkuloosin hoidon asiantuntijan kanssa.
ANNOSTELU JA HALLINNOINTI
Tuberkuloosin hoidossa suurin syy lääkeresistenttien organismien syntymiseen ja siten hoidon epäonnistumiseen on se, että potilas ei noudata määrättyä hoitoa. Hoidon epäonnistuminen ja lääkeresistentit organismit voivat olla hengenvaarallisia ja voivat aiheuttaa muita vakavia terveysriskejä. Siksi on tärkeää, että potilaat noudattavat lääkehoitoa koko hoidon ajan. Suoraa tarkkailtavaa hoitoa suositellaan potilaille, jotka saavat hoitoa tuberkuloosiin. Lääkeresistentin tuberkuloosin hoidon asiantuntijan konsultointia suositellaan potilaille, joilla epäillään tai todennäköistä on lääkeresistentti tuberkuloosi. Etionamidia tulee antaa vähintään yhden, joskus kahden muun lääkkeen kanssa, joille organismin tiedetään olevan herkkä (ks. INDIKAATIOT ).
Trecator annetaan suun kautta. Tavallinen aikuisten annos on 15-20 mg/kg/vrk, annettuna kerran vuorokaudessa tai, jos potilaalla on huono maha-suolikanavan sietokyky, jaettuna annoksiin, enimmäisvuorokausiannos on 1 gramma.
Trecator-tabletit on muotoiltu uudelleen sokeripäällysteisestä tabletista kalvopäällysteiseksi tabletiksi. Potilaita on tarkkailtava ja heidän annosta on säädettävä uudelleen, kun siirrytään sokeripäällysteisestä tabletista kalvopäällysteiseen tablettiin (ks. KLIININEN FARMAKOLOGIA ).
Hoito tulee aloittaa annoksella 250 mg vuorokaudessa ja titraus asteittain optimaalisiin annoksiin, joita potilas sietää. On raportoitu, että annos on 250 mg vuorokaudessa 1 tai 2 päivän ajan, jota seuraa 250 mg kahdesti vuorokaudessa 1 tai 2 päivän ajan, minkä jälkeen annos on nostettu 1 grammaan jaettuna 3 tai 4 annokseen.4,5 Toistaiseksi todisteita ei ole riittävästi. ilmaisemaan pienimmät tehokkaat annostasot. Siksi lääkkeelle tai rinnakkaislääkkeelle resistenssin kehittymisen riskin minimoimiseksi on noudatettu periaatetta antaa korkein siedetty annos (perustuen maha-suolikanavan intoleranssiin). Aikuisella tämä näyttäisi olevan 0,5–1,0 grammaa päivässä ja keskimäärin 0,75 grammaa päivässä.
Optimaalista annosta lapsipotilaille ei ole vahvistettu. Lapsille on kuitenkin suositeltu annoksia 10-20 mg/kg po vuorokaudessa jaettuna 2 tai 3 annokseen aterioiden jälkeen tai 15 mg/kg/24 tuntia yhtenä vuorokautisena annoksena.1,2 Kuten aikuisille, etionamidia voidaan antaa. lapsipotilaille kerran päivässä. On huomattava, että potilailla, joilla on samanaikainen tuberkuloosi ja HIV-infektio, voi esiintyä imeytymishäiriötä. Lääkkeiden imeytymishäiriötä tulee epäillä potilailla, jotka noudattavat hoitoa, mutta jotka eivät reagoi asianmukaisesti. Tällaisissa tapauksissa on harkittava terapeuttisten lääkkeiden seurantaa (ks KLIININEN FARMAKOLOGIA ).
Parhaat antoajat ovat ne ajat, jotka yksittäinen potilas pitää sopivimpana ruoansulatuskanavan intoleranssin välttämiseksi tai minimoimiseksi, mikä tapahtuu yleensä ruokailun yhteydessä. Potilaita on pyrittävä kannustamaan jatkamaan hoitoa, kun maha-suolikanavan sivuvaikutuksia ilmaantuu, koska ne voivat heiketä hoidon edetessä.
Pyridoksiinin samanaikainen anto on suositeltavaa.
Hoidon keston tulee perustua yksilölliseen kliiniseen vasteeseen. Yleensä hoitoa jatketaan, kunnes bakteriologinen konversio on muuttunut pysyväksi ja maksimaalinen kliininen paraneminen on tapahtunut.
MITEN TOIMITETAAN
Trecator (etionamiditabletit, USP) toimitetaan 100 tabletin pulloissa seuraavasti:
250 mg, oranssi kalvopäällysteinen tabletti, jonka toisella puolella on merkintä "W" ja toisella puolella "4117", NDC 0008-4117-01.
Säilytä kontrolloidussa huoneenlämmössä 20–25 °C (68–77 °F). Annostele tiiviiseen astiaan.
VIITTEET
1. Feigin, RD ja Cherry, JD: Textbook of Pediatric Infectious Diseases, 2nd Edition. Philadelphia, WB Saunders Co., 1987, s. 1371–1372.
2. Nelson, WE, Behrman, RE, Vaughan, VC (toim.): Nelson Textbook of Pediatrics, 13. painos. Philadelphia, WB Saunders Co., 1987, s. 636.
3. Tuberkuloosin ja tuberkuloosiinfektion hoito aikuisilla ja lapsilla, Am J Respiratory and Critical Care Medicine, 149:1359–1374, 1994.
4. Peloquin, CA: Pharmacology of the Antimycobacterial Drugs, Med Clin North Am 77(6): 1230–1262, 1993.
5. American Thoracic Society. Am J Respir Crit Care Med 1997;156:S1–S25.
Jakelija: Pfizer, Wyeth Pharmaceuticals LLC, Pfizer Inc:n tytäryhtiö, Philadelphia, PA 19101. Tarkistettu: tammikuu 2020
SIVUVAIKUTUKSET
Ruoansulatuskanava
Etionamidin yleisimmät sivuvaikutukset ovat ruoansulatuskanavan häiriöt, mukaan lukien pahoinvointi, oksentelu, ripuli, vatsakipu, liiallinen syljeneritys, metallin maku, stomatiitti, ruokahaluttomuus ja laihtuminen. Ruoansulatuskanavan haittavaikutukset näyttävät olevan annosriippuvaisia, ja noin 50 % potilaista ei siedä 1 grammaa kerta-annoksena. Ruoansulatuskanavan vaikutuksia voidaan minimoida pienentämällä annosta, muuttamalla lääkkeen antoaikaa tai antamalla samanaikaisesti antiemeettistä ainetta.

Hermosto
Psykoottisia häiriöitä (mukaan lukien henkinen masennus), uneliaisuutta, huimausta, levottomuutta, päänsärkyä ja posturaalista hypotensiota on raportoitu etionamidin käytön yhteydessä. Harvoissa tapauksissa on raportoitu myös perifeeristä hermotulehdusta, näköhermotulehdusta, kaksoiskuntaa, näön hämärtymistä ja pellagran kaltaista oireyhtymää. Pyridoksiinin samanaikaista antoa on suositeltu neurotoksisten vaikutusten ehkäisemiseksi tai lievittämiseksi.
Maksa
Seerumin bilirubiinin, SGOT:n, SGPT:n ohimenevä nousu; Hepatiitti (jossa on keltaisuutta tai ei).
muu
Yliherkkyysreaktioita, mukaan lukien ihottuma, valoherkkyys, trombosytopenia ja purppura, on raportoitu harvoin. Hypoglykemiaa, kilpirauhasen vajaatoimintaa, gynekomastiaa, impotenssia ja aknea on myös esiintynyt. Diabetes mellitusta sairastavien potilaiden hoito voi vaikeutua etionamidia saavilla potilailla.
HUUMEIDEN VUOROVAIKUTUKSET
Trecatorin on havaittu nostavan tilapäisesti seerumin isoniatsidipitoisuuksia. Trecator voi voimistaa muiden samanaikaisesti annettujen tuberkuloosilääkkeiden haittavaikutuksia. Erityisesti kouristuksia on raportoitu, kun etionamidia on annettu sykloseriinin kanssa, ja erityistä varovaisuutta on noudatettava, kun hoito-ohjelma sisältää molemmat näistä lääkkeistä. Liiallista etanolin nauttimista tulee välttää, koska psykoottista reaktiota on raportoitu.
VAROITUKSET
Pelkän Trecatorin käyttö tuberkuloosin hoidossa johtaa nopeaan resistenssin kehittymiseen. Siksi on välttämätöntä antaa sopiva seuralääke tai -lääkkeet, valinta perustuu herkkyystestien tuloksiin. Hoito voidaan kuitenkin aloittaa ennen herkkyystestien tulosten saamista lääkärin katsomalla tavalla. Etionamidia tulee antaa vähintään yhden, joskus kahden muun lääkkeen kanssa, joille organismin tiedetään olevan herkkä (ks. INDIKAATIOT ). Lääkkeitä, joita on käytetty rinnakkaisaineina, ovat rifampiini, etambutoli, pyratsiiniamidi, sykloseriini, kanamysiini, streptomysiini ja isoniatsidi. Näiden lääkkeiden tavanomaisia varoituksia, varotoimia ja annostusohjeita tulee noudattaa.
Potilaan myöntyvyys on välttämätöntä tuberkuloosihoidon onnistumisen ja lääkeresistenttien organismien syntymisen estämiseksi. Siksi potilaiden tulee noudattaa lääkehoitoa koko hoidon ajan. On suositeltavaa harjoittaa suoraan tarkkailtavaa hoitoa, kun potilaat saavat tuberkuloosilääkitystä. Lääkeresistentin tuberkuloosin hoidon asiantuntijoiden lisäkonsultointia suositellaan, jos potilaille kehittyy lääkeresistenttejä organismeja.
VAROTOIMENPITEET
Kenraali
Trecatorin määrääminen ilman todistettua tai vahvasti epäiltyä bakteeri-infektio-aihetta ei todennäköisesti hyödytä potilasta ja lisää lääkeresistenttien bakteerien kehittymisen riskiä.
Etionamidi voi voimistaa muiden samanaikaisesti annettavien tuberkuloosilääkkeiden haittavaikutuksia (ks. HUUMEIDEN VUOROVAIKUTUKSET ). Oftalmologiset tutkimukset (mukaan lukien oftalmoskopia) tulee tehdä ennen Trecator-hoitoa ja ajoittain sen aikana.
Laboratoriotestit
Seerumin transaminaasiarvot (SGOT, SGPT) on määritettävä ennen hoidon aloittamista ja niitä tulee seurata kuukausittain. Jos seerumin transaminaasiarvot kohoavat hoidon aikana, etionamidi ja siihen liittyvä tuberkuloosilääke tai -lääkkeet voidaan keskeyttää väliaikaisesti, kunnes laboratorioarvojen poikkeamat ovat hävinneet. Etionamidi ja muut tuberkuloosilääkkeet tulee sitten ottaa uudelleen käyttöön peräkkäin sen määrittämiseksi, mikä lääke (tai lääkkeet) on vastuussa maksatoksisuudesta.
Verensokeri on määritettävä ennen Trecator-hoitoa ja määräajoin sen aikana. Diabeetikoiden tulee olla erityisen valppaita hypoglykemiakohtausten varalta.
Kilpirauhasen toimintakokeiden säännöllistä seurantaa suositellaan, koska etionamidihoidon yhteydessä on raportoitu kilpirauhasen vajaatoimintaa joko struumalla tai ilman.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Teratogeeniset vaikutukset
Trecatorilla tehdyt eläintutkimukset osoittavat, että lääkkeellä on teratogeenistä potentiaalia kaneille ja rotille. Näissä tutkimuksissa käytetyt annokset mg/kg perusteella olivat huomattavasti suuremmat kuin ihmisille suositellut annokset. Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana oleville naisille. Näiden eläinkokeiden vuoksi on kuitenkin suositeltavaa, että Trecator-hoitoa ei saa antaa naisilta, jotka ovat raskaana tai jotka todennäköisesti tulevat raskaaksi hoidon aikana, ellei lääkkeen määräävä lääkäri katso sen olevan olennainen osa hoitoa.
Työ ja toimitus
Trecatorin vaikutusta raskaana olevien naisten synnytykseen ja synnytykseen ei tunneta.
Imettävät äidit
Koska tietoa etionamidin erittymisestä äidinmaitoon ei ole saatavilla, Trecatoria tulee antaa imettäville äideille vain, jos hyödyt ovat riskejä suuremmat. Trecatoria käyttävien äitien imettämiä vastasyntyneitä on seurattava haittavaikutusten varalta.
Käyttö lapsille
Koska primaariselle hoidolle resistenttiä keuhkotuberkuloosia esiintyy harvoin vastasyntyneillä, imeväisillä ja lapsilla, tutkimukset ovat olleet rajallisia näissä ikäryhmissä. Tällä hetkellä lääkettä ei tule käyttää alle 12-vuotiaille lapsipotilaille paitsi silloin, kun organismit ovat ehdottomasti vastustuskykyisiä primaarihoidolle ja taudin systeemisen leviämisen tai muiden hengenvaarallisten tuberkuloosikomplikaatioiden katsotaan olevan välitön.
YLIANNOSTUS
Trecator-yliannostuksen hoidosta ei ole saatavilla erityistä tietoa. Jos näin tapahtuu, on käytettävä tavanomaisia menetelmiä mahalaukun sisällön poistamiseksi ja elintoimintojen tukemiseksi.
VASTA-AIHEET
Etionamidi on vasta-aiheinen potilailla, joilla on vaikea maksan vajaatoiminta, ja potilaille, jotka ovat yliherkkiä lääkkeelle.
KLIININEN FARMAKOLOGIA
Imeytyminen
Etionamidi imeytyy olennaisesti täysin suun kautta annon jälkeen, eikä se ole alttiina merkittävälle ensikierron metabolialle. Etionamiditabletit voidaan antaa ruokailuajasta riippumatta.
Taulukossa 1 on esitetty etionamidin farmakokineettiset parametrit 250 mg:n Trecator-kalvopäällysteisten tablettien oraalisen kerta-annoksen jälkeen paastotilassa 40 terveelle aikuiselle vapaaehtoiselle.
Trecator-tabletit on muotoiltu uudelleen sokeripäällysteisestä tabletista kalvopäällysteiseksi tabletiksi. Kalvopäällysteisten tablettien Cmax (2,16 μg/ml) oli merkittävästi korkeampi kuin sokeripäällysteisten tablettien (1,48 μg/ml) (ks. ANNOSTELU JA HALLINNOINTI ).
Jakelu
Etionamidi jakautuu nopeasti ja laajasti kehon kudoksiin ja nesteisiin sokeripäällysteisen tabletin antamisen jälkeen, ja pitoisuudet plasmassa ja eri elimissä ovat suunnilleen samat. Merkittäviä pitoisuuksia on myös aivo-selkäydinnesteessä sokeripäällysteisen tabletin antamisen jälkeen. Etionamidin jakautumista samoihin kehon kudoksiin ja nesteisiin, mukaan lukien aivo-selkäydinnesteeseen, kalvopäällysteisen tabletin antamisen jälkeen ei ole tutkittu, mutta sen ei odoteta poikkeavan merkittävästi sokeripäällysteisen tabletin jakautumisesta. Lääke sitoutuu proteiineihin noin 30 %. Keskimääräinen (SD) näennäinen oraalinen jakautumistilavuus, joka havaittiin 40 terveellä vapaaehtoisella 250 mg:n kalvopäällysteisten tablettien oraalisen annoksen jälkeen, oli 93,5 (19,2) l.
Aineenvaihdunta
Etionamidi metaboloituu laajalti aktiivisiksi ja inaktiivisiksi metaboliiteiksi. Metabolian oletetaan tapahtuvan maksassa, ja tähän mennessä on eristetty 6 metaboliittia: 2-etyyli-isonikotiiniamidi, karbonyylidihydropyridiini, tiokarbonyylidihydropyridiini, S-oksokarbamoyylidihydropyridiini, 2-etyylitioiso-nikotiiniamidi ja etioniamidisulfaatti. Sulfoksidimetaboliitilla on osoitettu olevan antimikrobista vaikutusta Mycobacterium tuberculosis -bakteeria vastaan.
Eliminointi
Keskimääräinen (SD) puoliintumisaika, joka havaittiin 40 terveellä vapaaehtoisella 250 mg:n kalvopäällysteisten tablettien oraalisen annoksen jälkeen, oli 1,92 (0,27) tuntia. Alle 1 % oraalisesta annoksesta erittyy etionamidina virtsaan.
Toimintamekanismi
Etionamidi voi olla bakteriostaattinen tai bakteereja tappava vaikutus riippuen infektiokohdassa saavutetusta lääkkeen pitoisuudesta ja infektoivan organismin herkkyydestä. Etionamidin tarkkaa vaikutusmekanismia ei ole täysin selvitetty, mutta lääke näyttää estävän peptidisynteesiä herkissä organismeissa.
Mikrobiologia
In vitro -toimintaa
Etionamidilla on bakteriostaattista aktiivisuutta solunulkoisia ja intrasellulaarisia Mycobacterium tuberculosis -organismeja vastaan. Etionamidiresistenttien M. tuberculosis-isolaattien kehittäminen voidaan saada aikaan toistuvalla jatkoviljelmällä nesteessä tai kiinteässä alustassa, joka sisältää kasvavia pitoisuuksia etionamidia. Monelle lääkkeelle vastustuskykyiset M. tuberculosis -kannat ovat saattaneet saada resistenssin sekä isoniatsidille että etionamidille. Suurin osa yhdelle resistenteistä M. tuberculosisisolaateista on kuitenkin yleensä herkkiä toiselle. Ristiresistenssistä etionamidin ja para-aminosalisyylihapon (PAS), streptomysiinin tai sykloseriinin välillä ei ole näyttöä. Rajalliset tiedot viittaavat kuitenkin siihen, että etionamidin ja tiosemikarbatsonien (eli tiasetatsonin) sekä isoniatsidin välillä saattaa olla ristiresistenssiä.
In vivo -toimintaa
Suun kautta annettu etionamidi vähensi aluksi viljeltyjen Mycobacterium tuberculosis -organismien määrää H37Rv-tartunnan saaneiden hiirten keuhkoista. Lääkeresistenssi kehittyi etionamidimonoterapian jatkuessa, mutta sitä ei ilmennyt, kun hiiret saivat etionamidia yhdessä streptomysiinin tai isoniatsidin kanssa.
Herkkyystestaus
Katso tarkkoja tietoja herkkyystestin tulkintakriteereistä ja niihin liittyvistä testimenetelmistä sekä FDA:n tälle lääkkeelle tunnustamista laadunvalvontastandardeista: https://www.fda.gov/STIC.
POTILASTIEDOT
Potilaita tulee neuvoa ottamaan yhteyttä lääkäriin, jos hoidon aikana ilmenee näön hämärtymistä tai näön menetystä, johon liittyy silmäkipua tai ei.
Liiallista etanolin nauttimista tulee välttää, koska psykoottista reaktiota on raportoitu.
Potilaita tulee neuvoa, että antibakteerisia lääkkeitä, mukaan lukien Trecator, tulee käyttää vain bakteeri-infektioiden hoitoon. Ne eivät hoida virusinfektioita (esim. flunssaa). Kun Trecatoria määrätään bakteeri-infektion hoitoon, potilaille tulee kertoa, että vaikka on yleistä, että olo paranee hoidon alussa, lääkettä tulee ottaa täsmälleen ohjeiden mukaan. Annosten väliin jättäminen tai koko hoitojakson suorittamatta jättäminen voi (1) heikentää välittömän hoidon tehokkuutta ja (2) lisätä todennäköisyyttä, että bakteerit kehittävät resistenssiä ja että niitä ei voida hoitaa Trecatorilla tai muilla antibakteerisilla lääkkeillä tulevaisuudessa.
