Amoxil 250mg, 500mg, 625mg, 1000mg Amoxicillin Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Amoxicillin on ja miten sitä käytetään?
Mikä on Amoxil 1000mg?
Amoxil on reseptilääke, jota käytetään monien erityyppisten bakteeri-infektioiden, kuten tonsilliittien, keuhkoputkentulehduksen, keuhkokuumeen ja korva-, nenä-, kurkku-, iho- tai virtsateiden infektioiden oireiden hoitoon. Amoxil 1000mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Amoxil kuuluu lääkeluokkaan, jota kutsutaan penisilliineiksi, aminoiksi.
Mitkä ovat Amoxilin mahdolliset sivuvaikutukset?
Amoxil voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nokkosihottuma,
- vaikeuksia hengittää,
- kasvojen, huulten, kielen tai kurkun turvotus,
- kuume,
- kipeä kurkku,
- palavat silmät,
- ihokipu,
- punainen tai violetti ihottuma, johon liittyy rakkuloita ja hilseilyä,
- kova vatsakipu ja
- vetistä tai veristä ripulia (vaikka se ilmaantuisi kuukausia viimeisen annoksen jälkeen)
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Amoxilin yleisimpiä sivuvaikutuksia ovat:
- pahoinvointi,
- oksentelua,
- ripuli ja
- ihottuma
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Amoxilin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
AMOXIL-formulaatiot sisältävät amoksisilliinia, puolisynteettistä antibioottia, ampisilliinin analogia, jolla on laaja kirjo bakterisidinen vaikutus monia grampositiivisia ja gramnegatiivisia mikro-organismeja vastaan. Kemiallisesti se on (2S,5,R,6,R)-6-[(,R)-(-)-2-amino-2-(p-hydroksifenyyli)asetamido]-3,3-dimetyyli-7- okso-4-tia-1-atsabisyklo[3.2.0]heptaani-2-karboksyylihappotrihydraatti. Se voidaan esittää rakenteellisesti seuraavasti:
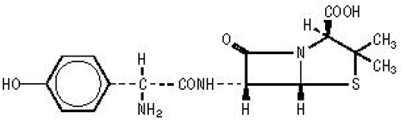
Amoksisilliinin molekyylikaava on C16H19N3O5S•3H2O ja molekyylipaino on 419,45.
Kapselit : Jokainen AMOXIL-kapseli, jossa on kuninkaallinen läpinäkymätön kansi ja vaaleanpunainen läpinäkymätön runko-osa, sisältää 250 mg tai 500 mg amoksisilliinia trihydraattina. 250 mg:n kapselin kanteen ja runkoon on painettu tuotenimet AMOXIL 1000mg ja 250; 500 mg:n kapselin kanteen ja runkoon on painettu AMOXIL 1000mg ja 500. Inaktiiviset aineet: D&C Red No. 28, FD&C Blue No. 1, FD&C Red No. 40, gelatiini, magnesiumstearaatti ja titaanidioksidi.
Yksi tabletti sisältää 500 mg tai 875 mg amoksisilliinia trihydraattina. Jokaisessa kalvopäällysteisessä, kapselinmuotoisessa, vaaleanpunaisessa tabletissa on AMOXIL 500mg, jonka keskipiste on 500 tai 875, vastaavasti. 875 mg:n tabletin kääntöpuolella on jakouurre. Ei-aktiiviset aineet: Kolloidinen piidioksidi, krospovidoni, FD&C Red No. 30 -alumiinilakka, hypromelloosi, magnesiumstearaatti, mikrokiteinen selluloosa, polyetyleeniglykoli, natriumtärkkelysglykolaatti ja titaanidioksidi.
Jauhe oraalisuspensiota varten Jokainen 5 ml käyttövalmiiksi saatettua suspensiota sisältää 125 mg, 200 mg, 250 mg tai 400 mg amoksisilliinia trihydraattina. Jokainen 5 ml 125 mg:n käyttökuntoon saatettua suspensiota sisältää 0,11 mekvivalenttia (2,51 mg) natriumia. Jokainen 5 ml 200 mg:n käyttökuntoon saatettua suspensiota sisältää 0,15 mekvivalenttia (3,39 mg) natriumia. Jokainen 5 ml 250 mg:n käyttökuntoon saatettua suspensiota sisältää 0,15 mekvivalenttia (3,36 mg) natriumia; jokainen 5 ml 400 mg:n käyttökuntoon saatettua suspensiota sisältää 0,19 mekvivalenttia (4,33 mg) natriumia. Ei-aktiiviset ainesosat: FD&C Red No. 3, aromit, silikageeli, natriumbentsoaatti, natriumsitraatti, sakkaroosi ja ksantaanikumi.
INDIKAATIOT
Korvan, nenän ja kurkun tulehdukset
AMOXIL® on tarkoitettu Streptococcus-lajien herkistä (VAIN β-laktamaasinegatiivisista) isolaateista johtuvien infektioiden hoitoon. (vain α- ja β-hemolyyttiset isolaatit), Streptococcus pneumoniae, Staphylococcus spp. tai Haemophilus influenzae.
Sukuelinten infektiot
AMOXIL® on tarkoitettu Escherichia colin, Proteus mirabilisin tai Enterococcus faecalisin herkkien (VAIN β-laktamaasinegatiivisten) isolaattien aiheuttamien infektioiden hoitoon.
Ihon ja ihon rakenteen tulehdukset
AMOXIL® on tarkoitettu Streptococcus spp.:n herkistä (VAIN β-laktamaasinegatiivisista) isolaateista johtuvien infektioiden hoitoon. (vain α- ja β-hemolyyttiset isolaatit), Staphylococcus spp. tai E. coli.
Alempien hengitysteiden infektiot
AMOXIL® on tarkoitettu Streptococcus spp.:n herkistä (VAIN β-laktamaasinegatiivisista) isolaateista johtuvien infektioiden hoitoon. (vain α- ja β-hemolyyttiset isolaatit), S. pneumoniae, Staphylococcus spp. tai H. influenzae.
Helicobacter pylori -infektio
Kolmoishoito Helicobacter Pylorille klaritromysiinin ja lansopratsolin kanssa
AMOXIL yhdessä klaritromysiinin ja lansopratsolin kanssa kolmoishoitona on tarkoitettu H. pylori -infektion ja pohjukaissuolihaavan (aktiivinen tai 1 vuoden historia pohjukaissuolihaava) hoitoon H. pylorin hävittämiseksi. H. pylorin hävittämisen on osoitettu vähentävän pohjukaissuolihaavan uusiutumisen riskiä.
Kaksoishoito H. Pylorille Lansopratsolin kanssa
AMOXIL yhdistettynä viivästetysti vapautuvien lansopratsolikapseleiden kanssa kaksoishoitona on tarkoitettu potilaiden hoitoon, joilla on H. pylori -infektio ja pohjukaissuolihaava (aktiivinen tai 1 vuoden historia pohjukaissuolihaava) jotka ovat allergisia tai intolerantteja klaritromysiinille tai joiden tiedetään tai epäillään olevan resistenssiä klaritromysiinille. (Katso klaritromysiinin pakkausseloste , Mikrobiologia .) H. pylorin hävittämisen on osoitettu vähentävän pohjukaissuolihaavan uusiutumisen riskiä.
Käyttö
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja AMOXILin (amoksisilliinin) ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi AMOXIL 250 mg:aa tulee käyttää vain sellaisten infektioiden hoitoon, joiden on todistettu tai epäillään olevan bakteerien aiheuttamia. Kun viljely- ja herkkyystiedot ovat saatavilla, ne tulee ottaa huomioon valittaessa tai muuttaessa antibakteerista hoitoa. Tällaisten tietojen puuttuessa paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa hoidon empiiriseen valintaan.
ANNOSTELU JA HALLINNOINTI
Annostus yli 3 kuukauden ikäisille aikuis- ja lapsipotilaille
Hoitoa on jatkettava vähintään 48–72 tuntia sen jälkeen, kun potilas on oireeton tai kun on saatu näyttöä bakteerien hävittämisestä. Streptococcus pyogenesin aiheuttamiin infektioihin suositellaan vähintään 10 päivän hoitoa akuutin reumakuumeen estämiseksi. Joissakin infektioissa hoito saattaa vaatia useita viikkoja. Kliinistä ja/tai bakteriologista seurantaa voi olla tarpeen jatkaa useita kuukausia hoidon lopettamisen jälkeen.
Annostelu vastasyntyneille ja vauvoille, joiden ikä on ≤ 12 viikkoa (≤ 3 kuukautta)
Hoitoa on jatkettava vähintään 48–72 tuntia sen jälkeen, kun potilas on oireeton tai kun on saatu näyttöä bakteerien hävittämisestä. Streptococcus pyogenesin aiheuttamiin infektioihin suositellaan vähintään 10 päivän hoitoa akuutin reumakuumeen estämiseksi. Koska munuaisten toiminta ei ole täysin kehittynyt, mikä vaikuttaa amoksisilliinin eliminaatioon tässä ikäryhmässä, AMOXILin suositeltu yläannos on 30 mg/kg/vrk jaettuna 12 tunnin välein. Tällä hetkellä ei ole olemassa annossuosituksia lapsipotilaille, joilla on munuaisten vajaatoiminta.
Annostus H. Pylori-infektioon
Kolminkertainen terapia
Suositeltu aikuisten suun kautta otettava annos on 1 g AMOXIL 1000 mg, 500 mg klaritromysiiniä ja 30 mg lansopratsolia, jotka kaikki annetaan kahdesti päivässä (12 tunnin välein) 14 päivän ajan.
Kaksoisterapia
Suositeltu aikuisten suun kautta otettava annos on 1 gramma AMOXIL 625 mg ja 30 mg lansopratsolia, kutakin kolme kertaa päivässä (8 tunnin välein) 14 päivän ajan. Katso täydelliset klaritromysiinin ja lansopratsolin ohjeet.
Annostus munuaisten vajaatoiminnassa
- Potilaiden, joilla on munuaisten vajaatoiminta, ei yleensä tarvitse pienentää annosta, ellei vajaatoiminta ole vakavaa.
- Vaikeasti heikentyneet potilaat, joiden glomerulussuodatusnopeus on
- Potilaiden, joiden glomerulussuodatusnopeus on 10–30 ml/min, tulee saada 500 mg tai 250 mg 12 tunnin välein infektion vakavuudesta riippuen.
- Potilaiden, joiden glomerulussuodatusnopeus on alle 10 ml/min, tulee saada 500 mg tai 250 mg 24 tunnin välein infektion vakavuudesta riippuen.
- Hemodialyysipotilaiden tulee saada 500 mg tai 250 mg 24 tunnin välein infektion vakavuudesta riippuen. Heille tulee antaa lisäannos sekä dialyysin aikana että sen lopussa.
Ohjeet oraalisuspension sekoittamiseen
Napauta pulloa, kunnes kaikki jauhe virtaa vapaasti. Lisää noin 1/3 käyttövalmiiksi saatettavan veden kokonaismäärästä (katso taulukko 2) ja ravista voimakkaasti kosteaan jauheeseen. Lisää loput vedestä ja ravista uudelleen voimakkaasti.
Käyttövalmiiksi saattamisen jälkeen tarvittava määrä suspensiota on asetettava suoraan lapsen kielelle nieltäväksi. Vaihtoehtoinen antotapa on lisätä tarvittava määrä suspensiota kaavaan, maitoon, hedelmämehuun, veteen, inkivääriolueseen tai kylmiin juomiin. Nämä valmisteet tulee sitten ottaa välittömästi.
HUOMAA: RAVISTA ORAL SUSPENSIAA HYVIN ENNEN KÄYTTÖÄ. Pidä pullo tiiviisti suljettuna. Käyttämätön osa käyttövalmiiksi saatetusta suspensiosta on hävitettävä 14 päivän kuluttua. Jäähdytys on suositeltavaa, mutta ei pakollista.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Kapselit
250 mg, 500 mg. Jokainen AMOXIL 625 mg kapseli, jossa on kuninkaallinen läpinäkymätön kansi ja vaaleanpunainen läpinäkymätön runko-osa, sisältää 250 mg tai 500 mg amoksisilliinia trihydraattina. 250 mg:n kapselin kanteen ja runkoon on painettu tuotenimet AMOXIL ja 250; 500 mg:n kapselin kanteen ja runkoon on painettu AMOXIL ja 500.
Tabletit
500 mg, 875 mg. Yksi tabletti sisältää 500 mg tai 875 mg amoksisilliinia trihydraattina. Jokaisessa kalvopäällysteisessä, kapselin muotoisessa, vaaleanpunaisessa tabletissa on AMOXIL, jonka keskipiste on vastaavasti yli 500 tai 875. 875 mg:n tabletin kääntöpuolella on jakouurre.
Jauhe oraalisuspensiota varten
125 mg/5 ml, 200 mg/5 ml, 250 mg/5 ml, 400 mg/5 ml. Jokainen 5 ml käyttövalmiiksi valmistettua mansikanmakuista suspensiota sisältää 125 mg amoksisilliinia trihydraattina. Jokainen 5 ml liuotettua purukumimakuista suspensiota sisältää 200 mg, 250 mg tai 400 mg amoksisilliinia trihydraattina.
Varastointi ja käsittely
Kapselit: Jokainen AMOXIL-kapseli, jossa on kuninkaallinen läpinäkymätön kansi ja vaaleanpunainen läpinäkymätön runko-osa, sisältää 250 mg tai 500 mg amoksisilliinia trihydraattina. 250 mg:n kapselin kanteen ja runkoon on painettu tuotenimet AMOXIL ja 250; 500 mg:n kapselin kanteen ja runkoon on painettu AMOXIL ja 500.
250 mg kapseli
NDC 43598-025-01 100 pullot NDC 43598-025-05 500 pullot
500 mg kapseli
NDC 43598-005-01 100 pullot NDC 43598-005-05 500 pullot
Yksi tabletti sisältää 500 mg tai 875 mg amoksisilliinia trihydraattina. Jokaisessa kalvopäällysteisessä, kapselin muotoisessa, vaaleanpunaisessa tabletissa on AMOXIL, jonka keskipiste on vastaavasti yli 500 tai 875. 875 mg:n tabletin kääntöpuolella on jakouurre.
500 mg tabletti
NDC 43598-024-01 100 pullot NDC 43598-024-05 500 pullot
875 mg:n tabletti
NDC 43598-019-01 100 pullot NDC 43598-019-14 20 pulloa
Jauhe oraalisuspensiota varten: Jokainen 5 ml käyttövalmiiksi valmistettua mansikanmakuista suspensiota sisältää 125 mg amoksisilliinia trihydraattina. Jokainen 5 ml liuotettua purukumimakuista suspensiota sisältää 200 mg, 250 mg tai 400 mg amoksisilliinia trihydraattina.
125 mg/5 ml
NDC 43598-022-80 80 ml:n pullo NDC 43598-022-52 100 ml:n pullo NDC 43598-022-53 150 ml:n pullo
200 mg/5 ml
NDC 43598-023-50 50 ml:n pullo NDC 43598-023-51 75 ml:n pullo NDC 43598-023-52 100 ml:n pullo
250 mg/5 ml
NDC 43598-009-80 80 ml:n pullo NDC 43598-009-52 100 ml:n pullo NDC 43598-009-53 150 ml:n pullo
400 mg/5 ml
NDC 43598-007-50 50 ml:n pullo NDC 43598-007-51 75 ml:n pullo NDC 43598-007-52 100 ml:n pullo
Säilytä 20 °C:ssa tai alle 250 mg:n ja 500 mg:n kapselit ja 125 mg ja 250 mg:n liuottamaton jauhe.
Säilytä enintään 25 °C:ssa (77 °F) -500 mg ja 875 mg tabletteja ja 200 mg ja 400 mg liuomatonta jauhetta.
Annostele tiiviiseen astiaan.
Valmistettu. Kirjoittaja: Dr. Reddy's Laboratories Tennessee, LLC. Bristol, TN 37620. Tarkistettu: syyskuussa 2015
SIVUVAIKUTUKSET
Seuraavaa käsitellään tarkemmin muissa merkintöjen osissa:
- Anafylaktiset reaktiot [katso VAROITUKSET JA VAROTOIMET ]
- CDAD [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Yleisimmät haittavaikutukset (> 1 %), jotka havaittiin AMOXIL-kapseleiden, tablettien tai oraalisuspension kliinisissä tutkimuksissa, olivat ripuli, ihottuma, oksentelu ja pahoinvointi.
Kolminkertainen terapia : Kolmoishoitoa (amoksisilliini/klaritromysiini/lansopratsoli) saaneiden potilaiden yleisimmin raportoidut haittatapahtumat olivat ripuli (7 %), päänsärky (6 %) ja makuaistin vääristyminen (5 %).
Kaksoisterapia : Amoksisilliini/lansopratsoli-kaksoishoitoa saaneilla potilailla yleisimmin raportoidut haittatapahtumat olivat ripuli (8 %) ja päänsärky (7 %). Lisätietoja klaritromysiinin tai lansopratsolin aiheuttamista haittavaikutuksista on niiden pakkausselosteissa Haittavaikutukset.
Jälkimarkkinoinnin tai muun kokemuksen
Kliinisissä tutkimuksissa raportoitujen haittatapahtumien lisäksi seuraavat tapahtumat on tunnistettu penisilliinien markkinoille tulon jälkeen. Koska ne raportoidaan vapaaehtoisesti tuntemattoman kokoisesta populaatiosta, arvioita esiintymistiheydestä ei voida tehdä. Nämä tapahtumat on valittu sisällytettäväksi niiden vakavuuden, ilmoitustiheyden tai mahdollisen syy-yhteyden AMOXILiin yhdistelmän vuoksi.
- Infektiot ja infektiot : Mukokutaaninen kandidoosi.
- Ruoansulatuskanava : Musta karvainen kieli ja hemorraginen/pseudomembranoottinen paksusuolitulehdus. Pseudomembranoottisen paksusuolitulehduksen oireet voivat ilmaantua antibakteerisen hoidon aikana tai sen jälkeen [katso VAROITUKSET JA VAROTOIMET ].
- Yliherkkyysreaktiot : Anafylaksia [katso VAROITUKSET JA VAROTOIMET ]. Seerumitaudin kaltaisia reaktioita, erytematoottista makulopapulaarista ihottumaa, erythema multiformea, Stevens-Johnsonin oireyhtymää, eksfoliatiivista ihotulehdusta, toksista epidermaalista nekrolyysiä, akuuttia yleistynyttä eksantematoottista pustuloosia, yliherkkyysvaskuliittia ja urtikariaa on raportoitu.
- Maksa ASAT- ja/tai ALAT-arvojen kohtalaista nousua on havaittu, mutta tämän löydön merkitystä ei tunneta. Maksan toimintahäiriöitä, mukaan lukien kolestaattinen keltaisuus, maksakolestaasi ja akuutti sytolyyttinen hepatiitti, on raportoitu.
- Munuaiset : Crystalluriaa on raportoitu [katso YLIANNOSTUS ].
- Hemic ja lymfaattiset järjestelmät : Anemiaa, mukaan lukien hemolyyttinen anemia, trombosytopenia, trombosytopeeninen purppura, eosinofilia, leukopenia ja agranulosytoosi on raportoitu. Nämä reaktiot palautuvat yleensä hoidon lopettamisen jälkeen, ja niiden uskotaan olevan yliherkkyysilmiöitä.
- Keskushermosto : Palautuvaa hyperaktiivisuutta, kiihtyneisyyttä, ahdistusta, unettomuutta, sekavuutta, kouristuksia, käyttäytymismuutoksia ja/tai huimausta on raportoitu
- Sekalaista : Hampaiden värjäytymistä (ruskeaa, keltaista tai harmaata värjäytymistä) on raportoitu. Useimmat ilmoitukset tapahtuivat lapsipotilailla. Värinmuutos väheni tai poistui harjaamalla tai hampaiden puhdistuksella useimmissa tapauksissa.
HUUMEIDEN VUOROVAIKUTUKSET
Probenesidi
Probenesidi vähentää amoksisilliinin eritystä munuaistiehyissä. Amoksisilliinin ja probenesidin samanaikainen käyttö voi johtaa veren amoksisilliinipitoisuuden nousuun ja pitkittymiseen.
Oraaliset antikoagulantit
Epänormaalia protrombiiniajan pidentymistä (lisääntynyt kansainvälinen normalisoitu suhde [INR]) on raportoitu potilailla, jotka ovat saaneet amoksisilliinia ja oraalisia antikoagulantteja. Asianmukaista seurantaa tulee suorittaa, kun antikoagulantteja määrätään samanaikaisesti. Suun kautta otettavien antikoagulanttien annosta voi olla tarpeen muuttaa halutun antikoagulanttitason ylläpitämiseksi.
Allopurinoli
Allopurinolin ja amoksisilliinin samanaikainen käyttö lisää ihottumien ilmaantuvuutta potilailla, jotka saavat kumpaakin lääkettä verrattuna potilaisiin, jotka saavat amoksisilliinia yksinään. Ei tiedetä, johtuuko tämä amoksisilliini-ihottumien voimistuminen allopurinolista tai näillä potilailla esiintyvästä hyperurikemiasta.
Ehkäisypillerit
AMOXIL voi vaikuttaa suolistoflooraan, mikä heikentää estrogeenin reabsorptiota ja heikentää oraalisten estrogeeni/progesteroni-yhdistelmäehkäisyvalmisteiden tehoa.

Muut antibakteeriset aineet
Kloramfenikoli, makrolidit, sulfonamidit ja tetrasykliinit voivat häiritä penisilliinin bakteereja tappavia vaikutuksia. Tämä on osoitettu in vitro; tämän yhteisvaikutuksen kliinistä merkitystä ei kuitenkaan ole hyvin dokumentoitu.
Vaikutukset laboratoriokokeisiin
Korkeat ampisilliinipitoisuudet virtsassa voivat aiheuttaa vääriä positiivisia reaktioita, kun virtsassa olevaa glukoosia testataan CLINITEST®-, Benedict's Solution- tai Fehling's Solution -liuoksella. Koska tämä vaikutus saattaa ilmetä myös amoksisilliinin kanssa, on suositeltavaa käyttää entsymaattisiin glukoosioksidaasireaktioihin perustuvia glukoositestejä (kuten CLINISTIX®).
Kun ampisilliinia tai amoksisilliinia on annettu raskaana oleville naisille, konjugoidun estriolin, estrioliglukuronidin, konjugoidun estronin ja estradiolin plasmapitoisuuden ohimenevä väheneminen on havaittu.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Anafylaktiset reaktiot
Vakavia ja joskus kuolemaan johtaneita yliherkkyysreaktioita (anafylaktisia) on raportoitu potilailla, jotka ovat saaneet penisilliinihoitoa, mukaan lukien amoksisilliinia. Vaikka anafylaksia on yleisempää parenteraalisen hoidon jälkeen, sitä on esiintynyt potilailla, jotka ovat saaneet suun kautta otettavia penisilliinejä. Näitä reaktioita esiintyy todennäköisemmin henkilöillä, joilla on aiemmin ollut yliherkkyys penisilliinille ja/tai herkkyys useille allergeeneille. On raportoitu henkilöitä, joilla on ollut penisilliiniyliherkkyyttä ja jotka ovat kokeneet vakavia reaktioita kefalosporiinihoidon aikana. Ennen AMOXIL-hoidon aloittamista on tutkittava huolellisesti aiemmat yliherkkyysreaktiot penisilliineille, kefalosporiineille tai muille allergeeneille.
Clostridium Difficilen liittyvä ripuli
Clostridium difficileen liittyvää ripulia (CDAD) on raportoitu käytettäessä lähes kaikkia antibakteerisia aineita, mukaan lukien AMOXIL, ja sen vaikeusaste voi vaihdella lievästä ripulista kuolemaan johtavaan paksusuolentulehdukseen. Hoito antibakteerisilla aineilla muuttaa paksusuolen normaalia kasvillisuutta, mikä johtaa C. difficilen liikakasvuun.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CDAD:n kehittymistä. Hypertoksiinia tuottavat C. difficilen kannat lisäävät sairastuvuutta ja kuolleisuutta, koska nämä infektiot voivat olla vastustuskykyisiä antimikrobiselle hoidolle ja saattavat vaatia kolektomiaa. CDAD on otettava huomioon kaikilla potilailla, joilla on ripulia antibakteeristen lääkkeiden käytön jälkeen. Huolellinen sairaushistoria on tarpeen, koska CDAD:n on raportoitu esiintyvän yli 2 kuukauden kuluttua antibakteeristen aineiden annosta.
Jos CDAD epäillään tai varmistetaan, jatkuva antibioottien käyttö, joka ei ole suunnattu C. difficileä vastaan, saattaa olla tarpeen lopettaa. Asianmukainen neste- ja elektrolyyttihallinta, proteiinilisä, C. difficilen antibioottihoito ja kirurginen arviointi tulee aloittaa kliinisen aiheen mukaan.
Lääkeresistenttien bakteerien kehittäminen
AMOXILin määrääminen ilman todistettua tai vahvasti epäiltyä bakteeri-infektiota ei todennäköisesti hyödytä potilasta ja lisää lääkeresistenttien bakteerien kehittymisen riskiä
Käyttö potilailla, joilla on mononukleoosi
Suuri osa amoksisilliinia saavista mononukleoosipotilaista kehittää punoittavan ihottuman. Siksi amoksisilliinia ei tule antaa potilaille, joilla on mononukleoosi.
Fenyyliketonuurit
Amoxil 250 mg purutabletit sisältävät aspartaamia, joka sisältää fenyylialaniinia. Yksi 200 mg:n purutabletti sisältää 1,82 mg fenyylialaniinia; yksi 400 mg:n purutabletti sisältää 3,64 mg fenyylialaniinia. Amoxil-oraalisuspensiot eivät sisällä fenyylialaniinia, ja fenyyliketonuriikat voivat käyttää niitä.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Pitkäaikaisia eläinkokeita ei ole suoritettu karsinogeenisen potentiaalin arvioimiseksi. Tutkimuksia amoksisilliinin pelkän mutageenisen potentiaalin havaitsemiseksi ei ole tehty; kuitenkin seuraavat tiedot ovat saatavilla testeistä 4:1 amoksisilliinin ja kaliumklavulanaatin (AUGMENTIN) seoksella. AUGMENTIN ei ollut mutageeninen Amesin bakteerimutaatiomäärityksessä ja hiivan geenimuunnosmäärityksessä. AUGMENTIN oli heikosti positiivinen hiiren lymfoomamäärityksessä, mutta suuntaus kohti lisääntynyttä mutaatiotaajuutta tässä määrityksessä esiintyi annoksilla, jotka liittyivät myös solujen eloonjäämisen vähenemiseen. AUGMENTIN oli negatiivinen hiiren mikrotumatestissä ja hallitsevassa tappavassa määrityksessä hiirillä. Pelkästään kaliumklavulanaattia testattiin Amesin bakteerimutaatiomäärityksessä ja hiiren mikrotumatestissä, ja se oli negatiivinen kaikissa näissä määrityksissä. Rotilla tehdyssä usean sukupolven lisääntymistutkimuksessa ei havaittu hedelmällisyyden heikkenemistä tai muita haitallisia lisääntymisvaikutuksia annoksilla 500 mg/kg asti (noin 2 kertaa ihmisen 3 g:n annos kehon pinta-alan perusteella).
Käyttö tietyissä populaatioissa
Raskaus
Teratogeeniset vaikutukset
Raskausluokka B. Lisääntymistutkimuksia on suoritettu hiirillä ja rotilla annoksilla 2000 mg/kg asti (3 ja 6 kertaa ihmisen 3 g:n annos, kehon pinta-alan perusteella). Ei ollut näyttöä amoksisilliinin aiheuttamasta haitasta sikiölle. Ei kuitenkaan ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, amoksisilliinia tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Työ ja toimitus
Suun kautta otettava ampisilliini imeytyy huonosti synnytyksen aikana. Ei tiedetä, onko amoksisilliinin käytöllä ihmisillä synnytyksen tai synnytyksen aikana välittömiä tai viivästyneitä haitallisia vaikutuksia sikiöön, pidentääkö synnytyksen kestoa vai lisääkö synnytyshoidon tarvetta.
Imettävät äidit
Penisilliinien on osoitettu erittyvän äidinmaitoon. Amoksisilliinin käyttö imettävillä äideillä voi aiheuttaa imeväisten herkistymistä. Varovaisuutta on noudatettava, kun amoksisilliinia annetaan imettävälle naiselle.
Käyttö lapsille
Amoksisilliinin eliminaatio saattaa viivästyä, koska vastasyntyneiden ja pikkulasten munuaisten toiminta ei ole täysin kehittynyt. AMOXIL 625 mg:n annosta tulee muuttaa 12 viikon tai sitä nuoremmilla lapsipotilailla (≤ 3 kuukautta). [Katso ANNOSTELU JA HALLINNOINTI ]
Geriatrinen käyttö
AMOXIL 250 mg:n kliinisten tutkimusten analyysi suoritettiin sen määrittämiseksi, reagoivatko 65-vuotiaat ja sitä vanhemmat henkilöt eri tavalla kuin nuoremmat. Nämä analyysit eivät ole havainneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin iäkkäiden henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
Tämän lääkkeen tiedetään erittyvän olennaisesti munuaisten kautta, ja tämän lääkkeen toksisten reaktioiden riski voi olla suurempi potilailla, joilla on heikentynyt munuaisten toiminta. Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, annoksen valinnassa on oltava varovainen, ja munuaisten toiminnan seuranta voi olla hyödyllistä.
Annostus munuaisten vajaatoiminnassa
Amoksisilliini eliminoituu ensisijaisesti munuaisten kautta, ja annostusta on yleensä muutettava potilailla, joilla on vaikea munuaisten vajaatoiminta (GFR Annostus munuaisten vajaatoiminnassa erityisiä suosituksia potilaille, joilla on munuaisten vajaatoiminta.
YLIANNOSTUS
Yliannostustapauksissa lopeta lääkitys, hoida oireenmukaisesti ja ryhdy tarvittaessa tukitoimenpiteisiin. Myrkytystietokeskuksessa 51 lapsipotilaalla tehty prospektiivinen tutkimus osoitti, että alle 250 mg/kg amoksisilliinin yliannostuksiin ei liity merkittäviä kliinisiä oireita.
Oliguriseen munuaisten vajaatoimintaan johtanutta interstitiaalista nefriittiä on raportoitu pienellä määrällä potilaita amoksisilliinin yliannostuksen jälkeen1.
Kristalluriaa, joka joissakin tapauksissa johtaa munuaisten vajaatoimintaan, on raportoitu myös amoksisilliinin yliannostuksen jälkeen aikuisilla ja lapsipotilailla. Yliannostustapauksissa tulee jatkaa riittävää nesteen saantia ja diureesia amoksisilliinikristallurian riskin vähentämiseksi.
Munuaisten vajaatoiminta näyttää palautuvan, kun lääkkeen anto lopetetaan. Korkeat veren pitoisuudet voivat ilmaantua helpommin potilailla, joilla on munuaisten vajaatoiminta, koska amoksisilliinin munuaispuhdistuma on heikentynyt. Amoksisilliini voidaan poistaa verenkierrosta hemodialyysillä.
VASTA-AIHEET
AMOXIL 625mg on vasta-aiheinen potilailla, joilla on ollut vakava yliherkkyysreaktio (esim. anafylaksia tai Stevens-Johnsonin oireyhtymä) AMOXILille tai muille β-laktaamiantibiooteille (esim. penisilliineille ja kefalosporiineille).
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Amoksisilliini on antibakteerinen lääke. [katso Mikrobiologia ].
Farmakokinetiikka
Imeytyminen
Amoksisilliini on stabiili mahahapon läsnä ollessa ja imeytyy nopeasti oraalisen annon jälkeen. Ruoan vaikutusta amoksisilliinin imeytymiseen AMOXIL-tableteista ja -suspensiosta on tutkittu osittain; 400 mg:n ja 875 mg:n formulaatioita on tutkittu vain, kun ne on annettu kevyen aterian alussa.
Suun kautta annetut 250 mg:n ja 500 mg:n amoksisilliinikapseleiden annokset johtavat keskimääräisiin huippupitoisuuksiin veressä 1–2 tuntia annon jälkeen välillä 3,5–5,0 mcg/ml ja 5,5–7,5 mcg/ml. .
Keskimääräiset amoksisilliinin farmakokineettiset parametrit avoimessa, kaksiosaisessa, kerta-annoksessa 27 aikuisen bioekvivalenssitutkimuksessa, jossa verrattiin 875 mg AMOXILia 875 mg:aan AUGMENTIN® (amoksisilliini/klavulanaattikalium), osoittivat, että 875 mg:n tabletti tuottaa 5 AMOXIL-tablettia. AUC0-∞ 35,4 ± 8,1 mcg•hr/ml ja Cmax 13,8 ± 4,1 mcg/ml. Annostelu tapahtui kevyen aterian alussa yön yli paaston jälkeen.
Suun kautta annetut amoksisilliinisuspension annokset, 125 mg/5 ml ja 250 mg/5 ml, johtavat keskimääräisiin huippupitoisuuksiin veressä 1–2 tunnin kuluttua annosta välillä 1,5–3,0 mikrogrammaa/ml ja 3,5–3,5 mikrogrammaa/ml. 5,0 mcg/ml, vastaavasti.
Kun kerta-annoksia 400 mg purutabletteja ja 400 mg/5 ml AMOXIL 625 mg suspensiota annettiin suun kautta 24 aikuiselle vapaaehtoiselle, saatiin vertailukelpoisia farmakokineettisiä tietoja:
Jakelu
Amoksisilliini diffundoituu helposti useimpiin kehon kudoksiin ja nesteisiin, aivo- ja selkäydinnesteitä lukuun ottamatta, paitsi silloin, kun aivokalvot ovat tulehtuneet. Veriseerumissa amoksisilliini sitoutuu proteiineihin noin 20-prosenttisesti. 1 gramman annoksen jälkeen ja käyttämällä erityistä ihoikkunatekniikkaa antibiootin pitoisuuksien määrittämiseen havaittiin, että interstitiaalisesta nesteestä löydettiin terapeuttisia tasoja.
Aineenvaihdunta ja erittyminen
Amoksisilliinin puoliintumisaika on 61,3 minuuttia. Noin 60 % suun kautta annetusta amoksisilliiniannoksesta erittyy virtsaan 6-8 tunnin kuluessa. Havaittavissa olevat seerumipitoisuudet havaitaan jopa 8 tunnin kuluttua suun kautta annetun amoksisilliiniannoksen jälkeen. Koska suurin osa amoksisilliinista erittyy muuttumattomana virtsaan, sen erittyminen voi hidastua, jos probenesidiä annetaan samanaikaisesti [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Mikrobiologia
Toimintamekanismi
Amoksisilliini on samanlainen kuin penisilliini bakteereja tappavassa vaikutuksessaan herkkiä bakteereja vastaan aktiivisen lisääntymisvaiheen aikana. Se toimii estämällä soluseinän biosynteesiä, mikä johtaa bakteerien kuolemaan.
Vastustusmekanismi
Resistenssi amoksisilliinille välittyy ensisijaisesti beetalaktamaaseiksi kutsuttujen entsyymien kautta, jotka katkaisevat amoksisilliinin beetalaktaamirenkaan ja tekevät sen inaktiiviseksi.
Amoksisilliinin on osoitettu olevan aktiivinen useimpia alla lueteltujen bakteerien isolaatteja vastaan sekä in vitro että kliinisissä infektioissa, kuten KÄYTTÖAIHEET JA KÄYTTÖ osio.
Gram-positiiviset bakteerit
Enterococcus faecalis Staphylococcus spp. Streptococcus pneumoniae Streptococcus spp. (alfa- ja beetahemolyyttinen)
Gram-negatiiviset bakteerit
Escherichia coli Haemophilus influenzae Helicobacter pylori Proteus mirabilis
Herkkyystestimenetelmät
Kliinisen mikrobiologian laboratorion tulee toimittaa lääkärille paikallisissa sairaaloissa ja vastaanottoalueilla käytettävien mikrobilääkkeiden kumulatiiviset in vitro -herkkyystestien tulokset määräaikaisraportteina, jotka kuvaavat sairaalasta ja yhteisöstä hankittujen patogeenien herkkyysprofiilia, mikäli mahdollista. Näiden raporttien pitäisi auttaa lääkäriä valitsemaan tehokkain antimikrobinen lääke.
Laimennustekniikat: Kvantitatiivisia menetelmiä käytetään antimikrobisten vähimmäisinhibitoristen pitoisuuksien (MIC) määrittämiseen. Nämä MIC-arvot antavat arvioita bakteerien herkkyydestä antimikrobisille yhdisteille. MIC-arvot on määritettävä käyttämällä standardoitua testimenetelmää (liemi tai agar)2,4. MIC-arvot tulee tulkita taulukon 4 kriteerien mukaisesti.
Diffuusiotekniikat: Kvantitatiiviset menetelmät, jotka edellyttävät vyöhykkeiden halkaisijoiden mittaamista, voivat myös tarjota toistettavia arvioita bakteerien herkkyydestä antimikrobisille yhdisteille3,4. Vyöhykkeen koko on määritettävä standardoidulla testimenetelmällä3.
Enterococcus spp.:n, Enterobacteriaceaen ja H. influenzaen herkkyys amoksisilliinille voidaan päätellä testaamalla ampisilliini4. Staphylococcus spp.:n ja beetahemolyyttisen Streptococcus spp.:n herkkyys amoksisilliinille voidaan päätellä penisilliinitestauksella4. Suurin osa Enterococcus spp. jotka ovat resistenttejä ampisilliinille tai amoksisilliinille, tuottavat TEM-tyyppistä beetalaktamaasia. Beetalaktamaasitesti voi tarjota nopean tavan määrittää resistenssi ampisilliinille ja amoksisilliinille4.
Streptococcus pneumoniaen (ei-meningiitti-isolaatit) herkkyys amoksisilliinille voidaan päätellä testaamalla penisilliiniä tai oksasilliinia4. S. pneumoniaen tulkintakriteerit amoksisilliinille on esitetty taulukossa 44.
"Herkkä"-raportti osoittaa, että antimikrobinen aine todennäköisesti estää patogeenin kasvua, jos antimikrobinen yhdiste saavuttaa tartuntakohdassa pitoisuuden, joka on tarpeen patogeenin kasvun estämiseksi. "Keskitaso"-raportti osoittaa, että tulosta on pidettävä epäselvänä, ja jos mikro-organismi ei ole täysin herkkä vaihtoehtoisille, kliinisesti toteuttamiskelpoisille lääkkeille, testi on toistettava. Tämä luokka tarkoittaa mahdollista kliinistä käyttökelpoisuutta kehon alueilla, joissa lääke on fysiologisesti keskittynyt. Tämä kategoria tarjoaa myös puskurivyöhykkeen, joka estää pieniä hallitsemattomia teknisiä tekijöitä aiheuttamasta suuria tulkintaeroja. Raportti "Resistant" osoittaa, että antimikrobinen aine ei todennäköisesti estä patogeenin kasvua, jos antimikrobinen yhdiste saavuttaa pitoisuuden, joka on yleensä saavutettavissa infektiokohdassa; tulee valita muu hoitomuoto.
Herkkyystestaus Helicobacter Pylorille
Amoksisilliinin in vitro -herkkyystestausmenetelmiä pienimmän estävän pitoisuuden (MIC) ja vyöhykekoon määrittämiseksi ei ole standardoitu, validoitu tai hyväksytty H. pylori -testaukseen. Näytteet H. pylori- ja klaritromysiiniherkkyystestien tuloksista tulee ottaa isolaateista potilaista, jotka eivät ole saaneet kolmoishoitoa. Jos havaitaan klaritromysiiniresistenssi, on käytettävä ei-klaritromysiiniä sisältävää hoito-ohjelmaa.
Laadunvalvonta
Standardoidut herkkyystestimenetelmät2,3,4 edellyttävät laboratoriokontrollien käyttöä määrityksessä käytettyjen tarvikkeiden ja reagenssien sekä testikontrollin suorittavien henkilöiden tekniikoiden tarkkuuden ja tarkkuuden valvomiseksi ja varmistamiseksi. Tavallisen amoksisilliinijauheen tulee antaa seuraavat taulukossa 54 esitetyt MIC-arvot. Diffuusiotekniikan osalta taulukossa 5 esitetyt kriteerit tulee saavuttaa.
Kliiniset tutkimukset
H. pylorin hävittäminen pohjukaissuolihaavan uusiutumisen riskin vähentämiseksi
Yhdysvalloissa tehdyissä satunnaistetuissa kaksoissokkoutetuissa kliinisissä tutkimuksissa potilailla, joilla oli helikobakteeri ja pohjukaissuolihaava (määritelty aktiiviseksi haavaksi tai haavaksi 1 vuoden sisällä) arvioitiin lansopratsolin tehoa yhdessä amoksisilliinikapseleiden ja klaritromysiinitablettien kanssa. kolminkertaisena 14 päivän hoitona tai yhdessä amoksisilliinikapseleiden kanssa 14 päivän kaksoishoitona H. pylorin hävittämiseen. Näiden tutkimusten tulosten perusteella vahvistettiin kahden erilaisen hävitysohjelman turvallisuus ja tehokkuus: Kolmoishoito: Amoksisilliini 1 gramma kahdesti vuorokaudessa / klaritromysiini 500 mg kahdesti vuorokaudessa / lansopratsoli 30 mg kahdesti vuorokaudessa (ks. taulukko 6). Kaksoishoito: amoksisilliini 1 gramma kolme kertaa vuorokaudessa / lansopratsoli 30 mg kolmesti vuorokaudessa (katso taulukko 7. Kaikki hoidot kestivät 14 päivää. H. pylori -hävitys määriteltiin kahdeksi negatiiviseksi kokeeksi (viljely ja histologia) 4-6 viikon kuluttua hoidon aloittamisesta. hoidon lopussa Kolmoishoidon osoitettiin olevan tehokkaampi kuin kaikki mahdolliset kaksoishoitoyhdistelmät Kaksoishoidon osoitettiin tehokkaammaksi kuin molemmat monoterapiat H. pylorin hävittämisen on osoitettu vähentävän pohjukaissuolihaavan uusiutumisen riskiä.
VIITTEET
1. Swanson-Biearman B, Dean BS, Lopez G, Krenzelok EP. Penisilliinin ja kefalosporiinin nauttimisen vaikutukset alle kuuden vuoden ikäisille lapsille. Vet Hum Toxicol. 1988; 30: 66-67.
2. Clinical and Laboratory Standards Institute (CLSI). Aerobisesti kasvavien bakteerien antimikrobisen herkkyystestien laimennusmenetelmät; Hyväksytty standardi – kymmenes painos. CLSI-dokumentti M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
3. Clinical and Laboratory Standards Institute (CLSI). Antimikrobisten levyjen diffuusioherkkyystestien suorituskykystandardit; Hyväksytty standardi – kahdestoista painos. CLSI-dokumentti M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
4. Clinical and Laboratory Standards Institute (CLSI). Suorituskykystandardit antimikrobiaaliselle herkkyystestaukselle; Kahdeskymmenesviides tiedote, CLSI-asiakirja M100-S25. CLSI-dokumentti M100-S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
POTILASTIEDOT
- Potilaille tulee kertoa, että AMOXIL voidaan ottaa 8 tunnin tai 12 tunnin välein määrätystä annoksesta riippuen.
- Potilaita tulee neuvoa, että antibakteerisia lääkkeitä, mukaan lukien AMOXIL, tulee käyttää vain bakteeri-infektioiden hoitoon. Ne eivät hoida virusinfektioita (esim. flunssaa). Kun AMOXIL 250mg on määrätty bakteeri-infektion hoitoon, potilaille tulee kertoa, että vaikka on yleistä, että olo paranee hoidon alussa, lääke tulee ottaa täsmälleen ohjeiden mukaan. Annosten väliin jättäminen tai koko hoitojakson suorittamatta jättäminen voi: (1) heikentää välittömän hoidon tehokkuutta ja (2) lisätä todennäköisyyttä, että bakteerit kehittävät resistenssiä, eikä niitä voida hoitaa AMOXIL 625 mg:lla tai muilla antibakteerisilla lääkkeillä tulevaisuudessa. .
- Potilaita tulee neuvoa, että ripuli on yleinen antibioottien aiheuttama ongelma, joka yleensä päättyy antibiootin käytön lopettamiseen. Joskus antibioottihoidon aloittamisen jälkeen potilaille voi ilmaantua vetisiä ja verisiä ulosteita (vatsakouristuksella ja kuumeella tai ilman) jopa 2 kuukautta tai enemmänkin viimeisen antibioottiannoksen ottamisen jälkeen. Jos näin tapahtuu, potilaiden tulee ottaa yhteyttä lääkäriin mahdollisimman pian.
- Potilaiden tulee olla tietoisia siitä, että AMOXIL sisältää penisilliiniluokan lääkevalmistetta, joka voi aiheuttaa allergisia reaktioita joillekin henkilöille.
