Keflex 250mg, 500mg Cephalexin Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Keflex 250mg on ja miten sitä käytetään?
Keflex on reseptilääke, jota käytetään erilaisten bakteeri-infektioiden oireiden hoitoon estämällä bakteerien kasvua. Keflex 500mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Keflex tunnetaan kefalosporiiniantibioottina.
Mitkä ovat Keflexin sivuvaikutukset?
Keflex voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- kova vatsakipu,
- vetistä tai veristä ripulia,
- epätavallinen väsymys,
- huimaus tai hengenahdistus,
- helppo mustelma,
- epätavallinen verenvuoto,
- violetit tai punaiset täplät ihon alla,
- kohtaus,
- kalpea iho,
- kylmät kädet ja jalat,
- kellastunut iho, tumma virtsa,
- kuume,
- heikkous,
- kipu kyljessäsi tai alaselässäsi,
- kivulias virtsaaminen,
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Keflex 500mg:n yleisimmät sivuvaikutukset ovat:
- ripuli,
- pahoinvointi,
- oksentelua,
- ruoansulatushäiriöt,
- vatsakipu,
- emättimen kutina tai vuoto,
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Keflexin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
KEFLEX® (kefaleksiini) kapselit, USP on puolisynteettinen kefalosporiinien antibakteerinen lääke, joka on tarkoitettu suun kautta annettavaksi. Se on 7-(D-a-amino-a-fenyyliasetamido)-3-metyyli-3-kefem-4-karboksyylihappomonohydraatti. Kefaleksiinin molekyylikaava on C16H17N3O4S•H2O ja molekyylipaino on 365,41.
Kefaleksiinilla on seuraava rakennekaava:
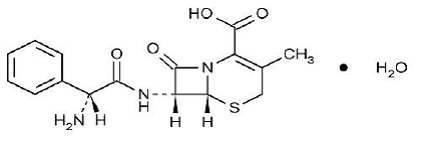
Jokainen kapseli sisältää kefaleksiinimonohydraattia, joka vastaa 250 mg, 500 mg tai 750 mg kefaleksiinia. Kapselit sisältävät myös karboksimetyyliselluloosanatriumia, D&C Yellow No. 10:tä, dimetikonia, FD&C Blue No. 1:tä, FD&C Yellow No. 6:a, gelatiinia, magnesiumstearaattia, mikrokiteistä selluloosaa ja titaanidioksidia.
INDIKAATIOT
Hengitysteiden infektiot
KEFLEX on tarkoitettu Streptococcus pneumoniaen ja Streptococcus pyogenesin herkkien isolaattien aiheuttamien hengitystieinfektioiden hoitoon.
Välikorvatulehdus
KEFLEX on tarkoitettu Streptococcus pneumoniaen, Haemophilus influenzaen, Staphylococcus aureuksen, Streptococcus pyogenesin ja Moraxella catarrhaliksen herkkien isolaattien aiheuttaman välikorvantulehduksen hoitoon.
Ihon ja ihon rakenteen infektiot
KEFLEX 250mg on tarkoitettu seuraavien grampositiivisten bakteerien herkkien isolaattien aiheuttamien iho- ja ihorakenteen infektioiden hoitoon: Staphylococcus aureus ja Streptococcus pyogenes.
Luun infektiot
KEFLEX 250mg on tarkoitettu Staphylococcus aureuksen ja Proteus mirabilisin herkkien isolaattien aiheuttamien luuinfektioiden hoitoon.
Sukuelinten infektiot
KEFLEX on tarkoitettu Escherichia colin, Proteus mirabilisin ja Klebsiella pneumoniaen herkkien isolaattien aiheuttamien virtsatieinfektioiden, mukaan lukien akuutin eturauhastulehduksen, hoitoon.
Käyttö
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja KEFLEX 250mg:n ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi KEFLEX 500mg -valmistetta tulee käyttää vain sellaisten infektioiden hoitoon, joiden on todistettu tai epäillään olevan herkkien bakteerien aiheuttamia. Kun viljely- ja herkkyystietoja on saatavilla, nämä tiedot tulee ottaa huomioon valittaessa tai muuttaessa antibakteerista hoitoa. Tällaisten tietojen puuttuessa paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa hoidon empiiriseen valintaan.
ANNOSTELU JA HALLINNOINTI
Aikuiset ja vähintään 15-vuotiaat lapsipotilaat
Tavallinen oraalisen KEFLEX 250 mg:n annos on 250 mg 6 tunnin välein, mutta 500 mg:n annos 12 tunnin välein voidaan antaa. Hoitoa annetaan 7-14 päivää.
Vaikeammissa infektioissa voidaan tarvita suurempia annoksia suun kautta otettavaa KEFLEXiä, jopa 4 grammaa päivässä kahdesta neljään yhtä suureen annokseen jaettuna.
Pediatriset potilaat (yli 1-vuotiaat)
Suun kautta otettavan KEFLEX 500 mg:n suositeltu päiväannos lapsipotilaille on 25-50 mg/kg jaettuna tasan annoksiin 7-14 päivän ajan. β-hemolyyttisten streptokokki-infektioiden hoidossa suositellaan vähintään 10 päivän kestoa. Vakavissa infektioissa vuorokausiannos 50-100 mg/kg voidaan antaa tasan jaettuna annoksina.
Välikorvan tulehduksen hoidossa suositeltu vuorokausiannos on 75-100 mg/kg jaettuna tasan annoksiin.
Annoksen muuttaminen vähintään 15-vuotiaille aikuis- ja lapsipotilaille, joilla on munuaisten vajaatoiminta
Anna seuraavat KEFLEXin annostusohjelmat potilaille, joilla on heikentynyt munuaisten toiminta [katso VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
250 mg kapselit: valkoinen tai vaaleankeltainen jauhe, joka on täytetty läpinäkymättömään valkoiseen ja läpinäkymättömään tummanvihreään kapseliin, jonka valkoiseen runkoon on painettu KEFLEX 250 mg syötävällä mustalla musteella.
500 mg kapselit: valkoinen tai vaaleankeltainen jauhe, joka on täytetty läpinäkymättömään vaaleanvihreään ja läpinäkymättömään tummanvihreään kapseliin, jonka vaaleanvihreään runkoon on painettu KEFLEX 500 mg syötävällä mustalla musteella.
750 mg kapselit: valkoinen tai vaaleankeltainen jauhe, joka on täytetty pitkänomaiseen läpinäkymättömään tummanvihreään ja läpinäkymättömään tummanvihreään kapseliin, jonka tummanvihreään runkoon on painettu KEFLEX 750 mg syötävällä valkoisella musteella.
Varastointi ja käsittely
KEFLEX (kefaleksiini) kapselit , USP, toimitetaan seuraavasti:
250 mg kapselit, pullot 100 - NDC 59630-112-10 500 mg kapselit, pullot 100 – NDC 59630-113-10 750 mg kapselit, pullot 50 – NDC 59630-115-05
KEFLEX tulee säilyttää 25 °C:ssa (77 °F); retket sallitaan 15° - 30°C (59° - 86°F) [katso USP-ohjattu huonelämpötila ].
Annostele tiiviiseen, valonkestävään astiaan.
Valmistettu: Shionogi Inc. Florham Park, NJ 07932. Valmistaja: Sandoz GmbH Kundl, Itävalta. Tarkistettu: lokakuuta 2015.
SIVUVAIKUTUKSET
Seuraavat vakavat tapahtumat on kuvattu tarkemmin Varoitukset ja varotoimet -osiossa:
- Yliherkkyysreaktiot [ks VAROITUKSET JA VAROTOIMET ]
- Clostridium difficileen liittyvä ripuli [katso VAROITUKSET JA VAROTOIMET ]
- Suora Coombsin serokonversion testi [katso VAROITUKSET JA VAROTOIMET ]
- Kohtauspotentiaali [katso VAROITUKSET JA VAROTOIMET ]
- Vaikutus protrombiiniaktiivisuuteen [katso VAROITUKSET JA VAROTOIMET ]
- Lääkeresistenttien bakteerien kehitys [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida verrata suoraan toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Kliinisissä tutkimuksissa yleisin haittavaikutus oli ripuli. Pahoinvointia ja oksentelua, dyspepsiaa, gastriittia ja vatsakipua on myös esiintynyt. Kuten penisilliinien ja muiden kefalosporiinien kohdalla, ohimenevää hepatiittia ja kolestaattista keltaisuutta on raportoitu.
Muita reaktioita ovat olleet yliherkkyysreaktiot, sukuelinten ja peräaukon kutina, sukuelinten kandidiaasi, emätintulehdus ja emätinvuoto, huimaus, väsymys, päänsärky, kiihtyneisyys, sekavuus, hallusinaatiot, nivelkipu, niveltulehdus ja nivelsairaus. Reversiibeliä interstitiaalista nefriittiä on raportoitu. Eosinofiliaa, neutropeniaa, trombosytopeniaa, hemolyyttistä anemiaa ja lievää aspartaattitransaminaasiarvojen (AST) ja alaniinitransaminaasiarvojen (ALT) nousua on raportoitu.
Edellä lueteltujen haittavaikutusten lisäksi, joita on havaittu potilailla, joita on hoidettu KEFLEX 500 mg:lla, kefalosporiiniluokan antibakteerisille lääkkeille on raportoitu seuraavia haittavaikutuksia ja muita muuttuneita laboratoriotutkimuksia:
Muut haittavaikutukset
Kuume, paksusuolentulehdus, aplastinen anemia, verenvuoto, munuaisten vajaatoiminta ja toksinen nefropatia.
Muutetut laboratoriokokeet
Pidentynyt protrombiiniaika, lisääntynyt veren ureatyppi (BUN), kohonnut kreatiniini, kohonnut alkalinen fosfataasi, kohonnut bilirubiini, kohonnut laktaattidehydrogenaasi (LDH), pansytopenia, leukopenia ja agranulosytoosi.
HUUMEIDEN VUOROVAIKUTUKSET
Metformiini
KEFLEX 250 mg:n antaminen metformiinin kanssa lisää plasman metformiinipitoisuuksia ja pienentää metformiinin munuaispuhdistumaa.
Potilaiden huolellista seurantaa ja metformiinin annoksen säätämistä suositellaan potilaille, jotka käyttävät samanaikaisesti KEFLEXiä ja metformiinia [ks. KLIININEN FARMAKOLOGIA ].
Probenesidi
Probenesidi estää KEFLEXin erittymistä munuaisten kautta. Probenesidin antoa samanaikaisesti KEFLEX 500 mg:n kanssa ei suositella.
Vuorovaikutus laboratorio- tai diagnostisten testausten kanssa
Väärä positiivinen reaktio voi ilmetä, kun testataan glukoosin esiintymistä virtsassa käyttämällä Benedictin tai Fehlingin liuosta.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Yliherkkyysreaktiot
Allergisia reaktioita, kuten ihottumaa, urtikariaa, angioedeemaa, anafylaksiaa, erythema multiformea, Stevens-Johnsonin oireyhtymää tai toksista epidermaalista nekrolyysiä, on raportoitu KEFLEXin käytön yhteydessä. Ennen kuin aloitat KEFLEX 500 mg -hoidon, tiedustele, onko potilaalla aiemmin ollut yliherkkyysreaktioita kefaleksiinille, kefalosporiineille, penisilliineille tai muille lääkkeille. Ristiyliherkkyyttä beetalaktaamilääkkeiden välillä voi esiintyä jopa 10 %:lla potilaista, joilla on ollut penisilliiniallergia.
Jos KEFLEX 500 mg:lle ilmenee allerginen reaktio, lopeta lääkkeen käyttö ja aloita asianmukainen hoito.
Clostridium Difficilen aiheuttama ripuli
Clostridium difficileen liittyvää ripulia (CDAD) on raportoitu käytettäessä lähes kaikkia antibakteerisia aineita, mukaan lukien KEFLEX 500 mg, ja sen vaikeusaste voi vaihdella lievästä ripulista kuolemaan johtavaan paksusuolentulehdukseen. Hoito antibakteerisilla aineilla muuttaa paksusuolen normaalia kasvillisuutta, mikä johtaa C. difficilen liikakasvuun.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CDAD:n kehittymistä. Hypertoksiinia tuottavat C. difficilen kannat lisäävät sairastuvuutta ja kuolleisuutta, koska nämä infektiot voivat olla vastustuskykyisiä antimikrobiselle hoidolle ja saattavat vaatia kolektomiaa. CDAD on otettava huomioon kaikilla potilailla, joilla on ripuli antibioottien käytön jälkeen. Huolellinen sairaushistoria on tarpeen, koska CDAD:n on raportoitu esiintyvän yli kaksi kuukautta antibakteeristen aineiden annon jälkeen.
Jos CDAD epäillään tai varmistetaan, jatkuva antibioottien käyttö, joka ei ole suunnattu C. difficileä vastaan, saattaa olla tarpeen lopettaa. Asianmukainen neste- ja elektrolyyttihallinta, proteiinilisä, C. difficilen antibioottihoito ja kirurginen arviointi tulee aloittaa kliinisen aiheen mukaan.
Suora Coombsin serokonversio
Positiivisia suoria Coombsin testejä on raportoitu kefalosporiinien antibakteerisilla lääkkeillä, mukaan lukien kefaleksiinilla, hoidon aikana. Kefaleksiinihoidon aiheuttamaa akuuttia intravaskulaarista hemolyysiä on raportoitu. Jos anemiaa kehittyy kefaleksiinihoidon aikana tai sen jälkeen, suorita diagnostinen tutkimus lääkkeiden aiheuttaman hemolyyttisen anemian varalta, keskeytä kefaleksiini ja aloita asianmukainen hoito.
Takavarikoisuus
Useat kefalosporiinit ovat saaneet aikaan kouristuskohtauksia, erityisesti potilailla, joilla on munuaisten vajaatoiminta, kun annosta ei ole pienennetty. Jos kouristuskohtauksia ilmenee, keskeytä KEFLEX-hoito. Antikonvulsanttihoitoa voidaan antaa, jos se on kliinisesti aiheellista.
Pidentynyt protrombiiniaika
Kefalosporiinit voivat liittyä protrombiiniajan pidentymiseen. Riskiryhmään kuuluvat potilaat, joilla on munuaisten tai maksan vajaatoiminta tai huono ravitsemustila, sekä potilaat, jotka saavat pitkäaikaista antibakteerista hoitoa ja potilaat, jotka saavat antikoagulanttihoitoa. Seuraa protrombiiniaikaa riskipotilailla ja hoida sitä ohjeiden mukaan.
Lääkeresistenttien bakteerien kehittäminen
KEFLEXin määrääminen ilman todistettua tai vahvasti epäiltyä bakteeri-infektiota ei todennäköisesti hyödytä potilasta ja lisää lääkeresistenttien bakteerien kehittymisen riskiä.
KEFLEXin pitkäaikainen käyttö voi johtaa ei-herkkien organismien liikakasvuun. Potilaan huolellinen tarkkailu on välttämätöntä. Jos superinfektio ilmenee hoidon aikana, on ryhdyttävä asianmukaisiin toimenpiteisiin.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Eläimillä ei ole tehty elinikäisiä tutkimuksia kefaleksiinin karsinogeenisen potentiaalin arvioimiseksi. Testejä kefaleksiinin mutageenisen potentiaalin määrittämiseksi ei ole suoritettu. Uros- ja naarasrottien hedelmällisyyteen ja lisääntymiskykyyn eivät vaikuttaneet suun kautta annetut kefaleksiiniannokset, jotka olivat korkeintaan 1,5 kertaa kehon pinta-alan perusteella suositeltuja korkeita ihmisannoksia.
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka B
Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana oleville naisille. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, tätä lääkettä tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Lisääntymistutkimuksia on suoritettu hiirillä ja rotilla käyttämällä suun kautta otettavia kefaleksiinimonohydraattiannoksia, jotka ovat 0,6 ja 1,5 kertaa ihmisen enimmäisvuorokausiannos (66 mg/kg/vrk) kehon pinta-alan perusteella, eikä niissä ole havaittu näyttöä heikentyneestä hedelmällisyydestä tai haitoista sikiö.
Imettävät äidit
Kefaleksiini erittyy äidinmaitoon. Varovaisuutta tulee noudattaa, kun KEFLEXiä annetaan imettävälle naiselle.
Käyttö lapsille
KEFLEX 500 mg:n turvallisuus ja tehokkuus lapsipotilailla varmistettiin kliinisissä tutkimuksissa annostus- ja anto-kohdassa kuvatuilla annoksilla [ks. ANNOSTELU JA HALLINNOINTI ].
Geriatrinen käyttö
Kolmessa julkaistussa kefaleksiinin kliinisessä tutkimuksessa 701 koehenkilöstä 433 (62 %) oli 65-vuotiaita tai vanhempia. Näiden ja nuorempien koehenkilöiden välillä ei havaittu yleisiä eroja turvallisuudessa tai tehokkuudessa, ja muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa.
Tämä lääke erittyy olennaisesti munuaisten kautta, ja tämän lääkkeen toksisten reaktioiden riski voi olla suurempi potilailla, joilla on heikentynyt munuaisten toiminta. Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, annoksen valinnassa on oltava varovainen [katso VAROITUKSET JA VAROTOIMET ].
Munuaisten vajaatoiminta
KEFLEXiä tulee antaa varoen, jos munuaisten toiminta on heikentynyt (kreatiniinipuhdistuma ANNOSTELU JA HALLINNOINTI ].
VIITTEET
1. Clinical and Laboratory Standards Institute (CLSI). Aerobisesti kasvavien bakteerien antimikrobisen herkkyystestien laimennusmenetelmät; Hyväksytty standardi – kymmenes painos. CLSI-dokumentti M07-A10, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
2. Clinical and Laboratory Standards Institute (CLSI). Suorituskykystandardit mikrobilääkkeille herkkyystesteille; Kahdeskymmenesviides tietoliite. CLSI-dokumentti M100-S25, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
3. Clinical and Laboratory Standards Institute (CLSI). Antimikrobisten levyjen herkkyystestien suorituskykystandardit; Hyväksytty standardi – kahdestoista painos. CLSI-dokumentti M02-A12, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2015.
YLIANNOSTUS
Oraalisen yliannostuksen oireita voivat olla pahoinvointi, oksentelu, ylävatsan ahdistus, ripuli ja hematuria. Yliannostustapauksissa on aloitettava yleiset tukitoimenpiteet.
Pakotetun diureesin, peritoneaalidialyysin, hemodialyysin tai hiilen hemoperfuusion ei ole osoitettu olevan hyödyllisiä kefaleksiinin yliannostuksissa.
VASTA-AIHEET
KEFLEX on vasta-aiheinen potilaille, joiden tiedetään olevan yliherkkiä kefaleksiinille tai muille kefalosporiiniluokan antibakteerisille lääkkeille.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Kefaleksiini on kefalosporiinien antibakteerinen lääke [katso Mikrobiologia ].
Farmakokinetiikka
Imeytyminen
Kefaleksiini on happostabiili, ja se voidaan antaa aterioista riippumatta. 250 mg:n, 500 mg:n ja 1 g:n annoksilla keskimääräiset seerumin huippupitoisuudet, vastaavasti noin 9, 18 ja 32 mcg/ml, saavutettiin 1 tunnin kohdalla. Seerumitasot olivat havaittavissa 6 tuntia annon jälkeen (toteamistasolla 0,2 mcg/ml).
Jakelu
Kefaleksiinista noin 10–15 % sitoutuu plasman proteiineihin.
Erittyminen
Kefaleksiini erittyy virtsaan glomerulussuodatuksen ja tubuluserityksen kautta. Tutkimukset osoittivat, että yli 90 % lääkkeestä erittyi muuttumattomana virtsaan 8 tunnin kuluessa. Tänä aikana virtsan huippupitoisuudet 250 mg:n, 500 mg:n ja 1 g:n annosten jälkeen olivat vastaavasti noin 1000, 2200 ja 5000 mcg/ml.
Huumeiden vuorovaikutukset
Terveillä koehenkilöillä, joille annettiin 500 mg:n kerta-annoksia kefaleksiinia ja metformiinia, plasman metformiinin keskimääräinen Cmax ja AUC kasvoivat keskimäärin 34 % ja AUC 24 %, ja metformiinin keskimääräinen munuaispuhdistuma pieneni 14 %. Kefaleksiinin ja metformiinin yhteisvaikutuksista kummankaan lääkkeen useiden annosten jälkeen ei ole saatavilla tietoa.
Mikrobiologia
Toimintamekanismi
Kefaleksiini on bakterisidinen aine, joka estää bakteerien soluseinämän synteesiä.
Resistanssi
Metisilliiniresistentit stafylokokit ja useimmat enterokokki-isolaatit ovat resistenttejä kefaleksiinille. Kefaleksiini ei ole aktiivinen useimpia Enterobacter spp.-, Morganella morganii- ja Proteus vulgariksen isolaatteja vastaan. Kefaleksiinilla ei ole vaikutusta Pseudomonas spp.- tai Acinetobacter calcoaceticus -bakteeriin. Penisilliiniresistentti Streptococcus pneumoniae on yleensä ristiresistentti beetalaktaamiantibakteerilääkkeille.
Antimikrobinen aktiivisuus
Kefaleksiinin on osoitettu olevan aktiivinen useimpia seuraavien bakteerien isolaatteja vastaan sekä in vitro että kliinisissä infektioissa [ks. KÄYTTÖAIHEET JA KÄYTTÖ ].
Gram-positiiviset bakteerit
Staphylococcus aureus (vain metisilliinille herkät isolaatit) Streptococcus pneumoniae (penisilliinille herkät isolaatit) Streptococcus pyogenes
Gram-negatiiviset bakteerit
Escherichia coli Haemophilus influenzae Klebsiella pneumoniae Moraxella catarrhalis Proteus mirabilis
Herkkyystestimenetelmät
Kliinisen mikrobiologian laboratorion tulee mahdollisuuksien mukaan toimittaa lääkärille paikallisissa sairaaloissa käytettävien mikrobilääkkeiden in vitro -herkkyystestien tulokset määräaikaisraportteina, jotka kuvaavat sairaalassa ja yhteisössä hankittujen patogeenien herkkyysprofiilia. Näiden raporttien pitäisi auttaa lääkäriä valitsemaan antibakteerinen lääkevalmiste hoitoa varten.
Ainoastaan komplisoitumattomissa virtsatieinfektioissa E. colin, K. pneumoniaen ja P. mirabilisin herkkyys kefaleksiinille voidaan päätellä kefatsoliinitestauksella2.
Laimennustekniikat
Kvantitatiivisia menetelmiä käytetään antimikrobisten minimaalisten estopitoisuuksien (MIC) määrittämiseen. Nämä MIC-arvot antavat arvioita bakteerien herkkyydestä antimikrobisille yhdisteille. MIC-arvot on määritettävä käyttämällä standardoituja testimenetelmiä (liemi tai agar)1,2.
Diffuusiotekniikat
Kvantitatiiviset menetelmät, jotka edellyttävät vyöhykkeiden halkaisijoiden mittaamista, tarjoavat myös toistettavia arvioita bakteerien herkkyydestä antimikrobisille yhdisteille. Vyöhykkeen koko antaa arvion bakteerien herkkyydestä antimikrobisille yhdisteille. Vyöhykkeen koko on määritettävä standardoidulla testimenetelmällä2,3.
Herkkä (S) -raportti osoittaa, että mikrobilääke todennäköisesti estää patogeenin kasvua, jos mikrobilääke saavuttaa pitoisuuden, joka on tavallisesti saavutettavissa infektiokohdassa. Välituotteen (I) raportti osoittaa, että tulosta on pidettävä epäselvänä, ja jos mikro-organismi ei ole täysin herkkä vaihtoehtoisille kliinisesti toteuttamiskelpoisille lääkkeille, testi on toistettava. Tämä kategoria tarkoittaa mahdollista kliinistä soveltuvuutta kehon kohteisiin, joissa lääke on fysiologisesti keskittynyt tai tilanteissa, joissa lääkettä voidaan käyttää suuria annoksia. Tämä kategoria tarjoaa myös puskurivyöhykkeen, joka estää pieniä hallitsemattomia teknisiä tekijöitä aiheuttamasta suuria tulkintaeroja. Resistantin (R) raportti osoittaa, että mikrobilääke ei todennäköisesti estä patogeenin kasvua, jos antimikrobinen lääke saavuttaa pitoisuudet, jotka ovat tavallisesti saavutettavissa infektiokohdassa; tulee valita muu hoitomuoto.
Laadunvalvonta
Standardoidut herkkyystestimenetelmät edellyttävät laboratoriokontrollien käyttöä määrityksessä käytettyjen tarvikkeiden ja reagenssien sekä testin suorittavan henkilön tekniikoiden tarkkuuden ja tarkkuuden valvomiseksi ja varmistamiseksi1,2,3.
POTILASTIEDOT
- Kerro potilaille, että allergisia reaktioita, myös vakavia allergisia reaktioita, saattaa esiintyä ja että vakavat reaktiot vaativat välitöntä hoitoa. Kysy potilaalta aiemmista yliherkkyysreaktioista KEFLEXille, muille beetalaktaameille (mukaan lukien kefalosporiinit) tai muille allergeeneille
- Kerro potilaille, että ripuli on yleinen antibakteeristen lääkkeiden aiheuttama ongelma, ja se yleensä paranee, kun lääke lopetetaan. Joskus voi esiintyä toistuvaa vetistä tai veristä ripulia, joka voi olla merkki vakavammasta suolistoinfektiosta. Jos vakava vetinen tai verinen ripuli kehittyy, kehota potilaita ottamaan yhteyttä terveydenhuollon tarjoajaan.
- Neuvo potilaita, että antibakteerisia lääkkeitä, mukaan lukien KEFLEX, tulee käyttää vain bakteeri-infektioiden hoitoon. Ne eivät hoida virusinfektioita (esim. flunssaa). Kun KEFLEX 500mg on määrätty bakteeri-infektion hoitoon, kerro potilaille, että vaikka on yleistä, että olo paranee hoidon alussa, lääke tulee ottaa täsmälleen ohjeiden mukaan. Annosten väliin jättäminen tai koko hoitojakson suorittamatta jättäminen voi (1) heikentää välittömän hoidon tehokkuutta ja (2) lisätä todennäköisyyttä, että bakteerit kehittävät vastustuskykyä ja että niitä ei voida hoitaa KEFLEXillä tai muilla antibakteerisilla lääkkeillä tulevaisuudessa.
