Duricef 250mg, 500mg Cefadroxil Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Duricef on ja miten sitä käytetään?
Duricef (kefadroksiili) on kefalosporiiniantibiootti, jota käytetään monien erityyppisten bakteerien aiheuttamien infektioiden hoitoon. Tuotenimi Duricef on lopetettu, ja kefadroksiili on saatavilla geneerisessä muodossa.
Mitkä ovat Duricefin sivuvaikutukset?
Duricefin (kefadroksiilin) yleisiä sivuvaikutuksia ovat:
- vatsavaivat tai kipu,
- pahoinvointi,
- oksentelua,
- ripuli,
- jäykät tai kireät lihakset,
- nivelkipu,
- levoton tai hyperaktiivinen olo,
- epätavallinen tai epämiellyttävä maku suussa,
- kutinaa tai ihottumaa tai
- emättimen kutina tai vuoto.
Kerro lääkärillesi, jos sinulla on epätodennäköisiä mutta erittäin vakavia Duricefin (kefadroksiili) sivuvaikutuksia, mukaan lukien:
- jatkuva pahoinvointi tai oksentelu,
- keltaiset silmät tai iho,
- tumma virtsa,
- uudet infektion merkit (esim. jatkuva kurkkukipu tai kuume),
- helppo mustelma tai verenvuoto,
- muutokset virtsan määrässä tai
- henkiset/mielialan muutokset (kuten sekavuus).
KUVAUS
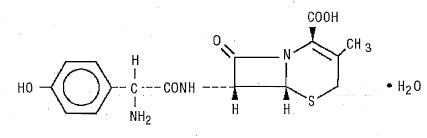
DURICEF (kefadroksiili) on puolisynteettinen kefalosporiiniantibiootti, joka on tarkoitettu suun kautta annettavaksi. Se on valkoista kellertävänvalkoista kiteistä jauhetta. Se liukenee veteen ja on happostabiili. Se on kemiallisesti nimetty 5-tia-l-atsabisyklo[4.2.0]okt-2-eeni-2-karboksyylihapoksi, 7-[[amino(4-hydroksifenyyli)asetyyli]amino]-3-metyyli-8-okso -, monohydraatti[6R- [6a,7p(R*)]]-. Sen kaava on C16H17N3O5S•H20 ja molekyylipaino 381,40. Sillä on seuraava rakennekaava:
DURICEF (kefadroksiili) kalvopäällysteiset tabletit, 1 g, sisältävät seuraavia inaktiivisia aineosia: mikrokiteinen selluloosa, hydroksipropyylimetyyliselluloosa, magnesiumstearaatti, polyetyleeniglykoli, polysorbaatti 80, simetikoniemulsio ja titaanidioksidi.
DURICEF (kefadroksiili) oraalisuspensioon sisältää seuraavat inaktiiviset aineosat: FD&C Yellow No. 6, aromit (luonnolliset ja keinotekoiset), polysorbaatti 80, natriumbentsoaatti, sakkaroosi ja ksantaanikumi.
DURICEF (kefadroksiili) -kapselit sisältävät seuraavia inaktiivisia aineosia: D&C Red No. 28, FD&C Blue No. 1, FD&C Red No. 40, gelatiini, magnesiumstearaatti ja titaanidioksidi.
INDIKAATIOT
DURICEF (kefadroksiili) on tarkoitettu sellaisten potilaiden hoitoon, joilla on alttiiden organismikantojen aiheuttama infektio seuraavissa sairauksissa:
E. colin aiheuttamat virtsatieinfektiot; P. mirabilis- ja Klebsiella-lajit.
Stafylokokkien ja/tai streptokokkien aiheuttamat iho- ja ihorakenteen infektiot.
Streptococcus pyogenesin (A-ryhmän beetahemolyyttinen streptokokki) aiheuttama nielutulehdus ja/tai tonsilliitti.
merkintä: Vain lihakseen annettu penisilliini on osoitettu tehokkaaksi reumakuumeen ehkäisyssä. DURICEF (kefadroksiili) on yleensä tehokas streptokokkien hävittämisessä suunielusta. Tietoja DURICEFin (kefadroksiilin) tehosta myöhemmän reumakuumeen ehkäisyssä ei kuitenkaan ole saatavilla.
merkintä: Viljely- ja herkkyystestit tulee aloittaa ennen hoidon aloittamista ja sen aikana. Munuaisten toimintatutkimukset tulee tehdä tarvittaessa.
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja DURICEFin (kefadroksiili) ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi DURICEF:ia (kefadroksiilia) tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden on todistettu tai epäillään olevan herkkiä bakteereja. Kun viljely- ja herkkyystiedot ovat saatavilla, ne tulee ottaa huomioon valittaessa tai muuttaessa antibakteerista hoitoa. Tällaisten tietojen puuttuessa paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa hoidon empiiriseen valintaan.
ANNOSTELU JA HALLINNOINTI
DURICEF (kefadroksiili) on happostabiili ja sitä voidaan antaa suun kautta riippumatta aterioista. Ruoan kanssa ottaminen voi auttaa vähentämään mahdollisia ruuansulatuskanavan vaivoja, jotka joskus liittyvät suun kautta otettavaan kefalosporiinihoitoon.
Aikuiset
Virtsatieinfektiot: Komplisoitumattomien alempien virtsateiden infektioiden (eli kystiitti) tavallinen annos on 1 tai 2 g päivässä yhtenä (qd) tai jaettuna annoksena (kahdesti).
Kaikille muille virtsatieinfektioille tavanomainen annos on 2 g päivässä jaettuna annoksiin (kahdesti).
Ihon ja ihon rakenneinfektiot: Iho- ja ihorakenteen infektioissa tavanomainen annos on 1 g vuorokaudessa kerta-annoksena (qd) tai jaettuna (kahdesti).
Nielutulehdus ja tonsilliitti: A-ryhmän beetahemolyyttisen streptokokkinielutulehduksen ja nielurisatulehduksen hoito - 1 g päivässä yhtenä (qd) tai jaettuna annoksina (kahdesti) 10 päivän ajan.
Lapset
Virtsatietulehduksissa suositeltu päiväannos lapsille on 30 mg/kg/vrk jaettuna 12 tunnin välein. Nielutulehduksen, nielurisatulehduksen ja impetigon hoitoon lapsille suositeltu päiväannos on 30 mg/kg/vrk yhtenä annoksena tai jaettuna yhtä suuriin annoksiin 12 tunnin välein. Muiden iho- ja ihorakenteen infektioiden kohdalla suositeltu vuorokausiannos on 30 mg/kg/vrk jaettuna tasan annoksiin 12 tunnin välein. Beetahemolyyttisten streptokokki-infektioiden hoidossa DURICEFin (kefadroksiili) terapeuttinen annos tulee antaa vähintään 10 päivän ajan.
Katso taulukosta lasten päiväannosten kokonaismäärä.
Munuaisten vajaatoiminta
Potilailla, joilla on munuaisten vajaatoiminta, kefadroksiilimonohydraatin annosta tulee säätää kreatiniinin puhdistumanopeuden mukaan lääkkeiden kertymisen estämiseksi. Seuraavaa aikataulua ehdotetaan. Aikuisilla aloitusannos on 1 000 mg DURICEF (kefadroksiili) ja ylläpitoannos (perustuen kreatiniinin puhdistumanopeuteen [mL/min/1,73 M2]) on 500 mg alla luetelluin aikavälein.
Potilaita, joiden kreatiniinin puhdistuma on yli 50 ml/min, voidaan kohdella kuin potilaita, joiden munuaisten toiminta on normaali.
MITEN TOIMITETAAN
DURICEF® (kefadroksiilimonohydraatti, USP) 500 mg kapselit: läpinäkymättömät, kastanjanruskeat ja valkoiset kovat gelatiinikapselit, joiden toiseen päähän on painettu "PPP" ja "784" ja toisessa päässä "DURICEF (kefadroksiili)" ja "500 mg" .
Kapselit toimitetaan seuraavasti:
N 0430-0780-19...................50 pullo
Säilytä valvotussa huoneenlämmössä 15° - 30° C (59° - 86° F).
DURICEF® (kefadroksiili) 1 gramma Tabletit: valkoisesta luonnonvalkoiseen, ylhäältä jaetut, soikion muotoiset, merkintä "PPP" puolikkaan toiselle puolelle ja "785" puolikkaan toiselle puolelle. Tabletit toimitetaan seuraavasti:
N 0430-0781-19...................50 pullo
Säilytä valvotussa huoneenlämmössä 15° - 30° C (59° - 86° F).
DURICEF® (kefadroksiili) oraalisuspensioon on appelsiini-ananasmakuinen, ja se toimitetaan seuraavasti:
250mg/5mL................................N 0430-2782-15 50 ml pullo
Ennen käyttövalmiiksi saattamista: Säilytä valvotussa huoneenlämmössä 15° - 30° C (59° - 86° F).
Valmistaja Bristol-Myers Squibb Co. Princeton, NJ 08543. For Warner Chilcott Company, Inc. Fajardo, PR 00738. Markkinoija: Warner Chilcott (US), Inc. Rockaway, NJ 07866. Tarkistettu huhtikuussa 2007. FDA/Rev. 5/2007
SIVUVAIKUTUKSET
Ruoansulatuskanava
Pseudomembranoottisen paksusuolitulehduksen oireita saattaa ilmetä antibioottihoidon aikana tai sen jälkeen (ks VAROITUKSET ). Dyspepsiaa, pahoinvointia ja oksentelua on raportoitu harvoin. Myös ripulia on esiintynyt.
Yliherkkyys
Allergiaa (ihottuma, nokkosihottuma, angioedeeema ja kutina) on havaittu. Nämä reaktiot yleensä hävisivät lääkkeen käytön lopettamisen jälkeen. Myös anafylaksia on raportoitu.
muu
Muita reaktioita ovat olleet maksan vajaatoiminta, mukaan lukien kolestaasi ja seerumin transaminaasiarvojen nousu, sukuelinten kutina, sukuelinten moniliaasi, vaginiitti, kohtalainen ohimenevä neutropenia, kuume. Agranulosytoosia, trombosytopeniaa, idiosynkraattista maksan vajaatoimintaa, erythema multiformea, Stevens-Johnsonin oireyhtymää, seerumitautia ja nivelsärkyä on raportoitu harvoin.
Edellä lueteltujen haittavaikutusten lisäksi, joita on havaittu kefadroksiililla hoidetuilla potilailla, kefalosporiiniluokan antibioottien yhteydessä on raportoitu seuraavia haittavaikutuksia ja muuttuneita laboratoriokokeita:
Toksinen epidermaalinen nekrolyysi, vatsakipu, superinfektio, munuaisten vajaatoiminta, toksinen nefropatia, aplastinen anemia, hemolyyttinen anemia, verenvuoto, pitkittynyt protrombiiniaika, positiivinen Coombsin testi, kohonnut BUN, kohonnut kreatiniini, kohonnut alkalinen fosfataasi, kohonnut aminotransferaasi (osaaminotransferaasi) alaniiniaminotransferaasi (ALT), kohonnut bilirubiini, kohonnut LDH, eosinofilia, pansytopenia, neutropenia.
Useat kefalosporiinit ovat saaneet aikaan kohtauksia, erityisesti munuaisten vajaatoimintaa sairastavilla potilailla, kun annosta ei ole pienennetty (ks. ANNOSTUS JA ANNOSTUS sekä YLIANNOSTUS ). Jos lääkehoitoon liittyviä kouristuskohtauksia ilmenee, lääkkeen käyttö on lopetettava. Antikonvulsanttihoitoa voidaan antaa, jos se on kliinisesti aiheellista.
HUUMEIDEN VUOROVAIKUTUKSET
Lääke/laboratoriotestien vuorovaikutukset
Positiivisia suoria Coombsin testejä on raportoitu kefalosporiiniantibioottihoidon aikana. Hematologisissa tutkimuksissa tai verensiirron ristiinsovitusmenetelmissä, kun antiglobuliinitestit tehdään alaikäiselle puolelle tai Coombsin testeissä vastasyntyneille, joiden äidit ovat saaneet kefalosporiiniantibiootteja ennen synnytystä, on otettava huomioon, että positiivinen Coombsin testi voi johtua huume.
VAROITUKSET
ENNEN DURICEF-HOIDON (kefadroksiili) ALOITTAMISTA TUTKIMUS TULEE HUOLELLISESTI TUTKISTAMINEN, ONKO POTILAALLE OLLUT AIEMMAT YLIHERKKYYSREAKTIOT CEFADROXTLILLE, KEFALOSPORININEILLE, MUIDEN KEFALOSPORINIEN,,PRUSU-ORKILLIINIEN,. JOS TÄTÄ TUOTETTA ANNETAAN PENISILLIINILLE HERKKEILLE POTILAILLE, VAROVAISUUTTA ON OLEVAT HYVÄKSYNÄ, KOSKA BETA-LAKTAAM-ANTIBIOOTIEN RISTIHERKKYYS ON DOKUMENTOINTI SELKEÄSTI JA TAPAHTUU 10 % TOUKOKUUTA TOUKKAAN.
JOS ALLERGINEN REAKTIO DURICEFILLE (kefadroksiilille) ILMOITtuu, LÄÄKE LÄÄKE. VAKAVAT AKUUTIT YLIHERKKYYSREAKTIOT SAATTAVAT VAATTAA EPINEFRIINILOITOA JA MUITA HÄTÄTOIMENPITEITÄ, MUKAAN LUKIEN HAPELLA, SUUNONSUOKSISET NESTEET, LASKIMEN ANTISTIMIINIT, KORTIKOOSTEROIDIT, PAINOSLIINI- JA ILMANAINEET.
Clostridium difficileen liittyvää ripulia (CDAD) on raportoitu käytettäessä lähes kaikkia antibakteerisia aineita, mukaan lukien DURICEF (kefadroksiili), ja sen vaikeusaste voi vaihdella lievästä ripulista kuolemaan johtavaan paksusuolentulehdukseen. Hoito antibakteerisilla aineilla muuttaa paksusuolen normaalia kasvillisuutta, mikä johtaa C. difficilen liikakasvuun.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CD AD:n kehittymistä. Hypertoksiinia tuottavat C. difficilen kannat lisäävät sairastuvuutta ja kuolleisuutta, koska nämä infektiot voivat olla vastustuskykyisiä antimikrobiselle hoidolle ja saattavat vaatia kolektomiaa. CD AD on otettava huomioon kaikilla potilailla, joilla on ripuli antibioottien käytön jälkeen. Huolellinen sairaushistoria on tarpeen, koska CD AD:n on raportoitu esiintyvän yli kaksi kuukautta antibakteeristen aineiden annon jälkeen.
Jos CD AD:ta epäillään tai varmistetaan, jatkuva antibioottien käyttö, joka ei ole suunnattu C. difficileä vastaan, saattaa olla tarpeen lopettaa. Asianmukainen neste- ja elektrolyyttihallinta, proteiinilisä, C. difficilen antibioottihoito ja kirurginen arviointi tulee aloittaa kliinisen tarpeen mukaan.
VAROTOIMENPITEET
Kenraali
DURICEF (kefadroksiili) tulee käyttää varoen, jos munuaisten toiminta on selvästi heikentynyt (kreatiniinin puhdistuma on alle 50 ml/min/1,73 M2). (Katso ANNOSTELU JA HALLINNOINTI .) Potilaille, joilla tiedetään tai epäillään olevan munuaisten vajaatoimintaa, tulee suorittaa huolellinen kliininen seuranta ja asianmukaiset laboratoriotutkimukset ennen hoidon aloittamista ja sen aikana.
DURICEFin (kefadroksiilin) määrääminen ilman todistettua tai vahvasti epäiltyä bakteeri-infektiota tai profylaktista indikaatiota ei todennäköisesti hyödytä potilasta ja lisää lääkeresistenttien bakteerien kehittymisen riskiä.
DURICEFin (kefadroksiilin) pitkäaikainen käyttö voi johtaa herkkien organismien liikakasvuun. Potilaan huolellinen tarkkailu on välttämätöntä. Jos superinfektio ilmenee hoidon aikana, on ryhdyttävä asianmukaisiin toimenpiteisiin.
DURICEF (kefadroksiili) tulee määrätä varoen henkilöille, joilla on ollut maha-suolikanavan sairaus, erityisesti koliitti.
Karsinogeneesi, mutageneesi ja hedelmällisyyden heikkeneminen
Pitkäaikaisia tutkimuksia karsinogeenisen potentiaalin määrittämiseksi ei ole tehty. Geneettisiä toksisuustestejä ei ole tehty.
Raskaus: Raskausluokka B
Lisääntymistutkimuksia on suoritettu hiirillä ja rotilla annoksilla, jotka ovat jopa 11-kertaisia ihmisen annokseen verrattuna, eivätkä ne ole osoittaneet merkkejä heikentyneestä hedelmällisyydestä tai haitasta sikiölle kefadroksiilimonohydraatin vuoksi. Ei kuitenkaan ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, tätä lääkettä tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Työ ja toimitus
DURICEFin (kefadroksiili) käyttöä synnytyksen ja synnytyksen aikana ei ole tutkittu. Hoitoa tulee antaa vain, jos se on selvästi tarpeen.
Imettävät äidit
Varovaisuutta on noudatettava, kun kefadroksiilimonohydraattia annetaan imettävälle äidille.
Käyttö lapsille
(Katso ANNOSTELU JA HALLINNOINTI. )
Geriatrinen käyttö
Noin 650 potilaasta, jotka saivat kefadroksiilia virtsatieinfektioiden hoitoon kolmessa kliinisessä tutkimuksessa, 28 % oli vähintään 60-vuotiaita ja 16 % 70-vuotiaita tai vanhempia. Noin 1 000 potilaasta, jotka saivat kefadroksiilia ihon ja ihon rakenneinfektioiden hoitoon 14 kliinisessä tutkimuksessa, 12 % oli 60-vuotiaita tai vanhempia ja 4 % 70-vuotiaita tai vanhempia. Näissä tutkimuksissa iäkkäiden potilaiden ja nuorempien potilaiden välillä ei havaittu yleisiä eroja turvallisuudessa. Kefadroksiilin kliiniset tutkimukset. nielutulehdus tai nielurisatulehduksen hoito ei sisältänyt riittävää määrää 65-vuotiaita tai vanhempia potilaita sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat potilaat. Muut raportoidut kliiniset kokemukset kefadroksiilista eivät ole havainneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin iäkkäiden henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
Kefadroksiili erittyy pääosin munuaisten kautta, ja annoksen muuttaminen on aiheellista potilaille, joilla on munuaisten vajaatoiminta (ks. ANNOSTUS JA ANTO: Munuaisten vajaatoiminta ). Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, annoksen valinnassa on oltava varovainen, ja munuaisten toiminnan seuranta voi olla hyödyllistä.
YLIANNOSTUS
Alle 6-vuotiailla lapsilla tehty tutkimus osoitti, että alle 250 mg/kg kefalosporiinien nauttiminen ei liity merkittäviin tuloksiin. Ei vaadita muita toimia kuin yleistä tukea ja tarkkailua. Yli 250 mg/kg:n määriä saa aikaan mahalaukun tyhjennys.
Viidellä anuriapotilaalla osoitettiin, että keskimäärin 63 % 1 gramman suun kautta annetusta annoksesta erittyy elimistöstä 6-8 tunnin hemodialyysijakson aikana.
VASTA-AIHEET
DURICEF (kefadroksiili) on vasta-aiheinen potilaille, jotka ovat allergisia kefalosporiiniryhmän antibiooteille.
KLIININEN FARMAKOLOGIA
DURICEF (kefadroksiili) imeytyy nopeasti oraalisen annon jälkeen. 500 mg:n ja 1000 mg:n kerta-annosten jälkeen keskimääräiset huippupitoisuudet seerumissa olivat noin 16 ja 28 |g/ml. Mitattavissa olevat tasot olivat läsnä 12 tuntia annon jälkeen. Yli 90 % lääkkeestä erittyy muuttumattomana virtsaan 24 tunnin kuluessa. Virtsan huippupitoisuudet ovat noin 1800 pg/ml suun kautta otetun 500 mg:n kerta-annoksen jälkeisenä aikana. Annoksen suurentaminen lisää yleensä DURICEFin (kefadroksiilimonohydraatti, USP) pitoisuutta virtsassa. Virtsan antibioottipitoisuus pidettiin 1 g:n annoksen jälkeen selvästi herkkien virtsan patogeenien MIC-arvon yläpuolella 20–22 tunnin ajan.
Mikrobiologia
In vitro -testit osoittavat, että kefalosporiinit ovat bakteereja tappavia, koska ne estävät soluseinän synteesiä. Kefadroksiilin on osoitettu olevan aktiivinen seuraavia organismeja vastaan sekä in vitro että kliinisissä infektioissa (ks. INDIKAATIOT ):
Beetahemolyyttiset streptokokit Stafylokokit, mukaan lukien penisillinaasia tuottavat kannat Streptococcus (Diplococcus) pneumoniae Escherichia coli Proteus mirabilis Klebsiella-lajit Moraxella (Branhamella) catarrhalis
merkintä: Useimmat Entervcoccus faecalis (entinen Streptococcus faecalis) ja Enterococcus faecium (entinen Streptococcus faecium) kannat ovat resistenttejä DURICEFille (kefadroksiili). Se ei ole aktiivinen useimpia Enterobacter-lajeja, Morganella morganii (entinen Proteus morganii) ja P. vulgaris -kantoja vastaan. Sillä ei ole vaikutusta Pseudomonas-lajeihin ja Acinetobacter calcoaceticus -lajeihin (ent. Mima- ja Herellea-lajit).
Herkkyystestit: Diffuusiotekniikat
Antibioottilevyherkkyystestimenetelmien käyttö, jotka mittaavat vyöhykkeen halkaisijaa, antavat tarkan arvion antibioottiherkkyydestä. Eräs tällainen standardimenettely1, jota on suositeltu käytettäväksi kiekkojen kanssa organismien kefadroksiililleherkkyyden testaamiseksi, käyttää kefalosporiiniluokan (kefalotiini) levyä. Tulkintaan kuuluu kiekkotestissä saatujen halkaisijoiden korrelaatio kefadroksiilin vähimmäisinhibiittoripitoisuuden (MIC) kanssa.
Laboratorion raportit, jotka antavat tuloksia yhden levyn standardin herkkyystestistä 30 µg:n kefalotiinilevyllä, on tulkittava seuraavien kriteerien mukaisesti:
Raportti "herkkä" osoittaa, että yleisesti saavutettavat veren tasot todennäköisesti estävät patogeenin. Raportti "keskimääräisestä herkkyydestä" viittaa siihen, että organismi olisi herkkä, jos käytetään suuria annoksia tai jos infektio rajoittuu kudokseen ja nesteisiin (esim. virtsaan), joissa saavutetaan korkeat antibioottitasot. Raportti "Resistant" osoittaa, että saavutettavissa olevat antibiootin pitoisuudet eivät todennäköisesti ole estäviä, ja tulee valita jokin muu hoito.
Standardoidut menetelmät edellyttävät laboratoriokontrolliorganismien käyttöä. 30 µg:n kefalotiinilevyn tulisi antaa seuraavat vyöhykkeiden halkaisijat:
Laimennustekniikat
Käytettäessä NCCLS-agarlaimennus- tai liemilaimennusmenetelmää (mukaan lukien mikrolaimennus)2 tai vastaavaa bakteeri-isolaattia voidaan pitää herkänä, jos kefalotiinin MIC-arvo (minimaalinen estävä pitoisuus) on 8 µg/ml tai vähemmän. Organismit katsotaan resistentiksi, jos MIC on 32 µg/ml tai suurempi. Organismit, joiden MIC-arvo on alle 32 µg/ml mutta yli 8 µg/ml, ovat välituotteita.
Kuten tavallisissa diffuusiomenetelmissä, laimennusmenettelyt vaativat laboratoriokontrolliorganismien käyttöä. Normaalin kefalotiinijauheen MIC-arvojen tulee olla välillä 0,12 µg/ml ja 0,5 µg/ml Staphylococcus aureus ATCC 29213:lle. Vox Escherichia coli ATCC 25922, MIC-alueen tulee olla välillä 4,0 µg/mL ja .16,0 µg/mL. Streptococcus faecalis ATCC 29212:n MIC-alueen tulee olla 8,0-32,0 µg/ml.
VIITTEET
1. National Committee for Clinical Laboratory Standards, Hyväksytty standardi, Performance Standards for Antimikrobial Disk Susceptibility Test, 4th Edition, Voi. 10 (7): M2-A4, Villanova, PA, huhtikuu 1990.
2. Kansallinen kliinisten laboratoriostandardien komitea, hyväksytty standardi: Methods for Dilution Antimikrobial Susceptibility Tests for Bakteries that Grow that Grow, 2nd Edition, Voi. 10 (8): M7-A2, Villanova, PA, huhtikuu 1990.
POTILASTIEDOT
Potilaita tulee neuvoa, että antibakteerisia lääkkeitä, mukaan lukien DURICEF (kefadroksiili), tulisi käyttää vain bakteeri-infektioiden hoitoon. Ne eivät hoida virusinfektioita (esim. flunssaa). Kun DURICEF (kefadroksiili) määrätään bakteeri-infektion hoitoon, potilaille tulee kertoa, että vaikka on yleistä tuntea olonsa paremmaksi hoidon alussa, lääke tulee ottaa täsmälleen ohjeiden mukaan. Annosten väliin jättäminen tai koko hoitojakson suorittamatta jättäminen voi (1) heikentää välittömän hoidon tehokkuutta ja (2) lisätä todennäköisyyttä, että bakteerit kehittävät resistenssiä ja että niitä ei voida hoitaa DURICEFilla (kefadroksiililla) tai muilla antibakteerisilla lääkkeillä tulevaisuudessa. .
Ripuli on yleinen antibioottien aiheuttama ongelma, joka yleensä loppuu, kun antibioottihoito lopetetaan. Joskus antibioottihoidon aloittamisen jälkeen potilaille voi ilmaantua vetisiä ja verisiä ulosteita (vatsakouristuksella ja kuumeella tai ilman) jopa kahden tai useamman kuukauden kuluttua viimeisen antibioottiannoksen ottamisesta. Jos näin tapahtuu, potilaiden tulee ottaa yhteyttä lääkäriin mahdollisimman pian.
