Levaquin 250mg, 500mg, 750mg Levofloxacin Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Levaquin 750mg on ja miten sitä käytetään?
Levaquin on reseptilääke, jota käytetään erilaisten bakteeri-infektioiden oireiden hoitoon. Levaquinia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Levaquin 500mg kuuluu lääkeryhmään nimeltä fluorokinolonit.
Ei tiedetä, onko Levaquin turvallinen ja tehokas lapsille yli 14 päivän hoidon aikana.
Mitkä ovat Levaquin 500mg:n mahdolliset sivuvaikutukset?
Levaquin 750mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- päänsärky,
- nälkä,
- hikoilu,
- ärtyneisyys,
- huimaus,
- pahoinvointi,
- nopea syke,
- ahdistuneisuus tai vapina,
- tunnottomuus tai pistely käsissäsi, käsivarsissasi, jaloissasi tai jaloissasi,
- heikkous käsissäsi, käsissäsi, jaloissasi tai jaloissasi,
- polttava kipu käsissä, käsissä, jaloissa tai jaloissa,
- vakavia mielialan tai käyttäytymisen muutoksia,
- hermostuneisuus,
- hämmennystä,
- agitaatio,
- vainoharhaisuus,
- hallusinaatiot,
- muistiongelmia,
- keskittymisvaikeuksia,
- itsemurha-ajatuksia,
- jänteen repeämä,
- äkillinen kipu,
- turvotus,
- mustelmat,
- arkuus,
- jäykkyys,
- liikkumisongelmia,
- napsahtava tai poksahtava ääni missä tahansa nivelissäsi,
- kova vatsakipu,
- vetistä tai veristä ripulia,
- lepattaa rinnassasi,
- hengenahdistus,
- ihottuma,
- hengitysongelmia,
- kohtaukset (kouristukset),
- kovat päänsäryt,
- näköongelmia,
- kipu silmiesi takana,
- ylävatsakipu,
- ruokahalun menetys,
- tumma virtsa,
- savenväriset ulosteet ja
- ihon tai silmien keltaisuus (keltatauti)
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Levaquin 250mg:n yleisimmät sivuvaikutukset ovat:
- pahoinvointi,
- ummetus,
- ripuli,
- päänsärky,
- huimaus ja
- nukahtamisvaikeuksia
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Levaquinin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
VAKAVAT HAITTAVAIKUTUKSET, MUKAAN lukien jännetulehdus, jänteen repeämä, perifeerinen neuropatia, KESKUSHERMOJÄRJESTELMÄN VAIKUTUKSET JA MYASTENIA GRAVISIN paheneminen
- Fluorokinolonit, mukaan lukien LEVAQUIN®, on yhdistetty vammautuviin ja mahdollisesti peruuttamattomiin vakaviin haittavaikutuksiin, jotka ovat ilmenneet yhdessä [ks. VAROITUKSET JA VAROTOIMET], mukaan lukien:
- Jännetulehdus ja jänteen repeämä [katso VAROITUKSET JA VAROTOIMET]
- Perifeerinen neuropatia [katso VAROITUKSET JA VAROTOIMET]
- Keskushermostovaikutukset [katso VAROITUKSET JA VAROTOIMET]
Lopeta LEVAQUIN®-hoito välittömästi ja vältä fluorokinolonien käyttöä, mukaan lukien LEVAQUIN®, potilailla, joilla on jokin näistä vakavista haittavaikutuksista (ks. VAROITUKSET JA VAROTOIMET)
- Fluorokinolonit, mukaan lukien LEVAQUIN®, voivat pahentaa lihasheikkoutta potilailla, joilla on myasthenia gravis. Vältä LEVAQUIN®:ia potilailla, joilla on tunnettu myasthenia gravis -historia [katso VAROITUKSET JA VAROTOIMET ].
- Koska fluorokinolonit, mukaan lukien LEVAQUIN®, on yhdistetty vakaviin haittavaikutuksiin [katso VAROITUKSET JA VAROTOIMET ], varaa LEVAQUIN® käytettäväksi potilailla, joilla ei ole vaihtoehtoisia hoitovaihtoehtoja seuraaviin käyttöaiheisiin:
- Komplisoitumaton virtsatieinfektio [katso INDIKAATIOT ]
- Kroonisen keuhkoputkentulehduksen akuutti bakteerien paheneminen [katso INDIKAATIOT ]
- Akuutti bakteeriperäinen sinuiitti [katso INDIKAATIOT ].
KUVAUS
LEVAQUIN®-tabletit ovat synteettisiä antibakteerisia aineita suun kautta annettavaksi. Kemiallisesti levofloksasiini, kiraalinen fluorattu karboksikinoloni, on raseemisen lääkeaineen ofloksasiinin puhdas (-)-(S)-enantiomeeri. Kemiallinen nimi on (-)-(S)-9-fluori-2,3-dihydro-3-metyyli-10-(4-metyyli-1-piperatsinyyli)-7-okso-7H-pyrido[1,2, 3-de]-1,4-bentsoksatsiini-6-karboksyylihappohemihydraatti.
Kuva 1: Levofloksasiinin kemiallinen rakenne
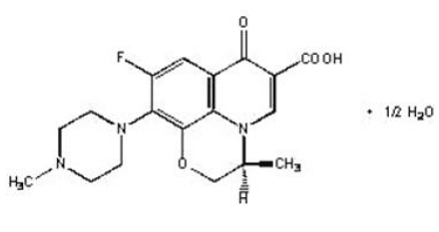
Empiirinen kaava on C18H20FN3O4 · ½ H2O ja molekyylipaino on 370,38. Levofloksasiini on vaalean kellertävänvalkoinen tai kellanvalkoinen kide tai kiteinen jauhe. Molekyyli esiintyy kahtaisionina ohutsuolen pH-olosuhteissa.
Tiedot osoittavat, että pH-arvosta 0,6 - 5,8 levofloksasiinin liukoisuus on olennaisesti vakio (noin 100 mg/ml). Levofloksasiinia pidetään liukoisena tai vapaasti liukenevana tällä pH-alueella USP-nimikkeistön määrittelemällä tavalla. pH:n 5,8 yläpuolella liukoisuus kasvaa nopeasti maksimissaan pH:ssa 6,7 (272 mg/ml), ja sitä pidetään tällä alueella vapaasti liukenevana. pH:n 6,7 yläpuolella liukoisuus laskee ja saavuttaa minimiarvon (noin 50 mg/ml) pH:ssa noin 6,9.
Levofloksasiinilla on mahdollisuus muodostaa stabiileja koordinaatioyhdisteitä monien metalli-ionien kanssa. Tällä in vitro kelatointipotentiaalilla on seuraava muodostumisjärjestys: Al+3>Cu+2>Zn+2>Mg+2>Ca+2.
LEVAQUIN®-tabletit ovat saatavilla kalvopäällysteisinä tabletteina ja sisältävät seuraavia inaktiivisia aineosia:
- 250 mg (ilmaistuna vedettömässä muodossa): krospovidoni, hypromelloosi, magnesiumstearaatti, mikrokiteinen selluloosa, polyetyleeniglykoli, polysorbaatti 80, synteettinen punainen rautaoksidi ja titaanidioksidi.
- 500 mg (ilmaistuna vedettömässä muodossa): krospovidoni, hypromelloosi, magnesiumstearaatti, mikrokiteinen selluloosa, polyetyleeniglykoli, polysorbaatti 80, synteettiset punaiset ja keltaiset rautaoksidit ja titaanidioksidi.
- 750 mg (ilmaistuna vedettömässä muodossa): krospovidoni, hypromelloosi, magnesiumstearaatti, mikrokiteinen selluloosa, polyetyleeniglykoli, polysorbaatti 80, titaanidioksidi.
INDIKAATIOT
Nosokomiaalinen keuhkokuume
LEVAQUIN® on tarkoitettu aikuispotilaille metisilliinille herkän Staphylococcus aureuksen, Pseudomonas aeruginosan, Serratia marcescensin, Escherichia colin, Klebsiella pneumoniaen, Haemophilus influenzaen tai Streptococcus pneumoniaen aiheuttaman nosokomiaalisen keuhkokuumeen hoitoon. Lisähoitoa tulee käyttää kliinisen tarpeen mukaan. Jos Pseudomonas aeruginosa on dokumentoitu tai oletettu patogeeni, yhdistelmähoitoa pseudomonaalisen β-laktaamin kanssa suositellaan [ks. Kliiniset tutkimukset ].
Yhteisön hankkima keuhkokuume
7-14 päivän hoito-ohjelma
LEVAQUIN® on tarkoitettu aikuispotilaille metisilliinille herkän Staphylococcus aureuksen, Streptococcus pneumoniaen (mukaan lukien monilääkeresistenssin Streptococcus pneumoniae [MDRSP]), Haemophilus influenzaen, Haemophilus parainfluellaxhal, Kleb parainfluellaxhalin aiheuttaman keuhkokuumeen hoitoon. , Chlamydophila pneumoniae, Legionella pneumophila tai Mycoplasma pneumoniae [katso ANNOSTELU JA HALLINNOINTI ja Kliiniset tutkimukset ].
MDRSP-isolaatit ovat isolaatteja, jotka ovat resistenttejä kahdelle tai useammalle seuraavista antibakteerisista aineista: penisilliini (MIC ≥2 mcg/ml), 2. sukupolven kefalosporiinit, esim. kefuroksiimi, makrolidit, tetrasykliinit ja trimetopriimi/sulfametoksatsoli.
Yhteisön hankkima keuhkokuume
5 päivän hoito-ohjelma
LEVAQUIN® on tarkoitettu aikuispotilaille Streptococcus pneumoniaen (lukuun ottamatta useille lääkkeille resistenttejä isolaatteja [MDRSP]), Haemophilus influenzae, Haemophilus parainfluenzae, Mycoplasma pneumoniae tai Chlamydophila pneumoniae aiheuttaman keuhkokuumeen hoitoon [ks. ANNOSTELU JA HALLINNOINTI ja Kliiniset tutkimukset ].
Monimutkaiset iho- ja ihorakenteen infektiot
LEVAQUIN® on tarkoitettu aikuispotilaille monimutkaisten iho- ja ihorakenneinfektioiden hoitoon, jotka johtuvat metisilliinille herkistä Staphylococcus aureus-, Enterococcus faecalis-, Streptococcus pyogenes- tai Proteus mirabilis -bakteerista [ks. Kliiniset tutkimukset ].
Komplisoitumattomat iho- ja ihorakenteen infektiot
LEVAQUIN® on tarkoitettu aikuispotilaille komplisoitumattomien ihon ja ihon rakenneinfektioiden (lievä tai kohtalainen) hoitoon, mukaan lukien paiseet, selluliitti, furunkelit, impetigo, pyoderma, haavainfektiot, jotka johtuvat metisilliinille herkistä Staphylococcus aureus- tai Streptococcus pyogenes -bakteerista.
Krooninen bakteerien aiheuttama eturauhastulehdus
LEVAQUIN® on tarkoitettu aikuispotilaille Escherichia colin, Enterococcus faecalisin tai metisilliinille herkän Staphylococcus epidermidis -bakteerin aiheuttaman kroonisen bakteeriperäisen eturauhastulehduksen hoitoon [ks. Kliiniset tutkimukset ].
Hengitetty pernarutto (altistuksen jälkeinen)
LEVAQUIN® on tarkoitettu inhaloitavaan pernaruttoon (altistuksen jälkeinen) vähentämään taudin ilmaantuvuutta tai etenemistä aerosolisoidulle Bacillus anthracikselle altistumisen jälkeen aikuisilla ja 6 kuukauden ikäisillä ja sitä vanhemmilla lapsipotilailla [ks. ANNOSTELU JA HALLINNOINTI ]. LEVAQUIN®:n tehokkuus perustuu ihmisillä saavutettuihin plasmapitoisuuksiin, mikä on korvaava päätetapahtuma, jonka perusteella voidaan kohtuudella ennustaa kliinistä hyötyä.
LEVAQUIN®-valmistetta ei ole testattu ihmisillä inhaloitavan pernaruton ehkäisyssä altistumisen jälkeen. LEVAQUIN®-valmisteen turvallisuutta aikuisilla yli 28 vuorokautta kestävän hoidon aikana tai lapsipotilailla yli 14 päivää kestävän hoidon aikana ei ole tutkittu. Pitkäaikaista LEVAQUIN®-hoitoa tulee käyttää vain, kun hyöty on riskiä suurempi [katso Kliiniset tutkimukset ].
Rutto
LEVAQUIN® on tarkoitettu Yersinia pestis -bakteerin (Y. pestis) aiheuttaman ruton, mukaan lukien keuhko- ja septiseemisen ruton, hoitoon ja ruton estoon 6 kuukauden ikäisille ja sitä vanhemmille aikuisille ja lapsipotilaille [ks. ANNOSTELU JA HALLINNOINTI ].
LEVAQUIN®:n tehokkuustutkimuksia ei voitu suorittaa ruttoa sairastavilla ihmisillä eettisistä ja toteutettavuussyistä. Siksi tämän käyttöaiheen hyväksyminen perustui eläimillä tehtyyn tehokkuustutkimukseen [katso Kliiniset tutkimukset ].
Monimutkaiset virtsatieinfektiot
5 päivän hoito-ohjelma
LEVAQUIN® on tarkoitettu aikuispotilaille Escherichia colin, Klebsiella pneumoniaen tai Proteus mirabilisin aiheuttamien monimutkaisten virtsatieinfektioiden hoitoon [ks. Kliiniset tutkimukset ].
Monimutkaiset virtsatieinfektiot
10 päivän hoito-ohjelma
LEVAQUIN® on tarkoitettu aikuispotilaille Enterococcus faecalisin, Enterobacter cloacaen, Escherichia colin, Klebsiella pneumoniaen, Proteus mirabilisin tai Pseudomonas aeruginosan aiheuttamien komplisoituneiden virtsatieinfektioiden (lievä tai kohtalainen) hoitoon [ks. Kliiniset tutkimukset ].
Akuutti pyelonefriitti
5 tai 10 päivän hoito-ohjelma
LEVAQUIN® on tarkoitettu aikuispotilaille Escherichia colin aiheuttaman akuutin pyelonefriitin hoitoon, mukaan lukien tapaukset, joissa on samanaikainen bakteremia [ks. Kliiniset tutkimukset ].
Komplisoitumattomat virtsatieinfektiot
LEVAQUIN® on tarkoitettu aikuispotilaille Escherichia colin, Klebsiella pneumoniaen tai Staphylococcus saprophyticuksen aiheuttamien komplisoitumattomien virtsatieinfektioiden (lievä tai kohtalainen) hoitoon.
Koska fluorokinoloneihin, mukaan lukien LEVAQUIN®, on liittynyt vakavia haittavaikutuksia [ks. VAROITUKSET JA VAROTOIMET ja joillekin potilaille komplisoitumaton virtsatietulehdus on itsestään rajoittuva, varaa LEVAQUIN® komplisoitumattomien virtsatieinfektioiden hoitoon potilailla, joilla ei ole vaihtoehtoisia hoitovaihtoehtoja.
Kroonisen keuhkoputkentulehduksen akuutti bakteerien paheneminen
LEVAQUIN® on tarkoitettu aikuispotilaille metisilliinille herkän Staphylococcus aureuksen, Streptococcus pneumoniaen, Haemophilus influenzaen, Haemophilus parainfluenzaen tai Moraxella catarrhalisin aiheuttaman akuutin bakteeriperäisen kroonisen keuhkoputkentulehduksen (ABECB) pahenemisen hoitoon.
Koska fluorokinoloneihin, mukaan lukien LEVAQUIN®, on liittynyt vakavia haittavaikutuksia [ks. VAROITUKSET JA VAROTOIMET ] ja joillekin potilaille ABECB on itsestään rajoittuva, varaa LEVAQUIN® ABECB:n hoitoon potilailla, joilla ei ole vaihtoehtoisia hoitovaihtoehtoja.
Akuutti bakteeriperäinen sinuiitti
5 päivän ja 10–14 päivän hoito-ohjelmat
LEVAQUIN® on tarkoitettu aikuispotilaille Streptococcus pneumoniaen, Haemophilus influenzaen tai Moraxella catarrhaliksen aiheuttaman akuutin bakteeriperäisen poskiontelotulehduksen (ABS) hoitoon [ks. Kliiniset tutkimukset ].
Koska fluorokinoloneihin, mukaan lukien LEVAQUIN®, on liittynyt vakavia haittavaikutuksia [ks. VAROITUKSET JA VAROTOIMET ja joillekin potilaille ABS on itsestään rajoittuva, varaa LEVAQUIN® ABS:n hoitoon potilailla, joilla ei ole vaihtoehtoisia hoitovaihtoehtoja.
Käyttö
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja LEVAQUIN®:n ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi LEVAQUIN®ia tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden on todistettu tai epäillään aiheuttavan herkkiä bakteereja. Kun viljely- ja herkkyystiedot ovat saatavilla, ne tulee ottaa huomioon valittaessa tai muuttaessa antibakteerista hoitoa. Tällaisten tietojen puuttuessa paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa hoidon empiiriseen valintaan.
Kulttuuri- ja herkkyystestaus
Ennen hoitoa tulee suorittaa asianmukaiset viljely- ja herkkyystestit infektion aiheuttavien organismien eristämiseksi ja tunnistamiseksi ja niiden herkkyyden määrittämiseksi levofloksasiinille [ks. Mikrobiologia ]. LEVAQUIN®-hoito voidaan aloittaa ennen kuin näiden testien tulokset ovat tiedossa; kun tulokset ovat saatavilla, on valittava sopiva hoito.
Kuten muutkin tämän luokan lääkkeet, jotkut Pseudomonas aeruginosa -isolaatit voivat kehittää resistenssiä melko nopeasti LEVAQUIN®-hoidon aikana. Hoidon aikana määräajoin suoritettavat viljely- ja herkkyystestit antavat tietoa taudinaiheuttajien jatkuvasta herkkyydestä mikrobilääkkeelle ja myös mahdollisesta bakteeriresistenssin syntymisestä.
ANNOSTELU JA HALLINNOINTI
LEVAQUIN®-tablettien annostus aikuispotilaille, joiden kreatiniinipuhdistuma on ≥ 50 ml/minuutti
Tavallinen LEVAQUIN®-tablettien annos on 250 mg, 500 mg tai 750 mg suun kautta 24 tunnin välein, kuten infektio osoittaa ja taulukossa 1 on kuvattu.
Nämä suositukset koskevat potilaita, joiden kreatiniinipuhdistuma on ≥ 50 ml/minuutti. Potilaille, joiden kreatiniinipuhdistuma on alle 50 ml/min, annostusohjelmaa on muutettava [ks. Annoksen säätäminen aikuisilla, joilla on munuaisten vajaatoiminta ].
LEVAQUIN®-tablettien annostus lapsipotilaille, joilla on inhaloitava pernarutto tai rutto
LEVAQUIN®-tablettien annostus inhaloitavaan pernaruttoon (altistuksen jälkeen) ja ruttoon lapsipotilaille, jotka painavat 30 kg tai enemmän, on kuvattu alla olevassa taulukossa 2. LEVAQUIN®-tabletteja ei voida antaa potilaille, jotka painavat alle 30 kg rajoitusten vuoksi. käytettävissä olevasta vahvuudesta. Vaihtoehtoisia levofloksasiinin formulaatioita voidaan harkita alle 30 kg painaville lapsipotilaille.
Annoksen säätäminen aikuisilla, joilla on munuaisten vajaatoiminta
Anna LEVAQUIN® varoen potilaille, joilla on munuaisten vajaatoiminta. Huolellinen kliininen seuranta ja asianmukaiset laboratoriotutkimukset on suoritettava ennen hoidon aloittamista ja sen aikana, koska levofloksasiinin eliminaatio saattaa heikentyä näillä potilailla.
Potilailla, joilla on munuaisten vajaatoiminta (kreatiniinipuhdistuma alle 50 ml/min), annostusohjelman muuttaminen on välttämätöntä levofloksasiinin kertymisen välttämiseksi puhdistuman vähenemisen vuoksi [ks. Käyttö tietyissä populaatioissa ]. Säätäminen ei ole tarpeen potilailla, joiden kreatiniinipuhdistuma on suurempi tai yhtä suuri kuin 50 ml/minuutti.
Taulukko 3 näyttää, kuinka annosta säädetään kreatiniinipuhdistuman perusteella.
Huumeiden vuorovaikutus kelaatioaineiden kanssa
Antasidit, sukralfaatti, metallikationit, monivitamiinit
LEVAQUIN®-tabletit tulee ottaa vähintään kaksi tuntia ennen tai kaksi tuntia sen jälkeen antasideja, jotka sisältävät magnesiumia, alumiinia sekä sukralfaattia, metallikationeja, kuten rautaa, ja monivitamiinivalmisteita sinkin tai didanosiinin puru-/puskuroitujen tablettien tai lasten jauheen oraaliliuosta varten. [katso HUUMEIDEN VUOROVAIKUTUKSET ja POTILASTIEDOT ].
Hallinto-ohjeet
LEVAQUIN®-tabletit voidaan ottaa ruokailusta riippumatta.
Nesteytys potilaille, jotka saavat LEVAQUIN®-tabletteja
LEVAQUIN®-hoitoa saavien potilaiden riittävä nesteytys tulee säilyttää, jotta estetään erittäin väkevän virtsan muodostuminen. Crystalluria ja sylindruria on raportoitu kinolonien kanssa [katso HAITTAVAIKUTUKSET ja POTILASTIEDOT ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
TABLETIT, Kalvopäällysteiset, kapselin muotoiset
- 250 mg terrakotta vaaleanpunainen tabletti, jonka toiselle puolelle on painettu "250" ja toiselle puolelle "LEVAQUIN"
- 500 mg persikkatabletit, joiden toiselle puolelle on painettu "500" ja toiselle puolelle "LEVAQUIN"
- 750 mg valkoiset tabletit, joiden toiselle puolelle on painettu "750" ja toiselle puolelle "LEVAQUIN"
Varastointi ja käsittely
LEVAQUIN®-tabletit toimitetaan 250, 500 ja 750 mg:n kapselin muotoisina päällystetyinä tabletteina.
LEVAQUIN®-tabletit on pakattu pulloihin seuraavissa kokoonpanoissa:
- 250 mg tabletit ovat terrakottavaaleanpunaisia ja niissä on merkintä: "LEVAQUIN®" toiselle puolelle ja "250" toiselle puolelle
- 50 pulloa ( NDC 50458-920-50)
- 500 mg tabletit ovat persikanvärisiä ja niissä on merkintä "LEVAQUIN®" toiselle puolelle ja "500" toiselle puolelle
- 50 pulloa ( NDC 50458-925-50)
- 750 mg tabletit ovat valkoisia, ja niiden toiselle puolelle on painettu "LEVAQUIN®" ja toiselle puolelle "750"
- 20 pulloa ( NDC 50458-930-20)
LEVAQUIN®-tabletit tulee säilyttää 15–30 °C:ssa (59–86 °F) hyvin suljetuissa astioissa.
Valmistaja: Active Ingredient Made in Japan. Tarkistettu: heinäkuuta 2018
SIVUVAIKUTUKSET
Vakavat ja muutoin tärkeät haittavaikutukset
Seuraavia vakavia ja muuten tärkeitä haittavaikutuksia käsitellään tarkemmin muissa merkintöjen osissa:
- Vakavat ja mahdollisesti peruuttamattomat vakavat haittavaikutukset [katso VAROITUKSET JA VAROTOIMET ]
- Jännetulehdus ja jänteen repeämä [katso VAROITUKSET JA VAROTOIMET ]
- Perifeerinen neuropatia [katso VAROITUKSET JA VAROTOIMET ]
- Keskushermoston vaikutukset [katso VAROITUKSET JA VAROTOIMET ]
- Myasthenia Gravisin paheneminen [katso VAROITUKSET JA VAROTOIMET ]
- Muut vakavat ja joskus kohtalokkaat reaktiot [katso VAROITUKSET JA VAROTOIMET ]
- Yliherkkyysreaktiot [katso VAROITUKSET JA VAROTOIMET ]
- Maksatoksisuus [katso VAROITUKSET JA VAROTOIMET ]
- Clostridium difficileen liittyvä ripuli [katso VAROITUKSET JA VAROTOIMET ]
- QT-ajan pidentyminen [katso VAROITUKSET JA VAROTOIMET ]
- Tuki- ja liikuntaelinten häiriöt lapsipotilailla [katso VAROITUKSET JA VAROTOIMET ]
- Verensokerin häiriöt [katso VAROITUKSET JA VAROTOIMET ]
- Valoherkkyys/valotoksisuus [katso VAROITUKSET JA VAROTOIMET ]
- Lääkeresistenttien bakteerien kehittäminen [katso VAROITUKSET JA VAROTOIMET ]
Kristalluriaa ja sylindruriaa on raportoitu kinolonien, mukaan lukien LEVAQUIN®:n, käytön yhteydessä. Siksi LEVAQUIN®-hoitoa saavien potilaiden riittävä nesteytys on säilytettävä erittäin väkevän virtsan muodostumisen estämiseksi [ks. ANNOSTELU JA HALLINNOINTI ].
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Alla kuvatut tiedot kuvaavat LEVAQUIN®-altistusta 7537 potilaalla 29 yhdistetyssä vaiheen 3 kliinisessä tutkimuksessa. Tutkitun väestön keski-ikä oli 50 vuotta (noin 74 % väestöstä oli alle 65-vuotiaita), 50 % oli miehiä, 71 % valkoihoisia ja 19 % mustia. Potilaita hoidettiin LEVAQUIN®-valmisteella monenlaisiin infektiosairauksiin [katso INDIKAATIOT ]. Potilaat saivat LEVAQUIN®-annoksia 750 mg kerran vuorokaudessa, 250 mg kerran vuorokaudessa tai 500 mg kerran tai kahdesti päivässä.
Hoidon kesto oli yleensä 3–14 päivää ja keskimääräinen hoitopäivien lukumäärä 10 päivää.
Haittavaikutusten yleinen ilmaantuvuus, tyyppi ja jakautuminen olivat samanlaiset potilailla, jotka saivat LEVAQUIN®-annoksia 750 mg kerran vuorokaudessa, 250 mg kerran vuorokaudessa ja 500 mg kerran tai kahdesti vuorokaudessa.
LEVAQUIN®-hoidon keskeyttäminen haittavaikutusten vuoksi tapahtui 4,3 %:lla potilaista, 3,8 %:lla potilaista, joita hoidettiin 250 mg:n ja 500 mg:n annoksilla, ja 5,4 %:lla potilaista, joita hoidettiin 750 mg:n annoksella. Yleisimmät haittavaikutukset, jotka johtivat hoidon lopettamiseen 250 ja 500 mg:n annoksilla, olivat maha-suolikanavan (1,4 %), pääasiassa pahoinvointia (0,6 %); oksentelu (0,4 %); huimaus (0,3 %); ja päänsärky (0,2 %). Yleisimmät haittavaikutukset, jotka johtivat hoidon lopettamiseen 750 mg:n annoksella, olivat maha-suolikanava (1,2 %), pääasiassa pahoinvointi (0,6 %), oksentelu (0,5 %); huimaus (0,3 %); ja päänsärky (0,3 %).
Haittavaikutukset, joita esiintyy ≥ 1 %:lla LEVAQUIN®-hoitoa saaneista potilaista ja vähemmän yleiset haittavaikutukset, joita esiintyy 0,1–
Kliinisissä tutkimuksissa, joissa käytettiin usean annoksen hoitoa, on havaittu oftalmologisia poikkeavuuksia, mukaan lukien kaihi ja useita pistemäisiä linssimäisiä sameuksia potilailla, jotka ovat saaneet hoitoa kinoloneilla, mukaan lukien LEVAQUIN®. Huumeiden suhdetta näihin tapahtumiin ei ole tällä hetkellä osoitettu.
Markkinoinnin jälkeinen kokemus
Taulukossa 6 luetellaan haittavaikutukset, jotka on tunnistettu LEVAQUIN®:n hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
HUUMEIDEN VUOROVAIKUTUKSET
Kelatointiaineet
Antasidit, sukralfaatti, metallikationit, monivitamiinit
Vaikka kaksiarvoisten kationien aiheuttama kelatointi on vähäisempää kuin muilla fluorokinoloneilla, LEVAQUIN®-tablettien samanaikainen anto magnesiumia tai alumiinia sekä sukralfaattia, metallikationeja, kuten rautaa sisältävien antasidien ja sinkkiä sisältävien monivitamiinivalmisteiden kanssa voi häiritä ruoansulatuskanavan imeytymistä. levofloksasiinia, mikä johtaa huomattavasti toivottua alhaisempiin systeemisiin tasoihin. Tabletit, jotka sisältävät magnesiumia, alumiinia sekä sukralfaattia, metallikationeja, kuten rautaa, sisältävät monivitamiinivalmisteet, joissa on sinkkiä tai didanosiinia, voivat olennaisesti häiritä levofloksasiinin imeytymistä maha-suolikanavasta, mikä johtaa huomattavasti toivottua alhaisempiin systeemisiin pitoisuuksiin. Nämä aineet tulee ottaa vähintään kaksi tuntia ennen tai kaksi tuntia oraalisen LEVAQUIN®-annon jälkeen.
Varfariini
LEVAQUIN®:lla ei havaittu merkittävää vaikutusta plasman huippupitoisuuksiin, AUC:hen ja muihin R- ja S-varfariinin jakautumisparametreihin kliinisessä tutkimuksessa, johon osallistui terveitä vapaaehtoisia. Samoin varfariinilla ei havaittu näkyvää vaikutusta levofloksasiinin imeytymiseen ja jakautumiseen. Markkinoille tulon jälkeen potilailla on kuitenkin raportoitu, että LEVAQUIN® voimistaa varfariinin vaikutuksia. Protrombiiniajan nousu, kun varfariinia ja LEVAQUIN®-hoitoa käytetään samanaikaisesti, on yhdistetty verenvuotojaksoihin. Protrombiiniaikaa, kansainvälistä normalisoitua suhdetta (INR) tai muita sopivia antikoagulaatiotestejä tulee seurata tarkasti, jos LEVAQUIN®ia annetaan samanaikaisesti varfariinin kanssa. Potilaita tulee myös tarkkailla verenvuodon varalta [katso HAITTAVAIKUTUKSET ja POTILASTIEDOT ].
Diabeteslääkkeet
Verensokerin häiriöitä, mukaan lukien hyperglykemiaa ja hypoglykemiaa, on raportoitu potilailla, joita on hoidettu samanaikaisesti fluorokinolonilla ja diabeteslääkkeillä. Siksi verensokerin huolellista seurantaa suositellaan, kun näitä aineita annetaan samanaikaisesti [ks VAROITUKSET JA VAROTOIMET , HAITTAVAIKUTUKSET , ja POTILASTIEDOT ].
Ei-steroidiset tulehduskipulääkkeet
Ei-steroidisen tulehduskipulääkkeen samanaikainen anto fluorokinolonin kanssa, mukaan lukien LEVAQUIN®, voi lisätä keskushermoston stimulaation ja kouristuksen riskiä [ks. VAROITUKSET JA VAROTOIMET ].
Teofylliini
LEVAQUIN®:lla ei havaittu merkittävää vaikutusta plasman pitoisuuksiin, AUC:hen ja muihin teofylliinin jakautumisparametreihin kliinisessä tutkimuksessa, johon osallistui terveitä vapaaehtoisia. Teofylliinillä ei myöskään havaittu ilmeistä vaikutusta levofloksasiinin imeytymiseen ja jakautumiseen. Muiden fluorokinolonien samanaikainen käyttö teofylliinin kanssa on kuitenkin pidentänyt eliminaation puoliintumisaikaa, kohonnut seerumin teofylliinitasoja ja lisännyt teofylliiniin liittyvien haittavaikutusten riskiä potilaspopulaatiossa. Siksi teofylliinitasoja on seurattava tarkasti ja annostusta on muutettava asianmukaisesti, kun LEVAQUIN®-valmistetta annetaan samanaikaisesti. Haittavaikutuksia, mukaan lukien kouristukset, voi esiintyä seerumin teofylliinipitoisuuden nousun kanssa tai ilman sitä [ks. VAROITUKSET JA VAROTOIMET ].
Syklosporiini
LEVAQUIN®:lla ei havaittu merkittävää vaikutusta plasman huippupitoisuuksiin, AUC:hen ja muihin siklosporiinin jakautumisparametreihin kliinisessä tutkimuksessa, johon osallistui terveitä vapaaehtoisia. Potilaspopulaatiossa on kuitenkin raportoitu kohonneita seerumin siklosporiinipitoisuuksia, kun sitä on annettu yhdessä joidenkin muiden fluorokinolonien kanssa. Levofloksasiinin Cmax ja ke olivat hieman pienemmät, kun taas Tmax ja t1/2 olivat hieman pidemmät siklosporiinin läsnä ollessa kuin ne, jotka havaittiin muissa tutkimuksissa ilman samanaikaista lääkitystä. Eroja ei kuitenkaan pidetä kliinisesti merkittävinä. Siksi LEVAQUIN®-valmisteen tai siklosporiinin annostusta ei tarvitse muuttaa, kun niitä käytetään samanaikaisesti.
Digoksiini
LEVAQUIN®:lla ei havaittu merkittävää vaikutusta plasman huippupitoisuuksiin, AUC:hen ja muihin digoksiinin jakautumisparametreihin kliinisessä tutkimuksessa, johon osallistui terveitä vapaaehtoisia. Levofloksasiinin imeytymis- ja jakautumiskinetiikka oli samanlainen digoksiinin läsnä ollessa tai ilman sitä. Siksi LEVAQUIN®- tai digoksiinin annostusta ei tarvitse muuttaa, kun niitä annetaan samanaikaisesti.
Probenesidi ja simetidiini
Probenesidillä tai simetidiinillä ei havaittu merkittävää vaikutusta levofloksasiinin Cmax-arvoon kliinisessä tutkimuksessa, johon osallistui terveitä vapaaehtoisia. Levofloksasiinin AUC ja t1/2 olivat korkeammat, kun taas CL/F ja CLR olivat alhaisemmat, kun LEVAQUIN®-hoitoa annettiin samanaikaisesti probenesidin tai simetidiinin kanssa verrattuna pelkkään LEVAQUIN®-hoitoon. Nämä muutokset eivät kuitenkaan oikeuta LEVAQUIN®-annoksen muuttamista, kun probenesidiä tai simetidiiniä annetaan samanaikaisesti.
Vuorovaikutus laboratorio- tai diagnostisten testausten kanssa
Jotkut fluorokinolonit, mukaan lukien LEVAQUIN®, voivat tuottaa vääriä positiivisia virtsaseulontatuloksia opiaateille käyttämällä kaupallisesti saatavia immunomäärityssarjoja. Positiivisten opiaattiseulojen vahvistaminen tarkemmilla menetelmillä saattaa olla tarpeen.
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Vakavia ja mahdollisesti peruuttamattomia vakavia haittavaikutuksia, mukaan lukien jännetulehdus ja jänteen repeämä, perifeerinen neuropatia ja keskushermoston vaikutukset
Fluorokinoloneihin, mukaan lukien LEVAQUIN®, on liitetty toimintakyvyttömyyttä aiheuttavia ja mahdollisesti peruuttamattomia vakavia haittavaikutuksia eri kehon järjestelmistä, joita voi esiintyä yhdessä samalla potilaalla. Yleisesti havaittuja haittavaikutuksia ovat jännetulehdus, jänteen repeämä, nivelsärky, lihaskipu, perifeerinen neuropatia ja keskushermostovaikutukset (hallusinaatiot, ahdistuneisuus, masennus, unettomuus, vaikea päänsärky ja sekavuus). Nämä reaktiot voivat ilmaantua tunneista viikkoihin LEVAQUIN®-hoidon aloittamisen jälkeen. Kaiken ikäiset potilaat tai ilman olemassa olevia riskitekijöitä ovat kokeneet näitä haittavaikutuksia [katso Jännetulehdus ja jänteen repeämä, perifeerinen neuropatia, keskushermoston vaikutukset ].
Lopeta LEVAQUIN®-hoito välittömästi, kun havaitset ensimmäisiä merkkejä tai oireita vakavasta haittavaikutuksesta. Vältä lisäksi fluorokinolonien, mukaan lukien LEVAQUIN®, käyttöä potilailla, joilla on ollut jokin näistä fluorokinoloneihin liittyvistä vakavista haittavaikutuksista.
Jännetulehdus ja jänteen repeämä
Fluorokinolonit, mukaan lukien LEVAQUIN®, on yhdistetty lisääntyneeseen jännetulehduksen ja jännerepeämän riskiin kaiken ikäisillä [ks. Vakavia ja mahdollisesti peruuttamattomia vakavia haittavaikutuksia, mukaan lukien jännetulehdus ja jänteen repeämä, perifeerinen neuropatia ja keskushermoston vaikutukset ja HAITTAVAIKUTUKSET ]. Tämä haittavaikutus koskee useimmiten akillesjännettä, ja sitä on raportoitu myös kiertäjämansetissa (olkapäässä), kädessä, hauislihaksessa, peukalossa ja muissa jännekohdissa. Jännetulehdus tai jänteen repeämä voi ilmaantua tuntien tai päivien sisällä LEVAQUIN®-hoidon aloittamisesta tai jopa useita kuukausia fluorokinolonihoidon päättymisen jälkeen. Jännetulehdus ja jänteen repeämä voivat esiintyä molemmin puolin.
Fluorokinoloneihin liittyvän jännetulehduksen ja jänteen repeämän riski on lisääntynyt yli 60-vuotiailla potilailla, kortikosteroidilääkkeitä käyttävillä sekä potilailla, joille on tehty munuais-, sydän- tai keuhkosiirto. Muita tekijöitä, jotka voivat itsenäisesti lisätä jänteen repeämisen riskiä, ovat rasittava fyysinen aktiivisuus, munuaisten vajaatoiminta ja aiemmat jännehäiriöt, kuten nivelreuma. Tendiniittiä ja jänteen repeämää on raportoitu fluorokinoloneja käyttävillä potilailla, joilla ei ole yllä mainittuja riskitekijöitä. Lopeta LEVAQUIN®-hoito välittömästi, jos potilaalla ilmenee kipua, turvotusta, tulehdusta tai jänteen repeämää. Potilaita tulee neuvoa lepäämään jännetulehduksen tai jänteen repeämän ensimmäisten merkkien yhteydessä ja ottamaan yhteyttä terveydenhuollon tarjoajaan ei-kinolonilääkkeeseen vaihtamisesta. Vältä LEVAQUIN®:ia potilailla, joilla on ollut jännehäiriöitä tai jänteen repeämä [ks. HAITTAVAIKUTUKSET ja POTILASTIEDOT ].
Perifeerinen neuropatia
Fluorokinoloneihin, mukaan lukien LEVAQUIN®, on yhdistetty lisääntynyt perifeerisen neuropatian riski. Fluorokinoloneja, mukaan lukien LEVAQUIN®, saaneilla potilailla on raportoitu tapauksia, joissa aistinvarainen tai sensorimotorinen aksonaalinen polyneuropatia vaikuttaa pieniin ja/tai suuriin aksoneihin ja on aiheuttanut parestesioita, hypoestesiaa, dysestesiaa ja heikkoutta. Oireet voivat ilmaantua pian LEVAQUIN®-hoidon aloittamisen jälkeen, ja ne voivat olla peruuttamattomia joillakin potilailla [ks. Vakavia ja mahdollisesti peruuttamattomia vakavia haittavaikutuksia, mukaan lukien jännetulehdus ja jänteen repeämä, perifeerinen neuropatia ja keskushermoston vaikutukset ja HAITTAVAIKUTUKSET ].
Lopeta LEVAQUIN®-hoito välittömästi, jos potilaalla ilmenee neuropatian oireita, kuten kipua, polttavaa, pistelyä, tunnottomuutta ja/tai heikkoutta tai muita muutoksia aistimisessa, mukaan lukien kevyt kosketus, kipu, lämpötila, asennon tunne ja tärinä. Vältä fluorokinoloneja, mukaan lukien LEVAQUIN®, potilailla, joilla on aiemmin ollut perifeeristä neuropatiaa [ks. HAITTAVAIKUTUKSET ja POTILASTIEDOT ].
Keskushermoston vaikutukset
Fluorokinoloneihin, mukaan lukien LEVAQUIN®, on yhdistetty lisääntynyt keskushermostovaikutusten riski, mukaan lukien kouristukset, toksiset psykoosit, kohonnut kallonsisäinen paine (mukaan lukien pseudotumor cerebri). Fluorokinolonit voivat myös aiheuttaa keskushermoston stimulaatiota, mikä voi aiheuttaa vapinaa, levottomuutta, ahdistusta, huimausta, sekavuutta, hallusinaatioita, vainoharhaisuutta, masennusta, painajaisia ja unettomuutta. Myös itsemurha-ajatuksia ja itsemurhayrityksiä tai sen loppuun saattamista voi esiintyä, erityisesti potilailla, joilla on ollut masennusta tai masennuksen taustalla oleva riskitekijä. Näitä reaktioita saattaa ilmetä ensimmäisen annoksen jälkeen. Jos näitä reaktioita ilmenee potilailla, jotka saavat LEVAQUIN®-hoitoa, lopeta LEVAQUIN®-hoito ja aloita asianmukaiset toimenpiteet. Kuten muita fluorokinoloneja, LEVAQUIN®-valmistetta tulee käyttää varoen potilailla, joilla tiedetään tai epäillään keskushermoston (CNS) häiriötä, joka voi altistaa heidät kohtauksille tai alentaa kouristuskynnystä (esim. vaikea aivoarterioskleroosi, epilepsia) tai jos potilaalla on muista riskitekijöistä, jotka voivat altistaa heidät kohtauksille tai alentaa kohtauskynnystä (esim. tietty lääkehoito, munuaisten vajaatoiminta). [katso HAITTAVAIKUTUKSET , HUUMEIDEN VUOROVAIKUTUKSET , ja POTILASTIEDOT ].
Myasthenia Gravisin paheneminen
Fluorokinoloneilla, mukaan lukien LEVAQUIN®, on hermo-lihassalpaava vaikutus ja ne voivat pahentaa lihasheikkoutta potilailla, joilla on myasthenia gravis. Markkinoille tulon jälkeisiä vakavia haittavaikutuksia, mukaan lukien kuolemat ja hengitystuen tarve, on liitetty fluorokinolonien käyttöön potilailla, joilla on myasthenia gravis. Vältä LEVAQUIN®:ia potilailla, joilla on tunnettu myasthenia gravis -historia [katso HAITTAVAIKUTUKSET ja POTILASTIEDOT ].
Muut vakavat ja joskus kohtalokkaat haittavaikutukset
Muita vakavia ja joskus kuolemaan johtavia haittavaikutuksia, joista osa johtuu yliherkkyydestä ja osa epävarmasta etiologiasta, on raportoitu harvoin potilailla, jotka ovat saaneet fluorokinoloneja, mukaan lukien LEVAQUIN®. Nämä tapahtumat voivat olla vakavia ja ilmaantuvat yleensä useiden annosten antamisen jälkeen. Kliiniset oireet voivat sisältää yhden tai useamman seuraavista:
- kuume, ihottuma tai vakavat dermatologiset reaktiot (esim. toksinen epidermaalinen nekrolyysi, Stevens-Johnsonin oireyhtymä);
- vaskuliitti; nivelkipu; myalgia; seerumitauti;
- allerginen pneumoniitti;
- interstitiaalinen nefriitti; akuutti munuaisten vajaatoiminta tai vajaatoiminta;
- hepatiitti; keltaisuus; akuutti maksanekroosi tai maksan vajaatoiminta;
- anemia, mukaan lukien hemolyyttinen ja aplastinen; trombosytopenia, mukaan lukien tromboottinen trombosytopeeninen purppura; leukopenia; agranulosytoosi; pansytopenia; ja/tai muut hematologiset poikkeavuudet.
Lopeta LEVAQUIN®-hoito välittömästi ihottuman, keltaisuuden tai minkä tahansa muun yliherkkyysmerkin ilmaantuessa ja aloita tukitoimenpiteet (ks. HAITTAVAIKUTUKSET ja POTILASTIEDOT ].
Yliherkkyysreaktiot
Vakavia ja joskus kuolemaan johtaneita yliherkkyys- ja/tai anafylaktisia reaktioita on raportoitu potilailla, jotka ovat saaneet fluorokinoloneja, mukaan lukien LEVAQUIN®. Nämä reaktiot ilmaantuvat usein ensimmäisen annoksen jälkeen. Joihinkin reaktioihin on liittynyt kardiovaskulaarinen romahdus, hypotensio/sokki, kouristukset, tajunnan menetys, pistely, angioödeema (mukaan lukien kielen, kurkunpään, kurkun tai kasvojen turvotus/turvotus), hengitysteiden tukkeuma (mukaan lukien bronkospasmi, hengenahdistus ja akuutti hengitysteiden turvotus) ahdistus), hengenahdistus, urtikaria, kutina ja muut vakavat ihoreaktiot. LEVAQUIN®-hoito tulee lopettaa välittömästi, kun ihottumaa tai jokin muu yliherkkyysmerkki ilmaantuu ensimmäisen kerran. Vakavat akuutit yliherkkyysreaktiot saattavat vaatia hoitoa epinefriinillä ja muilla elvytystoimenpiteillä, mukaan lukien happi, suonensisäiset nesteet, antihistamiinit, kortikosteroidit, paineet aiheuttavat amiinit ja hengitysteiden hallinta kliinisen aiheen mukaisesti [ks. HAITTAVAIKUTUKSET ja POTILASTIEDOT ].
Maksatoksisuus
Markkinoille tulon jälkeen LEVAQUIN®-hoitoa saaneilla potilailla on raportoitu vakavasta maksatoksisuudesta (mukaan lukien akuutti hepatiitti ja kuolemaan johtaneet tapahtumat). Yli 7 000 potilaan kliinisissä tutkimuksissa ei havaittu todisteita vakavasta lääkkeisiin liittyvästä maksatoksisuudesta. Vaikea maksatoksisuus ilmaantui yleensä 14 päivän kuluessa hoidon aloittamisesta ja useimmissa tapauksissa 6 päivän kuluessa. Useimmat vakavan maksatoksisuuden tapaukset eivät liittyneet yliherkkyyteen [katso Muut vakavat ja joskus kohtalokkaat haittavaikutukset ].
Suurin osa kuolemaan johtaneista maksatoksisuusilmoituksista tapahtui 65-vuotiailla tai sitä vanhemmilla potilailla, eikä useimpiin niistä liittynyt yliherkkyyttä. LEVAQUIN®-hoito tulee lopettaa välittömästi, jos potilaalle kehittyy hepatiitin merkkejä ja oireita [ks. HAITTAVAIKUTUKSET ja POTILASTIEDOT ].
Clostridium Difficilen aiheuttama ripuli
Clostridium difficile -bakteeriin liittyvää ripulia (CDAD) on raportoitu käytettäessä lähes kaikkia antibakteerisia aineita, mukaan lukien LEVAQUIN®, ja sen vaikeusaste voi vaihdella lievästä ripulista kuolemaan johtavaan paksusuolentulehdukseen. Hoito antibakteerisilla aineilla muuttaa paksusuolen normaalia kasvillisuutta, mikä johtaa C. difficilen liikakasvuun.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CDAD:n kehittymistä. Hypertoksiinia tuottavat C. difficilen kannat lisäävät sairastuvuutta ja kuolleisuutta, koska nämä infektiot voivat olla vastustuskykyisiä antimikrobiselle hoidolle ja saattavat vaatia kolektomiaa. CDAD on otettava huomioon kaikilla potilailla, joilla on ripuli antibioottien käytön jälkeen. Huolellinen sairaushistoria on tarpeen, koska CDAD:n on raportoitu esiintyvän yli kaksi kuukautta antibakteeristen aineiden annon jälkeen.
Jos CDAD epäillään tai varmistetaan, jatkuva antibioottien käyttö, joka ei ole suunnattu C. difficileä vastaan, saattaa olla tarpeen lopettaa. Asianmukainen neste- ja elektrolyyttihallinta, proteiinilisä, C. difficilen antibioottihoito ja kirurginen arviointi tulee aloittaa kliinisen tarpeen mukaan [ks. HAITTAVAIKUTUKSET ja POTILASTIEDOT ].
QT-ajan pidentyminen
Jotkut fluorokinolonit, mukaan lukien LEVAQUIN®, on liitetty QT-ajan pidentymiseen EKG:ssa ja harvoin rytmihäiriötapauksiin. Harvinaisia torsade de pointes -tapauksia on raportoitu spontaanisti markkinoille tulon jälkeisen seurannan aikana potilailla, jotka ovat saaneet fluorokinoloneja, mukaan lukien LEVAQUIN®. LEVAQUIN®:ia tulee välttää potilailla, joiden tiedetään pidentyneen QT-aikaa, potilailla, joilla on korjaamaton hypokalemia, ja potilailla, jotka saavat luokan IA (kinidiini, prokainamidi) tai luokan III (amiodaroni, sotaloli) rytmihäiriölääkkeitä. Iäkkäät potilaat voivat olla herkempiä lääkkeisiin liittyville vaikutuksille QT-välissä [katso HAITTAVAIKUTUKSET , Käyttö tietyissä populaatioissa , ja POTILASTIEDOT ].
Tuki- ja liikuntaelinten sairaudet lapsipotilailla ja artropaattiset vaikutukset eläimillä
LEVAQUIN® on tarkoitettu lapsipotilaille (6 kuukauden ikäisille ja sitä vanhemmille) vain inhaloitavan pernaruton (altistuksen jälkeen) ja ruton ehkäisyyn [ks. INDIKAATIOT ]. LEVAQUINia saavilla lapsipotilailla on havaittu lisääntynyttä tuki- ja liikuntaelinsairauksien (nivelkipu, niveltulehdus, tendinopatia ja kävelyhäiriöt) esiintyvyyttä verrokkeihin verrattuna [ks. Käyttö tietyissä populaatioissa ].
Epäkypsillä rotilla ja koirilla levofloksasiinin oraalinen ja suonensisäinen anto johti lisääntyneeseen osteokondroosiin. Levofloksasiinia saaneiden kehittymättömien koirien painoa kantavien nivelten histopatologinen tutkimus paljasti pysyviä rustovaurioita. Muut fluorokinolonit aiheuttavat myös samanlaisia eroosioita painoa kantavissa nivelissä ja muita nivelsairauksien merkkejä eri lajien kehittymättömissä eläimissä [ks. Eläinfarmakologia ].
Verensokerin häiriöt
Kuten muidenkin fluorokinolonien kohdalla, LEVAQUIN®-hoidon yhteydessä on raportoitu verensokerin häiriöitä, mukaan lukien oireinen hyper- ja hypoglykemia, yleensä diabeetikoilla, jotka saavat samanaikaisesti hoitoa suun kautta otettavalla hypoglykeemisellä aineella (esim. glyburidilla) tai insuliinilla. Näillä potilailla suositellaan verensokerin huolellista seurantaa. Jos LEVAQUIN®-hoitoa saavalla potilaalla ilmenee hypoglykeeminen reaktio, LEVAQUIN®-hoito on lopetettava ja asianmukainen hoito on aloitettava välittömästi [ks. HAITTAVAIKUTUKSET , HUUMEIDEN VUOROVAIKUTUKSET ja POTILASTIEDOT ].
Valoherkkyys/valotoksisuus
Keskivaikeat tai vaikeat valoherkkyys-/valotoksisuusreaktiot, joista jälkimmäinen voi ilmetä liioitelluina auringonpolttamina (esim. polttaminen, punoitus, erittyminen, rakkulat, rakkulat, turvotus), jotka koskevat valolle alttiita alueita (tyypillisesti kasvot, kaulan V-alue). , käsivarsien ojentajapinnat, käsien selkä), voivat liittyä fluorokinolonien käyttöön auringon tai UV-säteilyn jälkeen. Siksi liiallista altistumista näille valonlähteille tulee välttää. Lääkehoito tulee lopettaa, jos valoherkkyyttä/fototoksisuutta ilmenee [katso HAITTAVAIKUTUKSET ja POTILASTIEDOT ].
Lääkeresistenttien bakteerien kehittäminen
LEVAQUIN®in määrääminen ilman todistettua tai vahvasti epäiltyä bakteeri-infektiota tai profylaktista indikaatiota ei todennäköisesti hyödytä potilasta ja lisää lääkeresistenttien bakteerien kehittymisen riskiä [ks. POTILASTIEDOT ].
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ).
Vakavat haittavaikutukset
Neuvo potilaita lopettamaan LEVAQUIN®in käyttö, jos heillä on haittavaikutus, ja soittamaan terveydenhuollon tarjoajalle neuvoja täyden hoitojakson suorittamisesta toisella antibakteerisella lääkkeellä.
Kerro potilaille seuraavista vakavista haittavaikutuksista, jotka ovat liittyneet LEVAQUIN®- tai muun fluorokinolonin käyttöön:
- Vakavat ja mahdollisesti peruuttamattomat vakavat haittavaikutukset, joita voi esiintyä yhdessä: Kerro potilaille, että LEVAQUIN®:in käyttöön on liittynyt vammauttavia ja mahdollisesti peruuttamattomia vakavia haittavaikutuksia, mukaan lukien jännetulehdus ja jänteen repeämä, perifeeriset neuropatiat ja keskushermostovaikutukset, ja niitä voi esiintyä samanaikaisesti samalla potilaalla. Kerro potilaille, että he lopettavat LEVAQUIN®in käytön välittömästi, jos heillä on haittavaikutus, ja soita terveydenhuollon tarjoajalleen.
- Jännetulehdus ja jänteen repeämä: Neuvo potilaita ottamaan yhteyttä terveydenhuollon tarjoajaan, jos he kokevat kipua, turvotusta tai jännetulehdusta tai heikkoutta tai kyvyttömyyttä käyttää jotakin nivelistä; lepää ja pidättäydy harjoituksesta; ja lopeta LEVAQUIN®-hoito. Oireet voivat olla peruuttamattomia. Fluorokinolonien käytön riski vakavaan jännehäiriöön on suurempi vanhemmilla, yleensä yli 60-vuotiailla potilailla, kortikosteroidilääkkeitä käyttävillä potilailla sekä potilailla, joille on tehty munuais-, sydän- tai keuhkosiirto.
- Perifeeriset neuropatiat: Kerro potilaille, että levofloksasiinin käyttöön on liittynyt perifeerisiä neuropatioita. Oireet voivat ilmaantua pian hoidon aloittamisen jälkeen ja voivat olla peruuttamattomia. Jos perifeerisen neuropatian oireita, kuten kipua, polttavaa, pistelyä, tunnottomuutta ja/tai heikkoutta, kehittyy, lopeta LEVAQUIN®-hoito välittömästi ja pyydä heitä ottamaan yhteyttä lääkäriin.
- Keskushermoston vaikutukset (esimerkiksi kouristukset, huimaus, huimaus, kohonnut kallonsisäinen paine): Kerro potilaille, että kouristuksia on raportoitu potilailla, jotka saavat fluorokinoloneja, mukaan lukien levofloksasiini. Neuvo potilaita ilmoittamaan lääkärilleen ennen tämän lääkkeen ottamista, jos heillä on ollut kouristuksia. Kerro potilaille, että heidän tulee tietää, miten he reagoivat LEVAQUIN®-hoitoon, ennen kuin he käyttävät autoa tai koneita tai ryhtyvät muihin toimiin, jotka vaativat henkistä valppautta ja koordinaatiota. Neuvo potilaita ilmoittamaan lääkärilleen, jos esiintyy jatkuvaa päänsärkyä näön hämärtymisen kanssa tai ilman.
- Myasthenia Gravisin paheneminen: Neuvo potilaita ilmoittamaan lääkärilleen kaikista myasthenia graviksen aiemmista. Neuvo potilaita ilmoittamaan lääkärilleen, jos heillä on lihasheikkouden oireita, mukaan lukien hengitysvaikeudet.
- Yliherkkyysreaktiot: Kerro potilaille, että levofloksasiini voi aiheuttaa yliherkkyysreaktioita jopa kerta-annoksen jälkeen, ja lääkkeen käyttö on lopetettava heti, kun ilmenee ihottuman, nokkosihottuman tai muiden ihoreaktioiden, nopean sydämen sykkeen, nielemis- tai hengitysvaikeuksien tai angioedeemaan viittaavaa turvotusta ( esimerkiksi huulten, kielen, kasvojen turvotus, kurkun kireys, käheys) tai muut allergisen reaktion oireet.
- Maksatoksisuus: Kerro potilaille, että LEVAQUIN®-hoitoa saavilla potilailla on raportoitu vakavaa maksatoksisuutta (mukaan lukien akuutti hepatiitti ja kuolemaan johtaneet tapahtumat). Neuvo potilaita ilmoittamaan lääkärilleen, jos he kokevat maksavaurion merkkejä tai oireita, mukaan lukien ruokahaluttomuus, pahoinvointi, oksentelu, kuume, heikkous, väsymys, oikean yläneljänneksen arkuus, kutina, ihon ja silmien keltaisuus, vaaleat suolen liikkeet tai tumma virtsa.
- Ripuli: Ripuli on yleinen antibioottien aiheuttama ongelma, joka yleensä loppuu, kun antibioottihoito lopetetaan. Joskus antibioottihoidon aloittamisen jälkeen potilaille voi ilmaantua vetisiä ja verisiä ulosteita (vatsakouristuksella ja kuumeella tai ilman) jopa kahden tai useamman kuukauden kuluttua viimeisen antibioottiannoksen ottamisesta. Jos näin tapahtuu, kehota potilaita ottamaan yhteyttä lääkäriin mahdollisimman pian.
- QT-ajan pidentyminen: Neuvo potilaita ilmoittamaan lääkärilleen kaikista henkilökohtaisista tai suvussa esiintyneistä QT-ajan pitenemisestä tai rytmihäiriöistä, kuten hypokalemiasta, bradykardiasta tai äskettäisestä sydänlihaksen iskemiasta; jos he käyttävät luokan IA (kinidiini, prokaiiniamidi) tai luokan III (amiodaroni, sotaloli) rytmihäiriölääkkeitä. Neuvo potilaita ilmoittamaan lääkärilleen, jos heillä on QT-ajan pitenemisen oireita, mukaan lukien pitkittynyt sydämentykytys tai tajunnan menetys.
- Tuki- ja liikuntaelinten sairaudet lapsipotilailla: Pyydä vanhempia ilmoittamaan lapsensa lääkärille ennen tämän lääkkeen ottamista, jos lapsella on ollut nivelongelmia. Kerro lapsipotilaiden vanhemmille ilmoittamaan lapsensa lääkärille kaikista nivelongelmista, joita esiintyy levofloksasiinihoidon aikana tai sen jälkeen [ks. VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
- Valoherkkyys/valotoksisuus: Kerro potilaille, että valoherkkyyttä/fototoksisuutta on raportoitu potilailla, jotka saavat fluorokinoloneja. Kerro potilaille, että he minimoivat tai välttävät altistumista luonnolliselle tai keinotekoiselle auringonvalolle (solariumit tai UVA/B-hoito) fluorokinolonien käytön aikana. Jos potilaat joutuvat olemaan ulkona fluorokinolonien käytön aikana, kehota heitä käyttämään väljiä vaatteita, jotka suojaavat ihoa auringolta ja keskustele lääkärin kanssa muista auringonsuojatoimenpiteistä. Jos ilmaantuu auringonpolttaman kaltainen reaktio tai ihottuma, kehota potilaita ottamaan yhteyttä lääkäriin.
Antibakteerinen vastustuskyky
Antibakteerisia lääkkeitä, mukaan lukien LEVAQUIN®, tulee käyttää vain bakteeri-infektioiden hoitoon. Ne eivät hoida virusinfektioita (esim. flunssaa). Kun LEVAQUIN®ia määrätään bakteeri-infektion hoitoon, potilaille tulee kertoa, että vaikka on yleistä, että olo paranee hoidon alkuvaiheessa, lääkettä tulee ottaa täsmälleen ohjeiden mukaan. Annosten väliin jättäminen tai koko hoitojakson suorittamatta jättäminen voi (1) heikentää välittömän hoidon tehokkuutta ja (2) lisätä todennäköisyyttä, että bakteerit kehittävät resistenssiä ja että niitä ei voida hoitaa LEVAQUIN®:lla tai muilla antibakteerisilla lääkkeillä tulevaisuudessa.
Annostelu ruoan, nesteiden ja samanaikaisten lääkkeiden kanssa
Potilaille tulee kertoa, että LEVAQUIN®-tabletit voidaan ottaa ruoan kanssa tai ilman. Tabletit tulee ottaa samaan aikaan joka päivä.
Potilaiden tulee juoda runsaasti nesteitä LEVAQUIN®-hoidon aikana, jotta virtsaan ei muodostu erittäin tiivistä virtsaa ja kiteiden muodostumista.
Magnesiumia tai alumiinia sekä sukralfaattia, metallikationeja, kuten rautaa, sekä sinkkiä tai didanosiinia sisältävät monivitamiinivalmisteet sisältävät antasidit tulee ottaa vähintään kaksi tuntia ennen LEVAQUIN®-annosta tai kaksi tuntia sen jälkeen.
Lääkkeiden yhteisvaikutukset insuliinin, suun kautta otettavien hypoglykeemisten aineiden ja varfariinin kanssa
Potilaille tulee kertoa, että jos he ovat diabeetikoita ja heitä hoidetaan insuliinilla tai suun kautta otettavalla hypoglykeemisellä aineella ja hypoglykeeminen reaktio ilmenee, heidän tulee lopettaa LEVAQUIN®-hoito ja kääntyä lääkärin puoleen.
Potilaille tulee kertoa, että varfariinin ja LEVAQUIN®:n samanaikainen käyttö on yhdistetty kansainvälisen normalisoidun suhteen (INR) tai protrombiiniajan pidentymiseen ja kliinisiin verenvuotojaksoihin. Potilaiden tulee ilmoittaa lääkärilleen, jos he käyttävät varfariinia, heitä tulee seurata verenvuodon varalta, ja heidän on myös seurattava tarkoin antikoagulaatiotestejä, kun he käyttävät varfariinia samanaikaisesti.
Rutto- ja pernaruttotutkimukset
Potilaille, joille on annettu LEVAQUIN®-hoitoa näihin sairauksiin, tulee kertoa, että tehokkuustutkimuksia ei voida tehdä ihmisillä eettisistä ja toteutettavuussyistä. Siksi näiden tilojen hyväksyminen perustui eläimillä tehtyihin tehokkuustutkimuksiin.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Rotilla tehdyssä elinikäisessä biotestissä levofloksasiini ei osoittanut karsinogeenistä potentiaalia, kun sitä annettiin päivittäin 2 vuoden ajan; suurin annos (100 mg/kg/vrk) oli 1,4 kertaa suurin suositeltu annos ihmiselle (750 mg) suhteellisen kehon pinta-alan perusteella. Levofloksasiini ei lyhentänyt UV-indusoitujen ihokasvainten kasvainten kehittymiseen kuluvaa aikaa karvattomilla albiino- (Skh-1) -hiirillä millään levofloksasiiniannostasolla, eikä se siksi ollut valokarsinogeeninen tämän tutkimuksen olosuhteissa. Ihon levofloksasiinipitoisuudet karvattomilla hiirillä vaihtelivat välillä 25-42 mcg/g korkeimmalla valokarsinogeenisuustutkimuksessa käytetyllä levofloksasiinin annostasolla (300 mg/kg/vrk). Vertailun vuoksi, ihon levofloksasiinipitoisuudet ihmisillä, jotka saivat 750 mg LEVAQUIN®:ia, olivat keskimäärin noin 11,8 mcg/g Cmax-arvolla.
Levofloksasiini ei ollut mutageeninen seuraavissa määrityksissä: Amesin bakteerimutaatiomääritys (S. typhimurium ja E. coli), CHO/HGPRT eteenpäin suuntautuva mutaatiomääritys, hiiren mikrotumatesti, hiiren dominanttiletaalitesti, rotan suunnittelematon DNA-synteesimääritys ja hiiren sisarkromatidi vaihtomääritys. Se oli positiivinen in vitro kromosomipoikkeavuus (CHL-solulinja) ja sisarkromatidinvaihto (CHL/IU-solulinja) määrityksissä.
Levofloksasiini ei aiheuttanut heikentynyttä hedelmällisyyttä tai lisääntymiskykyä rotilla jopa 360 mg/kg/vrk suun kautta otetuilla annoksilla, mikä vastaa 4,2 kertaa suurinta suositeltua annosta ihmiselle suhteellisen kehon pinta-alan perusteella ja suonensisäisiä annoksia jopa 100 mg/kg/vrk. päivässä, mikä vastaa 1,2 kertaa suurinta suositeltua annosta ihmiselle suhteellisen kehon pinta-alan perusteella.
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka C
Levofloksasiini ei ollut teratogeeninen rotilla jopa 810 mg/kg/vrk annoksilla, mikä vastaa 9,4 kertaa suurinta suositeltua suun kautta otettavaa annosta ihmiselle suhteellisen kehon pinta-alan perusteella. Suun kautta annettu annos 810 mg/kg/vrk rotille aiheutti sikiön painon laskua ja sikiökuolleisuutta. Teratogeenisuutta ei havaittu, kun kaneille annettiin suun kautta niinkin suuri annos kuin 50 mg/kg/vrk, mikä vastaa 1,1 kertaa suurinta suositeltua suun kautta annettavaa annosta ihmiselle suhteellisen kehon pinta-alan perusteella.
Ei kuitenkaan ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla. LEVAQUIN®-valmistetta tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan riskin.
Imettävät äidit
Muita fluorokinoloneja koskevien tietojen ja hyvin rajallisten LEVAQUIN®-tietojen perusteella voidaan olettaa, että levofloksasiini erittyy äidinmaitoon. Koska LEVAQUIN® voi aiheuttaa vakavia haittavaikutuksia imeväisille, on päätettävä, lopetetaanko imetys vai lopetetaanko lääkehoito ottaen huomioon lääkkeen merkitys äidille.
Käyttö lapsille
Kinolonit, mukaan lukien levofloksasiini, aiheuttavat artropatiaa ja osteokondroosia useiden lajien nuorilla eläimillä. [katso VAROITUKSET JA VAROTOIMET ja Eläinfarmakologia ].
Hengitetty pernarutto (altistuksen jälkeinen)
Levofloksasiini on tarkoitettu 6 kuukauden ikäisille ja sitä vanhemmille lapsipotilaille inhaloitavaan pernaruttoon (altistuksen jälkeinen). Riski-hyötyarviointi osoittaa, että levofloksasiinin antaminen lapsipotilaille on asianmukaista. Levofloksasiinin turvallisuutta lapsipotilailla, joita hoidettiin yli 14 päivää, ei ole tutkittu [katso INDIKAATIOT , ANNOSTELU JA HALLINNOINTI ja Kliiniset tutkimukset ].
Rutto
Levofloksasiini on tarkoitettu 6 kuukauden ikäisille ja sitä vanhemmille lapsipotilaille ruton hoitoon, mukaan lukien Yersinia pestis (Y. pestis) -bakteerin aiheuttama keuhkokuume ja septiseeminen rutto, sekä ruton ehkäisyyn. LEVAQUIN®:n tehokkuustutkimuksia ei voitu suorittaa ihmisillä, joilla on keuhkokuume eettisistä ja toteutettavuussyistä. Siksi tämän käyttöaiheen hyväksyminen perustui eläimillä tehtyyn tehokkuustutkimukseen. Riski-hyötyarviointi osoittaa, että levofloksasiinin antaminen lapsipotilaille on asianmukaista [katso INDIKAATIOT , ANNOSTELU JA HALLINNOINTI ja Kliiniset tutkimukset ].
LEVAQUIN®in turvallisuutta ja tehokkuutta alle kuuden kuukauden ikäisillä lapsipotilailla ei ole osoitettu.
Farmakokinetiikka suonensisäisen annon jälkeen
Levofloksasiinin farmakokinetiikkaa suonensisäisen kerta-annoksen jälkeen tutkittiin lapsipotilailla, joiden ikä vaihteli kuudesta kuukaudesta 16 vuoteen. Lapsipotilaat puhdistuivat levofloksasiinista nopeammin kuin aikuispotilaat, mikä johti pienempään plasma-altistukseen kuin aikuisilla tietyllä mg/kg annoksella [ks. KLIININEN FARMAKOLOGIA ja Kliiniset tutkimukset ].
Annostus lapsipotilaille, joilla on inhaloitava pernarutto tai rutto
Katso suositeltu LEVAQUIN®-tablettiannos lapsipotilaille, joilla on inhaloitava pernarutto tai rutto. ANNOSTELU JA HALLINNOINTI . LEVAQUIN®-tabletteja ei voida antaa alle 30 kg painaville lapsipotilaille saatavilla olevien vahvuuksien rajoitusten vuoksi. Vaihtoehtoisia levofloksasiinin formulaatioita voidaan harkita alle 30 kg painaville lapsipotilaille.
Haittavaikutukset
Kliinisissä tutkimuksissa 1534 lapsipotilasta (iältään 6 kuukaudesta 16 vuoteen) hoidettiin suun kautta ja laskimoon annettavalla LEVAQUIN®-valmisteella. 6 kuukauden–5-vuotiaat lapsipotilaat saivat LEVAQUINia 10 mg/kg kahdesti päivässä ja yli 5-vuotiaat lapsipotilaat 10 mg/kg kerran päivässä (enintään 500 mg päivässä) noin 10 päivän ajan. LEVAQUIN®-tabletteja voidaan antaa vain lapsipotilaille, joilla on inhaloitava pernarutto (altistuksen jälkeen) tai rutto ja jotka painavat 30 kg tai enemmän saatavilla olevien vahvuuksien rajoitusten vuoksi [ks. ANNOSTELU JA HALLINNOINTI ].
Osa lapsipotilaista kliinisissä tutkimuksissa (1340 LEVAQUIN®-hoitoa ja 893 ei fluorokinolonilla hoidettua) osallistui prospektiiviseen, pitkäaikaiseen seurantatutkimukseen, jossa arvioitiin tutkimussuunnitelman mukaisten tuki- ja liikuntaelinten sairauksien (nivelkipu, niveltulehdus, tendinopatia, kulkuhäiriöt) ilmaantuvuus. ) 60 päivän ja 1 vuoden ajan ensimmäisen tutkimuslääkkeen annoksen jälkeen. LEVAQUIN®-hoitoa saaneilla lapsipotilailla oli merkittävästi suurempi tuki- ja liikuntaelinsairauksien ilmaantuvuus verrattuna ei-fluorokinolonilla hoidettuihin lapsiin, kuten taulukossa 7 on kuvattu. LEVAQUIN®-tabletteja voidaan antaa vain lapsipotilaille, joilla on inhaloitava pernarutto (altistuksen jälkeen) tai rutto. jotka painavat 30 kg tai enemmän saatavilla olevien vahvuuksien rajoitusten vuoksi [ks ANNOSTELU JA HALLINNOINTI ].
Nivelkipu oli useimmin esiintynyt tuki- ja liikuntaelinhäiriö molemmissa hoitoryhmissä. Suurin osa tuki- ja liikuntaelinsairauksista molemmissa ryhmissä koski useita painoa kantavia niveliä. Häiriöt olivat keskivaikeita 8/46 (17 %) lapsella ja lieviä 35/46 (76 %) LEVAQUIN®-hoitoa saaneella lapsipotilaalla, ja useimpia hoidettiin kipulääkkeillä. Mediaaniaika paranemiseen oli 7 päivää LEVAQUIN®-hoitoa saaneilla lapsipotilailla ja 9 päivää ei-fluorokinolonilla hoidetuilla lapsilla (noin 80 % parantui 2 kuukauden sisällä molemmissa ryhmissä). Yhdelläkään lapsipotilaalla ei ollut vakavaa tai vakavaa sairautta, ja kaikki tuki- ja liikuntaelinten sairaudet paranivat ilman jälkiseurauksia.
Oksentelu ja ripuli olivat yleisimmin raportoituja haittavaikutuksia, joita esiintyi yhtä usein LEVAQUIN®-hoitoa saaneilla ja ei-fluorokinoloneilla hoidetuilla lapsipotilailla.
Lapsipotilailla kliinisissä tutkimuksissa raportoitujen haittavaikutusten lisäksi aikuisilla kliinisissä tutkimuksissa tai markkinoille tulon jälkeen raportoidut haittavaikutukset [ks. HAITTAVAIKUTUKSET ] voidaan odottaa esiintyvän myös lapsipotilailla.
Geriatrinen käyttö
Fluorokinolonilla, kuten LEVAQUIN®-hoidolla, vanhemmilla potilailla on lisääntynyt riski saada vakavia jännehäiriöitä, mukaan lukien jänteen repeämä. Tämä riski kasvaa entisestään potilailla, jotka saavat samanaikaista kortikosteroidihoitoa. Jännetulehdus tai jänteen repeämä voi koskea akilles-, käsi-, olka- tai muita jännekohtia, ja niitä voi esiintyä hoidon aikana tai sen jälkeen; Useita kuukausia fluorokinolonihoidon jälkeen esiintyviä tapauksia on raportoitu. Varovaisuutta tulee noudattaa määrättäessä LEVAQUIN®-valmistetta iäkkäille potilaille, erityisesti niille, jotka käyttävät kortikosteroideja. Potilaille on kerrottava tästä mahdollisesta sivuvaikutuksesta ja heitä on neuvottava lopettamaan LEVAQUIN®-hoito ja ottamaan yhteyttä terveydenhuollon tarjoajaan, jos ilmenee jännetulehduksen tai jänteen repeämän oireita [ks. LAATIKKO VAROITUS ; VAROITUKSET JA VAROTOIMET ; ja HAITTAVAIKUTUKSET ].
Vaiheen 3 kliinisissä tutkimuksissa 1 945 LEVAQUIN®-hoitoa saanutta potilasta (26 %) oli ≥ 65-vuotiaita. Näistä 1 081 potilasta (14 %) oli iältään 65–74-vuotiaita ja 864 potilasta (12 %) oli 75-vuotiaita tai vanhempia. Yleisiä eroja turvallisuudessa tai tehokkuudessa ei havaittu näiden ja nuorempien koehenkilöiden välillä, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
LEVAQUIN®in markkinoille tulon jälkeen on raportoitu vakavia ja joskus kuolemaan johtaneita maksatoksisuustapauksia. Suurin osa kuolemaan johtaneista maksatoksisuusilmoituksista tapahtui 65-vuotiailla tai sitä vanhemmilla potilailla, eikä useimpiin niistä liittynyt yliherkkyyttä. LEVAQUIN®-hoito tulee lopettaa välittömästi, jos potilaalle kehittyy hepatiitin merkkejä ja oireita [ks. VAROITUKSET JA VAROTOIMET ].
Iäkkäät potilaat voivat olla herkempiä lääkkeisiin liittyville vaikutuksille QT-väliin. Siksi varovaisuutta tulee noudattaa käytettäessä LEVAQUIN®-valmistetta samanaikaisesti lääkkeiden kanssa, jotka voivat johtaa QT-ajan pidentymiseen (esim. luokan IA tai luokan III rytmihäiriölääkkeet) tai potilailla, joilla on torsade de pointesin riskitekijöitä (esim. tunnettu QT-ajan pidentyminen, korjaamaton). hypokalemia) [katso VAROITUKSET JA VAROTOIMET ].
Levofloksasiinin farmakokineettiset ominaisuudet nuoremmilla aikuisilla ja iäkkäillä aikuisilla eivät eroa merkittävästi, kun kreatiniinipuhdistuma otetaan huomioon. Koska lääkkeen tiedetään kuitenkin erittyvän olennaisesti munuaisten kautta, tämän lääkkeen toksisten reaktioiden riski voi olla suurempi potilailla, joilla on heikentynyt munuaisten toiminta. Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, annoksen valinnassa on oltava varovainen, ja munuaisten toiminnan seuranta voi olla hyödyllistä [ks. KLIININEN FARMAKOLOGIA ].
Munuaisten vajaatoiminta
Levofloksasiinin puhdistuma pienenee huomattavasti ja eliminaation puoliintumisaika plasmassa on huomattavasti pidentynyt potilailla, joilla on munuaisten vajaatoiminta (kreatiniinipuhdistuma ANNOSTELU JA HALLINNOINTI ].
Maksan vajaatoiminta
Farmakokineettisiä tutkimuksia potilailla, joilla on maksan vajaatoiminta, ei ole tehty. Koska levofloksasiinin metabolia on rajoitettu, maksan vajaatoiminnan ei odoteta vaikuttavan levofloksasiinin farmakokinetiikkaan.
YLIANNOSTUS
Akuutin yliannostuksen sattuessa mahalaukku on tyhjennettävä. Potilasta on tarkkailtava ja asianmukaista nesteytystä on ylläpidettävä. Levofloksasiini ei poistu tehokkaasti hemodialyysillä tai peritoneaalidialyysillä.
LEVAQUIN®:lla on alhainen akuutin toksisuuden mahdollisuus. Hiirillä, rotilla, koirilla ja apinoilla ilmeni seuraavat kliiniset oireet saatuaan yhden suuren LEVAQUIN®-annoksen: ataksia, ptoosi, alentunut liikuntaaktiivisuus, hengenahdistus, uupumus, vapina ja kouristukset. Annokset, jotka ylittivät 1500 mg/kg suun kautta ja 250 mg/kg IV, aiheuttivat merkittävää kuolleisuutta jyrsijöille.
VASTA-AIHEET
LEVAQUIN® on vasta-aiheinen henkilöille, joiden tiedetään olevan yliherkkiä levofloksasiinille tai muille kinolonin antibakteerisille aineille [ks. VAROITUKSET JA VAROTOIMET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Levofloksasiini kuuluu fluorokinolonien antibakteeristen aineiden ryhmään [ katso mikrobiologia ].
Farmakokinetiikka
Taulukossa 8 on yhteenveto levofloksasiinin farmakokineettisten parametrien keskiarvo ± SD yksittäisissä ja vakaan tilan olosuhteissa oraalisten tablettien antamisen jälkeen.
Levofloksasiinin farmakokinetiikka on lineaarinen ja ennustettavissa kerta- ja toistuvan oraalisen tai laskimonsisäisen annostelun jälkeen. Vakaan tilan olosuhteet saavutetaan 48 tunnin kuluessa 500 mg:n tai 750 mg:n kerran vuorokaudessa tapahtuvasta annostelusta. Keskimääräiset ± SD huippu- ja alimmat plasmapitoisuudet, jotka saavutettiin useiden kerran vuorokaudessa otettavien oraalisten annosten jälkeen, olivat noin 5,7 ± 1,4 ja 0,5 ± 0,2 mcg/ml 500 mg:n annosten jälkeen ja 8,6 ± 1,9 ja 1,1 ± 0,0 0,4 mc annoksen jälkeen. mg annoksia. Keskimääräiset ± SD huippu- ja alimmat plasmapitoisuudet, jotka saavutettiin useiden kerran päivässä annettavien laskimonsisäisten annosten jälkeen, olivat noin 6,4 ± 0,8 ja 0,6 ± 0,2 mcg/ml 500 mg:n annosten jälkeen ja 12,1 ± 4,1 ja 1,3 ± 0,71 mg 7 mc/5 mc:n jälkeen. annokset, vastaavasti.
Imeytyminen
Levofloksasiini imeytyy nopeasti ja olennaisesti täydellisesti suun kautta annetun annon jälkeen. Plasman huippupitoisuudet saavutetaan yleensä yhdestä kahteen tuntia suun kautta otetun annoksen jälkeen. Levofloksasiinin absoluuttinen biologinen hyötyosuus 500 mg:n tabletista ja 750 mg:n LEVAQUIN®-tabletista on molemmat noin 99 %, mikä osoittaa levofloksasiinin täydellisen oraalisen imeytymisen. Kun LEVAQUIN®-valmistetta annettiin kerta-annoksena suonensisäisesti terveille vapaaehtoisille, saavutettu keskimääräinen ± SD huippupitoisuus plasmassa oli 6,2 ± 1,0 mcg/ml 500 mg:n annoksen jälkeen 60 minuutin aikana ja 11,5 ± 4,0 mcg/ml 750 mg:n annoksen jälkeen. 90 minuuttia. 500 mg:n LEVAQUIN®-annoksen oraalinen antaminen ruoan kanssa pidentää huippupitoisuuden saavuttamiseen kuluvaa aikaa noin 1 tunnilla ja pienentää huippupitoisuutta noin 14 % tabletin ottamisen jälkeen ja noin 25 % oraalisen liuoksen antamisen jälkeen. Siksi LEVAQUIN®-tabletit voidaan ottaa ruokailusta riippumatta.
Levofloksasiinin plasmapitoisuusprofiili laskimonsisäisen annon jälkeen on samanlainen ja altistuksen laajuudeltaan (AUC) verrattavissa LEVAQUIN®-tableteilla havaittuun vastaavaan, kun annetaan yhtä suuret annokset (mg/mg). Siksi oraalista ja IV-antotapaa voidaan pitää keskenään vaihdettavissa olevina.
Jakelu
Levofloksasiinin keskimääräinen jakautumistilavuus on yleensä 74-112 litraa kerta- ja toistuvien 500 mg:n tai 750 mg:n annosten jälkeen, mikä viittaa laajaan jakautumiseen kehon kudoksiin. Levofloksasiini saavuttaa huippupitoisuutensa terveiden koehenkilöiden ihokudoksissa ja rakkulanesteessä noin 3 tunnin kuluttua annostelusta. Ihokudoksen biopsian ja plasman AUC-suhde on noin 2 ja rakkulan nesteen ja plasman AUC-suhde on noin 1 sen jälkeen, kun terveille koehenkilöille on annettu LEVAQUIN® 750 mg:n ja 500 mg:n suun kautta useita kertoja päivässä. Levofloksasiini tunkeutuu myös hyvin keuhkoihin. Keuhkokudospitoisuudet olivat yleensä 2–5 kertaa korkeammat kuin plasmapitoisuudet ja vaihtelivat noin 2,4–11,3 mikrog/g 24 tunnin aikana kerta-annoksen 500 mg suun kautta.
In vitro, kliinisesti merkittävällä seerumin/plasman levofloksasiinipitoisuuksien alueella (1-10 mcg/ml) levofloksasiini sitoutuu noin 24-38 % seerumin proteiineihin kaikissa tutkituissa lajeissa tasapainodialyysimenetelmällä määritettynä. Levofloksasiini sitoutuu ihmisillä pääasiassa seerumin albumiiniin. Levofloksasiinin sitoutuminen seerumin proteiineihin on riippumaton lääkeainepitoisuudesta.
Eliminointi
Aineenvaihdunta
Levofloksasiini on stereokemiallisesti stabiili plasmassa ja virtsassa, eikä se muutu metabolisesti enantiomeerikseen, D-ofloksasiiniksi. Levofloksasiini metaboloituu rajoitetusti ihmisellä ja se erittyy pääasiassa muuttumattomana lääkkeenä virtsaan. Suun kautta annetun annon jälkeen noin 87 % annetusta annoksesta erittyi muuttumattomana lääkkeenä virtsaan 48 tunnin kuluessa, kun taas alle 4 % annoksesta erittyi ulosteeseen 72 tunnissa. Alle 5 % annetusta annoksesta erittyi virtsaan desmetyyli- ja N-oksidimetaboliitteina, jotka ovat ainoita ihmisillä tunnistettuja metaboliitteja. Näillä metaboliiteilla on vähän merkityksellistä farmakologista aktiivisuutta.
Erittyminen
Levofloksasiini erittyy suurelta osin muuttumattomana lääkkeenä virtsaan. Levofloksasiinin keskimääräinen terminaalinen eliminaation puoliintumisaika plasmassa on noin 6-8 tuntia oraalisesti tai suonensisäisesti annetun kerta- tai toistuvan levofloksasiiniannoksen jälkeen. Keskimääräinen näennäinen kokonaispuhdistuma on noin 144-226 ml/min ja munuaispuhdistuma 96-142 ml/min. Munuaispuhdistuma, joka ylittää munuaiskerästen suodatusnopeuden, viittaa siihen, että levofloksasiinin eritystä tubulaarista tapahtuu sen glomerulussuodatuksen lisäksi. Joko simetidiinin tai probenesidin samanaikainen anto vähentää levofloksasiinin munuaispuhdistumaa noin 24 % ja probenesidiä 35 %, mikä viittaa siihen, että levofloksasiinin eritystä tapahtuu munuaisten proksimaalisissa tiehyissä. Levofloksasiinikiteitä ei löytynyt mistään virtsanäytteistä, jotka oli juuri kerätty LEVAQUIN®-hoitoa saaneilta henkilöiltä.
Tietyt populaatiot
Geriatriset potilaat
Levofloksasiinin farmakokinetiikassa ei ole merkittäviä eroja nuorten ja iäkkäiden koehenkilöiden välillä, kun koehenkilöt' erot kreatiniinipuhdistumassa otetaan huomioon. Kun LEVAQUIN®-valmistetta annettiin 500 mg:n suun kautta terveille iäkkäille henkilöille (66–80-vuotiaat), levofloksasiinin keskimääräinen terminaalinen eliminaation puoliintumisaika plasmassa oli noin 7,6 tuntia verrattuna noin 6 tuntiin nuoremmilla aikuisilla. Ero johtui koehenkilöiden munuaistoiminnan tilan vaihtelusta, eikä sen uskottu olevan kliinisesti merkitsevä. Ikä ei näytä vaikuttavan lääkkeiden imeytymiseen. LEVAQUIN®-annoksen muuttaminen pelkästään iän perusteella ei ole tarpeen [katso Käyttö tietyissä populaatioissa ].
Pediatriset potilaat
Levofloksasiinin farmakokinetiikkaa suonensisäisen 7 mg/kg kerta-annoksen jälkeen tutkittiin lapsipotilailla, joiden ikä vaihteli 6 kuukauden ja 16 vuoden välillä. Lapsipotilaat puhdistuivat levofloksasiinista nopeammin kuin aikuispotilaat, mikä johti pienempään plasma-altistukseen kuin aikuisilla tietyllä mg/kg annoksella. Myöhemmät farmakokineettiset analyysit ennustivat, että annostusohjelmalla 8 mg/kg joka 12. tunti (ei yli 250 mg annosta kohti) 6 kuukauden–17-vuotiaille lapsipotilaille saavutettaisiin vastaavat vakaan tilan plasma-altistukset (AUC0-24 ja Cmax) aikuispotilailla, joille annettiin 500 mg levofloksasiinia kerran 24 tunnin välein. LEVAQUIN®-tabletteja voidaan antaa vain lapsipotilaille, joilla on inhaloitava pernarutto (altistuksen jälkeen) tai rutto ja jotka painavat 30 kg tai enemmän saatavilla olevien vahvuuksien rajoitusten vuoksi [ks. ANNOSTELU JA HALLINNOINTI ].
Mies- ja naiskohteet
Levofloksasiinin farmakokinetiikassa ei ole merkittäviä eroja miesten ja naisten välillä, kun koehenkilöt' erot kreatiniinipuhdistumassa otetaan huomioon. Kun LEVAQUIN®-valmistetta annettiin 500 mg:n suun kautta terveille mieshenkilöille, levofloksasiinin keskimääräinen terminaalinen eliminaation puoliintumisaika plasmassa oli noin 7,5 tuntia verrattuna noin 6,1 tuntiin naishenkilöillä. Tämä ero johtui miesten ja naisten munuaistoiminnan tilan vaihtelusta, eikä sen uskottu olevan kliinisesti merkitsevä. Tutkittavien sukupuoli ei näytä vaikuttavan lääkkeiden imeytymiseen. Annosta ei tarvitse muuttaa pelkästään sukupuolen perusteella.
Rotu- tai etniset ryhmät
Rodun vaikutusta levofloksasiinin farmakokinetiikkaan tutkittiin kovariaattianalyysillä, joka suoritettiin 72 henkilön tiedoilla: 48 valkoista ja 24 ei-valkoista. Koehenkilöiden rotu ei vaikuttanut näennäiseen kokonaispuhdistumaan ja näennäiseen jakautumistilavuuteen.
Potilaat, joilla on munuaisten vajaatoiminta
Levofloksasiinin puhdistuma pienenee huomattavasti ja eliminaation puoliintumisaika plasmassa on huomattavasti pidentynyt aikuispotilailla, joilla on heikentynyt munuaisten toiminta (kreatiniinipuhdistuma ANNOSTELU JA HALLINNOINTI ja Käyttö tietyissä populaatioissa ].
Potilaat, joilla on maksan vajaatoiminta
Farmakokineettisiä tutkimuksia potilailla, joilla on maksan vajaatoiminta, ei ole tehty. Koska levofloksasiinin metabolia on rajoitettu, maksan vajaatoiminnan ei odoteta vaikuttavan levofloksasiinin farmakokinetiikkaan [ks. Käyttö tietyissä populaatioissa ].
Potilaat, joilla on bakteeri-infektio
Levofloksasiinin farmakokinetiikka potilailla, joilla on vakavia yhteisössä hankittuja bakteeri-infektioita, on verrattavissa terveillä koehenkilöillä havaittuun.
Huumeiden vuorovaikutustutkimukset
LEVAQUIN®:n ja antasidien, varfariinin, teofylliinin, syklosporiinin, digoksiinin, probenesidin ja simetidiinin välisten farmakokineettisten yhteisvaikutusten mahdollisuus on arvioitu [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Mikrobiologia
Toimintamekanismi
Levofloksasiini on rasemaatin, ofloksasiinin, kinolonien antimikrobisen aineen, L-isomeeri. Ofloksasiinin antibakteerinen vaikutus perustuu ensisijaisesti L-isomeeriin. Levofloksasiinin ja muiden fluorokinolonien mikrobilääkkeiden vaikutusmekanismiin kuuluu bakteerien topoisomeraasi IV:n ja DNA-gyraasin (molemmat ovat tyypin II topoisomeraaseja), DNA:n replikaatioon, transkriptioon, korjaamiseen ja rekombinaatioon tarvittavien entsyymien esto.
Resistanssi
Fluorokinoloniresistenssi voi syntyä mutaatioista DNA-gyraasin tai topoisomeraasi IV:n määritellyillä alueilla, joita kutsutaan kinoloniresistenssiä määrittäviksi alueiksi (QRDR), tai muuttuneen ulosvirtauksen kautta.
Fluorokinolonit, mukaan lukien levofloksasiini, eroavat kemialliselta rakenteeltaan ja vaikutukseltaan aminoglykosideista, makrolideista ja β-laktaamiantibiooteista, mukaan lukien penisilliineistä. Fluorokinolonit voivat siksi olla aktiivisia näille mikrobilääkkeille resistenttejä bakteereja vastaan.
Resistenssi levofloksasiinille, joka johtuu spontaanista mutaatiosta in vitro, on harvinainen tapaus (vaihteluväli: 10-9-10-10). Levofloksasiinin ja joidenkin muiden fluorokinolonien välillä on havaittu ristiresistenssiä, ja jotkut mikro-organismit, jotka ovat resistenttejä muille fluorokinoloneille, voivat olla herkkiä levofloksasiinille.
Antimikrobinen aktiivisuus
Levofloksasiinilla on in vitro aktiivisuutta gramnegatiivisia ja grampositiivisia bakteereja vastaan.
Levofloksasiinin on osoitettu olevan aktiivinen useimpia seuraavien bakteerien isolaatteja vastaan sekä in vitro että kliinisissä infektioissa, kuten ks. INDIKAATIOT :
Aerobiset bakteerit
Gram-positiiviset bakteerit
Enterococcus faecalisStaphylococcus aureus (metisilliinille herkät isolaatit) Staphylococcus epidermidis (metisilliinille herkät isolaatit) Staphylococcus saprophyticus Streptococcus pneumoniae (mukaan lukien useille lääkkeille resistentit isolaatit [MDRSP]1)Streptogeenit
Gram-negatiiviset bakteerit
Enterobacter cloacae Escherichia coliHaemophilus influenzaeHaemophilus parainfluenzaeKlebsiella pneumoniaeLegionella pneumophilaMoraxella catarrhalisProteus mirabilis Pseudomonas aeruginosa Serratia marcescens
Muut mikro-organismit
Chlamydophila pneumoniae Mycoplasma pneumoniae
Seuraavat in vitro -tiedot ovat saatavilla, mutta niiden kliinistä merkitystä ei tunneta: Levofloksasiinin in vitro -inhibiittoreiden vähimmäispitoisuudet (MIC-arvot) ovat 2 mcg/ml tai vähemmän useimpia (≥90 %) seuraavien mikro-organismien isolaatteja vastaan; LEVAQUIN®:n turvallisuutta ja tehokkuutta näiden bakteerien aiheuttamien kliinisten infektioiden hoidossa ei kuitenkaan ole osoitettu riittävissä ja hyvin kontrolloiduissa kliinisissä tutkimuksissa.
MDRSP (Multi Drug Resistents Streptococcus pneumoniae) -isolaatit ovat isolaatteja, jotka ovat resistenttejä kahdelle tai useammalle seuraavista antibiooteista: penisilliini (MIC ≥2 mcg/ml), 2. sukupolven kefalosporiinit, esim. kefuroksiimi; makrolidit, tetrasykliinit ja trimetopriimi/sulfametoksatsoli.
Aerobiset bakteerit
Gram-positiiviset bakteerit
Staphylococcus haemolyticusβ-hemolyyttinen streptokokki (ryhmä C/F) β-hemolyyttinen streptokokki (ryhmä G) Streptococcus agalactiaeStreptococcus milleriViridaaniryhmä streptokokitBacillus anthracis
Gram-negatiiviset bakteerit
Acinetobacter baumanniiAcinetobacter lwoffiiBordetella pertussisCitrobacter koseriCitrobacter freundiiEnterobacter aerogenesEnterobacter sakazakiiKlebsiella oxytocaMorganella morganiiPantoea agglomerans Proteus videncia vulgarit Proteus videncia vulgarit
Anaerobiset bakteerit
Gram-positiiviset bakteerit
Clostridium perfringens
Herkkyystestit
Katso tarkkoja tietoja herkkyystestin tulkintakriteereistä ja niihin liittyvistä testimenetelmistä sekä FDA:n tälle lääkkeelle tunnustamista laadunvalvontastandardeista: https://www.fda.gov/STIC.
Eläinten toksikologia ja/tai farmakologia
Levofloksasiinin ja muiden kinolonien on osoitettu aiheuttavan artropatiaa useimpien testattujen lajien epäkypsillä eläimillä [ks. VAROITUKSET JA VAROTOIMET ]. Epäkypsillä koirilla (4–5 kuukauden ikäiset) levofloksasiinin oraaliset annokset 10 mg/kg/vrk 7 päivän ajan ja suonensisäiset annokset 4 mg/kg/vrk 14 päivän ajan aiheuttivat artropaattisia leesioita. Annostelu oraalisilla annoksilla 300 mg/kg/vrk 7 päivän ajan ja suonensisäinen annos 60 mg/kg/vrk 4 viikon ajan aiheutti artropatiaa nuorilla rotilla. Kolmen kuukauden ikäisillä beagle-koirilla, joille annosteltiin levofloksasiinia 40 mg/kg/vrk, esiintyi kliinisesti vakavaa artrotoksisuutta, mikä johti 14 päivän annostusrutiinin 8. päivänä. Lievät tuki- ja liikuntaelimiin liittyvät kliiniset vaikutukset, ilman vakavia patologisia tai histopatologisia vaikutuksia, johtuivat alimmasta annostasosta 2,5 mg/kg/vrk (noin 0,2-kertainen lasten annokseen AUC-vertailujen perusteella). Niveltulehdus ja nivelrustovaurioita havaittiin annostasoilla 10 ja 40 mg/kg (noin 0,7-kertainen ja 2,4-kertainen lapsiannokseen verrattuna AUC-vertailujen perusteella). Nivelruston yleispatologia ja histopatologia säilyivät 18 viikon toipumisjakson loppuun asti näillä koirilla 10 ja 40 mg/kg/vrk annostasoilla.
Testattaessa hiiren korvan turvotuksen biotestissä levofloksasiini osoitti suuruudeltaan samanlaista fototoksisuutta kuin ofloksasiinilla, mutta vähemmän fototoksisuutta kuin muilla kinoloneilla.
Vaikka kristalluriaa on havaittu joissakin suonensisäisissä rotilla tehdyissä tutkimuksissa, virtsan kiteitä ei muodostu virtsarakkoon, vaan niitä esiintyy vasta virtsaamisen jälkeen, eikä niihin liity munuaistoksisuutta.
Hiirillä kinolonien keskushermostoa stimuloiva vaikutus voimistuu, kun ei-steroidisia tulehduskipulääkkeitä annetaan samanaikaisesti.
Koirilla levofloksasiinia 6 mg/kg tai enemmän annettiin nopeana suonensisäisenä injektiona, mikä aiheutti verenpainetta alentavaa vaikutusta. Näiden vaikutusten katsottiin liittyvän histamiinin vapautumiseen.
Eläimillä tehdyt in vitro- ja in vivo -tutkimukset osoittavat, että levofloksasiini ei ole entsyymien indusoija eikä estäjä ihmisen terapeuttisella plasmapitoisuudella. siksi ei odoteta lääkkeitä metaboloivien entsyymien aiheuttamia yhteisvaikutuksia muiden lääkkeiden tai aineiden kanssa.
Kliiniset tutkimukset
Nosokomiaalinen keuhkokuume
Aikuiset potilaat, joilla oli kliinisesti ja radiologisesti dokumentoitu nosokomiaalinen keuhkokuume, otettiin mukaan monikeskustutkimukseen, satunnaistettuun, avoimeen tutkimukseen, jossa verrattiin suonensisäistä LEVAQUIN®ia (750 mg kerran vuorokaudessa) ja sen jälkeen suun kautta annettua LEVAQUIN®ia (750 mg kerran vuorokaudessa) yhteensä 7–15 päivän ajan. suonensisäiseen imipeneemiin/silastatiiniin (500–1000 mg 6–8 tunnin välein päivittäin), minkä jälkeen oraalinen siprofloksasiini (750 mg 12 tunnin välein päivittäin) yhteensä 7–15 päivän ajan. LEVAQUIN®-hoitoa saaneet potilaat saivat keskimäärin 7 päivää suonensisäistä hoitoa (vaihteluväli: 1–16 päivää); vertailuvalmisteella hoidetut potilaat saivat keskimäärin 8 päivää suonensisäistä hoitoa (vaihteluväli: 1–19 päivää).
Kaiken kaikkiaan kliinisesti ja mikrobiologisesti arvioitavassa populaatiossa lisähoito aloitettiin empiirisesti tutkimuksen alkaessa 56:lla 93:sta (60,2 %) potilaasta LEVAQUIN®-haarassa ja 53:lla 94:stä (56,4 %) vertailuryhmässä. Keskimääräinen lisähoidon kesto oli 7 päivää LEVAQUIN®-haarassa ja 7 päivää vertailuryhmässä. Kliinisesti ja mikrobiologisesti arvioitavissa olevista potilaista, joilla oli dokumentoitu Pseudomonas aeruginosa -infektio, 15 potilaasta 17:stä (88,2 %) sai keftatsidiimia (N = 11) tai piperasilliini/tatsobaktaamia (N = 4) LEVAQUIN®-haarassa ja 16 potilasta 17:stä (94,1 %). aminoglykosidi vertailuhaarassa. Kaiken kaikkiaan kliinisesti ja mikrobiologisesti arvioitavissa olevilla potilailla vankomysiini lisättiin hoito-ohjelmaan 37 potilaalla 93:sta (39,8 %) LEVAQUIN®-haarassa ja 28 potilaasta 94:stä (29,8 %) vertailuryhmässä epäiltyjen metisilliiniresistenttien S. aureus -infektio.
Kliinisesti ja mikrobiologisesti arvioitavissa olevien potilaiden kliininen onnistumisprosentti hoidon jälkeisellä käynnillä (ensisijainen tutkimuksen päätetapahtuma arvioitiin päivänä 3–15 hoidon päättymisen jälkeen) oli 58,1 % LEVAQUIN®:lla ja 60,6 % vertailuvalmisteella. 95 %:n luottamusväli vasteen erolle (LEVAQUIN® miinus vertailuaine) oli [-17,2, 12,0]. Mikrobiologiset hävitysasteet hoidon jälkeisellä käynnillä olivat 66,7 % LEVAQUIN®:lla ja 60,6 % vertailuvalmisteella. Hävitysasteiden eron 95 % luottamusväli (LEVAQUIN® miinus vertailuaine) oli [-8,3, 20,3]. Taulukossa 9 on kuvattu kliininen menestys ja mikrobiologiset hävittämisluvut taudinaiheuttajittain.
Yhteisön hankkima keuhkokuume
7–14 päivän hoito-ohjelma
Aikuisia laitospotilaita ja avohoitopotilaita, joilla on diagnosoitu yhteisössä hankittu bakteerikeuhkokuume, arvioitiin kahdessa keskeisessä kliinisessä tutkimuksessa. Ensimmäisessä tutkimuksessa 590 potilasta otettiin mukaan prospektiiviseen, monikeskukseen, sokkoutumattomaan satunnaistettuun tutkimukseen, jossa verrattiin LEVAQUIN® 500 mg kerran vuorokaudessa suun kautta tai suonensisäisesti 7-14 päivän ajan keftriaksoniin 1-2 grammaa suonensisäisesti kerran tai tasa-annoksina kahdesti päivässä. sen jälkeen 500 mg kefuroksiimiaksetiilia suun kautta kahdesti vuorokaudessa yhteensä 7–14 päivän ajan. Potilaat, jotka saivat kontrollihoitoa, saivat saada erytromysiiniä (tai doksisykliiniä, jos he eivät siedä erytromysiiniä), jos epäiltiin tai todettiin epätyypillisistä taudinaiheuttajista johtuva infektio. Kliiniset ja mikrobiologiset arvioinnit suoritettiin hoidon aikana, 5-7 päivää hoidon jälkeen ja 3-4 viikkoa hoidon jälkeen. Kliininen menestys (parannus ja parantuminen) LEVAQUIN®:lla 5-7 päivää hoidon jälkeen, joka on ensisijainen tehokkuusmuuttuja tässä tutkimuksessa, oli parempi (95 %) kuin kontrolliryhmä (83 %). 95 %:n luottamusväli vasteen erolle (LEVAQUIN® miinus vertailuaine) oli [-6, 19]. Toisessa tutkimuksessa 264 potilasta otettiin mukaan prospektiiviseen, monikeskus-, ei-vertailevaan tutkimukseen, jossa 500 mg LEVAQUIN®ia annettiin suun kautta tai suonensisäisesti kerran päivässä 7–14 päivän ajan. Kliinisesti arvioitavilla potilailla kliininen menestys oli 93 %. Molemmissa tutkimuksissa kliininen onnistumisaste potilailla, joilla oli Chlamydophila pneumoniaen aiheuttama epätyypillinen keuhkokuume, Mycoplasma pneumoniae ja Legionella pneumophila oli 96 %, 96 % ja 70 %. Mikrobiologiset hävittämisluvut molemmissa tutkimuksissa on esitetty taulukossa 10.
Monelle lääkkeelle vastustuskykyisen Streptococcus Pneumoniaen aiheuttama yhteisön hankkima keuhkokuume
LEVAQUIN® oli tehokas monilääkeresistenssin Streptococcus pneumoniaen (MDRSP) aiheuttaman yhteisössä hankitun keuhkokuumeen hoidossa. MDRSP-isolaatit ovat isolaatteja, jotka ovat resistenttejä kahdelle tai useammalle seuraavista antibakteerisista aineista: penisilliini (MIC ≥2 mcg/ml), 2. sukupolven kefalosporiinit (esim. kefuroksiimi, makrolidit, tetrasykliinit ja trimetopriimi/sulfametoksatsoli). 40 mikrobiologisesti arvioitavasta potilaasta, joilla oli MDRSP-isolaatteja, 38 potilasta (95,0 %) saavutti kliinisen ja bakteriologisen menestyksen hoidon jälkeen. Kliiniset ja bakteeriperäiset onnistumisprosentit on esitetty taulukossa 11.
Kaikki isolaatit eivät olleet resistenttejä kaikille testatuille mikrobilääkkeille. Onnistuminen ja hävittämisasteet on esitetty taulukossa 12.
Yhteisön hankkima keuhkokuume
5 päivän hoito-ohjelma
Suuremman annoksen ja lyhyemmän LEVAQUIN®-hoidon turvallisuuden ja tehon arvioimiseksi 528 avohoidossa olevaa ja sairaalahoidossa olevaa aikuista, joilla oli kliinisesti ja radiologisesti määritetty lievä tai vaikea yhteisöstä hankittu keuhkokuume, arvioitiin kaksoissokkoutetussa, satunnaistetussa, prospektiivisessa monikeskustutkimuksessa, jossa verrattiin LEVAQUINia. ® 750 mg, IV tai suun kautta, joka päivä viiden päivän ajan tai LEVAQUIN® 500 mg IV tai suun kautta joka päivä 10 päivän ajan.
Kliininen onnistumisprosentti (paraneminen ja paraneminen) kliinisesti arvioitavassa populaatiossa oli 90,9 % LEVAQUIN® 750 mg -ryhmässä ja 91,1 % LEVAQUIN® 500 mg -ryhmässä. 95 %:n luottamusväli vasteen erolle (LEVAQUIN® 750 miinus LEVAQUIN® 500) oli [-5,9, 5,4]. Kliinisesti arvioitavassa populaatiossa (31–38 päivää ilmoittautumisen jälkeen) keuhkokuume havaittiin 7:llä 151 potilaasta LEVAQUIN® 750 mg -ryhmässä ja kahdella 147 potilaasta LEVAQUIN® 500 mg -ryhmässä. Kun otetaan huomioon havaitut pienet määrät, tämän havainnon merkitystä ei voida määrittää tilastollisesti. 5 päivän hoito-ohjelman mikrobiologinen tehokkuus dokumentoitiin taulukossa 13 lueteltujen infektioiden osalta.
Akuutti bakteeriperäinen sinuiitti
5 päivän ja 10–14 päivän hoito-ohjelmat
LEVAQUIN® on hyväksytty akuutin bakteeriperäisen poskiontelotulehduksen (ABS) hoitoon käyttämällä joko 750 mg suun kautta × 5 päivää tai 500 mg suun kautta kerran päivässä × 10–14 päivää. Suuren annoksen lyhyen LEVAQUIN®-hoidon turvallisuuden ja tehokkuuden arvioimiseksi 780 avohoidossa olevaa aikuista, joilla oli kliinisesti ja radiologisesti määritetty akuutti bakteeriperäinen poskiontelotulehdus, arvioitiin kaksoissokkoutetussa, satunnaistetussa, prospektiivisessa, monikeskustutkimuksessa, jossa verrattiin LEVAQUIN® 750 mg suun kautta kerran päivässä. viiden päivän ajan LEVAQUIN® 500 mg:aan suun kautta kerran päivässä 10 päivän ajan.
Kliiniset onnistumisprosentit (määritelty ABS:n hoitoa edeltäneiden merkkien ja oireiden täydelliseksi tai osittaiseksi häviämiseksi siinä määrin, että lisäantibioottihoitoa ei katsottu tarpeelliseksi) mikrobiologisesti arvioitavassa populaatiossa oli 91,4 % (139/152) LEVAQUIN®-tutkimuksessa. 750 mg ryhmä ja 88,6 % (132/149) LEVAQUIN® 500 mg ryhmässä parantumistestin (TOC) käynnillä (95 % CI [-4,2, 10,0] LEVAQUIN® 750 mg miinus LEVAQUIN® 500 mg) .
Patogeenin kliinisen onnistumisen prosenttiosuudet mikrobiologisesti arvioitavissa olevassa populaatiossa, jolta näytteet otettiin antrumilla tutkimukseen tullessa, osoittivat vertailukelpoisia tuloksia viiden ja kymmenen päivän hoito-ohjelmissa parantumistestikäynnillä 22 päivää hoidon jälkeen (katso taulukko 14). .
Monimutkaiset iho- ja ihorakenteen infektiot
Kolmesataa yhdeksänkymmentäyhdeksän potilasta otettiin mukaan avoimeen, satunnaistettuun, vertailevaan tutkimukseen monimutkaisten iho- ja ihorakenteen infektioiden osalta. Potilaat satunnaistettiin saamaan joko LEVAQUIN® 750 mg kerran vuorokaudessa (iv ja sen jälkeen suun kautta) tai hyväksyttyä vertailulääkettä keskimäärin 10 ± 4,7 päivän ajan. Kuten on odotettavissa monimutkaisissa iho- ja ihorakenteen infektioissa, kirurgiset toimenpiteet suoritettiin LEVAQUIN®- ja vertailuryhmissä. Leikkaus (viilto ja vedenpoisto tai debridement) suoritettiin 45 %:lle LEVAQUIN®-hoitoa saaneista potilaista ja 44 %:lle vertailuvalmisteella hoidetuista potilaista joko vähän ennen antibioottihoitoa tai sen aikana, ja ne olivat olennainen osa tämän käyttöaiheen hoitoa.
Niiden joukossa, jotka voitiin arvioida kliinisesti 2–5 päivää tutkimuslääkkeen lopettamisen jälkeen, kokonaismenestysprosentti (parantunut tai parantunut) oli 116/138 (84,1 %) LEVAQUIN®-hoitoa saaneilla potilailla ja 106/132 (80,3 %) hoidetuilla potilailla. vertailijan kanssa.
Onnistumisasteet vaihtelivat diagnoosin tyypin mukaan ja vaihtelivat 68 %:sta potilailla, joilla oli infektoituneita haavaumia, 90 %:iin potilailla, joilla oli infektoituneita haavoja ja paiseita. Nämä luvut olivat samat kuin vertailulääkkeillä.
Krooninen bakteerien aiheuttama eturauhastulehdus
Aikuiset potilaat, joilla oli kliininen eturauhastulehduksen diagnoosi ja mikrobiologiset viljelytulokset eturauhasen hieronnan (VB3) jälkeen kerätyistä virtsanäytteistä tai Meares-Stamey-menetelmällä saaduista ekspressoidun eturauhasen erityksen (EPS) näytteistä, otettiin mukaan monikeskustutkimukseen, satunnaistettuun kaksoissokkotutkimukseen, jossa verrattiin. suun kautta otettava LEVAQUIN® 500 mg kerran päivässä yhteensä 28 päivän ajan tai suun kautta otettava siprofloksasiini 500 mg kahdesti päivässä yhteensä 28 päivän ajan. Ensisijainen tehon päätetapahtuma oli mikrobiologinen teho mikrobiologisesti arvioitavilla potilailla. LEVAQUIN®- ja siprofloksasiiniryhmiin otettiin yhteensä 136 ja 125 mikrobiologisesti arvioitavissa olevaa potilasta. Potilaan infektion aiheuttama mikrobiologinen häviämisaste 5–18 päivää hoidon päättymisen jälkeen oli 75,0 % LEVAQUIN®-ryhmässä ja 76,8 % siprofloksasiiniryhmässä (95 % CI [-12,58, 8,98] LEVAQUIN® miinus siprofloksasiini). Kiinnostuksen kohteena olevien patogeenien yleiset hävittämisasteet on esitetty taulukossa 15.
S. epidermidiksen hävittämisnopeudet, kun niitä löydetään muiden rinnakkaispatogeenien kanssa, ovat yhdenmukaisia puhtaissa isolaateissa havaittujen nopeuksien kanssa.
Kliininen menestys (parannus + paraneminen ilman lisäantibioottihoitoa) mikrobiologisesti arvioitavissa olevassa populaatiossa 5–18 päivää hoidon päättymisen jälkeen oli 75,0 % LEVAQUIN®-hoitoa saaneilla potilailla ja 72,8 % siprofloksasiinilla hoidetuilla potilailla (95 % CI [- 8,87, 13,27] LEVAQUIN® miinus siprofloksasiini). Pitkän aikavälin kliininen onnistumisaste (24–45 päivää hoidon päättymisen jälkeen) oli 66,7 % LEVAQUIN®-hoitoa saaneilla potilailla ja 76,9 % siprofloksasiinilla hoidetuilla potilailla (95 % CI [-23,40, 2,89] LEVAQUIN® miinus siprofloksasiini).
Monimutkaiset virtsatieinfektiot ja akuutti pyelonefriitti
5 päivän hoito-ohjelma
Suuremman annoksen ja lyhyemmän LEVAQUIN®-hoidon turvallisuuden ja tehon arvioimiseksi 1109 cUTI- ja AP-potilasta otettiin mukaan satunnaistettuun kaksoissokkoutettuun monikeskustutkimukseen, joka suoritettiin Yhdysvalloissa marraskuusta 2004 huhtikuuhun 2006 ja jossa verrattiin LEVAQUIN® 750:tä. mg IV tai suun kautta kerran päivässä 5 päivän ajan (546 potilasta) siprofloksasiinilla 400 mg IV tai 500 mg suun kautta kahdesti päivässä 10 päivän ajan (563 potilasta). Potilaat, joilla AP oli komplisoitunut taustalla olevista munuaissairauksista tai tiloista, kuten täydellinen tukos, leikkaus, transplantaatio, samanaikainen infektio tai synnynnäinen epämuodostuma, suljettiin pois. Teho mitattiin perustason organismin (organismien) bakteriologisella hävittämisellä hoidon jälkeisellä käynnillä potilailla, joilla oli lähtötilanteessa tunnistettu patogeeni. Hoidon jälkeinen (parantumistesti) -käynti tapahtui 10–14 päivää viimeisen aktiivisen LEVAQUIN®-annoksen jälkeen ja 5–9 päivää viimeisen aktiivisen siprofloksasiiniannoksen jälkeen.
LEVAQUIN®:n ja kontrollin bakteriologiset paranemisasteet test-of-cure (TOC) -käynnillä kaikille potilaille, joilla on dokumentoitu patogeeni lähtötasolla (muunnettu hoitoaikeus tai mITT) ja potilasryhmä mITT-populaatiossa. jotka seurasivat tarkasti protokollaa (mikrobiologisesti arvioitavissa), on yhteenveto taulukossa 16.
Taulukossa 17 on esitetty LEVAQUIN®-hoitoon satunnaistetuilta potilailta toipuneiden yksittäisten patogeenien mikrobiologiset hävitysasteet mikrobiologisesti arvioitavassa populaatiossa TOC:ssa.
Monimutkaiset virtsatieinfektiot ja akuutti pyelonefriitti
10 päivän hoito-ohjelma
Arvioidakseen 250 mg:n annoksen turvallisuutta ja tehoa, 10 päivän LEVAQUIN®-hoito, 567 potilasta, joilla oli komplisoitumaton virtsatietulehdus, lievä tai kohtalainen cUTI ja lievä tai keskivaikea AP, otettiin mukaan satunnaistettuun kaksoissokkoutettuun monikeskustutkimukseen. Yhdysvalloissa kesäkuusta 1993 tammikuuhun 1995 suoritettu kliininen tutkimus, jossa verrattiin LEVAQUIN® 250 mg suun kautta kerran päivässä 10 päivän ajan (285 potilasta) siprofloksasiiniin 500 mg suun kautta kahdesti päivässä 10 päivän ajan (282 potilasta). Potilaat, joilla oli resistentti taudinaiheuttaja, uusiutuva virtsatietulehdus, yli 55-vuotiaat naiset ja kestokatetri, suljettiin alun perin pois ennen protokollan muuttamista, joka tehtiin 30 %:n ilmoittautumisen jälkeen. Mikrobiologinen teho mitattiin perustason organismin (organismien) bakteriologisella hävittämisellä 1–12 päivää hoidon jälkeen potilailla, joilla oli lähtötilanteessa tunnistettu patogeeni.
LEVAQUIN®:n ja kontrollin bakteriologiset paranemisasteet test-of-cure (TOC) -käynnillä kaikille potilaille, joilla on dokumentoitu patogeeni lähtötasolla (muunnettu hoitoaikeus tai mITT) ja potilasryhmä mITT-populaatiossa. jotka seurasivat tarkasti protokollaa (mikrobiologisesti arvioitavissa), on yhteenveto taulukossa 18.
Hengitetty pernarutto (altistuksen jälkeinen)
LEVAQUIN®:n tehokkuus tässä käyttöaiheessa perustuu ihmisillä saavutettuihin plasmapitoisuuksiin, mikä on korvaava päätetapahtuma, jonka perusteella voidaan kohtuudella ennustaa kliinistä hyötyä. LEVAQUIN®-valmistetta ei ole testattu ihmisillä inhaloitavan pernaruton ehkäisyssä altistumisen jälkeen. LEVAQUIN®in keskimääräiset plasmapitoisuudet, jotka liittyvät tilastollisesti merkitsevään eloonjäämisajan parantumiseen lumelääkkeeseen verrattuna inhaloitavan pernaruton reesusapinamallissa, saavutetaan tai ylittyvät aikuisilla ja lapsipotilailla, jotka saavat suositeltuja suun kautta ja suonensisäisiä annostusohjelmia [ks. INDIKAATIOT ja ANNOSTELU JA HALLINNOINTI ].
Levofloksasiinin farmakokinetiikkaa on arvioitu aikuisilla ja lapsipotilailla. Keskimääräinen (± SD) vakaan tilan huippupitoisuus plasmassa ihmisillä, jotka saavat 500 mg suun kautta tai suonensisäisesti kerran päivässä, on 5,7 ± 1,4 ja 6,4 ± 0,8 mikrog/ml, tässä järjestyksessä; ja vastaava plasman kokonaisaltistus (AUC) on 47,5 ± 6,7 ja 54,6 ± 11,1 mcg.h/ml, vastaavasti. Arvioidut vakaan tilan farmakokineettiset parametrit 6 kuukauden ja 17 vuoden ikäisillä lapsipotilailla, jotka saivat 8 mg/kg suun kautta 12 tunnin välein (ei saa ylittää 250 mg annosta kohti), laskettiin verrattavissa 500 mg:n aikuisilla havaittuihin parametreihin. suun kautta kerran päivässä [katso KLIININEN FARMAKOLOGIA ].
LEVAQUIN®-tabletteja voidaan antaa vain lapsipotilaille, joilla on inhaloitava pernarutto (altistuksen jälkeinen) tai rutto ja jotka painavat 30 kg tai enemmän saatavilla olevien vahvuuksien rajoitusten vuoksi [ks. ANNOSTELU JA HALLINNOINTI ].
Aikuisilla LEVAQUIN®:n turvallisuus jopa 28 päivää kestävän hoidon aikana on hyvin karakterisoitu. Tiedot pidennetystä käytöstä 500 mg:n vuorokaudessa 60 päivään asti ovat kuitenkin rajallisia. Pitkäkestoista LEVAQUIN®-hoitoa aikuisille tulee käyttää vain, jos hyöty on riskiä suurempi.
Lapsipotilailla levofloksasiinin turvallisuutta yli 14 päivää kestäneen hoidon aikana ei ole tutkittu. Tuki- ja liikuntaelimistön haittatapahtumien (nivelkipu, niveltulehdus, tendinopatia, kävelyhäiriöt) lisääntynyt esiintyvyys verrokkeihin verrattuna on havaittu kliinisissä tutkimuksissa, joissa hoidon kesto on enintään 14 päivää. Pitkäaikaiset turvallisuustiedot, mukaan lukien vaikutukset rustoon, levofloksasiinin annon jälkeen lapsipotilaille ovat rajallisia [ks. VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Suoritettiin lumekontrolloitu eläintutkimus reesusapinoilla, jotka altistettiin B. anthracisin (Ames-kanta) 49 LD50:n (~ 2,7 × 106) itiön (alue 17–118 LD50) hengitetylle keskiannokselle. Tässä tutkimuksessa käytetyn pernaruttokannan levofloksasiinin pienin estävä pitoisuus (MIC) oli 0,125 mcg/ml. Tutkituilla eläimillä levofloksasiinin keskimääräiset plasmapitoisuudet, jotka saavutettiin odotetulla Tmax-arvolla (1 tunti annoksen jälkeen) oraalisen annostelun jälkeen vakaaseen tilaan, vaihtelivat välillä 2,79-4,87 mcg/ml. Vakaan tilan pienimmät pitoisuudet 24 tunnin kuluttua annoksen ottamisesta vaihtelivat välillä 0,107-0,164 mikrog/ml. Keskimääräinen (SD) vakaan tilan AUC0-24 oli 33,4 ± 3,2 mcg.h/ml (vaihteluväli 30,4 - 36,0 mcg.h/ml). Pernaruttokuolleisuus eläimillä, jotka saivat 30 päivää suun kautta annettavaa LEVAQUIN®-hoitoa 24 tunnin kuluttua altistumisesta, oli merkitsevästi pienempi (1/10) verrattuna plaseboryhmään (9/10) [P = 0,0011, kaksipuolinen Fisher 39;s Tarkka testi]. Yksi levofloksasiinilla hoidettu eläin, joka kuoli pernaruttoon, kuoli 30 päivän lääkkeen antojakson jälkeen.
Rutto
LEVAQUIN®:n tehokkuustutkimuksia ei voitu suorittaa ihmisillä, joilla on keuhkokuume eettisistä ja toteutettavuussyistä. Siksi tämän käyttöaiheen hyväksyminen perustui eläimillä tehtyyn tehokkuustutkimukseen.
LEVAQUIN®:n keskimääräiset plasmapitoisuudet, jotka liittyvät tilastollisesti merkittävään eloonjäämisajan parantumiseen lumelääkkeeseen verrattuna afrikkalaisessa vihreässä apinassa keuhkoputon mallissa, saavutetaan tai ylittyvät aikuisilla ja lapsipotilailla, jotka saavat suositeltuja suun kautta ja suonensisäisiä annostusohjelmia [ks. INDIKAATIOT ja ANNOSTELU JA HALLINNOINTI ].
Levofloksasiinin farmakokinetiikkaa on arvioitu aikuisilla ja lapsipotilailla. Keskimääräinen (± SD) vakaan tilan huippupitoisuus plasmassa ihmisillä, jotka saavat 500 mg suun kautta tai suonensisäisesti kerran päivässä, on 5,7 ± 1,4 ja 6,4 ± 0,8 mikrog/ml, tässä järjestyksessä; ja vastaava plasman kokonaisaltistus (AUC0-24) on 47,5 ± 6,7 ja 54,6 ± 11,1 mcg.h/ml, vastaavasti. Arvioidut vakaan tilan farmakokineettiset parametrit 6 kuukauden ja 17 vuoden ikäisillä lapsipotilailla, jotka saivat 8 mg/kg suun kautta 12 tunnin välein (ei saa ylittää 250 mg annosta kohti), laskettiin verrattavissa 500 mg:n aikuisilla havaittuihin parametreihin. suun kautta kerran päivässä [katso KLIININEN FARMAKOLOGIA ]. LEVAQUIN®-tabletteja voidaan antaa vain lapsipotilaille, joilla on inhaloitava pernarutto (altistuksen jälkeinen) tai rutto ja jotka painavat 30 kg tai enemmän saatavilla olevien vahvuuksien rajoitusten vuoksi [ks. ANNOSTELU JA HALLINNOINTI ].
Suoritettiin lumekontrolloitu eläintutkimus afrikkalaisilla vihreillä apinoilla, jotka altistettiin Yersinia pestis (CO92 -kanta) -annokselle 65 LD (vaihteluväli 3–145 LD50). Tässä tutkimuksessa käytetyn Y. pestis -kannan levofloksasiinin pienin estävä pitoisuus (MIC) oli 0,03 mcg/ml. Keskimääräiset levofloksasiinin plasmapitoisuudet, jotka saavutettiin yhden 30 minuutin infuusion lopussa, vaihtelivat välillä 2,84-3,50 mcg/ml afrikkalaisilla vihreillä apinoilla. Pienimmät pitoisuudet 24 tunnin kuluttua annoksen ottamisesta vaihtelivat välillä
POTILASTIEDOT
LEVAQUIN® (Jätä ah kwin) (levofloksasiini) tabletit
Mikä on tärkein tieto, joka minun pitäisi tietää LEVAQUIN 500 mg:sta?
LEVAQUIN 500mg, fluorokinoloniantibiootti, voi aiheuttaa vakavia sivuvaikutuksia. Jotkut näistä vakavista sivuvaikutuksista voivat tapahtua samanaikaisesti ja voivat johtaa kuolemaan.
Jos sinulla on jokin seuraavista vakavista sivuvaikutuksista LEVAQUIN 500 mg -hoidon aikana, lopeta LEVAQUINin käyttö välittömästi ja hakeudu välittömästi lääkärin hoitoon.
- Jänteiden ongelmia voi esiintyä kaiken ikäisille ihmisille, jotka käyttävät LEVAQUINia. Jänteet ovat kovia kudosnaruja, jotka yhdistävät lihakset luihin. Joitakin jänne-ongelmia ovat:
- kipu
- turvotus
- jänteiden repeämät ja turvotus mukaan lukien nilkan takaosa (Achilles), olkapää, käsi tai muut jännekohdat.
- Jänneongelmien riski LEVAQUIN-hoidon aikana on suurempi, jos:
- ovat yli 60-vuotiaita
- sinulle on tehty munuaisen, sydämen tai keuhkonsiirto.
- Jänteiden ongelmia voi esiintyä ihmisillä, joilla ei ole yllä mainittuja riskitekijöitä, kun he käyttävät LEVAQUINia.
- Muita syitä, jotka voivat lisätä jänneongelmien riskiä, voivat olla:
- fyysistä toimintaa tai harjoittelua
- munuaisten vajaatoiminta
- jänneongelmat aiemmin, kuten ihmisillä, joilla on nivelreuma (RA)
- Lopeta LEVAQUINin käyttö välittömästi ja hakeudu välittömästi lääkärin hoitoon, kun havaitset ensimmäiset merkit jännekivusta, turvotuksesta tai tulehduksesta. Vältä liikuntaa ja vaurioituneen alueen käyttöä.
- Yleisin kipu- ja turvotusalue on akillesjänne nilkan takana. Tämä voi tapahtua myös muiden jänteiden kanssa. Saatat tarvita eri antibioottia, joka ei ole fluorokinoloni infektiosi hoitoon.
- Jännerepeämä voi tapahtua LEVAQUIN-hoidon aikana tai sen jälkeen, kun olet lopettanut LEVAQUIN-hoidon. Jänteiden repeämiä voi tapahtua tuntien tai päivien kuluessa LEVAQUINin ottamisesta, ja niitä on tapahtunut jopa useita kuukausia sen jälkeen, kun ihmiset ovat lopettaneet fluorokinolonin ottamisen.
- Lopeta LEVAQUIN 750 mg:n käyttö välittömästi ja hakeudu välittömästi lääkärin hoitoon, jos saat jonkin seuraavista jännerepeämän merkeistä tai oireista:
- kuulet tai tunnet napsahduksen tai poksahduksen jänteen alueella
- mustelmat heti vamman jälkeen jännealueella
- ei pysty liikuttamaan vahingoittunutta aluetta tai kestämään painoa
- kipu
- palaa
- pistely
- tunnottomuus
- heikkous
Hermovaurio voi olla pysyvä.
- kohtauksia
- kuulla ääniä, nähdä asioita tai aistia asioita, joita ei ole olemassa (hallusinaatiot)
- tuntea olonsa levottomaksi
- vapinaa
- tuntea olonsa ahdistuneeksi tai hermostuneeksi
- hämmennystä
- masennus
- nukahtamisvaikeuksia
- painajaisia
- tunne pyörrytystä tai huimausta
- tuntea olonsa epäluuloisemmaksi (paranoia)
- itsetuhoisia ajatuksia tai tekoja
- päänsäryt, jotka eivät häviä, näön hämärtymisen kanssa tai ilman
Mikä LEVAQUIN on?
LEVAQUIN 500mg on fluorokinolonilääke, jota käytetään 18-vuotiailla tai sitä vanhemmilla aikuisilla tiettyjen bakteerien aiheuttamien infektioiden hoitoon. Näitä bakteeri-infektioita ovat:
- sairaalakeuhkokuume
- yhteisössä hankittu keuhkokuume
- ihoinfektiot, monimutkaiset ja mutkaton
- krooninen eturauhastulehdus
- hengitettynä pernaruttobakteerit
- rutto
- virtsatietulehdukset, monimutkaiset ja komplisoitumattomat
- akuutti munuaistulehdus (pyelonefriitti)
- akuutti poskiontelotulehdus
- akuutti paheneminen tai krooninen keuhkoputkentulehdus
LEVAQUINin käyttöä ruton ja pernaruton hoidossa tutkittiin vain eläimillä, koska ruttoa ja pernaruttoa ei voitu tutkia ihmisillä.
LEVAQUINia ei tule käyttää potilaille, joilla on komplisoitumattomia virtsatieinfektioita, kroonisen keuhkoputkentulehduksen akuuttia bakteeriperäistä pahenemista tai akuuttia bakteeriperäistä sinuiittia, jos muita hoitovaihtoehtoja on saatavilla.
LEVAQUIN 750mg -tabletteja käytetään myös sellaisten lasten hoitoon, jotka painavat vähintään 66 puntaa (tai vähintään 30 kilogrammaa) ja ovat saattaneet hengittää pernaruttobakteeria, joilla on rutto tai altistuneet ruttobakteerille. Ei tiedetä, onko LEVAQUIN turvallinen ja tehokas alle 6 kuukauden ikäisille lapsille.
Turvallisuutta ja tehoa lapsilla, joita on hoidettu LEVAQUIN®-valmisteella yli 14 päivää, ei tunneta.
Kuka ei saa ottaa LEVAQUIN 750mg?
Älä ota LEVAQUINia: jos sinulla on koskaan ollut vaikea allerginen reaktio fluorokinoloniksi tunnetulle antibiootille tai jos olet allerginen levofloksasiinille tai jollekin LEVAQUINin aineosalle. Katso tämän pakkausselosteen lopusta täydellinen luettelo LEVAQUINin ainesosista.
Ennen kuin otat LEVAQUINia, kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, mukaan lukien jos:
- sinulla on jänne-ongelmia; LEVAQUIN 250 mg:aa ei tule käyttää henkilöille, joilla on ollut jänne-ongelmia.
- sinulla on ongelma, joka aiheuttaa lihasheikkoutta (myasthenia gravis); LEVAQUINia ei tule käyttää henkilöille, joilla on tiedossa myasthenia gravis.
- sinulla on keskushermostoongelmia, kuten kouristuskohtauksia (epilepsia).
- sinulla on hermoongelmia; LEVAQUIN 250 mg:aa ei tule käyttää potilaille, joilla on ollut perifeeriseksi neuropatiaksi kutsuttu hermoongelma.
- sinulla tai jollain perheenjäsenelläsi on epäsäännöllinen sydämenlyönti, erityisesti tila nimeltä "QT-ajan piteneminen".
- sinulla on alhainen veren kaliumpitoisuus (hypokalemia).
- on luuongelmia.
- sinulla on nivelongelmia, mukaan lukien nivelreuma (RA).
- on munuaisongelmia. Saatat tarvita pienemmän LEVAQUIN-annoksen, jos munuaisesi eivät toimi hyvin.
- sinulla on maksaongelmia.
- sinulla on diabetes tai ongelmia alhaisen verensokerin kanssa (hypoglykemia).
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, vahingoittaako LEVAQUIN 750 mg sikiötäsi.
- imetät tai aiot imettää. Ei tiedetä, erittyykö LEVAQUIN äidinmaitoon. Sinun ja terveydenhuollon tarjoajasi tulee päättää, otatko LEVAQUIN 250 mg vai imetätkö. Sinun ei pitäisi tehdä molempia.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät.
LEVAQUIN ja muut lääkkeet voivat vaikuttaa toisiinsa aiheuttaen sivuvaikutuksia.
Kerro erityisesti terveydenhuollon tarjoajallesi, jos otat:
- steroidilääke.
- antipsykoottinen lääke.
- trisyklinen masennuslääke.
- vesipilleri (diureetti).
- tietyt lääkkeet voivat estää LEVAQUIN 750 mg:n toimimasta oikein. Ota LEVAQUIN® joko 2 tuntia ennen näiden lääkkeiden tai lisäravinteiden ottamista tai 2 tuntia sen jälkeen:
- antasidi, monivitamiini tai muut lääkkeet tai lisäravinteet, joissa on magnesiumia, alumiinia, rautaa tai sinkkiä
- sukralfaatti (Carafate®)
- didanosiini (Videx®, Videx® EC)
- verenohennusaine (varfariini, Coumadin, Jantoven).
- suun kautta otettava diabeteslääke tai insuliini.
- NSAID (ei-steroidinen anti-inflammatorinen lääke). Monet yleiset kivunlievityslääkkeet ovat tulehduskipulääkkeitä. Tulehduskipulääkkeiden ottaminen LEVAQUIN 250 mg:n tai muiden fluorokinolonien käytön aikana saattaa lisätä keskushermostovaikutusten ja kohtausten riskiä.
- teofylliini (Theo-24®, Elixophyllin®, Theochron®, Uniphyl®, Theolair®).
- lääke, joka säätelee sykettäsi tai rytmiäsi (rytmihäiriölääkkeet).
Kysy terveydenhuollon tarjoajaltasi, jos et ole varma, onko jokin lääkkeistäsi lueteltu yllä. Tunne käyttämäsi lääkkeet. Pidä luetteloa lääkkeistäsi ja näytä se terveydenhuollon tarjoajalle ja apteekkihenkilökunnalle, kun hankit uuden lääkkeen.
Miten minun pitäisi ottaa LEVAQUIN 500 mg?
- Ota LEVAQUIN juuri sen verran kuin terveydenhuollon tarjoajasi on neuvonut sinua ottamaan sen.
- Ota LEVAQUIN 750 mg suunnilleen samaan aikaan joka päivä.
- Juo runsaasti nesteitä LEVAQUIN-hoidon aikana.
- LEVAQUIN voidaan ottaa ruoan kanssa tai ilman.
- Jos unohdat ottaa LEVAQUIN 500 mg -annoksen, ota se heti kun muistat. Älä ota enempää kuin 1 annosta 1 päivässä.
- Älä jätä väliin yhtään LEVAQUIN 750 mg:n annosta tai lopeta sen ottamista, vaikka tuntisit olosi paremmaksi, ennen kuin olet lopettanut määrätyn hoidon, ellei:
- sinulla on jänne-ongelmia. Katso "Mikä on tärkein tieto, joka minun pitäisi tietää LEVAQUIN 500mg:sta?".
- sinulla on hermoongelma. Katso "Mitä ovat LEVAQUINin mahdolliset sivuvaikutukset?".
- sinulla on keskushermoston ongelma. Katso "Mitä ovat LEVAQUIN 750mg:n mahdolliset sivuvaikutukset?".
- sinulla on vakava allerginen reaktio. Katso "Mitä ovat LEVAQUIN 250mg:n mahdolliset sivuvaikutukset?".
- terveydenhuollon tarjoajasi kehottaa sinua lopettamaan LEVAQUINin käytön.
Kaikkien LEVAQUIN 500 mg -annosten ottaminen auttaa varmistamaan, että kaikki bakteerit kuolevat. Kaikkien LEVAQUIN 250 mg -annosten ottaminen auttaa vähentämään mahdollisuutta, että bakteerit muuttuvat vastustuskykyisiksi LEVAQUINille. Jos infektiosi ei parane LEVAQUIN 750 mg -hoidon aikana, se voi tarkoittaa, että infektiosi aiheuttavat bakteerit voivat olla resistenttejä LEVAQUINille. Jos infektiosi ei parane, soita terveydenhuollon tarjoajallesi. Jos infektiosi ei parane, LEVAQUIN ja muut vastaavat antibioottilääkkeet eivät ehkä toimi sinulle tulevaisuudessa.
- Jos otat liikaa LEVAQUINia, soita terveydenhuollon tarjoajalle tai hakeudu välittömästi lääkärin hoitoon.
Mitä minun pitäisi välttää LEVAQUIN 500 mg:n käytön aikana?
- LEVAQUIN voi aiheuttaa huimausta ja pyörrytystä. Älä ajaa autoa, käyttää koneita tai tehdä muuta toimintaa, joka vaatii henkistä vireyttä tai koordinaatiota, kunnes tiedät kuinka LEVAQUIN vaikuttaa sinuun.
- Vältä aurinkolamppuja, solariumeja ja yritä rajoittaa aikaasi auringossa. LEVAQUIN 750mg voi tehdä ihosi herkäksi auringolle (valoherkkyys) ja aurinkolamppujen ja solariumien valolle. Saatat saada vakavan auringonpolttaman, rakkuloita tai ihon turvotusta. Jos saat jonkin näistä oireista LEVAQUIN-hoidon aikana, soita välittömästi terveydenhuollon tarjoajallesi. Sinun tulee käyttää aurinkovoidetta ja käyttää hattua ja ihoa peittäviä vaatteita, jos joudut olemaan auringonpaisteessa.
Mitkä ovat LEVAQUIN 750mg:n mahdolliset sivuvaikutukset?
LEVAQUIN 750mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää LEVAQUIN 250mg:sta?"
- Vakavat allergiset reaktiot.
Allergisia reaktioita voi esiintyä ihmisillä, jotka käyttävät fluorokinoloneja, mukaan lukien LEVAQUIN 500 mg, jopa yhden annoksen jälkeen. Lopeta LEVAQUIN 500 mg:n käyttö ja hakeudu välittömästi ensiapuun, jos sinulla on jokin seuraavista vakavan allergisen reaktion oireista:
- nokkosihottuma
- hengitys- tai nielemisvaikeudet
- huulten, kielen, kasvojen turvotus
- kurkun kireys, käheys
- nopea sydämen syke
- heikko
- ihottuma
LEVAQUIN 500 mg:aa saavilla ihmisillä voi esiintyä ihottumaa jopa yhden annoksen jälkeen. Lopeta LEVAQUIN 250 mg:n käyttö ensimmäisten ihottuman oireiden ilmaantuessa ja ota välittömästi yhteyttä terveydenhuollon tarjoajaan. Ihottuma voi olla merkki vakavammasta LEVAQUIN-reaktiosta.
- Maksavaurio (hepatotoksisuus): Maksatoksisuutta voi esiintyä ihmisillä, jotka käyttävät LEVAQUINia. Soita heti terveydenhuollon tarjoajallesi, jos sinulla on selittämättömiä oireita, kuten:
- pahoinvointia tai oksentelua
- vatsakipu
- kuume
- heikkous
- vatsakipu tai arkuus
- kutina
- epätavallinen väsymys
- ruokahalun menetys
- vaaleat suolenliikkeet
- tumma virtsa
- ihosi tai silmänvalkuaisten keltaisuus
Lopeta LEVAQUIN 750 mg:n käyttö ja kerro heti terveydenhuollon tarjoajallesi, jos ihosi tai silmäsi valkoinen osa on kellastunut tai jos sinulla on tumma virtsa. Nämä voivat olla merkkejä vakavasta reaktiosta LEVAQUINille (maksaongelma).
- Suolistotulehdus (pseudomembranoottinen koliitti) Pseudomembranoottinen koliitti voi ilmetä monien antibioottien, mukaan lukien LEVAQUINin, kanssa. Soita välittömästi terveydenhuollon tarjoajallesi, jos saat vetistä ripulia, ripulia, joka ei mene ohi, tai verisiä ulosteita. Sinulla voi olla vatsakramppeja ja kuumetta. Pseudomembranoottinen paksusuolitulehdus voi ilmaantua vähintään 2 kuukautta antibioottihoidon lopettamisen jälkeen.
- Vakavat sydämen rytmimuutokset (QT-ajan piteneminen ja torsade depointes) Kerro heti terveydenhuollon tarjoajallesi, jos sydämesi syke muuttuu (nopea tai epäsäännöllinen syke) tai jos pyörryt. LEVAQUIN 250 mg voi aiheuttaa harvinaisen sydänongelman, joka tunnetaan QT-ajan pidentymisenä. Tämä tila voi aiheuttaa epänormaalia sydämenlyöntiä ja voi olla erittäin vaarallinen. Tämän todennäköisyys on suurempi ihmisillä:
- jotka ovat vanhoja
- joiden suvussa on ollut pitkittynyt QT-aika
- joilla on alhainen veren kaliumpitoisuus (hypokalemia)
- jotka käyttävät tiettyjä lääkkeitä sydämen rytmin säätelyyn (antiarytmiset lääkkeet)
- Nivelongelmat Lasten nivelten ja nivelten ympärillä olevien kudosten ongelmien mahdollisuus kasvaa. Kerro lapsellesi terveydenhuollon tarjoajalle, jos lapsellasi on nivelongelmia LEVAQUIN-hoidon aikana tai sen jälkeen.
- Muutokset verensokerissa Ihmiset, jotka käyttävät LEVAQUINia ja muita fluorokinolonilääkkeitä oraalisten diabeteslääkkeiden tai insuliinin kanssa, voivat saada alhaisen verensokerin (hypoglykemian) ja korkean verensokerin (hyperglykemian). Noudata terveydenhuollon tarjoajan ohjeita siitä, kuinka usein tarkistat verensokerisi. Jos sinulla on diabetes ja verensokerisi on alhainen LEVAQUIN-hoidon aikana, lopeta LEVAQUIN 500 mg:n käyttö ja soita välittömästi terveydenhuollon tarjoajallesi. Antibioottilääkkeesi on ehkä vaihdettava.
- Herkkyys auringonvalolle (valoherkkyys) Katso "Mitä minun pitäisi välttää LEVAQUIN-hoidon aikana?" LEVAQUIN 250mg:n yleisimmät sivuvaikutukset ovat:
- pahoinvointi
- päänsärky
- ripuli
- unettomuus
- ummetus
- huimaus
Oksentelu on myös yleistä 6 kuukauden ikäisillä ja sitä vanhemmilla lapsilla, jotka käyttävät LEVAQUINia pernaruttotaudin tai ruton hoitoon.
LEVAQUIN voi aiheuttaa vääriä positiivisia virtsan seulontatuloksia opiaateille, kun testataan joillakin kaupallisesti saatavilla sarjoilla. Positiivinen tulos tulee vahvistaa käyttämällä tarkempaa testiä. Nämä eivät ole kaikkia LEVAQUINin mahdollisia sivuvaikutuksia.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää LEVAQUIN 250 mg?
- Säilytä LEVAQUIN 500 mg huoneenlämmössä 59 ° F - 86 ° F (15 ° C - 30 ° C).
- Säilytä LEVAQUIN 500mg tiiviisti suljetussa astiassa.
Yleistä tietoa LEVAQUINin turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä LEVAQUINia sairauksiin, joihin sitä ei ole määrätty. Älä anna LEVAQUIN 500 mg muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä. Tämä lääkitysopas tiivistää tärkeimmät tiedot LEVAQUINista. Jos haluat lisätietoja LEVAQUIN 750mg:sta, keskustele terveydenhuollon tarjoajasi kanssa. Voit kysyä terveydenhuollon tarjoajaltasi tai apteekista LEVAQUIN 500mg -valmistetta koskevia tietoja, jotka on kirjoitettu terveydenhuollon ammattilaisille.
Mitä ainesosia LEVAQUIN 500mg sisältää?
Aktiivinen ainesosa: levofloksasiini
Inaktiiviset ainesosat: krospovidoni, hypromelloosi, magnesiumstearaatti, mikrokiteinen selluloosa, polyetyleeniglykoli, polysorbaatti 80, titaanidioksidi.
LEVAQUIN 250 mg tabletit sisältävät myös synteettistä punaista rautaoksidia.
LEVAQUIN 500 mg tabletit sisältävät myös synteettistä punaista rautaoksidia ja synteettistä keltaista rautaoksidia.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto
