Cipro 1000mg, 250mg, 500mg, 750mg Ciprofloxacin Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Cipro 750mg on ja miten sitä käytetään?
Cipro 500mg on reseptilääke, jota käytetään bakteeri-infektioiden oireiden hoitoon. Ciproa voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Cipro kuuluu lääkeryhmään, jota kutsutaan fluorokinoloniksi.
Ei tiedetä, onko Cipro 750mg turvallinen ja tehokas alle 1-vuotiaille lapsille.
Mitkä ovat Cipron mahdolliset sivuvaikutukset?
Cipro voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- matala verensokeri,
- päänsärky,
- nälkä,
- hikoilu,
- ärtyneisyys,
- huimaus,
- pahoinvointi,
- nopea syke,
- ahdistuneisuus tai vapina,
- tunnottomuus käsissäsi, käsivarsissasi, jaloissasi tai jaloissasi,
- heikkous,
- pistely tai polttava kipu,
- hermostuneisuus,
- hämmennystä,
- agitaatio,
- vainoharhaisuus,
- hallusinaatiot,
- muistiongelmia,
- keskittymisvaikeuksia,
- itsemurha-ajatuksia,
- äkillinen kipu,
- turvotus,
- mustelmat,
- arkuus,
- jäykkyys,
- liikkumisongelmia,
- katkeaminen tai poksahtaminen missä tahansa nivelessä,
- vaikea tai jatkuva rintakipu, vatsa- tai selkäkipu,
- vetistä tai veristä ripulia,
- lepattaa rinnassasi,
- hengenahdistus,
- huimaus,
- ihottuma,
- hengitysongelmia,
- vähän tai ei ollenkaan virtsaamista,
- ihon tai silmien keltaisuus,
- kova päänsärky,
- soi korvissasi,
- näköongelmia ja
- kipua silmien takana
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Cipro 1000mg:n yleisimmät sivuvaikutukset ovat:
- pahoinvointi,
- oksentelua,
- ripuli,
- vatsakipu,
- emättimen kutina tai vuoto,
- päänsärkyä ja
- epänormaalit maksan toimintakokeet
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Cipron mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
VAKAVAT HAITTAVAIKUTUKSET, MUKAAN lukien jännetulehdus, jänteen repeämä, perifeerinen neuropatia, KESKUSHERMOJÄRJESTELMÄN VAIKUTUKSET JA MYASTENIA GRAVISIN paheneminen
- Fluorokinolonit, mukaan lukien Cipro 250 mg, on yhdistetty vammautuviin ja mahdollisesti peruuttamattomiin vakaviin haittavaikutuksiin, jotka ovat ilmenneet yhdessä [ks. VAROITUKSET JA VAROTOIMET], mukaan lukien:
- Jännetulehdus ja jänteen repeämä [katso VAROITUKSET JA VAROTOIMET]
- Perifeerinen neuropatia [katso VAROITUKSET JA VAROTOIMET]
- Keskushermostovaikutukset [katso VAROITUKSET JA VAROTOIMET]
Lopeta Cipro 750 mg:n käyttö välittömästi ja vältä fluorokinolonien käyttöä, mukaan lukien Cipro, potilailla, joilla on jokin näistä vakavista haittavaikutuksista [ks. VAROITUKSET JA VAROTOIMET ]
- Fluorokinolonit, mukaan lukien Cipro 750 mg, voivat pahentaa lihasheikkoutta potilailla, joilla on myasthenia gravis. Vältä Ciproa potilailla, joilla on aiemmin ollut myasthenia gravis. [katso VAROITUKSET JA VAROTOIMET]
- Koska fluorokinoloneihin, mukaan lukien CIPRO 500 mg, on liittynyt vakavia haittavaikutuksia [ks. VAROITUKSET JA VAROTOIMET], varaa CIPRO käytettäväksi potilailla, joilla ei ole vaihtoehtoisia hoitovaihtoehtoja komplisoitumattomiin virtsatieinfektioihin [katso KÄYTTÖAIHEET]
KUVAUS
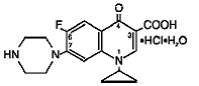
Cipro (cipro 750mgfloxacin*) depottabletit sisältävät cipro 500mgfloksasiinia, synteettistä antimikrobista ainetta suun kautta annettavaksi. Cipro 1000 mg tabletit ovat päällystettyjä, kaksikerroksisia tabletteja, jotka koostuvat välittömästi vapautuvasta kerroksesta ja eroosiomatriisityyppisestä kontrolloidusti vapautuvasta kerroksesta. Tabletit sisältävät kahden tyyppisen siprofloksasiini-lääkeaineen yhdistelmän, siprofloksasiinihydrokloridia ja siprofloksasiinibetaiinia (emäs). Cipro 750 mgfloksasiinihydrokloridi on 1-syklopropyyli-6-fluori-1,4-dihydro-4-okso-7-(1-piperatsinyyli)-3-kinoliinikarboksyylihappohydrokloridi. Se toimitetaan monohydraatin ja seskvihydraatin seoksena. Monohydraatin empiirinen kaava on C17H18FN3O3. HCl. H2O ja sen molekyylipaino on 385,8. Seskvihydraatin empiirinen kaava on C17H18FN3O3. HCl. 1,5 H2O ja sen molekyylipaino on 394,8. Lääkeaine on heikosti kellertävästä vaaleankeltaiseen kiteistä ainetta. Monohydraatin kemiallinen rakenne on seuraava:
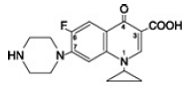
Cipro 1000 mgfloksasiinibetaiini on 1-syklopropyyli-6-fluori-1,4-dihydro-4-okso-7-(1-piperatsinyyli)-3-kinoliinikarboksyylihappo. Hydraattina sen empiirinen kaava on C17H18FN3O3. 3,5 H2O ja sen molekyylipaino on 394,3. Se on vaalean kellertävästä vaaleankeltaiseen kiteistä ainetta ja sen kemiallinen rakenne on seuraava:
Ciproa on saatavana 500 mg:n ja 1000 mg:n (cipro 500 mgfloksasiinia vastaava) tablettivahvuuksina. Cipro-tabletit ovat lähes valkoisia tai hieman kellertäviä, kalvopäällysteisiä, pitkänomaisia tabletteja. Jokainen Cipro 500 mg tabletti sisältää 500 mg siprofloksasiinia siprofloksasiini-HCl:nä (287,5 mg, laskettuna siprofloksasiinina kuiva-aineesta) ja cipro 1000 mgfloksasiinia† (212,6 mg, laskettuna kuiva-aineesta). Jokainen Cipro 1000 mg tabletti sisältää 1000 mg siprofloksasiinia siprofloksasiini-HCl:nä (574,9 mg, laskettuna siprofloksasiinina kuiva-aineesta) ja sipro 750 mgfloksasiinia† (425,2 mg, laskettuna kuiva-aineesta). Inaktiiviset aineet ovat krospovidoni, hypromelloosi, magnesiumstearaatti, polyetyleeniglykoli, vedetön kolloidinen piidioksidi, meripihkahappo ja titaanidioksidi.
* koska sipro 500mgfloksasiini† ja sipro 250mgfloksasiinihydrokloridi † eivät täytä USP-monografian kuivaushäviöitä ja sytytystestin jäämiä.
INDIKAATIOT
Ihon ja ihon rakenteen infektiot
CIPRO 1000mg on tarkoitettu aikuispotilaille Escherichia coli-, Klebsiella pneumoniae-, Enterobacter cloacae-, Proteus mirabilis-, Proteus vulgaris-, Providencia stuartii-, Morganella morganii-, Citrobacter freundii-, Pseudomusosceptus acillinosa-, Pseudomusosceptus acillinosa-, Pseudomusocepthis acillines-infektioiden aiheuttamien infektioiden hoitoon. metisilliinille herkkä Staphylococcus epidermidis tai Streptococcus pyogenes.
Luu- ja niveltulehdukset
CIPRO 750mg on tarkoitettu aikuispotilaille Enterobacter cloacaen, Serratia marcescensin tai Pseudomonas aeruginosan aiheuttamien luu- ja nivelinfektioiden hoitoon.
Monimutkaiset vatsansisäiset infektiot
CIPRO 250 mg on tarkoitettu aikuispotilaille Escherichia colin, Pseudomonas aeruginosan, Proteus mirabilisin, Klebsiella pneumoniaen tai Bacteroides fragilis -bakteerin aiheuttamien komplisoituneiden vatsansisäisten infektioiden hoitoon (käytetään yhdessä metronidatsolin kanssa).
Tarttuva ripuli
CIPRO 500 mg on tarkoitettu aikuispotilaille Escherichia colin (enterotoksigeeniset isolaatit), Campylobacter jejuni, Shigella boydii †, Shigella dysenteriae, Shigella flexneri tai Shigella sonnei† aiheuttaman tarttuvan ripulin hoitoon, kun antibakteerinen hoito on aiheellinen.
†Vaikka tämän organismin aiheuttamien infektioiden hoito tässä elinjärjestelmässä osoitti kliinisesti merkittävää lopputulosta, tehoa tutkittiin alle 10 potilaalla.
Lavantauti (enteerinen kuume)
CIPRO 1000mg on tarkoitettu aikuispotilaille Salmonella typhin aiheuttaman lavantautien (enteerinen kuume) hoitoon. Siprofloksasiinin tehoa kroonisen lavantautin kantajatilan hävittämisessä ei ole osoitettu.
Komplisoitumaton kohdunkaulan ja virtsaputken tippuri
CIPRO on tarkoitettu aikuispotilaille Neisseria gonorrhoeaen aiheuttaman komplisoitumattoman kohdunkaulan ja virtsaputken gonorrean hoitoon [ks. VAROITUKSET JA VAROTOIMET ].
Hengitetty pernarutto (altistuksen jälkeinen)
CIPRO 250 mg on tarkoitettu aikuisille ja lapsipotilaille syntymästä 17-vuotiaaksi inhaloitavaan pernaruttoon (altistuksen jälkeinen) vähentämään taudin ilmaantuvuutta tai etenemistä aerosolisoidulle Bacillus anthracikselle altistumisen jälkeen.
Ihmisillä saavutetut Cipro 500 mgfloksasiinin seerumipitoisuudet toimivat korvikepäätetapahtumana, joka kohtuudella ennustaa kliinisen hyödyn, ja se toimi alustavan perustan tämän käyttöaiheen hyväksymiselle.1 Siprofloksasiinista pernaruton jälkeisessä altistuksen jälkeisessä profylaksiassa tukevaa kliinistä tietoa saatiin lokakuun pernaruton bioterrori-iskujen aikana. 2001 [katso Kliiniset tutkimukset ].
Rutto
CIPRO 1000mg on tarkoitettu Yersinia pestis (Y. pestis) -taudin aiheuttaman ruton hoitoon, mukaan lukien keuhkokuume ja septiseeminen rutto, sekä ruton ehkäisyyn aikuisilla ja lapsipotilailla syntymästä 17-vuotiaaksi. Cipro 250mgfloksasiinin tehokkuustutkimuksia ei voitu suorittaa ruttoa sairastavilla ihmisillä toteutettavuussyistä. Siksi tämä käyttöaihe perustuu tehokkuustutkimukseen, joka on tehty vain eläimillä [ks Kliiniset tutkimukset ].
Krooninen bakteerien aiheuttama eturauhastulehdus
CIPRO on tarkoitettu aikuispotilaille Escherichia colin tai Proteus mirabilisin aiheuttaman kroonisen bakteeriperäisen eturauhastulehduksen hoitoon.
Alempien hengitysteiden infektiot
CIPRO 750mg on tarkoitettu aikuispotilaille Escherichia colin, Klebsiella pneumoniaen, Enterobacter cloacaen, Proteus mirabilisin, Pseudomonas aeruginosan, Haemophilus influenzaen, Haemophilus parainfluenzaen tai Streptococcusin aiheuttamien alahengitystieinfektioiden hoitoon.
CIPRO ei ole ensisijainen lääke Streptococcus pneumoniaen aiheuttaman sekundaarisen keuhkokuumeen hoidossa.
CIPRO on tarkoitettu Moraxella catarrhalis -bakteerin aiheuttaman kroonisen keuhkoputkentulehduksen (AECB) akuutin pahenemisvaiheen hoitoon.
Koska fluorokinoloneihin, mukaan lukien CIPRO, on liittynyt vakavia haittavaikutuksia [ks VAROITUKSET JA VAROTOIMET ] ja joillekin potilaille AECB on itsestään rajoittuva, varaa CIPRO 750 mg AECB:n hoitoon potilailla, joilla ei ole vaihtoehtoisia hoitovaihtoehtoja.
Virtsatieinfektiot
Virtsatieinfektiot aikuisilla
CIPRO 500 mg on tarkoitettu aikuispotilaille Escherichia coli-, Klebsiella pneumoniae-, Enterobacter cloacae-, Serratia marcescens-, Proteus mirabilis-, Providencia rettgeri-, Morganella morganii-, Citrobacter koseri-, Citrobacterus epidermodomiible-, P. Citrobacterphylocosuundi- ja P. , Staphylococcus saprophyticus tai Enterococcus faecalis.
Akuutti komplisoitumaton kystiitti
CIPRO 750mg on tarkoitettu aikuisille naispotilaille Escherichia colin tai Staphylococcus saprophyticus -bakteerin aiheuttaman akuutin komplisoitumattoman kystiitin hoitoon.
Koska fluorokinoloneihin, mukaan lukien CIPRO, on liittynyt vakavia haittavaikutuksia [ks VAROITUKSET JA VAROTOIMET ] ja joillekin potilaille akuutti komplisoitumaton kystiitti on itsestään rajoittuva, varaa CIPRO akuutin komplisoitumattoman kystiitin hoitoon potilailla, joilla ei ole vaihtoehtoisia hoitovaihtoehtoja.
Komplisoitunut virtsatieinfektio ja pyelonefriitti lapsipotilailla
CIPRO on tarkoitettu 1–17-vuotiaille lapsipotilaille Escherichia colin aiheuttamien komplisoituneiden virtsatieinfektioiden (cUTI) ja pyelonefriitin hoitoon [ks. Käyttö tietyissä populaatioissa ].
Vaikka CIPRO on tehokas kliinisissä tutkimuksissa, se ei ole ensisijainen lääke lapsiväestössä, koska haittavaikutusten ilmaantuvuus on lisääntynyt verrokkeihin verrattuna, mukaan lukien niveliin ja/tai ympäröiviin kudoksiin liittyvät reaktiot. CIPRO 250mg, kuten muutkin fluorokinolonit, liittyy artropatiaan ja histopatologisiin muutoksiin nuorten eläinten painoa kantavissa nivelissä [ks. VAROITUKSET JA VAROTOIMET , HAITTAVAIKUTUKSET , Käyttö tietyissä populaatioissa ja Ei-kliininen toksikologia ].
Akuutti sinuiitti
CIPRO on tarkoitettu aikuispotilaille Haemophilus influenzaen, Streptococcus pneumoniaen tai Moraxella catarrhalisin aiheuttaman akuutin sinuiitin hoitoon.
Koska fluorokinoloneihin, mukaan lukien CIPRO, on liittynyt vakavia haittavaikutuksia [ks VAROITUKSET JA VAROTOIMET ] ja joillekin potilaille akuutti sinuiitti on itsestään rajoittuva, varaa CIPRO akuutin poskiontelotulehduksen hoitoon potilailla, joilla ei ole vaihtoehtoisia hoitovaihtoehtoja.
Käyttö
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja CIPRO 1000mg:n ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi CIPRO 500mg:ta tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden on todistettu tai epäillään olevan herkkien bakteerien aiheuttamia. Kun viljely- ja herkkyystiedot ovat saatavilla, ne tulee ottaa huomioon valittaessa tai muuttaessa antibakteerista hoitoa. Tällaisten tietojen puuttuessa paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa hoidon empiiriseen valintaan.
Jos anaerobisten organismien epäillään myötävaikuttavan infektioon, asianmukaista hoitoa tulee antaa. Ennen hoitoa tulee suorittaa asianmukaiset viljely- ja herkkyystestit infektiota aiheuttavien organismien eristämiseksi ja tunnistamiseksi sekä niiden herkkyyden määrittämiseksi siprofloksasiinille. CIPRO-hoito voidaan aloittaa ennen kuin näiden testien tulokset ovat tiedossa; kun tulokset ovat saatavilla, asianmukaista hoitoa tulee jatkaa.
Kuten muutkin lääkkeet, jotkut Pseudomonas aeruginosa -isolaatit voivat kehittää resistenssiä melko nopeasti cipro 1000mgfloksasiinihoidon aikana. Hoidon aikana säännöllisesti suoritettavat viljely- ja herkkyystestit antavat tietoa mikrobilääkkeen terapeuttisen vaikutuksen lisäksi myös mahdollisesta bakteeriresistenssin syntymisestä.
ANNOSTELU JA HALLINNOINTI
CIPRO 1000 mg -tabletit ja oraalisuspensio tulee antaa suun kautta asianmukaisissa annostusohjetaulukoissa kuvatulla tavalla.
Annostus aikuisille
Kunkin tietyn potilaan annostusta ja kestoa määritettäessä on otettava huomioon infektion vakavuus ja luonne, aiheuttavan mikro-organismin herkkyys, potilaan isäntä-puolustusmekanismien eheys sekä munuaisten ja maksan toiminnan tila. . CIPRO-tabletteja tai CIPRO-oraalisuspensiota voidaan antaa aikuisille potilaille, jos se on kliinisesti aiheellista lääkärin harkinnan mukaan. Anna CIPRO oraalisuspensiota varten käyttämällä mukana pakattua mittalusikkaa [katso ANNOSTELU JA HALLINNOINTI ].
Suonensisäisen annostelun muuntaminen suun kautta annettavaksi aikuisille
Potilaat, joiden hoito aloitetaan CIPRO IV:llä, voidaan vaihtaa CIPRO 750 mg:n tabletteihin tai oraaliseen suspensioon, kun se on kliinisesti aiheellista lääkärin harkinnan mukaan (taulukko 2) [ks. KLIININEN FARMAKOLOGIA ].
Annostus lapsipotilaille
CUTI:n tai pyelonefriitin annostus ja ensimmäinen hoitoreitti (eli suonensisäinen tai oraalinen) tulee määrittää infektion vakavuuden mukaan. CIPRO tulee antaa taulukossa 3 kuvatulla tavalla. Anna CIPRO oraalisuspensiota varten käyttämällä mukana pakattua mittalusikkaa [ks. ANNOSTELU JA HALLINNOINTI ].
Annoksen muuttaminen potilailla, joilla on munuaisten vajaatoiminta
Cipro 250 mgfloksasiini eliminoituu pääasiassa munuaisten kautta; lääkeaine kuitenkin myös metaboloituu ja poistuu osittain maksan sappijärjestelmän ja suolen kautta. Nämä vaihtoehtoiset lääkkeen eliminaatioreitit näyttävät kompensoivan vähentynyttä erittymistä munuaisten kautta potilailla, joilla on munuaisten vajaatoiminta. Joitakin annoksen muuttamista suositellaan kuitenkin erityisesti potilaille, joilla on vaikea munuaisten vajaatoiminta. Annostusohjeet potilaille, joilla on munuaisten vajaatoiminta, on esitetty taulukossa 4.
Kun vain seerumin kreatiniinipitoisuus tiedetään, kreatiniinipuhdistuman arvioimiseen voidaan käyttää seuraavia kaavoja:
Seerumin kreatiniinin pitäisi edustaa vakaata munuaistoiminnan tilaa.
Potilaille, joilla on vaikeita infektioita ja vaikea munuaisten vajaatoiminta, voidaan antaa 750 mg:n yksikköannos edellä mainituin väliajoin. Potilaita tulee seurata huolellisesti.
Keskivaikeasta tai vaikeasta munuaisten vajaatoiminnasta kärsivät lapsipotilaat suljettiin pois cUTI:n ja pyelonefriitin kliinisestä tutkimuksesta. Tietoja ei ole saatavilla tarvittavista annostuksen muuttamisesta lapsipotilaille, joilla on kohtalainen tai vaikea munuaisten vajaatoiminta (eli kreatiniinipuhdistuma
Tärkeät hallintaohjeet
Moniarvoisten kationien kanssa
Anna CIPRO vähintään 2 tuntia ennen tai 6 tuntia sen jälkeen, kun magnesium/alumiini antasideja; polymeeriset fosfaattisideaineet (esimerkiksi sevelameeri, lantaanikarbonaatti) tai sukralfaatti; Videx® (didanosiini) pureskeltavat/puskuroidut tabletit tai lasten jauhe oraaliliuosta varten; muut erittäin puskuroidut lääkkeet; tai muita kalsiumia, rautaa tai sinkkiä sisältäviä tuotteita.
Maitotuotteiden kanssa
CIPRO 500 mg:n samanaikaista antoa maitotuotteiden (kuten maidon tai jogurtin) tai pelkän kalsiumpitoisuuksien mehujen kanssa tulee välttää, koska imeytymisen heikentyminen on mahdollista. CIPRO voidaan kuitenkin ottaa näitä tuotteita sisältävän aterian yhteydessä.
CIPRO-hoitoa saavien potilaiden nesteytys
Varmista CIPRO 1000 mg:aa saavien potilaiden riittävä nesteytys estääksesi erittäin väkevän virtsan muodostumisen. Crystalluriaa on raportoitu kinolonien yhteydessä.
Neuvo potilaalle sopivaa CIPRO 1000 mg -annosta [katso Potilasneuvontatiedot ].
Unohtuneet annokset
Jos annos jää väliin, se tulee ottaa milloin tahansa, mutta viimeistään 6 tuntia ennen seuraavaa suunniteltua annosta. Jos seuraavaan annokseen on jäljellä alle 6 tuntia, unohtunutta annosta ei saa ottaa ja hoitoa on jatkettava seuraavan aikataulun mukaisen annoksen mukaisesti. Kaksinkertaista annosta ei tule ottaa kompensoimaan unohtunutta annosta.
Halkaisevat CIPRO 1000 mg tabletit
CIPRO 750 mg -tabletit, 250 mg ja 500 mg ovat toiminnallisesti jaoteltuja tabletteja, jotka voidaan jakaa puoleen jakouurteesta, jolloin saadaan 125 mg ja 250 mg vahvuus.
Ohjeet CIPRO 500 mg:n mikrokapseleiden liuottamiseen oraalisuspensiota varten
CIPRO 750 mg oraalisuspensiota toimitetaan vahvuuksina 5 % (5 g siprofloksasiinia 100 ml:ssa) ja 10 % (10 g cipro 750 mgfloksasiinia 100 ml:ssa). CIPRO 250 mg oraalisuspensio koostuu kahdesta komponentista (mikrokapselit ja laimennusaine), jotka on yhdistettävä ennen annostelua.
Suspension valmistelu
Vaihe 1
Pieni pullo sisältää mikrokapselit, suuri pullo sisältää laimennusaineen.

Vaihe 2
Avaa molemmat pullot. Lapsiturvallinen korkki: Paina korkin ohjeiden mukaan samalla kun käännät vasemmalle.

Vaihe 3
 Kaada mikrokapselit kokonaan suurempaan liuotinpulloon. Älä lisää vettä suspensioon .

Vaihe 4
 Poista liuotinpullon etiketin yläkerros (jotta CIPRO 1000mg oraalisuspension etiketti tulee näkyviin). Sulje iso pullo kokonaan korkin ohjeiden mukaan ja ravista voimakkaasti noin 15 sekuntia. Suspensio on käyttövalmis.
Vaihe 5
Kirjoita uudelleen valmistetun oraalisuspension viimeinen käyttöpäivämäärä pullon etikettiin.
Käyttövalmiiksi saatettua tuotetta voidaan säilyttää alle 30°C:ssa (86°F) 14 päivän ajan. Suojaa jäätymiseltä.
Sekoitettuun lopulliseen siprofloksasiinisuspensioon ei saa tehdä lisäyksiä. CIPRO 1000 mg oraalisuspensiota ei tule antaa ruokinta- tai NG-letkujen kautta sen fysikaalisten ominaisuuksien vuoksi.
Anto-ohjeet CIPRO:lle oraalisuspensiolle käyttövalmiiksi saattamisen jälkeen
- Ravista CIPRO 750 mg oraalisuspensiota voimakkaasti joka kerta ennen käyttöä noin 15 sekunnin ajan.
- Anna CIPRO-oraalisuspensio käyttämällä potilaalle toimitettua samaan pakkautettua asteittain varustettua teelusikallista (katso kuva 1).
Kuva 1: Yhdessä pakattu 5 ml:n asteikolla varustettu teelusikka
Mukana tulee yhteispakattu asteittainen teelusikka (5 ml), jossa on merkinnät ½ (2,5 ml) ja 1/1 (5 ml)
- Puhdista mittalusikallinen käytön jälkeen juoksevan veden alla astianpesuaineella ja kuivaa huolellisesti.
- Älä pureskele CIPRO 250 mg -oraalisuspensiossa olevia mikrokapseleita, vaan niele ne kokonaisina.
- Vettä voidaan ottaa jälkeenpäin.
- Sulje pullo kunnolla jokaisen käyttökerran jälkeen korkin ohjeiden mukaisesti.
- Hoidon päätyttyä CIPRO 1000 mg oraalisuspensiota ei saa käyttää uudelleen.
CIPRO:n annostelu oraaliseen suspensioon käyttämällä mukana pakattua lusikkaa aikuisille ja lapsipotilaille
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Tabletit
- 250 mg, hieman kellertävä, kalvopäällysteinen, pyöreä, toiminnallisesti uurrettu, toisella puolella merkintä ”BAYER” ja toisella ”CIP 250”.
- 500 mg, hieman kellertävä, kalvopäällysteinen, kapselin muotoinen, toiminnallisesti jakouurrettu, toiselle puolelle painettu ”BAYER” ja toiselle ”CIP 500”.
Oraalinen suspensio
- % oraalisuspensio: 250 mg siproa 750 mgfloksasiinia per 5 ml käyttövalmiiksi saattamisen jälkeen
- 10 % oraalisuspensio: 500 mg siproa 250 mgfloksasiinia per 5 ml käyttövalmiiksi saattamisen jälkeen
Varastointi ja käsittely
CIPRO (cipro 750mgfloxacin hydrochloride) -tabletit ovat saatavilla pyöreinä, hieman kellertävinä kalvopäällysteisinä tabletteina, jotka sisältävät 250 mg cipro 500mgfloksasiinia. 250 mg:n tabletin toisella puolella on merkintä ”BAYER”, toiselle puolelle toiminnallinen jakouurre ja kaiverrus ”CIP 250”. CIPRO on saatavana myös kapselinmuotoisina, hieman kellertävinä kalvopäällysteisinä tabletteina, jotka sisältävät 500 mg siprofloksasiinia. 500 mg:n tabletin toisella puolella on merkintä ”BAYER”, toiselle puolelle toiminnallinen jakouurre ja kaiverrus ”CIP 500”. CIPRO 250 mg ja 500 mg on saatavana 100 pulloissa.
Säilytä 20° - 25°C (68° - 77°F); retket sallitaan 15° - 30°C (59° - 86°F) [katso USP-ohjattu huonelämpötila ].
CIPRO-oraalisuspensiota toimitetaan 5 % ja 10 % vahvuuksina. Lääkevalmiste koostuu kahdesta komponentista (mikrokapselit, jotka sisältävät vaikuttavaa ainetta ja laimennusainetta), jotka apteekin on sekoitettava [ks. ANNOSTELU JA HALLINNOINTI ].
Säilytä mikrokapselit ja laimennusaine alle 25°C (77°F); retket ovat sallittuja 15 °C - 30 °C (59 °F - 86 °F) [katso USP-ohjattu huonelämpötila ]. Suojaa jäätymiseltä.
Käyttövalmiiksi saatettua tuotetta voidaan säilyttää 25 °C:ssa (77 °F) 14 päivää; retket ovat sallittuja 15 °C - 30 °C (59 °F - 86 °F) [katso USP-ohjattu huonelämpötila ]. Suojaa jäätymiseltä.
Potilaalle annetaan asteikolla varustettu teelusikka (5 ml), jossa on merkinnät ½ (2,5 ml) ja 1/1 (5 ml).
VIITTEET
1. 21 CFR 314.510 (alaluku H–Uusien lääkkeiden nopeutettu hyväksyminen hengenvaarallisiin sairauksiin).
2. Friedman J, Polifka J. Lääkkeiden teratogeeniset vaikutukset: resurssi kliinikoille (TERIS). Baltimore, Maryland: Johns Hopkins University Press, 2000:149-195.
3. Loebstein R, Addis A, Ho E, et ai. Raskaustulos fluorokinoloneille altistumisen jälkeen: monikeskusprospektiivinen kontrolloitu tutkimus. Antimikrobiset aineet Chemother. 1998;42(6):1336-1339.
Valmistettu: Bayer HealthCare Pharmaceuticals Inc. Whippany, NJ 07981. Tarkistettu: marraskuu 2021
SIVUVAIKUTUKSET
Seuraavia vakavia ja muuten tärkeitä haittavaikutuksia käsitellään tarkemmin muissa merkintöjen osissa:
- Vakavat ja mahdollisesti peruuttamattomat vakavat haittavaikutukset [katso VAROITUKSET JA VAROTOIMET ]
- Jännetulehdus ja jänteen repeämä [katso VAROITUKSET JA VAROTOIMET ]
- Perifeerinen neuropatia [katso VAROITUKSET JA VAROTOIMET ]
- Keskushermoston vaikutukset [katso VAROITUKSET JA VAROTOIMET ] Myasthenia Gravisin paheneminen [katso VAROITUKSET JA VAROTOIMET ]
- Muut vakavat ja joskus kohtalokkaat haittavaikutukset [katso VAROITUKSET JA VAROTOIMET ]
- Yliherkkyysreaktiot [katso VAROITUKSET JA VAROTOIMET ]
- Maksatoksisuus [katso VAROITUKSET JA VAROTOIMET ]
- Aortan aneurysman ja dissektion riski [katso VAROITUKSET JA VAROTOIMET ]
- Vakavat haittavaikutukset samanaikaisen teofylliinin kanssa [katso VAROITUKSET JA VAROTOIMET ]
- Clostridioides difficileen liittyvä ripuli [katso VAROITUKSET JA VAROTOIMET ]
- QT-ajan pidentyminen [katso VAROITUKSET JA VAROTOIMET ]
- Tuki- ja liikuntaelinten häiriöt lapsipotilailla [katso VAROITUKSET JA VAROTOIMET ]
- Valoherkkyys/valotoksisuus [katso VAROITUKSET JA VAROTOIMET ]
- Lääkeresistenttien bakteerien kehittäminen [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Aikuiset potilaat
Kliinisissä tutkimuksissa suun kautta ja parenteraalisesti annetulla CIPRO 750 mg:lla 49 038 potilasta sai lääkekuureja.
Yleisimmin raportoidut haittavaikutukset kliinisistä tutkimuksista kaikista formulaatioista, kaikista annoksista, kaikista lääkehoidon kestoista ja kaikista siprofloksasiinihoidon indikaatioista olivat pahoinvointi (2,5 %), ripuli (1,6 %), epänormaalit maksan toimintakokeet (1,3 % ), oksentelua (1 %) ja ihottumaa (1 %).
Satunnaistetuissa kaksoissokkoutetuissa kontrolloiduissa kliinisissä tutkimuksissa, joissa verrattiin CIPRO-tabletteja [500 mg kahdesti päivässä (BID)] kefuroksiimiaksetiiliin (250–500 mg kahdesti vuorokaudessa) ja klaritromysiiniin (500 mg kahdesti vuorokaudessa) potilailla, joilla oli hengitystieinfektio, CIPRO osoitti keskushermoston haittavaikutusprofiili, joka on verrattavissa kontrollilääkkeisiin.
Pediatriset potilaat
Oraalisen/laskimonsisäisen siprofloksasiinin lyhytkestoista (6 viikkoa) ja pitkäaikaista (1 vuosi) tuki- ja liikuntaelimistön sekä neurologista turvallisuutta verrattiin kefalosporiiniin cUTI:n tai pyelonefriitin hoidossa 1–17-vuotiailla lapsipotilailla (keski-ikä 6 ± 4 vuotta). ) kansainvälisessä monikeskustutkimuksessa. Hoidon kesto oli 10–21 päivää (keskimääräinen hoidon kesto oli 11 päivää ja vaihteluväli 1–88 päivää). Mukaan otettiin yhteensä 335 siproa, 250 mgfloksasiinia ja 349 vertailulääkettä.
Riippumaton lastentautien turvallisuuskomitea (IPSC) tarkasteli kaikki tuki- ja liikuntaelimistön haittavaikutusten tapaukset, mukaan lukien epänormaali kävely tai epänormaali niveltutkimus (perustilanteen tai hoidon alkaessa). Kuuden viikon sisällä hoidon aloittamisesta tuki- ja liikuntaelimistön haittavaikutusten määrä oli 9,3 % (31/335) cipro 750 mgfloksasiinilla hoidetussa ryhmässä ja 6 % (21/349) vertailuvalmisteella hoidetuilla potilailla. Kaikki tuki- ja liikuntaelimistön haittavaikutukset, jotka ilmenivät 6 viikon kuluessa, hävisivät (oireiden kliininen häviäminen), yleensä 30 päivän kuluessa hoidon päättymisestä. Radiologisia arviointeja ei käytetty rutiininomaisesti haittavaikutusten häviämisen vahvistamiseksi. Cipro 500 mgfloksasiinilla hoidetut potilaat ilmoittivat todennäköisemmin useammasta kuin yhdestä haittavaikutuksesta ja useammin kuin kerran verrattuna kontrollipotilaisiin. Tuki- ja liikuntaelimistön haittavaikutusten määrä oli jatkuvasti korkeampi siprofloksasiiniryhmässä verrattuna kontrolliryhmään kaikissa ikäryhmissä. Vuoden lopussa näiden haittavaikutusten määrä, joka ilmoitettiin milloin tahansa kyseisenä ajanjaksona, oli 13,7 % (46/335) ciprolla 250 mgfloksasiinilla hoidetussa ryhmässä verrattuna 9,5 %:iin (33/349) vertailuvalmisteella hoidetuilla potilailla ( Taulukko 9).
Neurologisten haittavaikutusten ilmaantuvuus 6 viikon sisällä hoidon aloittamisesta oli 3 % (9/335) CIPRO-ryhmässä ja 2 % (7/349) vertailuryhmässä, ja niihin sisältyi huimaus, hermostuneisuus, unettomuus ja uneliaisuus.
Tässä tutkimuksessa haittavaikutusten yleinen ilmaantuvuus 6 viikon sisällä hoidon aloittamisesta oli 41 % (138/335) cipro 250 mgfloksasiiniryhmässä ja 31 % (109/349) vertailuryhmässä. Yleisimmät haittavaikutukset olivat maha-suolikanavaa: 15 % (50/335) siprofloksasiinipotilaista verrattuna 9 %:iin (31/349) vertailupotilaista. Vakavia haittavaikutuksia havaittiin 7,5 %:lla (25/335) siprofloksasiinilla hoidetuista potilaista verrattuna 5,7 %:iin (20/349) kontrollipotilaista. Lääkkeen käytön lopettamista haittavaikutuksen vuoksi havaittiin 3 %:lla (10/335) siprofloksasiinilla hoidetuista potilaista ja 1,4 %:lla (5/349) vertailupotilaista. Muita haittavaikutuksia, joita esiintyi vähintään 1 %:lla siprofloksasiinipotilaista, olivat ripuli 4,8 %, oksentelu 4,8 %, vatsakipu 3,3 %, dyspepsia 2,7 %, pahoinvointi 2,7 %, kuume 2,1 %, astma 1,8 % ja ihottuma 1,8 %.
Lyhyen aikavälin turvallisuustiedot cipro 1000 mgfloksasiinista kerättiin myös satunnaistetussa, kaksoissokkoutetussa kliinisessä tutkimuksessa akuuttien keuhkojen pahenemisvaiheiden hoidossa kystistä fibroosia sairastavilla potilailla (ikä 5–17 vuotta). Kuusikymmentäseitsemän potilasta sai CIPRO IV:tä 10 mg/kg/annos 8 tunnin välein yhden viikon ajan, minkä jälkeen CIPRO 250 mg:n tabletteja 20 mg/kg/annos 12 tunnin välein 10–21 päivän hoidon loppuunsaattamiseksi ja 62 potilasta sai keftatsidiimin yhdistelmää suonensisäisenä 50 mg/kg/annos 8 tunnin välein ja tobramysiini laskimoon 3 mg/kg/annos 8 tunnin välein yhteensä 10–21 päivän ajan. Säännölliset tuki- ja liikuntaelimistön arvioinnit suorittivat hoitosokkoutuneet tutkijat. Potilaita seurattiin keskimäärin 23 päivää hoidon päättymisen jälkeen (vaihteluväli 0–93 päivää). Tuki- ja liikuntaelimistön haittavaikutuksia raportoitiin 22 %:lla potilaista siprofloksasiiniryhmässä ja 21 %:lla vertailuryhmässä. Pienentynyt liikeraja raportoitiin 12 %:lla siprofloksasiiniryhmän ja 16 %:lla vertailuryhmästä. Nivelkipua raportoitiin 10 %:lla potilaista cipro 500mgfloksasiiniryhmässä ja 11 %:lla vertailuryhmässä. Muut haittavaikutukset olivat luonteeltaan ja esiintymistiheydeltään samanlaisia hoitoryhmien välillä. CIPRO:n tehoa akuuttien keuhkojen pahenemisvaiheiden hoidossa lapsilla, joilla on kystinen fibroosi, ei ole osoitettu.
Lapsipotilailla kliinisissä tutkimuksissa raportoitujen haittavaikutusten lisäksi on odotettavissa, että aikuisilla kliinisissä tutkimuksissa tai markkinoille tulon jälkeen raportoituja haittavaikutuksia saattaa esiintyä myös lapsipotilailla.
Markkinoinnin jälkeinen kokemus
Seuraavia haittavaikutuksia on raportoitu fluorokinolonien, mukaan lukien CIPRO:n, maailmanlaajuisesta markkinoinnista. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoiselta populaatiolta, ei aina ole mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkealtistukseen (taulukko 10).
Haitalliset laboratoriomuutokset
Muutokset laboratorioparametreissa CIPRO 250 mg:n käytön aikana on lueteltu alla:
Maksa – ALT (SGPT), AST (SGOT), alkalisen fosfataasin, LDH:n ja seerumin bilirubiinin kohoaminen.
Hematologinen – Eosinofilia, leukopenia, verihiutaleiden vähentyminen, kohonnut verihiutaleiden määrä, pansytopenia.
Munuaiset – Seerumin kreatiniini-, BUN-, kristalluria-, sylindruria- ja hematuria-arvojen nousua on raportoitu.
Muita tapahtuneita muutoksia olivat: seerumin gammaglutamyylitransferaasin nousu, seerumin amylaasipitoisuuden nousu, veren glukoosipitoisuuden lasku, kohonnut virtsahappo, hemoglobiinin lasku, anemia, verenvuotodiateesi, veren monosyyttien nousu ja leukosytoosi.
HUUMEIDEN VUOROVAIKUTUKSET
Siprofloksasiini on ihmisen sytokromi P450 1A2 (CYP1A2) -välitteisen metabolian estäjä. CIPRO:n samanaikainen anto muiden ensisijaisesti CYP1A2:n kautta metaboloituvien lääkkeiden kanssa johtaa näiden lääkkeiden plasmapitoisuuksien nousuun ja voi johtaa kliinisesti merkittäviin haittavaikutuksiin samanaikaisesti annetun lääkkeen kanssa.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Vakavia ja mahdollisesti peruuttamattomia vakavia haittavaikutuksia, mukaan lukien jännetulehdus ja jänteen repeämä, perifeerinen neuropatia ja keskushermoston vaikutukset
Fluorokinoloneihin, mukaan lukien CIPRO, on liitetty toimintakyvyttömyyttä aiheuttavia ja mahdollisesti peruuttamattomia vakavia haittavaikutuksia eri elimistön järjestelmistä, joita voi esiintyä yhdessä samalla potilaalla. Yleisesti havaittuja haittavaikutuksia ovat jännetulehdus, jänteen repeämä, nivelsärky, lihaskipu, perifeerinen neuropatia ja keskushermostovaikutukset (hallusinaatiot, ahdistuneisuus, masennus, unettomuus, vaikea päänsärky ja sekavuus). Nämä reaktiot voivat ilmaantua tuntien tai viikkojen kuluessa CIPRO-hoidon aloittamisesta. Kaiken ikäiset potilaat tai ilman olemassa olevia riskitekijöitä ovat kokeneet näitä haittavaikutuksia [katso VAROITUKSET JA VAROTOIMET ].
Lopeta CIPRO 250 mg:n käyttö välittömästi, kun havaitset ensimmäisiä merkkejä tai oireita vakavasta haittavaikutuksesta. Vältä lisäksi fluorokinolonien käyttöä, mukaan lukien CIPRO 500 mg, potilailla, joilla on ollut jokin näistä fluorokinoloneihin liittyvistä vakavista haittavaikutuksista.
Jännetulehdus ja jänteen repeämä
Fluorokinolonit, mukaan lukien CIPRO, on yhdistetty lisääntyneeseen jännetulehduksen ja jännerepeämän riskiin kaiken ikäisillä [ks. VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSET ]. Tämä haittavaikutus koskee useimmiten akillesjännettä, ja sitä on raportoitu myös rotaattorimansetin (olkapää), käden, hauislihaksen, peukalon ja muiden jänteiden yhteydessä. Jännetulehdus tai jänteen repeämä voi ilmetä tuntien tai päivien sisällä CIPRO 500 mg:n aloittamisesta tai useiden kuukausien kuluessa fluorokinolonihoidon päättymisen jälkeen. Jännetulehdus ja jänteen repeämä voivat esiintyä molemmin puolin.
Fluorokinoloneihin liittyvän jännetulehduksen ja jännerepeämän riski on lisääntynyt yli 60-vuotiailla potilailla, kortikosteroidilääkkeitä käyttävillä potilailla sekä potilailla, joille on tehty munuais-, sydän- tai keuhkosiirto. Muita tekijöitä, jotka voivat itsenäisesti lisätä jänteen repeämisen riskiä, ovat rasittava fyysinen aktiivisuus, munuaisten vajaatoiminta ja aiemmat jännehäiriöt, kuten nivelreuma. Tendiniittiä ja jänteen repeämää on esiintynyt myös fluorokinoloneja käyttävillä potilailla, joilla ei ole yllä mainittuja riskitekijöitä. Lopeta CIPRO 250 mg:n käyttö välittömästi, jos potilaalla ilmenee kipua, turvotusta, tulehdusta tai jänteen repeämä. Vältä fluorokinoloneja, mukaan lukien CIPRO 250 mg, potilailla, joilla on ollut jännehäiriöitä tai joilla on ollut jännetulehdus tai jännerepeämä [ks. HAITTAVAIKUTUKSET ].
Perifeerinen neuropatia
Fluorokinoloneihin, mukaan lukien CIPRO, on yhdistetty lisääntynyt perifeerisen neuropatian riski. Fluorokinoloneja, mukaan lukien CIPRO:ta, saaneilla potilailla on raportoitu tapauksia, joissa aistinvarainen tai sensorimotorinen aksonaalinen polyneuropatia vaikuttaa pieniin ja/tai suuriin aksoneihin ja on johtanut parestesioita, hypoestesiaa, dysestesiaa ja heikkoutta saaneilla potilailla. Oireet voivat ilmaantua pian CIPRO-hoidon aloittamisen jälkeen, ja ne voivat olla peruuttamattomia joillakin potilailla [katso VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSET ].
Lopeta CIPRO-hoito välittömästi, jos potilaalla ilmenee perifeerisen neuropatian oireita, kuten kipua, polttamista, pistelyä, tunnottomuutta ja/tai heikkoutta tai muita muutoksia aistimuksissa, mukaan lukien kevyt kosketus, kipu, lämpötila, asennon ja tärinän tunne ja/tai motorinen voima. peruuttamattoman tilan kehittymisen minimoimiseksi. Vältä fluorokinoloneja, mukaan lukien CIPRO 500 mg, potilailla, joilla on aiemmin ollut perifeeristä neuropatiaa [ks. HAITTAVAIKUTUKSET ].
Keskushermoston vaikutukset
Psykiatriset haittavaikutukset
Fluorokinolonit, mukaan lukien CIPRO, on yhdistetty lisääntyneeseen psykiatristen haittavaikutusten riskiin, mukaan lukien: toksinen psykoosi, psykoottiset reaktiot, jotka etenevät itsemurha-ajatuksiksi/-ajatuksiksi, hallusinaatiot tai vainoharhaisuus; masennus tai itseään vahingoittava käyttäytyminen, kuten itsemurhayritys tai sen loppuun saattaminen; ahdistuneisuus, kiihtyneisyys tai hermostuneisuus; sekavuus, delirium, desorientaatio tai huomiohäiriöt; unettomuus tai painajaiset; muistin heikkeneminen. Näitä reaktioita saattaa ilmetä ensimmäisen annoksen jälkeen. Neuvo CIPRO:ta saavia potilaita ilmoittamaan välittömästi terveydenhuollon tarjoajalleen, jos näitä reaktioita ilmenee, lopettamaan lääkkeen käyttö ja aloittamaan asianmukainen hoito.
Keskushermoston haittavaikutukset
Fluorokinolonit, mukaan lukien CIPRO 750 mg, on yhdistetty lisääntyneeseen kohtausten (kouristukset), kohonneen kallonsisäisen paineen (pscudotumor cerebri), huimauksen ja vapinariskin. CIPRO:n, kuten muiden fluorokinolonien, tiedetään laukaisevan kohtauksia tai alentavan kohtauskynnystä. Status epilepticus -tapauksia on raportoitu. Kuten kaikkia fluorokinoloneja, käytä CIPRO:ta varoen epilepsiapotilailla ja potilailla, joilla tiedetään tai epäillään keskushermoston häiriöitä, jotka voivat altistaa kohtauksille tai alentaa kohtauskynnystä (esim. vaikea aivoarterioskleroosi, aikaisempi kouristukset, aivojen verenkierron heikkeneminen, aivojen muuttuminen rakenne tai aivohalvaus) tai jos on muita riskitekijöitä, jotka voivat altistaa kohtauksille tai alentaa kohtauskynnystä (esimerkiksi tietty lääkehoito, munuaisten vajaatoiminta). Jos kouristuskohtauksia ilmenee, lopeta CIPRO 500 mg:n käyttö ja aloita asianmukainen hoito [ks. HAITTAVAIKUTUKSET ja HUUMEIDEN VUOROVAIKUTUKSET ].
Myasthenia Gravisin paheneminen
Fluorokinoloneilla, mukaan lukien CIPRO, on hermo-lihassalpaava vaikutus ja ne voivat pahentaa lihasheikkoutta potilailla, joilla on myasthenia gravis. Markkinoille tulon jälkeisiä vakavia haittavaikutuksia, mukaan lukien kuolemat ja hengitystuen tarve, on liitetty fluorokinolonien käyttöön potilailla, joilla on myasthenia gravis. Vältä CIPRO:ta potilailla, joilla on aiemmin ollut myasthenia gravis [katso HAITTAVAIKUTUKSET ].
Muut vakavat ja joskus kohtalokkaat haittavaikutukset
Muita vakavia ja joskus kuolemaan johtavia haittavaikutuksia, joista osa johtuu yliherkkyydestä ja osa epävarmasta etiologiasta, on raportoitu potilailla, jotka ovat saaneet kinoloneja, mukaan lukien CIPRO:ta. Nämä tapahtumat voivat olla vakavia ja ilmaantuvat yleensä useiden annosten antamisen jälkeen. Kliiniset oireet voivat sisältää yhden tai useamman seuraavista:
- Kuume, ihottuma tai vakavat dermatologiset reaktiot (esimerkiksi toksinen epidermaalinen nekrolyysi, Stevens-Johnsonin oireyhtymä);
- Vaskuliitti; nivelkipu; myalgia; seerumitauti;
- Allerginen pneumoniitti;
- Interstitiaalinen nefriitti; akuutti munuaisten vajaatoiminta tai vajaatoiminta;
- hepatiitti; keltaisuus; akuutti maksanekroosi tai maksan vajaatoiminta;
- Anemia, mukaan lukien hemolyyttinen ja aplastinen; trombosytopenia, mukaan lukien tromboottinen trombosytopeeninen purppura; leukopenia; agranulosytoosi; pansytopenia; ja/tai muut hematologiset poikkeavuudet.
Lopeta CIPRO 500 mg:n käyttö heti, kun ihottumaa, keltaisuutta tai mitä tahansa muuta yliherkkyysmerkkiä ilmaantuu ja tukitoimenpiteitä on aloitettu [ks. HAITTAVAIKUTUKSET ].
Yliherkkyysreaktiot
Vakavia ja joskus kuolemaan johtaneita yliherkkyysreaktioita (anafylaktisia) reaktioita, joista osa on seurannut ensimmäisen annoksen, on raportoitu potilailla, jotka ovat saaneet fluorokinolonihoitoa, mukaan lukien CIPRO. Joihinkin reaktioihin liittyi kardiovaskulaarinen romahdus, tajunnan menetys, pistely, nielun tai kasvojen turvotus, hengenahdistus, urtikaria ja kutina. Vain muutamalla potilaalla on ollut yliherkkyysreaktioita. Vakavat anafylaktiset reaktiot vaativat välitöntä hätähoitoa adrenaliinilla ja muilla elvytystoimenpiteillä, mukaan lukien happi, suonensisäiset nesteet, suonensisäiset antihistamiinit, kortikosteroidit, paineita aiheuttavat amiinit ja hengitysteiden hallinta, mukaan lukien intubaatio, kuten on osoitettu [ks. HAITTAVAIKUTUKSET ].
Maksatoksisuus
CIPRO:n käytön yhteydessä on raportoitu vakavia maksatoksisuustapauksia, mukaan lukien maksanekroosi, henkeä uhkaava maksan vajaatoiminta ja kuolemaan johtaneet tapahtumat. Akuutti maksavaurio alkaa nopeasti (vaihteluväli 1–39 päivää), ja siihen liittyy usein yliherkkyys. Vamman malli voi olla hepatosellulaarinen, kolestaattinen tai sekamuotoinen. Useimmat kuolemaan johtaneet potilaat olivat yli 55-vuotiaita. Jos havaitset hepatiitin merkkejä ja oireita (kuten anoreksia, keltaisuus, tumma virtsa, kutina tai arka vatsa), lopeta hoito välittömästi.
Transaminaasien, alkalisen fosfataasin tai kolestaattisen keltaisuuden tilapäistä nousua voi esiintyä, erityisesti potilailla, joilla on aiemmin ollut maksavaurio ja joita hoidetaan CIPRO:lla [ks. HAITTAVAIKUTUKSET ].
Aortan aneurysman ja dissektion riski
Epidemiologiset tutkimukset raportoivat aortan aneurysman ja dissektion lisääntyneen kahden kuukauden kuluessa fluorokinolonien käytöstä, erityisesti iäkkäillä potilailla. Lisääntyneen riskin syytä ei ole tunnistettu. Varaa CIPRO 750 mg potilaille, joilla on tunnettu aortan aneurysma tai joilla on suurempi riski saada aortan aneurysma, vain silloin, kun vaihtoehtoisia antibakteerisia hoitoja ei ole saatavilla.
Vakavat haittavaikutukset samanaikaisen teofylliinin kanssa
Vakavia ja kuolemaan johtaneita reaktioita on raportoitu potilailla, jotka ovat saaneet samanaikaisesti CIPRO 250 mg:n ja teofylliinin käyttöä. Näitä reaktioita ovat olleet sydämenpysähdys, kouristukset, status epilepticus ja hengitysvajaus. Myös pahoinvointia, oksentelua, vapinaa, ärtyneisyyttä tai sydämentykytystapauksia on esiintynyt.
Vaikka samanlaisia vakavia haittavaikutuksia on raportoitu pelkästään teofylliiniä saaneilla potilailla, mahdollisuutta, että CIPRO voi vahvistaa näitä reaktioita, ei voida poistaa. Jos samanaikaista käyttöä ei voida välttää, seuraa teofylliinin seerumipitoisuuksia ja säädä annosta tarvittaessa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Clostridioides Difficile -bakteeriin liittyvä ripuli
Clostridioides difficileen (C. difficile) liittyvää ripulia (CDAD) on raportoitu käytettäessä lähes kaikkia antibakteerisia aineita, mukaan lukien CIPRO, ja sen vaikeusaste voi vaihdella lievästä ripulista kuolemaan johtavaan paksusuolentulehdukseen. Hoito antibakteerisilla aineilla muuttaa paksusuolen normaalia kasvillisuutta, mikä johtaa C. difficilen liikakasvuun.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CDAD:n kehittymistä. Hypertoksiinia tuottavat C. difficilen isolaatit lisäävät sairastuvuutta ja kuolleisuutta, koska nämä infektiot voivat olla vastustuskykyisiä antimikrobiselle hoidolle ja saattavat vaatia kolektomiaa. CDAD on otettava huomioon kaikilla potilailla, joilla on ripulia antibakteeristen lääkkeiden käytön jälkeen. Huolellinen sairaushistoria on tarpeen, koska CDAD:n on raportoitu esiintyvän yli kaksi kuukautta antibakteeristen aineiden annon jälkeen.
Jos CDAD epäillään tai varmistetaan, jatkuva antibakteerinen käyttö, joka ei ole suunnattu C. difficileä vastaan, saattaa olla tarpeen lopettaa. Asianmukainen nesteen ja elektrolyyttipitoisuuden hallinta, proteiinilisä, C. difficilen antibakteerinen hoito ja kliinisen tarpeen mukaan kirurginen arviointi [ks. HAITTAVAIKUTUKSET ].
QT-ajan pidentyminen
Jotkut fluorokinolonit, mukaan lukien CIPRO 750 mg, on yhdistetty QT-ajan pidentymiseen EKG:ssa ja rytmihäiriötapauksiin. Torsade de pointes -tapauksia on raportoitu markkinoille tulon jälkeisen seurannan aikana potilailla, jotka ovat saaneet fluorokinoloneja, mukaan lukien CIPRO.
Vältä CIPRO 1000 mg:n antamista potilaille, joilla tiedetään pidentyneen QT-aikaa, QT-ajan pidentymisen tai torsade de pointesin riskitekijöitä (esim. synnynnäinen pitkä QT-oireyhtymä, korjaamaton elektrolyyttitasapainohäiriö, kuten hypokalemia tai hypomagnesemia ja sydänsairaus, kuten sydämen vajaatoiminta, sydänlihas infarkti tai bradykardia) ja potilaat, jotka saavat luokan IA rytmihäiriölääkkeitä (kinidiini, prokaiiniamidi) tai luokan III rytmihäiriölääkkeitä (amiodaroni, sotaloli), trisyklisiä masennuslääkkeitä, makrolideja ja psykoosilääkkeitä. Iäkkäät potilaat voivat myös olla herkempiä lääkkeisiin liittyville vaikutuksille QT-välissä [katso HAITTAVAIKUTUKSET , Käyttö tietyissä populaatioissa ].
Tuki- ja liikuntaelinten sairaudet lapsipotilailla ja artropaattiset vaikutukset eläimillä
CIPRO 250 mg on tarkoitettu lapsipotilaille (alle 18-vuotiaille) vain cUTI:n, inhaloitavan pernaruton (altistuksen jälkeen) ja ruton ehkäisyyn (ks. KÄYTTÖAIHEET JA KÄYTTÖ ]. Haittavaikutusten ilmaantuvuuden on havaittu lisääntyneen verrokkeihin verrattuna, mukaan lukien niveliin ja/tai ympäröiviin kudoksiin liittyvät reaktiot [ks. HAITTAVAIKUTUKSET ].
Prekliinisissä tutkimuksissa CIPRO:n oraalinen antaminen aiheutti ontumista kehittymättömillä koirilla. Näiden koirien painoa kantavien nivelten histopatologinen tutkimus paljasti pysyviä rustovaurioita. Aiheeseen liittyvät kinoloniluokan lääkkeet aiheuttavat myös painoa kantavien nivelten ruston eroosiota ja muita nivelsairauksien merkkejä eri lajien kehittymättömissä eläimissä [ks. Käyttö tietyissä populaatioissa ja Ei-kliininen toksikologia ].
Valoherkkyys/valotoksisuus
Keskivaikeat tai vaikeat valoherkkyys-/valotoksisuusreaktiot, joista jälkimmäinen voi ilmetä liioitelluina auringonpolttamina (esimerkiksi polttamisena, punoituksena, eritteenä, rakkuloina, rakkuloina, turvotuksena), jotka koskevat valolle alttiita alueita (tyypillisesti kasvot, ihon V-alue). niska, käsivarsien ojentajapinnat, käsien selkä), voivat liittyä kinolonien, mukaan lukien CIPRO, käyttöön auringon tai UV-säteilyn jälkeen. Vältä siksi liiallista altistumista näille valonlähteille. Lopeta CIPRO 250mg, jos fototoksisuutta ilmenee [katso HAITTAVAIKUTUKSET ].
Lääkeresistenttien bakteerien kehittäminen
CIPRO 250 mg -tablettien ja CIPRO-oraalisuspension määrääminen ilman todistettua tai vahvasti epäiltyä bakteeri-infektiota tai profylaktista indikaatiota ei todennäköisesti hyödytä potilasta ja lisää lääkeresistenttien bakteerien kehittymisen riskiä.
Sytokromi P450 1A2 -entsyymien metaboloimien lääkkeiden samanaikaisen käytön mahdolliset riskit
CIPRO 750mg on maksan CYP1A2-entsyymireitin estäjä. CIPRO:n ja muiden ensisijaisesti CYP1A2:n kautta metaboloituvien lääkkeiden (esim. teofylliini, metyyliksantiinit, kofeiini, titsanidiini, ropiniroli, klotsapiini, olantsapiini ja tsolpideemi) samanaikainen anto johtaa samanaikaisesti annetun lääkkeen plasmapitoisuuksien suurenemiseen ja voi johtaa kliinisesti merkittäviin samanaikaisesti annetun lääkkeen farmakodynaamiset haittavaikutukset [katso HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA ].
Häiritseminen kupan oikea-aikaiseen diagnoosiin
CIPRO 1000mg:n ei ole osoitettu olevan tehokas kupan hoidossa. Antimikrobiset aineet, joita käytetään suurina annoksina lyhyitä aikoja tippurin hoitoon, voivat peittää tai viivästyttää inkuboivan kupan oireita. Suorita serologinen kupan testi kaikille gonorreapotilaille diagnoosin yhteydessä. Suorita kupan serologinen seurantatesti kolme kuukautta CIPRO-hoidon jälkeen.
Crystalluria
Siprofloksasiinin kiteitä on havaittu harvoin ihmisten virtsassa, mutta useammin koe-eläinten virtsassa, joka on yleensä emäksistä [ks. Ei-kliininen toksikologia ]. CIPRO:hon liittyvää kristalluriaa on raportoitu vain harvoin ihmisillä, koska ihmisen virtsa on yleensä hapanta. Vältä virtsan alkalisuutta potilailla, jotka saavat CIPRO:ta. Kostuta potilaat hyvin estääksesi erittäin väkevän virtsan muodostumisen [katso ANNOSTELU JA HALLINNOINTI ].
Verensokerin häiriöt
Fluorokinoloneihin, mukaan lukien CIPRO, on liittynyt verensokerihäiriöitä, mukaan lukien oireinen hyperglykemia ja hypoglykemia, yleensä diabeetikoilla, jotka saavat samanaikaisesti hoitoa suun kautta otettavalla hypoglykeemisellä aineella (esimerkiksi glyburidilla) tai insuliinilla. Näillä potilailla suositellaan verensokerin huolellista seurantaa. Vakavia hypoglykemiatapauksia, jotka ovat johtaneet koomaan tai kuolemaan, on raportoitu. Jos CIPRO-hoitoa saavalla potilaalla ilmenee hypoglykeeminen reaktio, keskeytä CIPRO 750 mg:n käyttö ja aloita sopiva hoito välittömästi [ks. HAITTAVAIKUTUKSET , HUUMEIDEN VUOROVAIKUTUKSET ].
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas )
Vakavat haittavaikutukset
Neuvo potilaita lopettamaan CIPRO 250 mg:n käyttö, jos heillä on haittavaikutus, ja soittamaan terveydenhuollon tarjoajalle neuvoja täyden hoitojakson suorittamisesta toisella antibakteerisella lääkkeellä.
Kerro potilaille seuraavista vakavista haittavaikutuksista, jotka ovat liittyneet CIPRO:n tai muun fluorokinolonin käyttöön:
- Vakavat ja mahdollisesti peruuttamattomat vakavat haittavaikutukset, joita voi esiintyä yhdessä: Kerro potilaille, että CIPRO 1000 mg:n käyttöön on liittynyt vammauttavia ja mahdollisesti peruuttamattomia vakavia haittavaikutuksia, mukaan lukien jännetulehdus ja jänteen repeämä, perifeeriset neuropatiat ja keskushermostovaikutukset, ja niitä voi esiintyä yhdessä samalla potilaalla. Kerro potilaille, että he lopettavat CIPRO:n käytön välittömästi, jos heillä on haittavaikutus, ja soita terveydenhuollon tarjoajalleen.
- Jännetulehdus ja jänteen repeämä: Neuvo potilaita ottamaan yhteyttä terveydenhuollon tarjoajaan, jos he kokevat kipua, turvotusta tai jännetulehdusta tai heikkoutta tai kyvyttömyyttä käyttää jotakin nivelistä; lepää ja pidättäydy harjoituksesta; ja lopeta CIPRO 750 mg -hoito. Oireet voivat olla peruuttamattomia. Fluorokinolonien käytön riski vakavaan jännehäiriöön on suurempi vanhemmilla, yleensä yli 60-vuotiailla potilailla, kortikosteroidilääkkeitä käyttävillä potilailla sekä potilailla, joille on tehty munuais-, sydän- tai keuhkosiirto.
- Perifeeriset neuropatiat: Kerro potilaille, että perifeerisiä neuropatioita on yhdistetty siprofloksasiinin käyttöön. Oireet voivat ilmaantua pian hoidon aloittamisen jälkeen ja voivat olla peruuttamattomia. Jos perifeerisen neuropatian oireita, kuten kipua, kirvelyä, pistelyä, puutumista ja/tai heikkoutta, ilmaantuu, lopeta CIPRO-hoito välittömästi ja pyydä häntä ottamaan yhteyttä lääkäriin.
- Keskushermoston vaikutukset (esimerkiksi kouristukset, huimaus, huimaus, kohonnut kallonsisäinen paine): Kerro potilaille, että kouristuksia on raportoitu potilailla, jotka saavat fluorokinoloneja, mukaan lukien Ciprofloxacin. Neuvo potilaita ilmoittamaan lääkärilleen ennen tämän lääkkeen ottamista, jos heillä on ollut kouristuksia. Kerro potilaille, että heidän tulee tietää, miten he reagoivat CIPRO:hon ennen kuin he käyttävät autoa tai koneita tai ryhtyvät muihin toimiin, jotka vaativat henkistä valppautta ja koordinaatiota. Neuvo potilaita ilmoittamaan lääkärilleen, jos esiintyy jatkuvaa päänsärkyä näön hämärtymisen kanssa tai ilman.
- Myasthenia Gravisin paheneminen: Neuvo potilaita ilmoittamaan lääkärilleen kaikista myasthenia graviksen aiemmista. Neuvo potilaita ilmoittamaan lääkärilleen, jos heillä on lihasheikkouden oireita, mukaan lukien hengitysvaikeudet.
- Yliherkkyysreaktiot: Kerro potilaille, että siprofloksasiini voi aiheuttaa yliherkkyysreaktioita jopa kerta-annoksen jälkeen, ja lääkkeen käyttö on lopetettava heti, kun havaitaan ensimmäiset merkit ihottumasta, nokkosihottumasta tai muista ihoreaktioista, nopeasta sydämen sykkeestä, nielemis- tai hengitysvaikeuksista, turvotuksesta, joka viittaa angioedeemaan ( esimerkiksi huulten, kielen, kasvojen turvotus, kurkun kireys, käheys) tai muut allergisen reaktion oireet.
- Maksatoksisuus: Kerro potilaille, että CIPRO:ta käyttävillä potilailla on raportoitu vakavia maksatoksisuutta (mukaan lukien akuutti hepatiitti ja kuolemaan johtaneet tapahtumat). Neuvo potilaita ilmoittamaan lääkärilleen, jos he kokevat maksavaurion merkkejä tai oireita, mukaan lukien ruokahaluttomuus, pahoinvointi, oksentelu, kuume, heikkous, väsymys, oikean yläneljänneksen arkuus, kutina, ihon ja silmien keltaisuus, vaaleat suolen liikkeet tai tumma virtsa.
- Aortan aneurysma ja dissektio: Kerro potilaille hakeutumaan ensiapuun, jos he kokevat äkillistä rinta-, vatsa- tai selkäkipua.
- Ripuli: Ripuli on yleinen antibioottien aiheuttama ongelma, joka yleensä loppuu, kun antibioottihoito lopetetaan. Joskus antibioottihoidon aloittamisen jälkeen potilaille voi ilmaantua vetisiä ja verisiä ulosteita (vatsakouristuksella ja kuumeella tai ilman) jopa kahden tai useamman kuukauden kuluttua viimeisen antibioottiannoksen ottamisesta. Jos näin tapahtuu, kehota potilaita ottamaan yhteyttä lääkäriin mahdollisimman pian.
- QT-ajan pidentyminen: Neuvo potilaita ilmoittamaan lääkärilleen kaikista henkilökohtaisista tai suvussa esiintyneistä QT-ajan pitenemisestä tai rytmihäiriöistä, kuten hypokalemiasta, bradykardiasta tai äskettäisestä sydänlihaksen iskemiasta; jos he käyttävät luokan IA (kinidiini, prokaiiniamidi) tai luokan III (amiodaroni, sotaloli) rytmihäiriölääkkeitä. Neuvo potilaita ilmoittamaan lääkärilleen, jos heillä on QT-ajan pitenemisen oireita, mukaan lukien pitkittynyt sydämentykytys tai tajunnan menetys.
- Tuki- ja liikuntaelinten sairaudet lapsipotilailla: Neuvo vanhempia ilmoittamaan lapsensa lääkärille, jos lapsella on ollut nivelongelmia ennen tämän lääkkeen ottamista. Ilmoita lapsipotilaiden vanhempia ilmoittamaan lastensa lääkärille kaikista niveliin liittyvistä ongelmista, joita esiintyy cipro 1000mgfloksasiinihoidon aikana tai sen jälkeen [ks. VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
- Titsanidiini: Neuvo potilaita olemaan käyttämättä Cipro 250mgfloxacinia, jos he jo käyttävät titsanidiinia. CIPRO lisää titsanidiinin (Zanaflex®) vaikutuksia.
- Teofylliini: Kerro potilaille, että cipro 250mgfloxacin CIPRO 1000mg voi lisätä teofylliinin vaikutuksia. Henkeä uhkaavia keskushermostovaikutuksia ja rytmihäiriöitä voi esiintyä. Neuvo potilaita hakeutumaan välittömästi lääkärin hoitoon, jos heillä on kohtauksia, sydämentykytystä tai hengitysvaikeuksia.
- Kofeiini: Kerro potilaille, että CIPRO 500 mg voi lisätä kofeiinin vaikutuksia. Kofeiinin kertyminen on mahdollista, kun kofeiinia sisältäviä tuotteita nautitaan kinolonien käytön aikana.
- Valoherkkyys/valotoksisuus: Kerro potilaille, että valoherkkyyttä/fototoksisuutta on raportoitu potilailla, jotka saavat fluorokinoloneja. Kerro potilaille, että he minimoivat tai välttävät altistumista luonnolliselle tai keinotekoiselle auringonvalolle (solariumit tai UVA/B-hoito) kinolonien käytön aikana. Jos potilaat joutuvat olemaan ulkona kinolonien käytön aikana, kehota heitä käyttämään väljiä vaatteita, jotka suojaavat ihoa auringolta ja keskustele lääkärin kanssa muista auringonsuojatoimenpiteistä. Jos ilmaantuu auringonpolttaman kaltainen reaktio tai ihottuma, kehota potilaita ottamaan yhteyttä lääkäriin.
- Verensokerin häiriöt: Kerro potilaille, että jos he ovat diabeetikoita ja heitä hoidetaan insuliinilla tai suun kautta otettavalla hypoglykeemisellä aineella ja hypoglykeeminen reaktio ilmenee, heidän tulee keskeyttää CIPRO 250mg -hoito ja kääntyä lääkärin puoleen.
- Imetys: Muiden käyttöaiheiden kuin inhalaatioperäisen pernaruton (altistuksen jälkeen) tapauksessa kerro naiselle, että imettämistä ei suositella Cipro-hoidon aikana eikä vielä 2 päivää viimeisen annoksen jälkeen. Vaihtoehtoisesti nainen voi pumpata ja hävittää hoidon aikana ja vielä 2 päivää viimeisen annoksen jälkeen [katso Käyttö tietyissä populaatioissa ].
Antibakteerinen vastustuskyky
Kerro potilaille, että antibakteerisia lääkkeitä, mukaan lukien CIPRO 250 mg -tabletit ja CIPRO 1000 mg -oraalisuspensio, tulee käyttää vain bakteeri-infektioiden hoitoon. Niillä ei hoideta virusinfektioita (esimerkiksi flunssaa). Kun CIPRO 500mg -tabletteja ja CIPRO 500mg -oraalisuspensiota määrätään bakteeri-infektion hoitoon, potilaille tulee kertoa, että vaikka on yleistä, että olo paranee hoidon alussa, lääke tulee ottaa täsmälleen ohjeiden mukaan. Annosten väliin jättäminen tai koko hoitojakson suorittamatta jättäminen voi (1) heikentää välittömän hoidon tehokkuutta ja (2) lisätä todennäköisyyttä, että bakteerit kehittävät resistenssiä ja joita ei voida hoitaa CIPRO 500 mg tableteilla ja CIPRO 250 mg oraalisuspensiolla tai muilla antibakteerisilla aineilla. huumeita tulevaisuudessa.
Hallinto-ohjeet
Ohjaa potilasta
- Ravista CIPRO-oraalisuspensiota voimakkaasti joka kerta ennen käyttöä noin 15 sekunnin ajan.
- Käytä aina mukana pakattua mittalusikkaa, jossa on merkinnät ½ (2,5 ml) ja 1/1 (5 ml), saadaksesi tarkan annoksen.
- Käytön jälkeen mittalusikka tulee puhdistaa juoksevan veden alla ja astianpesuaineella ja kuivata huolellisesti.
- Ei pureskella mikrokapseleita, vaan niellä ne kokonaisina.
- Se vesi voidaan ottaa jälkeenpäin.
- Sulje pullo kunnolla jokaisen käyttökerran jälkeen korkin ohjeiden mukaisesti.
- Hoidon päätyttyä CIPRO 1000 mg oraalisuspensiota ei saa käyttää uudelleen.
Kerro potilaille, että CIPRO 250 mg voidaan ottaa ruoan kanssa tai ilman.
Pyydä potilaita juomaan runsaasti nesteitä CIPRO:n käytön aikana, jotta vältytään erittäin väkevöidyn virtsan ja kiteiden muodostumiselta virtsaan.
Kerro potilaille, että magnesiumia tai alumiinia sekä sukralfaattia, metallikationeja, kuten rautaa ja monivitamiinivalmisteita, joissa on sinkkiä tai didanosiinia, sisältävät antasidit tulee ottaa vähintään kaksi tuntia ennen CIPRO 1000 mg:n antoa tai kuusi tuntia sen jälkeen. CIPRO:ta ei tule ottaa pelkän maitotuotteiden (kuten maidon tai jogurtin) tai kalsiumpitoisten mehujen kanssa, koska siprofloksasiinin imeytyminen voi heikentyä merkittävästi. CIPRO 500mg voidaan kuitenkin ottaa näitä tuotteita sisältävän aterian yhteydessä.
Kerro potilaille, että jos annos jää väliin, se tulee ottaa milloin tahansa, mutta viimeistään 6 tuntia ennen seuraavaa suunniteltua annosta. Jos seuraavaan annokseen on jäljellä alle 6 tuntia, unohtunutta annosta ei saa ottaa ja hoitoa on jatkettava seuraavan aikataulun mukaisen annoksen mukaisesti. Kaksinkertaista annosta ei tule ottaa kompensoimaan unohtunutta annosta.
Kerro potilaille, että CIPRO 500 mg -tabletit (250 mg ja 500 mg) pisteytetään ja ne voidaan jakaa puoleen uurreviivalla, jotta saadaan 125 mg tai 250 mg vahvuus.
Lääkevuorovaikutukset Oraaliset diabeteslääkkeet
Kerro potilaille, että hypoglykemiaa on raportoitu, kun sipro 250mgfloksasiinia ja suun kautta otettavia diabeteslääkkeitä on annettu samanaikaisesti; Jos CIPRO 750mg:n käytön aikana ilmenee alhainen verensokeri, neuvo heitä ottamaan yhteyttä lääkäriin ja että heidän antibakteerinen lääkeaine on ehkä vaihdettava.
Pernarutto- ja ruttotutkimukset
Kerro potilaille, joille on annettu CIPRO:ta näiden sairauksien vuoksi, että tehokkuustutkimuksia ei voida tehdä ihmisillä toteutettavuussyistä. Siksi näiden tilojen hyväksyminen perustui eläimillä tehtyihin tehokkuustutkimuksiin.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Cipro 500mgfloksasiinilla on suoritettu kahdeksan in vitro mutageenisuustestiä, ja testitulokset on lueteltu alla:
- Salmonella/Mikrosomitesti (negatiivinen)
- E. coli DNA Repair Assay (negatiivinen)
- Hiiren lymfoomasolujen eteenpäin suuntautuva mutaatiomääritys (positiivinen)
- Kiinanhamsterin V79-solujen HGPRT-testi (negatiivinen)
- Syyrianhamsterin alkiosolutransformaatiomääritys (negatiivinen)
- Saccharomyces cerevisiae -pistemutaatiomääritys (negatiivinen)
- Saccharomyces cerevisiae Mitotic Crossover and Gene Conversion Assay (negatiivinen)
- Rotan maksasolujen DNA:n korjausmääritys (positiivinen)
Näin ollen 2 kahdeksasta testistä oli positiivinen, mutta seuraavan kolmen in vivo -testijärjestelmän tulokset antoivat negatiiviset tulokset:
- Rotan hepatosyyttien DNA:n korjausmääritys
- Mikrotumatesti (hiiret)
- Dominoiva tappava testi (hiiret)
Pitkäaikaiset karsinogeenisuustutkimukset rotilla ja hiirillä eivät johtaneet karsinogeenisiin tai kasvaimia aiheuttaviin vaikutuksiin, jotka johtuivat sipro 500 mgfloksasiinista vuorokausiannoksilla 250 mg/kg asti ja 750 mg/kg hiirillä (noin 1,7 ja 2,5 kertaa). suurin suositeltu terapeuttinen annos, joka perustuu kehon pinta-alaan).
Valokuvien yhteiskarsinogeenisuustestien tulokset osoittavat, että cipro 1000 mgfloksasiini ei lyhennä UV-indusoitujen ihokasvainten ilmaantumiseen kuluvaa aikaa verrattuna vehikkelikontrolliin. Karvattomat (Skh-1) hiiret altistettiin UVA-valolle 3,5 tunnin ajan viisi kertaa joka toinen viikko 78 viikon ajan, samalla kun heille annettiin siprofloksasiinia. Aika ensimmäisten ihokasvainten kehittymiseen oli 50 viikkoa hiirillä, joita hoidettiin samanaikaisesti UVA:lla ja siprolla 1000 mgfloksasiinilla (hiiren annos, joka on suunnilleen sama kuin ihmiselle suositeltu enimmäisannos kehon pinta-alan perusteella), kun taas 34 viikkoa, kun eläimiä hoidettiin molemmilla UVA-säteilyllä. ja ajoneuvo. Ihokasvainten kehittymisajat vaihtelivat 16 viikosta 32 viikkoon hiirillä, joita hoidettiin samanaikaisesti UVA:lla ja muilla kinoloneilla.
Tässä mallissa pelkällä siprofloksasiinilla hoidetut hiiret eivät kehittäneet iho- tai systeemisiä kasvaimia. Ei ole tietoja vastaavista malleista, joissa on käytetty pigmentoituja hiiriä ja/tai täysin karvaisia hiiriä. Näiden löydösten kliinistä merkitystä ihmisille ei tunneta.
Uros- ja naarasrotilla tehdyt hedelmällisyystutkimukset sipron 250 mgfloksasiinin oraalisilla annoksilla enintään 100 mg/kg (noin 0,6 kertaa korkein suositeltu suun kautta otettava annos kehon pinta-alan perusteella) eivät osoittaneet heikentymistä. Urosrotat saivat suun kautta siprofloksasiinia 10 viikon ajan ennen parittelua ja naaraat 3 viikkoa ennen parittelua 7. raskauspäivään asti.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Pitkäaikainen kokemus cipro 1000mgfloksasiinista raskaana olevilla naisilla useiden vuosikymmenten ajalta, perustuen saatavilla oleviin julkaistuihin tietoihin tapausraporteista, tapauskontrollitutkimuksista ja havainnointitutkimuksista cipro 1000mgfloksasiinista raskauden aikana annetusta cipro 1000mgfloksasiinista, ei ole osoittanut lääkkeeseen liittyvää vakavien synnynnäisten epämuodostumien, keskenmenon tai haittavaikutusten riskiä. äidin tai sikiön seuraukset (ks Data ). Cipro 500mgfloksasiinin oraalinen anto organogeneesin aikana annoksina 100 mg/kg asti tiineille hiirille ja rotille ja 30 mg/kg asti tiineille kaneille ei aiheuttanut sikiön epämuodostumia (ks. Data ). Nämä annokset olivat jopa 0,3-kertaisia, 0,6- ja 0,4-kertaisia hiirillä, rotilla ja kaniineilla kehon pinta-alan perusteella suositeltuun enimmäisannostukseen verrattuna. Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Data
Ihmistiedot
Vaikka saatavilla olevat tutkimukset eivät pysty lopullisesti osoittamaan riskin puuttumista, useiden vuosikymmenien ajalta tulevista havainnointitutkimuksista julkaistut tiedot eivät ole osoittaneet yhteyttä cipro 250 mgfloksasiinin käyttöön raskauden aikana ja vakavien synnynnäisten epämuodostumien, keskenmenon tai haitallisten äidin tai sikiön seurausten kanssa. Käytettävissä olevilla tutkimuksilla on metodologisia rajoituksia, mukaan lukien pieni näytekoko, ja jotkin niistä eivät ole spesifisiä siprofloksasiinille. Kontrolloidussa prospektiivisessa havainnointitutkimuksessa seurattiin 200 naista, jotka olivat altistuneet fluorokinoloneille (52,5 % siprolle 250 mgfloksasiinille ja 68 % ensimmäisen raskauskolmanneksen altistumisesta). In utero altistuminen fluorokinoloneille alkion synnyn aikana ei lisännyt vakavien epämuodostumien riskiä. Vakavien synnynnäisten epämuodostumien raportoitu määrä oli 2,2 % fluorokinoloniryhmässä ja 2,6 % kontrolliryhmässä (vakavien epämuodostumien taustaepämuodostumien esiintyvyys on 1–5 %). Spontaanien aborttien, keskosten ja alhaisen syntymäpainon määrät eivät eronneet ryhmien välillä, eikä kliinisesti merkittäviä tuki- ja liikuntaelimistön toimintahäiriöitä ollut alle vuoden ikään asti cipro 500 mgfloksasiinille altistetuilla lapsilla.
Toisessa prospektiivisessa seurantatutkimuksessa raportoitiin 549 raskaudesta fluorokinolonille (93 % ensimmäisen raskauskolmanneksen altistumisesta). Cipro 500 mgfloksasiinille altistettiin 70 kertaa, kaikki ensimmäisen raskauskolmanneksen aikana. Epämuodostumien määrä elävänä syntyneillä vauvoilla, jotka olivat altistuneet siprolle 750 mgfloksasiinille ja fluorokinoloneille, olivat molemmat taustalla. Mitään erityisiä synnynnäisten epämuodostumien kuvioita ei löydetty. Tutkimus ei paljastanut selkeitä haittavaikutuksia, jotka johtuisivat kohdussa altistumisesta siprofloksasiinille.
Siprofloksasiinille raskauden aikana altistuneilla naisilla ei havaittu eroja keskosten, spontaanien aborttien tai syntymäpainon välillä. Nämä pienet markkinoille tulon jälkeiset epidemiologiset tutkimukset, joista suurin osa on saatu lyhytaikaisesta, ensimmäisen raskauskolmanneksen altistumisesta, eivät kuitenkaan riitä arvioimaan vähemmän yleisten vaurioiden riskiä tai tekemään luotettavia ja lopullisia johtopäätöksiä siprofloksasiinin turvallisuudesta raskaana oleville naisille ja heidän kehittyville sikiöilleen. .
Eläinten tiedot
Kehitystoksikologisia tutkimuksia on suoritettu cipro 500mgfloksasiinilla rotilla, hiirillä ja kaniineilla. Rotilla ja hiirillä oraalisilla annoksilla 100 mg/kg asti organogeneesin aikana (Gestation Days, GD, 6-17) ei liittynyt haitallisia kehitystuloksia, mukaan lukien alkio- ja sikiötoksisuus tai epämuodostumat. Rotilla ja hiirillä 100 mg/kg annos on noin 0,6 ja 0,3 kertaa ihmisen suurin vuorokausiannos suun kautta (1500 mg/vrk) kehon pinta-alan perusteella. Sarjassa kaniinin kehitystoksikologisia tutkimuksia hän sai suun kautta tai suonensisäisesti siproa 250 mgfloksasiinia jonakin seuraavista 5 päivän ajanjaksoista: GD 6–10, GD 10–14 tai GD 14–18, jotka on tarkoitettu kattamaan organogeneesin ajanjakso. Tällä yritettiin lieventää antibakteerisia lääkkeitä saavilla kaniineilla havaittua ruoansulatuskanavan intoleranssia, joka ilmeni vähentyneenä emon ruuankulutuksena ja painonpudotuksena, mikä voi johtaa alkion ja sikiön resorptioon tai spontaaniin aborttiin. Suun kautta otettu cipro 750 mgfloksasiiniannos 100 mg/kg (noin 1,3 kertaa suurin suositeltu kliininen suun kautta otettava annos kehon pinta-alaan perustuen) aiheutti liiallista emomyrkyllisyyttä, mikä hämmensi sikiöiden arviointia. Suun kautta annettuun 30 mg/kg:n annokseen (noin 0,4 kertaa suurin suositeltu kliininen suun kautta otettava annos) liittyi äidin ja sikiön painonnousun hillitseminen, mutta sikiön epämuodostumia ei havaittu. Enintään 20 mg/kg:n (noin 0,3 kertaa suurin suositeltu kliininen suun kautta otettava annos kehon pinta-alan perusteella) suonensisäinen anto tiineille kaniineille ei ollut emolle toksista, eikä alkio- ja sikiötoksisuutta tai sikiön epämuodostumia havaittu.
Peri- ja postnataalisissa tutkimuksissa rotat saivat siproa 1000 mgfloksasiinia 200 mg/kg/vrk asti (suun kautta) tai 30 mg/kg/vrk (subkutaanisesti) GD:stä 16–22 päivää synnytyksen jälkeen. 200 mg/kg annos on noin 1,3 kertaa suurin suositeltu kliininen suun kautta otettava annos kehon pinta-alan perusteella. Ei havaittu emolle toksisuutta eikä haitallisia vaikutuksia pentujen kasvuun ja kehitykseen, mukaan lukien merkkejä niveltulehduksesta pentujen takanivelissä. Siprofloksasiinin ja muiden kinolonien on osoitettu aiheuttavan artropatiaa useimpien testattujen lajien epäkypsillä eläimillä, kun niitä annettiin suoraan [ks. VAROITUKSET JA VAROTOIMET ja Ei-kliininen toksikologia ].
Imetys
Riskien yhteenveto
Julkaistu kirjallisuus raportoi, että cipro 1000mgfloksasiini erittyy äidinmaitoon suonensisäisen ja suun kautta antamisen jälkeen. CIPRO:n vaikutuksista maidontuotantoon tai imetettävään lapseen ei ole tietoa. Koska rintaruokitetuilla imeväisillä on mahdollinen vakavien haittavaikutusten riski, mukaan lukien nuorilla eläimillä tehdyissä tutkimuksissa osoitettu artropatia [ks. Käyttö tietyissä populaatioissa (Kliiniset näkökohdat)], useimmissa käyttöaiheissa imettävä nainen voi harkita äidinmaidon pumppaamista ja poistamista CIPRO 500 mg -hoidon aikana ja vielä kaksi päivää (viisi puoliintumisaikaa) viimeisen annoksen jälkeen. Vaihtoehtoisesti kerro naiselle, että imetystä ei suositella CIPRO-hoidon aikana ja vielä kahden päivän ajan (viisi puoliintumisaikaa) viimeisen annoksen jälkeen.
Kuitenkin inhaloitavan pernaruton (altistumisen jälkeen) tapauksessa pernaruttoaltistukseen johtaneen tapahtuman aikana imetyksen jatkamisen riski-hyötyarviointi voi olla hyväksyttävää äidin (ja mahdollisesti vauvan) saaessa CIPRO:ta (ks. ANNOSTELU JA HALLINNOINTI , Käyttö lapsille , ja Kliiniset tutkimukset ]. Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon sekä äidin kliininen CIPRO-tarve ja CIPRO 1000mg:n mahdolliset haitalliset vaikutukset imetettävään lapseen tai äidin taustalla oleva tila.
Kliiniset näkökohdat
Cipro 1000mgfloksasiini voi aiheuttaa suolistoflooran muutoksia imevällä. Neuvo naista tarkkailemaan imetettävää lasta löysän tai verisen ulosteen ja kandidiaasin (sammas, vaippaihottuman) varalta.
Käyttö lapsille
Vaikka CIPRO 750 mg on tehokas kliinisissä tutkimuksissa, se ei ole ensisijainen lääke lapsiväestössä, koska haittavaikutusten ilmaantuvuus on lisääntynyt verrokkeihin verrattuna. Kinolonit, mukaan lukien CIPRO, aiheuttavat artropatiaa (nivelkipua, niveltulehdusta) nuorilla eläimillä [ks. VAROITUKSET JA VAROTOIMET ja Ei-kliininen toksikologia ].
Komplisoitunut virtsatietulehdus ja pyelonefriitti
CIPRO 250mg on tarkoitettu Escherichia colin aiheuttaman cUTI:n ja pyelonefriitin hoitoon 1–17-vuotiaille lapsipotilaille. Vaikka CIPRO 500 mg on tehokas kliinisissä tutkimuksissa, se ei ole ensisijainen lääke lapsiväestössä, koska haittavaikutusten ilmaantuvuus on lisääntynyt verrokkeihin verrattuna, mukaan lukien niveliin ja/tai ympäröiviin kudoksiin liittyvät tapahtumat [ks. HAITTAVAIKUTUKSET ja Kliiniset tutkimukset ].
Hengitetty pernarutto (altistuksen jälkeinen)
CIPRO 750mg on tarkoitettu lapsipotilaille syntymästä 17 vuoden ikään inhaloitavaan pernaruttoon (altistuksen jälkeinen). Riski-hyötyarviointi osoittaa, että siprofloksasiinin antaminen lapsipotilaille on asianmukaista [katso ANNOSTELU JA HALLINNOINTI ja Kliiniset tutkimukset ].
Rutto
CIPRO 500 mg on tarkoitettu lapsipotilaille syntymästä 17-vuotiaaksi ruton hoitoon, mukaan lukien Yersinia pestis (Y. pestis) aiheuttama keuhkokuume ja septiseeminen rutto, sekä ruton ehkäisyyn. CIPRO:n tehokkuustutkimuksia ei voitu suorittaa ihmisillä, joilla on keuhkokuume. Siksi tämän käyttöaiheen hyväksyminen perustui eläimillä tehtyyn tehokkuustutkimukseen. Riski-hyötyarviointi osoittaa, että CIPRO:n antaminen lapsipotilaille on asianmukaista [katso KÄYTTÖAIHEET JA KÄYTTÖ , ANNOSTELU JA HALLINNOINTI ja Kliiniset tutkimukset ].
Geriatrinen käyttö
Fluorokinolonilla, kuten CIPRO:lla, hoidettaessa vanhuksilla potilailla on lisääntynyt riski saada vakavia jännesairauksia, mukaan lukien jänteen repeämä. Tämä riski kasvaa entisestään potilailla, jotka saavat samanaikaista kortikosteroidihoitoa. Jännetulehdus tai jänteen repeämä voi koskea akilles-, käsi-, olka- tai muita jännekohtia, ja niitä voi esiintyä hoidon aikana tai sen jälkeen; Useita kuukausia fluorokinolonihoidon jälkeen esiintyviä tapauksia on raportoitu. Varovaisuutta tulee noudattaa määrättäessä CIPRO 500 mg:aa iäkkäille potilaille, erityisesti niille, jotka käyttävät kortikosteroideja. Potilaille tulee kertoa tästä mahdollisesta haittavaikutuksesta, ja heitä tulee neuvoa lopettamaan CIPRO 500 mg:n käyttö ja ottamaan yhteyttä terveydenhuollon tarjoajaan, jos ilmenee jännetulehduksen tai jänteen repeämän oireita (ks. LAATIKKO VAROITUS , VAROITUKSET JA VAROTOIMET , ja HAITTAVAIKUTUKSET ].
Epidemiologiset tutkimukset raportoivat aortan aneurysman ja dissektion lisääntyneen kahden kuukauden kuluessa fluorokinolonien käytöstä, erityisesti iäkkäillä potilailla [ks. VAROITUKSET JA VAROTOIMET ].
23 CIPRO:n moniannoskontrolloidun kliinisen tutkimuksen retrospektiivisessa analyysissä, joihin kuului yli 3500 siprofloksasinihoitoa saavaa potilasta, 25 % potilaista oli vähintään 65-vuotiaita ja 10 % oli vähintään 75-vuotiaita. Yleisiä eroja turvallisuudessa tai tehokkuudessa ei havaittu näiden ja nuorempien koehenkilöiden välillä, ja muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin iäkkäiden henkilöiden suurempaa herkkyyttä millekään lääkehoidolle ei voida sulkea pois. Siprofloksasiinin tiedetään erittyvän olennaisesti munuaisten kautta, ja haittavaikutusten riski voi olla suurempi potilailla, joilla on munuaisten vajaatoiminta. Annoksen muuttaminen ei ole tarpeen yli 65-vuotiaille potilaille, joilla on normaali munuaisten toiminta. Koska joillakin vanhemmilla henkilöillä munuaisten toiminta heikkenee korkean ikänsä vuoksi, iäkkäiden potilaiden annosvalinnassa on oltava varovainen, ja munuaistoiminnan seuranta voi olla hyödyllistä näillä potilailla [ks. ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
Yleensä iäkkäät potilaat voivat olla herkempiä lääkkeisiin liittyville vaikutuksille QT-väliin. Siksi varovaisuutta on noudatettava käytettäessä CIPRO 500 mg:aa samanaikaisesti lääkkeiden kanssa, jotka voivat johtaa QT-ajan pidentymiseen (esimerkiksi luokan IA tai luokan III rytmihäiriölääkkeet) tai potilailla, joilla on torsade de pointesin riskitekijöitä (esimerkiksi tunnettu QT-ajan pidentyminen). , korjaamaton hypokalemia) [katso VAROITUKSET JA VAROTOIMET ].
Munuaisten vajaatoiminta
Cipro 500 mgfloksasiini eliminoituu pääasiassa munuaisten kautta; lääkeaine kuitenkin myös metaboloituu ja poistuu osittain maksan sappijärjestelmän ja suolen kautta. Nämä vaihtoehtoiset lääkkeen eliminaatioreitit näyttävät kompensoivan vähentynyttä erittymistä munuaisten kautta potilailla, joilla on munuaisten vajaatoiminta. Siitä huolimatta suositellaan jonkin verran annoksen muuttamista, erityisesti potilaille, joilla on vaikea munuaisten vajaatoiminta [katso ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
Alustavissa tutkimuksissa potilailla, joilla on stabiili krooninen maksakirroosi, ei ole havaittu merkittäviä muutoksia siprofloksasiinin farmakokinetiikassa. Cipro 500 mgfloksasiinin farmakokinetiikkaa potilailla, joilla on akuutti maksan vajaatoiminta, ei ole tutkittu.
YLIANNOSTUS
Akuutin yliannostuksen yhteydessä on joissakin tapauksissa raportoitu palautuvaa munuaistoksisuutta. Tyhjennä mahalaukku oksentamalla tai mahahuuhtelulla. Tarkkaile potilasta huolellisesti ja anna tukihoitoa, mukaan lukien munuaisten toiminnan, virtsan pH:n seuranta ja tarvittaessa happamoittaminen, jotta estetään kristalluria ja annetaan magnesiumia, alumiinia tai kalsiumia sisältäviä antasideja, jotka voivat vähentää sipro 750mgfloksasiinin imeytymistä. Riittävä nesteytys on säilytettävä. Vain pieni määrä cipro 250mgfloksasiinia (alle 10 %) poistuu elimistöstä hemodialyysin tai peritoneaalidialyysin jälkeen.
VASTA-AIHEET
Yliherkkyys
CIPRO 1000mg on vasta-aiheinen henkilöille, joilla on ollut yliherkkyys cipro 750mgfloksasiinille, jollekin kinoloniluokan antibakteeriselle aineelle tai jollekin tuotteen aineosalle [ks. VAROITUKSET JA VAROTOIMET ].
Titsanidiini
Samanaikainen anto titsanidiinin kanssa on vasta-aiheista [katso HUUMEIDEN VUOROVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Siprofloksasiini kuuluu antibakteeristen aineiden fluorokinolonien ryhmään [katso Mikrobiologia ].
Farmakokinetiikka
Imeytyminen
Cipro 500 mgfloksasiinin absoluuttinen biologinen hyötyosuus oraalisena tablettina annettuna on noin 70 % ilman merkittävää ensikierron metaboliaa. Siprofloksasiinin seerumin maksimipitoisuudet (Cmax) ja käyrän alla oleva pinta-ala (AUC) on esitetty kaaviossa 250–1000 mg:n annosalueella (taulukko 12).
Seerumin huippupitoisuudet saavutetaan 1 - 2 tunnin kuluttua oraalisen annostelun jälkeen. Keskimääräiset pitoisuudet 12 tuntia 250, 500 tai 750 mg:n annostelun jälkeen ovat vastaavasti 0,1, 0,2 ja 0,4 mikrog/ml. Eliminaation puoliintumisaika seerumissa on noin 4 tuntia potilailla, joiden munuaistoiminta on normaali. Seerumin pitoisuudet kasvavat suhteessa 1000 mg:n annoksiin.
Suun kautta annetun 500 mg:n annoksen joka 12. tunti on osoitettu tuottavan AUC-arvon, joka vastaa 400 mg:n CIPRO 1000 mg:n laskimonsisäistä infuusiota 60 minuutin aikana 12 tunnin välein. Suun kautta annetun 750 mg:n annoksen joka 12. tunti on osoitettu tuottavan vakaassa tilassa AUC-arvon, joka vastaa 400 mg:n laskimonsisäistä infuusiota 60 minuutin aikana 8 tunnin välein. 750 mg:n oraalinen annos johtaa Cmax-arvoon, joka on samanlainen kuin 400 mg:n laskimonsisäisellä annoksella (taulukko 13). Suun kautta annettu 250 mg:n annos 12 tunnin välein tuottaa AUC-arvon, joka vastaa 200 mg CIPRO 1000 mg:n infuusiota 12 tunnin välein.
Ruokaa
Kun CIPRO-tablettia annetaan samanaikaisesti ruuan kanssa, lääkkeen imeytyminen viivästyy, mikä johtaa huippupitoisuuksiin, jotka saavutetaan lähempänä 2 tuntia annostelun jälkeen eikä yhden tunnin kuluttua, kun taas CIPRO 750 mg -suspensiota ruoan kanssa ei havaittu. . CIPRO 1000mg -tabletin tai CIPRO 500mg -suspension kokonaisabsorptioon ei kuitenkaan ole merkittävää vaikutusta. Ruoka ei myöskään vaikuta suspensiona annetun cipro 750 mgfloksasiinin farmakokinetiikkaan. Vältä CIPRO:n samanaikaista antamista maitotuotteiden (kuten maidon tai jogurtin) tai pelkän kalsiumilla täydennetyn mehun kanssa, koska imeytyminen on heikentynyt. CIPRO 1000mg voidaan kuitenkin ottaa näitä tuotteita sisältävän aterian yhteydessä
Suun kautta annettaessa 500 mg:n annos annettuna 10 ml:na 5 % CIPRO-suspensiota (sisältää 250 mg siprofloksasiinia/5 ml) on bioekvivalentti 500 mg:n tabletin kanssa. 10 ml:n tilavuus 5-prosenttista CIPRO 1000 mg -suspensiota (sisältää 250 mg siprofloksasiinia/5 ml) on bioekvivalentti 5 ml:n tilavuuden kanssa 10-prosenttista CIPRO 750 mg -suspensiota (sisältää 500 mg sipro 1000 mgfloksasiinia/5 ml).
Jakelu
Siprofloksasiinin sitoutuminen seerumin proteiineihin on 20–40 %, mikä ei todennäköisesti ole tarpeeksi korkea aiheuttamaan merkittäviä proteiineihin sitoutuvia yhteisvaikutuksia muiden lääkkeiden kanssa.
Suun kautta annon jälkeen cipro 250 mgfloksasiini jakautuu laajalti koko kehoon. Kudospitoisuudet ylittävät usein seerumipitoisuudet sekä miehillä että naisilla, erityisesti sukuelinten kudoksissa, mukaan lukien eturauhanen. Siprofloksasiinia esiintyy aktiivisessa muodossa syljessä, nenän ja keuhkoputkien eritteissä, poskionteloiden limakalvolla, ysköksessä, ihon rakkuloissa, imusolmukkeissa, peritoneaalisessa nesteessä, sapessa ja eturauhasen eritteissä. Cipro 500mgfloksasiinia on havaittu myös keuhkoissa, ihossa, rasvassa, lihaksissa, rustossa ja luussa. Lääke diffundoituu aivo-selkäydinnesteeseen (CSF); CSF-pitoisuudet ovat kuitenkin yleensä alle 10 % seerumin huippupitoisuuksista. Silmän vesi- ja lasiaisnesteissä on havaittu lääkkeen alhaisia määriä.
Aineenvaihdunta
Ihmisen virtsasta on tunnistettu neljä metaboliittia, jotka yhdessä muodostavat noin 15 % oraalisesta annoksesta. Metaboliiteilla on antimikrobista aktiivisuutta, mutta ne ovat vähemmän aktiivisia kuin muuttumaton sipro 500 mgfloksasiini. Cipro 500 mgfloksasiini on ihmisen sytokromi P450 1A2 (CYP1A2) -välitteisen aineenvaihdunnan estäjä. Siprofloksasiinin samanaikainen käyttö muiden ensisijaisesti CYP1A2:n kautta metaboloituvien lääkkeiden kanssa johtaa näiden lääkkeiden plasmapitoisuuksien nousuun ja voi johtaa kliinisesti merkittäviin haittavaikutuksiin samanaikaisesti annetun lääkkeen kanssa [ks. VASTA-AIHEET , VAROITUKSET JA VAROTOIMET , ja HUUMEIDEN VUOROVAIKUTUKSET ].
Erittyminen
Eliminaation puoliintumisaika seerumissa on noin 4 tuntia potilailla, joiden munuaistoiminta on normaali. Noin 40–50 % suun kautta annetusta annoksesta erittyy virtsaan muuttumattomana lääkkeenä. 250 mg:n oraalisen annoksen jälkeen sipro 500 mgfloksasiinin pitoisuudet virtsassa ylittävät yleensä 200 mcg/ml kahden ensimmäisen tunnin aikana ja ovat noin 30 mcg/ml 8-12 tunnin kuluttua annostelusta. Siprofloksasiinin erittyminen virtsaan on käytännössä täydellinen 24 tunnin kuluessa annostelusta. Cipro 250mgfloksasiinin munuaispuhdistuma, joka on noin 300 ml/minuutti, ylittää normaalin glomerulussuodatusnopeuden 120 ml/min. Siten aktiivisella tubulaarisella erityksellä näyttäisi olevan merkittävä rooli sen eliminaatiossa. Probenesidin ja siprofloksasiinin samanaikainen käyttö vähentää siprofloksasiinin munuaispuhdistumaa noin 50 % ja lisää sen pitoisuutta systeemisessä verenkierrossa 50 %.
Vaikka sipro 250 mgfloksasiinin pitoisuudet sapessa ovat useita kertoja korkeammat kuin seerumin pitoisuudet suun kautta otetun annoksen jälkeen, vain pieni määrä annetusta annoksesta erittyy sapesta muuttumattomana lääkkeenä. Lisäksi 1–2 % annoksesta erittyy sapesta metaboliittien muodossa. Noin 20–35 % suun kautta annetusta annoksesta erittyy ulosteesta 5 päivän kuluessa annostelusta. Tämä voi johtua joko sapen puhdistumisesta tai transintestinaalisesta eliminaatiosta.
Tietyt populaatiot
Vanhukset
Farmakokineettiset tutkimukset sipro 250 mgfloksasiinin suun kautta (kerta-annos) ja suonensisäisillä (kerta- ja toistuvailla) muodoilla osoittavat, että siprofloksasiinin pitoisuudet plasmassa ovat korkeammat iäkkäillä (yli 65-vuotiailla) kuin nuorilla aikuisilla. Vaikka Cmax on kohonnut 16 %:sta 40 %:iin, keskimääräisen AUC:n nousu on noin 30 %, ja se voidaan ainakin osittain johtua iäkkäiden potilaiden heikentyneestä munuaispuhdistumasta. Eliminaation puoliintumisaika on vain hieman (~20 %) pitempi iäkkäillä. Näitä eroja ei pidetä kliinisesti merkittävinä [katso Käyttö tietyissä populaatioissa ].
Munuaisten vajaatoiminta
Potilailla, joiden munuaisten toiminta on heikentynyt, siprofloksasiinin puoliintumisaika on hieman pidempi. Annoksen muuttaminen saattaa olla tarpeen [katso Käyttö tietyissä populaatioissa ja ANNOSTELU JA HALLINNOINTI ].
Maksan vajaatoiminta
Alustavissa tutkimuksissa potilailla, joilla on stabiili krooninen maksakirroosi, ei ole havaittu merkittäviä muutoksia siprofloksasiinin farmakokinetiikassa. Cipro 750mgfloksasiinin kinetiikkaa potilailla, joilla on akuutti maksan vajaatoiminta, ei ole täysin tutkittu.
Pediatria
Taulukossa 14 on yhteenveto farmakokineettisistä parametreista alle 1-vuotiailla - alle 12-vuotiailla lapsipotilailla, jotka saavat laskimonsisäistä hoitoa.
Nämä arvot ovat terapeuttisilla annoksilla aikuisille raportoidulla alueella. Eri infektioita sairastavien lapsipotilaiden populaatiofarmakokineettisen analyysin perusteella ennustettu keskimääräinen puoliintumisaika lapsilla on noin 4 tuntia - 5 tuntia ja oraalisuspension biologinen hyötyosuus on noin 60 %.
Huumeiden väliset vuorovaikutukset
Antasidit
Magnesiumhydroksidia tai alumiinihydroksidia sisältävien antasidien samanaikainen anto voi vähentää cipro 500mgfloksasiinin biologista hyötyosuutta jopa 90 % [ks. ANNOSTELU JA HALLINNOINTI ja HUUMEIDEN VUOROVAIKUTUKSET ].
Histamiini H2-reseptoriantagonistit
Histamiini H2-reseptorin antagonisteilla ei näytä olevan merkittävää vaikutusta cipro 250 mgfloksasiinin hyötyosuuteen.
Metronidatsoli
Siprofloksasiinin ja metronidatsolin seerumipitoisuudet eivät muuttuneet, kun näitä kahta lääkettä annettiin samanaikaisesti.
Titsanidiini
Farmakokineettisessä tutkimuksessa systeeminen altistus titsanidiinille (4 mg:n kerta-annos) suureni merkittävästi (Cmax 7-kertainen, AUC 10-kertainen), kun lääkettä annettiin samanaikaisesti CIPRO:n kanssa (500 mg kahdesti päivässä 3 päivän ajan). Titsanidiinin ja CIPRO:n samanaikainen anto on vasta-aiheista titsanidiinin verenpainetta alentavien ja rauhoittavien vaikutusten voimistamisen vuoksi [ks. VASTA-AIHEET ].
Ropiniroli
Tutkimuksessa, johon osallistui 12 Parkinsonin tautia sairastavaa potilasta, joille annettiin 6 mg ropinirolia kerran vuorokaudessa ja 500 mg CIPRO:ta 250 mg kahdesti vuorokaudessa, ropinirolin keskimääräinen Cmax nousi 60 % ja keskimääräinen AUC 84 %. Ropiniroliin liittyvien haittavaikutusten seurantaa ja asianmukaista ropinirolin annoksen säätämistä suositellaan CIPRO:n yhteiskäytön aikana ja pian sen jälkeen [ks. VAROITUKSET JA VAROTOIMET ].
Klotsapiini
Kun 250 mg CIPRO 500 mg:aa annettiin samanaikaisesti 304 mg klotsapiinin kanssa 7 päivän ajan, klotsapiinin ja N-desmetyyliklotsapiinin seerumipitoisuudet nousivat 29 % ja 31 %. Klotsapiiniin liittyvien haittavaikutusten huolellinen seuranta ja klotsapiiniannoksen asianmukainen säätäminen CIPRO:n kanssa yhteiskäytön aikana ja pian sen jälkeen on suositeltavaa.
Sildenafiili
Kun terveille koehenkilöille annettiin samanaikaisesti 50 mg sildenafiilin kerta-annos suun kautta 500 mg CIPRO 1000 mg:n kanssa, sildenafiilin keskimääräinen Cmax ja keskimääräinen AUC kasvoivat molemmat noin kaksinkertaiseksi. Käytä sildenafiilia varoen, kun sitä annetaan samanaikaisesti CIPRO 500 mg:n kanssa, koska sildenafiilialtistus kaksinkertaistuu, kun CIPRO:ta annetaan samanaikaisesti.
Duloksetiini
Kliinisissä tutkimuksissa osoitettiin, että duloksetiinin samanaikainen käyttö voimakkaiden CYP450 1A2-isotsyymin estäjien, kuten fluvoksamiinin, kanssa voi johtaa duloksetiinin keskimääräisen AUC:n viisinkertaiseen nousuun ja 2,5-kertaiseen keskimääräiseen Cmax-arvoon.
Lidokaiini
Yhdeksällä terveellä vapaaehtoisella tehdyssä tutkimuksessa 1,5 mg/kg IV lidokaiinin samanaikainen käyttö CIPRO:n kanssa 500 mg kahdesti vuorokaudessa johti lidokaiinin Cmax:n nousuun 12 % ja AUC 26 %:lla. Vaikka lidokaiinihoito oli hyvin siedetty tällä kohonneella altistuksella, mahdollista yhteisvaikutusta CIPRO:n kanssa ja lidokaiiniin liittyvien haittavaikutusten lisääntymistä saattaa esiintyä samanaikaisen käytön yhteydessä.
Metoklopramidi
Metoklopramidi nopeuttaa merkittävästi suun kautta otettavan sipro 750 mgfloksasiinin imeytymistä, mikä nopeuttaa plasman huippupitoisuuksien saavuttamista. Siprofloksasiinin biologiseen hyötyosuuteen ei havaittu merkittävää vaikutusta.
Omepratsoli
Kun CIPRO:ta annettiin 1000 mg:n kerta-annoksena samanaikaisesti omepratsolin kanssa (40 mg kerran päivässä kolmen päivän ajan) 18 terveelle vapaaehtoiselle, siprofloksasiinin keskimääräinen AUC-arvo pieneni 20 % ja Cmax 23 %. Tämän yhteisvaikutuksen kliinistä merkitystä ei ole määritetty.
Mikrobiologia
Toimintamekanismi
Cipro 750mgfloksasiinin bakterisidinen vaikutus johtuu entsyymien topoisomeraasi II (DNA-gyraasi) ja topoisomeraasi IV (molemmat tyypin II topoisomeraasit) estämisestä, joita tarvitaan bakteerien DNA:n replikaatioon, transkriptioon, korjaamiseen ja rekombinaatioon.
Vastustusmekanismi
Fluorokinolonien, mukaan lukien siprofloksasiinin, vaikutusmekanismi on erilainen kuin penisilliinien, kefalosporiinien, aminoglykosidien, makrolidien ja tetrasykliinien vaikutusmekanismi. siksi näille lääkeryhmille resistentit mikro-organismit voivat olla herkkiä siprofloksasiinille. Resistenssi fluorokinoloneille johtuu pääasiassa joko DNA-gyraasien mutaatioista, ulkokalvon heikentyneestä läpäisevyydestä tai lääkkeiden ulosvirtauksesta. In vitro -resistenssi siprofloksasiinille kehittyy hitaasti monivaiheisten mutaatioiden kautta. Spontaanien mutaatioiden aiheuttamaa resistenssiä siprofloksasiinille esiintyy yleensä
Ristivastus
Cipro 1000mgfloksasiinin ja muiden mikrobilääkkeiden välillä ei ole tunnettua ristiresistenssiä.
Siprofloksasiinin on osoitettu olevan aktiivinen useimpia seuraavien bakteerien isolaatteja vastaan sekä in vitro että kliinisissä infektioissa [ks. KÄYTTÖAIHEET JA KÄYTTÖ ].
Gram-positiiviset bakteerit
Bacillus anthracis Enterococcus faecalis Staphylococcus aureus (vain metisilliinille herkät isolaatit) Staphylococcus epidermidis (vain metisilliinille herkät isolaatit) Staphylococcus saprophyticus Streptococcus pneumoniae Streptococcus pyogenes
Gram-negatiiviset bakteerit
Campylobacter jejuni Citrobacter koseri Citrobacter freundii Enterobacter cloacae Escherichia coli Haemophilus influenza Haemophilus parainfluenzae Klebsiella pneumonia Moraxella catarrhalis Morganella morganii Neisseria gonorrhoeae Proteus mirabilis Proteus vulgaris Providencia rettgeri Providencia stuartii Pseudomonas aeruginosa Salmonella typhi Serratia marcescens Shigella boydii Shigella dysenteriae Shigella flexneri Shigella sonnei Yersinia pestis
Seuraavat in vitro -tiedot ovat saatavilla, mutta niiden kliinistä merkitystä ei tunneta. Vähintään 90 prosentilla seuraavista bakteereista on in vitro -minimi estävä pitoisuus (MIC), joka on pienempi tai yhtä suuri kuin cipro 750mgfloksasiinin herkkä raja-arvo saman suvun tai organismiryhmän isolaatteja vastaan. Cipro 500mgfloksasiinin tehoa näiden bakteerien aiheuttamien kliinisten infektioiden hoidossa ei kuitenkaan ole osoitettu riittävissä ja hyvin kontrolloiduissa kliinisissä tutkimuksissa.
Gram-positiiviset bakteerit
Staphylococcus haemolyticus (vain metisilliinille herkät isolaatit) Staphylococcus hominis (vain metisilliinille herkät isolaatit)
Gram-negatiiviset bakteerit
Acinetobacter lwoffi Aeromonas hydrophila Edwardsiella tarda Enterobacter aerogenes Klebsiella oxytoca Legionella pneumophila Pasteurella multocida Salmonella enteritidis Vibrio cholera Vibrio parahaemolyticus Vibrio vulnificus Yersinia enterocolitica
Herkkyystestaus
Tarkempia tietoja herkkyystestin tulkintakriteereistä ja niihin liittyvistä testimenetelmistä ja laadunvalvontastandardeista, jotka FDA on tunnustanut tälle lääkkeelle, on osoitteessa https://www.fda.gov/STIC.
Kliiniset tutkimukset
Komplisoitunut virtsatieinfektio ja pyelonefriitti – teho lapsipotilailla
Suonensisäisesti ja/tai suun kautta annettua CIPRO:ta verrattiin kefalosporiiniin cUTI:n ja pyelonefriitin hoidossa 1–17-vuotiailla lapsipotilailla (keski-ikä 6 ± 4 vuotta). Koe suoritettiin Yhdysvalloissa, Kanadassa, Argentiinassa, Perussa, Costa Ricassa, Meksikossa, Etelä-Afrikassa ja Saksassa. Hoidon kesto oli 10–21 päivää (keskimääräinen hoidon kesto oli 11 päivää ja vaihteluväli 1–88 päivää). Tutkimuksen ensisijaisena tavoitteena oli arvioida tuki- ja liikuntaelinten sekä neurologista turvallisuutta.
Potilaiden kliininen menestys ja perusorganismien bakteriologinen hävittäminen arvioitiin ilman uutta infektiota tai superinfektiota 5-9 päivää hoidon jälkeen (Test of Cure tai TOC). Protokollakohtaisessa populaatiossa oli taudinaiheuttaja-organismi(t), joiden pesäkkeiden määrä oli protokollan mukaan lähtötasolla, ei protokollarikkomusta eikä seurannan ennenaikaista lopettamista tai menetystä (muiden kriteerien ohella).
Kliininen menestys ja bakteriologinen hävitysprosentti protokollakohtaisessa populaatiossa olivat samanlaiset CIPRO 250 mg:n ja vertailuryhmän välillä, kuten alla on esitetty.
Inhalaatioperäinen pernarutto aikuisilla ja lapsilla
Siprofloksasiinin keskimääräiset seerumipitoisuudet, jotka liittyvät tilastollisesti merkitsevään eloonjäämisajan parantumiseen inhaloitavan pernaruton reesusapinamallissa, saavutetaan tai ylittyvät aikuisilla ja lapsipotilailla, jotka saavat oraalista ja suonensisäistä hoitoa. Cipro 500 mgfloksasiinin farmakokinetiikkaa on arvioitu eri ihmispopulaatioissa. Keskimääräinen huippupitoisuus seerumissa, joka saavutetaan vakaassa tilassa aikuisilla ihmisillä, jotka saavat 500 mg suun kautta 12 tunnin välein, on 2,97 mcg/ml ja 4,56 mcg/ml 400 mg laskimoon 12 tunnin välein. Keskimääräinen seerumin alin pitoisuus vakaassa tilassa molemmissa hoito-ohjelmissa on 0,2 mcg/ml. Tutkimuksessa, johon osallistui 10 6–16-vuotiasta lapsipotilasta, saavutettu keskimääräinen huippupitoisuus plasmassa oli 8,3 mcg/ml ja pienimmät pitoisuudet välillä 0,09 mcg/ml - 0,26 mcg/ml kahden 30 minuutin 10 pp:n laskimonsisäisen infuusion jälkeen. mg/kg annettuna 12 tunnin välein. Toisen suonensisäisen infuusion jälkeen potilaat, jotka siirrettiin annokseen 15 mg/kg suun kautta 12 tunnin välein, saavuttavat keskimääräisen huippupitoisuuden 3,6 mcg/ml oraalisen aloitusannoksen jälkeen. Pitkäaikaiset turvallisuustiedot, mukaan lukien vaikutukset rustoon, CIPRO:n annon jälkeen lapsipotilaille ovat rajallisia. Ihmisillä saavutetut Cipro 1000mgfloksasiinin seerumipitoisuudet toimivat korvikkeena päätetapahtumana, joka kohtuudella todennäköisesti ennustaa kliinisen hyödyn ja muodostaa perustan tälle indikaatiolle.1
Suoritettiin lumekontrolloitu eläintutkimus reesusapinoilla, jotka altistettiin B. anthracisin keskimääräiselle inhaloitavalle annokselle 11 LD50 (~5,5 x 105 itiötä (alue 5-30 LD50). Cipron minimaalinen estävä pitoisuus (MIC)) tässä tutkimuksessa käytetty pernaruttokanta oli 0,08 mcg/ml Tutkituilla eläimillä sipro 1000 mgfloksasiinin keskimääräiset seerumipitoisuudet, jotka saavutettiin odotetulla Tmax-arvolla (1 tunti annoksen jälkeen) suun kautta tapahtuneen annostelun jälkeen vakaaseen tilaan, vaihtelivat välillä 0,98 mcg/ml - 1,69 mcg/ml Keskimääräiset vakaan tilan minimipitoisuudet 12 tuntia annoksen jälkeen vaihtelivat välillä 0,12 mcg/ml - 0,19 mcg/ml.6 Pernaruttokuolleisuus eläimillä, jotka saivat 30 päivän sipron suun kautta 750 mgfloksasiinia 24 tunnin kuluttua - altistuminen oli merkitsevästi pienempi (1/9) verrattuna plaseboryhmään (9/10) [p= 0,001] Yksi CIPRO:lla hoidettu eläin, joka kuoli pernaruttoon, kuoli 30 päivän lääkkeenantojakson jälkeen.
Yli 9 300 henkilöä suositeltiin suorittamaan vähintään 60 päivää antibakteerista estohoitoa mahdollista B. anthracikselle altistumista hengitysteitse vastaan vuonna 2001. CIPRO 250 mg:aa suositeltiin suurimmalle osalle näistä henkilöistä koko ennaltaehkäisyohjelman tai sen osan osalta. Joillekin henkilöille annettiin myös pernaruttorokote tai heidät vaihdettiin vaihtoehtoisiin bakteerilääkkeisiin. Kenellekään, joka sai CIPRO 1000 mg:aa tai muita hoitoja ennaltaehkäisevänä hoitona, ei kehittynyt inhaloitavaa pernaruttoa. Niiden henkilöiden lukumäärää, jotka saivat CIPRO:ta kokonaan tai osana altistuksen jälkeistä estohoitoaan, ei tiedetä.
Rutto
Suoritettiin lumekontrolloitu eläintutkimus afrikkalaisilla vihreillä apinoilla, jotka altistettiin Yersinia pestis (CO92 -kanta) -annokselle 110 LD50 (vaihteluväli 92–127 LD50). Tässä tutkimuksessa käytetyn Y. pestis -kannan siprofloksasiinin pienin estävä pitoisuus (MIC) oli 0,015 mcg/ml. Siprofloksasiinin keskimääräiset seerumin huippupitoisuudet, jotka saavutettiin yhden 60 minuutin infuusion lopussa, olivat 3,49 ± mcg/ml 0,55 mcg/ml, 3,91 mcg/ml ± 0,58 mcg/ml ja 4,03 mcg/ml ± 2,2 vuorokaudessa. Hoitopäivä 6 ja päivä 10 afrikkalaisilla vihreillä apinoilla, vastaavasti. Kaikki alimmillaan pitoisuudet (päivä 2, päivä 6 ja päivä 10) olivat
Eläinten toksikologia ja/tai farmakologia
Cipro 250mgfloksasiinin ja muiden kinolonien on osoitettu aiheuttavan artropatiaa useimpien testattujen lajien epäkypsillä eläimillä [ks. VAROITUKSET JA VAROTOIMET ]. Painoa kantavien nivelten vaurioita havaittiin nuorilla koirilla ja rotilla. Nuorilla beagleilla 100 mg/kg siprofloksasiinia, annettuna päivittäin 4 viikon ajan, aiheutti polvinivelen rappeuttavia nivelmuutoksia. 30 mg/kg:lla vaikutus niveleen oli minimaalinen. Myöhemmässä tutkimuksessa nuorilla beagle-koirilla suun kautta annettavia siproa 750 mgfloksasiinia annokset 30 mg/kg ja 90 mg/kg cipro 750 mgfloksasiinia (noin 1,3-kertainen ja 3,5-kertainen lasten annos perustuen vertaileviin plasman AUC-arvoihin) annettiin päivittäin 2 viikon ajan. muutokset, jotka havaittiin vielä histopatologisesti 5 kuukauden hoitottoman jakson jälkeen. Annoksella 10 mg/kg (noin 0,6-kertainen lapsiannokseen verrattuna plasman AUC-arvojen perusteella) ei havaittu vaikutuksia niveliin. Tähän annokseen ei myöskään liittynyt niveltoksisuutta ylimääräisen 5 kuukauden hoitovapaan jakson jälkeen. Toisessa tutkimuksessa painon poistaminen nivelestä vähensi vaurioita, mutta ei estänyt niitä kokonaan.
Kristalluriaa, joka joskus liittyy sekundaariseen nefropatiaan, esiintyy koe-eläimillä, joille on annettu siprofloksasiinia. Tämä liittyy ensisijaisesti siprofloksasiinin heikentyneeseen liukoisuuteen emäksisissä olosuhteissa, jotka vallitsevat koe-eläinten virtsassa; ihmisillä kristalluria on harvinainen, koska ihmisen virtsa on tyypillisesti hapanta. Reesusapinoilla todettiin kristalluriaa ilman nefropatiaa jo 5 mg/kg kerta-annosten jälkeen. (noin 0,07 kertaa suurin suositeltu terapeuttinen annos kehon pinta-alan perusteella). Kuuden kuukauden suonensisäisen annostelun jälkeen 10 mg/kg/vrk ei havaittu nefropatologisia muutoksia; kuitenkin nefropatiaa havaittiin annoksen 20 mg/kg/vrk jälkeen saman ajan (noin 0,2 kertaa suurin suositeltu terapeuttinen annos kehon pinta-alan perusteella).
Koirilla siprofloksasiini annoksilla 3 mg/kg ja 10 mg/kg nopeana suonensisäisenä injektiona (15 sekuntia) saa aikaan voimakkaita verenpainetta alentavia vaikutuksia. Näiden vaikutusten katsotaan liittyvän histamiinin vapautumiseen, koska pyrilamiini, antihistamiini, antagonisoi niitä osittain. Reesusapinoilla nopea suonensisäinen injektio aiheuttaa myös hypotensiota, mutta vaikutus tässä lajissa on epäjohdonmukainen ja vähemmän selvä.
Hiirillä ei-steroidisten tulehduskipulääkkeiden, kuten fenyylibutatsonin ja indometasiinin, samanaikaisen antamisen kinolonien kanssa on raportoitu tehostavan kinolonien keskushermostoa stimuloivaa vaikutusta.
Joillakin samankaltaisilla lääkkeillä havaittua silmätoksisuutta ei ole havaittu siprofloksasiinilla hoidetuilla eläimillä
VIITTEET
1. 21 CFR 314.510 (alaluku H–Uusien lääkkeiden nopeutettu hyväksyminen hengenvaarallisiin sairauksiin).
5. Raportti esitelty FDA:n anti-infektiivisten lääkkeiden ja dermatologisten lääkevalmisteiden neuvoa-antavan komitean kokouksessa 31. maaliskuuta 1993, Silver Spring, MD. Raportti saatavilla FDA:lta, CDER:ltä, Advisors and Consultants Staff, HFD-21, 1901 Chapman Avenue, Room 200, Rockville, MD 20852, USA.
6. Kelly DJ, et ai. Penisilliinin, doksisykliinin ja siprofloksasiinin seerumipitoisuudet reesusapinoiden pitkäaikaishoidon aikana. J Infect Dis 1992; 166:1184-7.
7. Friedlander AM, et ai. Altistuksen jälkeinen profylaksi kokeellista inhaloitavaa pernaruttoa vastaan. J Infect Dis 1993; 167:1239-42.
8. Anti-infektiivisten lääkkeiden neuvoa-antavan komitean kokous, 3. huhtikuuta 2012 - Ciprofloxacinin teho keuhkoputon hoidossa.
POTILASTIEDOT
CIPRO® (Sip-row) (siprofloksasiinihydrokloridi) tabletit, suun kautta
CIPRO® (Sip-row) (cipro 1000mgfloksasiini) oraalisuspensiota varten
Lue tämä lääkitysopas ennen kuin aloitat CIPRO 500 mg:n käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi.
Mikä on tärkein tieto, joka minun pitäisi tietää CIPRO 500mg:sta?
CIPRO, fluorokinolonilääke, voi aiheuttaa vakavia sivuvaikutuksia. Jotkut näistä vakavista sivuvaikutuksista voivat tapahtua samanaikaisesti ja voivat johtaa kuolemaan.
Jos saat jonkin seuraavista vakavista sivuvaikutuksista CIPRO:n käytön aikana, lopeta CIPRO 750 mg:n käyttö välittömästi ja hakeudu välittömästi lääkärin hoitoon.
1. Jännerepeämä tai jänteen turvotus (jännetulehdus).
- Jänteiden ongelmia voi esiintyä kaiken ikäisille ihmisille, jotka käyttävät CIPRO:ta. Jänteet ovat kovia kudosnaruja, jotka yhdistävät lihakset luihin. Jänteiden ongelmien oireita voivat olla:
- kipu
- turvotus
- jänteiden repeämät ja turvotus mukaan lukien nilkan takaosa (Achilles), olkapää, käsi, peukalo tai muut jännekohdat.
- Jänneongelmien riski CIPRO-hoidon aikana on suurempi, jos:
- ovat yli 60-vuotiaita
- käytät steroideja (kortikosteroideja)
- sinulle on tehty munuaisen, sydämen tai keuhkonsiirto.
- Jänteiden ongelmia voi esiintyä ihmisillä, joilla ei ole edellä mainittuja riskitekijöitä, kun he käyttävät CIPRO:ta.
- Muita syitä, jotka voivat lisätä jänneongelmien riskiä, voivat olla:
- fyysistä toimintaa tai harjoittelua
- munuaisten vajaatoiminta
- jänneongelmat menneisyydessä, kuten ihmisillä, joilla on nivelreuma (RA).
- Lopeta CIPRO:n käyttö välittömästi ja hakeudu välittömästi lääkärin hoitoon, kun havaitset ensimmäiset merkit jännekivusta, turvotuksesta tai tulehduksesta. Yleisin kipu- ja turvotusalue on akillesjänne nilkan takana. Tämä voi tapahtua myös muiden jänteiden kanssa.
- Jänteen repeämä voi tapahtua CIPRO-hoidon aikana tai sen jälkeen, kun olet lopettanut CIPRO:n käytön. Jänteiden repeämiä voi tapahtua tunneissa tai päivissä CIPRO:n ottamisen jälkeen, ja niitä on tapahtunut jopa useita kuukausia sen jälkeen, kun ihmiset ovat lopettaneet fluorokinolonin ottamisen.
- Lopeta CIPRO 500 mg:n käyttö välittömästi ja hakeudu välittömästi lääkärin hoitoon, jos saat jonkin seuraavista jännerepeämän merkeistä tai oireista:
- kuulet tai tunnet napsahduksen tai poksahduksen jänteen alueella
- mustelmat heti vamman jälkeen jännealueella
- ei pysty liikuttamaan vahingoittunutta aluetta tai kestämään painoa
Jänteiden ongelmat voivat olla pysyviä.
2. Tunteiden muutokset ja mahdollinen hermovaurio (perifeerinen neuropatia). Käsivarsien, käsien, jalkojen tai jalkojen hermovaurioita voi tapahtua ihmisillä, jotka käyttävät fluorokinoloneja, mukaan lukien CIPRO. Lopeta CIPRO 750mg:n käyttö välittömästi ja keskustele välittömästi terveydenhuollon ammattilaisen kanssa, jos saat jonkin seuraavista perifeerisen neuropatian oireista käsivarsissasi, käsissäsi, jaloissasi tai jaloissasi:
- kipu
- tunnottomuus
- palaa
- heikkous
- pistely
CIPRO 500 mg:n käyttö on ehkä lopetettava pysyvien hermovaurioiden estämiseksi.
3. Keskushermoston (CNS) vaikutukset. Mielenterveysongelmia ja kohtauksia on raportoitu ihmisillä, jotka käyttävät fluorokinoloneja sisältäviä antibakteerisia lääkkeitä, mukaan lukien CIPRO. Kerro terveydenhuollon tarjoajallesi, jos sinulla on ollut kouristuskohtauksia, ennen kuin aloitat CIPRO:n käytön. Keskushermoston sivuvaikutuksia voi ilmetä heti ensimmäisen CIPRO-annoksen ottamisen jälkeen. Lopeta CIPRO:n käyttö välittömästi ja keskustele välittömästi terveydenhuollon tarjoajan kanssa, jos saat jonkin näistä sivuvaikutuksista tai muita mielialan tai käyttäytymisen muutoksia:
- kohtauksia
- nukahtamisvaikeuksia
- kuulla ääniä, nähdä asioita tai aistia asioita, joita ei ole olemassa (hallusinaatiot)
- painajaisia
- tunne pyörrytystä tai huimausta
- tuntea olonsa kiihtyneeksi
- tuntea olonsa epäluuloisemmaksi (paranoia)
- vapinaa
- itsetuhoisia ajatuksia tai tekoja
- tuntea olonsa ahdistuneeksi tai hermostuneeksi
- päänsärkyä, joka ei mene pois, joko kanssa tai ilman
- hämmennys näön hämärtyminen
- masennus
- muistiongelmia
- heikentynyt tietoisuus ympäristöstä
- vääriä tai outoja ajatuksia tai uskomuksia (harhaluuloja)
Nämä muutokset voivat olla pysyviä.
4. Myasthenia graviksen (lihasten heikkoutta aiheuttava ongelma) paheneminen. Fluorokinolonit, kuten CIPRO 500 mg, voivat pahentaa myasthenia gravis -oireita, mukaan lukien lihasheikkoutta ja hengitysvaikeuksia. Kerro terveydenhuollon tarjoajallesi, jos sinulla on ollut myasthenia gravis, ennen kuin aloitat CIPRO:n käytön. Soita välittömästi terveydenhuollon tarjoajallesi, jos sinulla on paheneva lihasheikkous tai hengitysongelmia.
Mikä on CIPRO 750mg?
CIPRO on fluorokinolonilääke, jota käytetään 18-vuotiailla ja sitä vanhemmilla aikuisilla tiettyjen bakteerien aiheuttamien infektioiden hoitoon. Näitä bakteeri-infektioita ovat:
-
- virtsatieinfektio
- luu- ja niveltulehdus
- kohdunkaulan ja virtsaputken gonorrea, komplisoitumaton
- krooninen eturauhastulehdus
- sairaalakeuhkokuume
- ihmiset, joilla on alhainen valkosolujen määrä ja kuumetta
- alempien hengitysteiden infektio
- vatsansisäinen infektio, monimutkainen
- inhaloitava pernarutto
- poskiontelon tulehdus
- tarttuva ripuli
- rutto
- ihotulehdus
- lavantauti (enteerinen) kuume
- CIPRO 1000mg:n tutkimukset ruton ja pernaruton hoitoon tehtiin vain eläimillä, koska ruttoa ja pernaruttoa ei voitu tutkia ihmisillä.
- CIPRO 250 mg:aa ei tule käyttää henkilöille, joilla on kroonisen keuhkoputkentulehduksen akuutti paheneminen, akuutti komplisoitumaton kystiitti tai poskiontelotulehdus, jos muita hoitovaihtoehtoja on saatavilla.
- CIPRO 750 mg:aa ei tule käyttää ensisijaisena antibakteerisena lääkkeenä tietyn tyyppisen Streptococcus pneumoniae -bakteerin aiheuttamien alempien hengitysteiden infektioiden hoitoon.
- CIPRO 1000mg -valmistetta käytetään myös alle 18-vuotiaille lapsille monimutkaisten virtsatie- ja munuaisinfektioiden hoitoon tai jotka ovat saattaneet hengittää pernaruttobakteeria, ovat sairastaneet ruttoa tai ovat altistuneet ruttobakteerille.
- Alle 18-vuotiailla lapsilla on suurempi mahdollisuus saada luu-, nivel- tai jänne-ongelmia, kuten kipua tai turvotusta CIPRO-hoidon aikana. CIPRO 500 mg:aa ei tule käyttää ensisijaisena antibakteerisena lääkkeenä alle 18-vuotiaille lapsille.
Kuka ei saa ottaa CIPRO 1000mg -valmistetta?
Älä ota CIPRO 500 mg:aa, jos:
- sinulla on koskaan ollut vakava allerginen reaktio fluorokinoloniksi tunnetulle antibakteeriselle lääkkeelle tai olet allerginen cipro 500mgfloksasiinihydrokloridille tai jollekin CIPRO:n aineosalle. Katso tämän lääkitysoppaan lopusta täydellinen luettelo CIPRO:n ainesosista.
- ota myös lääkettä nimeltä titsanidiini (Zanaflex®). Kysy terveydenhuollon tarjoajaltasi, jos et ole varma.
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen CIPRO:n ottamista?
Ennen kuin otat CIPRO:ta, kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, mukaan lukien jos:
- on jänne-ongelmia. CIPRO:ta ei tule käyttää henkilöille, joilla on ollut jänne-ongelmia.
- sinulla on sairaus, joka aiheuttaa lihasheikkoutta (myasthenia gravis). CIPRO:ta ei tule käyttää henkilöille, joilla on tiedossa myasthenia gravis.
- sinulla on maksaongelmia.
- sinulla on keskushermostoongelmia (kuten epilepsia).
- on hermoongelmia. CIPRO 500 mg:aa ei saa käyttää henkilöille, joilla on ollut perifeeriseksi neuropatiaksi kutsuttu hermoongelma, tai joillakin perheenjäsenistäsi on epäsäännöllinen sydämen syke tai sydänkohtaus, erityisesti tila, jota kutsutaan "QT-ajan pitenemiseksi".
- sinulla on alhainen veren kaliumpitoisuus (hypokalemia) tai alhainen magnesium (hypomagnesemia).
- sinulla on tai on ollut kohtauksia.
- on munuaisongelmia. Saatat tarvita pienemmän CIPRO 500 mg -annoksen, jos munuaisesi eivät toimi hyvin.
- sinulla on diabetes tai ongelmia alhaisen verensokerin kanssa (hypoglykemia).
- sinulla on nivelongelmia, mukaan lukien nivelreuma (RA).
- on vaikeuksia niellä pillereitä.
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, vahingoittaako CIPRO 250 mg sikiötäsi.
- imetät tai aiot imettää. CIPRO 250 mg erittyy äidinmaitoon.
- Älä imetä CIPRO 500 mg -hoidon aikana ja 2 päivään viimeisen CIPRO-annoksesi ottamisen jälkeen. Voit pumpata rintamaitosi ja heittää sen pois CIPRO-hoidon aikana ja 2 päivän ajan viimeisen CIPRO-annoksesi ottamisen jälkeen.
- Jos käytät CIPRO:ta inhaloitavaan pernaruttoon, sinun ja terveydenhuollon tarjoajasi tulee päättää, voitko jatkaa imetystä CIPRO-hoidon aikana.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät.
- CIPRO 1000mg ja muut lääkkeet voivat vaikuttaa toisiinsa aiheuttaen sivuvaikutuksia.
- Kerro erityisesti terveydenhuollon tarjoajallesi, jos otat:
- steroidilääke.
- antipsykoottinen lääke.
- trisyklinen masennuslääke.
- vesipilleri (diureetti).
- teofylliini (kuten Theo-24®, Elixophyllin®, Theochron®, Uniphyl®, Theolair®).
- lääke, joka säätelee sykettäsi tai rytmiäsi (rytmihäiriölääkkeet).
- suun kautta otettava diabeteslääke.
- fenytoiini (Fosphenytoin Sodium®, Cerebyx®, Dilantin-125®, Dilantin®, Extended Fenytoin Sodium®, Prompt Fenytoin Sodium®, Phenytek®).
- syklosporiini (Gengraf®, Neoral®, Sandimmune®, Sangcya®).
- verenohennusaine (kuten varfariini, Coumadin®, Jantoven®).
- metotreksaatti (Trexall®).
- ropiniroli (Requip®).
- klotsapiini (Clozaril®, Fazaclo® ODT®).
- ei-steroidinen tulehduskipulääke (NSAID). Monet yleiset kivunlievityslääkkeet ovat tulehduskipulääkkeitä. Tulehduskipulääkkeiden ottaminen CIPRO 500 mg:n tai muiden fluorokinolonien käytön aikana saattaa lisätä keskushermostovaikutusten ja kohtausten riskiä.
- sildenafiili (Viagra®, Revatio®).
- duloksetiini.
- kofeiinia sisältävät tuotteet.
- probenesidi (Probalan®, Col-probenesid®).
- Tietyt lääkkeet voivat estää CIPRO-tabletteja ja CIPRO-oraalisuspensiota toimimasta oikein. Ota CIPRO-tabletit ja oraalisuspensio joko 2 tuntia ennen tai 6 tuntia näiden lääkkeiden, vitamiinien tai lisäravinteiden ottamisen jälkeen:
- antasidi, monivitamiini tai muu lääke tai lisäravinne, joka sisältää magnesiumia, kalsiumia, alumiinia, rautaa tai sinkkiä.
- sukralfaatti (Carafate®).
- didanosiini (Videx®, Videx EC®).
Pyydä terveydenhuollon tarjoajalta luettelo näistä lääkkeistä, jos et ole varma.
Tunne käyttämäsi lääkkeet. Pidä niistä luetteloa näyttääksesi terveydenhuollon tarjoajalle ja apteekkihenkilökunnalle, kun saat uuden lääkkeen.
Miten minun pitäisi ottaa CIPRO 500mg?
- Ota CIPRO juuri sen verran kuin terveydenhuollon tarjoajasi neuvoo sinua ottamaan sen.
- Terveydenhuollon tarjoaja kertoo sinulle, kuinka paljon CIPRO:ta sinun tulee ottaa ja milloin se tulee ottaa.
- CIPRO voidaan ottaa ruoan kanssa tai ilman.
- CIPRO:ta ei tule ottaa pelkän maitotuotteiden (kuten maidon tai jogurtin) tai kalsiumpitoisten mehujen kanssa, vaan se voidaan ottaa näitä tuotteita sisältävän aterian yhteydessä.
- Juo runsaasti nesteitä CIPRO-hoidon aikana.
- Älä ohita yhtään CIPRO-annosta tai lopeta sen ottamista, vaikka tuntisit olosi paremmaksi, ennen kuin olet lopettanut määrätyn hoidon, ellei:
- sinulla on jänne-ongelmia. Katso "Mikä on tärkein tieto, joka minun pitäisi tietää CIPRO:sta?"
- sinulla on hermoongelmia. Katso "Mikä on tärkein tieto, joka minun pitäisi tietää CIPRO:sta?"
- sinulla on keskushermoston ongelmia. Katso "Mikä on tärkein tieto, joka minun pitäisi tietää CIPRO 1000mg:sta?"
- sinulla on vakava allerginen reaktio. Katso "Mitä ovat CIPRO 750mg:n mahdolliset sivuvaikutukset?"
- terveydenhuollon tarjoajasi kehottaa sinua lopettamaan CIPRO:n käytön.
Kaikkien CIPRO-annosten ottaminen auttaa varmistamaan, että kaikki bakteerit kuolevat. Kaikkien CIPRO-annosten ottaminen auttaa vähentämään mahdollisuutta, että bakteerit tulevat vastustuskykyisiksi CIPRO:lle. Jos tulet resistentiksi CIPRO:lle, CIPRO 1000mg ja muut antibakteeriset lääkkeet eivät ehkä toimi sinulle tulevaisuudessa.
-
Jos otat liikaa CIPRO 750 mg -valmistetta, soita terveydenhuollon tarjoajalle tai hakeudu välittömästi lääkärin hoitoon.
-
CIPRO toimitetaan jakouurteisena tablettina (CIPRO 1000 mg tabletit), oraalisuspensiona (CIPRO 750 mg oraalisuspensio), pitkävaikutteisena tablettina (CIPRO XR) ja injektiona suonensisäistä infuusiota varten (CIPRO IV). Lue ja noudata alla olevia ohjeita CIPRO 500 mg:n tyypin osalta, jonka terveydenhuollon tarjoaja on määrännyt sinulle.
CIPRO-tabletit:
- CIPRO Tablets -tabletit ovat 250 mg ja 500 mg jakouurteisia tabletteja, jotka voidaan ottaa kokonaisina tai ne voidaan jakaa kahtia jakouurteesta. Terveydenhuollon tarjoaja kertoo sinulle, kuinka paljon CIPRO 500 mg -tabletteja sinun tulee ottaa ja jos sinun on jaettava CIPRO 1000 mg -tabletit kahtia saadaksesi määrätyn annoksen.
- Ota CIPRO-tabletit aamulla ja illalla suunnilleen samaan aikaan joka päivä. Älä murskaa tai pureskele tablettia. Kerro terveydenhuollon tarjoajalle, jos et voi niellä tablettia.
- Jos unohdat ottaa CIPRO 500 mg -tabletteja ja se on:
- 6 tuntia tai enemmän seuraavaan suunniteltuun annokseen asti, ota unohtunut annos heti. Ota sitten seuraava annos normaaliin aikaan.
- alle 6 tuntia älä ota unohtunutta annosta ennen seuraavaa aikataulun mukaista annosta. Ota seuraava annos normaaliin aikaan.
- Älä ota kahta annosta CIPRO 750 mg -tabletteja kerralla korvataksesi unohtamasi annoksen. Jos et ole varma siitä, milloin ottaa CIPRO 500 mg -tabletit unohtuneen annoksen jälkeen, kysy terveydenhuollon tarjoajalta tai apteekista.
CIPRO oraalinen suspensio:
- Ota CIPRO 1000 mg oraalisuspensio aamulla ja illalla suunnilleen samaan aikaan joka päivä. Ravista CIPRO 750 mg:n oraalisuspensiopulloa hyvin joka kerta ennen käyttöä noin 15 sekunnin ajan varmistaaksesi, että suspensio on sekoittunut hyvin. Sulje pullo kokonaan käytön jälkeen.
- Jos unohdat ottaa annoksen CIPRO-oraalisuspensiota ja se on:
- 6 tuntia tai enemmän seuraavaan suunniteltuun annokseen asti, ota unohtunut annos heti. Ota sitten seuraava annos normaaliin aikaan.
- alle 6 tuntia älä ota unohtunutta annosta ennen seuraavaa aikataulun mukaista annosta. Ota seuraava annos normaaliin aikaan.
- Älä ota kahta annosta CIPRO 750 mg oraalisuspensiota kerralla korvataksesi unohtamasi annoksen. Jos et ole varma, milloin ottaa CIPRO-oraalisuspensiota unohtuneen annoksen jälkeen, kysy terveydenhuollon tarjoajalta tai apteekista.
Mitä minun pitäisi välttää CIPRO:n käytön aikana?
- CIPRO 250mg voi saada sinut tuntemaan huimausta ja huimausta. Älä aja, käytä koneita tai tee muita valppautta tai koordinaatiokykyä vaativia toimintoja, ennen kuin tiedät, kuinka CIPRO 250mg vaikuttaa sinuun.
- Vältä aurinkolamppuja, solariumeja ja yritä rajoittaa aikaasi auringossa. CIPRO 500mg voi tehdä ihosi herkäksi auringolle (valoherkkyys) ja aurinkolamppujen ja solariumien valolle. Saatat saada vakavan auringonpolttaman, rakkuloita tai turvotusta ihollesi. Jos saat jonkin näistä oireista CIPRO 250 mg:n käytön aikana, soita välittömästi terveydenhuollon tarjoajallesi. Sinun tulee käyttää aurinkovoidetta ja käyttää hattua ja ihoa peittäviä vaatteita, jos joudut olemaan auringonpaisteessa.
Mitkä ovat CIPRO:n mahdolliset sivuvaikutukset?
CIPRO voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää CIPRO:sta?"
- Vakavat allergiset reaktiot. Vakavia allergisia reaktioita, mukaan lukien kuolema, voi esiintyä ihmisillä, jotka käyttävät fluorokinoloneja, mukaan lukien CIPRO, jopa yhden annoksen jälkeen. Lopeta CIPRO:n käyttö ja hakeudu välittömästi ensiapuun, jos saat jonkin seuraavista vakavan allergisen reaktion oireista:
- nokkosihottuma
- nopea sydämen syke
- hengitys- tai nielemisvaikeudet
- heikko
- huulten, kielen, kasvojen turvotus
- ihottuma
- kurkun kireys, käheys
Ihmisillä, jotka käyttävät CIPRO 1000 mg:aa, voi esiintyä ihottumaa jopa yhden annoksen jälkeen. Lopeta CIPRO 500 mg:n ottaminen ensimmäisten ihottuman merkkien ilmaantuessa ja soita terveydenhuollon tarjoajalle. Ihottuma voi olla merkki vakavammasta CIPRO-reaktiosta.
- Maksavaurio (hepatotoksisuus). Maksatoksisuutta voi esiintyä ihmisillä, jotka käyttävät CIPRO:ta. Soita heti terveydenhuollon tarjoajallesi, jos sinulla on selittämättömiä oireita, kuten:
- pahoinvointia tai oksentelua
- epätavallinen väsymys
- vatsakipu
- ruokahalun menetys
- kuume
- vaaleat suolenliikkeet
- heikkous
- tumma virtsa
- vatsakipu tai arkuus
- ihon ja silmänvalkuaisten kellastuminen
- kutina
Lopeta CIPRO 750mg:n käyttö ja kerro heti terveydenhuollon tarjoajalle, jos ihosi tai silmäsi valkoinen osa on kellastunut tai jos sinulla on tumma virtsa. Nämä voivat olla merkkejä vakavasta reaktiosta CIPRO:lle (maksasairaus).
- Aortan aneurysma ja dissektio. Kerro terveydenhuollon tarjoajallesi, jos sinulle on koskaan kerrottu, että sinulla on aortan aneurysma, suuren valtimon turvotus, joka kuljettaa verta sydämestä kehoon. Hakeudu välittömästi ensiapuun, jos sinulla on äkillisiä rinta-, vatsa- tai selkäkipuja.
- Suolistotulehdus (Clostridioides difficile – liittyvä ripuli). Clostridioides difficile -bakteeriin liittyvää ripulia (CDAD) voi esiintyä monilla antibakteerisilla lääkkeillä, mukaan lukien CIPRO. Soita välittömästi terveydenhuollon tarjoajallesi, jos saat vetistä ripulia, ripulia, joka ei mene ohi, tai verisiä ulosteita. Sinulla voi olla vatsakramppeja ja kuumetta. CDAD voi tapahtua 2 kuukautta tai enemmän sen jälkeen, kun olet lopettanut antibakteerisen lääkkeesi.
- Vakavat sydämen rytmimuutokset (QT-ajan piteneminen ja torsade de pointes). Kerro heti terveydenhuollon tarjoajallesi, jos sydämesi syke muuttuu (nopea tai epäsäännöllinen syke) tai jos pyörryt. CIPRO voi aiheuttaa harvinaisen sydänongelman, joka tunnetaan QT-ajan pidentymisenä. Tämä tila voi aiheuttaa epänormaalia sydämenlyöntiä ja voi olla erittäin vaarallinen. Tämän tapahtuman todennäköisyys on suurempi ihmisillä:
- jotka ovat vanhoja.
- joiden suvussa on ollut pitkittynyt QT-aika.
- joilla on alhainen veren kaliumpitoisuus (hypokalemia) tai alhainen magnesium (hypomagnesemia).
- jotka käyttävät tiettyjä lääkkeitä sydämen rytmin säätelyyn (antiarytmiset lääkkeet).
- Nivelongelmat. Alle 18-vuotiaiden lasten nivel- ja nivelkudosongelmien mahdollisuus kasvaa. Kerro lapsesi terveydenhuollon tarjoajalle, jos lapsellasi on nivelongelmia CIPRO-hoidon aikana tai sen jälkeen.
- Herkkyys auringonvalolle (valoherkkyys). Katso "Mitä minun tulee välttää CIPRO 250 mg:n käytön aikana?"
- Muutokset verensokerissa. Ihmiset, jotka käyttävät CIPRO:ta ja muita fluorokinolonilääkkeitä oraalisten diabeteslääkkeiden tai insuliinin kanssa, voivat saada alhaisen verensokerin (hypoglykemian) ja korkean verensokerin (hyperglykemian). Noudata terveydenhuollon tarjoajan ohjeita siitä, kuinka usein tarkistat verensokerisi. Jos sinulla on diabetes ja verensokeri on alhainen CIPRO:n käytön aikana, lopeta CIPRO:n käyttö ja soita välittömästi terveydenhuollon tarjoajallesi. Antibioottilääkkeesi on ehkä vaihdettava.
CIPRO 750mg:n yleisimmät sivuvaikutukset ovat:
- pahoinvointi
- ripuli
- muutokset maksan toimintakokeissa
- oksentelua
- ihottuma
Kerro terveydenhuollon tarjoajallesi kaikista sivuvaikutuksista, jotka häiritsevät sinua tai jotka eivät katoa.
Nämä eivät ole kaikkia CIPRO:n mahdollisia sivuvaikutuksia. Lisätietoja saat terveydenhuollon tarjoajalta tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää CIPRO?
CIPRO 500 mg tabletit
- Säilytä huoneenlämmössä 20 °C - 25 °C (68–77 °F).
CIPRO 750 mg oraalisuspensio
- Säilytä mikrokapselit ja laimennusaine huoneenlämmössä 25 °C (77 °F) asti.
- Ei saa jäätyä.
- Kun CIPRO-hoito on päättynyt, hävitä käyttämätön oraalisuspensio turvallisesti.
Pidä CIPRO 250mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa CIPRO:n turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä CIPRO:ta sellaiseen sairauteen, johon sitä ei ole määrätty. Älä anna CIPRO:ta muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tämä lääkitysopas sisältää yhteenvedon tärkeimmistä tiedoista CIPRO:sta. Jos haluat lisätietoja CIPRO:sta, keskustele terveydenhuollon tarjoajasi kanssa. Voit kysyä terveydenhuollon tarjoajaltasi tai apteekista tietoja CIPRO 250mg:sta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Mitä ainesosia CIPRO 500mg sisältää?
CIPRO 1000mg tabletit:
- Aktiivinen ainesosa: sipro 250 mgfloksasiinihydrokloridia
- Inaktiiviset ainesosat: maissitärkkelys, krospovidoni, hypromelloosi, magnesiumstearaatti, mikrokiteinen selluloosa, polyetyleeniglykoli, piidioksidi ja titaanidioksidi.
CIPRO oraalinen suspensio:
- Aktiivinen ainesosa: siprofloksasiini
- Inaktiiviset ainesosat:
- Mikrokapselit sisältävät: hypromelloosi, magnesiumstearaatti, metakryylihappokopolymeeri ja polysorbaatti 20 ja povidoni.
- Laimennusaine sisältää: keskipitkäketjuiset triglyseridit, sakkaroosi, soijalesitiini, vesi ja mansikan maku.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
