Minocin 50mg, 100mg Minocycline Hydrochloride Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Minocin oraalisuspensio on ja miten sitä käytetään?
Minosiini (minosykliinihydrokloridi) on tetrasykliiniantibiootti, jota käytetään monien erilaisten bakteeri-infektioiden hoitoon, kuten virtsatieinfektiot, hengitystieinfektiot, ihotulehdukset, vaikea akne, tippuri, punkkikuume, klamydia ja muut.
Mitkä ovat Minocin-oraalisuspension sivuvaikutukset?
Minocinin yleisiä sivuvaikutuksia ovat:
- huimaus,
- väsynyt tunne,
- pyörivä tunne,
- nivel- tai lihaskipu,
- ihon tai kynsien tai ikenien värjäytymistä,
- pahoinvointi,
- ripuli,
- ärtynyt vatsa,
- ihottuma tai kutina,
- turvonnut kieli tai
- emättimen kutina tai vuoto.
Kerro lääkärillesi, jos sinulla on Minocin 50 mg:n vakavia sivuvaikutuksia, mukaan lukien:
- vatsakramppeja,
- vetistä tai veristä ripulia,
- flunssan oireet,
- haavaumat suussa ja kurkussa,
- heikkous,
- tumma virtsa,
- epätavallinen verenvuoto,
- violetit tai punaiset pisteet ihon alla,
- kuume,
- ihottuma,
- mustelmat,
- vaikea pistely tai puutuminen,
- lihas heikkous,
- ruokahalun menetys,
- ihon tai silmien keltaisuus,
- rintakipu,
- epäsäännöllinen sydämen rytmi,
- yskä,
- hengityksen vinkuminen,
- hengenahdistus,
- hämmennystä,
- oksentelua,
- turvotus,
- painonnousu,
- virtsata tavallista vähemmän tai ei ollenkaan,
- päänsärky tai kipu silmien takana,
- soi korvissasi,
- näköongelmia,
- nivelkipu tai turvotus, johon liittyy kuumetta,
- turvonneet rauhaset,
- lihassäryt,
- yleinen huono olo,
- epätavallisia ajatuksia tai käyttäytymistä,
- kohtaukset (kouristukset) tai
- vakava ihoreaktio.
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja MINOCIN®-oraalisuspension ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi MINOCIN®-oraalisuspensiota tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden on todistettu tai epäillään olevan bakteerin aiheuttamia.
KUVAUS
MINOCIN 100mg minosykliinihydrokloridi on puolisynteettinen johdannainen tetrasykliinistä, 4,7Bis(dimetyyliamino)-1,4,4a,5,5a,6,11,12a-oktahydro-3,10,12,12a-tetrahydroksi-1,11 -diokso-2-naftaseenikarboksamidimonohydrokloridi.
Sen rakennekaava on:
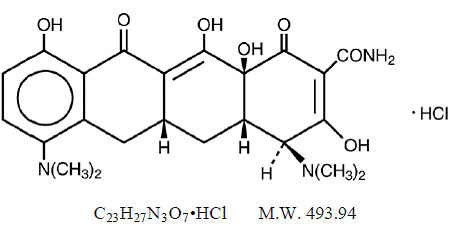 C23H27N3O7•HCl MW 493,94
C23H27N3O7•HCl MW 493,94 MINOCIN 50 mg oraalisuspensio sisältää minosykliinihydrokloridia, joka vastaa 50 mg minosykliiniä 5 ml:ssa (10 mg/ml) ja seuraavat inaktiiviset aineosat: alkoholi, butyyliparabeeni, kalsiumhydroksidi, selluloosa, dekaglyseryylitetraoleaatti, edetaattikalsiumdinatrium, guarbadinatrium 8 , propyyliparabeeni, propyleeniglykoli, natriumsakkariini, natriumsulfiitti (katso VAROITUKSET ) ja sorbitoli.
INDIKAATIOT
MINOCIN 100 mg oraalisuspensio on tarkoitettu seuraavien infektioiden hoitoon, jotka johtuvat nimettyjen mikro-organismien herkistä kannoista:
Rocky Mountain -täpläkuume, lavantauti ja lavantautiryhmä, Q-kuume, riketsiorokko ja riketsioiden aiheuttamat punkkikuumeet.
Mycoplasma pneumoniaen aiheuttamat hengitystieinfektiot.
Chlamydia trachomatis -bakteerin aiheuttama Lymphogranuloma venereum.
Chlamydophila psittacin aiheuttama psittakoosi (ornitoosi).
Chlamydia trachomatis -bakteerin aiheuttama trakooma, vaikka tartunnanaiheuttaja ei aina poistu immunofluoresenssin perusteella.
Chlamydia trachomatis -bakteerin aiheuttama inkluusio sidekalvotulehdus.
Ureaplasma urealyticumin tai Chlamydia trachomatisin aiheuttamat ei-nongonokokkivirtsaputket, kohdunkaulan tai peräsuolen infektiot aikuisilla.
Borrelia recurrentisin aiheuttama uusiutuva kuume.
Haemophilus ducreyin aiheuttama kancroid.
Yersinia pestiksen aiheuttama rutto.
Francisella tularensiksen aiheuttama tularemia.
Vibrio choleraen aiheuttama kolera.
Campylobacter fetusin aiheuttamat Campylobacter fetus -infektiot.
Brucella-lajin aiheuttama luomistauti (yhdessä streptomysiinin kanssa).
Bartonella bacilliformis -bakteerin aiheuttama bartonelloosi.
Granuloma inguinale, jonka aiheuttaa Klebsiella granulomatis.
Minosykliini on tarkoitettu seuraavien gram-negatiivisten mikro-organismien aiheuttamien infektioiden hoitoon, kun bakteriologiset testit osoittavat asianmukaista herkkyyttä lääkkeelle:
Escherichia coli.
Enterobacter aerogenes.
Shigella-lajit.
Acinetobacter-lajit.
Haemophilus influenzaen aiheuttamat hengitystieinfektiot.
Klebsiella-lajien aiheuttamat hengitystie- ja virtsatietulehdukset.
MINOCIN-oraalisuspensio on tarkoitettu seuraavien grampositiivisten mikro-organismien aiheuttamien infektioiden hoitoon, kun bakteriologiset testit osoittavat asianmukaista herkkyyttä lääkkeelle:
Streptococcus pneumoniaen aiheuttamat ylähengitystieinfektiot. Staphylococcus aureuksen aiheuttamat iho- ja ihorakenteen infektiot (huomautus: Minosykliini ei ole suosituin lääke minkään tyyppisten stafylokokki-infektioiden hoidossa).
Kun penisilliini on vasta-aiheinen, minosykliini on vaihtoehtoinen lääke seuraavien infektioiden hoidossa:
Miehillä Neisseria gonorrhoeaen aiheuttama komplisoitumaton virtsaputken tulehdus ja muiden gonokokki-infektioiden hoitoon.
Neisseria gonorrhoeaen aiheuttamat infektiot naisilla.
Treponema pallidum -alalajin pallidum aiheuttama kuppa.
Treponema pallidum -alalajin aiheuttamat leikkaukset pysyvät.
Listeria monocytogenesin aiheuttama listerioosi.
Bacillus anthraciksen aiheuttama pernarutto.
Fusobacterium fusiformen aiheuttama Vincentin infektio.
Actinomyces israelii -bakteerin aiheuttama aktinomykoosi.
Clostridium-lajien aiheuttamat infektiot.
Akuutissa suoliston amebiaasissa minosykliini voi olla hyödyllinen lisäaine amebisideille.
Vaikeassa aknen tapauksessa minosykliini voi olla hyödyllinen lisähoito.
Suun kautta otettava minosykliini on tarkoitettu Neisseria meningitidis -taudin oireettomien kantajien hoitoon meningokokkien poistamiseksi nenänielusta. Jotta minosykliinin käyttökelpoisuus säilyisi oireettomien meningokokkien kantajien hoidossa, on suoritettava diagnostisia laboratoriotoimenpiteitä, mukaan lukien serotyyppi- ja herkkyystestaus kantajatilan ja oikean hoidon määrittämiseksi. On suositeltavaa, että minosykliinin profylaktinen käyttö varataan tilanteisiin, joissa meningokokki-aivokalvontulehduksen riski on suuri.
Suun kautta otettava minosykliini ei ole tarkoitettu meningokokki-infektion hoitoon.
Vaikka kontrolloituja kliinisiä tehotutkimuksia ei ole tehty, rajalliset kliiniset tiedot osoittavat, että suun kautta otettavaa minosykliinihydrokloridia on käytetty menestyksekkäästi Mycobacterium marinumin aiheuttamien infektioiden hoidossa.
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja MINOCIN 100mg -oraalisuspension ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi MINOCIN-oraalisuspensiota tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden todistetaan tai epäillään olevan herkkien bakteerien aiheuttamia. Kun viljely- ja herkkyystiedot ovat saatavilla, ne tulee ottaa huomioon valittaessa tai muuttaessa antibakteerista hoitoa. Tällaisten tietojen puuttuessa paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa hoidon empiiriseen valintaan.
ANNOSTELU JA HALLINNOINTI
MINOSYKLIININ TAVAVALLISET ANNOSTUS JA ANTOTAAJUUS ERÄIVÄT MUIDEN TETRASYKLIINIEN ANNOSTUSTA JA ANTOTAAJUUS. SUOSITETUN ANNOSTUKSEN YLITTAMINEN VOI JOHTAA HAITTAVAIKUTUSTEN LISÄÄNTYMISEEN.
Hoitoa tulee jatkaa vähintään 24–48 tuntia oireiden ja kuumeen häviämisen jälkeen.
Tähän mennessä tehdyt tutkimukset ovat osoittaneet, että ruoka ja maitotuotteet eivät vaikuta merkittävästi MINOCIN-oraalisuspension imeytymiseen.
Minosykliinin farmakokinetiikkaa munuaisten vajaatoimintaa sairastavilla potilailla (CLCR VAROITUKSET ).
Streptokokki-infektioiden hoidossa tetrasykliiniä tulee antaa terapeuttinen annos vähintään kymmenen päivän ajan.
Yli 8-vuotiaille lapsipotilaille
MINOCINin tavallinen lastenannos on 4 mg/kg aluksi ja sen jälkeen 2 mg/kg joka 12. tunti, ei kuitenkaan ylittä tavallista aikuisten annosta.
Aikuiset
Tavallinen MINOCIN-annos on 200 mg aluksi ja sen jälkeen 100 mg 12 tunnin välein.
Syfiliksen hoidossa tavanomainen MINOCIN-annos tulee antaa 10–15 päivän aikana. Tarkkaa seurantaa, mukaan lukien laboratoriokokeet, suositellaan.
Penisilliinille herkkiä tippuripotilaita voidaan hoitaa MINOCIN 50 mg:lla, joka annetaan aluksi 200 mg:na, jonka jälkeen 100 mg 12 tunnin välein vähintään 4 päivän ajan, ja hoidon jälkeen viljelmät 2–3 päivän kuluessa.
Meningokokin kantajatilan hoidossa suositeltu annos on 100 mg 12 tunnin välein 5 päivän ajan.
Mycobacterium marinum -infektiot: Vaikka optimaalisia annoksia ei ole vahvistettu, 100 mg:n 12 tunnin välein 6–8 viikon ajan on käytetty onnistuneesti rajoitetuissa tapauksissa.
Chlamydia trachomatis- tai Ureaplasma urealyticumin aiheuttama komplisoitumaton virtsaputken, kohdunkaulan tai peräsuolen infektio aikuisilla: 100 mg suun kautta 12 tunnin välein vähintään 7 päivän ajan.
Komplisoitumattoman gonokokkivirtsaputkentulehduksen hoidossa miehillä suositellaan 100 mg kahdesti päivässä suun kautta 5 päivän ajan.
MITEN TOIMITETAAN
MINOCIN (minosykliinihydrokloridi) oraalinen suspensio sisältää minosykliinihydrokloridia, joka vastaa 50 mg minosykliiniä teelusikallista (5 ml) kohti. Säilytetty propyyliparabeenilla 0,10 % ja butyyliparabeenilla 0,06 % alkoholilla USP 5 % v/v. Vaniljakastikkeen makuinen.
NDC 16781-473-60 - Pullo 2 fl. Oz. (60 ml)
Säilytä kontrolloidussa huoneenlämmössä 20–25 °C (68–77 °F).
ÄLÄ JÄÄDÄ.
Valmistettu: Onset Dermatologics, LLC Cumberland, RI 02864. Tarkistettu: marraskuu 2018
SIVUVAIKUTUKSET
Suun kautta otettavan minosykliinin lähes täydellisen imeytymisen vuoksi alasuoleen kohdistuvat sivuvaikutukset, erityisesti ripuli, ovat olleet harvinaisia. Seuraavia haittavaikutuksia on havaittu potilailla, jotka ovat saaneet tetrasykliinejä.
Runko kokonaisuudessaan: Kuume ja eritteiden värimuutos.
Ruoansulatuskanava: Anoreksia, pahoinvointi, oksentelu, ripuli, dyspepsia, stomatiitti, glossiitti, dysfagia, kiilteen hypoplasia, enterokoliitti, pseudomembranoottinen paksusuolitulehdus, haimatulehdus, tulehdusvauriot (moniliaalien liikakasvu) suun ja anogenitaalisilla alueilla.
Sukuelimet: Vulvovaginiitti.
Maksatoksisuus: Hyperbilirubinemia, maksan kolestaasi, maksaentsyymien nousu, kuolemaan johtava maksan vajaatoiminta ja keltaisuus. Hepatiittia, mukaan lukien autoimmuunihepatiitti, ja maksan vajaatoimintaa on raportoitu (ks VAROTOIMENPITEET ).

Iho: Hiustenlähtö, erythema nodosum, kynsien hyperpigmentaatio, kutina, toksinen epidermaalinen nekrolyysi, vaskuliitti, makulopapulaarinen ihottuma ja erytematoottinen ihottuma. Eksfoliatiivista ihotulehdusta on raportoitu. Korjattuja huumepurkauksia, mukaan lukien balaniitti, on raportoitu. Erythema multiforme ja Stevens-Johnsonin oireyhtymä on raportoitu. Valoherkkyyttä käsitellään edellä (katso VAROITUKSET ). Ihon ja limakalvojen pigmentoitumista on raportoitu.
Hengitys: Yskä, hengenahdistus, bronkospasmi, astman paheneminen ja keuhkotulehdus.
Munuaisten toksisuus: Interstitiaalinen nefriitti. BUN:n kohoamista on raportoitu, ja ne ovat ilmeisesti annoksesta riippuvaisia (ks VAROITUKSET ). Palautuvaa akuuttia munuaisten vajaatoimintaa on raportoitu.
Tuki- ja liikuntaelimistö: Nivelkipu, niveltulehdus, luun värjäytyminen, myalgia, nivelten jäykkyys ja nivelten turvotus.
Yliherkkyysreaktiot: Nokkosihottuma, angioneuroottinen turvotus, polyartralgia, anafylaksia/anafylaktoidinen reaktio (mukaan lukien sokki ja kuolemantapaukset), anafylaktinen purppura, sydänlihastulehdus, perikardiitti, systeemisen lupus erythematosuksen paheneminen ja keuhkoinfiltraatteja, joihin liittyy eosinofilia, on raportoitu. Ohimenevää lupuksen kaltaista oireyhtymää ja seerumitaudin kaltaisia reaktioita on myös raportoitu.
Veri: Agranulosytoosia, hemolyyttistä anemiaa, trombosytopeniaa, leukopeniaa, neutropeniaa, pansytopeniaa ja eosinofiliaa on raportoitu.
Keskushermosto: Kouristukset, huimaus, hypestesia, parestesia, sedaatio ja huimaus. Pseudotumor cerebri (hyvänlaatuinen kallonsisäinen verenpainetauti) aikuisilla ja pullistuneet fontanelit imeväisillä (ks. VAROTOIMENPITEET - Kenraali ). Myös päänsärkyä on raportoitu.
Muuta: Kilpirauhassyöpää on raportoitu markkinoille tulon jälkeen minosykliinivalmisteiden yhteydessä. Kun minosykliinihoitoa annetaan pitkiä aikoja, kilpirauhassyövän merkkien seurantaa tulee harkita. Pitkään annettuna tetrasykliinien on raportoitu aiheuttavan kilpirauhasen ruskeanmustan mikroskooppisen värjäytymisen. Tapauksia epänormaalista kilpirauhasen toiminnasta on raportoitu.
Hampaiden värjäytyminen alle 8-vuotiailla lapsilla (ks VAROITUKSET ) ja myös aikuisilla on raportoitu.
Suuontelon värimuutoksia (mukaan lukien kieli, huuli ja ikenet) on raportoitu.
Tinnitusta ja kuulon heikkenemistä on raportoitu MINOCINia (minosykliinihydrokloridia) saaneilla potilailla.
Seuraavia oireyhtymiä on raportoitu. Joissakin tapauksissa, joihin liittyy näitä oireyhtymiä, on raportoitu kuolemaa. Kuten muidenkin vakavien haittavaikutusten yhteydessä, jos jokin näistä oireyhtymistä tunnistetaan, lääke on lopetettava välittömästi:
Yliherkkyysoireyhtymä, joka koostuu ihoreaktioista (kuten ihottumasta tai eksfoliatiivisesta ihottumasta), eosinofiliasta ja yhdestä tai useammasta seuraavista: hepatiitti, keuhkotulehdus, nefriitti, sydänlihastulehdus ja perikardiitti. Kuumetta ja lymfadenopatiaa voi esiintyä.
Lupuksen kaltainen oireyhtymä, joka koostuu positiivisesta antinukleaarisesta vasta-aineesta; nivelkipu, niveltulehdus, nivelten jäykkyys tai nivelten turvotus; ja yksi tai useampi seuraavista: kuume, lihaskipu, hepatiitti, ihottuma ja vaskuliitti.
Seerumitaudin kaltainen oireyhtymä, joka koostuu kuumeesta; urtikaria tai ihottuma; ja nivelkipu, niveltulehdus, nivelten jäykkyys tai nivelten turvotus ja lymfadenopatia. Eosinofiliaa voi esiintyä.
Jos haluat ilmoittaa EPÄILLEISTÄ HAITTAVAIKUTUKSISTA, ota yhteyttä Valeant Pharmaceuticals North America LLC:hen numeroon 1-800-321-4576 tai FDA:han numeroon 1-800-FDA-1088 tai www.fda.gov/medwatch.
HUUMEIDEN VUOROVAIKUTUKSET
Koska tetrasykliinien on osoitettu heikentävän plasman protrombiiniaktiivisuutta, antikoagulanttihoitoa saavien potilaiden antikoagulanttiannosta on ehkä muutettava alaspäin.
Koska bakteriostaattiset lääkkeet voivat häiritä penisilliinin bakterisidistä vaikutusta, on suositeltavaa välttää tetrasykliiniluokan lääkkeiden antamista yhdessä penisilliinin kanssa.
Alumiinia, kalsiumia tai magnesiumia sisältävät antasidit ja rautaa sisältävät valmisteet heikentävät tetrasykliinien imeytymistä.
Tetrasykliinin ja metoksifluraanin samanaikaisen käytön on raportoitu aiheuttaneen kuolemaan johtavan munuaistoksisuuden.
Tetrasykliinien samanaikainen käyttö oraalisten ehkäisyvalmisteiden kanssa voi heikentää oraalisten ehkäisyvalmisteiden tehoa.
Isotretinoiinin antamista tulee välttää juuri ennen minosykliinihoitoa, sen aikana ja pian sen jälkeen. Jokainen lääke yksinään on yhdistetty pseudotumor cerebriin (ks VAROTOIMENPITEET ).
Ergotismin riski kasvaa, kun torajyväalkaloideja tai niiden johdannaisia annetaan tetrasykliinien kanssa.
VAROITUKSET
Hampaiden kehitys
MINOCIN-oraalisuspensio, kuten muut tetrasykliiniluokan antibiootit, voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. Jos tetrasykliiniä käytetään raskauden aikana tai jos potilas tulee raskaaksi näiden lääkkeiden käytön aikana, potilasta on informoitava mahdollisesta vaarasta sikiölle. Tetrasykliiniluokan lääkkeiden käyttö hampaiden kehityksen aikana (raskauden viimeinen puolisko, vauvaikä ja lapsuus 8-vuotiaaksi) voi aiheuttaa hampaiden pysyvää värjäytymistä (kelta-harmaa-ruskea).
Tämä haittavaikutus on yleisempi lääkkeen pitkäaikaisen käytön aikana, mutta sitä on havaittu toistuvien lyhytaikaisten hoitokertojen jälkeen. Myös emalin hypoplasiaa on raportoitu. Tetrasykliinilääkkeitä ei siksi tule käyttää hampaiden kehittymisen aikana, elleivät muut lääkkeet todennäköisesti ole tehokkaita tai ne ovat vasta-aiheisia.
Luuston kehitys
Kaikki tetrasykliinit muodostavat vakaan kalsiumkompleksin missä tahansa luuta muodostavassa kudoksessa. Pohjeluun kasvunopeuden on havaittu hidastuvan keskosilla ihmisillä, joille on annettu tetrasykliiniä suun kautta 25 mg/kg kuuden tunnin välein. Tämän reaktion osoitettiin palautuvan, kun lääke lopetettiin.
Käyttö Raskauden aikana
Eläintutkimusten tulokset osoittavat, että tetrasykliinit läpäisevät istukan, niitä löytyy sikiön kudoksista ja niillä voi olla toksisia vaikutuksia kehittyvälle sikiölle (usein liittyy luuston kehityksen hidastumiseen). Näyttöä alkiotoksisuudesta on havaittu eläimillä, joita on hoidettu varhaisessa raskauden aikana. MINOCINin turvallisuutta raskauden aikana ei ole varmistettu.
Dermatologinen reaktio
Minosykliinin käytön yhteydessä on raportoitu lääkeihottumaa, johon liittyy eosinofiliaa ja systeemisiä oireita (DRESS), mukaan lukien kuolemaan johtaneet tapaukset. Jos tämä oireyhtymä tunnistetaan, lääke on lopetettava välittömästi.
Antianabolinen toiminta
Tetrasykliinien antianabolinen vaikutus voi lisätä BUN-arvoa. Vaikka tämä ei ole ongelma potilailla, joilla on normaali munuaisten toiminta, potilailla, joiden toiminta on merkittävästi heikentynyt, korkeammat seerumipitoisuudet tetrasykliiniä voivat johtaa atsotemiaan, hyperfosfatemiaan ja asidoosiin. Tällaisissa olosuhteissa kreatiniinin ja BUN:n seurantaa suositellaan, ja vuorokausiannos ei saa ylittää 200 mg 24 tunnin aikana (ks. ANNOSTELU JA HALLINNOINTI ). Jos munuaisten vajaatoiminta on olemassa, jopa tavalliset suun kautta tai parenteraalisesti annetut annokset voivat johtaa lääkkeen systeemiseen kertymiseen ja mahdolliseen maksatoksisuuteen.
Valoherkkyys
Valoherkkyyttä, joka ilmenee liioiteltuna auringonpolttamana, on havaittu joillakin tetrasykliinejä käyttävillä henkilöillä. Tätä on raportoitu minosykliinin yhteydessä.
Keskushermoston vaikutukset
Keskushermoston sivuvaikutuksia, kuten huimausta, huimausta tai huimausta, on raportoitu minosykliinihoidon yhteydessä. Potilaita, jotka kokevat näitä oireita, tulee varoittaa ajamasta ajoneuvoja tai käyttämästä vaarallisia koneita minosykliinihoidon aikana. Nämä oireet voivat hävitä hoidon aikana ja yleensä häviävät nopeasti, kun lääke lopetetaan.
Clostridium Difficilen liittyvä ripuli
Clostridium difficileen liittyvää ripulia (CDAD) on raportoitu käytettäessä lähes kaikkia antibakteerisia aineita, mukaan lukien MINOCIN 50 mg, ja sen vaikeusaste voi vaihdella lievästä ripulista kuolemaan johtavaan paksusuolentulehdukseen. Hoito antibakteerisilla aineilla muuttaa paksusuolen normaalia kasvillisuutta, mikä johtaa C. difficilen liikakasvuun.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CDAD:n kehittymistä. Hypertoksiinia tuottavat C. difficilen kannat lisäävät sairastuvuutta ja kuolleisuutta, koska nämä infektiot voivat olla vastustuskykyisiä antimikrobiselle hoidolle ja saattavat vaatia kolektomiaa. CDAD on otettava huomioon kaikilla potilailla, joilla on ripuli antibioottien käytön jälkeen. Huolellinen sairaushistoria on tarpeen, koska CDAD:n on raportoitu esiintyvän yli kaksi kuukautta antibakteeristen aineiden annon jälkeen.
Jos CDAD epäillään tai varmistetaan, jatkuva antibioottien käyttö, joka ei ole suunnattu C. difficileä vastaan, saattaa olla tarpeen lopettaa. Asianmukainen neste- ja elektrolyyttihallinta, proteiinilisä, C. difficilen antibioottihoito ja kirurginen arviointi tulee aloittaa kliinisen aiheen mukaan.
Yliherkkyys natriumsulfiitille
MINOCIN-oraalisuspensio sisältää natriumsulfiittia, sulfiittia, joka voi aiheuttaa allergisen tyyppisiä reaktioita, mukaan lukien anafylaktisia oireita ja hengenvaarallisia tai lievempiä astmakohtauksia tietyillä herkillä ihmisillä. Sulfiittiherkkyyden yleinen esiintyvyys väestössä on tuntematon ja todennäköisesti alhainen. Sulfiittiherkkyyttä havaitaan useammin astmaatikoilla kuin ei-astmaisilla.
Intrakraniaalinen hypertensio
Intrakraniaalinen hypertensio (IH, pseudotumor cerebri) on yhdistetty tetrasykliinien, mukaan lukien MINOCINin, käyttöön. IH:n kliinisiä ilmenemismuotoja ovat päänsärky, näön hämärtyminen, diplopia ja näönmenetys; papilledema löytyy fundoskopiassa. Hedelmällisessä iässä olevilla naisilla, jotka ovat ylipainoisia tai joilla on aiemmin ollut IH, on suurempi riski saada tetrasykliiniin liittyvä IH. Isotretinoiinin ja MINOCINin samanaikaista käyttöä tulee välttää, koska isotretinoiinin tiedetään myös aiheuttavan pseudotumor cerebriä.
Vaikka IH tyypillisesti paranee hoidon lopettamisen jälkeen, pysyvän näönmenetyksen mahdollisuus on olemassa. Jos visuaalisia oireita ilmaantuu hoidon aikana, pikainen oftalmologinen arviointi on aiheellista. Koska kallonsisäinen paine voi pysyä koholla vielä viikkoja lääkkeen lopettamisen jälkeen, potilaita tulee seurata, kunnes ne stabiloituvat.
VAROTOIMENPITEET
Kenraali
Kuten muidenkin antibioottivalmisteiden, tämän lääkkeen käyttö voi johtaa ei-herkkien organismien, mukaan lukien sienten, liikakasvuun. Jos superinfektio ilmenee, antibioottihoito on lopetettava ja asianmukainen hoito aloitettava.
Maksatoksisuutta on raportoitu minosykliinin yhteydessä; siksi minosykliiniä tulee käyttää varoen potilailla, joilla on maksan vajaatoiminta, ja yhdessä muiden maksatoksisten lääkkeiden kanssa.
Viilto ja tyhjennys tai muut kirurgiset toimenpiteet tulee tehdä antibioottihoidon yhteydessä, kun se on aiheellista.
MINOCIN-oraalisuspension määrääminen ilman todistettua tai vahvasti epäiltyä bakteeri-infektiota tai profylaktista indikaatiota ei todennäköisesti hyödytä potilasta ja lisää lääkeresistenttien bakteerien kehittymisen riskiä.
Laboratoriotestit
Elinjärjestelmien, mukaan lukien hematopoieettisten, munuaisten ja maksan, laboratorioarvioinnit tulee suorittaa säännöllisesti.
Kaikille gonorreapotilaille tulee tehdä serologinen testi kupan varalta diagnoosin yhteydessä. Minosykliinillä hoidetuille potilaille tulee tehdä serologinen seurantatesti kupan varalta 3 kuukauden kuluttua.
Lääke/laboratoriotestien vuorovaikutukset
Virtsan katekoliamiinitasojen vääriä nousuja voi esiintyä fluoresenssitestin häiriöiden vuoksi.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Minosykliinin ruokavalion antaminen pitkäaikaisissa tuumorigeenisyystutkimuksissa rotilla johti näyttöön kilpirauhaskasvaimen tuotannosta. Minosykliinin on myös havaittu aiheuttavan kilpirauhasen liikakasvua rotilla ja koirilla. Lisäksi on havaittu onkogeenistä aktiivisuutta rotilla tutkimuksissa samankaltaisella antibiootilla, oksitetrasykliinillä (eli lisämunuaisen ja aivolisäkkeen kasvaimia). Samoin, vaikka minosykliinin mutageenisuustutkimuksia ei ole tehty, positiivisia tuloksia in vitro nisäkässolumäärityksissä (eli hiiren lymfooma ja kiinanhamsterin keuhkosolut) on raportoitu samankaltaisilla antibiooteilla (tetrasykliinihydrokloridi ja oksitetrasykliini). Segmentin I (hedelmällisyys ja yleinen lisääntyminen) tutkimukset ovat osoittaneet, että minosykliini heikentää urosrottien hedelmällisyyttä.
Raskaus
Riskien yhteenveto
Kaikilla raskauksilla on taustariski synnynnäisille epämuodostumille, menetyksille tai muulle haitalliselle seuraukselle riippumatta lääkealtistuksesta. Minosykliinin käytöstä raskaana oleville naisille ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia. Minosykliini, kuten muut tetrasykliiniluokan antibiootit, läpäisee istukan ja voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. Harvinaisia spontaaneja raportteja synnynnäisistä epämuodostumista, mukaan lukien raajojen pieneneminen, on raportoitu markkinoille tulon jälkeen. Näistä raporteista on saatavilla vain rajoitetusti tietoa; siksi syy-yhteydestä ei voida tehdä päätelmiä. Jos minosykliiniä käytetään raskauden aikana tai jos potilas tulee raskaaksi tämän lääkkeen käytön aikana, potilasta on informoitava mahdollisesta vaarasta sikiölle.
Ei-teratogeeniset vaikutukset: (katso VAROITUKSET ).
Työ ja toimitus
Tetrasykliinien vaikutusta synnytykseen ja synnytykseen ei tunneta.
Imettävät äidit
Tetrasykliinit erittyvät äidinmaitoon. Koska tetrasykliinit voivat aiheuttaa vakavia haittavaikutuksia imetettäville vauvoille, on päätettävä, lopetetaanko imetys vai lopetetaanko lääkkeen käyttö, ottaen huomioon lääkkeen merkitys äidille (ks. VAROITUKSET ).
Käyttö lapsille
Minosykliiniä ei suositella käytettäväksi alle 8-vuotiaille lapsille, elleivät hoidon odotetut hyödyt ole riskejä suuremmat (ks. VAROITUKSET ).
Geriatrinen käyttö
Suun kautta otettavan minosykliinin kliinisissä tutkimuksissa ei ollut riittävästi 65-vuotiaita ja sitä vanhempia koehenkilöitä sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat. Yleensä iäkkäälle potilaalle annoksen valinnassa tulee olla varovaista, yleensä alkaen annosalueen alimmasta päästä, mikä heijastaa useammin heikentynyttä maksan, munuaisten tai sydämen toimintaa sekä samanaikaista sairautta tai muuta lääkehoitoa (ks. VAROITUKSET , ANNOSTELU JA HALLINNOINTI ).
MINOCIN 50 mg oraalisuspensio sisältää 4,3 mg (0,18 mekv.) natriumia 5 ml:ssa.
YLIANNOSTUS
Yliannostuksen yhteydessä yleisempiä haittavaikutuksia ovat huimaus, pahoinvointi ja oksentelu.
Minosykliinille ei tunneta spesifistä vastalääkettä.
Yliannostustapauksissa lopeta lääkitys, hoida oireenmukaisesti ja aloita tukitoimenpiteitä. Minosykliiniä ei poisteta merkittäviä määriä hemodialyysillä tai peritoneaalidialyysillä.
VASTA-AIHEET
Tämä lääke on vasta-aiheinen henkilöille, jotka ovat osoittaneet yliherkkyyttä jollekin tetrasykliinille tai jollekin tuotteen koostumuksen aineosista.
KLIININEN FARMAKOLOGIA
Kahden 100 mg:n minosykliini-HCl-jauhetäytteisen kapselin kerta-annoksen jälkeen, kun annettiin kymmenelle normaalille aikuiselle vapaaehtoiselle, seerumitasot vaihtelivat 0,74-4,45 mcg/ml tunnissa (keskiarvo 2,24); 12 tunnin kuluttua ne vaihtelivat välillä 0,34 - 2,36 mcg/ml (keskiarvo 1,25). Puoliintumisaika seerumissa 200 mg:n kerta-annoksen jälkeen 12:lla olennaisesti normaalilla vapaaehtoisella oli 11-17 tuntia. Seitsemällä maksan vajaatoimintaa sairastavalla potilaalla se vaihteli 11–16 tunnin välillä ja viidellä munuaisten vajaatoimintaa sairastavalla potilaalla 18–69 tuntia. Minosykliinin virtsaan ja ulosteeseen erittyi, kun sitä annettiin 12 normaalille vapaaehtoiselle, oli puolet tai kolmasosa muiden tetrasykliinien määrästä.
Mikrobiologia
Toimintamekanismi
Tetrasykliinit ovat ensisijaisesti bakteriostaattisia, ja niiden uskotaan saavan aikaan antimikrobisen vaikutuksensa estämällä proteiinisynteesiä. Tetrasykliineillä, mukaan lukien minosykliinillä, on samanlainen antimikrobinen aktiivisuusspektri monia grampositiivisia ja gramnegatiivisia organismeja vastaan. Näiden organismien ristiresistenssi tetrasykliinille on yleistä.
Antimikrobinen aktiivisuus
Minosykliinin on osoitettu olevan aktiivinen useimpia seuraavien mikro-organismien kantoja vastaan sekä in vitro että kliinisissä infektioissa, kuten INDIKAATIOT osio:
Gram-positiiviset bakteerit
Bacillus anthracis Listeria monocytogenes Staphylococcus aureus Streptococcus pneumoniae
Gram-negatiiviset bakteerit
Bartonella bacilliformis Brucella-lajit Klebsiella granulomatis Campylobacter fetus Francisella tularensis Haemophilus ducreyi Vibrio cholerae Yersinia pestis Acinetobacter-lajit Enterobacter aerogenes Escherichia coli Haemophilus influenzae Klebsiella-lajit Neisseria Neisseria gonorgehoe miehet
Muut mikro-organismit
Actinomyces-lajit Borrelia recurrentis Chlamydophila psittaci Chlamydia trachomatis Clostridium-lajit Entamoeba-lajit Fusobacterium nucleatum-alalaji fusiforme Mycobacterium marinum Mycoplasma pneumoniae Propionibacterium acnes Rickettsiae peruurepalliuplasma-alalajit Treponema pallidum-alalajit
Herkkyystestaus
Katso tarkkoja tietoja herkkyystestin tulkintakriteereistä ja niihin liittyvistä testimenetelmistä sekä FDA:n tälle lääkkeelle tunnustamista laadunvalvontastandardeista: https://www.fda.gov/STIC.
Eläinfarmakologia ja toksikologia
Minosykliini-HCl:n on havaittu aiheuttavan kilpirauhasen tummaa värimuutosta koe-eläimillä (rotilla, minisioilla, koirilla ja apinoilla). Rotilla krooninen hoito minosykliinihydrokloridilla on johtanut struumaan, johon on liittynyt lisääntynyt radioaktiivisen jodin otto ja näyttöä kilpirauhaskasvaimen tuotannosta. Minosykliinihydrokloridin on myös havaittu aiheuttavan kilpirauhasen liikakasvua rotilla ja koirilla.
POTILASTIEDOT
Ripuli on yleinen antibioottien aiheuttama ongelma, joka yleensä loppuu, kun antibioottihoito lopetetaan. Joskus antibioottihoidon aloittamisen jälkeen potilaille voi ilmaantua vetisiä ja verisiä ulosteita (vatsakouristuksella ja kuumeella tai ilman) jopa kahden tai useamman kuukauden kuluttua viimeisen antibioottiannoksen ottamisesta. Jos näin tapahtuu, potilaiden tulee ottaa yhteyttä lääkäriin mahdollisimman pian.
Valoherkkyyttä, joka ilmenee liioiteltuna auringonpolttamana, on havaittu joillakin tetrasykliinejä käyttävillä henkilöillä. Potilaita, jotka altistuvat suoralle auringonvalolle tai ultraviolettivalolle, tulee kertoa, että tämä reaktio voi ilmaantua tetrasykliinilääkkeiden käytön yhteydessä, ja hoito tulee lopettaa, kun ihon punoitusta havaitaan. Tämä reaktio on raportoitu käytettäessä minosykliiniä.
Potilaita, joilla on keskushermoston oireita, tulee varoittaa ajamasta ajoneuvoja tai käyttämästä vaarallisia koneita minosykliinihoidon aikana (ks. VAROITUKSET ).
Tetrasykliinin samanaikainen käyttö oraalisten ehkäisyvalmisteiden kanssa voi heikentää oraalisten ehkäisyvalmisteiden tehoa (ks. HUUMEIDEN VUOROVAIKUTUKSET ).
Potilaita tulee neuvoa, että antibakteerisia lääkkeitä, mukaan lukien MINOCIN 50 mg oraalisuspensiota, tulee käyttää vain bakteeri-infektioiden hoitoon. Ne eivät hoida virusinfektioita (esim. flunssaa). Kun MINOCIN-oraalisuspensiota määrätään bakteeri-infektion hoitoon, potilaille tulee kertoa, että vaikka on yleistä, että olo paranee hoidon alussa, lääkettä tulee ottaa täsmälleen ohjeiden mukaan. Annosten väliin jättäminen tai koko hoitojakson suorittamatta jättäminen voi (1) heikentää välittömän hoidon tehokkuutta ja (2) lisätä todennäköisyyttä, että bakteerit kehittävät resistenssiä ja että niitä ei voida hoitaa MINOCIN 50mg -oraalisuspensiolla tai muilla antibakteerisilla lääkkeillä tulevaisuudessa .
Käyttämättömät tetrasykliiniantibiootit on hävitettävä viimeiseen käyttöpäivään mennessä.
