Vantin 200mg, 100mg Cefpodoxime Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Vantin 100mg on ja miten sitä käytetään?
Vantin 100mg on reseptilääke, jota käytetään erilaisten bakteeri-infektioiden, kuten keuhkoputkentulehduksen, keuhkokuumeen, poskiontelotulehduksen, nielutulehduksen, nielurisatulehduksen, virtsatieinfektioiden, ihoinfektioiden ja tippuritulehdusten oireiden hoitoon. Vantin 200 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Vantin kuuluu lääkeryhmään nimeltä Caphalosporins, 3rd Generation.
Ei tiedetä, onko Vantin turvallinen ja tehokas alle 2 kuukauden ikäisille lapsille.
Mitkä ovat Vantin 200mg:n mahdolliset sivuvaikutukset?
Vantin voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nokkosihottuma,
- vaikeuksia hengittää,
- kasvojen, huulten, kielen tai kurkun turvotus,
- kuume,
- kipeä kurkku,
- polttaa silmissäsi,
- ihokipu,
- punainen tai violetti ihottuma, joka leviää ja aiheuttaa rakkuloita ja hilseilyä,
- kova vatsakipu,
- vetistä tai veristä ripulia,
- turvonneet rauhaset,
- nivelkipu,
- yleinen huono olo,
- sykkivät sydämenlyönnit,
- lepattaa rinnassasi,
- hengenahdistus ja
- kohtaus
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Vantinin yleisimpiä sivuvaikutuksia ovat:
- emättimen kutina tai vuoto,
- vaippaihottuma tätä lääkettä käyttävällä lapsella,
- pahoinvointi,
- oksentelua,
- ripuli,
- vatsakipuja ja
- päänsärky
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Vantinin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja VANTIN 100mg:n ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi VANTIN 100mg -valmistetta tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden todistetaan tai epäillään olevan bakteerien aiheuttamia.
KUVAUS
Kefpodoksiimiproksetiili on suun kautta otettava, laajakirjoinen, puolisynteettinen kefalosporiiniluokan antibiootti. Kemiallinen nimi on (RS)-1(isopropoksikarbonyylioksi)etyyli-(+)-(6R,7R)-7-[2-(2-amino-4-tiatsolyyli)-2-{(Z)metoksi-imino}asetamido]-3 -metoksimetyyli-8-okso-5-tia-1-atsabisyklo[4.2.0]okt-2-eeni-2-karboksylaatti. Sen empiirinen kaava on C21H27N5O9S2 ja sen rakennekaava on esitetty alla:
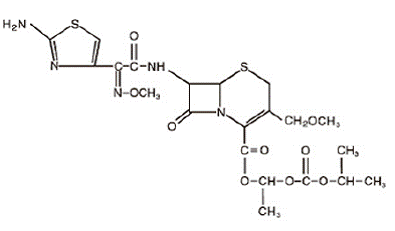
Kefpodoksiimiproksetiilin molekyylipaino on 557,6.
Kefpodoksiimiproksetiili on aihiolääke; sen aktiivinen metaboliitti on kefpodoksiimi. Kaikki kefpodoksiimiproksetiilin annokset tässä insertissä ilmaistaan aktiivisena kefpodoksiimiosana. Lääkettä toimitetaan sekä kalvopäällysteisinä tabletteina että maustetuina rakeina oraalisuspensiota varten.
VANTIN-tabletit sisältävät kefpodoksiimiproksetiilia, joka vastaa 100 mg tai 200 mg kefpodoksiimiaktiivisuutta, ja seuraavia inaktiivisia ainesosia: karboksimetyyliselluloosakalsium, karnaubavaha, FD&C Yellow nro 6, hydroksipropyyliselluloosa, hypromelloosi, laktoosi- ja vesipitoinen laktoosi, magnesiumsulfaatti, natriumsulfaatti ja natriumsulfaatti. titaanidioksidi. Lisäksi 100 mg:n kalvopäällysteiset tabletit sisältävät D&C Yellow No. 10:tä ja 200 mg:n kalvopäällysteiset tabletit sisältävät FD&C Red No. 40:tä.
Jokainen 5 ml VANTIN-oraalisuspensiota sisältää kefpodoksiimiproksetiilia, joka vastaa 50 mg tai 100 mg kefpodoksiimiaktiivisuutta valmistuksen jälkeen, ja seuraavat inaktiiviset aineosat: keinotekoiset aromit, butyloitu hydroksianisoli (BHA), karboksimetyyliselluloosanatrium, mikrokiteinen selluloosa, karrageeni, kolloidihappo, sitruunahappo. piidioksidi, kroskarmelloosinatrium, hydroksipropyyliselluloosa, laktoosi, maltodekstriini, luonnolliset aromit, propyleeniglykolialginaatti, natriumsitraatti, natriumbentsoaatti, tärkkelys, sakkaroosi ja kasviöljy.
INDIKAATIOT
Kefpodoksiimiproksetiili on tarkoitettu potilaiden hoitoon, joilla on lieviä tai keskivaikeita infektioita, jotka ovat aiheuttaneet nimettyjen mikro-organismien herkät kannat alla luetelluissa olosuhteissa.
Suositellut annokset, hoidon kesto ja soveltuvat potilasryhmät vaihtelevat näiden infektioiden välillä. Katso erityiset suositukset kohdasta ANNOSTUS JA ANNOSTUS. Akuutti välikorvatulehdus Streptococcus pneumoniae (pois lukien penisilliiniresistentit kannat), Streptococcus pyogenes, Haemophilus influenzae (mukaan lukien beetalaktamaasia tuottavat kannat) tai Moraxella (Branhamella) catarrhalis (mukaan lukien beetalaktamaasia tuottavat kannat).
Streptococcus pyogenesin aiheuttama nielutulehdus ja/tai tonsilliitti.
MERKINTÄ: Vain lihakseen annettu penisilliini on osoitettu tehokkaaksi reumakuumeen ehkäisyssä. Kefpodoksiimiproksetiili on yleensä tehokas streptokokkien hävittämisessä suunielusta. Tietoa kefpodoksiimiproksetiilin tehosta myöhemmän reumakuumeen ehkäisyssä ei kuitenkaan ole saatavilla.
Yhteisössä hankittu keuhkokuume S. pneumoniae tai H. Influenzae (mukaan lukien beetalaktamaasia tuottavat kannat).
Kroonisen keuhkoputkentulehduksen akuutti bakteerien paheneminen aiheuttaa S. pneumoniae, H. influenzae (ainoastaan ei-betalaktamaasia tuottavat kannat) tai M. catarrhalis. Tällä hetkellä tiedot eivät riitä osoittamaan tehoa potilailla, joilla on akuutteja bakteeriperäisiä kroonisen keuhkoputkentulehduksen pahenemisvaiheita, jotka johtuvat beetalaktamaasia tuottavista H. influenzae -kannoista.
Akuutti, komplisoitumaton virtsaputken ja kohdunkaulan tippuri Neisseria gonorrhoeae (mukaan lukien penisillinaasia tuottavat kannat).
Akuutit, komplisoitumattomat ano-peräsuolen infektiot naisilla Neisseria gonorrhoeae (mukaan lukien penisillinaasia tuottavat kannat).
MERKINTÄ: Kefpodoksiimin tehoa hoidettaessa miespotilaita, joilla on N. gonorrhoeaen aiheuttamia peräsuolen infektioita, ei ole osoitettu. Tiedot eivät tue kefpodoksiimiproksetiilin käyttöä N. gonorrhoeaen aiheuttamien nielun infektioiden hoidossa miehillä tai naisilla.
Komplisoitumattomat iho- ja ihorakenteen infektiot Staphylococcus aureuksen (mukaan lukien penisillinaasia tuottavat kannat) tai Streptococcus pyogenesin aiheuttamat. Paiseet tulee poistaa kirurgisesti kliinisen tarpeen mukaan.
MERKINTÄ: Kliinisissä tutkimuksissa komplisoitumattomien ihon ja ihon rakenneinfektioiden onnistunut hoito oli annosriippuvaista. Tehokas terapeuttinen annos ihotulehdusten hoidossa oli suurempi kuin muissa suositelluissa käyttöaiheissa käytetyt. (Katso ANNOSTELU JA HALLINNOINTI .)
Akuutti poskiontelotulehdus aiheuttajat Haemophilus influenzae (mukaan lukien beetalaktamaasia tuottavat kannat), Streptococcus pneumoniae ja Moraxella catarrhalis.
Komplisoitumattomat virtsatieinfektiot (kystiitti) Escherichia colin, Klebsiella pneumoniaen, Proteus mirabilisin tai Staphylococcus saprophyticuksen aiheuttamat.
MERKINTÄ: Harkittaessa kefpodoksiimiproksetiilin käyttöä kystiitin hoidossa, kefpodoksiimiproksetiilin alhaisempia bakteerien häviämisasteita on punnittava verrattuna joidenkin muiden hyväksyttyjen lääkeaineiden ryhmien lisääntyneeseen hävittämisasteeseen ja erilaisiin turvallisuusprofiileihin. (Katso Kliiniset tutkimukset jakso.)
Bakteriologista tutkimusta varten on hankittava asianmukaiset näytteet taudinaiheuttajaorganismien eristämiseksi ja tunnistamiseksi sekä niiden herkkyyden määrittämiseksi kefpodoksiimille. Hoito voidaan aloittaa näiden tutkimusten tuloksia odotellessa. Kun nämä tulokset ovat saatavilla, mikrobihoitoa on mukautettava vastaavasti.
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja VANTIN 100mg:n ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi VANTIN 200mg -valmistetta tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden todistetaan tai epäillään olevan herkkien bakteerien aiheuttamia. Kun viljely- ja herkkyystiedot ovat saatavilla, ne tulee ottaa huomioon valittaessa tai muuttaessa antibakteerista hoitoa. Tällaisten tietojen puuttuessa paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa hoidon empiiriseen valintaan.
ANNOSTELU JA HALLINNOINTI
(Katso KÄYTTÖAIHEET JA KÄYTTÖ osoitetuille taudinaiheuttajille.)
Kalvopäällysteiset tabletit
VANTIN-tabletit tulee ottaa suun kautta ruoan kanssa imeytymisen tehostamiseksi. (Katso KLIININEN FARMAKOLOGIA .)
Suositellut annokset, hoidon kesto ja soveltuva potilaspopulaatio on kuvattu seuraavassa taulukossa:
Aikuiset ja nuoret (12-vuotiaat ja sitä vanhemmat)
Rakeet oraalisuspensiota varten
VANTIN-oraalisuspensio voidaan antaa ruoasta riippumatta. Suositellut annokset, hoidon kesto ja sovellettavat potilasryhmät ovat seuraavan taulukon mukaisia:
Aikuiset ja nuoret (12-vuotiaat ja sitä vanhemmat)
Imeväiset ja lapsipotilaat (ikä 2 kuukautta - 12 vuotta)
Potilaat, joilla on munuaisten vajaatoiminta
Potilailla, joilla on vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma
Kun vain seerumin kreatiniinitaso on saatavilla, seuraavaa kaavaa (perustuu potilaan sukupuoleen, painoon ja ikään) voidaan käyttää kreatiniinipuhdistuman (ml/min) arvioimiseen. Jotta tämä arvio olisi pätevä, seerumin kreatiniinitason tulee edustaa vakaata munuaistoiminnan tilaa.
Miehet (ml/min): Paino (kg) x (140 - ikä) / 72 x seerumin kreatiniini (mg/100 ml)
Naaraat (ml/min) : 0,85 x arvon yläpuolella
Potilaat, joilla on kirroosi
Kefpodoksiimin farmakokinetiikka kirroosipotilailla (jolla on tai ei ole askitesta) on samanlainen kuin terveillä henkilöillä. Annoksen muuttaminen ei ole tarpeen tässä populaatiossa.
Suspension valmistelu
Perustuslain ohjeet suulliseen keskeyttämiseen
Sekoituksen jälkeen suspensio tulee säilyttää jääkaapissa, 2–8 °C (36–46 °F). Ravista hyvin ennen käyttöä. Pidä säiliö tiiviisti suljettuna. Seosta voidaan käyttää 14 päivää. Hävitä käyttämätön osa 14 päivän kuluttua.
MITEN TOIMITETAAN
VANTIN Tabletit on saatavana seuraavina vahvuuksina (kefpodoksiimivastine), väreinä ja kokoina:
100 mg (vaaleanoranssi, elliptinen, kohokuvioitu U3617)
Pullot 20 NDC 0009-3617-01 100 pullot NDC 0009-3617-02 100 yksikköannospakkaukset NDC 0009-3617-03
200 mg (korallinpunainen, elliptinen, kohokuvioitu U3618)
Pullot 20 NDC 0009-3618-01 100 pullot NDC 0009-3618-02
200 mg (korallinpunainen, elliptinen, kohokuvioitu U3618)
100 yksikköannospakkaukset NDC 0009-3618-03
Säilytä tabletit kontrolloidussa huoneenlämmössä 20–25 °C (68–77 °F) [katso USP ].
Kiinnitä korkki tiukasti jokaisen avaamisen jälkeen. Suojaa yksikköannospakkauksia liialliselta kosteudelta.
VANTIN 200 mg oraalisuspensio tarjoaa 50 mg tai 100 mg kefpodoksiimia vastaavan määrän 5 ml:aa suspensiota (ohjeiden mukaisesti valmistettuna) ja sitä on saatavana sitruunakerman makuisena seuraavissa koossa:
50 mg/5 ml
100 ml suspensiota NDC 0009-3531-01 75 ml suspensio NDC 0009-3531-02 50 ml suspensio NDC 0009-3531-03
100 mg/5 ml
100 ml suspensiota NDC 0009-3615-01 75 ml suspensio NDC 0009-3615-02 50 ml suspensio NDC 0009-3615-03
Säilytä suspendoimattomat rakeet valvotussa huoneenlämpötilassa 20–25 °C (68–77 °F) [katso USP ].
Sekoitusohjeet ovat etiketissä. Sekoituksen jälkeen suspensio tulee säilyttää jääkaapissa, 2° - 8°C (36° - 46°F). Ravista hyvin ennen käyttöä. Pidä säiliö tiiviisti suljettuna. Seosta voidaan käyttää 14 päivää. Hävitä käyttämätön osa 14 päivän kuluttua.
Jakelija: Pharmacia & Upjohn Company, Division of Pfizer Inc., NY, NY 10017. Tarkistettu: elokuu 2016
SIVUVAIKUTUKSET
Kliiniset tutkimukset
Kalvopäällysteiset tabletit (useita annoksia)
Kliinisissä tutkimuksissa käyttäen useita annoksia kefpodoksiimiproksetiilikalvopäällysteisistä tableteista 4 696 potilasta hoidettiin suositelluilla kefpodoksiimin annoksilla (100–400 mg Q 12 tuntia). Mitään kuolemia tai pysyviä vammoja ei uskottu liittyvän huumeiden toksisuuteen. Satakaksikymmentäyhdeksän (2,7 %) potilasta keskeytti lääkityksen mahdollisten tai todennäköisesti lääketoksisuuteen liittyvien haittatapahtumien vuoksi. Yhdeksänkymmentäkolme (52 %) 178 potilaasta, jotka keskeyttivät hoidon (riippumatta siitä, liittyvätkö he lääkehoitoon tai eivät), keskeytti sen maha-suolikanavan häiriöiden, pahoinvoinnin, oksentelun tai ripulin vuoksi. Kefpodoksiimiproksetiilia saaneiden potilaiden prosenttiosuus, jotka keskeyttivät tutkimuslääkkeen käytön haittavaikutusten vuoksi, oli merkittävästi suurempi 800 mg:n vuorokausiannoksella kuin 400 mg:n vuorokausiannoksella tai 200 mg:n vuorokausiannoksella. Haittatapahtumat, joiden uskottiin mahdollisesti tai todennäköisesti liittyvän kefpodoksiimiin usean annoksen kliinisissä tutkimuksissa (N = 4696 kefpodoksiimilla hoidettua potilasta), olivat:
Ilmaantuvuus suurempi kuin 1 %
Ripuli 7,0 %
Ripuli tai löysät ulosteet olivat annoksesta riippuvaisia: väheni 10,4 %:sta potilaista, jotka saivat 800 mg päivässä, 5,7 %:iin potilailla, jotka saivat 200 mg päivässä. Potilaista, joilla oli ripuli, 10 %:lla oli ulosteessa C. difficile -organismia tai -toksiinia. (Katso VAROITUKSET .)
Pahoinvointi 3,3 % Emättimen sieni-infektiot 1,0 % Vulvoemättimen infektiot 1,3 % Vatsakipu 1,2 % Päänsärky 1,0 %
Ilmaantuvuus alle 1 %
Kehon järjestelmän mukaan laskevassa järjestyksessä
Kliiniset tutkimukset
Kefpodoksiimiproksetiiliin mahdollisesti ajatellut tai todennäköisesti liittyvät haittatapahtumat, joita esiintyi alle 1 %:lla potilaista (N=4696)
Runko - sieni-infektiot, vatsan turvotus, huonovointisuus, väsymys, voimattomuus, kuume, rintakipu, selkäkipu, vilunväristykset, yleinen kipu, epänormaalit mikrobiologiset testit, moniliaasi, absessi, allerginen reaktio, kasvojen turvotus, bakteeri-infektiot, loisinfektiot, paikallinen turvotus, paikallinen kipu .
Sydän- kongestiivinen sydämen vajaatoiminta, migreeni, sydämentykytys, vasodilataatio, hematooma, verenpainetauti, hypotensio.
Ruoansulatus - oksentelu, dyspepsia, suun kuivuminen, ilmavaivat, ruokahalun heikkeneminen, ummetus, suun moniliaasi, ruokahaluttomuus, eryktaatio, gastriitti, suun haavaumat, maha-suolikanavan häiriöt, peräsuolen häiriöt, kielen häiriöt, hampaiden häiriöt, lisääntynyt jano, suun leesiot, tenesmus, kuivuminen .
Hemic ja lymfaattinen - anemia.
Aineenvaihdunta ja ravitsemus - nestehukka, kihti, perifeerinen turvotus, painon nousu.
Lihas-luusto - myalgia.
Hermostunut - huimaus, unettomuus, uneliaisuus, ahdistuneisuus, vapina, hermostuneisuus, aivoinfarkti, unien muutokset, keskittymiskyvyn heikkeneminen, sekavuus, painajaiset, parestesia, huimaus.
Hengitys - astma, yskä, nenäverenvuoto, nuha, hengityksen vinkuminen, keuhkoputkentulehdus, hengenahdistus, pleuraeffuusio, keuhkokuume, sinuiitti.
Iho - nokkosihottuma, ihottuma, kutina ei-levityskohdassa, hikoilu, makulopapulaarinen ihottuma, sieni-ihottuma, hilseily, kuiva iho ei-levityskohta, hiustenlähtö, vesiculobulloous ihottuma, auringonpolttama.
Erityiset aistit - makuaistin muutokset, silmien ärsytys, makuaistin menetys, tinnitus.
Urogenitaali - hematuria, virtsatietulehdukset, metrorrhagia, dysuria, virtsaamistiheys, nokturia, peniksen tulehdus, proteinuria, emätinkipu.
Rakeet oraalisuspensiota varten (useita annoksia)
Kliinisissä tutkimuksissa, joissa käytettiin useita annoksia kefpodoksiimiproksetiilirakeita oraalisuspensiota varten, 2128:aa lapsipotilasta (joista 93 % oli alle 12-vuotiaita) hoidettiin suositelluilla kefpodoksiimin annoksilla (10 mg/kg/vrk Q 24 tuntia tai jaettuna Q 12 tuntia aikuisen enimmäisannokseen). Yhdelläkään näissä tutkimuksissa olevista potilaista ei ollut kuolemia tai pysyviä vammoja. 24 potilasta (1,1 %) keskeytti lääkityksen tutkimuslääkkeeseen mahdollisesti tai todennäköisesti liittyvien haittavaikutusten vuoksi. Ensisijaisesti nämä keskeytykset johtuivat ruoansulatuskanavan häiriöiden, yleensä ripulin, oksentelun tai ihottumien vuoksi.
Haittatapahtumat, joiden uskottiin mahdollisesti tai luultavasti liittyvän kefpodoksiimiproksetiiliin oraalisuspensioon tai joiden suhdetta ei tiedetä moniannoksilla tehdyissä kliinisissä tutkimuksissa (N=2128 kefpodoksiimilla hoidettua potilasta):
Ilmaantuvuus suurempi kuin 1 %
Ripuli 6,0 % Ripulin ilmaantuvuus imeväisillä ja pikkulapsilla (ikä 1 kk - 2 vuotta) oli 12,8 %. Vaippaihottuma/sieni-ihottuma 2,0 % (sisältää moniliaasin) Vaippaihottuman ilmaantuvuus imeväisillä ja taaperoilla oli 8,5 %. Muut ihottumat 1,8 % Oksentelu 2,3 %
Ilmaantuvuus alle 1 %
Runko: Paikallinen vatsakipu, vatsakrampit, päänsärky, monilia, yleistynyt vatsakipu, astenia, kuume, sieni-infektio.
Ruoansulatus: Pahoinvointi, monilia, anoreksia, suun kuivuminen, stomatiitti, pseudomembranoottinen paksusuolitulehdus.
Hemic ja lymfaattiset: Trombosytemia, positiivinen suora Coombsin testi, eosinofilia, leukosytoosi, leukopenia, pitkittynyt osittainen tromboplastiiniaika, trombosytopeeninen purppura.
Aineenvaihdunta ja ravitsemus: Lisääntynyt SGPT.
Lihas-luusto: Myalgia.
Hermostunut: Hallusinaatiot, hyperkinesia, hermostuneisuus, uneliaisuus.
Hengitys: Nenäverenvuoto, nuha.

Iho: Ihon moniliaasi, nokkosihottuma, sieni-ihottuma, akne, hilseilevä ihottuma, makulopapulaarinen ihottuma.
Erityiset aistit: Makuperversio.
Kalvopäällysteiset tabletit (kerta-annos)
Kliinisissä tutkimuksissa a kerta-annos kefpodoksiimiproksetiilikalvopäällysteisistä tableteista 509 potilasta hoidettiin suositellulla kefpodoksiimiannoksella (200 mg). Näissä tutkimuksissa ei havaittu kuolemia tai pysyviä vammoja, joiden uskottiin liittyvän lääkkeiden toksisuuteen.
Haittatapahtumat, joiden uskottiin mahdollisesti tai todennäköisesti liittyvän kefpodoksiimiin Yhdysvalloissa tehdyissä kerta-annostutkimuksissa, olivat:
Ilmaantuvuus suurempi kuin 1 %
Pahoinvointi 1,4 % Ripuli 1,2 %
Ilmaantuvuus alle 1 %
Keskushermosto: Huimaus, päänsärky, pyörtyminen. Ihotauti: ihottuma. Sukuelimet: Vaginiitti. Ruoansulatuskanava: Vatsakipu. Psykiatrinen: Ahdistuneisuus.
Laboratoriomuutokset
Merkittäviä laboratoriomuutoksia, joita on raportoitu aikuisilla ja lapsipotilailla kefpodoksiimiproksetiilin kliinisissä tutkimuksissa, riippumatta lääkesuhteesta, olivat:
Maksa: Ohimenevä AST (SGOT), ALT (SGPT), GGT, alkalisen fosfataasin, bilirubiinin ja LDH:n nousu.
Hematologinen: Eosinofilia, leukosytoosi, lymfosytoosi, granulosytoosi, basofilia, monosytoosi, trombosytoosi, alentunut hemoglobiini, alentunut hematokriitti, leukopenia, neutropenia, lymfosytopenia, trombosytopenia, trombosytemia, positiivinen Coombsin PT-testi, ja pitkittynyt PTT.
Seerumin kemia: Hyperglykemia, hypoglykemia, hypoalbuminemia, hypoproteinemia, hyperkalemia ja hyponatremia.
Munuaiset: Lisääntynyt BUN ja kreatiniini.
Useimmat näistä poikkeavuuksista olivat ohimeneviä eivätkä kliinisesti merkittäviä.
Markkinoinnin jälkeinen kokemus
Seuraavia vakavia haittavaikutuksia on raportoitu: allergiset reaktiot mukaan lukien Stevens-Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi, erythema multiforme ja seerumitaudin kaltaiset reaktiot, pseudomembranoottinen paksusuolitulehdus, verinen ripuli vatsakipuineen, haavainen paksusuolitulehdus, rektorragia ja hypotensio, anafylaktinen sokki, akuutti maksavaurio, in utero altistuminen keskenmenoon, purpurinen nefriitti, keuhkoinfiltraatti eosinofiliaan ja silmäluomen dermatiitti.
Yksi kuolemantapaus johtui pseudomembranoottisesta paksusuolentulehduksesta ja disseminoituneesta intravaskulaarisesta koagulaatiosta.
Kefalosporiiniluokan merkintä
Edellä lueteltujen haittavaikutusten lisäksi, joita on havaittu kefpodoksiimiproksetililla hoidetuilla potilailla, kefalosporiiniluokan antibioottien kohdalla on raportoitu seuraavia haittavaikutuksia ja muuttuneita laboratoriokokeita:
Haittavaikutukset ja epänormaalit laboratoriokokeet: Munuaisten toimintahäiriö, toksinen nefropatia, maksan toimintahäiriö mukaan lukien kolestaasi, aplastinen anemia, hemolyyttinen anemia, seerumitaudin kaltainen reaktio, verenvuoto, agranulosytoosi ja pansytopenia.
Useat kefalosporiinit ovat saaneet aikaan kouristuskohtauksia, erityisesti potilailla, joilla on munuaisten vajaatoiminta, kun annosta ei ole pienennetty. (Katso ANNOSTELU JA HALLINNOINTI ja YLIANNOSTUS .) Jos lääkehoitoon liittyviä kohtauksia ilmaantuu, lääkkeen käyttö on lopetettava. Antikonvulsanttihoitoa voidaan antaa, jos se on kliinisesti aiheellista.
HUUMEIDEN VUOROVAIKUTUKSET
Antasidit
Suurien antasidien (natriumbikarbonaatti ja alumiinihydroksidi) tai H2-salpaajien samanaikainen anto alentaa plasman huippupitoisuuksia 24–42 % ja imeytymistä 27–32 %. Nämä samanaikaiset lääkkeet eivät muuta imeytymisnopeutta. Suun kautta otettavat antikolinergiset lääkkeet (esim. propanteliini) viivästävät huippupitoisuuksia plasmassa (Tmax:n nousu 47 %), mutta ne eivät vaikuta imeytymisen laajuuteen (AUC).
Probenesidi
Kuten muidenkin beetalaktaamiantibioottien kohdalla, probenesidi esti kefpodoksiimin erittymistä munuaisten kautta, mikä johti noin 31 %:n nousuun AUC:ssa ja 20 %:n nousuun plasman kefpodoksiimin huippupitoisuuksissa.
Nefrotoksiset lääkkeet
Vaikka munuaistoksisuutta ei ole havaittu, kun kefpodoksiimiproksetiilia annettiin yksinään, munuaisten toiminnan tarkka seuranta on suositeltavaa, kun kefpodoksiimiproksetiilia annetaan samanaikaisesti sellaisten yhdisteiden kanssa, joilla on tunnetusti nefrotoksinen vaikutus.
Lääke/laboratoriotestien vuorovaikutukset
Kefalosporiinien, mukaan lukien kefpodoksiimiproksetiilin, tiedetään toisinaan indusoivan positiivisen suoran Coombsin testin.
VAROITUKSET
ENNEN CEFPODOXIME PROXETIL -HOIDON ALOITTAMISTA TUTKIMUS TULEE HUOLELLISESTI, ONKO POTILAS ON AIEMMIN OLLUT YLIherkkyysreaktiota kefpodoksiimille, MUILLE KEFALOGS-ORISPORININEILLE, PEKFALOGSIORISPORININEILLE. JOS KEPODOKSIIMI ANNETAAN PENISILLIINILLE HERKKEILLE POTILAILILLE, ON NOUDATTAVA VAROITUS, KOSKA BETA-LAKTAAM-ANTIBIOOTIEN RASTI-YLIHERKKYYS ON DOKUMENTOITU SELKEÄSTI 10% KILPAILUSTA TOIMINNASSA. JOS ALLERGINEN REAKTIO KELPODOKSIIMIPROKSETILILLE ILMOITTAA, LÄÄKE LÄÄKE. VAKAVAT AKUUTIT YLIHERKKYYSREAKTIOT SAATTAVAT VAATTAA EPINEFIRIINILOITOA JA MUITA HÄTÄTOIMENPITEITÄ, MUKAAN LUKIEN HAPELLA, SUUNONSUOKSIIN LIITTYVÄT NESTEET, ANTIHISTAMIINI, ANTIHISTAMIINI SEKÄ HENGITYSTIETOJEN HALLINTA, KUIN KLINIKAINEN.
Clostridium difficileen liittyvää ripulia (CDAD) on raportoitu käytettäessä lähes kaikkia antibakteerisia aineita, mukaan lukien VANTIN, ja sen vaikeusaste voi vaihdella lievästä ripulista kuolemaan johtavaan paksusuolentulehdukseen. Hoito antibakteerisilla aineilla muuttaa paksusuolen normaalia kasvillisuutta, mikä johtaa C. difficilen liikakasvuun.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CDAD:n kehittymistä. Hypertoksiinia tuottavat C. difficilen kannat lisäävät sairastuvuutta ja kuolleisuutta, koska nämä infektiot voivat olla vastustuskykyisiä antimikrobiselle hoidolle ja saattavat vaatia kolektomiaa. CDAD on otettava huomioon kaikilla potilailla, joilla on ripuli antibioottien käytön jälkeen. Huolellinen sairaushistoria on tarpeen, koska CDAD:n on raportoitu esiintyvän yli kaksi kuukautta antibakteeristen aineiden annon jälkeen.
Jos CDAD epäillään tai varmistetaan, jatkuva antibioottien käyttö, joka ei ole suunnattu C. difficileä vastaan, saattaa olla tarpeen lopettaa. Asianmukainen neste- ja elektrolyyttihallinta, proteiinilisä, C. difficilen antibioottihoito ja kirurginen arviointi tulee aloittaa kliinisen aiheen mukaan.
C. difficilen tarkkailemiseksi kefpodoksiimilla hoidetuilla ripulia sairastavilla potilailla ryhdyttiin yhteisiin ponnisteluihin, koska C. difficileen liittyvän ripulin esiintyvyys oli lisääntynyt varhaisissa kokeissa normaaleilla koehenkilöillä. C. difficile -organismeja tai toksiinia raportoitiin 10 %:lla kefpodoksiimilla hoidetuista aikuispotilaista, joilla oli ripuli; näillä potilailla ei kuitenkaan tehty erityistä pseudomembranoottisen paksusuolitulehduksen diagnoosia.
Markkinoille tulon jälkeen Yhdysvaltojen ulkopuolella on saatu raportteja pseudomembranoottisesta paksusuolitulehduksesta, joka liittyy kefpodoksiimiproksetiilin käyttöön.
VAROTOIMENPITEET
Kenraali
Potilailla, joilla on ohimenevä tai jatkuva virtsan erityksen väheneminen munuaisten vajaatoiminnan vuoksi, kefpodoksiimiproksetiilin vuorokausiannosta tulee pienentää, koska näillä potilailla seerumin antibioottipitoisuuksia voi esiintyä korkeita ja pitkittyneitä tavanomaisten annosten jälkeen. Kefpodoksiimia, kuten muita kefalosporiineja, tulee antaa varoen potilaille, jotka saavat samanaikaista hoitoa tehokkailla diureeteilla. (Katso ANNOSTELU JA HALLINNOINTI .)
Kuten muidenkin antibioottien kohdalla, kefpodoksiimiproksetiilin pitkäaikainen käyttö voi johtaa ei-herkkien organismien liikakasvuun. Potilaan tilan toistuva arviointi on välttämätöntä. Jos superinfektio ilmenee hoidon aikana, on ryhdyttävä asianmukaisiin toimenpiteisiin.
VANTINin määrääminen ilman todistettua tai vahvasti epäiltyä bakteeri-infektiota tai profylaktista indikaatiota ei todennäköisesti hyödytä potilasta ja lisää lääkeresistenttien bakteerien kehittymisen riskiä.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Kefpodoksiimiproksetiilin pitkäaikaisia karsinogeneesitutkimuksia eläimillä ei ole tehty. Kefpodoksiimin mutageneesitutkimukset, mukaan lukien Amesin testi sekä metabolisen aktivaation kanssa että ilman, kromosomipoikkeamatesti, suunnittelematon DNA-synteesimääritys, mitoottinen rekombinaatio ja geenikonversio, eteenpäin suuntautuva geenimutaatiomääritys ja in vivo -mikronukleustesti, olivat kaikki negatiivisia. Mitään epäsuotuisia vaikutuksia hedelmällisyyteen tai lisääntymiseen ei havaittu, kun rotille annettiin suun kautta 100 mg/kg/vrk tai vähemmän (2 kertaa ihmisen annos perustuen mg/m2).
Raskaus
Teratogeeniset vaikutukset
Kefpodoksiimiproksetiili ei ollut teratogeeninen eikä alkioita tappava, kun sitä annettiin rotille organogeneesin aikana annoksina 100 mg/kg/vrk (2 kertaa ihmisen annos perustuen mg/m²:iin) tai kaneille annoksina 30 mg/kg/vrk (1 -2 kertaa ihmisen annos mg/m²:n perusteella).
Ei kuitenkaan ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia kefpodoksiimiproksetiilin käytöstä raskaana oleville naisille. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, tätä lääkettä tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Työ ja toimitus
Kefpodoksiimiproksetiilin käyttöä synnytyksen ja synnytyksen aikana ei ole tutkittu. Hoitoa tulee antaa vain, jos se on selvästi tarpeen.
Imettävät äidit
Kefpodoksiimi erittyy äidinmaitoon. Kolmella imettävällä naisella tehdyssä tutkimuksessa kefpodoksiimipitoisuudet äidinmaidossa olivat 0 %, 2 % ja 6 % samanaikaisista seerumipitoisuuksista 4 tunnin kuluttua 200 mg:n oraalisen kefpodoksiimiproksetiiliannoksen jälkeen. 6 tuntia annostelun jälkeen tasot olivat 0 %, 9 % ja 16 % samanaikaisista seerumipitoisuuksista. Vakavien reaktioiden mahdollisuuden vuoksi imeväisillä on päätettävä, lopetetaanko imetys vai lääkkeen käyttö, ottaen huomioon lääkkeen merkitys äidille.
Käyttö lapsille
Turvallisuutta ja tehoa alle 2 kuukauden ikäisille imeväisille ei ole varmistettu.
Geriatrinen käyttö
Niistä 3338 potilaasta, jotka osallistuivat kefpodoksiimiproksetiilikalvopäällysteisten tablettien usean annoksen kliinisiin tutkimuksiin, 521 (16 %) oli 65-vuotiaita ja sitä vanhempia ja 214 (6 %) 75-vuotiaita tai vanhempia. Mitään yleisiä eroja tehokkuudessa tai turvallisuudessa ei havaittu iäkkäiden ja nuorempien potilaiden välillä. Terveillä iäkkäillä henkilöillä, joiden munuaisten toiminta on normaali, kefpodoksiimin puoliintumisaika plasmassa oli keskimäärin 4,2 tuntia ja virtsan eritys keskimäärin 21 %, kun 400 mg:n annos annettiin 12 tunnin välein 15 päivän ajan. Muut farmakokineettiset parametrit pysyivät muuttumattomina verrattuna terveillä nuoremmilla koehenkilöillä havaittuihin.
Annosta ei tarvitse muuttaa iäkkäillä potilailla, joilla on normaali munuaisten toiminta.
YLIANNOSTUS
Akuutin jyrsijämyrkyllisyyden tutkimuksissa kerta-annos 5 g/kg suun kautta ei aiheuttanut haittavaikutuksia.
Yliannostuksesta johtuvan vakavan toksisen reaktion sattuessa hemodialyysi tai peritoneaalidialyysi voi auttaa kefpodoksiimin poistamisessa elimistöstä, erityisesti jos munuaisten toiminta on heikentynyt.
Beetalaktaamiantibioottien yliannostuksen jälkeisiä toksisia oireita voivat olla pahoinvointi, oksentelu, vatsakipu ja ripuli.
VASTA-AIHEET
Kefpodoksiimiproksetiili on vasta-aiheinen potilaille, jotka ovat allergisia kefpodoksiimille tai kefalosporiiniryhmän antibiooteille.
KLIININEN FARMAKOLOGIA
Imeytyminen ja erittyminen
Kefpodoksiimiproksetiili on aihiolääke, joka imeytyy maha-suolikanavasta ja deesteroituu sen aktiiviseksi metaboliitiksi, kefpodoksiimiksi. Kun paastopotilaille annettiin 100 mg kefpodoksiimiproksetiilia suun kautta, noin 50 % annetusta kefpodoksiimiannoksesta imeytyi systeemisesti. Suositellulla annosalueella (100–400 mg) noin 29–33 % annetusta kefpodoksiimiannoksesta erittyi muuttumattomana virtsaan 12 tunnissa. Kefpodoksiimin metabolia on minimaalista in vivo.
Ruoan vaikutukset
Imeytymisen laajuus (keskimääräinen AUC) ja keskimääräinen huippupitoisuus plasmassa lisääntyivät, kun kalvopäällysteiset tabletit otettiin ruoan kanssa. Ruoan kanssa otetun 200 mg:n tablettiannoksen jälkeen AUC oli 21-33 % suurempi kuin paasto-olosuhteissa, ja plasman huippupitoisuus oli keskimäärin 3,1 mcg/ml syöneillä koehenkilöillä verrattuna 2,6 mcg/ml paastopotilailla. Huippupitoisuuden saavuttamiseen kuluva aika ei eronnut merkitsevästi ruokittujen ja paastoneiden koehenkilöiden välillä.
Kun 200 mg:n annos suspensiota otettiin ruoan kanssa, imeytymisen laajuus (keskimääräinen AUC) ja keskimääräinen huippupitoisuus plasmassa ei eronnut merkitsevästi paastopotilaista, mutta imeytyminen oli hitaampaa ruoan kanssa (lisäys 48 % Tmax).
Cefpodoxime Proxetil -kalvopäällysteisten tablettien farmakokinetiikka
Suositellulla annosalueella (100-400 mg) kefpodoksiimin imeytymisnopeus ja -aste osoittivat annosriippuvuutta; annoksella normalisoitu Cmax ja AUC pienenivät jopa 32 % annoksen noustessa. Suositellulla annosalueella Tmax oli noin 2–3 tuntia ja T½ vaihteli välillä 2,09–2,84 tuntia. Keskimääräinen Cmax oli 1,4 mcg/ml 100 mg:n annoksella, 2,3 mcg/ml 200 mg:n annoksella ja 3,9 mcg/ml 400 mg:n annoksella. Potilailla, joiden munuaisten toiminta oli normaali, ei havaittu kumuloitumista eikä merkittäviä muutoksia muissa farmakokineettisissä parametreissa toistuvien suun kautta otettavien annosten (enintään 400 mg Q 12 tuntia) jälkeen.
CEFPODOXIIMI PLASMAN TASOT (mcg/ml) paastotuilla AIKUISILLE KALVOPÄÄLLYTETYT TABLETIN ANNON JÄLKEEN (kerta-annos)
Kefpodoksiimiproksetiilisuspension farmakokinetiikka
Aikuisilla koehenkilöillä 100 mg:n annos oraalisuspensiota tuotti kefpodoksiimin keskimääräisen huippupitoisuuden noin 1,5 mcg/ml (vaihteluväli: 1,1-2,1 mcg/ml), mikä vastaa 100 mg:n tabletin annon jälkeen raportoitua. Oraalisuspension huippupitoisuuteen plasmassa kulunut aika ja plasman pitoisuus-aikakäyrän alle jäänyt pinta-ala (AUC) olivat myös samat kuin kalvopäällysteisillä tableteilla aikuisilla 100 mg:n oraalisen annoksen jälkeen.
Kefpodoksiimin farmakokinetiikkaa tutkittiin 29 potilaalla, jotka olivat iältään 1–17 vuotta. Jokainen potilas sai kerta-annoksen suun kautta 5 mg/kg kefpodoksiimi-oraalisuspensiota. Plasma- ja virtsanäytteitä kerättiin 12 tunnin ajan annostelun jälkeen. Tästä tutkimuksesta raportoidut plasmapitoisuudet ovat seuraavat:
KEFPODOKSIMI-PLASMAN TASOT (mcg/ml) paastonneilla potilailla (1-17 VUOTTA) SUSPENSIOIDEN ANNON JÄLKEEN
Jakelu
Kefpodoksiimin sitoutuminen proteiineihin on 22-33 % seerumissa ja 21-29 % plasmassa.
Ihon rakkula
Kun kefpodoksiimiproksetiilia annettiin toistuvasti 12 tunnin välein 5 päivän ajan, kefpodoksiimin keskimääräinen enimmäispitoisuus ihon läpipainopakkauksessa oli 1,6 ja 2,8 mikrog/ml, vastaavasti. Ihon rakkulanesteen kefpodoksiimipitoisuudet 12 tunnin kuluttua annostelusta olivat keskimäärin 0,2 ja 0,4 mikrog/ml 200 mg:n ja 400 mg:n toistuvan annoksen hoito-ohjelmassa.
Tonsillakudos
Yhden oraalisen 100 mg:n kefpodoksiimiproksetiilikalvopäällysteisen tabletin jälkeen kefpodoksiimin keskimääräinen maksimipitoisuus nielurisakudoksessa oli keskimäärin 0,24 mcg/g 4 tuntia annoksen annon jälkeen ja 0,09 mcg/g 7 tunnin kuluttua annostelusta. Tasapaino plasman ja nielurisakudoksen välillä saavutettiin 4 tunnin kuluessa annostelusta. Kefpodoksiimia ei havaittu nielurisakudoksessa 12 tunnin kuluttua annostelusta. Nämä tulokset osoittivat, että kefpodoksiimipitoisuudet ylittivät S. pyogenesin MIC90:n vähintään 7 tunnin ajan 100 mg:n kefpodoksiimiproksetiiliannoksen jälkeen.
Keuhkokudos
Yhden oraalisen 200 mg:n kefpodoksiimiproksetiilia sisältävän kalvopäällysteisen tabletin jälkeen kefpodoksiimin keskimääräinen maksimipitoisuus keuhkokudoksessa oli keskimäärin 0,63 mcg/g 3 tuntia annoksen ottamisen jälkeen, 0,52 mcg/g 6 tunnin kuluttua annostelusta ja 0,19 mcg/g. 12 tuntia annostelun jälkeen. Tämän tutkimuksen tulokset osoittivat, että kefpodoksiimi tunkeutui keuhkokudokseen ja tuotti lääkeainepitoisuuksia vähintään 12 tunnin ajan annostelun jälkeen tasoilla, jotka ylittivät S. pneumoniaen ja H. influenzaen MIC90:n.
CSF
Kefpodoksiimin CSF-tasoista ei ole saatavilla riittäviä tietoja.
Munuaisten toiminnan heikkenemisen vaikutukset
Kefpodoksiimin eliminaatio vähenee potilailla, joilla on kohtalainen tai vaikea munuaisten vajaatoiminta ( VAROTOIMENPITEET ja ANNOSTELU JA HALLINNOINTI .) Kefpodoksiimin keskimääräinen puoliintumisaika plasmassa oli 3,5 tuntia potilailla, joilla oli lievä munuaisten vajaatoiminta (kreatiniinipuhdistuma 50-80 ml/min). Koehenkilöillä, joilla oli kohtalainen (kreatiniinipuhdistuma 30-49 ml/min) tai vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma 5-29 ml/min), puoliintumisaika piteni 5,9 tuntiin ja 9,8 tuntiin. Noin 23 % annetusta annoksesta poistui elimistöstä tavallisen 3 tunnin hemodialyysitoimenpiteen aikana.
Maksan vajaatoiminnan vaikutus (kirroosi)
Kirroosipotilailla imeytyminen oli jonkin verran heikentynyt ja eliminaatio muuttumaton. Keskimääräinen kefpodoksiimin T½ ja munuaispuhdistuma kirroosipotilailla olivat samanlaiset kuin terveillä koehenkilöillä tehdyissä tutkimuksissa. Askites ei näyttänyt vaikuttavan kirroosipotilaiden arvoihin. Annoksen muuttamista ei suositella tälle potilasryhmälle.
Farmakokinetiikka iäkkäillä henkilöillä
Iäkkäät henkilöt eivät tarvitse annoksen muuttamista, elleivät heillä ole heikentynyttä munuaisten toimintaa. (Katso VAROTOIMENPITEET .) Terveillä iäkkäillä koehenkilöillä kefpodoksiimin puoliintumisaika plasmassa oli keskimäärin 4,2 tuntia (vs. 3,3 nuoremmilla koehenkilöillä) ja virtsan eritys keskimäärin 21 %, kun 400 mg:n annos annettiin 12 tunnin välein. Muut farmakokineettiset parametrit (Cmax, AUC ja Tmax) eivät muuttuneet verrattuna terveillä nuorilla koehenkilöillä havaittuihin.
Mikrobiologia
Toimintamekanismi
Kefpodoksiimi on bakterisidinen aine, joka vaikuttaa estämällä bakteerin soluseinän synteesiä. Kefpodoksiimilla on aktiivisuutta joidenkin gramnegatiivisten ja grampositiivisten bakteerien beetalaktamaasien, sekä penisillinaasien että kefalosporinaasien, läsnä ollessa.
Vastustusmekanismi
Resistenssi kefpodoksiimille johtuu pääasiassa beetalaktamaasin aiheuttamasta hydrolyysistä, penisilliiniä sitovien proteiinien (PBP) muuttamisesta ja heikentyneestä läpäisevyydestä.
Kefpodoksiimin on osoitettu olevan aktiivinen useimpia seuraavien bakteerien isolaatteja vastaan sekä in vitro että kliinisissä infektioissa, kuten kohdassa Indikaatiot ja käyttö (1) on kuvattu:
Gram-positiiviset bakteerit
Staphylococcus aureus (metisilliinille herkät kannat, mukaan lukien penisillinaaseja tuottavat kannat) Staphylococcus saprophyticus Streptococcus pneumoniae (pois lukien penisilliiniresistentit isolaatit) Streptococcus pyogenes
Gram-negatiiviset bakteerit
Escherichia coli Klebsiella pneumoniae Proteus mirabilis Haemophilus influenzae (mukaan lukien beetalaktamaasia tuottavat isolaatit) Moraxella catarrhalis Neisseria gonorrhoeae (mukaan lukien penisillinaasia tuottavat isolaatit)
Seuraavat in vitro -tiedot ovat saatavilla, mutta niiden kliinistä merkitystä ei tunneta. Vähintään 90 prosentilla seuraavista mikro-organismeista on in vitro -minimi estävä pitoisuus (MIC), joka on pienempi tai yhtä suuri kuin kefpodoksiimin herkkä raja-arvo. Kefpodoksiimin tehoa näiden mikro-organismien aiheuttamien kliinisten infektioiden hoidossa ei kuitenkaan ole osoitettu riittävissä ja hyvin kontrolloiduissa kliinisissä tutkimuksissa.
Gram-positiiviset bakteerit
Streptococcus agalactiae Streptococcus spp. (Ryhmät C, F, G)
Gram-negatiiviset bakteerit
Citrobacter diversus Klebsiella oxytoca Proteus vulgaris Providencia rettgeri Haemophilus parainfluenzae
Anaerobiset grampositiiviset bakteerit
Peptostreptococcus magnus
Herkkyystestimenetelmät
Kliinisen mikrobiologian laboratorion tulee mahdollisuuksien mukaan toimittaa lääkärille paikallisissa sairaaloissa käytettävien mikrobilääkkeiden in vitro -herkkyystestien tulokset määräaikaisraportteina, jotka kuvaavat sairaalassa ja yhteisössä hankittujen patogeenien herkkyysprofiilia. Näiden raporttien pitäisi auttaa lääkäriä valitsemaan antibakteerinen lääkevalmiste hoitoa varten.
Laimennustekniikat
Kvantitatiivisia menetelmiä käytetään antimikrobisten minimaalisten estopitoisuuksien (MIC) määrittämiseen. Nämä MIC-arvot antavat arvioita bakteerien herkkyydestä antimikrobisille yhdisteille. MIC - arvot olisi määritettävä käyttämällä standardoitua testimenetelmää . MIC-arvot tulee tulkita taulukossa 1 annettujen kriteerien mukaisesti.
Diffuusiotekniikat
Kvantitatiiviset menetelmät, jotka edellyttävät vyöhykkeiden halkaisijoiden mittaamista, tarjoavat myös toistettavia arvioita bakteerien herkkyydestä antimikrobisille yhdisteille. Vyöhykkeen koko antaa arvion bakteerien herkkyydestä antimikrobisille yhdisteille. Vyöhykkeen koko on määritettävä standardoidulla testimenetelmällä. Tässä menetelmässä käytetään paperilevyjä, jotka on kyllästetty 10 mikrogrammalla kefpodoksiimia, testaamaan mikro-organismien herkkyyttä kefpodoksiimille. Levyn diffuusion tulkintakriteerit on esitetty taulukossa 1.
Herkkäraportti osoittaa, että antimikrobinen aine todennäköisesti estää patogeenin kasvua, jos antimikrobinen yhdiste saavuttaa tartuntakohdassa tarvittavan pitoisuuden patogeenin kasvun estämiseksi. Keskitason raportti osoittaa, että tulosta on pidettävä epäselvänä, ja jos mikro-organismi ei ole täysin herkkä vaihtoehtoisille, kliinisesti toteuttamiskelpoisille lääkkeille, testi on toistettava. Tämä kategoria tarkoittaa mahdollista kliinistä soveltuvuutta kehon kohteisiin, joissa lääke on fysiologisesti keskittynyt tai tilanteissa, joissa voidaan käyttää suuria lääkeannoksia. Tämä kategoria tarjoaa myös puskurivyöhykkeen, joka estää pieniä hallitsemattomia teknisiä tekijöitä aiheuttamasta suuria tulkintaeroja. Resistantin raportti osoittaa, että antimikrobinen aine ei todennäköisesti estä patogeenin kasvua, jos antimikrobinen yhdiste saavuttaa pitoisuudet, jotka ovat tavallisesti saavutettavissa infektiokohdassa; tulee valita muu hoitomuoto.
Laadunvalvonta
Standardoidut herkkyystestimenetelmät edellyttävät laboratoriokontrollien käyttöä määrityksessä käytettyjen tarvikkeiden ja reagenssien sekä testin suorittavan henkilön tekniikoiden tarkkuuden ja tarkkuuden valvomiseksi ja varmistamiseksi1,2,3. Vakiokefpodoksiimijauheen tulee tarjota seuraavat taulukossa 2 mainitut MIC-arvot. Diffuusiotekniikassa, jossa käytetään 10 mikrogramman levyä, taulukon 2 kriteerit tulisi saavuttaa.
Kliiniset tutkimukset
Kystiitti
Kahdessa kaksoissokkoutetussa, 2:1 satunnaistetussa, vertailevassa tutkimuksessa aikuisilla Yhdysvalloissa, kefpodoksiimiproksetiilia verrattiin muihin beetalaktaamiantibiootteihin. Näissä tutkimuksissa saavutettiin seuraavat bakteerien hävittämisasteet 5-9 päivää hoidon jälkeen:
Näissä tutkimuksissa kefpodoksiimiproksetiilin kliiniset paranemisasteet ja bakteerien häviämisasteet olivat verrattavissa vertailuaineisiin; kliiniset paranemisasteet ja bakteriologiset hävittämisasteet olivat kuitenkin alhaisemmat kuin joidenkin muiden kystiitin hoitoon hyväksyttyjen aineiden luokkien yhteydessä havaitut.
Akuutti välikorvatulehdus -tutkimukset
Yhdysvalloissa suoritetuissa akuutin välikorvantulehduksen kontrolloiduissa tutkimuksissa, joissa havaittiin merkittäviä määriä beetalaktamaasia tuottavia organismeja, kefpodoksiimiproksetiilia verrattiin kefiksiimiin. Näissä tutkimuksissa, joissa käytettiin erittäin tiukkoja arvioitavuuskriteerejä sekä mikrobiologisia ja kliinisiä vastekriteerejä 4–21 päivän hoidon jälkeisessä seurannassa, saavutettiin seuraavat oletetut bakteerien hävittämis-/kliiniset onnistumistulokset (parantuneet ja parantuneet).
VIITTEET
1. Clinical and Laboratory Standards Institute (CLSI). Aerobisesti kasvavien bakteerien antimikrobisen herkkyystestien laimennusmenetelmät; Hyväksytty standardi – yhdeksäs painos. CLSI-dokumentti M07-A9, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2012.
2. Clinical and Laboratory Standards Institute (CLSI). Suorituskykystandardit antimikrobiaaliselle herkkyystestaukselle; 23. tiedote, CLSI-asiakirja M100-S23. CLSI-dokumentti M100-S23, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2013.
3. Clinical and Laboratory Standards Institute (CLSI). Antimikrobisten levyjen diffuusioherkkyystestien suorituskykystandardit; Hyväksytty standardi – 11. painos CLSI-dokumentti M02-A11, Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA, 2012.
POTILASTIEDOT
Potilaita tulee neuvoa, että antibakteerisia lääkkeitä, mukaan lukien VANTIN, tulee käyttää vain bakteeri-infektioiden hoitoon. Ne eivät hoida virusinfektioita (esim. flunssaa). Kun VANTINia määrätään bakteeri-infektion hoitoon, potilaille tulee kertoa, että vaikka on yleistä, että olo paranee hoidon alussa, lääkettä tulee ottaa täsmälleen ohjeiden mukaan. Annosten väliin jättäminen tai koko hoitojakson suorittamatta jättäminen voi (1) heikentää välittömän hoidon tehokkuutta ja (2) lisätä todennäköisyyttä, että bakteerit kehittävät resistenssiä eikä niitä voida hoitaa VANTINilla tai muilla antibakteerisilla lääkkeillä tulevaisuudessa.
Ripuli on yleinen antibioottien aiheuttama ongelma, joka yleensä loppuu, kun antibioottihoito lopetetaan. Joskus antibioottihoidon aloittamisen jälkeen potilaille voi ilmaantua vetisiä ja verisiä ulosteita (vatsakouristuksella ja kuumeella tai ilman) jopa kahden tai useamman kuukauden kuluttua viimeisen antibioottiannoksen ottamisesta. Jos näin tapahtuu, potilaiden tulee ottaa yhteyttä lääkäriin mahdollisimman pian.
