Myambutol 200mg, 400mg, 600mg, 800mg Ethambutol Hydrochloride Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Myambutol on ja miten sitä käytetään?
Myambutol on reseptilääke, jota käytetään tuberkuloosin oireiden hoitoon. Myambutol 400mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Myambutoli kuuluu antituberkulaaristen aineiden luokkaan.
Ei tiedetä, onko Myambutol 800mg turvallinen ja tehokas alle 13-vuotiaille lapsille.
Mitkä ovat Myambutol 800mg:n mahdolliset sivuvaikutukset?
Myambutoli voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nokkosihottuma,
- vaikeuksia hengittää,
- kasvojen, huulten, kielen tai kurkun turvotus,
- näköongelmia,
- näönmenetys, joka voi olla pysyvä,
- näön hämärtyminen,
- keskittymisvaikeuksia,
- yhden silmän näön menetys, joka kestää tunnin tai kauemmin,
- silmiesi lisääntynyt herkkyys valolle,
- värinäön menetys,
- kipu silmien liikkeistä,
- kipu silmien takana,
- uusi tai paheneva yskä ja kuume,
- pistelyn tunnottomuus käsissäsi tai jaloissasi,
- hämmennystä,
- hallusinaatiot,
- kuume,
- turvonneet rauhaset,
- tuskalliset suun haavaumat,
- ihohaavat,
- vilustumisen tai flunssan oireet,
- yleinen huono olo,
- helppo mustelma tai verenvuoto,
- nenäverenvuoto,
- vuotavat ikenet,
- vähän tai ei ollenkaan virtsaamista,
- ylävatsakipu,
- tumma virtsa,
- savenväriset ulosteet,
- ihon tai silmien keltaisuus (keltatauti),
- kipeä kurkku,
- polttaa silmissäsi,
- ihokipu,
- punainen tai violetti ihottuma, joka leviää (erityisesti kasvoille tai ylävartalolle) ja aiheuttaa rakkuloita ja hilseilyä,
- rintakipu ja
- hengenahdistus
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Myambutolin yleisimpiä sivuvaikutuksia ovat:
- kutina,
- ihottuma,
- nivelkipu,
- päänsärky,
- huimaus,
- pahoinvointi,
- oksentelua,
- vatsakipu,
- ruoansulatushäiriöt ja
- ruokahalun menetys
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Myambutolin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
MYAMBUTOL (etambutolihydrokloridi) on suun kautta otettava kemoterapeuttinen aine, joka on erityisen tehokas Mycobacterium-suvun aktiivisesti kasvavia mikro-organismeja vastaan, mukaan lukien M. tuberculosis. Rakennekaava on:
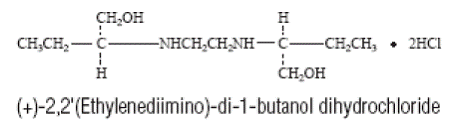
MYAMBUTOL (etambutolihydrokloridi) 100 ja 400 mg tabletit sisältävät seuraavia inaktiivisia aineita: gelatiini, hydroksipropyylimetyyliselluloosa, magnesiumstearaatti, natriumlauryylisulfaatti, sorbitoli, steariinihappo, sakkaroosi, titaanidioksidi ja muut aineosat.
INDIKAATIOT
MYAMBUTOL on tarkoitettu keuhkotuberkuloosin hoitoon. Sitä ei tule käyttää ainoana tuberkuloosilääkkeenä, vaan sitä tulee käyttää yhdessä vähintään yhden muun tuberkuloosilääkkeen kanssa. Täydentävän lääkkeen valinnan tulee perustua kliiniseen kokemukseen, vertailevaan turvallisuuteen ja asianmukaisiin in vitro -herkkyystutkimuksiin. Potilailla, jotka eivät ole saaneet aikaisempaa tuberkuloosihoitoa eli alkuhoitoa, yleisimmin käytetyt hoito-ohjelmat ovat olleet seuraavat:
MYAMBUTOL plus isoniatsidi
MYAMBUTOL 800mg plus isoniatsid plus streptomysiini.
Potilailla, jotka ovat saaneet aiempaa tuberkuloosihoitoa, mykobakteeriresistenssi muille aloitushoidossa käytetyille lääkkeille on yleistä. Tästä syystä tällaisilla uudelleenhoitopotilailla MYAMBUTOLI tulee yhdistää vähintään yhden toisen linjan lääkkeen kanssa, jota ei ole aiemmin annettu potilaalle ja jolle bakteerien herkkyys on osoitettu asianmukaisissa in vitro -tutkimuksissa. MYAMBUTOLin kanssa käytettyihin tuberkuloosilääkkeisiin ovat kuuluneet sykloseriini, etionamidi, pyratsiiniamidi, viomysiini ja muut lääkkeet. Isoniatsidia, aminosalisyylihappoa ja streptomysiiniä on myös käytetty useissa lääkehoito-ohjelmissa. Myös vuorottelevia lääkehoitoja on käytetty.
ANNOSTELU JA HALLINNOINTI
MYAMBUTOL 200mg -valmistetta ei tule käyttää yksinään, alkuhoidon tai uusintahoidon aikana. MYAMBUTOL 400 mg tulee antaa vain kerran 24 tunnin välein. Imeytyminen ei muutu merkittävästi ruoan kanssa ottaminen. Hoitoa tulee yleensä jatkaa, kunnes bakteriologinen konversio on muuttunut pysyväksi ja kliininen maksimaalinen paraneminen on tapahtunut.
MYAMBUTOLIA ei suositella käytettäväksi alle 13-vuotiaille lapsipotilaille, koska turvallisia käyttöolosuhteita ei ole vahvistettu.
Alkuhoito: Potilaille, jotka eivät ole saaneet aikaisempaa tuberkuloosihoitoa, anna MYAMBUTOL 15 mg/kg (7 mg/lb) kerta-annoksena suun kautta kerran 24 tunnin välein. Uusimmissa tutkimuksissa isoniatsidia on annettu samanaikaisesti yhtenä vuorokautisena annoksena suun kautta.
Uudelleenhoito: Potilaille, jotka ovat saaneet aiempaa tuberkuloosihoitoa, anna MYAMBUTOLIA 25 mg/kg (11 mg/lb) ruumiinpainoa kohti kerta-annoksena suun kautta kerran 24 tunnin välein. Anna samanaikaisesti vähintään yhtä muuta tuberkuloosilääkettä, jolle organismit on osoitettu olevan herkkiä asianmukaisilla in vitro -testeillä. Sopivia lääkkeitä ovat yleensä lääkkeet, joita ei ole aiemmin käytetty potilaan hoidossa. Kun MYAMBUTOL 600 mg on annettu 60 päivää, annosta pienennetään 15 mg:aan/kg (7 mg/lb) ruumiinpainoa kohti ja annetaan kerta-annoksena suun kautta kerran 24 tunnin välein.
Sinä aikana, kun potilas saa vuorokausiannoksen 25 mg/kg, suositellaan kuukausittaista silmätutkimusta.
Katso taulukosta oikean paino-annostabletin (tablettien) helppo valinta.
Paino-annostaulukko
MITEN TOIMITETAAN
Etambutolihydrokloriditabletit USP
100 mg – pyöreät, kuperat, valkoiset kalvopäällysteiset tabletit, joiden toiselle puolelle on kaiverrettu E6, toimitetaan seuraavasti:
NDC 54879-001-01 - 100 pullo NDC 54879-001-00 - 10 läpipainopakkausta x 10 tablettia
400 mg – pyöreät, kuperat, valkoiset, jakouurteiset, kalvopäällysteiset tabletit, joissa jakouurteen toiselle puolelle on kaiverrettu E ja oikealle puolelle 7, toimitetaan seuraavasti:
NDC 54879-002-01 - 100 pullo NDC 54879-002-00 - 10 läpipainopakkausta x 10 tablettia
Säilytä kontrolloidussa huoneenlämmössä 20–25 °C (68–77 °F).
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088
Valmistaja ja jakelija: STI Pharma, LLC Langhorne, PA 19047. Tarkistettu maaliskuussa 2013
SIVUVAIKUTUKSET
MYAMBUTOL voi aiheuttaa näöntarkkuuden heikkenemistä, mukaan lukien peruuttamatonta sokeutta, joka näyttää johtuvan näköhermotulehduksesta. Etambutolihoidon yhteydessä esiintyvä optinen neuropatia, mukaan lukien optinen neuriitti tai retrobulbaalinen neuriitti, voi olla luonteenomaista yhdestä tai useammasta seuraavista tapahtumista: näöntarkkuuden heikkeneminen, skotooma, värisokeus ja/tai näköhäiriö. Näitä tapahtumia on raportoitu myös optisen tai retrobulbaarisen neuriitin diagnoosin puuttuessa.
Potilaita tulee neuvoa ilmoittamaan viipymättä lääkärilleen kaikista näöntarkkuuden muutoksista.
Näöntarkkuuden muutos voi olla toispuoleista tai molemminpuolista, joten jokainen silmä on testattava erikseen ja molemmat silmät yhdessä. Näöntarkkuus tulee testata ennen MYAMBUTOL-hoidon aloittamista ja ajoittain lääkkeen annon aikana, paitsi että se tulisi tehdä kuukausittain, kun potilas saa yli 15 mg:n vuorokausiannoksen. Snellen-silmäkarttoja suositellaan näöntarkkuuden testaamiseen. Tutkimukset ovat osoittaneet, että monien tuberkuloosipotilaiden, jotka eivät saa MYAMBUTOLIA, näöntarkkuudessa on selvää yhden tai kahden Snellen-kaavion viivan vaihtelua.

Seuraava taulukko voi olla hyödyllinen tulkittaessa mahdollisia MYAMBUTOLin aiheuttamia näöntarkkuuden muutoksia.
Yleisesti ottaen näöntarkkuuden muutokset, jotka ovat pienempiä kuin kohdissa "Merkitsevä viivojen määrä" ja "Pienennä pisteiden lukumäärää", voivat johtua sattumanvaraisesta vaihtelusta, testausmenetelmän rajoituksista tai fysiologisesta vaihtelusta. Sitä vastoin muutokset näöntarkkuudessa, jotka vastaavat tai ylittävät kohdissa "Merkitsevä määrä viivoja" ja "Vähennä pisteiden määrää" -kohdassa havaitut muutokset, osoittavat, että potilaan näön tila on testattava uudelleen ja arvioitava huolellisesti. Jos huolellinen arviointi vahvistaa visuaalisen muutoksen suuruuden eikä muuta syytä paljasta, MYAMBUTOL 400 mg -hoito tulee lopettaa ja potilas arvioida uudelleen säännöllisin väliajoin. Progressiivisen näöntarkkuuden heikkenemisen hoidon aikana on katsottava johtuvan MYAMBUTOLista.
Jos korjaavia laseja käytetään ennen hoitoa, niitä on käytettävä näöntarkkuusmittauksen aikana. 1-2 vuoden hoidon aikana voi kehittyä taittovirhe, joka on korjattava tarkkojen testitulosten saamiseksi. Näöntarkkuuden testaus neulanreiän kautta eliminoi taittovirheen. Potilailla, joilla on näköhäiriöitä MYAMBUTOL 800 mg -hoidon aikana, saattaa esiintyä subjektiivisia näköoireita ennen näöntarkkuuden heikkenemisen osoittamista tai samanaikaisesti sen kanssa, ja kaikkia MYAMBUTOLIA saavia potilaita tulee kysyä säännöllisesti näön hämärtymisestä ja muista subjektiivisista silmäoireista.
Näöntarkkuuden palautuminen tapahtuu yleensä viikkojen tai kuukausien kuluessa lääkkeen käytön lopettamisen jälkeen. Jotkut potilaat ovat saaneet MYAMBUTOLIA (etambutolihydrokloridia) uudelleen tällaisen toipumisen jälkeen ilman näöntarkkuuden menetystä.
Muita raportoituja haittavaikutuksia ovat: yliherkkyys, anafylaktinen/anafylaktoidinen reaktio, dermatiitti, erythema multiforme, kutina ja nivelkipu; anoreksia, pahoinvointi, oksentelu, maha-suolikanavan häiriöt ja vatsakipu; kuume, huonovointisuus, päänsärky ja huimaus; henkinen sekavuus, desorientaatio ja mahdolliset hallusinaatiot; trombosytopenia, leukopenia ja neutropenia. Ääreishermotulehduksesta johtuvaa raajojen tunnottomuutta ja pistelyä on raportoitu.
Seerumin virtsahappopitoisuudet kohoavat ja akuutin kihdin saostumista on raportoitu. MYAMBUTOL-hoidon aikana on raportoitu myös keuhkoinfiltraatteja eosinofilian kanssa tai ilman. Maksatoksisuutta, mukaan lukien kuolemantapaukset, on raportoitu (ks VAROITUKSET .) Koska MYAMBUTOL 400 mg:aa suositellaan käytettäväksi yhdessä yhden tai useamman muun tuberkuloosilääkkeen kanssa, nämä muutokset voivat liittyä samanaikaiseen hoitoon. Yliherkkyysoireyhtymä, joka koostuu ihoreaktioista (kuten ihottumasta tai eksfoliatiivisesta ihottumasta), eosinofiliasta ja yhdestä tai useammasta seuraavista: hepatiitti, keuhkotulehdus, nefriitti, sydänlihastulehdus, perikardiitti. Kuumetta ja lymfadenopatiaa voi esiintyä.
HUUMEIDEN VUOROVAIKUTUKSET
Tutkimuksen tulokset MYAMBUTOLIN (50 mg/kg) antamisesta yhdessä alumiinihydroksidia sisältävän antasidin kanssa 13 tuberkuloosipotilaalle osoittivat etambutolin keskimääräisen seerumin pitoisuuden pienenemisen noin 20 % ja etambutolin virtsaan erittymisen 13 %, mikä viittaa siihen, että nämä antasidit voivat vähentää etambutolin oraalista imeytymistä. On suositeltavaa välttää etambutolin samanaikaista antoa alumiinihydroksidia sisältävien antasidien kanssa vähintään 4 tunnin ajan etambutolin annon jälkeen.
VAROITUKSET
MYAMBUTOL 600 mg voi aiheuttaa näöntarkkuuden heikkenemistä, mikä näyttää johtuvan näköhermotulehduksesta. Tämä vaikutus saattaa liittyä annokseen ja hoidon kestoon. Tämä vaikutus on yleensä palautuva, kun lääkkeen anto lopetetaan välittömästi. Peruuttamatonta sokeutta on kuitenkin raportoitu. (Katso VAROTOIMENPITEET ja HAITTAVAIKUTUKSET ).
Maksatoksisuutta, mukaan lukien kuolemantapaukset, on raportoitu (ks HAITTAVAIKUTUKSET ). Maksan toiminnan lähtötilanne ja määräajoin tulee arvioida.
VAROTOIMENPITEET
MYAMBUTOL 800 mg etambutolihydrokloridia ei suositella käytettäväksi alle 13-vuotiaille lapsipotilaille, koska turvallisia käyttöolosuhteita ei ole vahvistettu.
Potilaat, joiden munuaisten toiminta on heikentynyt, tarvitsevat MYAMBUTOLin seerumipitoisuuksien mukaan pienennettyä annosta, koska tämän lääkkeen pääasiallinen erittyminen tapahtuu munuaisten kautta.
Koska tällä lääkkeellä voi olla haitallisia vaikutuksia näkökykyyn, fyysiseen tutkimukseen tulee sisältyä oftalmoskopia, sormen ympärysmitta ja värin erottelun testaus. Näöntarkkuuden muutosten arviointi on vaikeampaa potilailla, joilla on näköhäiriöitä, kuten kaihi, toistuvia silmän tulehdussairauksia, näköhermotulehdus ja diabeettinen retinopatia, ja on huolehdittava siitä, että näön vaihtelut eivät johdu taustalla olevat sairaudet. Tällaisilla potilailla on otettava huomioon odotettavissa olevien hyötyjen ja mahdollisen näön heikkenemisen välinen suhde, koska näkömuutosten arviointi on vaikeaa. (Katso suositellut toimenpiteet alla olevista seuraavista kappaleista HAITTAVAIKUTUKSET ).
Kuten kaikkien voimakkaiden lääkkeiden kohdalla, elinjärjestelmän, mukaan lukien munuaisten, maksan ja hematopoieettisen toiminnan, lähtötilanne ja määräajoin on arvioitava.
Raskaus
Teratogeeniset vaikutukset
Raskausluokka C.
Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana oleville naisille. On raportoitu oftalmisia poikkeavuuksia lapsilla, jotka ovat syntyneet naisille, jotka ovat saaneet tuberkuloosihoitoa, johon sisältyi MYAMBUTOLI. MYAMBUTOLIA tulee käyttää raskauden aikana vain, jos hyöty oikeuttaa mahdollisen riskin sikiölle.
MYAMBUTOL 200 mg:n on osoitettu olevan teratogeeninen raskaana oleville hiirille ja kaniineille, kun sitä on annettu suurina annoksina. Kun tiineitä hiiriä tai kaneja käsiteltiin suurilla annoksilla etambutolihydrokloridia, sikiökuolleisuus lisääntyi hieman, mutta ei merkittävästi (P>0,05). Naarasrotilla, joita hoidettiin etambutolihydrokloridilla, havaittiin lievää, mutta merkityksetöntä (P>0,05) hedelmällisyyden ja pentueen koon laskua.
Sikiöillä, jotka ovat syntyneet hiiristä, joita hoidettiin suurilla annoksilla 400 mg MYAMBUTOLia raskauden aikana, havaittiin suulakihalkeamaa, eksenkefaliaa ja selkärangan poikkeavuuksia harvoin. Pieniä kohdunkaulan nikamien poikkeavuuksia havaittiin rottien vastasyntyneillä, joita hoidettiin suurilla annoksilla etambutolihydrokloridia raskauden aikana. Kanit, jotka saivat suuria annoksia MYAMBUTOLIA tiineyden aikana, synnyttivät kaksi sikiötä, joilla oli monoftalmia, joista toisella oli lyhennetty oikea kyynärvarsi, johon liittyi molemminpuolinen ranteen nivelen kontraktuura ja toisella jänishuuli ja suulakihalkio.
Imettävät äidit
MYAMBUTOL erittyy äidinmaitoon. MYAMBUTOLin käyttöä tulee harkita vain, jos odotettu hyöty äidille on suurempi kuin mahdollinen riski lapselle.
Käyttö lapsille
MYAMBUTOLIA (etambutolihydrokloridia) ei suositella käytettäväksi alle 13-vuotiaille lapsipotilaille, koska turvallisia käyttöolosuhteita ei ole vahvistettu.
Geriatrinen käyttö
Etambutolin käytöstä vanhuksilla on vain vähän tietoa. Yhdessä tutkimuksessa, johon osallistui 101 potilasta, vähintään 65-vuotias, ja jotka käyttivät useita tuberkuloosilääkkeitä, sisälsi 94 etambutolia saavaa potilasta. Näillä potilailla ei havaittu eroja turvallisuudessa tai siedettävyydessä verrattuna aikuisilla yleisesti raportoituihin. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
YLIANNOSTUS
Tietoja ei annettu
VASTA-AIHEET
MYAMBUTOL on vasta-aiheinen potilaille, joiden tiedetään olevan yliherkkiä tälle lääkkeelle. Se on myös vasta-aiheinen potilailla, joilla on tunnettu näköhermotulehdus, ellei kliininen arviointi päätä, että sitä voidaan käyttää. MYAMBUTOL on vasta-aiheinen potilaille, jotka eivät pysty arvostamaan visuaalisia sivuvaikutuksia tai näönmuutoksia ja raportoimaan niistä (esim. pienet lapset, tajuttomat potilaat).
KLIININEN FARMAKOLOGIA
MYAMBUTOL 600 mg, kun kerta-annos on 25 mg/kg, saavuttaa seerumin huippuarvon 2-5 mg/ml 2-4 tunnin kuluttua annosta. Kun lääkettä annetaan päivittäin pidempiä aikoja tällä annoksella, seerumipitoisuudet ovat samanlaiset. MYAMBUTOLin seerumin taso laskee havaitsemattomalle tasolle 24 tunnin kuluessa viimeisen annoksen jälkeen, paitsi joillakin potilailla, joilla on epänormaali munuaisten toiminta. Punasolujen solunsisäiset pitoisuudet saavuttavat huippuarvot noin kaksinkertaisesti plasmaan verrattuna ja säilyttävät tämän suhteen koko 24 tunnin ajan.
MYAMBUTOLin suun kautta ottamista seuraavan 24 tunnin aikana noin 50 prosenttia aloitusannoksesta erittyy muuttumattomana virtsaan, ja lisäksi 8–15 prosenttia erittyy metaboliittien muodossa. Pääasiallinen aineenvaihduntareitti näyttää olevan alkoholin ensimmäinen hapetus aldehydivälituotteeksi, jota seuraa konversio dikarboksyylihapoksi. Alkuannoksesta 20–22 prosenttia erittyy ulosteisiin muuttumattomana lääkkeenä. Lääkkeen kertymistä ei ole havaittu käytettäessä peräkkäisiä kerta-annoksia 25 mg/kg potilailla, joilla on normaali munuaisten toiminta, vaikka huomattavaa kumuloitumista on osoitettu potilailla, joilla on munuaisten vajaatoiminta.
MYAMBUTOL diffundoituu aktiivisesti kasvaviin mykobakteerisoluihin, kuten tuberkuloosibasilleihin. MYAMBUTOL 800mg näyttää estävän yhden tai useamman aineenvaihduntatuotteen synteesiä aiheuttaen siten solujen aineenvaihdunnan heikkenemistä, lisääntymisen pysähtymistä ja solukuolemaa. Ristiresistenssiä muiden saatavilla olevien mykobakteerilääkkeiden kanssa ei ole osoitettu.
MYAMBUTOL 200 mg:n on osoitettu olevan tehokas Mycobacterium tuberculosis -kantoja vastaan, mutta se ei näytä vaikuttavan sieniä, viruksia tai muita bakteereja vastaan. Mycobacterium tuberculosis -kannat, joita ei ole aiemmin altistettu MYAMBUTOLille, ovat olleet tasaisen herkkiä pitoisuuksille, jotka ovat 8 mikrog/ml tai vähemmän, riippuen viljelyalustan luonteesta. Kun MYAMBUTOLIA on käytetty yksinään tuberkuloosin hoitoon, näiden potilaiden tuberkuloosibasillit ovat kehittäneet resistenssin MYAMBUTOLIA (etambutolihydrokloridia) kohtaan in vitro -herkkyystesteillä; resistenssin kehittyminen on ollut arvaamatonta ja näyttää tapahtuvan vaiheittain. MYAMBUTOLIN ja muiden tuberkuloosilääkkeiden välillä ei ole raportoitu ristiresistenssiä. MYAMBUTOL on vähentänyt mykobakteeriresistenssin ilmaantumista isoniatsidille, kun molempia lääkkeitä on käytetty samanaikaisesti.
Agar-diffuusiomikrobiologista määritystä, joka perustuu Mycobacterium smegmatis -bakteerin (ATCC 607) estoon, voidaan käyttää MYAMBUTOLin pitoisuuksien määrittämiseen seerumissa ja virtsassa.
Eläinfarmakologia
Koirilla tehdyt toksikologiset tutkimukset suurilla pitkittyneillä annoksilla tuottivat näyttöä sydänlihaksen vaurioista ja vajaatoiminnasta sekä silmien tapetum lucidumin pigmentoitumisesta, jonka merkitystä ei tunneta. Keskushermoston rappeuttavia muutoksia, jotka eivät ilmeisesti ole annoksesta riippuvaisia, on myös havaittu koirilla, jotka ovat saaneet etambutolihydrokloridia pitkään.
Reesusapinoilla neurologisia oireita ilmaantui sen jälkeen, kun niitä annettiin suurilla annoksilla päivittäin useiden kuukausien ajan. Nämä korreloivat etambutolin spesifisten seerumipitoisuuksien ja selkeiden neuroanatomisten muutosten kanssa keskushermostossa. Fokaalista interstitiaalista sydäntulehdusta havaittiin myös apinoilla, jotka saivat etambutolihydrokloridia suurina annoksina pitkän ajan.
POTILASTIEDOT
Tietoja ei ole annettu. Katso VAROITUKSET ja VAROTOIMENPITEET osiot.
