Floxin 100mg, 200mg, 400mg Ofloxacin Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Floxin on ja miten sitä käytetään?
Floxin 200mg on reseptilääke, jota käytetään monien erilaisten bakteeri-infektioiden, kuten keuhkokuumeen, ihoinfektioiden, keuhkoputkentulehduksen ja akuutin lantion tulehdustaudin, oireiden hoitoon. Floxinia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Floxin kuuluu fluorokinolonien ryhmään.
Ei tiedetä, onko Floxin 200mg turvallinen ja tehokas lapsille.
Mitkä ovat Floxinin mahdolliset sivuvaikutukset?
Floxin 100mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nokkosihottuma,
- vaikeuksia hengittää,
- turvotus kasvoissasi tai kurkussasi,
- kuume,
- kipeä kurkku,
- polttaa silmissäsi,
- ihokipu,
- punainen tai violetti ihottuma, joka leviää ja aiheuttaa rakkuloita ja hilseilyä,
- päänsärky,
- nälkä,
- hikoilu,
- ärtyneisyys,
- huimaus,
- pahoinvointi,
- nopea syke,
- ahdistus,
- tärinä,
- tunnottomuus, heikkous tai pistely käsissäsi, käsivarsissasi, jaloissasi tai jaloissasi,
- hermostuneisuus,
- hämmennystä,
- agitaatio,
- vainoharhaisuus,
- hallusinaatiot,
- muistiongelmia,
- keskittymisvaikeuksia,
- itsemurha-ajatuksia,
- äkillinen kipu,
- turvotus,
- mustelmat,
- arkuus,
- jäykkyys,
- liikkumisongelmia,
- napsahtava tai poksahtava ääni missä tahansa nivelissäsi,
- vaikea ja jatkuva rintakipu, vatsa- tai selkäkipu,
- kova vatsakipu,
- vetistä tai veristä ripulia,
- hengenahdistus,
- ihottuma, olipa se kuinka lievä tahansa,
- vähän tai ei ollenkaan virtsaamista,
- kohtaus,
- kovat päänsäryt,
- soi korvissasi,
- näköongelmia,
- kipu silmiesi takana,
- ylävatsakipu,
- ruokahalun menetys,
- tumma virtsa,
- savenväriset ulosteet ja
- ihon tai silmien keltaisuus
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Floxinin yleisimmät sivuvaikutukset ovat:
- pahoinvointi,
- ummetus,
- ripuli,
- huimaus ja
- päänsärky
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Floxinin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
Fluorokinolonit, mukaan lukien FLOXIN® (ofloksasiini), liittyvät lisääntyneeseen jännetulehduksen ja jännerepeämän riskiin kaiken ikäisillä. Tämä riski kasvaa edelleen vanhemmilla, yleensä yli 60-vuotiailla potilailla, potilailla, jotka käyttävät kortikosteroidilääkkeitä ja potilailla, joille on tehty munuais-, sydän- tai keuhkosiirto (ks. VAROITUKSET).
Fluorokinolonit, mukaan lukien FLOXIN® (ofloksasiini), voivat pahentaa lihasheikkoutta henkilöillä, joilla on myasthenia gravis. Vältä FLOXIN®:ia (ofloksasiinia) potilailla, joilla on aiemmin ollut myasthenia gravis (katso VAROITUKSET).
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja FLOXIN® (ofloksasiinitabletit) -tablettien ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi FLOXIN® (ofloksasiinitabletit) -tabletteja tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden todistetusti tai vahvasti epäillään olevan bakteerien aiheuttama.
KUVAUS
FLOXIN® (ofloksasiinitabletit) Tabletit on synteettinen laajakirjoinen antimikrobinen aine suun kautta annettavaksi. Kemiallisesti ofloksasiini, fluorattu karboksikinoloni, on rasemaatti, (±)-9-fluori-2,3-dihydro-3-metyyli-10-(4-metyyli-1-piperatsinyyli)-7okso-7H-pyrido[1, 2,3-de]-1,4-bentsoksatsiini-6-karboksyylihappo. Kemiallinen rakenne on:
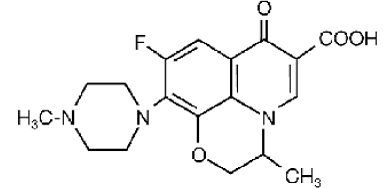
Sen empiirinen kaava on C18H20FN3O4 ja sen molekyylipaino on 361,4 Ofloksasiini on luonnonvalkoisesta vaaleankeltaiseen kiteistä jauhetta. Molekyyli esiintyy kahtaisionina ohutsuolen pH-olosuhteissa. Ofloksasiinin suhteelliset liukoisuusominaisuudet huoneenlämpötilassa, USP-nimikkeistössä määritellyt, osoittavat, että ofloksasiinin katsotaan liukenevan vesiliuoksiin, joiden pH on 2–5. Se on niukasti tai vähän liukoinen vesiliuoksiin, joiden pH on 7 (liukoisuus laskee 4 mg/ml) ja liukenee vapaasti vesiliuoksiin, joiden pH on yli 9. Ofloksasiinilla on mahdollisuus muodostaa stabiileja koordinaatioyhdisteitä monien metalli-ionien kanssa. Tällä in vitro kelatointipotentiaalilla on seuraava muodostumisjärjestys: Fe+3 > Al+3 > Cu+2 > Ni+2 > Pb+2 > Zn+2 > Mg+2 > Ca+2 > Ba+2.
FLOXIN® (ofloksasiini) -tabletit sisältävät seuraavia inaktiivisia aineita: vedetöntä laktoosia, modifioitua maissitärkkelystä, hydroksipropyyliselluloosaa, hypromelloosia, magnesiumstearaattia, polyetyleeniglykolia, polysorbaatti 80:tä, natriumtärkkelysglykolaattia, keltaista titaanidioksidia ja voi sisältää myös synteettistä ironia.
INDIKAATIOT
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja FLOXIN® (ofloksasiinitabletit) -tablettien ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi FLOXIN® (ofloksasiinitabletit) -tabletteja tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden todistetusti tai vahvasti epäillään olevan herkkien bakteerien aiheuttama. Kun viljely- ja herkkyystiedot ovat saatavilla, ne tulee ottaa huomioon valittaessa tai muuttaessa antibakteerista hoitoa. Tällaisten tietojen puuttuessa paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa hoidon empiiriseen valintaan.
FLOXIN® (ofloksasiinitabletit) Tabletit on tarkoitettu aikuisten hoitoon, joilla on lieviä tai kohtalaisia infektioita (ellei toisin mainita), jotka ovat aiheuttaneet alla luetelluissa infektioissa nimettyjen mikro-organismien herkät kannat. Ole hyvä ja katso ANNOSTELU JA HALLINNOINTI erityisiä suosituksia varten.
Kroonisen keuhkoputkentulehduksen akuutit bakteeriperäiset pahenemisvaiheet Haemophilus influenzaen tai Streptococcus pneumoniaen aiheuttamana.
Yhteisön hankkima keuhkokuume Haemophilus influenzaen tai Streptococcus pneumoniaen aiheuttamana.
Komplisoitumattomat iho- ja ihorakenteen infektiot johtuen metisilliinille herkistä Staphylococcus aureus-, Streptococcus pyogenes- tai Proteus mirabilis -bakteerista.
Akuutti, komplisoitumaton virtsaputken ja kohdunkaulan tippuri Neisseria gonorrhoeaen vuoksi. (Katso VAROITUKSET .)
Ei-ononokokki-uretriitti ja kohdunkaulantulehdus Chlamydia trachomatis -taudin vuoksi. (Katso VAROITUKSET .)
Virtsaputken ja kohdunkaulan sekainfektiot Chlamydia trachomatis ja Neisseria gonorrhoeae aiheuttavat. (Katso VAROITUKSET .)
Akuutti lantion alueen tulehdussairaus (mukaan lukien vakava infektio), jotka johtuvat Chlamydia trachomatis- ja/tai Neisseria gonorrhoeae -bakteerista. (Katso VAROITUKSET .)
MERKINTÄ: Jos anaerobisten mikro-organismien epäillään myötävaikuttavan infektioon, anaerobisille patogeeneille tulee antaa asianmukaista hoitoa.
Komplisoitumaton kystiitti Citrobacter diversuksen, Enterobacter aerogenesin, Escherichia colin, Klebsiella pneumoniaen, Proteus mirabilisin tai Pseudomonas aeruginosan vuoksi.
Monimutkaiset virtsatietulehdukset Escherichia colin, Klebsiella pneumoniaen, Proteus mirabilisin, Citrobacter diversuksen* tai Pseudomonas aeruginosan* aiheuttaman.
Eturauhastulehdus Escherichia colin takia.
* = Vaikka tämän organismin aiheuttamien infektioiden hoito tässä elinjärjestelmässä osoitti kliinisesti merkittävää lopputulosta, tehoa tutkittiin alle 10 potilaalla.
Ennen hoitoa on suoritettava asianmukaiset viljely- ja herkkyystestit infektion aiheuttavien organismien eristämiseksi ja tunnistamiseksi sekä niiden herkkyyden määrittämiseksi ofloksasiinille. Ofloksasiinihoito voidaan aloittaa ennen kuin näiden testien tulokset ovat tiedossa; kun tulokset ovat saatavilla, asianmukaista hoitoa tulee jatkaa.
Kuten muutkin tämän luokan lääkkeet, jotkut Pseudomonas aeruginosa -kannat voivat kehittää resistenssiä melko nopeasti ofloksasiinihoidon aikana. Hoidon aikana säännöllisesti suoritettavat viljely- ja herkkyystestit antavat tietoa mikrobilääkkeen terapeuttisen vaikutuksen lisäksi myös mahdollisesta bakteeriresistenssin syntymisestä.
ANNOSTELU JA HALLINNOINTI
FLOXIN® (ofloksasiinitabletit) -tablettien tavallinen annos on 200 mg - 400 mg suun kautta 12 tunnin välein seuraavassa annostustaulukossa kuvatulla tavalla. Nämä suositukset koskevat potilaita, joiden munuaisten toiminta on normaali (eli kreatiniinipuhdistuma > 50 ml/min). Jos potilaalla on munuaisten toimintahäiriö (eli kreatiniinipuhdistuma Potilaat, joilla on munuaisten vajaatoiminta alajakso.
Antasidit, jotka sisältävät kalsiumia, magnesiumia tai alumiinia; sukralfaatti; kaksi- tai kolmiarvoiset kationit, kuten rauta; tai sinkkiä sisältävät monivitamiinit; tai Videx® (didanosiini) ei tule ottaa kahden tunnin aikana ennen ofloksasiinin ottamista tai kahden tunnin aikana sen jälkeen. (Katso VAROTOIMENPITEET .)
Potilaat, joilla on munuaisten vajaatoiminta : Annostusta tulee säätää potilaille, joiden kreatiniinipuhdistuma on
Kun vain seerumin kreatiniini tunnetaan, seuraavaa kaavaa voidaan käyttää kreatiniinipuhdistuman arvioimiseen.
Naiset: 0,85 x miehille laskettu arvo
Seerumin kreatiniinin pitäisi edustaa vakaata munuaisten toimintaa.
Kirroosia sairastavat potilaat:
Ofloksasiinin erittyminen voi vähentyä potilailla, joilla on vaikeita maksan toimintahäiriöitä (esim. kirroosi, johon liittyy tai ei ole askitesta). Sen vuoksi 400 mg ofloksasiinin vuorokausiannosta ei saa ylittää.
MITEN TOIMITETAAN
FLOXIN® (ofloksasiinitabletit) Tabletit toimitetaan 200 mg vaaleankeltaisina, 300 mg valkoisina ja 400 mg vaalean kullanvärisinä soikeina, suorareunaisina päällystetyinä tabletteina. Jokaisessa tabletissa on merkintä "FLOXIN (ofloksasiini)" ja sopiva vahvuus. FLOXIN® (ofloksasiini) -tabletit on pakattu pulloihin seuraavissa kokoonpanoissa:
200 mg tabletit - pullot 50 ( NDC 0062 - 1540-02)
300 mg tabletit - pullot 50 ( NDC 0062 - 1541-02)
400 mg tabletit - 100 pullot ( NDC 0062 - 1542-01)
FLOXIN® (ofloksasiini) -tabletit tulee säilyttää hyvin suljetuissa astioissa. Säilytä 25°C (77°F); sallitaan 15-30°C (59-86°F).
Pidä poissa lasten ulottuvilta.
Ortho-McNeil, Division of Ortho-McNeil-Janssen Pharmaceuticals, Inc. Raritan, NJ USA 08869. Julkaistu tammikuussa 2011
SIVUVAIKUTUKSET
Seuraavassa on kokoelma ofloksasiinia koskevista tiedoista, jotka perustuvat kliiniseen kokemukseen sekä oraalisista että suonensisäisistä formulaatioista. Lääkkeisiin liittyvien haittavaikutusten ilmaantuvuus potilailla vaiheen 2 ja 3 kliinisissä tutkimuksissa oli 11 %. Useita annoksia saaneista potilaista 4 % keskeytti ofloksasiinihoidon haittavaikutusten vuoksi.
Kliinisissä tutkimuksissa seuraavien tapahtumien katsottiin liittyvän todennäköisesti lääkkeeseen potilailla, jotka saivat useita annoksia ofloksasiinia:
pahoinvointi 3%, unettomuus 3%, päänsärky 1%, huimaus 1%, ripuli 1%, oksentelu 1%, ihottuma 1%, kutina 1%, ulkoisten sukuelinten kutina naisilla 1%, vaginiitti 1%, dysgeusia 1%.
Kliinisissä tutkimuksissa yleisimmin raportoidut haittatapahtumat riippumatta lääkkeen suhteesta olivat:
pahoinvointi 10 %, päänsärky 9 %, unettomuus 7 %, ulkoisten sukuelinten kutina naisilla 6 %, huimaus 5 %, vaginiitti 5 %, ripuli 4 %, oksentelu 4 %.
Kliinisissä tutkimuksissa seuraavia tapahtumia esiintyi 1–3 %:lla potilaista riippumatta niiden suhteesta lääkkeeseen:
Vatsakipu ja -krampit, rintakipu, ruokahalun heikkeneminen, suun kuivuminen, dysgeusia, väsymys, ilmavaivat, ruoansulatuskanavan vaivat, hermostuneisuus, nielutulehdus, kutina, kuume, ihottuma, unihäiriöt, uneliaisuus, vartalokipu, emätinvuoto, näköhäiriöt ja ummetus.
Muita tapahtumia, joita esiintyi kliinisissä tutkimuksissa alle 1 %:lla riippumatta lääkkeen suhteesta, olivat:
Runko kokonaisuudessaan: astenia, vilunväristykset, huonovointisuus, raajakipu, kipu, nenäverenvuoto
Sydän- ja verisuonijärjestelmä: sydämenpysähdys, turvotus, verenpainetauti, hypotensio, sydämentykytys, vasodilataatio
Ruoansulatuskanava: Dyspepsia
Sukuelimet / lisääntymisjärjestelmä: polttaminen, ärsytys, kipu ja ihottuma naisten sukupuolielimissä; dysmenorrea; menorragia; metrorragia
Tuki- ja liikuntaelimistö: nivelkipu, myalgia
Hermosto: kohtaukset, ahdistus, kognitiiviset muutokset, masennus, unen poikkeavuus, euforia, hallusinaatiot, parestesia, pyörtyminen, huimaus, vapina, sekavuus
Ravitsemus/aineenvaihdunta: jano, laihtuminen
Hengitysjärjestelmä: hengityspysähdys, yskä, rinorrea
Iho/yliherkkyys: angioödeema, hikoilu, urtikaria, vaskuliitti
Erityiset aistit: heikentynyt kuulon tarkkuus, tinnitus, valonarkuus
Virtsajärjestelmä: dysuria, virtsaamistiheys, virtsanpidätys
Seuraavia laboratorioarvojen poikkeavuuksia esiintyi ≥ 1,0 %:lla potilaista, jotka saivat useita ofloksasiiniannoksia. Ei tiedetä, johtuivatko nämä poikkeavuudet lääkkeestä vai hoidetuista taustatiloista.
Hematopoieettinen: anemia, leukopenia, leukosytoosi, neutropenia, neutrofiilia, lisääntyneet nauhamuodot, lymfosytopenia, eosinofilia, lymfosytoosi, trombosytopenia, trombosytoosi, kohonnut ESR
Maksa: kohonnut: alkalinen fosfataasi, AST (SGOT), ALT (SGPT) Seerumin kemia: hyperglykemia, hypoglykemia, kohonnut kreatiniini, kohonnut BUN Virtsatie: glukosuria, proteinuria, alkalinuria, hypostenuria, hematuria, pyuria
Markkinoinnin jälkeiset haittatapahtumat
Muita haittatapahtumia riippumatta lääkkeen suhteesta, jotka on raportoitu kinolonien, mukaan lukien ofloksasiinin, maailmanlaajuisesta markkinointikokemuksesta:
Kliininen
Sydän- ja verisuonijärjestelmä: aivotromboosi, keuhkopöhö, takykardia, hypotensio/sokki, pyörtyminen, torsades de pointes
Endokriininen/aineenvaihdunta: hyper- tai hypoglykemia, erityisesti diabeetikoilla, jotka käyttävät insuliinia tai oraalisia hypoglykeemisiä aineita (katso VAROTOIMENPITEET : Kenraali ja HUUMEIDEN VUOROVAIKUTUKSET .)
Ruoansulatuskanava: maksan toimintahäiriö mukaan lukien: maksanekroosi, keltaisuus (kolestaattinen tai hepatosellulaarinen), hepatiitti; suoliston perforaatio; maksan vajaatoiminta (mukaan lukien kuolemaan johtaneet tapaukset); pseudomembranoottinen paksusuolitulehdus (pseudomembranoottisen paksusuolitulehduksen oireet voivat ilmaantua mikrobihoidon aikana tai sen jälkeen), maha-suolikanavan verenvuoto; hikka, kipeä suun limakalvo, pyroosi (katso VAROITUKSET .)
Sukuelimet / lisääntymisjärjestelmä: emättimen kandidoosi
Hematopoieettinen: anemia, mukaan lukien hemolyyttinen ja aplastinen; verenvuoto, pansytopenia, agranulosytoosi, leukopenia, palautuva luuytimen lama, trombosytopenia, tromboottinen trombosytopeeninen purppura, petekiat, mustelmat/mustelmat (ks. VAROITUKSET .)
Tuki- ja liikuntaelimistö: jännetulehdus/repeämä; heikkous; rabdomyolyysi (katso VAROITUKSET .)
Hermosto: painajaiset; itsetuhoiset ajatukset tai teot, desorientaatio, psykoottiset reaktiot, vainoharhaisuus; fobia, kiihtyneisyys, levottomuus, aggressiivisuus/vihamielisyys, maaninen reaktio, emotionaalinen labilisuus; perifeerinen neuropatia, ataksia, koordinaatiohäiriöt; paheneminen: myasthenia gravis ja ekstrapyramidaaliset häiriöt; dysfasia, huimaus (katso VAROITUKSET ja VAROTOIMENPITEET .)
Hengitysjärjestelmä: hengenahdistus, bronkospasmi, allerginen keuhkotulehdus, stridor (katso VAROITUKSET .)
Iho/yliherkkyys: anafylaktiset (-toid) reaktiot/sokki; purppura, seerumitauti, erythema multiforme/Stevens-Johnsonin oireyhtymä, erythema nodosum, eksfoliatiivinen dermatiitti, hyperpigmentaatio, toksinen epidermaalinen nekrolyysi, sidekalvotulehdus, valoherkkyys/fototoksisuusreaktio, vesiculobulloous eruptio (ks. VAROITUKSET ja VAROTOIMENPITEET .)
Erityiset aistit: diplopia, nystagmus, näön hämärtyminen, maku-, haju-, kuulo- ja tasapainohäiriöt, jotka yleensä palautuvat hoidon lopettamisen jälkeen
Virtsajärjestelmä: anuria, polyuria, munuaiskivi, munuaisten vajaatoiminta, interstitiaalinen nefriitti, hematuria (katso VAROITUKSET ja VAROTOIMENPITEET .)
Laboratorio
Hematopoieettinen: protrombiiniajan pidentyminen
Seerumin kemia: asidoosi, kohonneet: seerumin triglyseridit, seerumin kolesteroli, seerumin kalium, maksan toimintakokeet mukaan lukien: GGTP, LDH, bilirubiini
Virtsatie: albuminuria, kandiduria
Kliinisissä tutkimuksissa, joissa käytettiin usean annoksen hoitoa, on havaittu oftalmologisia poikkeavuuksia, mukaan lukien kaihi ja useita pistemäisiä linssimäisiä sameuksia, potilailla, jotka ovat saaneet hoitoa muilla kinoloneilla. Huumeiden suhdetta näihin tapahtumiin ei ole tällä hetkellä osoitettu.
CRYSTALLURIA ja CYLINDRURIA ON RAPORTOINTI muiden kinolonien kanssa.
HUUMEIDEN VUOROVAIKUTUKSET
Antasidit, sukralfaatti, metallikationit, monivitamiinit
Kinolonit muodostavat kelaatteja maa-alkali- ja siirtymämetallikationien kanssa. Kinolonien anto kalsiumia, magnesiumia tai alumiinia sisältävien antasidien, sukralfaatin, kaksi- tai kolmiarvoisten kationien, kuten raudan, tai sinkkiä sisältävien multivitamiinien tai Videx®:n (didanosiini) kanssa voi merkittävästi häiritä kinolonien imeytymistä, mikä johtaa huomattaviin systeemisiin tasoihin. haluttua alhaisempi. Näitä aineita ei saa ottaa kahden tunnin aikana ennen ofloksasiinin antoa tai kahden tunnin sisällä sen jälkeen. (Katso ANNOSTELU JA HALLINNOINTI .)
Kofeiini
Ofloksasiinin ja kofeiinin välisiä yhteisvaikutuksia ei ole havaittu.
Simetidiini
Simetidiinin on osoitettu häiritsevän joidenkin kinolonien eliminaatiota. Tämä häiriö on johtanut joidenkin kinolonien puoliintumisajan ja AUC:n merkittävään pidentymiseen. Ofloksasiinin ja simetidiinin välisiä yhteisvaikutuksia ei ole tutkittu.
Syklosporiini
Siklosporiinin kohonneita seerumipitoisuuksia on raportoitu, kun siklosporiinia on käytetty samanaikaisesti joidenkin muiden kinolonien kanssa. Ofloksasiinin ja siklosporiinin välisiä yhteisvaikutuksia ei ole tutkittu.
Sytokromi P450 -entsyymien kautta metaboloituvat lääkkeet
Useimmat kinolonien antimikrobiset lääkkeet estävät sytokromi P450 -entsyymiaktiivisuutta. Tämä voi johtaa joidenkin lääkkeiden puoliintumisajan pidentymiseen, jotka myös metaboloituvat tämän järjestelmän kautta (esim. syklosporiini, teofylliini/metyyliksantiinit, varfariini), kun niitä annetaan samanaikaisesti kinolonien kanssa. Tämän eston laajuus vaihtelee eri kinolonien välillä. (Katso muut huumeiden yhteisvaikutukset .)
Ei-steroidiset tulehduskipulääkkeet
Ei-steroidisen tulehduskipulääkkeen samanaikainen käyttö kinolonin, mukaan lukien ofloksasiinin, kanssa voi lisätä keskushermoston stimulaation ja kouristuksen riskiä. (Katso VAROITUKSET ja VAROTOIMENPITEET : Kenraali .)
Probenesidi
Probenesidin samanaikaisen käytön tiettyjen muiden kinolonien kanssa on raportoitu vaikuttavan munuaistiehyiden eritykseen. Probenesidin vaikutusta ofloksasiinin eliminaatioon ei ole tutkittu.
Teofylliini
Vakaan tilan teofylliinitasot voivat nousta, kun ofloksasiinia ja teofylliiniä annetaan samanaikaisesti. Kuten muidenkin kinolonien kanssa, ofloksasiinin samanaikainen käyttö voi pidentää teofylliinin puoliintumisaikaa, nostaa seerumin teofylliinitasoja ja lisätä teofylliiniin liittyvien haittavaikutusten riskiä. Teofylliinitasoja on seurattava tarkasti ja teofylliinin annosta on tarvittaessa muutettava, kun ofloksasiinia annetaan samanaikaisesti. Haittavaikutuksia (mukaan lukien kouristukset) voi esiintyä seerumin teofylliinitason nousun kanssa tai ilman sitä. (Katso VAROITUKSET ja VAROTOIMENPITEET : Kenraali .)
Varfariini
Joidenkin kinolonien on raportoitu voimistavan oraalisen antikoagulantin varfariinin tai sen johdannaisten vaikutuksia. Siksi, jos kinoloniantimikrobista lääkettä annetaan samanaikaisesti varfariinin tai sen johdannaisten kanssa, protrombiiniaikaa tai muuta sopivaa hyytymistestiä on seurattava tarkasti.
Diabeteslääkkeet (esim. insuliini, glyburidi/glibenklamidi)
Koska verensokerin häiriöitä, mukaan lukien hyperglykemiaa ja hypoglykemiaa, on raportoitu potilailla, joita on hoidettu samanaikaisesti kinoloneilla ja diabeteslääkkeellä, verensokerin huolellista seurantaa suositellaan käytettäessä näitä aineita samanaikaisesti. (Katso VAROTOIMENPITEET : Kenraali ja POTILASTIEDOT .)
Vuorovaikutus laboratorio- tai diagnostisten testausten kanssa
Jotkut kinolonit, mukaan lukien ofloksasiini, voivat tuottaa vääriä positiivisia virtsan seulontatuloksia opiaateille käyttämällä kaupallisesti saatavia immunomäärityssarjoja. Positiivisten opiaattiseulojen vahvistaminen tarkemmilla menetelmillä saattaa olla tarpeen.
VAROITUKSET
Tendinopatia ja jänteen repeämä
Fluorokinolonit, mukaan lukien FLOXIN® (ofloksasiini), liittyvät lisääntyneeseen jännetulehduksen ja jännerepeämän riskiin kaiken ikäisillä. Tämä haittavaikutus koskee useimmiten akillesjännettä, ja akillesjänteen repeämä saattaa vaatia kirurgista korjausta. Jännetulehdus ja jänteen repeämä rotaattorimansetissa (olkapäässä), kädessä, hauislihaksessa, peukalossa ja muissa jänteissä on myös raportoitu. Fluorokinoloneihin liittyvän jännetulehduksen ja jännerepeämän riski kasvaa edelleen vanhemmilla, yleensä yli 60-vuotiailla potilailla, kortikosteroidilääkkeitä käyttävillä sekä potilailla, joille on tehty munuais-, sydän- tai keuhkosiirto. Iän ja kortikosteroidien käytön lisäksi tekijöitä, jotka voivat itsenäisesti lisätä jänteen repeämän riskiä, ovat rasittava fyysinen rasitus, munuaisten vajaatoiminta ja aiemmat jännehäiriöt, kuten nivelreuma. Tendiniittiä ja jänteen repeämää on raportoitu fluorokinoloneja käyttävillä potilailla, joilla ei ole yllä mainittuja riskitekijöitä. Jänteen repeämä voi tapahtua hoidon aikana tai sen jälkeen; Useita kuukausia hoidon päättymisen jälkeen esiintyviä tapauksia on raportoitu. FLOXIN® (ofloksasiini) on lopetettava, jos potilaalla on kipua, turvotusta, tulehdusta tai jänteen repeämä. Potilaita tulee neuvoa lepäämään jännetulehduksen tai jänteen repeämän ensimmäisten merkkien yhteydessä ja ottamaan yhteyttä terveydenhuollon tarjoajaan ei-kinolonilääkkeeseen vaihtamisesta.
OFLOKSASIININ TURVALLISUUTTA JA TEHOKKUUTTA LAPSIPOTILAISILLE JA NUURILLE (ALLE 18-VUOTIILLE), RASAKALAISILLE NAISILLE JA IMETTÄVILLE NAISILLE EI OLE TUNNISTETTU. (Katso VAROTOIMENPITEET : Käyttö lapsille , Raskaus , ja Imettävien äitien alakohdat .)
Epäkypsillä rotilla ofloksasiinin oraalinen antaminen 5–16-kertaisena ihmiselle suositeltuun enimmäisannostukseen mg/kg:n perusteella tai 1–3 kertaa mg/m²:n perusteella lisäsi osteokondroosin ilmaantuvuutta ja vaikeusastetta. Leesiot eivät taantuneet 13 viikon lääkkeen lopettamisen jälkeen. Myös muut kinolonit aiheuttavat samanlaisia eroosioita painoa kantavissa nivelissä ja muita nivelsairauksien merkkejä eri eläinlajeissa. (Katso Eläinfarmakologia .)
Myasthenia Gravis -taudin paheneminen
Fluorokinoloneilla, mukaan lukien FLOXIN® (ofloksasiini), on hermo-lihassalpaava vaikutus ja ne voivat pahentaa lihasheikkoutta henkilöillä, joilla on myasthenia gravis. Markkinoille tulon jälkeisiä vakavia haittavaikutuksia, mukaan lukien kuolemat ja hengitystuen tarve, on liitetty fluorokinolonien käyttöön potilailla, joilla on myasthenia gravis. Vältä FLOXIN®:ia (ofloksasiinia) potilailla, joilla on tunnettu myasthenia gravis -historia. (Katso POTILASTIEDOT ja HAITTAVAIKUTUKSET : Markkinoinnin jälkeiset haittatapahtumat .)
Keskushermoston vaikutukset
Kouristuksia, kohonnutta kallonsisäistä painetta ja toksisia psykooseja on raportoitu potilailla, jotka ovat saaneet kinoloneja, mukaan lukien ofloksasiinia. Kinolonit, mukaan lukien ofloksasiini, voivat myös aiheuttaa keskushermoston stimulaatiota, mikä voi johtaa: vapinaan, levottomuuteen/kiihtyneisyyteen, hermostuneisuuteen/ahdistuneisuuteen, huimaukseen, sekaisuuteen, hallusinaatioihin, vainoharhaisuuteen ja masennukseen, painajaisiin, unettomuuteen ja harvoin itsemurha-ajatuksiin tai tekoihin. Näitä reaktioita saattaa ilmetä ensimmäisen annoksen jälkeen. Jos näitä reaktioita ilmenee ofloksasiinia saavilla potilailla, lääkkeen käyttö tulee lopettaa ja asianmukaisiin toimenpiteisiin ryhtyä. Unettomuus voi olla yleisempää ofloksasiinilla kuin joillakin muilla kinoloniryhmän tuotteilla. Kuten kaikkia kinoloneja, ofloksasiinia tulee käyttää varoen potilailla, joilla on tunnettu tai epäilty keskushermostosairaus, joka voi altistaa kohtauksille tai alentaa kouristuskynnystä (esim. vaikea aivoarterioskleroosi, epilepsia) tai jos on muita altistavia riskitekijöitä. kohtauksiin tai alentamaan kohtauskynnystä (esim. tietty lääkehoito, munuaisten vajaatoiminta). (Katso VAROTOIMENPITEET : Kenraali , POTILASTIEDOT , HUUMEIDEN VUOROVAIKUTUKSET ja HAITTAVAIKUTUKSET .)
Yliherkkyysreaktiot
Vakavia ja joskus kuolemaan johtaneita yliherkkyys- ja/tai anafylaktisia reaktioita on raportoitu potilailla, jotka ovat saaneet kinoloneja, mukaan lukien ofloksasiinia. Nämä reaktiot ilmaantuvat usein ensimmäisen annoksen jälkeen. Joihinkin reaktioihin on liittynyt kardiovaskulaarinen romahdus, hypotensio/sokki, kouristukset, tajunnan menetys, pistely, angioödeema (mukaan lukien kielen, kurkunpään, kurkun tai kasvojen turvotus/turvotus), hengitysteiden tukkeuma (mukaan lukien bronkospasmi, hengenahdistus ja akuutti hengitysteiden turvotus) ahdistus), hengenahdistus, urtikaria, kutina ja muut vakavat ihoreaktiot. Tämän lääkkeen käyttö on lopetettava välittömästi, kun ihottumaa tai jokin muu yliherkkyysmerkki ilmaantuu ensimmäisen kerran. Vakavat akuutit yliherkkyysreaktiot saattavat vaatia hoitoa epinefriinillä ja muilla elvytystoimenpiteillä, mukaan lukien happi, suonensisäiset nesteet, antihistamiinit, kortikosteroidit, painetta aiheuttavat amiinit ja hengitysteiden hoito kliinisen aiheen mukaisesti. (Katso VAROTOIMENPITEET ja HAITTAVAIKUTUKSET .)
Muita vakavia ja joskus kuolemaan johtaneita tapahtumia, joista osa johtuu yliherkkyydestä ja osa epävarmasta etiologiasta, on raportoitu harvoin potilailla, jotka ovat saaneet kinoloneja, mukaan lukien ofloksasiinia. Nämä tapahtumat voivat olla vakavia ja ilmaantuvat yleensä useiden annosten antamisen jälkeen. Kliiniset oireet voivat sisältää yhden tai useamman seuraavista:
- kuume, ihottuma tai vakavat dermatologiset reaktiot (esim. toksinen epidermaalinen nekrolyysi, Stevens-Johnsonin oireyhtymä);
- vaskuliitti; nivelkipu; myalgia; seerumitauti;
- allerginen pneumoniitti;
- interstitiaalinen nefriitti; akuutti munuaisten vajaatoiminta tai vajaatoiminta;
- hepatiitti; keltaisuus; akuutti maksanekroosi tai maksan vajaatoiminta;
- anemia, mukaan lukien hemolyyttinen ja aplastinen; trombosytopenia, mukaan lukien tromboottinen trombosytopeeninen purppura; leukopenia; agranulosytoosi; pansytopenia; ja/tai muut hematologiset poikkeavuudet.
Lääkkeen käyttö tulee lopettaa välittömästi, kun ihottumaa, keltaisuutta tai muita yliherkkyysoireita ilmaantuu ensimmäisen kerran, ja tukitoimenpiteitä on aloitettu (ks. POTILASTIEDOT ja HAITTAVAIKUTUKSET ).
Perifeerinen neuropatia
Harvinaisia tapauksia sensorista tai sensorimotorista aksonaalista polyneuropatiaa, joka vaikuttaa pieniin ja/tai suuriin aksoneihin, mikä on johtanut parestesioita, hypoestesiaa, dysestesiaa ja heikkoutta saaneilla potilailla, jotka ovat saaneet kinoloneja, mukaan lukien ofloksasiinia. Ofloksasiinihoito tulee lopettaa, jos potilaalla ilmenee neuropatian oireita, kuten kipua, polttelua, pistelyä, puutumista ja/tai heikkoutta tai muita muutoksia aistimisessa, mukaan lukien kevyt kosketus, kipu, lämpötila, asennon ja tärinäaistin kehittyminen. peruuttamaton tila.
Clostridium difficileen liittyvää ripulia (CDAD) on raportoitu käytettäessä lähes kaikkia antibakteerisia aineita, mukaan lukien FLOXIN® (ofloksasiini), ja sen vaikeusaste voi vaihdella lievästä ripulista kuolemaan johtavaan paksusuolentulehdukseen. Hoito antibakteerisilla aineilla muuttaa paksusuolen normaalia kasvillisuutta, mikä johtaa C. difficilen liikakasvuun.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CDAD:n kehittymistä. Hypertoksiinia tuottavat C. difficilen kannat lisäävät sairastuvuutta ja kuolleisuutta, koska nämä infektiot voivat olla vastustuskykyisiä antimikrobiselle hoidolle ja saattavat vaatia kolektomiaa. CDAD on otettava huomioon kaikilla potilailla, joilla on ripuli antibioottien käytön jälkeen. Huolellinen sairaushistoria on tarpeen, koska CDAD:n on raportoitu esiintyvän yli kaksi kuukautta antibakteeristen aineiden annon jälkeen.
Jos CDAD epäillään tai varmistetaan, jatkuva antibioottien käyttö, joka ei ole suunnattu C. difficileä vastaan, saattaa olla tarpeen lopettaa. Asianmukainen neste- ja elektrolyyttihallinta, proteiinilisä, C. difficilen antibioottihoito ja kirurginen arviointi tulee aloittaa kliinisen aiheen mukaan. (Katso HAITTAVAIKUTUKSET .)
Ofloksasiinin ei ole osoitettu olevan tehokas kupan hoidossa.
Antimikrobiset aineet, joita käytetään suurina annoksina lyhyitä aikoja tippurin hoitoon, voivat peittää tai viivästyttää inkuboivan kupan oireita. Kaikille gonorreapotilaille tulee tehdä serologinen testi kupan varalta diagnoosin yhteydessä. Potilaille, joita hoidetaan ofloksasiinilla tippuriin, tulee suorittaa serologinen seurantatesti kupan varalta kolmen kuukauden kuluttua, ja jos se on positiivinen, tulee aloittaa hoito sopivalla mikrobilääkkeellä.

VAROTOIMENPITEET
Kenraali
FLOXIN® (ofloksasiinitabletit) -tablettien määrääminen ilman todistettua tai vahvasti epäiltyä bakteeri-infektiota tai profylaktista indikaatiota ei todennäköisesti hyödytä potilasta ja lisää lääkeresistenttien bakteerien kehittymisen riskiä.
Ofloksasiinia saavien potilaiden riittävä nesteytys on säilytettävä, jotta estetään erittäin väkevän virtsan muodostuminen.
Anna ofloksasiinia varoen, jos kyseessä on munuaisten tai maksan vajaatoiminta/vajaus. Jos potilaalla tiedetään tai epäillään olevan munuaisten tai maksan vajaatoimintaa tai heikentynyttä, huolellinen kliininen seuranta ja asianmukaiset laboratoriotutkimukset on suoritettava ennen hoidon aloittamista ja sen aikana, koska ofloksasiinin eliminaatio saattaa hidastua. Potilailla, joilla on munuaisten vajaatoiminta (kreatiniinipuhdistuma KLIININEN FARMAKOLOGIA ja ANNOSTELU JA HALLINNOINTI .)
Keskivaikeat tai vaikeat valoherkkyys-/valotoksisuusreaktiot, joista jälkimmäinen voi ilmetä liioitelluina auringonpolttamina (esim. polttaminen, punoitus, erittyminen, rakkulat, rakkulat, turvotus), joihin liittyy valolle alttiina alueita (tyypillisesti kasvot, kaulan V-alue). , käsivarsien ojentajapinnat, käsien selkä), voivat liittyä kinolonien käyttöön auringon tai UV-säteilyn jälkeen. Siksi liiallista altistumista näille valonlähteille tulee välttää. Lääkehoito tulee keskeyttää, jos valoherkkyyttä/valotoksisuutta ilmenee (ks HAITTAVAIKUTUKSET / Markkinoinnin jälkeiset haittatapahtumat ).
Kuten muitakin kinoloneja, ofloksasiinia tulee käyttää varoen kaikille potilaille, joilla on tunnettu tai epäilty keskushermostosairaus, joka voi altistaa kohtauksille tai alentaa kohtauskynnystä (esim. vaikea aivoarterioskleroosi, epilepsia) tai jos muita riskitekijöitä altistaa kohtauksille tai alentaa kohtauskynnystä (esim. tietty lääkehoito, munuaisten toimintahäiriö). (Katso VAROITUKSET ja HUUMEIDEN VUOROVAIKUTUKSET .)
Suun kautta otettavien hypoglykeemisten lääkkeiden (esim. glyburidi/glibenklamidi) tai insuliinin ja fluorokinolonien antimikrobisten aineiden välillä on raportoitu mahdollista yhteisvaikutusta, mikä voimistaa näiden lääkkeiden hypoglykeemistä vaikutusta. Tämän yhteisvaikutuksen mekanismia ei tunneta. Jos potilaalla, jota hoidetaan ofloksasiinilla, ilmenee hypoglykeeminen reaktio, lopeta ofloksasiinihoito välittömästi ja ota yhteys lääkäriin. (Katso HUUMEIDEN VUOROVAIKUTUKSET ja HAITTAVAIKUTUKSET .)
Kuten minkä tahansa tehokkaan lääkkeen kohdalla, elinjärjestelmän, mukaan lukien munuaisten, maksan ja hematopoieettisen toiminnan, säännöllinen arviointi on suositeltavaa pitkäaikaisen hoidon aikana. (Katso VAROITUKSET ja HAITTAVAIKUTUKSET .)
Torsades de pointes
Jotkut kinolonit, mukaan lukien ofloksasiini, on yhdistetty QT-ajan pidentymiseen EKG:ssa ja harvoin rytmihäiriötapauksiin. Harvinaisia tapauksia torsades de pointes -tapauksia on raportoitu spontaanisti markkinoille tulon jälkeisen seurannan aikana potilailla, jotka ovat saaneet kinoloneja, mukaan lukien ofloksasiinia. Ofloksasiinia tulee välttää potilailla, joiden QT-ajan tiedetään pidentyneen, potilailla, joilla on korjaamaton hypokalemia, ja potilailla, jotka saavat luokan IA (kinidiini, prokaiiniamidi) tai luokan III (amiodaroni, sotaloli) rytmihäiriölääkkeitä.
Tietoa potilaille
Potilaita tulee neuvoa
- ota yhteyttä terveydenhuollon tarjoajaan, jos he kokevat kipua, turvotusta tai jännetulehdusta tai heikkoutta tai kyvyttömyyttä käyttää jotakin nivelistä; lepää ja pidättäydy harjoituksesta; ja lopeta FLOXIN® (ofloksasiini) -hoito. Fluorokinolonien aiheuttamien vakavien jännehäiriöiden riski on suurempi vanhemmilla, yleensä yli 60-vuotiailla potilailla, potilailla, jotka käyttävät kortikosteroidilääkkeitä sekä potilailla, joille on tehty munuais-, sydän- tai keuhkosiirto;
- että fluorokinolonit, kuten FLOXIN® (ofloksasiini), voivat pahentaa myasthenia gravis -oireita, mukaan lukien lihasheikkous ja hengitysvaikeudet. Potilaiden tulee soittaa välittömästi terveydenhuollon tarjoajalleen, jos sinulla on paheneva lihasheikkous tai hengitysongelmia;
- että antibakteerisia lääkkeitä, mukaan lukien FLOXIN® (ofloksasiinitabletit) Tabletteja tulee käyttää vain bakteeri-infektioiden hoitoon. Ne eivät hoida virusinfektioita (esim. flunssaa). Kun FLOXIN® (ofloksasiinitabletit) -tabletteja määrätään bakteeri-infektion hoitoon, potilaille tulee kertoa, että vaikka on yleistä, että olo paranee hoidon alkuvaiheessa, lääke tulee ottaa täsmälleen ohjeiden mukaan. Annosten väliin jättäminen tai koko hoitojakson suorittamatta jättäminen voi (1) heikentää välittömän hoidon tehokkuutta ja (2) lisätä todennäköisyyttä, että bakteerit kehittävät resistenssiä ja eivät ole hoidettavissa FLOXIN® (ofloksasiinitabletit) -tableteilla tai muilla antibakteerisilla lääkkeillä tulevaisuudessa.
- että perifeeriset neuropatiat on yhdistetty ofloksasiinin käyttöön. Jos perifeerisen neuropatian oireita, kuten kipua, polttamista, pistelyä, puutumista ja/tai heikkoutta, kehittyy, hoito tulee keskeyttää ja ottaa yhteyttä lääkäriinsä.
- juoda runsaasti nesteitä;
- että kivennäisvalmisteita, vitamiineja, joissa on rautaa tai kivennäisaineita, kalsium-, alumiini- tai magnesiumpohjaisia antasideja, sukralfaattia tai Videx® (didanosiini) ei tule ottaa kahden tunnin aikana ennen ofloksasiinin ottamista tai kahden tunnin aikana sen jälkeen. Katso HUUMEIDEN VUOROVAIKUTUKSET );
- että ofloksasiini voidaan ottaa aterioista riippumatta;
- että ofloksasiini voi aiheuttaa neurologisia haittavaikutuksia (esim. huimausta, huimausta) ja että potilaiden tulee tietää, miten he reagoivat ofloksasiiniin ennen kuin he käyttävät autoa tai koneita tai ryhtyvät toimiin, jotka vaativat henkistä valppautta ja koordinaatiota (ks. VAROITUKSET ja HAITTAVAIKUTUKSET );
- että ofloksasiiniin saattaa liittyä yliherkkyysreaktioita, jopa ensimmäisen annoksen jälkeen, lääkkeen käyttö lopetetaan heti, kun ilmenee ihottuman, nokkosihottuman tai muiden ihoreaktioiden ensimmäisiä merkkejä, sydämen syke nopeaa, nielemis- tai hengitysvaikeuksia, angioedeemaan viittaavaa turvotusta (esim. , huulten, kielen, kasvojen turvotus, kurkun kireys, käheys) tai mikä tahansa muu allergisen reaktion oire (ks. VAROITUKSET ja HAITTAVAIKUTUKSET );
- että valoherkkyyttä/valotoksisuutta on raportoitu potilailla, jotka saavat kinoloniantibiootteja. Potilaiden tulee minimoida tai välttää altistumista luonnolliselle tai keinotekoiselle auringonvalolle (solariumit tai UVA/B-hoito) kinolonien käytön aikana. Jos potilaiden on oltava ulkona kinolonien käytön aikana, heidän tulee käyttää väljiä vaatteita, jotka suojaavat ihoa auringolta ja keskusteltava muista auringonsuojatoimenpiteistä lääkärin kanssa. Jos auringonpolttaman kaltainen reaktio tai ihottuma ilmenee, potilaiden tulee ottaa yhteyttä lääkäriin.
- että jos he ovat diabeetikoita ja heitä hoidetaan insuliinilla tai suun kautta otettavalla hypoglykeemisellä lääkkeellä, ofloksasiinin käyttö on lopetettava välittömästi, jos hypoglykeeminen reaktio ilmaantuu, ja käännyttävä lääkärin puoleen (ks. VAROTOIMENPITEET : Kenraali ja HUUMEIDEN VUOROVAIKUTUKSET );
- että kouristuksia on raportoitu potilailla, jotka käyttävät kinoloneja, mukaan lukien ofloksasiinia, ja ilmoittamaan lääkärilleen ennen tämän lääkkeen ottamista, jos sinulla on aiemmin ollut tämä sairaus;
- että ripuli on yleinen antibioottien aiheuttama ongelma, joka yleensä loppuu, kun antibiootin käyttö lopetetaan. Joskus antibioottihoidon aloittamisen jälkeen potilaille voi ilmaantua vetisiä ja verisiä ulosteita (vatsakouristuksella ja kuumeella tai ilman) jopa kahden tai useamman kuukauden kuluttua viimeisen antibioottiannoksen ottamisesta. Jos näin tapahtuu, potilaiden tulee ottaa yhteyttä lääkäriin mahdollisimman pian.
- ilmoittamaan lääkärilleen kaikista henkilökohtaisista tai suvussa esiintyneistä QTc-ajan pitenemisestä tai rytmihäiriötiloista, kuten hypokalemiasta, bradykardiasta tai äskettäisestä sydänlihasiskemiasta; jos he käyttävät luokan IA (kinidiini, prokaiiniamidi) tai luokan III (amiodaroni, sotaloli) rytmihäiriölääkkeitä. Potilaiden tulee ilmoittaa lääkärilleen, jos heillä on QTc-ajan pitenemisen oireita, mukaan lukien pitkittynyt sydämentykytys tai tajunnan menetys.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Pitkäaikaisia tutkimuksia ofloksasiinin karsinogeenisen potentiaalin määrittämiseksi ei ole tehty.
Ofloksasiini ei ollut mutageeninen Amesin bakteeritestissä, in vitro ja in vivo sytogeneettisessä määrityksessä, sisarkromatidivaihdossa (kiinalainen hamsteri ja ihmissolulinjat), suunnittelemattomassa DNA-korjauksessa (UDS), jossa käytettiin ihmisen fibroblasteja, dominanteissa letaaleissa määrityksissä tai hiiren mikrotumamäärityksessä. Ofloksasiini oli positiivinen UDS-testissä käyttäen rotan hepatosyyttejä ja hiiren lymfoomamääritystä.
Raskaus
Teratogeeniset vaikutukset - Raskausluokka C
Ofloksasiinilla ei ole osoitettu olevan teratogeenisia vaikutuksia suun kautta otetuilla annoksilla, jotka ovat jopa 810 mg/kg/vrk (11 kertaa suositeltu enimmäisannos ihmiselle laskettuna mg/m²:n perusteella tai 50 kertaa mg/kg perusteella) ja 160 mg/kg/vrk. vuorokaudessa (4 kertaa suositeltu enimmäisannos ihmiselle laskettuna mg/m²:n perusteella tai 10 kertaa mg/kg:n perusteella), kun sitä annetaan raskaana oleville rotille ja kaniineille. Rotilla tehdyissä lisätutkimuksissa suun kautta annetuilla annoksilla 360 mg/kg/vrk (5 kertaa ihmiselle suositeltu enimmäisannos mg/m²:n perusteella tai 23 kertaa mg/kg:n perusteella) ei havaittu haitallista vaikutusta myöhäiseen sikiön kehitykseen, synnytykseen, synnytykseen, imetys, vastasyntyneen elinkelpoisuus tai vastasyntyneen kasvu. Annokset, jotka vastaavat 50 ja 10 kertaa ihmiselle suositeltua enimmäisannosta ofloksasiinia (perustuen mg/kg), olivat sikiötoksisia (eli pienensi sikiön ruumiinpainoa ja lisääntyi sikiökuolleisuus) rotilla ja kaneilla. Pieniä luustomuutoksia raportoitiin rotilla, jotka saivat 810 mg/kg/vrk annoksia, mikä on yli 10 kertaa suurempi kuin suositeltu enimmäisannos ihmiselle laskettuna mg/m2.
Ei kuitenkaan ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla. Ofloksasiinia tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan riskin. (Katso VAROITUKSET .)
Imettävät äidit
Imettävillä naisilla kerta-annos 200 mg ofloksasiinia johti maidon ofloksasiinipitoisuuksiin, jotka olivat samanlaisia kuin plasmassa. Koska ofloksasiini voi aiheuttaa vakavia haittavaikutuksia imeväisille, on tehtävä päätös, lopetetaanko imetys vai lopetetaanko lääkehoito, ottaen huomioon lääkkeen merkitys äidille. (Katso VAROITUKSET ja HAITTAVAIKUTUKSET .)
Käyttö lapsille
Turvallisuutta ja tehoa lapsipotilailla ja alle 18-vuotiailla nuorilla ei ole varmistettu. Ofloksasiini aiheuttaa artropatiaa (niveltulehdusta) ja osteokondroosia useiden lajien nuorilla eläimillä. (Katso VAROITUKSET .)
Geriatrinen käyttö
Ikäpotilailla on lisääntynyt riski saada vakavia jännehäiriöitä, mukaan lukien jänteen repeämä, kun heitä hoidetaan fluorokinolonilla, kuten FLOXIN® (ofloksasiini). Tämä riski kasvaa entisestään potilailla, jotka saavat samanaikaista kortikosteroidihoitoa. Jännetulehdus tai jänteen repeämä voi koskea akilles-, käsi-, olka- tai muita jännekohtia, ja niitä voi esiintyä hoidon aikana tai sen jälkeen; Useita kuukausia fluorokinolonihoidon jälkeen esiintyviä tapauksia on raportoitu. Varovaisuutta tulee noudattaa määrättäessä FLOXIN® (ofloksasiini) iäkkäille potilaille, erityisesti niille, jotka käyttävät kortikosteroideja. Potilaille tulee kertoa tästä mahdollisesta sivuvaikutuksesta ja neuvoa lopettamaan FLOXIN® (ofloksasiini) ja ottamaan yhteyttä terveydenhuollon tarjoajaan, jos ilmenee jännetulehduksen tai jänteen repeämän oireita (ks. LAATIKKO VAROITUS , VAROITUKSET , ja HAITTAVAIKUTUKSET / Markkinoinnin jälkeiset haittatapahtumaraportit ).
Vaiheen 2/3 kliinisissä tutkimuksissa ofloksasiinilla 688 potilasta (14,2 %) oli ≥ 65-vuotiaita. Näistä 436 potilasta (9,0 %) oli 65–74-vuotiaita ja 252 (5,2 %) 75-vuotiaita tai vanhempia. Iäkkäiden aikuisten haittavaikutusten esiintymistiheydessä tai vaikeusasteessa ei ollut selvää eroa nuorempiin aikuisiin verrattuna. Ofloksasiinin farmakokineettiset ominaisuudet iäkkäillä henkilöillä ovat samanlaiset kuin nuoremmilla. Ikä ei näytä vaikuttavan lääkkeiden imeytymiseen. Annoksen muuttaminen on tarpeen iäkkäillä potilailla, joilla on munuaisten vajaatoiminta (kreatiniinin puhdistuma ≤ 50 ml/min), koska ofloksasiinin puhdistuma on alentunut. Vertailevissa tutkimuksissa useimpien lääkkeisiin liittyvien hermostotapahtumien esiintymistiheys ja vaikeusaste ≥ 65-vuotiailla potilailla olivat vertailukelpoisia ofloksasiinilla ja vertailulääkkeillä. Ainoat tunnistetut erot olivat unettomuuden (3,9 % vs 1,5 %) ja päänsäryn (4,7 % vs 1,8 %) raporttien lisääntyminen ofloksasiinin käytön yhteydessä. On tärkeää huomata, että nämä vanhusten turvallisuustiedot on otettu 44 vertailevasta tutkimuksesta, joissa 20 erilaisen kontrollin (muita antibiootteja tai lumelääkettä) haittavaikutuksia koskevat tiedot yhdistettiin vertailua varten ofloksasiiniin. Tällaisen vertailun kliininen merkitys ei ole selvä. (Katso KLIININEN FARMAKOLOGIA ja ANNOSTELU JA HALLINNOINTI .)
Iäkkäät potilaat voivat olla herkempiä lääkkeisiin liittyville vaikutuksille QT-väliin. Siksi on noudatettava varovaisuutta käytettäessä ofloksasiinia samanaikaisten lääkkeiden kanssa, jotka voivat johtaa QT-ajan pidentymiseen (esim. luokan IA tai luokan III rytmihäiriölääkkeet) tai potilailla, joilla on torsade de pointes -riskitekijöitä (esim. tunnettu QT-ajan piteneminen, korjaamaton hypokalemia). (Katso VAROTOIMENPITEET : Kenraali : Torsades de pointes )
YLIANNOSTUS
Tietoa ofloksasiinin yliannostuksesta on rajoitetusti. Yhdestä tahattomasta yliannostuksesta on raportoitu. Tässä tapauksessa aikuinen nainen sai 3 grammaa ofloksasiinia suonensisäisesti 45 minuutin aikana. Verinäyte, joka otettiin 15 minuuttia infuusion päättymisen jälkeen, paljasti ofloksasiinitason 39,3 μg/ml. 7 tunnissa taso oli laskenut arvoon 16,2 μg/ml ja 24 tunnissa 2,7 μg/ml:aan. Infuusion aikana potilaalle kehittyi uneliaisuutta, pahoinvointia, huimausta, kuumia ja kylmää aaltoja, subjektiivista kasvojen turvotusta ja tunnottomuutta, puheen epäselvyyttä ja lievää tai kohtalaista sekavuutta. Kaikki valitukset huimausta lukuun ottamatta hävisivät 1 tunnin kuluessa infuusion lopettamisesta. Huimaus, joka häiritsi eniten seistessä, hävisi noin 9 tunnissa. Laboratoriotestit eivät paljastaneet kliinisesti merkittäviä muutoksia rutiiniparametreissa tällä potilaalla.
Akuutin yliannostuksen sattuessa mahalaukku on tyhjennettävä. Potilasta on tarkkailtava ja asianmukaista nesteytystä on ylläpidettävä. Ofloksasiini ei poistu tehokkaasti hemodialyysillä tai peritoneaalidialyysillä.
VASTA-AIHEET
FLOXIN® (ofloksasiinitabletit) -tabletit ovat vasta-aiheisia henkilöille, joilla on aiemmin esiintynyt yliherkkyyttä, joka liittyy ofloksasiinin tai minkä tahansa kinoloniryhmän antimikrobisten aineiden käyttöön.
KLIININEN FARMAKOLOGIA
Oraalisen annon jälkeen ofloksasiinin biologinen hyötyosuus tablettimuodossa on noin 98 %. Seerumin huippupitoisuudet saavutetaan 1-2 tuntia suun kautta otetun annoksen jälkeen. Ofloksasiinin imeytyminen kerta- tai useiden 200–400 mg:n annosten jälkeen on ennakoitavissa, ja imeytyneen lääkkeen määrä kasvaa suhteessa annokseen. Ofloksasiinilla on kaksivaiheinen eliminaatio. Toistuvien oraalisten annosten jälkeen vakaassa tilassa puoliintumisajat ovat noin 4-5 tuntia ja 20-25 tuntia. Pidempi puoliintumisaika on kuitenkin alle 5 % kokonais-AUC:sta. Vakaan tilan kumuloituminen voidaan arvioida käyttämällä 9 tunnin puoliintumisaikaa. Kokonaispuhdistuma ja jakautumistilavuus ovat suunnilleen samanlaiset kerta- tai useiden annosten jälkeen. Eliminaatio tapahtuu pääasiassa munuaisten kautta. Seuraavat ovat keskimääräiset huippupitoisuudet seerumissa terveillä 70-80 kg painoisilla vapaaehtoisilla miehillä 200, 300 tai 400 mg:n ofloksasiinin kerta-annosten tai toistuvien 400 mg:n suun kautta otettavien annosten jälkeen.
Vakaan tilan pitoisuudet saavutettiin neljän oraalisen annoksen jälkeen, ja käyrän alla oleva pinta-ala (AUC) oli noin 40 % suurempi kuin AUC yksittäisten annosten jälkeen. Siksi 200 mg:n ja 300 mg:n toistuvan annoksen jälkeen seerumin huippupitoisuudeksi ennustetaan 2,2 µg/ml ja 3,6 µg/ml vakaassa tilassa.
In vitro noin 32 % plasmassa olevasta lääkkeestä sitoutuu proteiineihin.
Ofloksasiini-injektion kerta-annos- ja vakaan tilan plasmaprofiilit olivat altistuksen laajuudeltaan (AUC) verrattavissa ofloksasiinitablettien vastaaviin, kun ofloksasiinin injektio- ja tablettiformulaatiot annettiin samansuuruisina annoksina (mg/mg) samalle ryhmälle. . Keskimääräinen vakaan tilan AUC(0-12), joka saavutettiin 400 mg:n laskimonsisäisen annon jälkeen 60 minuutin aikana, oli 43,5 µg•h/ml; keskimääräinen vakaan tilan AUC(0-12), joka saavutettiin suun kautta annetun 400 mg:n antamisen jälkeen, oli 41,2 μg•h/ml (kaksipuolinen t-testi, 90 %:n luottamusväli oli 103-109). (Katso seuraava kaavio .)
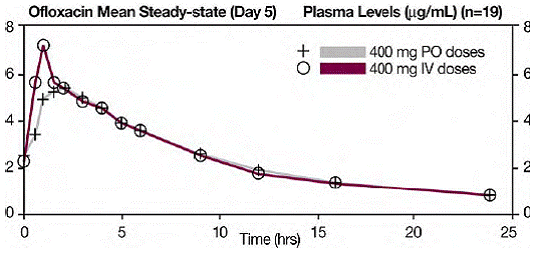
0–6 tuntia sen jälkeen, kun 12 terveelle vapaaehtoiselle annettiin kerta-annos 200 mg ofloksasiinia suun kautta, virtsan ofloksasiinin keskimääräinen pitoisuus oli noin 220 µg/ml. 12–24 tuntia annon jälkeen virtsan ofloksasiinin keskimääräinen taso oli noin 34 µg/ml.
Suositeltujen terapeuttisten annosten oraalisen annon jälkeen ofloksasiinia on havaittu rakkuloissa, kohdunkaulassa, keuhkokudoksessa, munasarjoissa, eturauhasnesteessä, eturauhaskudoksessa, ihossa ja ysköksessä. Ofloksasiinin keskimääräinen pitoisuus kussakin näistä eri kehon nesteistä ja kudoksista yhden tai useamman annoksen jälkeen oli 0,8-1,5 kertaa samanaikainen plasmataso. Tällä hetkellä ei ole saatavilla riittävästi tietoa ofloksasiinin jakautumisesta tai tasoista aivo-selkäydinnesteessä tai aivokudoksessa.
Ofloksasiinissa on pyridobentsoksatsiinirengas, joka näyttää vähentävän kantayhdisteen aineenvaihduntaa. 65–80 % suun kautta otetusta ofloksasiiniannoksesta erittyy muuttumattomana munuaisten kautta 48 tunnin kuluessa annoksesta. Tutkimukset osoittavat, että alle 5 % annetusta annoksesta erittyy virtsaan desmetyyli- tai N-oksidimetaboliitteina. Neljästä kahdeksaan prosenttia ofloksasiiniannoksesta erittyy ulosteisiin. Tämä osoittaa ofloksasiinin vähäistä erittymistä sappeen.
FLOXIN® (ofloksasiini) anto ruoan kanssa ei vaikuta lääkkeen Cmax- ja AUC∞-arvoihin, mutta Tmax pitenee.
Ofloksasiinin puhdistuma on heikentynyt potilailla, joilla on heikentynyt munuaisten toiminta (kreatiniinin puhdistuma ≤ 50 ml/min), ja annoksen muuttaminen on tarpeen. (Katso VAROTOIMENPITEET : Kenraali ja ANNOSTELU JA HALLINNOINTI .)
Terveille iäkkäille koehenkilöille (65-81-vuotiaille) suun kautta annetun annon jälkeen plasman huippupitoisuudet saavutetaan yleensä 1-2 tunnin kuluttua kerta-annosten ja toistuvien kahdesti vuorokaudessa otettavien annosten jälkeen, mikä osoittaa, että ikä tai sukupuoli ei vaikuta oraalisen imeytymisen nopeuteen. Keskimääräiset huippupitoisuudet plasmassa iäkkäillä koehenkilöillä olivat 9-21 % korkeammat kuin nuoremmilla koehenkilöillä. Iäkkäiden henkilöiden farmakokineettisissä ominaisuuksissa on havaittu sukupuolten välisiä eroja. Huippupitoisuudet plasmassa olivat 114 % ja 54 % korkeammat iäkkäillä naisilla kuin iäkkäillä miehillä kerta-annosten ja toistuvien kahdesti vuorokaudessa annettujen annosten jälkeen. [Tämä tulkinta perustui kahdesta erillisestä tutkimuksesta kerättyihin tutkimustuloksiin.] Plasman pitoisuudet suurenevat annosriippuvaisesti annosten noustessa kerta-annoksen jälkeen ja vakaassa tilassa. Jakautumisarvoissa ei havaittu eroja iäkkäiden ja nuorempien koehenkilöiden välillä. Kuten nuoremmilla henkilöillä, eliminaatio tapahtuu pääasiassa munuaisten kautta muuttumattomana lääkkeenä vanhuksilla, vaikka vähemmän lääkettä erittyy munuaisten kautta iäkkäillä henkilöillä. Nuorempien koehenkilöiden tavoin alle 5 % annetusta annoksesta erittyi virtsaan desmetyyli- ja N-oksidimetaboliitteina vanhuksilla. Pidempi puoliintumisaika plasmassa, noin 6,4-7,4 tuntia, havaittiin iäkkäillä koehenkilöillä verrattuna 4-5 tuntiin nuorilla koehenkilöillä. Ofloksasiinin eliminaatio on hitaampaa iäkkäillä koehenkilöillä verrattuna nuorempiin, mikä saattaa johtua heikentyneestä munuaistoiminnasta ja munuaispuhdistumasta, joka on havaittu vanhuksilla. Koska ofloksasiinin tiedetään erittyvän olennaisesti munuaisten kautta ja iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, annostusta on muutettava iäkkäille potilaille, joilla on munuaisten vajaatoiminta, kuten kaikille potilaille suositellaan. (Katso VAROTOIMENPITEET : Kenraali ja ANNOSTELU JA HALLINNOINTI .)
Mikrobiologia
Ofloksasiini on kinolonien antimikrobinen aine. Ofloksasiinin ja muiden fluorokinolonien mikrobilääkkeiden vaikutusmekanismiin kuuluu bakteerien topoisomeraasi IV:n ja DNA-gyraasin (molemmat ovat tyypin II topoisomeraaseja), DNA:n replikaatioon, transkriptioon, korjaamiseen ja rekombinaatioon tarvittavien entsyymien esto.
Ofloksasiinilla on in vitro aktiivisuutta monenlaisia gramnegatiivisia ja grampositiivisia mikro-organismeja vastaan. Ofloksasiini on usein bakterisidinen pitoisuuksina, jotka ovat yhtä suuria tai hieman suurempia kuin estävät pitoisuudet.
Fluorokinolonit, mukaan lukien ofloksasiini, eroavat kemialliselta rakenteeltaan ja vaikutukseltaan aminoglykosideista, makrolideista ja β-laktaamiantibiooteista, mukaan lukien penisilliineistä. Fluorokinolonit voivat siksi olla aktiivisia näille mikrobilääkkeille resistenttejä bakteereja vastaan.
Resistenssi ofloksasiinille, joka johtuu spontaanista mutaatiosta in vitro, on harvinainen (vaihteluväli: 10-9-10-11). Vaikka ofloksasiinin ja joidenkin muiden fluorokinolonien välillä on havaittu ristiresistenssiä, jotkut mikro-organismit, jotka ovat resistenttejä muille fluorokinoloneille, voivat olla herkkiä ofloksasiinille.
Ofloksasiinin on osoitettu olevan aktiivinen useimpia seuraavien mikro-organismien kantoja vastaan sekä in vitro että kliinisissä infektioissa, kuten KÄYTTÖAIHEET JA KÄYTTÖ Osio:
Aerobiset grampositiiviset mikro-organismit
Staphylococcus aureus (metisilliinille herkät kannat) Streptococcus pneumoniae (penisilliinille herkät kannat) Streptococcus pyogenes
Aerobiset gramnegatiiviset mikro-organismit
Citrobacter (diversus) koseri Enterobacter aerogenes Escherichia coli Haemophilus influenzae Klebsiella pneumoniae Neisseria gonorrhoeae Proteus mirabilis Pseudomonas aeruginosa
Kuten muutkin tämän luokan lääkkeet, jotkut Pseudomonas aeruginosa -kannat voivat kehittää resistenssiä melko nopeasti ofloksasiinihoidon aikana.
Muut mikro-organismit
Chlamydia trachomatis
Seuraavat in vitro -tiedot ovat saatavilla, mutta niiden kliinistä merkitystä ei tunneta.
Ofloksasiinin in vitro inhiboivat vähimmäispitoisuudet (MIC-arvot) ovat 2 μg/ml tai vähemmän useimpia (≥ 90 %) seuraavien mikro-organismien kantoja vastaan; Ofloksasiinin turvallisuutta ja tehokkuutta näiden mikro-organismien aiheuttamien kliinisten infektioiden hoidossa ei kuitenkaan ole osoitettu riittävissä ja hyvin kontrolloiduissa tutkimuksissa.
Aerobiset grampositiiviset mikro-organismit
Staphylococcus epidermidis (metisilliinille herkät kannat) Staphylococcus saprophyticus Streptococcus pneumoniae (penisilliiniresistentit kannat)
Aerobiset gramnegatiiviset mikro-organismit
Acinetobacter calcoaceticus Bordetella pertussis Citrobacter freundii Enterobacter cloacae Haemophilus ducreyi Klebsiella oxytoca Moraxella catarrhalis Morganella morganii Proteus vulgaris Providencia rettgeri Providencia stuarticens Serratia
Anaerobiset mikro-organismit
Clostridium perfringes
Muut mikro-organismit
Chlamydia pneumoniae Gardnerella vaginalis Legionella pneumophila Mycoplasma hominis Mycoplasma pneumoniae Ureaplasma urealyticum
Ofloksasiini ei tehoa Treponema pallidumia vastaan (katso VAROITUKSET .)
Monet muiden streptokokkilajien, Enterococcus-lajien ja anaerobien kannat ovat resistenttejä ofloksasiinille.
Herkkyystestit
Laimennustekniikat
Kvantitatiivisia menetelmiä käytetään antimikrobisten vähimmäisinhibitoristen pitoisuuksien (MIC-arvojen) määrittämiseen. Nämä MIC-arvot antavat arvioita bakteerien herkkyydestä antimikrobisille yhdisteille. MIC-arvot tulee määrittää standardoitua menettelyä käyttäen. Standardoidut menetelmät perustuvat laimennusmenetelmään1 (liemi tai agar) tai vastaavaan standardisoiduilla siirrostepitoisuuksilla ja standardoiduilla ofloksasiinijauheen pitoisuuksilla. MIC-arvot tulee tulkita seuraavien kriteerien mukaisesti:
Enterobacteriaceaen, metisilliinille herkän Staphylococcus aureuksen ja Pseudomonas aeruginosan testaamiseen:
Haemophilus influenzae -testausta varten:a
a Tätä tulkintastandardia voidaan soveltaa vain liemen mikrolaimennusherkkyystesteihin Haemophilus influenzaella käyttäen Haemophilus Test Mediumia1
Resistenttejä kantoja koskevien tietojen tämänhetkinen puuttuminen estää muiden kuin "herkkien" tulosten määrittelemisen. Kannat, jotka antavat MIC-tuloksia, jotka viittaavat luokkaan "ei-herkkä", tulee toimittaa vertailulaboratorioon lisätestausta varten.
Neisseria gonorrhoeae:n testaamiseen:b
b Näitä tulkinnallisia standardeja voidaan soveltaa vain agarlaimennustesteihin, joissa käytetään GC-agar-pohjaa ja 1 % määriteltyä kasvulisää, jota on inkuboitu 5 % CO2:ssa.
Streptococcus pneumoniaen ja Streptococcus pyogenesin testaamiseen:c
c Nämä tulkinnalliset standardit ovat sovellettavissa vain liemen mikrolaimennusherkkyystesteihin, joissa käytetään kationisäädettyä Mueller-Hinton-lientä, jossa on 2-5 % hajotettua hevosen verta.
"Herkkä"-raportti osoittaa, että patogeeni todennäköisesti estyy, jos antimikrobinen yhdiste veressä saavuttaa tavallisesti saavutettavissa olevan pitoisuuden. "Keskitaso"-raportti osoittaa, että tulosta on pidettävä epäselvänä, ja jos mikro-organismi ei ole täysin herkkä vaihtoehtoisille, kliinisesti toteuttamiskelpoisille lääkkeille, testi on toistettava. Tämä kategoria tarkoittaa mahdollista kliinistä soveltuvuutta kehon kohteisiin, joissa lääke on fysiologisesti keskittynyt tai tilanteissa, joissa voidaan käyttää suuria lääkeannoksia. Tämä kategoria tarjoaa myös puskurivyöhykkeen, joka estää pieniä hallitsemattomia teknisiä tekijöitä aiheuttamasta suuria tulkintaeroja. "Resistant"-raportti osoittaa, että patogeeni ei todennäköisesti estä, jos antimikrobinen yhdiste veressä saavuttaa tavallisesti saavutettavissa olevan pitoisuuden; tulee valita muu hoitomuoto.
Standardoidut herkkyystestimenetelmät edellyttävät laboratoriokontrollimikro-organismien käyttöä laboratoriomenetelmien teknisten näkökohtien hallitsemiseksi. Standardin ofloksasiinijauheen tulee antaa seuraavat MIC-arvot:
Diffuusiotekniikat
Kvantitatiiviset menetelmät, jotka edellyttävät vyöhykkeiden halkaisijoiden mittaamista, tarjoavat myös toistettavia arvioita bakteerien herkkyydestä antimikrobisille yhdisteille. Yksi tällainen standardoitu menettely2 edellyttää standardoitujen ymppipitoisuuksien käyttöä. Tässä menetelmässä käytetään 5 μg ofloksasiinilla kyllästettyjä paperikiekkoja mikro-organismien herkkyyden ofloksasiinille testaamiseen.
Laboratorion raportit, jotka sisältävät 5 μg:n ofloksasiinilevyllä tehdyn standardin yhden levyn herkkyystestin tulokset, tulee tulkita seuraavien kriteerien mukaisesti:
Enterobacteriaceaen, metisilliinille herkän Staphylococcus aureuksen ja Pseudomonas aeruginosan testaamiseen:
Haemophilus influenzae -testaukseen: g
Tätä vyöhykkeen halkaisijastandardia voidaan soveltaa vain levydiffuusiotesteihin Haemophilus influenzaella käyttämällä Haemophilus Test Medium (HTM)2:ta, jota on inkuboitu 5 % CO2:ssa.
Resistenttejä kantoja koskevien tietojen tämänhetkinen puuttuminen estää muiden kuin "herkkien" tulosten määrittelemisen. Kannat, jotka antavat vyöhykkeen läpimittatuloksia, jotka viittaavat luokkaan "ei-herkkyys", on toimitettava vertailulaboratorioon lisätestausta varten.
Neisseria gonorrhoeae:h testausta varten
h Nämä vyöhykkeen halkaisijastandardit ovat sovellettavissa vain kiekon diffuusiotesteihin, joissa käytetään GC-agarpohjaa ja 1 % määriteltyä kasvulisää, jota inkuboidaan 5 % CO2:ssa.
Streptococcus pneumoniaen ja Streptococcus pyogenesin testaamiseen:i
i Nämä vyöhykkeen halkaisijastandardit koskevat vain levydiffuusiotestejä, jotka on suoritettu käyttämällä Mueller-Hinton-agaria, jota on täydennetty 5 % defibrinoidulla lampaanverellä ja inkuboitu 5 % CO2:ssa.
Tulkinnan tulee olla edellä kuvattu laimennustekniikoita käytettäessä. Tulkintaan kuuluu kiekkotestissä saadun halkaisijan korrelaatio ofloksasiinin MIC-arvon kanssa.
Kuten standardoidut laimennustekniikat, diffuusiomenetelmät edellyttävät laboratoriokontrollimikro-organismien käyttöä, joita käytetään laboratoriomenetelmien teknisten näkökohtien hallintaan. Diffuusiotekniikkaa varten 5 μg ofloksasiinikiekon tulisi tarjota seuraavat vyöhykkeiden halkaisijat näissä laboratorion laadunvalvontakannoissa:
Eläinfarmakologia
Ofloksasiinin ja muiden kinolonien luokan lääkkeiden on osoitettu aiheuttavan nivelsairauksia (niveltulehdusta) epäkypsillä koirilla ja rotilla. Lisäksi nämä lääkkeet liittyvät osteokondroosin lisääntyneeseen ilmaantumiseen rotilla verrattuna esiintyvyyteen, joka havaittiin vehikkelillä hoidetuilla rotilla. (Katso VAROITUKSET .) Täysin kypsillä koirilla ei ole näyttöä nivelsairauksista, kun annettiin suonensisäisiä annoksia, jotka ovat enintään 3 kertaa ihmiselle suositeltua enimmäisannoksia (mg/m² perusteella tai 5 kertaa mg/kg perusteella) yhden viikon altistusjakson aikana.
Muiden kinolonien pitkäaikainen, suuriannoksinen systeeminen käyttö koe-eläimillä on aiheuttanut linssimäisiä sameuksia; tätä havaintoa ei kuitenkaan havaittu missään eläinkokeissa ofloksasiinilla.
Muilla kinoloneilla hoidetuilla eläimillä havaittiin alentuneita seerumiglobuliini- ja proteiinitasoja. Yhdessä ofloksasiinitutkimuksessa havaittiin lievää seerumin globuliini- ja proteiinipitoisuuden laskua naaraspuolisilla cynomolgus-apinoilla, joille annettiin oraalisesti 40 mg/kg ofloksasiinia päivittäin vuoden ajan. Näiden muutosten katsottiin kuitenkin olevan apinoiden normaaleissa rajoissa.
Kristalluriaa ja silmätoksisuutta ei havaittu missään ofloksasiinilla hoidetuissa eläimissä.
VIITTEET
1. Kansallinen kliinisten laboratoriostandardien komitea. Aerobisesti kasvavien bakteerien antimikrobisen herkkyystestien laimennusmenetelmät - 4. painos. Hyväksytty standardi NCCLS-asiakirja M7-A4, osa. 17, nro 2, NCCLS, Wayne, PA, tammikuu 1997.
2. Kansallinen kliinisten laboratoriostandardien komitea. Antimikrobisten levyjen herkkyystestien suorituskykystandardit - Kuudes painos. Hyväksytty standardi NCCLS-asiakirja M2-A6, osa. 17, nro 1, NCCLS, Wayne, PA, tammikuu 1997.
POTILASTIEDOT
LÄÄKKEEN OPAS
FLOXIN® [Flox in] (ofloksasiini)
Lue FLOXIN® (ofloksasiini) mukana tuleva lääkitysopas ennen kuin aloitat sen käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Tämä lääkitysopas ei korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi.
Mikä on tärkein tieto, joka minun pitäisi tietää FLOXIN®:ista (ofloksasiinista)?
FLOXIN® (ofloksasiini) kuuluu fluorokinoloneiksi kutsuttujen antibioottien luokkaan. FLOXIN® (ofloksasiini) voi aiheuttaa sivuvaikutuksia, jotka voivat olla vakavia tai jopa johtaa kuolemaan. Jos saat jonkin seuraavista vakavista sivuvaikutuksista, hakeudu välittömästi lääkärin hoitoon. Keskustele terveydenhuollon tarjoajan kanssa siitä, pitäisikö sinun jatkaa FLOXIN® (ofloksasiini) käyttöä.
- Jännerepeämä tai jänteen turvotus (jännetulehdus)
- Jänteet ovat kovia kudosnaruja, jotka yhdistävät lihakset luihin.
- Kipua, turvotusta, repeämiä ja jänteiden tulehdusta, mukaan lukien nilkan takaosa (Achilles), olkapää, käsi tai muut jännekohdat, voi esiintyä kaikenikäisille ihmisille, jotka käyttävät fluorokinoloniantibiootteja, mukaan lukien FLOXIN® (ofloksasiini). Jänneongelmien riski on suurempi, jos:
- ovat yli 60-vuotiaita tai
- käytät steroideja (kortikosteroideja) tai
- sinulle on tehty munuaisen, sydämen tai keuhkonsiirto.
- Fluorokinoloneja käyttävillä potilailla, joilla ei ole yllä mainittuja riskitekijöitä, on esiintynyt myös jänteen turvotusta (jännetulehdus) ja jänteen repeämää (murtumaa).
- Muita syitä jänteen repeämiin voivat olla:
- fyysistä toimintaa tai harjoittelua
- munuaisten vajaatoiminta
- jänneongelmat menneisyydessä, kuten ihmisillä, joilla on nivelreuma (RA).
- Soita terveydenhuollon tarjoajallesi heti, kun havaitset ensimmäiset merkit jännekivusta, turvotuksesta tai tulehduksesta. Lopeta FLOXIN® (ofloksasiini) käyttö, kunnes terveydenhuollon tarjoaja on sulkenut pois jännetulehduksen tai jännerepeämän. Vältä liikuntaa ja vaurioituneen alueen käyttöä. Yleisin kipu- ja turvotusalue on akillesjänne nilkan takana. Tämä voi tapahtua myös muiden jänteiden kanssa. Keskustele terveydenhuollon tarjoajan kanssa jänteen repeämisen riskistä, kun FLOXIN® (ofloksasiini) käytetään jatkuvasti. Saatat tarvita eri antibioottia, joka ei ole fluorokinoloni infektiosi hoitoon.
- Jännerepeämä voi tapahtua FLOXIN®-hoidon (ofloksasiini) käytön aikana tai sen jälkeen. Jänteiden repeämiä on tapahtunut jopa useita kuukausia sen jälkeen, kun potilaat ovat lopettaneet fluorokinolonin käytön.
- Hakeudu välittömästi lääkärin hoitoon, jos saat jonkin seuraavista jännerepeämän merkeistä tai oireista:
- kuulet tai tunnet napsahduksen tai poksahduksen jänteen alueella
- mustelmat heti vamman jälkeen jännealueella
- ei pysty liikuttamaan vahingoittunutta aluetta tai kestämään painoa
- Myasthenia graviksen (sairaus, joka aiheuttaa lihasheikkoutta) paheneminen. Fluorokinolonit, kuten FLOXIN® (ofloksasiini), voivat pahentaa myasthenia gravis -oireita, mukaan lukien lihasheikkous ja hengitysvaikeudet. Soita välittömästi terveydenhuollon tarjoajallesi, jos sinulla on paheneva lihasheikkous tai hengitysongelmia.
Katso kohta " Mitkä ovat FLOXIN® (ofloksasiini) mahdolliset sivuvaikutukset? " saadaksesi lisätietoja sivuvaikutuksista.
Mikä on FLOXIN® (ofloksasiini)?
FLOXIN® (ofloksasiini) on fluorokinolonilääke, jota käytetään aikuisilla tiettyjen bakteerien aiheuttamien infektioiden hoitoon. Ei tiedetä, onko FLOXIN® (ofloksasiini) turvallinen ja toimiiko alle 18-vuotiailla. Alle 18-vuotiailla lapsilla on suurempi mahdollisuus saada luu-, nivel- tai jänne-ongelmia, kuten kipua tai turvotusta FLOXIN® (ofloksasiini) käytön aikana.
Joskus infektiot johtuvat viruksista eikä bakteereista. Esimerkkejä ovat virusinfektiot poskionteloissa ja keuhkoissa, kuten flunssa tai flunssa. Antibiootit, mukaan lukien FLOXIN® (ofloksasiini), eivät tapa viruksia.
Soita terveydenhuollon tarjoajallesi, jos epäilet, että tilasi ei parane FLOXIN®-hoidon (ofloksasiini) käytön aikana.
Kuka ei saa ottaa FLOXIN® (ofloksasiini)?
Älä ota FLOXIN®-valmistetta (ofloksasiinia), jos sinulla on koskaan ollut vakava allerginen reaktio fluorokinoloniksi tunnetulle antibiootille tai jos olet allerginen jollekin FLOXIN®-valmisteen (ofloksasiini) aineosalle. Kysy terveydenhuollon tarjoajaltasi, jos et ole varma. Katso FLOXIN® (ofloksasiini) ainesosien luettelo tämän lääkitysoppaan lopusta.
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen FLOXIN®:in (ofloksasiini) ottamista?
Katso " Mikä on tärkein tieto, joka minun pitäisi tietää FLOXIN®:ista (ofloksasiinista)? ”
Kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, mukaan lukien jos:
- on jänne-ongelmia
- sinulla on sairaus, joka aiheuttaa lihasheikkoutta (myasthenia gravis)
- sinulla on keskushermostoongelmia (kuten epilepsia)
- on hermoongelmia
- sinulla tai jollain perheenjäsenelläsi on epäsäännöllinen sydämenlyönti, erityisesti tila nimeltä "QT-ajan piteneminen".
- sinulla on alhainen veren kaliumpitoisuus (hypokalemia)
- sinulla on ollut kohtauksia
- on munuaisongelmia. Saatat tarvita pienemmän FLOXIN®-annoksen (ofloksasiini), jos munuaisesi ei toimi hyvin.
- sinulla on maksaongelmia
- sinulla on nivelreuma (RA) tai muita nivelongelmia
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, vahingoittaako FLOXIN® (ofloksasiini) sikiötäsi
- imetät tai suunnittelet imetystä. FLOXIN® (ofloksasiini) erittyy äidinmaitoon. Sinun ja terveydenhuollon tarjoajasi tulee päättää, otatko FLOXIN® (ofloksasiini) vai imetätkö.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja reseptilääkkeet, vitamiinit, yrtti- ja ravintolisät. FLOXIN® (ofloksasiini) ja muut lääkkeet voivat vaikuttaa toisiinsa aiheuttaen sivuvaikutuksia. Kerro erityisesti terveydenhuollon tarjoajallesi, jos otat:
- NSAID (ei-steroidinen anti-inflammatorinen lääke). Monet yleiset kivunlievityslääkkeet ovat tulehduskipulääkkeitä. Tulehduskipulääkkeen ottaminen FLOXIN® (ofloksasiini) tai muiden fluorokinolonien käytön aikana voi lisätä keskushermostovaikutusten ja kohtausten riskiä. Katso " Mitkä ovat FLOXIN® (ofloksasiini) mahdolliset sivuvaikutukset? ”
- teofylliini
- verenohennuslääke (varfariini, Coumadin, Jantoven)
- suun kautta otettava diabeteslääke tai insuliini
- lääke, joka säätelee sykettäsi tai rytmiäsi (rytmihäiriölääkkeet). Katso " Mitkä ovat FLOXIN® (ofloksasiini) mahdolliset sivuvaikutukset ”.
- antipsykoottinen lääke
- trisyklinen masennuslääke
- vesipilleri (diureetti)
- steroidilääke. Suun kautta tai injektiona otetut kortikosteroidit voivat lisätä jännevaurioiden mahdollisuutta. Katso " Mikä on tärkein tieto, joka minun pitäisi tietää FLOXIN®:ista (ofloksasiinista)? ”.
- Tietyt lääkkeet voivat estää FLOXIN® (ofloksasiini) toimimasta oikein. Ota FLOXIN® (ofloksasiini) joko 2 tuntia ennen näiden tuotteiden ottamista tai 2 tuntia sen jälkeen:
- antasidi, monivitamiinit tai muu tuote, joka sisältää kalsiumia, magnesiumia, alumiinia, rautaa tai sinkkiä.
- sulkrafaatti (karafaatti)
- didanosiini (Videx®, Videx® EC)
Kysy terveydenhuollon tarjoajaltasi, jos et ole varma, onko jokin lääkkeistäsi lueteltu yllä.
Tunne käyttämäsi lääkkeet. Pidä luetteloa lääkkeistäsi ja näytä se terveydenhuollon tarjoajalle ja apteekkihenkilökunnalle, kun hankit uuden lääkkeen.
Kuinka minun pitäisi ottaa FLOXIN® (ofloksasiini)?
- Ota FLOXIN® (ofloksasiini) juuri sen verran kuin terveydenhuollon tarjoaja on määrännyt.
- Ota FLOXIN® (ofloksasiini) suunnilleen samaan aikaan joka päivä.
- Juo runsaasti nesteitä FLOXIN® (ofloksasiini) käytön aikana.
- FLOXIN® (ofloksasiini) voidaan ottaa ruoan kanssa tai ilman.
- Älä jätä väliin yhtään annosta tai lopeta FLOXIN® (ofloksasiini) käyttöä, vaikka alkaisit tuntea olosi paremmaksi, ennen kuin olet lopettanut määrätyn hoidon, ellei:
- sinulla on jännevaikutuksia (ks. Mikä on tärkein tieto, joka minun pitäisi tietää FLOXIN®:ista (ofloksasiinista)? ”),
- sinulla on vakava allerginen reaktio (ks. Mitkä ovat FLOXIN® (ofloksasiini) mahdolliset sivuvaikutukset? ”) tai
- terveydenhuollon tarjoajasi kehottaa sinua lopettamaan.
- Tämä auttaa varmistamaan, että kaikki bakteerit kuolevat, ja vähentää todennäköisyyttä, että bakteerit tulevat vastustuskykyisiksi FLOXIN®:lle (ofloksasiini). Jos näin tapahtuu, FLOXIN® (ofloksasiini) ja muut antibioottilääkkeet eivät ehkä toimi tulevaisuudessa.
- Jos unohdat ottaa FLOXIN®-annoksen (ofloksasiini), ota se heti kun muistat. Älä ota kahta annosta FLOXIN® (ofloksasiini) samanaikaisesti. Älä ota enempää kuin kaksi annosta yhden päivän aikana.
- Jos otat liikaa, ota välittömästi yhteyttä terveydenhuollon tarjoajaan tai hakeudu lääkärin hoitoon.
Mitä minun pitäisi välttää FLOXIN® (ofloksasiini) käytön aikana?
- FLOXIN® (ofloksasiini) voi saada sinut tuntemaan huimausta ja pyörrytystä. Älä aja, käytä koneita tai tee muita toimintoja, jotka vaativat henkistä valppautta tai koordinaatiota, ennen kuin tiedät, kuinka FLOXIN® (ofloksasiini) vaikuttaa sinuun.
- Vältä aurinkolamppuja, solariumeja ja yritä rajoittaa aikaasi auringossa. FLOXIN® (ofloksasiini) voi tehdä ihosi herkäksi auringolle (valoherkkyys) ja aurinkolamppujen ja solariumien valolle. Saatat saada vakavan auringonpolttaman, rakkuloita tai ihon turvotusta. Jos saat jonkin näistä oireista FLOXIN® (ofloksasiini) käytön aikana, soita heti terveydenhuollon tarjoajallesi. Sinun tulee käyttää aurinkovoidetta ja käyttää hattua ja ihoa peittäviä vaatteita, jos joudut olemaan auringonpaisteessa.
Mitkä ovat FLOXIN® (ofloksasiini) mahdolliset sivuvaikutukset?
FLOXIN® (ofloksasiini) voi aiheuttaa sivuvaikutuksia, jotka voivat olla vakavia tai jopa johtaa kuolemaan. Katso " Mikä on tärkein tieto, joka minun pitäisi tietää FLOXIN®:ista (ofloksasiinista)? ”
Muita FLOXIN® (ofloksasiini) vakavia sivuvaikutuksia ovat:
- Vaikutukset keskushermostoon: Kouristuskohtauksia on raportoitu ihmisillä, jotka käyttävät fluorokinoloniantibiootteja, mukaan lukien FLOXIN® (ofloksasiini). Kerro terveydenhuollon tarjoajallesi, jos sinulla on ollut kouristuskohtauksia. Kysy terveydenhuollon tarjoajalta, muuttaako FLOXIN® (ofloksasiini) ottaminen riskiäsi saada kohtaus. Keskushermoston (CNS) sivuvaikutuksia voi ilmetä heti ensimmäisen FLOXIN®-annoksen (ofloksasiini) ottamisen jälkeen. Keskustele välittömästi terveydenhuollon tarjoajan kanssa, jos saat jonkin näistä sivuvaikutuksista tai muita mielialan tai käyttäytymisen muutoksia:
- tuntuu pyörrykseltä
- kohtauksia
- kuulla ääniä, nähdä asioita tai aistia asioita, joita ei ole olemassa (hallusinaatiot)
- tuntea olonsa levottomaksi
- vapinaa
- tuntea olonsa ahdistuneeksi tai hermostuneeksi
- hämmennystä
- masennus
- nukahtamisvaikeuksia
- painajaisia
- tuntea olonsa epäluuloisemmaksi (paranoia)
- itsetuhoisia ajatuksia tai tekoja
- Vakavat allergiset reaktiot: Allergisia reaktioita voi esiintyä ihmisillä, jotka käyttävät fluorokinoloneja, mukaan lukien FLOXIN® (ofloksasiini), jopa yhden annoksen jälkeen. Lopeta FLOXIN® (ofloksasiini) käyttö ja hakeudu välittömästi lääkärin hoitoon, jos saat jonkin seuraavista vakavan allergisen reaktion oireista:
- nokkosihottuma
- hengitys- tai nielemisvaikeudet
- huulten, kielen, kasvojen turvotus
- kurkun kireys, käheys
- nopea sydämen syke
- heikko
- ihon tai silmien keltaisuus. Lopeta FLOXIN® (ofloksasiini) käyttö ja kerro heti terveydenhuollon tarjoajallesi, jos ihosi tai silmäsi valkoinen osa kellastuu tai jos sinulla on tumma virtsa. Nämä voivat olla merkkejä vakavasta FLOXIN®-reaktiosta (ofloksasiini) (maksaongelma).
- Ihottuma: Ihottumaa voi esiintyä ihmisillä, jotka käyttävät FLOXIN®-valmistetta (ofloksasiinia), jopa yhden annoksen jälkeen. Lopeta FLOXIN® (ofloksasiini) käyttö ensimmäisten ihottuman merkkien yhteydessä ja soita terveydenhuollon tarjoajallesi. Ihottuma voi olla merkki vakavammasta FLOXIN®-reaktiosta (ofloksasiini).
- Suolistotulehdus (pseudomembranoottinen koliitti): Pseudomembranoottinen koliitti voi tapahtua useimpien antibioottien kanssa, mukaan lukien FLOXIN® (ofloksasiini). Soita välittömästi terveydenhuollon tarjoajallesi, jos saat vetistä ripulia, ripulia, joka ei mene ohi, tai verisiä ulosteita. Sinulla voi myös olla vatsakramppeja ja kuumetta. Pseudomembranoottinen paksusuolitulehdus voi ilmaantua vähintään 2 kuukautta antibioottihoidon lopettamisen jälkeen.
- Tuntemuutokset ja mahdollinen hermovaurio (perifeerinen neuropatia): Käsivarsien, käsien, jalkojen tai jalkojen hermovaurioita voi tapahtua ihmisillä, jotka käyttävät fluorokinoloneja, mukaan lukien FLOXIN® (ofloksasiini). Keskustele välittömästi terveydenhuollon tarjoajan kanssa, jos saat jonkin seuraavista perifeerisen neuropatian oireista käsivarsissasi, käsissäsi, jaloissasi tai jaloissasi:
- kipu
- palaa
- pistely
- tunnottomuus
- heikkous FLOXIN® (ofloksasiini) on ehkä lopetettava pysyvien hermovaurioiden estämiseksi.
- Vakavat sydämen rytmimuutokset (QT-ajan piteneminen ja torsade de pointes): Kerro heti terveydenhuollon tarjoajallesi, jos sydämesi syke muuttuu (nopea tai epäsäännöllinen syke) tai jos pyörryt. FLOXIN® (ofloksasiini) voi aiheuttaa harvinaisen sydänongelman, joka tunnetaan QT-ajan pidentymisenä. Tämä tila voi aiheuttaa epänormaalia sydämenlyöntiä ja voi olla erittäin vaarallinen. Tämän todennäköisyys on suurempi ihmisillä:
- jotka ovat vanhoja
- joiden suvussa on ollut pitkittynyt QT-aika
- joilla on alhainen veren kaliumpitoisuus (hypokalemia)
- jotka käyttävät tiettyjä lääkkeitä sydämen rytmin säätelyyn (antiarytmiset lääkkeet)
- Herkkyys auringonvalolle (valoherkkyys): Katso "Mitä minun tulisi välttää FLOXIN® (ofloksasiini) käytön aikana?"
- Matala verensokeri (hypoglykemia). Ihmiset, jotka ottavat FLOXIN® (ofloksasiini) ja muita fluorokinolonilääkkeitä oraalisten diabeteslääkkeiden tai insuliinin kanssa, voivat saada alhaisen verensokerin (hypoglykemia). Noudata terveydenhuollon tarjoajan ohjeita siitä, kuinka usein tarkistat verensokerisi. Jos sinulla on diabetes ja verensokeri on alhainen FLOXIN® (ofloksasiini) käytön aikana, lopeta FLOXIN® (ofloksasiini) käyttö heti ja soita heti terveydenhuollon tarjoajallesi. Antibioottilääkkeesi on ehkä vaihdettava.
- FLOXIN® (ofloksasiini) yleisimmät sivuvaikutukset ovat:
- Unihäiriöt
- päänsärky
- huimaus
- pahoinvointi
- oksentelua
- ripuli
- kutina
- ulkoisten sukuelinten kutina naisilla
- emättimen tulehdus (emätintulehdus)
- maku muuttuu
FLOXIN® (ofloksasiini) voi aiheuttaa vääriä positiivisia virtsan seulontatuloksia opiaateille, kun testataan joillakin kaupallisesti saatavilla sarjoilla. Positiivinen tulos tulee vahvistaa käyttämällä tarkempaa testiä.
Nämä eivät ole kaikki FLOXIN® (ofloksasiini) mahdollisia sivuvaikutuksia. Kerro terveydenhuollon tarjoajallesi kaikista sivuvaikutuksista, jotka häiritsevät sinua tai jotka eivät katoa.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää FLOXIN® (ofloksasiini)?
- Säilytä FLOXIN® (ofloksasiini) lämpötilassa 59–86 °F (15–30 °C).
- Pidä FLOXIN® (ofloksasiini) -pullo tiiviisti suljettuna.
- Pidä FLOXIN® (ofloksasiini) ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa FLOXIN®:sta (ofloksasiini)
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä FLOXIN® (ofloksasiini) sairauteen, johon sitä ei ole määrätty. Älä anna FLOXIN® (ofloksasiini) muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tämä lääkitysopas sisältää yhteenvedon tärkeimmistä tiedoista FLOXIN®:ista (ofloksasiini). Jos haluat lisätietoja FLOXIN®-valmisteesta (ofloksasiini), keskustele terveydenhuollon tarjoajasi kanssa. Voit kysyä terveydenhuollon tarjoajalta tai apteekista terveydenhuollon ammattilaisille kirjoitettuja tietoja FLOXIN®-valmisteesta (ofloksasiini). Lisätietoja saat soittamalla numeroon 1-800-526-7736.
Mitä ainesosia FLOXIN® sisältää?
- Vaikuttava aine: ofloksasiini
- Ei-aktiiviset aineet: vedetön laktoosi, modifioitu maissitärkkelys, hydroksipropyyliselluloosa, hypromelloosi, magnesiumstearaatti, polyetyleeniglykoli, polysorbaatti 80, natriumtärkkelysglykolaatti, titaanidioksidi ja voivat sisältää myös synteettistä keltaista rautaoksidia.
