Augmentin 250/125mg, 500/125mg, 750/250mg, 875/125mg Clavulanate Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Augmentin 875mg on ja miten sitä käytetään?
Augmentin 250mg on reseptilääke, jota käytetään monien erilaisten bakteerien aiheuttamien infektioiden, kuten alempien hengitysteiden infektioiden, kroonisen obstruktiivisen keuhkosairauden, bakteeriperäisen poskiontelotulehduksen, eläimen/ihmisen puremahaavojen ja ihoinfektioiden hoitoon. Augmentin 125 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
- Augmentin on penisilliini, amino.
Mitkä ovat Augmentinin mahdolliset sivuvaikutukset?
Augmentin 750 mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- kova vatsakipu,
- ripuli, joka on vetistä tai veristä,
- vaalea tai kellastunut iho,
- tumma virtsa,
- kuume,
- hämmennystä,
- heikkous,
- ruokahalun menetys,
- ylävatsakipu,
- ihon tai silmien keltaisuus (keltaisuus),
- helppo mustelma tai verenvuoto,
- vähän tai ei ollenkaan virtsaamista,
- kipeä kurkku,
- turvotus kasvoissasi tai kielessäsi,
- polttaa silmissäsi,
- ihokipu, jota seuraa punainen tai violetti ihottuma, joka leviää (kasvoille tai ylävartalolle) rakkuloilla ja hilseilyllä
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Augmentinin yleisimpiä sivuvaikutuksia ovat:
- pahoinvointi,
- ripuli,
- emättimen kutina tai vuoto,
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Augmentinin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
AUGMENTIN 500mg on oraalinen antibakteerinen yhdistelmä, joka koostuu amoksisilliinista ja beetalaktamaasi-inhibiittorista, klavulanaattikaliumista (klavulaanihapon kaliumsuola).
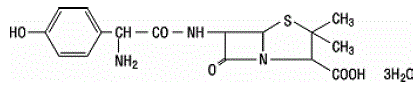
Amoksisilliini on ampisilliinin analogi, joka on peräisin penisilliinin emäksestä 6-aminopenisillaanihaposta. Amoksisilliinin molekyylikaava on C16H19N3O5S•3H2O ja molekyylipaino on 419,46. Kemiallisesti amoksisilliini on (2S,5R,6R)-6-[(R)-(-)-2-amino-2-(p-hydroksifenyyli)asetamido]-3,3-dimetyyli-7-okso-4-tia -1-atsabisyklo[3.2.0]heptaani-2-karboksyylihappotrihydraatti ja se voidaan esittää rakenteellisesti seuraavasti:
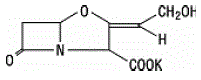
Klavulaanihappoa tuotetaan Streptomyces clavuligeruksen fermentoimalla. Se on beetalaktaami, joka on rakenteellisesti sukua penisilliineille, ja sillä on kyky inaktivoida joitain beetalaktamaaseja salpaamalla näiden entsyymien aktiiviset kohdat. Klavulanaattikaliumin molekyylikaava on C8H8KNO5 ja molekyylipaino on 237,25. Kemiallisesti klavulanaattikalium on kalium(Z)(2R,5R)-3-(2-hydroksietylideeni)-7-okso-4-oksa-1-atsabisyklo[3.2.0]heptaani-2-karboksylaattia, ja se voidaan esittää rakenteellisesti kuten:
Inaktiiviset ainesosat
- Tabletit - Kolloidinen piidioksidi, hypromelloosi, magnesiumstearaatti, mikrokiteinen selluloosa, polyetyleeniglykoli, natriumtärkkelysglykolaatti ja titaanidioksidi. Jokainen AUGMENTIN-tabletti sisältää 0,63 meekvivalenttia kaliumia.
- Jauhe oraalisuspensiota varten – Kolloidinen piidioksidi, aromit, ksantaanikumi ja yksi tai useampi seuraavista: hypromelloosi, mannitoli, silikageeli, piidioksidi, meripihkahappo, natriumsakariini ja aspartaami. [katso VAROITUKSET JA VAROTOIMET ]
- Purutabletit – Kolloidinen piidioksidi, aromit, magnesiumstearaatti, mannitoli ja yksi tai useampi seuraavista: D&C Yellow No. 10, FD&C Red No. 40, glysiini, natriumsakariini ja aspartaami. [katso VAROITUKSET JA VAROTOIMET]
- Jokainen 125 mg:n purutabletti ja jokainen 5 ml liuotettua 125/5 ml:n AUGMENTIN 750 mg:n oraalisuspensiota sisältävät 0,16 mekvivalenttia kaliumia
- Jokainen 250 mg:n purutabletti ja jokainen 5 ml liuotettua 250/5 ml:n AUGMENTIN-oraalisuspensiota sisältävät 0,32 meekvivalenttia kaliumia
- Jokainen 200 mg:n purutabletti ja jokainen 5 ml liuotettua 200/5 ml:n AUGMENTIN-oraalisuspensiota sisältävät 0,14 meekvivalenttia kaliumia
- Jokainen 400 mg:n purutabletti ja jokainen 5 ml käyttövalmiiksi saatettua 400/5 ml:n AUGMENTIN 500 mg:n oraalisuspensiota sisältävät 0,29 mekvivalenttia kaliumia
INDIKAATIOT
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja AUGMENTINin (amoksisilliini/klavulanaattikalium) ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi AUGMENTIN 500 mg:aa tulee käyttää vain sellaisten infektioiden hoitoon, joiden on todistettu tai epäillään olevan herkkien bakteerien aiheuttamia. Kun viljely- ja herkkyystiedot ovat saatavilla, ne tulee ottaa huomioon valittaessa tai muuttaessa antibakteerista hoitoa. Tällaisten tietojen puuttuessa paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa hoidon empiiriseen valintaan.
AUGMENTIN® on yhdistelmä penisilliiniluokan antibakteerinen ja beetalaktamaasin estäjä, joka on tarkoitettu nimettyjen bakteerien herkistä isolaateista johtuvien infektioiden hoitoon alla luetelluissa olosuhteissa*:
Alempien hengitysteiden infektiot
Sen aiheuttavat beetalaktamaasia tuottavat Haemophilus influenzae- ja Moraxella catarrhalis -isolaatit.
Akuutti bakteeriperäinen välikorvatulehdus
Syynä on beetalaktamaasia tuottavat H. influenzaen ja M. catarrhaliksen isolaatit.
Sinuiitti
Syynä on beetalaktamaasia tuottavat H. influenzaen ja M. catarrhaliksen isolaatit.
Ihon ja ihon rakenteen infektiot
Syynä on Staphylococcus aureus-, Escherichia coli- ja Klebsiella-lajien beetalaktamaasia tuottavat isolaatit.
Virtsatieinfektiot
Syynä on beetalaktamaasia tuottavat E. coli-, Klebsiella- ja Enterobacter-lajit.
Käyttörajoitukset
Jos herkkyystestin tulokset osoittavat herkkyyttä amoksisilliinille, mikä osoittaa, että beetalaktamaasin tuotanto ei ole, AUGMENTINia ei tule käyttää.
ANNOSTELU JA HALLINNOINTI
AUGMENTIN 875mg voidaan ottaa aterioista riippumatta; klavulanaattikaliumin imeytyminen kuitenkin paranee, kun AUGMENTIN 250 mg annetaan aterian alussa. Maha-suolikanavan intoleranssin mahdollisuuden minimoimiseksi AUGMENTIN 125 mg tulee ottaa aterian alussa.
Aikuiset
Tavallinen aikuisten annos on yksi 500 mg:n AUGMENTIN-tabletti 12 tunnin välein tai yksi 250 mg:n AUGMENTIN 125 mg:n tabletti 8 tunnin välein. Vakavammissa infektioissa ja hengitystieinfektioissa annoksen tulee olla yksi 875 mg:n AUGMENTIN 875 mg:n tabletti 12 tunnin välein tai yksi 500 mg:n AUGMENTIN-tabletti 8 tunnin välein. Aikuisille, joilla on nielemisvaikeuksia, voidaan antaa 125 mg/5 ml tai 250 mg/5 ml suspensio 500 mg:n tabletin tilalle. 200 mg/5 ml suspensiota tai 400 mg/5 ml suspensiota voidaan käyttää 875 mg:n tabletin tilalla.
Kahta 250 mg:n AUGMENTIN-tablettia ei tule korvata yhdellä 500 mg:n AUGMENTIN-tabletilla. Koska sekä 250 mg:n että 500 mg:n AUGMENTIN-tabletit sisältävät saman määrän klavulaanihappoa (125 mg, kuin kaliumsuola), kaksi 250 mg:n tablettia ei vastaa yhtä 500 mg:n AUGMENTIN-tablettia.
AUGMENTINin 250 mg:n tablettia ja 250 mg:n purutablettia ei pidä korvata toisillaan, koska ne eivät ole keskenään vaihdettavissa. AUGMENTIN 250 mg:n 250 mg:n tabletti ja 250 mg:n purutabletti eivät sisällä samaa määrää klavulaanihappoa (kuten kaliumsuola). 250 mg:n AUGMENTIN-tabletti sisältää 125 mg klavulaanihappoa, kun taas 250 mg:n purutabletti sisältää 62,5 mg klavulaanihappoa.
Pediatriset potilaat
Amoksisilliinikomponentin perusteella AUGMENTIN tulee annostella seuraavasti:
Vastasyntyneet ja alle 12 viikon ikäiset vauvat (
Suositeltu AUGMENTIN-annos on 30 mg/kg/vrk jaettuna 12 tunnin välein amoksisilliinikomponentin perusteella. Kokemus 200 mg/5 ml:n formulaatiosta tässä ikäryhmässä on rajallinen, ja siksi 125 mg/5 ml oraalisuspension käyttöä suositellaan.
12 viikon (3 kuukauden) ikäiset ja sitä vanhemmat potilaat
Katso annostusohjelmat taulukosta 1. 12 tunnin välein suositellaan, koska siihen liittyy merkittävästi vähemmän ripulia [ks. Kliiniset tutkimukset ]. Kuitenkin 12 tunnin välein annettava suspensio (200 mg/5 ml ja 400 mg/5 ml) ja purutabletit (200 mg ja 400 mg) sisältävät aspartaamia, eikä fenyyliketonuriat saa käyttää niitä. [katso VAROITUKSET JA VAROTOIMET ]
Potilaat, jotka painavat 40 kg tai enemmän
Lapsipotilaat, jotka painavat 40 kg tai enemmän, tulee annostella aikuisten suositusten mukaisesti.
250 mg:n AUGMENTIN-tablettia ei saa käyttää ennen kuin lapsi painaa vähintään 40 kg, koska 250 mg:n AUGMENTIN-tabletissa (250/125) on eri amoksisilliinin ja klavulaanihapon välinen suhde verrattuna 250 mg:n purutablettiin. AUGMENTIN (250/62,5).
Potilaat, joilla on munuaisten vajaatoiminta
Potilaiden, joilla on munuaisten vajaatoiminta, ei yleensä tarvitse pienentää annosta, ellei vajaatoiminta ole vakavaa. Munuaisten vajaatoimintapotilaiden, joiden glomerulussuodatusnopeus on
Hemodialyysipotilaiden tulee saada 500 mg tai 250 mg 24 tunnin välein infektion vakavuudesta riippuen. Heille tulee antaa lisäannos sekä dialyysin aikana että sen lopussa.
Ohjeet oraalisuspension sekoittamiseen
Valmista suspensio annostelun yhteydessä seuraavasti: Napauta pulloa, kunnes kaikki jauhe valuu vapaasti. Lisää noin 2/3 käyttövalmiiksi saatettavan veden kokonaismäärästä (katso taulukko 2 alla) ja ravista voimakkaasti jauheen suspendoimiseksi. Lisää loput vedestä ja ravista uudelleen voimakkaasti.
merkintä: Ravista oraalisuspensiota hyvin ennen käyttöä. Käyttövalmiiksi valmistettu suspensio on säilytettävä jääkaapissa ja hävitettävä 10 päivän kuluttua.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Tabletit
- 250 mg/125 mg tabletit: Jokainen valkoinen soikea kalvopäällysteinen tabletti, jonka toisella puolella on kaiverrus AUGMENTIN 750 mg ja toisella puolella 250/125, sisältää 250 mg amoksisilliinia ja 125 mg klavulaanihappoa kaliumsuolana.
- 500 mg/125 mg tabletit: Jokainen valkoinen soikea kalvopäällysteinen tabletti, jonka toisella puolella on kaiverrus AUGMENTIN 125 mg ja toisella puolella 500/125, sisältää 500 mg amoksisilliinia ja 125 mg klavulaanihappoa kaliumsuolana.
- 875 mg/125 mg tabletit: Jokainen jakouurteinen valkoinen kapselin muotoinen tabletti, jonka toiselle puolelle on kaiverrettu AUGMENTIN 875 ja toisella puolella jakouurre, sisältää 875 mg amoksisilliinia ja 125 mg klavulaanihappoa kaliumsuolana.
Jauhe oraalisuspensiota varten
- 125 mg/31,25 mg per 5 ml: Banaaninmakuinen jauhe oraalisuspensiota varten (jokainen 5 ml käyttövalmiiksi valmistettua suspensiota sisältää 125 mg amoksisilliinia ja 31,25 mg klavulaanihappoa kaliumsuolana).
- 200 mg/28,5 mg per 5 ml: Oranssisuosittu jauhe oraalisuspensiota varten (jokainen 5 ml käyttövalmiiksi valmistettua suspensiota sisältää 200 mg amoksisilliinia ja 28,5 mg klavulaanihappoa kaliumsuolana).
- 250 mg/62,5 mg per 5 ml: Appelsiininmakuinen jauhe oraalisuspensiota varten (jokainen 5 ml käyttövalmiiksi valmistettua suspensiota sisältää 250 mg amoksisilliinia ja 62,5 mg klavulaanihappoa kaliumsuolana).
- 400 mg/57 mg per 5 ml Appelsiininmakuinen jauhe oraalisuspensiota varten (jokainen 5 ml käyttövalmiiksi valmistettua suspensiota sisältää 400 mg amoksisilliinia ja 57,0 mg klavulaanihappoa kaliumsuolana).
Purutabletit
- 125 mg/31,25 mg purutabletit: Jokainen kirjava keltainen, pyöreä, sitruuna-limetin makuinen tabletti, jossa on kaiverrus BMP 189, sisältää 125 mg amoksisilliinia ja 31,25 mg klavulaanihappoa kaliumsuolana.
- 200 mg/28,5 mg purutabletit: Jokainen kirjava vaaleanpunainen, pyöreä, kaksoiskupera kirsikka-banaanin makuinen tabletti, jossa on kaiverrus AUGMENTIN 200, sisältää 200 mg amoksisilliinia ja 28,5 mg klavulaanihappoa kaliumsuolana.
- 250 mg/62,5 mg purutabletit: Jokainen kirjava keltainen, pyöreä, sitruuna-limetin makuinen tabletti, jossa on kaiverrus BMP 190, sisältää 250 mg amoksisilliinia ja 62,5 mg klavulaanihappoa kaliumsuolana.
- 400 mg/57 mg purutabletit: Jokainen kirjava vaaleanpunainen, pyöreä, kaksoiskupera kirsikka-banaanin makuinen tabletti, jossa on kaiverrus AUGMENTIN 400, sisältää 400 mg amoksisilliinia ja 57,0 mg klavulaanihappoa kaliumsuolana.
AUGMENTIN 750 mg:n 250 mg:n tablettia ja 250 mg:n purutablettia EI pidä korvata toisillaan, koska ne eivät ole keskenään vaihdettavissa, eikä 250 mg:n tablettia saa käyttää alle 40 kg painaville lapsille. AUGMENTINin 250 mg:n tabletti ja 250 mg:n purutabletti eivät sisällä samaa määrää klavulaanihappoa. 250 mg:n AUGMENTIN-tabletti sisältää 125 mg klavulaanihappoa, kun taas 250 mg:n purutabletti sisältää 62,5 mg klavulaanihappoa.
Kahta 250 mg:n AUGMENTIN 750 mg:n tablettia EI pidä korvata yhdellä 500 mg:n AUGMENTIN-tabletilla. Koska sekä 250 mg:n että 500 mg:n AUGMENTIN-tabletit sisältävät saman määrän klavulaanihappoa (125 mg, kuin kaliumsuola), kaksi 250 mg:n AUGMENTIN 750 mg:n tablettia ei vastaa yhtä 500 mg:n AUGMENTIN-tablettia.
Varastointi ja käsittely
Tabletit
250 mg/125 mg tabletit: Jokainen valkoinen soikea kalvopäällysteinen tabletti, jonka toisella puolella on kaiverrus AUGMENTIN 750 mg ja toisella puolella 250/125, sisältää 250 mg amoksisilliinia trihydraattina ja 125 mg klavulaanihappoa kaliumsuolana.
NDC 43598-018-30 pulloa 30 kappaletta NDC 43598-018-78 Yksikköannos (10x10) 100 tablettia
500 mg/125 mg tabletit: Jokainen valkoinen soikea kalvopäällysteinen tabletti, jonka toisella puolella on kaiverrus AUGMENTIN ja toisella puolella 500/125, sisältää 500 mg amoksisilliinia trihydraattina ja 125 mg klavulaanihappoa kaliumsuolana.
NDC 43598-006-14 pulloa 20 kappaletta NDC 43598-006-78 Yksikköannos (10x10) 100 tablettia
875 mg/125 mg tabletit: Jokainen jakouurteinen valkoinen kapselin muotoinen tabletti, jonka toisella puolella on kaiverrus AUGMENTIN 875 ja toisella puolella jakouurre, sisältää 875 mg amoksisilliinia trihydraattina ja 125 mg klavulaanihappoa kaliumsuolana.
NDC 43598-021-14 pulloa 20 kappaletta NDC 43598-021-78 Yksikköannos (10x10) 100 tablettia
Jauhe oraalisuspensiokynille: 125 mg/31,25 mg per 5 ml: Banaaninmakuinen jauhe oraalisuspensiota varten (jokainen 5 ml käyttövalmiiksi valmistettua suspensiota sisältää 125 mg amoksisilliinia ja 31,25 mg klavulaanihappoa kaliumsuolana).
NDC 43598-012-51 75 ml pullo NDC 43598-012-52 100 ml pullo NDC 43598-012-53 150 ml pullo
200 mg/28,5 mg per 5 ml: Oranssisuosittu jauhe oraalisuspensiota varten (jokainen 5 ml käyttövalmiiksi valmistettua suspensiota sisältää 200 mg amoksisilliinia ja 28,5 mg klavulaanihappoa kaliumsuolana).
NDC 43598-013-50 50 ml pullo NDC 43598-013-51 75 ml pullo NDC 43598-013-52 100 ml pullo
250 mg/62,5 mg per 5 ml: Appelsiininmakuinen jauhe oraalisuspensiota varten (jokainen 5 ml käyttövalmiiksi valmistettua suspensiota sisältää 250 mg amoksisilliinia ja 62,5 mg klavulaanihappoa kaliumsuolana).
NDC 43598-004-51 75 ml pullo NDC 43598-004-52 100 ml pullo NDC 43598-004-53 150 ml pullo
400 mg/57 mg per 5 ml Appelsiininmakuinen jauhe oraalisuspensiota varten (jokainen 5 ml käyttövalmiiksi valmistettua suspensiota sisältää 400 mg amoksisilliinia ja 57,0 mg klavulaanihappoa kaliumsuolana).
NDC 43598-008-50 50 ml pullo NDC 43598-008-51 75 ml pullo NDC 43598-008-52 100 ml pullo
Purutabletit: 125 mg/31,25 mg purutabletit: Jokainen kirjava keltainen, pyöreä, sitruunan limetinmakuinen tabletti, jossa on kaiverrus BMP 189, sisältää 125 mg amoksisilliinia ja 31,25 mg klavulaanihappoa kaliumsuolana.
NDC 43598-014-31 laatikko, jossa 30 (5x6) tablettia
200 mg/28,5 mg purutabletit: Jokainen kirjava vaaleanpunainen, pyöreä, kaksoiskupera, kirsikka-banaanin makuinen tabletti, jossa on kaiverrus AUGMENTIN 200, sisältää 200 mg amoksisilliinia ja 28,5 mg klavulaanihappoa kaliumsuolana.
NDC 43598-015-14 20 tabletin laatikko
250 mg/62,5 mg purutabletit: Jokainen kirjava keltainen, pyöreä, sitruuna-limetin makuinen tabletti, jossa on kaiverrus BMP 190, sisältää 250 mg amoksisilliinia ja 62,5 mg klavulaanihappoa kaliumsuolana.
NDC 43598-016-31 laatikko, jossa 30 (5x6) tablettia
400 mg/57 mg purutabletit: Jokainen kirjava vaaleanpunainen, pyöreä, kaksoiskupera, kirsikka-banaanin makuinen tabletti, jossa on kaiverrus AUGMENTIN 400, sisältää 400 mg amoksisilliinia ja 57,0 mg klavulaanihappoa kaliumsuolana.
NDC 43598-017-14 20 tabletin laatikko
Annostele alkuperäisessä pakkauksessa.
Säilytä tabletit ja kuivajauhe enintään 25 °C:ssa (77 °F).
Säilytä käyttövalmiiksi valmistettu suspensio jääkaapissa. Hävitä käyttämätön suspensio 10 päivän kuluttua. Pidä poissa lasten ulottuvilta.
VIITTEET
1. Swanson-Biearman B, Dean BS, Lopez G, Krenzelok EP. Penisilliinin ja kefalosporiinin nauttimisen vaikutukset alle kuuden vuoden ikäisille lapsille. Vet Hum Toxicol. 1988; 30: 66 67.
2. Clinical and Laboratory Standards Institute (CLSI). Aerobisesti kasvavien bakteerien antimikrobisen herkkyystestien laimennusmenetelmät; Hyväksytty standardi – 8. CLSI-asiakirja M7-A9. CLSI, 940 West Valley Road, Suite 1400, Wayne, PA, 19087, 2012.
3. Clinical and Laboratory Standards Institute (CLSI). Suorituskykystandardi antimikrobisille levyherkkyystesteille; Hyväksytty standardi – 11. päivä. CLSI-asiakirja M2-A11. CLSI, 940 West Valley Road, Suite 1400, Wayne, PA, 19087, 2012.
4. CLSI. Suorituskykystandardit antimikrobisille herkkyystestauksille: 22. tiedote. CLSI-asiakirja M100-S22. CLSI, Wayne, PA, 2012.
Jakelija: Dr. Reddy's Laboratories Inc.Bridgewater, NJ 08807. Tarkistettu: maaliskuu 2013
SIVUVAIKUTUKSET
Seuraavaa käsitellään tarkemmin muissa merkintöjen osissa:
- Anafylaktiset reaktiot [katso VAROITUKSET JA VAROTOIMET ]
- Maksan toimintahäiriö [katso VAROITUKSET JA VAROTOIMET ]
- CDAD [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Yleisimmin raportoidut haittavaikutukset olivat ripuli/löysät ulosteet (9 %), pahoinvointi (3 %), ihottumat ja nokkosihottuma (3 %), oksentelu (1 %) ja vaginiitti (1 %). Alle 3 % potilaista keskeytti hoidon lääkkeisiin liittyvien haittavaikutusten vuoksi. Haittavaikutusten ja erityisesti ripulin yleinen ilmaantuvuus lisääntyi suuremman suositellun annoksen myötä. Muita harvemmin raportoituja haittavaikutuksia (
Lapsipotilailla (2 kk - 12-vuotiaat) suoritettiin yksi yhdysvaltalainen/kanadalainen kliininen tutkimus, jossa verrattiin 45/6,4 mg/kg/vrk (jaettuna 12 tunnin välein) AUGMENTINia 10 päivän ajan verrattuna 40/10 mg/kg/vrk. (jaettuna 8 tunnin välein) AUGMENTIN 125 mg 10 päivän ajan akuutin välikorvatulehduksen hoidossa. Kaikkiaan 575 potilasta otettiin mukaan, ja tässä tutkimuksessa käytettiin vain suspensioformulaatioita. Kaiken kaikkiaan havaitut haittavaikutukset olivat verrattavissa yllä mainittuihin; Ripulin, ihottuman/urtikarian ja vaippa-alueen ihottumien esiintyvissä oli kuitenkin eroja. [Katso Kliiniset tutkimukset ]
Markkinoinnin jälkeinen kokemus
Kliinisissä tutkimuksissa raportoitujen haittavaikutusten lisäksi seuraavat on tunnistettu AUGMENTINin markkinoille tulon jälkeisen käytön aikana. Koska ne raportoidaan vapaaehtoisesti tuntemattoman kokoisesta populaatiosta, arvioita esiintymistiheydestä ei voida tehdä. Nämä tapahtumat on valittu sisällytettäväksi niiden vakavuuden, ilmoitustiheyden tai mahdollisen syy-yhteyden AUGMENTINiin yhdistelmän vuoksi.
Ruoansulatuskanava
Ruoansulatushäiriöt, gastriitti, stomatiitti, glossiitti, musta "karvainen" kieli, limakalvojen kandidiaasi, enterokoliitti ja verenvuoto/pseudomembranoottinen koliitti. Pseudomembranoottisen paksusuolitulehduksen oireita voi ilmetä antibioottihoidon aikana tai sen jälkeen. [katso VAROITUKSET JA VAROTOIMET ]
Yliherkkyysreaktiot
Kutina, angioödeema, seerumitaudin kaltaiset reaktiot (urtikaria tai ihottuma, johon liittyy niveltulehdus, nivelkipu, lihaskipu ja usein kuume), erythema multiforme, Stevens Johnsonin oireyhtymä, akuutti yleistynyt eksantematoospustuloosi, yliherkkyysvaskuliitti ja eksfoliatiiviset ihotulehdukset (mukaan lukien toksinen epidermaalinen nekrolyysi) on raportoitu. [katso VAROITUKSET JA VAROTOIMET ]
Maksa
Maksan toimintahäiriöitä, mukaan lukien hepatiitti ja kolestaattinen keltaisuus, seerumin transaminaasiarvojen (AST ja/tai ALAT), seerumin bilirubiinin ja/tai alkalisen fosfataasin nousua on raportoitu AUGMENTININ käytön yhteydessä. Sitä on raportoitu yleisemmin vanhuksilla, miehillä tai potilailla, jotka saavat pitkäaikaista hoitoa. Maksabiopsian histologiset löydökset ovat koostuneet pääasiassa kolestaattisesta hoidosta. Maksan biopsian histologiset löydökset ovat koostuneet pääasiassa kolestaattisista, hepatosellulaarisista tai sekakolestaattisista hepatosellulaarisista muutoksista. Maksan vajaatoiminnan merkit/oireet voivat ilmaantua hoidon lopettamisen aikana tai useita viikkoja sen jälkeen. Maksan toimintahäiriö, joka voi olla vakava, on yleensä palautuva. Kuolemia on raportoitu. [katso VASTA-AIHEET , VAROITUKSET JA VAROTOIMET ]
Munuaiset
Interstitiaalista nefriittiä, hematuriaa ja kristalluriaa on raportoitu. [katso YLIANNOSTUS ]

Hemic ja lymfaattiset järjestelmät
Anemiaa, mukaan lukien hemolyyttinen anemia, trombosytopenia, trombosytopeeninen purppura, eosinofilia, leukopenia ja agranulosytoosi on raportoitu. Nämä reaktiot palautuvat yleensä hoidon lopettamisen jälkeen, ja niiden uskotaan olevan yliherkkyysilmiöitä. Trombosytoosia havaittiin alle 1 %:lla AUGMENTIN-hoitoa saaneista potilaista. Protrombiiniajan pidentymistä on raportoitu potilailla, jotka ovat saaneet AUGMENTIN 125 mg:aa ja antikoagulanttihoitoa samanaikaisesti. [katso HUUMEIDEN VUOROVAIKUTUKSET ]
Keskushermosto
Kiihtyneisyyttä, ahdistusta, käyttäytymismuutoksia, sekavuutta, kouristuksia, huimausta, unettomuutta ja palautuvaa hyperaktiivisuutta on raportoitu.
Sekalaista
Hampaiden värjäytymistä (ruskeaa, keltaista tai harmaata värjäytymistä) on raportoitu. Useimmat ilmoitukset tapahtuivat lapsipotilailla. Värinmuutos väheni tai poistui harjaamalla tai hampaiden puhdistuksella useimmissa tapauksissa.
HUUMEIDEN VUOROVAIKUTUKSET
Probenesidi
Probenesidi vähentää amoksisilliinin eritystä munuaistiehyissä, mutta ei hidasta klavulaanihapon erittymistä munuaisten kautta. Samanaikainen käyttö AUGMENTIN 875 mg:n kanssa voi johtaa veren amoksisilliinipitoisuuksien nousuun ja pitkittymiseen. Probenesidin samanaikaista käyttöä ei suositella.
Oraaliset antikoagulantit
Epänormaalia protrombiiniajan pidentymistä (lisääntynyt kansainvälinen normalisoitu suhde [INR]) on raportoitu potilailla, jotka ovat saaneet amoksisilliinia ja oraalisia antikoagulantteja. Asianmukaista seurantaa tulee suorittaa, kun antikoagulantteja määrätään samanaikaisesti AUGMENTINin kanssa. Suun kautta otettavien antikoagulanttien annosta voi olla tarpeen muuttaa halutun antikoagulanttitason ylläpitämiseksi.
Allopurinoli
Allopurinolin ja amoksisilliinin samanaikainen käyttö lisää ihottumien ilmaantuvuutta potilailla, jotka saavat kumpaakin lääkettä verrattuna potilaisiin, jotka saavat amoksisilliinia yksinään. Ei tiedetä, johtuuko tämä amoksisilliini-ihottumien voimistuminen allopurinolista tai näillä potilailla esiintyvästä hyperurikemiasta.
Ehkäisypillerit
AUGMENTIN 750 mg voi vaikuttaa suolistoflooraan, mikä heikentää estrogeenin takaisinabsorptiota ja heikentää oraalisten estrogeeni/progesteroni-yhdistelmäehkäisyvalmisteiden tehoa.
Vaikutukset laboratoriokokeisiin
Amoksisilliinin korkeat pitoisuudet virtsassa voivat aiheuttaa vääriä positiivisia reaktioita, kun testataan glukoosin esiintymistä virtsassa käyttämällä CLINITEST®-, Benedict's Solution- tai Fehling's Solution -liuosta. Koska tämä vaikutus voi ilmetä myös AUGMENTIN-valmisteen kanssa, on suositeltavaa käyttää entsymaattisiin glukoosioksidaasireaktioihin perustuvia glukoositestejä.
Amoksisilliinin antamisen jälkeen raskaana oleville naisille on havaittu konjugoidun estriolin, estrioliglukuronidin, konjugoidun estronin ja estradiolin plasmapitoisuuden ohimenevä lasku.
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Yliherkkyysreaktiot
Vakavia ja joskus kuolemaan johtaneita yliherkkyysreaktioita (anafylaktisia) on raportoitu potilailla, jotka ovat saaneet beetalaktaamiantibakteerisia lääkkeitä, mukaan lukien AUGMENTIN. Näitä reaktioita esiintyy todennäköisemmin henkilöillä, joilla on aiemmin ollut yliherkkyys penisilliinille ja/tai herkkyys useille allergeeneille. Ennen AUGMENTIN 250 mg -hoidon aloittamista on tutkittava huolellisesti aiemmat yliherkkyysreaktiot penisilliineille, kefalosporiineille tai muille allergeeneille. Jos allerginen reaktio ilmenee, AUGMENTIN-hoito on lopetettava ja asianmukainen hoito aloitettava.
Maksan toimintahäiriö
Maksan toimintahäiriöitä, mukaan lukien hepatiitti ja kolestaattinen keltaisuus, on liitetty AUGMENTINin käyttöön. Maksatoksisuus on yleensä palautuva; kuolemantapauksia on kuitenkin raportoitu. Maksan toimintaa on seurattava säännöllisin väliajoin potilailla, joilla on maksan vajaatoiminta.
Clostridium Difficile -ripuli (CDAD)
Clostridium difficileen liittyvää ripulia (CDAD) on raportoitu käytettäessä lähes kaikkia antibakteerisia aineita, mukaan lukien AUGMENTIN 250 mg, ja sen vaikeusaste voi vaihdella lievästä ripulista kuolemaan johtavaan paksusuolentulehdukseen. Hoito antibakteerisilla aineilla muuttaa paksusuolen normaalia kasvillisuutta, mikä johtaa C. difficilen liikakasvuun.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CDAD:n kehittymistä. Hypertoksiinia tuottavat C. difficilen kannat lisäävät sairastuvuutta ja kuolleisuutta, koska nämä infektiot voivat olla vastustuskykyisiä antimikrobiselle hoidolle ja voivat vaatia kolektomiaa. CDAD on otettava huomioon kaikilla potilailla, joilla on ripulia antibakteeristen lääkkeiden käytön jälkeen. Huolellinen sairaushistoria on tarpeen, koska CDAD:n on raportoitu esiintyvän yli 2 kuukauden kuluttua antibakteeristen aineiden annosta.
Jos CDAD epäillään tai varmistetaan, jatkuva antibakteerinen käyttö, joka ei ole suunnattu C. difficileä vastaan, saattaa olla tarpeen lopettaa. Asianmukainen neste- ja elektrolyyttihallinta, proteiinilisä, C. difficilen antibakteerinen hoito ja kirurginen arviointi tulee aloittaa kliinisen tarpeen mukaan.
Ihottuma mononukleoosipotilailla
Suuri osa amoksisilliinia saavista mononukleoosipotilaista kehittää punoittavan ihottuman. Siksi AUGMENTINia ei tule antaa potilaille, joilla on mononukleoosi.
Mikrobien liikakasvun mahdollisuus
Sieni- tai bakteeripatogeenien superinfektioiden mahdollisuus tulee ottaa huomioon hoidon aikana. Jos superinfektio ilmenee, amoksisilliini/klavulanaattikaliumhoito on lopetettava ja asianmukainen hoito aloitettava.
Fenyyliketonuurit
AUGMENTIN 500 mg purutabletit ja AUGMENTIN jauhe oraaliliuosta varten sisältävät aspartaamia, joka sisältää fenyylialaniinia. Yksi 200 mg:n AUGMENTIN 750 mg:n purutabletti sisältää 2,1 mg fenyylialaniinia; yksi 400 mg:n purutabletti sisältää 4,2 mg fenyylialaniinia; jokainen 5 ml joko 200 mg/5 ml tai 400 mg/5 ml oraalisuspensiota sisältää 7 mg fenyylialaniinia. Muut AUGMENTIN 875 mg:n formulaatiot eivät sisällä fenyylialaniinia.
Lääkeresistenttien bakteerien kehittäminen
AUGMENTIN 250 mg:n määrääminen ilman todistettua tai vahvasti epäiltyä bakteeri-infektiota ei todennäköisesti hyödytä potilasta, ja se lisää lääkeresistenttien bakteerien kehittymisen riskiä.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Pitkäaikaisia tutkimuksia eläimillä ei ole suoritettu karsinogeenisuuden arvioimiseksi.
AUGMENTIN (amoksisilliini:klavulanaatti-suhdeformulaatio 4:1) ei ollut mutageeninen Amesin bakteerimutaatiomäärityksessä ja hiivan geenikonversiomäärityksessä. AUGMENTIN oli heikosti positiivinen hiiren lymfoomamäärityksessä, mutta suuntaus kohti lisääntynyttä mutaatiotaajuutta tässä määrityksessä esiintyi annoksilla, jotka liittyivät myös solujen eloonjäämisen vähenemiseen. AUGMENTIN oli negatiivinen hiiren mikrotumatestissä ja hallitsevassa tappavassa määrityksessä hiirillä. Pelkästään kaliumklavulanaattia testattiin Amesin bakteerimutaatiomäärityksessä ja hiiren mikrotumatestissä, ja se oli negatiivinen kaikissa näissä määrityksissä.
AUGMENTININ (amoksisilliini:klavulanaatti-suhde 2:1) suun kautta annetuilla annoksilla 1 200 mg/kg/vrk asti ei havaittu vaikuttavan rottien hedelmällisyyteen ja lisääntymiskykyyn. Kehon pinta-alan perusteella tämä amoksisilliiniannos on noin 4 kertaa suurin suositeltu aikuisen ihmisen suun kautta otettava annos (875 mg 12 tunnin välein). Klavulanaatin moninkertainen annos on noin 9 kertaa suurempi kuin suurin suositeltu aikuisen ihmisen suun kautta otettava annos (125 mg 8 tunnin välein), myös kehon pinta-alan perusteella.
Käyttö tietyissä populaatioissa
Raskaus
Teratogeeniset vaikutukset
Raskausluokka B. Tiineillä rotilla ja hiirillä tehdyt lisääntymistutkimukset, joille annettiin AUGMENTINia (amoksisilliini:klavulanaatti-suhde 2:1-formulaatio) suun kautta annetuilla annoksilla 1200 mg/kg/vrk asti, ei havaittu näyttöä AUGMENTINin aiheuttamasta haitasta sikiölle. Amoksisilliiniannokset rotilla ja hiirillä (kehon pinta-alan perusteella) olivat noin 4 ja 2 kertaa suuremmat kuin aikuisen ihmisen suurin suositeltu suun kautta otettava annos (875 mg 12 tunnin välein). Klavulanaatin kohdalla nämä annokset olivat noin 9- ja 4-kertaiset aikuisille ihmisille suun kautta otettavaan enimmäisannokseen verrattuna (125 mg joka 8. tunti). Ei kuitenkaan ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, tätä lääkettä tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Työ ja toimitus
Suun kautta otettavat ampisilliiniluokan antibiootit imeytyvät huonosti synnytyksen aikana. Ei tiedetä, onko amoksisilliini/klavulanaattikaliumin käytöllä ihmisillä synnytyksen tai synnytyksen aikana välittömiä tai viivästyneitä haitallisia vaikutuksia sikiöön, pidentääkö synnytyksen kestoa tai lisääkö synnytyshoidon tarpeellisuuden todennäköisyyttä.
Imettävät äidit
Amoksisilliinin on osoitettu erittyvän äidinmaitoon. Amoksisilliini/klavulanaattikaliumin käyttö imettävillä äideillä voi johtaa imeväisten herkistymiseen. Varovaisuutta on noudatettava, kun amoksisilliini/klavulanaattikaliumia annetaan imettäville naisille.
Käyttö lapsille
AUGMENTIN-jauheen oraalisuspensiota ja purutabletteja varten on turvallisuus ja tehokkuus osoitettu lapsipotilailla. AUGMENTIN 125 mg:n käyttöä lapsipotilailla tukevat todisteet AUGMENTIN-tabletteja koskevista aikuisilla tehdyistä tutkimuksista sekä lisätiedoista AUGMENTIN-jauhetta oraalisuspensiota koskevasta tutkimuksesta 2 kuukauden–12-vuotiailla lapsipotilailla, joilla on akuutti välikorvatulehdus. [katso Kliiniset tutkimukset ]
Koska vastasyntyneiden ja pikkulasten munuaisten toiminta ei ole täysin kehittynyt, amoksisilliinin eliminaatio saattaa viivästyä. klavulanaatin eliminaatio ei muutu tässä ikäryhmässä. AUGMENTIN 500 mg:n annosta tulee muuttaa alle 12 viikon ( ANNOSTELU JA HALLINNOINTI ]
Geriatrinen käyttö
AUGMENTINin kliinisten tutkimusten analyysissä 3 119 potilaasta 32 % oli ≥65-vuotiaita ja 14 % 75-vuotiaita. Yleisiä eroja turvallisuudessa tai tehokkuudessa ei havaittu näiden ja nuorempien koehenkilöiden välillä, ja muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
Tämän lääkkeen tiedetään erittyvän olennaisesti munuaisten kautta, ja tämän lääkkeen haittavaikutusten riski voi olla suurempi potilailla, joilla on heikentynyt munuaisten toiminta. Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, annoksen valinnassa on oltava varovainen, ja munuaisten toiminnan seuranta voi olla hyödyllistä.
Annostus munuaisten vajaatoiminnassa
Amoksisilliini eliminoituu ensisijaisesti munuaisten kautta, ja annostusta on yleensä muutettava potilailla, joilla on vaikea munuaisten vajaatoiminta (GFR Potilaat, joilla on munuaisten vajaatoiminta erityisiä suosituksia potilaille, joilla on munuaisten vajaatoiminta.
YLIANNOSTUS
Yliannostustapauksissa lopeta lääkitys, hoida oireenmukaisesti ja ryhdy tarvittaessa tukitoimenpiteisiin. Myrkytystietokeskuksessa 51 lapsipotilaalla tehty prospektiivinen tutkimus osoitti, että alle 250 mg/kg amoksisilliinin yliannostuksiin ei liity merkittäviä kliinisiä oireita1.
Oliguriseen munuaisten vajaatoimintaan johtanutta interstitiaalista nefriittiä on raportoitu potilailla amoksisilliini/klavulanaattikaliumin yliannostuksen jälkeen.
Kristalluriaa, joka joissakin tapauksissa johtaa munuaisten vajaatoimintaan, on raportoitu myös amoksisilliinin/klavulanaattikaliumin yliannostuksen jälkeen aikuisilla ja lapsipotilailla. Yliannostustapauksissa tulee jatkaa riittävää nesteen saantia ja diureesia amoksisilliini/klavulanaattikaliumkristallurian riskin vähentämiseksi. Munuaisten vajaatoiminta näyttää palautuvan, kun lääkkeen anto lopetetaan. Korkeat veren pitoisuudet voivat ilmaantua helpommin potilailla, joilla on munuaisten vajaatoiminta, koska amoksisilliini/klavulanaattikaliumin munuaispuhdistuma on heikentynyt. Amoksisilliini/klavulanaattikalium voidaan poistaa verenkierrosta hemodialyysillä. [katso ANNOSTELU JA HALLINNOINTI ]
VASTA-AIHEET
Vakavat yliherkkyysreaktiot
AUGMENTIN on vasta-aiheinen potilailla, joilla on ollut vakavia yliherkkyysreaktioita (esim. anafylaksia tai Stevens-Johnsonin oireyhtymä) amoksisilliinille, klavulanaatille tai muille beetalaktaamilääkkeille (esim. penisilliinit ja kefalosporiinit).
Kolestaattinen keltaisuus / maksan toimintahäiriö
AUGMENTIN 250 mg on vasta-aiheinen potilailla, joilla on aiemmin ollut AUGMENTINiin liittyvää kolestaattista keltaisuutta / maksan toimintahäiriötä.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
AUGMENTIN on antibakteerinen lääke. [katso Mikrobiologia ]
Farmakokinetiikka
Amoksisilliinin ja klavulanaattikaliumin farmakokineettiset parametrit normaaleissa aikuisissa AUGMENTIN 250 mg tablettien antamisen jälkeen on esitetty taulukossa 3 ja AUGMENTIN 250 mg jauheena oraalisuspensiota ja purutabletteja varten taulukossa 4.
Suun kautta annettaessa 5 ml 250 mg/5 ml AUGMENTIN-suspensiota tai vastaava annos 10 ml 125 mg/5 ml AUGMENTIN-suspensiota saa aikaan keskimääräiset huippupitoisuudet seerumissa noin tunnin kuluttua amoksisilliinin ja 1,6 ml:n annostelusta 6,9 mikrogrammaa/ml. /ml klavulaanihapolle. Seerumin pitoisuuskäyrien alla saadut pinta-alat ensimmäisten 4 tunnin aikana annostelun jälkeen olivat 12,6 mcg*h/ml amoksisilliinille ja 2,9 mcg*h/ml klavulaanihapolle, kun 5 ml 250 mg/5 ml AUGMENTIN-suspensiota tai vastaava annos Normaalille aikuiselle annettiin 10 ml 125 mg/5 ml AUGMENTIN-suspensiota. Yksi 250 mg:n AUGMENTIN-purutabletti tai kaksi 125 mg:n AUGMENTIN-purutablettia vastaavat 5 ml:aa 250 mg/5 ml:n AUGMENTIN-suspensiota ja tarjoavat samanlaiset amoksisilliini- ja klavulaanihappopitoisuudet seerumissa.
Amoksisilliinin seerumipitoisuudet, jotka saavutetaan AUGMENTIN 250 mg:lla, ovat samankaltaisia kuin ne, jotka saadaan annettaessa suun kautta vastaavia annoksia amoksisilliinia yksinään. Amoksisilliinin pienimmän estävän pitoisuuden 1 mikrog/ml ylittävän ajan on osoitettu olevan samanlainen AUGMENTIN 250 mg:n vastaavien 12 tunnin ja 8 tunnin välein annettujen annostusohjelmien jälkeen aikuisilla ja lapsilla.
Imeytyminen
Amoksisilliinin farmakokinetiikkaan annettaessa paaston tai ruokailun yhteydessä on vain vähän vaikutusta. Vaikka AUGMENTIN voidaan antaa aterioista riippumatta, klavulanaattikaliumin imeytyminen ruoan kanssa otettuna on suurempi kuin paasto. Yhdessä tutkimuksessa klavulanaatin suhteellinen hyötyosuus pieneni, kun AUGMENTIN annettiin 30 ja 150 minuuttia runsaan rasvaisen aamiaisen alkamisen jälkeen.
Jakelu
Kumpikaan AUGMENTINin komponenteista ei ole voimakkaasti proteiinisitoutunut; klavulaanihappo sitoutuu noin 25 % ihmisen seerumiin ja amoksisilliini noin 18 %. Amoksisilliini diffundoituu helposti useimpiin kehon kudoksiin ja nesteisiin aivo- ja selkäydinnesteitä lukuun ottamatta.
Kaksi tuntia AUGMENTIN 500 mg:n suspension kerta-annoksen 35 mg/kg oraalisen annon jälkeen paastolapsille havaittiin keskikorvan effuusioissa 3 mikrog/ml amoksisilliinia ja 0,5 mcg/ml klavulaanihappoa.
Aineenvaihdunta ja erittyminen
Amoksisilliinin puoliintumisaika suun kautta annetun AUGMENTIN 125 mg:n jälkeen on 1,3 tuntia ja klavulaanihapon puoliintumisaika on 1 tunti.
Noin 50-70 % amoksisilliinista ja noin 25-40 % klavulaanihaposta erittyy muuttumattomana virtsaan ensimmäisten 6 tunnin aikana yhden 250 mg:n tai 500 mg:n AUGMENTIN-tabletin annon jälkeen.
Mikrobiologia
Amoksisilliini on puolisynteettinen antibiootti, jolla on in vitro bakterisidinen vaikutus grampositiivisiin ja gramnegatiivisiin bakteereihin. Amoksisilliini on kuitenkin herkkä beetalaktamaasien hajoamiselle, ja siksi aktiivisuuskirjo ei sisällä näitä entsyymejä tuottavia organismeja. Klavulaanihappo on beetalaktaami, joka on rakenteellisesti sukua penisilliineille ja jolla on kyky inaktivoida joitain beetalaktamaasientsyymejä, joita esiintyy yleisesti penisilliineille ja kefalosporiineille vastustuskykyisissä mikro-organismeissa. Erityisesti sillä on hyvä aktiivisuus kliinisesti tärkeitä plasmidivälitteisiä beetalaktamaaseja vastaan, jotka ovat usein vastuussa siirtyneestä lääkeresistenssistä.
AUGMENTINin amoksisilliinin ja klavulaanihapon formulaatio suojaa amoksisilliinia joidenkin beetalaktamaasientsyymien aiheuttamalta hajoamiselta ja laajentaa amoksisilliinin antibioottikirjon sisältämään monia bakteereja, jotka normaalisti ovat resistenttejä amoksisilliinille.
Amoksisilliini/klavulaanihapon on osoitettu olevan aktiivinen useimpia seuraavien bakteerien isolaatteja vastaan sekä in vitro että kliinisissä infektioissa, kuten kohdassa KÄYTTÖAIHEET ja KÄYTTÖ on kuvattu.
Gram-positiiviset bakteerit
Staphylococcus aureus
Gram-negatiiviset bakteerit
Enterobakteerilajit Escherichia coli Haemophilus influenzae Klebsiella-lajit Moraxella catarrhalis
Seuraavat in vitro -tiedot ovat saatavilla, mutta niiden kliinistä merkitystä ei tunneta . Vähintään 90 prosentilla seuraavista bakteereista on in vitro -minimi estävä pitoisuus (MIC), joka on pienempi tai yhtä suuri kuin amoksisilliini/klavulaanihapon herkkä raja-arvo. Kuitenkin amoksisilliini/klavulaanihapon teho näiden bakteerien aiheuttamien kliinisten infektioiden hoidossa ei ole ollut riittävissä ja hyvin kontrolloiduissa kliinisissä tutkimuksissa.
Gram-positiiviset bakteerit
Enterococcus faecalis Staphylococcus epidermidis Staphylococcus saprophyticus Streptococcus pneumoniae Streptococcus pyogenes Viridans ryhmä Streptococcus
Gram-negatiiviset bakteerit
Eikenellacorrodens Proteus mirabilis
Anaerobiset bakteerit
Bacteroides-lajit mukaan lukien Bacteroides fragilis Fusobacterium-lajit Peptostreptococcus-lajit
Herkkyystestimenetelmät
Kliinisen mikrobiologian laboratorion tulee mahdollisuuksien mukaan toimittaa lääkärille paikallisissa sairaaloissa käytettävien mikrobilääkkeiden in vitro -herkkyystestien tulokset määräaikaisraportteina, jotka kuvaavat sairaalassa ja yhteisössä hankittujen patogeenien herkkyysprofiilia. Näiden raporttien pitäisi auttaa lääkäriä valitsemaan antibakteerinen lääkevalmiste hoitoa varten.
Laimennustekniikat
Kvantitatiivisia menetelmiä käytetään antimikrobisten vähimmäisinhibitoristen pitoisuuksien (MIC) määrittämiseen. Nämä MIC-arvot antavat arvioita bakteerien herkkyydestä antimikrobisille yhdisteille. MIC-arvot on määritettävä käyttämällä standardoitua testimenetelmää2,3 (liemi ja/tai agar). MIC-arvot tulee tulkita taulukossa 5 annettujen kriteerien mukaisesti.
Diffuusiotekniikat
Kvantitatiiviset menetelmät, jotka edellyttävät vyöhykkeiden halkaisijoiden mittaamista, voivat myös tarjota toistettavia arvioita bakteerien herkkyydestä antimikrobisille yhdisteille. Vyöhykkeen koko antaa arvion bakteerien herkkyydestä antimikrobisille yhdisteille. Vyöhykkeen koko on määritettävä standardoidulla testimenetelmällä3,4. Tässä menetelmässä käytetään paperikiekkoja, jotka on kyllästetty 30 mikrogrammalla amoksisilliini/klavulaanihappoa (20 mikrogrammaa amoksisilliinia plus 10 mikrogrammaa klavulaanihappoa) testaamaan bakteerien herkkyyttä amoksisilliini/klavulaanihapolle. Levyjen diffuusion tulkintakriteerit on esitetty taulukossa 5.
Laadunvalvonta
Standardoidut herkkyystestimenetelmät edellyttävät laboratoriokontrollien käyttöä määrityksessä käytettyjen tarvikkeiden ja reagenssien tarkkuuden ja tarkkuuden sekä testin suorittavien henkilöiden tekniikoiden valvomiseksi ja varmistamiseksi2,3,4. Tavallisen amoksisilliini/klavulaanihappojauheen tulee antaa seuraavat taulukossa 6 mainitut MIC-arvot diffuusiotekniikalle, jossa käytetään 30 mikrogrammaa amoksisilliini/klavulaanihappoa (20 mikrogrammaa amoksisilliinia plus 10 mikrogrammaa klavulaanihappoa), taulukon 6 kriteerit tulee saavuttaa .
Kliiniset tutkimukset
Alahengitysteiden ja monimutkaiset virtsatieinfektiot
Tiedot kahdesta keskeisestä tutkimuksesta 1 191 potilaalla, joita hoidettiin joko alempien hengitystieinfektioiden tai komplisoituneiden virtsatieinfektioiden vuoksi, verrattiin 875 mg:n AUGMENTIN-tabletteja 12 tunnin välein 500 mg:n AUGMENTIN 125 mg:n tabletteihin 8 tunnin välein (584 ja 607 potilasta, vastaavasti). ). Vertailukelpoinen teho osoitettiin 12 tunnin ja 8 tunnin välein annettujen annosteluohjelmien välillä. Kussakin ryhmässä ei ollut merkittävää eroa haittatapahtumien prosenttiosuudessa. Yleisin raportoitu haittatapahtuma oli ripuli; ilmaantuvuus oli samanlainen 875 mg 12 tunnin välein ja 500 mg 8 tunnin välein (15 % ja 14 %, vastaavasti); kuitenkin tilastollisesti merkitsevä ero (p
Yhdessä näistä keskeisistä tutkimuksista satunnaistettiin potilaat, joilla oli joko pyelonefriitti (n = 361) tai monimutkainen virtsatieinfektio (eli potilaat, joilla oli virtsateiden poikkeavuuksia, jotka altistavat bakteriurian uusiutumiseen hävittämisen jälkeen, n = 268) (1: 1) saada joko 875 mg AUGMENTIN 125 mg tabletteja 12 tunnin välein (n = 308) tai 500 mg AUGMENTIN tabletteja 8 tunnin välein (n = 321).
Bakteriologisesti arvioitavissa olevien potilaiden määrä oli vertailukelpoinen näiden kahden annostusohjelman välillä. AUGMENTIN 250 mg tuotti vertailukelpoisia bakteriologisia onnistumisprosentteja potilailla, jotka arvioitiin 2–4 päivää välittömästi hoidon päättymisen jälkeen. Bakteriologinen tehokkuus oli vertailukelpoinen yhdellä seurantakäynnillä (5–9 päivää hoidon jälkeen) ja myöhäisellä hoidon jälkeisellä käynnillä (useimmissa tapauksissa tämä oli 2–4 viikkoa hoidon jälkeen), kuten taulukosta näkyy. 7.
Kuten aiemmin todettiin, vaikka haittatapahtumien prosenttiosuudessa ei ollut merkitsevää eroa kussakin ryhmässä, oli tilastollisesti merkitsevä ero vaikean ripulin tai ripulin aiheuttamien vieroitusten määrässä eri hoito-ohjelmien välillä.
Akuutti bakteeriperäinen välikorvatulehdus ja ripuli lapsipotilailla
Yksi yhdysvaltalainen/kanadalainen kliininen tutkimus suoritettiin, jossa verrattiin 45/6,4 mg/kg/vrk (jaettuna 12 tunnin välein) AUGMENTINiä 10 päivän ajan ja 40/10 mg/kg/vrk (jaettuna 8 tunnin välein) AUGMENTINiä 10 päivän ajan. akuutin välikorvatulehduksen hoitoon. Tässä kokeessa käytettiin vain suspensioformulaatioita. Mukaan otettiin yhteensä 575 lapsipotilasta (ikä 2 kk - 12 vuotta), jakauma tasaisesti kahden hoitoryhmän kesken ja vertailukelpoinen määrä potilaita oli arvioitavissa (eli ³ 84 %) hoitoryhmää kohden. Välikorvantulehdukseen soveltuvia kriteerejä vaadittiin kelpoisuusvaatimuksia varten, ja hoidon ja seurannan lopussa havaittiin vahva korrelaatio näiden kriteerien ja lääkärin kliinisen vasteen arvioinnin välillä. Kliinisen tehon osuudet hoitokäynnin lopussa (määritelty 2-4 päivää hoidon päättymisen jälkeen) ja seurantakäynnillä (määritelty 22 28 päivää hoidon päättymisen jälkeen) olivat vertailukelpoisia kahdessa hoitoryhmässä, ja seuraavat seikat olivat arvioitaville potilaille saadut paranemisasteet: Hoidon lopussa 87 % (n = 265) ja 82 % (n = 260) 45 mg/kg/vrk 12 tunnin välein ja 40 mg/kg/vrk 8 tunnin välein. . Seurannassa 67 % (n = 249) ja 69 % (n = 243) 45 mg/kg/vrk 12 tunnin välein ja 40 mg/kg/vrk 8 tunnin välein.
Ripuli määriteltiin joko: (a) 3 tai enemmän vetistä ulostetta tai 4 tai useampaa löysää/vetistä ulostetta yhden päivän aikana; TAI (b) 2 vetistä ulostetta päivässä tai 3 löysää/vetistä ulostetta päivässä 2 peräkkäisenä päivänä. Ripulin ilmaantuvuus oli merkittävästi pienempi potilailla, jotka saivat 12 tunnin välein, verrattuna potilaisiin, jotka saivat 8 tunnin välein (14 % ja 34 %, vastaavasti). Lisäksi potilaiden määrä, joilla oli joko vaikea ripuli tai jotka lopetettiin ripulin vuoksi, oli merkittävästi pienempi joka 12 tunnin hoitoryhmässä (3 % ja 8 % joka 12 tunnin/10 päivän välein ja 8 tunnin välein 10 päivän välein). ). 12 tunnin välein hoidetusta ryhmästä poistettiin 3 potilasta (1 %) allergisen reaktion vuoksi, kun taas 1 potilas 8 tunnin välein hoidetusta ryhmästä poistettiin tästä syystä. Potilaiden määrä, joilla oli vaippaalueen kandidoositulehdus, oli 4 % ja 6 % 12 tunnin välein ja 8 tunnin välein.
Ei tiedetä, voidaanko havaita tilastollisesti merkitsevä ripulin väheneminen 12 tunnin välein annetuilla oraalisilla suspensioilla verrattuna 8 tunnin välein annosteltuihin suspensioihin ekstrapoloida purutabletteihin. Mannitolin esiintyminen purutableteissa voi vaikuttaa erilaiseen ripuliprofiiliin. 12 tunnin välein annettavat oraaliset suspensiot (200 mg/5 ml ja 400 mg/5 ml) makeutetaan aspartaamilla.
POTILASTIEDOT
Potilaille tulee kertoa, että AUGMENTIN voidaan ottaa 8 tunnin tai 12 tunnin välein määrätystä annoksesta riippuen. Jokainen annos tulee ottaa aterian tai välipalan yhteydessä ruoansulatuskanavan häiriöiden mahdollisuuden vähentämiseksi.
Potilaita tulee neuvoa, että antibakteerisia lääkkeitä, mukaan lukien AUGMENTIN 125 mg, tulee käyttää vain bakteeri-infektioiden hoitoon. Ne eivät hoida virusinfektioita (esim. flunssaa). Kun AUGMENTINia määrätään bakteeri-infektion hoitoon, potilaille tulee kertoa, että vaikka on yleistä, että olo paranee hoidon alussa, lääkettä tulee ottaa täsmälleen ohjeiden mukaan. Annosten väliin jättäminen tai koko hoitojakson suorittamatta jättäminen voi: (1) heikentää välittömän hoidon tehokkuutta ja (2) lisätä todennäköisyyttä, että bakteerit kehittävät resistenssiä ja että niitä ei voida hoitaa AUGMENTIN 250 mg:lla tai muilla antibakteerisilla lääkkeillä tulevaisuudessa. .
Potilaita neuvotaan, että ripuli on yleinen bakteerilääkkeiden aiheuttama ongelma, ja se yleensä loppuu, kun antibakteerinen lääke lopetetaan. Joskus bakteerilääkehoidon aloittamisen jälkeen potilaille voi kehittyä vetisiä ja verisiä ulosteita (vatsakouristuksella ja kuumeella tai ilman) jopa 2 kuukautta tai enemmän sen jälkeen, kun he ovat ottaneet viimeisen antibakteerisen annoksen. Jos ripuli on vakava tai kestää yli 2 tai 3 päivää, potilaiden tulee ottaa yhteyttä lääkäriin.
Potilaita tulee neuvoa pitämään suspensio jääkaapissa. Ravista hyvin ennen käyttöä. Kun annat lapselle AUGMENTIN 125 mg:n suspensiota (nestettä), käytä annoslusikkaa tai lääketiputinta. Muista huuhdella lusikka tai tippa jokaisen käyttökerran jälkeen. AUGMENTIN-suspensiopullot voivat sisältää enemmän nestettä kuin tarvitaan. Noudata lääkärisi ohjeita käytettävästä määrästä ja lapsesi tarvitsemista hoitopäivistä. Hävitä käyttämättömät lääkkeet.
Potilaiden tulee olla tietoisia siitä, että AUGMENTIN 125 mg sisältää penisilliiniluokan lääkevalmistetta, joka voi aiheuttaa allergisia reaktioita joillekin henkilöille.
