Omnicef 300mg Cefdinir Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Omnicef on ja miten sitä käytetään?
Omnicef (cefdinir) on kefalosporiiniantibiootti, jota käytetään monien erityyppisten bakteerien aiheuttamien infektioiden hoitoon. Tuotemerkki Omnicef on lopetettu Yhdysvalloissa Omnicef on saatavana yleisessä muodossa.
Mitkä ovat Omnicefin sivuvaikutukset?
Omnicef 300mg:n yleisiä sivuvaikutuksia ovat:
- ripuli,
- pahoinvointi,
- oksentelua,
- vatsakipu,
- ruoansulatushäiriöt,
- päänsärky,
- huimaus,
- vaippaihottuma pikkulapsella, joka ottaa nestemäistä kefdiniiriä,
- kutinaa tai
- ihottuma,
merkintä: Tämä luettelo ei välttämättä sisällä kaikkia mahdollisia sivuvaikutuksia.
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja OMNICEF 300mg:n ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi OMNICEFiä tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden on todistettu tai epäillään olevan bakteerin aiheuttamia.
KUVAUS
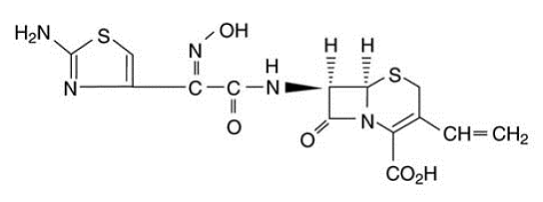
OMNICEF (kefdiniiri) kapselit ja OMNICEF (kefdiniiri) oraalisuspensiota varten sisältävät vaikuttavana aineena kefdiniiriä, laajakirjoista, puolisynteettistä kefalosporiinia suun kautta annettavaksi. Kemiallisesti kefdiniiri on [6R-[6a,7p(Z)]]-7-[[(2-amino-4-tiatsolyyli)(hydroksi-imino)asetyyli]amino]3-etenyyli-8-okso-5-tia-1 -atsabisyklo[4.2.0]okt-2-eeni-2-karboksyylihappo. Cefdinir on valkoinen tai hieman ruskeankeltainen kiinteä aine. Se liukenee heikosti laimeaan suolahappoon ja niukkaliukoiseen 0,1 M pH 7,0 fosfaattipuskuriin. Empiirinen kaava on C14H13N5O5S2 ja molekyylipaino on 395,42. Cefdinirillä on alla oleva rakennekaava:
OMNICEF 300 mg kapselit sisältävät 300 mg kefdiniiriä ja seuraavia inaktiivisia aineosia: karboksimetyyliselluloosakalsium, NF; polyoksyyli-40-stearaatti, NF; ja magnesiumstearaatti, NF. Kapselin kuoret sisältävät FD&C Blue #1; FD&C Red #40; D&C Red #28; titaanidioksidi, NF; gelatiini, NF; piidioksidi, NF; ja natriumlauryylisulfaatti, NF.
OMNICEF 300 mg oraalisuspensiota varten käyttövalmiiksi saattamisen jälkeen sisältää 125 mg kefdiniiriä 5 ml:aa kohti tai 250 mg kefdiniiriä 5 ml:aa kohti ja seuraavia inaktiivisia aineosia: sakkaroosi, NF; sitruunahappo, USP; natriumsitraatti, USP; natriumbentsoaatti, NF; ksantaanikumi, NF; guarkumi, NF; keinotekoiset mansikka- ja kermamakut; piidioksidi, NF; ja magnesiumstearaatti, NF.
INDIKAATIOT
Lääkeresistenttien bakteerien kehittymisen vähentämiseksi ja OMNICEF 300mg:n ja muiden antibakteeristen lääkkeiden tehokkuuden ylläpitämiseksi OMNICEF 300mg -valmistetta tulee käyttää vain sellaisten infektioiden hoitoon tai ehkäisyyn, joiden todistetusti tai vahvasti epäillään olevan herkkien bakteerien aiheuttamia. Kun viljely- ja herkkyystiedot ovat saatavilla, ne tulee ottaa huomioon valittaessa tai muuttaessa antibakteerista hoitoa. Tällaisten tietojen puuttuessa paikallinen epidemiologia ja herkkyysmallit voivat vaikuttaa hoidon empiiriseen valintaan.
OMNICEF (cefdinir) -kapselit ja OMNICEF (kefdiniiri) oraalisuspensiota varten on tarkoitettu potilaiden hoitoon, joilla on lieviä tai kohtalaisia infektioita, jotka ovat aiheuttaneet nimettyjen mikro-organismien herkät kannat alla luetelluissa olosuhteissa.
Aikuiset ja nuoret
Yhteisön hankkima keuhkokuume
aiheuttaja on Haemophilus influenzae (mukaan lukien β-laktamaasia tuottavat kannat), Haemophilus parainfluenzae (mukaan lukien β-laktamaasia tuottavat kannat), Streptococcus pneumoniae (ainoastaan penisilliinille herkät kannat) ja Moraxella catarrhalis (istrainssase) Kliiniset tutkimukset ).
Kroonisen keuhkoputkentulehduksen akuutit pahenemisvaiheet
aiheuttaja on Haemophilus influenzae (mukaan lukien β-laktamaasia tuottavat kannat), Haemophilus parainfluenzae (mukaan lukien β-laktamaasia tuottavat kannat), Streptococcus pneumoniae (vain penisilliinille herkät kannat) ja Moraxella, mukaan lukien β-laktamaasia tuottavat kannat (istrainssase).
Akuutti poskiontelotulehdus
Haemophilus influenzae (mukaan lukien β-laktamaasia tuottavat kannat), Streptococcus pneumoniae (vain penisilliinille herkät kannat) ja Moraxella catarrhalis (mukaan lukien β-laktamaasia tuottavat kannat) aiheuttamat kannat.
MERKINTÄ: Lisätietoja käytöstä lapsipotilailla, katso Käyttö lapsille ja ANNOSTELU JA HALLINNOINTI .
Nielutulehdus/tonsilliitti
Streptococcus pyogenesin aiheuttama (ks Kliiniset tutkimukset ).
MERKINTÄ: Cefdinir on tehokas S. pyogenes -bakteerin hävittämisessä suunielusta. Kefdiniiriä ei ole kuitenkaan tutkittu S. pyogenes -nielutulehdus/tonsilliitti aiheuttaman reumakuumeen ehkäisyssä. Vain lihaksensisäinen penisilliinin on osoitettu olevan tehokas reumakuumeen ehkäisyssä.
Komplisoitumattomat iho- ja ihorakenteen infektiot
Staphylococcus aureus (mukaan lukien β-laktamaasia tuottavat kannat) ja Streptococcus pyogenes.
Pediatriset potilaat
Akuutti bakteeriperäinen välikorvatulehdus Haemophilus influenzae (mukaan lukien β-laktamaasia tuottavat kannat), Streptococcus pneumoniae (vain penisilliinille herkät kannat) ja Moraxella catarrhalis (mukaan lukien β-laktamaasia tuottavat kannat).
Nielutulehdus/tonsilliitti
Streptococcus pyogenesin aiheuttama (ks Kliiniset tutkimukset ).
MERKINTÄ: Cefdinir on tehokas S. pyogenes -bakteerin hävittämisessä suunielusta. Kefdiniiriä ei ole kuitenkaan tutkittu S. pyogenes -nielutulehdus/tonsilliitti aiheuttaman reumakuumeen ehkäisyssä. Vain lihaksensisäinen penisilliinin on osoitettu olevan tehokas reumakuumeen ehkäisyssä.
Komplisoitumattomat iho- ja ihorakenteen infektiot
Staphylococcus aureus (mukaan lukien β-laktamaasia tuottavat kannat) ja Streptococcus pyogenes.
ANNOSTELU JA HALLINNOINTI
(katso KÄYTTÖAIHEET JA KÄYTTÖ varten Indikoidut patogeenit )
Kapselit
Suositeltu annostus ja hoidon kesto aikuisten ja nuorten infektioiden hoitoon on kuvattu seuraavassa taulukossa. kaikkien infektioiden vuorokausiannos on 600 mg. Kerran vuorokaudessa 10 päivän ajan annostelu on yhtä tehokas kuin kahdesti päivässä annostelu. Kerran vuorokaudessa annosta ei ole tutkittu keuhkokuumeessa tai ihoinfektioissa; siksi OMNICEF-kapseleita tulee antaa kahdesti päivässä näissä infektioissa. OMNICEF-kapselit voidaan ottaa ruokailusta riippumatta.
Aikuiset ja nuoret (13-vuotiaat ja sitä vanhemmat)
Jauhe oraaliseen suspensioon
Suositeltu annostus ja hoidon kesto lapsipotilaiden infektioiden hoitoon on kuvattu seuraavassa taulukossa; kaikkien infektioiden vuorokausiannos on 14 mg/kg, enimmäisannos 600 mg vuorokaudessa. Kerran vuorokaudessa 10 päivän ajan annostelu on yhtä tehokas kuin kahdesti päivässä annostelu. Kerran vuorokaudessa annosta ei ole tutkittu ihoinfektioissa; siksi OMNICEF 300 mg oraalisuspensiota tulee antaa kahdesti päivässä tässä infektiossa. OMNICEF oraalisuspensiota varten voidaan antaa aterioista riippumatta.
Pediatriset potilaat (ikä 6 kuukautta - 12 vuotta)
OMNICEF ORAL SUSPENSIJOILLE LASTEN ANNOSTUSKAAVIO
Potilaat, joilla on munuaisten vajaatoiminta
Aikuisille potilaille, joiden kreatiniinipuhdistuma on
Kreatiniinipuhdistumaa on vaikea mitata avohoidossa. Seuraavaa kaavaa voidaan kuitenkin käyttää kreatiniinipuhdistuman (CLcr) arvioimiseen aikuisilla potilailla. Jotta arviot olisivat päteviä, seerumin kreatiniinitasojen tulee kuvastaa munuaisten toiminnan vakaan tilan tasoja.
jossa kreatiniinipuhdistuma on ml/min, ikä on vuosia, paino kilogrammoina ja seerumin kreatiniini on mg/dl.4
Seuraavaa kaavaa voidaan käyttää kreatiniinipuhdistuman arvioimiseen lapsipotilailla:
CLcr = K × kehon pituus tai pituus / seerumin kreatiniini
jossa K = 0,55 yli 1-vuotiaille lapsipotilaille5 ja 0,45 imeväisille (enintään 1-vuotiaille)6.
Yllä olevassa yhtälössä kreatiniinipuhdistuma on ml/min/1,73 m², kehon pituus tai pituus on senttimetreinä ja seerumin kreatiniini on mg/dl.
Lapsipotilaille, joiden kreatiniinipuhdistuma on
Hemodialyysipotilaat
Hemodialyysi poistaa kefdinirin elimistöstä. Kroonista hemodialyysihoitoa saavilla potilailla suositeltu aloitusannos on 300 mg tai 7 mg/kg joka toinen päivä.
Jokaisen hemodialyysikerran päätteeksi tulee antaa 300 mg (tai 7 mg/kg). Seuraavat annokset (300 mg tai 7 mg/kg) annetaan sitten joka toinen päivä.
Omnicef 300mg oraalisuspension sekoittamisohjeet
Sekoituksen jälkeen suspensio voidaan säilyttää huoneenlämpötilassa (25 °C/77 °F). Säiliö on pidettävä tiiviisti suljettuna, ja suspensiota on ravistettava hyvin ennen jokaista antoa. Suspensiota voidaan käyttää 10 päivää, minkä jälkeen käyttämättä jäänyt osa on hävitettävä.
MITEN TOIMITETAAN
OMNICEF kapselit 300 mg kefdiniiriä sisältävät laventeli- ja turkoosikapselit, joihin on painettu tuotteen nimi, ovat saatavilla seuraavasti:
60 kapselia/pullo NDC 0074-3769-60 OMNI-PAC™ -pakkaus, jossa on 3 käyttöyksikköä, 5 päivän 10 kapselin läpipainopakkaus NDC 0074-3769-30
OMNICEF 300 mg oraalisuspensiota varten on kermanvärinen jauheformulaatio, joka ohjeiden mukaisesti liuotettuna sisältää 125 mg kefdiniiriä/5 ml tai 250 mg kefdiniiriä/5 ml. Käyttövalmiiksi saatetuilla suspensioilla on kermanvärinen ja mansikan maku. Jauhetta on saatavilla seuraavasti:
125 mg/5 ml
60 ml pullot NDC 0074-3771-60 100 ml pullot NDC 0074-3771-13 250 mg/5 ml 60 ml pullot NDC 0074-6151-60 100 ml pullot NDC 0074-6151-13
Säilytä kapselit ja suspendoitumaton jauhe 25 °C:ssa (77 °F); retket sallitaan 15°-30°C (59°-86°F) [katso USP Controlled Room Temperature]. Kun oraalisuspensio on valmistettu käyttövalmiiksi, sitä voidaan säilyttää valvotussa huoneenlämmössä 10 päivää.
Valmistaja: CEPH International Corporation Carolina, Puerto Rico 00986. AbbVie Inc., North Chicago, IL 60064, USA, lisenssi: Astellas Pharma Inc. Tokio, Japani. Tarkistettu marraskuussa 2015
SIVUVAIKUTUKSET
Vastoinkäymiset
Kliiniset tutkimukset – OMNICEF-kapselit (aikuiset ja nuoret potilaat)
Kliinisissä tutkimuksissa 5 093 aikuista ja nuorta potilasta (3 841 yhdysvaltalaista ja 1 252 ulkopuolista potilasta) hoidettiin suositellulla kefdinir-kapseleiden annoksella (600 mg/vrk). Useimmat haittatapahtumat olivat lieviä ja itsestään rajoittuvia. Cefdinirin ei katsottu aiheuttavan kuolemia tai pysyviä vammoja. Sataneljäkymmentäseitsemän 5093:sta (3 %) potilaasta keskeytti lääkityksen haittatapahtumien vuoksi, jotka tutkijat uskoivat mahdollisesti, todennäköisesti tai varmasti liittyvän kefdiniirihoitoon. Hoito keskeytettiin pääasiassa ruoansulatuskanavan häiriöiden, yleensä ripulin tai pahoinvoinnin vuoksi. Yhdeksäntoista 5093:sta (0,4 %) potilaasta keskeytettiin kefdinirin antamiseen liittyvän ihottuman vuoksi.
Yhdysvalloissa seuraavien haittatapahtumien katsottiin liittyvän mahdollisesti, luultavasti tai varmasti kefdinir-kapseleihin moniannoksisissa kliinisissä tutkimuksissa (N = 3841 kefdinirillä hoidettua potilasta):
CEFDINIR KAPSELIIN LIITTYVÄT HAITTAVAPAHTUMAT YHDYSVALTAIN AIKUIS- JA NUORIPOTILAATILLE (N = 3841)
Yhdysvalloissa suoritetuissa kliinisissä tutkimuksissa havaittiin seuraavat laboratorioarvojen muutokset, joilla on mahdollista kliinistä merkitystä, riippumatta niiden suhteesta kefdiniirihoitoon:
CEFDINIR KAPSELILLA USA:ssa tehdyissä kokeissa havaittuja LABORATORIOARVOMUUTOKSIA AIKUIS- JA NUORIPOTILAATILLE (N = 3841)
Kliiniset tutkimukset – OMNICEF oraalisuspensiolle (lapsipotilaat)
Kliinisissä tutkimuksissa 2 289 lapsipotilasta (1 783 yhdysvaltalaista ja 506 muuta potilasta) hoidettiin suositellulla kefdinir-suspensioannoksella (14 mg/kg/vrk). Useimmat haittatapahtumat olivat lieviä ja itsestään rajoittuvia. Cefdinirin ei katsottu aiheuttavan kuolemia tai pysyviä vammoja. Neljäkymmentä 2289:stä (2 %) potilaasta keskeytti lääkityksen haittatapahtumien vuoksi, jotka tutkijat katsoivat mahdollisesti, todennäköisesti tai varmasti liittyneen kefdiniirihoitoon. Hoito keskeytettiin pääasiassa ruoansulatuskanavan häiriöiden, yleensä ripulin, vuoksi. Viisi 2289:stä (0,2 %) potilaasta keskeytettiin kefdinirin antamiseen liittyvän ihottuman vuoksi.
Yhdysvalloissa seuraavien haittatapahtumien katsottiin liittyvän mahdollisesti, luultavasti tai varmasti kefdinirisuspensioon useiden annoksien kliinisissä tutkimuksissa (N = 1783 kefdinirilla hoidettua potilasta):
CEFDINIR-SUSPENSIOIDEN YHDYSVALTAIN KOKEILUIHIN LIITTYVÄT HAITTATAPAHTUMAT LAPSIPOTILAISIA KOSKEVAT TAPAHTUMAT (N = 1783)a
HUOMAA: Sekä kefdiniiri- että kontrollipotilailla ripulia ja ihottumaa esiintyi enemmän nuorimmilla lapsipotilailla. Ripulin ilmaantuvuus kefdiniiriä saaneilla ≤ 2-vuotiailla potilailla oli 17 % (95/557) verrattuna 4 %:iin (51/1226) yli 2-vuotiailla potilailla. Ihottuman ilmaantuvuus (pääasiassa vaippaihottumaa nuoremmilla potilailla) oli 8 % (43/557) ≤ 2-vuotiailla potilailla verrattuna 1 %:iin (8/1226) yli 2-vuotiailla potilailla.
Yhdysvalloissa suoritetuissa kliinisissä tutkimuksissa havaittiin seuraavat laboratorioarvojen muutokset, joilla on mahdollista kliinistä merkitystä, riippumatta niiden suhteesta kefdiniirihoitoon:
LABORATORIOARVON MUUTOKSET MAHDOLLISESSA KLIINISSÄ MERKITTÄVYYDESSÄ HUOMAUTUKSIA CEFDINIR-SUSPENSIOIDEN YHTEISÖN LAPSIPOTILAIDEN KOKEISSA (N = 1783)
Markkinoinnin jälkeinen kokemus
Seuraavia haitallisia kokemuksia ja muuttuneita laboratoriokokeita, riippumatta niiden suhteesta kefdiniiriin, on raportoitu laajan markkinoille tulon jälkeisen kokemuksen aikana, alkaen Japanissa vuonna 1991 hyväksytystä kokemuksesta: sokki, anafylaksia harvoin kuolemaan johtavin tapauksin, kasvojen ja kurkunpään turvotus, tukehtumistunne, seerumitaudin kaltaiset reaktiot, sidekalvotulehdus, stomatiitti, Stevens-Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi, eksfoliatiivinen ihottuma, erythema multiforme, erythema nodosum, akuutti hepatiitti, kolestaasi, fulminantti hepatiitti, maksan vajaatoiminta, keltaisuus, lisääntynyt amylaatti, veren akuutti enterokollaasi hemorraginen paksusuolitulehdus, melena, pseudomembranoottinen paksusuolitulehdus, pansytopenia, granulosytopenia, leukopenia, trombosytopenia, idiopaattinen trombosytopeeninen purppura, hemolyyttinen anemia, akuutti hengitysvajaus, astmakohtaus, lääkkeiden aiheuttama akuutti keuhkokuume, eosinofiilinen keuhkokuume, festitiverropaattinen verenvuototaipumus, hyytymishäiriö järjestys, disseminoitu intravaskulaarinen koagulaatio, ylemmän GI-verenvuoto, peptinen haava, ileus, tajunnan menetys, allerginen vaskuliitti, mahdollinen kefdiniirin ja diklofenaakin yhteisvaikutus, sydämen vajaatoiminta, rintakipu, sydäninfarkti, kohonnut verenpaine, tahattomat liikkeet ja rabdomyolyysi.
Kefalosporiiniluokan haittatapahtumat
Seuraavia haittatapahtumia ja muuttuneita laboratoriotestejä on raportoitu kefalosporiiniluokan antibiooteille yleensä:
Allergiset reaktiot, anafylaksia, Stevens-Johnsonin oireyhtymä, erythema multiforme, toksinen epidermaalinen nekrolyysi, munuaisten vajaatoiminta, toksinen nefropatia, maksan toimintahäiriö mukaan lukien kolestaasi, aplastinen anemia, hemolyyttinen anemia, verenvuoto, väärä positiivinen testi virtsan glukoosi-, pancytopenutropenitos- ja pancytopenutropenitososiin . Pseudomembranoottisen paksusuolitulehduksen oireet voivat alkaa antibioottihoidon aikana tai sen jälkeen (ks VAROITUKSET ).
Useat kefalosporiinit ovat saaneet aikaan kohtauksia, erityisesti potilailla, joilla on munuaisten vajaatoiminta, kun annosta ei ole pienennetty (ks. ANNOSTELU JA HALLINNOINTI ja YLIANNOSTUS ). Jos lääkehoitoon liittyviä kouristuskohtauksia ilmenee, lääkkeen käyttö on lopetettava. Antikonvulsanttihoitoa voidaan antaa, jos se on kliinisesti aiheellista.
HUUMEIDEN VUOROVAIKUTUKSET
Antasidit (alumiinia tai magnesiumia sisältävät)
300 mg:n kefdiniirikapseleiden ja 30 ml:n Maalox® TC -suspension samanaikainen anto vähentää imeytymisnopeutta (Cmax) ja -astetta (AUC) noin 40 %. Cmax-arvon saavuttamiseen kuluva aika pitenee myös 1 tunnilla. Kefdinirin farmakokinetiikkaan ei ole merkittäviä vaikutuksia, jos antasidi annetaan 2 tuntia ennen kefdinirin antoa tai 2 tuntia sen jälkeen. Jos antasideja tarvitaan OMNICEF 300 mg -hoidon aikana, OMNICEF 300 mg tulee ottaa vähintään 2 tuntia ennen antasidia tai sen jälkeen.
Probenesidi
Kuten muutkin beetalaktaamiantibiootit, probenesidi estää kefdiniirin erittymistä munuaisten kautta, mikä johtaa noin kaksinkertaiseen AUC-arvoon, 54 %:n nousuun plasman kefdiniirin huippupitoisuuksissa ja 50 %:n pidentymiseen näennäisessä eliminaatiossa t½.
Rautalisät ja raudalla täydennetyt ruoat
Kefdinirin samanaikainen anto terapeuttisen rautalisän kanssa, joka sisältää 60 mg alkuainerautaa (FeSO4:na) tai vitamiineja, joihin on lisätty 10 mg alkuainerautaa, vähensi imeytymistä 80 % ja 31 %. Jos rautalisiä tarvitaan OMNICEF 300 mg -hoidon aikana, OMNICEF tulee ottaa vähintään 2 tuntia ennen tai jälkeen lisäravinteen.
Alkuaineraudalla (ensisijaisesti raudalla täydennetyt aamiaismurot) runsaasti väkevöityjen ruokien vaikutusta kefdiniirin imeytymiseen ei ole tutkittu.
Samanaikaisesti annetulla raudalla täydennetyllä äidinmaidonkorvikkeella (2,2 mg alkuainerautaa/6 unssia) ei ole merkittävää vaikutusta kefdiniirin farmakokinetiikkaan. Siksi OMNICEF oraalisuspensiota varten voidaan antaa rautapitoisen äidinmaidonkorvikkeen kanssa.
Kefdiniiriä saaneilla potilailla on raportoitu punertavia ulosteita. Monissa tapauksissa potilaat saivat myös rautaa sisältäviä tuotteita. Punertava väri johtuu imeytymättömän kompleksin muodostumisesta kefdinirin tai sen hajoamistuotteiden ja raudan välille maha-suolikanavassa.
Lääke/laboratoriotestien vuorovaikutukset
Väärä positiivinen reaktio virtsan ketoneille voi ilmetä nitroprussidia käyttävillä testeillä, mutta ei nitroferrisyanidia käyttävillä testeillä. Kefdinirin anto voi aiheuttaa väärän positiivisen reaktion virtsan glukoosille käyttämällä Clinitest®-, Benedict- tai Fehling-liuosta. On suositeltavaa käyttää entsymaattisiin glukoosioksidaasireaktioihin perustuvia glukoositestejä (kuten Clinistix® tai Tes-Tape®). Kefalosporiinien tiedetään toisinaan indusoivan positiivisen suoran Coombsin testin.
VAROITUKSET
ENNEN OMNICEF-HOIDON (CEFDINIR) ALOITTAMISTA TUTKIMUS TULEE HUOLELLISESTI TUTKISTAMINEN, ONKO POTILAS ON AIEMMIN OLLUT YLIHERKKYYSREAKTOJA DEFDIINIRIIN, MUIHIN KEFALOSPILLIIRIIN. JOS CEFDINIR ANNETAAN PENISILLIINILLE HERKKIJÄLLE POTILAILLE, VAROVAISUUTTA ON OLEVAT HUOMIOITAVAA, Sillä β-LAKTAM-ANTIBIOOTIEN RIST-YLIHERKKYYS ON DOKUMENTETTU SELKEÄSTI PENISILLIINILLE 0.-% TOIMINTAKERTOMUKSESTA. JOS ALLERGINEN REAKTIO CEFDINIRILLE ILMOITTAA, LÄÄKEMUOTO ON KESKETTÄVÄ. VAKAVAT AKUUTIT YLIHERKKYYSREAKTIOT SAATTAVAT VAATTAA EPINEFRIINILOITOA JA MUITA HÄTÄTOIMENPITEITÄ, MUKAAN LUKIEN HAPELLA, SUUNONSUOKSISET NESTEET, LASKIMEN ANTISTIMIINIT, KORTIKOOSTEROIDIT, PAINOSLIINI- JA ILMANAINEET.
Clostridium difficileen liittyvää ripulia (CDAD) on raportoitu käytettäessä lähes kaikkia antibakteerisia aineita, mukaan lukien OMNICEF, ja sen vaikeusaste voi vaihdella lievästä ripulista kuolemaan johtavaan paksusuolentulehdukseen. Hoito antibakteerisilla aineilla muuttaa paksusuolen normaalia kasvillisuutta, mikä johtaa C. difficilen liikakasvuun.
C. difficile tuottaa toksiineja A ja B, jotka edistävät CDAD:n kehittymistä. Hypertoksiinia tuottavat C. difficilen kannat lisäävät sairastuvuutta ja kuolleisuutta, koska nämä infektiot voivat olla vastustuskykyisiä antimikrobiselle hoidolle ja saattavat vaatia kolektomiaa. CDAD on otettava huomioon kaikilla potilailla, joilla on ripulia antibakteeristen lääkkeiden käytön jälkeen. Huolellinen sairaushistoria on tarpeen, koska CDAD:n on raportoitu esiintyvän yli kaksi kuukautta antibakteeristen aineiden annon jälkeen.
Jos CDAD epäillään tai varmistetaan, jatkuva antibakteerinen käyttö, joka ei ole suunnattu C. difficileä vastaan, saattaa olla tarpeen lopettaa. Asianmukainen neste- ja elektrolyyttihallinta, proteiinilisä, C. difficilen antibakteerinen hoito ja kirurginen arviointi tulee aloittaa kliinisen tarpeen mukaan.
VAROTOIMENPITEET
Kenraali
OMNICEF 300 mg:n määrääminen ilman todistettua tai vahvasti epäiltyä bakteeri-infektiota tai profylaktista indikaatiota ei todennäköisesti hyödytä potilasta ja lisää lääkeresistenttien bakteerien kehittymisen riskiä.
Kuten muidenkin laajakirjoisten antibioottien kohdalla, pitkäkestoinen hoito voi johtaa resistenttien organismien mahdolliseen ilmaantumiseen ja liikakasvuun. Potilaan huolellinen tarkkailu on välttämätöntä. Jos superinfektio ilmenee hoidon aikana, on annettava sopiva vaihtoehtoinen hoito.
Kefdiniiriä, kuten muitakin laajakirjoisia mikrobilääkkeitä (antibiootteja), tulee määrätä varoen henkilöille, joilla on aiemmin ollut paksusuolentulehdus.
Potilailla, joilla on ohimenevä tai jatkuva munuaisten vajaatoiminta (kreatiniinin puhdistuma ANNOSTELU JA HALLINNOINTI ).
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Kefdinirin karsinogeenisuutta ei ole arvioitu. Mutageenisia vaikutuksia ei havaittu bakteerien käänteismutaatiomäärityksessä (Ames) tai pistemutaatiomäärityksessä hypoksantiini-guaniinifosforibosyylitransferaasilokuksessa (HGPRT) V79 kiinanhamsterin keuhkosoluissa. Klastogeenisia vaikutuksia ei havaittu in vitro rakenteellisessa kromosomipoikkeavuusmäärityksessä kiinanhamsterin V79 keuhkosoluissa eikä in vivo mikrotumamäärityksessä hiiren luuytimessä. Rotilla kefdiniiri ei vaikuttanut hedelmällisyyteen ja lisääntymiskykyyn oraalisilla annoksilla aina 1000 mg/kg/vrk asti (70 kertaa ihmisen annos perustuen mg/kg/vrk, 11 kertaa mg/m2/vrk perusteella).
Raskaus
Teratogeeniset vaikutukset
Raskausluokka B
Kefdiniiri ei ollut teratogeeninen rotilla oraalisilla annoksilla 1000 mg/kg/vrk asti (70 kertaa ihmisannos perustuen mg/kg/vrk, 11 kertaa mg/m2/vrk perusteella) eikä kaniineilla oraalisilla annoksilla enintään 10 mg/kg/vrk. mg/kg/vrk (0,7 kertaa ihmisen annos perustuen mg/kg/vrk, 0,23 kertaa mg/m2/vrk perusteella). Kaneilla havaittiin emolle toksisuutta (painon nousun vähentyminen) suurimmalla siedetyllä annoksella 10 mg/kg/vrk ilman haitallisia vaikutuksia jälkeläisiin. Ruumiinpainon laskua esiintyi rotan sikiöillä annoksella ≥ 100 mg/kg/vrk ja rotan jälkeläisillä annoksella ≥ 32 mg/kg/vrk. Ei havaittu vaikutuksia emon lisääntymisparametreihin tai jälkeläisten eloonjäämiseen, kehitykseen, käyttäytymiseen tai lisääntymistoimintoihin.

Ei kuitenkaan ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana olevilla naisilla. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, tätä lääkettä tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Työ ja toimitus
Kefdinirin käyttöä synnytyksen ja synnytyksen aikana ei ole tutkittu.
Imettävät äidit
600 mg:n kerta-annosten antamisen jälkeen kefdiniiriä ei havaittu ihmisen äidinmaidossa.
Käyttö lapsille
Turvallisuutta ja tehoa vastasyntyneillä ja alle 6 kuukauden ikäisillä imeväisillä ei ole varmistettu. Kefdinirin käyttöä akuutin poskiontelotulehduksen hoitoon lapsipotilailla (ikä 6 kuukautta - 12 vuotta) tukevat riittävät ja hyvin kontrolloidut aikuisilla ja nuorilla tehdyt tutkimukset, aikuisten ja lasten akuutin poskiontelotulehduksen samanlainen patofysiologia sekä vertailevat farmakokineettiset tiedot lapsiväestöstä.
Geriatrinen käyttö
Teho on verrattavissa geriatrisilla potilailla ja nuoremmilla aikuisilla. Vaikka kefdiniiri on ollut hyvin siedetty kaikissa ikäryhmissä, kliinisissä tutkimuksissa geriatriset potilaat kokivat vähemmän haittavaikutuksia, mukaan lukien ripulia, kuin nuoremmat aikuiset. Annoksen muuttaminen iäkkäillä potilailla ei ole tarpeen, ellei munuaisten toiminta ole merkittävästi heikentynyt (ks ANNOSTELU JA HALLINNOINTI ).
YLIANNOSTUS
Tietoa kefdiniirin yliannostuksesta ihmisillä ei ole saatavilla. Akuutin jyrsijämyrkyllisyyden tutkimuksissa kerta-annos 5600 mg/kg ei aiheuttanut haittavaikutuksia. Muiden β-laktaamiantibioottien yliannostuksen jälkeisiä toksisia merkkejä ja oireita ovat olleet pahoinvointi, oksentelu, vatsakipu, ripuli ja kouristukset. Hemodialyysi poistaa kefdinirin elimistöstä. Tämä voi olla hyödyllistä, jos yliannostus aiheuttaa vakavan toksisen reaktion, erityisesti jos munuaisten toiminta on heikentynyt.
VASTA-AIHEET
OMNICEF (kefdiniiri) on vasta-aiheinen potilaille, jotka ovat allergisia kefalosporiiniluokan antibiooteille.
KLIININEN FARMAKOLOGIA
Farmakokinetiikka ja lääkeaineenvaihdunta
Imeytyminen
Oraalinen biologinen hyötyosuus
Plasman kefdiniirin huippupitoisuudet ilmaantuvat 2–4 tunnin kuluttua annoksesta kapselin tai suspension antamisen jälkeen. Plasman kefdiniiripitoisuudet suurenevat annoksen myötä, mutta nousut ovat vähemmän kuin suhteessa annokseen 300 mg:sta (7 mg/kg) 600 mg:aan (14 mg/kg). Kun suspensiota on annettu terveille aikuisille, kefdiniirin hyötyosuus on 120 % kapseleista. Kefdiniirikapseleiden arvioitu biologinen hyötyosuus on 21 % 300 mg:n kapseliannoksen annon jälkeen ja 16 % 600 mg:n kapseliannoksen annon jälkeen. Kefdiniirisuspension arvioitu absoluuttinen hyötyosuus on 25 %. Kefdinirin oraalisuspension vahvuus 250 mg/5 ml osoitettiin olevan bioekvivalentti 125 mg/5 ml vahvuuden kanssa terveillä aikuisilla paastoolosuhteissa.
Ruoan vaikutus
Kapseleiden kefdinirin Cmax-arvo pienenee 16 % ja AUC 10 %, kun se annetaan rasvaisen aterian yhteydessä. Aikuisilla, jotka annettiin 250 mg/5 ml oraalisuspensiota runsaan aterian yhteydessä, kefdinirin Cmax-arvo pienenee 44 % ja AUC 33 %. Näiden vähennysten suuruus ei todennäköisesti ole kliinisesti merkittävä, koska oraalisuspension turvallisuus- ja tehokkuustutkimukset lapsipotilailla on suoritettu ottamatta huomioon ruokailun määrää. Siksi kefdiniiri voidaan ottaa ruuasta riippumatta.
Cefdinir kapselit
Kefdiniirin plasmapitoisuudet ja farmakokineettisten parametrien arvot aikuisille 300 ja 600 mg:n kerta-annosten oraalisen kefdinirin jälkeen on esitetty seuraavassa taulukossa:
Plasman kefdiniirin farmakokineettisten parametrien keskiarvot (± SD) kapseleiden antamisen jälkeen aikuisille koehenkilöille
Cefdinir-suspensio
Kefdinirin plasmapitoisuudet ja farmakokineettisten parametrien arvot 7 ja 14 mg/kg kefdinirin kerta-annosten oraalisen annon jälkeen lapsipotilaille (ikä 6 kuukautta - 12 vuotta) on esitetty seuraavassa taulukossa:
Plasman kefdiniirin farmakokineettisten parametrien keskiarvo (± SD) suspension antamisen jälkeen lapsipotilaille
Useita annoksia
Kefdiniiri ei kerry plasmaan, kun sitä annetaan kerran tai kahdesti päivässä potilaille, joiden munuaisten toiminta on normaali.
Jakelu
Kefdinirin keskimääräinen jakautumistilavuus (Vdarea) aikuisilla on 0,35 l/kg (± 0,29); lapsipotilailla (ikä 6 kuukautta - 12 vuotta) cefdinir Vdarea on 0,67 l/kg (± 0,38). Kefdiniiri sitoutuu 60–70 % plasman proteiineihin sekä aikuisilla että lapsilla; sitoutuminen on riippumaton pitoisuudesta.
Ihon rakkula
Aikuisilla koehenkilöillä keskimääräiset (vaihteluvälit) kefdinirin kefdinirin enimmäispitoisuudet läpipainopakkausnesteessä olivat 0,65 (0,33-1,1) ja 1,1 (0,49-1,9) μg/ml 4-5 tuntia 300 ja 600 mg:n annosten annon jälkeen. Keskimääräiset (± SD) kuplat Cmax- ja AUC (0-∞) -arvot olivat 48 % (± 13) ja 91 % (± 18) vastaavista plasma-arvoista.
Tonsillakudos
Aikuisilla potilailla, joille tehtiin elektiivinen nielurisojen poisto, vastaavat risojen kudoksen kefdinirin mediaanipitoisuudet 4 tuntia 300 ja 600 mg:n kerta-annosten annon jälkeen olivat 0,25 (0,220,46) ja 0,36 (0,22-0,80) μg/g. Keskimääräiset nielurisojen kudospitoisuudet olivat 24 % (± 8) vastaavista plasmapitoisuuksista.
Poskiontelokudos
Aikuisilla potilailla, joille tehtiin elektiivinen poskiontelo- ja poskionteloleikkaus, poskiontelokudoksen kefdinirin mediaanipitoisuudet 4 tuntia kerta-annosten 300 ja 600 mg annon jälkeen olivat
Keuhkokudos
Aikuisilla potilailla, joille tehtiin diagnostinen bronkoskopia, kefdiniirin mediaanipitoisuudet kefdiniirissä 4 tuntia kerta-annosten 300 ja 600 mg annon jälkeen olivat 0,78 (
Keskikorvan neste
14:llä lapsipotilaalla, joilla oli akuutti bakteeriperäinen välikorvatulehdus, keskikorvan nesteen vastaavat mediaanipitoisuudet 3 tuntia kerta-annosten 7 ja 14 mg/kg annon jälkeen olivat 0,21 (
CSF
Tietoja kefdiniirin tunkeutumisesta ihmisen aivo-selkäydinnesteeseen ei ole saatavilla.
Aineenvaihdunta ja erittyminen
Kefdiniiri ei metaboloidu merkittävästi. Aktiivisuus johtuu ensisijaisesti emolääkkeestä. Kefdiniiri eliminoituu pääasiassa munuaisten kautta, ja plasman eliminaation puoliintumisaika (t½) on keskimäärin 1,7 (± 0,6) tuntia. Terveillä koehenkilöillä, joiden munuaistoiminta on normaali, munuaispuhdistuma on 2,0 (± 1,0) ml/min/kg ja näennäinen oraalinen puhdistuma on 11,6 (± 6,0) ja 15,5 (± 5,4) ml/min/kg 300 ja 600 annoksen jälkeen. -mg, vastaavasti. Keskimääräinen prosenttiosuus annoksesta muuttumattomana virtsaan on 18,4 % (± 6,4) ja 600 mg:n annoksilla 11,6 % (± 4,6). Kefdiniirin puhdistuma pienenee potilailla, joilla on munuaisten vajaatoiminta (ks Erikoispopulaatiot - Potilaat, joilla on munuaisten vajaatoiminta ).
Koska pääasiallinen eliminaatioreitti on erittyminen munuaisten kautta, annosta tulee muuttaa potilailla, joiden munuaisten toiminta on selvästi heikentynyt tai jotka saavat hemodialyysihoitoa (ks. ANNOSTELU JA HALLINNOINTI ).
Erikoispopulaatiot
Potilaat, joilla on munuaisten vajaatoiminta
Kefdiniirin farmakokinetiikkaa tutkittiin 21 aikuisella koehenkilöllä, joilla oli eriasteinen munuaisten toiminta. Kefdiniirin eliminaationopeuden, näennäisen oraalisen puhdistuman (CL/F) ja munuaispuhdistuman aleneminen oli suunnilleen verrannollinen kreatiniinipuhdistuman (CLcr) vähenemiseen. Tämän seurauksena plasman kefdiniiripitoisuudet olivat korkeammat ja säilyivät pidempään potilailla, joilla oli munuaisten vajaatoimintaa kuin niillä, joilla ei ollut munuaisten vajaatoimintaa. Koehenkilöillä, joiden CLcr oli 30-60 ml/min, Cmax ja t½ nousivat noin 2-kertaisiksi ja AUC noin 3-kertaisiksi. Potilailla, joiden CLcr ANNOSTELU JA HALLINNOINTI ).
Hemodialyysi
Kefdiniirin farmakokinetiikkaa tutkittiin 8 aikuisella hemodialyysipotilaalla. Dialyysi (kesto 4 tuntia) poisti 63 % kefdiniiristä elimistöstä ja vähensi näennäisen eliminaation t½ 16 (± 3,5) tunnista 3,2 (± 1,2) tuntiin. Annoksen muuttamista suositellaan tälle potilasryhmälle (ks ANNOSTELU JA HALLINNOINTI ).
Maksasairaus
Koska kefdiniiri eliminoituu pääasiassa munuaisten kautta eikä metaboloitu merkittävästi, tutkimuksia potilailla, joilla on maksan vajaatoiminta, ei ole tehty. Ei odoteta, että annoksen muuttamista tarvitaan tässä populaatiossa.
Geriatriset potilaat
Iän vaikutusta kefdiniirin farmakokinetiikkaan 300 mg:n kerta-annoksen jälkeen arvioitiin 32:lla 19–91-vuotiaalla henkilöllä. Systeeminen kefdiniirialtistus suureni huomattavasti vanhemmilla koehenkilöillä (N = 16), Cmax 44 % ja AUC 86 %. Tämä kasvu johtui kefdiniirin puhdistuman pienenemisestä. Myös näennäinen jakautumistilavuus pieneni, joten näennäisessä eliminaation t½:ssä ei havaittu merkittäviä muutoksia (vanhukset: 2,2 ± 0,6 tuntia vs. nuoret: 1,8 ± 0,4 tuntia). Koska kefdiniirin puhdistuman on osoitettu liittyvän ensisijaisesti munuaisten toiminnan muutoksiin iän sijaan, iäkkäiden potilaiden annostusta ei tarvitse muuttaa, ellei heillä ole selvästi heikentynyt munuaisten toiminta (kreatiniinipuhdistuma Potilaat, joilla on munuaisten vajaatoiminta, edellä ).
Sukupuoli ja rotu
Kliinisen farmakokinetiikan meta-analyysin tulokset (N = 217) osoittivat, ettei sukupuolella tai rodulla ollut merkittävää vaikutusta kefdiniirin farmakokinetiikkaan.
Mikrobiologia
Toimintamekanismi
Kuten muidenkin kefalosporiinien, kefdinirin bakterisidinen vaikutus johtuu soluseinän synteesin estämisestä. Kefdiniiri on stabiili joidenkin, mutta ei kaikkien, β-laktamaasientsyymien läsnä ollessa. Tämän seurauksena monet penisilliineille ja joillekin kefalosporiineille resistentit organismit ovat herkkiä kefdiniirille.
Vastustusmekanismi
Resistenssi kefdiniirille johtuu pääasiassa joidenkin β-laktamaasien hydrolyysistä, penisilliiniä sitovien proteiinien (PBP) muuttamisesta ja heikentyneestä läpäisevyydestä. Kefdiniiri ei ole aktiivinen useimpia Enterobacter spp.-, Pseudomonas spp.-, Enterococcus spp.-, penisilliiniresistenttejä streptokokkeja ja metisilliiniresistenttejä stafylokokkeja vastaan. β-laktamaasinegatiiviset, ampisilliiniresistentit (BLNAR) H. influenzae -kannat eivät tyypillisesti ole herkkiä kefdiniirille.
Antimikrobinen aktiivisuus
Kefdinirin on osoitettu olevan aktiivinen useimpia seuraavien mikro-organismien kantoja vastaan sekä in vitro että kliinisissä infektioissa, kuten kohdassa on kuvattu KÄYTTÖAIHEET JA KÄYTTÖ .
Gram-positiiviset bakteerit
Staphylococcus aureus (vain metisilliinille herkät kannat) Streptococcus pneumoniae (vain penisilliinille herkät kannat) Streptococcus pyogenes
Gram-negatiiviset bakteerit
Haemophilus influenzae Haemophilus parainfluenzae Moraxella catarrhalis
Seuraavat in vitro -tiedot ovat saatavilla, mutta niiden kliinistä merkitystä ei tunneta.
Kefdinirin in vitro -vähintään inhiboiva pitoisuus (MIC) on 1 mcg/ml tai vähemmän (≥ 90 %) seuraavien mikro-organismien kantoja vastaan; kefdinirin turvallisuutta ja tehokkuutta näiden mikro-organismien aiheuttamien kliinisten infektioiden hoidossa ei kuitenkaan ole osoitettu riittävissä ja hyvin kontrolloiduissa kliinisissä tutkimuksissa.
Gram-positiiviset bakteerit
Staphylococcus epidermidis (vain metisilliinille herkät kannat) Streptococcus agalactiae Viridans-ryhmän streptokokit
Gram-negatiiviset bakteerit
Citrobacter koseri Escherichia coli Klebsiella pneumoniae Proteus mirabilis
Herkkyystestimenetelmät
Kliinisen mikrobiologian laboratorion tulee toimittaa säännöllisin väliajoin raportteja, jotka kuvaavat mahdollisten sairaalasta ja yhteisöstä hankittujen patogeenien alueellista/paikallista herkkyysprofiilia, mikäli mahdollista. Näiden raporttien pitäisi auttaa lääkäriä valitsemaan antibakteerinen lääke hoitoon.
Laimennustekniikat
Kvantitatiivisia menetelmiä käytetään antimikrobisten vähimmäisinhibitoristen pitoisuuksien (MIC) määrittämiseen. Nämä MIC-arvot antavat arvioita bakteerien herkkyydestä antimikrobisille yhdisteille. MIC-arvot on määritettävä käyttämällä standardisoitua testimenetelmää1 (liemi ja/tai agar). MIC-arvot tulee tulkita taulukossa 1 annettujen kriteerien mukaisesti.
Diffuusiotekniikat
Kvantitatiiviset menetelmät, jotka edellyttävät vyöhykkeiden halkaisijoiden mittaamista, tarjoavat myös toistettavia arvioita bakteerien herkkyydestä antimikrobisille yhdisteille. Vyöhykkeen koko tulee määrittää standardoidulla menetelmällä.2 Toimenpiteessä käytetään 5 mikrogrammalla kefdiniiriä kyllästettyjä paperilevyjä bakteerien herkkyyden testaamiseen. Levyn diffuusion tulkintakriteerit on esitetty taulukossa 1.
Stafylokokkien herkkyys kefdiniirille voidaan päätellä penisilliinin ja joko kefoksitiinin tai oksasilliinin testaamisesta. Stafylokokit, jotka ovat herkkiä oksasilliinille (kefoksitiinille), voidaan katsoa olevan herkkiä kefdiniirille.3
"Herkkä"-raportti osoittaa, että mikrobilääkkeet todennäköisesti estävät patogeenin kasvua, jos antimikrobinen yhdiste saavuttaa tartuntakohdassa tarvittavat pitoisuudet patogeenin kasvun estämiseksi. "Keskitaso"-raportti osoittaa, että tulosta on pidettävä epäselvänä, ja jos mikro-organismi ei ole täysin herkkä vaihtoehtoisille, kliinisesti toteuttamiskelpoisille lääkkeille, testi on toistettava. Tämä kategoria tarkoittaa mahdollista kliinistä soveltuvuutta kehon kohteisiin, joissa lääke on fysiologisesti keskittynyt tai tilanteissa, joissa voidaan käyttää suuria lääkeannoksia. Tämä kategoria tarjoaa myös puskurivyöhykkeen, joka estää pieniä hallitsemattomia teknisiä tekijöitä aiheuttamasta suuria tulkintaeroja. "Resistant"-raportti osoittaa, että antimikrobinen aine ei todennäköisesti estä patogeenin kasvua, jos antimikrobinen yhdiste saavuttaa pitoisuudet, jotka ovat tavallisesti saavutettavissa infektiokohdassa; tulee valita muu hoitomuoto.
Laadunvalvonta
Standardoidut herkkyystestimenetelmät edellyttävät laboratoriokontrollien käyttöä määrityksessä käytettyjen tarvikkeiden ja reagenssien tarkkuuden ja tarkkuuden sekä testin suorittavan henkilön tekniikoiden valvomiseksi ja varmistamiseksi.1,2,3 Vakiokefdiniirijauheen tulee tarjota seuraava alue MIC-arvoista, kuten taulukossa 2 on mainittu. Diffuusiotekniikassa, jossa käytetään 5 mikrogramman levyä, tulisi saavuttaa taulukon 2 kriteerit.
Kliiniset tutkimukset
Yhteisön hankkima bakteerikeuhkokuume
Yhdysvalloissa suoritetussa kontrolloidussa kaksoissokkotutkimuksessa aikuisilla ja nuorilla kefdiniiriä kahdesti päivässä verrattiin kefakloriin 500 mg kolme kertaa päivässä. Käyttämällä tiukkoja arvioitavuutta ja mikrobiologisia/kliinisiä vastekriteereitä 6-14 päivää hoidon jälkeen saatiin seuraavat kliiniset paranemisasteet, oletetut mikrobiologiset hävitysasteet ja tilastolliset tulokset:
Yhdysvaltain yhteisössä hankittu keuhkokuumetutkimus Cefdinir vs Cefaclor
Toisessa kontrolloidussa, tutkija-sokkotutkimuksessa aikuisilla ja nuorilla, jotka suoritettiin pääasiassa Euroopassa, kefdiniiriä kahdesti vuorokaudessa verrattiin amoksisilliini/klavulanaattiin 500/125 mg kolme kertaa vuorokaudessa. Käyttämällä tiukkoja arvioitavuuden ja kliinisen vasteen kriteerejä 6–14 päivää hoidon jälkeen saatiin seuraavat kliiniset paranemisasteet, oletetut mikrobiologiset hävitysasteet ja tilastolliset tulokset:
Euroopan yhteisön hankkima keuhkokuumetutkimus Cefdinir vs amoksisilliini/klavulanaatti
Streptokokki-nielutulehdus/tonsilliitti
Neljässä Yhdysvalloissa tehdyssä kontrolloidussa tutkimuksessa kefdiniiriä verrattiin 10 päivän penisilliiniin aikuisilla, nuorilla ja lapsipotilailla. Kahdessa tutkimuksessa (toisessa aikuisilla ja nuorilla ja toisessa lapsipotilailla) verrattiin 10 päivän kefdiniiriä QD tai BID penisilliiniin 250 mg tai 10 mg/kg QID. Käyttämällä tiukkoja arvioitavuutta ja mikrobiologisia/kliinisiä vastekriteereitä 5-10 päivää hoidon jälkeen saatiin seuraavat kliiniset paranemisasteet, mikrobiologiset hävitysasteet ja tilastolliset tulokset:
Nielutulehdus/tonsilliittitutkimukset Cefdinir (10 päivää) vs penisilliini (10 päivää)
Kahdessa tutkimuksessa (toisessa aikuisilla ja nuorilla, toisessa lapsipotilailla) verrattiin 5 päivää kefdiniiriä kahdesti vuorokaudessa 10 päivään penisilliiniä 250 mg tai 10 mg/kg QID. Käyttämällä tiukkoja arvioitavuutta ja mikrobiologisia/kliinisiä vastekriteereitä 4–10 päivää hoidon jälkeen saatiin seuraavat kliiniset paranemisasteet, mikrobiologiset hävitysasteet ja tilastolliset tulokset:
Nielutulehdus/tonsilliittitutkimukset Cefdinir (5 päivää) vs penisilliini (10 päivää)
VIITTEET
1. Clinical and Laboratory Standards Institute (CLSI). Aerobisesti kasvavien bakteerien antimikrobisen herkkyystestien laimennusmenetelmät; Hyväksytty standardi – kymmenes painos. CLSI Document M07-A10 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
2. Clinical and Laboratory Standards Institute (CLSI). Antimikrobisten levyjen diffuusioherkkyystestien suorituskykystandardit; Hyväksytty standardi – kahdestoista painos. CLSI Document M02-A12 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
3. Clinical and Laboratory Standards Institute (CLSI). Suorituskykystandardit antimikrobiaaliselle herkkyystestaukselle; Twenty-fifth Informational Supplement, CLSI Document M100-S25 [2015], Clinical and Laboratory Standards Institute, 950 West Valley Road, Suite 2500, Wayne, Pennsylvania 19087, USA.
4. Cockcroft DW, Gault MH. Kreatiniinipuhdistuman ennustaminen seerumin kreatiniinista. Nephron 1976;16:31-41.
5. Schwartz GJ, Haycock GB, Edelmann CM, Spitzer A. Yksinkertainen arvio glomerulusten suodatusnopeudesta lapsilla, joka on johdettu kehon pituudesta ja plasman kreatiniinista. Pediatrics 1976;58:259-63.
6. Schwartz GJ, Feld LG, Langford DJ. Yksinkertainen arvio glomerulussuodatusnopeudesta täysiaikaisilla vauvoilla ensimmäisen elinvuoden aikana. J Pediatrics 1984;104:849-54.
POTILASTIEDOT
Potilaita tulee neuvoa, että antibakteerisia lääkkeitä, mukaan lukien OMNICEF 300 mg, tulee käyttää vain bakteeri-infektioiden hoitoon. Ne eivät hoida virusinfektioita (esim. flunssaa). Kun OMNICEF 300mg on määrätty bakteeri-infektion hoitoon, potilaille tulee kertoa, että vaikka on yleistä, että olo paranee hoidon alussa, lääke tulee ottaa täsmälleen ohjeiden mukaan. Annosten väliin jättäminen tai koko hoitojakson suorittamatta jättäminen voi (1) heikentää välittömän hoidon tehokkuutta ja (2) lisätä todennäköisyyttä, että bakteerit kehittävät resistenssiä ja että niitä ei voida hoitaa OMNICEF 300 mg:lla tai muilla antibakteerisilla lääkkeillä tulevaisuudessa.
Magnesiumia tai alumiinia sisältävät antasidit häiritsevät kefdinirin imeytymistä. Jos tämäntyyppistä antasidia tarvitaan OMNICEF 300 mg -hoidon aikana, OMNICEF tulee ottaa vähintään 2 tuntia ennen antasidia tai sen jälkeen.
Rautalisät, mukaan lukien rautaa sisältävät monivitamiinit, häiritsevät kefdinirin imeytymistä. Jos rautalisiä tarvitaan OMNICEF 300 mg -hoidon aikana, OMNICEF tulee ottaa vähintään 2 tuntia ennen tai jälkeen lisäravinteen.
Raudalla täydennetty äidinmaidonkorvike ei häiritse merkittävästi kefdinirin imeytymistä. Siksi OMNICEF 300 mg oraalisuspensiota voidaan antaa rautapitoisen äidinmaidonkorvikkeen kanssa.
Diabetespotilaiden ja hoitajien tulee olla tietoisia siitä, että oraalisuspensio sisältää 2,86 g sakkaroosia teelusikallista kohden.
Ripuli on yleinen antibioottien aiheuttama ongelma, joka yleensä loppuu, kun antibioottihoito lopetetaan. Joskus antibioottihoidon aloittamisen jälkeen potilaille voi ilmaantua vetisiä ja verisiä ulosteita (vatsakouristuksella ja kuumeella tai ilman) jopa kahden tai useamman kuukauden kuluttua viimeisen antibioottiannoksen ottamisesta. Jos näin tapahtuu, potilaiden tulee ottaa yhteyttä lääkäriin mahdollisimman pian.
