Zyprexa 2.5mg, 5mg, 7.5mg, 10mg, 15mg, 20mg Olanzapine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Zyprexa 10mg on ja miten sitä käytetään?
Zyprexa on reseptilääke, jota käytetään skitsofrenian ja kaksisuuntaisen mielialahäiriön (maanisen masennuksen) oireiden hoitoon. Zyprexaa voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
- Zyprexa kuuluu lääkeluokkaan, jota kutsutaan psykoosilääkkeiksi, 2. sukupolven antimaanisiksi aineiksi.
- Ei tiedetä, onko Zyprexa turvallinen ja tehokas alle 13-vuotiaille lapsille.
Mitkä ovat Zyprexa 15mg:n mahdolliset sivuvaikutukset?
Zyprexa voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- hallitsemattomat lihasliikkeet kasvoissasi (pureskelu, huulten nykiminen, kulmien rypistäminen, kielen liike, räpyttely tai silmien liikkeet),
- puhe- tai nielemisvaikeuksia,
- turvotus käsissä tai jaloissa,
- hämmennystä,
- epätavallisia ajatuksia tai käyttäytymistä,
- hallusinaatiot,
- ajatuksia itsesi vahingoittamisesta,
- äkillinen heikkous tai huono tunne,
- kuume,
- vilunväristykset,
- kipeä kurkku,
- turvonneet ikenet,
- tuskalliset suun haavaumat,
- kipua nieltäessä,
- ihohaavat,
- vilustumisen tai flunssan oireet,
- yskä,
- tuntuu kovasti janoiselta tai kuumalta,
- kyvyttömyys virtsata,
- voimakas hikoilu,
- kuuma tai kuiva iho,
- ylävatsakipu,
- kutina,
- ruokahalun menetys,
- tumma virtsa,
- savenväriset ulosteet,
- ihon tai silmien keltaisuus (keltatauti),
- lisääntynyt jano,
- lisääntynyt virtsaaminen,
- nälkä,
- kuiva suu,
- hedelmäinen hengityksen tuoksu,
- uneliaisuus,
- näön hämärtyminen,
- painonpudotus,
- erittäin jäykät lihakset,
- korkea kuume,
- hämmennystä,
- nopeat tai epätasaiset sydämenlyönnit,
- vapina ja
- huimaus
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Zyprexan yleisimpiä sivuvaikutuksia ovat:
- painonnousu (yleisempää teini-ikäisillä),
- lisääntynyt ruokahalu,
- päänsäryt,
- huimaus,
- uneliaisuus,
- väsynyt tai levoton olo,
- ongelmia puheen tai muistin kanssa,
- vapina tai vapina,
- tunnottomuus tai pistely tunne,
- persoonallisuuden muutoksia,
- kuiva suu,
- lisääntynyt syljeneritys,
- vatsakipu,
- ummetus ja
- kipu käsissäsi tai jaloissasi
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Zyprexan mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
DEMENTIAAN LIITTYVÄÄ psykoosia sairastavien iäkkäiden potilaiden lisääntynyt kuolleisuus
Iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi ja joita hoidetaan psykoosilääkkeillä, on lisääntynyt kuolemanriski. Seitsemäntoista lumekontrolloidun tutkimuksen (modaalinen kesto 10 viikkoa) analyysit, jotka tehtiin pääasiassa potilailla, jotka käyttivät epätyypillisiä psykoosilääkkeitä, osoittivat, että lääkehoitoa saaneiden potilaiden kuolemanriski on 1,6–1,7 kertaa suurempi kuin lumelääkettä saaneiden potilaiden riski. Tyypillisen 10 viikon kontrolloidun tutkimuksen aikana kuolleisuusaste lääkehoidetuilla potilailla oli noin 4,5 % verrattuna lumeryhmässä noin 2,6 %:iin. Vaikka kuolinsyyt vaihtelivat, suurin osa kuolemista näytti olevan joko sydän- ja verisuoniperäisiä (esim. sydämen vajaatoiminta, äkillinen kuolema) tai tarttuvia (esim. keuhkokuume). Havaintotutkimukset viittaavat siihen, että kuten epätyypilliset psykoosilääkkeet, hoito tavanomaisilla psykoosilääkkeillä voi lisätä kuolleisuutta. Ei ole selvää, missä määrin havainnointitutkimuksissa havaitut havainnot lisääntyneestä kuolleisuudesta voidaan johtua psykoosilääkkeestä verrattuna joihinkin potilaiden ominaisuuksiin. ZYPREXAa (olantsapiinia) ei ole hyväksytty dementiaan liittyvän psykoosin potilaiden hoitoon [ks. VAROITUKSET JA VAROTOIMET ja POTILASTIEDOT ].
Kun käytät ZYPREXA 15 mg:aa ja fluoksetiinia yhdessä, katso myös Symbyaxin pakkausselosteen kohtaa Varoitus.
KUVAUS
ZYPREXA (olantsapiini) on tienobentsodiatsepiinien luokkaan kuuluva epätyypillinen antipsykootti. Kemiallinen nimitys on 2-metyyli-4-(4-metyyli-1-piperatsinyyli)-10H-tieno[2,3-b] [1,5]bentsodiatsepiini. Molekyylikaava on C17H20N4S, joka vastaa molekyylipainoa 312,44. Kemiallinen rakenne on:
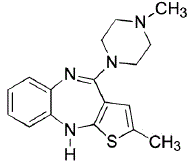
Olantsapiini on keltainen kiteinen kiinteä aine, joka on käytännössä veteen liukenematon.
ZYPREXA 7,5 mg tabletit on tarkoitettu annettavaksi vain suun kautta.
Yksi tabletti sisältää olantsapiinia, joka vastaa 2,5 mg (8 μmol), 5 mg (16 μmol), 7,5 mg (24 μmol), 10 mg (32 μmol), 15 mg (48 μmol) tai 20 mg (64 μmol). Inaktiiviset aineet ovat karnaubavaha, krospovidoni, hydroksipropyyliselluloosa, hypromelloosi, laktoosi, magnesiumstearaatti, mikrokiteinen selluloosa ja muut inaktiiviset aineet. Väripinnoite sisältää titaanidioksidia (kaikki vahvuudet), FD&C Blue No. 2 Aluminium Lake (15 mg) tai synteettistä punaista rautaoksidia (20 mg). 2,5, 5, 7,5 ja 10 mg:n tabletit on painettu syötävällä musteella, joka sisältää FD&C Blue No. 2 Aluminium Lakea.
ZYPREXA 2,5 mg ZYDIS (olantsapiinin suun kautta hajoavat tabletit) on tarkoitettu vain suun kautta annettavaksi.
Jokainen suussa hajoava tabletti sisältää olantsapiinia, joka vastaa 5 mg (16 μmol), 10 mg (32 μmol), 15 mg (48 μmol) tai 20 mg (64 μmol). Se alkaa hajota suussa muutamassa sekunnissa, jolloin sen sisältö voidaan myöhemmin niellä nesteen kanssa tai ilman. ZYPREXA 15mg ZYDIS (olantsapiini suun kautta hajoavat tabletit) sisältää myös seuraavat inaktiiviset aineosat: gelatiini, mannitoli, aspartaami, natriummetyyliparabeeni ja natriumpropyyliparabeeni.
ZYPREXA 2,5 mg Intramuscular (olantsapiini injektiota varten) on tarkoitettu vain lihaksensisäiseen käyttöön.
Kuhunkin injektiopulloon mahtuu 10 mg (32 μmol) olantsapiinia sekä inaktiivisia aineosia 50 mg laktoosimonohydraattia ja 3,5 mg viinihappoa. Kloorivetyhappoa ja/tai natriumhydroksidia on saatettu lisätä valmistuksen aikana pH:n säätämiseksi.
INDIKAATIOT
Skitsofrenia
Suun kautta otettava ZYPREXA on tarkoitettu skitsofrenian hoitoon. Teho vahvistettiin kolmessa kliinisessä tutkimuksessa aikuisilla skitsofreniapotilailla: kahdessa 6 viikon tutkimuksessa ja yhdessä ylläpitotutkimuksessa. Skitsofreniaa sairastavilla nuorilla potilailla (13–17-vuotiaat) teho vahvistettiin yhdessä 6 viikon tutkimuksessa [ks. Kliiniset tutkimukset ].
Päättäessään nuorille saatavilla olevista vaihtoehtoisista hoidoista kliinikon tulee ottaa huomioon painonnousun ja dyslipidemian lisääntynyt mahdollisuus (nuorilla aikuisiin verrattuna). Lääkäreiden tulee ottaa huomioon mahdolliset pitkän aikavälin riskit määrätessään lääkettä nuorille, ja monissa tapauksissa tämä voi saada heidät harkitsemaan muiden lääkkeiden määräämistä ensin nuorille [ks. VAROITUKSET JA VAROTOIMET ].
Kaksisuuntainen mielialahäiriö I (maaniset tai sekajaksot)
Monoterapia
Suun kautta otettava ZYPREXA on tarkoitettu I-tyypin kaksisuuntaiseen mielialahäiriöön liittyvien maanisten tai sekajaksojen akuuttiin hoitoon ja I-tyypin kaksisuuntaisen mielialahäiriön ylläpitohoitoon. Teho vahvistettiin kolmessa kliinisessä tutkimuksessa aikuispotilailla, joilla oli kaksisuuntaisen mielialahäiriön maanisia tai sekamuotoisia jaksoja: kaksi 3–4 viikkoa kestänyt tutkimusta ja yksi ylläpitohoito monoterapiatutkimuksessa. Nuorilla potilailla, joilla oli kaksisuuntaiseen mielialahäiriöön liittyviä maanisia tai sekajaksoja (13–17-vuotiaat), teho vahvistettiin yhdessä 3 viikon tutkimuksessa [ks. Kliiniset tutkimukset ].
Päättäessään nuorille saatavilla olevista vaihtoehtoisista hoidoista kliinikon tulee ottaa huomioon painonnousun ja dyslipidemian lisääntynyt mahdollisuus (nuorilla aikuisiin verrattuna). Lääkäreiden tulee ottaa huomioon mahdolliset pitkän aikavälin riskit määrätessään lääkettä nuorille, ja monissa tapauksissa tämä voi saada heidät harkitsemaan muiden lääkkeiden määräämistä ensin nuorille [ks. VAROITUKSET JA VAROTOIMET ].
Litiumia tai valproaattia täydentävä hoito
Suun kautta otettava ZYPREXA 5 mg on tarkoitettu I-tyypin kaksisuuntaiseen mielialahäiriöön liittyvien maanisten tai sekajaksojen hoitoon litiumin tai valproaatin lisänä. Teho vahvistettiin kahdessa 6 viikkoa kestäneessä kliinisessä tutkimuksessa aikuisilla. Pitkäaikaisen lisähoidon tehokkuutta ei ole arvioitu systemaattisesti kontrolloiduissa tutkimuksissa [ks. Kliiniset tutkimukset ].
Erityisiä huomioita lasten skitsofrenian ja kaksisuuntaisen mielialahäiriön I hoidossa
Lasten skitsofrenia ja kaksisuuntainen mielialahäiriö I ovat vakavia mielenterveyshäiriöitä; diagnoosi voi kuitenkin olla haastavaa. Lasten skitsofrenian oireprofiilit voivat olla vaihtelevia, ja kaksisuuntaisessa mielialahäiriössä I lapsipotilailla voi olla vaihtelevia mania- tai sekaoireita. Lasten skitsofrenian ja kaksisuuntaisen mielialahäiriön lääkitys on suositeltavaa aloittaa vasta perusteellisen diagnostisen arvioinnin ja lääkityshoitoon liittyvien riskien huolellisen harkinnan jälkeen. Sekä lasten skitsofrenian että I-tyypin kaksisuuntaisen mielialahäiriön lääkehoidon tulisi olla osa kokonaishoito-ohjelmaa, joka sisältää usein psykologisia, kasvatuksellisia ja sosiaalisia interventioita.
ZYPREXA 15 mg lihaksensisäinen: Skitsofreniaan ja I-kaksisuuntaiseen mielialahäiriöön liittyvä kiihtymys
ZYPREXA 15 mg IntraMuscular on tarkoitettu skitsofreniaan ja I-tyypin kaksisuuntaiseen mielialamaniaan liittyvän akuutin levottomuuden hoitoon.
Teho osoitettiin kolmessa lyhytaikaisessa (24 tuntia IM-hoitoa) lumekontrolloidussa tutkimuksessa kiihtyneillä aikuispotilailla, joilla oli: skitsofrenia tai kaksisuuntainen mielialahäiriö I (maaniset tai sekajaksot) [ks. Kliiniset tutkimukset ].
"Psykomotorinen agitaatio" määritellään DSM-IV:ssä "liiaiseksi motoriseksi aktiivisuudeksi, joka liittyy sisäisen jännityksen tunteeseen". Agitaatiota kokevat potilaat ilmentävät usein käyttäytymistä, joka häiritsee heidän diagnoosiaan ja hoitoaan, esim. uhkaava käyttäytyminen, lisääntyvä tai kiireellisesti ahdistava käytös tai itsensä uupuva käyttäytyminen, mikä saa kliinikot käyttämään lihaksensisäisiä antipsykoottisia lääkkeitä kiihtyneisyyden välittömän hallinnan saavuttamiseksi.
ZYPREXA ja fluoksetiini yhdistelmänä: I-kaksisuuntaiseen mielialahäiriöön liittyvät masennusjaksot
Suun kautta otettava ZYPREXA ja fluoksetiini yhdistelmänä on tarkoitettu I-tyypin kaksisuuntaiseen mielialahäiriöön liittyvien masennusjaksojen hoitoon kliinisten tutkimusten perusteella. Kun käytät ZYPREXA 10 mg:aa ja fluoksetiinia yhdessä, katso Symbyaxin pakkausselosteen Kliiniset tutkimukset -osa.
ZYPREXA-monoterapia ei ole tarkoitettu I-tyypin kaksisuuntaiseen mielialahäiriöön liittyvien masennusjaksojen hoitoon.
ZYPREXA ja fluoksetiini yhdistelmänä: Hoitoa kestävä masennus
Suun kautta otettava ZYPREXA ja fluoksetiini yhdistelmänä on tarkoitettu hoitoresistentin masennuksen hoitoon (vakava masennushäiriö potilailla, jotka eivät saa vastetta 2 erillisessä tutkimuksessa eri masennuslääkkeillä, joilla oli riittävä annos ja kesto nykyisessä jaksossa) aikuispotilailla tehtyjen kliinisten tutkimusten perusteella. . Kun käytät ZYPREXAa ja fluoksetiinia yhdessä, katso Symbyaxin pakkausselosteen Kliiniset tutkimukset -osa.
ZYPREXA 5 mg monoterapiaa ei ole tarkoitettu hoitoresistentin masennuksen hoitoon.
ANNOSTELU JA HALLINNOINTI
Skitsofrenia
Aikuiset
Annoksen valinta
Suun kautta otettava olantsapiini tulee antaa kerran vuorokaudessa aterioista riippumatta, yleensä aluksi 5–10 mg:lla ja tavoiteannoksella 10 mg/vrk useiden päivien kuluessa. Lisäannosta on tarvittaessa muutettava vähintään 1 viikon välein, koska tyypillisellä potilaalla olantsapiinin vakaa tila ei saavutettaisi noin 1 viikkoon. Kun annoksen muuttaminen on tarpeen, suositellaan 5 mg:n annoksen lisäyksiä/vähennyksiä.
Teho skitsofrenian hoidossa osoitettiin kliinisissä tutkimuksissa annosalueella 10-15 mg/vrk. Yli 10 mg/vrk annosten ei kuitenkaan osoitettu olevan tehokkaampia kuin 10 mg/vrk annos. Annoksen lisäämistä tavoiteannokseen 10 mg/vrk (eli annokseen 15 mg/vrk tai enemmän) suositellaan vasta kliinisen arvioinnin jälkeen. Olantsapiinia ei ole tarkoitettu käytettäväksi yli 20 mg/vrk annoksina.
Annostelu erityisryhmissä
Suositeltu aloitusannos on 5 mg potilailla, jotka ovat heikkokuntoisia, joilla on taipumus hypotensiivisiin reaktioihin ja joilla muutoin esiintyy yhdistelmä tekijöitä, jotka voivat hidastaa olantsapiinin metaboliaa (esim. tupakoimattomat naispotilaat ≥ 65-vuotiaat) tai jotka voivat olla farmakodynaamisesti herkempiä olantsapiinille [ks VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET , ja KLIININEN FARMAKOLOGIA ]. Annosta suurennetaan näillä potilailla tarvittaessa varoen.
Ylläpitohoito
Suun kautta otettavan olantsapiinin (10 mg/vrk - 20 mg/vrk) tehokkuus hoitovasteen ylläpitämisessä skitsofreniapotilailla, jotka olivat pysyneet vakaana ZYPREXA-hoidon aikana noin 8 viikon ajan ja joita seurattiin sitten uusiutumisen varalta, on osoitettu lumekontrolloidussa tutkimuksessa [ks. Kliiniset tutkimukset ]. Terveydenhuollon tarjoajan, joka päättää käyttää ZYPREXAa pitkiä aikoja, tulee säännöllisesti arvioida uudelleen lääkkeen pitkän aikavälin hyödyllisyys yksittäiselle potilaalle.
Nuoret
Annoksen valinta
Suun kautta otettava olantsapiini tulee antaa kerran vuorokaudessa aterioista riippumatta suositeltu aloitusannos on 2,5 tai 5 mg ja tavoiteannos 10 mg/vrk. Teho skitsofreniaa sairastavilla nuorilla osoitettiin kliinisissä tutkimuksissa joustavalla annosalueella 2,5–20 mg/vrk, jolloin keskimääräinen modaalinen annos oli 12,5 mg/vrk (keskimääräinen annos 11,1 mg/vrk). Jos annoksen muuttaminen on tarpeen, suositellaan 2,5 tai 5 mg:n annoksen lisäyksiä/pienennyksiä.
Yli 20 mg/vrk annosten turvallisuutta ja tehokkuutta ei ole arvioitu kliinisissä tutkimuksissa [katso Kliiniset tutkimukset ].
Ylläpitohoito
ZYPREXAn tehoa skitsofrenian ylläpitohoidossa nuorilla ei ole arvioitu systemaattisesti. Ylläpitoteho voidaan kuitenkin ekstrapoloida aikuisten tiedoista sekä olantsapiinin farmakokineettisten parametrien vertailuista aikuisilla ja nuorilla potilailla. Siksi yleensä suositellaan, että hoitovastetta saavien potilaiden hoitoa jatketaan akuutin vasteen jälkeen, mutta pienimmällä annoksella, joka tarvitaan remission ylläpitämiseen. Potilaat tulee säännöllisesti arvioida uudelleen ylläpitohoidon tarpeen määrittämiseksi.
Kaksisuuntainen mielialahäiriö I (maaniset tai sekajaksot)
Aikuiset
Annoksen valinta monoterapiaan
Suun kautta otettava olantsapiini tulee antaa kerran vuorokaudessa aterioista riippumatta, yleensä annoksella 10 tai 15 mg. Annosta on tarvittaessa muutettava vähintään 24 tunnin välein, mikä kuvastaa lumekontrolloitujen tutkimusten menettelyjä. Kun annoksen muuttaminen on tarpeen, suositellaan 5 mg:n annoksen lisäyksiä/vähennyksiä.
Kliinisissä tutkimuksissa osoitettiin lyhytaikainen (3–4 viikkoa) antimaaninen teho annosvälillä 5–20 mg/vrk. Yli 20 mg/vrk annosten turvallisuutta ei ole arvioitu kliinisissä tutkimuksissa [katso Kliiniset tutkimukset ].
Ylläpito Monoterapia
Kontrolloidussa tutkimuksessa osoitettiin kaksisuuntaisen mielialahäiriön I potilaiden ylläpitämisen hyöty monoterapiassa suun kautta annetulla ZYPREXA 10 mg:lla annoksella 5-20 mg/vrk sen jälkeen, kun hoitovaste oli saavutettu keskimäärin 2 viikon ajan [ks. Kliiniset tutkimukset ]. Terveydenhuollon tarjoajan, joka päättää käyttää ZYPREXAa pitkiä aikoja, tulee säännöllisesti arvioida uudelleen lääkkeen pitkän aikavälin hyödyllisyys yksittäiselle potilaalle.
Annoksen valinta lisähoitoa varten
Kun olantsapiinia annetaan litiumin tai valproaatin lisähoitona, suun kautta otettavan olantsapiinin annostelu tulee yleensä aloittaa annoksella 10 mg kerran vuorokaudessa aterioista riippumatta.
Antimaaninen teho osoitettiin kliinisissä tutkimuksissa annosalueella 5–20 mg/vrk [ks. Kliiniset tutkimukset ]. Yli 20 mg/vrk annosten turvallisuutta ei ole arvioitu kliinisissä tutkimuksissa.
Nuoret
Annoksen valinta
Suun kautta otettava olantsapiini tulee antaa kerran vuorokaudessa aterioista riippumatta suositeltu aloitusannos on 2,5 tai 5 mg ja tavoiteannos 10 mg/vrk. Teho I-tyypin kaksisuuntaista mielialahäiriötä sairastavilla nuorilla (maaniset tai sekavaiheet) osoitettiin kliinisissä tutkimuksissa joustavalla annosalueella 2,5–20 mg/vrk, jolloin keskimääräinen modaalinen annos oli 10,7 mg/vrk (keskimääräinen annos 8,9 mg/vrk). ). Jos annoksen muuttaminen on tarpeen, suositellaan 2,5 tai 5 mg:n annoksen lisäyksiä/pienennyksiä.
Yli 20 mg/vrk annosten turvallisuutta ja tehokkuutta ei ole arvioitu kliinisissä tutkimuksissa [katso Kliiniset tutkimukset ].
Ylläpitohoito
ZYPREXA 7,5 mg:n tehoa kaksisuuntaisen mielialahäiriön I ylläpitohoidossa nuorilla ei ole arvioitu. Ylläpitoteho voidaan kuitenkin ekstrapoloida aikuisten tiedoista sekä olantsapiinin farmakokineettisten parametrien vertailuista aikuisilla ja nuorilla potilailla. Siksi yleensä suositellaan, että hoitovastetta saavien potilaiden hoitoa jatketaan akuutin vasteen jälkeen, mutta pienimmällä annoksella, joka tarvitaan remission ylläpitämiseen. Potilaat tulee säännöllisesti arvioida uudelleen ylläpitohoidon tarpeen määrittämiseksi.
ZYPREXA ZYDISin (olantsapiinin suun kautta hajoavat tabletit) anto
Kuori pussin avaamisen jälkeen folio läpipainopakkauksesta. Älä työnnä tablettia folion läpi. Välittömästi läpipainopakkauksen avaamisen jälkeen poista tabletti kuivin käsin ja aseta koko ZYPREXA 15 mg ZYDIS suuhun. Tabletti hajoaa nopeasti syljessä, joten se voidaan helposti niellä nesteen kanssa tai ilman.
ZYPREXA Intra Lihas: Skitsofreniaan ja Bipolaari I -maniaan liittyvä kiihtymys
Annoksen valinta kiihtyneille aikuispotilaille, joilla on skitsofrenia ja kaksisuuntainen mieliala I mania
Lihakseen annettavan injektiona annettavan olantsapiinin teho kiihtyneisyyden hallinnassa näissä sairauksissa osoitettiin annosalueella 2,5–10 mg. Suositeltu annos näille potilaille on 10 mg. Pienempää 5 tai 7,5 mg:n annosta voidaan harkita, jos kliiniset tekijät sitä edellyttävät [katso Kliiniset tutkimukset ]. Jos levottomuus, joka vaatii lisäannoksia lihakseen, jatkuu aloitusannoksen jälkeen, voidaan antaa myöhempiä annoksia 10 mg:aan asti. Lihakseen annettavan olantsapiinin toistuvien annosten tehoa injektiota varten ei ole kuitenkaan systemaattisesti arvioitu kontrolloiduissa kliinisissä tutkimuksissa. Kliinisissä tutkimuksissa ei myöskään ole arvioitu yli 30 mg:n päivittäisten kokonaisannosten tai 10 mg:n injektioiden turvallisuutta, jotka on annettu useammin kuin 2 tuntia aloitusannoksen jälkeen ja 4 tuntia toisen annoksen jälkeen. Lihaksensisäisen olantsapiinin maksimiannostelu (esim. 3 10 mg:n annosta 2-4 tunnin välein) voi liittyä merkittävään ortostaattiseen hypotension esiintymiseen [ks. VAROITUKSET JA VAROTOIMET ]. Siksi on suositeltavaa, että potilaat, jotka tarvitsevat myöhempiä intramuskulaarisia injektioita, arvioidaan ortostaattisen hypotension varalta ennen myöhempien intramuskulaaristen olantsapiini-injektioiden antamista. Lisäannoksen antamista potilaalle, jolla on kliinisesti merkittävä systolisen verenpaineen asentomuutos, ei suositella.
Jos meneillään oleva olantsapiinihoito on kliinisesti aiheellista, suun kautta otettava olantsapiinihoito voidaan aloittaa annoksella 5-20 mg/vrk heti, kun se on kliinisesti tarkoituksenmukaista [ks. Skitsofrenia ja Kaksisuuntainen mielialahäiriö I (maaniset tai sekajaksot) ].
Lihaksensisäinen annostelu erityisryhmille
Iäkkäille potilaille tulee harkita 5 mg:n annosta/injektio tai kun muut kliiniset tekijät sitä edellyttävät. Pienempää 2,5 mg:n annosta/injektio tulee harkita potilailla, jotka muutoin voisivat olla heikkokuntoisia, alttiita hypotensiivisille reaktioille tai olla farmakodynaamisesti herkempiä olantsapiinille [ks. VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET , ja KLIININEN FARMAKOLOGIA ].
ZYPREXA Intra Muscular -valmisteen anto
ZYPREXA Intra Muscular on tarkoitettu käytettäväksi vain lihakseen. Ei saa antaa laskimoon tai ihon alle. Ruiskuta hitaasti syvälle lihasmassaan. Parenteraaliset lääkevalmisteet tulee tarkastaa silmämääräisesti hiukkasten ja värimuutosten varalta ennen antoa aina, kun liuos ja säiliö sen sallivat.
Ohjeet ZYPREXA 2,5 mg:n lihaksensisäisen ja steriilin injektioveden valmistamiseen
Liuota injektiopullon sisältö 2,1 ml:aan steriiliä injektionesteisiin käytettävää vettä, jolloin saadaan liuos, joka sisältää noin 5 mg/ml olantsapiinia. Saadun liuoksen tulee näyttää kirkkaalta ja keltaiselta. Steriiliin injektionesteisiin käytettävään veteen liuotettu lihaksensisäinen ZYPREXA 7,5 mg tulee käyttää välittömästi (1 tunnin kuluessa) käyttövalmiiksi saattamisen jälkeen. Hävitä käyttämättä jäänyt osa.
Seuraavassa taulukossa on injektiomäärät steriiliin injektionesteisiin käytettävään veteen liuotetun lihaksensisäisen olantsapiinin eri annosten antamista varten.
Fyysinen yhteensopimattomuustiedot
ZYPREXA 15 mg Intramuscular tulee saattaa käyttövalmiiksi vain steriiliin injektionesteisiin käytettävään veteen. ZYPREXA 20 mg IntraMuscular -valmistetta ei saa yhdistää ruiskuun, jossa on diatsepaami-injektio, koska näitä valmisteita sekoitettaessa esiintyy saostumista. Loratsepaami-injektiota ei tule käyttää ZYPREXA IntraMuscular -valmisteen käyttövalmiiksi saattamiseen, koska tämä yhdistelmä johtaa käyttövalmiiksi saattamisen viivästymiseen. ZYPREXA IntraMuscularia ei saa yhdistää ruiskuun haloperidoli-injektion kanssa, koska tuloksena olevan matalan pH:n on osoitettu hajottavan olantsapiinia ajan myötä.
ZYPREXA 20 mg ja fluoksetiini yhdistelmänä: I-kaksisuuntaiseen mielialahäiriöön liittyvät masennusjaksot
Kun käytät ZYPREXA 7,5 mg:aa ja fluoksetiinia yhdessä, katso myös Symbyaxin pakkausselosteen kohtaa Kliiniset tutkimukset.
Aikuiset
Suun kautta otettava olantsapiini tulee antaa yhdessä fluoksetiinin kanssa kerran vuorokaudessa illalla aterioista riippumatta, yleensä alkaen 5 mg:sta oraalista olantsapiinia ja 20 mg:lla fluoksetiinia. Annosta voidaan tarvittaessa muuttaa tehon ja siedettävyyden mukaan suun kautta otettavan olantsapiinin 5–12,5 mg ja fluoksetiinin 20–50 mg annosalueella. Masennuslääketeho osoitettiin ZYPREXA 10 mg:n ja fluoksetiinin yhdistelmällä aikuispotilailla annosalueella 6–12 mg olantsapiinia ja 25–50 mg fluoksetiinia. Yli 18 mg olantsapiiniannosten ja 75 mg fluoksetiinin yhteiskäytön turvallisuutta ei ole arvioitu kliinisissä tutkimuksissa.
Lapset ja nuoret (10-17-vuotiaat)
Suun kautta otettava olantsapiini tulee antaa yhdessä fluoksetiinin kanssa kerran vuorokaudessa illalla aterioista riippumatta, yleensä alkaen 2,5 mg:sta oraalista olantsapiinia ja 20 mg:lla fluoksetiinia. Annosta voidaan tarvittaessa muuttaa tehon ja siedettävyyden mukaan. Yli 12 mg:n olantsapiiniannosten ja 50 mg:n fluoksetiinin yhteiskäytön turvallisuutta ei ole arvioitu lapsilla tehdyissä kliinisissä tutkimuksissa.
ZYPREXAn ja fluoksetiinin yhdistelmän turvallisuus ja tehokkuus määritettiin kliinisissä tutkimuksissa, jotka tukivat Symbyaxin (ZYPREXA:n ja fluoksetiinin kiinteän annoksen yhdistelmä) hyväksyntää. Symbyaxia annostellaan välillä 3 mg/25 mg (olantsapiini/fluoksetiini) vuorokaudessa ja 12 mg/50 mg (olantsapiini/fluoksetiini) päivässä. Seuraavassa taulukossa esitetään ZYPREXA 10 mg:n ja fluoksetiinin asianmukaiset yksittäisten komponenttien annokset verrattuna Symbyaxiin. Annostusta tulee tarvittaessa muuttaa yksittäisten komponenttien kanssa tehon ja siedettävyyden mukaan.
Vaikka ei ole olemassa todisteita vastaamaan kysymykseen siitä, kuinka kauan ZYPREXAlla ja fluoksetiinilla yhdistelmähoitoa saaneen potilaan tulisi jatkaa hoitoa, on yleisesti hyväksytty, että kaksisuuntainen mielialahäiriö I, mukaan lukien kaksisuuntaiseen mielialahäiriöön I liittyvät masennusjaksot, on krooninen sairaus. kroonista hoitoa vaativa sairaus. Terveydenhuollon tarjoajan tulee ajoittain tarkastella uudelleen lääkehoidon jatkamisen tarvetta.
ZYPREXA 5 mg monoterapiaa ei ole tarkoitettu I-tyypin kaksisuuntaiseen mielialahäiriöön liittyvien masennusjaksojen hoitoon.
ZYPREXA 7,5 mg ja fluoksetiini yhdistelmänä: Hoitoon kestävä masennus
Kun käytät ZYPREXAa ja fluoksetiinia yhdessä, katso myös Symbyaxin pakkausselosteen kohtaa Kliiniset tutkimukset.
Suun kautta otettava olantsapiini tulee antaa yhdessä fluoksetiinin kanssa kerran vuorokaudessa illalla aterioista riippumatta, yleensä alkaen 5 mg:sta oraalista olantsapiinia ja 20 mg:lla fluoksetiinia. Annosta voidaan tarvittaessa muuttaa tehon ja siedettävyyden mukaan suun kautta otettavan olantsapiinin 5–20 mg ja fluoksetiinin 20–50 mg annosalueella. Masennuslääketeho osoitettiin olantsapiinin ja fluoksetiinin yhdistelmällä aikuispotilailla olantsapiinin 6-18 mg ja fluoksetiinin 25-50 mg annosalueella.
Olantsapiinin turvallisuus ja teho yhdessä fluoksetiinin kanssa määritettiin kliinisissä tutkimuksissa, jotka tukivat Symbyaxin (olantsapiinin ja fluoksetiinin kiinteän annoksen yhdistelmä) hyväksyntää. Symbyaxia annostellaan välillä 3 mg/25 mg (olantsapiini/fluoksetiini) vuorokaudessa ja 12 mg/50 mg (olantsapiini/fluoksetiini) päivässä. Yllä oleva taulukko 1 osoittaa ZYPREXA:n ja fluoksetiinin asianmukaiset yksittäisten komponenttien annokset verrattuna Symbyaxiin. Annostusta tulee tarvittaessa muuttaa yksittäisten komponenttien kanssa tehon ja siedettävyyden mukaan.
Vaikka ei ole olemassa todisteita vastaamaan kysymykseen siitä, kuinka kauan ZYPREXAlla ja fluoksetiinilla yhdistelmähoitoa saaneen potilaan tulisi jatkaa hoitoa, on yleisesti hyväksyttyä, että hoitoresistentti masennus (suuri masennushäiriö aikuisilla potilailla, jotka eivät reagoi kahteen erilliseen eri masennuslääkkeiden tutkimukset riittävän annoksen ja keston aikana nykyisessä jaksossa) on krooninen sairaus, joka vaatii kroonista hoitoa. Terveydenhuollon tarjoajan tulee ajoittain tarkastella uudelleen lääkehoidon jatkamisen tarvetta.
Yli 18 mg olantsapiiniannosten ja 75 mg fluoksetiinin yhteiskäytön turvallisuutta ei ole arvioitu kliinisissä tutkimuksissa.
ZYPREXA 7,5 mg monoterapiaa ei ole tarkoitettu hoitoresistentin masennuksen (vakava masennushäiriö potilailla, jotka eivät reagoi kahdelle riittävän annokselle ja riittävän pitkäkestoiselle masennuslääkkeelle nykyisessä jaksossa) hoitoon.
ZYPREXA 10 mg ja fluoksetiini yhdistelmänä: annostelu erityisille ryhmille
Suun kautta otettavan olantsapiinin 2,5–5 mg aloitusannosta 20 mg:n fluoksetiinin kanssa tulee käyttää potilaille, joilla on taipumus hypotensiivisille reaktioille, potilaille, joilla on maksan vajaatoiminta, tai potilaille, joilla on yhdistelmä tekijöitä, jotka voivat hidastaa olantsapiinin tai fluoksetiinin metaboliaa yhdistelmänä. (naisten sukupuoli, vanhus ikä, tupakoimattomuus) tai potilaille, jotka voivat olla farmakodynaamisesti herkkiä olantsapiinille. Annoksen muuttaminen saattaa olla tarpeen potilailla, joilla on yhdistelmä tekijöitä, jotka voivat hidastaa aineenvaihduntaa. Annosta suurennetaan näillä potilailla tarvittaessa varoen. ZYPREXAa ja fluoksetiinia yhdistelmänä ei ole tutkittu systemaattisesti yli 65-vuotiailla tai alle 10-vuotiailla potilailla [ks. VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET , ja KLIININEN FARMAKOLOGIA ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
ZYPREXA 2,5 mg, 5 mg, 7,5 mg ja 10 mg tabletit ovat valkoisia, pyöreitä, ja niihin on sinisellä painettu LILLY ja tabletin numero. 15 mg:n tabletit ovat elliptisiä, sinisiä, ja niissä on kaiverrus LILLY ja tabletin numero. 20 mg:n tabletit ovat elliptisiä, vaaleanpunaisia, ja niissä on kaiverrus LILLY ja tabletin numero. Tabletteja ei pisteytetä. Tabletit ovat saatavilla seuraavasti:
ZYPREXA 10 mg ZYDIS (olantsapiinin suun kautta hajoavat tabletit) ovat keltaisia, pyöreitä ja niissä on kaiverrus tabletin vahvuus. Tabletteja ei pisteytetä. Tabletit ovat saatavilla seuraavasti:
ZYPREXA 15 mg lihakseen on saatavana 10 mg:n injektiopullossa (1 s).
ZYPREXA 2,5 mg, 5 mg, 7,5 mg ja 10 mg tabletit ovat valkoisia, pyöreitä, ja niihin on sinisellä painettu LILLY ja tabletin numero. 15 mg:n tabletit ovat elliptisiä, sinisiä, ja niissä on kaiverrus LILLY ja tabletin numero. 20 mg:n tabletit ovat elliptisiä, vaaleanpunaisia, ja niissä on kaiverrus LILLY ja tabletin numero. Tabletit ovat saatavilla seuraavasti:
ZYPREXA 2,5 mg ZYDIS (olantsapiinin suun kautta hajoavat tabletit) ovat keltaisia, pyöreitä ja niissä on kaiverrus tabletin vahvuus. Tabletit ovat saatavilla seuraavasti:
ZYPREXA Intramuscular on saatavilla:
NDC 0002-7597-01 (nro VL7597) – 10 mg:n injektiopullo (1 s)
Varastointi ja käsittely
Säilytä ZYPREXA-tabletit, ZYPREXA ZYDIS ja ZYPREXA Intramuscular -injektiopullot (ennen käyttövalmiiksi saattamista) valvotussa huoneenlämpötilassa, 20–25 °C (68–77 °F) [ks. USP ]. Käyttövalmiiksi saatettu ZYPREXA 20 mg Intramuscular voidaan säilyttää kontrolloidussa huoneenlämmössä, 20–25 °C (68–77 °F) [ks. USP tarvittaessa enintään 1 tunti. Hävitä kaikki käyttämätön osa käyttövalmiiksi saatetusta ZYPREXA Intramuscular -valmisteesta. USP määrittelee kontrolloidun huonelämpötilan termostaattisesti ylläpidettäväksi lämpötilaksi, joka kattaa tavanomaisen ja tavanomaisen työympäristön 20° - 25°C (68° - 77°F); joka johtaa keskimääräiseen kineettiseen lämpötilaan, jonka lasketaan olevan enintään 25 °C; ja se mahdollistaa 15–30 °C:n (59–86 °F) väliset retket, jotka ovat kokeneet apteekeissa, sairaaloissa ja varastoissa.
Suojaa ZYPREXA-tabletit ja ZYPREXA ZYDIS valolta ja kosteudelta. Suojaa ZYPREXA IntraMuscular valolta, älä jäädytä.
Markkinoija: Lilly USA, LLC, Indianapolis, IN 46285, USA. Tarkistettu: lokakuuta 2019
SIVUVAIKUTUKSET
Kun käytät ZYPREXA 2,5 mg:aa ja fluoksetiinia yhdessä, katso myös Symbyaxin pakkausselosteen Haittavaikutukset-osio.
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta tai ennusta käytännössä havaittuja nopeuksia.
Kliiniset tutkimukset aikuisilla
Alla olevat tiedot olantsapiinista ovat peräisin olantsapiinia koskevasta kliinisten tutkimusten tietokannasta, joka sisältää 10 504 aikuispotilasta, jotka ovat altistuneet olantsapiinille noin 4 765 potilasvuoteen, sekä 722 potilasta, jotka ovat altistuneet olantsapiinille injektiota varten. Tämä tietokanta sisältää: (1) 2500 potilasta, jotka osallistuivat usean annoksen oraalisen olantsapiinin markkinoille saattamista edeltäviin tutkimuksiin skitsofrenian ja Alzheimerin taudin hoidossa, mikä edustaa noin 1122 potilasvuotta altistumisesta 14. helmikuuta 1995; (2) 182 potilasta, jotka osallistuivat suun kautta otettavan olantsapiinin markkinoille saattamista edeltäviin I-tyypin kaksisuuntaisen mielialahäiriön (maaniset tai sekajaksot) tutkimuksiin, jotka edustivat noin 66 potilasvuotta; (3) 191 potilasta, jotka osallistuivat suun kautta annettavaan olantsapiinitutkimukseen potilailla, joilla oli erilaisia Alzheimerin tautiin liittyviä psykiatrisia oireita, mikä vastaa noin 29 potilasvuoden altistumista; (4) 5788 muuta potilasta 88 oraalisen olantsapiinin kliinisestä tutkimuksesta 31. joulukuuta 2001; (5) 1843 muuta potilasta 41 olantsapiinin kliinisestä tutkimuksesta 31. lokakuuta 2011; ja (6) 722 potilasta, jotka osallistuivat lihaksensisäiseen injektioon tarkoitetun olantsapiinin markkinoille saattamista edeltäviin tutkimuksiin kiihtyneillä potilailla, joilla oli skitsofrenia, kaksisuuntainen mielialahäiriö I (maaniset tai sekavaiheet) tai dementia. Alla on myös tiedot olantsapiinin yhdistelmänä litiumin tai valproaatin kanssa markkinoille saattamista edeltävästä 6 viikkoa kestäneestä kliinisestä tutkimustietokannasta, joka koostui 224 potilaasta, jotka osallistuivat kaksisuuntaisen mielialahäiriön I (maaniset tai sekajaksot) tutkimuksiin noin 22 potilasvuoden altistumisesta.
Olantsapiinihoidon olosuhteet ja kesto vaihtelivat suuresti ja sisälsivät (päällekkäisissä luokissa) avoimet ja kaksoissokkotutkimukset, sairaala- ja avopotilaat, kiinteän annoksen ja annostitraustutkimukset sekä lyhyt- tai pitkäaikainen altistus . Haittavaikutukset arvioitiin keräämällä haittavaikutukset, fyysisten tutkimusten tulokset, elintoiminnot, painot, laboratorioanalyytit, EKG:t, rintakehän röntgenkuvat ja oftalmologisten tutkimusten tulokset.
Tietyt osat alla olevasta keskustelusta, jotka koskevat objektiivisia tai numeerisia turvallisuusparametreja, nimittäin annoksesta riippuvia haittavaikutuksia, elintoimintojen muutoksia, painonnousua, laboratoriomuutoksia ja EKG-muutoksia, ovat peräisin skitsofreniapotilailla tehdyistä tutkimuksista, eikä niitä ole toistettu kaksisuuntaisen mielialahäiriön I suhteen. (maaniset tai sekajaksot) tai agitaatio. Tämä tieto soveltuu kuitenkin yleisesti myös kaksisuuntaiseen mielialahäiriöön I (maaniset tai sekajaksot) ja kiihtyneisyyteen.
Haittavaikutukset altistuksen aikana saatiin spontaanilla raportilla, ja kliiniset tutkijat kirjasivat ne omaan valitsemaansa terminologiaan. Näin ollen ei ole mahdollista antaa merkityksellistä arviota haittavaikutuksia kokeneiden henkilöiden osuudesta ryhmittelemättä ensin samantyyppisiä reaktioita pienempään määrään standardoituja reaktiokategorioita. Seuraavissa taulukoissa ja taulukoissa on käytetty MedDRA- ja COSTART-sanakirjan terminologiaa raportoitujen haittavaikutusten luokittelussa.
Ilmoitetut haittavaikutusten esiintymistiheydet edustavat niiden henkilöiden osuutta, jotka ovat kokeneet vähintään kerran mainitun tyyppisen hoidon aiheuttaman haittavaikutuksen. Reaktion katsottiin olevan hoitoon liittyvä, jos se ilmeni ensimmäistä kertaa tai paheni hoidon aikana lähtötilanteen arvioinnin jälkeen. Raportoidut reaktiot eivät sisällä niitä reaktiotermejä, jotka olivat niin yleisiä, että ne eivät olleet informatiivisia. Muualla merkinnöissä lueteltuja reaktioita ei saa toistaa alla. On tärkeää korostaa, että vaikka reaktiot ilmenivät olantsapiinihoidon aikana, ne eivät välttämättä johtuneet siitä. Koko etiketti tulee lukea, jotta saadaan täydellinen käsitys olantsapiinin turvallisuusprofiilista.
Lääkkeen määrääjän tulee huomioida, että taulukoiden ja taulukoiden lukujen perusteella ei voida ennustaa haittavaikutusten ilmaantuvuutta tavanomaisessa lääketieteellisessä toiminnassa, kun potilaan ominaisuudet ja muut tekijät poikkeavat kliinisissä tutkimuksissa vallinneista. Samoin mainittuja esiintymistiheyksiä ei voida verrata lukuihin, jotka on saatu muista kliinisistä tutkimuksista, joissa on mukana erilaisia hoitoja, käyttöjä ja tutkijoita. Mainitut luvut antavat kuitenkin lääkkeen määräävälle terveydenhuollon tarjoajalle jonkinlaisen perustan arvioida lääkkeiden ja muiden tekijöiden suhteellista osuutta haittavaikutusten esiintyvyydestä tutkitussa väestössä.
Haittavaikutusten ilmaantuvuus lyhytaikaisissa, lumekontrolloiduissa ja yhdistelmätutkimuksissa
Seuraavat havainnot perustuvat markkinointia edeltäviin tutkimuksiin (1) suun kautta otettavalla olantsapiinilla skitsofrenian, kaksisuuntaisen mielialahäiriön (maaniset tai sekajaksot) hoitoon, myöhempään tutkimukseen potilailla, joilla on erilaisia Alzheimerin taudin yhteydessä olevia psykiatrisia oireita, sekä markkinointia edeltäviin yhdistelmätutkimuksiin ja (2) ) lihakseen annettava olantsapiini injektiona kiihtyneille potilaille, joilla on skitsofrenia tai kaksisuuntainen mielialahäiriö I mania.
Hoidon keskeyttämiseen liittyvät haittavaikutukset lyhytaikaisissa lumekontrolloiduissa tutkimuksissa
Skitsofrenia
Kaiken kaikkiaan haittavaikutuksista johtuvien keskeytysten ilmaantuvuus ei eronnut (5 % suun kautta otettavalla olantsapiinilla vs 6 % lumelääkkeellä). ALAT-arvon noususta johtuvien keskeytysten katsottiin kuitenkin johtuneen lääkkeestä (2 % suun kautta otettavalla olantsapiinilla vs 0 % lumelääkkeellä).
Kaksisuuntainen mielialahäiriö I (maaniset tai sekajaksot) Monoterapia
Kaiken kaikkiaan haittavaikutuksista johtuvien keskeytysten ilmaantuvuus ei eronnut (2 % suun kautta otettavalla olantsapiinilla vs 2 % lumelääkkeellä).
Agitaatio
Kaiken kaikkiaan haittavaikutuksista johtuvan hoidon keskeyttämisen ilmaantuvuus ei eronnut (0,4 % lihakseen annetulla injektiolla olantsapiinilla vs. 0 % lumelääkkeellä).
Hoidon lopettamiseen liittyvät haittavaikutukset lyhytaikaisissa yhdistelmätutkimuksissa
Kaksisuuntainen mielialahäiriö I (maaniset tai sekajaksot), olantsapiini litiumin tai valproaatin lisänä
Tutkimuksessa potilailla, jotka jo sietävät joko litiumia tai valproaattia monoterapiana, haittavaikutuksista johtuvia keskeyttämisprosentti oli 11 % oraalisen olantsapiinin ja litiumin tai valproaatin yhdistelmässä verrattuna 2 %:iin potilailla, jotka jatkoivat litiumia tai valproaattia monoterapiana. Suun kautta otettavan olantsapiinin ja litiumin tai valproaatin yhdistelmähoidon keskeyttämiset, joita esiintyi useammalla kuin yhdellä potilaalla, olivat: uneliaisuus (3 %), painonnousu (1 %) ja perifeerinen turvotus (1 %).
Yleisesti havaitut haittavaikutukset lyhytaikaisissa, lumekontrolloiduissa kokeissa
Yleisimmin havaitut haittavaikutukset, jotka liittyvät suun kautta otettavan olantsapiinin käyttöön (esiintyvyys 5 % tai enemmän) ja joita ei havaittu vastaavalla ilmaantuvyydellä lumelääkettä saaneiden potilaiden keskuudessa (olantsapiinin ilmaantuvuus vähintään kaksi kertaa lumelääkettä saaneilla), olivat:
Olantsapiini lihakseen
Lumehoidon aikana havaittiin yksi haittavaikutus (uneliaisuus), jonka ilmaantuvuus oli vähintään 5 % lihaksensisäisellä olantsapiinilla injektiohoitoa saaneilla potilailla, eikä vastaavaa esiintyvyyttä lumelääkettä saaneilla potilailla (olantsapiinin ilmaantuvuus vähintään kaksi kertaa lumelääkettä saaneilla). - kontrolloidut esimarkkinointitutkimukset. Uneliaisuuden ilmaantuvuus 24 tunnin IM-hoidon aikana kliinisissä tutkimuksissa kiihtyneillä potilailla, joilla oli skitsofrenia tai kaksisuuntainen mielialahäiriö I mania, oli 6 % lihakseen annettavalla injektiona olantsapiinilla ja 3 % lumelääkkeellä.
Haittavaikutukset, joita esiintyy vähintään 2 %:lla oraalisella olantsapiinilla hoidetuista potilaista lyhytaikaisissa lumekontrolloiduissa tutkimuksissa
Taulukossa 11 luetellaan lähimpään prosenttiin pyöristettynä hoidon aiheuttamien haittavaikutusten ilmaantuvuus, joita esiintyi vähintään 2 %:lla potilaista, jotka saivat suun kautta otettavaa olantsapiinia (annokset ≥ 2,5 mg/vrk) ja joiden ilmaantuvuus oli suurempi kuin lumelääkettä saaneilla, jotka osallistuivat akuuttiin lumekontrolloitujen tutkimusten vaiheessa.
Annosriippuvuus haittavaikutuksista
Annosryhmien eroja on havaittu väsymyksen, huimauksen, painonnousun ja prolaktiinin nousun osalta. Yhdessä 8 viikkoa kestäneessä satunnaistetussa kaksoissokkoutetussa kiinteäannoksisessa tutkimuksessa, jossa verrattiin 10 (N=199), 20 (N=200) ja 40 (N=200) mg/vrk oraalista olantsapiinia skitsofreniaa sairastavilla tai skitsoaffektiivisilla aikuispotilailla. häiriö, väsymyksen ilmaantuvuus (10 mg/vrk: 1,5 %; 20 mg/vrk: 2,1 %; 40 mg/vrk: 6,6 %) havaittiin merkittävillä eroilla välillä 10 vs 40 ja 20 vs 40 mg/vrk. Huimauksen ilmaantuvuus (10 mg/vrk: 2,6 %; 20 mg/vrk: 1,6 %; 40 mg/vrk: 6,6 %) havaittiin merkittävillä eroilla 20 mg:n ja 40 mg:n välillä. Annosryhmien erot havaittiin myös painonnousussa ja prolaktiinin nousussa [katso VAROITUKSET JA VAROTOIMET ].
Seuraavassa taulukossa käsitellään muiden haittavaikutusten annosriippuvuutta käyttämällä tietoja skitsofreniatutkimuksesta, jossa oli mukana kiinteitä oraalisen olantsapiinin annosalueita. Siinä luetellaan niiden potilaiden prosenttiosuus, joilla on hoidon aiheuttamia haittavaikutuksia kolmen kiinteän annoksen ryhmässä ja lumelääkkeessä. Tiedot analysoitiin käyttämällä Cochran-Armitage-testiä lumeryhmää lukuun ottamatta, ja taulukko sisältää vain ne haittavaikutukset, joissa oli suuntausta.
Yleisesti havaitut haittavaikutukset lyhytaikaisissa tutkimuksissa, joissa olantsapiinia käytetään litiumin tai valproaatin lisänä
Kaksisuuntaisen mielialahäiriön I (maaniset tai sekajaksot) plasebokontrolloiduissa lisätutkimuksissa olantsapiinin ja litiumin tai valproaatin yhdistelmään liittyvät yleisimmin havaitut haittavaikutukset (esiintyvyys ≥ 5 % ja vähintään kaksi kertaa lumelääke) olivat:
Haittavaikutukset, joita esiintyy vähintään 2 %:lla oraalisella olantsapiinilla hoidetuista potilaista lyhytaikaisissa tutkimuksissa, joissa olantsapiinia käytettiin litiumin tai valproaatin lisänä
Taulukossa 14 luetellaan lähimpään prosenttiin pyöristettynä hoidon aiheuttamien haittavaikutusten ilmaantuvuus, joita esiintyi vähintään 2 %:lla potilaista, joita hoidettiin olantsapiinin (annokset ≥ 5 mg/vrk) ja litiumin tai valproaatin yhdistelmällä ja joiden ilmaantuvuus oli suurempi kuin yksinään litiumia tai valproaattia, jotka osallistuivat lumekontrolloitujen yhdistelmätutkimusten akuuttiin vaiheeseen.
Tarkempia tietoja litiumin tai valproaatin yhteydessä havaituista haittavaikutuksista on näiden muiden tuotteiden pakkausselosteiden Haittavaikutukset-osiossa.
Haittavaikutukset, joita esiintyy vähintään 1 % lihaksensisäisellä olantsapiinilla injektiohoitoa saaneilla potilailla lyhytaikaisissa lumekontrolloiduissa tutkimuksissa
Taulukossa 15 luetellaan lähimpään prosenttiin pyöristettynä hoidon aiheuttamien haittavaikutusten ilmaantuvuus, joita esiintyi vähintään 1 %:lla potilaista, joita hoidettiin lihaksensisäisellä olantsapiinilla injektiota varten (annosalue 2,5-10 mg/injektio) ja joiden ilmaantuvuus oli suurempi kuin lumelääkkeellä. jotka osallistuivat lyhytaikaisiin lumekontrolloituihin tutkimuksiin kiihtyneillä potilailla, joilla oli skitsofrenia tai kaksisuuntainen mieliala I mania.
Ekstrapyramidaaliset oireet
Seuraavassa taulukossa luetellaan niiden potilaiden prosenttiosuus, joilla on hoidon aiheuttamia ekstrapyramidaalisia oireita, arvioituna kategorisilla analyyseillä muodollisista luokitusasteikoista akuutin hoidon aikana kontrolloidussa kliinisessä tutkimuksessa, jossa verrattiin oraalista olantsapiinia kolmella kiinteällä annoksella lumelääkkeeseen skitsofrenian hoidossa 6 viikon aikana. oikeudenkäyntiä.
Seuraavassa taulukossa luetellaan niiden potilaiden prosenttiosuus, joilla on hoidon aiheuttamia ekstrapyramidaalioireita, jotka on arvioitu spontaanisti raportoiduilla haittavaikutuksilla akuutin hoidon aikana samassa kontrolloidussa kliinisessä tutkimuksessa, jossa verrattiin olantsapiinia kolmella kiinteällä annoksella lumelääkkeeseen skitsofrenian hoidossa 6 viikkoa kestäneessä tutkimuksessa.
Seuraavassa taulukossa luetellaan niiden nuorten potilaiden prosenttiosuus, joilla on hoidon aiheuttamia ekstrapyramidaalioireita, arvioituna spontaanisti raportoitujen haittavaikutusten perusteella akuutin hoidon aikana (annosalue: 2,5-20 mg/vrk).
Seuraavassa taulukossa luetellaan niiden potilaiden prosenttiosuus, joilla on hoidon aiheuttamia ekstrapyramidaalioireita, jotka on arvioitu kategorisilla analyyseillä muodollisista luokitusasteikoista kontrolloiduissa kliinisissä tutkimuksissa, joissa verrattiin kiinteitä lihaksensisäisen olantsapiinin injektioannoksia plaseboon levottomuudessa. Potilaat kussakin annosryhmässä voivat saada enintään 3 injektiota kokeiden aikana [katso Kliiniset tutkimukset ]. Potilasarvioinnit suoritettiin 24 tunnin aikana lihakseen annettavan olantsapiinin aloitusannoksen jälkeen.
Seuraavassa taulukossa luetellaan niiden potilaiden prosenttiosuus, joilla on hoidon aiheuttamia ekstrapyramidaalisia oireita arvioituna spontaanisti raportoitujen haittavaikutusten perusteella samassa kontrolloidussa kliinisessä tutkimuksessa, jossa verrattiin kiinteitä lihaksensisäisen olantsapiinin injektioannoksia lumelääkkeeseen kiihtyneillä skitsofreniapotilailla.
Dystonia, luokkaefekti
Dystonian oireita, pitkittyneitä lihasryhmien epänormaaleja supistuksia, voi esiintyä herkillä henkilöillä muutaman ensimmäisen hoitopäivän aikana. Dystonisia oireita ovat: niskalihasten kouristukset, jotka joskus etenevät kurkun kireyteen, nielemisvaikeudet, hengitysvaikeudet ja/tai kielen ulkoneminen. Vaikka nämä oireet voivat ilmaantua pienillä annoksilla, esiintymistiheys ja vakavuus ovat suurempia suuren tehon ja suuremmilla ensimmäisen sukupolven psykoosilääkkeiden annoksilla. Yleisesti ottaen psykoosilääkkeitä saavilla miehillä ja nuoremmilla ikäryhmillä voidaan havaita kohonnut akuutin dystonian riski; Dystoniatapahtumia on kuitenkin raportoitu harvoin (
Muut haittavaikutukset
Muut suun kautta otettavan olantsapiinin kliinisen tutkimuksen arvioinnin aikana havaitut haittavaikutukset
Seuraavassa on luettelo hoitoon liittyvistä haittavaikutuksista, joita potilaat ovat raportoineet oraalisella olantsapiinilla (useita annoksia ≥ 1 mg/vrk) kliinisissä tutkimuksissa. Tämän luettelon ei ole tarkoitus sisältää reaktioita (1), jotka on jo lueteltu aiemmissa taulukoissa tai muualla merkinnöissä, (2) joiden lääkkeen syy oli kaukainen, (3) jotka olivat niin yleisiä, että ne eivät olleet informatiivisia, (4) jotka eivät olleet joilla katsottiin olevan merkittäviä kliinisiä vaikutuksia, tai (5) joita esiintyi yhtä suurella tai pienemmällä nopeudella kuin lumelääke. Reaktiot luokitellaan elimistön mukaan käyttämällä seuraavia määritelmiä: yleisiä haittavaikutuksia ovat ne, joita esiintyy vähintään 1/100 potilaalla; harvinaiset haittavaikutukset ovat niitä, joita esiintyy 1/100 - 1/1000 potilaalla; Harvinaisia reaktioita esiintyy harvemmalla kuin 1/1000 potilaalla.
Keho kokonaisuutena - Harvinainen: vilunväristykset, kasvojen turvotus, valoherkkyysreaktio, itsemurhayritys1; Harvinainen: vilunväristykset ja kuume, krapula, äkillinen kuolema1.
Sydän- ja verisuonijärjestelmä - Harvinainen: aivoverenkiertohäiriö, vasodilataatio.
Ruoansulatuselimistö - Harvinainen: vatsan turvotus, pahoinvointi ja oksentelu, kielen turvotus; Harvinainen: ileus, suolitukos, maksan rasvakertymä.
Hemic ja lymfaattinen järjestelmä - Harvinainen: trombosytopenia.
Aineenvaihdunta- ja ravitsemushäiriöt - Usein: alkalinen fosfataasi lisääntynyt; Harvinainen: bilirubinemia, hypoproteinemia.
Tuki- ja liikuntaelimistö - Harvinainen: osteoporoosi.
Hermosto - Harvinainen: ataksia, dysartria, libidon heikkeneminen, stupor; Harvinainen: kooma.
Hengityselimet - Harvinainen: nenäverenvuoto; Harvinainen: keuhkopöhö.
Iho ja lisäkkeet - Harvinainen: hiustenlähtö.
Erityiset aistit - Harvinainen: akkomodaatiohäiriöt, silmien kuivuminen; Harvinainen: mydriaasi.
Urogenitaalijärjestelmä - Harvinainen: amenorrea2, rintojen kipu, kuukautisten vähentyminen, impotenssi2, lisääntyneet kuukautiset2, menorrhagia2, metrorrhagia2, polyuria2, virtsaamistiheys, virtsanpidätys, virtsaamispakko, virtsaamisen heikkeneminen.
1 Nämä termit edustavat vakavia haittatapahtumia, mutta eivät täytä haittavaikutusten määritelmää. Ne on sisällytetty tähän niiden vakavuuden vuoksi. 2 Muokattu sukupuolen mukaan.
Muut haitalliset vaikutukset, joita havaittiin kliinisen tutkimuksen aikana intramuskulaarista olantsapiinia injektiota varten
Seuraavassa on luettelo hoidosta aiheutuvista haittavaikutuksista, joita potilaat ovat raportoineet kliinisissä tutkimuksissa lihakseen annettavalla olantsapiinilla injektiota varten (yhdellä tai useammalla annoksella ≥2,5 mg/injektio). Tämän luettelon ei ole tarkoitus sisältää reaktioita (1), jotka on jo lueteltu aiemmissa taulukoissa tai muualla merkinnöissä, (2) joiden lääkkeen syy oli kaukainen, (3) jotka olivat niin yleisiä, että ne eivät olleet informatiivisia, (4) jotka eivät olleet joilla katsottiin olevan merkittäviä kliinisiä vaikutuksia, tai (5) joiden esiintymistiheys on yhtä suuri tai pienempi kuin lumelääke. Reaktiot luokitellaan elimistön mukaan käyttämällä seuraavia määritelmiä: yleisiä haittavaikutuksia ovat ne, joita esiintyy vähintään 1/100 potilaalla; Harvinaiset haittavaikutukset ovat niitä, joita esiintyy 1/100 - 1/1000 potilaalla.
Keho kokonaisuutena - Usein: pistoskohdan kipu.
Sydän- ja verisuonijärjestelmä - Harvinainen: pyörtyminen.
Ruoansulatuselimistö - Harvinainen: pahoinvointi.
Aineenvaihdunta- ja ravitsemushäiriöt - Harvinainen: kreatiinifosfokinaasin nousu.
Kliiniset tutkimukset nuorilla potilailla (13-17-vuotiaat)
Yleisesti havaitut haittavaikutukset oraalisen olantsapiinin lyhytaikaisissa lumekontrolloiduissa tutkimuksissa
Taulukossa 21 on listattu haittavaikutukset nuorilla potilailla, joita hoidettiin suun kautta otettavalla olantsapiinilla (annokset ≥ 2,5 mg), joiden ilmaantuvuus on vähintään 5 % ja joita on raportoitu vähintään kaksi kertaa niin usein kuin lumelääkettä saaneilla potilailla.
Haittavaikutukset, joita esiintyy vähintään 2 %:lla oraalisella olantsapiinilla hoidetuista potilaista lyhyellä aikavälillä (3-6 viikkoa), lumekontrolloidut tutkimukset
Haittavaikutukset nuorilla potilailla, joita hoidettiin suun kautta otettavalla olantsapiinilla (annokset ≥ 2,5 mg), joiden ilmaantuvuus on vähintään 2 % ja suurempi kuin lumelääkettä saaneiden, on lueteltu taulukossa 22.
Elintoiminnot ja laboratoriotutkimukset
Elintoimintojen muutokset
Suun kautta otettavaan olantsapiiniin liittyi ortostaattista hypotensiota ja takykardiaa kliinisissä tutkimuksissa. Intramuskulaarinen olantsapiini injektiota varten liittyi bradykardiaan, hypotensioon ja takykardiaan kliinisissä tutkimuksissa [ks. VAROITUKSET JA VAROTOIMET ].
Laboratoriomuutokset
Olantsapiinimonoterapia aikuisilla
Olantsapiinin markkinoille saattamista edeltävän kokemuksen arviointi paljasti yhteyden oireettoman ALAT-, ASAT- ja GGT-arvon nousuun. Alkuperäisessä, noin 2 400 aikuispotilaan, joiden ALAT-arvo oli ≤90 IU/l, markkinoille saattamista edeltävässä tietokannassa ALAT-arvojen nousun ilmaantuvuus >200 IU/l:iin oli 2 % (50/2381). Yhdelläkään näistä potilaista ei esiintynyt keltaisuutta tai muita maksan vajaatoiminnasta johtuvia oireita, ja useimmilla oli ohimeneviä muutoksia, jotka normalisoituivat olantsapiinihoidon jatkuessa.
Lumekontrolloiduissa olantsapiinimonoterapiatutkimuksissa aikuisilla kliinisesti merkitseviä ALAT-arvojen nousuja (muutos
Laboratoriotietojen analyysi integroidussa tietokannassa, jossa oli 41 loppuun suoritettua kliinistä tutkimusta aikuispotilailla, joita hoidettiin suun kautta otettavalla olantsapiinilla, korkeita GGT-tasoja havaittiin ≥ 1 %:lla (88/5245) potilaista.
Varovaisuutta on noudatettava potilailla, joilla on merkkejä ja oireita maksan vajaatoiminnasta, potilailla, joilla on aiempia sairauksia, joihin liittyy rajoitettu maksan toimintareservi, ja potilaita, joita hoidetaan mahdollisesti maksatoksisilla lääkkeillä.
Olantsapiinin antoon liittyi myös seerumin prolaktiinipitoisuuden nousu [katso VAROITUKSET JA VAROTOIMET ], oireeton eosinofiilimäärän nousu 0,3 %:lla potilaista ja CPK-arvon nousu.
Laboratoriotietojen analyysi integroidussa tietokannassa, jossa oli 41 loppuun suoritettua kliinistä tutkimusta aikuispotilailla, joita hoidettiin suun kautta otettavalla olantsapiinilla, kohonnut virtsahappopitoisuus kirjattiin ≥3 %:lla (171/4641) potilaista.
Olantsapiinimonoterapia nuorilla
Lumekontrolloiduissa kliinisissä tutkimuksissa nuorilla potilailla, joilla oli skitsofrenia tai kaksisuuntainen mielialahäiriö (maaniset tai sekavaiheet), laboratorioanalyytit havaittiin milloin tahansa useammin seuraavien hoitoon liittyvien löydösten esiintymiselle plaseboon verrattuna: kohonnut ALAT (≥ 3X ULN) potilailla, joiden ALAT lähtötilanteessa
Nuorten lumelääkekontrolloiduissa olantsapiinimonoterapiatutkimuksissa kliinisesti merkitseviä ALAT-arvojen nousuja (muutos
EKG:n muutokset
Aikuisilla ja nuorilla tehdyissä yhdistetyissä tutkimuksissa ei havaittu merkittäviä eroja olantsapiinin ja lumelääkkeen välillä niiden potilaiden osuudessa, joilla oli mahdollisesti merkittäviä muutoksia EKG-parametreissa, mukaan lukien QT, QTc (Fridericia-korjattu) ja PR-välit. Olantsapiinin käyttöön liittyi sydämen sykkeen keskimääräinen nousu lumelääkkeeseen verrattuna (aikuiset: +2,4 lyöntiä minuutissa vs. lumelääkettä saaneiden ei muutosta; nuoret: +6,3 lyöntiä minuutissa vs. lumelääkettä saaneet -5,1 lyöntiä minuutissa). Tämä sydämen sykkeen nousu saattaa liittyä olantsapiinin mahdollisuuteen aiheuttaa ortostaattisia muutoksia [ks. VAROITUKSET JA VAROTOIMET ].
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu ZYPREXA:n hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, on vaikea arvioida luotettavasti niiden esiintymistiheyttä tai arvioida syy-yhteyttä lääkealtistukseen.
Markkinoille tulon jälkeen raportoituja haittavaikutuksia, jotka liittyivät ajallisesti (mutta ei välttämättä kausaalisesti) ZYPREXA-hoitoon, ovat seuraavat: allerginen reaktio (esim. anafylaktoidinen reaktio, angioedeema, kutina tai nokkosihottuma), kolestaattinen tai sekamuotoinen maksavaurio, diabeettinen kooma, diabeettinen ketoasidoosi, lopetusreaktio (läpäisy, pahoinvointi tai oksentelu), lääkereaktio eosinofilian ja systeemisten oireiden kanssa (DRESS), hepatiitti, keltaisuus, neutropenia, haimatulehdus, priapismi, ihottuma, levottomat jalat -oireyhtymä, rabdomyolyysi, änkytys1 ja pulmonaaliset veritulpat (mukaan lukien laskimotukos syvä laskimotromboosi). Satunnaisia kolesterolitasoja ≥240 mg/dl ja satunnaisia triglyseridipitoisuuksia ≥1000 mg/dl on raportoitu.
1 Änkytystä tutkittiin vain oraalisissa ja pitkävaikutteisissa injektiovalmisteissa (LAI).
HUUMEIDEN VUOROVAIKUTUKSET
Olantsapiinin käytön riskejä yhdessä muiden lääkkeiden kanssa ei ole arvioitu laajasti systemaattisissa tutkimuksissa.
Muiden lääkkeiden mahdollisuus vaikuttaa olantsapiiniin
Diatsepaami
Diatsepaamin ja olantsapiinin samanaikainen anto voimisti olantsapiinin yhteydessä havaittua ortostaattista hypotensiota.
Simetidiini ja antasidit
Simetidiinin (800 mg) tai alumiinia ja magnesiumia sisältävien antasidien kerta-annokset eivät vaikuttaneet olantsapiinin oraaliseen biologiseen hyötyosuuteen.
CYP1A2:n indusoijat
Karbamatsepiinihoito (200 mg kahdesti) lisää olantsapiinin puhdistumaa noin 50 %. Tämä lisääntyminen johtuu todennäköisesti siitä, että karbamatsepiini on voimakas CYP1A2-aktiivisuuden indusoija. Suuremmat karbamatsepiinin päivittäiset annokset voivat lisätä olantsapiinin puhdistumaa vielä enemmän.
Alkoholi
Etanolilla (45 mg/70 kg kerta-annos) ei ollut vaikutusta olantsapiinin farmakokinetiikkaan. Alkoholin (eli etanolin) samanaikainen anto olantsapiinin kanssa voimisti olantsapiinin yhteydessä havaittua ortostaattista hypotensiota [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
CYP1A2:n estäjät
Fluvoksamiini
Fluvoksamiini, CYP1A2:n estäjä, vähentää olantsapiinin puhdistumaa. Tämä johtaa olantsapiinin Cmax-arvon keskimääräiseen nousuun fluvoksamiinin jälkeen 54 % tupakoimattomilla naisilla ja 77 % tupakoivilla miehillä. Olantsapiinin AUC:n keskimääräinen nousu on 52 % ja 108 %. Pienempiä olantsapiiniannoksia tulee harkita potilailla, jotka saavat samanaikaista fluvoksamiinihoitoa.
CYP2D6:n estäjät
Fluoksetiini
Fluoksetiini (60 mg kerta-annos tai 60 mg vuorokausiannos 8 päivän ajan) aiheuttaa pienen (keskimäärin 16 %) olantsapiinin maksimipitoisuuden nousun ja pienen (keskimäärin 16 %) olantsapiinin puhdistuman pienenemisen. Tämän tekijän vaikutuksen suuruus on pieni verrattuna yksilöiden väliseen yleiseen vaihteluun, joten annoksen muuttamista ei rutiininomaisesti suositella. Kun käytät ZYPREXAa ja fluoksetiinia yhdessä, katso myös Symbyaxin pakkausselosteen kohtaa Lääkkeiden yhteisvaikutukset.
Varfariini
Varfariini (20 mg:n kerta-annos) ei vaikuttanut olantsapiinin farmakokinetiikkaan.
CYP1A2:n tai glukuronyylitransferaasin indusoijat
Omepratsoli ja rifampiini voivat lisätä olantsapiinin puhdistumaa.
Puuhiili
Aktiivihiilen (1 g) antaminen pienensi suun kautta otettavan olantsapiinin Cmax- ja AUC-arvoja noin 60 %. Koska olantsapiinin huippupitoisuudet saavutetaan tyypillisesti vasta noin 6 tunnin kuluttua annostelusta, puuhiili voi olla hyödyllinen hoito olantsapiinin yliannostukseen.
Olantsapiinin mahdollisuus vaikuttaa muihin lääkkeisiin
Keskushermostoon vaikuttavat lääkkeet
Olantsapiinin ensisijaiset keskushermostovaikutukset huomioon ottaen on noudatettava varovaisuutta, kun olantsapiinia käytetään yhdessä muiden keskushermostoon vaikuttavien lääkkeiden ja alkoholin kanssa.
Verenpainetta alentavat aineet
Koska olantsapiini voi aiheuttaa hypotensiota, se voi voimistaa tiettyjen verenpainetta alentavien aineiden vaikutuksia.
Levodopa ja dopamiiniagonistit
Olantsapiini saattaa antagonisoida levodopan ja dopamiiniagonistien vaikutuksia.
Loratsepaami (IM)
Lihaksensisäisen loratsepaamin (2 mg) antaminen 1 tunti lihakseen annettavan olantsapiinin (5 mg) jälkeen ei vaikuttanut merkitsevästi olantsapiinin, konjugoimattoman loratsepaamin tai kokonaisloratsepaamin farmakokinetiikkaan. Tämä intramuskulaarisen loratsepaamin ja lihaksensisäisen olantsapiinin anto injektiota varten lisäsi kuitenkin uneliaisuutta, joka havaittiin kummallakin lääkkeellä yksinään [ks. VAROITUKSET JA VAROTOIMET ].
Litium
Olantsapiinin useat annokset (10 mg 8 päivän ajan) eivät vaikuttaneet litiumin kinetiikkaan. Siksi samanaikainen olantsapiinin anto ei vaadi litiumin annoksen säätämistä [katso VAROITUKSET JA VAROTOIMET ].
Valproaatti
Olantsapiini (10 mg päivässä 2 viikon ajan) ei vaikuttanut plasman valproaatin vakaan tilan pitoisuuksiin. Siksi samanaikainen olantsapiinin anto ei vaadi valproaatin annoksen muuttamista [katso VAROITUKSET JA VAROTOIMET ].
Olantsapiinin vaikutus lääkettä metaboloiviin entsyymeihin
Ihmisen maksan mikrosomeja käyttävät in vitro -tutkimukset viittaavat siihen, että olantsapiinilla on vähän potentiaalia estää CYP1A2-, CYP2C9-, CYP2C19-, CYP2D6- ja CYP3A-entsyymejä. Siten olantsapiini ei todennäköisesti aiheuta kliinisesti merkittäviä näiden entsyymien välittämiä yhteisvaikutuksia.
Imipramiini
Olantsapiinin kerta-annokset eivät vaikuttaneet imipramiinin tai sen aktiivisen metaboliitin desipramiinin farmakokinetiikkaan.
Varfariini
Olantsapiinin kerta-annokset eivät vaikuttaneet varfariinin farmakokinetiikkaan.
Diatsepaami
Olantsapiini ei vaikuttanut diatsepaamin tai sen aktiivisen metaboliitin Ndesmetyylidiatsepaamin farmakokinetiikkaan. Kuitenkin, kun diatsepaami annettiin samanaikaisesti olantsapiinin kanssa, se lisäsi ortostaattista hypotensiota, joka havaittiin kummallakin lääkkeellä yksinään.
Alkoholi
Useat olantsapiiniannokset eivät vaikuttaneet etanolin kinetiikkaan.
Biperiden
Useat olantsapiiniannokset eivät vaikuttaneet biperideenin kinetiikkaan.
Teofylliini
Useat olantsapiiniannokset eivät vaikuttaneet teofylliinin tai sen metaboliittien farmakokinetiikkaan.
Huumeiden väärinkäyttö ja riippuvuus
Riippuvuus
Tutkimuksissa, jotka suunniteltiin arvioimaan väärinkäyttö- ja riippuvuuspotentiaalia, olantsapiinilla on osoitettu olevan akuutteja masennusvaikutuksia keskushermostoon, mutta vain vähän tai ei ollenkaan mahdollisia väärinkäytöksiä tai fyysistä riippuvuutta rotilla, joille annettiin suun kautta enintään 15-kertainen päivittäinen suun kautta otettava MRHD (20 mg) ja reesusapinoita. suun kautta annettuina annoksina, jotka ovat enintään 8 kertaa päivittäisen suun kautta otettavan MRHD:n suuruisia mg/m² kehon pinta-alaa.
Olantsapiinia ei ole systemaattisesti tutkittu ihmisillä sen mahdollisen väärinkäytön, sietokyvyn tai fyysisen riippuvuuden suhteen. Vaikka kliiniset tutkimukset eivät paljastaneet minkäänlaista taipumusta huumeidenhakukäyttäytymiseen, nämä havainnot eivät olleet systemaattisia, eikä tämän rajallisen kokemuksen perusteella ole mahdollista ennustaa, missä määrin keskushermostoon vaikuttavaa lääkettä käytetään väärin tai muualle. ja/tai väärinkäytöksiä, kun ne on markkinoitu. Tästä syystä potilaat on arvioitava huolellisesti anamneesissa huumeiden väärinkäytön varalta, ja tällaisia potilaita tulee tarkkailla tarkasti olantsapiinin väärinkäytön merkkien varalta (esim. sietokyvyn kehittyminen, annoksen suurentaminen, huumeiden etsintäkäyttäytyminen).
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Kun käytät ZYPREXA 7,5 mg:aa ja fluoksetiinia yhdessä, katso myös Symbyaxin pakkausselosteen Varoitukset ja varotoimet -osa.
Iäkkäät potilaat, joilla on dementiaan liittyvä psykoosi
Lisääntynyt kuolleisuus
Iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi ja joita hoidetaan psykoosilääkkeillä, on lisääntynyt kuolemanriski. ZYPREXA 20 mg:aa ei ole hyväksytty dementiaan liittyvän psykoosin potilaiden hoitoon [katso LAATIKKOVAROITUS, Käyttö samanaikaisista sairauksista kärsivillä potilailla ja POTILASTIEDOT].
Lumekontrolloiduissa kliinisissä tutkimuksissa iäkkäillä potilailla, joilla oli dementiaan liittyvä psykoosi, kuoleman ilmaantuvuus olantsapiinia saaneilla potilailla oli merkitsevästi suurempi kuin lumelääkettä saaneilla potilailla (3,5 % vs. 1,5 %).
Aivoverenkierron haittatapahtumat (CVAE), mukaan lukien aivohalvaus
Aivoverenkierron haittavaikutuksia (esim. aivohalvaus, ohimenevä iskeeminen kohtaus), mukaan lukien kuolemaan johtaneet, raportoitiin potilailla olantsapiinitutkimuksissa iäkkäillä potilailla, joilla oli dementiaan liittyvä psykoosi. Lumekontrolloiduissa tutkimuksissa aivoverenkierron haittavaikutusten ilmaantuvuus oli merkittävästi suurempi olantsapiinilla hoidetuilla potilailla kuin lumelääkettä saaneilla potilailla. Olantsapiinia ei ole hyväksytty dementiaan liittyvän psykoosin potilaiden hoitoon [katso LAATIKKO VAROITUS ja POTILASTIEDOT ].
Itsemurha
Itsemurhayrityksen mahdollisuus on luontainen skitsofrenialle ja kaksisuuntaiselle mielialahäiriölle I, ja suuren riskin potilaiden tiivistä valvonnasta tulee seurata lääkehoitoa. Yliannostusriskin vähentämiseksi olantsapiinin reseptit tulee kirjoittaa pienimmälle tablettimäärälle hyvän potilaan hoidon mukaisesti.
Maligni neuroleptinen oireyhtymä (NMS)
Mahdollisesti kuolemaan johtava oireyhtymä, jota joskus kutsutaan maligniksi neuroleptioireyhtymäksi (NMS), on raportoitu psykoosilääkkeiden, mukaan lukien olantsapiinin, käytön yhteydessä. NMS:n kliinisiä oireita ovat hyperpyreksia, lihasjäykkyys, muuttunut henkinen tila ja todisteet autonomisesta epävakaudesta (epäsäännöllinen pulssi tai verenpaine, takykardia, hikoilu ja sydämen rytmihäiriö). Muita oireita voivat olla kohonnut kreatiniinifosfokinaasi, myoglobinuria (rabdomyolyysi) ja akuutti munuaisten vajaatoiminta.
Tätä oireyhtymää sairastavien potilaiden diagnostinen arviointi on monimutkaista. Diagnoosia tehtäessä on tärkeää sulkea pois tapaukset, joissa kliininen kuva sisältää sekä vakavan sairauden (esim. keuhkokuume, systeeminen infektio jne.) että hoitamattomia tai riittämättömästi hoidettuja ekstrapyramidaalisia merkkejä ja oireita (EPS). Muita tärkeitä näkökohtia erotusdiagnoosissa ovat keskushermoston antikolinerginen toksisuus, lämpöhalvaus, lääkekuume ja primaarinen keskushermoston patologia.
NMS-taudin hoitoon tulisi kuulua: 1) psykoosilääkkeiden ja muiden samanaikaisen hoidon kannalta välttämättömien lääkkeiden välitön lopettaminen; 2) intensiivinen oireenmukainen hoito ja lääketieteellinen seuranta; ja 3) kaikkien samanaikaisten vakavien lääketieteellisten ongelmien hoito, joihin on saatavilla erityisiä hoitoja. Ei ole olemassa yleistä yksimielisyyttä NMS:n erityisistä farmakologisista hoito-ohjelmista.
Jos potilas tarvitsee psykoosilääkehoitoa NMS:stä toipumisen jälkeen, lääkehoidon mahdollista uudelleen aloittamista tulee harkita huolellisesti. Potilasta on seurattava huolellisesti, koska NMS:n uusiutumista on raportoitu [ks POTILASTIEDOT ].
Lääkereaktio eosinofilian ja systeemisten oireiden kanssa (DRESS)
Lääkereaktiota, johon liittyy eosinofiliaa ja systeemisiä oireita (DRESS), on raportoitu olantsapiinialtistuksen yhteydessä. DRESS voi aiheuttaa ihoreaktion (kuten ihottumaa tai eksfoliatiivista ihotulehdusta), eosinofiliaa, kuumetta ja/tai lymfadenopatiaa, johon liittyy systeemisiä komplikaatioita, kuten hepatiitti, nefriitti, keuhkotulehdus, sydänlihastulehdus ja/tai perikardiitti. PUKU on joskus kohtalokasta. Lopeta olantsapiinin käyttö, jos epäilet DRESSiä [ks POTILASTIEDOT ].
Metaboliset muutokset
Epätyypillisiin psykoosilääkkeisiin on liitetty aineenvaihdunnan muutoksia, mukaan lukien hyperglykemia, dyslipidemia ja painonnousu. Aineenvaihduntamuutokset voivat liittyä lisääntyneeseen kardiovaskulaariseen/aivoverisuoniriskiin. Olantsapiinin spesifinen metabolinen profiili on esitetty alla.
Hyperglykemia ja diabetes mellitus
Terveydenhuollon tarjoajien tulee ottaa huomioon riskit ja hyödyt, kun he määräävät olantsapiinia potilaille, joilla on todettu diabetes mellitus tai joilla on rajallisesti kohonnut verensokeri (paasto 100-126 mg/dl, ei-paasto 140-200 mg/dl). Olantsapiinia käyttäviä potilaita tulee seurata säännöllisesti glukoositasapainon heikkenemisen varalta. Potilaille, jotka aloittavat olantsapiinihoidon, tulee tehdä paastoverensokerimittaus hoidon alussa ja määräajoin hoidon aikana. Potilaita, joita hoidetaan epätyypillisillä psykoosilääkkeillä, tulee seurata hyperglykemian oireiden varalta, mukaan lukien polydipsia, polyuria, polyfagia ja heikkous. Potilaille, joille kehittyy hyperglykemian oireita atyyppisten psykoosilääkkeiden käytön aikana, on tehtävä paastoverensokerimittaus. Joissakin tapauksissa hyperglykemia on parantunut, kun epätyypillinen antipsykootti on lopetettu; Jotkut potilaat kuitenkin tarvitsivat diabeteslääkityksen jatkamista huolimatta epäillyn lääkkeen käytön lopettamisesta [ks. POTILASTIEDOT ].
Hyperglykemiaa, joka on joissain tapauksissa äärimmäistä ja joka liittyy ketoasidoosiin tai hyperosmolaariseen koomaan tai kuolemaan, on raportoitu potilailla, joita on hoidettu epätyypillisillä psykoosilääkkeillä, mukaan lukien olantsapiinilla. Epätyypillisen psykoosilääkkeiden käytön ja glukoosipoikkeavuuksien välisen suhteen arviointia vaikeuttaa skitsofreniapotilaiden lisääntynyt diabeteksen taustariski ja yleisväestössä lisääntynyt diabetes mellituksen esiintyvyys. Epidemiologiset tutkimukset viittaavat lisääntyneeseen hoitoon liittyvien hyperglykemiaan liittyvien haittavaikutusten riskiin potilailla, joita hoidetaan epätyypillisillä psykoosilääkkeillä. Vaikka suhteelliset riskiarviot ovat epäjohdonmukaisia, epätyypillisten psykoosilääkkeiden ja glukoosipitoisuuksien nousun välinen yhteys näyttää jatkuvan, ja olantsapiinilla näyttää olevan suurempi yhteys kuin joillakin muilla atyyppisillä psykoosilääkkeillä.
Keskimääräistä verensokerin nousua on havaittu potilailla, joita hoidettiin (mediaanialtistus 9,2 kuukautta) olantsapiinilla CATIE-tutkimuksen (Clinical Antipsychotic Trials of Intervention Effectiveness) vaiheessa 1. Seerumin glukoosin (paasto- ja ei-paastonäytteet) keskimääräinen nousu lähtötasosta kahden suurimman seerumipitoisuuden keskiarvoon oli 15,0 mg/dl.
Terveillä vapaaehtoisilla tehdyssä tutkimuksessa koehenkilöillä, jotka saivat olantsapiinia (N=22) 3 viikon ajan, paastoveren glukoosipitoisuus nousi keskimäärin 2,3 mg/dl lähtötasoon verrattuna. Plasebolla hoidetuilla koehenkilöillä (N=19) paastoverensokeri kohotti keskimäärin 0,34 mg/dl:n lähtötasoon verrattuna.
Olantsapiinimonoterapia aikuisilla
Viiden lumekontrolloidun aikuisten olantsapiinimonoterapiatutkimuksen analyysissä, joiden keskimääräinen hoidon kesto oli noin 3 viikkoa, olantsapiiniin liittyi suurempi keskimääräinen muutos paastoglukoosipitoisuuksissa kuin lumelääke (2,76 mg/dl vs. 0,17 mg/dl). Ero keskimääräisissä muutoksissa olantsapiinin ja lumelääkkeen välillä oli suurempi potilailla, joilla oli merkkejä glukoosin säätelyhäiriöstä lähtötilanteessa (potilaat, joilla on diagnosoitu diabetes mellitus tai siihen liittyvät haittavaikutukset, potilaat, joita hoidettiin diabeteslääkkeillä, potilaat, joiden lähtötilanteen satunnainen glukoositaso oli ≥ 200 mg/ dl ja/tai perustason paastoglukoositaso ≥ 126 mg/dl). Olantsapiinilla hoidetuilla potilailla HbA1c:n keskimääräinen nousu oli suurempi 0,04 % lähtötasosta (mediaanialtistus 21 päivää), kun taas lumelääkettä saaneiden potilaiden HbA1c:n keskimääräinen lasku oli 0,06 % (mediaanialtistus 17 päivää).
Kahdeksan lumekontrolloidun tutkimuksen (mediaanihoitoaltistus 4-5 viikkoa) analyysissä 6,1 %:lla olantsapiinilla hoidetuista potilaista (N=855) oli hoidon aiheuttamaa glykosuriaa verrattuna 2,8 %:iin lumelääkettä saaneista (N=599). . Taulukossa 2 esitetään lyhyen ja pitkän aikavälin muutokset paastoglukoositasoissa aikuisten olantsapiinimonoterapiatutkimuksista.
Paastoglukoosin keskimääräinen muutos vähintään 48 viikkoa altistuneilla potilailla oli 4,2 mg/dl (N=487). Analyyseissa potilaista, jotka saivat 9-12 kuukauden olantsapiinihoidon, keskimääräinen muutos paasto- ja ei-paasto-glukoositasoissa jatkoi nousuaan ajan myötä.
Olantsapiinimonoterapia nuorilla
Olantsapiinin turvallisuutta ja tehoa ei ole osoitettu alle 13-vuotiailla potilailla. Kolmen lumekontrolloidun olantsapiinimonoterapiatutkimuksen analyysissä nuorilla potilailla, mukaan lukien skitsofreniaa (6 viikkoa) tai kaksisuuntaista mielialahäiriötä (maanisia tai sekamuotoisia jaksoja) (3 viikkoa) sairastavilla potilailla, olantsapiiniin liittyi suurempi keskimääräinen muutos lähtötasosta paaston aikana. glukoositasot verrattuna lumelääkkeeseen (2,68 mg/dl vs. -2,59 mg/dl). Paastoglukoosin keskimääräinen muutos vähintään 24 viikkoa altistuneilla nuorilla oli 3,1 mg/dl (N=121). Taulukossa 3 esitetään lyhyen ja pitkän aikavälin muutokset paastoverensokerissa nuorten olantsapiinimonoterapiatutkimuksista.
Dyslipidemia
Ei-toivottuja lipidien muutoksia on havaittu olantsapiinin käytön yhteydessä. Olantsapiinia käyttävillä potilailla suositellaan kliinistä seurantaa, mukaan lukien lähtötilanteen ja määräajoin seurantaa koskevat lipidien arvioinnit [ks. POTILASTIEDOT ].
Kliinisesti merkitseviä ja joskus erittäin korkeita (>500 mg/dl) triglyseridipitoisuuksia on havaittu olantsapiinin käytön yhteydessä. Keskimääräistä kokonaiskolesterolin nousua on havaittu myös olantsapiinin käytön yhteydessä.
Olantsapiinimonoterapia aikuisilla
Viiden lumekontrolloidun olantsapiinimonoterapiatutkimuksen analyysissä, joissa hoidon kesto oli enintään 12 viikkoa, olantsapiinilla hoidetuilla potilailla keskimääräinen paaston kokonaiskolesteroli-, LDL-kolesteroli- ja triglyseridiarvot nousivat lähtötasosta 5,3 mg/dl, 3,0 mg/dl ja 20,8 mg/dl verrattuna keskimääräiseen paastokolesterolin, LDL-kolesterolin ja triglyseridien 6,1 mg/dl, 4,3 mg/dl ja 10,7 mg/dl paastotason laskuun lumelääkettä saaneilla potilailla. Paasto-HDL-kolesterolin osalta ei havaittu kliinisesti merkittäviä eroja olantsapiinia saaneiden potilaiden ja lumelääkettä saaneiden potilaiden välillä. Paasto-lipidiarvojen (kokonaiskolesteroli, LDL-kolesteroli ja triglyseridit) keskimääräinen nousu oli suurempi potilailla, joilla ei ollut merkkejä lipidien säätelyhäiriöstä lähtötilanteessa, jolloin lipidien säätelyhäiriöksi määriteltiin potilaita, joilla oli diagnosoitu dyslipidemia tai siihen liittyviä haittavaikutuksia, sekä potilaita, joita hoidettiin lipidejä alentavilla aineilla, tai potilaille, joilla on korkeat lähtötason lipiditasot.
Pitkäaikaisissa tutkimuksissa (vähintään 48 viikkoa) potilaiden keskimääräinen paaston kokonaiskolesteroli-, LDL-kolesteroli- ja triglyseridiarvot nousivat lähtötasosta 5,6 mg/dl, 2,5 mg/dl ja 18,7 mg/dl. HDL-kolesterolin paaston lasku 0,16 mg/dl. Analyysissa potilaista, jotka saivat 12 kuukauden hoidon loppuun, keskimääräinen ei-paasto-ajan kokonaiskolesteroli ei noussut enää noin 4-6 kuukauden kuluttua.
Niiden potilaiden osuus, joilla oli (vähintään kerran) muutoksia kokonaiskolesteroli-, LDL-kolesteroli- tai triglyseridiarvoissa normaalista tai raja-arvosta korkeaan tai HDL-kolesterolin muutoksia normaalista tai raja-arvosta matalaksi, oli suurempi pitkäaikaisissa tutkimuksissa (vähintään 48 viikkoa). verrattuna lyhytaikaisiin tutkimuksiin. Taulukko 4 esittää kategorisia muutoksia paasto-lipidiarvoissa.
Clinical Antipsychotic Trials of Intervention Effectiveness (CATIE) -tutkimuksen (Clinical Antipsychotic Trials of Intervention Effectiveness) vaiheessa 1, kun keskimääräinen altistus oli 9,2 kuukautta, triglyseridien keskimääräinen nousu olantsapiinia käyttävillä potilailla oli 40,5 mg/dl. CATIE:n vaiheessa 1 kokonaiskolesterolin keskimääräinen nousu oli 9,4 mg/dl.
Olantsapiinimonoterapia nuorilla
Olantsapiinin turvallisuutta ja tehoa ei ole osoitettu alle 13-vuotiailla potilailla. Kolmen lumekontrolloidun olantsapiinimonoterapiatutkimuksen analyysissä nuorilla, mukaan lukien nuoret, joilla oli skitsofrenia (6 viikkoa) tai kaksisuuntainen mielialahäiriö (maaniset tai sekajaksot) (3 viikkoa), olantsapiinihoitoa saaneiden nuorten keskimääräinen paaston kokonaiskolesteroli (LDL) nousi lähtötasosta. kolesteroli ja triglyseridit 12,9 mg/dl, 6,5 mg/dl ja 28,4 mg/dl, verrattuna keskimääräisen paaston kokonaiskolesterolin ja LDL-kolesterolin 1,3 mg/dl ja 1,0 mg/dl nousuun lähtötasosta ja laskuun. triglyserideissä 1,1 mg/dl lumelääkettä saaneilla nuorilla. Paasto-HDL-kolesterolin osalta ei havaittu kliinisesti merkittäviä eroja olantsapiinihoitoa saaneiden ja lumelääkettä saaneiden nuorten välillä.
Pitkäaikaisissa tutkimuksissa (vähintään 24 viikkoa) nuorten keskimääräinen paastokolesteroli-, LDL-kolesteroli- ja triglyseridiarvot nousivat lähtötasosta 5,5 mg/dl, 5,4 mg/dl ja 20,5 mg/dl, ja keskiarvo. HDL-kolesterolin paaston lasku 4,5 mg/dl. Taulukko 5 esittää kategorisia muutoksia nuorten paasto-lipidiarvoissa.
Painonnousu
Painon nousun mahdolliset seuraukset tulee ottaa huomioon ennen olantsapiinihoidon aloittamista. Olantsapiinia saavien potilaiden painoa tulee seurata säännöllisesti [ks Potilasneuvontatiedot ].
Olantsapiinimonoterapia aikuisilla
13 lumekontrolloidun olantsapiinimonoterapiatutkimuksen analyysissä olantsapiinilla hoidetut potilaat lihoivat keskimäärin 2,6 kg (5,7 lb) verrattuna keskimääräiseen 0,3 kg:n (0,6 lb) painonpudotukseen lumelääkettä saaneilla potilailla, joiden mediaanialtistus oli 6 viikkoa ; 22,2 % olantsapiinilla hoidetuista potilaista nousi vähintään 7 % lähtöpainostaan verrattuna 3 %:iin lumelääkettä saaneista potilaista, joiden mediaanialtistus tapahtumalle oli 8 viikkoa; 4,2 % olantsapiinilla hoidetuista potilaista nousi vähintään 15 % lähtöpainostaan verrattuna 0,3 %:iin lumelääkettä saaneista potilaista, ja tapahtumalle altistumisen mediaani oli 12 viikkoa. Kliinisesti merkittävää painonnousua havaittiin kaikissa lähtötilanteen painoindeksin (BMI) luokissa. Hoito keskeytettiin painonnousun vuoksi 0,2 %:lla olantsapiinia saaneista potilaista ja 0 %:lla lumelääkettä saaneista potilaista.
Pitkäaikaisissa tutkimuksissa (vähintään 48 viikkoa) keskimääräinen painonnousu oli 5,6 kg (12,3 lb) (mediaanialtistus 573 päivää, N = 2021). Niiden potilaiden prosenttiosuudet, jotka nousivat vähintään 7 %, 15 % tai 25 % lähtöpainostaan pitkäaikaisen altistuksen aikana, olivat vastaavasti 64 %, 32 % ja 12 %. Hoito keskeytettiin painonnousun vuoksi 0,4 %:lla olantsapiinihoitoa saaneista potilaista vähintään 48 viikon altistuksen jälkeen.
Taulukko 6 sisältää tiedot aikuisten painonnoususta olantsapiinilla, jotka on yhdistetty 86 kliinisestä tutkimuksesta. Kunkin sarakkeen tiedot edustavat tietoja potilaista, jotka suorittivat määritetyn keston hoitojaksot.
Annosryhmissä on havaittu eroja painonnousun suhteen. Yhdessä 8 viikkoa kestäneessä satunnaistetussa kaksoissokkoutetussa kiinteäannoksisessa tutkimuksessa, jossa verrattiin 10 (N=199), 20 (N=200) ja 40 (N=200) mg/vrk oraalista olantsapiinia skitsofreniaa tai skitsoaffektiivista häiriötä sairastavilla aikuispotilailla, Painon keskimääräinen nousu lähtötilanteesta päätepisteeseen (10 mg/vrk: 1,9 kg; 20 mg/vrk: 2,3 kg; 40 mg/vrk: 3 kg) havaittiin merkittävillä eroilla välillä 10 vs. 40 mg/vrk.
Olantsapiinimonoterapia nuorilla
Olantsapiinin turvallisuutta ja tehoa ei ole osoitettu alle 13-vuotiailla potilailla. Keskimääräinen painonnousu oli nuorilla suurempi kuin aikuisilla. Neljässä lumekontrolloidussa tutkimuksessa painonnousun vuoksi hoidon keskeyttäminen tapahtui 1 %:lla olantsapiinia saaneista potilaista verrattuna 0 %:iin lumelääkettä saaneista potilaista.
Pitkäaikaisissa tutkimuksissa (vähintään 24 viikkoa) keskimääräinen painonnousu oli 11,2 kg (24,6 lb); (mediaanialtistus 201 päivää, N = 179). Niiden nuorten prosenttiosuudet, jotka nousivat vähintään 7 %, 15 % tai 25 % lähtöpainostaan pitkäaikaisen altistuksen aikana, olivat vastaavasti 89 %, 55 % ja 29 %. Nuorten potilaiden keskimääräinen painonnousu lähtötason BMI-kategorian mukaan oli 11,5 kg (25,3 lb), 12,1 kg (26,6 lb) ja 12,7 kg (27,9 lb) normaalilla (N=106), ylipainoisella (N=26). ja lihavia (N=17). Hoito keskeytettiin painonnousun vuoksi 2,2 %:lla olantsapiinilla hoidetuista potilaista vähintään 24 viikon altistuksen jälkeen.
Taulukossa 8 esitetään tiedot nuorten painonnoususta olantsapiinilla, jotka on yhdistetty 6 kliinisestä tutkimuksesta. Kunkin sarakkeen tiedot edustavat tietoja potilaista, jotka suorittivat määritetyn keston hoitojaksot. Kliinisistä tutkimuksista on vain vähän tietoa nuorten painonnoususta olantsapiinilla yli 6 kuukauden hoidon jälkeen.
Tardiivi dyskinesia
Mahdollisesti irreversiibelien, tahattomien, dyskineettisten liikkeiden oireyhtymä voi kehittyä potilailla, joita hoidetaan psykoosilääkkeillä. Vaikka oireyhtymän esiintyvyys näyttää olevan korkein vanhuksilla, erityisesti iäkkäillä naisilla, on mahdotonta luottaa esiintyvyysarvioihin sen ennustamiseksi antipsykoottisen hoidon alussa, ketkä potilaat todennäköisesti saavat oireyhtymän. Ei tiedetä, eroavatko psykoosilääkkeet tardiivista dyskinesiasta.
Tardiivin dyskinesian kehittymisen riskin ja todennäköisyyden, että se muuttuu peruuttamattomaksi, uskotaan kasvavan hoidon keston ja potilaalle annettavien psykoosilääkkeiden kumulatiivisen kokonaisannoksen kasvaessa. Oireyhtymä voi kuitenkin kehittyä, vaikkakin paljon harvemmin, suhteellisen lyhyiden hoitojaksojen jälkeen pienillä annoksilla tai jopa hoidon lopettamisen jälkeen.
Tardiivi dyskinesia voi lievittyä osittain tai kokonaan, jos antipsykoottinen hoito lopetetaan. Antipsykoottinen hoito itsessään voi kuitenkin tukahduttaa (tai osittain tukahduttaa) oireyhtymän merkit ja oireet ja saattaa siten mahdollisesti peittää taustalla olevan prosessin. Oireisen suppression vaikutusta oireyhtymän pitkäaikaiseen kulumiseen ei tunneta.
Nämä näkökohdat huomioon ottaen olantsapiinia tulee määrätä tavalla, joka todennäköisimmin minimoi tardiivin dyskinesian esiintymisen. Krooninen antipsykoottinen hoito tulisi yleensä varata potilaille (1) jotka kärsivät kroonisesta sairaudesta, jonka tiedetään reagoivan psykoosilääkkeisiin, ja (2) joille ei ole saatavilla tai sopivia vaihtoehtoisia, yhtä tehokkaita mutta mahdollisesti vähemmän haitallisia hoitoja. Potilailla, jotka tarvitsevat kroonista hoitoa, tulee pyrkiä pienintä annosta ja lyhyintä hoidon kestoa, joka tuottaa tyydyttävän kliinisen vasteen. Hoidon jatkamisen tarvetta tulee arvioida uudelleen säännöllisesti.
Jos olantsapiinia saaneella potilaalla ilmenee tardiivin dyskinesian merkkejä ja oireita, lääkkeen käytön lopettamista tulee harkita. Jotkut potilaat saattavat kuitenkin tarvita olantsapiinihoitoa oireyhtymästä huolimatta.
Tarkempia tietoja litiumia tai valproaattia koskevista varoituksista on näiden muiden tuotteiden pakkausselosteiden Varoitukset-osiossa.
Ortostaattinen hypotensio
Olantsapiini saattaa aiheuttaa ortostaattista hypotensiota, johon liittyy huimausta, takykardiaa, bradykardiaa ja joillakin potilailla pyörtymistä, erityisesti annoksen titrausvaiheen alussa, mikä todennäköisesti heijastaa sen α1-adrenergisiä antagonistisia ominaisuuksia [ks. Potilasneuvontatiedot ].
Ortostaattista hypotensiota havaittiin ≥ 20 %:lla (1277/6030) potilaista 41 loppuun suoritetun kliinisen tutkimuksen integroidussa tietokannassa.
Suun kautta annettavassa olantsapiinihoidossa ortostaattisen hypotension ja pyörtymisen riskiä voidaan minimoida aloittamalla hoito 5 mg:lla QD [ks. ANNOSTELU JA HALLINNOINTI ]. Tavoiteannoksen asteittaista titrausta tulee harkita, jos hypotensiota ilmenee.
Hypotensiota, bradykardiaa hypotensiolla tai ilman, takykardiaa ja pyörtymistä raportoitiin myös kliinisissä tutkimuksissa, joissa olantsapiinia annettiin lihakseen. Avoimessa kliinisessä farmakologisessa tutkimuksessa skitsofreniaa sairastavilla ei-hermostuneilla potilailla, joissa lihakseen annetun olantsapiinin turvallisuutta ja siedettävyyttä arvioitiin maksimaalisella annosteluohjelmalla (kolme 10 mg:n annosta 4 tunnin välein), noin kolmanneksella näistä potilaista oli merkittävä systolisen verenpaineen ortostaattinen lasku (eli lasku ≥30 mmHg) [ks ANNOSTELU JA HALLINNOINTI ]. Pyörtymistä raportoitiin 0,6 %:lla (15/2500) olantsapiinilla hoidetuista potilaista vaiheen 2–3 oraalista olantsapiinia koskevissa tutkimuksissa ja 0,3 %:lla (2/722) olantsapiinilla hoidetuista potilaista kiihtyneisyyttä olantsapiinin lihaksensisäisissä injektiotutkimuksissa. Kolme normaalia vapaaehtoista faasin 1 tutkimuksissa lihaksensisäisellä olantsapiinilla koki hypotensiota, bradykardiaa ja korkeintaan 6 sekunnin pituisia poskiontelotaukoja, jotka hävisivät itsestään (2 tapauksessa reaktiot ilmenivät lihaksensisäisellä olantsapiinilla ja yhdessä tapauksessa oraalisen olantsapiinin yhteydessä). Tämän hypotension, bradykardian ja sinustauon sarjan riski voi olla suurempi ei-psykiatrisilla potilailla verrattuna psykiatrisiin potilaisiin, jotka ovat mahdollisesti sopeutuneet paremmin tiettyihin psykotrooppisten lääkkeiden vaikutuksiin. Lihakseen annettavan olantsapiinin injektion jälkeen potilaiden tulee pysyä makuuasennossa, jos he ovat uneliaisia tai huimausta injektion jälkeen, kunnes tutkimukset osoittavat, ettei heillä ole posturaalista hypotensiota, bradykardiaa ja/tai hypoventilaatiota.
Olantsapiinia tulee käyttää erityisen varoen potilailla, joilla on tunnettu sydän- ja verisuonisairaus (aiemmin sydäninfarkti tai iskemia, sydämen vajaatoiminta tai johtumishäiriöt), aivoverisuonisairaus ja tilat, jotka altistavat potilaan hypotensiolle (dehydraatio, hypovolemia ja hoito verenpainelääkkeillä) ), joissa pyörtyminen tai hypotensio ja/tai bradykardia saattaa lisätä potilaan lääketieteellistä riskiä.
Varovaisuus on tarpeen potilailla, jotka saavat hoitoa muilla lääkkeillä, joilla on vaikutuksia, jotka voivat aiheuttaa hypotensiota, bradykardiaa, hengitysteiden tai keskushermoston lamaa [ks. HUUMEIDEN VUOROVAIKUTUKSET ]. Lihaksensisäisen olantsapiinin ja parenteraalisen bentsodiatsepiinin samanaikaista antoa ei suositella, koska se voi aiheuttaa liiallista sedaatiota ja kardiorespiratorista lamaa.
Falls
ZYPREXA voi aiheuttaa uneliaisuutta, posturaalista hypotensiota, motorista ja sensorista epävakautta, mikä voi johtaa kaatumisiin ja sen seurauksena murtumiin tai muihin vammoihin. Potilaille, joilla on sairauksia, tiloja tai lääkkeitä, jotka voivat pahentaa näitä vaikutuksia, suorita putoamisriskin arvioinnit antipsykoottista hoitoa aloitettaessa ja toistuvasti potilailla, jotka saavat pitkäaikaista antipsykoottista hoitoa.
Leukopenia, neutropenia ja agranulosytoosi
Luokkaefekti
Kliinisissä tutkimuksissa ja/tai markkinoille tulon jälkeen on raportoitu leukopenia/neutropeniatapahtumia, jotka liittyvät ajallisesti psykoosilääkkeisiin, mukaan lukien ZYPREXA. Myös agranulosytoosia on raportoitu.
Mahdollisia leukopenian/neutropenian riskitekijöitä ovat aiempi alhainen valkosolujen määrä (WBC) ja aiempi lääkkeiden aiheuttama leukopenia/neutropenia. Potilaiden, joilla on ollut kliinisesti merkitsevä alhainen valkosoluarvo tai lääkkeiden aiheuttama leukopenia/neutropenia, koko verenkuvaa (CBC) tulee seurata usein muutaman ensimmäisen hoitokuukauden aikana, ja ZYPREXA-hoidon lopettamista tulee harkita kliinisesti merkittävän heikentymisen ensimmäisten merkkien yhteydessä. valkosoluissa ilman muita aiheuttavia tekijöitä.
Potilaita, joilla on kliinisesti merkittävää neutropeniaa, tulee seurata huolellisesti kuumeen tai muiden oireiden tai infektion merkkien varalta, ja heitä tulee hoitaa välittömästi, jos tällaisia oireita tai merkkejä ilmaantuu. Potilaiden, joilla on vaikea neutropenia (absoluuttinen neutrofiilien määrä
Dysfagia
Ruokatorven dysmotiliteetti ja aspiraatio on yhdistetty psykoosilääkkeiden käyttöön. Aspiraatiokeuhkokuume on yleinen sairastuvuuden ja kuolleisuuden syy potilailla, joilla on pitkälle edennyt Alzheimerin tauti. Olantsapiinia ei ole hyväksytty Alzheimerin tautia sairastavien potilaiden hoitoon.
Kohtaukset
Markkinoille tuloa edeltävien testien aikana kouristuskohtauksia esiintyi 0,9 %:lla (22/2500) olantsapiinilla hoidetuista potilaista. Oli hämmentäviä tekijöitä, jotka saattoivat vaikuttaa kohtausten esiintymiseen monissa näistä tapauksista. Olantsapiinia tulee käyttää varoen potilailla, joilla on ollut kouristuskohtauksia tai sairauksia, jotka mahdollisesti alentavat kohtauskynnystä, esim. Alzheimerin dementia. Olantsapiinia ei ole hyväksytty Alzheimerin tautia sairastavien potilaiden hoitoon. Kouristuskynnystä alentavat tilat voivat olla yleisempiä 65-vuotiailla tai vanhemmilla.
Kognitiivisen ja motorisen vajaatoiminnan mahdollisuus
Uneliaisuus oli yleisesti raportoitu olantsapiinihoitoon liittyvä haittavaikutus, jota esiintyi 26 %:lla olantsapiinipotilailla verrattuna 15 %:iin lumelääkettä saaneilla potilailla. Tämä haittavaikutus oli myös annoksesta riippuvainen. Uneliaisuus johti hoidon keskeyttämiseen 0,4 %:lla (9/2500) markkinointia edeltävässä tietokannassa olevista potilaista.
Koska olantsapiini saattaa heikentää harkintakykyä, ajattelua tai motorisia taitoja, potilaita tulee varoittaa vaarallisten koneiden, mukaan lukien autojen käytöstä, kunnes he ovat kohtuullisen varmoja siitä, että olantsapiinihoito ei vaikuta heihin haitallisesti [ks. Potilasneuvontatiedot ].
Kehon lämpötilan säätely
Antipsykoottisten aineiden on katsottu aiheuttavan häiriöitä kehon kyvyssä alentaa ruumiinlämpöä. Asianmukaista varovaisuutta suositellaan määrättäessä olantsapiinia potilaille, jotka kokevat tiloja, jotka voivat osaltaan kohottaa ruumiinlämpöä, esim. jotka harjoittelevat raskaasti, altistuvat äärimmäiselle kuumuudelle, saavat samanaikaisesti antikolinergisiä lääkkeitä tai ovat kuivuneet [ks. POTILASTIEDOT ].
Käyttö potilailla, joilla on samanaikainen sairaus
Kliininen kokemus olantsapiinista potilailla, joilla on tiettyjä samanaikaisia systeemisiä sairauksia, on rajallinen [ks KLIININEN FARMAKOLOGIA ].
Olantsapiinilla on in vitro -muskariinireseptoriaffiniteettia. Ennen markkinoille saattamista olantsapiinilla tehdyissä kliinisissä tutkimuksissa olantsapiiniin liittyi ummetusta, suun kuivumista ja takykardiaa. Kaikki haittavaikutukset liittyivät mahdollisesti kolinergiseen antagonismiin. Tällaiset haittavaikutukset eivät usein olleet perusteena olantsapiinihoidon keskeyttämiselle, mutta olantsapiinia tulee käyttää varoen potilailla, joilla on kliinisesti merkittävä eturauhasen liikakasvu, kapeakulmaglaukooma tai joilla on anamneesissa paralyyttinen ileus tai siihen liittyviä sairauksia.
Viidessä lumekontrolloidussa olantsapiinitutkimuksessa iäkkäillä potilailla, joilla oli dementiaan liittyvä psykoosi (n = 1184), seuraavia hoitoon liittyviä haittavaikutuksia raportoitiin olantsapiinilla hoidetuilla potilailla vähintään 2 %:lla ja huomattavasti enemmän kuin lumelääkettä saaneilla. hoidetut potilaat: kaatumiset, uneliaisuus, perifeerinen turvotus, epänormaali kävely, virtsanpidätyskyvyttömyys, letargia, painon nousu, voimattomuus, kuume, keuhkokuume, suun kuivuminen ja näköhalusinaatiot. Haittavaikutuksista johtuvien keskeytysten määrä oli suurempi olantsapiinilla kuin lumelääkettä saaneella (13 % vs. 7 %). Olantsapiinilla hoidetuilla iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi, on suurempi kuolemanriski verrattuna lumelääkkeeseen. Olantsapiinia ei ole hyväksytty dementiaan liittyvän psykoosin potilaiden hoitoon [katso LAATIKKO VAROITUS , Iäkkäät potilaat, joilla on dementiaan liittyvä psykoosi , ja POTILASTIEDOT ].
Olantsapiinia ei ole arvioitu tai käytetty merkittävässä määrin potilailla, joilla on äskettäin ollut sydäninfarkti tai epävakaa sydänsairaus. Potilaat, joilla oli tällaisia diagnooseja, suljettiin pois markkinoille saattamista edeltävistä kliinisistä tutkimuksista. Ortostaattisen hypotension riskin vuoksi olantsapiinin käytön yhteydessä on noudatettava varovaisuutta sydänpotilailla [ks. Ortostaattinen hypotensio ].
Hyperprolaktinemia
Kuten muutkin dopamiini D2-reseptoreita antagonisoivat lääkkeet, olantsapiini nostaa prolaktiinipitoisuutta, ja nousu jatkuu jatkuvan käytön aikana. Hyperprolaktinemia voi supistaa hypotalamuksen GnRH:ta, mikä johtaa aivolisäkkeen gonadotropiinin erittymisen vähenemiseen. Tämä puolestaan voi estää lisääntymistoimintoa heikentämällä sukurauhasten steroidogeneesiä sekä nais- että miespotilailla. Galaktorreaa, amenorreaa, gynekomastiaa ja impotenssia on raportoitu potilailla, jotka ovat saaneet prolaktiinia kohottavia yhdisteitä. Pitkäaikainen hyperprolaktinemia, joka liittyy hypogonadismiin, voi johtaa luun tiheyden vähenemiseen sekä nais- että miespotilailla.
Kudosviljelykokeet osoittavat, että noin kolmasosa ihmisen rintasyövistä on prolaktiinista riippuvaisia in vitro, mikä on mahdollisesti tärkeä tekijä, jos näiden lääkkeiden määrääminen harkitaan potilaalle, jolla on aiemmin todettu rintasyöpä. Kuten on tavallista prolaktiinin vapautumista lisääville yhdisteille, olantsapiinin karsinogeenisuustutkimuksissa hiirillä ja rotilla havaittiin lisääntynyt maitorauhasten neoplasia [ks. Ei-kliininen toksikologia ]. Tähän mennessä tehdyt kliiniset tutkimukset tai epidemiologiset tutkimukset eivät ole osoittaneet yhteyttä tämän lääkeluokan kroonisen annon ja kasvainten muodostumisen välillä ihmisillä; saatavilla olevaa näyttöä pidetään liian rajallisena ollakseen ratkaiseva tällä hetkellä.
Plasebokontrolloiduissa olantsapiinin kliinisissä tutkimuksissa (enintään 12 viikkoa) prolaktiinipitoisuuksien muutoksia normaalista korkeisiin havaittiin 30 %:lla olantsapiinilla hoidetuista aikuisista verrattuna 10,5 %:iin lumelääkettä saaneista aikuisista. Kliinisistä tutkimuksista tehdyssä yhdistetyssä analyysissä, johon osallistui 8136 olantsapiinilla hoidettua aikuista, mahdollisesti liittyviä kliinisiä oireita olivat kuukautisiin liittyvät tapahtumat1 (2 % [49/3240] naisista), seksuaaliseen toimintaan liittyvät tapahtumat2 (2 % [150/8136] naisista) ja miehet) ja rintoihin liittyvät tapahtumat3 (0,7 % [23/3240] naisista, 0,2 % [9/4896] miehistä).
Lumekontrolloiduissa olantsapiinimonoterapiatutkimuksissa nuorilla potilailla (enintään 6 viikkoa), joilla oli skitsofrenia tai kaksisuuntainen mielialahäiriö I (maanisia tai sekamuotoisia jaksoja), prolaktiinipitoisuuksien muutoksia normaalista korkeisiin havaittiin 47 %:lla olantsapiinilla hoidetuista potilaista verrattuna 7:ään. % lumelääkettä saaneista potilaista. Kliinisistä tutkimuksista, joihin osallistui 454 olantsapiinilla hoidettua nuorta, tehdyssä yhdistetyssä analyysissä mahdollisiin kliinisiin oireisiin kuuluivat kuukautisiin liittyvät tapahtumat1 (1 % [2/168] naisista), seksuaaliseen toimintaan liittyvät tapahtumat2 (0,7 % [3/454] naisista ja miehistä). ) ja rintoihin liittyvät tapahtumat3 (2 % [3/168] naisista, 2 % [7/286] miehistä) [ks. Käyttö tietyissä populaatioissa ].
1 Perustuu seuraavien termien hakuun: amenorrea, hypomenorrea, kuukautisten viivästyminen ja oligomenorrea.
2 Perustuu seuraavien termien hakuun: anorgasmia, viivästynyt siemensyöksy, erektiohäiriö, libidon heikkeneminen, libidon menetys, epänormaali orgasmi ja seksuaalinen toimintahäiriö.
Perustuu seuraavien termien hakuun: rintojen vuoto, suureneminen tai turvotus, galaktorrea, gynekomastia ja imetyshäiriö.
Annosryhmissä on havaittu eroja prolaktiinin nousun suhteen. Yhdessä 8 viikkoa kestäneessä satunnaistetussa kaksoissokkoutetussa kiinteäannoksisessa tutkimuksessa, jossa verrattiin 10 (N=199), 20 (N=200) ja 40 (N=200) mg/vrk oraalista olantsapiinia skitsofreniaa sairastavilla tai skitsoaffektiivisilla aikuispotilailla. häiriö, prolaktiinin nousun ilmaantuvuus >24,2 ng/ml (nainen) tai >18,77 ng/ml (mies) milloin tahansa tutkimuksen aikana (10 mg/vrk: 31,2 %; 20 mg/vrk: 42,7 %; 40 mg/vrk : 61,1 %) osoitti merkittäviä eroja 10 vs 40 mg/vrk ja 20 vs 40 mg/vrk välillä.
Käytä yhdessä fluoksetiinin, litiumin tai valproaatin kanssa
Käytettäessä ZYPREXAa ja fluoksetiinia yhdessä, lääkärin tulee myös tutustua Symbyaxin pakkausselosteen kohtaan Varoitukset ja varotoimet. Kun ZYPREXAa käytetään yhdessä litiumin tai valproaatin kanssa, lääkärin tulee katsoa litiumin tai valproaatin pakkausselosteiden Varoitukset ja varotoimet -osiot [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Laboratoriotestit
Paastoverensokerin ja lipidiprofiilin mittaamista suositellaan hoidon alussa ja ajoittain sen aikana [ks. Metaboliset muutokset ja POTILASTIEDOT ].
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ) oraalisille formulaatioille.
Potilaita tulee kertoa seuraavista ongelmista ja pyytää heitä varoittamaan lääkäriään, jos niitä ilmenee, kun he käyttävät ZYPREXA 15 mg -valmistetta monoterapiana tai yhdessä fluoksetiinin kanssa. Jos et usko paranevasi tai olet huolissasi tilastasi ZYPREXA 2,5 mg:n käytön aikana, ota yhteys lääkäriisi. Kun käytät ZYPREXAa ja fluoksetiinia yhdessä, katso myös Symbyaxin pakkausselosteen kohtaa Potilaiden neuvontatiedot.
Iäkkäät potilaat, joilla on dementiaan liittyvä psykoosi: lisääntynyt kuolleisuus ja aivoverenkierron haittatapahtumat (CVAE), mukaan lukien aivohalvaus
Potilaille ja omaishoitajille tulee kertoa, että iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi ja joita hoidetaan psykoosilääkkeillä, on lisääntynyt kuolemanriski. Potilaille ja heidän hoitajilleen tulee kertoa, että ZYPREXA-hoitoa saaneilla iäkkäillä potilailla, joilla oli dementiaan liittyvä psykoosi, oli merkitsevästi suurempi aivoverenkierron haittavaikutusten (esim. aivohalvaus, ohimenevä iskeeminen kohtaus) ilmaantuvuus lumelääkkeeseen verrattuna.
ZYPREXAa ei ole hyväksytty iäkkäille potilaille, joilla on dementiaan liittyvä psykoosi [katso LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ].
Maligni neuroleptinen oireyhtymä (NMS)
Potilaita ja hoitajia tulee neuvoa siitä, että psykoosilääkkeiden, mukaan lukien ZYPREXA, käytön yhteydessä on raportoitu mahdollisesti kuolemaan johtavaa oireyhtymää, jota joskus kutsutaan NMS:ksi. NMS:n merkkejä ja oireita ovat hyperpyreksia, lihasjäykkyys, muuttunut henkinen tila ja todisteet autonomisesta epävakaudesta (epäsäännöllinen pulssi tai verenpaine, takykardia, hikoilu ja sydämen rytmihäiriö) [ks. VAROITUKSET JA VAROTOIMET ].
Lääkereaktio eosinofilian ja systeemisten oireiden kanssa (DRESS)
Potilaita tulee neuvoa ilmoittamaan terveydenhuollon tarjoajalleen mahdollisimman varhaisessa vaiheessa kaikista merkeistä ja oireista, jotka voivat liittyä lääkereaktioon eosinofilian ja systeemisten oireiden kanssa (DRESS) [ks. VAROITUKSET JA VAROTOIMET ].
Hyperglykemia ja diabetes mellitus
Potilaita tulee kertoa mahdollisesta hyperglykemiaan liittyvien haittavaikutusten riskistä. Potilaita tulee seurata säännöllisesti glukoositasapainon heikkenemisen varalta. Diabetespotilaiden tulee noudattaa lääkärinsä ohjeita siitä, kuinka usein verensokerinsa tulee tarkistaa ZYPREXA-hoidon aikana [ks. VAROITUKSET JA VAROTOIMET ].
Dyslipidemia
Potilaita tulee neuvoa, että ZYPREXA-hoidon aikana on esiintynyt dyslipidemiaa. Potilaiden lipidiprofiilia tulee seurata säännöllisesti [katso VAROITUKSET JA VAROTOIMET ].
Painonnousu
Potilaita tulee neuvoa, että paino on noussut ZYPREXA-hoidon aikana. Potilaiden painoa tulee seurata säännöllisesti [katso VAROITUKSET JA VAROTOIMET ].
Ortostaattinen hypotensio
Potilaita tulee kertoa ortostaattisen hypotension riskistä, erityisesti aloitusannoksen titrausvaiheessa ja sellaisten lääkkeiden samanaikaisen käytön yhteydessä, jotka voivat voimistaa ZYPREXAn ortostaattista vaikutusta, esim. diatsepaami tai alkoholi [ks. VAROITUKSET JA VAROTOIMET ja HUUMEIDEN VUOROVAIKUTUKSET ]. Potilaita tulee neuvoa vaihtamaan asentoa varovasti ortostaattisen hypotension estämiseksi ja menemään makuulle, jos he tuntevat huimausta tai pyörtymistä, kunnes he tuntevat olonsa paremmaksi. Potilaita tulee neuvoa ottamaan yhteyttä lääkäriin, jos heillä on jokin seuraavista ortostaattiseen hypotensioon liittyvistä merkeistä ja oireista: huimaus, nopea tai hidas syke tai pyörtyminen.
Kognitiivisen ja motorisen vajaatoiminnan mahdollisuus
Koska ZYPREXA saattaa heikentää harkintakykyä, ajattelua tai motorisia taitoja, potilaita tulee varoittaa vaarallisten koneiden, mukaan lukien autojen, käytöstä, kunnes he ovat kohtuullisen varmoja siitä, että ZYPREXA-hoito ei vaikuta heihin haitallisesti [ks. VAROITUKSET JA VAROTOIMET ].
Kehon lämpötilan säätely
Potilaita tulee neuvoa asianmukaisesta hoidosta ylikuumenemisen ja kuivumisen välttämiseksi. Potilaita tulee neuvoa soittamaan välittömästi lääkärille, jos he sairastuvat vakavasti ja heillä on osa tai kaikki näistä kuivumisen oireista: liiallinen tai ei ollenkaan hikoilu, suun kuivuminen, erittäin kuuma tunne, jano, ei pysty erittämään virtsaa [ katso VAROITUKSET JA VAROTOIMET ].
Samanaikainen lääkitys
Potilaita tulee neuvoa ilmoittamaan terveydenhuollon tarjoajilleen, jos he käyttävät tai aikovat ottaa Symbyaxia. Potilaita tulee myös neuvoa ilmoittamaan terveydenhuollon tarjoajilleen, jos he käyttävät, suunnittelevat ottavansa tai ovat lopettaneet resepti- tai käsikauppalääkkeiden käytön, mukaan lukien yrttilisät, koska interaktiot ovat mahdollisia [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Alkoholi
Potilaita tulee neuvoa välttämään alkoholia ZYPREXA-hoidon aikana [ks HUUMEIDEN VUOROVAIKUTUKSET ].
Fenyyliketonuurit
ZYPREXA 10 mg ZYDIS (olantsapiinia suun kautta hajoavat tabletit) sisältää fenyylialaniinia (0,34, 0,45, 0,67 tai 0,90 mg per 5, 10, 15 tai 20 mg tabletti, vastaavasti) [ks. KUVAUS ].
Käyttö tietyissä populaatioissa
Raskaus
Kehota naisia ilmoittamaan terveydenhuollon tarjoajalleen, jos he tulevat raskaaksi tai aikovat tulla raskaaksi ZYPREXA-hoidon aikana. Kerro potilaille, että ZYPREXA voi aiheuttaa ekstrapyramidaalisia ja/tai vieroitusoireita (levottomuus, hypertonia, hypotonia, vapina, uneliaisuus, hengitysvaikeudet ja syömishäiriöt) vastasyntyneellä. Kerro potilaille, että on olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet ZYPREXA 7,5 mg:lle raskauden aikana [ks. Käyttö tietyissä populaatioissa ].
Imetys
Neuvo ZYPREXA 20 mg:aa käyttäviä imeviä naisia tarkkailemaan imeväisten liiallista sedaatiota, ärtyneisyyttä, huonoa ruokintaa ja ekstrapyramidaalisia oireita (vapina ja epänormaalit lihasliikkeet) ja hakeutumaan lääkärin hoitoon, jos he havaitsevat nämä merkit. [katso Käyttö tietyissä populaatioissa ].
Hedelmättömyys
Kerro lisääntymispotentiaalisille naisille, että ZYPREXA saattaa heikentää hedelmällisyyttä seerumin prolaktiinipitoisuuden nousun vuoksi. Vaikutukset hedelmällisyyteen ovat palautuvia [katso Käyttö tietyissä populaatioissa ].
Käyttö lapsille
ZYPREXA 15 mg on tarkoitettu 13–17-vuotiaiden nuorten skitsofrenian ja kaksisuuntaiseen mielialahäiriöön I liittyvien maanisten tai sekajaksojen hoitoon. Verrattuna aikuisten kliinisissä tutkimuksissa oleviin potilaisiin nuoret lihoivat todennäköisesti enemmän, kokivat lisääntynyttä sedaatiota ja kokonaiskolesteroli-, triglyseridi-, LDL-kolesteroli-, prolaktiini- ja maksan aminotransferaasitasot kohosivat enemmän. Potilaita tulee neuvoa ZYPREXAan liittyvistä mahdollisista pitkän aikavälin riskeistä ja kertoa, että nämä riskit voivat saada heidät harkitsemaan ensin muita lääkkeitä [ks. KÄYTTÖAIHEET JA KÄYTTÖ ]. ZYPREXA 5 mg:n turvallisuutta ja tehoa alle 13-vuotiailla potilailla ei ole osoitettu. ZYPREXA 15 mg:n ja fluoksetiinin yhdistelmän turvallisuus ja teho 10–17-vuotiailla potilailla on osoitettu I-tyypin kaksisuuntaiseen mielialahäiriöön liittyvien masennusjaksojen akuutin hoidossa. ZYPREXAn ja fluoksetiinin yhdistelmän turvallisuutta ja tehokkuutta alle 10-vuotiailla potilailla ei ole varmistettu [ks. VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Kattava hoito-ohjelma lapsipotilaille
ZYPREXA 20mg on tarkoitettu osaksi skitsofreniaa ja kaksisuuntaista mielialahäiriötä sairastavien lapsipotilaiden kokonaishoito-ohjelmaa, joka voi sisältää muita toimenpiteitä (psykologisia, kasvatuksellisia, sosiaalisia) potilaille, joilla on häiriö. ZYPREXA 7,5 mg:n tehoa ja turvallisuutta ei ole osoitettu alle 13-vuotiailla lapsipotilailla. Epätyypillisiä psykoosilääkkeitä ei ole tarkoitettu käytettäväksi lapsipotilailla, joilla on ympäristötekijöistä ja/tai muista primaarisista psykiatrisista häiriöistä johtuvia oireita. Sopiva koulutuspaikka on välttämätön, ja psykososiaalinen interventio on usein hyödyllistä. Päätös määrätä epätyypillistä antipsykoottista lääkitystä riippuu terveydenhuollon tarjoajan arviosta potilaan oireiden kroonisuudesta ja vakavuudesta [ks. KÄYTTÖAIHEET JA KÄYTTÖ ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Suun karsinogeenisuustutkimukset suoritettiin hiirillä ja rotilla. Olantsapiinia annettiin hiirille kahdessa 78 viikkoa kestäneessä tutkimuksessa annoksilla 3, 10, 30/20 mg/kg/vrk (vastaa 0,8-5 kertaa päivittäistä suun kautta otettavaa MRHD-arvoa mg/m² kehon pinta-alasta) ja 0,25, 2 8 mg/kg/vrk (vastaa 0,06-2 kertaa päivittäistä suun kautta otettavaa MRHD:tä, joka perustuu mg/m² kehon pinta-alaan). Rotille annettiin 2 vuoden ajan annoksia 0,25, 1, 2,5, 4 mg/kg/vrk (urokset) ja 0,25, 1, 4, 8 mg/kg/vrk (naaraat) (vastaa 0,13-2 ja 0,13-4). kertaa päivittäinen suun kautta otettava MRHD, joka perustuu mg/m² kehon pinta-alaan, vastaavasti). Maksan hemangioomien ja hemangiosarkoomien ilmaantuvuus lisääntyi merkitsevästi yhdellä hiirellä tehdyssä naarashiirillä tehdyssä tutkimuksessa 2-kertaisella päivittäisellä suun kautta otettavalla MRHD:llä laskettuna mg/m² kehon pinta-alasta. Nämä kasvaimet eivät lisääntyneet toisessa hiirillä tehdyssä tutkimuksessa naarailla, joille annettiin jopa 2-5 kertaa päivittäinen suun kautta otettava MRHD mitattuna mg/m² kehon pinta-alasta; Tässä tutkimuksessa 30/20 mg/kg/vrk-ryhmän miehillä oli suuri varhaiskuolleisuus. Maitorauhasten adenoomien ja adenokarsinoomien ilmaantuvuus lisääntyi merkittävästi naaraspuolisilla hiirillä, joille annos oli ≥ 2 mg/kg/vrk ja naarasrotilla, joille annos oli ≥ 4 mg/kg/vrk (0,5 ja 2 kertaa päivittäinen suun kautta otettava MRHD perustuen mg/m² kehon pinta-ala). Psykoosilääkkeiden on osoitettu nostavan kroonisesti prolaktiinipitoisuutta jyrsijöillä. Seerumin prolaktiinitasoja ei mitattu olantsapiinin karsinogeenisuustutkimusten aikana; Subkroonisten toksisuustutkimusten aikana tehdyt mittaukset osoittivat kuitenkin, että olantsapiini nosti seerumin prolaktiinipitoisuuden jopa 4-kertaiseksi rotilla samoilla annoksilla, joita käytettiin karsinogeenisuustutkimuksessa. Jyrsijöillä on havaittu rintarauhaskasvaimien lisääntymistä muiden psykoosilääkkeiden pitkäaikaisen annon jälkeen, ja sen katsotaan olevan prolaktiinivälitteistä. Prolaktiinivälitteisten endokriinisten kasvainten löytämisen merkitystä jyrsijöillä ei tunneta ihmisen riskin kannalta [ks. VAROITUKSET JA VAROTOIMET ].
Mutageneesi
Todisteita olantsapiinin genotoksisuudesta ei löytynyt Amesin käänteismutaatiotestissä, in vivo mikrotumatestissä hiirillä, kromosomipoikkeavuustestissä kiinanhamsterin munasarjasoluissa, suunnittelemattomassa DNA-synteesitestissä rotan maksasoluissa, eteenpäin suuntautuvan mutaatiotestin induktiotestissä hiiren lymfoomasoluissa tai in vivo -sisarkromatidinvaihtotesti kiinalaisten hamstereiden luuytimessä.
Hedelmällisyyden heikkeneminen
Rotilla tehdyssä suun hedelmällisyyttä ja lisääntymiskykyä koskevassa tutkimuksessa uroksen parittelukyky, mutta ei hedelmällisyys, heikkeni annoksella 22,4 mg/kg/vrk ja naaraan hedelmällisyys heikkeni annoksella 3 mg/kg/vrk (11 ja 1,5). kertaa päivittäinen suun kautta otettava MRHD, joka perustuu mg/m² kehon pinta-alaan, vastaavasti). Olantsapiinihoidon lopettaminen muutti vaikutukset urosten parittelukykyyn. Naarasrotilla prekoitaalinen ajanjakso pidentyi ja paritteluindeksi pieneni annoksella 5 mg/kg/vrk (2,5 kertaa päivittäinen suun kautta otettava MRHD perustuen mg/m² kehon pinta-alaan). Diestrous pitkittyi ja kiima viivästyi annoksella 1,1 mg/kg/vrk (0,6 kertaa päivittäinen suun kautta otettava MRHD perustuen mg/m² kehon pinta-alaan); siksi olantsapiini saattaa hidastaa ovulaation alkamista.
Käyttö tietyissä populaatioissa
Kun käytät ZYPREXAa ja fluoksetiinia yhdessä, katso myös Symbyaxin pakkausselosteen kohtaa Käyttö tietyissä ryhmissä.
Raskaus
Raskausaltistusrekisteri
On olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet epätyypillisille psykoosilääkkeille, mukaan lukien ZYPREXA, raskauden aikana. Terveydenhuollon tarjoajia kehotetaan rekisteröimään potilaat ottamalla yhteyttä National Pregnancy Registry for Atyyppisten antipsykoottien rekisteriin numeroon 1-866-961-2388 tai käymällä osoitteessa http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/.
Riskien yhteenveto
Vastasyntyneillä, jotka ovat altistuneet psykoosilääkkeille, mukaan lukien ZYPREXA, kolmannen raskauskolmanneksen aikana, on riski saada ekstrapyramidaalisia ja/tai vieroitusoireita synnytyksen jälkeen (ks. Kliiniset näkökohdat ). Kaiken kaikkiaan saatavilla olevat tiedot julkaistuista epidemiologisista tutkimuksista olantsapiinille altistuneilla raskaana olevilla naisilla eivät ole osoittaneet lääkkeeseen liittyvää vakavien synnynnäisten epämuodostumien, keskenmenon tai haittavaikutusten riskiä äidille tai sikiölle (ks. Data ). Hoitamaton skitsofrenia tai kaksisuuntainen mielialahäiriö I ja psykoosilääkkeille, mukaan lukien ZYPREXA 7,5 mg, raskauden aikana altistumiseen liittyvät riskit äidille (ks. Kliiniset näkökohdat ).
Olantsapiini ei ollut teratogeeninen, kun sitä annettiin suun kautta raskaana oleville rotille ja kaniineille annoksina, jotka ovat 9- ja 30-kertaiset ihmisen suun kautta otettavaan vuorokausiannokseen (MRHD) laskettuna mg/m² kehon pinta-alasta; Näillä annoksilla havaittiin joitakin sikiötoksisia vaikutuksia (ks Data ).
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski mainituilla väestöryhmillä ei ole tiedossa. Kaikilla raskauksilla on taustariski synnynnäisille epämuodostumille, menetyksille tai muille haitallisille seurauksille. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia.
Kliiniset näkökohdat
Äidin ja alkion/sikiön sairauteen liittyvä riski
Äidille on olemassa riski hoitamattomasta skitsofreniasta tai kaksisuuntaisesta mielialahäiriöstä I, mukaan lukien lisääntynyt uusiutumisen, sairaalahoidon ja itsemurhan riski. Skitsofrenia ja kaksisuuntainen mielialahäiriö I liittyvät lisääntyneisiin perinataalisiin haittavaikutuksiin, mukaan lukien ennenaikainen synnytys. Ei tiedetä, onko tämä suora seuraus sairaudesta tai muista samanaikaisista tekijöistä.
Sikiön/vastasyntyneen haittavaikutukset
Ekstrapyramidaalisia ja/tai vieroitusoireita, mukaan lukien agitaatio, hypertonia, hypotonia, vapina, uneliaisuus, hengitysvaikeudet ja syömishäiriöt, on raportoitu vastasyntyneillä, jotka ovat altistuneet psykoosilääkkeille, mukaan lukien ZYPREXA 2,5 mg, raskauden kolmannen kolmanneksen aikana. Nämä oireet ovat vaihdelleet vakavuudeltaan. Tarkkaile vastasyntyneitä ekstrapyramidaalisten ja/tai vieroitusoireiden varalta ja hallitse oireita asianmukaisesti. Jotkut vastasyntyneet toipuivat tunneissa tai päivissä ilman erityistä hoitoa; toiset vaativat pitkäaikaista sairaalahoitoa.
Data
Ihmistiedot
Istukan läpikulkua on raportoitu julkaistuissa tutkimusraporteissa; Istukan läpäisysuhde vaihteli kuitenkin voimakkaasti 7 %:n ja 167 %:n välillä syntymähetkellä raskaudenaikaisen altistuksen jälkeen. Tämän löydön kliinistä merkitystä ei tunneta.
Julkaistut tiedot havainnointitutkimuksista, syntymärekistereistä ja tapausraporteista, joissa on arvioitu epätyypillisten psykoosilääkkeiden käyttöä raskauden aikana, eivät osoita suurentunutta vakavien syntymävikojen riskiä. Medicaid-tietokannasta tehty retrospektiivinen kohorttitutkimus, jossa oli mukana 9 258 raskauden aikana psykoosilääkkeille altistunutta naista, ei osoittanut yleistä lisääntynyttä riskiä vakaville synnynnäisille epämuodostumille.
Eläinten tiedot
Rotilla tehdyissä lisääntymistutkimuksissa annoksilla 18 mg/kg/vrk asti ja kaniineilla annoksilla 30 mg/kg/vrk (9 ja 30 kertaa päivittäinen suun kautta otettava MRHD perustuen mg/m² kehon pinta-alaan). teratogeenisuutta ei havaittu. Suun kautta annetussa rotalla tehdyssä teratologisessa tutkimuksessa havaittiin varhaista resorptiota ja lisääntynyttä elottomien sikiöiden määrää annoksella 18 mg/kg/vrk (9 kertaa päivittäinen suun kautta otettava MRHD perustuen mg/m² kehon pinta-alaan), ja raskaus pitkittyi 10. mg/kg/vrk (5 kertaa päivittäinen suun kautta otettava MRHD perustuen mg/m² kehon pinta-alaan). Suun kautta tehdyssä kaniinin teratologisessa tutkimuksessa sikiötoksisuus ilmeni lisääntyneenä resorptiona ja alentuneena sikiön painona, kun emolle toksinen annos oli 30 mg/kg/vrk (30 kertaa päivittäinen suun kautta otettava MRHD laskettuna mg/m² kehon pinta-alasta).
Imetys
Riskien yhteenveto
Olantsapiini erittyy äidinmaitoon. Imeväisillä, jotka ovat altistuneet olantsapiinille äidinmaidon välityksellä, on raportoitu liiallisesta sedaatiosta, ärtyneisyydestä, huonosta ruokinnasta ja ekstrapyramidaalisista oireista (vapina ja epänormaalit lihasliikkeet) Kliiniset näkökohdat ). Olantsapiinin vaikutuksista maidontuotantoon ei ole tietoa.
Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon sekä äidin kliininen ZYPREXA-tarve ja kaikki ZYPREXAsta tai äidin perussairaudesta johtuvat mahdolliset haitalliset vaikutukset imetettävään lapseen.
Kliiniset näkökohdat
ZYPREXA 7,5 mg:lle altistuneita imeväisiä tulee tarkkailla liiallisen sedaation, ärtyneisyyden, huonon ruokinnan ja ekstrapyramidaalisten oireiden (vapina ja epänormaalit lihasliikkeet) varalta.
Naaraat ja urokset, joilla on lisääntymispotentiaali
Hedelmättömyys
Naaraat
Olantsapiinin farmakologisen vaikutuksen (D2-reseptorin antagonismi) perusteella ZYPREXA-hoito voi johtaa seerumin prolaktiinipitoisuuden nousuun, mikä voi johtaa palautuvaan hedelmällisyyden heikkenemiseen lisääntymiskykyisillä naisilla [ks. VAROITUKSET JA VAROTOIMET ].
Käyttö lapsille
Suun kautta otettavan ZYPREXAn turvallisuus ja tehokkuus skitsofrenian ja kaksisuuntaiseen mielialahäiriöön I liittyvien maanisten tai sekajaksojen hoidossa on osoitettu lyhytaikaisissa tutkimuksissa nuorilla (13–17-vuotiaat). ZYPREXA:n käyttöä nuorilla tukee näyttö riittävistä ja hyvin kontrolloiduista ZYPREXA 5 mg:n tutkimuksista, joissa 268 nuorta sai ZYPREXAa 20 mg annoksella 2,5–20 mg/vrk [ks. Kliiniset tutkimukset ]. Suositeltu aloitusannos nuorille on pienempi kuin aikuisille [katso ANNOSTELU JA HALLINNOINTI ]. Verrattuna aikuisten kliinisissä tutkimuksissa oleviin potilaisiin nuoret lihoivat todennäköisesti enemmän, kokivat lisääntynyttä sedaatiota ja kokonaiskolesteroli-, triglyseridi-, LDL-kolesteroli-, prolaktiini- ja maksan aminotransferaasitasot kohosivat enemmän [ks. VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSET ]. Päättäessään nuorille saatavilla olevista vaihtoehtoisista hoidoista kliinikon tulee ottaa huomioon painonnousun ja dyslipidemian lisääntynyt mahdollisuus (nuorilla aikuisiin verrattuna). Lääkäreiden tulee ottaa huomioon mahdolliset pitkän aikavälin riskit määrätessään lääkettä nuorille, ja monissa tapauksissa tämä voi saada heidät harkitsemaan muiden lääkkeiden määräämistä ensin nuorille [ks. KÄYTTÖAIHEET JA KÄYTTÖ ].
Olantsapiinin turvallisuutta ja tehokkuutta alle 13-vuotiailla lapsilla ei ole varmistettu [ks POTILASTIEDOT ].
ZYPREXA 7,5 mg:n ja fluoksetiinin yhdistelmän turvallisuus ja tehokkuus lapsille ja nuorille (10–17-vuotiaille) on osoitettu I-tyypin kaksisuuntaiseen mielialahäiriöön liittyvien masennusjaksojen akuutin hoidossa.
ZYPREXAn ja fluoksetiinin yhdistelmän turvallisuutta ja tehokkuutta alle 10-vuotiailla lapsilla ei ole osoitettu.
Geriatrinen käyttö
Suun kautta otettavan olantsapiinin kliinisissä tutkimuksissa markkinoille saattamista edeltäneistä 2 500 potilaasta 11 % (263) oli 65-vuotiaita tai vanhempia. Skitsofreniapotilailla ei ollut viitteitä siitä, että olantsapiinin siedettävyys olisi erilainen iäkkäillä potilailla kuin nuoremmilla potilailla. Tutkimukset iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi, ovat osoittaneet, että siedettävyysprofiili voi olla erilainen tässä populaatiossa kuin nuoremmilla skitsofreniapotilailla. Olantsapiinilla hoidetuilla iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi, on suurempi kuolemanriski verrattuna lumelääkkeeseen. Lumekontrolloiduissa olantsapiinitutkimuksissa iäkkäillä potilailla, joilla oli dementiaan liittyvä psykoosi, aivoverenkiertohäiriöiden (esim. aivohalvauksen, ohimenevän iskeemisen kohtauksen) ilmaantuvuus oli suurempi olantsapiinilla hoidetuilla potilailla kuin lumelääkettä saaneilla potilailla. Olantsapiinia ei ole hyväksytty dementiaan liittyvää psykoosia sairastavien potilaiden hoitoon. Myös sellaisten tekijöiden läsnäolon, jotka saattavat vähentää farmakokineettistä puhdistumaa tai lisätä olantsapiinin farmakodynaamista vastetta, pitäisi johtaa pienemmän aloitusannoksen harkitsemiseen kaikille iäkkäille potilaille [ks. LAATIKKO VAROITUS , ANNOSTELU JA HALLINNOINTI , ja VAROITUKSET JA VAROTOIMET ].
ZYPREXAn ja fluoksetiinin yhdistelmän kliinisissä tutkimuksissa ei ollut riittävästi 65-vuotiaita potilaita sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat potilaat.
YLIANNOSTUS
Inhimillinen kokemus
Markkinoille saattamista edeltävissä tutkimuksissa, joihin osallistui yli 3 100 potilasta ja/tai normaalia henkilöä, 67 potilaalla havaittiin tahaton tai tahallinen akuutti olantsapiinin yliannostus. Potilaalla, joka otti suurimman tunnistetun määrän, 300 mg, ainoat raportoidut oireet olivat uneliaisuus ja epäselvä puhe. Pienellä määrällä potilaita, jotka arvioitiin sairaaloissa, mukaan lukien potilas, joka otti 300 mg:aa, ei havaittu haitallisia muutoksia laboratorioanalyytteissä tai EKG:ssä. Elintoiminnot olivat yleensä normaalirajoissa yliannostuksen jälkeen.
Markkinoille tulon jälkeisissä raporteissa pelkän olantsapiinin yliannostuksesta useimmissa tapauksissa on raportoitu oireita. Oireellisilla potilailla oireita, joiden ilmaantuvuus oli ≥10 %, olivat kiihtyneisyys/aggressiivisuus, dysartria, takykardia, erilaiset ekstrapyramidaaliset oireet ja tajunnan taso sedaatiosta koomaan. Harvemmin raportoituihin oireisiin kuuluivat seuraavat mahdollisesti lääketieteellisesti vakavat reaktiot: aspiraatio, sydänpysähdys, sydämen rytmihäiriöt (kuten supraventrikulaarinen takykardia ja 1 potilas, joka kärsii sinustaukosta ja normaalin rytmin spontaani palautuminen), delirium, mahdollinen maligni neuroleptioireyhtymä, hengityslama/arrest , kouristukset, verenpainetauti ja hypotensio. Eli Lilly and Company on saanut raportteja kuolemantapauksista, jotka liittyvät pelkän olantsapiinin yliannostukseen. Yhdessä kuolemantapauksessa akuutisti nautitun olantsapiinin määrän ilmoitettiin olevan mahdollisesti niinkin alhainen kuin 450 mg oraalista olantsapiinia; kuitenkin toisessa tapauksessa potilaan ilmoitettiin selviytyvän akuutista olantsapiinin nauttimisesta noin 2 g oraalista olantsapiinia.
Yliannostuksen hallinta
Saat nykyiset tiedot ZYPREXA (olantsapiini) yliannostuksen hoidosta ottamalla yhteyttä sertifioituun myrkytystietokeskukseen (1-800-222-1222 tai www.poison.org). On harkittava useiden lääkkeiden vaikutusta. Akuutin yliannostuksen sattuessa on luotava ja ylläpidettävä hengitystiet sekä varmistettava riittävä hapetus ja ventilaatio, johon voi sisältyä intubaatio. Mahahuuhtelua (intuboinnin jälkeen, jos potilas on tajuton) ja aktiivihiilen antamista yhdessä laksatiivin kanssa tulee harkita. Aktiivihiilen (1 g) antaminen pienensi suun kautta otettavan olantsapiinin Cmax- ja AUC-arvoja noin 60 %. Koska olantsapiinin huippupitoisuudet saavutetaan tyypillisesti vasta noin 6 tunnin kuluttua annostelusta, puuhiili voi olla hyödyllinen hoito olantsapiinin yliannostukseen.
Yliannostuksen jälkeinen tajunnan heikkeneminen, kouristuskohtaukset tai pään ja kaulan dystoniset reaktiot voivat aiheuttaa aspiraatioriskin, johon liittyy oksentelua. Sydämen ja verisuonten seuranta on aloitettava välittömästi, ja siihen tulee sisältyä jatkuva elektrokardiografinen seuranta mahdollisten rytmihäiriöiden havaitsemiseksi.
Olantsapiinille ei ole spesifistä vastalääkettä. Sen vuoksi olisi aloitettava asianmukaiset tukitoimenpiteet. Hypotensiota ja verenkierron kollapsia tulee hoitaa asianmukaisilla toimenpiteillä, kuten suonensisäisellä nesteellä ja/tai sympatomimeettisilla aineilla. (Älä käytä epinefriiniä, dopamiinia tai muita sympatomimeettisiä aineita, joilla on beeta-agonistivaikutusta, koska beetastimulaatio voi pahentaa hypotensiota olantsapiinin aiheuttaman alfasalpauksen yhteydessä.) Tarkkaa lääkärin valvontaa ja seurantaa tulee jatkaa, kunnes potilas toipuu.
Tarkempia tietoja litiumin tai valproaatin yliannostuksesta on näiden tuotteiden pakkausselosteissa Yliannostus. Tarkempia tietoja olantsapiinin ja fluoksetiinin yhdistelmän yliannostuksesta on Symbyaxin pakkausselosteen Yliannostus-osiossa.
VASTA-AIHEET
- Ei mitään ZYPREXA-monoterapian yhteydessä.
- Kun käytät ZYPREXAa ja fluoksetiinia yhdessä, katso myös Symbyaxin pakkausselosteen kohtaa Vasta-aiheet.
- Tarkempia tietoja litiumin tai valproaatin vasta-aiheista on näiden muiden tuotteiden pakkausselosteiden Vasta-aiheet-osiossa.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Olantsapiinin vaikutusmekanismi luetelluissa käyttöaiheissa on epäselvä. Olantsapiinin teho skitsofreniassa saattaa kuitenkin välittyä dopamiinin ja serotoniinin tyypin 2 (5HT2) antagonismin yhdistelmän kautta.
Farmakodynamiikka
Olantsapiini sitoutuu suurella affiniteetilla seuraaviin reseptoreihin: serotoniini 5HT2A/2C, 5HT6 (Ki = 4, 11 ja 5 nM, vastaavasti), dopamiini D1-4 (Ki = 11-31 nM), histamiini H1 (Ki = 7 nM) ) ja adrenergiset a1-reseptorit (Ki = 19 nM). Olantsapiini on antagonisti, jonka affiniteetti sitoutuu kohtalaisesti serotoniiniin 5HT3 (Ki = 57 nM) ja muskariiniin M1-5 (Ki = 73, 96, 132, 32 ja 48 nM, vastaavasti). Olantsapiini sitoutuu alhaisella affiniteetilla GABAA-, BZD- ja β-adrenergisiin reseptoreihin (Ki > 10 μM).
Farmakokinetiikka
Suun kautta antaminen, monoterapia
Olantsapiini imeytyy hyvin ja saavuttaa huippupitoisuudet noin 6 tunnissa suun kautta otetun annoksen jälkeen. Se eliminoituu laajasti ensikierron metabolian kautta, ja noin 40 % annoksesta metaboloituu ennen kuin se pääsee systeemiseen verenkiertoon. Ruoka ei vaikuta olantsapiinin imeytymisen nopeuteen tai laajuuteen. Farmakokineettiset tutkimukset osoittivat, että ZYPREXA 5 mg tabletit ja ZYPREXA ZYDIS (olantsapiinia suun kautta hajoavat tabletit) olantsapiinin annosmuodot ovat biologisesti samanarvoisia.
Olantsapiinin kinetiikka on lineaarinen kliinisellä annosalueella. Sen puoliintumisaika vaihtelee 21 - 54 tunnin välillä (5. - 95. persentiili; keskiarvo 30 tuntia), ja näennäinen plasmapuhdistuma vaihtelee välillä 12 - 47 l/h (5. - 95. prosenttipiste; keskiarvo 25 l/h).
Olantsapiinin anto kerran vuorokaudessa johtaa vakaan tilan pitoisuuksiin noin 1 viikossa, mikä on noin kaksinkertainen pitoisuuksiin kerta-annosten jälkeen. Olantsapiinin plasmapitoisuudet, puoliintumisaika ja puhdistuma voivat vaihdella yksilöiden välillä tupakoinnin, sukupuolen ja iän mukaan.
Olantsapiini jakautuu laajalti koko kehoon, jakaantumistilavuus on noin 1 000 l. Se sitoutuu 93 % plasman proteiineihin pitoisuuksilla 7-1100 ng/ml ja sitoutuu ensisijaisesti albumiiniin ja happamaan α1-glykoproteiiniin.
Aineenvaihdunta ja eliminaatio
Oraalisen 14C-merkityn olantsapiinin kerta-annoksen jälkeen 7 % olantsapiiniannoksesta erittyi virtsaan muuttumattomana lääkkeenä, mikä osoittaa, että olantsapiini metaboloituu voimakkaasti. Noin 57 % annoksesta erittyi virtsaan ja 30 % ulosteeseen. Plasmassa olantsapiinin osuus kokonaisradioaktiivisuuden AUC-arvosta oli vain 12 %, mikä viittaa merkittävään altistumiseen metaboliiteille. Toistuvan annostelun jälkeen tärkeimmät verenkierrossa olevat metaboliitit olivat 10-N-glukuronidi, jota oli vakaassa tilassa 44 % olantsapiinin pitoisuudesta, ja 4Â'-N-desmetyyliolantsapiini, jota oli vakaassa tilassa 31 % olantsapiinin pitoisuudesta. . Molemmilla metaboliiteilla ei ole farmakologista aktiivisuutta havaituilla pitoisuuksilla.
Suora glukuronidaatio ja sytokromi P450 (CYP) -välitteinen hapetus ovat olantsapiinin ensisijaiset metaboliset reitit. In vitro -tutkimukset viittaavat siihen, että CYP:t 1A2 ja 2D6 sekä flaviinia sisältävä mono-oksygenaasijärjestelmä osallistuvat olantsapiinin hapettumiseen. CYP2D6-välitteinen hapettuminen näyttää olevan vähäinen aineenvaihduntareitti in vivo, koska olantsapiinin puhdistuma ei vähene henkilöillä, joilla on tämän entsyymin puutos.
Lihaksensisäinen anto
ZYPREXA Intramuscular johtaa nopeaan imeytymiseen ja huippupitoisuudet plasmassa saavutetaan 15-45 minuutissa. Terveillä vapaaehtoisilla tehdyn farmakokineettisen tutkimuksen perusteella 5 mg:n annos lihakseen tarkoitettua olantsapiinia injektiota varten tuottaa keskimäärin noin viisi kertaa korkeamman plasmapitoisuuden kuin 5 mg:n oraalisen olantsapiiniannoksen aiheuttama maksimipitoisuus plasmassa. Lihaksensisäisen annoksen jälkeen saavutettu käyrän alla oleva pinta-ala on samanlainen kuin saman annoksen oraalisen annon jälkeen. Lihakseen annon jälkeen havaittu puoliintumisaika on samanlainen kuin oraalisen annostelun jälkeen. Farmakokinetiikka on lineaarinen kliinisellä annosalueella. Metaboliset profiilit lihakseen annon jälkeen ovat kvalitatiivisesti samanlaisia kuin oraalisen annon jälkeen.
Tietyt populaatiot
Munuaisten vajaatoiminta
Koska olantsapiini metaboloituu voimakkaasti ennen erittymistä ja vain 7 % lääkkeestä erittyy muuttumattomana, pelkällä munuaisten vajaatoiminnalla ei todennäköisesti ole suurta vaikutusta olantsapiinin farmakokinetiikkaan. Olantsapiinin farmakokineettiset ominaisuudet olivat samankaltaisia potilailla, joilla oli vaikea munuaisten vajaatoiminta, ja terveillä koehenkilöillä, mikä osoittaa, että annoksen muuttaminen munuaisten vajaatoiminnan asteen mukaan ei ole tarpeen. Lisäksi olantsapiini ei poistu dialyysillä. Munuaisten vajaatoiminnan vaikutusta metaboliitin eliminaatioon ei ole tutkittu.
Maksan vajaatoiminta
Vaikka maksan vajaatoiminnan olemassaolon voidaan odottaa vähentävän olantsapiinin puhdistumaa, tutkimus heikentyneen maksan toiminnan vaikutuksesta potilailla (n=6), joilla oli kliinisesti merkittävä (Childs Pughin luokitus A ja B) kirroosi, paljasti vain vähän vaikutusta farmakokinetiikkaan. olantsapiinista.
Geriatric
Tutkimuksessa, johon osallistui 24 tervettä henkilöä, olantsapiinin keskimääräinen eliminaation puoliintumisaika oli noin 1,5 kertaa pitempi iäkkäillä (≥65-vuotiailla) kuin ei-iäkkäillä ( ANNOSTELU JA HALLINNOINTI ].
Sukupuoli
Olantsapiinin puhdistuma on noin 30 % pienempi naisilla kuin miehillä. Miesten ja naisten välillä ei kuitenkaan ollut ilmeisiä eroja tehokkuudessa tai haittavaikutuksissa. Sukupuoleen perustuvia annosmuutoksia ei pitäisi tarvita.
Tupakointitila
Olantsapiinin puhdistuma on noin 40 % korkeampi tupakoijilla kuin tupakoimattomilla, vaikka annoksen muuttamista ei rutiininomaisesti suositella.
Rotu
In vivo -tutkimukset ovat osoittaneet, että altistukset ovat samanlaisia japanilaisten, kiinalaisten ja valkoihoisten keskuudessa, erityisesti painoerojen normalisoinnin jälkeen. Annoksen muuttamista rodun mukaan ei siksi suositella.
Yhdistetyt tehosteet
Iän, tupakoinnin ja sukupuolen yhteisvaikutukset voivat johtaa merkittäviin farmakokineettisiin eroihin populaatioissa. Esimerkiksi nuorilla tupakoimattomilla miehillä puhdistuma voi olla 3 kertaa suurempi kuin iäkkäillä tupakoimattomilla naisilla. Annoksen muuttaminen saattaa olla tarpeen potilailla, joilla on yhdistelmä tekijöitä, jotka voivat johtaa olantsapiinin hitaampaan metaboliaan [ks. ANNOSTELU JA HALLINNOINTI ].
Nuoret (13-17-vuotiaat)
Kliinisissä tutkimuksissa useimmat nuoret olivat tupakoimattomia, ja tällä populaatiolla oli pienempi keskimääräinen ruumiinpaino, mikä johti korkeampaan keskimääräiseen olantsapiinialtistukseen kuin aikuisilla.
Eläinten toksikologia ja/tai farmakologia
Olantsapiinilla tehdyissä eläinkokeissa tärkeimmät hematologiset löydökset olivat palautuvat perifeeriset sytopeniat yksittäisillä koirilla, joille annettiin annos 10 mg/kg (17 kertaa päivittäinen suun kautta otettava MRHD laskettuna mg/m² kehon pinta-alasta), annoksesta riippuvainen lymfosyyttien ja neutrofiilien väheneminen hiirillä. ja lymfopeniaa rotilla. Muutamille 10 mg/kg:lla hoidetuille koirille kehittyi palautuva neutropenia ja/tai palautuva hemolyyttinen anemia 1-10 kuukauden hoidon aikana. Annosriippuvaista lymfosyyttien ja neutrofiilien vähenemistä havaittiin hiirillä, joille annettiin annoksia 10 mg/kg (vastaa 2 kertaa päivittäistä suun kautta otettavaa MRHD:tä, joka perustuu mg/m² kehon pinta-alaan) kolmen kuukauden kestoisissa tutkimuksissa. Epäspesifistä lymfopeniaa, joka on sopusoinnussa alentuneen painonnousun kanssa, esiintyi rotilla, jotka saivat 22,5 mg/kg (11 kertaa päivittäinen suun kautta otettava MRHD perustuen mg/m² kehon pinta-alaan) 3 kuukauden ajan tai 16 mg/kg (8 kertaa päivittäinen suun kautta otettava MRHD perustuu). mg/m² kehon pinta-alaa kohti) 6 tai 12 kuukauden ajan. Mitään todisteita luuytimen sytotoksisuudesta ei löydetty missään tutkituista lajeista. Luuytimet olivat normaalisoluisia tai hypersellulaarisia, mikä osoittaa, että verenkierrossa olevien verisolujen väheneminen johtui luultavasti perifeerisistä (ei-ytimen) tekijöistä.
Kliiniset tutkimukset
Kun käytät ZYPREXA 7,5 mg:aa ja fluoksetiinia yhdessä, katso myös Symbyaxin pakkausselosteen kohtaa Kliiniset tutkimukset.
Skitsofrenia
Aikuiset
Suun kautta otettavan olantsapiinin teho skitsofrenian hoidossa vahvistettiin kahdessa lyhytaikaisessa (6 viikkoa) kontrolloidussa tutkimuksessa aikuispotilailla, jotka täyttivät skitsofrenian DSM III-R -kriteerit. Yksi haloperidolihaara sisällytettiin vertailuhoitona yhteen kahdesta tutkimuksesta, mutta tässä tutkimuksessa ei verrattu näitä kahta lääkettä kaikilla kliinisesti merkityksellisillä annoksilla kummallekin.
Näissä tutkimuksissa psykiatristen merkkien ja oireiden arvioimiseen käytettiin useita instrumentteja, muun muassa Brief Psychiatric Rating Scale (BPRS), moniosainen yleisen psykopatologian luettelo, jota on perinteisesti käytetty skitsofrenian huumehoidon vaikutusten arvioimiseen. BPRS-psykoosiklusteria (käsitteellinen epäjärjestys, hallusinatorinen käyttäytyminen, epäluuloisuus ja epätavallinen ajatussisältö) pidetään erityisen hyödyllisenä osaryhmänä arvioitaessa aktiivisesti psykoottisia skitsofreniapotilaita. Toinen perinteinen arviointi, Clinical Global Impression (CGI), heijastaa ammattitaitoisen tarkkailijan, joka on täysin perehtynyt skitsofrenian ilmenemismuotoihin, vaikutelman potilaan yleisestä kliinisestä tilasta. Lisäksi käytettiin kahta äskettäin kehitettyä vaakaa; Näitä olivat 30-kohdan positiivisten ja negatiivisten oireiden asteikko (PANSS), johon on upotettu BPRS:n 18 kohtaa, ja negatiivisten oireiden arviointiasteikko (SANS). Alla olevat koeyhteenvedot keskittyvät seuraaviin tuloksiin: PANSS yhteensä ja/tai BPRS yhteensä; BPRS-psykoosiklusteri; PANSS negatiivinen alaskaala tai SANS; ja CGI:n vakavuus. Kokeiden tulokset ovat seuraavat:
(1) 6 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa (n = 149), jossa oli kaksi kiinteää olantsapiiniannosta 1 ja 10 mg/vrk (kerran vuorokaudessa), olantsapiinia 10 mg/vrk (mutta ei 1 mg/vrk). päivä), oli parempi kuin lumelääke PANSS-kokonaispisteissä (myös erotetussa BPRS-kokonaispisteessä), BPRS-psykoosiklusterissa, PANSS-negatiivisessa ala-asteikossa ja CGI-vakavuudessa.
(2) 6 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa (n = 253), jossa oli kolme kiinteää olantsapiiniannosaluetta (5 ± 2,5 mg/vrk, 10 ± 2,5 mg/vrk ja 15 ± 2,5 mg/vrk) kerran vuorokaudessa annettaessa kaksi suurinta olantsapiiniannosryhmää (todelliset keskiannokset 12 ja 16 mg/vrk) olivat parempia kuin lumelääke BPRS:n kokonaispisteytyksen, BPRS-psykoosiklusterin ja CGI-vakavuuspisteiden suhteen; suurin olantsapiiniannosryhmä oli parempi kuin lumelääke SANS-tutkimuksessa. Suuren annoksen ryhmällä ei ollut selvää etua keskiannoksen ryhmään verrattuna.
(3) Pitkäaikaisessa tutkimuksessa aikuiset avopotilaat (n=326), jotka täyttivät pääasiassa DSM-IV:n skitsofrenian kriteerit ja jotka pysyivät vakaina olantsapiinilla avoimen hoidon aikana vähintään 8 viikkoa, satunnaistettiin jatkamaan nykyistä olantsapiinihoitoaan. annokset (vaihtelevat 10-20 mg/vrk) tai lumelääkettä. Potilaiden uusiutumisen seurantajakso, joka määritellään BPRS-positiivisten oireiden lisääntymisenä tai sairaalahoitona, suunniteltiin 12 kuukaudeksi, mutta kriteerit kokeen keskeyttämiseksi varhain täyttyivät, koska lumelääkettä esiintyi enemmän kuin olantsapiinin uusiutumista. , ja olantsapiini oli parempi kuin lumelääke ajoissa uusiutumiseen, mikä oli tämän tutkimuksen ensisijainen tulos. Siten olantsapiini oli lumelääkettä tehokkaampi säilyttämään tehonsa potilailla, jotka olivat vakiintuneet noin 8 viikon ajan ja joita seurattiin jopa 8 kuukauden havainnointijakson ajan.
Väestön alaryhmien (rotu ja sukupuoli) tarkastelu ei paljastanut mitään eroavaa vastetta näiden alaryhmien perusteella.
Nuoret
Suun kautta otettavan olantsapiinin teho skitsofrenian akuutissa hoidossa nuorilla (13–17-vuotiaat) varmistettiin 6 viikkoa kestäneessä kaksoissokkoutetussa, lumekontrolloidussa, satunnaistetussa tutkimuksessa skitsofreniapotilailla ja avohoidoilla (n=107). DSM-IV-TR:n mukaiset diagnostiset kriteerit, jotka on vahvistettu Kiddie Schedule for Affective Disorders and skitsofrenia for School Aged Aged Children - Present and Lifetime Version (K-SADS-PL).
Ensisijainen arviointiväline, jota käytettiin psykiatristen merkkien ja oireiden arvioinnissa tässä kokeessa, oli Ankkuroitu versio lasten psykiatrisen lyhytarviointiasteikon (BPRS-C) kokonaispistemäärästä.
Tässä joustavan annoksen tutkimuksessa olantsapiinia 2,5–20 mg/vrk (keskimääräinen modaalinen annos 12,5 mg/vrk, keskimääräinen annos 11,1 mg/vrk) oli tehokkaampi kuin lumelääke skitsofreniadiagnoosin saaneiden nuorten hoidossa, mitä tilastollisesti tukevat. merkitsevästi suurempi keskimääräinen BPRS-C-kokonaispistemäärän lasku olantsapiinihoitoryhmän potilailla kuin lumeryhmässä.
Vaikka käytettävissä ei ole todisteita, jotka vastaisivat kysymykseen siitä, kuinka kauan ZYPREXA-hoitoa saavaa nuorta potilasta tulisi jatkaa, ylläpitoteho voidaan ekstrapoloida aikuisten tiedoista sekä olantsapiinin farmakokineettisten parametrien vertailusta aikuisilla ja nuorilla potilailla. Yleensä suositellaan, että hoitovastetta saavien potilaiden hoitoa jatketaan akuutin vasteen jälkeen, mutta pienimmällä annoksella, joka tarvitaan remission ylläpitämiseen. Potilaat tulee säännöllisesti arvioida uudelleen ylläpitohoidon tarpeen määrittämiseksi.
Kaksisuuntainen mielialahäiriö I (maaniset tai sekajaksot)
Aikuiset
Monoterapia
Oraalisen olantsapiinin teho maanisten tai sekamuotoisten jaksojen hoidossa varmistettiin kahdessa lyhytaikaisessa (yksi 3 viikkoa ja yksi 4 viikkoa) lumekontrolloidussa tutkimuksessa aikuispotilailla, jotka täyttivät I-kaksisuuntaisen mielialahäiriön DSM-IV-kriteerit. maaniset tai sekajaksot. Näihin tutkimuksiin osallistui potilaita, joilla oli tai ei ollut psykoottisia piirteitä ja joilla oli tai ei ollut nopeaa pyöräilyä.
Näissä kokeissa maanisten oireiden arvioinnissa käytetty ensisijainen luokitusväline oli Young Mania Rating Scale (Y-MRS), 11 kohdan kliinikon arvioima asteikko, jota käytetään perinteisesti arvioimaan maanisten oireiden astetta (ärtyneisyys, häiritsevä/aggressiivinen käyttäytyminen, uni). , kohonnut mieliala, puhe, lisääntynyt aktiivisuus, seksuaalinen kiinnostus, kieli-/ajatteluhäiriö, ajatussisältö, ulkonäkö ja oivallus) välillä 0 (ei maanisia piirteitä) - 60 Â (maksimipisteet). Ensisijainen tulos näissä tutkimuksissa oli muutos lähtötasosta Y-MRS-kokonaispisteissä. Kokeiden tulokset ovat seuraavat:
(1) Yhdessä 3 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa (n = 67), joka sisälsi olantsapiinin annosalueen (5-20 mg/vrk, kerran päivässä, alkaen annoksesta 10 mg/vrk), olantsapiini oli lumelääkettä parempi Y-MRS:n kokonaispistemäärän aleneminen. Samanaikaisesti ensimmäisen tutkimuksen kanssa suoritetussa identtisessä tutkimuksessa olantsapiini osoitti samanlaista hoitoeroa, mutta mahdollisesti näytteen koosta ja paikan vaihteluista johtuen, sen ei osoitettu olevan parempi kuin lumelääke tässä tuloksessa.
(2) 4 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa (n=115), johon osallistui olantsapiinin annosalue (5-20 mg/vrk, kerran päivässä, alkaen annoksesta 15 mg/vrk), olantsapiini oli lumelääkettä parempi Y-MRS:n kokonaispistemäärän aleneminen.
(3) Toisessa tutkimuksessa 361 potilasta, jotka täyttivät I-tyypin kaksisuuntaisen mielialahäiriön maanisen tai sekavaiheen DSM-IV-kriteerit ja jotka olivat reagoineet avoimen aloitusvaiheen aikana keskimäärin noin 2 viikon ajan olantsapiiniin 5-20 mg/ päivänä satunnaistettiin joko jatkamaan olantsapiinin käyttöä samalla annoksella (n = 225) tai saamaan lumelääkettä (n = 136) uusiutumisen havaitsemiseksi. Noin 50 % potilaista oli lopettanut olantsapiiniryhmän hoidon päivään 59 mennessä ja 50 % lumelääkeryhmästä oli lopettanut kaksoissokkohoidon päivään 23 mennessä. Avoimen vaiheen vaste määriteltiin siten, että Y-MRS:n kokonaispistemäärä laski arvoon ≤12 ja HAM-D 21 arvoon ≤8. Relapsi kaksoissokkovaiheen aikana määriteltiin Y-MRS- tai HAM-D 21 -kokonaispistemäärän nousuksi ≥15:een tai sairaalahoitoon joko manian tai masennuksen vuoksi. Satunnaistetussa vaiheessa potilailla, jotka saivat jatkuvasti olantsapiinia, oli merkittävästi pidempi aika uusiutumiseen.
Litiumin tai valproaatin lisäaine
Suun kautta annetun olantsapiinin ja litiumin tai valproaatin samanaikaisen käytön teho mania- tai sekajaksojen hoidossa vahvistettiin kahdessa kontrolloidussa tutkimuksessa potilailla, jotka täyttivät I-tyypin kaksisuuntaisen mielialahäiriön DSM-IV-kriteerit, joilla on maanisia tai sekamuotoisia jaksoja. Näihin tutkimuksiin osallistui potilaita, joilla oli tai ei ollut psykoottisia piirteitä ja joilla oli tai ei ollut nopeaa pyöräilyä. Kokeiden tulokset ovat seuraavat:
(1) Yhdessä 6 viikkoa kestäneessä lumekontrolloidussa yhdistelmätutkimuksessa 175 litium- tai valproaattihoitoa saavaa avopotilasta, joilla oli riittämättömästi hallittuja maanisia tai sekaoireita (Y-MRS ≥16), satunnaistettiin saamaan joko olantsapiinia tai lumelääkettä yhdessä alkuperäisen hoitonsa kanssa. . Olantsapiini (annosalueella 5-20 mg/vrk, kerran vuorokaudessa, alkaen annoksesta 10 mg/vrk) yhdistettynä litiumiin tai valproaattiin (terapeuttisella alueella 0,6-1,2 mEq/l tai 50 µg/ml- 125 µg/ml) oli parempi kuin pelkkä litium tai valproaatti Y-MRS:n kokonaispistemäärän pienentymisessä.
(2) Toisessa 6 viikkoa kestäneessä lumekontrolloidussa yhdistelmätutkimuksessa 169 litium- tai valproaattihoitoa saavaa avopotilasta, joilla oli riittämättömästi hallittuja maanisia tai sekaoireita (Y-MRS ≥16), satunnaistettiin saamaan joko olantsapiinia tai lumelääkettä yhdessä alkuperäisen lääkkeensä kanssa. terapiaa. Olantsapiini (annosalueella 5-20 mg/vrk, kerran vuorokaudessa, alkaen annoksesta 10 mg/vrk) yhdistettynä litiumiin tai valproaattiin (terapeuttisella alueella 0,6-1,2 mEq/l tai 50 µg/ml- 125 µg/ml) oli parempi kuin pelkkä litium tai valproaatti Y-MRS:n kokonaispistemäärän pienentymisessä.
Nuoret
Akuutti monoterapia
Suun kautta otettavan olantsapiinin teho akuuttien maanisten tai sekamuotoisten jaksojen hoidossa nuorilla (13–17-vuotiaat) varmistettiin 3 viikkoa kestäneessä kaksoissokkoutetussa, lumekontrolloidussa, satunnaistetussa tutkimuksessa nuorilla sairaala- ja avohoitopotilailla, jotka täyttivät diagnostiset vaatimukset. kriteerit I-tyypin kaksisuuntaiseen mielialahäiriöön liittyville maanisille tai sekajaksoille (psykoottisilla piirteillä tai ilman) DSM-IV-TR:n mukaan (n = 161). K-SADS-PL vahvisti diagnoosin.
Tässä tutkimuksessa maanisten oireiden arvioinnissa käytetty ensisijainen arviointiväline oli nuorten strukturoidun nuorten mania-arviointiasteikon (Y-MRS) kokonaispistemäärä.
Tässä joustavan annoksen tutkimuksessa olantsapiini 2,5–20 mg/vrk (keskimääräinen modaalinen annos 10,7 mg/vrk, keskimääräinen annos 8,9 mg/vrk) oli lumelääkettä tehokkaampi hoidettaessa nuoria, joilla oli kaksisuuntaiseen mielialahäiriöön I liittyviä maanisia tai sekajaksoja. häiriö, mitä tukee tilastollisesti merkitsevästi suurempi keskimääräinen aleneminen Y-MRS-kokonaispisteissä potilailla olantsapiinihoitoryhmässä kuin lumeryhmässä.
Vaikka käytettävissä ei ole todisteita, jotka vastaisivat kysymykseen siitä, kuinka kauan ZYPREXA-hoitoa saavaa nuorta potilasta tulisi jatkaa, ylläpitoteho voidaan ekstrapoloida aikuisten tiedoista sekä olantsapiinin farmakokineettisten parametrien vertailusta aikuisilla ja nuorilla potilailla. Yleensä suositellaan, että hoitovastetta saavien potilaiden hoitoa jatketaan akuutin vasteen jälkeen, mutta pienimmällä annoksella, joka tarvitaan remission ylläpitämiseen. Potilaat tulee säännöllisesti arvioida uudelleen ylläpitohoidon tarpeen määrittämiseksi.
Skitsofreniaan ja I kaksisuuntaiseen mielialaan liittyvään maniaan liittyvä kiihtymys
Lihakseen annettavan injektiona annettavan olantsapiinin teho kiihtyneisyyden hoidossa vahvistettiin kolmessa lyhytaikaisessa (24 tuntia IM-hoitoa) lumekontrolloidussa tutkimuksessa kiihtyneillä aikuisilla laitospotilailla kahdesta diagnostisesta ryhmästä: skitsofrenia ja kaksisuuntainen mielialahäiriö I (maaniset tai sekajaksot) . Kuhunkin tutkimukseen sisältyi yksi aktiivinen vertailuhoitohaara joko haloperidoli-injektiolla (skitsofreniatutkimukset) tai loratsepaami-injektiolla (kaksisuuntainen mieliala I maniatutkimus). Tutkimuksiin osallistuneiden potilaiden piti: (1) arvioida kliiniset tutkijat kliinisesti kiihtyneiksi ja kliinisesti sopiviksi ehdokkaiksi hoidettavaksi lihaksensisäisellä lääkityksellä ja (2) levottomuutta, joka saavutti tai ylitti kynnysarvon ≥14 5 kohdetta, jotka sisältävät positiivisen ja negatiivisen oireyhtymäasteikon (PANSS) kiihtyneen komponentin (eli huono impulssinhallinta, jännitys, vihamielisyys, yhteistyökyvyttömyys ja jännityskohteet), joissa vähintään 1 yksittäisen kohteen pistemäärä on ≥ 4 pisteytysjärjestelmällä 1-7 (1 = poissa, 4 = kohtalainen, 7 = äärimmäinen). Tutkimuksissa keskimääräinen lähtötason PANSS Excited Component -pistemäärä oli 18,4 ja pisteet vaihtelivat välillä 13-32 (maksimipistemäärästä 35), mikä viittaa pääosin kohtalaiseen kiihtyneisyyteen ja joillakin potilailla oli lievää tai vaikeaa levottomuutta. Ensisijainen tehon mitta, jota käytettiin kiihtyneisyyden merkkien ja oireiden arvioinnissa näissä tutkimuksissa, oli PANSS Excited Componentin muutos lähtötasosta 2 tuntia injektion jälkeen. Potilaat voivat saada jopa 3 injektiota 24 tunnin IM-hoitojaksojen aikana; potilaat eivät kuitenkaan voineet saada toista injektiota ennen kuin ensimmäisen 2 tunnin jakson jälkeen, jolloin ensisijainen tehokkuusmitta arvioitiin. Kokeiden tulokset ovat seuraavat:
(1) Plasebokontrolloidussa tutkimuksessa kiihtyneillä laitospotilailla, jotka täyttivät skitsofrenian DSM-IV-kriteerit (n = 270), arvioitiin 4 kiinteää lihaksensisäistä olantsapiinia injektioannoksilla 2,5 mg, 5 mg, 7,5 mg ja 10 mg. Kaikki annokset olivat tilastollisesti parempia kuin lumelääke PANSS Excited Component -komponentilla 2 tuntia injektion jälkeen. Vaikutus oli kuitenkin suurempi ja johdonmukaisempi 3 suurimmalla annoksella. Ei ollut merkittäviä parittaisia eroja 7,5 ja 10 mg:n annoksilla verrattuna 5 mg:n annoksiin.
(2) Toisessa lumekontrolloidussa tutkimuksessa kiihtyneillä laitospotilailla, jotka täyttivät skitsofrenian DSM-IV-kriteerit (n=311), arvioitiin yksi kiinteä lihaksensisäinen 10 mg:n injektioannos olantsapiini. Injektioon tarkoitettu olantsapiini oli tilastollisesti parempi kuin lumelääke PANSS Excited Component -komponentilla 2 tuntia injektion jälkeen.
(3) Plasebokontrolloidussa tutkimuksessa kiihtyneillä laitospotilailla, jotka täyttivät I-tyypin kaksisuuntaisen mielialahäiriön DSM-IV-kriteerit (ja joilla on tällä hetkellä akuutti maaninen tai sekajakso psykoottisten oireiden kanssa tai ilman) (n = 201), 1 kiinteä lihaksensisäinen olantsapiini injektioannos 10 mg arvioitiin. Injektioon tarkoitettu olantsapiini oli tilastollisesti parempi kuin lumelääke PANSS Excited Component -komponentilla 2 tuntia injektion jälkeen.
Väestön alaryhmien (ikä, rotu ja sukupuoli) tarkastelu ei paljastanut mitään eroavaa vastetta näiden alaryhmien perusteella.
POTILASTIEDOT
ZYPREXA® (zy-PREX-a) (olantsapiini) Tabletti
ZYPREXA® ZYDIS® (zy-PREX-a ZY-dis) (olantsapiini) tabletti, suussa hajoava
Lue ZYPREXAn mukana tuleva lääkitysopas ennen kuin aloitat sen käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Tämä lääkitysopas ei korvaa sitä, että keskustelet lääkärisi kanssa terveydentilastasi tai hoidostasi. Keskustele lääkärin tai apteekkihenkilökunnan kanssa, jos et ymmärrä jotain tai haluat tietää lisää ZYPREXAsta.
Mikä on tärkein tieto, joka minun pitäisi tietää ZYPREXAsta?
ZYPREXA 20mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
Nämä vakavat sivuvaikutukset on kuvattu alla.
1. Suurentunut kuolemanriski iäkkäillä ihmisillä, jotka ovat hämmentyneitä, heikentyneet muistissa ja menettäneet yhteyden todellisuuteen (dementiaan liittyvä psykoosi). ZYPREXAa ei ole hyväksytty psykoosin hoitoon vanhuksilla, joilla on dementia.
2. Korkea verensokeri (hyperglykemia). Korkea verensokeri voi esiintyä, jos sinulla on jo diabetes tai jos sinulla ei ole koskaan ollut diabetesta. Korkea verensokeri voi johtaa:
- hapon kertyminen vereen ketonien vuoksi (ketoasidoosi)
- kooma
- kuolema
Lääkärisi tulee tehdä kokeita verensokerisi tarkistamiseksi ennen kuin aloitat ZYPREXA 7,5 mg -valmisteen käytön ja hoidon aikana. Ihmisillä, joilla ei ole diabetesta, korkea verensokeri joskus häviää, kun ZYPREXA 7,5 mg:n käyttö lopetetaan. Diabeetikoiden ja joidenkin ihmisten, joilla ei ollut diabetesta ennen ZYPREXAn ottamista, on otettava lääke korkeaan verensokeriin myös ZYPREXA-hoidon lopettamisen jälkeen.
Jos sinulla on diabetes, noudata lääkärisi ohjeita siitä, kuinka usein sinun tulee tarkistaa verensokerisi ZYPREXA-hoidon aikana.
Soita lääkärillesi jos sinulla on jokin näistä korkean verensokerin (hyperglykemian) oireista ZYPREXA-hoidon aikana:
- tuntuu kovin janoiselta
- täytyy virtsata tavallista enemmän
- tuntuu kovin nälkäiseltä
- tuntuu heikolta tai väsyneeltä
- tuntuu pahalta vatsassasi
- olet hämmentynyt tai hengityksesi tuoksuu hedelmäiseltä
3. Veren korkea rasvapitoisuus (kolesteroli ja triglyseridit). Suuria rasvapitoisuuksia voi esiintyä ihmisillä, joita hoidetaan ZYPREXA 10 mg:lla, erityisesti teini-ikäisillä (13–17-vuotiailla) tai lapsilla (10–17-vuotiailla) yhdessä fluoksetiinin kanssa. Sinulla ei ehkä ole oireita, joten lääkärisi tulee tehdä verikokeita kolesteroli- ja triglyseridipitoisuuksien tarkistamiseksi ennen ZYPREXA-hoidon aloittamista ja hoidon aikana.
4. Painonnousu. Painonnousu on hyvin yleistä ihmisillä, jotka käyttävät ZYPREXAa. Teini-ikäiset (13–17-vuotiaat) lihovat todennäköisemmin ja lihoavat enemmän kuin aikuiset. Myös lapset (10–17-vuotiaat) lihoavat ja lihoavat todennäköisemmin kuin aikuiset, kun ZYPREXA 7,5 mg:aa käytetään yhdessä fluoksetiinin kanssa. Jotkut ihmiset voivat lihoa paljon ZYPREXA-hoidon aikana, joten sinun ja lääkärisi tulee tarkistaa painosi säännöllisesti. Keskustele lääkärisi kanssa tavoista hallita painonnousua, kuten syömällä terveellistä, tasapainoista ruokavaliota ja harjoittelua.
Mikä ZYPREXA on?
ZYPREXA on reseptilääke, jota käytetään:
- skitsofrenia 13-vuotiailla tai sitä vanhemmilla.
- kaksisuuntainen mielialahäiriö, mukaan lukien:
- maaniset tai sekajaksot, joita esiintyy kaksisuuntaisen mielialahäiriön I kanssa 13-vuotiailla tai sitä vanhemmilla ihmisillä.
- maaniset tai sekajaksot, joita esiintyy kaksisuuntaisen mielialahäiriön I kanssa käytettäessä litiumin tai valproaatin kanssa aikuisilla.
- kaksisuuntaisen mielialahäiriön I pitkäaikainen hoito aikuisilla.
- masennusjaksot, jotka ilmenevät kaksisuuntaisen mielialahäiriön I kanssa, kun niitä käytetään fluoksetiinilääkkeen (Prozac®) kanssa vähintään 10-vuotiailla.
- masennusjaksot, jotka eivät parane kahden muun lääkkeen käytön jälkeen, joita kutsutaan myös hoitoresistentiksi masennukseksi, kun niitä käytetään yhdessä fluoksetiinilääkkeen (Prozac) kanssa aikuisilla.
ZYPREXA 7,5 mg:aa ei ole hyväksytty alle 13-vuotiaille lapsille. ZYPREXA 10 mg:aa yhdessä fluoksetiinin kanssa ei ole hyväksytty käytettäväksi alle 10-vuotiaille lapsille.
Skitsofrenian oireisiin kuuluvat äänien kuuleminen, puuttuvien asioiden näkeminen, epätodenmukaisuus ja epäluuloisuus tai sulkeutuminen.
Kaksisuuntaisen mielialahäiriön oireita ovat vaihtelevat masennusjaksot ja korkea tai ärtyisä mieliala, lisääntynyt aktiivisuus ja levottomuus, ajatukset, nopea puhuminen, impulsiivinen käyttäytyminen ja vähentynyt unentarve.
Hoitoon vastustuskykyisen masennuksen oireita ovat alentunut mieliala, vähentynyt kiinnostus, lisääntyneet syyllisyyden tunteet, vähentynyt energia, vähentynyt keskittymiskyky, muutokset ruokahalussa ja itsemurha-ajatukset tai -käyttäytyminen.
Jotkut oireistasi voivat parantua hoidon myötä. Jos et usko, että paranet, soita lääkärillesi.
Mitä minun tulee kertoa lääkärilleni ennen ZYPREXAn ottamista?
ZYPREXA ei ehkä ole oikea sinulle. Kerro lääkärillesi ennen ZYPREXAn aloittamista, jos sinulla on tai on ollut:
- sydänongelmat
- kohtauksia
- diabetes tai korkea verensokeri (hyperglykemia)
- korkea kolesteroli- tai triglyseridiarvo veressäsi
- maksaongelmia
- matala tai korkea verenpaine
- aivohalvaukset tai "minihalvaukset", joita kutsutaan myös ohimeneviksi iskeemisiksi kohtauksiksi (TIA)
- Alzheimerin tauti
- kapeakulmaglaukooma
- laajentunut eturauhanen miehillä
- suolen tukos
- fenyyliketonuria, koska ZYPREXA 5 mg ZYDIS sisältää fenyylialaniinia
- rintasyöpä
- itsemurha-ajatuksia tai itsensä satuttamista
- mikä tahansa muu sairaus
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, vahingoittaako ZYPREXA 2,5 mg sikiötäsi.
- Jos tulet raskaaksi ZYPREXA 20mg -hoidon aikana, keskustele terveydenhuollon tarjoajasi kanssa rekisteröitymisestä National Pregnancy Registry for Atyyppisten antipsykoottien rekisteriin. Voit rekisteröityä soittamalla numeroon 1-866-961-2388 tai siirtymällä osoitteeseen http://womensmentalhealth.org/clinical-andresearch-programs/pregnancyregistry/.
- imetät tai aiot imettää. ZYPREXA erittyy äidinmaitoon. Keskustele lääkärisi kanssa siitä, mikä on paras tapa ruokkia vauvasi, jos käytät ZYPREXAa.
Kerro lääkärillesi, jos liikut paljon tai olet usein kuumissa paikoissa.
Kaksisuuntaisen mielialahäiriön I, hoitoresistentin masennuksen tai skitsofrenian oireita voivat olla itsemurha-ajatuksia tai vahingoittaa itseäsi tai muita. Jos sinulla on näitä ajatuksia milloin tahansa, kerro siitä lääkärillesi tai mene heti ensiapuun.
Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät. ZYPREXA 20 mg ja jotkin lääkkeet voivat olla yhteisvaikutuksia keskenään, eivätkä ne välttämättä toimi yhtä hyvin tai voivat aiheuttaa vakavia sivuvaikutuksia. Lääkärisi voi kertoa sinulle, onko ZYPREXAa turvallista käyttää muiden lääkkeiden kanssa. Älä aloita tai lopeta mitään lääkettä ZYPREXA-hoidon aikana keskustelematta ensin lääkärin kanssa.
Miten minun pitäisi ottaa ZYPREXA 7,5 mg?
- Ota ZYPREXA juuri niin kuin on määrätty. Lääkärisi saattaa joutua muuttamaan (säätämään) ZYPREXA 15 mg -annosta, kunnes se sopii sinulle.
- Jos unohdat ottaa ZYPREXA 20 mg -annoksen, ota unohtunut annos heti kun muistat. Jos on melkein seuraavan annoksen aika, jätä unohtunut annos väliin ja ota seuraava annos normaaliin aikaan. Älä ota kahta ZYPREXA 10 mg annosta samanaikaisesti.
- Älä lopeta ZYPREXAn käyttöä äkillisesti vakavien sivuvaikutusten välttämiseksi. Jos sinun on lopetettava ZYPREXA-valmisteen käyttö, lääkärisi voi kertoa sinulle, kuinka voit lopettaa sen käytön turvallisesti.
- Jos otat liikaa ZYPREXAa, soita heti lääkärillesi tai myrkytystietokeskukseen numeroon 1-800-222-1222 tai hakeudu ensiapuun.
- ZYPREXA 10 mg voidaan ottaa ruoan kanssa tai ilman ruokaa.
- ZYPREXA otetaan yleensä kerran päivässä.
- Ota ZYPREXA 20 mg ZYDIS seuraavasti:
- Varmista, että kätesi ovat kuivat.
- Avaa pussi ja irrota kalvo läpipainopakkauksesta. Älä työnnä tablettia kalvon läpi.
- Heti kun avaat läpipainopakkauksen, poista tabletti ja laita se suuhusi.
- Tabletti hajoaa nopeasti syljessäsi, joten voit helposti niellä sen juomaveden kanssa tai ilman.
- Soita lääkärillesi, jos et usko paranevasi tai olet huolissasi tilastasi ZYPREXA-hoidon aikana.
Mitä minun tulisi välttää ZYPREXA-hoidon aikana?
- ZYPREXA voi aiheuttaa uneliaisuutta ja vaikuttaa kykyysi tehdä päätöksiä, ajatella selkeästi tai reagoida nopeasti. Älä aja autoa, käytä raskaita koneita tai tee muuta vaarallista toimintaa, ennen kuin tiedät, kuinka ZYPREXA 7,5 mg vaikuttaa sinuun.
- Vältä alkoholin juomista ZYPREXA-hoidon aikana. Alkoholin juominen ZYPREXA-hoidon aikana saattaa tehdä sinut uneliaammaksi kuin jos käytät ZYPREXA 15 mg yksinään.
Mitkä ovat ZYPREXA 5mg:n mahdolliset sivuvaikutukset?
Kun otat ZYPREXA 5 mg -valmistetta, voi esiintyä vakavia sivuvaikutuksia, mukaan lukien:
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää ZYPREXAsta?", joka kuvaa dementiaan liittyvän psykoosin iäkkäiden ihmisten lisääntynyttä kuolemanriskiä sekä korkean verensokerin, korkean kolesteroli- ja triglyseridipitoisuuden ja painonnousun riskejä.
- Lisääntynyt aivohalvausten tai "miniaivohalvausten", joita kutsutaan ohimeneviksi iskeemisiksi kohtauksiksi (TIA) ilmaantuvuus iäkkäillä ihmisillä, joilla on dementiaan liittyvä psykoosi (vanhukset, jotka ovat menettäneet yhteyden todellisuuteen sekavuuden ja muistin heikkenemisen vuoksi). ZYPREXAa ei ole hyväksytty näille potilaille.
- Maligni neuroleptinen oireyhtymä (NMS): NMS on harvinainen mutta erittäin vakava sairaus, joka voi ilmaantua ihmisille, jotka käyttävät psykoosilääkkeitä, mukaan lukien ZYPREXA. NMS voi aiheuttaa kuoleman, ja se on hoidettava sairaalassa. Soita lääkärillesi välittömästi, jos sairastut vakavasti ja sinulla on jokin seuraavista oireista:
- korkea kuume
- liiallinen hikoilu
- jäykät lihakset
- hämmennystä
- hengityksen, sydämen sykkeen ja verenpaineen muutokset.
- Lääkereaktio eosinofilian ja systeemisten oireiden kanssa (DRESS): PUKEUTTA voi esiintyä ZYPREXAn kanssa. DRESSin ominaisuuksia voivat olla ihottuma, kuume, rauhasten turvotus ja muut sisäelimet, kuten maksa, munuaiset, keuhkot ja sydän. MEKO on joskus kohtalokas; siksi kerro lääkärillesi välittömästi, jos saat jonkin näistä oireista.
- Tardiivi dyskinesia: Tämä tila aiheuttaa kehon liikkeitä, jotka jatkuvat ja joita et voi hallita. Nämä liikkeet vaikuttavat yleensä kasvoihin ja kieleen. Tardiivi dyskinesia ei välttämättä häviä, vaikka lopettaisit ZYPREXA-hoidon. Se voi alkaa myös ZYPREXA-hoidon lopettamisen jälkeen. Kerro lääkärillesi, jos sinulla on kehon liikkeitä, joita et voi hallita.
- Verenpaineen lasku, kun vaihdat asentoa, johon liittyy huimausta, nopeaa tai hidasta sydämenlyöntiä tai pyörtymistä.
- Nielemisvaikeudet, jotka voivat aiheuttaa ruoan tai nesteen pääsyn keuhkoihin.
- Kouristuskohtaukset: Kerro lääkärillesi, jos sinulla on kouristuskohtaus ZYPREXA-hoidon aikana.
- Ongelmia kehon lämpötilan hallinnassa: Saatat tulla erittäin kuumaksi, esimerkiksi kun harjoittelet paljon tai oleskelet erittäin kuumalla alueella. On tärkeää, että juot vettä kuivumisen välttämiseksi. Soita lääkärillesi välittömästi, jos sairastut vakavasti ja sinulla on jokin näistä kuivumisen oireista:
- hikoilee liikaa tai ei ollenkaan
- kuiva suu
- tuntuu erittäin kuumalta
- janon tunne
- ei pysty tuottamaan virtsaa.
ZYPREXAn yleisiä sivuvaikutuksia ovat: energian puute, suun kuivuminen, lisääntynyt ruokahalu, uneliaisuus, vapina (vapina), kovat tai harvoin esiintyvät ulosteet, huimaus, muutokset käyttäytymisessä tai levottomuus.
Muita yleisiä sivuvaikutuksia teini-ikäisillä (13-17-vuotiailla) ovat: päänsärky, vatsakipu, käsien tai jalkojen kipu tai väsymys. Teini-ikäiset kokivat enemmän prolaktiinin, maksaentsyymien ja uneliaisuuden nousua aikuisiin verrattuna.
Kerro lääkärillesi kaikista haittavaikutuksista, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia ZYPREXAn mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää ZYPREXA?
- Säilytä ZYPREXA huoneenlämmössä, välillä 68 °F - 77 °F (20 °C - 25 °C).
- Pidä ZYPREXA poissa valolta.
- Pidä ZYPREXA 15mg kuivana ja poissa kosteudelta.
Pidä ZYPREXA 5 mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä ZYPREXAsta
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä ZYPREXAa sairauteen, johon sitä ei ole määrätty. Älä anna ZYPREXA 5 mg:aa muille ihmisille, vaikka heillä olisi sama sairaus. Se voi vahingoittaa heitä.
Tässä lääkitysoppaassa on yhteenveto tärkeimmistä ZYPREXAa koskevista tiedoista. Jos haluat lisätietoja, keskustele lääkärisi kanssa. Voit kysyä lääkäriltäsi tai apteekista tietoja ZYPREXA 20 mg:sta, joka on kirjoitettu terveydenhuollon ammattilaisille. Lisätietoja ZYPREXAsta saat soittamalla numeroon 1-800-Lilly-Rx (1-800-545-5979).
Mitä ainesosia ZYPREXA sisältää?
Aktiivinen ainesosa: olantsapiini
Inaktiiviset ainesosat:
karnaubavaha, krospovidoni, hydroksipropyyliselluloosa, hypromelloosi, laktoosi, magnesiumstearaatti, mikrokiteinen selluloosa ja muut inaktiiviset aineet. Väripinnoite sisältää: Titaanidioksidia, FD&C Blue No. 2 Aluminium Lakea tai synteettistä punaista rautaoksidia.
ZYDIS - gelatiini, mannitoli, aspartaami, natriummetyyliparabeeni ja natriumpropyyliparabeeni.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
