Tofranil 25mg, 50mg, 75mg Imipramine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Tofranil on ja miten sitä käytetään?
Tofranil 50mg on reseptilääke, jota käytetään masennuksen oireiden hoitoon. Tofranil 25 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Tofraniili kuuluu lääkeryhmään, jota kutsutaan masennuslääkkeiksi, TCA:iksi.
Ei tiedetä, onko Tofranil turvallinen ja tehokas alle 6-vuotiaille lapsille.
Mitkä ovat Tofranil 50mg:n mahdolliset sivuvaikutukset?
Tofranil voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- mielialan tai käyttäytymisen muutokset,
- ahdistus,
- paniikkikohtaukset,
- nukahtamisvaikeuksia,
- impulsiivinen käyttäytyminen,
- ärtyneisyys,
- agitaatio,
- vihamielisyys,
- aggressio,
- levottomuus,
- yliaktiivisuus (henkisesti tai fyysisesti),
- lisää masennusta,
- itsemurha-ajatuksia,
- näön hämärtyminen,
- putkinäkö,
- silmäkipu tai turvotus,
- nähdä haloja valojen ympärillä,
- huimaus,
- uusi tai paheneva rintakipu,
- sykkivät sydämenlyönnit,
- lepattaa rinnassasi,
- äkillinen tunnottomuus tai heikkous,
- näkö-, puhe- tai tasapainoongelmia,
- kuume,
- kipeä kurkku,
- hämmennystä,
- hallusinaatiot,
- epätavallisia ajatuksia tai käyttäytymistä,
- kivulias tai vaikea virtsaaminen,
- kohtaukset ja
- ihon tai silmien keltaisuus (keltatauti)
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Tofranilin yleisimmät sivuvaikutukset ovat:
- kihelmöivä tunne,
- heikkous,
- koordinoinnin puute,
- kuiva suu,
- pahoinvointi,
- oksentelua,
- ummetus,
- ripuli,
- näkö muuttuu,
- soi korvissasi,
- rintojen paraneminen (sekä miehillä että naisilla),
- vähentynyt seksihalu,
- impotenssi ja
- vaikeuksia saada orgasmi
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Tofranilin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Itsemurha- ja masennuslääkkeet
Masennuslääkkeet lisäsivät plaseboon verrattuna itsemurha-ajattelun ja -käyttäytymisen (itsetuhoisuuden) riskiä lapsilla, nuorilla ja nuorilla aikuisilla lyhytaikaisissa masennushäiriön (MDD) ja muiden psykiatristen häiriöiden tutkimuksissa. Jokaisen, joka harkitsee imipramiinihydrokloridin tai minkä tahansa muun masennuslääkkeen käyttöä lapsella, nuorella tai nuorella aikuisella, on tasapainotettava tämä riski kliinisen tarpeen kanssa. Lyhytaikaiset tutkimukset eivät osoittaneet lisääntynyttä itsemurhariskiä masennuslääkkeillä lumelääkkeeseen verrattuna yli 24-vuotiailla aikuisilla; 65-vuotiailla ja sitä vanhemmilla aikuisilla masennuslääkkeiden riski pieneni lumelääkkeeseen verrattuna. Masennus ja tietyt muut psykiatriset häiriöt liittyvät itsemurhariskin lisääntymiseen. Kaiken ikäisiä potilaita, jotka saavat masennuslääkehoitoa, tulee seurata asianmukaisesti ja tarkkailla kliinisen pahenemisen, itsemurha-ajattelun tai epätavallisten käyttäytymismuutosten varalta. Perheille ja omaishoitajille tulee kertoa, että heitä on tarkkailtava tarkasti ja kommunikoida lääkärin kanssa. Imipramiinihydrokloridia ei ole hyväksytty käytettäväksi lapsipotilailla (ks VAROITUKSET kliininen paheneminen ja itsemurhariski; VAROTOIMENPITEET Tietoa potilaille; ja VAROTOIMENPITEET , Käyttö lapsille).
KUVAUS
Tofranil™ toimitetaan tablettimuodossa suun kautta annettavaksi.
Tofranil 75 mg, imipramiinihydrokloridi USP, alkuperäinen trisyklinen masennuslääke, on dibentsatsepiiniyhdisteryhmän jäsen. Sitä kutsutaan 5-3-(dimetyyliamino)propyyli-10,11-dihydro-5Hdibents[b,f]-atsepiinimonohydrokloridiksi. Sen rakennekaava on:
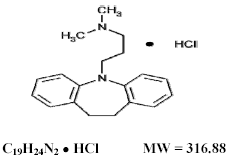
Imipramine hydrochloride USP on valkoinen tai luonnonvalkoinen, hajuton tai käytännössä hajuton kiteinen jauhe. Se liukenee vapaasti veteen ja alkoholiin, liukenee asetoniin ja liukenematon eetteriin ja bentseeniin.
Inaktiiviset ainesosat
Kalsiumfosfaatti, selluloosayhdisteet, dokusaattinatrium, rautaoksidit, magnesiumstearaatti, polyetyleeniglykoli, povidoni, natriumtärkkelysglykolaatti, sakkaroosi, talkki ja titaanidioksidi.
INDIKAATIOT
Masennus
Masennuksen oireiden lievitykseen. Endogeeninen masennus helpottuu todennäköisemmin kuin muut masennustilat. Hoito voi olla tarpeen yhdestä kolmeen viikkoa ennen kuin optimaaliset terapeuttiset vaikutukset ovat ilmeisiä.
Lapsuuden enureesi
Voi olla hyödyllinen tilapäisenä lisähoitona enureesin vähentämisessä yli 6-vuotiailla lapsilla, kun mahdolliset orgaaniset syyt on suljettu pois asianmukaisilla testeillä. Potilailla, joilla on päiväsaikaan esiintyviä oireiden esiintymistiheyttä ja kiireellisyyttä, tutkimukseen tulee tarvittaessa sisältyä tyhjennyskystouretrografia ja kystoskopia. Hoidon tehokkuus saattaa heikentyä lääkkeen käytön jatkuessa.
ANNOSTELU JA HALLINNOINTI
Masennus
Pienempiä annoksia suositellaan iäkkäille potilaille ja nuorille. Pienempiä annoksia suositellaan myös avohoidossa oleville potilaille verrattuna sairaalapotilaisiin, joita seurataan tarkasti. Annostus on aloitettava alhaisella tasolla ja sitä on lisättävä asteittain huomioimalla huolellisesti kliininen vaste ja kaikki todisteet intoleranssista. Remission jälkeen voidaan tarvita ylläpitolääkitystä pidemmän aikaa, pienimmällä annoksella, joka ylläpitää remission.
Tavallinen aikuisten annos
Sairaalapotilaat
Aluksi 100 mg/vrk jaettuina annoksina nostettiin asteittain 200 mg:aan/vrk tarpeen mukaan. Jos vastetta ei ole kahden viikon kuluttua, nosta annos 250-300 mg:aan/vrk.
Avopotilaat
Aluksi 75 mg/vrk nostettiin 150 mg:aan/vrk. Yli 200 mg/vrk annoksia ei suositella. Ylläpito, 50-150 mg/vrk.
Nuoret ja iäkkäät potilaat
Aluksi 30 - 40 mg/päivä; ei yleensä ole tarpeen ylittää 100 mg/vrk.
Lapsuuden enureesi
Aluksi 6-vuotiaille ja sitä vanhemmille lapsille tulisi kokeilla suun kautta annettavaa 25 mg/vrk annosta. Lääke tulee antaa tuntia ennen nukkumaanmenoa. Jos tyydyttävää vastetta ei saavuteta viikon kuluessa, nosta annosta 50 mg:aan iltaisin alle 12-vuotiaille lapsille. yli 12-vuotiaat lapset voivat saada jopa 75 mg iltaisin. Yli 75 mg:n vuorokausiannos ei lisää tehoa, ja sillä on taipumus lisätä sivuvaikutuksia. Todisteet viittaavat siihen, että varhaisillalla yökastelevilla lääke on tehokkaampi annettuna aikaisemmin ja jaettuna, eli 25 mg iltapäivällä, toistetaan nukkumaan mennessä. On harkittava lääkkeettömän ajanjakson aloittamista riittävän terapeuttisen kokeen jälkeen, jolla on myönteinen vaste. Annosta tulee pienentää vähitellen eikä äkillisesti lopettaa; tämä voi vähentää taipumusta uusiutumiseen. Lapset, jotka uusiutuvat lääkkeen käytön lopettamisen jälkeen, eivät aina reagoi seuraavaan hoitoon.
Annosta 2,5 mg/kg/vrk ei saa ylittää. EKG-muutoksia, joiden merkittävyyttä ei tunneta, on raportoitu lapsipotilailla kaksinkertaisilla annoksilla.
Tofranilin turvallisuutta ja tehokkuutta tilapäisenä lisähoitona yön enureesin hoitoon alle 6-vuotiailla lapsilla ei ole osoitettu.
MITEN TOIMITETAAN
Tofranil™ (imipramiinihydrokloridi USP) kolme vahvuutta on saatavilla seuraavasti:
– kolmion muotoinen, kaksoiskupera, korallinpunaisenruskea, sokeripäällysteinen tabletti, jonka toisella puolella on mustalla merkintä "10" ja toisella puolella.
Pullot 30 NDC 0406-9920-03 100 pullot NDC 0406-9920-01
– pyöreä, kaksoiskupera, korallinpunaisenruskea, sokeripäällysteinen tabletti, jonka toisella puolella on mustalla merkintä "25" ja toisella puolella.
Pullot 30 NDC 0406-9921-03 100 pullot NDC 0406-9921-01
– pyöreä, kaksoiskupera, korallinpunaisenruskea, sokeripäällysteinen tabletti, jonka toisella puolella on mustalla merkintä "50" ja toisella puolella.
Pullot 30 NDC 0406-9922-03 100 pullot NDC 0406-9922-01
Säilytä 20–25 °C (68–77 °F) [katso USP:n ohjaama huonelämpötila].
Annostele tiiviiseen astiaan (USP), jossa on lapsiturvallinen suljin.
Valmistaja: Patheon Inc. Whitby, Ontario, Kanada, L1N 5Z5. Tarkistettu: huhtikuuta 2017
SIVUVAIKUTUKSET
Merkintä – Vaikka seuraava luettelo sisältää muutamia haittavaikutuksia, joita ei ole raportoitu tämän lääkkeen yhteydessä, trisyklisten masennuslääkkeiden farmakologiset yhtäläisyydet edellyttävät, että jokainen reaktio otetaan huomioon, kun Tofranil 25 mg:aa annetaan.
Sydän: Ortostaattinen hypotensio, kohonnut verenpaine, takykardia, sydämentykytys, sydäninfarkti, rytmihäiriöt, sydäntukokset, EKG-muutokset, kongestiivisen sydämen vajaatoiminnan saostuminen, aivohalvaus.
Psykiatrinen: sekavuustilat (erityisesti vanhuksilla), joihin liittyy hallusinaatioita, desorientaatiota, harhaluuloja; ahdistuneisuus, levottomuus, kiihtyneisyys; unettomuus ja painajaiset; hypomania; psykoosin paheneminen.
Neurologinen: Tunnottomuus, pistely, raajojen parestesiat; koordinaatiohäiriö, ataksia, vapina; perifeerinen neuropatia; ekstrapyramidaaliset oireet; kohtaukset, muutokset EEG-kuvioissa; tinnitus.
Antikolinergiset: Suun kuivuminen ja harvoin siihen liittyvä sublingvaalinen adeniitti; näön hämärtyminen, akkomodaatiohäiriöt, mydriaasi; ummetus, paralyyttinen ileus; virtsanpidätys, viivästynyt virtsaaminen, virtsateiden laajentuminen.
Allerginen: Ihottuma, petekiat, nokkosihottuma, kutina, valoherkistyminen; turvotus (yleinen tai kasvojen ja kielen turvotus); huumekuume; ristiherkkyys desipramiinin kanssa.
Hematologinen: Luuytimen lama, mukaan lukien agranulosytoosi; eosinofilia; purppura; trombosytopenia.
Ruoansulatuskanava: Pahoinvointi ja oksentelu, ruokahaluttomuus, mahalaukun ahdistus, ripuli; erikoinen maku, stomatiitti, vatsakrampit, musta kieli.
Endokriiniset: gynekomastia miehillä; rintojen suureneminen ja galaktorrea naisella; lisääntynyt tai vähentynyt libido, impotenssi; kivesten turvotus; verensokeritason nousu tai lasku; sopimaton antidiureettisen hormonin (ADH) eritysoireyhtymä.
Muuta: Keltaisuus (simuloiva obstruktiivista); muuttunut maksan toiminta; painon nousu tai lasku; hiki; huuhtelu; virtsaamistiheys; uneliaisuus, huimaus, heikkous ja väsymys; päänsärky; korvasylkirauhasen turvotus; hiustenlähtö; taipumus putoamiseen.
Vieroitusoireet: Vaikka hoidon äkillinen lopettaminen pitkäaikaisen hoidon jälkeen ei ole merkki riippuvuudesta, se voi aiheuttaa pahoinvointia, päänsärkyä ja huonovointisuutta.
Merkintä – Tofranil 75 mg:lla hoidetuilla enureettisilla lapsilla yleisimmät haittavaikutukset ovat olleet hermostuneisuus, unihäiriöt, väsymys ja lievät ruoansulatuskanavan häiriöt. Nämä yleensä häviävät lääkkeen jatkuvan annon aikana tai kun annosta pienennetään. Muita raportoituja reaktioita ovat ummetus, kouristukset, ahdistuneisuus, emotionaalinen epävakaus, pyörtyminen ja romahdus. Kaikki aikuisen käytön yhteydessä raportoidut haittavaikutukset tulee ottaa huomioon.
HUUMEIDEN VUOROVAIKUTUKSET
P450 2D6:n metaboloimat lääkkeet
Lääkettä metaboloivan isotsyymin sytokromi P450 2D6:n (debrisokiinihydroksylaasi) biokemiallinen aktiivisuus on heikentynyt osassa valkoihoisia (noin 7–10 % valkoihoisista on niin kutsuttuja "huonoja metaboloijia"); Luotettavia arvioita vähentyneen P450 2D6 -isotsyymiaktiivisuuden esiintyvyydestä aasialaisten, afrikkalaisten ja muiden populaatioiden keskuudessa ei ole vielä saatavilla. Heikoilla metaboloijilla on odotettua korkeammat trisyklisten masennuslääkkeiden (TCA:t) pitoisuudet plasmassa tavanomaisina annoksina. P450 2D6:n metaboloiman lääkkeen fraktion mukaan plasmapitoisuuden nousu voi olla pientä tai melko suurta (8-kertainen TCA:n plasman AUC:n nousu).
Lisäksi tietyt lääkkeet estävät tämän isotsyymin aktiivisuutta ja saavat normaalit aineenvaihdunta-aineet muistuttamaan huonoja aineenvaihdunnan tekijöitä. Henkilö, joka on vakaa tietyllä TCA-annoksella, voi tulla äkillisesti toksiseksi, kun hänelle annetaan yhtä näistä estolääkkeistä samanaikaisena hoitona. Sytokromi P450 2D6:ta inhiboivia lääkkeitä ovat jotkin entsyymit eivät metaboloi (kinidiini; simetidiini) ja monet, jotka ovat P450 2D6:n substraatteja (monet muut masennuslääkkeet, fenotiatsiinit ja tyypin 1C rytmihäiriölääkkeet propafenoni ja flekainidi). Vaikka kaikki selektiiviset serotoniinin takaisinoton estäjät (SSRI), esim. fluoksetiini, sertraliini ja paroksetiini, estävät P450 2D6:ta, ne voivat vaihdella eston laajuudessa. Se, missä määrin SSRI-TCA-vuorovaikutus voi aiheuttaa kliinisiä ongelmia, riippuu SSRI:n eston asteesta ja farmakokinetiikasta. Varovaisuutta on kuitenkin noudatettava annettaessa TCA:ita samanaikaisesti minkä tahansa SSRI:n kanssa ja myös vaihdettaessa luokasta toiseen. Erityisen tärkeää on kulua riittävästi aikaa ennen TCA-hoidon aloittamista potilaalla, jolla fluoksetiinihoito lopetetaan, koska lähtöaineen ja aktiivisen metaboliitin puoliintumisaika on pitkä (vähintään 5 viikkoa saattaa olla tarpeen).
Trisyklisten masennuslääkkeiden samanaikainen käyttö sytokromi P450 2D6:ta inhiboivien lääkkeiden kanssa saattaa vaatia pienempiä annoksia kuin tavallisesti on määrätty joko trisykliselle masennuslääkkeelle tai toiselle lääkkeelle. Lisäksi aina, kun jokin näistä muista lääkkeistä poistetaan yhteishoidosta, trisyklisen masennuslääkkeen annosta voidaan joutua lisäämään. On toivottavaa seurata TCA:n plasmatasoja aina, kun TCA:ta annetaan yhdessä toisen lääkkeen kanssa, jonka tiedetään olevan P450 2D6:n estäjä.
Imipramiinin pitoisuus plasmassa voi nousta, kun lääkettä annetaan samanaikaisesti maksaentsyymi-inhibiittoreiden (esim. simetidiini, fluoksetiini) kanssa, ja laskea, jos sitä annetaan samanaikaisesti maksaentsyymi-induktorien (esim. barbituraatit, fenytoiini) kanssa, minkä vuoksi imipramiinin annoksen säätäminen saattaa aiheuttaa olla tarpeen.
Satunnaisesti herkillä potilailla tai niillä, jotka saavat lisäksi antikolinergisiä lääkkeitä (mukaan lukien parkinsonismilääkkeet), atropiinin kaltaiset vaikutukset voivat tulla voimakkaammiksi (esim. halvaantuva ileus). Tarkkaa valvontaa ja annoksen huolellista säätämistä tarvitaan, kun imipramiinihydrokloridia annetaan samanaikaisesti antikolinergisten lääkkeiden kanssa.
Vältä sellaisten valmisteiden, kuten dekongestanttien ja paikallispuudutteiden käyttöä, jotka sisältävät sympatomimeettisiä amiinia (esim. epinefriini, norepinefriini), koska trisyklisten masennuslääkkeiden on raportoitu voimistavan katekoliamiinien vaikutuksia.
Varovaisuutta tulee noudattaa käytettäessä imipramiinihydrokloridia verenpainetta alentavien aineiden kanssa. Imipramiinihydrokloridi voi voimistaa keskushermostoa lamaavien lääkkeiden vaikutuksia.
Potilaita tulee varoittaa, että imipramiinihydrokloridi voi voimistaa alkoholin keskushermostoa lamaavia vaikutuksia (ks. VAROITUKSET ).
VAROITUKSET
Kliininen paheneminen ja itsemurhariski
Potilaat, joilla on vaikea masennushäiriö (MDD), sekä aikuisilla että lapsilla, voivat kokea masennuksensa pahenemista ja/tai itsemurha-ajatuksia ja -käyttäytymisen ilmaantumista (itsemurha-ajatuksia) tai epätavallisia muutoksia käyttäytymisessä riippumatta siitä, käyttävätkö he masennuslääkkeitä vai eivät, ja tämä riski voi jatkua, kunnes merkittävä remissio tapahtuu. Itsemurha on tunnettu masennuksen ja tiettyjen muiden psykiatristen häiriöiden riski, ja nämä häiriöt itsessään ovat vahvimpia itsemurhan ennustajia. Pitkään on kuitenkin ollut huolta siitä, että masennuslääkkeillä voi olla rooli masennuksen pahenemisessa ja itsetuhoisuuden syntymisessä tietyillä potilailla hoidon alkuvaiheessa. Lyhytaikaisten lumekontrolloitujen masennuslääkkeiden (SSRI-lääkkeiden ja muiden) tutkimusten yhdistetyt analyysit osoittivat, että nämä lääkkeet lisäävät itsemurha-ajattelun ja -käyttäytymisen (itsemurha-ajattelun) riskiä lapsilla, nuorilla ja nuorilla aikuisilla (18–24-vuotiaat), joilla on vakava masennus. häiriö (MDD) ja muut psykiatriset häiriöt. Lyhytaikaiset tutkimukset eivät osoittaneet lisääntynyttä itsemurhariskiä masennuslääkkeillä lumelääkkeeseen verrattuna yli 24-vuotiailla aikuisilla; 65-vuotiailla ja sitä vanhemmilla aikuisilla masennuslääkkeet vähenivät lumelääkkeeseen verrattuna.
Plasebokontrolloitujen tutkimusten yhdistetyt analyysit lapsilla ja nuorilla, joilla oli MDD, pakko-oireinen häiriö (OCD) tai muut psykiatriset häiriöt, sisälsivät yhteensä 24 lyhytaikaista tutkimusta 9 masennuslääkkeellä yli 4400 potilaalla. Plasebokontrolloitujen tutkimusten yhdistetyt analyysit aikuisilla, joilla oli MDD tai muita psykiatrisia häiriöitä, sisälsivät yhteensä 295 lyhytaikaista tutkimusta (mediaanikesto 2 kuukautta), joissa oli 11 masennuslääkettä yli 77 000 potilaalla. Itsemurhariskissä oli huomattavaa vaihtelua lääkkeiden välillä, mutta taipumus nuorempien potilaiden lisääntymiseen lähes kaikkien tutkittujen lääkkeiden kohdalla. Absoluuttisessa itsemurhariskissä oli eroja eri indikaatioiden välillä, ja suurin ilmaantuvuus MDD:ssä. Riskierot (lääke vs. lumelääke) olivat kuitenkin suhteellisen vakaita ikäryhmien sisällä ja eri käyttöaiheissa. Nämä riskierot (lääkkeen ja lumelääkkeen ero itsemurhatapausten määrässä 1000 hoidettua potilasta kohti) on esitetty taulukossa 1.
Yhtään itsemurhaa ei tapahtunut missään lapsitutkimuksessa. Aikuisten kokeissa oli itsemurhia, mutta määrä ei riittänyt päättämään lääkkeiden vaikutuksesta itsemurhaan.
Ei tiedetä, ulottuuko itsemurhariski pitkäaikaiseen käyttöön eli useiden kuukausien jälkeiseen käyttöön. Lumekontrolloiduista ylläpitotutkimuksista aikuisilla, joilla on masennus, on kuitenkin huomattavaa näyttöä siitä, että masennuslääkkeiden käyttö voi viivyttää masennuksen uusiutumista.
Kaikkia potilaita, joita hoidetaan masennuslääkkeillä missä tahansa indikaatiossa, on seurattava asianmukaisesti ja tarkkailtava tarkasti kliinisen pahenemisen, itsemurha-ajattelun ja epätavallisten käyttäytymismuutosten varalta, erityisesti lääkehoidon ensimmäisten kuukausien aikana tai annosta muutettaessa, joko annosta suurennetaan. tai pienenee.
Seuraavia oireita, ahdistusta, kiihtyneisyyttä, paniikkikohtauksia, unettomuutta, ärtyneisyyttä, vihamielisyyttä, aggressiivisuutta, impulsiivisuutta, akatisiaa (psykomotorista levottomuutta), hypomaniaa ja maniaa on raportoitu myös aikuisilla ja lapsipotilailla, joita on hoidettu masennuslääkkeillä vakavan masennuksen vuoksi. kuten muissakin indikaatioissa, sekä psykiatrisissa että ei-psykiatrisissa. Vaikka syy-yhteyttä tällaisten oireiden ilmaantumisen ja joko masennuksen pahenemisen ja/tai itsetuhoisten impulssien ilmaantumisen välillä ei ole osoitettu, on huolestuttavaa, että tällaiset oireet voivat olla syntyvän itsetuhoisuuden esiaste.
Hoito-ohjelman muuttamista, mukaan lukien lääkityksen mahdollista lopettamista, tulee harkita potilailla, joiden masennus pahenee jatkuvasti tai joilla on ilmennyt itsemurha tai oireita, jotka saattavat olla masennuksen tai itsemurha-ajatuksen pahenemisen edeltäjä, varsinkin jos nämä oireet ovat vakavia, äkillisiä. alkuvaiheessa tai eivät olleet osa potilaan ilmeneviä oireita.
Masennuslääkkeillä vakavan masennushäiriön tai muiden, sekä psykiatristen että ei-psykiatristen oireiden vuoksi hoidettavien potilaiden perheitä ja hoitajia tulee varoittaa tarpeesta seurata potilaita kiihtyneisyyden, ärtyneisyyden, epätavallisten käyttäytymismuutosten ja muiden edellä kuvattujen oireiden ilmaantumisen varalta. , sekä itsemurha-ajatuksen ilmaantumista, ja ilmoittamaan tällaisista oireista välittömästi terveydenhuollon tarjoajille. Tällaiseen seurantaan tulisi sisältyä perheiden ja omaishoitajien päivittäinen tarkkailu. Imipramiinihydrokloridia koskevat reseptit tulee kirjoittaa pienimmälle tablettimäärälle potilaan hyvän hoidon mukaisesti, jotta voidaan vähentää yliannostusriskiä.
Potilaiden seulonta kaksisuuntaisen mielialahäiriön varalta
Vakava masennusjakso voi olla kaksisuuntaisen mielialahäiriön ensimmäinen ilmentymä. Yleisesti uskotaan (vaikkakaan sitä ei ole vahvistettu kontrolloiduissa tutkimuksissa), että tällaisen episodin hoito pelkällä masennuslääkkeellä voi lisätä seka-/maanisen vaiheen esiintymisen todennäköisyyttä potilailla, joilla on kaksisuuntaisen mielialahäiriön riski. Ei tiedetä, edustavatko mikään yllä kuvatuista oireista tällaista muutosta. Ennen masennuslääkehoidon aloittamista masennusoireista kärsivät potilaat tulee kuitenkin seuloa riittävästi sen määrittämiseksi, onko heillä kaksisuuntaisen mielialahäiriön riski; Tällaiseen seulontaan tulee sisältyä yksityiskohtainen psykiatrinen historia, mukaan lukien suvussa itsemurhaa, kaksisuuntaista mielialahäiriötä ja masennusta esiintynyt historia. On huomattava, että imipramiinihydrokloridia ei ole hyväksytty käytettäväksi kaksisuuntaisen mielialahäiriön hoidossa.
Kulman sulkeutuva glaukooma
Monien masennuslääkkeiden, mukaan lukien Tofranilin, käytön jälkeen ilmenevä pupillien laajentuminen voi laukaista kulman sulkemiskohtauksen potilaalla, jolla on anatomisesti kapeat kulmat ja jolle ei ole tehty iridektomiaa.
Lapset
Tofranil 25 mg:n annosta 2,5 mg/kg/vrk ei saa ylittää lapsuudessa. EKG-muutoksia, joiden merkittävyyttä ei tunneta, on raportoitu lapsipotilailla kaksinkertaisilla annoksilla.
Äärimmäistä varovaisuutta tulee noudattaa, kun tätä lääkettä annetaan: potilaille, joilla on sydän- ja verisuonisairaus johtumishäiriöiden, rytmihäiriöiden, kongestiivisen sydämen vajaatoiminnan, sydäninfarktin, aivohalvausten ja takykardian vuoksi. Nämä potilaat tarvitsevat sydämen seurantaa kaikilla lääkkeen annostasoilla;
potilaat, joilla on ollut virtsaretentiota tai ahdaskulmaglaukooma lääkkeen antikolinergisten ominaisuuksien vuoksi; hypertyreoosipotilaat tai kilpirauhaslääkitystä käyttävät potilaat kardiovaskulaarisen toksisuuden mahdollisuuden vuoksi;
potilaat, joilla on ollut kohtaushäiriöitä, koska tämän lääkkeen on osoitettu alentavan kohtauskynnystä;
potilaat, jotka saavat guanetidiinia, klonidiinia tai vastaavia aineita, koska Tofranil voi estää näiden lääkkeiden farmakologiset vaikutukset;
potilailla, jotka saavat metyylifenidaattihydrokloridia. Koska metyylifenidaattihydrokloridi voi estää Tofranilin 75 mg:n metaboliaa, imipramiinihydrokloridin annosta voidaan joutua säätämään alaspäin, kun sitä annetaan samanaikaisesti metyylifenidaattihydrokloridin kanssa.
Tofranil voi lisätä alkoholin keskushermostoa lamaavia vaikutuksia. Siksi on pidettävä mielessä, että itsemurhayritykseen tai vahingossa tapahtuvaan lääkkeen yliannostukseen liittyvät vaarat voivat lisääntyä potilaalla, joka käyttää liikaa alkoholia (ks. VAROTOIMENPITEET ).
Koska Tofranil voi heikentää mahdollisesti vaarallisten tehtävien suorittamiseen vaadittavia henkisiä ja/tai fyysisiä kykyjä, kuten auton tai koneiden käyttö, potilasta tulee varoittaa vastaavasti.
VAROTOIMENPITEET
Kenraali
EKG-tallenne tulee ottaa ennen tavallista suurempien Tofranil-annosten aloittamista ja asianmukaisin väliajoin sen jälkeen, kunnes vakaa tila on saavutettu. (Potilaat, joilla on näyttöä sydän- ja verisuonitaudeista, tarvitsevat sydämen seurantaa kaikilla lääkkeen annostasoilla. Katso VAROITUKSET .) Iäkkäät potilaat ja potilaat, joilla on sydänsairaus tai joilla on aiemmin ollut sydänsairaus, ovat erityisen alttiita Tofranilin käyttöön liittyville sydämen poikkeavuuksille.
On pidettävä mielessä, että vakavasti masentuneiden potilaiden itsemurhan mahdollisuus liittyy sairauteen ja voi jatkua, kunnes merkittävä remissio tapahtuu. Tällaisia potilaita tulee tarkkailla huolellisesti Tofranil 75 mg -hoidon alkuvaiheessa, ja ne voivat vaatia sairaalahoitoa. Reseptit tulee kirjoittaa pienin mahdollinen summa. Hypomaanisia tai maanisia jaksoja saattaa esiintyä, erityisesti potilailla, joilla on syklisiä häiriöitä. Tällaiset reaktiot voivat edellyttää lääkkeen käytön lopettamista. Tarvittaessa Tofranil 75 mg:n käyttöä voidaan jatkaa pienemmällä annoksella, kun nämä jaksot ovat helpottuneet.
Rauhoittavan lääkkeen antaminen voi olla hyödyllistä tällaisten jaksojen hallinnassa.
Skitsofreniapotilailla voidaan toisinaan havaita psykoosin aktivaatiota, ja se voi vaatia annoksen pienentämistä ja fenotiatsiinin lisäämistä.
Tofranil 50 mg:n samanaikainen anto sähkösokkihoidon kanssa voi lisätä vaaroja; tällainen hoito tulee rajoittaa potilaisiin, joille se on välttämätöntä, koska kliinistä kokemusta on vain vähän.
Imipramiinihydrokloridia käyttävien potilaiden tulee välttää liiallista altistumista auringonvalolle, koska valoherkistymistä on raportoitu.
Sekä verensokeritason nousua että laskua on raportoitu imipramiinihydrokloridin käytön yhteydessä.
Imipramiinihydrokloridia tulee käyttää varoen potilailla, joilla on merkittävästi heikentynyt munuaisten tai maksan toiminta.
Potilaille, joille kehittyy kuumetta ja kurkkukipua imipramiinihydrokloridihoidon aikana, tulee tehdä leukosyytti- ja verenkuvaus. Imipramiinihydrokloridin käyttö tulee lopettaa, jos havaitaan patologista neutrofiilien laskua.
Ennen elektiivistä leikkausta imipramiinihydrokloridihoito tulee keskeyttää niin kauan kuin kliininen tilanne sen sallii.
Tietoja potilaille
Lääkäreiden tai muiden terveydenhuollon ammattilaisten tulee kertoa potilaille, heidän perheilleen ja heidän hoitajilleen imipramiinihydrokloridihoidon eduista ja riskeistä ja neuvoa heitä sen asianmukaisessa käytössä. Potilas Lääkitysopas Tietoja masennuslääkkeistä, masennuksesta ja muista vakavista mielenterveyssairauksista sekä itsemurha-ajatuksista tai -toimista on saatavilla imipramiinihydrokloridille. Lääkkeen määrääjän tai terveydenhuollon ammattilaisen tulee neuvoa potilaita, heidän perheitään ja hoitajiaan lukemaan lääkitysopas ja auttaa heitä ymmärtämään sen sisältö. Potilaille tulee antaa mahdollisuus keskustella lääkitysoppaan sisällöstä ja saada vastauksia mahdollisiin kysymyksiinsä. Lääkitysoppaan koko teksti on painettu uudelleen tämän asiakirjan lopussa.
Potilaita tulee kertoa seuraavista ongelmista ja pyytää heitä varoittamaan lääkäriään, jos niitä ilmenee imipramiinihydrokloridin käytön aikana.
Potilaita tulee kertoa, että Tofranilin ottaminen voi aiheuttaa lievää pupillien laajentumista, mikä voi herkillä henkilöillä johtaa sulkeutumiskulmaglaukooman episodiin. Aiempi glaukooma on lähes aina avokulmaglaukooma, koska sulkukulmaglaukooma voidaan diagnosoituna hoitaa lopullisesti iridektomialla. Avokulmaglaukooma ei ole kulmaglaukooman riskitekijä. Potilaat saattavat haluta tulla tutkimuksiin sen määrittämiseksi, ovatko he alttiita kulman sulkemiselle, ja heille voidaan tehdä ennaltaehkäisevä toimenpide (esim. iridektomia), jos he ovat alttiita.
Kliininen paheneminen ja itsemurhariski
Potilaita, heidän perheitään ja heidän omaisiaan tulee kannustaa olemaan valppaana ahdistuneisuuden, kiihtyneisyyden, paniikkikohtausten, unettomuuden, ärtyneisyyden, vihamielisyyden, aggressiivisuuden, impulsiivisuuden, akatisian (psykomotorinen levottomuus), hypomanian, manian ja muiden epätavallisten käyttäytymismuutosten ilmaantuessa. , masennuksen paheneminen ja itsemurha-ajatukset, erityisesti masennuslääkehoidon alkuvaiheessa ja kun annosta muutetaan ylös tai alas. Potilaiden perheitä ja hoitajia tulee neuvoa etsimään tällaisten oireiden ilmaantumista päivittäin, koska muutokset voivat olla äkillisiä. Tällaisista oireista tulee ilmoittaa potilaan määräävälle lääkärille tai terveydenhuollon ammattilaiselle, varsinkin jos ne ovat vakavia, alkavat äkillisesti tai eivät olleet osa potilaan oireita. Tällaiset oireet voivat liittyä lisääntyneeseen itsemurha-ajattelun ja -käyttäytymisen riskiin, ja ne voivat viitata erittäin tiiviin seurannan tarpeeseen ja mahdollisesti lääkityksen muutoksiin.
Raskaus
Eläinten lisääntymistutkimukset ovat tuottaneet epävarmoja tuloksia (katso myös Eläinfarmakologia ).
Raskaana olevilla naisilla ei ole tehty hyvin kontrolloituja tutkimuksia Tofranilin vaikutuksen määrittämiseksi sikiöön. Lääkkeen käyttöön liittyviä synnynnäisiä epämuodostumia on kuitenkin raportoitu kliinisesti. Vaikka näiden vaikutusten ja lääkkeen välistä syy-yhteyttä ei voitu osoittaa, sikiöriskin mahdollisuutta äidin Tofranilin nauttimisesta ei voida sulkea pois. Siksi Tofranilia tulee käyttää naisille, jotka ovat tai saattavat tulla raskaaksi, vain, jos kliininen tila oikeuttaa selvästi mahdollisen riskin sikiölle.
Imettävät äidit
Rajalliset tiedot viittaavat siihen, että Tofranil 75 mg todennäköisesti erittyy äidinmaitoon. Yleissääntönä on, että lääkettä käyttävä nainen ei saa imettää, koska on olemassa mahdollisuus, että lääke erittyy äidinmaitoon ja voi olla haitallista lapselle.
Käyttö lapsille
Turvallisuutta ja tehokkuutta muilla lapsipotilailla kuin lapsipotilailla, joilla on yöllinen enureesi, ei ole varmistettu (ks. LAATIKKO VAROITUS ja VAROITUKSET , Kliininen paheneminen ja itsemurhariski ). Jokaisen, joka harkitsee imipramiinihydrokloridin käyttöä lapsella tai nuorella, on tasapainotettava mahdolliset riskit kliinisen tarpeen kanssa.
Lääkkeen turvallisuutta ja tehokkuutta tilapäisenä lisähoitona yöllisen enureesin hoitoon alle 6-vuotiailla lapsipotilailla ei ole varmistettu.
Lääkkeen turvallisuutta pitkäaikaisessa, kroonisessa käytössä yönureesin lisähoitona 6-vuotiailla tai sitä vanhemmilla lapsipotilailla ei ole varmistettu; tulisi harkita lääkkeettömän ajanjakson aloittamista riittävän terapeuttisen kokeen jälkeen, jolla on myönteinen vaste.
Annosta 2,5 mg/kg/vrk ei saa ylittää lapsuudessa. EKG-muutoksia, joiden merkittävyyttä ei tunneta, on raportoitu lapsipotilailla kaksinkertaisilla annoksilla.
Geriatrinen käyttö
Kirjallisuudessa oli neljä hyvin kontrolloitua, satunnaistettua, kaksoissokkoutettua, rinnakkaisten ryhmien kliinistä vertailututkimusta, jotka tehtiin Tofranil 50 mg:lla vanhuksilla. Näissä tutkimuksissa oli yhteensä 651 koehenkilöä. Nämä tutkimukset eivät tarjonneet vertailua nuorempiin koehenkilöihin. Vanhuksilla ei havaittu muita haittavaikutuksia.
Alkuperäisen hakemuksen Tofranil 75 mg:n kliiniset tutkimukset eivät sisältäneet riittävää määrää 65-vuotiaita tai vanhempia, jotta voitaisiin määrittää, reagoivatko he eri tavalla kuin nuoremmat. Markkinoille tulon jälkeinen kliininen kokemus ei ole osoittanut eroja iäkkäiden ja nuorempien koehenkilöiden vasteissa. Yleensä iäkkäiden potilaiden annoksen valinnassa tulee olla varovainen, yleensä aloitettava annosalueen alimmasta päästä, mikä heijastaa useammin heikentynyttä maksan, munuaisten tai sydämen toimintaa sekä samanaikaista sairautta tai muuta lääkehoitoa.
(Katso myös ANNOSTELU JA HALLINNOINTI , Teini-ikäinen ja Geriatriset potilaat .)
(Katso myös VAROTOIMENPITEET , Kenraali. )
YLIANNOSTUS
Kuolemia voi tapahtua tämän luokan lääkeaineiden yliannostuksesta. Useiden lääkkeiden (mukaan lukien alkoholin) nauttiminen on yleistä tahallisessa trisyklisissä yliannostuksissa. Koska hoito on monimutkaista ja muuttuvaa, on suositeltavaa, että lääkäri ottaa yhteyttä myrkytystietokeskukseen saadakseen ajantasaista tietoa hoidosta. Toksisuuden merkit ja oireet kehittyvät nopeasti trisyklisen yliannostuksen jälkeen. Siksi sairaalan seurantaa tarvitaan mahdollisimman pian.
Lasten on raportoitu olevan aikuisia herkempiä imipramiinihydrokloridin akuutille yliannokselle. Minkä tahansa määrän akuuttia yliannostusta erityisesti imeväisille tai pienille lapsille on pidettävä vakavana ja mahdollisesti kuolemaan johtavana.
Ilmestymiset
Nämä voivat vaihdella vakavuudeltaan riippuen tekijöistä, kuten imeytyneen lääkkeen määrä, potilaan ikä ja lääkkeen nauttimisen ja hoidon aloittamisen välinen aika. Yliannostuksen kriittisiä oireita ovat sydämen rytmihäiriöt, vaikea hypotensio, kouristukset ja keskushermoston lama, mukaan lukien kooma. Muutokset elektrokardiogrammissa, erityisesti QRS-akselilla tai -leveydellä, ovat kliinisesti merkittäviä indikaattoreita trisyklisestä toksisuudesta.
Muita keskushermoston ilmenemismuotoja voivat olla uneliaisuus, tokkuraisuus, ataksia, levottomuus, kiihtyneisyys, hyperaktiiviset refleksit, lihasjäykkyys, atetoidiset ja koreimuotoiset liikkeet.
Sydämen poikkeavuuksiin voi kuulua takykardia ja merkkejä kongestiivisesta vajaatoiminnasta. Hengityslamaa, syanoosia, sokkia, oksentelua, hyperpyreksiaa, mydriaasia ja hikoilua voi myös esiintyä.
Hallinto
Ota EKG ja aloita välittömästi sydämen seuranta. Suojaa potilaan hengitysteitä, luo suonensisäinen linja ja aloita mahalaukun dekontaminaatio. Vähintään 6 tunnin tarkkailu ja sydämen seuranta sekä keskushermoston tai hengityslaman, hypotension, sydämen rytmihäiriöiden ja/tai johtumishäiriöiden ja kohtausten tarkkailu on tarpeen. Jos myrkyllisyyden merkkejä ilmenee milloin tahansa tämän ajanjakson aikana, tarvitaan pidennettyä seurantaa. On raportoitu tapauksia potilaista, jotka ovat antaneet kuolemaan johtaneille rytmihäiriöille myöhään yliannostuksen jälkeen; näillä potilailla oli kliinisiä todisteita merkittävästä myrkytyksestä ennen kuolemaa, ja useimmat saivat riittämättömästi maha-suolikanavan dekontaminaatiota. Plasman lääkepitoisuuksien seuranta ei saa ohjata potilaan hoitoa.
Ruoansulatuskanavan puhdistaminen
Kaikki potilaat, joiden epäillään saaneen trisyklisen yliannostuksen, on dekontaminoitava maha-suolikanavassa. Tähän tulisi sisältyä suuri mahahuuhtelu ja sen jälkeen aktiivihiili. Jos tajunta on heikentynyt, hengitystiet tulee varmistaa ennen huuhtelua. Emesis on vasta-aiheinen.
Kardiovaskulaarinen
Raajajohdon QRS:n maksimikesto ≥0,10 sekuntia voi olla paras osoitus yliannostuksen vakavuudesta. Suonensisäistä natriumbikarbonaattia tulee käyttää pitämään seerumin pH välillä 7,45–7,55. Jos pH-vaste on riittämätön, voidaan käyttää myös hyperventilaatiota. Hyperventilaatiota ja natriumbikarbonaattia käytettäessä samanaikaisesti tulee noudattaa äärimmäistä varovaisuutta ja pH-arvoa on seurattava säännöllisesti. pH > 7,60 tai pCO2
Harvinaisissa tapauksissa hemoperfuusio voi olla hyödyllinen akuutin refraktaarisen kardiovaskulaarisen epävakauden hoidossa potilailla, joilla on akuutti toksisuus. Hemodialyysin, peritoneaalidialyysin, vaihtosiirtojen ja pakkodiureesin on kuitenkin yleensä raportoitu olevan tehottomia trisyklisissä myrkytyksissä.
CNS
Potilaille, joilla on keskushermoston masennus, suositellaan varhaista intubaatiota, koska se voi huonontua äkillisesti. Kouristuskohtauksia tulee hallita bentsodiatsepiineilla tai jos ne ovat tehottomia, muilla kouristuslääkkeillä (esim. fenobarbitaalilla, fenytoiinilla). Fysostigmiiniä ei suositella paitsi sellaisten hengenvaarallisten oireiden hoitoon, jotka eivät ole reagoineet muihin hoitoihin, ja sitten vain myrkytystietokeskuksen kanssa neuvotellen.
Psykiatrinen seuranta
Koska yliannostus on usein tahallista, potilaat voivat yrittää itsemurhaa muilla tavoilla toipumisvaiheessa. Psykiatrin lähete voi olla sopiva.
Pediatrian hoito
Lapsen ja aikuisen yliannostusten hallintaperiaatteet ovat samanlaiset. On erittäin suositeltavaa, että lääkäri ottaa yhteyttä paikalliseen myrkytystietokeskukseen erityistä lasten hoitoa varten.
VASTA-AIHEET
Monoamiinioksidaasia estävien yhdisteiden samanaikainen käyttö on vasta-aiheista. Tällaisia yhdistelmiä saavilla potilailla voi esiintyä hyperpyreettisiä kriisejä tai vaikeita kouristuskohtauksia. Haitallisten vaikutusten voimistuminen voi olla vakavaa tai jopa kuolemaan johtavaa. Kun Tofranil halutaan korvata potilailla, jotka saavat monoamiinioksidaasin estäjää, tulee kliinisen tilanteen salliessa kulua niin pitkä aika, että vähintään 14 päivää. Aloitusannoksen tulee olla pieni ja lisäyksiä tulee määrätä asteittain ja varovaisesti.
Lääke on vasta-aiheinen sydäninfarktin jälkeisen akuutin toipumisjakson aikana. Potilaille, joiden tiedetään olevan yliherkkiä tälle yhdisteelle, ei tule antaa lääkettä. On syytä pitää mielessä ristiherkkyys muille dibentsatsepiiniyhdisteille.
KLIININEN FARMAKOLOGIA
Tofranil 25 mg:n vaikutusmekanismia ei tunneta tarkasti. Se ei kuitenkaan vaikuta ensisijaisesti keskushermostoa stimuloimalla. Kliinisen vaikutuksen oletetaan johtuvan adrenergisten synapsien voimistumisesta estämällä norepinefriinin sisäänotto hermopäätteissä. Lääkkeen vaikutustavan lasten enureesin hillitsemisessä uskotaan olevan erillään sen masennusta lievittävästä vaikutuksesta.
Eläinfarmakologia ja toksikologia
A. Akuutti
Oraaliset LD50-alueet ovat seuraavat:
Rotta 355-682 mg/kg Koira 100-215 mg/kg
Molempien lajien annostuksesta riippuen toksiset oireet etenivät asteittain masennuksesta, epäsäännöllisestä hengityksestä ja ataksiasta kouristukseen ja kuolemaan.
B. Lisääntyminen/teratogeeninen
Kokonaisarviointi voidaan tiivistää seuraavasti:
Suun kautta: Kolmella lajilla (rotta, hiiri ja kani) tehdyt riippumattomat tutkimukset paljastivat, että kun Tofranilia annetaan suun kautta annoksina, jotka olivat noin 2-1/2 kertaa ihmisen enimmäisannos kahdella ensimmäisellä lajilla ja jopa 25 kertaa ihmisen enimmäisannos. Kolmannen lajin kohdalla lääkkeellä ei ole olennaisesti teratogeenista potentiaalia. Kolmessa tutkitussa lajissa esiintyi vain yksi tapaus sikiön poikkeavuudesta (kaniinilla), ja siinä tutkimuksessa poikkeavuus oli myös kontrolliryhmässä. Rotilla tehdyistä tutkimuksista on kuitenkin olemassa näyttöä siitä, että systeemistä ja embryotoksisuutta on osoitettavissa. Tämä ilmenee pienentyneenä pentueen kokona, lievänä kuolleena syntyneiden määrän kasvuna ja keskimääräisen syntymäpainon laskuna.
