Wellbutrin 150mg, 300mg Bupropion Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Wellbutrin 150mg on ja miten sitä käytetään?
Wellbutrin 150mg on reseptilääke, jota käytetään vakavan masennuksen ja kausiluonteisen mielialahäiriön oireiden hoitoon. Wellbutrin 150mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Wellbutrin 150mg kuuluu lääkkeiden luokkaan, joita kutsutaan masennuslääkkeiksi, dopamiinin takaisinoton estäjiksi, masennuslääkkeiksi, muuksi, tupakoinnin lopettamisen apuaineiksi.
Mitkä ovat Wellbutrin 150mg:n mahdolliset sivuvaikutukset?
Wellbutrin voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- kohtaukset (kouristukset),
- hämmennystä,
- epätavalliset muutokset mielialassa tai käyttäytymisessä,
- näön hämärtyminen,
- putkinäkö,
- silmäkipu tai turvotus,
- nähdä haloja valojen ympärillä,
- nopea tai epäsäännöllinen syke,
- kilpa ajatuksia,
- lisääntynyt energia,
- huolimaton käytös,
- erittäin iloinen tai ärtynyt olo,
- puhuu tavallista enemmän ja
- vakavia unihäiriöitä
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Wellbutrinin yleisimmät sivuvaikutukset ovat:
- kuiva suu,
- tukkoinen nenä,
- näköongelmia,
- kuulo-ongelmia,
- pahoinvointi,
- oksentelua,
- ummetus,
- unihäiriöt (unettomuus),
- vapina,
- hikoilu,
- ahdistuneisuus tai hermostuneisuus,
- nopeat sydämenlyönnit,
- hämmennystä,
- agitaatio,
- vihamielisyys,
- ihottuma,
- päänsärky,
- huimaus ja
- nivelkipu
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Wellbutrinin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088
VAROITUS
ITSUTURMA-AJAUKSET JA KÄYTTÄYTYMINEN
Itsemurha- ja masennuslääkeaineet
Masennuslääkkeet lisäsivät itsemurha-ajatusten ja -käyttäytymisen riskiä lapsilla, nuorilla ja nuorilla aikuisilla lyhytaikaisissa tutkimuksissa. Nämä tutkimukset eivät osoittaneet itsemurha-ajatusten ja -käyttäytymisen riskin lisääntymistä masennuslääkkeiden käytön yhteydessä yli 24-vuotiailla. masennuslääkkeiden käytön riski pieneni 65-vuotiailla ja sitä vanhemmilla [ks. VAROITUKSET JA VAROTOIMET].
Kaiken ikäisiä potilaita, joilla on aloitettu masennuslääkehoito, on seurattava tarkasti pahenemisen ja itsemurha-ajatusten ja -käyttäytymisen ilmaantumisen varalta. Kerro perheille ja omaishoitajille tiiviin tarkkailun ja yhteydenpidon tarpeesta lääkkeen määräävän lääkärin kanssa [katso VAROITUKSET JA VAROTOIMET].
KUVAUS
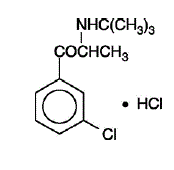
WELLBUTRIN (bupropionihydrokloridi), aminoketoniluokan masennuslääke, ei ole kemiallisesti sukua trisyklisille, tetrasyklisille, selektiivisille serotoniinin takaisinoton estäjille tai muille tunnetuille masennuslääkkeille. Sen rakenne muistuttaa läheisesti dietyylipropionin rakennetta; se liittyy fenyylietyyliamiineihin. Sitä kutsutaan (±)-1-(3-kloorifenyyli)-2-[(1,1-dimetyylietyyli)amino]-1-propanonihydrokloridiksi. Molekyylipaino on 276,2. Molekyylikaava on C13H18ClNO•HCl. Bupropionihydrokloridijauhe on valkoista, kiteistä ja liukenee hyvin veteen. Sillä on karvas maku ja se tuottaa paikallispuudutuksen tunteen suun limakalvolla. Rakennekaava on:
WELLBUTRIN toimitetaan suun kautta 75 mg (keltakultainen) ja 100 mg (punainen) kalvopäällysteisinä tabletteina. Jokainen tabletti sisältää merkityn määrän bupropionihydrokloridia ja inaktiivisia aineosia: 75 mg tabletti – D&C Yellow No. 10 Lake, FD&C Yellow No. 6 Lake, hydroksipropyyliselluloosa, hypromelloosi, mikrokiteinen selluloosa, polyetyleeniglykoli, talkki ja titaanidioksidi; 100 mg tabletti – FD&C Red No. 40 Lake, FD&C Yellow No. 6 Lake, hydroksipropyyliselluloosa, hypromelloosi, mikrokiteinen selluloosa, polyetyleeniglykoli, talkki ja titaanidioksidi.
INDIKAATIOT
WELLBUTRIN (bupropionihydrokloridi) on tarkoitettu vakavan masennushäiriön (MDD) hoitoon diagnostisen ja tilastollisen käsikirjan (DSM) määritelmän mukaisesti.
WELLBUTRIN 300 mg:n teho vakavan masennusjakson hoidossa varmistettiin kahdessa 4 viikkoa kestäneessä kontrolloidussa avohoitotutkimuksessa ja yhdessä 6 viikkoa kestäneessä kontrolloidussa avohoitotutkimuksessa aikuisilla MDD-potilailla [ks. Kliiniset tutkimukset ].
ANNOSTELU JA HALLINNOINTI
Yleiset käyttöohjeet
Pienennä kohtausriskiä lisäämällä annosta vähitellen [katso VAROITUKSET JA VAROTOIMET ]. Annoksen lisäys ei saa ylittää 100 mg/vrk kolmen päivän aikana. Wellbutrin-tabletit tulee niellä kokonaisina, eikä niitä saa murskata, jakaa tai pureskella. Wellbutrin 300 mg voidaan ottaa ruoan kanssa tai ilman.
Suositeltu aloitusannos on 200 mg/vrk, annettuna 100 mg kahdesti vuorokaudessa. Kolmen päivän annostelun jälkeen annosta voidaan nostaa 300 mg:aan vuorokaudessa, joka annetaan 100 mg:na 3 kertaa vuorokaudessa, ja peräkkäisten annosten välillä on oltava vähintään 6 tuntia. Yli 300 mg:n vuorokausiannos voidaan saavuttaa käyttämällä 75 tai 100 mg:n tabletteja.
Enintään 450 mg/vrk jaettuna enintään 150 mg:n annoksiin voidaan harkita potilaille, joilla ei havaita kliinistä paranemista useiden viikkojen 300 mg:n vuorokausihoidon jälkeen. Anna 100 mg:n tabletti 4 kertaa päivässä, jotta kerta-annoksena ei ylitetä 150 mg:n rajaa.
Yleisesti ollaan samaa mieltä siitä, että akuutit masennuksen jaksot vaativat useita kuukausia tai pidempään masennuslääkehoitoa akuutin episodin vasteen lisäksi. Ei tiedetä, onko ylläpitohoitoon tarvittava WELLBUTRIN-annos identtinen alkuperäisen vasteen aiheuttaneen annoksen kanssa. Arvioi ajoittain uudelleen ylläpitohoidon tarve ja sopiva annos tällaiselle hoidolle.
Annoksen säätäminen potilailla, joilla on maksan vajaatoiminta
Keskivaikeasta tai vaikeasta maksan vajaatoiminnasta kärsivillä potilailla (Child-Pugh-pistemäärä: 7–15) WELLBUTRIN 150 mg:n enimmäisannos on 75 mg/vrk. Potilailla, joilla on lievä maksan vajaatoiminta (Child-Pugh-pistemäärä: 5–6), harkitse annoksen ja/tai annostelutiheyden pienentämistä [ks. Käyttö tietyissä populaatioissa , KLIININEN FARMAKOLOGIA ].
Annoksen säätäminen potilailla, joilla on munuaisten vajaatoiminta
Harkitse Wellbutrin 150 mg:n annoksen ja/tai käyttötiheyden pienentämistä potilailla, joilla on munuaisten vajaatoiminta (glomerulaarinen suodatusnopeus alle 90 ml/min) [ks. Käyttö tietyissä populaatioissa , KLIININEN FARMAKOLOGIA ].
Potilaan vaihtaminen monoamiinioksidaasin estäjää (MAOI) tai masennuslääkkeestä
Masennuksen hoitoon tarkoitetun MAO-estäjän käytön lopettamisen ja Wellbutrin-hoidon aloittamisen välillä tulee kulua vähintään 14 päivää. Sitä vastoin vähintään 14 päivää tulisi olla WELLBUTRIN-hoidon lopettamisen jälkeen ennen MAOI-masennuslääkkeen aloittamista [ks. VASTA-AIHEET , HUUMEIDEN VUOROVAIKUTUKSET ].
Wellbutriinin käyttö palautuvien MAO-estäjien, kuten linetsolidin tai metyleenisinisen, kanssa
Älä aloita WELLBUTRIN 300 mg:n käyttöä potilaalla, jota hoidetaan reversiibelillä MAO:n estäjällä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä. Lääkkeiden yhteisvaikutukset voivat lisätä hypertensiivisten reaktioiden riskiä. Potilaalla, joka tarvitsee kiireellisempää hoitoa psykiatriseen tilaan, ei-lääketieteellisiä toimenpiteitä, mukaan lukien sairaalahoito, tulee harkita [ks. VASTA-AIHEET , HUUMEIDEN VUOROVAIKUTUKSET ].
Joissakin tapauksissa potilas, joka saa jo Wellbutrin-hoitoa, saattaa tarvita kiireellistä hoitoa linetsolidilla tai suonensisäisellä metyleenisinisellä. Jos hyväksyttäviä vaihtoehtoja linetsolidi- tai suonensisäiselle metyleenisinihoidolle ei ole saatavilla ja linetsolidi- tai suonensisäisen metyleenisinihoidon mahdollisten hyötyjen katsotaan ylittävän tietyn potilaan hypertensiivisten reaktioiden riskit, WELLBUTRIN 300 mg:n käyttö tulee lopettaa välittömästi ja linetsolidi tai suonensisäinen metyleeni sinistä voidaan antaa. Potilasta tulee tarkkailla 2 viikon ajan tai 24 tunnin ajan viimeisen linetsolidin tai suonensisäisen metyleenisinisen annoksen jälkeen sen mukaan, kumpi tulee ensin. WELLBUTRIN 300 mg -hoitoa voidaan jatkaa 24 tunnin kuluttua viimeisen linetsolidin tai suonensisäisen metyleenisinisen annoksen jälkeen.
Riski metyleenisinisen antamisesta ei-intravenoosisesti (kuten suun kautta otettavien tablettien tai paikallisten injektioiden kautta) tai laskimonsisäisinä annoksina, jotka ovat paljon pienempiä kuin 1 mg/kg Wellbutrin 300 mg:n kanssa, on epäselvä. Kliinikon tulee kuitenkin olla tietoinen mahdollisesta lääkevuorovaikutuksesta tällaisen käytön kanssa [katso VASTA-AIHEET , HUUMEIDEN VUOROVAIKUTUKSET ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
- 75 mg – keltakultaisia, pyöreitä, kaksoiskuperia tabletteja, joihin on painettu ”WELLBUTRIN 75”.
- 100 mg – punaisia, pyöreitä, kaksoiskuperia tabletteja, joihin on painettu ”WELLBUTRIN 100”.
Varastointi ja käsittely
WELLBUTRIN 150 mg tabletit, 75 mg bupropionihydrokloridia, ovat keltakultaisia, pyöreitä, kaksoiskuperia tabletteja, joihin on painettu "WELLBUTRIN 75" 100 ( NDC 0173-0177-55).
WELLBUTRIN-tabletit, 100 mg bupropionihydrokloridia, ovat punaisia, pyöreitä, kaksoiskuperia tabletteja, joihin on painettu "WELLBUTRIN 100" 100 ( NDC 0173-0178-55).
Säilytä huoneenlämmössä, 20° - 25°C (68° - 77°F); retket sallitaan 15°C - 30°C (59°F - 86°F) [Katso USP-ohjattu huonelämpötila ]. Suojaa valolta ja kosteudelta.
Valmistettu: GlaxoSmithKline, Research Triangle Park,. Tarkistettu: marraskuuta 2019
SIVUVAIKUTUKSET
Seuraavia haittavaikutuksia käsitellään tarkemmin muissa merkintöjen osissa:
- Nuorten ja nuorten aikuisten itsemurha-ajatukset ja -käyttäytyminen [katso LAATIKKO VAROITUS , VAROITUKSET JA VAROTOIMET ]
- Neuropsykiatriset oireet ja itsemurhariski tupakoinnin lopettamisen hoidossa [katso VAROITUKSET JA VAROTOIMET ]
- Kohtaus [katso VAROITUKSET JA VAROTOIMET ]
- Hypertensio [katso VAROITUKSET JA VAROTOIMET ]
- Manian tai hypomanian aktivointi [katso VAROITUKSET JA VAROTOIMET ]
- Psykoosi ja muut neuropsykiatriset reaktiot [katso VAROITUKSET JA VAROTOIMET ]
- Kulman sulkeutuva glaukooma [katso VAROITUKSET JA VAROTOIMET ]
- Yliherkkyysreaktiot [ks VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta kliinisessä käytännössä havaittuja nopeuksia.
Haittavaikutukset, jotka johtavat hoidon keskeyttämiseen
Haittavaikutukset olivat riittävän vaikeita aiheuttaakseen WELLBUTRIN-hoidon keskeyttämisen noin 10 %:lla niistä 2 400 tutkittavasta ja terveestä vapaaehtoisesta, jotka osallistuivat kliinisiin tutkimuksiin tuotteen alkukehityksen aikana. Yleisempiä hoidon lopettamisen aiheuttavia tapahtumia ovat neuropsykiatriset häiriöt (3,0 %), pääasiassa kiihtyneisyys ja psyykkisen tilan poikkeavuudet; ruoansulatuskanavan häiriöt (2,1 %), pääasiassa pahoinvointia ja oksentelua; neurologiset häiriöt (1,7 %), pääasiassa kohtaukset, päänsärky ja unihäiriöt; ja dermatologiset ongelmat (1,4 %), pääasiassa ihottumaa. On kuitenkin tärkeää huomata, että monet näistä tapahtumista tapahtuivat annoksilla, jotka ylittävät suositellun vuorokausiannoksen.
Yleisesti havaitut haittavaikutukset
Wellbutrinilla hoidetuilla potilailla yleisesti esiintyviä haittavaikutuksia ovat kiihtyneisyys, suun kuivuminen, unettomuus, päänsärky/migreeni, pahoinvointi/oksentelu, ummetus, vapina, huimaus, liiallinen hikoilu, näön hämärtyminen, takykardia, sekavuus, ihottuma, vihamielisyys, sydämen rytmihäiriöt ja kuulohäiriöt. häiriötä.
Taulukossa 2 on yhteenveto haittavaikutuksista, joita esiintyi lumekontrolloiduissa tutkimuksissa vähintään 1 %:lla 150 mg Wellbutrinia saaneista potilaista ja useammin näillä potilailla kuin lumeryhmässä.
Muut Wellbutrinin kliinisen kehityksen aikana havaitut haittavaikutukset
WELLBUTRIN-altistuksen olosuhteet ja kesto vaihtelivat suuresti, ja merkittävä osa kokemuksesta saatiin avoimissa ja kontrolloimattomissa kliinisissä olosuhteissa. Tämän kokemuksen aikana raportoitiin lukuisia haittatapahtumia; Ilman asianmukaisia kontrolleja on kuitenkin mahdotonta määrittää varmasti, mitkä tapahtumat olivat tai eivät olleet WELLBUTRINin aiheuttamia. Seuraava luettelo on organisoitu elinjärjestelmittäin ja kuvaa tapahtumia niiden suhteellisella raportointitiheydellä tietokannassa.
Käytetään seuraavia esiintymistiheyden määritelmiä: Usein esiintyvät haittavaikutukset määritellään sellaisiksi, joita esiintyy vähintään 1/100:lla. Harvinaiset haittavaikutukset ovat niitä, joita esiintyy 1/100–1/1 000 koehenkilöllä, kun taas harvinaisia haittavaikutuksia esiintyy alle 1/1 000:lla.
Kardiovaskulaarinen Usein esiintyi turvotusta; harvinaisia olivat rintakipu, EKG:n poikkeavuuksia (ennenaikaisia lyöntejä ja epäspesifisiä ST-T-muutoksia) ja hengenahdistusta/hengenahdistusta; harvinaisia olivat punoitus ja sydäninfarkti.
Ihotauti: Harvoin oli hiustenlähtö.
Endokriiniset: Harvinainen oli gynekomastia; harvinainen oli glykosuria.
Ruoansulatuskanava: Harvinaisia olivat dysfagia, janohäiriö ja maksavaurio/keltatauti; harvinainen oli suolen perforaatio.
Sukuelimet: Usein oli nokturia; harvoin olivat emättimen ärsytys, kivesten turvotus, virtsatietulehdus, kivulias erektio ja hidastunut siemensyöksy; harvinaisia olivat enureesi ja virtsankarkailu.
Neurologinen: Yleisiä olivat ataksia/koordinaatiohäiriöt, kohtaukset, myoklonus, dyskinesia ja dystonia; harvoin olivat mydriaasi, huimaus ja dysartria; harvinaisia olivat elektroenkefalogrammin (EEG) poikkeavuudet ja heikentynyt tarkkaavaisuus.
Neuropsykiatriset: Usein olivat mania/hypomania, lisääntynyt libido, hallusinaatiot, seksuaalisen toiminnan heikkeneminen ja masennus; harvoin olivat muistin heikkeneminen, depersonalisaatio, psykoosi, dysforia, mielialan epävakaus, vainoharhaisuus ja muodollinen ajatteluhäiriö; harvinainen itsemurha-ajatukset.
Suulliset valitukset: Usein oli stomatiitti; harvoin olivat hammassärky, bruksismi, ikenien ärsytys ja suun turvotus.
Hengitys: Harvinaisia olivat keuhkoputkentulehdus ja hengenahdistus/hengenahdistus; harvinainen oli keuhkoembolia.
Erityiset aistit: Harvoin oli näköhäiriöitä; harvinainen oli diplopia.
Epäspesifinen: Usein oli flunssan kaltaisia oireita; harvoin oli epäspesifistä kipua; harvinainen oli yliannostus.
Muuttunut ruokahalu ja paino
Painonpudotus yli 5 kiloa. esiintyi 28 %:lla Wellbutrinia saaneista potilaista. Tämä ilmaantuvuus on noin kaksinkertainen verrattuna vastaavilla trisyklisillä lääkkeillä tai lumelääkettä saaneilla potilailla. Lisäksi vaikka 35 % trisyklisiä masennuslääkkeitä saaneista koehenkilöistä lihoi, vain 9,4 % Wellbutrinilla hoidetuista koehenkilöistä nousi. Näin ollen, jos painonpudotus on merkittävä merkki potilaan masennussairaudesta, WELLBUTRINin ruokahaluttomuutta ja/tai painoa alentavaa potentiaalia tulee harkita.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu WELLBUTRINin hyväksymisen jälkeisen käytön aikana, eikä niitä ole kuvattu muualla etiketissä. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Runko (yleinen)
Nivelsärky, lihaskipu ja kuume, johon liittyy ihottumaa ja muita viivästyneeseen yliherkkyyteen viittaavia oireita. Nämä oireet voivat muistuttaa seerumitautia [katso VAROITUKSET JA VAROTOIMET ].
Kardiovaskulaarinen
Hypertensio (joissakin tapauksissa vaikea), ortostaattinen hypotensio, kolmannen asteen sydänkatkos.
Endokriininen
Hyponatremia, epäasianmukaisen antidiureettisen hormonin erityksen oireyhtymä, hyperglykemia, hypoglykemia.
Ruoansulatuskanava
Esofagiitti, hepatiitti.
Hemic ja lymfaattinen
Ekkymoosi, leukosytoosi, leukopenia, trombosytopenia. Muuttuneita PT- ja/tai INR-arvoja, joihin harvoin liittyi verenvuoto- tai tromboottisia komplikaatioita, havaittiin, kun bupropionia annettiin samanaikaisesti varfariinin kanssa.
Tuki- ja liikuntaelimistön
Lihasten jäykkyys/kuume/rabdomyolyysi, lihasheikkous.
Hermosto
Aggressio, kooma, valmistunut itsemurha, delirium, unen poikkeavuudet, vainoharhaiset ajatukset, parestesia, parkinsonismi, levottomuus, itsemurhayritys, tardiivin dyskinesian paljastaminen.
Iho ja lisäkkeet
Stevens-Johnsonin oireyhtymä, angioödeema, eksfoliatiivinen dermatiitti, nokkosihottuma.
Erityiset aistit
Tinnitus, kohonnut silmänpaine.
HUUMEIDEN VUOROVAIKUTUKSET
Muiden lääkkeiden mahdollisuus vaikuttaa Wellbutriniin
Bupropioni metaboloituu pääasiassa hydroksibupropioniksi CYP2B6:n vaikutuksesta. Siksi WELLBUTRINin ja lääkkeiden välillä, jotka ovat CYP2B6:n estäjiä tai indusoijia, on olemassa mahdollisuus yhteisvaikutuksiin.
CYP2B6:n estäjät
Tiklopidiini ja klopidogreeli
Samanaikainen hoito näillä lääkkeillä voi lisätä bupropionialtistusta, mutta vähentää hydroksibupropionialtistusta. Kliinisen vasteen perusteella Wellbutrinin annoksen muuttaminen saattaa olla tarpeen, kun sitä annetaan samanaikaisesti CYP2B6-estäjien (esim. tiklopidiinin tai klopidogreelin) kanssa (ks. KLIININEN FARMAKOLOGIA ].
CYP2B6:n indusoijat
Ritonaviiri, lopinaviiri ja efavirentsi
Samanaikainen hoito näillä lääkkeillä voi vähentää bupropionin ja hydroksibupropionin altistumista. WELLBUTRIN-annoksen suurentaminen voi olla tarpeen, kun sitä annetaan yhdessä ritonaviirin, lopinaviirin tai efavirentsin kanssa (ks. KLIININEN FARMAKOLOGIA ], mutta se ei saa ylittää suurinta suositeltua annosta.
Karbamatsepiini, fenobarbitaali, fenytoiini
Vaikka näitä lääkkeitä ei ole tutkittu systemaattisesti, ne voivat indusoida bupropionin metaboliaa ja vähentää bupropionin altistumista [ks. KLIININEN FARMAKOLOGIA ]. Jos bupropionia käytetään samanaikaisesti CYP-induktorin kanssa, voi olla tarpeen suurentaa bupropionin annosta, mutta suurinta suositeltua annosta ei saa ylittää.
WELLBUTRIN 300 mg:n mahdollisuus vaikuttaa muihin lääkkeisiin
CYP2D6:n kautta metaboloituvat lääkkeet
Bupropioni ja sen metaboliitit (erytrohydrobupropioni, treohydrobupropioni, hydroksibupropioni) ovat CYP2D6:n estäjiä. Siksi WELLBUTRINin samanaikainen anto CYP2D6:n kautta metaboloituvien lääkkeiden kanssa voi lisätä altistumista lääkkeille, jotka ovat CYP2D6:n substraatteja. Tällaisia lääkkeitä ovat tietyt masennuslääkkeet (esim. venlafaksiini, nortriptyliini, imipramiini, desipramiini, paroksetiini, fluoksetiini ja sertraliini), psykoosilääkkeet (esim. haloperidoli, risperidoni, tioridatsiini), beetasalpaajat (esim. metoprololi) ja tyypin 1C verenpainelääkkeet (esim. propafenoni ja flekainidi). Kun niitä käytetään samanaikaisesti Wellbutrinin kanssa, voi olla tarpeen pienentää näiden CYP2D6-substraattien annosta, erityisesti lääkkeiden, joilla on kapea terapeuttinen indeksi.
Lääkkeet, jotka vaativat CYP2D6:n metabolista aktivointia ollakseen tehokkaita (esim. tamoksifeeni), voivat teoreettisesti heikentää tehoa, kun niitä on annettu samanaikaisesti CYP2D6:n estäjien, kuten bupropionin, kanssa. Potilaat, joita hoidetaan samanaikaisesti Wellbutrin-valmisteella ja tällaisilla lääkkeillä, voivat tarvita suurempia lääkeannoksia (ks. KLIININEN FARMAKOLOGIA ].
Digoksiini
Wellbutrinin samanaikainen käyttö digoksiinin kanssa voi alentaa plasman digoksiinipitoisuutta. Tarkkaile plasman digoksiinitasoja potilailla, joita hoidetaan samanaikaisesti Wellbutrinilla ja digoksiinilla [ks. KLIININEN FARMAKOLOGIA ].
Lääkkeet, jotka alentavat kohtauskynnystä
Ole äärimmäisen varovainen, kun käytät Wellbutrinia yhdessä muiden kohtauskynnystä alentavien lääkkeiden kanssa (esim. muut bupropionituotteet, psykoosilääkkeet, masennuslääkkeet, teofylliini tai systeemiset kortikosteroidit). Käytä pieniä aloitusannoksia ja lisää annosta vähitellen [katso VASTA-AIHEET , VAROITUKSET JA VAROTOIMET ].
Dopaminergiset lääkkeet (levodopa ja amantadiini)
Bupropionilla, levodopalla ja amantadiinilla on dopamiiniagonistivaikutuksia. Keskushermostotoksisuutta on raportoitu, kun bupropionia annettiin samanaikaisesti levodopan tai amantadiinin kanssa. Haittavaikutuksia ovat olleet levottomuus, kiihtyneisyys, vapina, ataksia, kävelyhäiriöt, huimaus ja huimaus. Myrkyllisyyden oletetaan johtuvan kumulatiivisista dopamiiniagonistivaikutuksista. Ole varovainen, kun annat Wellbutrin 150 mg samanaikaisesti näiden lääkkeiden kanssa.
Käytä alkoholin kanssa
Markkinoille tulon jälkeen on raportoitu harvoin haitallisia neuropsykiatrisia tapahtumia tai heikentynyttä alkoholinsietokykyä potilailla, jotka joivat alkoholia Wellbutrin-hoidon aikana. Alkoholin käyttöä Wellbutrin-hoidon aikana tulee minimoida tai sitä tulee välttää.
MAO-estäjät
Bupropioni estää dopamiinin ja norepinefriinin takaisinottoa. MAO-estäjien ja bupropionin samanaikainen käyttö on vasta-aiheista, koska hypertensiivisten reaktioiden riski kasvaa, jos bupropionia käytetään samanaikaisesti MAO-estäjien kanssa. Eläinkokeet osoittavat, että MAO-estäjä feneltsiini lisää bupropionin akuuttia toksisuutta. Masennuksen hoitoon tarkoitetun MAO-estäjän käytön lopettamisen ja Wellbutrin-hoidon aloittamisen välillä tulee kulua vähintään 14 päivää. Sitä vastoin Wellbutrin 150 mg:n lopettamisen jälkeen tulisi varata vähintään 14 päivää ennen MAOI-masennuslääkkeen aloittamista [ks. ANNOSTELU JA HALLINNOINTI , VASTA-AIHEET ].
Lääkkeiden ja laboratoriotestien vuorovaikutukset
Virtsan amfetamiinien varalta on raportoitu vääriä positiivisia immunologisia seulontatestejä bupropionia käyttävillä potilailla. Tämä johtuu joidenkin seulontatestien spesifisyyden puutteesta. Vääriä positiivisia testituloksia voi saada jopa bupropionihoidon lopettamisen jälkeen. Vahvistavat testit, kuten kaasukromatografia/massaspektrometria, erottavat bupropionin amfetamiineista.
Huumeiden väärinkäyttö ja riippuvuus
Valvottu aine
Bupropioni ei ole valvottu aine.
Väärinkäyttö
Ihmiset
Kontrolloidut kliiniset tutkimukset, jotka suoritettiin normaaleilla vapaaehtoisilla, koehenkilöillä, joilla on ollut useita huumeiden väärinkäyttöä, ja masentuneilla koehenkilöillä osoittivat jonkin verran lisääntynyttä motorista aktiivisuutta ja kiihtyneisyyttä/kiihtyneisyyttä, mikä on usein tyypillistä keskushermostovaikutukselle.
Huumeiden väärinkäytöstä kokeneiden henkilöiden populaatiossa kerta-annos 400 mg bupropionia aiheutti lievää amfetamiinin kaltaista aktiivisuutta verrattuna lumelääkkeeseen Addiction Research Center Inventoriesin (ARCI) morfiini-bentsedriini-alaskaalalla ja pistemäärä, joka oli suurempi kuin plasebo. lumelääkettä, mutta alle 15 mg Schedule II stimulanttia dekstroamfetamiinia ARCI:n mieltymysasteikolla. Nämä asteikot mittaavat yleistä euforian tunnetta ja huumeiden mieltymystä, jotka usein liittyvät väärinkäyttömahdollisuuksiin.
Kliinisissä tutkimuksissa saatujen tulosten ei kuitenkaan tiedetä ennustavan luotettavasti lääkkeiden väärinkäyttöpotentiaalia. Siitä huolimatta kerta-annostutkimuksista saadut todisteet viittaavat siihen, että bupropionin suositeltu päivittäinen annos, kun se annetaan suun kautta jaettuna annoksina, ei todennäköisesti vahvista merkittävästi amfetamiinia tai keskushermostoa stimuloivien aineiden väärinkäyttäjiä. Suuremmat annokset (joita ei voitu testata kohtausriskin vuoksi) voivat kuitenkin olla vaatimattomasti houkuttelevia niille, jotka käyttävät väärin keskushermostoa stimuloivia lääkkeitä.
WELLBUTRIN on tarkoitettu vain suun kautta käytettäväksi. Murskattujen tablettien hengittämistä tai liuenneen bupropionin injektiota on raportoitu. Kouristuskohtauksia ja/tai kuolemantapauksia on raportoitu, kun bupropionia on annettu intranasaalisesti tai parenteraalisesti.
Eläimet
Jyrsijöillä ja kädellisillä tehdyt tutkimukset osoittivat, että bupropionilla on joitain psykostimulanteille yhteisiä farmakologisia vaikutuksia. Jyrsijöillä sen on osoitettu lisäävän liikkumisaktiivisuutta, saavan aikaan lievän stereotyyppisen käyttäytymisvasteen ja lisäävän vasteastetta useissa aikatauluohjatun käyttäytymisen paradigmissa. Psykoaktiivisten lääkkeiden positiivisia vahvistavia vaikutuksia arvioivissa kädellismalleissa bupropionia annettiin itse suonensisäisesti. Rotilla bupropioni tuotti amfetamiinin kaltaisia ja kokaiinin kaltaisia erottavia ärsykevaikutuksia huumeiden syrjinnän paradigmoissa, joita käytettiin psykoaktiivisten huumeiden subjektiivisten vaikutusten luonnehtimiseen.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Itsemurha-ajatukset ja -käyttäytyminen lapsilla, nuorilla ja nuorilla aikuisilla
MDD-potilaat, sekä aikuiset että lapsipotilaat, voivat kokea masennuksensa pahenemista ja/tai itsemurha-ajatuksia ja -käyttäytymistä (itsemurha-ajatuksia) tai epätavallisia muutoksia käyttäytymisessä riippumatta siitä, käyttävätkö he masennuslääkkeitä vai eivät, ja tämä riski voi jatkua, kunnes se on merkittävää. remissio tapahtuu. Itsemurha on tunnettu masennuksen ja tiettyjen muiden psykiatristen häiriöiden riski, ja nämä häiriöt itsessään ovat vahvimpia itsemurhan ennustajia. Pitkään on ollut huoli siitä, että masennuslääkkeillä voi olla rooli masennuksen pahenemisessa ja itsetuhoisuuden syntymisessä tietyillä potilailla hoidon alkuvaiheessa.
Lyhytaikaisten lumekontrolloitujen masennuslääkkeiden (selektiiviset serotoniinin takaisinoton estäjät [SSRI:t] ja muut) analyysit osoittavat, että nämä lääkkeet lisäävät itsemurha-ajattelun ja -käyttäytymisen (itsemurha-ajattelun) riskiä lapsilla, nuorilla ja nuorilla aikuisilla (18-vuotiaat). - 24), joilla on MDD ja muut psykiatriset häiriöt. Lyhytaikaiset kliiniset tutkimukset eivät osoittaneet itsemurhariskin lisääntymistä masennuslääkkeillä lumelääkkeeseen verrattuna yli 24-vuotiailla aikuisilla; 65-vuotiailla ja sitä vanhemmilla aikuisilla masennuslääkkeet vähenivät lumelääkkeeseen verrattuna.
Plasebokontrolloitujen tutkimusten yhdistetyt analyysit lapsilla ja nuorilla, joilla oli MDD, pakko-oireinen häiriö (OCD) tai muita psykiatrisia häiriöitä, sisälsivät yhteensä 24 lyhytaikaista tutkimusta 9 masennuslääkkeestä yli 4 400 potilaalla. Plasebokontrolloitujen tutkimusten yhdistetyt analyysit aikuisilla, joilla oli MDD tai muita psykiatrisia häiriöitä, sisälsivät yhteensä 295 lyhytaikaista tutkimusta (mediaanikesto 2 kuukautta), joissa oli 11 masennuslääkettä yli 77 000 koehenkilöllä. Itsemurhariskissä huumeiden välillä oli huomattavaa vaihtelua, mutta lähes kaikkien tutkittujen huumeiden kohdalla suuntaus nuorempien koehenkilöiden lisääntymiseen. Absoluuttisessa itsemurhariskissä oli eroja eri indikaatioiden välillä, ja suurin ilmaantuvuus MDD:ssä. Riskierot (lääke vs. lumelääke) olivat kuitenkin suhteellisen vakaita ikäryhmien sisällä ja eri käyttöaiheissa. Nämä riskierot (lääkkeen ja lumelääkkeen välinen ero itsemurhatapausten määrässä 1 000 hoidettavaa kohden) on esitetty taulukossa 1.
Yhtään itsemurhaa ei tapahtunut missään lapsitutkimuksessa. Aikuisten kokeissa oli itsemurhia, mutta määrä ei riittänyt päättämään lääkkeiden vaikutuksesta itsemurhaan.
Ei tiedetä, ulottuuko itsemurhariski pitkäaikaiseen käyttöön eli useiden kuukausien jälkeiseen käyttöön. Lumekontrolloiduista ylläpitotutkimuksista aikuisilla, joilla on masennus, on kuitenkin huomattavaa näyttöä siitä, että masennuslääkkeiden käyttö voi viivyttää masennuksen uusiutumista.
Kaikkia potilaita, joita hoidetaan masennuslääkkeillä missä tahansa indikaatiossa, on seurattava asianmukaisesti ja tarkkailtava tarkasti kliinisen pahenemisen, itsemurha-ajattelun ja epätavallisten käyttäytymismuutosten varalta, erityisesti lääkehoidon ensimmäisten kuukausien aikana tai annosta muutettaessa, joko annosta suurennetaan. tai pienenee [katso LAATIKKOVAROITUS].
Seuraavia oireita, ahdistusta, kiihtyneisyyttä, paniikkikohtauksia, unettomuutta, ärtyneisyyttä, vihamielisyyttä, aggressiivisuutta, impulsiivisuutta, akatisiaa (psykomotorista levottomuutta), hypomaniaa ja maniaa on raportoitu myös aikuisilla ja lapsipotilailla, joita on hoidettu masennuslääkkeillä vakavan masennuksen vuoksi. kuten muissakin indikaatioissa, sekä psykiatrisissa että ei-psykiatrisissa. Vaikka syy-yhteyttä tällaisten oireiden ilmaantumisen ja joko masennuksen pahenemisen ja/tai itsetuhoisten impulssien ilmaantumisen välillä ei ole osoitettu, on huolestuttavaa, että tällaiset oireet voivat olla syntyvän itsetuhoisuuden esiaste.
Hoito-ohjelman muuttamista, mukaan lukien lääkityksen mahdollista lopettamista, tulee harkita potilailla, joiden masennus pahenee jatkuvasti tai joilla on ilmennyt itsemurha tai oireita, jotka saattavat olla masennuksen tai itsemurha-ajatuksen pahenemisen edeltäjä, varsinkin jos nämä oireet ovat vakavia, äkillisiä. oireiden alkaessa tai eivät olleet osa potilaan oireita.
MDD:n tai muiden, sekä psykiatristen että ei-psykiatristen, masennuslääkkeiden hoitoon saavien potilaiden perheitä ja hoitajia tulee varoittaa tarpeesta seurata potilaita kiihtyneisyyden, ärtyneisyyden, epätavallisten käyttäytymismuutosten ja muiden edellä kuvattujen oireiden ilmaantumisen varalta. sekä itsemurha-ajatuksen ilmaantumista ja ilmoittamaan tällaisista oireista välittömästi terveydenhuollon tarjoajille. Tällaiseen seurantaan tulisi sisältyä perheiden ja omaishoitajien päivittäinen tarkkailu. WELLBUTRIN 150 mg:n resepti tulee kirjoittaa pienimmälle tablettimäärälle, joka on potilaan hyvän hoidon mukainen, jotta voidaan vähentää yliannostusriskiä.
Neuropsykiatriset haittatapahtumat ja itsemurhariski tupakoinnin lopettamishoidossa
WELLBUTRIN ei ole hyväksytty tupakoinnin vieroitushoitoon; se sisältää kuitenkin samaa vaikuttavaa ainetta kuin tupakoinnin vieroituslääke ZYBAN. Vakavia neuropsykiatrisia haittavaikutuksia on raportoitu potilailla, jotka ovat käyttäneet bupropionia tupakoinnin lopettamiseksi. Nämä markkinoille tulon jälkeiset raportit ovat sisältäneet mielialan muutoksia (mukaan lukien masennus ja mania), psykoosia, hallusinaatioita, vainoharhaisuutta, harhaluuloja, murha-ajatuksia, aggressiota, vihamielisyyttä, kiihtyneisyyttä, ahdistusta ja paniikkia sekä itsemurha-ajatuksia, itsemurhayrityksiä ja valmiita itsemurhia [ katso HAITTAVAIKUTUKSET ]. Jotkut tupakoinnin lopettaneet potilaat ovat saattaneet kokea nikotiinin vieroitusoireita, mukaan lukien masentunut mieliala. Masennusta, johon harvoin sisältyy itsemurha-ajatuksia, on raportoitu tupakoitsijoilla, jotka ovat yrittäneet lopettaa tupakoinnin ilman lääkitystä. Jotkut näistä haittavaikutuksista kuitenkin ilmenivät potilailla, jotka käyttivät bupropionia ja jotka jatkoivat tupakointia.
Neuropsykiatrisia haittavaikutuksia esiintyi potilailla, joilla ei ollut tai joilla oli aiempaa psykiatrista sairautta; joidenkin potilaiden psykiatriset sairaudet pahenivat. Tarkkaile potilaita neuropsykiatristen haittatapahtumien esiintymisen varalta. Neuvo potilaita ja hoitajia, että potilaan tulee lopettaa Wellbutrin 300 mg:n käyttö ja ottaa välittömästi yhteyttä terveydenhuollon tarjoajaan, jos havaitaan levottomuutta, masentunutta mielialaa tai muutoksia käyttäytymisessä tai ajattelussa, jotka eivät ole tyypillisiä potilaalle tai jos potilaalle kehittyy itsemurha-ajatuksia tai itsemurhakäyttäytymistä. . Monissa markkinoille tulon jälkeen oireiden on raportoitu häviävän bupropionin käytön lopettamisen jälkeen. Oireet kuitenkin jatkuivat joissakin tapauksissa; siksi jatkuvaa seurantaa ja tukihoitoa tulee tarjota, kunnes oireet häviävät.
Kohtaus
Wellbutrin 300 mg voi aiheuttaa kohtauksia. Kohtausten riski on annoksesta riippuvainen. Annos ei saa ylittää 450 mg/vrk. Lisää annosta vähitellen. Lopeta Wellbutrin 150 mg:n käyttö äläkä aloita hoitoa uudelleen, jos potilaalla on kohtauksia.
Kohtausten riski liittyy myös potilaan tekijöihin, kliinisiin tilanteisiin ja samanaikaisiin lääkkeisiin, jotka alentavat kohtauskynnystä. Harkitse näitä riskejä ennen Wellbutrin-hoidon aloittamista. WELLBUTRIN 300mg on vasta-aiheinen potilaille, joilla on kohtaushäiriö, anoreksia nervosa tai bulimia on tällä hetkellä tai aiemmin diagnosoitu tai joille alkoholin, bentsodiatsepiinien, barbituraattien ja epilepsialääkkeiden käyttö lopetetaan äkillisesti (ks. VASTA-AIHEET , HUUMEIDEN VUOROVAIKUTUKSET ]. Myös seuraavat olosuhteet voivat lisätä kohtausten riskiä: vakava päävamma; arteriovenoosinen epämuodostuma; CNS-kasvain tai CNS-infektio; vakava aivohalvaus; muiden kouristuskynnystä alentavien lääkkeiden samanaikainen käyttö (esim. muut bupropionituotteet, psykoosilääkkeet, trisykliset masennuslääkkeet, teofylliini ja systeemiset kortikosteroidit); aineenvaihduntahäiriöt (esim. hypoglykemia, hyponatremia, vaikea maksan vajaatoiminta ja hypoksia); laittomien huumeiden (esim. kokaiinin) käyttö; tai reseptilääkkeiden, kuten keskushermoston stimulanttien, väärinkäyttö tai väärinkäyttö. Muita altistavia tiloja ovat diabetes mellitus, jota hoidetaan oraalisilla hypoglykeemisillä lääkkeillä tai insuliinilla; anorektisten lääkkeiden käyttö; ja alkoholin, bentsodiatsepiinien, rauhoittavien/unilääkkeiden tai opiaattien liiallinen käyttö.
Kohtausten ilmaantuvuus bupropionin käytön yhteydessä
Bupropioni liittyy kohtauksiin noin 0,4 %:lla (4/1 000) potilaista, joita hoidettiin enintään 450 mg/vrk annoksilla. Wellbutrinin arvioitu kohtausten ilmaantuvuus kasvaa lähes 10-kertaiseksi välillä 450-600 mg/vrk.
Kohtausten riskiä voidaan pienentää, jos WELLBUTRIN 300 mg:n annos ei ylitä 450 mg/vrk, annettuna 150 mg 3 kertaa päivässä, ja titraus on asteittainen.
Hypertensio
Wellbutrin-hoito voi johtaa kohonneeseen verenpaineeseen ja verenpaineeseen. Arvioi verenpaine ennen Wellbutrin 150 mg -hoidon aloittamista ja seuraa sitä säännöllisesti hoidon aikana. Verenpainetaudin riski kasvaa, jos Wellbutrin 150 mg:aa käytetään samanaikaisesti MAO-estäjien tai muiden dopaminergistä tai noradrenergistä aktiivisuutta lisäävien lääkkeiden kanssa (ks. VASTA-AIHEET ].
Vertailevasta tutkimuksesta, jossa koski bupropioni-HCl:n hitaasti vapautuvaa formulaatiota, nikotiini transdermaalista järjestelmää (NTS), hitaasti vapauttavan bupropionin ja NTS:n yhdistelmää ja lumelääkettä tupakoinnin lopettamisen apuvälineenä, viittaavat siihen, että hoitoon liittyvän verenpainetaudin esiintyvyys on suurempi potilaat, joita hoidettiin hitaasti vapauttavan bupropionin ja NTS:n yhdistelmällä. Tässä tutkimuksessa 6,1 %:lla potilaista, joita hoidettiin hitaasti vapautuvan bupropionin ja NTS:n yhdistelmällä, oli hoidon aiheuttama hypertensio, kun vastaavasti 2,5 %:lla, 1,6 %:lla ja 3,1 %:lla potilaista, joita hoidettiin hitaasti vapautuvalla bupropionilla, NTS:llä ja plasebolla, vastaavasti. . Suurimmalla osalla näistä koehenkilöistä oli todisteita olemassa olevasta verenpaineesta. Kolmella koehenkilöllä (1,2 %), joita hoidettiin hitaasti vapauttavan bupropionin ja NTS:n yhdistelmällä, ja yhdellä NTS:llä hoidetulla koehenkilöllä (0,4 %) tutkimuslääkitys keskeytettiin kohonneen verenpaineen vuoksi verrattuna yhteenkään potilasta, joita hoidettiin hitaasti vapauttavalla bupropionilla tai lumelääkeellä. Verenpaineen seurantaa suositellaan potilaille, jotka saavat bupropionin ja nikotiinikorvaushoidon yhdistelmää.
Kliinisessä tutkimuksessa, joka koski välittömästi vapautuvaa bupropionia MDD-potilailla, joilla oli stabiili kongestiivinen sydämen vajaatoiminta (N = 36), bupropioni liittyi olemassa olevan verenpainetaudin pahenemiseen kahdella henkilöllä, mikä johti bupropionihoidon lopettamiseen. Ei ole olemassa kontrolloituja tutkimuksia, joissa arvioitaisiin bupropionin turvallisuutta potilailla, joilla on äskettäin ollut sydäninfarkti tai epästabiili sydänsairaus.
Manian/hypomanian aktivointi
Masennuslääkehoito voi laukaista maanisen, sekalaisen tai hypomaanisen maniajakson. Riski näyttää olevan suurentunut potilailla, joilla on kaksisuuntainen mielialahäiriö tai joilla on kaksisuuntaisen mielialahäiriön riskitekijöitä. Ennen kuin aloitat WELLBUTRIN-hoidon, seulo potilaat aiemman kaksisuuntaisen mielialahäiriön ja kaksisuuntaisen mielialahäiriön riskitekijöiden (esim. suvussa kaksisuuntaisen mielialahäiriön, itsemurhan tai masennuksen) varalta. Wellbutrin 150 mg ei ole hyväksytty käytettäväksi kaksisuuntaisen mielialahäiriön masennuksen hoidossa.
Psykoosi ja muut neuropsykiatriset reaktiot
Wellbutrinilla hoidetuilla masentuneilla potilailla on ollut erilaisia neuropsykiatrisia merkkejä ja oireita, mukaan lukien harhaluulot, hallusinaatiot, psykoosit, keskittymishäiriöt, vainoharhaisuus ja sekavuus. Joillakin näistä potilaista oli diagnosoitu kaksisuuntainen mielialahäiriö. Joissakin tapauksissa nämä oireet hävisivät, kun annosta pienennettiin ja/tai hoito lopetettiin. Neuvo potilaita ottamaan yhteyttä terveydenhuollon ammattilaiseen, jos tällaisia reaktioita ilmenee.
Kulman sulkeutuva glaukooma
Monien masennuslääkkeiden, mukaan lukien Wellbutrin 300 mg:n, käytön jälkeen ilmenevä pupillien laajentuminen voi laukaista kulman sulkemiskohtauksen potilaalla, jolla on anatomisesti kapeat kulmat ja jolle ei ole tehty iridektomiaa.
Yliherkkyysreaktiot
Anafylaktisia/anafylaktisia reaktioita on esiintynyt bupropionin kliinisissä tutkimuksissa. Reaktioihin on ominaista kutina, nokkosihottuma, angioedeema ja hengenahdistus, jotka vaativat lääketieteellistä hoitoa. Lisäksi on ollut harvinaisia, spontaaneja markkinoille tulon jälkeen raportoituja bupropioniin liittyvästä erythema multiformesta, Stevens-Johnsonin oireyhtymästä ja anafylaktisesta sokista. Neuvo potilaita lopettamaan Wellbutrin 150 mg:n käyttö ja kääntymään terveydenhuollon tarjoajan puoleen, jos heille kehittyy hoidon aikana allerginen tai anafylaktoidinen/anafylaktinen reaktio (esim. ihottuma, kutina, nokkosihottuma, rintakipu, turvotus ja hengenahdistus).
Nivelkipua, lihaskipua, kuumetta ja ihottumaa ja muita seerumitaudin kaltaisia oireita, jotka viittaavat viivästyneeseen yliherkkyyteen, on raportoitu.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ).
Itsemurha-ajatukset ja -käyttäytymiset
Opeta potilaita, heidän perheitään ja/tai heidän hoitajiaan olemaan valppaana ahdistuneisuuden, kiihtyneisyyden, paniikkikohtausten, unettomuuden, ärtyisyyden, vihamielisyyden, aggressiivisuuden, impulsiivisuuden, akatisian (psykomotorinen levottomuus), hypomanian, manian ja muiden epätavallisten käyttäytymismuutosten ilmaantuessa. , masennuksen paheneminen ja itsemurha-ajatukset, erityisesti masennuslääkehoidon alkuvaiheessa ja kun annosta muutetaan ylös tai alas. Neuvo potilaiden perheitä ja hoitajia tarkkailemaan tällaisten oireiden ilmaantumista päivittäin, koska muutokset voivat olla äkillisiä. Tällaisista oireista tulee ilmoittaa potilaan määräävälle lääkärille tai terveydenhuollon ammattilaiselle, varsinkin jos ne ovat vakavia, alkavat äkillisesti tai eivät kuuluneet potilaan oireisiin. Tällaiset oireet voivat liittyä lisääntyneeseen itsemurha-ajattelun ja -käyttäytymisen riskiin, ja ne voivat viitata erittäin tiiviin seurannan tarpeeseen ja mahdollisesti lääkityksen muutoksiin.
Neuropsykiatriset haittatapahtumat ja itsemurhariski tupakoinnin lopettamishoidossa
Vaikka WELLBUTRIN 150mg ei ole tarkoitettu tupakoinnin lopettamisen hoitoon, se sisältää samaa vaikuttavaa ainetta kuin ZYBAN, joka on hyväksytty tähän käyttöön. Kerro potilaille, että jotkut potilaat ovat kokeneet mielialan muutoksia (mukaan lukien masennus ja mania), psykoosia, hallusinaatioita, vainoharhaisuutta, harhaluuloja, murha-ajatuksia, aggressiota, vihamielisyyttä, kiihtyneisyyttä, ahdistusta ja paniikkia sekä itsemurha-ajatuksia ja itsemurhaa yrittäessään lopettaa tupakointi bupropionin käytön aikana. Neuvo potilaita lopettamaan bupropionin käyttö ja ottamaan yhteyttä terveydenhuollon ammattilaiseen, jos heillä on tällaisia oireita [katso VAROITUKSET JA VAROTOIMET , HAITTAVAIKUTUKSET ].
Vakavat allergiset reaktiot
Opeta potilaita yliherkkyysoireista ja lopeta Wellbutrin 300 mg:n käyttö, jos heillä on vakava allerginen reaktio.
Kohtaus
Neuvo potilaita lopettamaan WELLBUTRIN-hoito ja olemaan aloittamatta uudelleen, jos heillä on kohtauksia hoidon aikana. Kerro potilaille, että alkoholin, bentsodiatsepiinien, epilepsialääkkeiden tai rauhoittavien/unilääkkeiden liiallinen käyttö tai äkillinen lopettaminen voi lisätä kohtausten riskiä. Neuvo potilaita minimoimaan tai välttämään alkoholin käyttöä.
Kulman sulkeutuva glaukooma
Potilaita tulee kertoa, että Wellbutrin 150 mg:n ottaminen voi aiheuttaa lievää pupillien laajentumista, joka voi herkillä henkilöillä johtaa sulkeutumiskulmaglaukooman episodiin. Aiempi glaukooma on lähes aina avokulmaglaukooma, koska sulkukulmaglaukooma voidaan diagnosoituna hoitaa lopullisesti iridektomialla. Avokulmaglaukooma ei ole kulmaglaukooman riskitekijä. Potilaat saattavat haluta tulla tutkituksi sen määrittämiseksi, ovatko he alttiita kulman sulkemiselle, ja heille voidaan tehdä profylaktinen toimenpide (esim. iridektomia), jos he ovat alttiita [ks. VAROITUKSET JA VAROTOIMET ].
Bupropionia sisältävät tuotteet
Opeta potilaita siitä, että WELLBUTRIN 150mg sisältää samaa vaikuttavaa ainetta (bupropionihydrokloridia), joka löytyy ZYBANista, jota käytetään apuna tupakoinnin vieroitushoidossa, ja että Wellbutrin 150mg -valmistetta ei tule käyttää yhdessä ZYBANin tai muiden bupropionia sisältävien lääkkeiden kanssa (esim. kuten WELLBUTRIN 150mg SR, pitkävaikutteinen formulaatio ja WELLBUTRIN XL tai FORFIVO XL, pitkittyvästi vapautuvat formulaatiot, ja APLENZIN, pitkittyvästi vapautuva bupropionihydrobromidin formulaatio). Lisäksi on olemassa useita geneerisiä bupropioni-HCl-tuotteita välittömästi, hitaasti ja pitkävaikutteisia formulaatioita varten.
Kognitiivisen ja motorisen vajaatoiminnan mahdollisuus
Kerro potilaille, että mikä tahansa keskushermostoon vaikuttava lääke, kuten WELLBUTRIN, voi heikentää heidän kykyään suorittaa tehtäviä, jotka vaativat harkintaa tai motorisia ja kognitiivisia taitoja. Neuvo potilaita, että kunnes he ovat kohtuullisen varmoja siitä, että Wellbutrin 300mg ei vaikuta haitallisesti heidän suorituskykyyn, heidän tulee pidättäytyä ajamasta autoa tai käyttämästä monimutkaisia, vaarallisia koneita. Wellbutrin 150mg voi heikentää alkoholinsietokykyä.
Samanaikaiset lääkkeet
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen, jos he käyttävät tai suunnittelevat ottavansa mitä tahansa resepti- tai käsikauppalääkkeitä, koska Wellbutrin 150mg ja muut lääkkeet voivat vaikuttaa toistensa aineenvaihduntaan.
Raskaus
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen, jos he tulevat raskaaksi tai aikovat tulla raskaaksi Wellbutrin-hoidon aikana. Kerro potilaille, että on olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet WELLBUTRIN 150 mg:lle raskauden aikana [ks. Käyttö tietyissä populaatioissa ].
Varastointitiedot
Neuvo potilaita säilyttämään WELLBUTRIN huoneenlämmössä, välillä 68 ° F - 77 ° F (20 ° C - 25 ° C) ja pitämään tabletit kuivina ja poissa valolta.
Hallintotiedot
Neuvo potilaita ottamaan Wellbutrinia tasan jaettuina annoksina 3 tai 4 kertaa päivässä siten, että annosten välillä on vähintään 6 tuntia kouristuskohtausten riskin minimoimiseksi. Neuvo potilaita, jos he unohtavat ottaa annoksen, olemaan ottamatta ylimääräistä tablettia korvatakseen unohtuneen annoksen ja ottamaan seuraavan tabletin tavanomaiseen aikaan annoksesta riippuvan kohtausriskin vuoksi. Kerro potilaille, että Wellbutrin-tabletit tulee niellä kokonaisina, eikä niitä saa murskata, jakaa tai pureskella. WELLBUTRIN voidaan ottaa ruoan kanssa tai ilman.
WELLBUTRIN, WELLBUTRIN SR, WELLBUTRIN 150mg XL ja ZYBAN ovat GSK-yritysryhmän omistamia tai sille lisensoituja tavaramerkkejä. Muut luetellut tuotemerkit ovat omistajiensa omistamia tai niille lisensoituja tavaramerkkejä, eivätkä ne ole GSK-yritysryhmän omistuksessa tai niille lisensoituja. Näiden merkkien valmistajat eivät ole sidoksissa GSK-yritysryhmään tai sen tuotteisiin eivätkä tue sitä.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Elinikäisiä karsinogeenisuustutkimuksia suoritettiin rotilla ja hiirillä bupropioniannoksilla 300 ja 150 mg/kg/vrk. Nämä annokset ovat vastaavasti noin 6 ja 2 kertaa MRHD:tä mitattuna mg/m2. Rottatutkimuksessa maksan nodulaaristen proliferatiivisten leesioiden määrä lisääntyi annoksilla 100–300 mg/kg/vrk (noin 2–6 kertaa MRHD mg/m2:n perusteella); pienempiä annoksia ei testattu. Kysymys siitä, voivatko tällaiset vauriot olla maksakasvainten esiasteita, on tällä hetkellä ratkaisematta. Samanlaisia maksavaurioita ei havaittu hiiritutkimuksessa, eikä maksan ja muiden elinten pahanlaatuisten kasvainten lisääntymistä havaittu kummassakaan tutkimuksessa.
Bupropioni tuotti positiivisen vasteen (2–3-kertainen kontrollimutaationopeus) kahdessa viidestä kannasta Amesin bakteerien mutageenisuuskokeessa. Bupropioni lisäsi kromosomipoikkeavuuksia yhdessä kolmesta rotan luuytimen sytogeneettisestä in vivo -tutkimuksesta.
Uros- ja naarasrotilla ei ollut vaikutuksia uros- ja naaraspuolisten hedelmällisyyteen, kun rotille annettiin suun kautta bupropionia 300 mg/kg/vrk (noin 6 kertaa MRHD mg/m2:n perusteella laskettuna) naaraille ennen parittelua ja joko 13. tiineyspäivän ajan. tai laktaation aikana ja uroksilla 60 päivän ajan ennen parittelua ja sen aikana. Kuitenkin annokset 200 mg/kg/vrk (noin 4 kertaa MRHD mg/m2:n perusteella) tai suuremmat aiheuttivat ohimenevää ataksiaa tai käyttäytymismuutoksia aikuisilla naarasrotilla. Ei myöskään ollut haitallisia vaikutuksia uros- tai naarasjälkeläisten hedelmällisyyteen, lisääntymiseen tai kasvuun ja kehitykseen.
Käyttö tietyissä populaatioissa
Raskaus
Raskausaltistusrekisteri
On olemassa riippumaton raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet masennuslääkkeille raskauden aikana. Terveydenhuollon tarjoajia kehotetaan rekisteröimään potilaita soittamalla National Pregnancy Registry for Antidepressants numeroon 1-844-4056185 tai käymällä verkossa osoitteessa https://womensmentalhealth.org/clinical-and-researchprograms/pregnancyregistry/antidepressants.
Riskien yhteenveto
Epidemiologisista tutkimuksista saadut tiedot raskaana olevista naisista, jotka ovat altistuneet bupropionille ensimmäisen raskauskolmanneksen aikana, eivät ole osoittaneet lisääntynyttä synnynnäisten epämuodostumien riskiä (ks. Data ). Hoitamattomaan masennukseen raskauden aikana liittyy riskejä äidille (ks Kliiniset näkökohdat ). Kun bupropionia annettiin tiineille rotille organogeneesin aikana, sikiön epämuodostumia ei havaittu annoksilla, jotka olivat enintään noin 10 kertaa ihmiselle suositeltuja enimmäisannoksia (MRHD) 450 mg/vrk. Kun sitä annettiin tiineille kaneille organogeneesin aikana, sikiön epämuodostumien ja luuston vaihteluiden esiintyvyyden lisääntymistä havaittiin annoksesta riippumattomilla annoksilla, jotka olivat suunnilleen yhtä suuria kuin MRHD tai suurempia. Sikiön painon laskua havaittiin annoksilla, jotka olivat kaksinkertaisia MRHD:tä ja suurempia (ks Eläinten tiedot ).
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ei ole tiedossa mainitulla väestöllä. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 % ja 15–20 %.
Kliiniset näkökohdat
Äidin ja/tai alkion/sikiön sairauteen liittyvä riski
Prospektiivisessa pitkittäistutkimuksessa seurattiin 201 raskaana olevaa naista, joilla oli aiemmin ollut vaikea masennus ja jotka olivat eutymia ja käyttivät masennuslääkkeitä raskauden aikana raskauden alussa. Naiset, jotka lopettivat masennuslääkkeiden käytön raskauden aikana, saivat todennäköisemmin vakavan masennuksen uusiutumisen kuin naiset, jotka jatkoivat masennuslääkkeiden käyttöä. Ota huomioon hoitamattoman masennuksen äidille aiheutuvat riskit ja mahdolliset vaikutukset sikiöön, kun masennuslääkehoito keskeytetään tai vaihdetaan raskauden ja synnytyksen jälkeen.
Data
Ihmistiedot
Kansainvälisen bupropioniraskausrekisterin tiedot (675 ensimmäisen raskauskolmanneksen altistumista) ja retrospektiivistä kohorttitutkimusta, jossa käytettiin United Healthcare -tietokantaa (1 213 ensimmäisen raskauskolmanneksen altistumista), eivät osoittaneet lisääntynyttä epämuodostumien riskiä. Rekisteriä ei suunniteltu tai käytetty arvioimaan tiettyjä vikoja, mutta se ehdotti sydämen epämuodostumien mahdollista lisääntymistä.
Kokonaisuudessaan kardiovaskulaaristen epämuodostumien riskiä ei ole havaittu bupropionialtistuksen jälkeen ensimmäisen raskauskolmanneksen aikana. Kansainvälisen raskausrekisterin mukaan prospektiivisesti havaittu kardiovaskulaaristen epämuodostumien määrä raskauksissa, jotka olivat altistuneet bupropionille ensimmäisen raskauskolmanneksen aikana, oli 1,3 % (9 kardiovaskulaarista epämuodostumaa/675 äidin ensimmäisen raskauskolmanneksen bupropionialtistusta), mikä on samanlainen kuin sydän- ja verisuonitautien taustalla esiintyvien epämuodostumien määrä (noin 1 %). Tiedot United Healthcare -tietokannasta, jossa oli rajoitettu määrä altistuneita sydän- ja verisuonitautien epämuodostumia, sekä tapauskontrollitutkimus (6 853 vauvaa, joilla oli sydän- ja verisuonitautien epämuodostumia ja 5 763 vauvaa, joilla ei ole kardiovaskulaarisia epämuodostumia) itse ilmoittamasta bupropionin käytöstä National Birth Defects -järjestöstä. Ennaltaehkäisytutkimus (NBDPS) ei osoittanut suurentunutta kardiovaskulaaristen epämuodostumien riskiä bupropionialtistuksen jälkeen ensimmäisen raskauskolmanneksen aikana.
Tutkimustulokset bupropionialtistumisesta ensimmäisen raskauskolmanneksen aikana ja vasemman kammion ulosvirtaustukoksen (LVOTO) riskistä ovat epäjohdonmukaisia eivätkä mahdollista johtopäätösten tekemistä mahdollisesta yhteydestä. United Healthcare -tietokanta ei riittänyt arvioimaan tätä yhteyttä; NBDPS havaitsi lisääntyneen LVOTO-riskin (n = 10; korjattu OR = 2,6; 95 % CI: 1,2, 5,7), ja Slone Epidemiology -tapauskontrollitutkimus ei löytänyt lisääntynyttä LVOTO-riskiä.
Tutkimustulokset bupropionialtistumisesta ensimmäisen raskauskolmanneksen aikana ja kammion väliseinävaurion (VSD) riskistä ovat epäjohdonmukaisia, eivätkä ne mahdollista johtopäätösten tekemistä mahdollisesta yhteydestä. Slone Epidemiology Study -tutkimuksessa havaittiin lisääntynyt VSD-riski äidin ensimmäisen raskauskolmanneksen bupropionialtistuksen jälkeen (n = 17; mukautettu OR = 2,5; 95 % CI: 1,3, 5,0), mutta ei havaittu lisääntynyttä riskiä muille tutkituille kardiovaskulaarisille epämuodostumille (mukaan lukien LVOTO edellä). NBDPS:n ja United Healthcaren tietokantatutkimuksessa ei löytynyt yhteyttä äidin ensimmäisen raskauskolmanneksen bupropionialtistuksen ja VSD:n välillä.
LVOTOn ja VSD:n havaintojen osalta tutkimuksia rajoitti altistuneiden tapausten pieni määrä, epäjohdonmukaiset löydökset tutkimusten välillä ja mahdollisuus saada sattumanvaraisia löydöksiä useista vertailuista tapauskontrollitutkimuksissa.
Eläinten tiedot
Tiineillä rotilla ja kaniineilla tehdyissä tutkimuksissa bupropionia annettiin suun kautta organogeneesin aikana annoksina 450 mg/kg/vrk ja 150 mg/kg/vrk (noin 10 ja 6 kertaa MRHD, mg/m2 perusteella laskettuna). ). Rotilla ei ollut näyttöä sikiön epämuodostumista. Kun sitä annettiin tiineille kaniineille organogeneesin aikana, sikiön epämuodostumien ja luuston vaihteluiden esiintyvyyden lisääntyminen annoksesta riippumattomalla tavalla havaittiin pienimmällä testatulla annoksella (25 mg/kg/vrk, suunnilleen sama kuin MRHD mg/m2 perusteella). ja suurempi. Sikiön painon laskua havaittiin annoksilla 50 mg/kg/vrk (noin 2 kertaa MRHD mg/m2:n perusteella) ja suuremmilla annoksilla. Emotoksisuutta ei havaittu annoksilla 50 mg/kg/vrk tai vähemmän.
Pre- ja postnataalisessa kehitystutkimuksessa bupropionilla, joka annettiin suun kautta tiineille rotille annoksina 150 mg/kg/vrk (noin 3 kertaa MRHD mg/m2:n perusteella) alkion implantaatiosta imetykseen, ei ollut vaikutusta pentujen kasvuun. tai kehitystä.
Imetys
Riskien yhteenveto
Julkaistun kirjallisuuden tiedot kertovat bupropionin ja sen metaboliittien esiintymisestä äidinmaidossa (ks Data ). Bupropionin tai sen metaboliittien vaikutuksista maidontuotantoon ei ole tietoa. Markkinoille tulon jälkeisistä raporteista saadut rajalliset tiedot eivät ole osoittaneet selvää yhteyttä haittavaikutuksiin imetetyllä lapsella. Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon äidin kliinisen WELLBUTRIN-tarpeen ja WELLBUTRINin mahdollisten haitallisten vaikutusten kanssa imetettävään lapseen tai äidin taustalla olevaan sairauteen.
Data
Imetystutkimuksessa, johon osallistui 10 naista, suun kautta annostellun bupropionin ja sen aktiivisten metaboliittien pitoisuudet mitattiin lypsetystä maidosta. Vauvan keskimääräinen päivittäinen altistus (olettaen 150 ml/kg päivittäinen kulutus) bupropionille ja sen aktiivisille metaboliiteille oli 2 % äidin painoon mukautetusta annoksesta. Markkinoille tulon jälkeisissä raporteissa on kuvattu rintaruokittujen imeväisten kohtauksia. Bupropionialtistuksen ja näiden kohtausten suhde on epäselvä.
Käyttö lapsille
Turvallisuutta ja tehokkuutta lapsiväestössä ei ole osoitettu [katso LAATIKKO VAROITUS , VAROITUKSET JA VAROTOIMET ].
Geriatrinen käyttö
Noin 6 000 koehenkilöstä, jotka osallistuivat kliinisiin tutkimuksiin bupropionia depottableteilla (masennus- ja tupakoinnin lopettamistutkimukset), 275 oli 65-vuotiaita ja 47 75-vuotiaita. Lisäksi useita satoja ≥ 65-vuotiaita koehenkilöitä osallistui kliinisiin tutkimuksiin, joissa käytettiin välittömästi vapautuvaa bupropioniformulaatiota (masennustutkimukset). Näiden ja nuorempien koehenkilöiden välillä ei havaittu yleisiä eroja turvallisuudessa tai tehokkuudessa. Raportoitu kliininen kokemus ei ole osoittanut eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin iäkkäiden henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
Bupropioni metaboloituu laajalti maksassa aktiivisiksi metaboliiteiksi, jotka metaboloituvat edelleen ja erittyvät munuaisten kautta. Haittavaikutusten riski voi olla suurempi potilailla, joilla on munuaisten vajaatoiminta. Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, tämä tekijä saattaa olla tarpeen ottaa huomioon annosvalinnassa. voi olla hyödyllistä seurata munuaisten toimintaa [ks ANNOSTELU JA HALLINNOINTI , Käyttö tietyissä populaatioissa , KLIININEN FARMAKOLOGIA ].
Munuaisten vajaatoiminta
Harkitse WELLBUTRIN-annoksen ja/tai annostelutiheyden pienentämistä potilailla, joilla on munuaisten vajaatoiminta (glomerulaarinen suodatusnopeus: alle 90 ml/min). Bupropioni ja sen metaboliitit poistuvat munuaisten kautta ja voivat kertyä tällaisiin potilaisiin tavallista enemmän. Seuraa tarkasti haittavaikutuksia, jotka voivat viitata korkeaan bupropioni- tai metaboliittialtistumiseen [katso ANNOSTELU JA HALLINNOINTI , KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
Keskivaikeasta tai vaikeasta maksan vajaatoiminnasta kärsivillä potilailla (Child-Pugh-pistemäärä: 7–15) WELLBUTRIN 150 mg:n enimmäisannos on 75 mg vuorokaudessa. Potilailla, joilla on lievä maksan vajaatoiminta (Child-Pugh-pistemäärä: 5–6), harkitse annoksen ja/tai annostelutiheyden pienentämistä [ks. ANNOSTELU JA HALLINNOINTI , KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Kokemus ihmisten yliannostuksesta
Enintään 30 grammaa tai enemmän bupropionia on raportoitu. Kohtauksia raportoitiin noin kolmanneksessa kaikista tapauksista. Muita vakavia reaktioita, joita on raportoitu pelkän bupropionin yliannostuksen yhteydessä, olivat hallusinaatiot, tajunnan menetys, sinustakykardia ja EKG-muutokset, kuten johtumishäiriöt (mukaan lukien QRS-ajan piteneminen) tai rytmihäiriöt. Kuumetta, lihasjäykkyyttä, rabdomyolyysiä, hypotensiota, stuporia, koomaa ja hengitysvaikeutta on raportoitu pääasiassa, kun bupropioni oli osa useiden lääkkeiden yliannostuksia.
Vaikka useimmat potilaat toipuivat ilman jälkiseurauksia, pelkän bupropionin yliannostuksiin liittyviä kuolemantapauksia on raportoitu potilailla, jotka nielivät suuria annoksia lääkettä. Näillä potilailla raportoitiin useita hallitsemattomia kohtauksia, bradykardiaa, sydämen vajaatoimintaa ja sydämenpysähdystä ennen kuolemaa.
Yliannostuksen hallinta
Ota yhteyttä sertifioituun myrkytystietokeskukseen saadaksesi ajantasaisia ohjeita ja neuvoja. Sertifioitujen myrkytystietokeskusten puhelinnumerot on lueteltu Physician's Desk Reference (PDR) -luettelossa. Soita numeroon 1-800-222-1222 tai käy osoitteessa www.poison.org.
Bupropionille ei ole tunnettuja vastalääkkeitä. Yliannostustapauksessa on annettava tukihoitoa, mukaan lukien tarkka lääkärin valvonta ja seuranta. Harkitse useiden lääkkeiden yliannostuksen mahdollisuutta. Varmista riittävät hengitystiet, hapetus ja ilmanvaihto. Tarkkaile sydämen rytmiä ja elintoimintoja. Oksentamisen aiheuttamista ei suositella.
VASTA-AIHEET
- Wellbutrin 150 mg on vasta-aiheinen potilaille, joilla on kohtaushäiriö.
- WELLBUTRIN on vasta-aiheinen potilailla, joilla on bulimia tai anoreksia nervosa, koska kouristuskohtausten esiintyvyys oli suurempi sellaisilla potilailla, joita hoidettiin Wellbutrinilla [ks. VAROITUKSET JA VAROTOIMET ].
- WELLBUTRIN 300mg on vasta-aiheinen potilaille, joille alkoholin, bentsodiatsepiinien, barbituraattien ja epilepsialääkkeiden käyttö lopetetaan äkillisesti [ks. VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ].
- MAO-estäjien (psykiatristen häiriöiden hoitoon tarkoitettujen) käyttö samanaikaisesti Wellbutrin 300 mg:n kanssa tai 14 päivän sisällä Wellbutrin 150 mg -hoidon lopettamisesta on vasta-aiheista. Hypertensiivisten reaktioiden riski kasvaa, kun Wellbutrinia käytetään samanaikaisesti MAO-estäjien kanssa. Wellbutrinin käyttö 14 päivän sisällä MAO-estäjän hoidon lopettamisesta on myös vasta-aiheista. Wellbutrin 150 mg:n aloittaminen potilaalla, jota hoidetaan palautuvilla MAO-estäjillä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä, on vasta-aiheista [ks. ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ].
- WELLBUTRIN on vasta-aiheinen potilaille, joiden tiedetään olevan yliherkkiä bupropionille tai muille Wellbutrinin aineosille. Anafylaktisia / anafylaktisia reaktioita ja Stevens-Johnsonin oireyhtymää on raportoitu [katso VAROITUKSET JA VAROTOIMET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Bupropionin masennuslääkkeen tarkkaa mekanismia ei tunneta, mutta sen oletetaan liittyvän noradrenergisiin ja/tai dopaminergisiin mekanismeihin. Bupropioni on suhteellisen heikko noradrenaliinin ja dopamiinin neuronaalisen takaisinoton estäjä, eikä se estä serotoniinin takaisinottoa. Bupropioni ei estä monoamiinioksidaasia.
Farmakokinetiikka
Bupropioni on raseeminen seos. Yksittäisten enantiomeerien farmakologista aktiivisuutta ja farmakokinetiikkaa ei ole tutkittu. Bupropionin keskimääräinen eliminaation puoliintumisaika (±SD) pitkäaikaisen annostelun jälkeen on 21 (±9) tuntia, ja vakaan tilan plasmapitoisuudet saavutetaan 8 päivässä.
Imeytyminen
Wellbutrinin absoluuttista biologista hyötyosuutta ihmisillä ei ole määritetty, koska ihmisille tarkoitettua suonensisäistä formulaatiota ei ole saatavilla. Näyttää kuitenkin todennäköiseltä, että vain pieni osa suun kautta annetusta annoksesta pääsee systeemiseen verenkiertoon ehjänä. Rotilla ja koirilla tehdyissä tutkimuksissa bupropionin biologinen hyötyosuus vaihteli 5–20 %:n välillä.
Ihmisillä WELLBUTRIN 300 mg:n oraalisen annon jälkeen plasman bupropionin huippupitoisuudet saavutetaan yleensä 2 tunnin kuluessa. Plasman bupropionipitoisuudet ovat suhteessa annokseen 100–250 mg:n kerta-annosten jälkeen; ei kuitenkaan tiedetä, säilyykö annoksen ja plasman tason välinen suhde pitkäaikaisessa käytössä.
Jakelu
In vitro -testit osoittavat, että bupropioni sitoutuu 84 %:sti ihmisen plasman proteiineihin pitoisuuksilla 200 mikrog/ml asti. Hydroksibupropionimetaboliitin proteiineihin sitoutumisen aste on samanlainen kuin bupropionin, kun taas treohydrobupropionimetaboliitin sitoutuminen proteiineihin on noin puolet bupropionilla havaitusta sitoutumisesta.
Aineenvaihdunta
Bupropioni metaboloituu laajalti ihmisissä. Kolme metaboliittia ovat aktiivisia: hydroksibupropioni, joka muodostuu bupropionin tert-butyyliryhmän hydroksylaatiolla, ja aminoalkoholi-isomeerit treohydrobupropioni ja erytrohydrobupropioni, jotka muodostuvat karbonyyliryhmän pelkistymisen kautta. In vitro -löydökset viittaavat siihen, että CYP2B6 on pääasiallinen isoentsyymi, joka osallistuu hydroksibupropionin muodostukseen, kun taas sytokromi P450 -entsyymit eivät osallistu treohydrobupropionin muodostukseen. Bupropionin sivuketjun hapettuminen johtaa metaklooribentsoehapon glysiinikonjugaatin muodostumiseen, joka sitten erittyy pääasiallisena virtsametaboliitina. Metaboliittien tehoa ja toksisuutta bupropioniin verrattuna ei ole täysin karakterisoitu. Hiirillä tehdyssä masennuslääkeseulontatestissä on kuitenkin osoitettu, että hydroksibupropioni on puolet tehokkaampi kuin bupropioni, kun taas treohydrobupropioni ja erytrohydrobupropioni ovat 5 kertaa vähemmän tehokkaita kuin bupropioni. Tällä voi olla kliinistä merkitystä, koska metaboliittien plasmapitoisuudet ovat yhtä korkeat tai korkeammat kuin bupropionin pitoisuudet.
Ihmisellä kerta-annoksen jälkeen hydroksibupropionin huippupitoisuudet plasmassa saavutetaan noin 3 tunnin kuluttua Wellbutrinin annon jälkeen ja ovat noin 10 kertaa suuremmat kuin vakaan tilan emolääkkeen huippupitoisuudet. Hydroksibupropionin eliminaation puoliintumisaika on noin 20 (±5) tuntia, ja sen AUC vakaassa tilassa on noin 17 kertaa bupropionin puoliintumisaika. Erytrohydrobupropionin ja treohydrobupropionin metaboliittien huippupitoisuuksien saavuttamisajat ovat samanlaiset kuin hydroksibupropionimetaboliitin. Niiden eliminaation puoliintumisajat ovat kuitenkin pidemmät, 33 (±10) ja 37 (±13) tuntia, vastaavasti, ja vakaan tilan AUC-arvot ovat 1,5 ja 7 kertaa bupropionin vastaavat.
Bupropionilla ja sen metaboliiteilla on lineaarinen kinetiikka pitkäaikaisen 300-450 mg/vrk antamisen jälkeen.
Eliminointi
Kun ihmisille annettiin 200 mg 14C-bupropionia suun kautta, 87 % radioaktiivisesta annoksesta erittyi virtsaan ja 10 % ulosteeseen. Vain 0,5 % suun kautta otetusta annoksesta erittyi muuttumattomana bupropionina.
Tietyt populaatiot
Aineenvaihduntakapasiteettia muuttavien tekijöiden tai tilojen (esim. maksasairaus, sydämen vajaatoiminta [CHF], ikä, samanaikainen lääkitys jne.) tai eliminaatioon voidaan odottaa vaikuttavan bupropionin aktiivisten metaboliittien kertymisen asteeseen ja laajuuteen. Bupropionin tärkeimpien metaboliittien eliminaatioon voi vaikuttaa heikentynyt munuaisten tai maksan toiminta, koska ne ovat kohtalaisen polaarisia yhdisteitä ja todennäköisesti metaboloituvat edelleen tai konjugoituvat maksassa ennen virtsaan erittymistä.
Potilaat, joilla on munuaisten vajaatoiminta
Bupropionin farmakokinetiikasta munuaisten vajaatoimintaa sairastavilla potilailla on vain vähän tietoa. Tutkimusten välinen vertailu normaalien koehenkilöiden ja loppuvaiheen munuaisten vajaatoimintaa sairastavien potilaiden välillä osoitti, että lähtölääkkeen Cmax- ja AUC-arvot olivat vertailukelpoisia kahdessa ryhmässä, kun taas hydroksibupropionin ja treohydrobupropionin metaboliiteilla oli vastaavasti 2,3- ja 2,8-kertainen nousu. AUC:ssa potilailla, joilla on loppuvaiheen munuaisten vajaatoiminta. Toinen tutkimus, jossa verrattiin normaaleja koehenkilöitä ja potilaita, joilla oli keskivaikea tai vaikea munuaisten vajaatoiminta (GFR 30,9 ± 10,8 ml/min), osoitti, että kerta-annoksen 150 mg:n hitaasti vapautuvaa bupropionia jälkeen altistuminen bupropionille oli noin 2 kertaa suurempi. munuaisten vajaatoimintaa sairastavilla potilailla, kun taas hydroksibupropionin ja treo/erytrohydrobupropionin (yhdistettyjen) metaboliittien tasot olivat samanlaiset kahdessa ryhmässä. Bupropioni metaboloituu laajalti maksassa aktiivisiksi metaboliiteiksi, jotka metaboloituvat edelleen ja erittyvät myöhemmin munuaisten kautta. Munuaisten vajaatoiminta voi vähentää bupropionin tärkeimpien metaboliittien eliminaatiota. Wellbutrinia tulee käyttää varoen potilailla, joilla on munuaisten vajaatoiminta, ja harventaa ja/tai annosta tulee harkita [ks. Käyttö tietyissä populaatioissa ].
Potilaat, joilla on maksan vajaatoiminta
Maksan vajaatoiminnan vaikutus bupropionin farmakokinetiikkaan karakterisoitiin kahdessa kerta-annostutkimuksessa, joista yksi koehenkilöillä, joilla oli alkoholiperäinen maksasairaus, ja toinen potilailla, joilla oli lievä tai vaikea kirroosi. Ensimmäinen tutkimus osoitti, että hydroksibupropionin puoliintumisaika oli merkittävästi pidempi kahdeksalla koehenkilöllä, joilla oli alkoholiperäinen maksasairaus, kuin 8 terveellä vapaaehtoisella (32 ± 14 tuntia vs. 21 ± 5 tuntia, vastaavasti). Vaikka bupropionin ja hydroksibupropionin AUC-arvot eivät olleet tilastollisesti merkitseviä, ne vaihtelivat enemmän ja olivat yleensä suurempia (53–57 %) vapaaehtoisilla, joilla oli alkoholiperäinen maksasairaus. Erot bupropionin ja muiden metaboliittien puoliintumisajassa näissä kahdessa ryhmässä olivat minimaaliset.
Toisessa tutkimuksessa ei havaittu tilastollisesti merkitseviä eroja bupropionin ja sen aktiivisten metaboliittien farmakokinetiikassa 9 potilaalla, joilla oli lievä tai keskivaikea maksakirroosi, verrattuna 8 terveeseen vapaaehtoiseen. Kuitenkin joissakin bupropionin (AUC, Cmax ja Tmax) ja sen aktiivisten metaboliittien (t½) farmakokineettisissä parametreissa havaittiin enemmän vaihtelua potilailla, joilla oli lievä tai keskivaikea maksakirroosi. Koehenkilöillä, joilla oli vaikea maksakirroosi, havaittiin merkittäviä muutoksia bupropionin ja sen metaboliittien farmakokinetiikassa (taulukko 3).
Potilaat, joilla on vasemman kammion toimintahäiriö
Kroonisessa bupropionin annostelututkimuksessa 14 masentuneella potilaalla, joilla oli vasemman kammion toimintahäiriö (historian CHF tai suurentunut sydän röntgenkuvassa), bupropionin tai sen metaboliittien farmakokinetiikkaan ei ollut selvää vaikutusta terveisiin vapaaehtoisiin verrattuna.
Ikä
Iän vaikutuksia bupropionin ja sen metaboliittien farmakokinetiikkaan ei ole täysin karakterisoitu, mutta vakaan tilan bupropionipitoisuuksia on tutkittu useista masennuksen tehokkuutta koskevista tutkimuksista, joihin osallistui koehenkilöitä, joille annettiin 300-750 mg/vrk, 3-vuotiaana. vuorokaudessa, ei osoittanut yhteyttä iän (18-83 vuotta) ja plasman bupropionipitoisuuden välillä. Kerta-annoksella tehty farmakokineettinen tutkimus osoitti, että bupropionin ja sen metaboliittien jakautuminen iäkkäillä koehenkilöillä oli samanlainen kuin nuoremmilla koehenkilöillä. Nämä tiedot viittaavat siihen, että iällä ei ole merkittävää vaikutusta bupropionipitoisuuteen; kuitenkin toinen kerta- ja usean annoksen farmakokineettinen tutkimus viittaa siihen, että vanhuksilla on lisääntynyt riski bupropionin ja sen metaboliittien kertymisestä [ks. Käyttö tietyissä populaatioissa ].
Mies- ja naispotilaat
90 terveen miehen ja 90 terveen naispuolisen vapaaehtoisen bupropionin farmakokineettisten tietojen yhdistetty analyysi ei paljastanut sukupuoleen liittyviä eroja plasman bupropionin huippupitoisuuksissa. Keskimääräinen systeeminen altistus (AUC) oli noin 13 % suurempi miehillä vapaaehtoisilla kuin naispuolisilla vapaaehtoisilla. Tämän löydön kliinistä merkitystä ei tunneta.
Tupakoitsijat
Tupakoinnin vaikutuksia bupropionin farmakokinetiikkaan tutkittiin 34 terveellä vapaaehtoisella mies- ja naispuolisella henkilöllä; Kroonisesti tupakoivia oli 17 ja tupakoimattomia 17. Bupropionin tai sen aktiivisten metaboliittien Cmax:ssa, puoliintumisajassa, Tmax:ssa, AUC:ssa tai puhdistumassa ei havaittu tilastollisesti merkitseviä eroja kerta-annoksen 150 mg bupropionia jälkeen tupakoitsijoiden ja tupakoimattomien välillä.
Huumeiden vuorovaikutustutkimukset
Muiden lääkkeiden mahdollisuus vaikuttaa Wellbutriniin
In vitro -tutkimukset osoittavat, että bupropioni metaboloituu ensisijaisesti hydroksibupropioniksi CYP2B6:n vaikutuksesta. Siksi WELLBUTRINin ja lääkkeiden välillä, jotka ovat CYP2B6:n estäjiä tai indusoijia, on olemassa mahdollisuus yhteisvaikutuksiin. Lisäksi in vitro -tutkimukset viittaavat siihen, että paroksetiini, sertraliini, norfluoksetiini, fluvoksamiini ja nelfinaviiri estävät bupropionin hydroksylaatiota.
CYP2B6:n estäjät
Tiklopidiini, klopidogreeli: Terveillä miehillä tehdyssä tutkimuksessa klopidogreeli 75 mg kerran vuorokaudessa tai tiklopidiini 250 mg kahdesti vuorokaudessa lisäsi bupropionin altistuksia (Cmax ja AUC) 40 % ja 60 % klopidogreelilla ja 38 % ja 85 % tiklopidiinilla. , vastaavasti. Klopidogreeli pienensi hydroksibupropionin altistuksia (Cmax ja AUC) 50 % ja tiklopidiini 78 % ja 84 %. Tämän vaikutuksen uskotaan johtuvan CYP2B6:n katalysoiman bupropionin hydroksylaation estämisestä.
Prasugreeli: Prasugreeli on heikko CYP2B6:n estäjä. Terveillä koehenkilöillä prasugreeli nosti bupropionin Cmax- ja AUC-arvoja 14 % ja AUC 18 % ja pienensi bupropionin aktiivisen metaboliitin hydroksibupropionin Cmax- ja AUC-arvoja 32 % ja AUC-arvoja 24 %.
Simetidiini: Sytokromi P450 -entsyymit eivät näytä tuottavan bupropionin treohydrobupropioni-metaboliitia. Simetidiinin samanaikaisen annon vaikutuksia bupropionin ja sen aktiivisten metaboliittien farmakokinetiikkaan tutkittiin 24 terveellä nuorella vapaaehtoisella miehellä. Bupropionin ja hydroksibupropionin farmakokinetiikka ei muuttunut 300 mg:n bupropionin suun kautta 800 mg:n simetidiinin kanssa tai ilman sitä. Treohydrobupropionin ja erytrohydrobupropionin yhdistettyjen osien AUC- ja Cmax-arvot kasvoivat kuitenkin 16 % ja Cmax 32 %.
Sitalopraami: Sitalopraami ei vaikuttanut bupropionin ja sen kolmen metaboliitin farmakokinetiikkaan.
CYP2B6:n indusoijat
Ritonaviiri ja lopinaviiri: Terveillä vapaaehtoisilla tehdyssä tutkimuksessa ritonaviiri 100 mg kahdesti vuorokaudessa pienensi bupropionin AUC-arvoa 22 % ja Cmax-arvoa 21 %. Hydroksibupropionin metaboliitin altistuminen pieneni 23 %, treohydrobupropioni 38 % ja erytrohydrobupropioni 48 %.
Toisessa terveillä vapaaehtoisilla tehdyssä tutkimuksessa ritonaviiri annoksella 600 mg kahdesti vuorokaudessa pienensi bupropionin AUC-arvoa 66 % ja Cmax-arvoa 62 %. Hydroksibupropionin metaboliitin altistuminen väheni 78 %, treohydrobupropionin 50 % ja erytrohydrobupropionin 68 %.
Toisessa terveillä vapaaehtoisilla tehdyssä tutkimuksessa lopinaviiri 400 mg/ritonaviiri 100 mg kahdesti vuorokaudessa pienensi bupropionin AUC- ja Cmax-arvoja 57 %. Hydroksibupropionin AUC-arvo pieneni 50 % ja Cmax 31 %.
Efavirentsi: Terveillä vapaaehtoisilla tehdyssä tutkimuksessa efavirentsi 600 mg kerran vuorokaudessa 2 viikon ajan pienensi bupropionin AUC-arvoa noin 55 % ja Cmax-arvoa 34 %. Hydroksibupropionin AUC pysyi muuttumattomana, kun taas hydroksibupropionin Cmax nousi 50 %.
Karbamatsepiini, fenobarbitaali, fenytoiini: Vaikka näitä lääkkeitä ei ole tutkittu systemaattisesti, ne voivat indusoida bupropionin metaboliaa.
WELLBUTRINilla on mahdollisuus vaikuttaa muihin lääkkeisiin
Eläintutkimukset osoittavat, että bupropioni saattaa indusoida lääkkeitä metaboloivia entsyymejä ihmisillä. Yhdessä tutkimuksessa, kun bupropionia annettiin 100 mg kolmesti vuorokaudessa 8 terveelle miespuoliselle vapaaehtoiselle 14 päivän ajan, sen oman aineenvaihdunnan induktiosta ei havaittu näyttöä. Siitä huolimatta, että samanaikaisesti annettavien lääkkeiden veren tasoissa voi olla kliinisesti merkittäviä muutoksia.
CYP2D6:n kautta metaboloituvat lääkkeet
In vitro bupropioni ja sen metaboliitit (erytrohydrobupropioni, treohydrobupropioni, hydroksibupropioni) ovat CYP2D6:n estäjiä. Kliinisessä tutkimuksessa, johon osallistui 15 miespuolista koehenkilöä (ikä 19–35 vuotta), jotka metaboloivat voimakkaasti CYP2D6:ta, bupropioni 300 mg/vrk, jota seurasi kerta-annos 50 mg desipramiinia suurensi desipramiinin Cmax-, AUC- ja t½-arvoja keskimäärin noin 2-, 5- ja 2-kertainen, vastaavasti. Vaikutus oli voimassa vähintään 7 päivää viimeisen bupropioniannoksen jälkeen. Bupropionin samanaikaista käyttöä muiden CYP2D6:n kautta metaboloituvien lääkkeiden kanssa ei ole virallisesti tutkittu.
Sitalopraami: Vaikka sitalopraami ei ensisijaisesti metaboloidu CYP2D6:n vaikutuksesta, yhdessä tutkimuksessa bupropioni suurensi sitalopraamin Cmax-arvoa 30 % ja AUC-arvoa 40 %.
Lamotrigiini: Bupropionin useilla suun kautta otetuilla annoksilla ei ollut tilastollisesti merkitsevää vaikutusta lamotrigiinin kerta-annoksen farmakokinetiikkaan 12 terveellä vapaaehtoisella.
Digoksiini: Kirjallisuustiedot osoittivat, että digoksiinialtistus pieneni, kun kerta-annos 0,5 mg digoksiinia annettiin suun kautta 24 tuntia kerta-annoksen jälkeen kerta-annoksena pitkävaikutteista 150 mg:n bupropionia terveille vapaaehtoisille.
Kliiniset tutkimukset
WELLBUTRIN 150 mg:n teho masennuksen hoidossa vahvistettiin kahdessa 4 viikon lumekontrolloidussa tutkimuksessa aikuisilla MDD-potilailla (tutkimukset 1 ja 2 taulukossa 4) ja yhdessä 6 viikon lumekontrolloidussa tutkimuksessa aikuisilla MDD-potilailla (koe 3 taulukossa 4). Ensimmäisessä tutkimuksessa WELLBUTRIN 300 mg:n annosalue oli 300–600 mg/vrk jaettuna 3 annokseen; 78 % potilaista hoidettiin annoksilla 300 mg - 450 mg/vrk. Koe osoitti WELLBUTRIN 300 mg:n tehokkuuden mitattuna Hamilton Depression Rating Scale (HDRS) -kokonaispisteillä, HDRS-masennetun mielialan pisteellä (kohde 1) ja Clinical Global Impressions -vakavuuspisteellä (CGI-S). Toinen tutkimus sisälsi 2 annosta WELLBUTRINia (300 ja 450 mg/vrk) ja lumelääkettä. Tämä tutkimus osoitti WELLBUTRIN 150 mg:n tehokkuuden vain 450 mg:n vuorokausiannoksella. Tehokkuustulokset olivat tilastollisesti merkitseviä HDRS-kokonaispisteiden ja CGI-S-pisteiden osalta, mutta eivät HDRS-kohdassa 1. Kolmannessa tutkimuksessa avopotilaita hoidettiin 300 mg:lla päivässä WELLBUTRINia. Tämä tutkimus osoitti WELLBUTRIN 150 mg:n tehon mitattuna HDRS-kokonaispisteillä, HDRS-kohdalla 1, Montgomery-Asbergin masennuksen luokitusasteella (MADRS), CGI-S-pisteillä ja CGI-Improvement Scale (CGI-I) -pisteillä. . WELLBUTRIN 300 mg:n tehokkuutta pitkäaikaisessa käytössä eli yli 6 viikon käytössä ei ole arvioitu systemaattisesti kontrolloiduissa tutkimuksissa.
POTILASTIEDOT
WELLBUTRIN (WELL byu-trin) (bupropionihydrokloridi) Tabletit
TÄRKEÄÄ: Muista lukea tämän lääkitysoppaan kolme osaa. Ensimmäinen osa käsittelee itsemurha-ajatusten ja -toimien riskiä masennuslääkkeiden yhteydessä; toisessa osassa käsitellään ajattelun ja käyttäytymisen muutosten riskiä, masennusta ja itsemurha-ajatuksia tai toimia tupakoinnin lopettamiseen käytettävien lääkkeiden kanssa; ja kolmannen osan otsikko on "Mitä muita tärkeitä tietoja minun pitäisi tietää Wellbutrin 150 mg:sta?"
Masennuslääkkeet, masennus ja muut vakavat mielisairaudet ja itsemurha-ajatukset tai -toimet
Tämä lääkitysoppaan osa käsittelee vain itsemurha-ajatusten ja masennuslääkkeiden käytön riskiä.
Mikä on tärkein tieto, joka minun pitäisi tietää masennuslääkkeistä, masennuksesta ja muista vakavista mielenterveyssairauksista sekä itsetuhoisista ajatuksista tai toimista?
1. Masennuslääkkeet voivat lisätä itsemurha-ajatusten tai -tekojen riskiä joillakin lapsilla, teini-ikäisillä tai nuorilla aikuisilla hoidon ensimmäisten kuukausien aikana.
2. Masennus tai muut vakavat mielen sairaudet ovat tärkeimmät syyt itsemurha-ajatuksiin ja -toimiin. Joillakin ihmisillä voi olla erityisen suuri riski saada itsetuhoisia ajatuksia tai toimia. Näitä ovat ihmiset, joilla on kaksisuuntainen mielialahäiriö (tai maanis-depressiivinen sairaus) tai itsetuhoisia ajatuksia tai tekoja.
3. Miten voin tarkkailla ja yrittää estää itsetuhoisia ajatuksia ja tekoja itsessäni tai perheenjäsenessäni?
- Kiinnitä huomiota kaikkiin muutoksiin, erityisesti äkillisiin muutoksiin mielialassa, käyttäytymisessä, ajatuksissa tai tunteissa. Tämä on erittäin tärkeää, kun masennuslääke aloitetaan tai annosta muutetaan.
- Soita välittömästi terveydenhuollon tarjoajallesi ilmoittaaksesi uusista tai äkillisistä mielialan, käyttäytymisen, ajatusten tai tunteiden muutoksista.
- Pidä kaikki seurantakäynnit terveydenhuollon tarjoajan kanssa aikataulun mukaisesti. Soita terveydenhuollon tarjoajalle käyntien välillä tarvittaessa, varsinkin jos olet huolissasi oireista.
Soita välittömästi terveydenhuollon tarjoajallesi, jos sinulla tai perheenjäsenelläsi on jokin seuraavista oireista, varsinkin jos ne ovat uusia, pahempia tai huolestuttavia:
- ajatuksia itsemurhasta tai kuolemasta
- yrittää itsemurhaa
- uusi tai pahempi masennus
- uusi tai pahempi ahdistus
- hyvin kiihtynyt tai levoton olo
- paniikkikohtaukset
- unihäiriöt (unettomuus)
- uusi tai pahempi ärtyneisyys
- käyttäytyy aggressiivisesti, on vihainen tai väkivaltainen
- vaarallisten impulssien vaikutuksesta
- äärimmäinen lisääntynyt aktiivisuus ja puhuminen (mania)
- muita epätavallisia muutoksia käyttäytymisessä tai mielialassa
Mitä muuta minun on tiedettävä masennuslääkkeistä?
- Älä koskaan lopeta masennuslääkettä keskustelematta ensin terveydenhuollon tarjoajan kanssa. Masennuslääkehoidon äkillinen lopettaminen voi aiheuttaa muita oireita.
- Masennuslääkkeet ovat lääkkeitä, joita käytetään masennuksen ja muiden sairauksien hoitoon. On tärkeää keskustella kaikista masennuksen hoidon riskeistä ja myös riskeistä, jos sitä ei hoideta. Potilaiden ja heidän perheidensä tai muiden hoitajien tulee keskustella terveydenhuollon tarjoajan kanssa kaikista hoitovaihtoehdoista, ei vain masennuslääkkeiden käytöstä.
- Masennuslääkkeillä on muita sivuvaikutuksia. Keskustele terveydenhuollon tarjoajan kanssa sinulle tai perheenjäsenellesi määrätyn lääkkeen sivuvaikutuksista.
- Masennuslääkkeet voivat olla vuorovaikutuksessa muiden lääkkeiden kanssa. Tiedä kaikki lääkkeet, joita sinä tai perheenjäsenesi käytät. Pidä luettelo kaikista lääkkeistä näyttääksesi terveydenhuollon tarjoajalle. Älä aloita uusia lääkkeitä keskustelematta ensin terveydenhuollon tarjoajalta.
Ei tiedetä, onko Wellbutrin turvallinen ja tehokas alle 18-vuotiaille lapsille.
Tupakoinnin lopettaminen, tupakoinnin lopettamiseen liittyvät lääkkeet, ajattelun ja käytöksen muutokset, masennus ja itsetuhoiset ajatukset tai teot
Tämä lääkitysoppaan osio käsittelee vain ajattelun ja käyttäytymisen muutosten riskiä, masennusta ja itsemurha-ajatuksia tai toimia tupakoinnin lopettamiseen käytettävien lääkkeiden kanssa. Vaikka WELLBUTRIN ei ole lääke tupakoinnin lopettamiseen, se sisältää samaa vaikuttavaa ainetta (bupropionihydrokloridia) kuin ZYBAN, jota käytetään auttamaan potilaita tupakoinnin lopettamisessa.
Keskustele terveydenhuollon tarjoajasi tai perheenjäsenesi terveydenhuollon tarjoajan kanssa seuraavista asioista:
- kaikki tupakoinnin lopettamiseen liittyvien lääkkeiden riskit ja edut.
- kaikki hoitovaihtoehdot tupakoinnin lopettamiseksi.
Kun yrität lopettaa tupakoinnin bupropionin kanssa tai ilman, sinulla voi olla oireita, jotka voivat johtua nikotiinin vieroituksesta, mukaan lukien:
- halu tupakoida
- turhautumista
- levottomuus
- masentunut
- suututtaa
- alentunut syke
- nukahtamisvaikeuksia
- ahdistuneena
- lisääntynyt ruokahalu
- ärtyneisyys
- keskittymisvaikeuksia
- painonnousu
Jotkut ihmiset ovat jopa kokeneet itsemurha-ajatuksia yrittäessään lopettaa tupakoinnin ilman lääkkeitä.
Joskus tupakoinnin lopettaminen voi johtaa jo olemassa olevien mielenterveysongelmien, kuten masennuksen, pahenemiseen.
Joillakin ihmisillä on ollut vakavia sivuvaikutuksia, kun he ovat käyttäneet bupropionia auttamaan heitä lopettamaan tupakoinnin, mukaan lukien: Uudet tai pahemmat mielenterveysongelmat, kuten muutokset käyttäytymisessä tai ajattelussa, aggressio, vihamielisyys, kiihtyneisyys, masennus tai itsetuhoiset ajatukset tai teot. Joillakin ihmisillä oli näitä oireita, kun he aloittivat bupropionin käytön, ja toisille ne kehittyivät useiden viikkojen hoidon jälkeen tai bupropionin lopettamisen jälkeen. Näitä oireita esiintyi useammin ihmisillä, joilla oli ollut mielenterveysongelmia ennen bupropionin ottamista, kuin ihmisillä, joilla ei ollut mielenterveysongelmia.
Lopeta Wellbutrinin käyttö ja soita heti terveydenhuollon tarjoajallesi, jos sinä, perheesi tai hoitaja huomaat jonkin näistä oireista. Työskentele terveydenhuollon tarjoajan kanssa päättääksesi, pitäisikö sinun jatkaa Wellbutrinin käyttöä. Monilla ihmisillä nämä oireet hävisivät Wellbutrin 300 mg:n lopettamisen jälkeen, mutta joillakin ihmisillä oireet jatkuivat Wellbutrinin lopettamisen jälkeen. On tärkeää, että seuraat terveydenhuollon tarjoajasi, kunnes oireesi häviävät. Ennen kuin otat Wellbutrin 150 mg, kerro terveydenhuollon tarjoajallesi, jos sinulla on koskaan ollut masennusta tai muita mielenterveysongelmia. Sinun tulee myös kertoa terveydenhuollon tarjoajallesi kaikista oireistasi, jotka sinulla oli muina aikoina, kun yritit lopettaa tupakoinnin, bupropionin kanssa tai ilman.
Mitä muita tärkeitä tietoja minun pitäisi tietää Wellbutrinista?
- Kouristuskohtaukset: On olemassa mahdollisuus saada kohtaus (kouristukset, kohtaus) käytettäessä Wellbutrin 150 mg, erityisesti ihmisillä:
- tiettyjen lääketieteellisten ongelmien kanssa.
- jotka käyttävät tiettyjä lääkkeitä. Kouristuskohtausten mahdollisuus kasvaa suuremmilla WELLBUTRIN-annoksilla. Katso lisätietoja kohdista "Kuka ei saa ottaa Wellbutrinia?" ja "Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen WELLBUTRIN 300mg:n ottamista?" Kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi ja kaikista käyttämistäsi lääkkeistä. Älä käytä muita lääkkeitä, kun käytät Wellbutrin 150 mg -valmistetta, ellei terveydenhuollon tarjoaja ole sanonut, että niiden ottaminen on sallittua. Jos sinulla on kohtaus Wellbutrin-hoidon aikana, lopeta tablettien ottaminen ja soita välittömästi terveydenhuollon tarjoajallesi. Älä ota Wellbutrin 150 mg uudelleen, jos sinulla on kohtaus.
- Korkea verenpaine (hypertensio). Joillakin ihmisillä on korkea verenpaine, joka voi olla vakava, kun he käyttävät Wellbutrinia. Korkean verenpaineen mahdollisuus voi olla suurempi, jos käytät myös nikotiinikorvaushoitoa (kuten nikotiinilaastaria) tupakoinnin lopettamiseksi (katso tämän lääkitysoppaan kohta "Miten minun pitäisi ottaa Wellbutrin 150 mg?").
- Manisia jaksoja. Joillakin ihmisillä voi olla maniajaksoja Wellbutrin 300 mg:n käytön aikana, mukaan lukien:
- Lisääntynyt energia huomattavasti
- Vakavat unihäiriöt
- Kilpailevia ajatuksia
- Huolimaton käytös
- Epätavallisen mahtavia ideoita
- Liiallinen onnellisuus tai ärtyneisyys
- Puhu tavallista enemmän tai nopeammin Jos sinulla on jokin yllä mainituista manian oireista, soita terveydenhuollon tarjoajallesi.
- Epätavalliset ajatukset tai käytökset. Joillakin potilailla on epätavallisia ajatuksia tai käyttäytymistä WELLBUTRIN-hoidon aikana, mukaan lukien harhaluulot (uskoot olevasi joku muu), hallusinaatioita (ei ole olemassa), vainoharhaisuutta (tunne, että ihmiset ovat sinua vastaan) tai hämmennyksen tunne. Jos näin käy sinulle, soita terveydenhuollon tarjoajallesi.
- Visuaaliset ongelmat.
- silmän kipu
- muutoksia näkökyvyssä
- turvotus tai punoitus silmässä tai silmän ympärillä Vain joillakin ihmisillä on näiden ongelmien riski. Haluat ehkä käydä silmätutkimuksessa nähdäksesi, oletko vaarassa, ja saada ehkäisevää hoitoa, jos olet.
- Vaikeat allergiset reaktiot. Joillakin ihmisillä voi olla vakavia allergisia reaktioita Wellbutrinille. Lopeta Wellbutrin 300 mg:n käyttö ja soita heti terveydenhuollon tarjoajallesi jos saat ihottumaa, kutinaa, nokkosihottumaa, kuumetta, imusolmukkeiden turvotusta, kivuliaita haavaumia suussa tai silmien ympärillä, huulten tai kielen turvotusta, rintakipua tai hengitysvaikeuksia. Nämä voivat olla merkkejä vakavasta allergisesta reaktiosta.
Mikä on WELLBUTRIN?
WELLBUTRIN on reseptilääke, jota käytetään aikuisille, joilla on tietyntyyppinen masennus, jota kutsutaan vakavaksi masennushäiriöksi.
Kuka ei saa ottaa Wellbutrin 150mg?
Älä ota WELLBUTRINia, jos
- sinulla on tai on ollut kohtaushäiriö tai epilepsia.
- sinulla on tai on ollut syömishäiriö, kuten anorexia nervosa tai bulimia.
- käytät muita bupropionia sisältäviä lääkkeitä, mukaan lukien ZYBAN (käytetään tupakoinnin lopettamiseen), WELLBUTRIN 300mg SR, WELLBUTRIN 150mg XL, APLENZIN tai FORFIVO XL. Bupropioni on sama vaikuttava aine kuin WELLBUTRINissa.
- juo paljon alkoholia ja lopeta juominen äkillisesti tai käytä rauhoiteiksi kutsuttuja lääkkeitä (nämä tekevät uneliaisuudesta), bentsodiatsepiineja tai kouristuslääkkeitä, ja lopetat niiden käytön yhtäkkiä.
- ottaa monoamiinioksidaasin estäjää (MAOI). Kysy terveydenhuollon tarjoajalta tai apteekista, jos et ole varma, käytätkö MAO-estäjää, mukaan lukien antibiootti linetsolidi.
- älä ota MAO-estäjää 2 viikon kuluessa Wellbutrin-hoidon lopettamisesta, ellei terveydenhuollon tarjoajasi kehota tekemään niin.
- älä aloita Wellbutrin 150 mg -hoitoa, jos olet lopettanut MAO-estäjän käytön viimeisen 2 viikon aikana, ellei terveydenhuollon tarjoajasi kehota tekemään niin.
- olet allerginen Wellbutrin 300 mg:n vaikuttavalle aineelle, bupropionille tai jollekin inaktiiviselle aineosalle. Katso tämän lääkitysoppaan lopusta täydellinen luettelo WELLBUTRINin ainesosista.
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen WELLBUTRINin ottamista?
Kerro terveydenhuollon tarjoajallesi, jos sinulla on koskaan ollut masennusta, itsetuhoisia ajatuksia tai tekoja tai muita mielenterveysongelmia. Katso "Masennuslääkkeet, masennus ja muut vakavat mielisairaudet ja itsemurha-ajatukset tai -toimet".
- Kerro terveydenhuollon tarjoajallesi muista sairauksistasi, mukaan lukien jos:
- sinulla on maksaongelmia, erityisesti maksakirroosi.
- on munuaisongelmia.
- sinulla on tai on ollut syömishäiriö, kuten anorexia nervosa tai bulimia.
- on saanut päävamman.
- sinulla on ollut kohtaus (kouristukset, kohtaus).
- sinulla on kasvain hermostossasi (aivoissa tai selkärangassa).
- sinulla on ollut sydänkohtaus, sydänongelmia tai korkea verenpaine.
- olet diabeetikko, joka käyttää insuliinia tai muita lääkkeitä verensokerisi säätelemiseksi.
- juoda alkoholia.
- käyttää väärin reseptilääkkeitä tai katulääkkeitä.
- olet raskaana tai suunnittelet raskautta. Keskustele terveydenhuollon tarjoajan kanssa syntymättömälle lapsellesi aiheutuvista riskeistä, jos otat Wellbutrin 300 mg raskauden aikana.
- Kerro terveydenhuollon tarjoajallesi, jos tulet raskaaksi tai luulet olevasi raskaana Wellbutrin-hoidon aikana.
- Jos tulet raskaaksi Wellbutrin-hoidon aikana, keskustele terveydenhuollon tarjoajasi kanssa rekisteröitymisestä National Pregnancy Registry for masennuslääkkeisiin. Voit ilmoittautua soittamalla numeroon 1-844-405-6185.
- imetät tai aiot imettää Wellbutrin-hoidon aikana. WELLBUTRIN erittyy maitoon. Keskustele terveydenhuollon tarjoajan kanssa parhaasta tavasta ruokkia vauvasi Wellbutrin-hoidon aikana.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet, reseptivapaat lääkkeet, vitamiinit ja yrttilisät. Monet lääkkeet lisäävät kouristuskohtausten tai muiden vakavien sivuvaikutusten riskiä, jos otat niitä WELLBUTRIN-hoidon aikana.
Miten minun pitäisi ottaa WELLBUTRIN 300 mg?
- Ota Wellbutrin 300 mg juuri sen verran kuin terveydenhuollon tarjoaja on määrännyt. Älä muuta annostasi tai lopeta Wellbutrinin käyttöä keskustelematta ensin terveydenhuollon tarjoajan kanssa.
- Niele WELLBUTRIN-tabletit kokonaisina. Älä pureskele, leikkaa tai murskaa WELLBUTRIN 300 mg tabletteja.
- Ota Wellbutrin 300 mg samaan aikaan joka päivä.
- Ota Wellbutrin 300 mg -annoksesi vähintään 6 tunnin välein.
- Voit ottaa Wellbutrinin ruoan kanssa tai ilman.
- Jos unohdat ottaa annoksen, älä ota ylimääräistä annosta korvataksesi unohtamasi annoksen. Odota ja ota seuraava annos normaaliin aikaan. Tämä on hyvin tärkeää. Liian suuri määrä WELLBUTRINia voi lisätä kouristuskohtauksen mahdollisuutta.
- Jos otat liikaa Wellbutrinia tai otat yliannostuksen, soita heti paikalliseen ensiapuun tai myrkytystietokeskukseen.
- Älä käytä muita lääkkeitä WELLBUTRIN 300 mg -hoidon aikana, ellei terveydenhuollon tarjoaja ole kertonut, että se on kunnossa.
- Jos käytät Wellbutrin 150 mg:aa vakavan masennuksen hoitoon, voi kestää useita viikkoja, ennen kuin tunnet, että Wellbutrin 150 mg toimii. Kun tunnet olosi paremmaksi, on tärkeää jatkaa Wellbutrinin ottamista täsmälleen terveydenhuollon tarjoajasi ohjeiden mukaan. Soita terveydenhuollon tarjoajallesi, jos sinusta tuntuu, että WELLBUTRIN ei toimi sinulle.
Mitä minun pitäisi välttää WELLBUTRIN 300 mg:n käytön aikana?
- Rajoita tai vältä alkoholin käyttöä Wellbutrin-hoidon aikana. Jos juot yleensä paljon alkoholia, keskustele terveydenhuollon tarjoajan kanssa ennen kuin lopetat yhtäkkiä. Jos lopetat alkoholin käytön yhtäkkiä, saatat lisätä kouristuskohtausten riskiä.
- Älä aja autoa tai käytä raskaita koneita, ennen kuin tiedät, kuinka Wellbutrin 150mg vaikuttaa sinuun. WELLBUTRIN voi vaikuttaa kykyysi tehdä nämä asiat turvallisesti.
Mitkä ovat WELLBUTRIN 300mg:n mahdolliset sivuvaikutukset?
WELLBUTRIN voi aiheuttaa vakavia sivuvaikutuksia. Katso tämän lääkitysoppaan alussa olevista osioista tietoa WELLBUTRINin vakavista sivuvaikutuksista.
Wellbutrinin yleisimpiä sivuvaikutuksia ovat:
- hermostuneisuus
- kovaa hikoilua
- kuiva suu
- vapina (vapina)
- ummetus
- nukahtamisvaikeuksia
- päänsärky
- näön hämärtyminen
- pahoinvointia tai oksentelua
- nopea sydämenlyönti
- huimaus
Jos sinulla on pahoinvointia, ota lääke ruoan kanssa. Jos sinulla on unihäiriöitä, älä ota lääkettäsi liian lähellä nukkumaanmenoa.
Kerro heti terveydenhuollon tarjoajallesi kaikista sinua vaivaavista sivuvaikutuksista.
Nämä eivät ole kaikkia WELLBUTRINin mahdollisia sivuvaikutuksia. Lisätietoja saat terveydenhuollon tarjoajalta tai apteekista.
Soita terveydenhuollon tarjoajallesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Voit myös ilmoittaa sivuvaikutuksista GlaxoSmithKlinelle numerossa 1-888-825-5249.
Kuinka minun pitäisi säilyttää WELLBUTRIN 300mg?
- Säilytä WELLBUTRIN huoneenlämmössä välillä 68 ° F - 77 ° F (20 ° C - 25 ° C).
- Pidä WELLBUTRIN-tabletit kuivana ja poissa valolta.
Pidä Wellbutrin ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa WELLBUTRINin turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä WELLBUTRIN 300 mg -valmistetta sairauteen, johon sitä ei ole määrätty. Älä anna Wellbutrinia muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Jos teet virtsan huumeiden seulontatestin, WELLBUTRIN voi tehdä testituloksen positiiviseksi amfetamiinien suhteen. Jos kerrot sinulle huumeiden seulontatestin suorittavalle henkilölle, että käytät Wellbutrin 300 mg -valmistetta, hän voi tehdä tarkemman lääkeseulontatestin, jolla ei pitäisi olla tätä ongelmaa.
Tämä lääkitysopas sisältää yhteenvedon tärkeästä tiedosta WELLBUTRINista. Jos haluat lisätietoja, keskustele terveydenhuollon tarjoajasi kanssa. Voit kysyä terveydenhuollon tarjoajalta tai apteekista terveydenhuollon ammattilaisille kirjoitettua tietoa WELLBUTRINista.
Lisätietoja WELLBUTRINista saat soittamalla numeroon 1-888-825-5249.
Mitä ainesosia WELLBUTRIN 300mg sisältää?
Vaikuttava aine: bupropionihydrokloridi.
Ei-aktiiviset aineet: 75 mg:n tabletti – D&C Yellow No. 10 Lake, FD&C Yellow No. 6 Lake, hydroksipropyyliselluloosa, hypromelloosi, mikrokiteinen selluloosa, polyetyleeniglykoli, talkki ja titaanidioksidi; 100 mg tabletti – FD&C Red No. 40 Lake, FD&C Yellow No. 6 Lake, hydroksipropyyliselluloosa, hypromelloosi, mikrokiteinen selluloosa, polyetyleeniglykoli, talkki ja titaanidioksidi.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
