Abilify 10mg, 15mg, 20mg Aripiprazole Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.

Mikä Abilify 20mg on ja miten sitä käytetään?
Abilify on reseptilääke, jota käytetään skitsofrenian, kaksisuuntaisen mielialahäiriön I (maanisen masennuksen) ja vakavan masennuksen oireiden hoitoon. Abilify 10 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa. Abilify on antipsykoottinen, antimaaninen aine.
- Ei tiedetä, onko Abilify turvallinen ja tehokas alle 6-vuotiaille lapsille.
Mitkä ovat Abilify 15mg:n mahdolliset sivuvaikutukset?
Abilify 15mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- vakava levottomuus tai ahdistus,
- levoton olo,
- silmien, huulten, kielen, kasvojen, käsivarsien tai jalkojen nykiminen tai hallitsemattomat liikkeet,
- kasvojen naamiomainen ulkonäkö,
- nielemisvaikeuksia,
- puheongelmat,
- kohtaukset (kouristukset),
- ajatuksia itsemurhasta tai itsensä vahingoittamisesta,
- jäykät tai jäykät lihakset,
- korkea kuume,
- hikoilu,
- hämmennystä,
- nopeat tai epätasaiset sydämenlyönnit,
- vapina (vapina),
- huima olo,
- vilunväristykset,
- kipeä kurkku,
- suun haavaumat,
- ihohaavat,
- yskä,
- vaikeuksia hengittää,
- lisääntynyt jano,
- lisääntynyt virtsaaminen,
- suun kuivuminen ja
- hedelmäinen hengityksen tuoksu
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Abilify 20mg:n yleisimmät sivuvaikutukset ovat:
- hallitsemattomat lihasliikkeet,
- ahdistus,
- levoton olo,
- painonnousu,
- pahoinvointi,
- oksentelua,
- ummetus,
- lisääntynyt ruokahalu,
- päänsärky,
- huimaus,
- uneliaisuus,
- väsynyt olo,
- unihäiriöt (unettomuus),
- tukkoinen nenä ja
- kipeä kurkku
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Abilifyn mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
DEMENTIAAN LIITTYVÄÄ psykoosia sairastavien iäkkäiden potilaiden lisääntynyt kuolleisuus sekä itsemurha-ajatukset ja -käyttäytyminen masennuslääkeaineella
Antipsykoottisilla lääkkeillä hoidetuilla iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi, on lisääntynyt kuolemanriski. ABILIFY 20 mg ei ole hyväksytty potilaiden hoitoon, joilla on dementiaan liittyvä psykoosi (ks. VAROITUKSET JA VAROTOIMET).
Masennuslääkkeet lisäsivät itsemurha-ajatusten ja -käyttäytymisen riskiä lapsilla, nuorilla ja nuorilla aikuisilla lyhytaikaisissa tutkimuksissa. Nämä tutkimukset eivät osoittaneet itsemurha-ajatusten ja -käyttäytymisen riskin lisääntymistä masennuslääkkeiden käytön yhteydessä yli 24-vuotiailla potilailla; masennuslääkkeiden käytön riski pieneni 65-vuotiailla ja sitä vanhemmilla potilailla [ks. VAROITUKSET JA VAROTOIMET].
Kaiken ikäisiä potilaita, joilla on aloitettu masennuslääkehoito, on seurattava tarkasti pahenemisen ja itsemurha-ajatusten ja -käyttäytymisen ilmaantumisen varalta. Kerro perheille ja omaishoitajille tiiviin tarkkailun ja yhteydenpidon tarpeesta lääkkeen määräävän lääkärin kanssa [katso VAROITUKSET JA VAROTOIMET].
KUVAUS
Aripipratsoli on psykotrooppinen lääke, jota on saatavana ABILIFY® (aripipratsoli) tabletteina, ABILIFY DISCMELT® (aripipratsoli) suun kautta hajoavina tabletteina, ABILIFY® (aripipratsoli) oraaliliuoksena ja ABILIFY® (aripipratsoli) injektioliuoksena lihakseen. Aripipratsoli on 7-[4-[4-(2,3-dikloorifenyyli)-1-piperatsinyyli]butoksi]-3,4-dihydrokarbostyriili. Empiirinen kaava on C23H27Cl2N3O2 ja sen molekyylipaino on 448,38. Kemiallinen rakenne on:
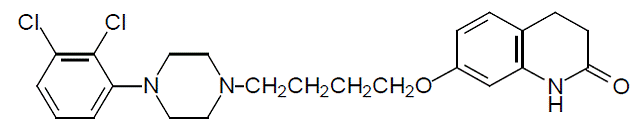
ABILIFY-tabletteja on saatavana 2 mg, 5 mg, 10 mg, 15 mg, 20 mg ja 30 mg vahvuuksina. Inaktiivisia ainesosia ovat maissitärkkelys, hydroksipropyyliselluloosa, laktoosimonohydraatti, magnesiumstearaatti ja mikrokiteinen selluloosa. Väriaineita ovat rautaoksidi (keltainen tai punainen) ja FD&C Blue No. 2 Aluminium Lake.
ABILIFY 20 mg DISCMELT suun kautta hajoavia tabletteja on saatavana 10 mg ja 15 mg vahvuuksina. Inaktiivisia ainesosia ovat asesulfaamikalium, aspartaami, kalsiumsilikaatti, kroskarmelloosinatrium, krospovidoni, vaniljakerma (luonnolliset ja keinotekoiset aromit), magnesiumstearaatti, mikrokiteinen selluloosa, piidioksidi, viinihappo ja ksylitoli. Väriaineita ovat rautaoksidi (keltainen tai punainen) ja FD&C Blue No. 2 Aluminium Lake.
ABILIFY oraaliliuos on kirkas, väritön tai vaaleankeltainen liuos, jota on saatavana pitoisuutena 1 mg/ml. Tämän liuoksen inaktiivisia aineosia ovat dinatriumedetaatti, fruktoosi, glyseriini, dl-maitohappo, metyyliparabeeni, propyleeniglykoli, propyyliparabeeni, natriumhydroksidi, sakkaroosi ja puhdistettu vesi. Oraaliliuos on maustettu luonnollisella appelsiinikermalla ja muilla luonnollisilla aromeilla.
ABILIFY Injection on saatavana kerta-annosinjektiopulloissa käyttövalmiina, 9,75 mg/1,3 ml (7,5 mg/ml) kirkkaana, värittömänä, steriilinä vesiliuoksena, joka on tarkoitettu käytettäväksi vain lihakseen. Tämän liuoksen inaktiivisia ainesosia ovat 199,5 mg sulfobutyylieetteri-β-syklodekstriiniä (SBECD), 10,4 mg viinihappoa, qs - pH 4,3 natriumhydroksidia ja qs - 1,33 ml injektionesteisiin käytettävää vettä.
INDIKAATIOT
ABILIFY-oraaliset tabletit, suun kautta hajoavat tabletit ja oraaliliuos on tarkoitettu seuraavien sairauksien hoitoon:
- Skitsofrenia [katso Kliiniset tutkimukset ]
- Kaksisuuntaiseen mielialahäiriöön I liittyvien maanisten ja sekajaksojen akuutti hoito [katso Kliiniset tutkimukset ]
- Vakavan masennushäiriön lisähoito [katso Kliiniset tutkimukset ]
- Autistiseen häiriöön liittyvä ärtyneisyys [katso Kliiniset tutkimukset ]
- Touretten häiriön hoito [katso Kliiniset tutkimukset ]
ABILIFY-injektio on tarkoitettu seuraavien sairauksien hoitoon:
- Agitaatio, joka liittyy skitsofreniaan tai kaksisuuntaiseen mielialamaniaan [katso Kliiniset tutkimukset ]
ANNOSTELU JA HALLINNOINTI
Skitsofrenia
Aikuiset
ABILIFYn suositeltu aloitus- ja tavoiteannos on 10 tai 15 mg/vrk, joka annetaan kerran vuorokaudessa aterioista riippumatta. ABILIFY on arvioitu systemaattisesti ja sen on osoitettu olevan tehokas annosalueella 10-30 mg/vrk, kun sitä annetaan tablettimuodossa. yli 10 tai 15 mg/vrk annokset eivät kuitenkaan olleet tehokkaampia kuin 10 tai 15 mg/vrk. Annosta ei yleensä saa suurentaa ennen 2 viikkoa, joka on vakaan tilan saavuttamiseen tarvittava aika [ks. Kliiniset tutkimukset ].
Ylläpitohoito: Tehon säilyminen skitsofrenian hoidossa osoitettiin tutkimuksessa, johon osallistui skitsofreniapotilaita, jotka olivat olleet oireellisesti stabiileja muilla antipsykoottisilla lääkkeillä vähintään 3 kuukauden ajan. Nämä potilaat lopetettiin näiden lääkkeiden käyttö ja satunnaistettiin saamaan joko ABILIFY 15 mg/vrk tai lumelääkettä, ja heidän havaittiin uusiutumisen varalta [ks. Kliiniset tutkimukset ]. Potilaat tulee säännöllisesti arvioida uudelleen ylläpitohoidon jatkuvan tarpeen määrittämiseksi.
Nuoret
Suositeltu ABILIFYn tavoiteannos on 10 mg/vrk. Aripipratsolia tutkittiin skitsofreniaa sairastavilla 13–17-vuotiailla nuorilla 10 mg:n ja 30 mg:n vuorokausiannoksilla. Tablettiformulaation aloitusannos näillä potilailla oli 2 mg, joka titrattiin 5 mg:aan 2 päivän kuluttua ja tavoiteannokseen 10 mg 2 lisäpäivän jälkeen. Myöhemmin annosta suurennetaan 5 mg:n lisäyksin. Annoksen 30 mg/vrk ei osoitettu olevan tehokkaampi kuin 10 mg/vrk annos. ABILIFY voidaan antaa aterioista riippumatta [katso Kliiniset tutkimukset ]. Potilaat tulee säännöllisesti arvioida uudelleen ylläpitohoidon tarpeen määrittämiseksi.
Siirtyminen muista psykoosilääkkeistä
Ei ole systemaattisesti kerättyjä tietoja, jotka koskevat erityisesti skitsofreniapotilaiden vaihtamista muista psykoosilääkkeistä ABILIFY 20 mg:aan tai samanaikaista antoa muiden psykoosilääkkeiden kanssa. Vaikka aiemman antipsykoottisen hoidon välitön lopettaminen voi olla hyväksyttävää joillekin skitsofreniapotilaille, asteittainen lopettaminen voi olla sopivinta toisille. Kaikissa tapauksissa päällekkäisen antipsykoottisen lääkkeen antamisen ajanjakso tulee minimoida.
Kaksisuuntainen mielialahäiriö I
Maanisten ja sekamuotoisten jaksojen akuutti hoito
Aikuiset
Suositeltu aloitusannos aikuisille on 15 mg kerran vuorokaudessa monoterapiana ja 10–15 mg kerran vuorokaudessa litiumin tai valproaatin lisähoitona. ABILIFY 10 mg voidaan antaa aterioista riippumatta. Suositeltu ABILIFYn tavoiteannos on 15 mg/vrk monoterapiana tai litiumin tai valproaatin liitännäishoitona. Annosta voidaan suurentaa 30 mg:aan/vrk kliinisen vasteen perusteella. Yli 30 mg/vrk annosten turvallisuutta ei ole arvioitu kliinisissä tutkimuksissa.
Pediatria
Suositeltu aloitusannos lapsipotilaille (10–17-vuotiaat) monoterapiana on 2 mg/vrk, titraus 5 mg:aan/vrk 2 päivän kuluttua ja tavoiteannos 10 mg/vrk 2 lisäpäivän jälkeen. Suositeltu annostus litiumin tai valproaatin lisähoitona on sama. Myöhemmin annosta suurennetaan tarvittaessa 5 mg/vrk lisäyksin. ABILIFY voidaan antaa aterioista riippumatta [katso Kliiniset tutkimukset ].
Vakavan masennushäiriön lisähoito
Aikuiset
Suositeltu ABILIFYn aloitusannos lisähoitona potilaille, jotka jo käyttävät masennuslääkettä, on 2–5 mg/vrk. Suositeltu annosalue on 2-15 mg/vrk. Annoksen muuttaminen 5 mg:aan/vrk asti tulee tapahtua vähitellen, vähintään 1 viikon välein [ks. Kliiniset tutkimukset ]. Potilaat tulee säännöllisesti arvioida uudelleen ylläpitohoidon jatkuvan tarpeen määrittämiseksi.
Autistiseen häiriöön liittyvä ärtyneisyys
Lapsipotilaat (6–17-vuotiaat)
Suositeltu annosalue lapsipotilaiden hoitoon, joilla on autistiseen häiriöön liittyvää ärtyneisyyttä, on 5-15 mg/vrk.
Annostus tulee aloittaa annoksella 2 mg/vrk. Annos tulee suurentaa 5 mg:aan/vrk, minkä jälkeen annosta nostetaan tarvittaessa 10 tai 15 mg:aan/vrk. Annoksen muuttaminen 5 mg:aan/vrk asti tulee tapahtua vähitellen, vähintään 1 viikon välein [ks. Kliiniset tutkimukset ]. Potilaat tulee säännöllisesti arvioida uudelleen ylläpitohoidon jatkuvan tarpeen määrittämiseksi.
Touretten häiriö
Lapsipotilaat (6–18-vuotiaat)
Suositeltu annostusalue Touretten taudin hoitoon on 5-20 mg/vrk.
Alle 50 kg painavien potilaiden annostus tulee aloittaa annoksella 2 mg/vrk ja tavoiteannoksella 5 mg/vrk 2 päivän kuluttua. Annos voidaan nostaa 10 mg:aan/vrk potilailla, jotka eivät saavuta optimaalista tic-hallintaa. Annostusta tulee muuttaa asteittain vähintään 1 viikon välein.
Potilaille, jotka painavat 50 kg tai enemmän, annostus tulee aloittaa annoksella 2 mg/vrk 2 päivän ajan ja nostaa sitten 5 mg:aan/vrk 5 päivän ajan tavoiteannoksella 10 mg/vrk 8. päivänä. nostettiin 20 mg:aan/vrk potilailla, jotka eivät saavuta optimaalista tic-hallintaa. Annostusta tulee muuttaa asteittain 5 mg:n lisäyksin päivässä vähintään 1 viikon välein. [Katso Kliiniset tutkimukset ].
Potilaat tulee säännöllisesti arvioida uudelleen ylläpitohoidon jatkuvan tarpeen määrittämiseksi.
Skitsofreniaan tai kaksisuuntaiseen mielialamaniiaan liittyvä kiihtymys (lihaksensisäinen injektio)
Aikuiset
Suositeltu annos näille potilaille on 9,75 mg. Suositeltu annostusalue on 5,25–15 mg. Mitään lisähyötyä 15 mg:lla ei osoitettu verrattuna 9,75 mg:aan. Pienempää 5,25 mg:n annosta voidaan harkita, jos kliiniset tekijät sitä edellyttävät. Jos levottomuus, joka vaatii toisen annoksen, jatkuu aloitusannoksen jälkeen, voidaan antaa kumulatiivisia annoksia yhteensä 30 mg/vrk asti. Toistuvien ABILIFY 10 mg injektioannosten tehoa kiihtyneillä potilailla ei ole kuitenkaan arvioitu systemaattisesti kontrolloiduissa kliinisissä tutkimuksissa. Yli 30 mg:n päivittäisten kokonaisannosten tai useammin kuin 2 tunnin välein annettujen injektioiden turvallisuutta ei ole arvioitu riittävästi kliinisissä tutkimuksissa [ks. Kliiniset tutkimukset ].
Jos jatkuva ABILIFY-hoito on kliinisesti aiheellista, suun kautta otettava ABILIFY 10-30 mg/vrk tulee korvata ABILIFY-injektiolla mahdollisimman pian [ks. ANNOSTELU JA HALLINNOINTI ].
ABILIFY-injektion anto
Anna ABILIFY 10 mg -injektio vedä ruiskuun tarvittava määrä liuosta taulukon 1 mukaisesti. Hävitä käyttämättä jäänyt annos.
ABILIFY-injektio on tarkoitettu vain lihaksensisäiseen käyttöön. Ei saa antaa laskimoon tai ihon alle. Ruiskuta hitaasti syvälle lihasmassaan.
Parenteraaliset lääkevalmisteet tulee tarkastaa silmämääräisesti hiukkasten ja värimuutosten varalta ennen antoa aina, kun liuos ja säiliö sen sallivat.
Annostuksen muuttaminen sytokromi P450:tä varten
Annoksen muuttamista suositellaan potilaille, joiden tiedetään olevan heikko CYP2D6-metabolia, ja potilaille, jotka käyttävät samanaikaisesti CYP3A4- tai CYP2D6-estäjiä tai vahvoja CYP3A4-induktoreita (ks. taulukko 2). Kun samanaikaisesti käytetty lääke poistetaan yhdistelmähoidosta, ABILIFY 10 mg -annos tulee säätää alkuperäiselle tasolle. Kun samanaikaisesti annettu CYP3A4-induktori lopetetaan, ABILIFY-annos tulee pienentää alkuperäiselle tasolle 1-2 viikon aikana. Potilaiden, jotka saattavat saada yhdistelmää vahvoja, kohtalaisia ja heikkoja CYP3A4:n ja CYP2D6:n estäjiä (esim. vahvaa CYP3A4:n estäjää ja kohtalaista CYP2D6:n estäjää tai kohtalaista CYP3A4:n estäjää kohtalaisen CYP2D6:n estäjän kanssa), annos voidaan pienentää yhteen. - neljäsosa (25 %) tavallisesta annoksesta aluksi ja sitä muutetaan sitten suotuisan kliinisen vasteen saavuttamiseksi.
Kun ABILIFY-lisähoitoa annetaan potilaille, joilla on vakava masennushäiriö, ABILIFY 10 mg tulee antaa ilman annosmuutosta kohdan Annostus ja antotapa (2.3) mukaisesti.
Oraaliliuoksen annostelu
Oraaliliuos voidaan korvata tableteilla mg/mg-periaatteella 25 mg:n annostasoon asti. Potilaiden, jotka saavat 30 mg:n tabletteja, tulee saada 25 mg liuosta [katso KLIININEN FARMAKOLOGIA ].
Suun kautta hajoavien tablettien annostelu
ABILIFY 10 mg suun kautta hajoavien tablettien annostus on sama kuin suun kautta otettavien tablettien [ks. yllä olevissa osioissa ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
ABILIFY® (aripipratsoli) -tabletit ovat saatavilla taulukossa 3 kuvatulla tavalla.
ABILIFY DISCMELT® (aripipratsoli) suun kautta hajoavia tabletteja on saatavana taulukossa 4 kuvatulla tavalla.
ABILIFY® (aripipratsoli) oraaliliuos (1 mg/ml) on kirkas, väritön tai vaaleankeltainen liuos, joka toimitetaan lapsiturvallisissa pulloissa kalibroidun oraalisen annostelukupin kanssa.
ABILIFY® (aripipratsoli) -injektio lihakseen on kirkas, väritön liuos, joka on saatavana käyttövalmiina 9,75 mg/1,3 ml (7,5 mg/ml) liuoksena kirkkaissa tyypin 1 lasipulloissa.
Varastointi ja käsittely
ABILIFY® (aripipratsoli) -tabletit on merkinnät toisella puolella ja niitä on saatavana vahvuuksina ja pakkauksissa, jotka on lueteltu taulukossa 32.
ABILIFY 15 mg DISCMELT® (aripipratsoli) suussa hajoavat tabletit ovat pyöreitä tabletteja, joiden molemmilla puolilla on merkinnät. ABILIFY 15 mg DISCMELT on saatavana vahvuuksina ja pakkauksissa, jotka on lueteltu taulukossa 33.
ABILIFY® (aripipratsoli) -oraaliliuos (1 mg/ml) toimitetaan lapsiturvallisissa pulloissa kalibroidun oraalisen annostelukupin kanssa. ABILIFY 20 mg oraaliliuosta on saatavana seuraavasti:
150 ml pullo NDC 59148-013-15
ABILIFY® (aripipratsoli) lihakseen tarkoitettu injektio on saatavana käyttövalmiina 9,75 mg/1,3 ml (7,5 mg/ml) liuoksena kirkkaissa tyypin 1 lasipulloissa seuraavasti:
9,75 mg/1,3 ml kerta-annospullo NDC 59148-016-65
Varastointi
Tabletit
Säilytä 25°C (77°F); retket sallitaan 15°C - 30°C (59°F - 86°F) [katso USP-ohjattu huonelämpötila ].
Oraaliliuos
Säilytä 25°C (77°F); retket sallitaan 15°C - 30°C (59°F - 86°F) [katso USP-ohjattu huonelämpötila ]. Avattuja ABILIFY-oraaliliuospulloja voidaan käyttää enintään 6 kuukautta avaamisen jälkeen, mutta ei pullossa olevan viimeisen käyttöpäivän jälkeen. Pullo ja sen sisältö tulee hävittää viimeisen käyttöpäivän jälkeen.
Injektio
Säilytä 25°C (77°F); retket sallitaan 15°C - 30°C (59°F - 86°F) [katso USP-ohjattu huonelämpötila ]. Suojaa valolta säilyttämällä alkuperäispakkauksessa. Säilytä laatikossa käyttöhetkeen asti.
Jakelija ja markkinoija: Otsuka America Pharmaceutical, Inc., Rockville, MD 20850 USA. Otsuka America Pharmaceutical, Inc.,. Tarkastus elokuu 2019
SIVUVAIKUTUKSET
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Seuraavia haittavaikutuksia käsitellään tarkemmin muissa merkintöjen osissa:
- Lisääntynyt kuolleisuus iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi [ks. LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ]
- Aivoverenkierron haittatapahtumat, mukaan lukien aivohalvaus [katso VAROITUKSET JA VAROTOIMET ]
- Itsemurha-ajatukset ja -käyttäytyminen lapsilla, nuorilla ja nuorilla aikuisilla [ks. LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ]
- Maligni neuroleptinen oireyhtymä (NMS) [katso VAROITUKSET JA VAROTOIMET ]
- Tardiivi dyskinesia [katso VAROITUKSET JA VAROTOIMET ]
- Metaboliset muutokset [katso VAROITUKSET JA VAROTOIMET ]
- Patologinen pelaaminen ja muut pakko-oireet [katso VAROITUKSET JA VAROTOIMET ]
- Ortostaattinen hypotensio [katso VAROITUKSET JA VAROTOIMET ]
- Falls [katso VAROITUKSET JA VAROTOIMET ]
- Leukopenia, neutropenia ja agranulosytoosi [katso VAROITUKSET JA VAROTOIMET ]
- Kohtaukset/kouristukset [katso VAROITUKSET JA VAROTOIMET ]
- Kognitiivisen ja motorisen heikentymisen mahdollisuus [katso VAROITUKSET JA VAROTOIMET ]
- Kehon lämpötilan säätö [katso VAROITUKSET JA VAROTOIMET ]
- Itsemurha [katso VAROITUKSET JA VAROTOIMET ]
- Dysfagia [katso VAROITUKSET JA VAROTOIMET ]
Yleisimmät haittavaikutukset aikuispotilailla kliinisissä tutkimuksissa (≥10 %) olivat pahoinvointi, oksentelu, ummetus, päänsärky, huimaus, akatisia, ahdistuneisuus, unettomuus ja levottomuus.
Yleisimmät haittavaikutukset lapsilla tehdyissä kliinisissä tutkimuksissa (≥10 %) olivat uneliaisuus, päänsärky, oksentelu, ekstrapyramidaalinen häiriö, väsymys, lisääntynyt ruokahalu, unettomuus, pahoinvointi, nenänielutulehdus ja painon nousu.
ABILIFYn turvallisuutta on arvioitu 13 543 aikuispotilaalla, jotka osallistuivat usean annoksen kliinisiin tutkimuksiin skitsofrenian, kaksisuuntaisen mielialahäiriön, vakavan masennushäiriön, Alzheimerin tyypin dementian, Parkinsonin taudin ja alkoholismin osalta ja joilla oli noin 7 619 potilasvuotta. altistuminen suun kautta otetulle 10 mg ABILIFY-annokselle ja 749 potilasta, jotka olivat altistuneet ABILIFY-injektiolle. Yhteensä 3 390 potilasta hoidettiin suun kautta annetulla ABILIFYllä vähintään 180 päivän ajan ja 1 933 potilasta, joita hoidettiin suun kautta annetulla ABILIFYllä, oli altistunut vähintään vuoden ajan.
ABILIFY 15 mg:n turvallisuutta on arvioitu 1 686 potilaalla (6-18 vuotta), jotka osallistuivat usean annoksen kliinisiin tutkimuksiin skitsofrenian, kaksisuuntaisen mielialan manian, autistisen häiriön tai Touretten häiriön osalta ja jotka olivat altistuneet suun kautta annetulle ABILIFYlle noin 1 342 potilasvuotta. . Yhteensä 959 lapsipotilasta hoidettiin suun kautta annetulla ABILIFYllä vähintään 180 päivän ajan ja 556 lapsipotilaalla, joita hoidettiin suun kautta annetulla ABILIFY 10 mg:lla, altistus oli vähintään 1 vuosi.
ABILIFY-hoidon olosuhteet ja kesto (monoterapia ja lisähoito masennuslääkkeillä tai mielialan stabiloijilla) sisälsivät (päällekkäisissä luokissa) kaksoissokkotutkimukset, vertailevat ja ei-vertailevat avoimet tutkimukset, laitos- ja avohoitotutkimukset, kiinteän ja joustavan annoksen tutkimukset, sekä lyhyt- ja pitkäaikainen altistuminen.
Kokemus kliinisistä kokeista
Skitsofreniaa sairastavat aikuispotilaat
Seuraavat havainnot perustuvat viiden lumekontrolloidun tutkimuksen (neljä 4 viikkoa ja yksi 6 viikkoa) tutkimukseen, joissa ABILIFY 15 mg suun kautta annettiin annoksina 2–30 mg/vrk.
Yleisesti havaitut haittavaikutukset
Ainoa yleisesti havaittu haittavaikutus, joka liittyy ABILIFY 20 mg:n käyttöön skitsofreniapotilailla (esiintyvyys vähintään 5 % ja ABILIFYn ilmaantuvuus vähintään kaksi kertaa lumelääkkeeseen verrattuna), oli akatisia (ABILIFY 8 %; lumelääke 4 %).
Aikuiset potilaat, joilla on kaksisuuntainen mielialamania
Monoterapia
Seuraavat havainnot perustuvat 3 viikon lumekontrolloidun kaksisuuntaisen mielialahäiriön maniatutkimusten pooliin, joissa annettiin suun kautta 15 mg ABILIFYä 15 tai 30 mg/vrk.
Yleisesti havaitut haittavaikutukset
Yleisesti havaitut haittavaikutukset, jotka liittyvät ABILIFYn käyttöön potilailla, joilla on kaksisuuntainen mielialamania (esiintyvyys vähintään 5 % ja ABILIFY 15 mg:n ilmaantuvuus vähintään kaksi kertaa lumelääkkeeseen verrattuna) on esitetty taulukossa 16.
Harvemmat haittavaikutukset aikuisilla
Taulukossa 17 luetellaan akuutin hoidon aikana esiintyneiden haittavaikutusten (enintään 6 viikkoa skitsofreniassa ja enintään 3 viikkoa kaksisuuntaisessa mielialamaniassa) aikana esiintyneiden haittavaikutusten yhteenlaskettu ilmaantuvuus lähimpään prosenttiin pyöristettynä, mukaan lukien vain ne reaktiot, joita esiintyi 2 %:lla tai useammalla potilaista. ABILIFYllä hoidetuilla potilailla (annokset ≥ 2 mg/vrk) ja joiden esiintyvyys ABILIFYllä 20 mg hoidetuilla potilailla oli suurempi kuin lumelääkettä saaneilla potilailla yhdistetyssä tietoaineistossa.
Väestön alaryhmien tarkastelu ei paljastanut selkeitä todisteita iän, sukupuolen tai rodun perusteella erilaisesta haittavaikutusten esiintyvyydestä.
Aikuiset potilaat, joilla on kaksisuuntainen mielialamania lisähoitoa
Seuraavat havainnot perustuvat plasebokontrolloituun tutkimukseen aikuispotilailla, joilla on kaksisuuntainen mielialahäiriö, jossa ABILIFY 15 mg:aa annettiin 15 tai 30 mg:n vuorokausiannoksina litiumin tai valproaatin lisähoitona.
Hoidon lopettamiseen liittyvät haittavaikutukset
Tutkimuksessa potilailla, jotka jo sietoivat joko litiumia tai valproaattia monoterapiana, haittavaikutuksista johtuen hoidon keskeyttämisprosentti oli 12 % ABILIFY-lisähoitoa saaneilla potilailla ja 6 % lumelääkettä saaneilla potilailla. Yleisimmät haittavaikutukset, jotka liittyivät hoidon lopettamiseen ABILIFY-lisähoitoa saaneilla potilailla verrattuna lumelääkettä saaneisiin potilaisiin, olivat akatisia (5 % ja 1 %) ja vapina (2 % ja 1 %).
Yleisesti havaitut haittavaikutukset
Yleisesti havaitut haittavaikutukset, jotka liittyvät ABILIFYn ja litiumin tai valproaatin lisähoitoon potilailla, joilla on kaksisuuntainen mielialamania (esiintyvyys vähintään 5 % ja ilmaantuvuus vähintään kaksinkertainen lumelääkkeeseen verrattuna), olivat: akatisia, unettomuus ja ekstrapyramidaalinen häiriö.
Harvemmat haittavaikutukset aikuispotilailla, jotka saavat lisähoitoa kaksisuuntaisessa maniassa
Taulukossa 18 luetellaan lähimpään prosenttiin pyöristettyjen haittavaikutusten ilmaantuvuus akuutin hoidon aikana (enintään 6 viikkoa), mukaan lukien vain ne reaktiot, joita esiintyi 2 %:lla tai useammalla ABILIFY-lisähoitoa saaneista potilaista (15 tai 30 annokset). mg/vrk) ja litium tai valproaatti ja joiden ilmaantuvuus tällä yhdistelmällä hoidetuilla potilailla oli suurempi kuin lumelääkettä plus litiumia tai valproaattia saaneilla potilailla.
Lapsipotilaat (13–17-vuotiaat), joilla on skitsofrenia
Seuraavat havainnot perustuvat yhteen 6 viikkoa kestäneeseen, lumekontrolloituun tutkimukseen, jossa ABILIFYä annettiin suun kautta annoksina 2–30 mg/vrk.
Hoidon lopettamiseen liittyvät haittavaikutukset
Haittavaikutuksista johtuvien keskeytysten ilmaantuvuus ABILIFY-hoitoa saaneiden ja lumelääkettä saaneiden lapsipotilaiden välillä (13-17-vuotiaat) oli 5 % ja 2 %.
Yleisesti havaitut haittavaikutukset
Yleisesti havaittuja haittavaikutuksia, jotka liittyvät ABILIFY 10 mg:n käyttöön skitsofreniaa sairastavilla nuorilla potilailla (esiintyvyys vähintään 5 % ja ABILIFYn ilmaantuvuus vähintään kaksi kertaa lumelääkkeeseen verrattuna), olivat ekstrapyramidaalinen häiriö, uneliaisuus ja vapina.
Pediatriset potilaat (10–17-vuotiaat), joilla on kaksisuuntainen mielialamania
Seuraavat havainnot perustuvat yhteen 4 viikkoa kestäneeseen lumekontrolloituun tutkimukseen, jossa ABILIFYä annettiin suun kautta annoksina 10 tai 30 mg/vrk.
Hoidon lopettamiseen liittyvät haittavaikutukset
Haittavaikutuksista johtuvien keskeytysten ilmaantuvuus ABILIFY-hoitoa saaneiden ja lumelääkettä saaneiden lapsipotilaiden välillä (10-17 vuotta) oli 7 % ja 2 %.
Yleisesti havaitut haittavaikutukset
Yleisesti havaitut haittavaikutukset, jotka liittyvät ABILIFY 20 mg:n käyttöön lapsipotilailla, joilla on kaksisuuntainen mielialamania (esiintyvyys vähintään 5 % ja ABILIFYn ilmaantuvuus vähintään kaksi kertaa lumelääkkeeseen verrattuna) on esitetty taulukossa 19.
Pediatriset potilaat (6–17-vuotiaat), joilla on autistinen häiriö
Seuraavat havainnot perustuvat kahteen 8 viikkoa kestäneeseen, lumekontrolloituun tutkimukseen, joissa ABILIFY 20 mg suun kautta annettiin annoksina 2–15 mg/vrk.
Hoidon lopettamiseen liittyvät haittavaikutukset
Haittavaikutuksista johtuvien hoidon keskeyttämisen ilmaantuvuus ABILIFY-hoitoa saaneiden ja lumelääkettä saaneiden lapsipotilaiden välillä (6-17 vuotta) oli 10 % ja 8 %.
Yleisesti havaitut haittavaikutukset
Yleisesti havaitut haittavaikutukset, jotka liittyvät ABILIFYn käyttöön lapsipotilailla, joilla on autistinen sairaus (esiintyvyys 5 % tai enemmän ja ABILIFY 10 mg:n ilmaantuvuus vähintään kaksi kertaa lumelääkkeeseen verrattuna) on esitetty taulukossa 20.
Pediatriset potilaat (6–18-vuotiaat), joilla on Touretten häiriö
Seuraavat havainnot perustuvat yhteen 8 viikkoa ja yhteen 10 viikkoa kestäneeseen lumekontrolloituun tutkimukseen, joissa ABILIFY 15 mg suun kautta annettiin annoksina 2–20 mg/vrk.
Hoidon lopettamiseen liittyvät haittavaikutukset
Haittavaikutuksista johtuvien keskeytysten ilmaantuvuus ABILIFY-hoitoa saaneiden ja lumelääkettä saaneiden lapsipotilaiden välillä (6–18 vuotta) oli 7 % ja 1 %.
Yleisesti havaitut haittavaikutukset
Yleisesti havaitut haittavaikutukset, jotka liittyvät ABILIFYn käyttöön Touretten häiriötä sairastavilla lapsipotilailla (ilmaantuvuus vähintään 5 % ja ABILIFY 10 mg:n ilmaantuvuus vähintään kaksi kertaa lumelääkkeeseen verrattuna), on esitetty taulukossa 21.
Harvemmat haittavaikutukset lapsipotilailla (6–18-vuotiaat), joilla on skitsofrenia, kaksisuuntainen mielialamania, autistinen häiriö tai Touretten häiriö
Taulukossa 22 luetellaan akuutin hoidon aikana esiintyneiden haittavaikutusten yhteenlaskettu ilmaantuvuus, pyöristettynä lähimpään prosenttiin (enintään 6 viikkoa skitsofreniassa, enintään 4 viikkoa kaksisuuntaisessa maniassa, enintään 8 viikkoa autistisessa häiriössä ja enintään 10 viikkoa Touretten häiriössä), mukaan lukien vain ne reaktiot, joita esiintyi 2 %:lla tai useammalla ABILIFYllä hoidetuista lapsipotilaista (annokset ≥ 2 mg/vrk) ja joiden ilmaantuvuus ABILIFYllä 10 mg hoidetuilla potilailla oli suurempi kuin ilmaantuvuus potilailla, joita hoidettiin plasebo.
Aikuiset potilaat, jotka saavat ABILIFY-hoitoa vakavan masennushäiriön lisähoitona
Seuraavat havainnot perustuvat kahteen lumekontrolloituun tutkimukseen, joissa oli potilaita, joilla oli vakava masennussairaus ja joissa ABILIFY 20 mg:aa annettiin 2–20 mg:n annoksina lisähoitona jatkuvan masennuslääkehoidon yhteydessä.
Hoidon lopettamiseen liittyvät haittavaikutukset
Haittavaikutuksista johtuvien keskeytysten ilmaantuvuus oli 6 % ABILIFY-lisähoitoa saaneilla potilailla ja 2 % lumelääkettä saaneilla potilailla.
Yleisesti havaitut haittavaikutukset
Yleisesti havaitut haittavaikutukset, jotka liittyvät ABILIFY 15 mg:n lisälääkkeen käyttöön potilailla, joilla on vakava masennushäiriö (esiintyvyys vähintään 5 % ja ABILIFY 15 mg:n ilmaantuvuus vähintään kaksi kertaa lumelääkkeeseen verrattuna), olivat: akatisia, levottomuus, unettomuus, ummetus, väsymys ja näön hämärtyminen.
Harvemmat haittavaikutukset aikuispotilailla, joilla on vakava masennushäiriö
Taulukossa 23 luetellaan akuutin hoidon aikana (enintään 6 viikkoa) esiintyneiden haittavaikutusten yhdistetty ilmaantuvuus, pyöristettynä lähimpään prosenttiin, mukaan lukien vain ne haittavaikutukset, joita esiintyi 2 %:lla tai useammalla ABILIFY-lisähoitoa saaneista potilaista (annos ≥2). mg/vrk) ja joiden ilmaantuvuus ABILIFY 10 mg:n lisäannoksella hoidetuilla potilailla oli suurempi kuin lumelääkettä saaneilla potilailla yhdistetyssä tietoaineistossa.
Potilaat, joilla on skitsofreniaan tai kaksisuuntaiseen mielialaan liittyvää kiihtyneisyyttä (lihaksensisäinen injektio)
Seuraavat havainnot perustuvat kolmeen lumekontrolloituun tutkimukseen potilailla, joilla oli skitsofreniaan tai kaksisuuntaiseen mielialahäiriöön liittyvää kiihtyneisyyttä ja joissa ABILIFY 20 mg:n injektio annettiin 5,25–15 mg:n annoksina.
Yleisesti havaitut haittavaikutukset
Yksi yleisesti havaittu haittavaikutus (pahoinvointi) liittyi ABILIFY 10 mg:n injektion käyttöön potilailla, joilla oli skitsofreniaan ja kaksisuuntaiseen mielialahäiriöön liittyvää kiihtyneisyyttä (ilmaantuvuus 5 % tai suurempi ja ABILIFY 20 mg:n ilmaantuvuus vähintään kaksi kertaa lumelääkkeeseen verrattuna).
Harvemmat haittavaikutukset potilailla, joilla on skitsofreniaan tai kaksisuuntaiseen mielialaan liittyvää levottomuutta
Taulukossa 24 luetellaan akuutin hoidon aikana (24 tuntia) esiintyneiden haittavaikutusten yhdistetty ilmaantuvuus, pyöristettynä lähimpään prosenttiin, mukaan lukien vain ne haittavaikutukset, joita esiintyi vähintään 2 %:lla ABILIFY-injektiolla hoidetuista potilaista (annokset ≥ 5,25 mg) /vrk) ja joiden esiintyvyys ABILIFY 15 mg:n injektiolla hoidetuilla potilailla oli suurempi kuin lumelääkettä saaneilla potilailla yhdistetyssä tietoaineistossa.
Annoksiin liittyvät haittavaikutukset
Skitsofrenia
Annos-vastesuhteita hoidosta aiheutuvien haittatapahtumien esiintyvyyden suhteen arvioitiin neljässä tutkimuksessa aikuisilla skitsofreniapotilailla, joissa verrattiin erilaisia kiinteitä oraalisia ABILIFY-annoksia (2, 5, 10, 15, 20 ja 30 mg/vrk) lumelääkkeeseen. Tämä tutkimuksen mukaan ositettu analyysi osoitti, että ainoa haittavaikutus, jolla oli mahdollinen annos-vastesuhde, ja sitten näkyvin vain 30 mg:lla, oli uneliaisuus [mukaan lukien sedaatio]; (esiintymistiheydet olivat lumelääkettä, 7,1 %; 10 mg, 8,5 %; 15 mg, 8,7 %; 20 mg, 7,5 %; 30 mg, 12,6 %).
Skitsofreniaa sairastavilla lapsipotilailla (13–17-vuotiailla) tehdyssä tutkimuksessa kolme yleistä haittavaikutusta näytti olevan mahdollinen annos-vastesuhde: ekstrapyramidaalinen häiriö (esiintymistiheys oli lumelääke, 5,0 %; 10 mg, 13,0 %; 30 mg, 21,6 %); uneliaisuus (esiintymistiheydet olivat lumelääkettä, 6,0 %; 10 mg, 11,0 %; 30 mg, 21,6 %); ja vapina (esiintymistiheys oli lumelääke, 2,0 %; 10 mg, 2,0 %; 30 mg, 11,8 %).
Kaksisuuntainen mania
Tutkimuksessa lapsipotilailla (10–17-vuotiaat), joilla oli kaksisuuntainen mielialamania, neljällä yleisellä haittavaikutuksella oli mahdollinen annos-vastesuhde 4 viikon kohdalla; ekstrapyramidaalinen häiriö (esiintymistiheys oli lumelääke, 3,1 %; 10 mg, 12,2 %; 30 mg, 27,3 %); uneliaisuus (esiintymistiheys oli lumelääke, 3,1 %; 10 mg, 19,4 %; 30 mg, 26,3 %); akatisia (esiintymistiheys oli lumelääke, 2,1 %; 10 mg, 8,2 %; 30 mg, 11,1 %); ja syljen liikaeritys (esiintymistiheys oli lumelääke, 0 %; 10 mg, 3,1 %; 30 mg, 8,1 %).
Autistinen häiriö
Tutkimuksessa lapsipotilailla (6–17-vuotiaat), joilla oli autistinen sairaus, yhdellä yleisellä haittavaikutuksella oli mahdollinen annos-vastesuhde: väsymys (esiintymistiheydet olivat lumelääkettä, 0 %; 5 mg, 3,8 %; 10 mg, 22,0 %; 15 mg, 18,5 %).
Touretten häiriö
Tutkimuksessa lapsipotilailla (7–17-vuotiaat), joilla oli Touretten sairaus, ei yleisillä haittavaikutuksilla ollut annosvastesuhdetta.
Ekstrapyramidaaliset oireet
Skitsofrenia
Lyhytaikaisissa lumekontrolloiduissa tutkimuksissa aikuisten skitsofreniasta raportoitujen EPS-tapahtumien ilmaantuvuus, lukuun ottamatta akatisiaan liittyviä tapahtumia, ABILIFY-hoitoa saaneilla potilailla oli 13 % vs. 12 % lumelääkettä saaneilla potilailla. ja akatisiaan liittyvien tapahtumien ilmaantuvuus ABILIFYllä hoidetuilla potilailla oli 8 % vs. 4 % lumelääkettä saaneilla potilailla. Lyhytaikaisessa lumekontrolloidussa skitsofreniatutkimuksessa lapsipotilailla (13–17-vuotiaat) raportoitujen EPS-tapahtumien ilmaantuvuus, lukuun ottamatta akatisiaan liittyviä tapahtumia, oli ABILIFY-hoitoa saaneilla potilailla 25 % vs. 7 %. plasebo; ja akatisiaan liittyvien tapahtumien ilmaantuvuus ABILIFYllä hoidetuilla potilailla oli 9 % vs. 6 % lumelääkettä saaneilla potilailla.
Objektiivisesti kerätyt tiedot näistä kokeista kerättiin Simpson Angus Rating Scale -asteikolla (EPS), Barnes Akathisia -asteikolla (akatisialle) ja Assessments of Involuntary Movement Scales (dyskinesioita varten). Aikuisten skitsofreniatutkimuksissa objektiivisesti kerätyt tiedot eivät osoittaneet eroa ABILIFY 10 mg:n ja lumelääkkeen välillä, lukuun ottamatta Barnesin Akathisia-asteikkoa (ABILIFY 20 mg, 0,08; lumelääke -0,05). Lasten (13–17-vuotiaat) skitsofreniatutkimuksessa objektiivisesti kerätyt tiedot eivät osoittaneet eroa ABILIFY 20 mg:n ja lumelääkkeen välillä, lukuun ottamatta Simpson Angus -luokitusasteikkoa (ABILIFY 20 mg, 0,24; lumelääke -0,29).
Vastaavasti pitkäaikaisessa (26 viikkoa) lumekontrolloidussa skitsofreniatutkimuksessa aikuisilla kerättiin objektiivisesti tietoja Simpson Angus -luokitusasteikosta (EPS), Barnes Akathisia -asteikosta (akatisialle) ja Assessments of Involuntary. Liikeasteikot (dyskinesioita varten) eivät osoittaneet eroa ABILIFYn ja lumelääkkeen välillä.
Kaksisuuntainen mania
Lyhytaikaisissa, lumekontrolloiduissa tutkimuksissa kaksisuuntaisen mielialahäiriön maniaa aikuisilla, raportoitujen EPS-tapahtumien ilmaantuvuus, lukuun ottamatta akatisiaan liittyviä tapahtumia, ABILIFY-monoterapiaa saaneilla potilailla oli 16 % vs. 8 % lumelääkettä saaneilla potilailla. akatisiaan liittyviä tapahtumia monoterapiassa ABILIFY-hoitoa saaneilla potilailla oli 13 % vs. 4 % lumelääkettä saaneista potilaista. 6 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa kaksisuuntaisen mielialahäiriön maniasta litium- tai valproaattilisähoidossa raportoitujen EPS-tapahtumien ilmaantuvuus ABILIFY-lisähoitoa saaneiden potilaiden akatisiaan liittyvien tapahtumien ilmaantuvuus oli 15 % vs. 8 % lisähoitoa saaneilla potilailla. lumelääkettä ja akatisiaan liittyvien tapahtumien ilmaantuvuus ABILIFY-lisähoitoa saaneilla potilailla oli 19 % vs. 5 % lumelääkettä saaneilla. Lyhytaikaisessa lumekontrolloidussa tutkimuksessa kaksisuuntaisen mielialahäiriön maniasta lapsipotilailla (10–17-vuotiaat) raportoitujen EPS-tapahtumien ilmaantuvuus ABILIFY-hoitoa saaneilla potilailla, lukuun ottamatta akatisiaan liittyviä tapahtumia, oli 26 % vs. 5 %. lumelääkeryhmässä ja akatisiaan liittyvien tapahtumien ilmaantuvuus ABILIFYllä hoidetuilla potilailla oli 10 % vs. 2 % lumelääkettä saaneilla potilailla.
Aikuisten kaksisuuntaisen mielialahäiriön maniatutkimuksissa ABILIFY-monoterapialla Simpson Angus -luokitusasteikko ja Barnes Akathisia -asteikko osoittivat merkittävän eron ABILIFY 15 mg:n ja lumelääkkeen välillä (ABILIFY, 0,50; lumelääke, -0,01 ja ABILIFY 10 mg, -201,0,0,0,0). Muutokset tahattomien liikkeiden asteikoissa olivat samanlaisia ABILIFY 15 mg:n ja lumelääkeryhmissä. Kaksisuuntaisen mielialahäiriön maniatutkimuksissa, joissa ABILIFY 20 mg lisähoitona joko litiumin tai valproaatin kanssa, Simpson Angus -luokitusasteikko ja Barnes Akathisia -asteikko osoittivat merkittävän eron ABILIFYn lisähoidon ja lumelääkkeen (ABILIFY 20mg, ABILIFY 20mg, 0,0,7,0,0,0,1,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0,0 mg) maniatutkimuksissa. 0,30; lumelääke, 0,11). Muutokset tahdottomien liikkeiden asteikoissa olivat samankaltaisia ABILIFY 20 mg:n lisäannoksen ja lumelääkkeen yhteydessä. Lasten (10–17-vuotiaat) lyhytaikaisessa kaksisuuntaisessa maniatutkimuksessa Simpson Angus Rating Scale osoitti merkittävän eron ABILIFY 10 mg:n ja lumelääkkeen välillä (ABILIFY 15 mg, 0,90; lumelääke -0,05). Barnesin Akathisia-asteikon ja tahattomien liikkeiden asteikon muutokset olivat samanlaisia ABILIFY 20 mg:n ja lumelääkeryhmissä.
Masennustila
Lyhytaikaisissa lumekontrolloiduissa masennushäiriötutkimuksissa raportoitujen EPS-tapahtumien ilmaantuvuus, lukuun ottamatta akatisiaan liittyviä tapahtumia, ABILIFY-lisähoitoa saaneilla potilailla oli 8 % vs. 5 % lumelääkettä saaneilla potilailla. ja akatisiaan liittyvien tapahtumien ilmaantuvuus ABILIFY-lisähoitoa saaneilla potilailla oli 25 % vs. 4 % lumelääkettä saaneilla potilailla.
Suurten masennushäiriöiden tutkimuksissa Simpson Angus -luokitusasteikko ja Barnes Akathisia -asteikko osoittivat merkittävän eron ABILIFY-lisähoidon ja lumelääkkeen (ABILIFY 10 mg, 0,31; lumelääke, 0,03 ja ABILIFY, 0,02; lumelääke) välillä. Muutokset tahdosta riippumattomien liikkeiden asteikoissa olivat samanlaisia ABILIFY- ja lumelääke-lisäryhmissä.
Autistinen häiriö
Lyhytaikaisissa, lumekontrolloiduissa autistisissa lapsipotilailla (6-17-vuotiailla) tehdyissä tutkimuksissa EPS-tapahtumien ilmaantuvuus, lukuun ottamatta akatisiaan liittyviä tapahtumia, oli ABILIFY-hoitoa saaneilla potilailla 18 % vs. 2 %. lumelääkkeellä ja akatisiaan liittyvien tapahtumien ilmaantuvuus ABILIFY-hoitoa saaneilla potilailla oli 3 % vs. 9 % lumelääkettä saaneilla potilailla.
Lasten (6–17-vuotiaat) lyhytaikaisissa autististen häiriöiden tutkimuksissa Simpson Angus -luokitusasteikko osoitti merkittävän eron ABILIFYn ja lumelääkkeen välillä (ABILIFY 20 mg, 0,1; lumelääke -0,4). Barnesin Akathisia-asteikon ja tahattomien liikkeiden asteikkojen muutokset olivat samanlaisia ABILIFY 10 mg:n ja lumelääkeryhmissä.
Touretten häiriö
Lyhytaikaisissa lumekontrolloiduissa Touretten häiriötutkimuksissa lapsipotilailla (6–18-vuotiaat) raportoitujen EPS-tapahtumien ilmaantuvuus ABILIFY-hoitoa saaneilla potilailla, lukuun ottamatta akatisiaan liittyviä tapahtumia, oli 7 % vs. 6 %. lumelääkeryhmässä ja akatisiaan liittyvien tapahtumien ilmaantuvuus ABILIFY-hoitoa saaneilla potilailla oli 4 % vs. 6 % lumelääkettä saaneilla potilailla.
Lasten (6–18-vuotiaat) lyhytaikaisissa Touretten häiriötutkimuksissa muutokset Simpson Angus -luokitusasteikossa, Barnes Akathisia -asteikossa ja Assessments of Involuntary Movement Scale -asteikossa eivät eronneet kliinisesti merkittävästi ABILIFY 15 mg:n ja lumelääkkeen osalta.
Skitsofreniaan tai kaksisuuntaiseen mielialamaniaan liittyvä kiihtymys
Lumekontrolloiduissa tutkimuksissa potilailla, joilla oli skitsofreniaan tai kaksisuuntaiseen mielialahäiriöön liittyvää kiihtyneisyyttä, raportoitujen EPS-tapahtumien ilmaantuvuus, pois lukien akatisiaan liittyvät tapahtumat, oli ABILIFY-hoitoa saaneilla potilailla 2 % vs. 2 % lumelääkettä saaneilla potilailla ja akatisia- ABILIFY-hoitoa saaneilla potilailla oli 2 % vs. 0 % lumelääkettä saaneilla potilailla. Objektiivisesti kerätyt tiedot Simpson Angus Rating Scalesta (EPS) ja Barnes Akathisia Scale (akatiisia) kaikista hoitoryhmistä eivät osoittaneet eroa ABILIFY 10 mg:n ja lumelääkkeen välillä.
Dystonia
Dystonian oireita, pitkittyneitä lihasryhmien epänormaaleja supistuksia, voi esiintyä herkillä henkilöillä muutaman ensimmäisen hoitopäivän aikana. Dystonisia oireita ovat: niskalihasten kouristukset, jotka joskus etenevät kurkun kireyteen, nielemisvaikeudet, hengitysvaikeudet ja/tai kielen ulkoneminen. Vaikka nämä oireet voivat ilmaantua pienillä annoksilla, niitä esiintyy useammin ja voimakkaammin suuren tehon ja suuremmilla ensimmäisen sukupolven psykoosilääkkeiden annoksilla. Miehillä ja nuoremmilla ikäryhmillä havaitaan kohonnut akuutin dystonian riski.
Kliinisissä kokeissa havaittuja lisähavaintoja
Haittavaikutukset pitkäaikaisissa, kaksoissokkoutetuissa, lumekontrolloiduissa kokeissa
Haittavaikutukset, jotka raportoitiin 26 viikkoa kestäneessä kaksoissokkotutkimuksessa, jossa verrattiin oraalista ABILIFY 10 mg:aa ja lumelääkettä skitsofreniapotilailla, olivat yleensä yhdenmukaisia lyhytaikaisissa lumekontrolloiduissa tutkimuksissa raportoitujen haittavaikutusten kanssa, lukuun ottamatta vapinaa [8]. % (12/153) ABILIFY 20 mg:lla vs. 2 % (3/153) lumelääkkeellä]. Tässä tutkimuksessa suurin osa vapinatapauksista oli lievää (8/12 lievää ja 4/12 kohtalaista), esiintyi hoidon alkuvaiheessa (9/12 ≤ 49 päivää) ja kesto oli rajallinen (7/12 ≤). 10 päivää). Vapina johti harvoin (
Muut ABILIFYn markkinointia edeltävän arvioinnin aikana havaitut haittavaikutukset
Seuraavassa luettelossa ei ole mukana reaktioita: 1) jotka on jo lueteltu aiemmissa taulukoissa tai muualla merkinnöissä, 2) joille lääkkeen syy oli etäinen, 3) jotka olivat niin yleisiä, että ne eivät olleet informatiivisia, 4) joilla ei katsottu olevan merkittäviä kliinisiä seurauksia tai 5) joita esiintyi yhtä suurella tai pienemmällä nopeudella kuin lumelääke.
Reaktiot luokitellaan kehon järjestelmän mukaan seuraavien määritelmien mukaisesti: yleisiä haittavaikutuksia ovat ne, joita esiintyy vähintään 1/100 potilaalla; harvinaiset haittavaikutukset ovat niitä, joita esiintyy 1/100 - 1/1000 potilaalla; harvinaiset reaktiot ovat sellaisia, joita esiintyy harvemmalla kuin 1/1000 potilaalla:
Aikuiset - Suun kautta
Veren ja lymfaattisen järjestelmän häiriöt: harvinainen - trombosytopenia
Sydänhäiriöt: harvinainen - bradykardia, sydämentykytys, harvinainen - eteislepatus, sydämen hengityspysähdys, eteiskammiokatkos, eteisvärinä, angina pectoris, sydänlihasiskemia, sydäninfarkti, sydämen keuhkojen vajaatoiminta
Silmäsairaudet: harvoin - valonarkuus; harvinainen - diplopia
Ruoansulatuskanavan häiriöt: harvinainen - gastroesofageaalinen refluksitauti
Yleiset häiriöt ja hallintosivuston ehdot: usein - astenia; harvinainen - perifeerinen turvotus, rintakipu; harvinainen - kasvojen turvotus
Maksan ja sappien häiriöt: harvinainen - hepatiitti, keltaisuus
Immuunijärjestelmän häiriöt : harvinainen - yliherkkyys
Loukkaantumiset, myrkytykset ja toimenpiteeseen liittyvät komplikaatiot: harvinainen - syksy; harvinainen - lämpöhalvaus
Tutkimukset: usein - painon lasku, harvoin - kohonnut maksaentsyymi, kohonnut verensokeri, lisääntynyt veren laktaattidehydrogenaasi, lisääntynyt gammaglutamyylitransferaasi; harvinainen - kohonnut veren prolaktiini, kohonnut veren urea, kohonnut veren kreatiniini, kohonnut veren bilirubiini, pidentynyt elektrokardiogrammissa QT-aika, kohonnut glykosyloitunut hemoglobiini
Aineenvaihdunta- ja ravitsemushäiriöt: usein - anoreksia; harvinainen - hypokalemia, hyponatremia, hypoglykemia
Tuki- ja liikuntaelimistön ja sidekudosten häiriöt: harvinainen - lihasheikkous, lihasten kireys; harvinainen - rabdomyolyysi, liikkuvuuden heikkeneminen
Hermoston häiriöt: harvinainen - parkinsonismi, muistin heikkeneminen, hammaspyörän jäykkyys, hypokinesia, bradykinesia; harvinainen - akinesia, myoklonus, koordinaatiohäiriö, puhehäiriö, Grand Mal -kouristukset;
Psyykkiset häiriöt: harvinainen - aggressio, libidon menetys, delirium; harvinainen - lisääntynyt libido, anorgasmia, tic, murha-ajatukset, katonia, unissakävely
Munuaisten ja virtsateiden häiriöt: harvinainen - virtsanpidätys, nokturia
Lisääntymisjärjestelmän ja rintojen häiriöt: harvinainen - erektiohäiriö; harvinainen - gynekomastia, epäsäännölliset kuukautiset, amenorrea, rintakipu, priapismi
Hengityselinten, rintakehän ja välikarsinan häiriöt: harvinainen - nenän tukkoisuus, hengenahdistus
Ihon ja ihonalaisten kudosten häiriöt: harvinainen - ihottuma, liikahikoilu, kutina, valoherkkyysreaktio, hiustenlähtö; harvinainen - urtikaria
Verisuonihäiriöt: harvinainen - hypotensio, verenpainetauti
Pediatriset potilaat - Suun kautta annettava anto
Useimmat haittatapahtumat, jotka havaittiin yhdistetyssä tietokannassa, jossa oli 1 686 6–18-vuotiasta lapsipotilasta, havaittiin myös aikuisväestössä. Muita lapsipotilailla havaittuja haittavaikutuksia on lueteltu alla.
Silmäsairaudet harvoin - okulogyrinen kriisi
Ruoansulatuskanavan häiriöt: harvinainen - kielen kuivuminen, kielen kouristukset
Tutkimukset: usein - veren insuliini lisääntynyt
Hermoston häiriöt: harvoin - unessa puhuminen
Munuais- ja virtsatiehäiriöt usein - enureesi
Ihon ja ihonalaisten kudosten häiriöt: harvoin - hirsutismi
Aikuiset - Injektio lihakseen
Useimmat haitalliset reaktiot, jotka havaittiin yhdistetyssä tietokannassa, jossa oli 749 ABILIFY-injektiolla hoidettua aikuispotilasta, havaittiin myös aikuisväestössä, jota hoidettiin suun kautta annetulla ABILIFYllä. Muut ABILIFY-injektiopotilailla havaitut haittavaikutukset on lueteltu alla.
Yleiset häiriöt ja hallintosivuston ehdot: ≥1/100 potilasta - pistoskohdan reaktio; ≥1/1000 potilasta ja
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu ABILIFYn hyväksynnän jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoiselta populaatiolta, ei aina ole mahdollista määrittää syy-yhteyttä lääkkeelle altistumiseen: allergisten reaktioiden esiintyminen (anafylaktinen reaktio, angioedeema, kurkunpään kouristus, kutina/urtikaria tai suunielun kouristukset), patologinen pelihimo , hikka ja verensokerin vaihtelu.
HUUMEIDEN VUOROVAIKUTUKSET
Lääkkeet, joilla on kliinisesti tärkeitä yhteisvaikutuksia ABILIFYn kanssa
Lääkkeet, joilla ei ole kliinisesti merkittäviä yhteisvaikutuksia ABILIFYn kanssa
Farmakokineettisten tutkimusten perusteella ABILIFYn annosta ei tarvitse muuttaa, kun sitä annetaan samanaikaisesti famotidiinin, valproaatin, litiumin tai loratsepaamin kanssa.
Lisäksi CYP2D6:n (esim. dekstrometorfaani, fluoksetiini, paroksetiini tai venlafaksiini), CYP2C9:n (esim. varfariini), CYP2C19:n (esim. omepratsoli, varfariini, essitalopraami) tai CYP3A4:n (esim. dekstrometorfaani) substraattien annosta ei tarvitse muuttaa. annettaessa samanaikaisesti ABILIFYn kanssa. Lisäksi valproaatin, litiumin, lamotrigiinin, loratsepaamin tai sertraliinin annostusta ei tarvitse muuttaa, kun niitä annetaan yhdessä ABILIFYn kanssa [ks. KLIININEN FARMAKOLOGIA ].
Huumeiden väärinkäyttö ja riippuvuus
Valvottu aine
ABILIFY ei ole valvottu aine.
Väärinkäyttö
ABILIFY:tä ei ole tutkittu systemaattisesti ihmisillä sen mahdollisen väärinkäytön, sietokyvyn tai fyysisen riippuvuuden suhteen. Tästä syystä potilaat tulee arvioida huolellisesti anamneesissa huumeiden väärinkäytön varalta, ja tällaisia potilaita tulee tarkkailla tarkasti ABILIFY 20 mg:n väärinkäytön merkkien varalta (esim. sietokyvyn kehittyminen, annoksen suurentaminen, huumeiden etsintäkäyttäytyminen).
Riippuvuus
Fyysistä riippuvuutta koskevissa tutkimuksissa apinoilla havaittiin vieroitusoireita, kun annostelu lopetettiin äkillisesti. Vaikka kliiniset tutkimukset eivät paljastaneet minkäänlaista taipumusta huumeiden etsivään käyttäytymiseen, nämä havainnot eivät olleet systemaattisia, eikä tämän rajallisen kokemuksen perusteella ole mahdollista ennustaa, missä määrin keskushermostoon vaikuttavaa lääkettä käytetään väärin tai muualle, ja/tai väärinkäytöksiä sen jälkeen, kun ne on markkinoitu.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Lisääntynyt kuolleisuus iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi
Lisääntynyt kuolleisuus
Iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi ja joita hoidetaan psykoosilääkkeillä, on lisääntynyt kuolemanriski. ABILIFY (aripipratsoli) ei ole hyväksytty potilaiden hoitoon, joilla on dementiaan liittyvä psykoosi (ks. VAROITUS).
Turvallisuuskokemus iäkkäillä potilailla, joilla on Alzheimerin tautiin liittyvä psykoosi
Kolmessa 10 viikkoa kestäneessä lumekontrolloidussa ABILIFY 10 mg:n tutkimuksessa iäkkäillä potilailla, joilla oli Alzheimerin tautiin liittyvä psykoosi (n = 938; keski-ikä: 82,4 vuotta; vaihteluväli: 56-99 vuotta), haittavaikutukset olivat Raportoitu ≥ 3 %:n ja ABILIFY 15 mg:n ilmaantuvuus vähintään kaksi kertaa lumelääkkeeseen verrattuna, olivat uneliaisuus  [plasebo 2 %, ABILIFY 5 %], uneliaisuus (mukaan lukien sedaatio) [plasebo 3 %, ABILIFY 8 %] ja inkontinenssi (pääasiassa , virtsankarkailu) [plasebo 1 %, ABILIFY 5 %], liiallinen syljeneritys [plasebo 0 %, ABILIFY 4 %] ja huimaus [plasebo 1 %, ABILIFY 4 %].
ABILIFY 15 mg:n turvallisuutta ja tehoa dementiaan liittyvän psykoosin hoidossa ei ole varmistettu. Jos lääkäri päättää hoitaa tällaisia potilaita ABILIFY 15 mg:lla, arvioi nielemisvaikeuksien tai liiallisen uneliaisuuden ilmaantuminen, mikä voi altistaa vahingossa tapahtuvalle loukkaantumiselle tai aspiraatiolle [ks. LAATIKKO VAROITUS ].
Aivoverenkierron haittatapahtumat, mukaan lukien aivohalvaus
Dementiaan liittyvän psykoosin lumekontrolloiduissa kliinisissä tutkimuksissa (kahden joustavan annoksen ja yhden kiinteän annoksen tutkimus) ABILIFY-hoitoa saaneilla potilailla lisääntyi aivoverenkierron haittavaikutusten (esim. aivohalvaus, ohimenevä iskeeminen kohtaus), mukaan lukien kuolemantapaukset. keski-ikä: 84 vuotta; vaihteluväli: 78-88 vuotta). Kiinteän annoksen tutkimuksessa ABILIFYllä hoidetuilla potilailla oli tilastollisesti merkitsevä annos-vastesuhde aivoverenkierron haittavaikutuksiin. ABILIFYä ei ole hyväksytty dementiaan liittyvän psykoosin potilaiden hoitoon [katso LAATIKKO VAROITUS ].
Itsemurha-ajatukset ja -käyttäytyminen lapsilla, nuorilla ja nuorilla aikuisilla
Potilaat, joilla on vaikea masennushäiriö (MDD), sekä aikuisilla että lapsilla, voivat kokea masennuksensa pahenemista ja/tai itsemurha-ajatuksia ja -käyttäytymisen ilmaantumista (itsemurha-ajatuksia) tai epätavallisia muutoksia käyttäytymisessä riippumatta siitä, käyttävätkö he masennuslääkkeitä vai eivät, ja tämä riski voi jatkua, kunnes merkittävä remissio tapahtuu. Itsemurha on tunnettu masennuksen ja tiettyjen muiden psykiatristen häiriöiden riski, ja nämä häiriöt itsessään ovat vahvimpia itsemurhan ennustajia. Pitkään on kuitenkin ollut huolta siitä, että masennuslääkkeillä voi olla rooli masennuksen pahenemisessa ja itsetuhoisuuden syntymisessä tietyillä potilailla hoidon alkuvaiheessa. Lyhytaikaisten, lumekontrolloitujen masennuslääkkeiden (SSRI-lääkkeiden ja muiden) kokeiden yhdistetyt analyysit osoittivat, että nämä lääkkeet lisäävät itsemurha-ajattelun ja -käyttäytymisen (itsemurha-ajattelun) riskiä lapsilla, nuorilla ja nuorilla aikuisilla (18–24-vuotiaat), joilla on MDD. ja muut psykiatriset häiriöt. Lyhytaikaiset tutkimukset eivät osoittaneet lisääntynyttä itsemurhariskiä masennuslääkkeillä lumelääkkeeseen verrattuna yli 24-vuotiailla aikuisilla; 65-vuotiailla ja sitä vanhemmilla aikuisilla masennuslääkkeet vähenivät lumelääkkeeseen verrattuna.
Plasebokontrolloitujen tutkimusten yhdistetyt analyysit lapsilla ja nuorilla, joilla oli MDD, pakko-oireinen häiriö (OCD) tai muita psykiatrisia häiriöitä, sisälsivät yhteensä 24 lyhytaikaista tutkimusta 9 masennuslääkkeellä yli 4400 potilaalla. Plasebokontrolloitujen tutkimusten yhdistetyt analyysit aikuisilla, joilla oli MDD tai muita psykiatrisia häiriöitä, sisälsivät yhteensä 295 lyhytaikaista tutkimusta (mediaanikesto 2 kuukautta), joissa oli 11 masennuslääkettä yli 77 000 potilaalla. Itsemurhariskissä oli huomattavaa vaihtelua lääkkeiden välillä, mutta taipumus nuorempien potilaiden lisääntymiseen lähes kaikkien tutkittujen lääkkeiden kohdalla. Absoluuttisessa itsemurhariskissä oli eroja eri indikaatioiden välillä, ja suurin ilmaantuvuus MDD:ssä. Riskierot (lääke vs. lumelääke) olivat kuitenkin suhteellisen vakaita ikäryhmien sisällä ja eri käyttöaiheissa. Nämä riskierot (lääkkeen ja lumelääkkeen ero itsemurhatapausten määrässä 1000 hoidettua potilasta kohti) on esitetty taulukossa 5.
Yhtään itsemurhaa ei tapahtunut missään lapsitutkimuksessa. Aikuisten kokeissa oli itsemurhia, mutta määrä ei riittänyt päättämään lääkkeiden vaikutuksesta itsemurhaan.
Ei tiedetä, ulottuuko itsemurhariski pitkäaikaiseen käyttöön eli useiden kuukausien jälkeiseen käyttöön. Lumekontrolloiduista ylläpitotutkimuksista aikuisilla, joilla on masennus, on kuitenkin huomattavaa näyttöä siitä, että masennuslääkkeiden käyttö voi viivyttää masennuksen uusiutumista.
Kaikkia potilaita, joita hoidetaan masennuslääkkeillä missä tahansa indikaatiossa, on seurattava asianmukaisesti ja tarkkailtava tarkasti kliinisen pahenemisen, itsemurha-ajattelun ja epätavallisten käyttäytymismuutosten varalta, erityisesti lääkehoidon ensimmäisten kuukausien aikana tai annosta muutettaessa, joko annosta suurennetaan. tai pienenee.
Seuraavia oireita, ahdistusta, kiihtyneisyyttä, paniikkikohtauksia, unettomuutta, ärtyneisyyttä, vihamielisyyttä, aggressiivisuutta, impulsiivisuutta, akatisiaa (psykomotorista levottomuutta), hypomaniaa ja maniaa on raportoitu aikuisilla ja lapsipotilailla, joita on hoidettu masennuslääkkeillä MDD:n ja muut indikaatiot, sekä psykiatriset että ei-psykiatriset. Vaikka syy-yhteyttä tällaisten oireiden ilmaantumisen ja joko masennuksen pahenemisen ja/tai itsetuhoisten impulssien ilmaantumisen välillä ei ole osoitettu, on huolestuttavaa, että tällaiset oireet voivat olla syntyvän itsetuhoisuuden esiaste.
Hoito-ohjelman muuttamista, mukaan lukien lääkityksen mahdollista lopettamista, tulee harkita potilailla, joiden masennus pahenee jatkuvasti tai joilla on ilmennyt itsemurha tai oireita, jotka saattavat olla masennuksen tai itsemurha-ajatuksen pahenemisen edeltäjä, varsinkin jos nämä oireet ovat vakavia, äkillisiä. oireiden alkaessa tai eivät olleet osa potilaan oireita.
Masennuslääkkeillä vakavan masennushäiriön tai muiden, sekä psykiatristen että ei-psykiatristen oireiden vuoksi hoidettavien potilaiden perheitä ja hoitajia tulee varoittaa tarpeesta seurata potilaita kiihtyneisyyden, ärtyneisyyden, epätavallisten käyttäytymismuutosten ja muiden edellä kuvattujen oireiden ilmaantumisen varalta. , sekä itsemurha-ajatuksen ilmaantumista, ja ilmoittamaan tällaisista oireista välittömästi terveydenhuollon tarjoajille. Tällaiseen seurantaan tulisi sisältyä perheiden ja omaishoitajien päivittäinen tarkkailu. Yliannostusriskin vähentämiseksi ABILIFY-resepti tulee kirjoittaa pienimmälle tablettimäärälle hyvän potilashoidon mukaisesti.
Potilaiden seulonta kaksisuuntaisen mielialahäiriön varalta
Vakava masennusjakso voi olla kaksisuuntaisen mielialahäiriön ensimmäinen ilmentymä. Yleisesti uskotaan (vaikkakaan sitä ei ole vahvistettu kontrolloiduissa tutkimuksissa), että tällaisen episodin hoito pelkällä masennuslääkkeellä voi lisätä seka-/maanisen vaiheen esiintymisen todennäköisyyttä potilailla, joilla on kaksisuuntaisen mielialahäiriön riski. Ei tiedetä, edustavatko mikään yllä kuvatuista oireista tällaista muutosta. Ennen masennuslääkehoidon aloittamista masennusoireista kärsivät potilaat tulee kuitenkin seuloa riittävästi sen määrittämiseksi, onko heillä kaksisuuntaisen mielialahäiriön riski; Tällaiseen seulontaan tulee sisältyä yksityiskohtainen psykiatrinen historia, mukaan lukien suvussa itsemurhaa, kaksisuuntaista mielialahäiriötä ja masennusta esiintynyt historia.
On huomattava, että ABILIFY 20 mg:aa ei ole hyväksytty käytettäväksi lasten masennuksen hoitoon.
Maligni neuroleptinen oireyhtymä (NMS)
Mahdollisesti kuolemaan johtava oireyhtymä, jota joskus kutsutaan pahanlaatuiseksi neuroleptioireyhtymäksi (NMS), saattaa ilmetä psykoosilääkkeiden, mukaan lukien ABILIFYn, käytön yhteydessä. Maailmanlaajuisessa kliinisessä tietokannassa esiintyi harvinaisia NMS-tapauksia ABILIFY 15 mg -hoidon aikana. NMS:n kliinisiä oireita ovat hyperpyreksia, lihasjäykkyys, muuttunut henkinen tila ja todisteet autonomisesta epävakaudesta (epäsäännöllinen pulssi tai verenpaine, takykardia, hikoilu ja sydämen rytmihäiriö). Muita oireita voivat olla kohonnut kreatiinifosfokinaasi, myoglobinuria (rabdomyolyysi) ja akuutti munuaisten vajaatoiminta.
Tätä oireyhtymää sairastavien potilaiden diagnostinen arviointi on monimutkaista. Diagnoosia tehtäessä on tärkeää sulkea pois tapaukset, joissa kliininen kuva sisältää sekä vakavan sairauden (esim. keuhkokuume, systeeminen infektio) että hoitamattomia tai riittämättömästi hoidettuja ekstrapyramidaalisia merkkejä ja oireita (EPS). Muita tärkeitä näkökohtia erotusdiagnoosissa ovat keskushermoston antikolinerginen toksisuus, lämpöhalvaus, lääkekuume ja primaarinen keskushermoston patologia.
NMS-taudin hoitoon tulisi kuulua: 1) psykoosilääkkeiden ja muiden samanaikaisen hoidon kannalta välttämättömien lääkkeiden välitön lopettaminen; 2) intensiivinen oireenmukainen hoito ja lääketieteellinen seuranta; ja 3) kaikkien samanaikaisten vakavien lääketieteellisten ongelmien hoito, joihin on saatavilla erityisiä hoitoja. Ei ole olemassa yleistä yksimielisyyttä komplisoitumattoman NMS:n erityisistä farmakologisista hoito-ohjelmista.
Jos potilas tarvitsee psykoosilääkehoitoa NMS:stä toipumisen jälkeen, lääkehoidon mahdollista uudelleen aloittamista tulee harkita huolellisesti. Potilasta on seurattava huolellisesti, koska NMS-taudin uusiutumista on raportoitu.
Tardiivi dyskinesia
Mahdollisesti irreversiibelien, tahattomien, dyskineettisten liikkeiden oireyhtymä voi kehittyä potilailla, joita hoidetaan psykoosilääkkeillä. Vaikka oireyhtymän esiintyvyys näyttää olevan korkein vanhuksilla, erityisesti iäkkäillä naisilla, on mahdotonta luottaa esiintyvyysarvioihin sen ennustamiseksi antipsykoottisen hoidon alussa, ketkä potilaat todennäköisesti saavat oireyhtymän. Ei tiedetä, eroavatko psykoosilääkkeet tardiivista dyskinesiasta.
Tardiivin dyskinesian kehittymisen riskin ja todennäköisyyden, että se muuttuu peruuttamattomaksi, uskotaan kasvavan hoidon keston ja potilaalle annettavien psykoosilääkkeiden kumulatiivisen kokonaisannoksen kasvaessa. Oireyhtymä voi kuitenkin kehittyä, vaikkakin paljon harvemmin, suhteellisen lyhyiden hoitojaksojen jälkeen pienillä annoksilla.
Tardiivi dyskinesia voi lievittyä osittain tai kokonaan, jos antipsykoottinen hoito lopetetaan. Antipsykoottinen hoito itsessään voi kuitenkin tukahduttaa (tai osittain tukahduttaa) oireyhtymän merkkejä ja oireita ja siten mahdollisesti peittää taustalla olevan prosessin. Oireisen suppression vaikutusta oireyhtymän pitkäaikaiseen kulumiseen ei tunneta.
Nämä näkökohdat huomioon ottaen ABILIFY tulee määrätä tavalla, joka todennäköisimmin minimoi tardiivin dyskinesian esiintymisen. Krooninen antipsykoottinen hoito tulee yleensä varata potilaille, jotka kärsivät kroonisesta sairaudesta, jonka (1) tiedetään reagoivan psykoosilääkkeisiin ja (2) joille ei ole saatavilla tai sopivia vaihtoehtoisia, yhtä tehokkaita mutta mahdollisesti vähemmän haitallisia hoitoja. Potilailla, jotka tarvitsevat kroonista hoitoa, tulee pyrkiä pienintä annosta ja lyhyintä hoidon kestoa, joka tuottaa tyydyttävän kliinisen vasteen. Hoidon jatkamisen tarvetta tulee arvioida uudelleen säännöllisesti.
Jos ABILIFY-potilaalla ilmenee tardiivin dyskinesian merkkejä ja oireita, lääkkeen käytön lopettamista tulee harkita. Jotkut potilaat saattavat kuitenkin tarvita ABILIFY 15 mg -hoitoa oireyhtymästä huolimatta.
Metaboliset muutokset
Epätyypillisiin psykoosilääkkeisiin on liitetty aineenvaihdunnan muutoksia, joita ovat hyperglykemia/diabetes mellitus, dyslipidemia ja painonnousu. Vaikka kaikkien luokan lääkkeiden on osoitettu aiheuttavan joitain metabolisia muutoksia, jokaisella lääkkeellä on oma erityinen riskiprofiilinsa.
Hyperglykemia/Diabetes mellitus
Hyperglykemiaa, joka on joissain tapauksissa äärimmäistä ja joka liittyy ketoasidoosiin tai hyperosmolaariseen koomaan tai kuolemaan, on raportoitu potilailla, joita on hoidettu epätyypillisillä psykoosilääkkeillä. ABILIFYllä hoidetuilla potilailla on raportoitu hyperglykemiaa [katso HAITTAVAIKUTUKSET ]. Epätyypillisen psykoosilääkkeiden käytön ja glukoosipoikkeavuuksien välisen suhteen arviointia vaikeuttaa skitsofreniapotilaiden lisääntynyt diabeteksen taustariski ja yleisväestössä lisääntynyt diabetes mellituksen esiintyvyys. Näiden sekaannusten vuoksi epätyypillisen psykoosilääkkeen käytön ja hyperglykemiaan liittyvien haittatapahtumien välistä suhdetta ei täysin ymmärretä. Epidemiologiset tutkimukset viittaavat kuitenkin hyperglykemiaan liittyvien haittavaikutusten lisääntyneeseen riskiin potilailla, joita hoidetaan epätyypillisillä psykoosilääkkeillä. Koska ABILIFY:tä ei ollut myynnissä näiden tutkimusten suorittamisajankohtana, ei tiedetä, liittyykö ABILIFYyn tämä lisääntynyt riski. Tarkkoja riskiarvioita hyperglykemiaan liittyvistä haittavaikutuksista potilailla, joita hoidetaan epätyypillisillä psykoosilääkkeillä, ei ole saatavilla.
Potilaita, joilla on todettu diabetes mellitus ja jotka aloittavat atyyppisten psykoosilääkkeiden käytön, tulee seurata säännöllisesti glukoositasapainon heikkenemisen varalta. Potilaille, joilla on diabetes mellituksen riskitekijöitä (esim. liikalihavuus, diabetes suvussa), jotka aloittavat hoidon atyyppisillä psykoosilääkkeillä, tulee tehdä paastoverensokerimittaus hoidon alussa ja määräajoin hoidon aikana. Potilaita, joita hoidetaan epätyypillisillä psykoosilääkkeillä, tulee seurata hyperglykemian oireiden varalta, mukaan lukien polydipsia, polyuria, polyfagia ja heikkous. Potilaille, joille kehittyy hyperglykemian oireita atyyppisten psykoosilääkkeiden käytön aikana, on tehtävä paastoverensokerimittaus. Joissakin tapauksissa hyperglykemia on parantunut, kun epätyypillinen antipsykootti on lopetettu; Jotkut potilaat kuitenkin tarvitsivat diabeteslääkityksen jatkamista huolimatta epäillyn lääkkeen käytön lopettamisesta.
Aikuiset
Analyysissa 13 lumekontrolloidusta monoterapiatutkimuksesta aikuisilla, joilla oli pääasiassa skitsofrenia tai kaksisuuntainen mielialahäiriö, keskimääräinen muutos paastoglukoosissa ABILIFYllä hoidetuilla potilailla (+4,4 mg/dl; mediaanialtistus 25 päivää; N=1057) ei ollut merkitsevästi. erilainen kuin lumelääkettä saaneilla potilailla (+2,5 mg/dl; mediaanialtistus 22 päivää; N=799). Taulukossa 6 esitetään niiden ABILIFY-hoitoa saaneiden potilaiden osuus, joiden paastoglukoosipitoisuus oli normaali ja raja-arvo lähtötilanteessa (mediaanialtistus 25 päivää), joilla oli hoidon aikana korkea paastoglukoosiarvo verrattuna lumelääkettä saaneisiin potilaisiin (mediaanialtistus 22 päivää).
Viikon 24 kohdalla ABILIFY-hoitoa saaneiden potilaiden paastoglukoosin keskimääräinen muutos ei ollut merkitsevästi erilainen kuin lumelääkettä saaneilla potilailla [+2,2 mg/dl (n=42) ja +9,6 mg/dl (n=28), vastaavasti] .
Paastoglukoosin keskimääräinen muutos ABILIFY-hoitoa saaneilla potilailla, joilla oli vakava masennus (+0,7 mg/dl; mediaanialtistus 42 päivää; N = 241) ei ollut merkitsevästi erilainen kuin lumelääkettä saaneilla potilailla (+0,8 mg/dl; mediaani). altistuminen 42 päivää; N = 246). Taulukko 7 osoittaa niiden aikuisten potilaiden osuuden, joiden paastoglukoositasot ovat muuttuneet kahdesta lumekontrolloidusta lisätutkimuksesta (mediaanialtistus 42 päivää) potilailla, joilla on vakava masennushäiriö.
Lapsipotilaat ja nuoret
Kahden lumekontrolloidun tutkimuksen analyysissä skitsofreniaa sairastavilla nuorilla (13-17-vuotiaat) ja kaksisuuntaisen mielialahäiriön (10-17-vuotiaat) lapsipotilailla paastoglukoosin keskimääräinen muutos ABILIFY-hoitoa saaneilla potilailla (+4,8 mg/dl; joiden mediaanialtistus oli 43 päivää; N=259) ei ollut merkitsevästi erilainen kuin lumelääkettä saaneilla potilailla (+1,7 mg/dl; mediaanialtistus 42 päivää; N=123).
Kahden lumekontrolloidun tutkimuksen analyysissä lapsi- ja nuorisopotilailla, joilla oli autistiseen häiriöön liittyvää ärtyneisyyttä (6–17 vuotta), joiden keskimääräinen altistus oli 56 päivää, keskimääräinen muutos paastoglukoosissa ABILIFY-hoitoa saaneilla potilailla (-0,2 mg) /dl; N=83) ei ollut merkitsevästi erilainen kuin lumelääkettä saaneilla potilailla (–0,6 mg/dl; N=33).
Kahden lumekontrolloidun tutkimuksen analyysissä lapsi- ja nuorilla potilailla, joilla oli Touretten sairaus (6-18 vuotta), joiden mediaanialtistus oli 57 päivää, keskimääräinen muutos paastoglukoosissa ABILIFY-hoitoa saaneilla potilailla (0,79 mg/dl; N=90) ei ollut merkitsevästi erilainen kuin lumelääkettä saaneilla potilailla (–1,66 mg/dl; N=58).
Taulukko 8 esittää niiden potilaiden osuuden, joiden paastoglukoosipitoisuudet muuttivat nuorten skitsofreniaa ja kaksisuuntaista mielialahäiriötä sairastavia lapsipotilaita (mediaanialtistus 42–43 päivää), kahdesta lumekontrolloidusta tutkimuksesta lapsipotilailla (6–17-vuotiaat), joihin liittyi ärtyneisyyttä. autistisen häiriön (mediaanialtistus 56 päivää) ja kahdesta lumekontrolloidusta tutkimuksesta lapsipotilailla (6-18 vuotta), joilla oli Touretten häiriö (mediaanialtistus 57 päivää).
Nuorten skitsofreniaa ja lasten kaksisuuntaista mielialahäiriötä koskevissa yhdistetyissä tutkimuksissa 12 viikon kohdalla keskimääräinen muutos paastoglukoosissa ABILIFY-hoitoa saaneilla potilailla ei ollut merkitsevästi erilainen kuin lumelääkettä saaneilla potilailla [+2,4 mg/dl (n = 81) ja +0,1 mg /dL (n = 15), vastaavasti].
Dyslipidemia
Ei-toivottuja lipidien muutoksia on havaittu potilailla, joita on hoidettu epätyypillisillä psykoosilääkkeillä.
ABILIFY- ja lumelääkettä saaneiden potilaiden välillä ei havaittu merkittäviä eroja paasto-/ei-paasto-kolesterolin, paastotriglyseridien, paasto-LDL- ja paasto-/ei-paasto-HDL-arvojen muuttuessa normaalista kliinisesti merkitsevään tasoon. Vähintään 12 tai 24 viikkoa altistuneiden potilaiden analyyseja rajoitti pieni määrä potilaita.
Aikuiset
Taulukossa 9 esitetään niiden aikuisten potilaiden osuus, jotka ovat peräisin pääasiassa yhdistetyistä skitsofrenian ja kaksisuuntaisen mielialahäiriön monoterapiatutkimuksista, plasebokontrolloiduista tutkimuksista, joiden kokonaiskolesteroli (yhdistetty 17 tutkimuksesta; mediaanialtistus 21–25 päivää), triglyseridien paasto (yhdistetty kahdeksasta tutkimuksesta; mediaani) altistus 42 päivää), paasto-LDL-kolesteroli (yhdistetty kahdeksasta tutkimuksesta; mediaanialtistus 39–45 päivää, paitsi lumelääkehoitoa saaneet potilaat, joilla oli lähtötilanteen normaali paasto-LDL-mittaus ja joiden keskimääräinen hoitoaltistus oli 24 päivää) ja HDL-kolesteroli (yhdistetty yhdeksästä tutkimuksesta) kokeet; mediaanialtistus 40–42 päivää).
Aikuisilla tehdyissä monoterapiatutkimuksissa niiden potilaiden osuus 12 viikon ja 24 viikon kohdalla, joiden kokonaiskolesteroli (paasto/ei-paasto), triglyseridien ja paasto-LDL-kolesterolin määrä muuttui normaalista korkeaan, oli samanlainen ABILIFY- ja lumelääkettä saaneiden potilaiden välillä: klo. 12 viikkoa, kokonaiskolesteroli (paasto/ei-paasto), 1/71 (1,4 %) vs. 3/74 (4,1 %); Paastotriglyseridit, 8/62 (12,9 %) vs. 5/37 (13,5 %); Paasto-LDL-kolesteroli, 0/34 (0 %) vs. 1/25 (4,0 %), vastaavasti; ja viikolla 24 kokonaiskolesteroli (paasto/ei-paasto), 1/42 (2,4 %) vs. 3/37 (8,1 %); Paastotriglyseridit, 5/34 (14,7 %) vs. 5/20 (25 %); Paaston LDL-kolesteroli, 0/22 (0 %) vs. 1/18 (5,6 %), vastaavasti.
Taulukko 10 osoittaa niiden potilaiden osuuden, joilla oli muutoksia kokonaiskolesterolissa (paasto/ei-paasto), paastotriglyseridit, paasto-LDL-kolesteroli ja HDL-kolesteroli kahdesta lumekontrolloidusta lisätutkimuksesta aikuispotilailla, joilla on vakava masennushäiriö (mediaanialtistus 42 päivää).
Lapsipotilaat ja nuoret
Taulukossa 11 on esitetty skitsofreniaa sairastavien nuorten (13-17-vuotiaiden) ja kaksisuuntaisen mielialahäiriön (10-17-vuotiaiden) lapsipotilaiden osuus kokonaiskolesterolin ja HDL-kolesterolin muutoksista (yhdistetty kahdesta lumekontrolloidusta tutkimuksesta; altistuksen mediaani 42-43 päivää ) ja paastotriglyseridit (yhdistetty kahdesta lumekontrolloidusta tutkimuksesta; altistuksen mediaani 42–44 päivää).
Skitsofreniaa sairastavilla nuorilla ja kaksisuuntaisen mielialahäiriön lapsipotilailla tehdyissä monoterapiatutkimuksissa niiden potilaiden osuus 12 viikon ja 24 viikon kohdalla, joiden kokonaiskolesteroli (paasto/ei-paasto), paastotriglyseridit ja paasto-LDL-kolesteroli olivat muuttuneet normaalista korkeaan, oli samanlainen ABILIFYn välillä. - ja lumelääkettä saaneet potilaat: 12 viikon kohdalla kokonaiskolesteroli (paasto/ei-paasto), 0/57 Â (0 %) vs. 0/15 (0 %); Paastotriglyseridit, 2/72 (2,8 %) vs. 1/14 (7,1 %), vastaavasti; ja viikolla 24 kokonaiskolesteroli (paasto/ei-paasto), 0/36 (0 %) vs. 0/12 (0 %); Paastotriglyseridit, 1/47 (2,1 %) vs. 1/10 (10,0 %).
Taulukossa 12 on esitetty niiden potilaiden osuus, joilla oli muutoksia kokonaiskolesteroliarvoissa (paasto/ei-paasto) ja paastotriglyseridit (mediaanialtistus 56 päivää) ja HDL-kolesteroli (mediaanialtistus 55–56 päivää) kahdessa lumekontrolloidussa lapsipotilailla tehdyssä tutkimuksessa (6–17). vuotta) ja autistiseen häiriöön liittyvää ärtyneisyyttä.
Taulukossa 13 on esitetty niiden potilaiden osuus, joilla oli muutoksia kokonaiskolesteroliarvoissa (paasto/ei-paasto) ja paastotriglyseridit (mediaanialtistus 57 päivää) ja HDL-kolesteroli (mediaanialtistus 57 päivää) kahdesta lumekontrolloidusta tutkimuksesta lapsipotilailla (6–18 vuotta). Touretten häiriön kanssa.
Painonnousu
Painonnousua on havaittu epätyypillisen antipsykoottisen käytön yhteydessä. Painon kliinistä seurantaa suositellaan.
Aikuiset
Analyysissa 13 lumekontrolloidusta monoterapiatutkimuksesta, jotka koskivat pääasiassa yhdistettyä skitsofreniaa ja kaksisuuntaista mielialahäiriötä ja joiden mediaanialtistus oli 21–25 päivää, keskimääräinen painonmuutos ABILIFYllä hoidetuilla potilailla oli +0,3 kg (N=1673) verrattuna. 0,1 kg (N=1100) lumekontrolloiduilla potilailla. Viikon 24 kohdalla keskimääräinen ruumiinpainon muutos lähtötasosta ABILIFY-hoitoa saaneilla potilailla oli –1,5 kg (n=73) verrattuna –0,2 kg:aan (n=46) lumelääkettä saaneilla potilailla.
Kokeissa, joissa ABILIFY lisättiin masennuslääkkeisiin, potilaat saivat ensin 8 viikon masennuslääkehoitoa, minkä jälkeen 6 viikon lisähoitoa ABILIFY 10 mg tai lumelääkettä jatkuvan masennuslääkehoidon lisäksi. Keskimääräinen ruumiinpainon muutos ABILIFY-lisähoitoa saaneilla potilailla oli +1,7 kg (N=347) verrattuna +0,4 kg:aan (N=330) lumelääkettä saaneilla potilailla.
Taulukossa 14 esitetään niiden aikuisten potilaiden prosenttiosuus, joiden painonnousu on ≥ 7 % ruumiinpainosta indikaatioittain.
Lapsipotilaat ja nuoret
Analyysissa kahdesta lumekontrolloidusta tutkimuksesta skitsofreniaa sairastavilla nuorilla (13-17-vuotiaat) ja lapsipotilailla, joilla on kaksisuuntainen mielialahäiriö (10-17-vuotiaat), joiden keskimääräinen altistus oli 42-43 päivää, keskimääräinen painonmuutos ABILIFY-hoitoa saaneilla potilailla. potilaiden paino oli +1,6 kg (N=381) verrattuna +0,3 kg:aan (N=187) lumelääkettä saaneilla potilailla. Viikon 24 kohdalla ruumiinpainon keskimääräinen muutos lähtötasosta
ABILIFY-hoitoa saaneiden potilaiden paino oli +5,8 kg (n=62) verrattuna +1,4 kg:aan (n=13) lumelääkettä saaneilla potilailla.
Kahdessa lyhytaikaisessa lumekontrolloidussa tutkimuksessa potilailla (6-17 vuotta), joilla oli autistiseen häiriöön liittyvää ärtyneisyyttä ja joiden mediaanialtistus oli 56 päivää, keskimääräinen painonmuutos ABILIFY-hoitoa saaneilla potilailla oli +1,6 kg (n=209). ) verrattuna +0,4 kg:aan (n=98) lumelääkettä saaneilla potilailla.
Kahdessa lyhytaikaisessa lumekontrolloidussa tutkimuksessa potilailla (6-18 vuotta), joilla oli Touretten sairaus ja joiden mediaanialtistus oli 57 päivää, keskimääräinen painonmuutos ABILIFY-hoitoa saaneilla potilailla oli +1,5 kg (n = 105). ) verrattuna +0,4 kg:aan (n=66) lumelääkettä saaneilla potilailla.
Taulukossa 15 esitetään niiden lapsi- ja nuorisopotilaiden prosenttiosuus, joiden paino on noussut ≥ 7 % painosta käyttöaiheittain.
Avoimessa tutkimuksessa, johon otettiin potilaita kahdesta lumekontrolloidusta tutkimuksesta, joissa osallistui skitsofreniaa sairastavia nuoria (13–17-vuotiaita) ja lapsipotilaita, joilla oli kaksisuuntainen mielialahäiriö (10–17 vuotta), 73,2 % potilaista (238/325) suoritti 26. viikon ABILIFY-hoitoa. 26 viikon jälkeen 32,8 % potilaista nousi ≥ 7 % painostaan ilman normaalia kasvua. Normaalin kasvun mukauttamiseksi johdettiin z-pisteet (mitattu standardipoikkeamilla [SD]), jotka normalisoivat lapsipotilaiden ja nuorten luonnollisen kasvun vertaamalla iän ja sukupuolen mukaisiin populaatiostandardeihin. Z-pisteen muutosta
Avoimessa tutkimuksessa, johon osallistui potilaita kahdesta lyhytaikaisesta, lumekontrolloidusta tutkimuksesta, potilaita (6–17 vuotta), joilla oli autistiseen häiriöön liittyvää ärtyneisyyttä, sekä de novo -potilaita, 60,3 % (199/330) suoritti yhden tutkimuksen. vuoden ABILIFY-hoitoa. Painon z-pistemäärän keskimääräinen muutos oli 0,26 SDs potilailla, jotka saivat yli 9 kuukauden hoitoa.
Kun lapsipotilaita hoidetaan missä tahansa indikaatiossa, painonnousua on seurattava ja arvioitava verrattuna normaaliin kasvuun.
Patologinen pelaaminen ja muut pakko-oireiset käytökset
Markkinoille tulon jälkeiset tapausraportit viittaavat siihen, että potilaat voivat kokea voimakkaita haluja, erityisesti uhkapelaamista, ja kyvyttömyyttä hallita näitä haluja aripipratsolihoidon aikana. Muita harvemmin raportoituja pakko-oireita ovat seksuaaliset halut, ostokset, syöminen tai ahmiminen ja muut impulsiiviset tai pakko-oireiset käytökset. Koska potilaat eivät välttämättä tunnista näitä käyttäytymismalleja epänormaaliksi, on tärkeää, että lääkärit kysyvät potilailta tai heidän hoitajilta erityisesti uusien tai voimakkaiden pelihimojen, pakko-elämän seksuaalisten halujen, pakko-ostosten, ahmimis- tai pakko-oireisen syömisen tai muiden halujen kehittymisestä hoidon aikana. aripipratsolin kanssa. On huomattava, että impulssihallintaoireet voivat liittyä taustalla olevaan häiriöön. Joissakin tapauksissa, vaikkakaan ei kaikissa, halujen ilmoitettiin loppuneen, kun annosta pienennettiin tai lääkitys lopetettiin. Pakonomaiset käytökset voivat aiheuttaa vahinkoa potilaalle ja muille, jos niitä ei tunnisteta. Harkitse annoksen pienentämistä tai lääkityksen lopettamista, jos potilaalle tulee tällaisia haluja.
Ortostaattinen hypotensio
ABILIFY 20 mg voi aiheuttaa ortostaattista hypotensiota, mahdollisesti sen α1-adrenergisten reseptorien antagonismin vuoksi. Ortostaattiseen hypotensioon liittyvien tapahtumien ilmaantuvuus lyhytaikaisissa, lumekontrolloiduissa tutkimuksissa aikuispotilailla, jotka saivat ABILIFYä suun kautta (n = 2467), sisälsivät (ABILIFY 20 mg:n ilmaantuvuus, lumelääkettä) ortostaattinen hypotensio (1 %, 0,3 %), asentohuimaus ( 0,5 %, 0,3 % ja pyörtyminen (0,5 %, 0,4 %); 6–18-vuotiaista lapsipotilaista (n=732), jotka saivat suun kautta ABILIFYä, olivat ortostaattinen hypotensio (0,5 %, 0 %), asentohuimaus (0,4 %, 0 %) ja pyörtyminen (0,2 %, 0 %); ja ABILIFY-injektiota saaneista potilaista (n=501) esiintyi ortostaattista hypotensiota (0,6 %, 0 %), asentohuimausta (0,2 %, 0,5 %) ja pyörtymistä (0,4 %, 0 %) [ks. HAITTAVAIKUTUKSET ].
Merkittävän ortostaattisen verenpaineen muutoksen ilmaantuvuus (määritelty systolisen verenpaineen laskuksi ≥20 mmHg, johon liittyy sydämen sykkeen nousu ≥ 25 lyöntiä minuutissa, kun verrataan seisten ja makuulle asetettuja arvoja) ABILIFYssä ei eronnut merkittävästi lumelääkkeestä (ABILIFY-esiintyvyys). , lumelääkkeen ilmaantuvuus): aikuisilla suun kautta ABILIFY-hoitoa saaneilla potilailla (4 %, 2 %), lapsille suun kautta
ABILIFYllä hoidetut 6–18-vuotiaat potilaat (0,4 %, 1 %) tai ABILIFY 15 mg:n injektiolla hoidetut potilaat (3 %, 2 %).
ABILIFY 20 mg:aa tulee käyttää varoen potilailla, joilla on tunnettu sydän- ja verisuonisairaus (aiemmin sydäninfarkti tai iskeeminen sydänsairaus, sydämen vajaatoiminta tai johtumishäiriöt), aivoverisuonitauti tai tilat, jotka altistavat potilaan hypotensiolle (dehydraatio, hypovolemia ja hoito verenpainelääke). lääkkeet) [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Jos parenteraalinen bentsodiatsepiinihoito katsotaan tarpeelliseksi ABILIFY-injektiohoidon lisäksi, potilaita tulee tarkkailla liiallisen sedaation ja ortostaattisen hypotension varalta [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Falls
Psykoosilääkkeet, mukaan lukien ABILIFY 10 mg, voivat aiheuttaa uneliaisuutta, asennon hypotensiota, motorista ja sensorista epävakautta, mikä voi johtaa kaatumisiin ja sen seurauksena murtumiin tai muihin vammoihin. Potilaille, joilla on sairauksia, tiloja tai lääkkeitä, jotka voivat pahentaa näitä vaikutuksia, suorita putoamisriskin arvioinnit antipsykoottista hoitoa aloitettaessa ja toistuvasti potilailla, jotka saavat pitkäaikaista antipsykoottista hoitoa.
Leukopenia, neutropenia ja agranulosytoosi
Kliinisissä tutkimuksissa ja/tai markkinoille tulon jälkeen on raportoitu leukopeniaa ja neutropeniaa, jotka liittyvät ajallisesti psykoosilääkkeisiin, mukaan lukien ABILIFY. Myös agranulosytoosia on raportoitu.
Mahdollisia leukopenian/neutropenian riskitekijöitä ovat aiempi alhainen valkosolujen määrä (WBC)/absoluuttinen neutrofiilien määrä (ANC) ja aiempi lääkkeiden aiheuttama leukopenia/neutropenia. Potilaille, joilla on ollut kliinisesti merkitsevästi alhainen valkosolujen/ANC-arvo tai lääkkeiden aiheuttama leukopenia/neutropenia, suorita täydellinen verenkuva (CBC) usein muutaman ensimmäisen hoitokuukauden aikana. Harkitse tällaisilla potilailla ABILIFY-hoidon lopettamista, kun havaitaan ensimmäiset merkit kliinisesti merkittävästä valkosolujen vähenemisestä ilman muita aiheuttavia tekijöitä.
Seuraa potilaita, joilla on kliinisesti merkittävää neutropeniaa kuumeen tai muiden oireiden tai infektion merkkien varalta, ja hoitaa välittömästi, jos tällaisia oireita tai merkkejä ilmaantuu. Lopeta ABILIFY 20 mg -hoito potilailla, joilla on vaikea neutropenia (absoluuttinen neutrofiilien määrä
Kohtaukset/Kouristukset
Lyhytaikaisissa, lumekontrolloiduissa tutkimuksissa potilaita, joilla on ollut kouristuskohtauksia, ei esiintynyt 0,1 %:lla (3/2467) diagnosoimattomista aikuispotilaista, joita hoidettiin ABILIFY 20 mg suun kautta, ja 0,1 %:lla (1/732) lapsipotilaista. (6-18 vuotta) ja 0,2 %:lla (1/501) aikuisista ABILIFY 15 mg injektiopotilaista.
Kuten muitakin psykoosilääkkeitä, ABILIFY 15 mg:aa tulee käyttää varoen potilailla, joilla on ollut kouristuskohtauksia tai sairauksia, jotka alentavat kohtauskynnystä. Kouristuskynnystä alentavat tilat voivat olla yleisempiä 65-vuotiailla tai vanhemmilla.
Kognitiivisen ja motorisen vajaatoiminnan mahdollisuus
ABILIFY, kuten muutkin psykoosilääkkeet, saattaa heikentää arvostelukykyä, ajattelua tai motorisia taitoja. Esimerkiksi lyhytaikaisissa, lumekontrolloiduissa tutkimuksissa uneliaisuutta (mukaan lukien sedaatio) raportoitiin seuraavasti (ABILIFY-ilmaantuvuus, lumelääkettä): aikuisilla potilailla (n=2467), joita hoidettiin suun kautta annetulla ABILIFYllä (11 %, 6 %), 6–17-vuotiailla lapsipotilailla (n=611) (24 %, 6 %) ja aikuispotilailla (n=501) ABILIFY-injektiota saavilla potilailla (9 %, 6 %). Uneliaisuus (mukaan lukien sedaatio) johti hoidon keskeyttämiseen 0,3 %:lla (8/2467) aikuispotilaista ja 3 %:lla (20/732) lapsipotilaista (6-18-vuotiaat), jotka saivat ABILIFY 10 mg:n suun kautta lyhytaikaisissa lumekontrolloiduissa tutkimuksissa. mutta ei johtanut minkään ABILIFY-injektiota saaneen aikuispotilaan lopettamiseen.
Huolimatta näiden tapahtumien suhteellisen vaatimattomasta lisääntymisestä lumelääkkeeseen verrattuna, potilaita tulee varoittaa käyttämästä vaarallisia koneita, mukaan lukien autot, kunnes he ovat kohtuullisen varmoja siitä, että ABILIFY 15 mg -hoito ei vaikuta heihin haitallisesti.
Kehon lämpötilan säätely
Antipsykoottisten aineiden on katsottu aiheuttavan häiriöitä kehon kyvyssä alentaa ruumiinlämpöä. Asianmukaista varovaisuutta suositellaan määrättäessä ABILIFY 10 mg -valmistetta potilaille, joilla on tiloja, jotka voivat osaltaan kohottaa kehon sisälämpötilaa (esim. rasittava harjoittelu, altistuminen äärimmäiselle kuumuudelle, samanaikainen antikolinerginen lääke tai kuivuminen). [katso HAITTAVAIKUTUKSET ].
Itsemurha
Itsemurhayrityksen mahdollisuus on luontainen psykoottisille sairauksille, kaksisuuntaiselle mielialahäiriölle ja vakavalle masennushäiriölle, ja suuren riskin potilaiden tiivistä valvonnasta tulee seurata lääkehoitoa. ABILIFY-reseptit tulee kirjoittaa pienimmälle määrälle, joka on sopusoinnussa hyvän potilashoidon kanssa, jotta voidaan vähentää yliannostusriskiä [ks. HAITTAVAIKUTUKSET ].
Dysfagia
Ruokatorven dysmotiliteetti ja aspiraatio on yhdistetty psykoosilääkkeiden, mukaan lukien ABILIFYn, käyttöön. Aspiraatiokeuhkokuume on yleinen sairastuvuuden ja kuolleisuuden syy iäkkäillä potilailla, erityisesti niillä, joilla on pitkälle edennyt Alzheimerin dementia. ABILIFYä ja muita psykoosilääkkeitä tulee käyttää varoen potilailla, joilla on aspiraatiokeuhkokuumeen riski [ks. Lisääntynyt kuolleisuus iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi  ja HAITTAVAIKUTUKSET ].
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ).
Keskustele seuraavista ongelmista potilaiden kanssa, joille on määrätty ABILIFY:
Masennuksen ja itsemurhariskin kliininen paheneminen
Potilaita, heidän perheitään ja heidän omaisiaan tulee kannustaa olemaan valppaana ahdistuneisuuden, kiihtyneisyyden, paniikkikohtausten, unettomuuden, ärtyneisyyden, vihamielisyyden, aggressiivisuuden, impulsiivisuuden, akatisian (psykomotorinen levottomuus), hypomanian, manian ja muiden epätavallisten käyttäytymismuutosten ilmaantuessa. , masennuksen paheneminen ja itsemurha-ajatukset, erityisesti masennuslääkehoidon alkuvaiheessa ja kun annosta muutetaan ylös tai alas. Potilaiden perheitä ja hoitajia tulee neuvoa etsimään tällaisten oireiden ilmaantumista päivittäin, koska muutokset voivat olla äkillisiä. Tällaisista oireista tulee ilmoittaa potilaan lääkkeen määrääjälle tai terveydenhuollon ammattilaiselle, varsinkin jos ne ovat vakavia, alkavat äkillisesti tai eivät kuuluneet potilaan oireisiin. Tällaiset oireet voivat liittyä lisääntyneeseen itsemurha-ajattelun ja -käyttäytymisen riskiin, ja ne osoittavat erittäin tiiviin seurannan ja mahdollisesti lääkityksen muuttamisen tarpeen [ks. VAROITUKSET JA VAROTOIMET ].
Lääkäreiden tai muiden terveydenhuollon ammattilaisten tulee kertoa potilaille, heidän perheilleen ja heidän hoitajilleen ABILIFY-hoidon eduista ja riskeistä ja neuvoa heitä sen asianmukaisessa käytössä. ABILIFYlle on saatavilla potilaan lääkitysopas, joka sisältää tietoja "masennuslääkkeistä, masennuksesta ja muista vakavista mielisairaudista ja itsemurha-ajatuksista tai -toimista". Lääkkeen määrääjän tai terveydenhuollon ammattilaisen tulee neuvoa potilaita, heidän perheitään ja hoitajiaan lukemaan lääkitysopas ja auttaa heitä ymmärtämään sen sisältö. Potilaille tulee antaa mahdollisuus keskustella lääkitysoppaan sisällöstä ja saada vastauksia mahdollisiin kysymyksiinsä. On huomattava, että ABILIFYä ei ole hyväksytty ainoana lääkkeenä masennuksen hoitoon, eikä sitä ole arvioitu lasten vakavassa masennushäiriössä.
Patologinen pelaaminen ja muut pakko-oireiset käytökset
Kerro potilaille ja heidän omaishoitajilleen mahdollisuudesta, että he voivat kokea pakko-ostoksille, voimakkaita uhkapelaamisen haluja, pakko-oireisia seksuaalisia haluja, ahmimishalua ja/tai muita pakko-oireita ja kyvyttömyyttä hallita näitä haluja ottaessaan aripipratsolia. Joissakin tapauksissa, mutta ei kaikissa, halujen raportoitiin lakkaaneen, kun annosta pienennettiin tai lopetettiin [katso VAROITUKSET JA VAROTOIMET ].
Suun kautta hajoavan tabletin käyttö
Älä avaa läpipainopakkausta ennen kuin olet valmis annostelemaan. Jos haluat poistaa yhden tabletin, avaa pakkaus ja irrota läpipainopakkauksen kalvo takaisin tabletin paljastamiseksi. Älä työnnä tablettia kalvon läpi, koska se voi vahingoittaa tablettia. Välittömästi läpipainopakkauksen avaamisen jälkeen poista tabletti kuivin käsin ja aseta koko ABILIFY DISCMELT suussa hajoava tabletti kielelle. Tabletti hajoaa nopeasti syljessä. On suositeltavaa ottaa ABILIFY DISCMELT ilman nestettä. Tarvittaessa se voidaan kuitenkin ottaa nesteen kanssa. Älä yritä halkaista tablettia.
Häiriö kognitiiviseen ja motoriseen suorituskykyyn
Koska ABILIFY saattaa heikentää harkintakykyä, ajattelua tai motorisia taitoja, potilaita tulee varoittaa vaarallisten koneiden, mukaan lukien autojen, käytöstä, kunnes he ovat kohtuullisen varmoja siitä, että ABILIFY-hoito ei vaikuta heihin haitallisesti [ks. VAROITUKSET JA VAROTOIMET ].
Samanaikainen lääkitys
Potilaita tulee neuvoa ilmoittamaan lääkäreilleen, jos he käyttävät tai aikovat ottaa resepti- tai käsikauppalääkkeitä, koska interaktiot ovat mahdollisia [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Lämmölle altistuminen ja kuivuminen
Potilaita tulee neuvoa asianmukaisesta hoidosta ylikuumenemisen ja kuivumisen välttämiseksi [katso VAROITUKSET JA VAROTOIMET ].
Sokeripitoisuus
Potilaille tulee kertoa, että jokainen ml ABILIFY 10 mg oraaliliuosta sisältää 400 mg sakkaroosia ja 200 mg fruktoosia.
Raskaus
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen, jos he tulevat raskaaksi tai aikovat tulla raskaaksi ABILIFY-hoidon aikana. Kerro potilaille, että ABILIFY 20 mg voi aiheuttaa ekstrapyramidaalisia ja/tai vieroitusoireita (levottomuus, hypertonia, hypotonia, vapina, uneliaisuus, hengitysvaikeudet ja syömishäiriöt) vastasyntyneellä. Kerro potilaille, että on olemassa raskausrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet ABILIFY 15 mg:lle raskauden aikana [ks. Käyttö tietyissä populaatioissa ].
Fenyyliketonuurit
Fenyylialaniini on aspartaamin komponentti. Jokainen ABILIFY DISCMELT suussa hajoava tabletti sisältää seuraavat määrät: 10 mg, 1,12 mg fenyylialaniinia ja 15 mg, 1,68 mg fenyylialaniinia.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Elinikäisiä karsinogeenisuustutkimuksia suoritettiin ICR-hiirillä, F344-rotilla ja Sprague-Dawley-rotilla (SD). Aripipratsolia annettiin 2 vuoden ajan ruokavalion yhteydessä annoksina 1, 3, 10 ja 30 mg/kg/vrk ICR-hiirille ja 1, 3 ja 10 mg/kg/vrk F344-rotille (0,2, 0,5, 2 ja 5 kertaa ja 0,3, 1 ja 3 kertaa MRHD 30 mg/vrk perustuen mg/m² kehon pinta-alaan, vastaavasti). Lisäksi SD-rotille annettiin suun kautta 2 vuoden ajan annoksia 10, 20, 40 ja 60 mg/kg/vrk, jotka ovat 3, 6, 13 ja 19 kertaa MRHD:tä mitattuna mg/m² kehon pinta-alasta. Aripipratsoli ei aiheuttanut kasvaimia uroshiirillä tai urosrotilla. Naarashiirillä aivolisäkkeen adenoomien ja maitorauhasten adenokarsinoomien ja adenoakantoomien ilmaantuvuus lisääntyi ravinnon annoksilla 3–30 mg/kg/vrk (0,5–5 kertaa MRHD). Naarasrotilla maitorauhasten fibroadenoomien ilmaantuvuus lisääntyi ruokavalioannoksella 10 mg/kg/vrk (3 kertaa MRHD). ja lisämunuaiskuoren karsinoomien ja yhdistettyjen lisämunuaiskuoren adenoomien/karsinoomien ilmaantuvuus lisääntyi oraalisella annoksella 60 mg/kg/vrk (19 kertaa MRHD).
Jyrsijöillä on havaittu lisääntynyttä rintarauhasen, aivolisäkkeen ja endokriinisen haiman kasvaimia muiden antipsykoottisten lääkkeiden kroonisen annon jälkeen, ja sen katsotaan välittävän pitkittyneen dopamiini-D2-reseptoriantagonismin ja hyperprolaktinemian. Seerumin prolaktiinia ei mitattu aripipratsolin karsinogeenisuustutkimuksissa. Naarashiirillä havaittiin kuitenkin seerumin prolaktiinipitoisuuden nousua 13 viikkoa kestäneessä ravitsemustutkimuksessa annoksilla, jotka liittyivät rintarauhas- ja aivolisäkekasvaimiin. Seerumin prolaktiini ei lisääntynyt naarasrotilla 4 ja 13 viikkoa kestäneissä ravitsemustutkimuksissa annoksilla, jotka liittyivät rintarauhaskasvaimiin. Jyrsijöillä esiintyvien prolaktiinivälitteisten endokriinisten kasvainten löydösten merkitys ihmisen riskin kannalta on epäselvä.
Mutageneesi
Aripipratsolin mutageeninen potentiaali testattiin in vitro bakteerien käänteismutaatiomäärityksessä, in vitro bakteerien DNA:n korjausmäärityksessä, in vitro eteenpäin suuntautuvassa geenimutaatiomäärityksessä hiiren lymfoomasoluissa, in vitro kromosomipoikkeavuusmäärityksessä kiinanhamsterin keuhkoissa (CHL) soluissa, in vivo mikrotumamääritys hiirillä ja suunnittelematon DNA-synteesimääritys rotilla. Aripipratsoli ja metaboliitti (2,3-DCPP) olivat klastogeenisiä in vitro kromosomipoikkeavuusmäärityksessä CHL-soluissa metabolisen aktivaation kanssa tai ilman. Metaboliitti, 2,3DCPP, lisäsi numeerisia poikkeavuuksia in vitro -määrityksessä CHL-soluissa metabolisen aktivaation puuttuessa. Positiivinen vaste saatiin in vivo -mikronukleusmäärityksessä hiirillä; vaste johtui kuitenkin mekanismista, jota ei pidetty ihmiselle merkityksellisenä.
Hedelmällisyyden heikkeneminen
Naarasrottia hoidettiin suun kautta aripipratsolilla 2 viikkoa ennen parittelua raskauspäivään 7 asti annoksilla 2, 6 ja 20 mg/kg/vrk, jotka ovat 0,6, 2 ja 6 kertaa MRHD:tä 30 mg/vrk. mg/m² kehon pinta-alaa. Kaikilla annoksilla havaittiin kiimakierron epäsäännöllisyyttä ja lisääntynyttä keltasolua, mutta hedelmällisyyden heikkenemistä ei havaittu. Lisääntynyt pre-implantaatiohäviö havaittiin 2- ja 6-kertaisella MRHD:llä ja sikiön painon lasku 6-kertaisella MRHD:llä.
Urosrottia hoidettiin suun kautta aripipratsolilla 9 viikkoa ennen parittelua paritteluun asti annoksilla 20, 40 ja 60 mg/kg/vrk, jotka ovat 6, 13 ja 19 kertaa MRHD 30 mg/vrk perustuen mg/vrk. m² kehon pinta-ala. Spermatogeneesin häiriöitä havaittiin 19-kertaisella MRHD:llä ja eturauhasen atrofiaa 13-kertaisella ja 19-kertaisella MRHD:llä ilman hedelmällisyyden heikkenemistä.
Käyttö tietyissä populaatioissa
Raskaus
Raskausaltistusrekisteri
On olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet epätyypillisille psykoosilääkkeille, mukaan lukien ABILIFYlle, raskauden aikana. Terveydenhuollon tarjoajia kehotetaan rekisteröimään potilaat ottamalla yhteyttä National Pregnancy Registry for Atyyppisten antipsykoottien rekisteriin numeroon 1-866-961-2388 tai käymällä osoitteessa http://womensmentalhealth.org/clinical-and-researchprograms/pregnancyregistry/.
Riskien yhteenveto
Vastasyntyneillä, jotka ovat altistuneet antipsykoottisille lääkkeille, mukaan lukien ABILIFY 20 mg, kolmannen raskauskolmanneksen aikana, on riski saada ekstrapyramidaalisia ja/tai vieroitusoireita synnytyksen jälkeen (ks. Kliiniset näkökohdat ). Aripipratsolille altistuneilla raskaana olevilla naisilla tehdyistä julkaistuista epidemiologisista tutkimuksista saatavilla olevat tiedot eivät ole osoittaneet lääkkeeseen liittyvää vakavien synnynnäisten epämuodostumien, keskenmenon tai haittavaikutusten riskiä äidille tai sikiölle (ks. Data ). Äidille liittyy riskejä, jotka liittyvät hoitamattomaan skitsofreniaan, I-tyypin kaksisuuntaiseen mielialahäiriöön tai vakavaan masennushäiriöön ja raskauden aikana altistumiseen psykoosilääkkeille, mukaan lukien ABILIFY (ks. Kliiniset näkökohdat ).
Eläinten lisääntymistutkimuksissa aripipratsolin oraalinen ja suonensisäinen antaminen organogeneesin aikana rotille ja/tai kaniineille annoksilla, jotka olivat 10-kertaisia ja 19-kertaisia annoksina, jotka olivat vastaavasti 30 mg/vrk ihmisen suurinta suositeltua annosta (MRHD) kehon pinta-alan mg/m²:n perusteella. sikiökuolema, alentunut sikiön paino, laskeutumattomat kivekset, viivästynyt luuston luustuminen, luuston poikkeavuudet ja palleantyrä. Suun kautta ja suonensisäinen aripipratsolin antaminen pre- ja postnataalisen ajanjakson aikana rotille annoksilla, jotka olivat 10 kertaa MRHD-annokset, joka perustuu mg/m² kehon pinta-alaan, pitkitti tiineyttä, syntyi kuolleena, laski poikasten painoa ja vähensi poikasten eloonjäämistä (ks. Data ).
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Kliiniset näkökohdat
Äidin ja/tai alkion/sikiön sairauteen liittyvä riski
Äidille on olemassa riski hoitamattomasta skitsofreniasta tai kaksisuuntaisesta mielialahäiriöstä I, mukaan lukien lisääntynyt uusiutumisen, sairaalahoidon ja itsemurhan riski. Skitsofrenia ja kaksisuuntainen mielialahäiriö I liittyvät lisääntyneisiin perinataalisiin haittavaikutuksiin, mukaan lukien ennenaikainen synnytys. Ei tiedetä, onko tämä suora seuraus sairaudesta tai muista samanaikaisista tekijöistä.
Prospektiivisessa pitkittäistutkimuksessa seurattiin 201 raskaana olevaa naista, joilla oli aiemmin ollut vakava masennushäiriö ja jotka olivat eutymia ja käyttivät masennuslääkkeitä raskauden alussa. Naiset, jotka lopettivat masennuslääkkeiden käytön raskauden aikana, saivat todennäköisemmin vakavan masennuksen uusiutumisen kuin naiset, jotka jatkoivat masennuslääkkeiden käyttöä. Ota huomioon hoitamattoman masennuksen riski, kun lopetat tai vaihdat masennuslääkehoitoa raskauden ja synnytyksen aikana.
Sikiön/vastasyntyneen haittavaikutukset
Ekstrapyramidaalisia ja/tai vieroitusoireita, kuten kiihtyneisyyttä, hypertoniaa, hypotoniaa, vapinaa, uneliaisuutta, hengitysvaikeutta ja ruokintahäiriötä, on raportoitu vastasyntyneillä, jotka ovat altistuneet psykoosilääkkeille (mukaan lukien ABILIFY) raskauden kolmannen kolmanneksen aikana. Nämä oireet ovat vaihdelleet vakavuudeltaan. Tarkkaile vastasyntyneitä ekstrapyramidaalisten ja/tai vieroitusoireiden varalta ja hallitse oireita asianmukaisesti. Jotkut vastasyntyneet toipuivat tunneissa tai päivissä ilman erityistä hoitoa; toiset vaativat pitkäaikaista sairaalahoitoa.
Data
Ihmistiedot
Havaintotutkimuksista, syntymärekistereistä ja tapausraporteista saadut tiedot epätyypillisten psykoosilääkkeiden käytöstä raskauden aikana eivät kerro selkeää yhteyttä psykoosilääkkeisiin ja merkittäviin synnynnäisiin epämuodostumisiin. Medicaid-tietokannasta tehty retrospektiivinen tutkimus, jossa käsiteltiin 9 258 raskauden aikana psykoosilääkkeille altistunutta naista, ei osoittanut yleisen lisääntyneen riskin saada vakavia synnynnäisiä epämuodostumia.
Eläinten tiedot
Eläintutkimuksissa aripipratsoli osoitti kehitystoksisuutta, mukaan lukien mahdolliset teratogeeniset vaikutukset rotilla ja kaniineilla.
Tiineillä rotilla, joita hoidettiin oraalisesti aripipratsolilla organogeneesin aikana annoksilla 3, 10 ja 30 mg/kg/vrk, jotka ovat noin 1, 3 ja 10 kertaa MRHD 30 mg/vrk laskettuna mg/m² kehon pinta-alasta, raskauden lievää pitkittymistä ja sikiön kehityksen viivästymistä, mikä on osoituksena sikiön painon laskusta ja laskeutumattomista kiveksistä, havaittiin 10-kertaisella MRHD:llä. Viivästynyttä luuston luutumista havaittiin 3- ja 10-kertaisella MRHD:llä. Syntyneillä jälkeläisillä hepatodiafragmaattisten kyhmyjen ilmaantuvuus ja palleantyrä havaittiin 10-kertaisella MRHD:llä (muita annosryhmiä ei tutkittu näiden löydösten varalta). Synnytyksen jälkeen viivästynyt emättimen avautuminen havaittiin 3- ja 10-kertaisella MRHD:llä. Lisääntymissuorituskyvyn heikkeneminen (alentunut hedelmällisyysaste, keltasolut, implantit, elävät sikiöt ja lisääntynyt istutuksen jälkeinen menetys, mikä todennäköisesti välittyi naaraspuolisiin jälkeläisiin kohdistuvien vaikutusten kautta) havaittiin 10-kertaisella MRHD:llä; ei kuitenkaan ollut näyttöä siitä, että nämä kehitysvaikutukset olisivat toissijaisia emolle aiheutuvan toksisuuden vuoksi.
Tiineillä rotilla, joille injektoitiin suonensisäisesti aripipratsolia organogeneesin aikana annoksilla 3, 9 ja 27 mg/kg/vrk, jotka ovat 1, 3 ja 9 kertaa MRHD 30 mg/vrk laskettuna mg/m² kehon pinta-alasta. sikiön paino ja viivästynyt luuston luutuminen havaittiin 9-kertaisella MRHD:llä; tämä annos aiheutti myös emolle toksisuutta.
Tiineillä kaniineilla, joita hoidettiin oraalisesti aripipratsolilla organogeneesin aikana annoksilla 10, 30 ja 100 mg/kg/vrk, jotka ovat 6, 19 ja 65 kertaa MRHD 30 mg/vrk perustuen mg/m² ruumiinpinta-alaan ruoankulutus, lisääntynyt abortti ja lisääntynyt sikiökuolleisuus havaittiin 65-kertaisella MHRD:llä. Sikiön painon aleneminen ja fuusioituneiden rintakehän esiintyvyys havaittiin 19- ja 65-kertaisella MRHD:llä.
Tiineillä kaniineilla, joille injektoitiin suonensisäisesti aripipratsolia organogeneesin aikana annoksilla 3, 10 ja 30 mg/kg/vrk, jotka ovat 2, 6 ja 19 kertaa MRHD 30 mg/vrk laskettuna mg/m² kehon pinta-alasta. sikiön paino, lisääntyneet sikiön poikkeavuudet (pääasiassa luuston) ja vähentynyt sikiön luuston luutuminen havaittiin 19-kertaisella MRHD:llä; tämä annos aiheutti myös emolle toksisuutta. Sikiön vaikutuston annos oli 10 mg/kg/vrk, mikä on 6 kertaa MRHD.
Rotilla, joita hoidettiin suun kautta aripipratsolia peri- ja postnataalisesti tiineyspäivästä 17 synnytyksen jälkeiseen päivään 21 annoksilla 3, 10 ja 30 mg/kg/vrk, jotka ovat 1, 3 ja 10 kertaa MRHD 30 mg/vrk. mg/m² kehon pinta-alasta laskettuna havaittiin lievää toksisuutta emolle ja hieman pitkittynyttä raskausaikaa 10-kertaisella MHRD:llä. Tällä annoksella havaittiin myös kuolleena syntyneiden lisääntymistä ja poikasten painon laskua (jatkuvaa aikuisuuteen asti) ja eloonjäämistä.
Rotille, joille injektoitiin suonensisäisesti aripipratsolia tiineyspäivästä 6. imetyspäivään 20 annoksilla 3, 8 ja 20 mg/kg/vrk, jotka ovat 1, 3 ja 6 kertaa MRHD 30 mg/vrk perustuen mg/m² kehon pinta-ala, lisääntynyttä kuolleena syntymistä havaittiin 3- ja 6-kertaisella MRHD:llä; ja varhaisen postnataalisen poikasten painon ja eloonjäämisen laskua havaittiin 6-kertaisella MRHD:llä; nämä annokset aiheuttivat myös jonkin verran emolle toksisuutta. Ei ollut vaikutuksia postnataaliseen käyttäytymiseen ja lisääntymiseen.
Imetys
Riskien yhteenveto
Rajoitetut tiedot julkaistusta kirjallisuudesta raportoivat aripipratsolin esiintyvän ihmisen rintamaidossa suhteellisilla imeväisten annoksilla, jotka vaihtelevat välillä 0,7–8,3 % äidin painon mukaan sovitetusta annoksesta. Aripipratsolille altistuneiden rintaruokittujen imeväisten painonnousua on raportoitu huonosti ja maidon riittämättömyyttä aripipratsolia saavilla imettävillä naisilla.
Imetyksen kehitystä ja terveydellisiä etuja tulee harkita sekä äidin kliinistä ABILIFY-tarvetta ja kaikkia mahdollisia ABILIFYn tai äidin taustalla olevista haitallisista vaikutuksista imetettävään lapseen.
Käyttö lapsille
Turvallisuutta ja tehoa lapsipotilailla, joilla on vaikea masennus tai kiihtyneisyys, johon liittyy skitsofrenia tai kaksisuuntainen mielialamania, ei ole osoitettu.
Aripipratsolin ja dehydroaripipratsolin farmakokinetiikka 10–17-vuotiailla lapsipotilailla oli samanlainen kuin aikuisilla, kun painoerot oli korjattu [ks. KLIININEN FARMAKOLOGIA ].
Skitsofrenia
Turvallisuus ja tehokkuus skitsofreniaa sairastavilla lapsipotilailla varmistettiin 6 viikkoa kestäneessä, lumekontrolloidussa kliinisessä tutkimuksessa 202:lla 13–17-vuotiaalla lapsipotilaalla [ks. ANNOSTELU JA HALLINNOINTI , HAITTAVAIKUTUKSET , ja Kliiniset tutkimukset ]. Vaikka ylläpitotehoa lapsipotilailla ei ole arvioitu systemaattisesti, ylläpitoteho voidaan ekstrapoloida aikuisten tiedoista sekä aripipratsolin farmakokineettisten parametrien vertailusta aikuisilla ja lapsipotilailla.
Kaksisuuntainen mielialahäiriö I
Turvallisuus ja tehokkuus kaksisuuntaisen mielialahäiriön maniaa sairastavilla lapsipotilailla vahvistettiin 4 viikkoa kestäneessä, lumekontrolloidussa kliinisessä tutkimuksessa 197 10–17-vuotiaalla lapsipotilaalla [ks. ANNOSTELU JA HALLINNOINTI , HAITTAVAIKUTUKSET , ja Kliiniset tutkimukset ]. Vaikka ylläpitotehoa lapsipotilailla ei ole arvioitu systemaattisesti, ylläpitoteho voidaan ekstrapoloida aikuisten tiedoista sekä aripipratsolin farmakokineettisten parametrien vertailusta aikuisilla ja lapsipotilailla.
ABILIFY 10 mg:n ja samanaikaisen litiumin tai valproaatin tehoa maanisten tai sekamuotoisten jaksojen hoidossa lapsipotilailla ei ole arvioitu systemaattisesti. Tällainen tehokkuus ja farmakokineettisten yhteisvaikutusten puute aripipratsolin ja litiumin tai valproaatin välillä voidaan kuitenkin ekstrapoloida aikuisten tiedoista sekä aripipratsolin farmakokineettisten parametrien vertailusta aikuisilla ja lapsipotilailla.
Autistiseen häiriöön liittyvä ärtyneisyys
Turvallisuus ja tehokkuus lapsipotilailla, jotka osoittavat autistiseen häiriöön liittyvää ärtyneisyyttä, vahvistettiin kahdessa 8 viikon lumekontrolloidussa kliinisessä tutkimuksessa 212:lla 6–17-vuotiaalla lapsipotilaalla [ks. KÄYTTÖAIHEET JA KÄYTTÖ , ANNOSTELU JA HALLINNOINTI , HAITTAVAIKUTUKSET , ja Kliiniset tutkimukset ]. Ylläpitokoe suoritettiin lapsipotilailla (6–17-vuotiaat), joilla oli autistiseen häiriöön liittyvää ärtyneisyyttä. Tämän tutkimuksen ensimmäinen vaihe oli avoin, joustavasti annosteltu (aripipratsoli 2-15 mg/vrk) vaihe, jossa potilaat vakiintuivat (määritelty > 25 %:n parantumiseksi ABC-I-ala-asteikolla ja CGI-I-luokitus "paljon parannettu" tai "erittäin parantunut") ABILIFYllä 12 peräkkäisen viikon ajan. Kaiken kaikkiaan 85 potilasta vakiintui ja siirtyi toiseen, 16 viikon kaksoissokkovaiheeseen, jossa heidät satunnaistettiin joko jatkamaan ABILIFY-hoitoa tai vaihtamaan lumelääkkeeseen. Tässä tutkimuksessa ABILIFYn tehoa autistiseen häiriöön liittyvän ärtyneisyyden ylläpitohoidossa ei osoitettu.
Touretten häiriö
Aripipratsolin turvallisuus ja tehokkuus Touretten häiriötä sairastavilla lapsipotilailla varmistettiin yhdessä 8 viikon (7–17-vuotiaat) ja yhdessä 10 viikon tutkimuksessa (6–18-vuotiaat) 194 lapsipotilaalla [ks. ANNOSTELU JA HALLINNOINTI , HAITTAVAIKUTUKSET , ja Kliiniset tutkimukset ]. Ylläpitotehoa lapsipotilailla ei ole arvioitu systemaattisesti.
Nuorten eläinten tutkimukset
Aripipratsoli aiheutti nuorilla rotilla kuolleisuutta, keskushermoston kliinisiä oireita, muistin ja oppimisen heikkenemistä sekä seksuaalisen kypsymisen viivästymistä, kun sitä annettiin suun kautta annoksina 10, 20, 40 mg/kg/vrk vieroituksesta (21 päivän ikäinen) kypsyyteen (80 päivän ikäinen) . Annoksella 40 mg/kg/vrk molemmilla sukupuolilla havaittiin kuolleisuutta, vähentynyttä aktiivisuutta, vääntyneitä takaraajoja, kumartunutta asentoa, ataksiaa, vapinaa ja muita keskushermoston merkkejä. Lisäksi miehillä havaittiin viivästynyttä seksuaalista kypsymistä. Kaikilla annoksilla ja annoksesta riippuvaisella tavalla heikentynyt muisti ja oppiminen, lisääntynyt motorinen aktiivisuus ja histopatologiset muutokset aivolisäkkeessä (atrofia), lisämunuaisissa (lisämunuaiskuoren liikakasvu), maitorauhasissa (hyperplasia ja lisääntynyt eritys) ja naisen sukuelimiin ( emättimen limakalvon muodostumista, kohdun limakalvon surkastumista, munasarjojen keltasolujen vähenemistä). Naisten sukuelinten muutoksia pidettiin toissijaisena seerumin prolaktiinipitoisuuden nousun vuoksi. No Observed Adverse Effect Level (NOAEL) -tasoa ei voitu määrittää, ja pienimmällä testatulla annoksella 10 mg/kg/vrk ei ole turvamarginaalia verrattuna aripipratsolin tai sen tärkeimmän aktiivisen metaboliitin systeemiseen altistukseen (AUC0-24). nuorilla suurin suositeltu lasten annos 15 mg/vrk. Kaikki lääkkeeseen liittyvät vaikutukset palautuivat 2 kuukauden toipumisjakson jälkeen, ja suurin osa lääkevaikutuksista nuorilla rotilla havaittiin myös aikuisilla rotilla aiemmin suoritetuissa tutkimuksissa.
Aripipratsoli nuorilla koirilla (2 kuukauden ikäisillä) aiheutti keskushermoston kliinisiä merkkejä vapinasta, hypoaktiivisuudesta, ataksiasta, makuuasennosta ja takaraajojen rajoitetusta käytöstä, kun sitä annettiin suun kautta 6 kuukauden ajan 3, 10, 30 mg/kg/vrk. Keskimääräinen ruumiinpaino ja painonnousu laskivat jopa 18 % naisilla kaikissa lääkeryhmissä verrattuna kontrolliarvoihin. NOAEL-arvoa ei voitu määrittää, ja pienimmällä testatulla annoksella 3 mg/kg/vrk ei ole turvamarginaalia verrattuna aripipratsolin tai sen tärkeimmän aktiivisen metaboliitin systeemiseen altistukseen (AUC0-24) nuorilla suositellulla enimmäismäärällä lapsilla. annos 15 mg/vrk. Kaikki lääkkeisiin liittyvät vaikutukset palautuivat 2 kuukauden toipumisjakson jälkeen.
Geriatrinen käyttö
Annoksen muuttamista ei suositella iäkkäille potilaille [katso LAATIKKO VAROITUS , VAROITUKSET JA VAROTOIMET , ja KLIININEN FARMAKOLOGIA ].
Kliinisissä tutkimuksissa suun kautta otettavalla ABILIFY 15 mg:lla hoidetuista 13 543 potilaasta 1073 (8 %) oli ≥65-vuotiaita ja 799 (6 %) ≥75-vuotiaita. Plasebokontrolloiduissa tutkimuksissa suun kautta otettavalla ABILIFY 10 mg:lla skitsofrenian, kaksisuuntaisen mielialan manian tai vakavan masennushäiriön hoitoon ei sisältynyt riittävää määrää 65-vuotiaita ja sitä vanhempia koehenkilöitä sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat.
Kliinisissä tutkimuksissa ABILIFY-injektiolla hoidetuista 749 potilaasta 99 (13 %) oli ≥65-vuotiaita ja 78 (10 %) ≥75-vuotiaita. Lumekontrolloidut ABILIFY-injektiotutkimukset potilailla, joilla oli skitsofreniaan tai kaksisuuntaiseen mielialahäiriöön liittyvää kiihtyneisyyttä, eivät sisältäneet riittävää määrää 65-vuotiaita ja sitä vanhempia, jotta voitaisiin määrittää, reagoivatko he eri tavalla kuin nuoremmat.
ABILIFY 15 mg ei ole hyväksytty Alzheimerin tautiin liittyvän psykoosin potilaiden hoitoon [ks. LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ].
CYP2D6 huonot metaboloijat
Annoksen muuttamista suositellaan tunnetuille CYP2D6:n hitaille metaboloijille korkeiden aripipratsolipitoisuuksien vuoksi. Noin 8 % valkoihoisista ja 3–8 % mustista/afrikkalaisista amerikkalaisista ei pysty metaboloimaan CYP2D6-substraatteja ja heidät luokitellaan hitaiksi metaboloijiksi (PM) [ks. ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
Maksan ja munuaisten vajaatoiminta
ABILIFYn annosta ei tarvitse muuttaa potilaan maksan toiminnan (lievä tai vaikea maksan vajaatoiminta, Child-Pugh-pistemäärä 5–15) tai munuaisten toiminnan (lievä tai vaikea munuaisten vajaatoiminta, munuaisten suodatusnopeus välillä 15) perusteella. ja 90 ml/minuutti) [katso KLIININEN FARMAKOLOGIA ].
Muut erityiset populaatiot
ABILIFYn annosta ei tarvitse muuttaa potilaan sukupuolen, rodun tai tupakoinnin perusteella [ks. KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Haittavaikutusten luokittelussa on käytetty MedDRA-terminologiaa.
Inhimillinen kokemus
Kliinisissä tutkimuksissa ja markkinoille tulon jälkeen on raportoitu maailmanlaajuisesti suun kautta otettavan ABILIFYn tahallisen tai tahattoman yliannostuksen haittavaikutuksia. Näitä ovat esimerkiksi suun kautta otettavan ABILIFY 20 mg:n yliannostukset yksinään ja yhdessä muiden aineiden kanssa. Pelkästään ABILIFYllä ei raportoitu kuolemantapauksia. Suurin tunnettu annos, jonka lopputulos tunnetaan, oli täysin toipuneen potilaan akuutti 1260 mg:n suun kautta otettava ABILIFY-annos (42 kertaa suurin suositeltu päiväannos). Lapsilla (12-vuotiaat ja sitä nuoremmat) raportoitiin myös tahallista tai vahingossa tapahtuvaa yliannostusta, jossa ABILIFY 10 mg otettiin suun kautta aina 195 mg:aan asti ilman kuolemantapauksia.
Oraalisen ABILIFY-yliannostuksen yhteydessä (yksin tai yhdessä muiden aineiden kanssa) raportoituja yleisiä haittavaikutuksia (raportoitu vähintään 5 %:ssa kaikista yliannostustapauksista) ovat oksentelu, uneliaisuus ja vapina. Muita kliinisesti tärkeitä merkkejä ja oireita, joita on havaittu yhdellä tai useammalla ABILIFY-yliannostuksen saaneella potilaalla (yksin tai muiden aineiden kanssa), ovat asidoosi, aggressio, aspartaattiaminotransferaasin lisääntyminen, eteisvärinä, bradykardia, kooma, sekavuustila, kouristukset, veren kreatiinifosfokinaasitason nousu, masentunut taso tajunnanhäiriöt, kohonnut verenpaine, hypokalemia, hypotensio, letargia, tajunnanmenetys, QRS-kompleksin pitkittyminen, QT-ajan piteneminen, keuhkokuumeen aspiraatio, hengityspysähdys, status epilepticus ja takykardia.
Yliannostuksen hallinta
ABILIFY-yliannostuksen hoidosta ei ole saatavilla erityistä tietoa. Yliannostustapauksissa tulee ottaa EKG, ja jos QT-aika pitenee, sydämen toimintaa on seurattava. Muussa tapauksessa yliannostuksen hallinnassa tulee keskittyä tukihoitoon, riittävien hengitysteiden ylläpitämiseen, hapettumiseen ja ventilaatioon sekä oireiden hallintaan. Tarkkaa lääketieteellistä valvontaa ja seurantaa tulee jatkaa, kunnes potilas toipuu.
Puuhiili
Jos ABILIFY 10 mg yliannostetaan, varhainen hiilen antaminen voi olla hyödyllistä estämään osittain aripipratsolin imeytymistä. Kun annettiin 50 g aktiivihiiltä, tunti 15 mg:n kerta-annoksen oraalisen ABILIFY-annoksen jälkeen, aripipratsolin keskimääräinen AUC ja Cmax pienenivät 50 %.
Hemodialyysi
Vaikka ei ole tietoa hemodialyysin vaikutuksesta ABILIFY-yliannostuksen hoidossa, hemodialyysistä ei todennäköisesti ole hyötyä yliannostuksen hoidossa, koska aripipratsoli sitoutuu voimakkaasti plasman proteiineihin.
VASTA-AIHEET
ABILIFY 15 mg on vasta-aiheinen potilaille, joilla on aiemmin ollut yliherkkyysreaktio aripipratsolille. Reaktiot ovat vaihdelleet kutinasta/urtikariasta anafylaksiaan [katso HAITTAVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Aripipratsolin vaikutusmekanismi skitsofrenian tai kaksisuuntaisen mielialahäiriön manian hoidossa on epäselvä. Aripipratsolin tehokkuus luetelluissa käyttöaiheissa saattaa kuitenkin välittyä osittaisen agonistiaktiivisuuden D2- ja 5-HT1A-reseptoreissa ja antagonistiaktiivisuuden yhdistelmällä 5-HT2A-reseptoreissa.
Farmakodynamiikka
Aripipratsolilla on suuri affiniteetti dopamiini D2- ja D3-, serotoniini-5-HT1A- ja 5-HT2A-reseptoreihin (Ki-arvot 0,34 nM, 0,8 nM, 1,7 nM ja 3,4 nM, vastaavasti), kohtalainen affiniteetti dopamiini D5- ja HT2-dopamiiniin 5-HT7, alfa1-adrenergiset ja histamiini H1-reseptorit (Ki-arvot 44 nM, 15 nM, 39 nM, 57 nM ja 61 nM, vastaavasti) ja kohtalainen affiniteetti serotoniinin takaisinottokohtaan (Ki = 98 nM). Aripipratsolilla ei ole merkittävää affiniteettia kolinergisiin muskariinireseptoreihin (IC50 > 1000 nM).
Farmakokinetiikka
ABILIFY-aktiivisuus johtuu oletettavasti ensisijaisesti emolääkkeestä, aripipratsolista, ja vähemmässä määrin sen päämetaboliitista, dehydroaripipratsolista, jolla on osoitettu olevan samanlainen affiniteetti D2-reseptoreihin kuin emolääkkeellä ja joka edustaa 40 % emolääkkeestä. lääkeainealtistus plasmassa. Keskimääräiset eliminaation puoliintumisajat ovat aripipratsolin noin 75 tuntia ja dehydroaripipratsolin 94 tuntia. Vakaan tilan pitoisuudet saavutetaan 14 päivän kuluessa annostelusta molemmille aktiivisille osille. Aripipratsolin kumuloituminen on ennustettavissa kerta-annoksen farmakokinetiikasta. Vakaassa tilassa aripipratsolin farmakokinetiikka on suhteessa annokseen. Aripipratsolin eliminaatio tapahtuu pääasiassa maksametaboliassa, johon osallistuu kaksi P450-isoentsyymiä, CYP2D6 ja CYP3A4. CYP2D6:n hitailla metaboloijilla aripipratsolin eliminaation puoliintumisaika on noin 146 tuntia.
Farmakokineettiset tutkimukset osoittivat, että ABILIFY 10 mg DISCMELT suun kautta hajoavat tabletit ovat biologisesti samanarvoisia ABILIFY 15 mg tablettien kanssa.
Suullinen hallinto
Imeytyminen
Tabletti: Aripipratsoli imeytyy hyvin tabletin ottamisen jälkeen, ja huippupitoisuudet plasmassa saavutetaan 3–5 tunnin kuluessa. tablettien absoluuttinen oraalinen hyötyosuus on 87 %. ABILIFY 10 mg voidaan ottaa ruoan kanssa tai ilman. 15 mg:n ABILIFY-tabletin anto tavallisen runsasrasvaisen aterian yhteydessä ei vaikuttanut merkitsevästi aripipratsolin tai sen aktiivisen metaboliitin, dehydroaripipratsolin, Cmax- tai AUC-arvoon, mutta viivästytti Tmax-arvoa 3 tuntia aripipratsolin ja 12 tuntia dehydroaripipratsolin osalta.
Oraaliliuos: Aripipratsoli imeytyy hyvin, kun sitä annetaan suun kautta liuoksena. Vastaavilla annoksilla aripipratsolin pitoisuudet plasmassa liuoksesta olivat korkeammat kuin tablettimuodossa. Suhteellisessa hyötyosuustutkimuksessa, jossa verrattiin 30 mg:n aripipratsolin farmakokinetiikkaa oraaliliuoksena 30 mg:n aripipratsolitabletteihin terveillä koehenkilöillä, geometrisen keskimääräisen Cmax- ja AUC-arvojen liuoksen ja tabletin välinen suhde oli 122 % ja 114 % [ks. ANNOSTELU JA HALLINNOINTI ]. Aripipratsolin kerta-annoksen farmakokinetiikka oli lineaarinen ja suhteessa annokseen 5–30 mg:n annosten välillä.
Jakelu
Aripipratsolin vakaan tilan jakautumistilavuus laskimonsisäisen annon jälkeen on suuri (404 l tai 4,9 l/kg), mikä viittaa laajaan ekstravaskulaariseen jakautumiseen. Terapeuttisilla pitoisuuksilla aripipratsoli ja sen päämetaboliitit sitoutuvat yli 99 % seerumin proteiineihin, pääasiassa albumiiniin. Terveillä vapaaehtoisilla ihmisillä, joille annettiin aripipratsolia 0,5–30 mg/vrk 14 päivän ajan, havaittiin annoksesta riippuvaa D2-reseptorin miehitystä, mikä osoitti aripipratsolin tunkeutumista aivoihin ihmisillä.
Aineenvaihdunta ja eliminaatio
Aripipratsoli metaboloituu pääasiassa kolmen biotransformaatioreitin kautta: dehydrogenaatio, hydroksylaatio ja N-dealkylaatio. In vitro -tutkimusten perusteella CYP3A4- ja CYP2D6-entsyymit ovat vastuussa aripipratsolin dehydraamisesta ja hydroksylaatiosta, ja N-dealkylaatiota katalysoi CYP3A4. Aripipratsoli on hallitseva lääkeaineosa systeemisessä verenkierrossa. Vakaassa tilassa dehydroaripipratsoli, aktiivinen metaboliitti, edustaa noin 40 % aripipratsolin AUC-arvosta plasmassa.
[14C]-merkityn aripipratsolin oraalisen kerta-annoksen jälkeen noin 25 % annetusta radioaktiivisuudesta erittyi virtsaan ja 55 % ulosteeseen. Alle 1 % muuttumattomana aripipratsolista erittyi virtsaan ja noin 18 % suun kautta otetusta annoksesta erittyi muuttumattomana ulosteeseen.
Huumeiden vuorovaikutustutkimukset
Muiden lääkkeiden vaikutukset aripipratsolin ja dehydroaripipratsolin altistukseen on esitetty yhteenveto kuvassa 1 ja kuvassa 2, vastaavasti. Simuloinnin perusteella keskimääräisten Cmax- ja AUC-arvojen odotetaan nousevan 4,5-kertaiseksi vakaassa tilassa, kun CYP2D6:n nopeita metaboloijia annetaan sekä vahvojen CYP2D6- että CYP3A4-estäjien kanssa. Keskimääräisten Cmax- ja AUC-arvojen odotetaan nousevan kolminkertaiseksi vakaassa tilassa, jos CYP2D6:n metaboloijat saavat voimakkaita CYP3A4-estäjiä.
Kuva 1: Muiden lääkkeiden vaikutukset aripipratsolin farmakokinetiikkaan 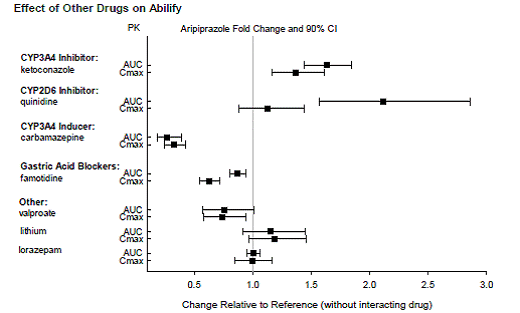
Kuva 2: Muiden lääkkeiden vaikutukset dehydroaripipratsolin farmakokinetiikkaan 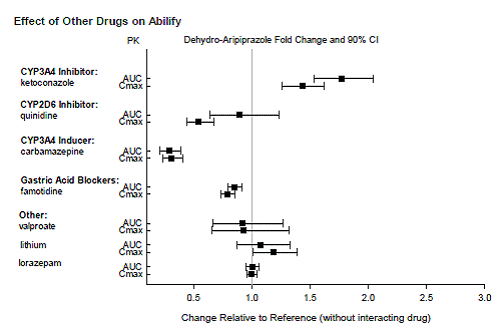
ABILIFY 15 mg:n vaikutukset muiden lääkkeiden altistukseen on esitetty yhteenvetona kuvassa 3. Populaatio-PK-analyysi potilailla, joilla oli vaikea masennus, ei osoittanut merkittävää muutosta plasman fluoksetiinin (20 tai 40 mg/vrk), paroksetiinin CR:n (37,5 tai 50 mg/vrk) tai sertraliinia (100 tai 150 mg/vrk) annosteltuna vakaaseen tilaan. Fluoksetiinin vakaan tilan pitoisuudet plasmassa nousivat noin 18 % ja norfluoksetiinin 36 %, ja paroksetiinin pitoisuudet laskivat noin 27 %. Sertraliinin ja desmetyylisertraliinin vakaan tilan plasmapitoisuudet eivät olennaisesti muuttuneet, kun näitä masennuslääkehoitoja annettiin samanaikaisesti aripipratsolin kanssa.
Kuva 3: ABILIFY 15 mg:n vaikutukset muiden lääkkeiden farmakokinetiikkaan 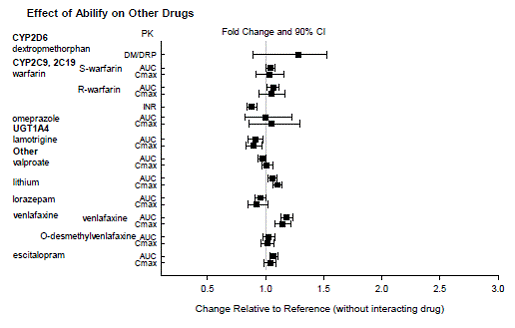
Tutkimukset tietyissä populaatioissa
Aripipratsolin ja dehydroaripipratsolin altistuminen tietyissä populaatioissa on yhteenveto kuviossa 4 ja kuviossa 5, vastaavasti. Lisäksi lapsipotilailla (10–17-vuotiaat), joille annettiin ABILIFYä (20–30 mg), ruumiinpainokorjattu aripipratsolin puhdistuma oli samanlainen kuin aikuisilla.
Kuva 4: Sisäisten tekijöiden vaikutukset aripipratsolin farmakokinetiikkaan 
Kuva 5: Sisäisten tekijöiden vaikutukset dehydroaripipratsolin farmakokinetiikkaan 
Lihaksensisäinen anto
Kahdessa farmakokineettisessä tutkimuksessa, joissa aripipratsoli-injektio annettiin lihakseen terveille koehenkilöille, mediaaniajat plasman huippupitoisuuksien saavuttamiseen olivat 1 tunti ja 3 tuntia. Aripipratsolin 5 mg:n lihaksensisäisen injektion absoluuttinen biologinen hyötyosuus oli 100 %. Lihaksensisäisen annoksen jälkeen saavutettu maksimipitoisuuden geometrinen keskiarvo oli keskimäärin 19 % suurempi kuin suun kautta otettavan tabletin Cmax. Vaikka systeeminen altistus 24 tunnin aikana oli yleensä samanlainen lihakseen annetun aripipratsolin injektion ja oraalisen tabletin annon jälkeen, aripipratsolin AUC ensimmäisen 2 tunnin aikana lihakseen annetun injektion jälkeen oli 90 % suurempi kuin AUC saman annoksen jälkeen kuin tabletilla. Vakailla potilailla, joilla oli skitsofrenia tai skitsoaffektiivinen häiriö, aripipratsolin farmakokinetiikka lihaksensisäisen annon jälkeen oli lineaarinen annosalueella 1–45 mg. Vaikka aripipratsolin injektion metaboliaa ei arvioitu systemaattisesti, lihaksensisäisen antoreitin ei odoteta muuttavan metaboliareittejä.
Eläinten toksikologia ja/tai farmakologia
Aripipratsoli aiheutti verkkokalvon rappeutumista albiinorotilla 26 viikkoa kestäneessä kroonisen toksisuustutkimuksessa annoksella 60 mg/kg/vrk ja 2 vuoden karsinogeenisuustutkimuksessa annoksilla 40 ja 60 mg/kg/vrk, jotka ovat 13 ja 19 kertaa MRHD on 30 mg/vrk perustuen mg/m² kehon pinta-alaan. Albiinohiirten ja apinoiden verkkokalvon arviointi ei paljastanut näyttöä verkkokalvon rappeutumisesta. Lisätutkimuksia mekanismin arvioimiseksi ei ole tehty. Tämän löydön merkitystä ihmisen riskille ei tunneta.
Kliiniset tutkimukset
ABILIFYn (aripipratsolin) oraalisten formulaatioiden tehokkuus vahvistettiin seuraavissa riittävissä ja hyvin kontrolloiduissa tutkimuksissa:
- Neljä lyhytaikaista tutkimusta ja yksi ylläpitotutkimus aikuispotilailla ja yksi lyhytaikainen tutkimus nuorilla (13-17-vuotiailla), joilla on skitsofrenia [ks. Kliiniset tutkimukset ]
- Neljä lyhytaikaista monoterapiatutkimusta ja yksi 6 viikon lisätutkimus aikuispotilailla ja yksi lyhytaikainen monoterapiatutkimus lapsipotilailla (ikä 1017), joilla on maanisia tai sekajaksoja [ks. Kliiniset tutkimukset ]
- Yksi ylläpitomonoterapiatutkimus ja yhdessä ylläpitoa tukeva lisätutkimus aikuispotilailla, joilla on kaksisuuntainen mielialahäiriö I [katso Kliiniset tutkimukset ]
- Kaksi lyhytaikaista tutkimusta aikuisilla MDD-potilailla, joilla ei ollut riittävä vaste masennuslääkehoitoon nykyisen jakson aikana [ks. Kliiniset tutkimukset ]
- Kaksi lyhytaikaista tutkimusta lapsipotilailla (6-17-vuotiaat) autistiseen häiriöön liittyvän ärtyneisyyden hoitoon [ks. Kliiniset tutkimukset ]
- Kaksi lyhytaikaista tutkimusta lapsipotilailla (6-18-vuotiaat), joilla on Touretten häiriö [ks. Kliiniset tutkimukset ]
ABILIFYn (aripipratsolin) injektoitavan formulaation tehokkuus vahvistettiin seuraavissa riittävissä ja hyvin kontrolloiduissa tutkimuksissa:
- Kolme 24 tunnin tutkimusta kiihtyneillä aikuispotilailla, joilla on skitsofrenia tai kaksisuuntaisen mielialahäiriön maanisia/sekamuotoisia jaksoja [ks. Kliiniset tutkimukset ]
Skitsofrenia
Aikuiset
ABILIFY 15 mg:n tehoa skitsofrenian hoidossa arvioitiin viidessä lyhytaikaisessa (4 viikkoa ja 6 viikkoa) lumekontrolloidussa tutkimuksessa akuutisti uusiutuneilla laitospotilailla, jotka täyttivät pääasiassa skitsofrenian DSM-III/IV-kriteerit. Neljä viidestä tutkimuksesta pystyi erottamaan ABILIFYn lumelääkkeestä, mutta yksi tutkimus, pienin, ei. Kolmeen näistä tutkimuksista sisältyi myös aktiivinen kontrolliryhmä, joka koostui joko risperidonista (yksi tutkimus) tai haloperidolista (kaksi tutkimusta), mutta niitä ei suunniteltu mahdollistamaan ABILIFY 20 mg:n ja aktiivisten vertailuaineiden vertailua.
ABILIFY 10 mg:n neljässä positiivisessa tutkimuksessa käytettiin neljää ensisijaista mittaa psykiatristen merkkien ja oireiden arvioimiseen. Teho arvioitiin positiivisten ja negatiivisten syndroomaasteikon (PANSS) kokonaispistemäärän avulla. PANSS on 30 kohdan asteikko, joka mittaa skitsofrenian positiivisia oireita (7 kohtaa), skitsofrenian negatiivisia oireita (7 kohtaa) ja yleistä psykopatologiaa (16 kohtaa), joista jokainen on arvioitu asteikolla 1 (ei poissa) 7 (äärimmäinen). ; PANSS-pistemäärät vaihtelevat 30:stä 210:een. Kliinisen globaalin vaikutelman (CGI) arviointi heijastaa taitavan tarkkailijan, joka on täysin perehtynyt skitsofrenian ilmenemismuotoihin, käsitystä potilaan kliinisestä yleistilasta.
Neljän viikon tutkimuksessa (n=414), jossa verrattiin kahta kiinteää ABILIFY-annosta (15 tai 30 mg/vrk) lumelääkkeeseen, molemmat ABILIFY 10 mg:n annokset olivat parempia kuin lumelääke PANSS-kokonaispisteissä (tutkimus 1 taulukossa 26). PANSS-positiivinen alaskaala ja CGI-vakavuuspisteet. Lisäksi 15 mg:n annos oli parempi kuin lumelääke PANSS-negatiivisella ala-asteikolla.
Neljän viikon tutkimuksessa (n = 404), jossa verrattiin kahta kiinteää ABILIFY-annosta (20 tai 30 mg/vrk) lumelääkkeeseen, molemmat ABILIFY-annokset olivat parempia kuin lumelääke PANSS-kokonaispisteissä (tutkimus 2 taulukossa 26), PANSS. positiivinen alaasteikko, PANSS negatiivinen alaasteikko ja CGI-vakavuuspisteet.
6 viikkoa kestäneessä tutkimuksessa (n = 420), jossa verrattiin kolmea kiinteää ABILIFY-annosta (10, 15 tai 20 mg/vrk) lumelääkkeeseen, kaikki kolme ABILIFY-annosta olivat parempia kuin lumelääke PANSS-kokonaispisteissä (tutkimus 3 taulukossa). 26), PANSS-positiivinen alaasteikko ja PANSS-negatiivinen alaasteikko.
viikkoa kestäneessä tutkimuksessa (n = 367), jossa verrattiin kolmea kiinteää ABILIFY-annosta (2, 5 tai 10 mg/vrk) lumelääkkeeseen, ABILIFYn 10 mg:n annos oli parempi kuin lumelääke PANSS-kokonaispisteissä (tutkimus 4. Taulukko 26), tutkimuksen ensisijainen tulosmitta. 2 ja 5 mg:n annokset eivät olleet parempia kuin lumelääke ensisijaisessa tulosmittauksessa.
Siten 10, 15, 20 ja 30 mg:n päivittäisten annosten tehokkuus vahvistettiin kahdessa tutkimuksessa kullekin annokselle. Näiden annosten joukossa ei ollut näyttöä siitä, että suuremman annoksen ryhmät olisivat tarjonneet mitään etua näiden tutkimusten pienimmän annoksen ryhmään verrattuna.
Väestön alaryhmien tarkastelu ei paljastanut mitään selkeitä todisteita iän, sukupuolen tai rodun perusteella eroavaisuuksista.
Pitkäkestoiseen tutkimukseen otettiin mukaan 310 skitsofrenian DSM-IV-kriteerit täyttävää sairaala- tai avohoitopotilasta, jotka olivat historian perusteella oireellisesti stabiileja muilla psykoosilääkkeillä vähintään 3 kuukauden ajan. Nämä potilaat lopettivat psykoosilääkityksensä ja satunnaistettiin saamaan ABILIFY 15 mg/vrk tai lumelääkettä 26 viikon ajan uusiutumisen varalta. Relapsi kaksoissokkovaiheen aikana määriteltiin CGI-parantumispisteeksi ≥ 5 (minimi huonompi), pisteiksi ≥ 5 (kohtalaisen vaikea) PANSS:n vihamielisyyden tai yhteistyökyvyttömyyden kohteissa tai ≥ 20 %:n kasvu PANSS-kokonaispisteissä. Potilailla, jotka saivat ABILIFY:tä 15 mg/vrk, oli merkittävästi pidempi relapsi seuraavien 26 viikon aikana verrattuna lumelääkettä saaneisiin potilaisiin (tutkimus 5 kuvassa 6).
Pediatriset potilaat
ABILIFY:n (aripipratsolin) tehoa skitsofrenian hoidossa lapsipotilailla (13-17-vuotiaat) arvioitiin yhdessä 6 viikon lumekontrolloidussa avohoidossa avopotilailla, jotka täyttivät skitsofrenian DSM-IV-kriteerit ja joilla oli PANSS-pisteet. ≥70 lähtötilanteessa. Tässä tutkimuksessa (n=302), jossa verrattiin kahta kiinteää ABILIFY-annosta (10 tai 30 mg/vrk) lumelääkkeeseen, ABILIFY 15 mg titrattiin alkaen annoksesta 2 mg/vrk tavoiteannokseen 5 päivässä 10 mg/vrk hoitohaarassa. ja 11 päivässä 30 mg/vrk hoitohaarassa. Molemmat ABILIFY-annokset olivat parempia kuin lumelääke PANSS-kokonaispisteissä (tutkimus 6 taulukossa 26), joka on tutkimuksen ensisijainen tulosmitta. 30 mg/vrk annoksen ei osoitettu olevan tehokkaampi kuin 10 mg/vrk annos. Vaikka ylläpitotehoa lapsipotilailla ei ole arvioitu systemaattisesti, ylläpitoteho voidaan ekstrapoloida aikuisten tiedoista sekä aripipratsolin farmakokineettisten parametrien vertailusta aikuisilla ja lapsipotilailla.
Kuva 6: Kaplan-Meier-arvio uusiutuvien potilaiden kumulatiivisesta osuudesta (Skitsofreniatutkimus 5) 
Kaksisuuntainen mielialahäiriö
Manisten ja sekajaksojen akuutti hoito
Aikuiset
Monoterapia
ABILIFY 10 mg:n teho monoterapiana maanisten jaksojen akuutissa hoidossa vahvistettiin neljässä 3 viikon lumekontrolloidussa tutkimuksessa sairaalahoidossa olevilla potilailla, jotka täyttivät DSM-IV:n kriteerit kaksisuuntaiselle mielialahäiriölle I, johon liittyy maanisia tai sekajaksoja. Näissä tutkimuksissa oli potilaita, joilla oli tai ei ollut psykoottisia piirteitä, ja kahteen tutkimukseen osallistui myös potilaita, joilla oli tai ei ollut nopea pyöräily.
Ensisijainen maanisten oireiden arvioinnissa käytetty instrumentti oli Young Mania Rating Scale (Y-MRS), 11-osainen kliinikon arvioima asteikko, jota käytetään perinteisesti arvioimaan maanisten oireiden astetta välillä 0 (ei maanisia piirteitä) - 60 ( enimmäispistemäärä). Tärkeä toissijainen instrumentti sisälsi kliinisen globaalin vaikutelman-kaksisuuntaisen mielialan (CGI-BP) -skaalan.
Neljässä positiivisessa, 3 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa (n=268; n=248; n=480; n=485), joissa arvioitiin ABILIFY-hoitoa 15–30 mg kerran vuorokaudessa (aloitusannoksen kanssa). 30 mg/vrk kahdessa tutkimuksessa ja 15 mg/vrk kahdessa tutkimuksessa), ABILIFY 20 mg/vrk oli parempi kuin lumelääke Y-MRS:n kokonaispistemäärän (tutkimukset 1-4 taulukossa 27) ja sairauden vakavuuden CGI-BP-pisteiden pienentämisessä. (mania). Kahdessa tutkimuksessa, joissa aloitusannos oli 15 mg/vrk, 48 % ja 44 % potilaista sai 15 mg/vrk päätepisteessä. Kahdessa tutkimuksessa, joissa aloitusannos oli 30 mg/vrk, 86 % ja 85 % potilaista sai 30 mg/vrk päätepisteessä.
Lisähoito
ABILIFYn ja samanaikaisen litiumin tai valproaatin tehokkuus maanisten tai sekavaiheiden hoidossa vahvistettiin 6 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa (n = 384), jossa annettiin 2 viikon mittainen mielialaa stabiloiva monoterapiavaihe aikuisilla potilailla. jotka täyttivät kaksisuuntaisen mielialahäiriön DSM-IV-kriteerit. Tähän tutkimukseen osallistui potilaita, joilla oli maanisia tai sekajaksoja ja joilla oli tai ei ollut psykoottisia piirteitä.
Potilaat aloitettiin avoimella litiumilla (0,6 - 1,0 mekv/l) tai valproaatilla (50 - 125 μg/ml) terapeuttisilla seerumitasoilla ja pysyivät vakailla annoksilla 2 viikkoa. Kahden viikon lopussa potilaat, joiden vaste (YMRS-kokonaispistemäärä ≥16 ja Y-MRS-kokonaispistemäärä ≤25 % parannus) litiumiin tai valproaattiin, satunnaistettiin saamaan joko ABILIFY-hoitoa (15 mg/vrk tai lisäys 30:een). mg/vrk jo 7. päivänä) tai lumelääkettä lisähoitona avoimen litiumin tai valproaatin kanssa. Kuuden viikon lumekontrolloidussa vaiheessa ABILIFY-lisähoito, joka aloitettiin annoksella 15 mg/vrk ja samanaikaisesti litiumia tai valproaattia (terapeuttisella alueella 0,6-1,0 mekv/l tai 50-125 µg/ml, vastaavasti) oli parempi kuin litiumin. tai valproaatti yhdessä lumelääkkeen kanssa YMRS:n kokonaispistemäärän (tutkimus 5 taulukossa 27) ja CGI-BP:n sairauden vaikeuspistemäärän (mania) pienentämiseksi. 71 prosenttia potilaista sai samanaikaisesti valproaattia ja 62 prosenttia potilaista, jotka saivat samanaikaisesti litiumia, 15 mg/vrk 6 viikon päätepisteessä.
Pediatriset potilaat
ABILIFY 15 mg:n tehoa I-tyypin kaksisuuntaisen mielialahäiriön hoidossa lapsipotilailla (10–17-vuotiaat) arvioitiin yhdessä 4 viikon lumekontrolloidussa tutkimuksessa (n=296), jossa avopotilaita täyttivät kaksisuuntaisen mielialahäiriön DSM-IV-kriteerit. I-häiriön maanisia tai sekajaksoja, joissa on psykoottisia piirteitä tai ei niitä, ja niiden Y-MRS-pistemäärä oli ≥20 lähtötilanteessa. Tässä kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa verrattiin kahta kiinteää ABILIFY-annosta (10 tai 30 mg/vrk) lumelääkkeeseen. ABILIFY 20 mg:n annos aloitettiin annoksella 2 mg/vrk, joka titrattiin 5 mg:aan/vrk 2 päivän kuluttua ja tavoiteannokseen 5 päivän kuluttua 10 mg/vrk hoitohaarassa ja 13 päivän kuluttua 30 mg/vrk. päivähoitovarsi. Molemmat 10 mg ABILIFY-annokset olivat parempia kuin lumelääke Y-MRS-kokonaispistemäärän muutoksissa lähtötasosta viikkoon 4 (tutkimus 6 taulukossa 27).
Kaksisuuntaisen mielialahäiriön I ylläpitohoito
Monoterapia ylläpitohoito
Ylläpitotutkimus suoritettiin aikuispotilailla, jotka täyttivät I-tyypin kaksisuuntaisen mielialahäiriön DSM-IV-kriteerit ja joilla oli äskettäinen maaninen tai sekajakso ja jotka oli stabiloitunut avoimella ABILIFY 20 mg -annoksella ja joilla oli säilynyt kliininen vaste vähintään 6 viikon ajan. Tämän tutkimuksen ensimmäinen vaihe oli avoin stabilointijakso, jossa sairaalapotilaat ja avopotilaat stabiloitiin kliinisesti ja pidettiin sitten avoimella ABILIFYllä (15 tai 30 mg/vrk, aloitusannos 30 mg/vrk) vähintään 6 peräkkäistä viikkoa. Satakuusikymmentäyksi avopotilasta satunnaistettiin kaksoissokkomenetelmällä joko samaan ABILIFY-annokseen, jota he käyttivät stabilointi- ja ylläpitojakson lopussa, tai lumelääkettä, ja sitten heitä seurattiin maanisten tai masennuksen uusiutumisen varalta. Satunnaistamisvaiheen aikana ABILIFY oli lumelääkettä parempi ajallaan yhdistettyjen mielialarelapsien (maaninen ja masennus) lukumäärään nähden, joka on tämän tutkimuksen ensisijainen tulosmitta (tutkimus 7 kuvassa 7). Yhteensä 55 mielialatapahtumaa havaittiin kaksoissokkohoitovaiheen aikana. 19 oli ABILIFY-ryhmästä ja 36 lumelääkeryhmästä. Havaittujen maanisten jaksojen määrä ABILIFY 15 mg -ryhmässä (6) oli pienempi kuin lumeryhmässä (19), kun taas masennusjaksojen määrä ABILIFY-ryhmässä (9) oli samanlainen kuin lumeryhmässä (11). .
Väestön alaryhmien tarkastelu ei paljastanut selkeitä todisteita iän ja sukupuolen perusteella erilaisesta reagointikyvystä; kussakin etnisessä ryhmässä ei kuitenkaan ollut riittävästi potilaita arvioidakseen riittävästi ryhmien välisiä eroja.
Kuva 7: Kaplan-Meier-arvio potilaiden, joilla on uusiutuminen, kumulatiivisen osuuden (kaksisuuntainen mielialatutkimus 7) 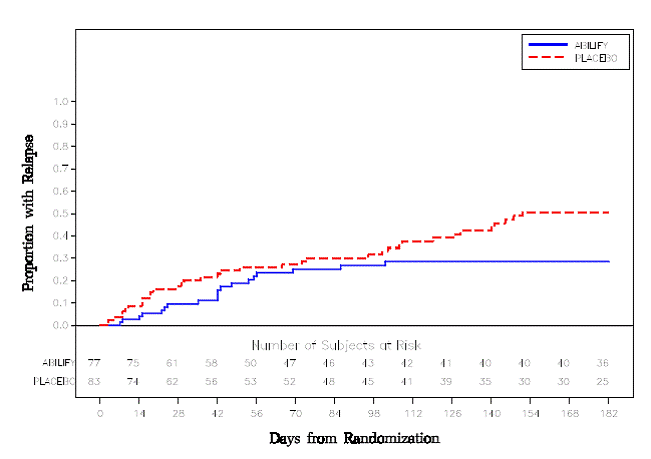
Täydentävä ylläpitohoito
Lisäylläpitotutkimus suoritettiin aikuispotilailla, jotka täyttivät I-tyypin kaksisuuntaisen mielialahäiriön DSMIV-kriteerit ja joilla oli äskettäinen maaninen tai sekamuotoinen episodi. Potilaat aloitettiin avoimella litiumilla (0,6 - 1,0 mekv/l) tai valproaatilla (50 - 125 μg/ml) terapeuttisilla seerumitasoilla ja pysyivät vakailla annoksilla 2 viikkoa. Kahden viikon lopussa potilaat, joiden vaste (Y-MRS-kokonaispistemäärä ≥16 ja Y-MRS-kokonaispistemäärä parani ≤35 %) litiumiin tai valproaattiin, sai ABILIFY-hoitoa aloitusannoksella 15 mg/vrk valinnaisena nostaa 30 mg:aan tai vähentää 10 mg:aan jo 4. päivänä avoimen litiumin tai valproaatin lisähoitona. Ennen satunnaistamista yksittäissokko ABILIFYn ja litiumin tai valproaatin yhdistelmää saaneiden potilaiden piti säilyttää stabiilisuus (Y-MRS- ja MADRS-kokonaispisteet ≤12) 12 peräkkäisen viikon ajan. Kolmesataakolmekymmentäseitsemän potilasta satunnaistettiin kaksoissokkomenetelmällä joko samaan 20 mg:n ABILIFY-annokseen, jota he käyttivät stabilointijakson lopussa tai lumelääkettä plus litiumia tai valproaattia, ja sitten heitä seurattiin maanisten, seka- tai masennuksen uusiutumista enintään 52 viikon ajan. ABILIFY 15 mg oli parempi kuin lumelääke ensisijaisessa päätetapahtumassa, aika satunnaistamisesta uusiutumiseen mielialatapahtumaan (tutkimus 8 kuvassa 8). Mielialatapahtumaksi määriteltiin sairaalahoito maanisen, sekalaisen tai masennusjakson vuoksi, tutkimuksen keskeyttäminen tehon puutteen vuoksi, johon liittyi Y-MRS-pistemäärä >16 ja/tai MADRS >16, tai sairauden pahenemisen SAE, johon liittyy Y- MRS-pisteet >16 ja/tai MADRS >16. Yhteensä 68 mielialatapahtumaa havaittiin kaksoissokkohoitovaiheen aikana. 25 oli ABILIFY 20 mg -ryhmästä ja 43 lumelääkeryhmästä. Havaittujen maanisten jaksojen määrä ABILIFY 15 mg -ryhmässä (7) oli pienempi kuin lumeryhmässä (19), kun taas masennusjaksojen määrä ABILIFY-ryhmässä (14) oli samanlainen kuin lumeryhmässä (18). . Kaplan-Meier-käyrät ajasta satunnaistamisesta uusiutumiseen mihin tahansa mielialatapahtumaan 52 viikon kaksoissokkoutetussa hoitovaiheessa ABILIFY 10 mg:n ja lumelääkeryhmille on esitetty kuvassa 8.
Kuva 8: Kaplan-Meier-arvio niiden potilaiden kumulatiivisesta osuudesta, joilla on uusiutuminen mihin tahansa mielialatapahtumaan (kaksisuuntainen mielialatutkimus 8) 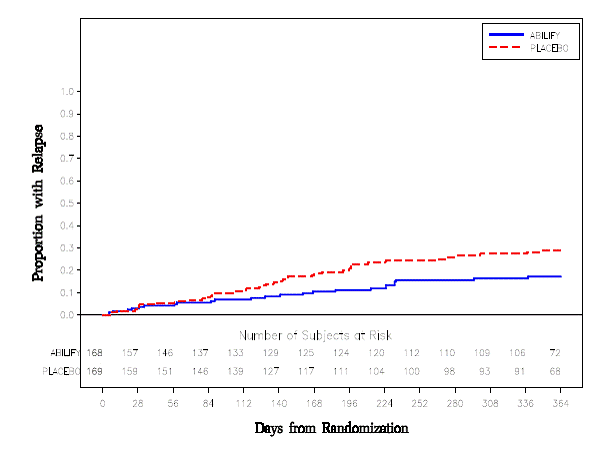
Väestön alaryhmien tarkastelu ei paljastanut selkeitä todisteita iän ja sukupuolen perusteella erilaisesta reagointikyvystä; kussakin etnisessä ryhmässä ei kuitenkaan ollut riittävästi potilaita arvioidakseen riittävästi ryhmien välisiä eroja.
Vakavan masennushäiriön lisähoito
Aikuiset
ABILIFY 15 mg:n teho masennuksen (MDD) lisähoidossa osoitettiin kahdessa lyhytaikaisessa (6 viikkoa) lumekontrolloidussa tutkimuksessa aikuispotilailla, jotka täyttivät MDD:n DSM-IV-kriteerit ja joilla ei ollut riittävä vaste aiempaa masennuslääkehoitoa (1–3 kurssia) nykyisen jakson aikana ja jotka olivat myös osoittaneet riittämättömän vasteen 8 viikon mahdolliseen masennuslääkehoitoon (kontrolloidusti vapautuva paroksetiini, venlafaksiini pitkittyvästi vapauttava, fluoksetiini, essitalopraami tai sertraliini). Riittämättömäksi vasteeksi tulevaa hoitoa varten määriteltiin alle 50 %:n parantuminen Hamilton Depression Rating Scale (HAMD17) -asteikon 17 pisteen versiosta, HAMD17:n vähimmäispistemääräksi 14 ja Clinical Global Impressions Improvement -luokitukseksi, joka oli vain minimaalista parannusta. Riittämätön vaste aikaisempaan hoitoon määriteltiin alle 50 %:n parantumiseksi, jonka potilas havaitsi vähintään 6 viikon masennuslääkehoidon jälkeen vähimmäisteholla tai sitä suuremmalla annoksella.
Ensisijainen masennusoireiden arvioinnissa käytetty instrumentti oli Montgomery-Asberg Depression Rating Scale (MADRS), joka on 10 kohdan kliinikon arvioima asteikko, jota käytettiin masennuksen oireiden asteen arvioimiseen. Keskeinen toissijainen instrumentti oli Sheehan Disability Scale (SDS), 3-osainen itsearvioitu mittari, jota käytettiin arvioimaan masennuksen vaikutusta kolmeen toiminta-alueeseen, ja jokainen kohta pisteytettiin 0:sta (ei ollenkaan) 10:een (äärimmäinen).
Kahdessa tutkimuksessa (n = 381, n = 362) ABILIFY 15 mg alensi keskimääräisiä MADRS-kokonaispisteitä paremmin kuin lumelääke (tutkimukset 1, 2 taulukossa 28). Yhdessä tutkimuksessa ABILIFY oli myös parempi kuin lumelääke keskimääräisen SDS-pistemäärän pienentämisessä.
Molemmissa tutkimuksissa potilaat saivat ABILIFY 15 mg masennuslääkkeiden lisänä annoksella 5 mg/vrk. Siedettävyyden ja tehon perusteella annoksia voitiin säätää 5 mg:n välein viikon välein. Sallitut annokset olivat: 2, 5, 10, 15 mg/vrk ja potilaille, jotka eivät saaneet voimakkaita CYP2D6-estäjiä fluoksetiinia ja paroksetiinia, 20 mg/vrk. Keskimääräinen lopullinen annos loppupisteessä molemmissa kokeissa oli 10,7 ja 11,4 mg/vrk.
Väestön alaryhmien tarkastelu ei paljastanut todisteita erilaisesta vasteesta iän, mahdollisen masennuslääkkeen valinnan tai rodun perusteella. Sukupuolen osalta MADRS-kokonaispisteiden keskimääräinen lasku oli pienempi miehillä kuin naisilla.
Autistiseen häiriöön liittyvä ärtyneisyys
Pediatriset potilaat
ABILIFY:n (aripipratsolin) teho autistiseen häiriöön liittyvän ärtyneisyyden hoidossa vahvistettiin kahdessa 8 viikon lumekontrolloidussa tutkimuksessa lapsipotilailla (6-17-vuotiaat), jotka täyttivät DSM-IV:n kriteerit autistiselle häiriölle ja osoittanut käyttäytymistä, kuten raivokohtauksia, aggressiota, itseään vahingoittavaa käyttäytymistä tai näiden ongelmien yhdistelmää. Yli 75 % näistä koehenkilöistä oli alle 13-vuotiaita.
Tehoa arvioitiin käyttämällä kahta arviointiasteikkoa: Aberrant Behavior Checklist (ABC) ja Clinical Global Impression-Improvement (CGI-I) -asteikko. Ensisijainen tulosmitta molemmissa tutkimuksissa oli muutos lähtötilanteesta päätepisteeseen ABC:n ärtyvyys-ala-asteikolla (ABC-I). ABC-I-alaasteikko mittasi ärtyneisyyden oireita autistisessa häiriössä.
Näiden kokeiden tulokset ovat seuraavat:
Yhdessä 8 viikkoa kestäneistä lumekontrolloiduista tutkimuksista lapset ja nuoret, joilla oli autistinen sairaus (n=98), iältään 6–17-vuotiaat, saivat päivittäin lumelääkettä tai ABILIFYä 2–15 mg/vrk. ABILIFY, joka aloitettiin annoksesta 2 mg/vrk ja lisäys sallittiin 15 mg:aan/vrk kliinisen vasteen perusteella, paransi merkitsevästi ABC-I-ala-asteikon ja CGI-I-asteikon pisteitä lumelääkkeeseen verrattuna. Keskimääräinen vuorokausiannos ABILIFY 10 mg 8 viikon hoidon lopussa oli 8,6 mg/vrk (tutkimus 1 taulukossa 29).
Toisessa 8 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa autistisista häiriöistä kärsivillä lapsilla ja nuorilla (n=218), iältään 6–17 vuotta, kolme kiinteää ABILIFY-annosta (5 mg/vrk, 10 mg/vrk tai 15 mg/vrk) päivä) verrattiin lumelääkkeeseen. ABILIFY-annos aloitettiin annoksella 2 mg/vrk ja nostettiin 5 mg:aan/vrk viikon kuluttua. Toisen viikon jälkeen se nostettiin 10 mg:aan/vrk potilailla, jotka saivat 10 ja 15 mg:n annosryhmiä, ja kolmannen viikon jälkeen se nostettiin 15 mg:aan/vrk 15 mg/vrk hoitoryhmässä (tutkimus 2 Taulukko 29). Kaikki kolme ABILIFY-annosta paransivat merkittävästi ABC-I-ala-asteikkopisteitä lumelääkkeeseen verrattuna.
Touretten häiriö
Pediatriset potilaat
ABILIFYn (aripipratsolin) teho Touretten sairauden hoidossa varmistettiin yhdessä 8 viikon (7–17-vuotiaat) ja yhdessä 10 viikon (6–18-vuotiaat) lumelääkekontrolloidussa tutkimuksessa. lapsipotilaat (6–18-vuotiaat), jotka täyttivät Touretten häiriön DSM-IV-kriteerit ja joiden Tic-pistemäärä (TTS) oli ≥ 20 - 22 Yalen Global Tic Severity Scale -asteikolla (YGTSS). YGTSS on täysin validoitu asteikko, joka on suunniteltu mittaamaan nykyisen tic-vakavuuden. Tehoa arvioitiin käyttämällä kahta arviointiasteikkoa: 1) YGTSS:n Tic-pistemäärä (TTS) ja 2) Touretten oireyhtymän kliininen globaali näyttökertojen asteikko (CGI-TS), kliinikon määrittämä yhteenvetomitta, joka ottaa huomioon kaikki saatavilla olevat potilastiedot. Yli 65 % näistä potilaista oli alle 13-vuotiaita.
Ensisijainen tulosmitta molemmissa tutkimuksissa oli muutos lähtötilanteesta päätepisteeseen YGTSS:n TTS:ssä. TTS:n arvosanat tehdään 5 eri mittasuhteella asteikolla 0-5 sekä motoriselle että äänelle. Näiden 10 pisteen summaus antaa TTS:n (eli 0-50).
Näiden kokeiden tulokset ovat seuraavat:
Kahdeksan viikkoa kestäneessä lumekontrolloidussa kiinteäannoksisessa tutkimuksessa Touretten häiriötä sairastavat lapset ja nuoret (n=133), iältään 7–17-vuotiaat, satunnaistettiin suhteessa 1:1:1 pieniannoksiseen ABILIFY-annokseen. ABILIFY 15 mg tai lumelääke. Tavoiteannokset pienen ja suuren annoksen ABILIFY 10 mg -ryhmille perustuivat painoon. Potilaat, joiden paino on
Kuva 9: Pienin neliömetrin muutos lähtötasosta YGTSS TTS:ssä viikoittain (Tourette's Disorder Study 1) 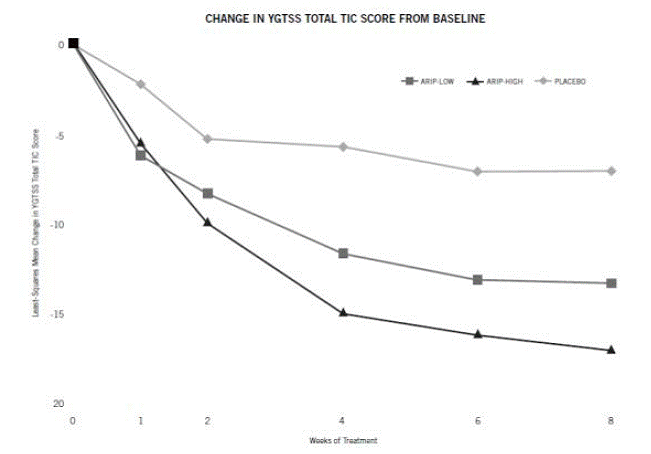
10 viikkoa kestäneessä, lumekontrolloidussa, joustavalla annoksella tehdyssä tutkimuksessa Touretten häiriötä sairastavilla lapsilla ja nuorilla (n=61), iältään 6–18 vuotta, potilaat saivat päivittäin lumelääkettä tai ABILIFY-annoksia alkaen annoksesta 2 mg/ vuorokaudessa ja lisäys sallittu 20 mg:aan/vrk kliinisen vasteen perusteella. ABILIFY osoitti tilastollisesti merkitsevästi parempia pisteitä YGTSS TTS -asteikolla lumelääkkeeseen verrattuna (tutkimus 2 taulukossa 30). ABILIFYn keskimääräinen vuorokausiannos 10 viikon hoidon lopussa oli 6,54 mg/vrk.
Skitsofreniaan tai kaksisuuntaiseen mielialamaniaan liittyvä kiihtymys
Lihakseen annettavan ABILIFY-injektion teho kiihtyneisyyden hoidossa vahvistettiin kolmessa lyhytaikaisessa (24 tunnin) lumekontrolloidussa tutkimuksessa kiihtyneillä laitospotilailla kahdesta diagnostisesta ryhmästä: skitsofrenia ja kaksisuuntainen mielialahäiriö I (maaniset tai sekajaksot, joihin liittyy tai ilman psykoottisia piirteitä). Kuhunkin tutkimukseen sisältyi yksi aktiivinen vertailuhoitohaara joko haloperidoli-injektiolla (skitsofreniatutkimukset) tai loratsepaami-injektiolla (kaksisuuntaisen mielialahäiriön maniatutkimus). Potilaat voivat saada enintään kolme injektiota 24 tunnin hoitojakson aikana; potilaat eivät kuitenkaan voineet saada toista injektiota ennen kuin ensimmäisen 2 tunnin jakson jälkeen, jolloin ensisijainen tehokkuus oli arvioitu. Tutkimuksiin osallistuneiden potilaiden piti: (1) arvioida kliiniset tutkijat kliinisesti kiihtyneiksi ja kliinisesti sopiviksi ehdokkaiksi hoidettavaksi lihaksensisäisellä lääkityksellä ja (2) levottomuutta, joka saavutti tai ylitti kynnysarvon ≥15 viisi kohtaa, jotka sisältävät positiivisen ja negatiivisen oireyhtymäasteikon (PANSS) jännittyneen komponentin (eli huono impulssinhallinta, jännitys, vihamielisyys, yhteistyökyvyttömyys ja jännityskohteet), joissa on vähintään kaksi yksittäistä kohtaa ≥ 4 pisteytysjärjestelmällä 1-7 (1) = poissa, 4 = kohtalainen, 7 = äärimmäinen). Tutkimuksissa keskimääräinen lähtötason PANSS Excited Component -pistemäärä oli 19, ja pisteet vaihtelivat välillä 15-34 (maksimipistemäärästä 35), mikä viittaa pääosin kohtalaiseen kiihtyneisyyteen ja joillakin potilailla oli lievää tai vaikeaa levottomuutta. Ensisijainen tehon mitta, jota käytettiin kiihtyneisyyden merkkien ja oireiden arvioinnissa näissä tutkimuksissa, oli PANSS Excited Componentin muutos lähtötasosta 2 tuntia injektion jälkeen. Keskeinen toissijainen mitta oli CGI-I (Clinical Global Impression of Improvement) -asteikko. Kokeiden tulokset ovat seuraavat:
Plasebokontrolloidussa tutkimuksessa kiihtyneillä laitospotilailla, jotka täyttivät pääasiassa skitsofrenian DSM-IV-kriteerit (n = 350), arvioitiin neljä kiinteää ABILIFY 20 mg injektioannosta 1 mg, 5,25 mg, 9,75 mg ja 15 mg. 2 tuntia injektion jälkeen annokset 5,25 mg, 9,75 mg ja 15 mg olivat tilastollisesti parempia kuin lumelääke PANSS Excited Component -tutkimuksessa (tutkimus 1 taulukossa 31) ja CGII-asteikolla.
Toisessa lumekontrolloidussa tutkimuksessa kiihtyneillä laitospotilailla, jotka täyttivät pääasiassa skitsofrenian DSM-IV-kriteerit (n=445), arvioitiin yksi kiinteä ABILIFY 15 mg:n injektioannos 9,75 mg. 2 tuntia injektion jälkeen ABILIFY for injektio oli tilastollisesti parempi kuin lumelääke PANSS Excited -komponentissa (tutkimus 2 taulukossa 31) ja CGI-I-asteikolla.
Lumekontrolloidussa tutkimuksessa levottomilla laitospotilailla, jotka täyttivät kaksisuuntaisen mielialahäiriön (maaninen tai sekamuotoinen) DSMIV-kriteerit (n = 291), arvioitiin kaksi kiinteää ABILIFY 10 mg:n injektioannosta 9,75 mg ja 15 mg. 2 tuntia injektion jälkeen molemmat annokset olivat tilastollisesti parempia kuin lumelääke PANSS Excited -komponentissa (tutkimus 3 taulukossa 31).
Väestön alaryhmien (ikä, rotu ja sukupuoli) tarkastelu ei paljastanut mitään eroavaa vastetta näiden alaryhmien perusteella.
POTILASTIEDOT
ABILIFY® (aripipratsoli) Tabletit
ABILIFY DISCMELT® (aripipratsoli) Suun kautta hajoavat tabletit
ABILIFY® (aripipratsoli) Oraaliliuos
ABILIFY® (aripipratsoli) Injektio Vain lihaksensisäiseen käyttöön
Mikä on tärkein tieto, joka minun pitäisi tietää ABILIFY 20mg:sta?
(Muut sivuvaikutukset, katso myös "Mitä ovat ABILIFYn mahdolliset sivuvaikutukset?")
Vakavia sivuvaikutuksia saattaa ilmetä, kun otat ABILIFYä, mukaan lukien:
- Suurentunut kuolinriski iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi: Lääkkeet, kuten ABILIFY 10mg, voivat lisätä kuolemanriskiä vanhuksilla, jotka ovat menettäneet yhteyden todellisuuteen (psykoosi) sekavuuden ja muistin heikkenemisen (dementian) vuoksi. ABILIFYä ei ole hyväksytty dementiaan liittyvää psykoosia sairastavien potilaiden hoitoon.
- Itsemurha-ajatusten tai -tekojen riski: Masennuslääkkeet, masennus ja muut vakavat mielisairaudet sekä itsetuhoiset ajatukset tai teot:
1. Masennuslääkkeet voivat lisätä itsemurha-ajatuksia tai -toimia joillakin lapsilla, teini-ikäisillä ja nuorilla aikuisilla hoidon ensimmäisten kuukausien aikana.
2. Masennus ja muut vakavat mielen sairaudet ovat tärkeimmät syyt itsemurha-ajatuksiin ja -toimiin. Joillakin ihmisillä voi olla erityisen suuri riski saada itsetuhoisia ajatuksia tai toimia. Näitä ovat ihmiset, joilla on kaksisuuntainen mielialahäiriö (tai maanis-depressiivinen sairaus) tai itsetuhoisia ajatuksia tai tekoja.
3. Miten voin tarkkailla ja yrittää estää itsetuhoisia ajatuksia ja tekoja itsessäni tai perheenjäsenessäni?
- Kiinnitä huomiota kaikkiin muutoksiin, erityisesti äkillisiin muutoksiin mielialassa, käyttäytymisessä, ajatuksissa tai tunteissa. Tämä on erittäin tärkeää, kun masennuslääke aloitetaan tai annosta muutetaan.
- Soita välittömästi terveydenhuollon tarjoajalle ilmoittaaksesi uusista tai äkillisistä mielialan, käyttäytymisen, ajatusten tai tunteiden muutoksista.
- Pidä kaikki seurantakäynnit terveydenhuollon tarjoajan kanssa aikataulun mukaisesti. Soita terveydenhuollon tarjoajalle käyntien välillä tarvittaessa, varsinkin jos olet huolissasi oireista.
Soita välittömästi terveydenhuollon tarjoajalle, jos sinulla tai perheenjäsenelläsi on jokin seuraavista oireista, varsinkin jos ne ovat uusia, pahempia tai huolestuttavia:
- ajatuksia itsemurhasta tai kuolemasta
- yrittää itsemurhaa
- uusi tai pahempi masennus
- uusi tai pahempi ahdistus
- hyvin kiihtynyt tai levoton olo
- paniikkikohtaukset
- unihäiriöt (unettomuus)
- uusi tai pahempi ärtyneisyys
- käyttäytyy aggressiivisesti, on vihainen tai väkivaltainen
- vaarallisten impulssien vaikutuksesta
- äärimmäinen lisääntynyt aktiivisuus ja puhuminen (mania)
- muita epätavallisia muutoksia käyttäytymisessä tai mielialassa
Mitä muuta minun on tiedettävä masennuslääkkeistä?
- Älä koskaan lopeta masennuslääkettä keskustelematta ensin terveydenhuollon tarjoajan kanssa. Masennuslääkehoidon äkillinen lopettaminen voi aiheuttaa muita oireita.
- Masennuslääkkeet ovat lääkkeitä, joita käytetään masennuksen ja muiden sairauksien hoitoon. On tärkeää keskustella kaikista masennuksen hoidon riskeistä ja myös riskeistä, jos sitä ei hoideta. Potilaiden ja heidän perheidensä tai muiden hoitajien tulee keskustella terveydenhuollon tarjoajan kanssa kaikista hoitovaihtoehdoista, ei vain masennuslääkkeiden käytöstä.
- Masennuslääkkeillä on muita sivuvaikutuksia. Keskustele terveydenhuollon tarjoajan kanssa sinulle tai perheenjäsenellesi määrätyn lääkkeen sivuvaikutuksista.
- Masennuslääkkeet voivat olla vuorovaikutuksessa muiden lääkkeiden kanssa. Tiedä kaikki lääkkeet, joita sinä tai perheenjäsenesi käytät. Pidä luettelo kaikista lääkkeistä näyttääksesi terveydenhuollon tarjoajalle. Älä aloita uusia lääkkeitä keskustelematta ensin terveydenhuollon tarjoajalta.
- Kaikki lapsille määrätyt masennuslääkkeet eivät ole FDA:n hyväksymiä lapsille. Pyydä lisätietoja lapsesi terveydenhuollon tarjoajalta.
Mikä on ABILIFY?
- ABILIFY 20mg suun kautta otettavat tabletit, suun kautta hajoavat tabletit ja oraaliliuos ovat reseptilääkkeitä, joita käytetään seuraavien hoitoon:
- Skitsofrenia
- maaniset tai sekajaksot, joita esiintyy kaksisuuntaisen mielialahäiriön I kanssa
- vakava masennushäiriö (MDD), kun ABILIFY 20 mg:aa käytetään yhdessä masennuslääkkeiden kanssa
- autistiseen häiriöön liittyvä ärtyneisyys
- Touretten sairaus
- ABILIFY-injektio on reseptilääke, jota käytetään:
- levottomuutta, joka liittyy skitsofreniaan tai kaksisuuntaiseen mielialamaniaan
Ei tiedetä, onko ABILIFY 10mg turvallinen tai tehokas lapsille:
- alle 13-vuotiaat, joilla on skitsofrenia
- alle 10-vuotiaat, joilla on kaksisuuntainen mielialahäiriö I
- alle 6-vuotiaat, joilla on autistiseen häiriöön liittyvää ärtyneisyyttä
- alle 6-vuotiaat, joilla on Touretten sairaus
Älä ota ABILIFY 20 mg -valmistetta, jos olet allerginen aripipratsolille tai jollekin ABILIFYn aineosalle. Katso tämän lääkitysoppaan lopusta täydellinen luettelo ABILIFYn ainesosista.
Ennen kuin otat ABILIFY 15 mg -valmistetta, kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, mukaan lukien jos sinulla on tai on ollut:
- diabetes tai korkea verensokeri sinulla tai perheelläsi; terveydenhuollon tarjoajan tulee tarkistaa verensokerisi ennen ABILIFY 10 mg -hoidon aloittamista ja myös hoidon aikana.
- kohtaukset (kouristukset).
- matala tai korkea verenpaine.
- sydänongelmia tai aivohalvausta.
- raskaus tai suunnittelet raskautta. Ei tiedetä, vahingoittaako ABILIFY sikiötäsi.
- Jos tulet raskaaksi ABILIFY 10mg -hoidon aikana, keskustele terveydenhuollon tarjoajasi kanssa rekisteröitymisestä National Pregnancy Registry for Atyyppisten antipsykoottien rekisteriin. Voit rekisteröityä soittamalla numeroon 1-866-961-2388 tai menemällä osoitteeseen http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- imetät tai aiot imettää. ABILIFY erittyy äidinmaitoon. Keskustele terveydenhuollon tarjoajan kanssa parhaasta tavasta ruokkia vauvasi, jos saat ABILIFY-valmistetta.
- alhainen valkosolujen määrä.
- fenyyliketonuria. ABILIFY DISCMELT suussa hajoavat tabletit sisältävät fenyylialaniinia.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät.
ABILIFY ja muut lääkkeet voivat vaikuttaa toisiinsa aiheuttaen mahdollisia vakavia sivuvaikutuksia. ABILIFY voi vaikuttaa muiden lääkkeiden tehoon, ja muut lääkkeet voivat vaikuttaa ABILIFYn toimintaan.
Terveydenhuollon tarjoaja voi kertoa sinulle, onko ABILIFYn ottaminen muiden lääkkeiden kanssa turvallista. Älä aloita tai lopeta lääkkeitä ABILIFY-hoidon aikana keskustelematta ensin terveydenhuollon tarjoajan kanssa. Tunne käyttämäsi lääkkeet. Pidä luetteloa lääkkeistäsi näyttääksesi terveydenhuollon tarjoajalle ja apteekkihenkilökunnalle, kun saat uuden lääkkeen.
Kuinka minun pitäisi ottaa ABILIFY 20 mg?
- Ota ABILIFY 10 mg juuri sen verran kuin lääkärisi on määrännyt. Älä muuta annosta tai lopeta ABILIFYn käyttöä itse.
- ABILIFY 20 mg voidaan ottaa ruoan kanssa tai ilman.
- ABILIFY-tabletit tulee niellä kokonaisina.
- Jos unohdat ottaa ABILIFY 20 mg -annoksen, ota unohtunut annos heti kun muistat. Jos on melkein seuraavan annoksen aika, jätä unohtunut annos väliin ja ota seuraava annos normaaliin aikaan. Älä ota kahta ABILIFY 10 mg -annosta samanaikaisesti.
- Jos sinulle on määrätty ABILIFY DISCMELTiä, ota se seuraavasti:
- Älä avaa läpipainopakkausta ennen kuin olet valmis ottamaan DISCMELT-tabletin.
- Poista yksi DISCMELT-tabletti avaamalla pakkaus ja poistamalla läpipainopakkauksen folio, jotta tabletti tulee näkyviin.
- Älä työnnä tablettia kalvon läpi, koska se voi vahingoittaa tablettia.
- Välittömästi läpipainopakkauksen avaamisen jälkeen poista tabletti kuivin käsin ja aseta koko ABILIFY DISCMELT suussa hajoava tabletti kielelle.
- Tabletti hajoaa nopeasti syljessä. On suositeltavaa ottaa ABILIFY 10 mg DISCMELT ilman nestettä. Tarvittaessa se voidaan kuitenkin ottaa nesteen kanssa.
- Älä yritä halkaista DISCMELT-tablettia.
- Jos otat liian paljon ABILIFY-valmistetta, soita välittömästi terveydenhuollon tarjoajalle tai myrkytystietokeskukseen numeroon 1-800-222-1222 tai mene lähimmän sairaalan ensiapuun.
Mitä minun tulee välttää ABILIFY 10mg -hoidon aikana?
- Älä aja, käytä raskaita koneita tai tee muuta vaarallista toimintaa, ennen kuin tiedät, kuinka ABILIFY 10mg vaikuttaa sinuun. ABILIFY 20 mg voi tehdä sinut uneliaaksi.
- Vältä ylikuumenemista tai kuivumista.
- Älä liioittele.
- Kuumalla säällä pysy sisällä viileässä paikassa, jos mahdollista.
- Pysy poissa auringosta. Älä käytä liikaa tai raskaita vaatteita.
- Juo runsaasti vettä.
Mitkä ovat ABILIFYn mahdolliset sivuvaikutukset?
ABILIFY 10mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää ABILIFY 10mg:sta?"
- Aivohalvaus iäkkäillä ihmisillä (aivoverisuoniongelmat), joka voi johtaa kuolemaan
- Maligni neuroleptinen oireyhtymä (NMS). Kerro heti terveydenhuollon tarjoajalle, jos sinulla on jokin tai kaikki seuraavista oireista: korkea kuume, lihasjäykkyys, sekavuus, hikoilu, muutokset pulssissa, sykkeessä ja verenpaineessa. Nämä voivat olla oireita harvinaisesta ja vakavasta sairaudesta, joka voi johtaa kuolemaan. Soita heti terveydenhuollon tarjoajallesi, jos sinulla on jokin näistä oireista.
- Hallitsemattomat kehon liikkeet (tardiivi dyskinesia). ABILIFY voi aiheuttaa liikkeitä, joita et voi hallita kasvoissasi, kielessäsi tai muissa kehon osissa. Tardiivi dyskinesia ei välttämättä häviä, vaikka lopettaisit ABILIFYn käytön. Tardiivi dyskinesia voi alkaa myös sen jälkeen, kun lopetat ABILIFY-hoidon.
- Ongelmia aineenvaihdunnassasi, kuten:
- Korkea verensokeri (hyperglykemia) ja diabetes. Joillakin ABILIFYä käyttävillä ihmisillä voi esiintyä verensokerin nousua. Erittäin korkea verensokeri voi johtaa koomaan tai kuolemaan. Jos sinulla on diabetes tai diabeteksen riskitekijöitä (kuten ylipainoinen tai suvussasi on diabetes), terveydenhuollon ammattilaisen tulee tarkistaa verensokerisi ennen ABILIFY-hoidon aloittamista ja hoidon aikana.
Soita terveydenhuollon tarjoajallesi, jos sinulla on jokin näistä korkean verensokerin oireista ABILIFY-hoidon aikana:
- tuntuu kovin janoiselta
- täytyy virtsata tavallista enemmän
- tuntuu kovin nälkäiseltä
- tuntuu heikolta tai väsyneeltä
- tuntuu pahalta vatsassasi
- olet hämmentynyt tai hengityksesi tuoksuu hedelmäiseltä
- Lisääntynyt rasvapitoisuus (kolesteroli ja triglyseridit) veressäsi.
- Painonnousu. Sinun ja terveydenhuollon tarjoajasi tulee tarkistaa painosi säännöllisesti.
- Epätavalliset halut. Joillakin ABILIFY 15 mg -valmistetta käyttävillä ihmisillä on ollut epätavallisia haluja, kuten uhkapelaamista, ahmimishalua tai syömistä, jota et voi hallita (kompulsiivinen), pakko-ostoksilla ja seksuaalisia haluja. Jos sinä tai perheenjäsenesi huomaat, että sinulla on epätavallisia haluja tai käyttäytymistä, keskustele terveydenhuollon tarjoajan kanssa.
- Ortostaattinen hypotensio (verenpaineen lasku). Huimausta tai pyörtymistä voi esiintyä noustessa liian nopeasti istuma- tai makuuasennosta.
- Falls. ABILIFY saattaa tehdä sinut uneliaaksi tai huimausta, saattaa aiheuttaa verenpaineesi laskua asentoa vaihtaessasi ja voi hidastaa ajatteluasi ja motorisia taitojasi, mikä voi johtaa kaatumisiin, jotka voivat aiheuttaa murtumia tai muita vammoja.
- Alhainen valkosolujen määrä
- Kohtaukset (kouristukset)
- Ongelmia kehon lämpötilan hallinnassa erityisesti silloin, kun harjoittelet paljon tai olet alueella, joka on erittäin kuuma. On tärkeää, että juot vettä kuivumisen välttämiseksi. Katso "Mitä minun tulee välttää ABILIFY 15mg -hoidon aikana?"
- Nielemisvaikeudet, jotka voivat aiheuttaa ruoan tai nesteen pääsyn keuhkoihin.
ABILIFY 10 mg:n yleisimmät sivuvaikutukset aikuisilla ovat:
- Pahoinvointi
- huimaus
- oksentelua
- ahdistusta
- ummetus
- unettomuus
- päänsärky
- levottomuus
- näön hämärtyminen
- ylempien hengitysteiden sairaus
- sisäinen levottomuus/liikkumisen tarve (akatisia)
ABILIFYn yleisimmät sivuvaikutukset lapsilla ovat:
- tuntea itsensä väsyneeksi
- unettomuus
- päänsärky
- pahoinvointi
- oksentelua
- tukkoinen nenä
- väsymys
- painonnousu
- lisääntynyt tai vähentynyt ruokahalu
- hallitsemattomat liikkeet, kuten levottomuus, vapina
- lisääntynyt syljeneritys tai kuolaa
- lihasten jäykkyys
Nämä eivät ole kaikki ABILIFYn mahdollisia sivuvaikutuksia.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää ABILIFY?
- Säilytä ABILIFY 15 mg huoneenlämmössä, 20 °C - 25 °C (68–77 °F).
- Avattuja ABILIFY 10 mg oraaliliuospulloja voidaan käyttää enintään 6 kuukautta avaamisen jälkeen, mutta ei pullossa olevan viimeisen käyttöpäivämäärän jälkeen.
Pidä ABILIFY ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa ABILIFYn turvallisesta ja tehokkaasta käytöstä
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä ABILIFY 20 mg -valmistetta sairauteen, johon sitä ei ole määrätty. Älä anna ABILIFY 20 mg:aa muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä. Voit kysyä terveydenhuollon tarjoajaltasi tai apteekista tietoja ABILIFY 10mg -valmisteesta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Mitä ainesosia ABILIFY sisältää?
Aktiivinen ainesosa: aripipratsoli
Inaktiiviset ainesosat:
maissitärkkelys, hydroksipropyyliselluloosa, laktoosimonohydraatti, magnesiumstearaatti ja mikrokiteinen selluloosa. Väriaineita ovat rautaoksidi (keltainen tai punainen) ja FD&C Blue No. 2 Aluminium Lake
ABILIFY 10mg DISCMELT suussa hajoavat tabletit: asesulfaamikalium, aspartaami (joka sisältää fenyylialaniinia), kalsiumsilikaatti, kroskarmelloosinatrium, krospovidoni, vaniljakerma (luonnolliset ja keinotekoiset aromit), magnesiumstearaatti, mikrokiteinen selluloosa, piidioksidi, viinihappo ja ksylitoli. Väriaineita ovat rautaoksidi (keltainen tai punainen) ja FD&C Blue No. 2 Aluminium Lake
ABILIFY-oraaliliuos: dinatriumedetaatti, fruktoosi (200 mg/ml), glyseriini, dl-maitohappo, metyyliparabeeni, propyleeniglykoli, propyyliparabeeni, natriumhydroksidi, sakkaroosi (400 mg/ml) ja puhdistettu vesi. Oraaliliuos on maustettu luonnollisella appelsiinikermalla ja muilla luonnollisilla aromeilla
Lisätietoja ABILIFYstä saat osoitteesta www.abilify.com tai soittamalla numeroon 1-800-438-6055.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto
