Seroquel 25mg, 50mg, 100mg, 200mg, 300mg Quetiapine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Seroquel 100mg on ja miten sitä käytetään?
Seroquel 50mg on reseptilääke, jota käytetään skitsofrenian, kaksisuuntaisen mielialahäiriön I ja manian oireiden hoitoon. Kaksisuuntainen mielialahäiriö, masennusjaksot; Kaksisuuntainen mielialahäiriö I, ylläpito; ja vakava masennus. Seroquel 50 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Seroquel kuuluu lääkeluokkaan nimeltä psykoosilääkkeet, 2nd Generation; Antimaaniset aineet.
Ei tiedetä, onko Seroquel 200 mg turvallinen ja tehokas alle 12-vuotiaille lapsille.
Mitkä ovat Seroquel 50mg:n mahdolliset sivuvaikutukset?
Seroquel voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- kasvojen hallitsemattomat lihasliikkeet (pureskelu, huulten lyöminen, kulmien rypistäminen, kielen liike, räpyttely tai silmien liike),
- kasvojen naamiomainen ulkonäkö,
- nielemisvaikeuksia,
- ongelmia puheen kanssa,
- huimaus,
- vaikea ummetus,
- kivulias tai vaikea virtsaaminen,
- näön hämärtyminen,
- putkinäkö,
- silmäkipu,
- nähdä haloja valojen ympärillä,
- erittäin jäykät (jäykät) lihakset,
- korkea kuume,
- hikoilu,
- hämmennystä,
- nopeat tai epätasaiset sydämenlyönnit,
- vapina,
- pyörtyminen,
- lisääntynyt jano,
- lisääntynyt virtsaaminen,
- kuiva suu,
- hedelmäinen hengityksen tuoksu,
- kuume,
- vilunväristykset,
- suun haavaumat,
- ihohaavat,
- kipeä kurkku,
- yskä ja
- vaikeuksia hengittää
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Seroquelin yleisimpiä sivuvaikutuksia ovat:
- puheongelmat,
- huimaus,
- uneliaisuus,
- väsymys,
- energian puute,
- nopeat sydämenlyönnit,
- tukkoinen nenä,
- lisääntynyt ruokahalu,
- painonnousu,
- ärtynyt vatsa,
- oksentelua,
- ummetus,
- suun kuivuminen ja
- epänormaali maksan toimintakoe
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Seroquelin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
DEMENTIAAN LIITTYVÄÄ psykoosia sairastavien iäkkäiden potilaiden lisääntynyt kuolleisuus; ja itsemurha-ajatuksia ja -käyttäytymistä
Lisääntynyt kuolleisuus iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi
Antipsykoottisilla lääkkeillä hoidetuilla iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi, on lisääntynyt kuolemanriski [ks. VAROITUKSET JA VAROTOIMET]. SEROQUEL-valmistetta ei ole hyväksytty dementiaan liittyvän psykoosin potilaiden hoitoon (ks. VAROITUKSET JA VAROTOIMET].
Itsetuhoiset ajatukset ja käyttäytyminen
Masennuslääkkeet lisäsivät itsemurha-ajatusten ja -käyttäytymisen riskiä lapsilla, nuorilla ja nuorilla aikuisilla lyhytaikaisissa tutkimuksissa. Nämä tutkimukset eivät osoittaneet itsemurha-ajatusten ja -käyttäytymisen riskin lisääntymistä masennuslääkkeiden käytön yhteydessä yli 24-vuotiailla potilailla; masennuslääkkeiden käytön riski pieneni 65-vuotiailla ja sitä vanhemmilla potilailla [ks. VAROITUKSET JA VAROTOIMET].
Kaiken ikäisiä potilaita, joilla on aloitettu masennuslääkehoito, on seurattava tarkasti pahenemisen ja itsemurha-ajatusten ja -käyttäytymisen ilmaantumisen varalta. Kerro perheille ja omaishoitajille tiiviin tarkkailun ja yhteydenpidon tarpeesta lääkkeen määräävän lääkärin kanssa [katso VAROITUKSET JA VAROTOIMET].
SEROQUEL 50 mg ei ole hyväksytty käytettäväksi alle 10-vuotiaille lapsipotilaille (katso Käyttö tietyissä ryhmissä).
KUVAUS
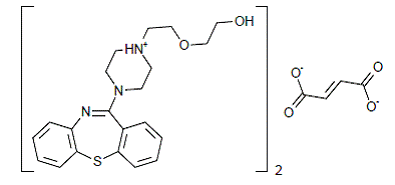
SEROQUEL® (ketiapiinifumaraatti) on psykotrooppinen aine, joka kuuluu kemialliseen luokkaan, dibentsotiatsepiinijohdannaisiin. Kemiallinen nimitys on 2-[2-(4-dibentso[b,f] [1,4]tiatsepin-11-yyli-1-piperatsinyyli)etoksi]etanolifumaraatti (2:1) (suola). Sitä on tableteissa fumaraattisuolana. Kaikki annokset ja tablettien vahvuudet ilmaistaan milligrammoina emästä, ei fumaraattisuolana. Sen molekyylikaava on C42H50N6O4S2•C4H4O4 ja sen molekyylipaino on 883,11 (fumaraattisuola). Rakennekaava on:
Ketiapiinifumaraatti on valkoinen tai luonnonvalkoinen kiteinen jauhe, joka liukenee kohtalaisesti veteen.
SEROQUEL toimitetaan suun kautta 25 mg (pyöreä, persikka), 50 mg (pyöreä, valkoinen), 100 mg (pyöreä, keltainen), 200 mg (pyöreä, valkoinen), 300 mg (kapselin muotoinen, valkoinen) ja 400 mg (kapselinmuotoiset, keltaiset) tabletit.
Inaktiiviset aineet ovat povidoni, kaksiemäksinen dikalsiumfosfaattidihydraatti, mikrokiteinen selluloosa, natriumtärkkelysglykolaatti, laktoosimonohydraatti, magnesiumstearaatti, hypromelloosi, polyetyleeniglykoli ja titaanidioksidi.
25 mg:n tabletit sisältävät punaista rautaoksidia ja keltaista rautaoksidia ja 100 mg:n ja 400 mg:n tabletit sisältävät vain keltaista rautaoksidia.
INDIKAATIOT
Skitsofrenia
SEROQUEL XR on tarkoitettu skitsofrenian hoitoon. SEROQUEL XR:n teho skitsofrenian hoidossa varmistettiin yhdessä 6 viikon ja yhdessä ylläpitotutkimuksessa skitsofreniaa sairastavilla aikuisilla. Tehoa tuki kolme 6 viikon tutkimusta skitsofreniaa sairastavilla aikuisilla ja yksi 6 viikon tutkimus skitsofreniaa sairastavilla nuorilla (13-17 vuotta), joita hoidettiin SEROQUELilla [ks. Kliiniset tutkimukset ].
Kaksisuuntainen mielialahäiriö
SEROQUEL 25 mg XR on tarkoitettu kaksisuuntaiseen mielialahäiriöön I liittyvien maanisten tai sekajaksojen akuutin hoitoon sekä monoterapiana että litiumin tai divalproaatin lisänä. SEROQUEL XR:n teho I-tyypin kaksisuuntaisen mielialahäiriön maanisissa tai sekajaksoissa varmistettiin yhdessä 3 viikkoa kestäneessä tutkimuksessa aikuisilla, joilla oli I-tyypin kaksisuuntaiseen mielialahäiriöön liittyviä maanisia tai sekajaksoja. Tehoa tuki kaksi 12 viikon monoterapiatutkimusta ja yksi 3 viikon lisätutkimus aikuisilla, joilla oli I-tyypin kaksisuuntaiseen mielialahäiriöön liittyviä maanisia jaksoja, sekä yksi 3 viikon monoterapiatutkimus lapsilla ja nuorilla (10–17-vuotiailla), joihin liittyi maanisia jaksoja. kaksisuuntainen mielialahäiriö I, jota hoidetaan SEROQUELilla [katso Kliiniset tutkimukset ].
SEROQUEL 100mg XR on tarkoitettu kaksisuuntaiseen mielialahäiriöön liittyvien masennusjaksojen akuuttiin hoitoon. SEROQUEL XR:n teho vahvistettiin yhdessä 8 viikon tutkimuksessa aikuisilla, joilla oli I tai II kaksisuuntainen mielialahäiriö, ja sitä tuki kaksi 8 viikon tutkimusta aikuisilla, joilla oli I tai II kaksisuuntainen mielialahäiriö ja joita hoidettiin SEROQUELilla [ks. Kliiniset tutkimukset ].
SEROQUEL 100mg XR on tarkoitettu kaksisuuntaisen mielialahäiriön I ylläpitohoitoon litiumin tai divalproaatin lisänä. Teho ekstrapoloitiin kahdesta ylläpitotutkimuksesta aikuisilla, joilla oli kaksisuuntainen mielialahäiriö I, joita hoidettiin SEROQUELilla. Monoterapian tehokkuutta I-tyypin kaksisuuntaisen mielialahäiriön ylläpitohoidossa ei ole arvioitu systemaattisesti kontrolloiduissa kliinisissä tutkimuksissa [ks. Kliiniset tutkimukset ].
Masennushäiriön (MDD) lisähoito
SEROQUEL 100mg XR on tarkoitettu käytettäväksi masennuslääkkeiden lisähoitona MDD:n hoidossa. SEROQUEL XR:n teho masennuslääkkeiden lisähoitona MDD:ssä vahvistettiin kahdessa 6 viikkoa kestäneessä tutkimuksessa aikuisilla, joilla oli MDD ja joilla ei ollut riittävä vaste masennuslääkehoitoon [ks. Kliiniset tutkimukset ].
Erityisiä huomioita lasten skitsofrenian ja kaksisuuntaisen mielialahäiriön I hoidossa
Lasten skitsofrenia ja kaksisuuntainen mielialahäiriö I ovat vakavia mielenterveyshäiriöitä, mutta diagnoosi voi olla haastavaa. Lasten skitsofrenian oireprofiilit voivat olla vaihtelevia, ja kaksisuuntaisessa mielialahäiriössä I potilailla voi olla vaihtelevia mania- tai sekaoireita. Lasten skitsofrenian ja kaksisuuntaisen mielialahäiriön lääkitys on suositeltavaa aloittaa vasta perusteellisen diagnostisen arvioinnin ja lääkityshoitoon liittyvien riskien huolellisen harkinnan jälkeen. Sekä lasten skitsofrenian että kaksisuuntaisen mielialahäiriön lääkehoito on tarkoitettu osaksi kokonaishoito-ohjelmaa, joka sisältää usein psykologisia, kasvatuksellisia ja sosiaalisia interventioita.
ANNOSTELU JA HALLINNOINTI
Tärkeät hallintaohjeet
SEROQUEL XR -tabletit tulee niellä kokonaisina, eikä niitä saa halkaista, pureskella tai murskata.
On suositeltavaa, että SEROQUEL 50mg XR otetaan ilman ruokaa tai kevyen aterian yhteydessä (noin 300 kaloria) [ks. KLIININEN FARMAKOLOGIA ].
SEROQUEL 25 mg XR tulee antaa kerran päivässä, mieluiten illalla.
Suositeltu annostus
Suositeltu aloitusannos, titraus, annosalue ja suurin SEROQUEL 50 mg XR -annos kullekin hyväksytylle indikaatiolle on esitetty alla olevassa taulukossa 1. Aloitusannostuksen jälkeen säätöjä voidaan tehdä ylös- tai alaspäin tarvittaessa potilaan kliinisen vasteen ja siedettävyyden mukaan [ks. Kliiniset tutkimukset ].
Skitsofrenian ja kaksisuuntaisen mielialahäiriön I ylläpitohoito
Ylläpitohoito
Potilaat tulee säännöllisesti arvioida uudelleen ylläpitohoidon tarpeen ja sopivan annoksen määrittämiseksi [ks. Kliiniset tutkimukset ].
Annoksen muutokset iäkkäillä potilailla
On harkittava hitaampaa annoksen titrausta ja pienempää tavoiteannosta vanhuksilla ja potilailla, jotka ovat heikkokuntoisia tai joilla on taipumus hypotensiivisiin reaktioihin [ks. Käyttö tietyissä populaatioissa , ja KLIININEN FARMAKOLOGIA ]. Annosta suurennetaan näillä potilailla tarvittaessa varoen.
Iäkkäiden potilaiden hoito tulee aloittaa annoksella SEROQUEL XR 50 mg/vrk, ja annosta voidaan suurentaa 50 mg/vrk lisäyksin yksittäisen potilaan kliinisen vasteen ja siedettävyyden mukaan.
Annoksen muuttaminen maksan vajaatoimintapotilailla
Maksan vajaatoimintaa sairastavien potilaiden hoito tulee aloittaa annoksella SEROQUEL XR 50 mg/vrk. Annosta voidaan suurentaa päivittäin 50 mg:n lisäyksin tehokkaaksi annokseksi potilaan kliinisen vasteen ja siedettävyyden mukaan.
Annoksen muutokset käytettäessä CYP3A4-estäjien kanssa
SEROQUEL XR -annosta tulee pienentää kuudenteenosaan alkuperäisestä annoksesta, kun sitä käytetään samanaikaisesti voimakkaan CYP3A4-estäjän (esim. ketokonatsolin, itrakonatsolin, indinaviirin, ritonaviirin, nefatsodonin jne.) kanssa. Kun CYP3A4-estäjän käyttö lopetetaan, SEROQUEL XR:n annosta tulee nostaa 6-kertaiseksi [ks. KLIININEN FARMAKOLOGIA ja HUUMEIDEN VUOROVAIKUTUKSET ].
Annoksen muutokset käytettäessä CYP3A4-induktorien kanssa
SEROQUEL XR -annosta tulee suurentaa enintään 5-kertaiseksi alkuperäiseen annokseen verrattuna, kun sitä käytetään yhdessä pitkäaikaisen hoidon kanssa (esim. yli 7-14 päivää) voimakkaalla CYP3A4:n indusoijalla (esim. fenytoiini, karbamatsepiini, rifampiini, avasimibi, St. . mäkikuisma jne.). Annos tulee titrata yksittäisen potilaan kliinisen vasteen ja sietokyvyn perusteella. Kun CYP3A4-induktori lopetetaan, SEROQUEL 100mg XR:n annos tulee pienentää alkuperäiselle tasolle 7-14 päivän kuluessa [ks. KLIININEN FARMAKOLOGIA ja HUUMEIDEN VUOROVAIKUTUKSET ].
Aiemmin lopetettujen potilaiden hoidon aloittaminen uudelleen
Vaikka hoidon uudelleen aloittamista koskevia tietoja ei ole erityisesti, suositellaan, että aloitettaessa hoito uudelleen potilailla, jotka ovat olleet poissa SEROQUEL 50 mg XR:stä yli viikon ajan, tulee noudattaa alkuperäistä annostusaikataulua. Kun potilaat, jotka eivät ole saaneet SEROQUEL 300 mg XR:ää alle viikon, aloitetaan uudelleen, annoksen asteittaista nostamista ei välttämättä tarvita ja ylläpitoannos voidaan aloittaa uudelleen.
Potilaiden vaihtaminen SEROQUEL 50 mg tableteista SEROQUEL 100 mg XR -tabletteihin
Potilaat, joita hoidetaan parhaillaan SEROQUEL-valmisteella (välittömästi vapauttavalla formulaatiolla), voidaan vaihtaa SEROQUEL XR:ään vastaavalla kokonaisvuorokausiannoksella kerran vuorokaudessa. Yksilölliset annoksen säädöt voivat olla tarpeen.
Psykoosilääkkeistä siirtyminen
Ei ole systemaattisesti kerättyjä tietoja, jotka koskevat erityisesti potilaiden vaihtamista muista psykoosilääkkeistä SEROQUEL 200 mg XR:ään tai samanaikaista antoa muiden psykoosilääkkeiden kanssa. Vaikka aiemman antipsykoottisen hoidon välitön lopettaminen voi olla hyväksyttävää joillekin potilaille, asteittainen lopettaminen voi olla sopivinta toisille. Kaikissa tapauksissa päällekkäisen antipsykoottisen lääkkeen antamisen ajanjakso tulee minimoida. Kun potilas vaihdetaan depot-antipsykooteista, aloita SEROQUEL XR -hoito seuraavan ajoitetun injektion sijaan, jos se on lääketieteellisesti tarkoituksenmukaista. Ekstrapyramidaalisen oireyhtymän lääkityksen jatkamisen tarve tulee arvioida uudelleen säännöllisesti.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
- 50 mg depottabletit ovat persikanvärisiä, kalvopäällysteisiä, kapselin muotoisia, kaksoiskuperia, upotettuja tabletteja, joiden toisella puolella on merkintä "XR 50" ja toisella puolella sileä.
- 150 mg depottabletit ovat valkoisia, kalvopäällysteisiä, kapselin muotoisia, kaksoiskuperia, upotettuja tabletteja, joiden toisella puolella on "XR 150" ja toisella puolella sileä.
- 200 mg depottabletit ovat keltaisia, kalvopäällysteisiä, kapselin muotoisia, kaksoiskuperia, upotettuja tabletteja, joiden toisella puolella on ”XR 200” ja toisella puolella sileä.
- 300 mg depottabletit ovat vaaleankeltaisia, kalvopäällysteisiä, kapselin muotoisia, kaksoiskuperia, upotettuja tabletteja, joiden toisella puolella on merkintä "XR 300" ja toisella puolella sileä.
- 400 mg depottabletit ovat valkoisia, kalvopäällysteisiä, kapselin muotoisia, kaksoiskuperia, upotettuja tabletteja, joiden toisella puolella on "XR 400" ja toisella puolella sileä.
Varastointi ja käsittely
50 mg tabletit ( NDC 0310-0280-60) persikka, kalvopäällysteinen, kapselin muotoinen, kaksoiskupera, upotettu tabletti, jonka toisella puolella on "XR 50" ja toinen puoli sileä, toimitetaan 60 tabletin pulloissa.
150 mg tabletit ( NDC 0310-0281-60) valkoinen, kalvopäällysteinen, kapselin muotoinen, kaksoiskupera, upotettu tabletti, jonka toisella puolella on "XR 150" ja toinen puoli sileä, toimitetaan 60 tabletin pulloissa.
200 mg tabletit ( NDC 0310-0282-60) keltainen, kalvopäällysteinen, kapselin muotoinen, kaksoiskupera, upotettu tabletti, jonka toisella puolella on "XR 200" ja toinen puoli sileä, toimitetaan 60 tabletin pulloissa.
300 mg tabletit ( NDC 0310-0283-60) vaaleankeltainen, kalvopäällysteinen, kapselin muotoinen, kaksoiskupera, upotettu tabletti, jonka toisella puolella on merkintä "XR 300" ja toinen puoli sileä, toimitetaan 60 tabletin pulloissa.
400 mg tabletit ( NDC 0310-0284-60) valkoinen, kalvopäällysteinen, kapselin muotoinen, kaksoiskupera, upotettu tabletti, jonka toisella puolella on merkintä "XR 400" ja toinen puoli sileä, toimitetaan 60 tabletin pulloissa.
Säilytä SEROQUEL XR 25°C:ssa (77°F); retket sallitaan 15-30°C:een (59-86°F) [katso USP ].
Jakelija: AstraZeneca Pharmaceuticals LP, Wilmington, DE 19850. Tarkistettu: maaliskuu 2020
SIVUVAIKUTUKSET
Seuraavia haittavaikutuksia käsitellään tarkemmin muissa merkintöjen osissa:
- Lisääntynyt kuolleisuus iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi [ks VAROITUKSET JA VAROTOIMET ]
- Nuorten ja nuorten aikuisten itsemurha-ajatukset ja -käyttäytyminen [katso VAROITUKSET JA VAROTOIMET ]
- Aivoverenkierron haittavaikutukset, mukaan lukien aivohalvaus iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi [ks VAROITUKSET JA VAROTOIMET ]
- Maligni neuroleptinen oireyhtymä (NMS) [katso VAROITUKSET JA VAROTOIMET ]
- Aineenvaihduntamuutokset (hyperglykemia, dyslipidemia, painonnousu) [katso VAROITUKSET JA VAROTOIMET ]
- Tardiivi dyskinesia [katso VAROITUKSET JA VAROTOIMET ]
- Hypotensio [katso VAROITUKSET JA VAROTOIMET ]
- Falls [katso VAROITUKSET JA VAROTOIMET ]
- Verenpaineen nousu (lapset ja nuoret) [ks VAROITUKSET JA VAROTOIMET ]
- Leukopenia, neutropenia ja agranulosytoosi [katso VAROITUKSET JA VAROTOIMET ]
- Kaihi [katso VAROITUKSET JA VAROTOIMET ]
- QT-ajan pidentyminen [katso VAROITUKSET JA VAROTOIMET ]
- Kohtaukset [katso VAROITUKSET JA VAROTOIMET ]
- Kilpirauhasen vajaatoiminta [katso VAROITUKSET JA VAROTOIMET ]
- Hyperprolaktinemia [katso VAROITUKSET JA VAROTOIMET ]
- Mahdollisuus kognitiiviseen ja motoriseen heikkenemiseen [katso VAROITUKSET JA VAROTOIMET ]
- Kehon lämpötilan säätely [katso VAROITUKSET JA VAROTOIMET ]
- Dysfagia [katso VAROITUKSET JA VAROTOIMET ]
- Keskeytysoireyhtymä [katso VAROITUKSET JA VAROTOIMET ]
- Antikolinergiset (antimuskariiniset) vaikutukset [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä tutkimuksista
Koska kliiniset tutkimukset tehdään hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutusten määrää ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Aikuiset
Alla olevat tiedot on johdettu SEROQUEL 200mg:n kliinisten tutkimusten tietokannasta, joka sisältää yli 4300 potilasta. Tämä tietokanta sisältää 698 potilasta, jotka ovat altistuneet SEROQUELille kaksisuuntaisen mielialahäiriön hoitoon, 405 potilasta, jotka ovat altistuneet SEROQUELille 200 mg akuutin kaksisuuntaisen mielialahäiriön hoitoon (monoterapia ja lisähoito), 646 potilasta, jotka ovat altistuneet SEROQUELille I-tyypin kaksisuuntaisen mielialahäiriön ylläpitohoidossa. ja noin 2 600 potilasta ja/tai normaalia henkilöä, jotka altistettiin yhdelle tai useammalle annokselle SEROQUEL 200 mg skitsofrenian hoitoon.
Näistä noin 4 300 tutkittavasta noin 4 000 (2 300 skitsofreniaa, 405 akuuttia kaksisuuntaista mielialahäiriötä sairastavia, 698 kaksisuuntaisia mielialahäiriöitä sairastavia ja 646 kaksisuuntaisen mielialahäiriön ylläpitohoitoa sairastavia) oli potilaita, jotka osallistuivat usean annoksen tehokkuutta koskeviin tutkimuksiin, ja heidän kokemuksensa vastasi noin 2400 potilasvuotta. Seroquel 200mg -hoidon olosuhteet ja kesto vaihtelivat suuresti ja sisälsivät (päällekkäisissä luokissa) avoimet ja kaksoissokkotutkimukset, sairaala- ja avopotilaat, kiinteän annoksen ja annostitraustutkimukset sekä lyhyt- tai pidemmän aikavälin tutkimukset. valotus. Haittavaikutukset arvioitiin keräämällä haittavaikutukset, fyysisten tutkimusten tulokset, elintoiminnot, painot, laboratorioanalyysit, EKG:t ja oftalmologisten tutkimusten tulokset.
Ilmoitetut haittavaikutusten esiintymistiheydet edustavat niiden henkilöiden osuutta, jotka ovat kokeneet mainitun tyyppisen haittavaikutuksen vähintään kerran.
Hoidon keskeyttämiseen liittyvät haittavaikutukset lyhytaikaisissa lumekontrolloiduissa tutkimuksissa
Skitsofrenia
Kaiken kaikkiaan haittavaikutuksista johtuvien keskeytysten ilmaantuvuuden välillä oli vain vähän eroa (4 % SEROQUELilla vs. 3 % lumelääkkeellä) kontrolloiduissa tutkimuksissa. Kuitenkin uneliaisuudesta (0,8 % SEROQUEL 100 mg vs. 0 % lumelääkettä) ja hypotensiosta (0,4 % SEROQUEL 200 mg vs. 0 % lumelääke) johtuvien keskeytysten katsottiin liittyvän lääkkeisiin [ks. VAROITUKSET JA VAROTOIMET ].
Kaksisuuntainen mielialahäiriö
Mania
Kaiken kaikkiaan haittavaikutuksista johtuvia keskeytyksiä oli SEROQUEL 25 mg:n kohdalla 5,7 % vs. 5,1 % lumelääkettä saaneiden monoterapian kohdalla ja 3,6 % SEROQUELin ja 5,9 % lumelääkettä saaneiden lisähoitona.
Masennus
Kaiken kaikkiaan haittavaikutuksista johtuvia keskeytyksiä oli 12,3 % SEROQUEL 300 mg:n kohdalla vs. 19,0 % SEROQUEL 600 mg:n ja 5,2 % lumelääkkeen kohdalla.
Yleisesti havaitut haittavaikutukset lyhytaikaisissa, lumekontrolloiduissa kokeissa
Skitsofrenian (enintään 6 viikkoa) ja kaksisuuntaisen mielialahäiriön manian (enintään 12 viikkoa) akuutin hoidon tutkimuksissa yleisimmin havaitut haittavaikutukset, jotka liittyivät SEROQUEL-monoterapian käyttöön (ilmaantuvuus 5 % tai enemmän) ja joita havaittiin useilla vuosilla SEROQUEL vähintään kaksinkertainen lumelääkkeeseen verrattuna olivat uneliaisuus (18 %), huimaus (11 %), suun kuivuminen (9 %), ummetus (8 %), ALAT lisääntynyt (5 %), painonnousu (5 %) ja dyspepsia ( 5 %).
Haittavaikutukset, joita esiintyy vähintään 2 %:lla SEROQUEL-hoitoa saaneista potilaista lyhytaikaisissa lumekontrolloiduissa tutkimuksissa
Lääkkeen määrääjän tulee huomioida, että taulukoiden ja taulukoiden lukujen perusteella ei voida ennustaa haittavaikutusten ilmaantuvuutta tavanomaisessa lääketieteellisessä toiminnassa, kun potilaan ominaisuudet ja muut tekijät poikkeavat kliinisissä tutkimuksissa vallinneista. Samoin mainittuja esiintymistiheyksiä ei voida verrata lukuihin, jotka on saatu muista kliinisistä tutkimuksista, joissa on mukana erilaisia hoitoja, käyttöjä ja tutkijoita. Mainitut luvut antavat kuitenkin lääkkeen määräävälle lääkärille jonkinlaisen perustan arvioida lääkkeiden ja muiden tekijöiden suhteellista osuutta sivuvaikutusten esiintyvyydestä tutkitussa populaatiossa.
Taulukossa 9 luetellaan lähimpään prosenttiin pyöristettyjen haittavaikutusten ilmaantuvuus skitsofrenian (enintään 6 viikkoa) ja kaksisuuntaisen mielialahäiriön manian (enintään 12 viikkoa) akuutin hoidon aikana 2 %:lla tai useammalla SEROQUEL-hoitoa saaneista potilaista (annos vaihtelee 75–800 mg/vrk), joiden ilmaantuvuus SEROQUEL-hoitoa saaneilla potilailla oli suurempi kuin lumelääkettä saaneilla potilailla.
Kaksisuuntaisen mielialahäiriön manian akuutin lisähoidon tutkimuksissa (enintään 3 viikkoa) yleisimmin havaitut SEROQUELin käyttöön liittyvät haittavaikutukset (ilmaantuvuus 5 % tai enemmän), joita havaittiin SEROQUELilla vähintään kaksi kertaa lumelääkkeeseen verrattuna. uneliaisuus (34 %), suun kuivuminen (19 %), voimattomuus (10 %), ummetus (10 %), vatsakipu (7 %), posturaalinen hypotensio (7 %), nielutulehdus (6 %) ja painonnousu (6 %) %).
Taulukossa 10 luetellaan lähimpään prosenttiin pyöristettyjen haittavaikutusten ilmaantuvuus (enintään 3 viikkoa) akuutin manian hoidon aikana vähintään 2 %:lla potilaista, joita hoidettiin SEROQUEL-hoidolla (annokset vaihtelevat 100-800 mg/vrk). litiumin ja divalproaatin lisähoitona, kun ilmaantuvuus SEROQUEL-hoitoa saaneilla potilailla oli suurempi kuin lumelääkettä saaneilla potilailla.
Kaksisuuntaisen mielialahäiriön masennustutkimuksissa (enintään 8 viikkoa) yleisimmin havaitut SEROQUELin käyttöön liittyvät haittavaikutukset (esiintyvyys 5 % tai enemmän), joita havaittiin SEROQUEL 200 mg:lla vähintään kaksi kertaa lumelääkkeeseen verrattuna, olivat uneliaisuus (57 %). ), suun kuivuminen (44 %), huimaus (18 %), ummetus (10 %) ja letargia (5 %).
Taulukossa 11 luetellaan lähimpään prosenttiin pyöristettyjen haittavaikutusten ilmaantuvuus (enintään 8 viikkoa) kaksisuuntaisen mielialahäiriön masennuksen aikana vähintään 2 %:lla potilaista, jotka saivat SEROQUEL-hoitoa (annokset 300 ja 600 mg/vrk), kun ilmaantuvuus SEROQUELilla hoidetuilla potilailla oli suurempi kuin lumelääkettä saaneilla potilailla.
Sukupuolen, iän ja rodun perusteella tehdyt vuorovaikutustutkimukset eivät paljastaneet kliinisesti merkittäviä eroja haittavaikutusten esiintymisessä näiden demografisten tekijöiden perusteella.
Haittavaikutusten annosriippuvuus lyhytaikaisissa lumekontrolloiduissa tutkimuksissa
Annoksiin liittyvät haittavaikutukset
Spontaanisti saatuja haittavaikutuksia koskevia tietoja skitsofreniatutkimuksesta, jossa verrattiin viittä kiinteää SEROQUEL-annosta (75 mg, 150 mg, 300 mg, 600 mg ja 750 mg/vrk) lumelääkkeeseen, tutkittiin haittavaikutusten annosriippuvuuden suhteen. Logistiset regressioanalyysit paljastivat positiivisen annosvasteen (p
Haittavaikutukset kliinisissä tutkimuksissa ketiapiinilla ja joita ei ole mainittu muualla etiketissä:
Seuraavia haittavaikutuksia on raportoitu myös ketiapiinin käytön yhteydessä: painajaiset, yliherkkyys ja seerumin kreatiinifosfokinaasiarvon nousu (ei liity NMS-oireyhtymään), galaktorrea, bradykardia (joita voi ilmaantua hoidon alussa tai lähellä sitä ja liittyä hypotensioon ja/tai pyörtymiseen ) vähentynyt verihiutaleiden määrä, somnambulismi (ja muut vastaavat tapahtumat), gamma-GT-tasojen nousu, hypotermia, hengenahdistus, eosinofilia, virtsanpidätys, suolitukos ja priapismi.
Ekstrapyramidaaliset oireet (EPS)
Dystonia
Luokkaefekti
Dystonian oireita, pitkittyneitä lihasryhmien epänormaaleja supistuksia, voi esiintyä herkillä henkilöillä muutaman ensimmäisen hoitopäivän aikana. Dystonisia oireita ovat: niskalihasten kouristukset, jotka joskus etenevät kurkun kireyteen, nielemisvaikeudet, hengitysvaikeudet ja/tai kielen ulkoneminen. Vaikka nämä oireet voivat ilmaantua pienillä annoksilla, niitä esiintyy useammin ja voimakkaammin suuren tehon ja suuremmilla ensimmäisen sukupolven psykoosilääkkeiden annoksilla. Miehillä ja nuoremmilla ikäryhmillä havaitaan kohonnut akuutin dystonian riski.
EPS:n mittaamiseen käytettiin neljää menetelmää: (1) Simpson-Angusin kokonaispistemäärä (keskimääräinen muutos lähtötilanteesta), joka arvioi parkinsonismia ja akatisiaa, (2) Barnes Akathisia -luokitusasteikko (BARS) Global Assessment Score, (3) spontaanien valitusten ilmaantuvuus EPS (akatisia, akinesia, hammaspyörän jäykkyys, ekstrapyramidaalinen oireyhtymä, hypertonia, hypokinesia, kaulan jäykkyys ja vapina) ja (4) antikolinergisten lääkkeiden käyttö EPS:n hoitoon.
Aikuiset
Tiedot yhdestä 6 viikkoa kestäneestä skitsofreniaa koskevasta kliinisestä tutkimuksesta, jossa verrattiin viittä kiinteää SEROQUEL-annosta (75, 150, 300, 600, 750 mg/vrk), antoivat todisteita SEROQUEL-hoitoon liittyvien ekstrapyramidaalisten oireiden (EPS) puuttumisesta ja annosriippuvuudesta. 100mg hoitoa. EPS:n mittaamiseen käytettiin kolmea menetelmää: (1) Simpson-Angusin kokonaispistemäärä (keskimääräinen muutos lähtötilanteesta), joka arvioi parkinsonismin ja akatisian, (2) spontaanin EPS-valituksen ilmaantuvuus (akatisia, akinesia, hammaspyörän jäykkyys, ekstrapyramidaalinen oireyhtymä, hypertonia, hypokinesia, kaulan jäykkyys ja vapina) ja (3) antikolinergisten lääkkeiden käyttö EPS:ään.
Taulukossa 12 dystoninen tapahtuma sisälsi niskan jäykkyyden, hypertonia, dystonia, lihasjäykkyys, silmänympärys; parkinsonismi sisälsi hammaspyörän jäykkyyden, vapina, kuolaa, hypokinesia; akatisia sisälsi akatisian, psykomotorisen levottomuuden; dyskineettinen tapahtuma sisälsi tardiivin dyskinesian, dyskinesian, koreoatetoosin; ja muita ekstrapyramidaalisia tapahtumia olivat levottomuus, ekstrapyramidaalinen häiriö, liikehäiriö.
Parkinsonismin ilmaantuvuusluvut mitattuna Simpson-Angus-kokonaispisteillä lumelääkkeellä ja viidellä kiinteällä annoksella (75, 150, 300, 600, 750 mg/vrk) olivat: -0,6; -1,0, -1,2; -1,6; -1,8 ja -1,8. Antikolinergisten lääkkeiden käyttö EPS:n hoitoon lumelääkkeellä ja viidellä kiinteällä annoksella oli: 14 %; 11 %; 10 %; 8 %; 12 % ja 11 %.
Kuudessa muussa lumekontrolloidussa kliinisessä tutkimuksessa (3 akuutissa maniassa ja 3 skitsofreniassa), joissa käytettiin vaihtelevia SEROQUEL-annoksia, ei havaittu eroja SEROQUEL- ja lumelääkeryhmien välillä EPS:n ilmaantuvuuden suhteen Simpson-Angusin kokonaispistemäärän perusteella. spontaanit EPS-valitukset ja samanaikainen antikolinergisten lääkkeiden käyttö EPS:n hoitoon.
Kahdessa lumekontrolloidussa kliinisessä tutkimuksessa kaksisuuntaisen mielialahäiriön hoitoon käytettiin 300 mg ja 600 mg SEROQUEL 100 mg:aa, EPS:ään mahdollisesti liittyvien haittavaikutusten ilmaantuvuus oli 12 % molemmissa annosryhmissä ja 6 % lumeryhmässä. Näissä tutkimuksissa yksittäisten haittavaikutusten (akatisia, ekstrapyramidaalinen häiriö, vapina, dyskinesia, dystonia, levottomuus, tahattomat lihassupistukset, psykomotorinen yliaktiivisuus ja lihasjäykkyys) ilmaantuvuus oli yleensä alhainen eivätkä ylittänyt 4 % missään hoitoryhmässä.
Kolme hoitoryhmää olivat samanlaisia keskimääräisen muutoksen osalta SAS-kokonaispisteissä ja BARS Global Assessment -pisteissä hoidon lopussa. Samanaikainen antikolinergisten lääkkeiden käyttö oli harvinaista ja samanlaista kaikissa kolmessa hoitoryhmässä.
Lapset Ja Nuoret
Alla olevat tiedot on johdettu SEROQUEL 200mg:n kliinisten tutkimusten tietokannasta, joka sisältää yli 1000 lapsipotilasta. Tämä tietokanta sisältää 677 potilasta, jotka ovat altistuneet SEROQUEL 200 mg:lle skitsofrenian hoitoon, ja 393 lasta ja nuorta (10-17-vuotiaita), jotka ovat altistuneet SEROQUELille akuutin kaksisuuntaisen mielialahäiriön manian hoitoon.
Hoidon keskeyttämiseen liittyvät haittavaikutukset lyhytaikaisissa lumekontrolloiduissa tutkimuksissa
Skitsofrenia
Ketiapiinihoitoa saaneiden potilaiden haittavaikutuksista johtuvien keskeytysten ilmaantuvuus oli 8,2 % ja lumelääkettä 2,7 %. Haittatapahtuma, joka johti hoidon keskeyttämiseen 1 %:lla tai useammalla SEROQUEL-hoitoa saaneista potilaista ja jota esiintyi useammin kuin lumelääkettä saaneista potilaista, oli uneliaisuus (2,7 % ja 0 % lumelääkkeellä).
Kaksisuuntainen mieliala I Mania
Ketiapiinihoitoa saaneiden potilaiden haittavaikutuksista johtuvien keskeytysten ilmaantuvuus oli 11,4 % ja lumelääkettä 4,4 %. Haittavaikutukset, jotka johtivat hoidon lopettamiseen 2 %:lla tai useammalla SEROQUEL-hoitoa saaneista potilaista ja useammin kuin lumelääkettä saaneista, olivat uneliaisuus (4,1 % vs. 1,1 %) ja väsymys (2,1 % vs. 0).
Yleisesti havaitut haittavaikutukset lyhytaikaisissa, lumekontrolloiduissa kokeissa
Skitsofrenian hoidossa (enintään 6 viikkoa) yleisimmin havaitut ketiapiinin käyttöön liittyvät haittavaikutukset nuorilla (esiintyvyys vähintään 5 % ja ketiapiinin ilmaantuvuus vähintään kaksi kertaa lumelääkkeeseen verrattuna) olivat uneliaisuus (34 %), huimaus. (12 %), suun kuivuminen (7 %), takykardia (7 %).
Kaksisuuntaisen mielialahäiriön manian hoidossa (enintään 3 viikkoa) yleisimmin havaitut haittavaikutukset, jotka liittyvät ketiapiinin käyttöön lapsilla ja nuorilla (esiintyvyys 5 % tai enemmän ja ketiapiinin ilmaantuvuus vähintään kaksi kertaa lumelääkkeeseen verrattuna) olivat uneliaisuus (53 %), huimaus (18 %), väsymys (11 %), lisääntynyt ruokahalu (9 %), pahoinvointi (8 %), oksentelu (8 %), takykardia (7 %), suun kuivuminen (7 %) ja painon nousu (6 %) ).
Akuutissa (8 viikkoa) SEROQUEL 100 mg XR -tutkimuksessa kaksisuuntaista mielialahäiriötä sairastavilla lapsilla ja nuorilla (10-17-vuotiailla), jossa tehoa ei osoitettu, yleisimmin havaitut SEROQUEL XR:n käyttöön liittyvät haittavaikutukset (esiintyvyys) 5 % tai enemmän ja vähintään kaksi kertaa lumelääkkeeseen verrattuna) olivat huimaus 7 %, ripuli 5 %, väsymys 5 % ja pahoinvointi 5 %.
Haittavaikutukset, joita esiintyi ≥ 2 %:lla SEROQUEL 300 mg:lla hoidetuilla potilailla lyhytaikaisissa lumekontrolloiduissa tutkimuksissa
Skitsofrenia (nuoret, 13-17-vuotiaat)
Seuraavat havainnot perustuivat 6 viikkoa kestäneeseen lumekontrolloituun tutkimukseen, jossa ketiapiinia annettiin joko 400 tai 800 mg:n vuorokausiannoksina.
Taulukossa 13 luetellaan lähimpään prosenttiin pyöristettyjen haittavaikutusten ilmaantuvuus (enintään 6 viikkoa) skitsofrenian hoidon aikana 2 %:lla tai useammalla SEROQUEL-hoitoa saaneista potilaista (annokset 400 tai 800 mg/vrk), jos ilmaantuvuus on SEROQUELilla hoidetuilla potilailla oli vähintään kaksinkertainen esiintyvyys lumelääkettä saaneilla potilailla.
Haittavaikutuksia, jotka olivat mahdollisesti annoksesta riippuvaisia useammin 800 mg:n ryhmässä kuin 400 mg:n ryhmässä, olivat huimaus (8 % vs. 15 %), suun kuivuminen (4 % vs. 10 %) ja takykardia (6 % vs. 15 %). 11 %).
Kaksisuuntainen mielialahäiriö I mania (lapset ja nuoret 10-17-vuotiaat)
Seuraavat havainnot perustuivat 3 viikkoa kestäneeseen lumekontrolloituun tutkimukseen, jossa ketiapiinia annettiin joko 400 tai 600 mg/vrk annoksina.
Yleisesti havaitut haittavaikutukset
Kaksisuuntaisen mielialahäiriön manian hoidossa (enintään 3 viikkoa) yleisimmin havaitut haittavaikutukset, jotka liittyvät ketiapiinin käyttöön lapsilla ja nuorilla (esiintyvyys 5 % tai enemmän ja ketiapiinin ilmaantuvuus vähintään kaksi kertaa lumelääkkeeseen verrattuna) olivat uneliaisuus (53 %), huimaus (18 %), väsymys (11 %), lisääntynyt ruokahalu (9 %), pahoinvointi (8 %), oksentelu (8 %), takykardia (7 %), suun kuivuminen (7 %) ja painon nousu (6 %) ).
Taulukossa 14 luetellaan lähimpään prosenttiin pyöristettynä haittavaikutusten ilmaantuvuus (enintään 3 viikkoa) kaksisuuntaisen mielialahäiriön manian hoidon aikana 2 %:lla tai useammalla SEROQUEL-hoitoa saaneista potilaista (annokset 400 tai 600 mg/vrk), kun ilmaantuvuus SEROQUELilla hoidetuilla potilailla oli suurempi kuin lumelääkettä saaneilla potilailla.
Haittavaikutuksia, jotka olivat mahdollisesti annoksesta riippuvaisia useammin 600 mg:n ryhmässä kuin 400 mg:n ryhmässä, olivat uneliaisuus (50 % vs. 57 %), pahoinvointi (6 % vs. 10 %) ja takykardia (6 % vs. 9 %).
Ekstrapyramidaaliset oireet
Lyhytaikaisessa lumekontrolloidussa monoterapiatutkimuksessa skitsofreniaa sairastavilla nuorilla potilailla (kesto 6 viikkoa) ekstrapyramidaalioireiden yhteenlaskettu ilmaantuvuus oli 12,9 % (19/147) SEROQUEL 100 mg:lla ja 5,3 % (4/75) lumelääkettä saaneilla. Yksittäisten haittavaikutusten (akatisia, vapina, ekstrapyramidaalihäiriö, hypokinesia, levottomuus, psykomotorinen hyperaktiivisuus, lihasjäykkyys, dyskinesia) esiintyvyys ei kuitenkaan ylittänyt 4,1 % missään hoitoryhmässä. Lyhytaikaisessa lumekontrolloidussa monoterapiatutkimuksessa lapsilla ja nuorilla potilailla, joilla oli kaksisuuntainen mielialamania (3 viikkoa), ekstrapyramidaalioireiden yhteenlaskettu ilmaantuvuus oli 3,6 % (7/193) tai SEROQUEL ja 1,1 % (1/90) plasebo.
Taulukossa 15 on luettelo potilaista, joilla on mahdollisesti ekstrapyramidaalisiin oireisiin liittyviä haittavaikutuksia lyhytaikaisessa lumekontrolloidussa monoterapiatutkimuksessa skitsofreniaa sairastavilla nuorilla (6 viikkoa).
Taulukoissa 15–16 dystoninen tapahtuma sisälsi niskan jäykkyyden, hypertonia ja lihasjäykkyyden; parkinsonismi sisälsi hammaspyörän jäykkyyden ja vapina; akatisia sisälsi vain akatisian; dyskineettinen tapahtuma sisälsi tardiivin dyskinesian, dyskinesian ja koreoatetoosin; ja muita ekstrapyramidaalisia tapahtumia olivat levottomuus ja ekstrapyramidaalinen häiriö.
Taulukossa 16 on luettelo potilaista, joilla oli ekstrapyramidaalisiin oireisiin liittyviä haittavaikutuksia lyhytaikaisessa lumekontrolloidussa monoterapiatutkimuksessa lapsilla ja nuorilla potilailla, joilla on kaksisuuntainen mielialamania (kesto 3 viikkoa).
Kliinisissä tutkimuksissa havaitut laboratorio-, EKG- ja elintoimintojen muutokset
Laboratoriomuutokset
Neutrofiilien määrä
Aikuiset
Kliinisissä lumekontrolloiduissa monoterapiatutkimuksissa, joihin osallistui 3 368 ketiapiinifumaraattia saavaa potilasta ja 1 515 lumelääkettä saavaa potilasta, vähintään yhden neutrofiilimäärän VAROITUKSET JA VAROTOIMET ].
Transaminaasien nousu
Aikuiset
Oireetonta, ohimenevää ja palautuvaa seerumin transaminaasiarvojen (ensisijaisesti ALAT) nousua on raportoitu. Aikuisilla tehdyissä skitsofreniatutkimuksissa potilaiden osuus, joiden transaminaasiarvot ylittivät >3 kertaa normaalin vertailualueen ylärajat 3–6 viikkoa kestäneiden lumekontrolloitujen tutkimusten poolissa, oli noin 6 % (29/483) SEROQUEL-hoidon yhteydessä. verrattuna 1 prosenttiin (3/194) lumelääkkeellä. Aikuisilla tehdyissä akuutin kaksisuuntaisen mielialahäiriön maniatutkimuksissa potilaiden osuus, joiden transaminaasiarvot ylittivät >3 kertaa normaalin vertailualueen ylärajat 3–12 viikkoa kestäneissä lumekontrolloiduissa tutkimuksissa, oli noin 1 % molemmissa SEROQUEL-valmisteissa (3 /560) ja lumelääkettä (3/294). Nämä maksaentsyymien nousut ilmenivät yleensä kolmen ensimmäisen lääkehoidon viikon aikana ja palasivat välittömästi tutkimusta edeltävälle tasolle jatkuvan SEROQUEL-hoidon myötä. Kaksisuuntaisen mielialahäiriön masennusta koskevissa tutkimuksissa potilaiden osuus, joiden transaminaasiarvot ylittivät yli 3 kertaa normaalin vertailualueen ylärajat kahdessa 8 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa, oli 1 % (5/698) SEROQUEL 50 mg:lla ja 2 % (6/ 347) lumelääkettä varten.
Hemoglobiinin lasku
Aikuiset
Lyhytaikaisissa lumekontrolloiduissa tutkimuksissa hemoglobiinin laskua ≤ 13 g/dl miehillä, ≤ 12 g/dl naisilla ainakin kerran esiintyi 8,3 %:lla (594/7155) ketiapiinilla hoidetuista potilaista verrattuna 6,2 %:iin ( 219/3536) lumelääkettä saaneista potilaista. Kontrolloitujen ja kontrolloimattomien kliinisten tutkimusten tietokannassa hemoglobiinin alenemista arvoon ≤13 g/dl miehillä ja ≤12 g/dl naisilla esiintyi vähintään kerran 11 %:lla (2277/20729) ketiapiinilla hoidetuista potilaista.
Häiriöt virtsan huumenäytöille
Kirjallisuudessa on raportoitu vääriä positiivisia tuloksia metadonin ja trisyklisten masennuslääkkeiden virtsan entsyymi-immunomäärityksissä ketiapiinia käyttäneillä potilailla. Varovaisuutta tulee noudattaa näiden lääkkeiden positiivisten virtsan lääkeseulontatulosten tulkinnassa, ja varmistusta vaihtoehtoisella analyysitekniikalla (esim. kromatografisilla menetelmillä) tulee harkita.
EKG:n muutokset
Aikuiset
Ryhmävertailut yhdistetyissä lumekontrolloiduissa tutkimuksissa ei paljastanut tilastollisesti merkittäviä SEROQUEL/plasebo-eroja niiden potilaiden osuuksissa, joilla oli mahdollisesti merkittäviä muutoksia EKG-parametreissa, mukaan lukien QT-, QTc- ja PR-välit. Takykardian kriteerit täyttävien potilaiden osuutta verrattiin kuitenkin neljässä 3–6 viikkoa kestäneessä lumekontrolloidussa kliinisessä skitsofrenian hoitotutkimuksessa, jotka paljastivat 1 % (4/399) SEROQUEL 100 mg:n ilmaantuvuuden verrattuna 0,6 %:iin (1). /156) lumelääkkeen ilmaantuvuus. Akuutin (monoterapia) kaksisuuntaisen mielialahäiriön maniatutkimuksissa takykardian kriteerit täyttävien potilaiden osuus oli 0,5 % (1/192) SEROQUEL 200 mg:n kohdalla verrattuna 0 %:iin (0/178) lumelääkettä saaneiden potilaiden kohdalla. Akuutin kaksisuuntaisen mielialahäiriön maniaa (lisähoito) koskevissa tutkimuksissa samat kriteerit täyttävien potilaiden osuus oli 0,6 % (1/166) SEROQUEL 100 mg:n kohdalla verrattuna 0 %:iin (0/171) lumelääkettä saaneiden potilaiden kohdalla. Kaksisuuntaisen mielialahäiriön masennustutkimuksissa yhdelläkään potilaalla syke ei noussut yli 120 lyöntiin minuutissa. SEROQUEL 50 mg:n käyttöön liittyi sydämen sykkeen keskimääräinen nousu EKG:llä arvioituna 7 lyöntiä minuutissa verrattuna lumelääkepotilaiden keskimääräiseen nousuun 1 lyöntiä minuutissa. Tämä lievä taipumus takykardiaan aikuisilla saattaa liittyä SEROQUELin mahdollisuuteen aiheuttaa ortostaattisia muutoksia [ks. VAROITUKSET JA VAROTOIMET ].
Lapset ja nuoret
Nuorilla tehdyssä akuutin (6 viikkoa) skitsofreniatutkimuksessa sydämen sykkeen nousua (> 110 bpm) esiintyi 5,2 %:lla (3/73) SEROQUEL 400 mg:aa saaneista potilaista ja 8,5 %:lla (5/74) SEROQUEL 800 -valmistetta saaneista potilaista. mg verrattuna 0 %:iin (0/75) lumelääkettä saaneista potilaista. Sykkeen keskimääräinen nousu oli 3,8 lyöntiä minuutissa SEROQUEL 400 mg:n ja 800 mg:n ryhmissä 11,2 lyöntiä minuutissa verrattuna 3,3 lyöntiä minuutissa lumeryhmässä [ks. VAROITUKSET JA VAROTOIMET ].
Akuutin (3 viikkoa) kaksisuuntaisen mielialahäiriön maniatutkimuksessa lapsilla ja nuorilla sydämen sykkeen nousua (>110 bpm) esiintyi 1,1 %:lla (1/89) SEROQUEL 400 mg:n saaneista potilaista ja 4,7 %:lla (4/85) potilaista. SEROQUEL 600 mg:aa verrattuna 0 %:iin (0/98) lumelääkettä saaneista potilaista. Keskimääräinen sydämen sykkeen nousu oli 12,8 lyöntiä minuutissa SEROQUEL 400 mg ja 600 mg ryhmissä, vastaavasti, verrattuna 1,7 bpm:n laskuun lumeryhmässä [ks. VAROITUKSET JA VAROTOIMET ].
Akuutissa (8 viikkoa) SEROQUEL XR -tutkimuksessa kaksisuuntaista mielialahäiriötä sairastavilla lapsilla ja nuorilla (10-17-vuotiailla), jossa tehoa ei osoitettu, sykkeen nousu (>110 bpm 10-12-vuotiaat ja 13-17-vuotiaat) vuotta) esiintyi 0 %:lla SEROQUEL XR:ää saaneista potilaista ja 1,2 %:lla lumelääkettä saaneista potilaista. Keskimääräinen sykkeen nousu oli 3,4 lyöntiä minuutissa SEROQUEL XR -ryhmässä verrattuna 0,3 lyöntiä minuutissa lumeryhmässä [ks. VAROITUKSET JA VAROTOIMET ].
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset tunnistettiin SEROQUELin hyväksymisen jälkeen. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Markkinoille tulon jälkeen raportoituja haittavaikutuksia, jotka liittyivät ajallisesti ketiapiinihoitoon, ovat anafylaktinen reaktio, kardiomyopatia, lääkereaktio, johon liittyy eosinofiliaa ja systeemisiä oireita (DRESS), hyponatremia, sydänlihastulehdus, yöllinen enureesi, haimatulehdus, retrogradinen muistinmenetys, rabdomyolyysi, hormonihäiriön vastainen oireyhtymä (SIADH), Stevens-Johnsonin oireyhtymä (SJS), toksinen epidermaalinen nekrolyysi (TEN), verihiutaleiden määrän lasku, vakavat maksareaktiot (mukaan lukien hepatiitti, maksanekroosi ja maksan vajaatoiminta), agranulosytoosi, suolen tukkeuma, ileus, paksusuolen iskemia, virtsan pidätys , uniapnea ja akuutti yleistynyt eksantematoottinen pustuloosi (AGEP).
HUUMEIDEN VUOROVAIKUTUKSET
Muiden lääkkeiden vaikutus ketiapiiniin
SEROQUELin käytön riskejä yhdessä muiden lääkkeiden kanssa ei ole arvioitu laajasti systemaattisissa tutkimuksissa. Ottaen huomioon SEROQUELin ensisijaiset keskushermostovaikutukset, varovaisuutta tulee noudattaa, kun sitä käytetään yhdessä muiden keskushermostoon vaikuttavien lääkkeiden kanssa. SEROQUEL 300mg vahvisti alkoholin kognitiivisia ja motorisia vaikutuksia kliinisessä tutkimuksessa koehenkilöillä, joilla oli valikoituja psykoottisia häiriöitä, ja alkoholijuomien käyttöä tulee rajoittaa ketiapiinihoidon aikana.
Ketiapiinialtistus lisää CYP3A4:n prototyypin estäjät (esim. ketokonatsoli, itrakonatsoli, indinaviiri, ritonaviiri, nefatsodoni jne.) ja vähentävät CYP3A4:n prototyypin indusoijat (esim. fenytoiini, karbamatsepiini, rifampiini, avasimibi, mäkikuisma jne.) . Ketiapiinin annosta on muutettava, jos sitä annetaan samanaikaisesti voimakkaiden CYP3A4:n indusoijien tai estäjien kanssa.
CYP3A4:n estäjät
Ketokonatsolin, voimakkaan sytokromi CYP3A4:n estäjän, samanaikainen anto lisäsi merkittävästi ketiapiinialtistusta. SEROQUEL 200 mg annosta tulee pienentää kuudesosaan alkuperäisestä annoksesta, jos sitä annetaan yhdessä vahvan CYP3A4-estäjän kanssa (ks. ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
CYP3A4:n indusoijat
Ketiapiinin ja fenytoiinin, CYP3A4:n indusoijan, samanaikainen käyttö lisäsi ketiapiinin keskimääräistä oraalista puhdistumaa viisinkertaiseksi. SEROQUEL 50 mg:n annoksia voidaan joutua lisäämään jopa 5-kertaiseksi skitsofrenian oireiden pitämiseksi hallinnassa potilailla, jotka saavat ketiapiinia ja fenytoiinia tai muita tunnettuja voimakkaita CYP3A4-induktoreita (ks. ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ]. Kun CYP3A4-induktori lopetetaan, SEROQUEL 25 mg:n annos tulee pienentää alkuperäiselle tasolle 7-14 päivän kuluessa [ks. ANNOSTELU JA HALLINNOINTI ].
Useiden samanaikaisten lääkkeiden mahdollisia vaikutuksia ketiapiinin farmakokinetiikkaan tutkittiin [katso KLIININEN FARMAKOLOGIA ].
Ketiapiinin vaikutus muihin lääkkeisiin
Koska SEROQUEL 50 mg voi aiheuttaa hypotensiota, se voi tehostaa tiettyjen verenpainetta alentavien aineiden vaikutuksia.
SEROQUEL 25 mg voi antagonisoida levodopan ja dopamiiniagonistien vaikutuksia.
Seroquelilla ei ole kliinisesti merkittäviä farmakokineettisiä yhteisvaikutuksia muiden CYP-reittiin perustuvien lääkkeiden kanssa. Seroquel 50 mg ja sen metaboliitit eivät ole tärkeimpien metaboloivien CYP:ien (1A2, 2C9, 2C19, 2D6 ja 3A4) estäjiä.
Huumeiden väärinkäyttö ja riippuvuus
Valvottu aine
SEROQUEL ei ole valvottu aine.
Väärinkäyttö
SEROQUEL-valmistetta ei ole systemaattisesti tutkittu eläimillä tai ihmisillä sen mahdollisen väärinkäytön, sietokyvyn tai fyysisen riippuvuuden suhteen. Vaikka kliiniset tutkimukset eivät paljastaneet minkäänlaista taipumusta huumeiden etsivään käyttäytymiseen, nämä havainnot eivät olleet systemaattisia, eikä tämän rajallisen kokemuksen perusteella ole mahdollista ennustaa, missä määrin keskushermostoon vaikuttavaa lääkettä käytetään väärin tai muualle, ja/tai väärinkäytöksiä sen jälkeen, kun ne on markkinoitu. Tästä syystä potilaita tulee arvioida huolellisesti anamneesissa huumeiden väärinkäytön varalta, ja tällaisia potilaita tulee tarkkailla tarkasti SEROQUELin väärinkäytön merkkien varalta, esim. sietokyvyn kehittyminen, annoksen suurentaminen, huumeiden etsintäkäyttäytyminen.
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Lisääntynyt kuolleisuus iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi
Iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi ja joita hoidetaan psykoosilääkkeillä, on lisääntynyt kuolemanriski. Analyysi 17 lumekontrolloidusta tutkimuksesta (modaalinen kesto 10 viikkoa), pääasiassa potilailla, jotka käyttivät epätyypillisiä psykoosilääkkeitä, osoittivat, että lääkehoitoa saaneiden potilaiden kuolemanriski on 1,6-1,7 kertaa suurempi kuin lumelääkettä saaneiden potilaiden riski. Tyypillisen 10 viikon kontrolloidun tutkimuksen aikana kuolleisuusaste lääkehoidetuilla potilailla oli noin 4,5 % verrattuna lumeryhmässä noin 2,6 %:iin. Vaikka kuolinsyyt vaihtelivat, suurin osa kuolemista näytti olevan joko sydän- ja verisuoniperäisiä (esim. sydämen vajaatoiminta, äkillinen kuolema) tai tarttuvia (esim. keuhkokuume). Havaintotutkimukset viittaavat siihen, että kuten epätyypilliset psykoosilääkkeet, hoito tavanomaisilla psykoosilääkkeillä voi lisätä kuolleisuutta. Ei ole selvää, missä määrin havainnointitutkimuksissa havaitut havainnot lisääntyneestä kuolleisuudesta voidaan johtua psykoosilääkkeestä verrattuna joihinkin potilaiden ominaisuuksiin. SEROQUEL ei ole hyväksytty potilaiden hoitoon, joilla on dementiaan liittyvä psykoosi [katso LAATIKKO VAROITUS ].
Nuorten ja nuorten aikuisten itsemurha-ajatukset ja -käyttäytyminen
Potilaat, joilla on vaikea masennushäiriö (MDD), sekä aikuisilla että lapsilla, voivat kokea masennuksensa pahenemista ja/tai itsemurha-ajatuksia ja -käyttäytymisen ilmaantumista (itsemurha-ajatuksia) tai epätavallisia muutoksia käyttäytymisessä riippumatta siitä, käyttävätkö he masennuslääkkeitä vai eivät, ja tämä riski voi jatkua, kunnes merkittävä remissio tapahtuu. Itsemurha on tunnettu masennuksen ja tiettyjen muiden psykiatristen häiriöiden riski, ja nämä häiriöt itsessään ovat vahvimpia itsemurhan ennustajia. Pitkään on kuitenkin ollut huolta siitä, että masennuslääkkeillä voi olla rooli masennuksen pahenemisessa ja itsetuhoisuuden syntymisessä tietyillä potilailla hoidon alkuvaiheessa. Lyhytaikaisten lumekontrolloitujen masennuslääkkeiden (SSRI-lääkkeiden ja muiden) tutkimusten yhdistetyt analyysit osoittivat, että nämä lääkkeet lisäävät itsemurha-ajattelun ja -käyttäytymisen (itsemurha-ajattelun) riskiä lapsilla, nuorilla ja nuorilla aikuisilla (18–24-vuotiaat), joilla on vakava masennus. häiriö (MDD) ja muut psykiatriset häiriöt. Lyhytaikaiset tutkimukset eivät osoittaneet lisääntynyttä itsemurhariskiä masennuslääkkeillä lumelääkkeeseen verrattuna yli 24-vuotiailla aikuisilla; 65-vuotiailla ja sitä vanhemmilla aikuisilla masennuslääkkeet vähenivät lumelääkkeeseen verrattuna.
Plasebokontrolloitujen tutkimusten yhdistetyt analyysit lapsilla ja nuorilla, joilla oli MDD, pakko-oireinen häiriö (OCD) tai muut psykiatriset häiriöt, sisälsivät yhteensä 24 lyhytaikaista tutkimusta 9 masennuslääkkeellä yli 4400 potilaalla. Plasebokontrolloitujen tutkimusten yhdistetyt analyysit aikuisilla, joilla oli MDD tai muita psykiatrisia häiriöitä, sisälsivät yhteensä 295 lyhytaikaista tutkimusta (mediaanikesto 2 kuukautta), joissa oli 11 masennuslääkettä yli 77 000 potilaalla. Itsemurhariskissä oli huomattavaa vaihtelua lääkkeiden välillä, mutta taipumus nuorempien potilaiden lisääntymiseen lähes kaikkien tutkittujen lääkkeiden kohdalla. Absoluuttisessa itsemurhariskissä oli eroja eri indikaatioiden välillä, ja suurin ilmaantuvuus MDD:ssä. Riskierot (lääke vs. lumelääke) olivat kuitenkin suhteellisen vakaita ikäryhmien sisällä ja eri käyttöaiheissa. Nämä riskierot (lääkkeen ja lumelääkkeen ero itsemurhatapausten määrässä 1000 hoidettua potilasta kohti) on esitetty taulukossa 2.
Yhtään itsemurhaa ei tapahtunut missään lapsitutkimuksessa. Aikuisten kokeissa oli itsemurhia, mutta määrä ei riittänyt päättämään lääkkeiden vaikutuksesta itsemurhaan.
Ei tiedetä, ulottuuko itsemurhariski pitkäaikaiseen käyttöön eli useiden kuukausien jälkeiseen käyttöön. Lumekontrolloiduista ylläpitotutkimuksista aikuisilla, joilla on masennus, on kuitenkin huomattavaa näyttöä siitä, että masennuslääkkeiden käyttö voi viivyttää masennuksen uusiutumista.
Kaikkia potilaita, joita hoidetaan masennuslääkkeillä missä tahansa indikaatiossa, on seurattava asianmukaisesti ja tarkkailtava tarkasti kliinisen pahenemisen, itsemurha-ajattelun ja epätavallisten käyttäytymismuutosten varalta, erityisesti lääkehoidon ensimmäisten kuukausien aikana tai annosta muutettaessa, joko annosta suurennetaan. tai pienenee.
Seuraavia oireita, ahdistusta, kiihtyneisyyttä, paniikkikohtauksia, unettomuutta, ärtyneisyyttä, vihamielisyyttä, aggressiivisuutta, impulsiivisuutta, akatisiaa (psykomotorista levottomuutta), hypomaniaa ja maniaa on raportoitu myös aikuisilla ja lapsipotilailla, joita on hoidettu masennuslääkkeillä vakavan masennuksen vuoksi. Kuten muutkin indikaatiot, sekä psykiatriset että ei-psykiatriset. Vaikka syy-yhteyttä tällaisten oireiden ilmaantumisen ja joko masennuksen pahenemisen ja/tai itsetuhoisten impulssien ilmaantumisen välillä ei ole osoitettu, on huolestuttavaa, että tällaiset oireet voivat olla syntyvän itsetuhoisuuden esiaste.
Hoito-ohjelman muuttamista, mukaan lukien lääkityksen mahdollista lopettamista, tulee harkita potilailla, joiden masennus pahenee jatkuvasti tai joilla on ilmennyt itsemurha tai oireita, jotka saattavat olla masennuksen tai itsemurha-ajatuksen pahenemisen edeltäjä, varsinkin jos nämä oireet ovat vakavia, äkillisiä. ovat alkaneet tai eivät olleet osa potilaan oireita.
Masennuslääkkeillä vakavan masennushäiriön tai muiden, sekä psykiatristen että ei-psykiatristen, hoitoon saavien potilaiden perheitä ja hoitajia tulee varoittaa tarpeesta seurata potilaita kiihtyneisyyden, ärtyneisyyden, epätavallisten käyttäytymismuutosten ja muiden oireiden ilmaantumisen varalta. edellä kuvatut, sekä itsemurha-ajattelun ilmaantuminen ja ilmoittamaan tällaisista oireista välittömästi terveydenhuollon tarjoajille. Tällaiseen seurantaan tulisi sisältyä perheiden ja omaishoitajien päivittäinen tarkkailu. SEROQUEL-resepti tulee kirjoittaa pienimmälle tablettimäärälle, mikä on hyvän potilashoidon mukaista, jotta voidaan vähentää yliannostusriskiä.
Potilaiden seulonta kaksisuuntaisen mielialahäiriön varalta
Vakava masennusjakso voi olla kaksisuuntaisen mielialahäiriön ensimmäinen ilmentymä. Yleisesti uskotaan (vaikkakaan sitä ei ole vahvistettu kontrolloiduissa tutkimuksissa), että tällaisen episodin hoito pelkällä masennuslääkkeellä voi lisätä seka-/maanisen vaiheen esiintymisen todennäköisyyttä potilailla, joilla on kaksisuuntaisen mielialahäiriön riski. Ei tiedetä, edustavatko mikään yllä kuvatuista oireista tällaista muutosta. Ennen masennuslääkehoidon aloittamista, mukaan lukien SEROQUEL, potilaita, joilla on masennusoireita, tulee kuitenkin seuloa riittävästi sen määrittämiseksi, onko heillä kaksisuuntaisen mielialahäiriön riski. Tällaiseen seulontaan tulee sisältyä yksityiskohtainen psykiatrinen historia, mukaan lukien suvussa itsemurhaa, kaksisuuntaista mielialahäiriötä ja masennusta esiintynyt historia.
Aivoverenkierron haittavaikutukset, mukaan lukien aivohalvaus, iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi
Lumekontrolloiduissa risperidonilla, aripipratsolilla ja olantsapiinilla tehdyissä iäkkäillä dementiapotilailla tehdyissä tutkimuksissa aivoverenkierron haittavaikutuksia (aivoverisuonitapahtumat ja ohimenevät iskeemiset kohtaukset) mukaan lukien kuolemaan johtaneiden potilaiden ilmaantuvuus oli suurempi kuin lumelääkettä saaneilla potilailla. SEROQUEL ei ole hyväksytty potilaiden hoitoon, joilla on dementiaan liittyvä psykoosi [katso myös LAATIKKO VAROITUS ja Lisääntynyt kuolleisuus iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi ].
Maligni neuroleptinen oireyhtymä (NMS)
Mahdollisesti kuolemaan johtava oireyhtymä, jota joskus kutsutaan maligniksi neuroleptioireyhtymäksi (NMS), on raportoitu psykoosilääkkeiden, mukaan lukien SEROQUELin, käytön yhteydessä. Harvinaisia NMS-tapauksia on raportoitu SEROQUELin käytön yhteydessä. NMS:n kliinisiä oireita ovat hyperpyreksia, lihasjäykkyys, muuttunut henkinen tila ja todisteet autonomisesta epävakaudesta (epäsäännöllinen pulssi tai verenpaine, takykardia, hikoilu ja sydämen rytmihäiriö). Muita oireita voivat olla kohonnut kreatiniinifosfokinaasi, myoglobinuria (rabdomyolyysi) ja akuutti munuaisten vajaatoiminta.
Tätä oireyhtymää sairastavien potilaiden diagnostinen arviointi on monimutkaista. Diagnoosia tehtäessä on tärkeää sulkea pois tapaukset, joissa kliininen kuva sisältää sekä vakavan sairauden (esim. keuhkokuume, systeeminen infektio jne.) että hoitamattomia tai riittämättömästi hoidettuja ekstrapyramidaalisia merkkejä ja oireita (EPS). Muita tärkeitä näkökohtia erotusdiagnoosissa ovat keskushermoston antikolinerginen toksisuus, lämpöhalvaus, lääkekuume ja primaarinen keskushermoston (CNS) patologia.
NMS-taudin hoitoon tulisi kuulua: 1) psykoosilääkkeiden ja muiden samanaikaisen hoidon kannalta välttämättömien lääkkeiden välitön lopettaminen; 2) intensiivinen oireenmukainen hoito ja lääketieteellinen seuranta; ja 3) kaikkien samanaikaisten vakavien lääketieteellisten ongelmien hoito, joihin on saatavilla erityisiä hoitoja. Ei ole olemassa yleistä yksimielisyyttä NMS:n erityisistä farmakologisista hoito-ohjelmista.
Jos potilas tarvitsee psykoosilääkehoitoa NMS:stä toipumisen jälkeen, lääkehoidon mahdollista uudelleen aloittamista tulee harkita huolellisesti. Potilasta on seurattava huolellisesti, koska NMS-taudin uusiutumista on raportoitu.
Metaboliset muutokset
Epätyypillisiin psykoosilääkkeisiin on liitetty aineenvaihdunnan muutoksia, joita ovat hyperglykemia/diabetes mellitus, dyslipidemia ja painonnousu. Vaikka kaikkien luokkaan kuuluvien lääkkeiden on osoitettu aiheuttavan joitain metabolisia muutoksia, jokaisella lääkkeellä on oma erityinen riskiprofiilinsa. Joillakin potilailla havaittiin kliinisissä tutkimuksissa useamman kuin yhden metabolisen parametrin, kuten painon, verensokerin ja lipidien, huononemista. Muutoksia näissä aineenvaihduntaprofiileissa tulee hallita kliinisesti tarkoituksenmukaisella tavalla.
Hyperglykemia ja diabetes mellitus
Hyperglykemiaa, joka on joissain tapauksissa äärimmäistä ja joka liittyy ketoasidoosiin tai hyperosmolaariseen koomaan tai kuolemaan, on raportoitu potilailla, joita on hoidettu epätyypillisillä psykoosilääkkeillä, mukaan lukien ketiapiinilla. Epätyypillisen psykoosilääkkeiden käytön ja glukoosipoikkeavuuksien välisen suhteen arviointia vaikeuttaa skitsofreniapotilaiden lisääntynyt diabeteksen taustariski ja yleisväestössä lisääntynyt diabetes mellituksen esiintyvyys. Kun otetaan huomioon nämä sekaannukset, epätyypillisen psykoosilääkkeen käytön ja hyperglykemiaan liittyvien haittavaikutusten välistä suhdetta ei täysin ymmärretä. Epidemiologiset tutkimukset viittaavat kuitenkin hyperglykemiaan liittyvien haittavaikutusten lisääntyneeseen riskiin potilailla, joita hoidetaan epätyypillisillä psykoosilääkkeillä. Tarkkoja riskiarvioita hyperglykemiaan liittyvistä haittavaikutuksista potilailla, joita hoidetaan epätyypillisillä psykoosilääkkeillä, ei ole saatavilla.
Potilaita, joilla on todettu diabetes mellitus ja jotka aloittavat atyyppisten psykoosilääkkeiden käytön, tulee seurata säännöllisesti glukoositasapainon heikkenemisen varalta. Potilaille, joilla on diabetes mellituksen riskitekijöitä (esim. liikalihavuus, diabetes suvussa), jotka aloittavat hoidon atyyppisillä psykoosilääkkeillä, tulee tehdä paastoverensokerimittaus hoidon alussa ja määräajoin hoidon aikana. Potilaita, joita hoidetaan epätyypillisillä psykoosilääkkeillä, tulee seurata hyperglykemian oireiden varalta, mukaan lukien polydipsia, polyuria, polyfagia ja heikkous. Potilaille, joille kehittyy hyperglykemian oireita atyyppisten psykoosilääkkeiden käytön aikana, on tehtävä paastoverensokerimittaus. Joissakin tapauksissa hyperglykemia on parantunut, kun epätyypillinen antipsykootti on lopetettu; Jotkut potilaat kuitenkin tarvitsivat diabeteslääkityksen jatkamista huolimatta epäillyn lääkkeen käytön lopettamisesta.
Aikuiset
24 viikkoa kestäneessä tutkimuksessa (aktiivisesti kontrolloitu, 115 potilasta, joita hoidettiin SEROQUELilla), jonka tarkoituksena oli arvioida kaikkien potilaiden glykeeminen tila suun kautta otetun glukoosinsietotestin avulla, viikolla 24 glukoosialtistuksen jälkeisen glukoositason ilmaantuvuus oli ≥ 200 mg/dl. 1,7 % ja paastoveren glukoositason ≥126 mg/dl ilmaantuvuus oli 2,6 %. Paastoglukoosin keskimääräinen muutos lähtötasosta oli 3,2 mg/dl ja 2 tunnin glukoosin keskimääräinen muutos lähtötasosta oli -1,8 mg/dl ketiapiinilla.
Kahdessa pitkäaikaisessa lumelääkekontrolloidussa satunnaistetussa kliinisessä vieroitustutkimuksessa kaksisuuntaisen mielialahäiriön ylläpitoa varten, keskimääräinen altistus 213 päivää SEROQUELilla (646 potilasta) ja 152 päivää lumelääkeryhmällä (680 potilasta), glukoosin keskimääräinen muutos lähtötasosta oli +5,0 mg /dl SEROQUEL 100 mg:lle ja –0,05 mg/dl lumelääkettä varten. Kaikkien kohonneiden veren glukoosipitoisuuksien (≥126 mg/dl) altistumisnopeus potilailla, jotka ovat kuluneet yli 8 tuntia aterian jälkeen (joitakin potilaita ei kuitenkaan ehkä ole estetty ottamasta kaloreita nesteestä paastojakson aikana) oli 18,0/100 potilasvuodet SEROQUELilla (10,7 % potilaista; n = 556) ja 9,5 lumelääkettä 100 potilasvuotta kohden (4,6 % potilaista; n = 581).
Lapset ja nuoret
Plasebokontrolloidussa SEROQUEL 25 mg monoterapiatutkimuksessa skitsofreniaa sairastavilla nuorilla (13-17-vuotiailla) potilailla (kesto 6 viikkoa) SEROQUELin (n=138) paastoglukoositasojen keskimääräinen muutos lumelääkkeeseen (n=67) verrattuna oli –0,75 mg/dl vs. –1,70 mg/dl. Plasebokontrolloidussa SEROQUEL 300 mg monoterapiatutkimuksessa lapsilla ja nuorilla potilailla (10-17-vuotiaat), joilla oli kaksisuuntainen mielialamania (3 viikkoa kesto), keskimääräinen muutos paastoglukoosipitoisuudessa SEROQUELilla (n=170) verrattuna lumelääkkeeseen (n =81) oli 3,62 mg/dl vs. -1,17 mg/dl. Kummassakaan tutkimuksessa potilaalla, jonka lähtötilanteen normaali paastoglukoositaso (
Plasebokontrolloidussa SEROQUEL XR -monoterapiatutkimuksessa (8 viikkoa), jossa käytettiin kaksisuuntaista mielialahäiriötä sairastavia lapsia ja nuoria (1017-vuotiaita) potilaita, joiden tehoa ei osoitettu, keskimääräinen muutos paastoglukoosipitoisuuksissa SEROQUEL 300 mg XR:n kohdalla (n= 60) lumelääkkeeseen verrattuna (n=62) oli 1,8 mg/dl vs. 1,6 mg/dl. Tässä tutkimuksessa SEROQUEL XR -ryhmässä tai lumelääkettä saaneissa ryhmissä ei ollut potilaita, joiden lähtötilanteen normaali paastoglukoositaso ( 126 mg/dl. SEROQUEL 25 mg XR -ryhmässä oli yksi potilas, jonka paastoglukoositaso oli lähtötasolla (> 100 mg/dl ja 126 mg/dl verrattuna nollaan potilaaseen. lumeryhmä.
Dyslipidemia
Aikuiset
Taulukossa 4 esitetään niiden aikuisten potilaiden prosenttiosuus, joiden kokonaiskolesteroli-, triglyseridi-, LDL-kolesteroli- ja HDL-kolesteroliarvot ovat muuttuneet lähtötasosta indikaatioiden mukaan SEROQUELin kliinisissä tutkimuksissa.
Lapset ja nuoret
Taulukossa 5 esitetään niiden lasten ja nuorten prosenttiosuus, joiden kokonaiskolesteroli-, triglyseridi-, LDL-kolesteroli- ja HDL-kolesteroliarvot muuttuivat lähtötasosta SEROQUELin kliinisissä tutkimuksissa.
Plasebokontrolloidussa SEROQUEL XR -monoterapiatutkimuksessa (8 viikkoa), jossa käytettiin kaksisuuntaista mielialahäiriötä sairastavia lapsia ja nuoria (1017-vuotiaita) potilaita, joiden tehoa ei osoitettu, niiden lasten ja nuorten prosenttiosuus, joilla oli muutoksia kokonaiskolesteroliarvoissa (≥200). mg/dl), triglyseridit (≥150 mg/dl), LDL-kolesteroli (≥ 130 mg/dl) ja HDL-kolesteroli (≤40 mg/dl) lähtötasosta kliinisesti merkitseviin tasoihin olivat: kokonaiskolesteroli 8 % (7 /83) SEROQUEL 50mg XR vs. 6 % (5/84) lumelääkkeellä; triglyseridit 28 % (22/80) SEROQUEL 100 mg XR:lle vs. 9 % (7/82) lumelääkkeelle; LDL-kolesteroli 2 % (2/86) SEROQUEL XR:lle vs. 4 % (3/85) lumelääkettä ja HDL-kolesteroli 20 % (13/65) SEROQUEL XR vs. 15 % (11/74) lumelääkettä varten.
Painonnousu
Kliinisissä tutkimuksissa on havaittu painon nousua. Ketiapiinia saavien potilaiden painoa tulee seurata säännöllisesti.
Aikuiset
Kliinisissä tutkimuksissa SEROQUEL 50 mg:lla on raportoitu seuraavia painonnousuja.
Lapset ja nuoret
Kahdessa SEROQUEL 25 mg:n kliinisessä tutkimuksessa, joista toisessa oli kaksisuuntainen mielialamania ja toinen skitsofrenia, raportoidut painonnousut sisältyvät taulukkoon 7.
Keskimääräinen ruumiinpainon muutos skitsofreniatutkimuksessa oli 2,0 kg SEROQUEL 25 mg -ryhmässä ja -0,4 kg lumeryhmässä ja kaksisuuntaisen mielialahäiriön maniatutkimuksessa, se oli 1,7 kg SEROQUEL 200 mg -ryhmässä ja 0,4 kg lumeryhmässä.
Avoimessa tutkimuksessa, johon osallistui potilaita yllä olevista kahdesta lapsitutkimuksesta, 63 % potilaista (241/380) suoritti 26 viikon SEROQUEL-hoidon. 26 viikon hoidon jälkeen ruumiinpainon keskimääräinen nousu oli 4,4 kg. 45 prosenttia potilaista nousi ≥ 7 % painostaan, jota ei ole mukautettu normaaliin kasvuun. Normaalin kasvun mukauttamiseksi 26 viikon aikana käytettiin kliinisesti merkittävän muutoksen mittana vähintään 0,5 keskihajonnan lisäystä lähtötasosta BMI:ssä; 18,3 % SEROQUEL-potilaista täytti tämän kriteerin 26 viikon hoidon jälkeen.
Kliinisessä SEROQUEL XR:n tutkimuksessa kaksisuuntaista mielialahäiriötä sairastavilla lapsilla ja nuorilla (10–17-vuotiailla), jossa tehoa ei osoitettu, potilaiden prosenttiosuus, joiden paino nousi ≥ 7 % kehon painosta milloin tahansa, oli 15 % ( 14/92) SEROQUEL 25mg XR vs. 10 % (10/100) lumelääkkeellä. Keskimääräinen painonmuutos oli 1,4 kg SEROQUEL 50 mg XR -ryhmässä vs. 0,6 kg lumeryhmässä.
Kun lapsipotilaita hoidetaan SEROQUEL 50 mg:lla mihin tahansa käyttöaiheeseen, painonnousu tulee arvioida suhteessa normaaliin kasvuun odotettavissa olevaan painonnousuun.
Tardiivi dyskinesia
Mahdollisesti palautumattomien, tahattomien, dyskineettisten liikkeiden oireyhtymä voi kehittyä potilaille, joita hoidetaan psykoosilääkkeillä, mukaan lukien ketiapiini. Vaikka oireyhtymän esiintyvyys näyttää olevan korkein vanhuksilla, erityisesti iäkkäillä naisilla, on mahdotonta luottaa esiintyvyysarvioihin sen ennustamiseksi antipsykoottisen hoidon alussa, ketkä potilaat todennäköisesti saavat oireyhtymän. Ei tiedetä, eroavatko psykoosilääkkeet tardiivista dyskinesiasta.
Tardiivin dyskinesian kehittymisen riskin ja todennäköisyyden, että se muuttuu peruuttamattomaksi, uskotaan kasvavan hoidon keston ja potilaalle annettavien psykoosilääkkeiden kumulatiivisen kokonaisannoksen kasvaessa. Oireyhtymä voi kuitenkin kehittyä, vaikkakin paljon harvemmin, suhteellisen lyhyiden hoitojaksojen jälkeen pienillä annoksilla tai jopa hoidon lopettamisen jälkeen.
Tardiivi dyskinesia voi lievittyä osittain tai kokonaan, jos antipsykoottinen hoito lopetetaan. Antipsykoottinen hoito itsessään voi kuitenkin tukahduttaa (tai osittain tukahduttaa) oireyhtymän merkit ja oireet ja saattaa siten mahdollisesti peittää taustalla olevan prosessin. Oireisen suppression vaikutusta oireyhtymän pitkäaikaiseen kulumiseen ei tunneta.
Nämä näkökohdat huomioon ottaen SEROQUEL 50 mg tulee määrätä tavalla, joka todennäköisimmin minimoi tardiivin dyskinesian esiintymisen. Krooninen antipsykoottinen hoito tulee yleensä varata potilaille, jotka näyttävät kärsivän kroonisesta sairaudesta, jonka (1) tiedetään reagoivan psykoosilääkkeisiin ja (2) joille ei ole saatavilla tai sopivia vaihtoehtoisia, yhtä tehokkaita mutta mahdollisesti vähemmän haitallisia hoitoja. . Potilailla, jotka tarvitsevat kroonista hoitoa, tulee pyrkiä pienintä annosta ja lyhyintä hoidon kestoa, joka tuottaa tyydyttävän kliinisen vasteen. Hoidon jatkamisen tarvetta tulee arvioida uudelleen säännöllisesti.

Jos potilaalla, joka saa SEROQUEL 200 mg, ilmaantuu tardiivin dyskinesian merkkejä ja oireita, lääkkeen käytön lopettamista tulee harkita. Jotkut potilaat saattavat kuitenkin tarvita hoitoa SEROQUEL 200 mg:lla oireyhtymästä huolimatta.
Hypotensio
Ketiapiini saattaa aiheuttaa ortostaattista hypotensiota, johon liittyy huimausta, takykardiaa ja joillakin potilailla pyörtymistä, erityisesti annoksen titrausvaiheen alussa, mikä todennäköisesti heijastaa sen α1-adrenergisiä antagonisteja. Pyörtymistä raportoitiin 1 %:lla (28/3265) SEROQUEL-hoitoa saaneista potilaista verrattuna 0,2 %:iin (2/954) lumelääkettä saaneista ja noin 0,4 %:lla (2/527) aktiivisia kontrollilääkkeitä saaneista potilaista. Ortostaattinen hypotensio, huimaus ja pyörtyminen voivat johtaa kaatumisiin.
SEROQUEL 25 mg:n käytössä tulee noudattaa erityistä varovaisuutta potilailla, joilla on tunnettu sydän- ja verisuonisairaus (aiemmin sydäninfarkti tai iskeeminen sydänsairaus, sydämen vajaatoiminta tai johtumishäiriöt), aivoverisuonitauti tai tilat, jotka altistavat potilaat hypotensiolle (dehydraatio, hypovolemia ja hoito verenpainetta alentavat lääkkeet). Ortostaattisen hypotension ja pyörtymisen riskiä voidaan minimoida rajoittamalla aloitusannos 25 mg:aan kahdesti vuorokaudessa [ks. ANNOSTELU JA HALLINNOINTI ]. Jos hypotensiota ilmenee tavoiteannoksen titrauksen aikana, on aiheellista palata edelliseen annokseen titrausohjelmassa.
Falls
Epätyypilliset psykoosilääkkeet, mukaan lukien SEROQUEL, voivat aiheuttaa uneliaisuutta, posturaalista hypotensiota, motorista ja sensorista epävakautta, mikä voi johtaa kaatumisiin ja sen seurauksena murtumiin tai muihin vammoihin. Potilaille, joilla on sairauksia, tiloja tai lääkkeitä, jotka voivat pahentaa näitä vaikutuksia, suorita putoamisriskin arvioinnit antipsykoottista hoitoa aloitettaessa ja toistuvasti potilailla, jotka saavat pitkäaikaista antipsykoottista hoitoa.
Verenpaineen nousu (lapset ja nuoret)
Plasebokontrolloiduissa tutkimuksissa lapsilla ja nuorilla, joilla oli skitsofrenia (kesto 6 viikkoa) tai kaksisuuntainen mielialamania (kesto 3 viikkoa), systolisen verenpaineen (≥ 20 mmHg) nousun ilmaantuvuus oli 15,2 % (51/335). ) SEROQUEL 50 mg:n ja 5,5 % (9/163) lumelääkkeen osalta; Diastolisen verenpaineen nousun ilmaantuvuus milloin tahansa (≥10 mmHg) oli 40,6 % (136/335) SEROQUEL-ryhmässä ja 24,5 % (40/163) lumelääkeryhmässä. 26 viikkoa kestäneessä avoimessa kliinisessä tutkimuksessa yksi lapsi, jolla oli raportoitu verenpainetauti, koki hypertensiivisen kriisin. Lasten ja nuorten verenpaine tulee mitata hoidon alussa ja ajoittain hoidon aikana.
Plasebokontrolloidussa SEROQUEL XR -kliinisessä tutkimuksessa (8 viikkoa) kaksisuuntaista mielialahäiriötä sairastavilla lapsilla ja nuorilla (10-17-vuotiailla), jossa tehoa ei osoitettu, systolisen verenpaineen nousun ilmaantuvuus milloin tahansa (≥ 20 mmHg) oli 6,5 % (6/92) SEROQUEL XR:llä ja 6,0 % (6/100) lumelääkkeellä; Diastolisen verenpaineen nousun ilmaantuvuus milloin tahansa (≥10 mmHg) oli 46,7 % (43/92) SEROQUEL 25 mg XR:llä ja 36,0 % (36/100) lumelääkkeellä.
Leukopenia, neutropenia ja agranulosytoosi
Kliinisissä tutkimuksissa ja markkinoille tulon jälkeisissä kokemuksissa on raportoitu leukopenia/neutropenia tapahtumia, jotka liittyvät ajallisesti epätyypillisiin psykoosilääkkeisiin, mukaan lukien SEROQUEL. Agranulosytoosia on raportoitu.
Agranulosytoosia (määritelty absoluuttiseksi neutrofiilimääräksi
Mahdollisia leukopenian/neutropenian riskitekijöitä ovat alhainen valkosolujen määrä (WBC) ja lääkkeiden aiheuttama leukopenia/neutropenia. Potilaiden, joilla on ennestään alhainen valkosolujen määrä tai joilla on aiemmin ollut lääkkeiden aiheuttama leukopenia/neutropenia, koko verenkuvaa (CBC) tulee seurata usein muutaman ensimmäisen hoitokuukauden aikana, ja heidän tulee lopettaa SEROQUEL 50 mg -hoito heti, kun havaitaan ensimmäiset merkit valkosolujen määrän vähenemisestä muiden aiheuttavien tekijöiden puuttuminen.
Potilaita, joilla on neutropenia, tulee tarkkailla huolellisesti kuumeen tai muiden oireiden tai infektion merkkien varalta, ja heitä tulee hoitaa välittömästi, jos tällaisia oireita tai merkkejä ilmaantuu. Potilaiden, joilla on vaikea neutropenia (absoluuttinen neutrofiilien määrä
Kaihi
Kaihien kehittymistä havaittiin ketiapiinihoidon yhteydessä kroonisissa koiratutkimuksissa [katso Ei-kliininen toksikologia ]. Linssimuutoksia on havaittu myös aikuisilla, lapsilla ja nuorilla pitkäaikaisen SEROQUEL 100 mg -hoidon aikana, mutta syy-yhteyttä SEROQUEL 200 mg:n käyttöön ei ole osoitettu. Tästä huolimatta linssimäisten muutosten mahdollisuutta ei voida sulkea pois tällä hetkellä. Siksi linssin tutkimista kaihimuodostuksen havaitsemiseen sopivilla menetelmillä, kuten rakolampun tutkimuksella tai muilla asianmukaisesti herkillä menetelmillä, suositellaan hoidon alussa tai pian sen jälkeen ja 6 kuukauden välein kroonisen hoidon aikana.
QT-ajan pidentyminen
Kliinisissä tutkimuksissa ketiapiiniin ei liittynyt jatkuvaa QT-ajan pidentymistä. QT-vaikutusta ei kuitenkaan arvioitu systemaattisesti perusteellisessa QT-tutkimuksessa. Markkinoille tulon jälkeen on raportoitu QT-ajan pidentymistä potilailla, jotka ottivat yliannostuksen ketiapiinia [ks. YLIANNOSTUS ], potilailla, joilla on samanaikainen sairaus, ja potilailla, jotka käyttävät lääkkeitä, joiden tiedetään aiheuttavan elektrolyyttitasapainoa tai pidentävän QT-aikaa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Ketiapiinin käyttöä tulee välttää yhdessä muiden lääkkeiden kanssa, joiden tiedetään pidentävän QTc-aikaa, mukaan lukien luokan 1A rytmihäiriölääkkeet (esim. kinidiini, prokaiiniamidi) tai luokan III rytmihäiriölääkkeet (esim. amiodaroni, sotaloli), psykoosilääkkeiden (esim. tsiprasidoni, klooripromatsiini, tioridatsiini), antibiootit (esim. gatifloksasiini, moksifloksasiini) tai mikä tahansa muu lääkeluokka, jonka tiedetään pidentävän QTc-aikaa (esim. pentamidiini, levometadyyliasetaatti, metadoni).
Ketiapiinin käyttöä tulee myös välttää olosuhteissa, jotka voivat lisätä torsade de pointesin ja/tai äkillisen kuoleman riskiä, mukaan lukien (1) anamneesissa sydämen rytmihäiriöitä, kuten bradykardia; (2) hypokalemia tai hypomagnesemia; (3) muiden QTc-aikaa pidentävien lääkkeiden samanaikainen käyttö; ja (4) QT-ajan synnynnäinen pidentyminen.
Varovaisuutta tulee myös noudattaa, kun ketiapiinia määrätään potilaille, joilla on suurentunut QT-ajan pidentymisen riski (esim. sydän- ja verisuonisairaus, QT-ajan piteneminen suvussa, iäkkäät henkilöt, sydämen vajaatoiminta ja sydämen hypertrofia).
Kohtaukset
Kliinisissä tutkimuksissa kouristuskohtauksia esiintyi 0,5 %:lla (20/3490) SEROQUEL-hoitoa saaneista potilaista verrattuna 0,2 %:iin (2/954) lumelääkettä saaneista ja 0,7 %:lla (4/527) aktiivisia kontrollilääkkeitä saaneista potilaista. Kuten muitakin psykoosilääkkeitä, SEROQUEL 25 mg:aa tulee käyttää varoen potilailla, joilla on ollut kouristuskohtauksia tai sairauksia, jotka mahdollisesti alentavat kohtauskynnystä, esim. Alzheimerin dementia. Kouristuskynnystä alentavat tilat voivat olla yleisempiä 65-vuotiailla tai vanhemmilla.
Kilpirauhasen vajaatoiminta
Aikuiset
Ketiapiinilla tehdyt kliiniset tutkimukset osoittivat annoksesta riippuvaa kilpirauhashormonitasojen laskua. Kokonais- ja vapaan tyroksiinin (T4) väheneminen noin 20 % terapeuttisen annosalueen yläpäässä oli maksimi kuuden ensimmäisen hoitoviikon aikana, ja se säilyi ilman mukautumista tai etenemistä kroonisemman hoidon aikana. Lähes kaikissa tapauksissa ketiapiinihoidon lopettaminen liittyi kokonais- ja vapaaseen T4:ään kohdistuvien vaikutusten kääntymiseen hoidon kestosta riippumatta. Mekanismi, jolla ketiapiini vaikuttaa kilpirauhasen akseliin, on epäselvä. Jos hypotalamus-aivolisäke-akselilla on vaikutusta, pelkkä TSH:n mittaus ei välttämättä kuvasta tarkasti potilaan kilpirauhasen tilaa. Siksi sekä TSH että vapaa T4 tulee kliinisen arvioinnin lisäksi mitata lähtötilanteessa ja seurannassa.
Mania-lisätutkimuksissa, joissa SEROQUEL 50 mg lisättiin litiumiin tai divalproaattiin, 12 %:lla (24/196) SEROQUEL 200 mg:lla hoidetuista potilaista verrattuna 7 %:iin (15/203) lumelääkettä saaneista potilaista oli kohonnut TSH-taso. SEROQUEL 300 mg:lla hoidetuista potilaista, joilla oli kohonnut TSH-taso, kolmella oli samanaikaisesti alhainen vapaa T4-taso (vapaa T4
Noin 0,7 % (26/3489) SEROQUEL-potilaista koki TSH:n nousua monoterapiatutkimuksissa. Jotkut potilaat, joilla oli kohonnut TSH, tarvitsivat korvauskilpirauhashoitoa.
Kaikissa ketiapiinitutkimuksissa kilpirauhashormonien ja TSH:n muutosten esiintyvyys oli1: vapaan T4:n lasku (5 mIU/L), 4,9 % (956/19412). Kahdeksalla potilaalla, joilla TBG mitattiin, TBG-tasot pysyivät muuttumattomina.
Taulukossa 8 on esitetty näiden muutosten esiintyvyys lyhytaikaisissa lumekontrolloiduissa kliinisissä tutkimuksissa.
Lyhytaikaisissa lumekontrolloiduissa monoterapiatutkimuksissa T3:n ja TSH:n vastavuoroisten muutosten ilmaantuvuus oli 0,0 % sekä ketiapiinin (1/4800) että lumelääkkeen (0/2190) kohdalla ja T4:n ja TSH:n osalta 0,1 % (7). /6154) ketiapiinilla verrattuna 0,0 % (1/3007) lumelääkkeeseen.
Lapset Ja Nuoret
Akuuteissa lumekontrolloiduissa tutkimuksissa lapsilla ja nuorilla potilailla, joilla on skitsofrenia (kesto 6 viikkoa) tai kaksisuuntainen mielialamania (kesto 3 viikkoa), kilpirauhasen toiminta-arvojen muutosten esiintyvyys milloin tahansa SEROQUEL 100 mg:lla hoidetuilla potilailla ja lumelääkettä saaneilla potilailla kohonneelle TSH:lle oli 2,9 % (8/280) vs. 0,7 % (1/138) ja alentuneelle kokonaistyroksiinille 2,8 % (8/289) vs. 0 % (0/145). SEROQUEL-hoidetuista potilaista, joilla oli kohonnut TSH-taso, yhdellä oli samanaikaisesti alhainen vapaa T4-taso hoidon lopussa.
Hyperprolaktinemia
Aikuiset
Ketiapiinilla tehdyissä kliinisissä tutkimuksissa prolaktiinipitoisuuksien siirtymien kliinisesti merkitsevään arvoon esiintyi 3,6 %:lla (158/4416) ketiapiinilla hoidetuista potilaista verrattuna 2,6 %:iin (51/1968) lumelääkettä saaneista potilaista.
Lapset Ja Nuoret
Akuuteissa lumekontrolloiduissa tutkimuksissa lapsilla ja nuorilla potilailla, joilla oli kaksisuuntainen mielialamania (kesto 3 viikkoa) tai skitsofrenia (kesto 6 viikkoa), prolaktiinipitoisuuksien siirtymien ilmaantuvuus arvoon (> 20 μg/l miehet; > 26 μg) /L naisia milloin tahansa) oli 13,4 % (18/134) SEROQUELilla verrattuna 4 %:iin (3/75) lumelääkkeellä miehillä ja 8,7 % (9/104) SEROQUEL 25 mg:lla verrattuna 0 %:iin (0/39). lumelääkkeeseen naisilla.
Kuten muutkin lääkkeet, jotka antagonisoivat dopamiini D2-reseptoreita, SEROQUEL 300 mg nostaa prolaktiinipitoisuutta joillakin potilailla, ja nousu saattaa jatkua pitkäaikaisen käytön aikana. Hyperprolaktinemia voi etiologiasta riippumatta tukahduttaa hypotalamuksen GnRH:ta, mikä johtaa aivolisäkkeen gonadotropiinin erittymisen vähenemiseen. Tämä puolestaan voi estää lisääntymistoimintoa heikentämällä sukurauhasten steroidogeneesiä sekä nais- että miespotilailla. Galaktorreaa, amenorreaa, gynekomastiaa ja impotenssia on raportoitu potilailla, jotka ovat saaneet prolaktiinia kohottavia yhdisteitä. Pitkäaikainen hyperprolaktinemia, joka liittyy hypogonadismiin, voi johtaa luun tiheyden vähenemiseen sekä nais- että miespotilailla.
Kudosviljelykokeet osoittavat, että noin kolmasosa ihmisen rintasyövistä on prolaktiinista riippuvaisia in vitro, mikä on mahdollisesti tärkeä tekijä, jos näiden lääkkeiden määrääminen harkitaan potilaalle, jolla on aiemmin todettu rintasyöpä. Hiirillä ja rotilla tehdyissä karsinogeenisuustutkimuksissa, kuten on tavallista prolaktiinin vapautumista lisääville yhdisteille, havaittiin maitorauhasten ja haiman saarekesolujen neoplasiaa (rintarauhasen adenokarsinoomat, aivolisäkkeen ja haiman adenoomat). Tähän mennessä tehdyt kliiniset tutkimukset tai epidemiologiset tutkimukset eivät ole osoittaneet yhteyttä tämän lääkeluokan kroonisen annon ja kasvainten muodostumisen välillä ihmisillä, mutta saatavilla oleva näyttö on liian rajallinen ollakseen vakuuttava [ks. Ei-kliininen toksikologia ].
Kognitiivisen ja motorisen vajaatoiminnan mahdollisuus
Uneliaisuus oli yleisesti raportoitu haittatapahtuma, jota raportoitiin SEROQUEL-hoitoa saaneilla potilailla, erityisesti 3–5 päivän aloitusannoksen titrausjakson aikana. Skitsofreniatutkimuksissa uneliaisuutta raportoitiin 18 %:lla (89/510) SEROQUEL 200 mg:n potilaista verrattuna 11 %:iin (22/206) lumelääkepotilaista. Akuutin kaksisuuntaisen mielialahäiriön maniatutkimuksissa, joissa käytettiin SEROQUEL 200 mg monoterapiana, uneliaisuutta raportoitiin 16 %:lla (34/209) SEROQUEL 300 mg:n potilaista verrattuna 4 %:iin lumelääkepotilaista. Akuutin kaksisuuntaisen mielialahäiriön maniatutkimuksissa, joissa käytettiin SEROQUEL-hoitoa lisähoitona, uneliaisuutta raportoitiin 34 %:lla (66/196) SEROQUEL-potilaista verrattuna 9 %:iin (19/203) lumelääkepotilaista. Kaksisuuntaisen mielialahäiriön masennustutkimuksissa uneliaisuutta raportoitiin 57 %:lla (398/698) SEROQUEL 50 mg:n potilaista verrattuna 15 %:iin (51/347) lumelääkepotilaista. Koska SEROQUEL 25 mg voi heikentää harkintakykyä, ajattelua tai motorisia taitoja, potilaita tulee varoittaa suorittamasta henkistä valppautta vaativia toimintoja, kuten moottoriajoneuvon (mukaan lukien autot) tai vaarallisten koneiden käyttämistä, kunnes he ovat kohtuullisen varmoja siitä, että SEROQUEL-hoito vaikuttaa eivät vaikuta niihin haitallisesti. Uneliaisuus voi johtaa kaatumiseen.
Kehon lämpötilan säätely
Vaikka sitä ei ole raportoitu SEROQUEL 100 mg:n kanssa, psykoosilääkkeiden on katsottu aiheuttavan häiriöitä kehon kyvyssä alentaa ruumiinlämpöä. Asianmukaista varovaisuutta suositellaan määrättäessä SEROQUEL 300 mg:aa potilaille, jotka kokevat tiloja, jotka voivat osaltaan kohottaa ruumiinlämpöä, esim. rasittava harjoittelu, altistuminen äärimmäiselle kuumuudelle, samanaikainen antikolinerginen lääke tai kuivuminen.
Dysfagia
Ruokatorven dysmotiliteetti ja aspiraatio on yhdistetty psykoosilääkkeiden käyttöön. Aspiraatiokeuhkokuume on yleinen sairastuvuuden ja kuolleisuuden syy iäkkäillä potilailla, erityisesti niillä, joilla on pitkälle edennyt Alzheimerin dementia. SEROQUEL 100 mg ja muita psykoosilääkkeitä tulee käyttää varoen potilailla, joilla on aspiraatiokeuhkokuumeen riski.
Keskeytysoireyhtymä
Akuutteja vieroitusoireita, kuten unettomuutta, pahoinvointia ja oksentelua, on kuvattu epätyypillisten psykoosilääkkeiden, mukaan lukien SEROQUELin, käytön äkillisen lopettamisen jälkeen. Lyhytaikaisissa lumelääkekontrolloiduissa, monoterapiatutkimuksissa SEROQUEL 25 mg XR:llä, joihin sisältyi keskeytysvaihe, jossa arvioitiin lopetusoireita, yhteenlaskettu ilmaantuvuus potilaille, joilla oli yhtä tai useampaa hoidon keskeytysoiretta äkillisen lopettamisen jälkeen, oli 12,1 % (241/1993) SEROQUEL XR:llä. ja 6,7 % (71/1065) lumelääkkeellä. Yksittäisten haittavaikutusten (esim. unettomuus, pahoinvointi, päänsärky, ripuli, oksentelu, huimaus ja ärtyneisyys) ilmaantuvuus ei ylittänyt 5,3 % missään hoitoryhmässä ja yleensä hävisi viikon kuluttua hoidon lopettamisesta. Asteittainen vetäytyminen on suositeltavaa. [katso Käyttö tietyissä populaatioissa ]
Antikolinergiset (antimuskariiniset) vaikutukset
Norketiapiinilla, ketiapiinin aktiivisella metaboliitilla, on kohtalainen tai vahva affiniteetti useisiin muskariinireseptorin alatyyppeihin. Tämä lisää antikolinergisiä haittavaikutuksia, kun SEROQUEL 25 mg:aa käytetään terapeuttisina annoksina, samanaikaisesti muiden antikolinergisten lääkkeiden kanssa tai yliannostuksena. SEROQUEL-valmistetta tulee käyttää varoen potilailla, jotka saavat lääkkeitä, joilla on antikolinergisiä (antimuskariinisia) vaikutuksia (ks. YLIANNOSTUS ja KLIININEN FARMAKOLOGIA ].
Ummetus oli yleisesti raportoitu haittatapahtuma ketiapiinilla hoidetuilla potilailla, ja se edustaa suolitukoksen riskitekijää. Ketiapiinin käytön yhteydessä on raportoitu suolen tukkeutumista, mukaan lukien kuolemaan johtaneita raportteja potilailla, jotka saivat samanaikaisesti useita suoliston motiliteettia vähentäviä lääkkeitä.
SEROQUEL 300 mg:aa tulee käyttää varoen potilailla, joilla on nykyinen diagnoosi tai aiempi virtsanpidätys, kliinisesti merkittävä eturauhasen liikakasvu, ummetus tai kohonnut silmänpaine.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä (Lääkitysopas).
Potilaita tulee neuvoa seuraavista ongelmista, ja heitä tulee pyytää varoittamaan lääkäriään, jos niitä ilmenee SEROQUEL-hoidon aikana.
Lisääntynyt kuolleisuus dementiaan liittyvää psykoosia sairastavilla iäkkäillä potilailla Potilaille ja heidän hoitajilleen tulee kertoa, että iäkkäillä potilailla, joilla on dementiaan liittyvää psykoosia ja joita on hoidettu epätyypillisillä psykoosilääkkeillä, on suurempi kuolinriski verrattuna lumelääkkeeseen. Ketiapiinia ei ole hyväksytty iäkkäille potilaille, joilla on dementiaan liittyvä psykoosi [katso VAROITUKSET JA VAROTOIMET ].
Itsemurha-ajatukset ja -käyttäytymiset
Potilaita, heidän perheitään ja heidän omaisiaan tulee kannustaa olemaan valppaana ahdistuneisuuden, kiihtyneisyyden, paniikkikohtausten, unettomuuden, ärtyneisyyden, vihamielisyyden, aggressiivisuuden, impulsiivisuuden, akatisian (psykomotorinen levottomuus), hypomanian, manian ja muiden epätavallisten käyttäytymismuutosten ilmaantuessa. , masennuksen paheneminen ja itsemurha-ajatukset, erityisesti masennuslääkehoidon alkuvaiheessa ja kun annosta muutetaan ylös tai alas. Potilaiden perheitä ja hoitajia tulee neuvoa etsimään tällaisten oireiden ilmaantumista päivittäin, koska muutokset voivat olla äkillisiä. Tällaisista oireista tulee ilmoittaa potilaan määräävälle lääkärille tai terveydenhuollon ammattilaiselle, varsinkin jos ne ovat vakavia, alkavat äkillisesti tai eivät olleet osa potilaan oireita. Tällaiset oireet voivat liittyä lisääntyneeseen itsemurha-ajattelun ja -käyttäytymisen riskiin, ja ne osoittavat erittäin tiiviin seurannan ja mahdollisesti lääkityksen muuttamisen tarpeen [ks. VAROITUKSET JA VAROTOIMET ].
Maligni neuroleptinen oireyhtymä (NMS)
Potilaita tulee neuvoa ilmoittamaan lääkärilleen kaikista merkeistä tai oireista, jotka voivat liittyä NMS:ään. Näitä voivat olla lihasjäykkyys ja korkea kuume [katso VAROITUKSET JA VAROTOIMET ].
Hyperglykemia ja diabetes mellitus
Potilaiden tulee olla tietoisia hyperglykemian (korkea verensokeri) ja diabetes mellituksen oireista. Potilaiden, joilla on diagnosoitu diabetes, joilla on diabeteksen riskitekijöitä tai joilla on näitä oireita hoidon aikana, verensokeria tulee seurata hoidon alussa ja ajoittain hoidon aikana [ks. VAROITUKSET JA VAROTOIMET ].
Hyperlipidemia
Potilaille tulee kertoa, että kokonaiskolesteroli-, LDL-kolesteroli- ja triglyseridiarvot voivat kohota ja HDL-kolesteroliarvot laskea. Potilaiden lipidiprofiilia tulee seurata hoidon alussa ja ajoittain hoidon aikana [katso VAROITUKSET JA VAROTOIMET ].
Painonnousu
Potilaille tulee kertoa, että he voivat kokea painonnousua. Potilaiden painoa tulee seurata säännöllisesti [katso VAROITUKSET JA VAROTOIMET ].
Ortostaattinen hypotensio
Potilaita tulee kertoa ortostaattisen hypotension vaarasta (oireita ovat huimaus tai huimaus noustessa, mikä voi johtaa kaatumiseen), erityisesti aloitusannoksen titrausvaiheessa sekä myös hoidon uudelleen aloittamisen tai annoksen suurentamisen yhteydessä. katso VAROITUKSET JA VAROTOIMET ].
Kohonnut verenpaine lapsilla ja nuorilla
Lasten ja nuorten potilaiden verenpaine tulee mitata hoidon alussa ja määräajoin hoidon aikana [katso VAROITUKSET JA VAROTOIMET ].
Leukopenia/neutropenia
Potilaita, joilla on alhainen valkosoluarvo tai joilla on aiemmin ollut lääkkeiden aiheuttama leukopenia/neutropenia, tulee neuvoa, että heidän CBC:tä tulee seurata SEROQUEL-hoidon aikana. Potilaita tulee neuvoa keskustelemaan lääkärin kanssa mahdollisimman pian, jos heillä on kuumetta, flunssan kaltaisia oireita, kurkkukipua tai mikä tahansa muu infektio, koska tämä voi johtua erittäin alhaisesta valkosoluarvosta, mikä saattaa vaatia SEROQUEL 100 mg:n lopetettu ja/tai annettava hoito [ks VAROITUKSET JA VAROTOIMET ].
Häiriö kognitiiviseen ja motoriseen suorituskykyyn
Potilaita tulee kertoa uneliaisuuden tai sedaation (joka voi johtaa kaatumiseen) vaarasta, erityisesti aloitusannoksen titrauksen aikana. Potilaita tulee varoittaa kaikista henkistä valppautta vaativien toimien suorittamisesta, kuten moottoriajoneuvon (mukaan lukien autot) tai koneiden käyttämisestä, kunnes he ovat kohtuullisen varmoja, että ketiapiinihoito ei vaikuta heihin haitallisesti [ks. VAROITUKSET JA VAROTOIMET ].
Lämmölle altistuminen ja kuivuminen
Potilaita tulee neuvoa asianmukaisesta hoidosta ylikuumenemisen ja kuivumisen välttämiseksi [katso VAROITUKSET JA VAROTOIMET ].
Samanaikainen lääkitys
Kuten muitakin lääkkeitä käytettäessä, potilaita tulee neuvoa ilmoittamaan lääkärilleen, jos he käyttävät tai aikovat ottaa resepti- tai käsikauppalääkkeitä [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Raskaus
Neuvo raskaana olevia naisia ilmoittamaan terveydenhuollon tarjoajalleen, jos he tulevat raskaaksi tai aikovat tulla raskaaksi SEROQUEL-hoidon aikana. Kerro potilaille, että SEROQUEL voi aiheuttaa ekstrapyramidaalisia ja/tai vieroitusoireita (levottomuus, hypertonia, hypotonia, vapina, uneliaisuus, hengitysvaikeudet ja syömishäiriöt) vastasyntyneellä. Kerro potilaille, että on olemassa raskausrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet SEROQUEL 25 mg:lle raskauden aikana [ks. Käyttö tietyissä populaatioissa ].
Hedelmättömyys
Kertokaa lisääntymiskykyisille naisille, että SEROQUEL saattaa heikentää hedelmällisyyttä seerumin prolaktiinipitoisuuden nousun vuoksi. Vaikutukset hedelmällisyyteen ovat palautuvia [katso Käyttö tietyissä populaatioissa ].
Tarvitsee kattavan hoitoohjelman
SEROQUEL on tarkoitettu osaksi skitsofreniaa ja lasten kaksisuuntaista mielialahäiriötä sairastavien nuorten kokonaishoito-ohjelmaa, joka voi sisältää muita toimenpiteitä (psykologisia, kasvatuksellisia ja sosiaalisia). SEROQUEL 100 mg:n tehoa ja turvallisuutta ei ole osoitettu alle 13-vuotiailla lapsipotilailla skitsofrenian tai alle 10-vuotiailla kaksisuuntaisen mielialahäiriön manian vuoksi. Sopiva koulutuspaikka on välttämätön, ja psykososiaalinen interventio on usein hyödyllistä. Päätös määrätä epätyypillistä antipsykoottista lääkitystä riippuu lääkärin arviosta potilaan oireiden kroonisuudesta ja vakavuudesta [ks. INDIKAATIOT ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Karsinogeenisuustutkimukset suoritettiin C57BL-hiirillä ja Wistar-rotilla. Ketiapiinia annettiin ruokavalion yhteydessä hiirille annoksina 20, 75, 250 ja 750 mg/kg ja rotille annoksina 25, 75 ja 250 mg/kg kahden vuoden ajan. Nämä annokset vastaavat 0,1, 0,5, 1,5 ja 4,5 kertaa MRHD 800 mg/vrk laskettuna mg/m2 kehon pinta-alasta (hiiret) tai 0,3, 1 ja 3 kertaa MRHD perustuen mg/m2 kehon pinta-alaa (rotat). Kilpirauhasen follikulaariset adenoomat lisääntyivät tilastollisesti merkitsevästi uroshiirillä annoksilla, jotka olivat 1,5- ja 4,5-kertaisia MRHD-annokseen verrattuna mg/m2 kehon pinta-alaa kohden, ja urosrotilla annoksella, joka oli 3 kertaa MRHD (mg/m2 kehon pinta-alaa kohti). Maitorauhasten adenokarsinoomat lisääntyivät tilastollisesti merkitsevästi naarasrotilla kaikilla testatuilla annoksilla (0,3, 1 ja 3 kertaa MRHD perustuen mg/m2 kehon pinta-alaan).
Kilpirauhasen follikulaaristen solujen adenoomat ovat saattaneet johtua kilpirauhasen kroonisesta stimulaatiosta kilpirauhasta stimuloivan hormonin (TSH) vaikutuksesta, mikä johtuu jyrsijän maksan lisääntyneestä aineenvaihdunnasta ja tyroksiinin puhdistumasta. Tämän mekanismin mukaisia muutoksia TSH:ssa, tyroksiinissa ja tyroksiinissa havaittiin subkroonista toksisuutta koskevissa tutkimuksissa rotilla ja hiirillä ja yhden vuoden toksisuustutkimuksessa rotilla; näiden tutkimusten tulokset eivät kuitenkaan olleet lopullisia. Kilpirauhasen follikulaaristen solujen adenoomien lisääntymisen merkitystä ihmisen riskille millä tahansa mekanismilla ei tunneta.
Psykoosilääkkeiden on osoitettu nostavan kroonisesti prolaktiinipitoisuutta jyrsijöillä. Seerumimittaukset vuoden kestäneessä toksisuustutkimuksessa osoittivat, että ketiapiini nosti seerumin prolaktiinipitoisuuden mediaaniarvoa enintään 32-kertaiseksi ja naarasrotilla 13-kertaiseksi. Jyrsijöillä on havaittu lisääntynyttä rintarauhasen kasvaimia muiden psykoosilääkkeiden pitkäaikaisen annon jälkeen, ja niiden katsotaan olevan prolaktiinivälitteisiä. Tämän rottien prolaktiinivälitteisten maitorauhaskasvainten lisääntyneen esiintyvyyden merkitystä ihmisen riskiin ei tunneta [ks. VAROITUKSET JA VAROTOIMET ].
Mutageneesi
Ketiapiini ei ollut mutageeninen tai klastogeeninen tavanomaisissa genotoksisuustesteissä. Ketiapiinin mutageeninen potentiaali testattiin in vitro Ames-bakteerin geenimutaatiotestissä ja in vitro nisäkäsgeenimutaatiomäärityksessä kiinanhamsterin munasarjasoluissa. Ketiapiinin klastogeeninen potentiaali testattiin in vitro kromosomipoikkeavuusmäärityksessä viljellyillä ihmisen lymfosyyteillä ja in vivo luuytimen mikrotumamäärityksellä rotilla annokseen 500 mg/kg, mikä on 6 kertaa ihmiselle suositeltu enimmäisannos mg/m2:n perusteella. kehon pinta-ala.
Hedelmällisyyden heikkeneminen
Ketiapiini vähensi parittelua ja hedelmällisyyttä Sprague-Dawley-urosrotilla suun kautta otetuilla annoksilla 50 ja 150 mg/kg tai noin 1 ja 3 kertaa MRHD 800 mg/vrk perustuen mg/m2 kehon pinta-alaan. Lääkkeisiin liittyviin vaikutuksiin sisältyi paritteluvälin ja onnistuneen kyllästyksen edellyttämien parittelukertojen lisääntyminen. Näitä vaikutuksia havaittiin edelleen 3-kertaisella MRHD:llä jopa kahden viikon hoitottoman jakson jälkeen. Ei-vaikuttava annos pariutumisen ja hedelmällisyyden heikkenemiseen urosrotilla oli 25 mg/kg tai 0,3 kertaa MRHD-annos, joka perustuu mg/m2 kehon pinta-alaan. Ketiapiini vaikutti haitallisesti paritteluun ja hedelmällisyyteen naaraspuolisilla Sprague-Dawley-rotilla suun kautta annetulla annoksella, joka oli noin 1 kertaa MRHD 800 mg/vrk laskettuna mg/m2 kehon pinta-alasta. Lääkkeisiin liittyviä vaikutuksia olivat parittelujen väheneminen ja raskauteen johtaneiden parittelujen väheneminen sekä paritteluvälin pidentyminen. Epäsäännöllisten kiimasyklien lisääntymistä havaittiin annoksilla 10 ja 50 mg/kg tai noin 0,1 ja 1 kertaa MRHD 800 mg/vrk laskettuna mg/m2 kehon pinta-alasta. Vaikutukseton annos naarasrotilla oli 1 mg/kg eli 0,01 kertaa MRHD 800 mg/vrk laskettuna mg/m2 kehon pinta-alasta.
Käyttö tietyissä populaatioissa
Raskaus
Raskausaltistusrekisteri
On olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet epätyypillisille psykoosilääkkeille, mukaan lukien SEROQUEL 50 mg, raskauden aikana. Terveydenhuollon tarjoajia kehotetaan rekisteröimään potilaita ottamalla yhteyttä kansalliseen epätyypillisten antipsykoottien raskausrekisteriin numeroon 1-866-961-2388 tai verkossa osoitteessa http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
Riskien yhteenveto
Vastasyntyneillä, jotka ovat altistuneet psykoosilääkkeille (mukaan lukien SEROQUEL) kolmannen raskauskolmanneksen aikana, on riski saada ekstrapyramidaalisia ja/tai vieroitusoireita synnytyksen jälkeen (ks. Kliiniset näkökohdat ). Kaiken kaikkiaan saatavilla olevat tiedot ketiapiinille altistuneista raskaana olevista naisista julkaistuista epidemiologisista tutkimuksista eivät ole osoittaneet lääkkeisiin liittyvää riskiä vakaville synnynnäisille epämuodostumille, keskenmenolle tai haitallisille äidille tai sikiölle (ks. Data ). Äidille liittyy riskejä, jotka liittyvät hoitamattomaan skitsofreniaan, I-tyypin kaksisuuntaiseen mielialahäiriöön tai vakavaan masennustilaan ja raskauden aikana altistumiseen psykoosilääkkeille, mukaan lukien SEROQUEL 200 mg (ks. Kliiniset näkökohdat ).
Eläintutkimuksissa havaittiin alkio-sikiötoksisuutta, mukaan lukien luuston luutumisen viivästyminen noin 1-2 kertaa ihmiselle suositeltuun enimmäisannoksiin (MRHD) verrattuna 800 mg/vrk sekä rotilla että kaneilla, sekä ranne-/tarsaalisen taivutuksen lisääntyminen (vähäinen). pehmytkudosten poikkeavuus) kaniinin sikiöillä noin 2-kertaisella MRHD:llä. Lisäksi molemmilla lajeilla sikiön painot laskivat. Emotoksisuutta (havaittiin alentuneena ruumiinpainona ja/tai kuolemana) esiintyi rotilla 2-kertaisella MRHD:llä ja kaniinilla noin 1-2 kertaa MRHD:llä.
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski mainituilla väestöryhmillä ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Kliiniset näkökohdat
Äidin ja/tai sikiön sairauteen liittyvä riski
Äidille on olemassa riski hoitamattoman skitsofrenian tai kaksisuuntaisen mielialahäiriön I takia, mukaan lukien lisääntynyt uusiutumisen, sairaalahoidon ja itsemurhan riski. Skitsofrenia ja kaksisuuntainen mielialahäiriö I liittyvät lisääntyneisiin perinataalisiin haittavaikutuksiin, mukaan lukien ennenaikainen synnytys. Ei tiedetä, onko tämä suora seuraus sairaudesta tai muista samanaikaisista tekijöistä.
Prospektiivisessa pitkittäistutkimuksessa seurattiin 201 raskaana olevaa naista, joilla oli aiemmin ollut vakava masennushäiriö ja jotka olivat eutymia ja käyttivät masennuslääkkeitä raskauden alussa. Naiset, jotka lopettivat masennuslääkkeiden käytön raskauden aikana, saivat todennäköisemmin vakavan masennuksen uusiutumisen kuin naiset, jotka jatkoivat masennuslääkkeiden käyttöä. Ota huomioon hoitamattoman masennuksen riski, kun lopetat tai vaihdat masennuslääkehoitoa raskauden ja synnytyksen aikana.
Sikiön/vastasyntyneen haittavaikutukset
Ekstrapyramidaalisia ja/tai vieroitusoireita, kuten kiihtyneisyyttä, hypertoniaa, hypotoniaa, vapinaa, uneliaisuutta, hengitysvaikeutta ja ruokintahäiriötä, on raportoitu vastasyntyneillä, jotka ovat altistuneet psykoosilääkkeille, mukaan lukien SEROQUEL 50 mg, raskauden kolmannen kolmanneksen aikana. Nämä oireet vaihtelivat vakavuudeltaan. Tarkkaile vastasyntyneitä ekstrapyramidaalisten ja/tai vieroitusoireiden varalta ja hallitse oireita asianmukaisesti. Jotkut vastasyntyneet toipuivat tunneissa tai päivissä ilman erityistä hoitoa; toiset vaativat pitkäaikaista sairaalahoitoa.
Data
Ihmistiedot
Havaintotutkimuksista, syntymärekistereistä ja tapausraporteista saadut tiedot epätyypillisten psykoosilääkkeiden käytöstä raskauden aikana eivät kerro selkeää yhteyttä psykoosilääkkeisiin ja merkittäviin synnynnäisiin epämuodostumisiin. Medicaid-tietokannasta tehty retrospektiivinen kohorttitutkimus 9 258 naisesta, jotka olivat altistuneet psykoosilääkkeille raskauden aikana, eivät osoittaneet yleistä lisääntynyttä vakavien synnynnäisten epämuodostumien riskiä.
Eläinten tiedot
Kun raskaana olevat rotat ja kanit altistettiin ketiapiinille organogeneesin aikana, sikiöissä ei ollut teratogeenistä vaikutusta. Annokset olivat 25, 50 ja 200 mg/kg rotilla ja 25, 50 ja 100 mg/kg kaneilla, jotka ovat noin 0,3, 0,6 ja 2 kertaa (rotilla) ja 0,6, 1 ja 2 kertaa (kanit) MRHD:n kanssa skitsofrenia 800 mg/vrk perustuen mg/m2 kehon pinta-alaa. Sekä rotilla että kaniineilla oli kuitenkin näyttöä alkio-sikiötoksisuudesta, mukaan lukien luuston luutumisen viivästyminen noin 1-2 kertaa MRHD-annoksella 800 mg/vrk sekä ranne-/tarsaalisen taivutuksen (pieni pehmytkudospoikkeama) lisääntyminen kanin sikiöt noin 2 kertaa MRHD. Lisäksi molemmilla lajeilla sikiön painot laskivat. Emotoksisuutta (havaittiin alentuneena ruumiinpainona ja/tai kuolemana) esiintyi rotilla 2-kertaisella MRHD:llä ja kaniinilla noin 1-2-kertaisella MRHD:llä (kaikki annokset testattu).
Peri/postnataalisessa lisääntymistutkimuksessa rotilla ei havaittu lääkkeisiin liittyviä vaikutuksia, kun tiineitä emoja hoidettiin ketiapiinilla annoksilla 0,01, 0,1 ja 0,2 kertaa MRHD 800 mg/vrk perustuen mg/m2 kehon pinta-alaan. Kuitenkin alustavassa peri/postnataalisessa tutkimuksessa sikiön ja pentujen kuolleisuus lisääntyi ja keskimääräinen poikuepaino laski 3 kertaa MRHD:ään verrattuna.
Imetys
Riskien yhteenveto
Rajoitetut tiedot julkaistusta kirjallisuudesta raportoivat ketiapiinin esiintyvän ihmisen rintamaidossa, kun suhteellinen vauvan annos on
Naaraat ja urokset, joilla on lisääntymispotentiaali
Hedelmättömyys
Naaraat
Ketiapiinin farmakologisen vaikutuksen (D2-antagonismi) perusteella SEROQUEL-hoito voi johtaa seerumin prolaktiinipitoisuuden nousuun, mikä voi johtaa palautuvaan hedelmällisyyden heikkenemiseen lisääntymiskykyisillä naisilla [ks. VAROITUKSET JA VAROTOIMET ].
Käyttö lapsille
Lapsilla ja nuorilla kliinisissä tutkimuksissa havaitut haittavaikutukset olivat yleisesti ottaen samanlaisia kuin aikuisväestössä muutamaa poikkeusta lukuun ottamatta. Systolisen ja diastolisen verenpaineen nousua esiintyi lapsilla ja nuorilla, eikä niitä esiintynyt aikuisilla. Ortostaattista hypotensiota esiintyi useammin aikuisilla (4-7 %) kuin lapsilla ja nuorilla ( VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSET ].
Skitsofrenia
SEROQUEL 50 mg:n teho ja turvallisuus skitsofrenian hoidossa 13–17-vuotiailla nuorilla osoitettiin yhdessä 6 viikon kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa [ks. INDIKAATIOT , ANNOSTELU JA HALLINNOINTI , HAITTAVAIKUTUKSET , ja Kliiniset tutkimukset ].
SEROQUEL 300 mg:n turvallisuutta ja tehoa skitsofreniaa sairastavilla alle 13-vuotiailla lapsipotilailla ei ole varmistettu.
Huolto
SEROQUELin turvallisuutta ja tehokkuutta kaksisuuntaisen mielialahäiriön ylläpitohoidossa ei ole osoitettu alle 18-vuotiailla lapsipotilailla. SEROQUELin turvallisuutta ja tehokkuutta skitsofrenian ylläpitohoidossa ei ole osoitettu missään potilasryhmässä, mukaan lukien lapsipotilaat.
Kaksisuuntainen mania
SEROQUELin teho ja turvallisuus manian hoidossa 10–17-vuotiailla lapsilla ja nuorilla, joilla on kaksisuuntainen mielialahäiriö I, osoitettiin 3 viikon kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa [ks. INDIKAATIOT , ANNOSTELU JA HALLINNOINTI , HAITTAVAIKUTUKSET , ja Kliiniset tutkimukset ]. SEROQUELin turvallisuutta ja tehokkuutta alle 10-vuotiailla lapsipotilailla, joilla on kaksisuuntainen mielialamania, ei ole osoitettu.
Kaksisuuntainen mielialahäiriö
SEROQUEL 300 mg:n turvallisuutta ja tehoa alle 18-vuotiailla lapsipotilailla, joilla on kaksisuuntainen mielialahäiriö, ei ole osoitettu. Kliininen tutkimus SEROQUEL XR:llä suoritettiin lapsilla ja nuorilla (10-17-vuotiailla), joilla on kaksisuuntainen mielialahäiriö, mutta tehoa ei ole varmistettu.
Ketiapiinin farmakokinetiikassa havaittiin joitakin eroja lasten/nuorten (10-17-vuotiaiden) ja aikuisten välillä. Painon mukaan tarkistettuna ketiapiinin AUC ja Cmax olivat 41 % ja 39 % pienemmät lapsilla ja nuorilla aikuisiin verrattuna. Aktiivisen metaboliitin, norketiapiinin, farmakokinetiikka oli samanlainen lasten/nuorten ja aikuisten välillä painon mukauttamisen jälkeen [ks. KLIININEN FARMAKOLOGIA ].
Geriatrinen käyttö
Noin 3700 potilaasta, jotka osallistuivat kliinisissä tutkimuksissa SEROQUEL 300 mg:lla, 7 % (232) oli 65-vuotiaita tai vanhempia. Yleisesti ottaen ei ollut viitteitä SEROQUELin erilaisesta siedettävyydestä iäkkäillä ja nuoremmilla aikuisilla. Kuitenkin sellaisten tekijöiden olemassaolo, jotka voivat vähentää farmakokineettistä puhdistumaa, lisätä farmakodynaamista vastetta SEROQUEL 200 mg:lle tai aiheuttaa heikomman sietokyvyn tai ortostaasin, pitäisi johtaa pienemmän aloitusannoksen harkitsemiseen, hitaampaan titraukseen ja huolelliseen seurantaan aloitusannostusjakson aikana. vanhuksia. SEROQUEL 25 mg:n keskimääräinen plasmapuhdistuma pieneni 30–50 % iäkkäillä potilailla verrattuna nuorempiin potilaisiin [ks. KLIININEN FARMAKOLOGIA ja ANNOSTELU JA HALLINNOINTI ].
Munuaisten vajaatoiminta
Kliininen kokemus SEROQUEListä munuaisten vajaatoimintaa sairastavilla potilailla on rajallinen [katso KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
Koska ketiapiini metaboloituu laajalti maksassa, maksan vajaatoimintaa sairastavilla potilailla odotetaan korkeampia plasmapitoisuuksia. Tässä populaatiossa suositellaan pientä aloitusannosta 25 mg/vrk, ja annosta voidaan suurentaa 25 mg/vrk - 50 mg/vrk lisäyksin [ks. ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Inhimillinen kokemus
Kliinisissä tutkimuksissa on raportoitu eloonjäämistä jopa 30 gramman ketiapiinin yliannostuksissa. Suurin osa yliannostuksen saaneista potilaista ei kokenut haittavaikutuksia tai toipui täysin raportoiduista tapahtumista. Kliinisessä tutkimuksessa on raportoitu kuolemantapausta pelkästään ketiapiinin 13,6 gramman yliannoksen jälkeen. Yleensä raportoidut merkit ja oireet olivat merkkejä ja oireita, jotka johtuivat lääkkeen tunnettujen farmakologisten vaikutusten liioittamisesta, eli uneliaisuudesta, sedaatiosta, takykardiasta, hypotensiosta ja antikolinergisesta toksisuudesta, mukaan lukien kooma ja delirium. Potilailla, joilla on ennestään vakava sydän- ja verisuonisairaus, voi olla lisääntynyt yliannostuksen vaikutusten riski [ks. VAROITUKSET JA VAROTOIMET ]. Yksi tapaus, joka koski arviolta 9 600 mg:n yliannostusta, liittyi hypokalemiaan ja ensimmäisen asteen sydäntukkoon. Markkinoille tulon jälkeen on raportoitu QT-ajan pidentymistä yliannostuksen yhteydessä.
Yliannostuksen hallinta
Luo ja ylläpitä hengitystiet sekä varmista riittävä hapetus ja ilmanvaihto. Sydämen ja verisuonten seuranta on aloitettava välittömästi, ja siihen tulee sisältyä jatkuva elektrokardiografinen seuranta mahdollisten rytmihäiriöiden havaitsemiseksi.
Asianmukaiset tukitoimenpiteet ovat hallinnon peruspilari. Saat viimeisimmät tiedot Seroquel XR -yliannostuksen hoidosta ottamalla yhteyttä sertifioituun alueelliseen myrkytystietokeskukseen (1-800-222-1222).
VASTA-AIHEET
Yliherkkyys ketiapiinille tai jollekin SEROQUEL XR -valmisteen apuaineelle. Anafylaktisia reaktioita on raportoitu potilailla, joita on hoidettu SEROQUEL XR:llä.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Ketiapiinin vaikutusmekanismi luetelluissa käyttöaiheissa on epäselvä. Ketiapiinin tehokkuus näissä käyttöaiheissa saattaa kuitenkin johtua dopamiinityypin 2 (D2) ja serotoniinityypin 2 (5HT2) antagonismin yhdistelmästä. Aktiivisella metaboliitilla, N-desalkyyliketiapiinilla (norketiapiinilla), on samanlainen aktiivisuus D2:ssa, mutta suurempi aktiivisuus 5HT2A-reseptoreissa kuin emolääkkeellä (ketiapiinilla).
Farmakodynamiikka
Ketiapiinilla ja sen metaboliitilla, norketiapiinilla, on affiniteettia useisiin välittäjäainereseptoreihin, ja norketiapiini sitoutuu suuremmalla affiniteetilla kuin ketiapiini yleensä. Ketiapiinin ja norketiapiinin Ki-arvot dopamiinilla D1 ovat 428/99,8 nM, D2:lla 626/489 nM, serotoniinilla 5HT1A 1040/191 nM 5HT2A:lla 38/2,9 nM, histamiinilla H1, 6, 1,0 M1, 1,0 M1. 38,3 nM ja adrenergisellä a1b:llä 14,6/46,4 nM ja a2-reseptorilla 617/1290 nM, vastaavasti. Ketiapiinilla ja norketiapiinilla ei ole huomattavaa affiniteettia bentsodiatsepiinireseptoreihin.
Vaikutus QT-väliin
Kliinisissä tutkimuksissa ketiapiiniin ei liittynyt jatkuvaa QT-ajan pidentymistä. QT-vaikutusta ei kuitenkaan arvioitu systemaattisesti perusteellisessa QT-tutkimuksessa. Markkinoille tulon jälkeen on raportoitu QT-ajan pidentymistä potilailla, jotka ottivat yliannostuksen ketiapiinia [ks. YLIANNOSTUS ], potilailla, joilla on samanaikainen sairaus, ja potilailla, jotka käyttävät lääkkeitä, joiden tiedetään aiheuttavan elektrolyyttitasapainoa tai pidentävän QT-aikaa.
Farmakokinetiikka
Aikuiset
Ketiapiinifumaraatin aktiivisuus johtuu ensisijaisesti emolääkkeestä. Ketiapiinin usean annoksen farmakokinetiikka on suhteessa annokseen ehdotetulla kliinisellä annosalueella, ja ketiapiinin kumuloituminen on ennakoitavissa toistuvan annostelun yhteydessä. Ketiapiini eliminoituu pääasiassa maksassa tapahtuvan metabolian kautta, ja sen keskimääräinen terminaalinen puoliintumisaika on noin 6 tuntia ehdotetulla kliinisellä annosalueella. Vakaan tilan pitoisuudet odotetaan saavutettavan kahden vuorokauden kuluessa annostelusta. Ketiapiini ei todennäköisesti häiritse sytokromi P450 -entsyymien metaboloimien lääkkeiden metaboliaa.
Lapset Ja Nuoret
Vakaassa tilassa lähtöaineen farmakokinetiikka lapsilla ja nuorilla (10-17-vuotiailla) oli samanlainen kuin aikuisilla. Kuitenkin annoksen ja painon mukaan säädettynä lähtöaineen AUC ja Cmax olivat 41 % ja 39 % pienemmät lapsilla ja nuorilla kuin aikuisilla. Aktiivisen metaboliitin, norketiapiinin, AUC ja Cmax olivat 45 % korkeammat lapsilla ja 31 % suuremmilla nuorilla kuin aikuisilla. Annoksen ja painon mukaan sovitettuna metaboliitin, norketiapiinin, farmakokinetiikka oli samanlainen lasten ja nuorten ja aikuisten välillä [ks. Käyttö tietyissä populaatioissa ].
Imeytyminen
Ketiapiinifumaraatti imeytyy nopeasti oraalisen annon jälkeen ja saavuttaa huippupitoisuudet plasmassa 1,5 tunnissa. Tablettiformulaation biologinen hyötyosuus on 100 % liuokseen verrattuna. Ketiapiinin biologiseen hyötyosuuteen vaikuttaa marginaalisesti anto ruoan kanssa, ja Cmax-arvo nousi 25 % ja AUC 15 %.
Jakelu
Ketiapiini jakautuu laajalti koko kehoon ja näennäinen jakautumistilavuus on 10±4 l/kg. Se sitoutuu 83 % plasman proteiineihin terapeuttisilla pitoisuuksilla. Ketiapiini ei vaikuttanut in vitro varfariinin tai diatsepaamin sitoutumiseen ihmisen seerumin albumiiniin. Varfariini ja diatsepaami eivät puolestaan muuttaneet ketiapiinin sitoutumista.
Aineenvaihdunta ja eliminaatio
Suun kautta annetun 14C-ketiapiinin kerta-annoksen jälkeen alle 1 % annetusta annoksesta erittyi muuttumattomana lääkkeenä, mikä osoittaa, että ketiapiini metaboloituu voimakkaasti. Noin 73 % annoksesta erittyi virtsaan ja 20 % ulosteeseen.
Ketiapiini metaboloituu laajalti maksassa. Tärkeimmät aineenvaihduntareitit ovat sulfoksidoituminen sulfoksidimetaboliitiksi ja hapettuminen emohappometaboliitiksi; molemmat metaboliitit ovat farmakologisesti inaktiivisia. Ihmisen maksan mikrosomeilla tehdyt in vitro -tutkimukset osoittivat, että sytokromi P450 3A4 -isoentsyymi osallistuu ketiapiinin metaboliaan sen pääasialliseksi, mutta inaktiiviseksi sulfoksidimetaboliitiksi ja sen aktiivisen metaboliitin, N-desalkyyliketiapiinin, metaboliaan.
Ikä
Ketiapiinin oraalinen puhdistuma pieneni 40 % iäkkäillä potilailla (≥ 65 vuotta, n=9) verrattuna nuoriin potilaisiin (n=12), ja annostuksen muuttaminen saattaa olla tarpeen [ks. ANNOSTELU JA HALLINNOINTI ].
Sukupuoli
Sukupuoli ei vaikuta ketiapiinin farmakokinetiikkaan.
Rotu
Ketiapiinilla ei ole rotuvaikutusta farmakokinetiikkaan.
Tupakointi
Tupakointi ei vaikuta ketiapiinin oraaliseen puhdistumaan.
Munuaisten vajaatoiminta
Potilailla, joilla oli vaikea munuaisten vajaatoiminta (Clcr = 10-30 ml/min/1,73 m2, n = 8), keskimääräinen oraalinen puhdistuma oli 25 % pienempi kuin normaaleilla koehenkilöillä (Clcr > 80 ml/min/1,73 m2, n = 8), mutta plasman ketiapiinipitoisuudet munuaisten vajaatoimintaa sairastavilla koehenkilöillä olivat samaa annosta saavien normaaleiden koehenkilöiden pitoisuuksien vaihteluvälin sisällä. Annoksen muuttaminen ei siksi ole tarpeen näillä potilailla [katso Käyttö tietyissä populaatioissa ].
Maksan vajaatoiminta
Maksan vajaatoimintapotilailla (n=8) ketiapiinin keskimääräinen oraalinen puhdistuma oli 30 % pienempi kuin normaaleilla koehenkilöillä. Kahdella kahdeksasta maksan vajaatoimintapotilaasta AUC ja Cmax olivat 3 kertaa suuremmat kuin tyypillisesti terveillä koehenkilöillä. Koska ketiapiini metaboloituu laajalti maksassa, maksan vajaatoimintapotilailla odotetaan korkeampia plasmapitoisuuksia, ja annoksen muuttaminen saattaa olla tarpeen [ks. ANNOSTELU JA HALLINNOINTI ja KÄYTTÖ TIETTYISSÄ POULUTIOISSA ].
Huumeiden väliset vuorovaikutustutkimukset
In vivo -arvioinnit muiden lääkkeiden vaikutuksesta ketiapiinin farmakokinetiikkaan on koottu taulukkoon 17 [ks. ANNOSTELU JA HALLINNOINTI ja HUUMEIDEN VUOROVAIKUTUKSET ].
In vitro -entsyymi-inhibitiotiedot viittaavat siihen, että ketiapiinilla ja sen yhdeksällä metaboliitilla olisi vain vähän estävää vaikutusta in vivo -metaboliaan, jota välittävät sytokromit CYP 1A2, 2C9, 2C19, 2D6 ja 3A4. Ketiapiini annoksilla 750 mg/vrk ei vaikuttanut antipyriinin, litiumin tai loratsepaamin kerta-annoksen farmakokinetiikkaan (taulukko 18) [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Eläinten toksikologia ja/tai farmakologia
Ketiapiini lisäsi annoksesta riippuvaa pigmentin kertymistä kilpirauhasessa rotille tehdyissä toksisuustutkimuksissa, jotka olivat kestoltaan 4 viikkoa tai pidempiä, ja hiirillä tehdyssä 2 vuoden karsinogeenisuustutkimuksessa. Rottatutkimuksissa annokset olivat 10, 25, 50, 75, 150 ja 250 mg/kg, jotka ovat noin 0,1, 0,3, 0,6, 1, 2 ja 3 kertaa MRHD 800 mg/vrk perustuen mg/m2 kehon pinta-alaa , vastaavasti. Hiirillä tehdyssä karsinogeenisuustutkimuksessa annokset olivat 20, 75, 250 ja 750 mg/kg, jotka ovat noin 0,1, 0,5, 1,5 ja 4,5 kertaa MRHD 800 mg/vrk perustuen mg/m2 kehon pinta-alaan. Pigmentin kerrostumisen osoitettiin olevan peruuttamaton rotilla. Pigmentin identiteettiä ei voitu määrittää, mutta sen havaittiin lokalisoituneen ketiapiinin kanssa kilpirauhasen follikulaarisissa epiteelisoluissa. Tämän löydön toiminnallisia vaikutuksia ja merkitystä ihmisen riskin kannalta ei tunneta.
Koirilla, jotka saivat ketiapiinia 6 tai 12 kuukauden ajan, mutta ei 1 kuukauden ajan, esiintyi fokaalista kolmiokaihia linssin ulkokuoren takaompeleiden risteyksessä annoksella 100 mg/kg tai 4 kertaa MRHD 800 mg/vrk perustuen mg/m2 kehon pinta-alaan. Tämä löydös voi johtua ketiapiinin aiheuttamasta kolesterolin biosynteesin estämisestä. Ketiapiini aiheutti annoksesta riippuvan plasman kolesterolitason alenemisen toistuvan annoksen koirilla ja apinoilla tehdyissä tutkimuksissa; plasman kolesterolin ja yksittäisten koirien kaihien välillä ei kuitenkaan ollut korrelaatiota. Delta-8-kolestanolin esiintyminen plasmassa on yhdenmukainen kolesterolin biosynteesin myöhäisen vaiheen eston kanssa näissä lajeissa. Erityisessä tutkimuksessa ketiapiinilla hoidetuilla naaraskoirilla havaittiin myös linssin ulkokuoren kolesterolipitoisuuden lasku 25 %. Lääkkeisiin liittyviä kaihia ei ole havaittu millään muulla lajilla; kuitenkin 1 vuoden tutkimuksessa apinoilla linssin etupinnan juovainen ilme havaittiin 2/7 naaraalla annoksella 225 mg/kg tai 5,5 kertaa MRHD 800 mg/vrk perustuen mg/m2 kehon pinta-ala.
Kliiniset tutkimukset
Skitsofrenia
Lyhytaikaiset kokeet - aikuiset
SEROQUEL 50 mg:n teho skitsofrenian hoidossa vahvistettiin kolmessa lyhytaikaisessa (6 viikkoa) kontrolloidussa tutkimuksessa skitsofreniapotilailla, jotka täyttivät skitsofrenian DSM III-R -kriteerit. Vaikka kerta-annos haloperidolihaara sisällytettiin vertailuhoitona yhteen kolmesta tutkimuksesta, tämä haloperidolikerta-annosryhmä ei riittänyt tarjoamaan luotettavaa ja pätevää vertailua SEROQUEL 200 mg:n ja haloperidolin välillä.
Näissä tutkimuksissa psykiatristen merkkien ja oireiden arvioimiseen käytettiin useita instrumentteja, muun muassa Brief Psychiatric Rating Scale (BPRS), moniosainen yleisen psykopatologian luettelo, jota on perinteisesti käytetty skitsofrenian huumehoidon vaikutusten arvioimiseen. BPRS-psykoosiklusteria (käsitteellinen epäjärjestys, hallusinatorinen käyttäytyminen, epäluuloisuus ja epätavallinen ajatussisältö) pidetään erityisen hyödyllisenä osaryhmänä arvioitaessa aktiivisesti psykoottisia skitsofreniapotilaita. Toinen perinteinen arviointi, Clinical Global Impression (CGI), heijastaa ammattitaitoisen tarkkailijan, joka on täysin perehtynyt skitsofrenian ilmenemismuotoihin, vaikutelman potilaan yleisestä kliinisestä tilasta.
Kokeiden tulokset ovat seuraavat:
Näiden kolmen tutkimuksen ensisijaiset tehokkuustulokset skitsofrenian hoidossa aikuisilla on esitetty taulukossa 19.
Populaatioalaryhmien (rotu, sukupuoli ja ikä) tutkiminen ei paljastanut eroa rotuun tai sukupuoleen perustuvaa vastetta, ja vaikutus oli ilmeisesti suurempi alle 40-vuotiailla kuin yli 40-vuotiailla. tämä löytö on tuntematon.
Nuoret (13–17-vuotiaat)
SEROQUEL 300 mg:n teho skitsofrenian hoidossa nuorilla (13-17-vuotiailla) osoitettiin 6 viikkoa kestäneessä kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa (tutkimus 4). Potilaat, jotka täyttivät skitsofrenian DSM-IV:n diagnostiset kriteerit, satunnaistettiin yhteen kolmesta hoitoryhmästä: SEROQUEL 400 mg/vrk (n=73), SEROQUEL 800 mg/vrk (n=74) tai lumelääke (n=75). Tutkimuslääkitys aloitettiin annoksella 50 mg/vrk ja päivänä 2 nostettiin 100 mg:aan/vrk (jaettu ja annettu kaksi tai kolme kertaa päivässä). Sen jälkeen annos titrattiin tavoiteannokseen 400 mg/vrk tai 800 mg/vrk käyttämällä 100 mg/vrk lisäyksiä, jaettiin ja annettiin kaksi tai kolme kertaa päivässä. Ensisijainen tehokkuusmuuttuja oli positiivisen ja negatiivisen kokonaissyndroomaasteikon (PANSS) keskimääräinen muutos lähtötilanteesta.
SEROQUEL annoksilla 400 mg/vrk ja 800 mg/vrk oli parempi kuin lumelääke PANSS-kokonaispisteiden pienentämisessä. Tämän tutkimuksen ensisijaiset tehokkuustulokset nuorten skitsofrenian hoidossa on esitetty taulukossa 19.
Kaksisuuntainen mielialahäiriö
Kaksisuuntainen mielialahäiriö I, maaniset tai sekajaksot
Aikuiset
SEROQUELin teho maniajaksojen akuutissa hoidossa vahvistettiin kolmessa lumekontrolloidussa tutkimuksessa potilailla, jotka täyttivät DSM-IV:n kriteerit kaksisuuntaiselle mielialahäiriölle, jolla oli maniajaksoja. Näihin tutkimuksiin osallistui potilaita, joilla oli tai ei ollut psykoottisia oireita, ja poissuljettiin potilaat, joilla oli nopea pyöräily ja sekalaisia jaksoja. Näistä tutkimuksista 2 oli monoterapiaa (12 viikkoa) ja 1 lisähoitoa (3 viikkoa) joko litiumin tai divalproaatin kanssa. Tärkeimmät tulokset näissä tutkimuksissa olivat muutos lähtötasosta Young Mania Rating Scale (YMRS) -pistemäärässä 3 ja 12 viikon kohdalla monoterapiassa ja 3 viikon kohdalla lisähoidossa. Lisähoidoksi määritellään SEROQUEL 100 mg:n samanaikainen aloitus tai myöhempi antaminen litiumin tai divalproaatin kanssa.
Näissä tutkimuksissa maanisten oireiden arvioinnissa käytetty ensisijainen luokitusväline oli YMRS, 11 pisteen kliinikon asteikko, jota käytetään perinteisesti arvioimaan maanisten oireiden astetta (ärtyneisyys, häiritsevä/aggressiivinen käyttäytyminen, uni, kohonnut mieliala, puhe, lisääntynyt aktiivisuus, seksuaalinen kiinnostus, kieli-/ajatteluhäiriö, ajatussisältö, ulkonäkö ja oivallus) välillä 0 (ei maanisia piirteitä) - 60 (maksimipistemäärä).
Kokeiden tulokset ovat seuraavat:
Monoterapia
SEROQUELin teho kaksisuuntaisen mielialahäiriön manian akuutissa hoidossa vahvistettiin kahdessa lumekontrolloidussa tutkimuksessa. Kahdessa 12 viikkoa kestäneessä tutkimuksessa (n = 300, n = 299), joissa verrattiin SEROQUELiä lumelääkkeeseen, SEROQUEL 300 mg oli parempi kuin lumelääke YMRS:n kokonaispistemäärän pienentämisessä viikolla 3 ja 12. Suurin osa potilaista näissä tutkimuksissa sai SEROQUEL 100 mg annettiin välillä 400 mg/vrk ja 800 mg/vrk (tutkimukset 1 ja 2 taulukossa 20).
Lisäterapia
Tässä 3 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa 170 potilasta, joilla oli kaksisuuntainen mielialamania (YMRS ≥20), satunnaistettiin saamaan SEROQUEL 100 mg tai lumelääke litiumin tai divalproaatin lisähoitona. Potilaat ovat saaneet tai eivät ole saaneet riittävää litiumia tai divalproaattia ennen satunnaistamista. SEROQUEL 50 mg oli parempi kuin lumelääke, kun se lisättiin pelkkään litiumiin tai divalproaattiin YMRS-kokonaispisteiden pienentämisessä (tutkimus 3 taulukossa 20).
Suurin osa tämän tutkimuksen potilaista, jotka ottivat SEROQUEL 25 mg:aa, saivat annokset välillä 400 mg/vrk ja 800 mg/vrk. Samalla tavalla suunnitellussa tutkimuksessa (n = 200) SEROQUEL yhdistettiin YMRS-pisteiden paranemiseen, mutta se ei osoittanut parempia lumelääkettä, mikä johtui mahdollisesti suuremmasta lumelääkkeestä.
Näiden tutkimusten ensisijaiset tehokkuustulokset manian hoidossa aikuisilla on esitetty taulukossa 20.
Lapset ja nuoret (10-17-vuotiaat)
SEROQUELin teho I-kaksisuuntaiseen mielialahäiriöön liittyvien maanisten jaksojen akuutissa hoidossa lapsilla ja nuorilla (10-17-vuotiaat) osoitettiin 3 viikon kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa (tutkimus 4 Taulukko 20). Potilaat, jotka täyttivät maniajakson DSM-IV:n diagnostiset kriteerit, satunnaistettiin yhteen kolmesta hoitoryhmästä: SEROQUEL 400 mg/vrk (n=95), SEROQUEL 600 mg/vrk (n=98) tai lumelääke (n=91). . Tutkimuslääkitys aloitettiin annoksella 50 mg/vrk ja 2. päivänä annos nostettiin 100 mg:aan/vrk (jaettuna kaksi tai kolme kertaa päivässä). Myöhemmin annos titrattiin tavoiteannokseen 400 mg/vrk tai 600 mg/vrk käyttämällä 100 mg/vrk lisäyksiä jaettuna kaksi tai kolme kertaa päivässä. Ensisijainen tehokkuusmuuttuja oli YMRS-kokonaispistemäärän keskimääräinen muutos lähtötasosta.
SEROQUEL 400 mg/vrk ja 600 mg/vrk olivat parempia kuin lumelääke YMRS:n kokonaispistemäärän pienentymisessä (taulukko 20).
Kaksisuuntainen mielialahäiriö, masennusjaksot
Aikuiset
SEROQUEL 25 mg:n teho kaksisuuntaiseen mielialahäiriöön liittyvien masennusjaksojen akuutissa hoidossa vahvistettiin kahdessa identtisesti suunnitellussa 8 viikon satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa (N = 1045) (tutkimukset 5 ja 6 taulukossa 21) . Näihin tutkimuksiin osallistui potilaita, joilla oli joko I tai II kaksisuuntainen mielialahäiriö, sekä potilaita, joilla oli tai ei ollut nopea kiertokulku. Potilaille, jotka oli satunnaistettu saamaan SEROQUEL 200 mg, annettiin kiinteät annokset joko 300 mg tai 600 mg kerran päivässä.
Näissä tutkimuksissa ensisijainen masennuksen oireiden arvioinnissa käytetty arviointiväline oli Montgomery-Asberg Depression Rating Scale (MADRS), 10 kohdan kliinikon arvioima asteikko, jonka pisteet vaihtelivat välillä 0–60. Ensisijainen päätetapahtuma molemmissa tutkimuksissa oli muutos MADRS-pistemäärän lähtötaso viikolla 8. Molemmissa tutkimuksissa SEROQUEL 50 mg alensi MADRS-pisteitä paremmin kuin lumelääke. Oireiden paranemista mitattuna MADRS-pisteiden muutoksella lumelääkkeeseen verrattuna havaittiin molemmissa tutkimuksissa päivänä 8 (viikko 1) ja siitä eteenpäin. Näissä tutkimuksissa 600 mg:n annoksella ei havaittu lisähyötyä. 300 mg:n annosryhmässä havaittiin tilastollisesti merkitseviä parannuksia plaseboon verrattuna yleisessä elämänlaadussa ja tyytyväisyydessä, jotka liittyvät eri toiminta-alueisiin, mitattuna Q-LES-Q(SF):llä.
Näiden tutkimusten ensisijaiset tehokkuustulokset kaksisuuntaiseen mielialahäiriöön liittyvien masennusjaksojen akuutin hoidossa aikuisilla on esitetty taulukossa 21.
Ylläpitohoito litiumin tai divalproexin lisänä
SEROQUEL 100 mg:n teho I-tyypin kaksisuuntaisen mielialahäiriön ylläpitohoidossa vahvistettiin kahdessa lumekontrolloidussa tutkimuksessa potilailla (n=1326), jotka täyttivät I-tyypin kaksisuuntaisen mielialahäiriön DSM-IV-kriteerit (tutkimukset 7 ja 8 kuvissa 1 ja 2). Tutkimuksiin osallistui potilaita, joiden viimeisin episodi oli maaninen, masentunut tai sekamuotoinen, psykoottisten ominaisuuksien kanssa tai ilman. Avoimessa vaiheessa potilaiden edellytettiin olevan stabiileja SEROQUEL- ja litium- tai divalproex-hoitoa saaneiden potilaiden suhteen vähintään 12 viikon ajan, jotta heidät satunnaistettiin. Keskimäärin potilaat stabiloituivat 15 viikon ajan. Satunnaistamisvaiheessa potilaat jatkoivat litium- tai divalproaattihoitoa ja satunnaistettiin saamaan joko SEROQUEL-hoitoa (annostettu kahdesti vuorokaudessa yhteensä 400–800 mg/vrk) tai lumelääkettä. Noin 50 % potilaista oli lopettanut hoidon SEROQUEL-ryhmästä päivään 280 mennessä ja 50 % lumeryhmästä oli lopettanut kaksoissokkohoidon päivään 117 mennessä. Ensisijainen päätetapahtuma näissä tutkimuksissa oli aika mielialatapahtuman (maaninen, sekalainen tai masennusjakso) uusiutumiseen. Mielialatapahtuma määriteltiin lääkityksen aloittamiseksi tai sairaalahoidoksi mielialajakson vuoksi; YMRS-pisteet ≥20 tai MADRS-pisteet ≥20 kahdessa peräkkäisessä arvioinnissa; tai opintojen keskeyttäminen mielialatapahtuman vuoksi (kuva 1 ja kuva 2).
Molemmissa tutkimuksissa SEROQUEL oli lumelääkettä parempi pidentää mielialatapahtuman uusiutumiseen kuluvaa aikaa. Hoitovaikutus pidensi sekä maanisten että masentuneiden jaksojen uusiutumiseen kuluvaa aikaa. SEROQUELin vaikutus oli riippumaton tietystä alaryhmästä (määrätty mielialan stabilointiaine, sukupuoli, ikä, rotu, viimeisin kaksisuuntainen mielialakohtaus tai nopea pyöräilykurssi).
Kuva 1: Kaplan-Meier-käyrät mielialatapahtuman toistumiseen (tutkimus 7)
Kuva 2: Kaplan-Meier-käyrät mielialatapahtuman toistumiseen (tutkimus 8)
POTILASTIEDOT
SEROQUEL (SER-oh-kwell) (ketiapiinifumaraatti) Tabletit
Lue tämä lääkitysopas ennen kuin aloitat SEROQUEL-hoidon ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi.
Mikä on tärkein tieto, joka minun pitäisi tietää SEROQUEListä?
SEROQUEL 100mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Keskustele oman tai perheenjäsenesi terveydenhuollon tarjoajan kanssa seuraavista asioista:
- kaikki masennuslääkehoidon riskit ja edut.
- kaikki masennuksen tai muiden vakavien mielenterveyssairauksien hoitovaihtoehdot
- Masennuslääkkeet voivat lisätä itsemurha-ajatuksia tai -toimia joillakin lapsilla, teini-ikäisillä ja nuorilla aikuisilla hoidon ensimmäisten kuukausien aikana.
- Masennus ja muut vakavat mielisairaudet ovat tärkeimmät syyt itsemurha-ajatuksiin ja -toimiin. Joillakin ihmisillä voi olla erityisen suuri riski saada itsetuhoisia ajatuksia tai toimia. Näitä ovat ihmiset, joilla on (tai joilla on suvussa) masennusta, kaksisuuntaista mielialahäiriötä (kutsutaan myös maanis-masennussairaudeksi) tai itsetuhoisia ajatuksia tai tekoja.
- Miten voin tarkkailla ja yrittää estää itsetuhoisia ajatuksia ja tekoja itsessäni tai perheenjäsenessäni?
- Kiinnitä huomiota kaikkiin muutoksiin, erityisesti äkillisiin muutoksiin mielialassa, käyttäytymisessä, ajatuksissa tai tunteissa. Tämä on erittäin tärkeää, kun masennuslääke aloitetaan tai annosta muutetaan.
- Soita välittömästi terveydenhuollon tarjoajalle ilmoittaaksesi uusista tai äkillisistä mielialan, käyttäytymisen, ajatusten tai tunteiden muutoksista.
- Pidä kaikki seurantakäynnit terveydenhuollon tarjoajan kanssa aikataulun mukaisesti. Soita terveydenhuollon tarjoajalle käyntien välillä tarvittaessa, varsinkin jos olet huolissasi oireista.
Soita välittömästi terveydenhuollon tarjoajalle, jos sinulla tai perheenjäsenelläsi on jokin seuraavista oireista, varsinkin jos ne ovat uusia, pahempia tai huolestuttavia:
- ajatuksia itsemurhasta tai kuolemasta
- yrittää itsemurhaa
- uusi tai pahempi masennus
- uusi tai pahempi ahdistus
- hyvin kiihtynyt tai levoton olo
- paniikkikohtaukset
- unihäiriöt (unettomuus)
- uusi tai pahempi ärtyneisyys
- käyttäytyy aggressiivisesti, on vihainen tai väkivaltainen
- vaarallisten impulssien vaikutuksesta
- äärimmäinen lisääntynyt aktiivisuus ja puhuminen (mania)
- muita epätavallisia muutoksia käyttäytymisessä tai mielialassa
Mitä muuta minun on tiedettävä masennuslääkkeistä?
- Älä koskaan lopeta masennuslääkettä keskustelematta ensin terveydenhuollon tarjoajan kanssa. Masennuslääkehoidon äkillinen lopettaminen voi aiheuttaa muita oireita.
- Masennuslääkkeet ovat lääkkeitä, joita käytetään masennuksen ja muiden sairauksien hoitoon. On tärkeää keskustella kaikista masennuksen hoidon riskeistä ja myös riskeistä, jotka liittyvät sen hoitamatta jättämiseen. Potilaiden ja heidän perheidensä tai muiden hoitajien tulee keskustella terveydenhuollon tarjoajan kanssa kaikista hoitovaihtoehdoista, ei vain masennuslääkkeiden käytöstä.
- Masennuslääkkeillä on muita sivuvaikutuksia. Keskustele terveydenhuollon tarjoajan kanssa sinulle tai perheenjäsenellesi määrätyn lääkkeen sivuvaikutuksista.
- Masennuslääkkeet voivat olla vuorovaikutuksessa muiden lääkkeiden kanssa. Tiedä kaikki lääkkeet, joita sinä tai perheenjäsenesi käytät. Pidä luettelo kaikista lääkkeistä näyttääksesi terveydenhuollon tarjoajalle. Älä aloita uusia lääkkeitä keskustelematta ensin terveydenhuollon tarjoajalta.
- Kaikki lapsille määrätyt masennuslääkkeet eivät ole FDA:n hyväksymiä lapsille. Pyydä lisätietoja lapsesi terveydenhuollon tarjoajalta.
Mikä on SEROQUEL 300mg?
SEROQUEL 100mg on reseptilääke, jota käytetään:
- skitsofrenia 13-vuotiailla tai sitä vanhemmilla
- kaksisuuntainen mielialahäiriö aikuisilla, mukaan lukien:
- kaksisuuntaiseen mielialahäiriöön liittyvät masennusjaksot
- maaniset jaksot, jotka liittyvät yksinomaan kaksisuuntaiseen mielialahäiriöön tai litiumiin tai divalproaatiin
- I-tyypin kaksisuuntaisen mielialahäiriön pitkäaikainen hoito litiumilla tai valproaatilla
- kaksisuuntaiseen mielialahäiriöön I liittyvät maaniset jaksot 10–17-vuotiailla lapsilla
Ei tiedetä, onko SEROQUEL 100mg turvallinen ja tehokas alle 10-vuotiaille lapsille.
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen SEROQUEL 100 mg:n ottamista?
Ennen kuin otat SEROQUEL 200 mg -valmistetta, kerro terveydenhuollon tarjoajallesi, jos sinulla on tai on ollut:
- diabetes tai korkea verensokeri sinulla tai perheelläsi. Terveydenhuollon tarjoajan tulee tarkistaa verensokerisi ennen SEROQUEL 300 mg -hoidon aloittamista ja myös hoidon aikana
- korkea kokonaiskolesteroli, triglyseridi tai LDL-kolesteroli tai alhainen HDL-kolesterolitaso
- matala tai korkea verenpaine
- alhainen valkosolujen määrä
- kaihi
- kohtauksia
- epänormaalit kilpirauhastutkimukset
- korkeat prolaktiinitasot
- sydänongelmat
- maksaongelmia
- mikä tahansa muu sairaus
- raskaus tai suunnittelet raskautta. Ei tiedetä, vahingoittaako SEROQUEL 100 mg sikiötäsi.
- Jos tulet raskaaksi SEROQUEL-hoidon aikana, keskustele terveydenhuollon tarjoajasi kanssa rekisteröitymisestä National Pregnancy Registry for Atypes Antipsychotics. Voit rekisteröityä soittamalla numeroon 1-866-961-2388 tai menemällä osoitteeseen http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- imetät tai aiot imettää. SEROQUEL voi erittyä äidinmaitoon. Keskustele terveydenhuollon tarjoajan kanssa parhaasta tavasta ruokkia vauvasi, jos saat SEROQUEL-valmistetta.
- jos sinulla on tai on ollut tila, jossa et pysty tyhjentämään rakkoasi kokonaan (virtsanpidätys), sinulla on eturauhasen suureneminen tai ummetus tai kohonnut paine silmäsi sisällä.
Kerro terveydenhuollon tarjoajalle kaikista lääkkeistä, joita käytät tai olet äskettäin käyttänyt mukaan lukien reseptilääkkeet, käsikauppalääkkeet, yrttilisät ja vitamiinit.
SEROQUEL 300mg ja muut lääkkeet voivat vaikuttaa toisiinsa aiheuttaen vakavia sivuvaikutuksia. SEROQUEL 200mg voi vaikuttaa muiden lääkkeiden tehoon, ja muut lääkkeet voivat vaikuttaa SEROQUEL 200mg:n tehoon.
Kerro terveydenhuollon tarjoajallesi, jos sinulla on virtsan lääkeseulonta, koska SEROQUEL voi vaikuttaa testituloksiisi. Kerro testin tekijöille, että käytät SEROQUEL-valmistetta.
Miten minun pitäisi ottaa SEROQUEL?
- Ota SEROQUEL juuri sen verran kuin terveydenhuollon tarjoajasi on neuvonut sinua ottamaan sen. Älä muuta annosta itse.
- Ota SEROQUEL 25 mg suun kautta ruoan kanssa tai ilman.
- Jos sinusta tuntuu, että sinun on lopetettava SEROQUEL 25 mg:n käyttö, keskustele ensin terveydenhuollon tarjoajan kanssa. Jos lopetat äkillisesti SEROQUELin käytön, sinulla voi olla sivuvaikutuksia, kuten unihäiriöitä tai univaikeuksia (unettomuus), pahoinvointia ja oksentelua.
- Jos unohdat ottaa SEROQUEL 25 mg -annoksen, ota se heti kun muistat. Jos olet lähellä seuraavaa annostasi, jätä unohtunut annos väliin. Ota vain seuraava annos normaaliin aikaan. Älä ota kahta annosta samanaikaisesti, ellei terveydenhuollon tarjoaja kehota sinua tekemään niin. Jos et ole varma annoksestasi, soita terveydenhuollon tarjoajallesi.
Mitä minun pitäisi välttää käyttäessäni SEROQUEL 100mg?
- Älä aja, käytä koneita tai tee muuta vaarallista toimintaa, ennen kuin tiedät, miten SEROQUEL vaikuttaa sinuun. SEROQUEL voi tehdä sinut uneliaaksi.
- Vältä ylikuumenemista tai kuivumista.
- Älä liioittele.
- Kuumalla säällä pysy sisällä viileässä paikassa, jos mahdollista.
- Pysy poissa auringosta. Älä käytä liikaa tai raskaita vaatteita.
- Juo runsaasti vettä.
- Älä juo alkoholia SEROQUEL-hoidon aikana. Se voi pahentaa joitain SEROQUELin sivuvaikutuksia.
Mitkä ovat SEROQUEL 300mg:n mahdolliset sivuvaikutukset?
SEROQUEL 200mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää SEROQUEL 200mg:sta?"
- aivohalvaus, joka voi johtaa kuolemaan, voi tapahtua iäkkäillä dementiaa sairastavilla ihmisillä, jotka käyttävät SEROQUELin kaltaisia lääkkeitä
- maligni neuroleptioireyhtymä (NMS). NMS on harvinainen mutta erittäin vakava sairaus, joka voi ilmetä ihmisillä, jotka käyttävät psykoosilääkkeitä, mukaan lukien SEROQUEL. NMS voi aiheuttaa kuoleman, ja se on hoidettava sairaalassa. Soita heti terveydenhuollon tarjoajallesi, jos sairastut vakavasti ja sinulla on jokin tai kaikki näistä oireista:
- korkea kuume
- liiallinen hikoilu
- jäykät lihakset
- hämmennystä
- hengityksen, sydämen sykkeen ja verenpaineen muutokset
- putoaa voi tapahtua joillakin SEROQUEL-hoitoa käyttävillä ihmisillä. Nämä putoamiset voivat aiheuttaa vakavia vammoja.
- korkea verensokeri (hyperglykemia). Korkea verensokeri voi esiintyä, jos sinulla on jo diabetes tai jos sinulla ei ole koskaan ollut diabetesta. Korkea verensokeri voi johtaa:
- hapon kertyminen vereen ketonien vuoksi (ketoasidoosi)
- kooma
- kuolema
Joillakin SEROQUEL-valmistetta käyttävillä ihmisillä voi esiintyä verensokerin nousua. Erittäin korkea verensokeri voi johtaa koomaan tai kuolemaan. Jos sinulla on diabetes tai sinulla on diabeteksen riskitekijöitä (kuten ylipainoinen tai suvussasi on diabetes), terveydenhuollon ammattilaisen tulee tarkistaa verensokerisi ennen SEROQUEL 50 mg -hoidon aloittamista ja hoidon aikana. Soita terveydenhuollon tarjoajallesi, jos sinulla on jokin näistä korkean verensokerin (hyperglykemian) oireista SEROQUEL-hoidon aikana:
- tuntuu kovin janoiselta
- täytyy virtsata tavallista enemmän
- tuntuu kovin nälkäiseltä
- tuntuu heikolta tai väsyneeltä
- tuntuu pahalta vatsassasi
- olet hämmentynyt tai hengityksesi tuoksuu hedelmäiseltä
- veren korkea rasvapitoisuus (kohonnut kolesteroli ja triglyseridit). Seroquelilla hoidetuilla ihmisillä voi esiintyä korkeita rasvapitoisuuksia. Sinulla ei ehkä ole oireita, joten terveydenhuollon tarjoaja voi päättää tarkistaa kolesteroli- ja triglyseridisi SEROQUEL-hoidon aikana.
- painonnousu (painonnousu). Painonnousu on yleistä ihmisillä, jotka käyttävät SEROQUEL-valmistetta, joten sinun ja terveydenhuollon tarjoajasi tulee tarkistaa painosi säännöllisesti. Keskustele terveydenhuollon tarjoajan kanssa tavoista hallita painonnousua, kuten syömällä terveellistä, tasapainoista ruokavaliota ja harjoittelua.
- liikkeet, joita et voi hallita kasvoissasi, kielessäsi tai muissa kehon osissa (tardiivinen dyskinesia). Nämä voivat olla merkkejä vakavasta tilasta. Tardiivi dyskinesia ei välttämättä häviä, vaikka lopettaisit SEROQUELin käytön. Tardiivi dyskinesia voi alkaa myös sen jälkeen, kun lopetat SEROQUELin käytön.
- alentunut verenpaine (ortostaattinen hypotensio), mukaan lukien huimaus tai pyörtyminen, joka johtuu äkillisestä sydämen sykkeen ja verenpaineen muutoksesta noustessa liian nopeasti istuma- tai makuuasennosta.
- lasten ja teini-ikäisten verenpaineen nousu. Terveydenhuollon tarjoajan tulee tarkistaa lasten ja nuorten verenpaine ennen SEROQUEL-hoidon aloittamista ja hoidon aikana.
- alhainen valkosolujen määrä. Kerro terveydenhuollon tarjoajalle mahdollisimman pian, jos sinulla on kuumetta, flunssan kaltaisia oireita tai muita infektioita, koska tämä voi johtua erittäin alhaisesta valkosolujen määrästä. Terveydenhuollon tarjoaja voi tarkistaa valkosolutasosi määrittääkseen, tarvitaanko lisähoitoa tai muita toimia.
- kaihi
- kohtauksia
- epänormaalit kilpirauhastutkimukset. Terveydenhuollon tarjoaja voi tehdä verikokeita kilpirauhashormonitasosi tarkistamiseksi.
- prolaktiinitason nousu
- uneliaisuus, uneliaisuus, väsymys, ajattelu- ja tavanomaisten toimintojen vaikeudet
- kohonnut kehon lämpötila
- nielemisvaikeudet
- univaikeudet tai univaikeudet (unettomuus), pahoinvointi tai oksentelu, jos lopetat äkillisesti SEROQUELin käytön. Nämä oireet paranevat yleensä 1 viikon kuluttua niiden alkamisesta.
SEROQUEL 50mg:n yleisimmät sivuvaikutukset ovat:
Aikuisilla:
- uneliaisuus
- äkillinen verenpaineen lasku noustessa
- painonnousu
- hitaus
- epänormaaleja maksakokeita
- ärtynyt vatsa
- kuiva suu
- huimaus
- heikkous
- vatsakipu
- ummetus
- kipeä kurkku
Lapsilla ja nuorilla:
- uneliaisuus
- huimaus
- väsymys
- pahoinvointi
- kuiva suu
- painonnousu
- lisääntynyt ruokahalu
- oksentelua
- nopea sydämen syke
Nämä eivät ole kaikki SEROQUELin mahdollisia sivuvaikutuksia. Lisätietoja saat terveydenhuollon tarjoajalta tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää SEROQUEL 100mg?
- Säilytä SEROQUEL 100 mg huoneenlämmössä, 20 °C - 25 °C (68–77 °F).
- Pidä SEROQUEL ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa SEROQUELin turvallisesta ja tehokkaasta käytöstä
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä SEROQUEL-valmistetta sairauteen, johon sitä ei ole määrätty. Älä anna SEROQUEL-valmistetta muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tämä lääkitysopas sisältää yhteenvedon tärkeimmistä SEROQUEL-tiedoista. Jos haluat lisätietoja, keskustele terveydenhuollon tarjoajasi kanssa. Voit kysyä apteekista tai terveydenhuollon tarjoajalta tietoja SEROQUEL 100mg -valmisteesta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Lisätietoja saat osoitteesta www.SEROQUEL.com tai soita numeroon 1-800-236-9933.
Mitä ainesosia SEROQUEL 200mg sisältää?
Aktiivinen ainesosa: ketiapiinifumaraatti
Inaktiiviset ainesosat: povidoni, kaksiemäksinen dikalsiumfosfaattidihydraatti, mikrokiteinen selluloosa, natriumtärkkelysglykolaatti, laktoosimonohydraatti, magnesiumstearaatti, hypromelloosi, polyetyleeniglykoli ja titaanidioksidi. 25 mg:n tabletit sisältävät punaista ja keltaista rautaoksidia. 100 mg ja 400 mg tabletit sisältävät vain keltaista rautaoksidia.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
