Cymbalta 20mg, 30mg, 40mg, 60mg Duloxetine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Cymbalta on ja miten sitä käytetään?
Cymbalta on reseptilääke, jota käytetään vakavan masennuksen, diabeettisen perifeerisen neuropaattisen kivun, yleistyneen ahdistuneisuushäiriön, fibromyalgian ja kroonisen lihaskivun hoitoon. Cymbaltaa voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
- Cymbalta kuuluu lääkeryhmään, jota kutsutaan masennuslääkkeiksi, SNRI:iksi, fibromyalgialääkkeiksi.
- Ei tiedetä, onko Cymbalta turvallinen ja tehokas alle 7-vuotiaille lapsille.
Mitkä ovat Cymbalta 20mg:n mahdolliset sivuvaikutukset?
Cymbalta voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- hakkaavia sydämenlyöntejä tai lepatusta rinnassasi,
- huimaus,
- helppo mustelma,
- epätavallinen verenvuoto,
- näkö muuttuu,
- kivulias tai vaikea virtsaaminen,
- impotenssi,
- seksuaaliset ongelmat,
- oikeanpuoleinen ylävatsakipu,
- kutina,
- tumma virtsa,
- ihon tai silmien keltaisuus (keltatauti),
- päänsärky,
- hämmennystä,
- sammaltava puhe,
- vakava heikkous,
- oksentelua,
- koordinaation menetys,
- epävakaa olo,
- kilpa ajatuksia,
- lisääntynyt energia,
- huolimaton käytös,
- erittäin iloinen tai ärtynyt olo,
- puhuu tavallista enemmän ja
- vakavia unihäiriöitä
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Cymbaltan yleisimmät sivuvaikutukset ovat:
- uneliaisuus,
- pahoinvointi,
- ummetus,
- ruokahalun menetys,
- suun kuivuminen ja
- lisääntynyt hikoilu
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Cymbaltan mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
ITSUTURMA-AJAUKSET JA KÄYTTÄYTYMINEN
Masennuslääkkeet lisäsivät itsemurha-ajatusten ja -käyttäytymisen riskiä lapsilla, nuorilla ja nuorilla aikuisilla lyhytaikaisissa tutkimuksissa. Nämä tutkimukset eivät osoittaneet itsemurha-ajatusten ja -käyttäytymisen riskin lisääntymistä masennuslääkkeiden käytön yhteydessä yli 24-vuotiailla potilailla; 65-vuotiailla ja sitä vanhemmilla potilailla masennuslääkkeiden käytön riski pieneni [katso VAROITUKSET JA VAROTOIMET ].
Kaiken ikäisiä potilaita, joilla on aloitettu masennuslääkehoito, on seurattava tarkasti pahenemisen ja itsemurha-ajatusten ja -käyttäytymisen ilmaantumisen varalta. Neuvo perheitä ja omaishoitajia tiiviin tarkkailun ja yhteydenpidon tarpeesta lääkkeen määräävän lääkärin kanssa [katso VAROITUKSET JA VAROTOIMET ].
KUVAUS
CYMBALTA® (duloksetiinia viivästyneesti vapauttavat kapselit) on selektiivinen serotoniinin ja norepinefriinin takaisinoton estäjä (SSNRI) suun kautta annettavaksi. Sen kemiallinen nimitys on (+)-(S)-N-metyyli-y-(1-naftyylioksi)-2-tiofeenipropyyliamiinihydrokloridi. Empiirinen kaava on C18H19NOS•HCl, joka vastaa molekyylipainoa 333,88. Rakennekaava on:
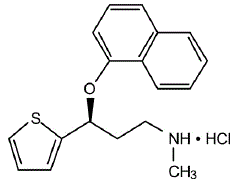
Duloksetiinihydrokloridi on valkoinen tai hieman ruskehtavan valkoinen kiinteä aine, joka liukenee heikosti veteen.
Jokainen kapseli sisältää enteropäällysteisiä pellettejä, joissa on 22,4, 33,7 tai 67,3 mg duloksetiinihydrokloridia, mikä vastaa 20, 30 tai 60 mg duloksetiinia. Nämä enteropäällysteiset pelletit on suunniteltu estämään lääkkeen hajoaminen mahan happamassa ympäristössä. Inaktiivisia ainesosia ovat FD&C Blue No. 2, gelatiini, hypromelloosi, hydroksipropyylimetyyliselluloosa-asetaattisukkinaatti, natriumlauryylisulfaatti, sakkaroosi, sokeripallot, talkki, titaanidioksidi ja trietyylisitraatti. 20 ja 60 mg:n kapselit sisältävät myös keltaista rautaoksidia.
INDIKAATIOT
CYMBALTA® on tarkoitettu seuraavien sairauksien hoitoon:
- Vakava masennushäiriö aikuisilla
- Yleistynyt ahdistuneisuushäiriö aikuisilla ja yli 7-vuotiailla lapsipotilailla
- Diabeettinen perifeerinen neuropaattinen kipu aikuisilla
- Fibromyalgia aikuisilla ja 13-vuotiailla ja sitä vanhemmilla lapsipotilailla
- krooninen tuki- ja liikuntaelinkipu aikuisilla
ANNOSTELU JA HALLINNOINTI
Tärkeät hallintaohjeet
Anna CYMBALTA suun kautta (aterian yhteydessä tai ilman) ja niele kokonaisena. Älä pureskele tai murskaa, äläkä avaa viivästetysti vapautuvaa kapselia äläkä ripottele sen sisältöä ruokaan tai sekoita nesteisiin, koska nämä vaikutukset voivat vaikuttaa enteropäällysteeseen. Jos unohdat ottaa CYMBALTA 20 mg -annoksen, ota unohtunut annos heti kun muistat. Jos on melkein seuraavan annoksen aika, jätä unohtunut annos väliin ja ota seuraava annos tavalliseen aikaan. Älä ota kahta CYMBALTA 60 mg annosta samanaikaisesti.
Annostus vakavan masennushäiriön hoitoon aikuisilla
Suositeltu aloitusannos aikuisille, joilla on MDD, on 40 mg/vrk (20 mg kahdesti vuorokaudessa) - 60 mg/vrk (joko kerran vuorokaudessa tai 30 mg kahdesti vuorokaudessa). Joillekin potilaille voi olla toivottavaa aloittaa annoksella 30 mg kerran vuorokaudessa 1 viikon ajan, jotta potilaat voivat sopeutua CYMBALTA 30 mg:aan ennen kuin annoksen nostaminen 60 mg:aan kerran päivässä. Vaikka 120 mg:n vuorokausiannoksen osoitettiin olevan tehokas, ei ole näyttöä siitä, että yli 60 mg:n vuorokausiannoksilla olisi lisähyötyjä. Arvioi säännöllisesti uudelleen ylläpitohoidon tarpeen ja sopivan annoksen määrittämiseksi.
Annostus yleistyneen ahdistuneisuushäiriön hoitoon
Suositeltu annostus alle 65-vuotiaille aikuisille
Useimmille alle 65-vuotiaille aikuisille, joilla on GAD, aloitetaan CYMBALTA 60 mg kerran vuorokaudessa. Joillekin potilaille voi olla toivottavaa aloittaa annoksella 30 mg kerran vuorokaudessa 1 viikon ajan, jotta potilaat voivat sopeutua CYMBALTA 40 mg:aan ennen kuin annoksen nostaminen 60 mg:aan kerran vuorokaudessa. Vaikka 120 mg:n kerran vuorokaudessa annettavan annoksen osoitettiin olevan tehokas, ei ole näyttöä siitä, että yli 60 mg:n vuorokausiannoksilla olisi lisähyötyä. Jos kuitenkin päätetään suurentaa annosta yli 60 mg kerran vuorokaudessa, nosta annosta 30 mg:n kerrallaan kerran vuorokaudessa. Arvioi säännöllisin väliajoin uudelleen määrittääksesi jatkuvan ylläpitohoidon tarpeen ja sopivan annoksen tällaiselle hoidolle.
Suositeltu annostus iäkkäille potilaille
Aloita CYMBALTA-hoito iäkkäillä GAD-potilailla annoksella 30 mg kerran vuorokaudessa 2 viikon ajan ennen kuin harkitset nostamista tavoiteannokseen 60 mg/vrk. Tämän jälkeen potilaat voivat hyötyä yli 60 mg:n annoksista kerran päivässä. Jos annosta päätetään suurentaa yli 60 mg kerran vuorokaudessa, nosta annosta 30 mg:n kerrallaan kerran vuorokaudessa. Suurin tutkittu annos oli 120 mg vuorokaudessa.
Suositeltu annostus 7–17-vuotiaille lapsipotilaille
Aloita CYMBALTA 30 mg 7–17-vuotiaille lapsipotilaille, joilla on GAD, annoksella 30 mg kerran vuorokaudessa 2 viikon ajan, ennen kuin harkitaan nostamista 60 mg:aan kerran vuorokaudessa. Suositeltu annosalue on 30-60 mg kerran vuorokaudessa. Jotkut potilaat voivat hyötyä yli 60 mg:n annoksista kerran päivässä. Jos annosta päätetään suurentaa yli 60 mg kerran vuorokaudessa, nosta annosta 30 mg:n kerrallaan kerran vuorokaudessa. Suurin tutkittu annos oli 120 mg vuorokaudessa.
Annostus diabeettisen perifeerisen neuropaattisen kivun hoitoon aikuisilla
Anna 60 mg kerran päivässä aikuisille, joilla on diabeettista perifeeristä neuropaattista kipua. Ei ole näyttöä siitä, että yli 60 mg kerran vuorokaudessa annettavat annokset aiheuttaisivat merkittävää lisähyötyä, ja suurempi annos on selvästi huonommin siedetty. Potilaille, joiden siedettävyys on huolenaihe, voidaan harkita pienempää aloitusannosta.
Koska diabetes on usein monimutkaista munuaisten vajaatoiminnasta kärsiville potilaille, harkitse pienempää aloitusannosta ja annoksen asteittaista lisäämistä [ks. Annostus potilaille, joilla on maksan vajaatoiminta tai vaikea munuaisten vajaatoiminta ja Käyttö tietyissä populaatioissa ].
Annostus fibromyalgian hoitoon
Suositeltu annostus aikuisille
Suositeltu CYMBALTA-annos on 60 mg kerran päivässä fibromyalgiaa sairastaville aikuisille. Aloita hoito annoksella 30 mg kerran vuorokaudessa 1 viikon ajan, jotta potilaat voivat sopeutua CYMBALTA 20 mg:aan ennen kuin se nostetaan 60 mg:aan kerran vuorokaudessa. Jotkut potilaat saattavat reagoida aloitusannokseen. Ei ole näyttöä siitä, että yli 60 mg:n vuorokausiannoksilla olisi lisähyötyä, jopa potilailla, jotka eivät saa vastetta 60 mg:n vuorokausiannoksella, ja suurempiin annoksiin liittyi suurempi haittavaikutusten määrä.
Suositeltu annostus 13–17-vuotiaille lapsipotilaille
Suositeltu CYMBALTA 60 mg aloitusannos fibromyalgiaa sairastaville 13–17-vuotiaille lapsipotilaille on 30 mg kerran vuorokaudessa. Annosta voidaan suurentaa 60 mg:aan kerran vuorokaudessa vasteen ja siedettävyyden perusteella.
Annostus kroonisen tuki- ja liikuntaelinten kivun hoitoon aikuisilla
Suositeltu CYMBALTA-annos on 60 mg kerran vuorokaudessa aikuisille, joilla on krooninen tuki- ja liikuntaelinkipu. Aloita hoito annoksella 30 mg kerran vuorokaudessa viikon ajan, jotta potilaat voivat sopeutua CYMBALTA-hoitoon, ennen kuin annoksen nostaminen 60 mg:aan kerran päivässä. Ei ole näyttöä siitä, että suuremmat annokset tuottaisivat lisähyötyä, jopa potilailla, jotka eivät reagoi 60 mg:n kerran vuorokaudessa annettavaan annokseen, ja suurempiin annoksiin liittyy suurempi haittavaikutusten määrä [ks. Kliiniset tutkimukset ].
Annostus potilaille, joilla on maksan vajaatoiminta tai vaikea munuaisten vajaatoiminta
Vältä käyttöä potilailla, joilla on krooninen maksasairaus tai kirroosi [katso VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Vältä käyttöä potilailla, joilla on vaikea munuaisten vajaatoiminta, GFR VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
CYMBALTA:n lopettaminen
Haittavaikutuksia CYMBALTA-hoidon lopettamisen, äkillisen tai kapenevan lopettamisen jälkeen ovat: huimaus, päänsärky, pahoinvointi, ripuli, parestesia, ärtyneisyys, oksentelu, unettomuus, ahdistuneisuus, liikahikoilu ja väsymys. Annoksen asteittaista pienentämistä äkillisen lopettamisen sijaan suositellaan aina kun mahdollista [katso VAROITUKSET JA VAROTOIMET ].
Potilaan vaihtaminen psykiatristen häiriöiden hoitoon tarkoitettuun monoamiinioksidaasin estäjään (MAOI)
Psykiatristen häiriöiden hoitoon tarkoitetun MAO-estäjän käytön lopettamisen ja CYMBALTA-hoidon aloittamisen välillä tulee kulua vähintään 14 päivää. Sitä vastoin CYMBALTA 60 mg:n käytön lopettamisen jälkeen tulisi kestää vähintään 5 päivää ennen MAO-estäjän aloittamista psykiatristen häiriöiden hoitoon [ks. VASTA-AIHEET ].
CYMBALTA:n käyttö muiden MAO-estäjien, kuten linetsolidin tai metyleenisinisen, kanssa
Älä aloita CYMBALTA-hoitoa potilaalle, jota hoidetaan linetsolidilla tai suonensisäisellä metyleenisinisellä, koska serotoniinioireyhtymän riski on lisääntynyt. Potilaalla, joka tarvitsee psykiatrisen tilan kiireellistä hoitoa, tulee harkita muita toimenpiteitä, mukaan lukien sairaalahoitoa [ks. VASTA-AIHEET ].
Joissakin tapauksissa potilas, joka jo saa CYMBALTA-hoitoa, saattaa tarvita kiireellistä linetsolidia tai suonensisäistä metyleenisinistä hoitoa. Jos hyväksyttäviä vaihtoehtoja linetsolidi- tai suonensisäiselle metyleenisinihoidolle ei ole saatavilla ja linetsolidin tai suonensisäisen metyleenisinisen hoidon mahdollisten hyötyjen katsotaan olevan suurempia kuin serotoniinioireyhtymän riskit tietyllä potilaalla, CYMBALTA on lopetettava välittömästi ja linetsolidi tai suonensisäinen metyleenisininen voidaan antaa. Potilasta tulee tarkkailla serotoniinioireyhtymän oireiden varalta 5 päivän ajan tai 24 tunnin ajan viimeisen linetsolidin tai suonensisäisen metyleenisinisen annoksen jälkeen sen mukaan, kumpi tulee ensin. CYMBALTA-hoitoa voidaan jatkaa 24 tuntia viimeisen linetsolidin tai suonensisäisen metyleenisinisen annoksen jälkeen [ks. VAROITUKSET JA VAROTOIMET ].
Riski, että metyleenisinistä annettaisiin ei-intravenoosisesti (kuten suun kautta otettavina tabletteina tai paikallisena injektiona) tai laskimonsisäisinä annoksina, jotka ovat paljon pienempiä kuin 1 mg/kg CYMBALTAn kanssa, on epäselvä. Kliinikon tulee kuitenkin olla tietoinen serotoniinioireyhtymän oireiden mahdollisuudesta tällaisen käytön yhteydessä [ks. VAROITUKSET JA VAROTOIMET ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
CYMBALTA on saatavana viivästetysti vapauttavina kapseleina:
- 20 mg läpinäkymättömät vihreät kapselit, joihin on painettu ”Lilly 3235 20mg”
- 30 mg läpinäkymättömät valkoiset ja siniset kapselit, joihin on painettu ”Lilly 3240 30mg”
- 60 mg läpinäkymättömät vihreät ja siniset kapselit, joihin on painettu ”Lilly 3270 60mg”
CYMBALTA (duloksetiinin viivästetysti vapautuvat kapselit) on saatavana seuraavina vahvuuksina, väreinä, painatuksina ja esityksissä:
Varastointi ja käsittely
Säilytä 25°C (77°F); retket sallitaan 15-30 °C:seen (59-86 °F) [katso USP Controlled Room Temperature].
Markkinoija: Lilly USA, LLC Indianapolis, IN 46285, USA. Tarkistettu: heinäkuuta 2021
SIVUVAIKUTUKSET
Seuraavat vakavat haittavaikutukset on kuvattu alla ja muualla merkinnöissä:
- Itsemurha-ajatukset ja -käyttäytyminen lapsilla, nuorilla ja nuorilla aikuisilla [ks. LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ]
- Maksatoksisuus [katso VAROITUKSET JA VAROTOIMET ]
- Ortostaattinen hypotensio, kaatumiset ja pyörtyminen [katso VAROITUKSET JA VAROTOIMET ]
- Serotoniinioireyhtymä [katso VAROITUKSET JA VAROTOIMET ]
- Lisääntynyt verenvuotoriski [katso VAROITUKSET JA VAROTOIMET ]
- Vakavat ihoreaktiot [katso VAROITUKSET JA VAROTOIMET ]
- Keskeytysoireyhtymä [katso VAROITUKSET JA VAROTOIMET ]
- Manian/hypomanian aktivointi [katso VAROITUKSET JA VAROTOIMET ]
- Kulman sulkeutuva glaukooma [katso VAROITUKSET JA VAROTOIMET ]
- Kohtaukset [katso VAROITUKSET JA VAROTOIMET ]
- Verenpaineen nousu [katso VAROITUKSET JA VAROTOIMET ]
- Kliinisesti tärkeät lääkevuorovaikutukset [katso VAROITUKSET JA VAROTOIMET ]
- Hyponatremia [katso VAROITUKSET JA VAROTOIMET ]
- Virtsan epäröinti ja pidätys [katso VAROITUKSET JA VAROTOIMET ]
- Seksuaalinen toimintahäiriö [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Ilmoitetut haittavaikutusten esiintymistiheydet edustavat niiden potilaiden osuutta, jotka ovat kokeneet vähintään kerran yhden lueteltua tyyppiä olevan hoidon aiheuttaman haittavaikutuksen. Reaktiota pidettiin hoitoon liittyvänä, jos se ilmeni ensimmäistä kertaa tai paheni hoidon aikana lähtötilanteen arvioinnin jälkeen.
Haittavaikutukset aikuisilla
Adult Clinical Trial Database
Alla kuvatut tiedot heijastavat altistumista CYMBALTAlle lumekontrolloiduissa aikuistutkimuksissa MDD:n (N=3779), GAD:n (N=1018), OA:n (N=503), CLBP:n (N=600), DPNP:n (N=906), ja FM (N=1294). Ikähaitari tässä yhdistetyssä populaatiossa oli 17-89 vuotta. Tässä yhdistetyssä populaatiossa 66 %, 61 %, 61 %, 43 % ja 94 % aikuispotilaista oli naisia; ja 82 %, 73 %, 85 %, 74 % ja 86 % aikuispotilaista oli valkoihoisia MDD-, GAD-, OA- ja CLBP-, DPNP- ja FM-populaatioissa, vastaavasti. Useimmat potilaat saivat CYMBALTA-annoksia yhteensä 60-120 mg päivässä [ks. Kliiniset tutkimukset ]. Alla olevat tiedot eivät sisällä tuloksia tutkimuksesta, jossa arvioitiin CYMBALTA 30 mg:n tehoa GAD:n hoidossa ≥65-vuotiailla potilailla (tutkimus GAD-5) [ks. Kliiniset tutkimukset ]; tässä iäkkäässä populaatiossa havaitut haittavaikutukset olivat kuitenkin yleensä samanlaisia kuin koko aikuisväestön haittavaikutukset.
Haittavaikutukset, jotka johtavat hoidon lopettamiseen aikuisten lumekontrolloiduissa tutkimuksissa
Masennustila
Noin 8,4 % (319/3779) CYMBALTAlla hoidetuista potilaista lumelääkekontrolloiduissa aikuisten MDD-tutkimuksissa keskeytti hoidon haittavaikutuksen vuoksi, verrattuna 4,6 %:iin (117/2536) lumelääkettä saaneista potilaista. Pahoinvointi (CYMBALTA 1,1 %, lumelääke 0,4 %) oli ainoa haittavaikutus, joka ilmoitettiin syynä hoidon lopettamiseen ja jonka katsottiin liittyvän lääkkeeseen (eli hoidon keskeytyminen tapahtui vähintään 1 %:lla CYMBALTA-hoitoa saaneista potilaista ja taajuudella vähintään kaksi kertaa lumelääkettä saaneilla potilailla).
Yleistynyt ahdistuneisuushäiriö
Noin 13,7 % (139/1018) CYMBALTAlla hoidetuista potilaista lumekontrolloiduissa GAD:n aikuistutkimuksissa keskeytti hoidon haittavaikutuksen vuoksi, kun taas lumelääkettä saaneiden potilaiden luku oli 5 % (38/767). Yleisiä haittavaikutuksia, joita ilmoitettiin hoidon lopettamisen syynä ja joiden katsottiin liittyvän lääkkeeseen (kuten edellä on määritelty), olivat pahoinvointi (CYMBALTA 3,3 %, lumelääke 0,4 %) ja huimaus (CYMBALTA 1,3 %, lumelääke 0,4 %).
Diabeettinen perifeerinen neuropaattinen kipu
Noin 12,9 % (117/906) CYMBALTAlla hoidetuista potilaista lumekontrolloiduissa aikuisten DPNP-tutkimuksissa keskeytti hoidon haittavaikutuksen vuoksi, kun taas lumelääkettä saaneiden potilaiden luku oli 5,1 % (23/448). Yleisiä haittavaikutuksia, joita ilmoitettiin syynä lopettamiseen ja joiden katsottiin olevan lääkkeeseen liittyviä (kuten edellä on määritelty), olivat pahoinvointi (CYMBALTA 3,5 %, lumelääke 0,7 %), huimaus (CYMBALTA 1,2 %, lumelääke 0,4 %) ja uneliaisuus (CYMBALTA 1,1 %). , lumelääke 0 %).
Fibromyalgia
Noin 17,5 % (227/1294) CYMBALTA-hoitoa saaneista potilaista 3–6 kuukauden lumelääkekontrolloiduissa aikuisten FM-tutkimuksissa keskeytti hoidon haittavaikutuksen vuoksi, kun taas lumelääkettä saaneista potilaista 10,1 % (96/955) . Lääkehoidon lopettamisen syyksi ilmoitettuja ja lääkkeeseen liittyviksi katsottuja haittavaikutuksia (kuten edellä on määritelty) olivat pahoinvointi (CYMBALTA 2,0 %, lumelääke 0,5 %), päänsärky (CYMBALTA 1,2 %, lumelääke 0,3 %), uneliaisuus (CYMBALTA 1,1 %, lumelääke). 0 %) ja väsymys (CYMBALTA 1,1 %, lumelääke 0,1 %).
Krooninen kipu nivelrikosta
Noin 15,7 % (79/503) CYMBALTAlla hoidetuista potilaista 13 viikon lumelääkekontrolloiduissa aikuisten kroonisen kivun tutkimuksissa keskeytti hoidon haittavaikutuksen vuoksi, kun taas lumelääkettä saaneiden potilaiden luku oli 7,3 % (37/508). hoidettuja potilaita. Lääkehoidon lopettamisen syyksi ilmoitettuja haittavaikutuksia, joiden katsottiin olevan lääkkeeseen liittyviä (kuten edellä on määritelty), olivat pahoinvointi (CYMBALTA 2,2 %, lumelääke 1 %).
Krooninen alaselän kipu
Noin 16,5 % (99/600) CYMBALTAlla hoidetuista potilaista 13 viikon lumekontrolloiduissa aikuisten CLBP-tutkimuksissa keskeytti hoidon haittavaikutuksen vuoksi, kun taas lumelääkettä saaneiden potilaiden luku oli 6,3 % (28/441). Lääkehoidon lopettamisen syyksi ilmoitettuja haittavaikutuksia, joiden katsottiin olevan lääkkeeseen liittyviä (kuten edellä on määritelty), olivat pahoinvointi (CYMBALTA 3 %, lumelääke 0,7 %) ja uneliaisuus (CYMBALTA 1 %, lumelääke 0 %).
Yleisimmät haittavaikutukset aikuisten kokeissa
Yleisimmin havaitut haittavaikutukset CYMBALTA-hoitoa saaneilla potilailla (kuten edellä on määritelty):
- Diabeettinen perifeerinen neuropaattinen kipu: pahoinvointi, uneliaisuus, vähentynyt ruokahalu, ummetus, liikahikoilu ja suun kuivuminen.
- Fibromyalgia: pahoinvointi, suun kuivuminen, ummetus, uneliaisuus, vähentynyt ruokahalu, liikahikoilu ja kiihtyneisyys.
- Krooninen nivelrikon aiheuttama kipu: pahoinvointi, väsymys, ummetus, suun kuivuminen, unettomuus, uneliaisuus ja huimaus.
- Krooninen alaselän kipu: pahoinvointi, suun kuivuminen, unettomuus, uneliaisuus, ummetus, huimaus ja väsymys.
Yleisimmin havaitut haittavaikutukset CYMBALTA-hoidetuilla potilailla kaikissa yhdistetyissä aikuispopulaatioissa (eli MDD, GAD, DPNP, FM, OA ja CLBP) (ilmaantuvuus vähintään 5 % ja vähintään kaksinkertainen esiintyvyys lumelääkettä saaneissa). potilaat) olivat pahoinvointi, suun kuivuminen, uneliaisuus, ummetus, ruokahalun heikkeneminen ja liikahikoilu.
Taulukossa 2 on esitetty haittavaikutusten ilmaantuvuus lumekontrolloiduissa tutkimuksissa hyväksytyillä aikuisväestöillä (eli MDD, GAD, DPNP, FM, OA ja CLBP), joita esiintyi vähintään 5 %:lla CYMBALTA-hoitoa saaneista potilaista ja joiden ilmaantuvuus oli suurempi. kuin lumelääkettä saaneet potilaat.
Haittavaikutukset yhdistetyissä MDD- ja GAD-kokeissa aikuisilla
Taulukossa 3 on esitetty haittavaikutusten ilmaantuvuus MDD- ja GAD- lumekontrolloiduissa aikuistutkimuksissa, joita esiintyi vähintään 2 %:lla CYMBALTA-hoitoa saaneista potilaista ja joiden ilmaantuvuus oli suurempi kuin lumelääkettä saaneilla potilailla.
Haittavaikutukset DPNP-, FM-, OA- ja CLBP-aikuisten kokeissa
Taulukossa 4 on esitetty haittavaikutusten ilmaantuvuus 2 %:lla tai useammalla CYMBALTA-hoitoa saaneista potilaista (määritetty ennen pyöristämistä) DPNP-, FM-, OA- ja CLBP- lumekontrolloitujen aikuisten akuuttivaiheen akuutissa vaiheessa ennen myyntiä ja joiden ilmaantuvuus oli suurempi. kuin lumelääkettä saaneet potilaat.
Vaikutukset miesten ja naisten seksuaaliseen toimintaan aikuisilla, joilla on MDD
Muutokset seksuaalisessa halussa, seksuaalisessa suorituskyvyssä ja seksuaalisessa tyytyväisyydessä esiintyvät usein psykiatristen häiriöiden tai diabeteksen ilmenemismuotoina, mutta ne voivat olla myös seurausta lääkehoidosta. Koska haitallisten seksuaalisten reaktioiden oletetaan olevan vapaaehtoisesti aliraportoitu, Arizona Sexual Experience Scalea (ASEX), validoitua mittaa seksuaalisten haittavaikutusten tunnistamiseen, käytettiin prospektiivisesti neljässä MDD- lumelääkekontrolloidussa aikuistutkimuksessa (tutkimukset MDD-1, MDD-2). , MDD-3 ja MDD-4) [katso Kliiniset tutkimukset ]. ASEX-asteikko sisältää viisi kysymystä, jotka koskevat seuraavia seksuaalisen toiminnan näkökohtia: 1) sukupuolihalu, 2) kiihottumisen helppous, 3) kyky saavuttaa erektio (miehet) tai voitelu (naiset), 4) orgasmin saavuttamisen helppous ja 5) orgasmityytyväisyys. Positiiviset luvut tarkoittavat seksuaalisen toiminnan heikkenemistä lähtötasosta. Negatiiviset luvut tarkoittavat parannusta toimintahäiriön lähtötasosta, mikä on yleisesti havaittavissa masentuneilla potilailla.
Näissä tutkimuksissa CYMBALTA-hoitoa saaneilla miespotilailla oli huomattavasti enemmän seksuaalisia toimintahäiriöitä mitattuna ASEX:n kokonaispistemäärällä ja kyvyllä saavuttaa orgasmi kuin lumelääkettä saaneilla miespotilailla (katso ). CYMBALTAlla hoidetuilla naispotilailla ei esiintynyt enemmän seksuaalisia toimintahäiriöitä kuin lumelääkettä saaneilla naispotilailla ASEX-kokonaispisteillä mitattuna. Terveydenhuollon tarjoajien tulee rutiininomaisesti tiedustella mahdollisista seksuaalisista haittavaikutuksista CYMBALTA-hoitoa saavilla potilailla.
Elintoimintojen muutokset aikuisilla
Lumekontrolloiduissa kliinisissä tutkimuksissa hyväksytyissä aikuispopulaatioissa muutosta lähtötilanteesta päätepisteeseen CYMBALTA-hoitoa saaneiden potilaiden systolinen verenpaine (SBP) nousi keskimäärin 0,23 mm Hg ja diastolinen verenpaine (DBP) 0,73 mm Hg verrattuna keskimääräiseen laskuun. 1,09 mm Hg verenpaineessa ja 0,55 mm Hg DBP:ssä lumelääkettä saaneilla potilailla. Pitkään (3 peräkkäistä käyntiä) kohonneen verenpaineen esiintymistiheydessä ei ollut merkittävää eroa [ks. VAROITUKSET JA VAROTOIMET ].
CYMBALTA 20 mg:n hoito lumekontrolloiduissa tutkimuksissa hyväksytyissä aikuisväestössä 26 viikon ajan aiheutti tyypillisesti pienen sykkeen nousun lähtötilanteesta päätepisteeseen verrattuna lumelääkkeeseen, jopa 1,37 lyöntiä minuutissa (lisäys 1,20 lyöntiä minuutissa). CYMBALTA-hoitoa saaneilla potilailla 0,17 lyöntiä minuutissa lumelääkettä saaneilla potilailla).
Laboratoriomuutokset aikuisilla
CYMBALTA-hoitoon plasebokontrolloiduissa kliinisissä tutkimuksissa hyväksytyissä aikuisväestössä liittyi ALAT-, ASAT-, CPK- ja alkalinen fosfataasin pieni keskimääräinen nousu lähtötilanteesta päätepisteeseen. harvinaisia, vaatimattomia, ohimeneviä, epänormaaleja arvoja näille analyyteille havaittiin CYMBALTA-hoitoa saaneilla potilailla verrattuna lumelääkettä saaneisiin potilaisiin [ks. VAROITUKSET JA VAROTOIMET ]. Korkeaa bikarbonaattia, kolesterolia ja epänormaalia (korkeaa tai matalaa) kaliumpitoisuutta havaittiin useammin CYMBALTA-hoitoa saaneilla potilailla kuin lumelääkettä saaneilla potilailla.
Muut aikuisilla CYMBALTA-valmisteen kliinisen kokeen arvioinnin aikana havaitut haittavaikutukset
Seuraavassa on luettelo haittavaikutuksista, joita potilaat ovat raportoineet CYMBALTA 40 mg:lla kliinisissä aikuistutkimuksissa. Kaikilla hyväksytyillä aikuisväestöillä tehdyissä kliinisissä tutkimuksissa 34 756 potilasta hoidettiin CYMBALTAlla. Näistä 27 % (9 337) otti CYMBALTA 60 mg vähintään 6 kuukauden ajan ja 12 % (4 317) otti CYMBALTAa vähintään vuoden ajan. Seuraavan luettelon ei ole tarkoitus sisältää reaktioita (1), jotka on jo lueteltu aiemmissa taulukoissa tai muualla merkinnöissä, (2) joille lääkkeen syy oli kaukainen, (3) jotka olivat niin yleisiä, että ne eivät olleet informatiivisia, (4) jotka olivat joilla ei katsota olevan merkittäviä kliinisiä vaikutuksia, tai (5) joita esiintyi yhtä suurella tai pienemmällä nopeudella kuin lumelääke.
Reaktiot luokitellaan kehon järjestelmän mukaan seuraavien määritelmien mukaisesti: yleisiä haittavaikutuksia ovat ne, joita esiintyy vähintään 1/100 potilaalla; harvinaiset haittavaikutukset ovat niitä, joita esiintyy 1/100 - 1/1000 potilaalla; Harvinaisia reaktioita esiintyy harvemmalla kuin 1/1000 potilaalla.
- Sydämen häiriöt - Usein: sydämentykytys; Harvinainen: sydäninfarkti, takykardia ja Takotsubo-kardiomyopatia.
- Korva- ja labyrinttihäiriöt - Usein: huimaus; Harvinainen: korvakipu ja tinnitus.
- Endokriiniset häiriöt - Harvinainen: kilpirauhasen vajaatoiminta.
- Silmäsairaudet - Usein: näön hämärtyminen; Harvinainen: diplopia, kuiva silmä ja näön heikkeneminen.
- Ruoansulatuskanavan häiriöt - Usein: ilmavaivat; Harvinaiset: dysfagia, ryktaatio, gastriitti, maha-suolikanavan verenvuoto, halitoosi ja stomatiitti; Harvinainen: mahahaava.
- Yleiset häiriöt ja hallintopaikan ehdot - Usein: vilunväristykset/jäykistykset; Harvinaiset: kaatumiset, epänormaali olo, kuuma ja/tai kylmä tunne, huonovointisuus ja jano; Harvinainen: kävelyhäiriö.
- Infektiot ja infektiot - Harvinainen: gastroenteriitti ja kurkunpäätulehdus.
- Tutkimukset Usein: paino noussut, paino laskenut; Harvinainen: veren kolesteroliarvojen nousu.
- Aineenvaihdunta- ja ravitsemushäiriöt - Harvinainen: nestehukka ja hyperlipidemia; Harvinainen: dyslipidemia.
- Tuki- ja liikuntaelimistön ja sidekudosten häiriöt - Usein: tuki- ja liikuntaelinten kipu; Harvinainen: lihasten kireys ja lihasten nykiminen.
- Hermoston häiriöt - Usein: dysgeusia, letargia ja parestesia/hypoestesia; Harvinainen: tarkkaavaisuus, dyskinesia, myoklonus ja huonolaatuinen uni; Harvinainen: dysartria.
- Psykiatriset häiriöt - Usein: epänormaalit unet ja unihäiriöt; Harvinainen: apatia, bruksismi, disorientaatio/sekaisuustila, ärtyneisyys, mielialan vaihtelut ja itsemurhayritys; Harvinainen: täydellinen itsemurha.
- Munuais- ja virtsatiehäiriöt - Usein: virtsaamistiheys; Harvinainen: dysuria, virtsaamisen pakko, nokturia, polyuria ja epänormaali virtsan haju.
- Lisääntymisjärjestelmän ja rintojen häiriöt - Usein: anorgasmia/epänormaali orgasmi; Harvinainen: vaihdevuosien oireet, seksuaalinen toimintahäiriö ja kivesten kipu; Harvinainen: kuukautiskiertohäiriö.
- Hengityselinten, rintakehän ja välikarsinan häiriöt Usein: haukottelu, suunielun kipu; Harvinainen: kurkun kireys.
- Ihon ja ihonalaisten kudosten häiriöt - Usein: kutina; Harvinainen: kylmä hiki, ihotulehdus, eryteema, lisääntynyt taipumus mustelmiin, yöhikoilu ja valoherkkyysreaktio; Harvinainen: mustelma.
- Verisuonihäiriöt - Usein: kuumat aallot; Harvinainen: punoitus, ortostaattinen hypotensio ja perifeerinen kylmyys.
Lapsipotilailla tehdyissä lumekontrolloiduissa kliinisissä tutkimuksissa havaitut haittavaikutukset
Pediatric Clinical Trial Database
Alla kuvatut tiedot kuvaavat CYMBALTA-altistusta (N=567) 7–18-vuotiailla lapsipotilailla kahdesta 10 viikon lumekontrolloidusta tutkimuksesta potilailla, joilla on MDD (N=341) (tutkimukset MDD-6 ja MDD- 7), yksi 10 viikon plasebokontrolloitu GAD-tutkimus (N=135) (tutkimus GAD-6) ja 13-viikkoinen fibromyalgian tutkimus (N=91). CYMBALTA 60 mg ei ole hyväksytty MDD:n hoitoon lapsipotilailla [katso Käyttö tietyissä populaatioissa ]. Näissä tutkimuksissa CYMBALTAlla hoidetuista potilaista 36 % oli 7-11-vuotiaita (64 % 12-18-vuotiaita), 55 % naisia ja 69 % valkoihoisia. Potilaat saivat 30–120 mg CYMBALTAa päivässä lumekontrolloiduissa akuuttien hoitotutkimuksissa. Lasten MDD-, GAD- ja fibromyalgiatutkimuksissa, jotka kestivät enintään 40 viikkoa, oli 988 CYMBALTAlla hoidettua 7–17-vuotiasta lapsipotilasta (useimmat potilaat saivat 30–120 mg päivässä) – 35 % oli 7–11-vuotiaita. ikäisiä (65 % oli 12–17-vuotiaita) ja 56 % naisia.
Yleisimmät haittavaikutukset pediatrisissa kokeissa
Yleisimmät haittavaikutukset (≥ 5 % CYMBALTA-hoitoa saaneilla potilailla ja vähintään kaksinkertainen esiintyvyys lumelääkettä saaneilla potilailla) kaikissa yhdistetyissä lapsipopulaatioissa (MDD, GAD ja fibromyalgia) olivat painon lasku, vähentynyt ruokahalu, pahoinvointi, oksentelu, väsymys ja ripuli.
Haittavaikutukset 7–17-vuotiailla lapsipotilailla, joilla on MDD ja GAD
Kliinisissä tutkimuksissa 7–18-vuotiailla MDD- ja GAD-potilailla havaittu haittavaikutusprofiili oli yhdenmukainen aikuisilla tehdyissä kliinisissä tutkimuksissa havaitun haittavaikutusprofiilin kanssa. Näissä lapsilla tehdyissä kliinisissä tutkimuksissa havaittuja yleisimpiä (≥5 % ja kahdesti lumelääkettä) haittavaikutuksia olivat pahoinvointi, ripuli, painon lasku ja huimaus.
Taulukossa 6 on esitetty haittavaikutusten ilmaantuvuus MDD- ja GAD-lapsipotilaiden lumekontrolloiduissa tutkimuksissa, joita esiintyi yli 2 %:lla CYMBALTA-hoitoa saaneista potilaista ja ilmaantuvuus oli suurempi kuin lumelääkettä saaneilla potilailla. CYMBALTAa ei ole hyväksytty MDD:n hoitoon lapsipotilailla [katso Käyttö tietyissä populaatioissa ].
Muita haittavaikutuksia, joita esiintyi alle 2 %:lla ja joita raportoitiin enemmän CYMBALTA-hoitoa saaneilla potilailla kuin lumelääkettä saaneilla lapsilla tehdyissä kliinisissä MDD- ja GAD-tutkimuksissa, olivat: epänormaalit unet (mukaan lukien painajaiset), ahdistuneisuus, punoitus (mukaan lukien kuumat aallot). ), liikahikoilu, sydämentykytys, pulssin nousu ja vapina (CYMBALTA 20 mg ei ole hyväksytty MDD-potilaiden hoitoon).
Yleisimmin raportoituja oireita CYMBALTA 30 mg:n käytön lopettamisen jälkeen lasten MDD- ja GAD-tutkimuksissa olivat päänsärky, huimaus, unettomuus ja vatsakipu [ks. VAROITUKSET JA VAROTOIMET ].
Kasvu (pituus ja paino) 7–17-vuotiailla lapsipotilailla, joilla on GAD ja MDD
Vähentynyttä ruokahalua ja painon laskua on havaittu SSRI- ja SNRI-lääkkeiden käytön yhteydessä. CYMBALTA-hoitoa saaneiden lapsipotilaiden paino laski kliinisissä tutkimuksissa keskimäärin 0,1 kg 10 viikon kohdalla, kun lumelääkettä saaneiden lapsipotilaiden keskimääräinen painonnousu oli noin 0,9 kg. Kliinisesti merkitsevää painonlaskua (≥ 3,5 %) havaitsevien potilaiden osuus oli suurempi CYMBALTA-ryhmässä kuin lumeryhmässä (16 % ja 6 %). Myöhemmin CYMBALTA-hoitoa saaneiden potilaiden 4–6 kuukauden kontrolloimattomien jatkojaksojen aikana oli keskimäärin toipumassa odotettuun lähtötason painoprosenttipisteeseen perustuen ikä- ja sukupuolitovereiden populaatiotietoihin.
Enintään 9 kuukautta kestäneissä tutkimuksissa CYMBALTAlla hoidetut lapsipotilaat pitivät keskimäärin 1,7 cm (2,2 cm 7–11-vuotiailla potilailla ja 1,3 cm 12–17-vuotiailla potilailla). Vaikka pituuden nousua havaittiin näiden tutkimusten aikana, pituuden prosenttipisteen keskimääräinen lasku 1 % (lasku 2 % 7–11-vuotiailla potilailla ja 0,3 % nousu 12–17-vuotiailla). Painoa ja pituutta on seurattava säännöllisesti CYMBALTA-hoitoa saavilla lapsipotilailla [katso Käyttö tietyissä populaatioissa ].
Haittavaikutukset 13–17-vuotiailla lapsipotilailla, joilla on fibromyalgia
Taulukossa 7 esitetään haittavaikutusten ilmaantuvuus lasten fibromyalgia- lumelääkekontrolloidussa tutkimuksessa (tutkimus FM-4), joita esiintyi yli 5 %:lla potilaista, joita hoidettiin CYMBALTA 30 mg:lla ja joiden ilmaantuvuus oli suurempi kuin lumelääkettä saaneilla potilailla [ks. Kliiniset tutkimukset ].
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu CYMBALTA:n hyväksynnän jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Markkinoille tulon jälkeen raportoituja haittavaikutuksia, jotka liittyivät ajallisesti CYMBALTA 40 mg -hoitoon ja joita ei mainita muualla pakkausmerkinnöissä, ovat: akuutti haimatulehdus, anafylaktinen reaktio, aggressio ja viha (erityisesti hoidon alussa tai hoidon lopettamisen jälkeen), angioneuroottinen turvotus, kulmaglaukooma, paksusuolitulehdus (mikroskooppinen tai määrittelemätön), ihon vaskuliitti (joskus liittyy systeemiseen vaikutukseen), ekstrapyramidaalinen häiriö, galaktorrea, gynekologinen verenvuoto, hallusinaatiot, hyperglykemia, hyperprolaktinemia, yliherkkyys, hypertensiivinen kriisi, lihasspasmit, ihottuma, levottomat jalat -oireyhtymä, kouristukset, hoidon lopettamisen jälkeen supraventrikulaarinen rytmihäiriö, tinnitus (hoidon lopettamisen jälkeen), trismus ja urtikaria.
HUUMEIDEN VUOROVAIKUTUKSET
Sekä CYP1A2 että CYP2D6 ovat vastuussa duloksetiinin metaboliosta.
CYP1A2:n estäjät
Kun CYMBALTA 60 mg annettiin yhdessä 100 mg:n fluvoksamiinin, voimakkaan CYP1A2:n estäjän, kanssa miespuolisille koehenkilöille (n=14), duloksetiinin AUC nousi noin 6-kertaiseksi, Cmax nousi noin 2,5-kertaiseksi ja duloksetiinin t1/2 nousi. kasvoi noin 3-kertaiseksi. Muita CYP1A2-metaboliaa estäviä lääkkeitä ovat simetidiini ja kinoloniantimikrobilääkkeet, kuten siprofloksasiini ja enoksasiini [ks. VAROITUKSET JA VAROTOIMET ].
CYP2D6:n estäjät
CYMBALTAn (40 mg kerran vuorokaudessa) ja paroksetiinin (20 mg kerran vuorokaudessa) samanaikainen käyttö suurensi duloksetiinin AUC-pitoisuutta noin 60 %, ja suurempia estoasteita odotetaan käytettäessä suurempia paroksetiiniannoksia. Samanlaisia vaikutuksia voidaan odottaa käytettäessä muita tehokkaita CYP2D6-estäjiä (esim. fluoksetiini, kinidiini) [ks. VAROITUKSET JA VAROTOIMET ].
CYP1A2:n ja CYP2D6:n kaksoisestäminen
CYMBALTA 40 mg kahdesti vuorokaudessa ja 100 mg fluvoksamiinia, joka on voimakas CYP1A2:n estäjä, annettiin samanaikaisesti CYP2D6:n heikosti metaboloiville koehenkilöille (n=14), mikä johti duloksetiinin AUC- ja Cmax-arvojen 6-kertaiseen nousuun.
Hemostaasia häiritsevät lääkkeet (esim. tulehduskipulääkkeet, aspiriini ja varfariini)
Verihiutaleiden vapauttamalla serotoniinia on tärkeä rooli hemostaasissa. Epidemiologiset tutkimukset tapauskontrollista ja kohorttisuunnittelusta, jotka ovat osoittaneet yhteyden serotoniinin takaisinottoa häiritsevien psykotrooppisten lääkkeiden käytön ja ylemmän maha-suolikanavan verenvuodon välillä, ovat myös osoittaneet, että NSAID-lääkkeen tai aspiriinin samanaikainen käyttö voi voimistaa tätä verenvuotoriskiä. Muuttuneita antikoagulanttivaikutuksia, mukaan lukien lisääntynyt verenvuoto, on raportoitu, kun SSRI- tai SNRI-lääkkeitä on annettu samanaikaisesti varfariinin kanssa. Varfariinin (2-9 mg kerran vuorokaudessa) samanaikainen anto vakaan tilan olosuhteissa CYMBALTA 60 tai 120 mg kerran vuorokaudessa enintään 14 päivän ajan terveillä koehenkilöillä (n=15) ei muuttanut merkittävästi INR:ää lähtötasosta (keskimääräiset INR-muutokset vaihtelivat 0,05 - +0,07). Duloksetiini ei muuttanut varfariinin (proteiiniin sitoutuneen ja vapaan lääkeaineen) farmakokinetiikkaa (AUCτ,ss, Cmax,ss tai tmax,ss) sekä R- että S-varfariinille. Duloksetiinin mahdollisen verihiutalevaikutuksen vuoksi varfariinihoitoa saavia potilaita on seurattava huolellisesti, kun CYMBALTA-hoito aloitetaan tai lopetetaan (ks. VAROITUKSET JA VAROTOIMET ].
Loratsepaami
CYMBALTA (60 mg Q 12 tuntia) ja loratsepaami (2 mg Q 12 tuntia) vakaan tilan olosuhteissa samanaikainen anto ei vaikuttanut duloksetiinin farmakokinetiikkaan.
Tematsepaami
CYMBALTAn (20 mg qhs) ja tematsepaamin (30 mg qhs) vakaan tilan olosuhteissa samanaikainen anto ei vaikuttanut duloksetiinin farmakokinetiikkaan.
Mahalaukun happamuuteen vaikuttavat lääkkeet
CYMBALTAlla on enteerinen pinnoite, joka vastustaa liukenemista, kunnes se saavuttaa maha-suolikanavan segmentin, jossa pH ylittää 5,5. Äärimmäisen happamissa olosuhteissa CYMBALTA 20mg, jota ei suojaa enteerinen pinnoite, voi käydä läpi hydrolyysin muodostaen naftolia. Varovaisuutta tulee noudattaa käytettäessä CYMBALTA 30 mg potilaita, joilla on sairauksia, jotka voivat hidastaa mahalaukun tyhjenemistä (esim. joillakin diabeetikoilla). Ruoansulatuskanavan pH:ta nostavat lääkkeet voivat johtaa duloksetiinin aikaisempaan vapautumiseen. CYMBALTA 60 mg:n anto samanaikaisesti alumiinia ja magnesiumia sisältävien antasidien (51 mekvivalentti) tai CYMBALTAn ja famotidiinin kanssa ei kuitenkaan vaikuttanut merkittävästi duloksetiinin imeytymisnopeuteen tai -laajuuteen 40 mg:n oraalisen annostelun jälkeen.
CYP1A2:n metaboloimat lääkkeet
In vitro -lääkkeiden yhteisvaikutustutkimukset osoittavat, että duloksetiini ei indusoi CYP1A2-aktiivisuutta. Siksi CYP1A2-substraattien (esim. teofylliinin, kofeiinin) metabolian ei ole odotettavissa induktion seurauksena, vaikka kliinisiä induktiotutkimuksia ei ole tehty. Duloksetiini on CYP1A2-isoformin estäjä in vitro -tutkimuksissa, ja kahdessa kliinisessä tutkimuksessa teofylliinin AUC:n keskimääräinen (90 %:n luottamusväli) nousu oli 7 % (1–15 %) ja 20 % (13–27 %). annettaessa samanaikaisesti CYMBALTA:n kanssa (60 mg kahdesti vuorokaudessa).
CYP2D6:n kautta metaboloituvat lääkkeet
Duloksetiini on kohtalainen CYP2D6:n estäjä. Kun CYMBALTA annettiin (annoksena 60 mg kahdesti vuorokaudessa) yhdessä 50 mg:n kerta-annoksen desipramiinia, CYP2D6-substraattia, desipramiinin AUC-arvo kolminkertaistui [ks. VAROITUKSET JA VAROTOIMET ].
CYP2C9:n metaboloimat lääkkeet
In vitro -tutkimusten tulokset osoittavat, että duloksetiini ei estä aktiivisuutta. Kliinisessä tutkimuksessa duloksetiini ei vaikuttanut merkittävästi S-varfariinin, CYP2C9-substraatin, farmakokinetiikkaan [ks. Hemostaasia häiritsevät lääkkeet (esim. tulehduskipulääkkeet, aspiriini ja varfariini) ].
CYP3A:n metaboloimat lääkkeet
In vitro -tutkimusten tulokset osoittavat, että duloksetiini ei estä tai indusoi CYP3A-aktiivisuutta. Siksi CYP3A-substraattien (esim. suun kautta otettavien ehkäisyvalmisteiden ja muiden steroidisten aineiden) metabolian ei ole odotettavissa induktion tai eston seurauksena, vaikka kliinisiä tutkimuksia ei ole tehty.
CYP2C19:n kautta metaboloituvat lääkkeet
In vitro -tutkimusten tulokset osoittavat, että duloksetiini ei estä CYP2C19-aktiivisuutta terapeuttisilla pitoisuuksilla. Siksi CYP2C19-substraattien metabolian estymistä ei ole odotettavissa, vaikka kliinisiä tutkimuksia ei ole suoritettu.
Monoamiinioksidaasin estäjät (MAOI)
[Katso ANNOSTELU JA HALLINNOINTI , VASTA-AIHEET , ja VAROITUKSET JA VAROTOIMET ].
Serotonergiset lääkkeet
[Katso ANNOSTELU JA HALLINNOINTI , VASTA-AIHEET , ja VAROITUKSET JA VAROTOIMET ].
Alkoholi
Kun CYMBALTA 40 mg ja etanoli annettiin useiden tuntien välein niin, että kummankin huippupitoisuudet olivat samat, CYMBALTA ei lisännyt alkoholin aiheuttamaa henkisten ja motoristen taitojen heikkenemistä.
CYMBALTA-kliinisten tutkimusten tietokannassa kolmella CYMBALTA-hoitoa saaneella potilaalla oli maksavaurioita, jotka ilmenivät ALAT- ja kokonaisbilirubiinin nousuna, ja merkkejä tukkeutumisesta. Kaikissa näissä tapauksissa esiintyi huomattavaa jatkuvaa etanolin käyttöä, ja tämä saattoi vaikuttaa havaittuihin poikkeavuuksiin [ks. VAROITUKSET JA VAROTOIMET ].
Keskushermostolääkkeet
[Katso VAROITUKSET JA VAROTOIMET ].
Lääkkeet, jotka sitoutuvat voimakkaasti plasman proteiineihin
Koska duloksetiini sitoutuu voimakkaasti plasman proteiineihin, CYMBALTA 30 mg:n antaminen potilaalle, joka ottaa toista lääkettä, joka sitoutuu voimakkaasti proteiineihin, voi lisätä toisen lääkkeen vapaita pitoisuuksia, mikä saattaa aiheuttaa haittavaikutuksia. CYMBALTA:n (60 tai 120 mg) samanaikainen antaminen varfariinin (2-9 mg) kanssa, joka on voimakkaasti proteiineihin sitoutunut lääke, ei kuitenkaan aiheuttanut merkittäviä muutoksia INR:ssä eikä kokonais-S- tai kokonais-R- farmakokinetiikkassa. varfariini (proteiiniin sidottu plus vapaa lääke) [katso Hemostaasia häiritsevät lääkkeet (esim. tulehduskipulääkkeet, aspiriini ja varfariini) ].
Huumeiden väärinkäyttö ja riippuvuus
Väärinkäyttö
Eläintutkimuksissa duloksetiini ei osoittanut barbituraatin kaltaista (masennuslääkettä) väärinkäyttöpotentiaalia.
Vaikka CYMBALTAa ei ole systemaattisesti tutkittu ihmisillä sen mahdollisen väärinkäytön suhteen, kliinisissä tutkimuksissa ei havaittu merkkejä huumeiden etsimisestä. Markkinointia edeltävän kokemuksen perusteella ei kuitenkaan ole mahdollista ennustaa, missä määrin keskushermostoon vaikuttavaa lääkettä käytetään väärin, ohjataan muualle ja/tai väärinkäyttöön sen jälkeen, kun se on markkinoitu. Tästä syystä lääkäreiden tulee huolellisesti arvioida potilaiden anamneesi huumeiden väärinkäytön varalta ja seurata tällaisia potilaita tarkasti ja tarkkailla heitä CYMBALTA-valmisteen väärinkäytön merkkien varalta (esim. toleranssin kehittyminen, annoksen suurentaminen, huumeiden etsintäkäyttäytyminen).
Riippuvuus
Lääkeriippuvuustutkimuksissa duloksetiini ei osoittanut riippuvuutta aiheuttavaa potentiaalia rotilla.
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Itsemurha-ajatukset ja -käyttäytyminen lapsilla, nuorilla ja nuorilla aikuisilla
Potilaat, joilla on vaikea masennushäiriö (MDD), sekä aikuisilla että lapsilla, voivat kokea masennuksensa pahenemista ja/tai itsemurha-ajatuksia ja -käyttäytymisen ilmaantumista (itsemurha-ajatuksia) tai epätavallisia muutoksia käyttäytymisessä riippumatta siitä, käyttävätkö he masennuslääkkeitä vai eivät, ja tämä riski voi jatkua, kunnes merkittävä remissio tapahtuu. Itsemurha on tunnettu masennuksen ja tiettyjen muiden psykiatristen häiriöiden riski, ja nämä häiriöt itsessään ovat vahvimpia itsemurhan ennustajia. Pitkään on kuitenkin ollut huolta siitä, että masennuslääkkeillä voi olla rooli masennuksen pahenemisessa ja itsetuhoisuuden syntymisessä tietyillä potilailla hoidon alkuvaiheessa.
Lyhytaikaisten lumekontrolloitujen masennuslääkkeiden (SSRI-lääkkeiden ja muiden) kokeiden yhdistetyt analyysit osoittivat, että nämä lääkkeet lisäävät itsemurha-ajattelun ja -käyttäytymisen (itsemurha-ajattelun) riskiä lapsilla, nuorilla ja nuorilla aikuisilla (1824-vuotiaat), joilla on vakava masennus. MDD) ja muut psykiatriset häiriöt. Lyhytaikaiset tutkimukset eivät osoittaneet lisääntynyttä itsemurhariskiä masennuslääkkeillä lumelääkkeeseen verrattuna yli 24-vuotiailla aikuisilla; 65-vuotiailla ja sitä vanhemmilla aikuisilla masennuslääkkeet vähenivät lumelääkkeeseen verrattuna.
Plasebokontrolloitujen tutkimusten yhdistetyt analyysit lapsilla ja nuorilla, joilla oli MDD, pakko-oireinen häiriö (OCD) tai muut psykiatriset häiriöt, sisälsivät yhteensä 24 lyhytaikaista tutkimusta 9 masennuslääkkeellä yli 4400 potilaalla. Plasebokontrolloitujen tutkimusten yhdistetyt analyysit aikuisilla, joilla oli MDD tai muita psykiatrisia häiriöitä, sisälsivät yhteensä 295 lyhytaikaista tutkimusta (mediaanikesto 2 kuukautta), joissa oli 11 masennuslääkettä yli 77 000 potilaalla. Itsemurhariskissä oli huomattavaa vaihtelua lääkkeiden välillä, mutta taipumus nuorempien potilaiden lisääntymiseen lähes kaikkien tutkittujen lääkkeiden kohdalla. Absoluuttisessa itsemurhariskissä oli eroja eri indikaatioiden välillä, ja suurin ilmaantuvuus MDD:ssä. Erojen riski (lääke vs. lumelääke) oli kuitenkin suhteellisen vakaa ikäryhmien sisällä ja eri käyttöaiheissa. Nämä riskierot (lääkkeen ja lumelääkkeen ero itsemurhatapausten määrässä 1000 hoidettua potilasta kohti) on esitetty taulukossa 1.
Yhtään itsemurhaa ei tapahtunut missään lasten CYMBALTA-tutkimuksessa. Aikuisten CYMBALTA 20 mg tutkimuksissa tehtiin itsemurhia, mutta luku ei riittänyt päätelmään CYMBALTAn vaikutuksesta itsemurhaan.
Ei tiedetä, ulottuuko itsemurhariski pitkäaikaiseen käyttöön eli useiden kuukausien jälkeiseen käyttöön. Lumekontrolloiduista ylläpitotutkimuksista aikuisilla, joilla on masennus, on kuitenkin huomattavaa näyttöä siitä, että masennuslääkkeiden käyttö voi viivyttää masennuksen uusiutumista.
Kaikkia potilaita, joita hoidetaan masennuslääkkeillä missä tahansa indikaatiossa, on seurattava asianmukaisesti ja tarkkailtava tarkasti kliinisen pahenemisen, itsemurha-ajattelun ja epätavallisten käyttäytymismuutosten varalta, erityisesti lääkehoidon ensimmäisten kuukausien aikana tai annosta muutettaessa, joko annosta suurennetaan. tai pienenee.
Seuraavia oireita, ahdistusta, kiihtyneisyyttä, paniikkikohtauksia, unettomuutta, ärtyneisyyttä, vihamielisyyttä, aggressiivisuutta, impulsiivisuutta, akatisiaa (psykomotorista levottomuutta), hypomaniaa ja maniaa on raportoitu myös aikuisilla ja lapsipotilailla, joita on hoidettu masennuslääkkeillä vakavan masennuksen vuoksi. kuten muissakin indikaatioissa, sekä psykiatrisissa että ei-psykiatrisissa. Vaikka syy-yhteyttä tällaisten oireiden ilmaantumisen ja joko masennuksen pahenemisen ja/tai itsetuhoisten impulssien ilmaantumisen välillä ei ole osoitettu, on huolestuttavaa, että tällaiset oireet voivat olla syntyvän itsetuhoisuuden esiaste.
Hoito-ohjelman muuttamista, mukaan lukien lääkityksen mahdollista lopettamista, tulee harkita potilailla, joiden masennus pahenee jatkuvasti tai joilla on ilmennyt itsemurha tai oireita, jotka saattavat olla masennuksen tai itsemurha-ajatuksen pahenemisen edeltäjä, varsinkin jos nämä oireet ovat vakavia, äkillisiä. alkuvaiheessa tai eivät olleet osa potilaan ilmeneviä oireita.
Jos hoito on päätetty keskeyttää, lääkitystä tulee pienentää niin nopeasti kuin mahdollista, mutta huomioiden, että hoidon lopettamiseen voi liittyä tiettyjä oireita [ks. ANNOSTELU JA HALLINNOINTI ja Keskeytysoireyhtymä ] kuvaukset CYMBALTA-hoidon lopettamisen riskeistä.
Masennuslääkkeillä vakavan masennushäiriön tai muiden, sekä psykiatristen että ei-psykiatristen oireiden vuoksi hoidettavien potilaiden perheitä ja hoitajia tulee varoittaa tarpeesta seurata potilaita kiihtyneisyyden, ärtyneisyyden, epätavallisten käyttäytymismuutosten ja muiden edellä kuvattujen oireiden ilmaantumisen varalta. , sekä itsemurha-ajattelun ilmaantuminen, ja ilmoittaa tällaisista oireista välittömästi terveydenhuollon tarjoajille. Tällaiseen seurantaan tulisi sisältyä perheiden ja omaishoitajien päivittäinen tarkkailu. Yliannostusriskin vähentämiseksi CYMBALTA-resepti tulee kirjoittaa pienimmälle kapselimäärälle, joka on potilaan hyvän hoidon mukainen.
Potilaiden seulonta kaksisuuntaisen mielialahäiriön varalta
Vakava masennusjakso voi olla kaksisuuntaisen mielialahäiriön ensimmäinen ilmentymä. Yleisesti uskotaan (vaikkakaan sitä ei ole vahvistettu kontrolloiduissa tutkimuksissa), että tällaisen episodin hoito pelkällä masennuslääkkeellä voi lisätä seka-/maanisen vaiheen esiintymisen todennäköisyyttä potilailla, joilla on kaksisuuntaisen mielialahäiriön riski. Ei tiedetä, edustavatko mikään yllä kuvatuista oireista tällaista muutosta. Ennen masennuslääkehoidon aloittamista masennusoireista kärsivät potilaat tulee kuitenkin seuloa riittävästi sen määrittämiseksi, onko heillä kaksisuuntaisen mielialahäiriön riski; Tällaiseen seulontaan tulee sisältyä yksityiskohtainen psykiatrinen historia, mukaan lukien suvussa itsemurhaa, kaksisuuntaista mielialahäiriötä ja masennusta esiintynyt historia. On huomattava, että CYMBALTAa ei ole hyväksytty käytettäväksi kaksisuuntaisen mielialahäiriön hoidossa.
Maksatoksisuus
CYMBALTAlla hoidetuilla potilailla on raportoitu maksan vajaatoimintaa, joskus kuolemaan johtanutta. Nämä tapaukset ovat ilmenneet hepatiittinä, johon liittyy vatsakipuja, hepatomegaliaa ja transaminaasiarvojen nousua yli 20 kertaa normaalin ylärajaan (ULN) keltaisuuden kanssa tai ilman, mikä kuvastaa maksavaurion sekamuotoista tai hepatosellulaarista mallia. CYMBALTA 30 mg -hoito tulee keskeyttää potilailla, joille kehittyy keltaisuus tai muu kliinisesti merkittävä maksan toimintahäiriö, eikä sitä saa jatkaa, ellei muuta syytä voida osoittaa.
Myös kolestaattista keltaisuutta, johon liittyy vähäistä transaminaasiarvojen nousua, on raportoitu. Muut markkinoille tulon jälkeiset raportit osoittavat, että kohonneita transaminaasi-, bilirubiini- ja alkalisen fosfataasin arvoja on esiintynyt potilailla, joilla on krooninen maksasairaus tai kirroosi.
CYMBALTA lisäsi seerumin transaminaasiarvojen nousun riskiä kehitysohjelman kliinisissä tutkimuksissa. Maksan transaminaasiarvojen nousu johti 0,3 %:lla (92/34 756) CYMBALTAlla hoidetuista potilaista hoidon keskeyttämiseen. Useimmilla potilailla keskimääräinen aika transaminaasiarvojen nousun havaitsemiseen oli noin kaksi kuukautta. Aikuisten lumekontrolloiduissa tutkimuksissa potilailla, joilla oli normaalit ja epänormaalit lähtötason ALAT-arvot, ALAT-arvon kohoaminen yli 3-kertaiseksi ULN-arvoon todettiin 1,25 %:lla (144/11 496) CYMBALTA-hoitoa saaneista potilaista verrattuna 0,45 %:iin (39/8716) lumelääkettä saaneista potilaista. - hoidettuja potilaita. Aikuisten lumekontrolloiduissa tutkimuksissa, joissa käytettiin kiinteän annoksen suunnittelua, saatiin näyttöä CYMBALTA-annosvastesuhteesta ALAT:n ja ASAT:n nousun suhteen, joka oli > 3 kertaa ULN ja > 5 kertaa ULN.
Koska on mahdollista, että CYMBALTA ja alkoholi voivat aiheuttaa maksavaurioita tai että CYMBALTA 20 mg voi pahentaa olemassa olevaa maksasairautta, CYMBALTAa ei tule määrätä potilaille, jotka käyttävät runsaasti alkoholia tai joilla on todettu krooninen maksasairaus.
Ortostaattinen hypotensio, kaatumiset ja pyörtyminen
Ortostaattista hypotensiota, kaatumisia ja pyörtymistä on raportoitu potilailla, joita on hoidettu suositelluilla CYMBALTA-annoksilla. Pyörtyminen ja ortostaattinen hypotensio ilmaantuvat yleensä ensimmäisen hoitoviikon aikana, mutta niitä voi esiintyä milloin tahansa CYMBALTA-hoidon aikana, erityisesti annoksen suurentamisen jälkeen. Kaatumisriski näyttää liittyvän verenpaineen ortostaattisen laskun asteeseen sekä muihin tekijöihin, jotka voivat lisätä taustalla olevaa kaatumisriskiä.
Kaikkien lumekontrolloitujen tutkimusten potilaiden analyysissä CYMBALTA 20 mg:lla hoidetut potilaat ilmoittivat suuremman putoamisnopeuden verrattuna lumelääkettä saaneisiin potilaisiin. Riski näyttää liittyvän verenpaineen ortostaattiseen laskuun. Verenpaineen laskun riski voi olla suurempi potilailla, jotka käyttävät samanaikaisesti lääkkeitä, jotka aiheuttavat ortostaattista hypotensiota (kuten verenpainelääkkeet) tai ovat voimakkaita CYP1A2-estäjiä (ks. VAROITUKSET JA VAROTOIMET ja Kliinisesti tärkeät lääkevuorovaikutukset ] ja potilailla, jotka ottavat CYMBALTA 20 mg yli 60 mg vuorokaudessa. Annoksen pienentämistä tai CYMBALTA-hoidon lopettamista tulee harkita potilailla, joilla ilmenee oireista ortostaattista hypotensiota, kaatumista ja/tai pyörtymistä CYMBALTA 40 mg -hoidon aikana.
Putoamisriski näytti myös olevan verrannollinen potilaan taustalla olevaan kaatumisriskiin ja näytti kasvavan tasaisesti iän myötä. Koska iäkkäillä potilailla on yleensä suurempi taustalla kaatumisriski riskitekijöiden, kuten useiden lääkkeiden käytön, lääketieteellisten sairauksien ja kävelyhäiriöiden, suuremman esiintyvyyden vuoksi, iän nousun vaikutus sinänsä on epäselvä. CYMBALTA 30 mg:n käytön yhteydessä on raportoitu kaatumisia, joilla on vakavia seurauksia, mukaan lukien murtumia ja sairaalahoitoa [ks. HAITTAVAIKUTUKSET ].
Serotoniinin oireyhtymä
Mahdollisesti hengenvaarallisen serotoniinioireyhtymän kehittymistä on raportoitu käytettäessä SNRI-lääkkeitä ja SSRI-lääkkeitä, mukaan lukien CYMBALTA 60 mg, yksinään, mutta erityisesti muiden serotonergisten lääkkeiden (mukaan lukien triptaanit, trisykliset masennuslääkkeet, fentanyyli, litium, tramadoli, tryptofaani, buspironi, amphetamiinit) samanaikaisen käytön yhteydessä. ja mäkikuisma) sekä serotoniinin aineenvaihduntaa heikentävien lääkkeiden kanssa (erityisesti MAO-estäjät, sekä psykiatristen häiriöiden hoitoon tarkoitetut, että myös muut, kuten linetsolidi ja suonensisäinen metyleenisininen).
Serotoniinioireyhtymän oireita voivat olla mielentilan muutokset (esim. kiihtyneisyys, hallusinaatiot, delirium ja kooma), autonominen epävakaus (esim. takykardia, labiili verenpaine, huimaus, hikoilu, punoitus, hypertermia), hermo-lihasoireet (esim. vapina, jäykkyys, myoklonus, hyperrefleksia, koordinaatiohäiriöt), kohtaukset ja/tai maha-suolikanavan oireet (esim. pahoinvointi, oksentelu, ripuli). Potilaita tulee seurata serotoniinioireyhtymän ilmaantumisen varalta.
CYMBALTA 30 mg:n samanaikainen käyttö MAO-estäjien kanssa on vasta-aiheista. CYMBALTA 60 mg -hoitoa ei myöskään saa aloittaa potilaalle, jota hoidetaan MAO-estäjillä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä. Kaikki metyleenisinistä koskevat raportit, jotka antoivat tietoa antoreitistä, koskivat suonensisäistä antoa annosalueella 1 mg/kg - 8 mg/kg. Ei raportoitu metyleenisinisen antamista muilla reiteillä (kuten oraalisilla tableteilla tai paikallisilla kudosinjektioilla) tai pienempinä annoksina. Joissakin tilanteissa CYMBALTAa käyttävän potilaan hoito MAO-estäjillä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä, saattaa olla tarpeen. CYMBALTA tulee lopettaa ennen MAO:n estäjähoidon aloittamista [katso ANNOSTELU JA HALLINNOINTI ja VASTA-AIHEET ].
Jos CYMBALTA 20 mg:n samanaikainen käyttö muiden serotonergisten lääkkeiden, kuten triptaanien, trisyklisten masennuslääkkeiden, fentanyylin, litiumin, tramadolin, buspironin, tryptofaanin, amfetamiinien ja mäkikuisman kanssa on kliinisesti perusteltua, potilaille on kerrottava mahdollisesta lisääntyneestä serotoniinioireyhtymän riskistä. varsinkin hoidon aloittamisen ja annosta suurennettaessa. Hoito CYMBALTA 60 mg:lla ja kaikilla samanaikaisilla serotonergisilla aineilla on lopetettava välittömästi, jos yllä mainitut tapahtumat ilmenevät, ja oireenmukaista tukihoitoa on aloitettava.
Lisääntynyt verenvuotoriski
Serotoniinin takaisinoton estoa häiritsevät lääkkeet, mukaan lukien CYMBALTA, voivat lisätä verenvuototapahtumien riskiä. Tapausraportit ja epidemiologiset tutkimukset (tapauskontrolli ja kohorttisuunnittelu) ovat osoittaneet yhteyden serotoniinin takaisinottoa häiritsevien lääkkeiden käytön ja maha-suolikanavan verenvuodon välillä. Markkinoille tulon jälkeinen tutkimus osoitti synnytyksen jälkeisen verenvuodon korkeamman ilmaantuvuuden CYMBALTAa käyttävillä äideillä. Muut SSRI:n ja SNRI:n käyttöön liittyvät verenvuototapahtumat ovat vaihdelleet mustelmista, hematoomista, nenäverenvuotoista ja petekioista hengenvaarallisiin verenvuotoon. Aspiriinin, ei-steroidisten tulehduskipulääkkeiden (NSAID), varfariinin ja muiden antikoagulanttien samanaikainen käyttö voi lisätä tätä riskiä.
Kerro potilaille verenvuotoriskistä, joka liittyy CYMBALTAn ja tulehduskipulääkkeiden, aspiriinin tai muiden hyytymiseen vaikuttavien lääkkeiden samanaikaiseen käyttöön [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Vakavat ihoreaktiot
CYMBALTA voi aiheuttaa vakavia ihoreaktioita, mukaan lukien erythema multiforme ja Stevens-Johnsonin oireyhtymä (SJS). CYMBALTA-käyttöön liittyvän SJS:n ilmoitusprosentti ylittää tämän vakavan ihoreaktion yleisen väestön taustaesiintymisasteen (1-2 tapausta miljoonaa henkilövuotta kohden). Raportointiaste on yleisesti hyväksytty aliarvioitu aliraportoinnin vuoksi.
CYMBALTA-hoito tulee lopettaa ensimmäisten rakkuloiden, hilseilevän ihottuman, limakalvoeroosioiden tai muiden yliherkkyysoireiden ilmaantuessa, jos muuta etiologiaa ei voida tunnistaa.
Keskeytysoireyhtymä
CYMBALTAa käyttävien potilaiden keskeytysoireita on arvioitu systemaattisesti. Aikuisten lumekontrolloiduissa kliinisissä tutkimuksissa äkillisen tai kapenevan lopettamisen jälkeen seuraavia oireita esiintyi vähintään 1 %:lla ja merkittävästi useammin CYMBALTA-hoitoa saaneilla potilailla kuin lumelääkkeen lopettaneilla: huimaus, päänsärky, pahoinvointi, ripuli, parestesia, ärtyneisyys, oksentelu, unettomuus, ahdistuneisuus, liikahikoilu ja väsymys.
Muiden SSRI- ja SNRI-lääkkeiden (serotoniinin ja norepinefriinin takaisinoton estäjät) markkinoinnin aikana on raportoitu spontaaneja haittavaikutuksia, jotka ilmenevät näiden lääkkeiden käytön lopettamisen jälkeen, erityisesti äkillisesti, mukaan lukien seuraavat: dysforinen mieliala, ärtyneisyys, kiihtyneisyys, huimaus, aistihäiriöt ( esim. parestesiat, kuten sähköiskun tuntemukset), ahdistuneisuus, sekavuus, päänsärky, letargia, emotionaalinen labilisuus, unettomuus, hypomania, tinnitus ja kohtaukset. Vaikka nämä tapahtumat ovat yleensä itsestään ohimeneviä, joidenkin on raportoitu olleen vakavia.
Potilaita tulee seurata näiden oireiden varalta, kun he lopettavat CYMBALTA-hoidon. Annoksen asteittaista pienentämistä äkillisen lopettamisen sijaan suositellaan aina kun mahdollista. Jos sietämättömiä oireita ilmaantuu annoksen pienentämisen tai hoidon lopettamisen jälkeen, voidaan harkita jatkamista aiemmin määrätyllä annoksella. Myöhemmin terveydenhuollon tarjoaja voi jatkaa annoksen pienentämistä, mutta asteittain [ks. ANNOSTELU JA HALLINNOINTI ].
Manian/hypomanian aktivointi
Aikuisten lumekontrolloiduissa tutkimuksissa MDD-potilailla manian tai hypomanian aktivaatiota raportoitiin 0,1 %:lla (4/3779) CYMBALTA-hoitoa saaneista potilaista ja 0,04 %:lla (1/2536) lumelääkettä saaneista potilaista. Manian tai hypomanian aktivaatiota ei raportoitu DPNP-, GAD-, fibromyalgia- tai kroonisen tuki- ja liikuntaelinkivun plasebokontrolloiduissa tutkimuksissa. Manian tai hypomanian aktivaatiota on raportoitu pienellä osalla mielialahäiriöpotilaita, joita on hoidettu muilla markkinoiduilla lääkkeillä, jotka ovat tehokkaita vakavan masennushäiriön hoidossa. Kuten näitä muitakin aineita, CYMBALTA 60 mg:aa tulee käyttää varoen potilailla, joilla on ollut mania.
Kulman sulkeutuva glaukooma
Pupillien laajentuminen, joka ilmenee monien masennuslääkkeiden, mukaan lukien CYMBALTA, käytön jälkeen voi laukaista kulman sulkemiskohtauksen potilaalla, jolla on anatomisesti kapeat kulmat ja jolle ei ole tehty iridektomiaa.
Kohtaukset
CYMBALTAa ei ole arvioitu systemaattisesti potilailla, joilla oli kohtaushäiriö, ja tällaiset potilaat suljettiin pois kliinisistä tutkimuksista. Aikuisten lumekontrolloiduissa kliinisissä tutkimuksissa kohtauksia/kouristuksia esiintyi 0,02 %:lla (3/12 722) CYMBALTA 60 mg:lla hoidetuista potilaista ja 0,01 %:lla (1/9513) lumelääkettä saaneista potilaista. CYMBALTAa tulee määrätä varoen potilaille, joilla on aiemmin ollut kohtaushäiriö.
Verenpaineen nousu
Aikuisten lumelääkekontrolloiduissa kliinisissä tutkimuksissa hyväksytyissä aikuisväestössä lähtötilanteesta päätepisteeseen CYMBALTA-hoitoon liittyi systolisen verenpaineen keskimääräinen nousu 0,5 mm Hg ja diastolinen verenpaine 0,8 mm Hg verrattuna keskimääräiseen 0,6 mm Hg:n systolisen ja 0,3 mmHg diastolinen lumelääkettä saaneilla potilailla. Jatkuvasti (3 peräkkäistä käyntiä) kohonneen verenpaineen esiintymistiheydessä ei ollut merkittävää eroa. Kliinisfarmakologisessa tutkimuksessa, jonka tarkoituksena oli arvioida CYMBALTA 60 mg:n vaikutuksia useisiin parametreihin, mukaan lukien verenpaine supraterapeuttisilla annoksilla nopeutetulla annostitrauksella, havaittiin verenpaineen nousua makuuasennossa annoksilla 200 mg kahdesti vuorokaudessa (noin 3,3 kertaa). suurin suositeltu annos). Suurimmalla annoksella 200 mg kahdesti vuorokaudessa keskimääräinen pulssi nousi 5,0–6,8 lyöntiä ja keskimääräinen verenpaine 4,7–6,8 mm Hg (systolinen) ja 4,5–7 mm Hg (diastolinen) 12 tunnin ajan annostelun jälkeen. .
Verenpaine tulee mitata ennen hoidon aloittamista ja mitata säännöllisesti hoidon aikana [katso HAITTAVAIKUTUKSET ].
Kliinisesti tärkeät lääkevuorovaikutukset
Sekä CYP1A2 että CYP2D6 ovat vastuussa CYMBALTA-metaboliasta.
Muiden lääkkeiden mahdollisuus vaikuttaa CYMBALTAAN
CYP1A2:n estäjät
CYMBALTA 40 mg:n samanaikaista antamista voimakkaiden CYP1A2-estäjien kanssa tulee välttää [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
CYP2D6:n estäjät
Koska CYP2D6 osallistuu CYMBALTA-aineenvaihduntaan, CYMBALTA:n samanaikainen käyttö voimakkaiden CYP2D6:n estäjien kanssa johtaa ja johtaa CYMBALTA:n korkeampiin pitoisuuksiin (keskimäärin 60 %) [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
CYMBALTA 30 mg voi vaikuttaa muihin lääkkeisiin
CYP2D6:n kautta metaboloituvat lääkkeet
CYMBALTA 20 mg:n anto samanaikaisesti sellaisten lääkkeiden kanssa, jotka metaboloituvat laajalti CYP2D6:n kautta ja joilla on kapea terapeuttinen indeksi, mukaan lukien tietyt masennuslääkkeet (trisykliset masennuslääkkeet [TCA:t], kuten nortriptyliini, amitriptyliini ja imipramiini), fenotiatsiinit ja tyypin 1C rytmihäiriölääkkeet (esim. propafenoni, flekainidi), tulee suhtautua varoen. Plasman TCA-pitoisuuksia on ehkä seurattava ja TCA:n annosta on ehkä pienennettävä, jos TCA:ta annetaan samanaikaisesti CYMBALTA:n kanssa. Vakavien kammiorytmihäiriöiden ja äkillisen kuoleman riskin vuoksi, joka mahdollisesti liittyy kohonneisiin plasman tioridatsiinipitoisuuksiin, CYMBALTA 30 mg:aa ja tioridatsiinia ei tule antaa samanaikaisesti [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Muut kliinisesti tärkeät lääkevuorovaikutukset
Alkoholi
CYMBALTA 40 mg:n samanaikainen käyttö runsaan alkoholin käytön kanssa voi liittyä vakavaan maksavaurioon. Tästä syystä CYMBALTA 60 mg:aa ei tule määrätä potilaille, jotka käyttävät runsaasti alkoholia [katso Maksatoksisuus ja lääkkeiden vuorovaikutus ].
Keskushermostoon vaikuttavat lääkkeet
Ottaen huomioon CYMBALTAn ensisijaiset keskushermostovaikutukset, sitä tulee käyttää varoen, kun sitä otetaan yhdessä muiden keskushermostoon vaikuttavien lääkkeiden kanssa tai korvataan niillä, mukaan lukien ne, joilla on samanlainen vaikutusmekanismi [ks. Kliinisesti tärkeät lääkevuorovaikutukset ja HUUMEIDEN VUOROVAIKUTUKSET ].
Hyponatremia
Hyponatremiaa voi esiintyä SSRI- ja SNRI-hoidon seurauksena, mukaan lukien CYMBALTA. Monissa tapauksissa tämä hyponatremia näyttää olevan seurausta epäasianmukaisen antidiureettisen hormonin erityksen oireyhtymästä (SIADH). CYMBALTA 40 mg:n käytön yhteydessä on raportoitu tapauksia, joissa seerumin natriumpitoisuus oli alle 110 mmol/l, ja ne näyttivät palautuvan, kun CYMBALTA-hoito lopetettiin. Ikäpotilailla saattaa olla suurempi riski saada hyponatremia SSRI- ja SNRI-lääkkeiden käytön yhteydessä. Myös potilailla, jotka käyttävät diureetteja tai joilla on muuten nestevajaus, voi olla suurempi riski [ks Käyttö tietyissä populaatioissa ]. CYMBALTA-hoidon lopettamista tulee harkita potilailla, joilla on oireinen hyponatremia, ja asianmukainen lääketieteellinen toimenpide on aloitettava.
Hyponatremian merkkejä ja oireita ovat päänsärky, keskittymisvaikeudet, muistin heikkeneminen, sekavuus, heikkous ja epävakaus, jotka voivat johtaa kaatumiseen. Vakavampiin ja/tai akuutimpiin tapauksiin on liittynyt hallusinaatioita, pyörtymistä, kohtauksia, koomaa, hengityspysähdystä ja kuolemaa.
Käyttö potilailla, joilla on samanaikainen sairaus
Kliininen kokemus CYMBALTAsta potilailla, joilla on samanaikaisia systeemisiä sairauksia, on rajallinen. Ei ole tietoa vaikutuksista, joita mahalaukun motiliteetti saattaa vaikuttaa CYMBALTAn enteropäällysteen stabiilisuuteen. Äärimmäisen happamissa olosuhteissa CYMBALTA, jota suolistossa liukeneva pinnoite ei suojaa, voi läpikäydä hydrolyysin muodostaen naftolia. Varovaisuutta on noudatettava käytettäessä CYMBALTAa potilailla, joilla on sairauksia, jotka voivat hidastaa mahalaukun tyhjenemistä (esim. joillakin diabeetikoilla).
CYMBALTA 30 mg:aa ei ole arvioitu systemaattisesti potilailla, joilla on äskettäin ollut sydäninfarkti tai epästabiili sepelvaltimotauti. Potilaat, joilla oli tällaisia diagnooseja, suljettiin yleensä pois kliinisistä tutkimuksista tuotteen markkinointia edeltävän testauksen aikana.
Maksan vajaatoiminta
Vältä käyttöä potilailla, joilla on krooninen maksasairaus tai kirroosi [katso ANNOSTELU JA HALLINNOINTI , Maksatoksisuus , ja Käyttö tietyissä populaatioissa ].
Vaikea munuaisten vajaatoiminta
Vältä käyttöä potilailla, joilla on vaikea munuaisten vajaatoiminta, GFR ANNOSTELU JA HALLINNOINTI ja Käyttö tietyissä populaatioissa ].
Glykeeminen hallinta diabeetikoilla
Kuten DPNP-tutkimuksissa havaittiin, CYMBALTA 30 mg:n hoito heikensi glukoositasapainoa joillakin diabetespotilailla. Kolmessa CYMBALTA-tutkimuksessa diabeettiseen perifeeriseen neuropatiaan liittyvän neuropaattisen kivun hoitoon [ks. Kliiniset tutkimukset ], diabeteksen keskimääräinen kesto oli noin 12 vuotta, keskimääräinen lähtötilanteen paastoverenglukoosi oli 176 mg/dl ja hemoglobiini A1c (HbA1c) keskimääräinen lähtötilanne oli 7,8 %. Näiden tutkimusten 12 viikkoa kestäneen akuutin hoitovaiheen aikana CYMBALTAan liittyi pieni keskimääräisen paastoverensokerin nousu lumelääkkeeseen verrattuna. Näiden tutkimusten jatkovaiheessa, joka kesti jopa 52 viikkoa, keskimääräinen paastoverenglukoosi nousi 12 mg/dl CYMBALTA 40 mg:n ryhmässä ja laski 11,5 mg/dl rutiinihoitoryhmässä. HbA1c nousi 0,5 % CYMBALTA 40 mg:n ryhmässä ja 0,2 % rutiinihoitoryhmässä.
Virtsan epäröinti ja pidättyminen
CYMBALTA 60 mg kuuluu lääkeryhmään, jonka tiedetään vaikuttavan virtsaputken resistenssiin. Jos virtsaamishäiriön oireita ilmaantuu CYMBALTA 20 mg -hoidon aikana, on otettava huomioon mahdollisuus, että ne voivat johtua lääkkeestä.
Markkinoille tulon jälkeisessä kokemuksessa on havaittu virtsanpidätystapauksia. Joissakin tapauksissa, joissa CYMBALTA 60 mg:n käyttöön liittyy virtsanpidätys, sairaalahoitoa ja/tai katetrointia on vaadittu.
Seksuaalinen toimintahäiriö
SNRI-lääkkeiden käyttö, mukaan lukien CYMBALTA 60 mg, voi aiheuttaa seksuaalisen toimintahäiriön oireita [ks. HAITTAVAIKUTUKSET ]. Miespotilailla SNRI:n käyttö voi aiheuttaa siemensyöksyn viivästymistä tai epäonnistumista, libidon heikkenemistä ja erektiohäiriöitä. Naispotilailla SNRI-lääkkeiden käyttö voi heikentää libidoa ja hidastaa orgasmia tai orgasmin puuttumista.
On tärkeää, että lääkärit tiedustelevat seksuaalista toimintaa ennen CYMBALTA 40 mg -hoidon aloittamista ja tiedustelevat erityisesti seksuaalisen toiminnan muutoksista hoidon aikana, koska seksuaalista toimintaa ei välttämättä raportoida spontaanisti. Seksuaalisen toiminnan muutoksia arvioitaessa yksityiskohtainen historia (mukaan lukien oireiden alkamisajankohta) on tärkeää, koska seksuaalisilla oireilla voi olla muita syitä, mukaan lukien taustalla oleva psykiatrinen häiriö. Keskustele mahdollisista hoitostrategioista potilaiden tukemiseksi tekemään tietoisia hoitopäätöksiä.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ).
Itsemurha-ajatukset ja -käyttäytymiset
Neuvo potilaita, heidän perheitään ja heidän hoitajiaan etsimään itsemurha-ajatuksia ja -käyttäytymistä, erityisesti hoidon aikana ja kun annosta säädetään ylös tai alas, ja neuvoa heitä ilmoittamaan tällaisista oireista terveydenhuollon tarjoajalleen [ks. LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ].
Hallinto
Neuvo potilaita nielemään CYMBALTA 20 mg kokonaisena ja olemaan pureskelematta, murskaamatta tai avaamatta kapselia (älä ripottele sisältöä ruokaan tai sekoita nesteisiin), koska nämä vaikutukset voivat vaikuttaa enteropäällysteeseen.
Maksatoksisuus
Kerro potilaille, että CYMBALTAlla hoidetuilla potilailla on raportoitu vakavia maksaongelmia, joskus kuolemaan johtaneita. Neuvo potilaita keskustelemaan terveydenhuollon tarjoajansa kanssa, jos heille ilmaantuu kutinaa, vatsakipua oikealla ylhäällä, tumma virtsa tai keltainen iho/silmät CYMBALTA-hoidon aikana, mikä saattaa olla merkkejä maksaongelmista. Neuvo potilaita keskustelemaan terveydenhuollon tarjoajan kanssa alkoholinkäytöstään. CYMBALTAn käyttö runsaan alkoholin nauttimisen kanssa voi liittyä vakavaan maksavaurioon [ks VAROITUKSET JA VAROTOIMET ].
Alkoholi
Vaikka CYMBALTA ei lisää alkoholin aiheuttamaa henkisten ja motoristen taitojen heikkenemistä, CYMBALTAn samanaikainen käyttö runsaan alkoholin nauttimisen kanssa saattaa liittyä vakavaan maksavaurioon (ks. VAROITUKSET JA VAROTOIMET ja HUUMEIDEN VUOROVAIKUTUKSET ].
Ortostaattinen hypotensio, kaatumiset ja pyörtyminen
Neuvoa potilaita ortostaattisen hypotension, kaatumisten ja pyörtymisen riskistä, erityisesti ensimmäisen käytön ja myöhemmän annoksen nostamisen aikana sekä sellaisten lääkkeiden samanaikaisen käytön yhteydessä, jotka voivat voimistaa CYMBALTAn ortostaattista vaikutusta [ks. VAROITUKSET JA VAROTOIMET ].
Serotoniinin oireyhtymä
Varo potilaita serotoniinioireyhtymän riskistä käytettäessä CYMBALTA 30 mg:aa ja muita serotonergisia aineita, mukaan lukien triptaanit, trisykliset masennuslääkkeet, fentanyyli, litium, tramadoli, buspironi, tryptofaani, amfetamiinit ja mäkikuisma [ks. VASTA-AIHEET , VAROITUKSET JA VAROTOIMET , ja HUUMEIDEN VUOROVAIKUTUKSET ]. Kerro potilaille serotoniinioireyhtymään liittyvistä merkeistä ja oireista, joita voivat olla mielentilan muutokset (esim. kiihtyneisyys, hallusinaatiot, delirium ja kooma), autonominen epävakaus (esim. takykardia, labiili verenpaine, huimaus, hikoilu, punoitus, hypertermia), neuromuskulaariset muutokset (esim. vapina, jäykkyys, myoklonus, hyperrefleksia, koordinaatiohäiriöt), kohtaukset ja/tai maha-suolikanavan oireet (esim. pahoinvointi, oksentelu, ripuli). Varoita potilaita hakeutumaan välittömästi lääkärin hoitoon, jos heillä on näitä oireita.
Lisääntynyt verenvuotoriski
Varo potilaita CYMBALTA 30 mg:n ja tulehduskipulääkkeiden, aspiriinin, varfariinin tai muiden hyytymiseen vaikuttavien lääkkeiden samanaikaisesta käytöstä, koska serotoniinin takaisinottoa häiritsevien psykotrooppisten lääkkeiden ja näiden aineiden yhteiskäyttö on yhdistetty lisääntyneeseen verenvuotoriskiin [ks. VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Vakavat ihoreaktiot
Varo potilaita, että CYMBALTA voi aiheuttaa vakavia ihoreaktioita. Tämä saattaa olla tarpeen hoitaa sairaalassa ja se voi olla hengenvaarallinen. Neuvo potilaita soittamaan välittömästi lääkärilleen tai saamaan hätäapua, jos heillä on ihorakkuloita, hilseilevää ihottumaa, haavaumia suussa, nokkosihottumaa tai muita allergisia reaktioita [ks. VAROITUKSET JA VAROTOIMET ].
Hoidon keskeyttäminen
Kerro potilaille, että CYMBALTA 30 mg -hoidon lopettamiseen saattaa liittyä oireita, kuten huimausta, päänsärkyä, pahoinvointia, ripulia, parestesiaa, ärtyneisyyttä, oksentelua, unettomuutta, ahdistusta, liikahikoilua ja väsymystä, ja heitä tulee neuvoa olemaan muuttamatta annostusohjelmaa tai lopettamaan CYMBALTAn ottaminen keskustelematta terveydenhuollon tarjoajasta [katso VAROITUKSET JA VAROTOIMET ].
Manian tai hypomanian aktivointi
Ennen CYMBALTA-hoidon aloittamista on tutkittava riittävästi potilaita, joilla on masennusoireita kaksisuuntaisen mielialahäiriön riskin varalta (esim. suvussa itsemurha, kaksisuuntainen mielialahäiriö ja masennus). Neuvo potilaita ilmoittamaan kaikista maanisen reaktion merkeistä tai oireista, kuten suuresti lisääntyneestä energiasta, vakavista unihäiriöistä, ajatusten kiihtymisestä, holtittomasta käytöksestä, tavallista enemmän tai nopeammin puhumisesta, epätavallisen mahtavista ideoista ja liiallisesta onnesta tai ärtyneisyydestä [ks. VAROITUKSET JA VAROTOIMET ].
Kulman sulkeutuva glaukooma
Kerro potilaille, että CYMBALTA 40 mg:n ottaminen voi aiheuttaa lievää pupillien laajentumista, mikä voi herkillä henkilöillä johtaa sulkeutumiskulmaglaukooman episodiin. Aiempi glaukooma on lähes aina avokulmaglaukooma, koska sulkukulmaglaukooma voidaan diagnosoituna hoitaa lopullisesti iridektomialla. Avokulmaglaukooma ei ole kulmaglaukooman riskitekijä. Potilaat saattavat haluta tulla tutkituksi sen määrittämiseksi, ovatko he alttiita kulman sulkemiselle, ja heille voidaan tehdä ennaltaehkäisevä toimenpide (esim. iridektomia), jos he ovat alttiita [ks. VAROITUKSET JA VAROTOIMET ].
Kohtaukset
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen, jos heillä on aiemmin ollut kohtaushäiriö [katso VAROITUKSET JA VAROTOIMET ].
Vaikutukset verenpaineeseen
Varo potilaita, että CYMBALTA 60 mg voi aiheuttaa verenpaineen nousua [ks VAROITUKSET JA VAROTOIMET ].
Samanaikaiset lääkkeet
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen, jos he käyttävät tai suunnittelevat ottavansa mitä tahansa resepti- tai käsikauppalääkkeitä, koska interaktiot ovat mahdollisia [ks. ANNOSTELU JA HALLINNOINTI , VASTA-AIHEET , VAROITUKSET JA VAROTOIMET , ja HUUMEIDEN VUOROVAIKUTUKSET ].
Hyponatremia
Kerro potilaille, että hyponatremiaa on raportoitu SNRI- ja SSRI-hoidon seurauksena, mukaan lukien CYMBALTA. Kerro potilaille hyponatremian merkeistä ja oireista [katso VAROITUKSET JA VAROTOIMET ].

Samanaikaiset sairaudet
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen kaikista heidän sairauksistaan [katso VAROITUKSET JA VAROTOIMET ].
Virtsan epäröinti ja pidättyminen
CYMBALTA kuuluu lääkeryhmään, joka voi vaikuttaa virtsaamiseen. Neuvo potilaita ottamaan yhteyttä terveydenhuollon tarjoajaan, jos heillä on virtsan virtausongelmia [katso VAROITUKSET JA VAROTOIMET ].
Seksuaalinen toimintahäiriö
Kerro potilaille, että CYMBALTA 40 mg:n käyttö voi aiheuttaa seksuaalisen toimintahäiriön oireita sekä mies- että naispotilailla. Kerro potilaille, että heidän tulee keskustella kaikista seksuaalisen toiminnan muutoksista ja mahdollisista hoitostrategioista terveydenhuollon tarjoajan kanssa [katso VAROITUKSET JA VAROTOIMET ].
Raskaus
- Kehota naisia ilmoittamaan terveydenhuollon tarjoajalleen, jos he tulevat raskaaksi tai aikovat tulla raskaaksi CYMBALTA-hoidon aikana.
- Kerro raskaana oleville naisille tai potilaille, jotka aikovat tulla raskaaksi, että CYMBALTA 40 mg:n käyttö kuukauden aikana ennen synnytystä voi lisätä synnytyksen jälkeisen verenvuodon riskiä ja saattaa lisätä vastasyntyneiden komplikaatioiden riskiä, jotka vaativat pitkäaikaista sairaalahoitoa, hengitystukea ja putkiruokintaa.
- Kerro raskaana oleville naisille, että masennuslääkkeiden käytön lopettamisen yhteydessä on olemassa uusiutumisen riski.
- Kerro potilaille, että on olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet duloksetiinille raskauden aikana [ks. Käyttö tietyissä populaatioissa ].
Imetys
Neuvo imettäviä naisia, jotka käyttävät CYMBALTA 30 mg, seuraamaan imeväisten sedaatiota, huonoa ruokintaa ja huonoa painonnousua ja hakeutumaan lääkärin hoitoon, jos he huomaavat näitä merkkejä [ks. Käyttö tietyissä populaatioissa ].
Psykomotorisen suorituskyvyn häiriöt
CYMBALTA 30 mg:aan saattaa liittyä sedaatiota ja huimausta. Siksi potilaita on varoitettava käyttämästä vaarallisia koneita, mukaan lukien autot, kunnes he ovat kohtuullisen varmoja siitä, että CYMBALTA-hoito ei vaikuta heidän kykyynsä osallistua sellaisiin toimintoihin.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Duloksetiinia annettiin ruokavaliossa hiirille ja rotille 2 vuoden ajan.
Naarashiirillä, jotka saivat duloksetiinia annoksella 140 mg/kg/vrk (3 kertaa suurin suositeltu ihmisannos (MRHD) 120 mg/vrk annettuna lapsille mg/m2:n perusteella), hepatosellulaaristen adenoomien ja karsinoomien ilmaantuvuus lisääntyi. Vaikuton annos oli 50 mg/kg/vrk (1 kertaa lapsille annettu MRHD). Kasvainten ilmaantuvuus ei lisääntynyt uroshiirillä, jotka saivat duloksetiinia enintään 100 mg/kg/vrk annoksilla (2 kertaa lapsille annettu MRHD).
Rotilla duloksetiiniannokset, jotka olivat enintään 27 mg/kg/vrk naarailla (1 kertaa lapsille annettu MRHD) ja uroksilla enintään 36 mg/kg/vrk (1,4 kertaa lapsille annettu MRHD) eivät lisänneet kasvainten ilmaantuvuus.
Mutageneesi
Duloksetiini ei ollut mutageeninen in vitro bakteerien käänteismutaatiomäärityksessä (Ames-testi) eikä klastogeeninen hiiren luuydinsoluilla tehdyssä in vivo kromosomipoikkeamatestissä. Lisäksi duloksetiini ei ollut genotoksinen in vitro nisäkkään eteenpäin suuntautuvassa geenimutaatiomäärityksessä hiiren lymfoomasoluissa tai in vitro unscheduled DNA synthesis (UDS) -määrityksessä rotan primaarisissa maksasoluissa, eikä se indusoinut sisarkromatidin vaihtoa kiinanhamsterin luuytimessä in vivo .
Hedelmällisyyden heikkeneminen
Duloksetiini, joka annettiin suun kautta joko uros- tai naarasrotille ennen parittelua ja sen aikana annoksina 45 mg/kg/vrk (3 kertaa nuorille annettu MRHD mg/m2:n perusteella), ei muuttanut parittelua tai hedelmällisyyttä.
Käyttö tietyissä populaatioissa
Raskaus
Raskausaltistusrekisteri
On olemassa raskausaltistusrekisteri, joka seuraa CYMBALTAlle raskauden aikana altistuneiden naisten raskaustuloksia. Ilmoittautuaksesi ota yhteyttä CYMBALTA-raskausrekisteriin numerossa 1-866-814-6975 tai www.cymbalta 20mgpregnancyregistry.com.
Riskien yhteenveto
Markkinoille tulon jälkeisen retrospektiivisen kohorttitutkimuksen tiedot osoittavat, että duloksetiinin käyttö synnytystä edeltävän kuukauden aikana saattaa liittyä lisääntyneeseen synnytyksen jälkeisen verenvuodon riskiin. Tiedot julkaistusta kirjallisuudesta ja markkinoille tulon jälkeisestä retrospektiivisestä kohorttitutkimuksesta eivät ole osoittaneet selkeää lääkkeisiin liittyvää riskiä vakaville synnynnäisille epämuodostumille tai muille haitallisille kehitysvaikutuksille (ks. Data ). Hoitamattomaan masennukseen ja fibromyalgiaan raskauden aikana sekä altistumiseen SNRI- ja SSRI-lääkkeille, mukaan lukien CYMBALTA, raskauden aikana liittyy riskejä (ks. Kliiniset näkökohdat ).
Rotilla ja kaniineilla, joita hoidettiin duloksetiinilla organogeneesin aikana, sikiön paino laski, mutta kehitysvaikutuksista ei ollut näyttöä annoksilla, jotka olivat enintään 3-kertaisia ja 6-kertaisia ihmisille suositeltuun enimmäisannoksiin (MRHD) verrattuna 120 mg/vrk. nuorille mg/m2 perusteella. Kun duloksetiinia annettiin suun kautta raskaana oleville rotille koko tiineyden ja imetyksen ajan, poikasten paino syntyessään ja pentujen eloonjäämisaika 1 päivään synnytyksen jälkeen pieneni annoksella, joka oli 2 kertaa nuorille annettu MRHD mg/m2:n perusteella. Tällä annoksella havaittiin pentujen käyttäytymistä, joka vastasi lisääntynyttä reaktiivisuutta, kuten lisääntynyt hätkähdysvaste melulle ja vähentynyt tottuminen liikuntaaktiivisuuteen. Vieroituksen jälkeiseen kasvuun ei ollut haitallista vaikutusta.
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Kliiniset näkökohdat
Äidin ja/tai alkion/sikiön sairauteen liittyvä riski
Naiset, jotka lopettavat masennuslääkkeiden käytön raskauden aikana, kokevat todennäköisemmin vakavan masennuksen uusiutumisen kuin naiset, jotka jatkavat masennuslääkkeiden käyttöä. Tämä havainto on prospektiivisesta pitkittäistutkimuksesta, jossa seurattiin 201 raskaana olevaa naista, joilla oli aiemmin ollut vakava masennushäiriö ja jotka olivat eutymia ja käyttivät masennuslääkkeitä raskauden alussa. Ota huomioon hoitamattoman masennuksen riski, kun lopetat tai vaihdat masennuslääkehoitoa raskauden ja synnytyksen aikana.
Fibromyalgiaa sairastavilla raskaana olevilla naisilla on lisääntynyt riski saada äidille ja lapselle haitallisia seurauksia, mukaan lukien ennenaikainen kalvojen repeämä, ennenaikainen synnytys, raskausikään nähden pieni, kohdunsisäinen kasvurajoitus, istukan häiriö ja laskimotukos. Ei tiedetä, ovatko nämä haitalliset äidin ja sikiön seuraukset suoraan seurausta fibromyalgiasta tai muista samanaikaisista tekijöistä.
Äidin haittavaikutukset
Duloksetiinin käyttö synnytystä edeltävän kuukauden aikana saattaa liittyä lisääntyneeseen synnytyksen jälkeisen verenvuodon riskiin [ks. VAROITUKSET JA VAROTOIMET ].
Sikiön/vastasyntyneen haittavaikutus
Vastasyntyneille, jotka ovat altistuneet CYMBALTAlle ja muille SNRI- tai SSRI-lääkkeille myöhään kolmannen kolmanneksen aikana, on kehittynyt komplikaatioita, jotka vaativat pitkäaikaista sairaalahoitoa, hengitystukea ja letkuruokintaa. Tällaiset komplikaatiot voivat ilmaantua heti synnytyksen jälkeen. Raportoituja kliinisiä löydöksiä ovat olleet hengitysvaikeudet, syanoosi, apnea, kohtaukset, lämpötilan epävakaus, ruokintavaikeudet, oksentelu, hypoglykemia, hypotonia, hypertonia, hyperrefleksia, vapina, hermostuneisuus, ärtyneisyys ja jatkuva itku. Nämä löydökset ovat yhdenmukaisia joko SNRI- tai SSRI-lääkkeiden suoran toksisen vaikutuksen tai mahdollisesti lääkkeen lopettamisen oireyhtymän kanssa. On huomattava, että joissakin tapauksissa kliininen kuva on yhdenmukainen serotoniinioireyhtymän kanssa [katso VAROITUKSET JA VAROTOIMET ].
Data
Ihmistiedot
Markkinoille tulon jälkeen tehdyn retrospektiivisen väitteisiin perustuvan kohorttitutkimuksen tiedot havaitsivat lisääntyneen synnytyksen jälkeisen verenvuodon riskin 955 raskaana olevalla naisella, jotka olivat altistuneet duloksetiinille viimeisenä raskauskuukautena, verrattuna 4 128 460:een altistumattomaan raskaana olevaan naiseen (oikaistu suhteellinen riski: 1,53; 95 % CI: 1,08-2,18). ). Samassa tutkimuksessa ei havaittu kliinisesti merkittävää lisäystä vakavien synnynnäisten epämuodostumien riskissä, kun verrattiin 2 532 naista, jotka olivat altistuneet duloksetiinille ensimmäisen raskauskolmanneksen aikana, ja 1 284 827 altistumatonta naista useiden hämmennysten vuoksi. Metodologisia rajoituksia ovat mahdolliset jäännössekoitukset, altistumisen ja tulosten virheellinen luokittelu, taudin vakavuuden suorien mittareiden puuttuminen sekä tiedon puute alkoholin käytöstä, ravitsemuksesta ja käsikauppalääkkeistä altistumisesta.
Eläinten tiedot
Eläinten lisääntymistutkimuksissa duloksetiinilla on osoitettu olevan haitallisia vaikutuksia alkion/sikiön ja postnataaliseen kehitykseen.
Kun duloksetiinia annettiin suun kautta tiineille rotille ja kaneille organogeneesin aikana, ei havaittu epämuodostumia tai kehitysvaihteluita annoksilla 45 mg/kg/vrk asti [3 ja 6 kertaa MRHD 120 mg/vrk. annetaan nuorille mg/m2 perusteella]. Sikiön paino kuitenkin pieneni tällä annoksella, ja vaikutuston annos oli 10 mg/kg/vrk (suunnilleen yhtä suuri kuin MRHD rotilla ja 2 kertaa MRHD kaneilla).
Kun duloksetiinia annettiin suun kautta raskaana oleville rotille koko tiineyden ja imetyksen ajan, pentujen eloonjääminen 1 päivää synnytyksen jälkeen ja pentujen ruumiinpainot syntyessään ja imetyksen aikana vähenivät annoksella 30 mg/kg/vrk (2 kertaa MRHD annettu). nuorille mg/m2 perusteella); vaikutuston annos oli 10 mg/kg/vrk. Lisäksi pennuilla havaittiin lisääntynyttä reaktiivisuutta vastaavaa käyttäytymistä, kuten lisääntynyt hätkähdysvaste melulle ja vähentynyt tottuminen liikkumiseen, kun emo altistui annokselle 30 mg/kg/vrk. Äidin duloksetiinihoito ei vaikuttanut haitallisesti jälkeläisten vieroituksen jälkeiseen kasvuun ja lisääntymiskykyyn.
Imetys
Riskien yhteenveto
Julkaistun kirjallisuuden tiedot kertovat duloksetiinin esiintymisestä äidinmaidossa (ks Data ). On raportoitu sedaatiota, huonoa ruokintaa ja huonoa painonnousua imeväisillä, jotka ovat altistuneet duloksetiinille rintamaidon kautta (ks. Kliiniset näkökohdat ). Duloksetiinin vaikutuksesta maidontuotantoon ei ole tietoa.
Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon sekä äidin kliininen CYMBALTA-tarve ja mahdolliset haitalliset vaikutukset CYMBALTAsta imetettävään lapseen tai äidin taustalla olevasta tilasta.
Kliiniset näkökohdat
CYMBALTA-valmisteelle altistuneita imeväisiä tulee seurata sedaation, huonon ruokinnan ja vähäisen painonnousun varalta.
Data
CYMBALTA 60 mg:n jakautumista tutkittiin kuudella imettävällä naisella, jotka olivat vähintään 12 viikkoa synnytyksen jälkeen ja olivat päättäneet vieroittaa lapsensa. Naisille annettiin 40 mg CYMBALTA 60 mg kahdesti vuorokaudessa 3,5 päivän ajan. Äidinmaidosta mitattu huippupitoisuus saavutettiin keskimäärin 3 tunnin kuluttua annoksesta. CYMBALTA:n määrä äidinmaidossa oli noin 7 mikrog/vrk tämän annoksen aikana; arvioitu vuorokausiannos vauvalle oli noin 2 mikrog/kg/vrk, mikä on alle 1 % äidin annoksesta. CYMBALTA 40 mg:n metaboliittien esiintymistä äidinmaidossa ei tutkittu.
Käyttö lapsille
CYMBALTA 60 mg:n turvallisuus ja tehokkuus on osoitettu yleistyneen ahdistuneisuushäiriön (GAD) hoidossa 7–17-vuotiailla potilailla ja juveniilin fibromyalgiaoireyhtymän hoidossa 13–17-vuotiailla potilailla. CYMBALTA 20 mg:n turvallisuutta ja tehoa ei ole osoitettu lapsipotilailla, joilla on vakava masennushäiriö (MDD), diabeettinen perifeerinen neuropaattinen kipu tai krooninen tuki- ja liikuntaelinkipu.
Masennuslääkkeet lisäsivät itsemurha-ajatusten ja -käyttäytymisen riskiä lapsipotilailla. Tarkkaile kaikkia masennuslääkkeitä saavia lapsipotilaita kliinisen pahenemisen ja itsemurha-ajatusten ja -käyttäytymisen varalta, erityisesti hoidon ensimmäisten kuukausien aikana tai annosmuutosten yhteydessä [ks. VAROITUKSET JA VAROTOIMET ]. Suorita säännöllinen painon ja kasvun seuranta CYMBALTA-hoitoa saavilla lapsipotilailla [katso HAITTAVAIKUTUKSET ].
Yleistynyt ahdistuneisuushäiriö
CYMBALTA:n käyttöä GAD:n hoitoon 7–17-vuotiailla potilailla tukee yksi 10 viikon lumekontrolloitu tutkimus (GAD-6). Tutkimukseen osallistui 272 GAD-potilasta, joista 47 % oli 7–11-vuotiaita (53 % 12–17-vuotiaita). CYMBALTA osoitti parempana lumelääkkeeseen verrattuna GAD-vakavuuspisteiden parantumisena lasten ahdistuneisuusluokitusasteikossa (PARS) [ks. Kliiniset tutkimukset ].
CYMBALTA 20 mg:n turvallisuutta ja tehokkuutta GAD:n hoidossa alle 7-vuotiailla lapsipotilailla ei ole osoitettu.
Fibromyalgia
CYMBALTA:n käyttöä fibromyalgian hoitoon 13–17-vuotiailla potilailla tukee 13 viikkoa kestänyt lumekontrolloitu tutkimus 184 potilaalla, joilla oli juveniili fibromyalgiaoireyhtymä (tutkimus FM-4). CYMBALTA osoitti parannusta lumelääkkeeseen verrattuna ensisijaisessa päätetapahtumassa, muutos lähtötilanteesta hoidon loppuun Brief Pain Inventoryssa (BPI) – Modified Short Form: Adolescent Version 24 tunnin keskimääräinen kivun vaikeusaste [ks. Kliiniset tutkimukset ].
CYMBALTA:n turvallisuutta ja tehokkuutta fibromyalgian hoidossa alle 13-vuotiailla potilailla ei ole osoitettu.
Masennustila
CYMBALTA:n turvallisuutta ja tehokkuutta ei ole osoitettu lapsipotilailla MDD:n hoidossa.
CYMBALTA:n tehoa ei osoitettu kahdessa 10 viikon lumekontrolloidussa tutkimuksessa, johon osallistui 800 7–17-vuotiasta MDD-potilasta (MDD-6 ja MDD-7). CYMBALTA tai aktiivinen kontrolli (hyväksytty lasten MDD:n hoitoon) eivät olleet parempia kuin lumelääke.
MDD-lapsipotilaiden kliinisissä tutkimuksissa yleisimmin havaittuja haittavaikutuksia olivat pahoinvointi, päänsärky, painon lasku ja vatsakipu. Vähentynyttä ruokahalua ja painon laskua on havaittu SSRI- ja SNRI-lääkkeiden käytön yhteydessä.
Nuorten eläinten toksikologiset tiedot
Duloksetiinin antaminen nuorille rotille synnytyksen jälkeisestä päivästä 21 (vieroitus) syntymän jälkeiseen päivään 90 (aikuinen) johti painon laskuun, joka säilyi aikuisikään asti, mutta palautui, kun lääkehoito lopetettiin; hieman viivästynyt (noin 1,5 päivää) seksuaalinen kypsyminen naisilla ilman vaikutusta hedelmällisyyteen; ja viivästyminen monimutkaisen tehtävän oppimisessa aikuisiässä, mitä ei havaittu huumehoidon lopettamisen jälkeen. Näitä vaikutuksia havaittiin suurella annoksella 45 mg/kg/vrk (2 kertaa MRHD, lapselle); vaikutukseton taso oli 20 mg/kg/vrk (≈1 kertaa MRHD, lapselle).
Geriatrinen käyttö
Geriatrinen altistuminen CYMBALTA:n markkinointia edeltävissä kliinisissä tutkimuksissa
- MDD-tutkimusten 2 418 potilaasta 6 % (143) oli 65-vuotiaita tai vanhempia.
- CLBP-tutkimuksissa olleista 1041 potilaasta 21 % (221) oli 65-vuotiaita tai vanhempia.
- OA-tutkimuksissa 487 potilaasta 41 % (197) oli 65-vuotiaita tai vanhempia.
- DPNP-tutkimuksiin osallistuneista 1 074 potilaasta 33 % (357) oli 65-vuotiaita tai vanhempia.
- FM-tutkimuksissa olleista 1 761 potilaasta 8 % (140) oli 65-vuotiaita tai vanhempia.
MDD-, GAD-, DPNP-, FM-, OA- ja CLBP-tutkimuksissa näiden potilaiden ja nuorempien aikuisten potilaiden välillä ei yleensä havaittu yleisiä eroja turvallisuudessa tai tehokkuudessa, ja muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja vasteissa näiden geriatristen ja nuorempien välillä. aikuispotilailla, mutta joidenkin iäkkäiden potilaiden suurempaa herkkyyttä ei voida sulkea pois.
SSRI:t ja SNRI:t, mukaan lukien CYMBALTA, on yhdistetty kliinisesti merkittävään hyponatremiaan iäkkäillä potilailla, joilla saattaa olla suurempi riski saada tämä haittavaikutus [ks. VAROITUKSET JA VAROTOIMET ].
Kaikista lumekontrolloiduista tutkimuksista saatujen tietojen analyysissä CYMBALTA-hoitoa saaneet potilaat ilmoittivat suuremman putoamisnopeuden lumelääkettä saaneisiin potilaisiin verrattuna. Suurentunut riski näyttää olevan verrannollinen potilaan taustalla olevaan kaatumisriskiin. Taustalla oleva riski näyttää kasvavan tasaisesti iän myötä. Koska iäkkäillä potilailla on yleensä korkeampi kaatumisriskitekijöiden, kuten lääkkeiden, lääketieteellisten sairauksien ja kävelyhäiriöiden, esiintyvyys, iän nousun vaikutus sinänsä CYMBALTA 30 mg -hoidon kaatumisiin on epäselvä. CYMBALTAn käytön yhteydessä on raportoitu kaatumisia, joilla on vakavia seurauksia, mukaan lukien luunmurtumia ja sairaalahoitoja [ks. VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSET ].
Duloksetiinin farmakokinetiikkaa 40 mg:n kerta-annoksen jälkeen verrattiin terveillä iäkkäillä naisilla (65-77-vuotiaat) ja terveillä keski-ikäisillä naisilla (32-50-vuotiaat). Cmax-arvossa ei ollut eroa, mutta duloksetiinin AUC oli jonkin verran (noin 25 %) korkeampi ja puoliintumisaika noin 4 tuntia pidempi iäkkäillä naisilla. Populaatiofarmakokineettiset analyysit viittaavat siihen, että tyypilliset puhdistumaarvot laskevat noin 1 % jokaista ikää kohden 25-75 vuoden iässä; mutta ikä ennustavana tekijänä vastaa vain pienen prosenttiosuuden potilaiden välisestä vaihtelusta. Annoksen muuttaminen aikuisen potilaan iän perusteella ei ole tarpeen.
Sukupuoli
Duloksetiinin puoliintumisaika on sama miehillä ja naisilla. Annosta ei tarvitse muuttaa sukupuolen mukaan.
Tupakointitila
Duloksetiinin hyötyosuus (AUC) näyttää pienenevän noin kolmanneksella tupakoitsijoilla. Annoksen muuttamista ei suositella tupakoitsijoille.
Rotu
Erityistä farmakokineettistä tutkimusta ei ole tehty rodun vaikutusten tutkimiseksi.
Maksan vajaatoiminta
Potilailla, joilla on kliinisesti ilmeinen maksan vajaatoiminta, duloksetiinin metabolia ja eliminaatio on heikentynyt. 20 mg:n kerta-annoksen 20 mg CYMBALTA-annoksen jälkeen kuudella maksakirroosipotilaalla, joilla oli kohtalainen maksan vajaatoiminta (Child-Pugh-luokka B), keskimääräinen plasman duloksetiinipuhdistuma oli noin 15 % iän ja sukupuolen kanssa samankaltaisten terveiden koehenkilöiden puhdistumasta, mikä oli 5-kertainen. keskimääräisessä altistuksessa (AUC). Vaikka Cmax oli samanlainen kuin normaalit kirroosipotilailla, puoliintumisaika oli noin 3 kertaa pidempi [ks. ANNOSTELU JA HALLINNOINTI ja VAROITUKSET JA VAROTOIMET ].
Vaikea munuaisten vajaatoiminta
CYMBALTA 40 mg:n vaikutuksista potilailla, joilla on loppuvaiheen munuaissairaus (ESRD), on saatavilla rajoitetusti tietoa. CYMBALTA 20 mg:n 60 mg:n kerta-annoksen jälkeen Cmax- ja AUC-arvot olivat noin 100 % suuremmat kroonista ajoittaista hemodialyysihoitoa saavilla ESRD-potilailla kuin potilailla, joiden munuaistoiminta oli normaali. Eliminaation puoliintumisaika oli kuitenkin samanlainen molemmissa ryhmissä. Tärkeimpien verenkierrossa olevien metaboliittien, 4-hydroksiduloksetiiniglukuronidin ja 5-hydroksi-6-metoksiduloksetiinisulfaatin, suurelta osin virtsaan erittyneiden AUC-arvot olivat noin 7-9 kertaa suuremmat, ja niiden odotetaan nousevan edelleen toistuvilla annoksilla. Populaatio-PK-analyysit viittaavat siihen, että lievä tai kohtalainen munuaisten vajaatoiminta (arvioitu CrCl 30-80 ml/min) ei vaikuta merkittävästi duloksetiinin näennäiseen puhdistumaan [ks. ANNOSTELU JA HALLINNOINTI ja VAROITUKSET JA VAROTOIMET ].
YLIANNOSTUS
Merkit ja oireet
Markkinoille tulon jälkeen on raportoitu kuolemaan johtaneita seurauksia akuuteissa CYMBALTA 60 mg:n yliannostuksissa, pääasiassa yliannostuksissa, mutta myös vain CYMBALTA 20 mg, mukaan lukien 1000 mg CYMBALTA (noin 8,3 kertaa suositeltu enimmäisannos). Yliannostuksen merkkejä ja oireita (CYMBALTA yksinään tai yhdessä lääkkeiden kanssa) olivat uneliaisuus, kooma, serotoniinioireyhtymä, kouristukset, pyörtyminen, takykardia, hypotensio, verenpainetauti ja oksentelu.
Yliannostuksen hallinta
CYMBALTA 60 mg:n yliannostukselle ei ole spesifistä vastalääkettä, mutta jos serotoniinioireyhtymä ilmenee, spesifistä hoitoa (kuten syproheptadiinilla ja/tai lämpötilan säätelyllä) voidaan harkita.
CYMBALTA 30 mg:n akuutin yliannostuksen yhteydessä hoidon tulee koostua yleisistä toimenpiteistä, joita käytetään minkä tahansa lääkkeen yliannostuksen hallintaan, kuten riittävien hengitysteiden, hapetuksen ja ventilaation varmistaminen sekä sydämen rytmin ja elintoimintojen seuranta. Mahahuuhtelu laajareikäisellä, sopivalla hengitysteitä suojaavalla letkulla voi tarvittaessa olla aiheellista, jos se suoritetaan pian nielemisen jälkeen tai potilaille, joilla on oireita. Oksentamisen aiheuttamista ei suositella.
Aktiivihiili voi olla hyödyllinen rajoittamaan duloksetiinin imeytymistä maha-suolikanavasta. Aktiivihiilen antamisen on osoitettu pienentävän duloksetiinin AUC- ja Cmax-arvoja keskimäärin kolmanneksella, vaikka joillakin potilailla aktiivihiilen vaikutus oli rajallinen. Duloksetiinin suuresta jakautumistilavuudesta johtuen pakotetusta diureesista, dialyysistä, hemoperfuusiosta ja verensiirrosta ei todennäköisesti ole hyötyä.
Yliannostuksen hallinnassa tulee ottaa huomioon useiden lääkkeiden vaikutus. Erityistä varovaisuutta on noudatettava potilailla, jotka yliannostivat CYMBALTA 60 mg:n ja trisyklisten masennuslääkkeiden kanssa. Tällaisessa tapauksessa trisyklisen lähtöaineen ja/tai sen aktiivisen metaboliitin vähentynyt puhdistuma voi lisätä kliinisesti merkittävien seurausten mahdollisuutta ja pidentää tarkkaan lääketieteelliseen seurantaan tarvittavaa aikaa [ks. VAROITUKSET JA VAROTOIMET ja HUUMEIDEN VUOROVAIKUTUKSET ].
Harkitse yhteydenottoa myrkytystietokeskukseen (1-800-222-1222 tai www.poison.org) saadaksesi lisätietoja yliannostuksen hoidosta.
VASTA-AIHEET
Psykiatristen häiriöiden hoitoon tarkoitettujen MAO-estäjien käyttö CYMBALTA 40 mg:lla tai 5 päivän sisällä CYMBALTA-hoidon lopettamisesta on vasta-aiheista, koska se lisää serotoniinioireyhtymän riskiä. CYMBALTA:n käyttö 14 päivän sisällä psykiatristen häiriöiden hoitoon tarkoitetun MAO-estäjän käytön lopettamisesta on vasta-aiheista [ks. ANNOSTELU JA HALLINNOINTI ja VAROITUKSET JA VAROTOIMET ].
CYMBALTA 30 mg:n aloittaminen potilaalla, jota hoidetaan MAO-estäjillä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä, on myös vasta-aiheista, koska serotoniinioireyhtymän riski on lisääntynyt (ks. ANNOSTELU JA HALLINNOINTI ja VAROITUKSET JA VAROTOIMET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Vaikka duloksetiinin masennuslääkkeen, sentraalisen kipua estävän ja ahdistusta lievittävän vaikutuksen tarkkaa mekanismeja ihmisillä ei tunneta, näiden vaikutusten uskotaan liittyvän sen serotonergisen ja noradrenergisen aktiivisuuden voimistamiseen keskushermostossa.
Farmakodynamiikka
Prekliiniset tutkimukset ovat osoittaneet, että duloksetiini on voimakas hermosolujen serotoniinin ja norepinefriinin takaisinoton estäjä ja vähemmän tehokas dopamiinin takaisinoton estäjä. Duloksetiinilla ei ole merkittävää affiniteettia dopaminergisiin, adrenergisiin, kolinergisiin, histaminergisiin, opioidi-, glutamaatti- ja GABA-reseptoreihin in vitro. Duloksetiini ei estä monoamiinioksidaasia (MAO).
CYMBALTA kuuluu lääkeluokkaan, jonka tiedetään vaikuttavan virtsaputken resistenssiin [katso VAROITUKSET JA VAROTOIMET ].
Sydämen elektrofysiologia
CYMBALTA 160 mg ja 200 mg kahdesti vuorokaudessa (2,7 ja 3,3 kertaa suositeltu enimmäisannos) vakaan tilan vaikutusta vakaaseen tilaan arvioitiin satunnaistetussa, kaksoissokkoutetussa, kaksisuuntaisessa ristikkäistutkimuksessa, johon osallistui 117 tervettä aikuista naista. QT-ajan pidentymistä ei havaittu. CYMBALTA 40 mg näyttää liittyvän pitoisuudesta riippuvaiseen, mutta ei kliinisesti merkittävään QT-lyhenemiseen.
Farmakokinetiikka
Duloksetiinin eliminaation puoliintumisaika on noin 12 tuntia (vaihteluväli 8–17 tuntia), ja sen farmakokinetiikka on suhteessa annokseen terapeuttisella alueella. Vakaan tilan plasmapitoisuudet saavutetaan tyypillisesti 3 päivän annostelun jälkeen. Duloksetiini eliminoituu pääasiassa maksassa tapahtuvan metabolian kautta, johon osallistuu kaksi P450-isoentsyymiä, CYP1A2 ja CYP2D6.
Imeytyminen
Suun kautta annetun CYMBALTA 30 mg:n annon jälkeen duloksetiinihydrokloridi imeytyy hyvin. Imeytymisen alkamiseen (Tlag) on mediaani 2 tunnin viive, ja duloksetiinin maksimipitoisuudet plasmassa (Cmax) saavutetaan 6 tuntia annoksen jälkeen. Iltaannoksen jälkeen duloksetiinin imeytyminen viivästyy 3 tuntia ja näennäinen puhdistuma lisääntyy kolmanneksella aamuannokseen verrattuna.
Ruoan vaikutus
Ruoka ei vaikuta duloksetiinin Cmax-arvoon, mutta viivästyttää huippupitoisuuden saavuttamiseen kuluvaa aikaa 6:sta 10 tuntiin ja pienentää imeytymisen laajuutta (AUC) marginaalisesti noin 10 %.
Jakelu
Näennäinen jakautumistilavuus on keskimäärin noin 1640 l. Duloksetiini sitoutuu voimakkaasti (>90 %) ihmisen plasman proteiineihin ja sitoutuu ensisijaisesti albumiiniin ja happamaan α1-glykoproteiiniin. Duloksetiinin ja muiden voimakkaasti proteiineihin sitoutuvien lääkkeiden välistä yhteisvaikutusta ei ole täysin arvioitu. Munuaisten tai maksan vajaatoiminta ei vaikuta duloksetiinin sitoutumiseen plasman proteiineihin.
Eliminointi
Aineenvaihdunta
Duloksetiinin biotransformaatio ja jakautuminen ihmisillä on määritetty 14C-leimatun duloksetiinin oraalisen annon jälkeen. Duloksetiini muodostaa noin 3 % plasman radioaktiivisesti leimatusta materiaalista, mikä osoittaa, että se metaboloituu laajasti useiksi metaboliiteiksi. Duloksetiinin tärkeimpiin biotransformaatioreitteihin kuuluu naftyylirenkaan hapettuminen, jota seuraa konjugaatio ja lisähapetus. Sekä CYP1A2 että CYP2D6 katalysoivat naftyylirenkaan hapettumista in vitro. Plasmasta löydettyjä aineenvaihduntatuotteita ovat 4-hydroksiduloksetiiniglukuronidi ja 5-hydroksi-6-metoksiduloksetiinisulfaatti.
Erittyminen
Virtsasta on tunnistettu monia muita metaboliitteja, joista osa edustaa vain vähäisiä eliminaatioreittejä. Virtsassa on vain pieniä määriä (
Tietyt populaatiot
Pediatriset potilaat
Duloksetiinin vakaan tilan pitoisuus plasmassa oli verrattavissa 7–17-vuotiailla lapsipotilailla ja aikuispotilailla. Keskimääräinen vakaan tilan duloksetiinipitoisuus oli noin 30 % pienempi tässä lapsiryhmässä aikuispotilaisiin verrattuna. Mallin mukaan ennustetut duloksetiinin vakaan tilan plasmapitoisuudet 7–17-vuotiailla lapsipotilailla olivat enimmäkseen aikuispotilailla havaittujen pitoisuuksien alueella eivätkä ylittäneet aikuisten pitoisuuksia.
Kliiniset tutkimukset
Yleiskatsaus kliinisistä kokeista
CYMBALTA 60 mg:n teho on osoitettu seuraavissa populaatioissa riittävillä ja hyvin kontrolloiduilla tutkimuksilla:
Vakava masennushäiriö (MDD)
4 lyhytaikaista (tutkimukset MDD-1, MDD-2, MDD-3 ja MDD-4) ja 1 ylläpitokoe (tutkimus MDD-5) aikuisilla [ks. Vakava masennushäiriö aikuisilla ].
Yleistynyt ahdistuneisuushäiriö (GAD)
3 lyhytaikaista tutkimusta aikuisilla (tutkimukset GAD-1, GAD-2 ja GAD-3), 1 ylläpitotutkimus aikuisilla (tutkimus GAD-4), 1 lyhytaikainen tutkimus iäkkäillä potilailla (tutkimus GAD-5), ja yksi lyhytaikainen tutkimus 7–17-vuotiailla lapsipotilailla (tutkimus GAD-6) [ks. Yleistynyt ahdistuneisuushäiriö ].
Diabeettinen perifeerinen neuropaattinen kipu (DPNP)
Kaksi 12 viikon koetta aikuisilla (tutkimukset DPNP-1 ja DPNP-2) [ks. Diabeettinen perifeerinen neuropaattinen kipu aikuisilla ].
Fibromyalgia (FM)
Kaksi aikuisten tutkimusta (yksi 3 kuukauden ja toinen 6 kuukauden mittainen) (tutkimukset FM-1 ja FM-2) ja yksi 13 viikon tutkimus 13–17-vuotiailla lapsipotilailla (tutkimus FM-4) [ks. Fibromyalgia ].
Krooninen tuki- ja liikuntaelinten kipu
Kaksi 12–13 viikkoa kestävää tutkimusta aikuispotilailla, joilla on krooninen alaselän kipu (CLBP) (tutkimukset CLBP-1 ja CLBP-3) ja yksi 13 viikon tutkimus aikuispotilailla, joilla oli krooninen nivelrikon aiheuttama kipu (OA) (tutkimus OA). -1) [katso Krooninen tuki- ja liikuntaelinten kipu aikuisilla ].
Lisäksi alla on yhteenveto seuraavista tutkimuksista, jotka eivät osoittaneet tehoa: Tutkimus FM-3 (16 viikon tutkimus aikuisilla fibromyalgiapotilailla), tutkimus CLBP-2 (13 viikon tutkimus aikuisilla CLBP-potilailla) ja Tutkimus OA-2 (13 viikkoa kestänyt tutkimus aikuispotilailla, joilla oli krooninen OA-kipu).
Vakava masennushäiriö aikuisilla
CYMBALTA:n teho MDD:n hoidossa aikuisilla varmistettiin neljässä satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa, kiinteäannoksisessa tutkimuksessa aikuisilla avohoitopotilailla (18–83-vuotiaat), jotka täyttävät DSM-IV:n MDD-kriteerit:
- Tutkimuksissa MDD-1 ja MDD-2 potilaat satunnaistettiin saamaan CYMBALTA 60 mg kerran vuorokaudessa (N=123 ja N=128) tai lumelääkettä (vastaavasti N=122 ja N=139) 9 viikon ajan.
- Tutkimuksessa MDD-3 potilaat satunnaistettiin saamaan CYMBALTA 20 tai 40 mg kahdesti vuorokaudessa (N=86 ja N=91) tai lumelääkettä (N=89) 8 viikon ajan.
- Tutkimuksessa MDD-4 potilaat satunnaistettiin saamaan CYMBALTAa 40 tai 60 mg kahdesti vuorokaudessa (N=95 ja N=93) tai lumelääkettä (N=93) 8 viikon ajan.
Kaikissa neljässä tutkimuksessa CYMBALTA 40 mg osoitti parempia kuin lumelääke mitattuna 17-pisteisen Hamilton Depression Rating Scalen (HAMD-17) kokonaispistemäärän paranemisena (katso ). Ei ole näyttöä siitä, että yli 60 mg/vrk annoksilla olisi lisähyötyjä.
Kaikissa näissä kliinisissä tutkimuksissa hoidon lopputuloksen ja iän, sukupuolen ja rodun välistä suhdetta koskevat analyysit eivät osoittaneet mitään eroavaa vastetta näiden potilaan ominaisuuksien perusteella.
Tutkimus MDD-1 CYMBALTA (60 mg/vrk)b Plasebo 21,5 (4,10) 21,1 (3,71) -10,9 (0,70) -6,1 (0,69) -4,9 (-6,8, -2,9) --
Tutkimuksessa MDD-5 533 aikuispotilasta, jotka täyttivät MDD:n DSM-IV-kriteerit, sai CYMBALTAa 60 mg kerran vuorokaudessa ensimmäisen 12 viikon avoimen hoitovaiheen aikana. Kaksisataaseitsemänkymmentäkahdeksan potilasta, jotka reagoivat avoimeen hoitoon [määritelty täyttävän seuraavat kriteerit viikoilla 10 ja 12: HAMD-17 kokonaispistemäärä ≤ 9, kliiniset maailmanlaajuiset vaikeusvaikutelmat (CGI-S) ≤2, eikä jotka täyttivät DSM-IV:n MDD-kriteerit], jaettiin satunnaisesti jatkamaan CYMBALTA-hoitoa samalla annoksella (N=136) tai lumelääkettä (N=142) kuuden kuukauden ajan.
Tutkimuksessa MDD-5 CYMBALTA-potilailla oli tilastollisesti merkitsevästi pidempi aika masennuksen uusiutumiseen kuin lumelääkettä saaneilla potilailla (ks. Kuvio 1 ). Relapsi määriteltiin CGI-S-pisteiden nousuksi ≥ 2 pisteellä verrattuna viikolla 12 saatuun arvoon sekä DSM-IV-kriteerien täyttymiseen MDD:lle kahdella peräkkäisellä käynnillä vähintään 2 viikon välein, kun 2 viikon välein ajallinen kriteeri oli täytettävä vasta toisella käynnillä.
Kuva 1: MDD-relapsia sairastavien aikuispotilaiden kumulatiivinen osuus (tutkimus MDD-5)
Yleistynyt ahdistuneisuushäiriö
GAD-tutkimukset aikuisilla (mukaan lukien iäkkäät potilaat)
CYMBALTA 20 mg:n teho yleistyneen ahdistuneisuushäiriön (GAD) hoidossa vahvistettiin 1 kiinteän annoksen satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa ja kahdessa joustavan annoksen satunnaistetussa, kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa aikuisilla avohoitopotilailla. 18–83-vuotiaat, jotka täyttävät GAD:n DSM-IV-kriteerit (tutkimukset GAD-1, GAD-2 ja GAD-3).
Tutkimuksissa GAD-1 ja GAD-2 aloitusannos oli 60 mg kerran vuorokaudessa (titraus 30 mg:aan kerran vuorokaudessa sallittiin siedettävyyden vuoksi; annosta voitiin nostaa 60 mg:aan kerran vuorokaudessa). Viisitoista prosenttia potilaista oli titrattu alaspäin. Tutkimuksen GAD-3 aloitusannos oli 30 mg kerran vuorokaudessa 1 viikon ajan ennen kuin se nostettiin 60 mg:aan kerran päivässä.
GAD-2- ja GAD-3-tutkimuksissa annostitrattiin CYMBALTA-annoksilla 60 mg:sta kerran vuorokaudessa 120 mg:aan kerran vuorokaudessa (N=168 ja N=162) verrattuna lumelääkkeeseen (N=159 ja N=161) 10-vuotiaana. viikon hoitojakso. Keskimääräinen annos päätökseen saaneille oli näiden tutkimusten päätepisteessä 104,8 mg/vrk. GAD-1-tutkimuksessa arvioitiin CYMBALTA 60 mg:n annoksia 60 mg kerran vuorokaudessa (N=168) ja 120 mg kerran vuorokaudessa (N=170) verrattuna lumelääkkeeseen (N=175) 9 viikon hoitojakson aikana. Vaikka 120 mg:n vuorokausiannos osoittautui tehokkaaksi, ei ole näyttöä siitä, että yli 60 mg:n vuorokausiannos tuottaisi lisähyötyä.
Kaikissa kolmessa tutkimuksessa CYMBALTA osoitti parempana lumelääkkeeseen verrattuna Hamiltonin ahdistusasteikon (HAM-A) kokonaispistemäärän (katso ) ja Sheehanin vammaisuusasteikon (SDS) maailmanlaajuisen toimintahäiriöpisteen parantuneena. SDS on yhdistelmämittaus siitä, missä määrin emotionaaliset oireet häiritsevät potilaan toimintaa kolmella elämänalueella: työ/koulu, sosiaalinen elämä/vapaa-aika ja perhe-/kotivastuut.
GAD-4-tutkimuksessa 887 potilasta, jotka täyttivät GAD:n DSM-IV-TR-kriteerit, saivat CYMBALTAa 60–120 mg kerran vuorokaudessa ensimmäisen 26 viikon avoimen hoitovaiheen aikana. Neljäsataakaksikymmentäyhdeksän potilasta, jotka reagoivat avoimeen hoitoon [määritelty täyttävän seuraavat kriteerit viikoilla 24 ja 26: lasku lähtötason HAM-A-kokonaispistemäärästä vähintään 50 % arvoon, joka on enintään 11, ja CGI-Improvement (Clinical Global Impressions of Improvement) -pistemäärä 1 tai 2] jaettiin satunnaisesti CYMBALTA 30 mg:n jatkamiseen samalla annoksella (N=216) tai lumelääkkeeseen (N=213), ja havaittiin uusiutumista. Satunnaistetuista potilaista 73 %:lla oli ollut hoitovaste vähintään 10 viikkoa. Relapsi määriteltiin CGI-vakavuuspisteiden nousuksi vähintään 2 pisteellä arvoon ≥ 4 ja GAD:n MINI-diagnoosiksi (Mini-International Neuropsychiatric Interview) (pois lukien kesto) tai hoidon lopettamiseksi tehon puutteen vuoksi. CYMBALTAa saaneilla potilailla oli tilastollisesti merkitsevästi pidempi aika GAD:n uusiutumiseen kuin lumelääkettä saaneilla potilailla (ks. Kuva 2 ).
Alaryhmäanalyysit eivät osoittaneet, että hoitotuloksissa olisi eroja iän tai sukupuolen mukaan.
GAD-tutkimus iäkkäillä potilailla
CYMBALTA:n teho ≥ 65-vuotiaiden GAD-potilaiden hoidossa vahvistettiin yhdessä 10 viikon joustavan annoksen, satunnaistetussa, kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa DSM-IV-kriteerit täyttävillä ≥ 65-vuotiailla aikuisilla. GAD:lle (tutkimus GAD-5). GAD-5-tutkimuksessa aloitusannos oli 30 mg kerran vuorokaudessa 2 viikon ajan, ennen kuin annoksen lisäkorotukset 30 mg:lla hoitoviikoilla 2, 4 ja 7 sallittiin aina 120 mg:aan kerran vuorokaudessa tutkijan kliinisen vasteen arvioinnin perusteella. siedettävyyttä. Keskimääräinen annos potilaille, jotka olivat saaneet päätökseen 10 viikon akuutin hoitovaiheen, oli 51 mg. CYMBALTAlla hoidetuilla potilailla (N=151) havaittiin merkitsevästi suurempaa parannusta lumelääkkeeseen verrattuna (N=140) keskimääräisessä muutoksessa lähtötasosta päätepisteeseen mitattuna HAM-A-kokonaispisteillä (katso ).
GAD-koe 7–17-vuotiailla lapsipotilailla
CYMBALTA:n teho 7–17-vuotiaiden GAD-potilaiden hoidossa vahvistettiin 1 joustavaannoksiin perustuvassa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa avohoitopotilailla, joilla oli GAD (DSM-IV-kriteerien perusteella) (tutkimus). GAD-6).
GAD-6-tutkimuksessa aloitusannos oli 30 mg kerran päivässä 2 viikon ajan. Annoksen lisäkorotukset 30 mg:lla aina 120 mg:aan kerran vuorokaudessa sallittiin tutkijan kliinisen vasteen ja siedettävyyden arvioinnin perusteella. Keskimääräinen annos potilaille, jotka päättivät 10 viikon hoitovaiheen, oli 57,6 mg/vrk. Tässä tutkimuksessa CYMBALTA (N=135) osoitti parempia kuin lumelääke (N=137) lähtötasosta päätepisteeseen mitattuna GAD-vakavuuspisteiden parantumisena lasten ahdistuneisuusluokitusasteikossa (PARS) (katso ).
Kuva 2: GAD-relapsia sairastavien aikuispotilaiden kumulatiivinen osuus (tutkimus GAD-4)
Diabeettinen perifeerinen neuropaattinen kipu aikuisilla
CYMBALTA 30 mg:n teho diabeettiseen perifeeriseen neuropatiaan liittyvän neuropaattisen kivun hoidossa aikuisilla vahvistettiin kahdessa satunnaistetussa, 12 viikkoa kestäneessä kaksoissokkoutetussa lumekontrolloidussa kiinteäannoksisessa tutkimuksessa aikuispotilailla, joilla oli diabeettista perifeeristä neuropaattista kipua (DPNP) ) vähintään 6 kuukauden ajan (tutkimus DPNP-1 ja tutkimus DPNP-2). Näihin tutkimuksiin osallistui yhteensä 791 potilasta, joista 592 (75 %) suoritti kokeet. Mukaan otetuilla potilailla oli tyypin I tai II diabetes mellitus, jolla oli diagnosoitu kivulias distaalinen symmetrinen sensorimotorinen polyneuropatia vähintään 6 kuukauden ajan. Potilaiden lähtötilanteen kipupisteet olivat ≥ 4 11 pisteen asteikolla välillä 0 (ei kipua) 10:een (pahin mahdollinen kipu). Potilaat saivat CYMBALTA-valmisteen lisäksi 4 grammaa asetaminofeenia päivässä tarpeen mukaan kivun hoitoon. Potilaat kirjasivat kipunsa päivittäin päiväkirjaan.
Molemmissa tutkimuksissa verrattiin CYMBALTAa 60 mg kerran vuorokaudessa tai 60 mg kahdesti vuorokaudessa lumelääkkeeseen. Tutkimuksessa DPNP-1 verrattiin lisäksi CYMBALTA 20 mg:aa lumelääkkeeseen. Yhteensä 457 potilasta (342 CYMBALTA, 115 lumelääkettä) otettiin mukaan tutkimukseen DPNP-1 ja yhteensä 334 potilasta (226 CYMBALTA, 108 lumelääkettä) tutkimukseen DPNP-2.
Hoito CYMBALTA 60 mg:lla kerran tai kahdesti päivässä paransi tilastollisesti merkitsevästi päätepisteen keskimääräisiä kipupisteitä lähtötilanteesta ja lisäsi niiden potilaiden osuutta, joiden kipupisteet vähenivät vähintään 50 % lähtötasosta. Kuviot 3 ja 4 esittävät kivun eri asteen paranemisasteelle lähtötilanteesta tutkimuksen päätepisteeseen niiden potilaiden osuuden, jotka saavuttivat tämän parannusasteen tutkimuksissa DPNP-1 ja DPNP-2, vastaavasti. Luvut ovat kumulatiivisia, joten potilaat, joiden muutos lähtötilanteesta on esimerkiksi 50 %, ovat mukana myös kaikilla alle 50 %:n parannustasoilla. Potilaille, jotka eivät suorittaneet koetta loppuun, määrättiin 0 % parannus. Joillakin potilailla kipu väheni jo viikolla 1, mikä jatkui koko tutkimuksen ajan.
Kuva 3: Prosenttiosuus DPNP-aikuisista potilaista, jotka saavuttavat eri tasoisia kivunlievitystä mitattuna 24 tunnin keskimääräisellä kivun vaikeusasteella (tutkimus DPNP-1)
Kuva 4: Prosenttiosuus DPNP-aikuisista potilaista, jotka saavuttavat eri tasoisia kivunlievitystä mitattuna 24 tunnin keskimääräisellä kivun vaikeusasteella (tutkimus DPNP-2)
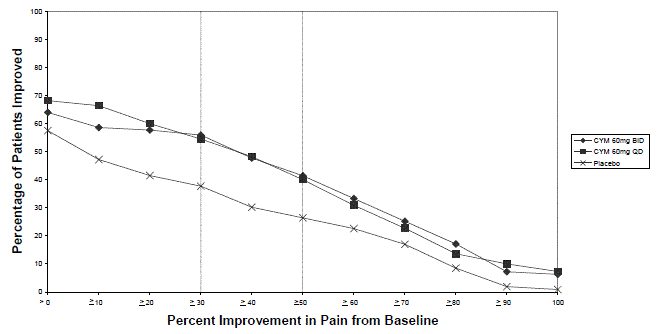
Fibromyalgia
Aikuisten kokeet fibromyalgiassa
CYMBALTA:n teho fibromyalgian hoidossa aikuisilla vahvistettiin kahdessa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa, kiinteäannoksisessa tutkimuksessa aikuispotilailla, jotka täyttivät American College of Rheumatologyn fibromyalgian kriteerit (historiassa laajalle levinnyt kipu 3 kuukauden ajan). ja kipua 11:ssä tai useammassa 18:sta erityisestä arkuuskohdasta). FM-1-tutkimus kesti kolme kuukautta, ja siihen osallistui vain naispotilaita. Tutkimus FM-2 kesti kuusi kuukautta, ja siihen otettiin mies- ja naispotilaita. Noin 25 %:lla osallistujista oli samanaikainen MDD-diagnoosi. FM1- ja FM-2-tutkimuksiin otettiin yhteensä 874 potilasta, joista 541 (62 %) suoritti kokeet. Yhteensä 354 potilasta (234 CYMBALTA 40 mg, 120 lumelääkettä) otettiin mukaan tutkimukseen FM-1 ja yhteensä 520 potilasta (376 CYMBALTA, 144 lumelääkettä) tutkimukseen FM-2 (5 % miehiä, 95 % naisia). Potilaiden lähtötilanteen kipupistemäärä oli 6,5 11 pisteen asteikolla välillä 0 (ei kipua) 10:een (huonompi mahdollinen kipu).
Tutkimuksissa FM-1 ja FM-2 verrattiin CYMBALTA 60 mg kerran vuorokaudessa tai 120 mg vuorokaudessa (annostettuna jaettuina annoksina tutkimuksessa FM-1 ja kerta-annoksena tutkimuksessa FM-2) lumelääkkeeseen. Tutkimuksessa FM-2 verrattiin lisäksi CYMBALTA 20 mg:aa lumelääkkeeseen kuuden kuukauden tutkimuksen kolmen ensimmäisen kuukauden aikana.
Hoito CYMBALTA 60 mg tai 120 mg päivässä paransi tilastollisesti merkitsevästi päätepisteen keskimääräisiä kipupisteitä lähtötasosta ja lisäsi niiden potilaiden osuutta, joiden kipupisteet pienenivät vähintään 50 % lähtötasosta. Kivun vähentymistä havaittiin potilailla, joilla oli tai ei ollut samanaikainen MDD. Kivun vähenemisaste voi kuitenkin olla suurempi potilailla, joilla on samanaikainen MDD. Kuviot 5 ja 6 esittävät kivun eriasteista paranemista lähtötilanteesta tutkimuksen päätepisteeseen, mikä osoittaa potilaiden osuuden, jotka saavuttivat tämän parannustason tutkimuksissa FM-1 ja FM-2, vastaavasti. Luvut ovat kumulatiivisia, joten potilaat, joiden muutos lähtötilanteesta on esimerkiksi 50 %, ovat mukana myös kaikilla alle 50 %:n parannustasoilla. Potilaille, jotka eivät suorittaneet koetta loppuun, määrättiin 0 % parannus. Joillakin potilailla kipu väheni jo viikolla 1, mikä jatkui koko tutkimuksen ajan. Parantumista osoitettiin myös toiminnan mittareissa (Fibromyalgia Impact Questionnaires) ja potilaan globaalissa vaikutelmassa muutoksesta (PGI). Kumpikaan tutkimus ei osoittanut 120 mg:n etua verrattuna 60 mg:aan, ja suurempi annos liittyi enemmän haittavaikutuksiin ja hoidon ennenaikaiseen lopettamiseen.
Kuva 5: Prosenttiosuus aikuisista fibromyalgiapotilaista, jotka saavuttavat eri tasoisia kivunlievitystä tutkimuksen päätepisteessä mitattuna 24 tunnin keskimääräisellä kivun vaikeusasteella (tutkimus FM-1)
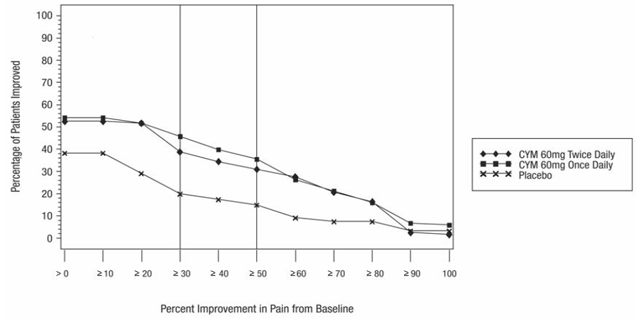
Kuva 6: Prosenttiosuus aikuisista fibromyalgiapotilaista, jotka saavuttavat eri tasoisia kivunlievitystä tutkimuksen päätepisteessä mitattuna 24 tunnin keskimääräisellä kivun vaikeusasteella (tutkimus FM-2)
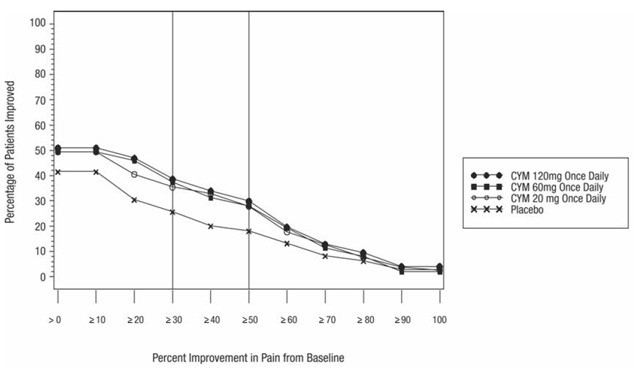
Lisäksi CYMBALTA-annoksen 60 mg/vrk annoksen suurentamisen hyöty, joka ei reagoinut CYMBALTAan, arvioitiin erillisessä tutkimuksessa (tutkimus FM-3). Aikuisia potilaita hoidettiin aluksi CYMBALTAlla 60 mg kerran vuorokaudessa kahdeksan viikon ajan avoimesti. Myöhemmin tämän vaiheen päättäjät satunnaistettiin kaksoissokkohoitoon CYMBALTAlla joko 60 mg kerran vuorokaudessa tai 120 mg kerran vuorokaudessa. Responderiksi määriteltiin potilaita, joiden kipupisteet pienenivät vähintään 30 % lähtötasosta 8 viikon hoidon lopussa. Potilaat, jotka eivät saaneet vastetta 8 viikon kohdalla, eivät todennäköisemmin täyttäneet vastekriteerit 60 viikon hoidon lopussa, jos potilaat titrattiin sokeasti CYMBALTA 120 mg:aan verrattuna potilaisiin, jotka jatkoivat sokeasti CYMBALTA 60 mg:aa.
Pediatrinen tutkimus fibromyalgiassa
CYMBALTAa tutkittiin 184:llä 13–17-vuotiaalla lapsipotilaalla, joilla oli juveniili fibromyalgiaoireyhtymä, 13 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa (tutkimus FM-4). Tutkimuksessa FM-4 149 (81 %) potilasta suoritti tutkimuksen päätökseen. CYMBALTA (N=91) aloitettiin annoksella 30 mg kerran vuorokaudessa yhden viikon ajan ja titrattiin 60 mg:aan kerran vuorokaudessa 12 viikon ajan siedetyn annoksen mukaan. Keskimääräinen annos potilaille, jotka päättivät 12 viikon hoitovaiheen, oli 49 mg/vrk. CYMBALTA osoitti parannusta lumelääkkeeseen verrattuna ensisijaisessa päätetapahtumassa [muutos lähtötilanteesta hoidon loppuun Brief Pain Inventoryssa (BPI) – Modified Short Form: Adolescent Version 24 tunnin keskimääräinen kivun vakavuusluokitus] p-arvolla 0,052 alkaen ennalta määritetty primaarianalyysi ja p-arvot, jotka vaihtelivat välillä 0,011-0,020 herkkyysanalyyseistä, joissa määritettiin perusarvot, puuttuviin arviointeihin joistakin potilaista, jotka eivät suorittaneet tutkimusta eri syistä. Potilaiden lähtötason BPI oli 5,7. Kivun eri asteen paranemisen osalta lähtötilanteesta tutkimuksen päätepisteeseen, kuvio 7 näyttää niiden potilaiden osuuden, jotka saavuttivat tämän parannusasteen tutkimuksessa FM-4.
Kuva 7: Niiden 13–17-vuotiaiden lapsipotilaiden prosenttiosuus, joilla on juveniili fibromyalgiaoireyhtymä ja jotka saavuttivat eri tasoisia kivunlievitystä viikolla 12 (tutkimus FM-4)a
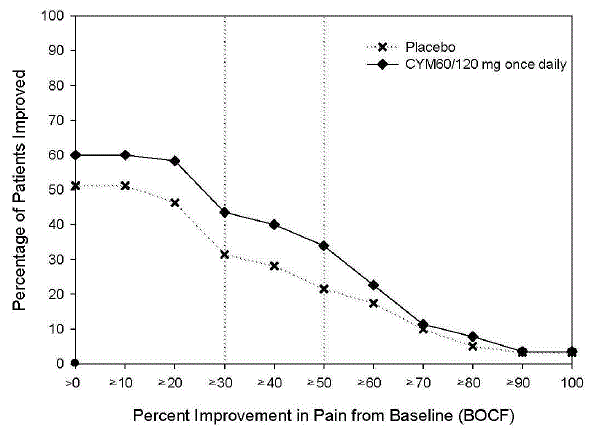
Krooninen tuki- ja liikuntaelinten kipu aikuisilla
CYMBALTA on tarkoitettu kroonisen tuki- ja liikuntaelinkivun hoitoon aikuisilla. Tämä on osoitettu tutkimuksissa aikuispotilailla, joilla on krooninen alaselän kipu ja krooninen nivelrikosta johtuva kipu.
Kroonisen alaselkäkivun kokeet aikuisilla
CYMBALTA 60 mg:n tehoa kroonisen alaselkäkivun (CLBP) hoidossa aikuisilla arvioitiin kahdessa kaksoissokkoutetussa, lumekontrolloidussa, satunnaistetussa kliinisessä 13 viikon tutkimuksessa (tutkimukset CLBP-1 ja CLBP-2) ja yhdessä 12:sta -viikkojen kesto (CLBP-3). Tutkimukset CLBP-1 ja CLBP-3 osoittivat CYMBALTAn tehokkuuden CLBP:n hoidossa. Kaikissa tutkimuksissa potilailla ei ollut merkkejä radikulopatiasta tai selkäytimen ahtaumasta.
Tutkimus CLBP-1
Kaksisataakolmekymmentäkuusi aikuispotilasta (N = 115 CYMBALTA 40 mg:lla, N = 121 lumelääkettä saaneella) osallistui ja 182 (77 %) suoritti 13 viikon hoitovaiheen. Seitsemän viikon hoidon jälkeen CYMBALTA-hoitoa saaneiden potilaiden, joiden keskimääräinen päivittäinen kipu väheni alle 30 % ja jotka sietivät 60 mg:n kerran vuorokaudessa, CYMBALTA-annos nostettiin kaksoissokkoutetulla tavalla 120 mg:aan kerran vuorokaudessa. oikeudenkäynnin loppuosa. Potilaiden keskimääräinen lähtötilanteen kivun arvosana oli 6 numeerisella luokitusasteikolla, joka vaihteli 0:sta (ei kipua) 10:een (pahin mahdollinen kipu). 13 viikon hoidon jälkeen potilailla, jotka saivat CYMBALTAa 60–120 mg päivässä, kipu väheni merkittävästi enemmän kuin lumelääkettä saaneilla potilailla. Satunnaistaminen ositettiin potilaiden NSAID-hoidon lähtötilanteen mukaan. Alaryhmäanalyysit eivät osoittaneet, että hoitotuloksissa olisi eroja tulehduskipulääkkeiden käytön funktiona.
Tutkimus CLBP-2
Neljäsataa neljä potilasta satunnaistettiin saamaan kiinteitä CYMBALTA-annoksia 60 mg päivässä tai vastaavaa lumelääkettä (N = 59 CYMBALTA 20 mg:lla, N = 116 CYMBALTA 60 mg:lla, N = 112 CYMBALTA 120 mg:lla, N = 117 lumelääkkeellä). ja 267 (66 %) suoritti koko 13 viikon kokeen. 13 viikon hoidon jälkeen mikään kolmesta CYMBALTA 30 mg:n annoksesta ei osoittanut tilastollisesti merkitsevää eroa kivun vähenemisessä lumelääkkeeseen verrattuna.
Tutkimus CLBP-3
Neljäsataa potilasta satunnaistettiin saamaan kiinteät 60 mg CYMBALTA-annokset vuorokaudessa tai lumelääke (N = 198 CYMBALTA 20 mg:lla, N = 203 lumelääkkeellä), ja 303 (76 %) sai tutkimuksen päätökseen. Potilaiden keskimääräinen lähtötilanteen kivun arvosana oli 6 numeerisella luokitusasteikolla, joka vaihteli 0:sta (ei kipua) 10:een (pahin mahdollinen kipu). 12 viikon hoidon jälkeen potilailla, jotka saivat CYMBALTAa 60 mg päivässä, kipu väheni merkittävästi enemmän kuin lumelääkettä saaneilla potilailla.
Kuvioissa 8 ja 9 esitetään kivun eriasteista paranemista lähtötilanteesta tutkimuksen päätepisteeseen, mikä osuus potilaista tutkimuksissa CLBP-1 ja CLBP-3 saavutti vastaavasti tämän parannusasteen. Luvut ovat kumulatiivisia, joten potilaat, joiden muutos lähtötilanteesta on esimerkiksi 50 %, ovat mukana myös kaikilla alle 50 %:n parannustasoilla. Potilaille, jotka eivät suorittaneet koetta loppuun, määritettiin 0 %:n parannus.
Kuva 8: Prosenttiosuus aikuispotilaista, joilla on CLBP:tä ja jotka saavuttavat eri tasoisia kivunlievitystä mitattuna 24 tunnin keskimääräisellä kivun vaikeusasteella (tutkimus CLBP-1)
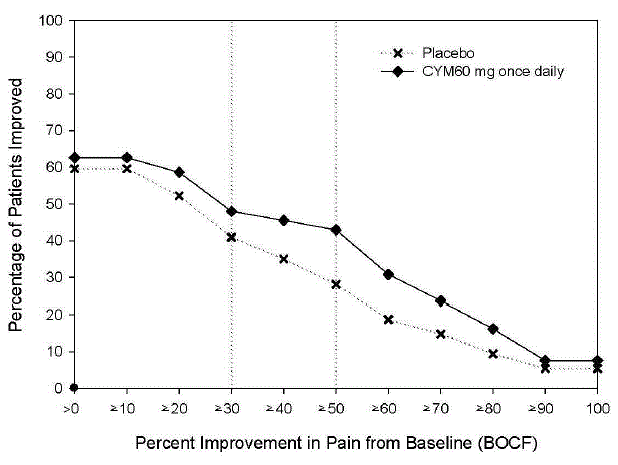
Kuva 9: Prosenttiosuus aikuispotilaista, joilla on CLBP:tä ja jotka saavuttavat eri tasoisia kivunlievitystä mitattuna 24 tunnin keskimääräisellä kivun vaikeusasteella (tutkimus CLBP-3)
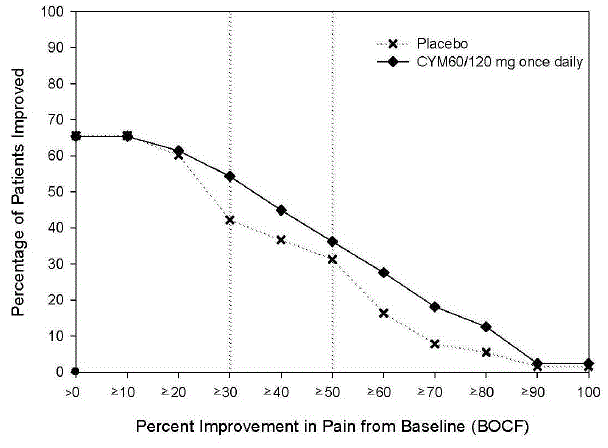
Aikuisten nivelrikosta johtuvan kroonisen kivun kokeet
CYMBALTA:n tehoa aikuisten nivelrikosta (OA) johtuvan kroonisen kivun hoidossa arvioitiin kahdessa kaksoissokkoutetussa, lumekontrolloidussa, satunnaistetussa kliinisessä 13 viikon tutkimuksessa (tutkimus OA-1 ja tutkimus OA-2). Kaikki potilaat molemmissa tutkimuksissa täyttivät ACR:n kliiniset ja radiografiset kriteerit polven idiopaattisen OA:n luokittelussa. Satunnaistaminen ositettiin potilaiden NSAID-lääkkeiden käytön lähtötilanteen mukaan.
CYMBALTA-hoitoon määrätyt potilaat aloittivat hoidon molemmissa tutkimuksissa annoksella 30 mg kerran vuorokaudessa yhden viikon ajan. Ensimmäisen viikon jälkeen CYMBALTA-annos nostettiin 60 mg:aan kerran vuorokaudessa. Seitsemän viikon hoidon jälkeen CYMBALTA 60 mg kerran vuorokaudessa tutkimuksessa OA-1 potilailla, joiden hoitovaste ei ollut optimaalinen (kivun väheneminen
Tutkimus OA-1
Kaksisataaviisikymmentäkuusi potilasta (N = 128 CYMBALTA 30 mg:lla, N = 128 lumelääkettä saaneella) osallistui ja 204 (80 %) suoritti tutkimuksen. Potilaiden keskimääräinen lähtötilanteen kivun arvosana oli 6 numeerisella luokitusasteikolla, joka vaihteli 0:sta (ei kipua) 10:een (pahin mahdollinen kipu). 13 viikon hoidon jälkeen potilailla, jotka saivat CYMBALTA 20 mg, kipu väheni merkittävästi enemmän kuin lumelääkettä saaneilla potilailla. Alaryhmäanalyysit eivät osoittaneet, että hoitotuloksissa olisi eroja tulehduskipulääkkeiden käytön funktiona.
Tutkimus OA-2
Kaksisataakolmekymmentäyksi potilasta (N = 111 CYMBALTA 30 mg:lla, N = 120 lumelääkettä saaneella) osallistui ja 173 (75 %) suoritti tutkimuksen. Potilaiden keskimääräinen lähtötason kipu oli 6 numeerisella luokitusasteikolla, joka vaihteli 0:sta (ei kipua) 10:een (pahin mahdollinen kipu). 13 viikon hoidon jälkeen CYMBALTA 20 mg:aa saaneiden potilaiden kipu ei vähentynyt merkittävästi enemmän kuin lumelääkettä saaneilla potilailla.
Tutkimuksessa OA-1 kuvassa 10 esitetään kivun eriasteista paranemista lähtötilanteesta tutkimuksen päätepisteeseen, mikä osuus potilaista on saavuttanut tämän parannusasteen. Luku on kumulatiivinen, joten potilaat, joiden muutos lähtötilanteesta on esimerkiksi 50 %, ovat mukana myös kaikilla alle 50 %:n parannustasoilla. Potilaille, jotka eivät suorittaneet koetta loppuun, määritettiin 0 %:n parannus.
Kuva 10: Prosenttiosuus aikuispotilaista, joilla on erilainen kivunlievitys, mitattuna 24 tunnin keskimääräisellä kivun vaikeusasteella (tutkimus OA-1)
POTILASTIEDOT
Cymbalta® [sim-BALL-tah] (duloksetiinia viivästyneesti vapauttavat kapselit)
Lue tämä lääkitysopas ennen kuin aloitat Cymbalta®-hoidon ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi.
Keskustele terveydenhuollon tarjoajan kanssa seuraavista asioista:
- kaikki masennuslääkehoidon riskit ja edut
- kaikki masennuksen tai muiden vakavien mielenterveyssairauksien hoitovaihtoehdot
Mikä on tärkein tieto, joka minun pitäisi tietää masennuslääkkeistä, masennuksesta, muista vakavista mielenterveyssairauksista ja itsemurha-ajatuksista tai -toimista?
- Kiinnitä huomiota kaikkiin mielialan, käyttäytymisen, toiminnan, ajatusten tai tunteiden muutoksiin, erityisesti äkillisiin muutoksiin. Tämä on erittäin tärkeää, kun masennuslääke aloitetaan tai annosta muutetaan.
- Soita välittömästi terveydenhuollon tarjoajallesi ilmoittaaksesi uusista tai äkillisistä mielialan, käyttäytymisen, ajatusten tai tunteiden muutoksista.
- Pidä kaikki seurantakäynnit terveydenhuollon tarjoajan kanssa aikataulun mukaisesti. Soita terveydenhuollon tarjoajallesi käyntien välillä tarvittaessa, varsinkin jos olet huolissasi oireista.
Soita välittömästi terveydenhuollon tarjoajallesi, jos sinulla on jokin seuraavista oireista tai tunteista, varsinkin jos ne ovat uusia, pahempia tai huolestuttavia. Hätätilanteessa soita 911.
- yrittää itsemurhaa
- vaarallisten impulssien vaikutuksesta
- käyttäytyy aggressiivisesti, on vihainen tai väkivaltainen
- ajatuksia itsemurhasta tai kuolemasta
- uusi tai pahempi masennus
- uusi tai pahempi ahdistus
- paniikkikohtaukset
- hyvin kiihtynyt tai levoton olo
- uusi tai pahempi ärtyneisyys
- nukahtamisvaikeuksia
- äärimmäinen lisääntynyt aktiivisuus tai puhuminen (mania)
- muita epätavallisia muutoksia käyttäytymisessä tai mielialassa
Mitä muuta minun on tiedettävä masennuslääkkeistä?
- Älä koskaan lopeta masennuslääkettä keskustelematta ensin terveydenhuollon tarjoajan kanssa. Masennuslääkehoidon äkillinen lopettaminen voi aiheuttaa muita oireita.
- Masennuslääkkeet ovat lääkkeitä, joita käytetään masennuksen ja muiden sairauksien hoitoon. On tärkeää keskustella kaikista masennuksen hoidon riskeistä ja myös riskeistä, jos sitä ei hoideta. Potilaiden tulee keskustella kaikista hoitovaihtoehdoista terveydenhuollon tarjoajan kanssa, ei vain masennuslääkkeiden käytöstä.
- Masennuslääkkeillä on muita sivuvaikutuksia. Keskustele terveydenhuollon tarjoajan kanssa sinulle tai perheenjäsenellesi määrätyn lääkkeen sivuvaikutuksista.
- Masennuslääkkeet voivat olla vuorovaikutuksessa muiden lääkkeiden kanssa. Tiedä kaikki lääkkeet, joita sinä tai perheenjäsenesi käytät. Pidä luettelo kaikista lääkkeistä näyttääksesi terveydenhuollon tarjoajallesi. Älä aloita uusia lääkkeitä keskustelematta ensin terveydenhuollon tarjoajalta.
Mikä on Cymbalta 60mg?
Cymbalta on reseptilääke, jota käytetään tietyntyyppisen masennuksen hoitoon, jota kutsutaan vakavaksi masennushäiriöksi (MDD). Cymbalta 20 mg kuuluu lääkeryhmään, joka tunnetaan nimellä SNRI (orserotoniini-norepinefriinin takaisinoton estäjät).
Cymbalta 60 mg:aa käytetään myös seuraavien hoitoon tai hoitoon:
- Yleistynyt ahdistuneisuushäiriö (GAD)
- Diabeettinen perifeerinen neuropaattinen kipu (DPNP)
- Fibromyalgia (FM)
- Krooninen tuki- ja liikuntaelinten kipu
Kuka ei saa ottaa Cymbaltaa?
Älä ota Cymbalta 20 mg:aa, jos:
- ota monoamiinioksidaasin estäjää (MAOI). Kysy terveydenhuollon tarjoajalta tai apteekista, jos et ole varma, käytätkö MAO-estäjää, mukaan lukien antibiootti linetsolidi tai suonensisäinen metyleenisininen.
- Älä ota MAO-estäjää 5 päivän sisällä Cymbaltan lopettamisesta, ellei terveydenhuollon tarjoaja kehota tekemään niin.
- Älä aloita Cymbaltan käyttöä, jos olet lopettanut MAO:n estäjän käytön viimeisten 14 päivän aikana, ellei terveydenhuollon tarjoajasi ole niin määrännyt.
Ihmisillä, jotka ottavat Cymbalta 60 mg:aa lähellä MAO:n estäjähoitoa ajoissa, voi olla vakava ongelma nimeltä serotoniinioireyhtymä (katso "Mitä ovat Cymbalta 60 mg:n mahdolliset sivuvaikutukset?").
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen Cymbaltan ottamista?
Ennen kuin aloitat Cymbaltan, kerro terveydenhuollon tarjoajallesi, jos:
- sinulla on sydänongelmia tai korkea verenpaine
- sinulla on diabetes (Cymbalta 40 mg -hoito vaikeuttaa joidenkin diabetesta sairastavien ihmisten verensokerin hallintaa)
- sinulla on maksaongelmia
- on munuaisongelmia
- on glaukooma
- sinulla on tai on ollut kohtauksia tai kouristuksia
- sinulla on kaksisuuntainen mielialahäiriö tai mania
- sinulla on alhainen natriumpitoisuus veressäsi
- vatsan tyhjeneminen on viivästynyt
- sinulla on tai on ollut verenvuotoongelmia
- olet raskaana tai suunnittelet raskautta. Cymbalta voi vahingoittaa sikiötäsi. Keskustele terveydenhuollon tarjoajan kanssa sikiölle aiheutuvista riskeistä, jos otat Cymbaltaa raskauden aikana.
- Kerro heti terveydenhuollon tarjoajallesi, jos tulet raskaaksi tai epäilet olevasi raskaana Cymbalta-hoidon aikana.
- Jos tulet raskaaksi Cymbalta 30 mg -hoidon aikana, keskustele terveydenhuollon tarjoajasi kanssa Cymbalta-raskausrekisteriin rekisteröitymisestä. Voit rekisteröityä soittamalla numeroon 1-866-8146975 tai käymällä osoitteessa www.cymbalta 40mgpregnancyregistry.com. Tämän rekisterin tarkoituksena on seurata raskauden tuloksia naisilla, joita on hoidettu Cymbaltalla milloin tahansa raskauden aikana.
- imetät tai aiot imettää. Cymbalta erittyy äidinmaitoon ja voi vahingoittaa vauvaasi. Keskustele terveydenhuollon tarjoajan kanssa parhaasta tavasta ruokkia vauvasi Cymbalta-hoidon aikana.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät. Cymbalta ja jotkut lääkkeet voivat olla vuorovaikutuksessa keskenään, eivät ehkä toimi yhtä hyvin tai voivat aiheuttaa vakavia sivuvaikutuksia.
Kerro erityisesti terveydenhuollon tarjoajallesi, jos otat:
- triptaanit, joita käytetään migreenipäänsäryn hoitoon
- mieliala-, ahdistuneisuus-, psykoottisten tai ajatushäiriöiden hoitoon käytettävät lääkkeet, mukaan lukien trisykliset lääkkeet, litium, buspironi, SSRI-lääkkeet, SNRI-lääkkeet tai MAO-estäjät
- tramadoli ja fentanyyli
- amfetamiinit
- simetidiini
- antibiootit siprofloksasiini, enoksasiini
- epäsäännöllisen sykkeen hoitoon tarkoitettu lääke (kuten propafenoni, flekainidi, kinidiini)
- teofylliini
- verta ohentava varfariini (Coumadin, Jantoven)
- ei-steroidiset tulehduskipulääkkeet (NSAID) (kuten ibuprofeeni, naprokseeni tai aspiriini).
- reseptivapaat lisäravinteet, kuten tryptofaani tai mäkikuisma
- tioridatsiini (Mellaril). Mellaril yhdessä Cymbaltan kanssa voi aiheuttaa vakavia sydämen rytmihäiriöitä tai äkillisen kuoleman.
Pyydä terveydenhuollon tarjoajalta luettelo näistä lääkkeistä, jos et ole varma.
Älä ota Cymbaltaa muiden duloksetiinia sisältävien lääkkeiden kanssa.
Kuinka minun pitäisi ottaa Cymbalta 60 mg?
- Ota Cymbalta juuri sen verran kuin terveydenhuollon tarjoajasi on neuvonut sinua ottamaan sen. Terveydenhuollon tarjoajasi saattaa joutua muuttamaan Cymbalta 20 mg -annosta, kunnes se on oikea annos sinulle.
- Niele Cymbalta kokonaisena. Älä pureskele tai murskaa Cymbaltaa.
- Älä avaa kapselia ja ripottele sitä ruoan päälle tai sekoita nesteisiin. Kapselin avaaminen voi vaikuttaa Cymbaltan tehoon.
- Cymbalta voidaan ottaa ruoan kanssa tai ilman ruokaa.
- Jos unohdat ottaa Cymbalta 30 mg -annoksen, ota unohtunut annos heti kun muistat. Jos on melkein seuraavan annoksen aika, jätä unohtunut annos väliin ja ota seuraava annos normaaliin aikaan. Älä ota kahta Cymbalta 30 mg annosta samanaikaisesti.
- Jos otat liian paljon Cymbaltaa, soita välittömästi terveydenhuollon tarjoajallesi tai myrkytystietokeskukseen numeroon 1800-222-1222 tai hakeudu ensiapuun.
- Kun vaihdat toisesta masennuslääkkeestä Cymbaltaan, terveydenhuollon tarjoajasi saattaa haluta alentaa alkuperäisen masennuslääkkeen annosta ensin sivuvaikutusten välttämiseksi.
Mitä minun pitäisi välttää Cymbaltan käytön aikana?
- Cymbalta voi aiheuttaa uneliaisuutta tai vaikuttaa kykyysi tehdä päätöksiä, ajatella selkeästi tai reagoida nopeasti. Älä aja, käytä raskaita koneita tai tee muuta vaarallista toimintaa, ennen kuin tiedät, kuinka Cymbalta vaikuttaa sinuun.
- Cymbaltan käyttöön samanaikaisesti runsaan alkoholin käytön kanssa voi liittyä vakava maksavaurio. Vältä runsasta alkoholin käyttöä Cymbaltan käytön aikana.
Mitkä ovat Cymbaltan mahdolliset sivuvaikutukset?
Cymbalta 30mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien: Katso "Mikä on tärkein tieto, joka minun pitäisi tietää Cymbaltasta?"
Yleisiä mahdollisia sivuvaikutuksia ihmisillä, jotka käyttävät Cymbalta 20 mg:ta, ovat:
Miehillä oireita voivat olla:
Naisilla oireita voivat olla:
Keskustele terveydenhuollon tarjoajan kanssa, jos seksuaalisessa toiminnassasi ilmenee muutoksia tai jos sinulla on kysymyksiä tai huolia seksuaalisista ongelmista CYMBALTA-hoidon aikana. Terveydenhuollon tarjoajasi voi ehdottaa hoitoja.
- kutina
- oikean ylävatsan kipu
- tumma virtsa
- keltainen iho tai silmät
- suurentunut maksa
- kohonneet maksaentsyymit
- nosta verenpainettasi.
- alentaa verenpainettasi seistessäsi ja aiheuttaa huimausta tai pyörtymistä, useimmiten Cymbalta-hoidon aloittamisen tai annosta suurennettaessa.
- lisää kaatumisriskiä, erityisesti vanhuksilla.
- kiihtyneisyys, hallusinaatiot, kooma tai muut mielentilan muutokset
- koordinaatiohäiriöt tai lihasnykitykset (yliaktiiviset refleksit)
- syke, korkea tai matala verenpaine
- hikoilu tai kuume
- pahoinvointia, oksentelua tai ripulia
- lihasten jäykkyys
- huimaus
- punoitus
- vapina
- kohtauksia
- ahdistusta
- ärtyneisyys
- väsymys tai unihäiriöt
- päänsärky
- hikoilu
- huimaus
- sähköiskun kaltaisia tuntemuksia
- oksentelua tai pahoinvointia
- ripuli
- lisääntynyt huomattavasti energiaa
- vakavia unihäiriöitä
- kilpailevia ajatuksia
- huolimaton käytös
- epätavallisen mahtavia ideoita
- liiallinen onnellisuus tai ärtyneisyys
- puhua enemmän tai nopeammin kuin tavallisesti
Vain jotkut ihmiset ovat vaarassa saada nämä ongelmat. Haluat ehkä käydä silmätutkimuksessa nähdäksesi, oletko vaarassa, ja saada ehkäisevää hoitoa, jos olet.
- silmän kipu
- muutoksia näkökyvyssä
- turvotus tai punoitus silmässä tai sen ympärillä
- päänsärky
- heikkous tai epävakaus
- sekavuus, keskittymis- tai ajattelu- tai muistiongelmat
- lisääntynyt virtsan virtaus
- ei pysty erittämään virtsaa
- viivästynyt siemensyöksy tai kyvyttömyys saada siemensyöksyä
- vähentynyt seksihalu
- ongelmia erektion saamisessa tai säilyttämisessä
- vähentynyt seksihalu
- viivästynyt orgasmi tai kyvyttömyys saada orgasmi
Cymbalta 20mg:n yleisimmät sivuvaikutukset ovat:
- pahoinvointi
- kuiva suu
- uneliaisuus
- väsymys
- ummetus
- ruokahalun menetys
- lisääntynyt hikoilu
- huimaus
Yleisiä mahdollisia sivuvaikutuksia lapsille ja nuorille, jotka käyttävät Cymbalta 20 mg:ta, ovat:
- pahoinvointi
- vähentynyt paino
- huimaus
Haittavaikutuksia aikuisilla voi esiintyä myös lapsilla ja nuorilla, jotka käyttävät Cymbaltaa. Lasten ja nuorten pituutta ja painoa tulee seurata hoidon aikana.
Kerro terveydenhuollon tarjoajallesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei katoa.
Nämä eivät ole kaikkia Cymbaltan mahdollisia sivuvaikutuksia. Lisätietoja saat terveydenhuollon tarjoajalta tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista numeroon 1800-FDA-1088.
Kuinka Cymbalta 40mg pitäisi säilyttää?
Säilytä Cymbalta huoneenlämmössä 20 °C - 25 °C (68–77 °F).
Pidä Cymbalta ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa Cymbaltan turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa mainittuihin tarkoituksiin. Älä käytä Cymbaltaa sairauteen, johon sitä ei ole määrätty. Älä anna Cymbalta 20 mg:aa muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tämä lääkitysopas tiivistää tärkeimmät tiedot Cymbaltasta. Jos haluat lisätietoja, keskustele terveydenhuollon tarjoajasi kanssa. Voit kysyä terveydenhuollon tarjoajaltasi tai apteekista tietoja Cymbaltasta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Lisätietoja saat soittamalla numeroon 1-800-545-5979.
Mitä ainesosia Cymbalta 30mg sisältää?
Vaikuttava aine: duloksetiinihydrokloridi
Inaktiiviset ainesosat:
FD&C Blue No. 2, gelatiini, hypromelloosi, hydroksipropyylimetyyliselluloosa-asetaattisukkinaatti, natriumlauryylisulfaatti, sakkaroosi, sokeripallot, talkki, titaanidioksidi ja trietyylisitraatti. 20 ja 60 mg:n kapselit sisältävät myös keltaista rautaoksidia.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
