Lexapro 10mg, 20mg, 5mg Escitalopram Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Lexapro on ja miten sitä käytetään?
Lexapro on reseptilääke, jota käytetään vakavan masennuksen ja yleistyneen ahdistuneisuushäiriön oireiden hoitoon. Lexaproa voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
- Lexapro kuuluu lääkeryhmään, jota kutsutaan masennuslääkkeiksi, SSRI:iksi.
- Ei tiedetä, onko Lexapro 10mg turvallinen ja tehokas alle 12-vuotiaille lapsille.
Mitkä ovat Lexapron mahdolliset sivuvaikutukset?
Lexapro voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Vatsakipu,
- Epänormaali verenvuoto,
- Epänormaalit unet,
- Allergia,
- näön hämärtyminen,
- putkinäkö,
- rintakipu,
- vähentynyt keskittymiskyky,
- hemostaasi,
- silmäkipu tai turvotus,
- nähdä haloja valojen ympärillä,
- kilpa ajatuksia,
- epätavallinen riskinotto,
- äärimmäisen onnen tai surun tunteita,
- päänsärky,
- närästys,
- kuumia aaltoja,
- hämmennystä,
- sammaltava puhe,
- vakava heikkous,
- oksentelua,
- koordinaation menetys,
- epävakaa olo,
- erittäin jäykät (jäykät) lihakset,
- korkea kuume,
- hikoilu,
- hämmennystä,
- nopea tai epätasainen sydämenlyönti,
- vapina ja
- huimaus
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Lexapron yleisimpiä sivuvaikutuksia ovat:
- huimaus,
- uneliaisuus,
- heikkous,
- hikoilu,
- vapina tai ahdistunut olo,
- unihäiriöt (unettomuus),
- kuiva suu,
- ruokahalun menetys,
- pahoinvointi,
- ummetus,
- ammottava,
- painon muutokset,
- vähentynyt seksihalu,
- impotenssi ja
- vaikeuksia saada orgasmi
VAROITUS
Itsemurha- ja masennuslääkeaineet
Masennuslääkkeet lisäsivät plaseboon verrattuna itsemurha-ajattelun ja -käyttäytymisen (itsetuhoisuuden) riskiä lapsilla, nuorilla ja nuorilla aikuisilla lyhytaikaisissa masennushäiriön (MDD) ja muiden psykiatristen häiriöiden tutkimuksissa. Jokaisen, joka harkitsee Lexapron tai minkä tahansa muun masennuslääkkeen käyttöä lapsella, nuorella tai nuorella aikuisella, on tasapainotettava tämä riski kliinisen tarpeen kanssa. Lyhytaikaiset tutkimukset eivät osoittaneet lisääntynyttä itsemurhariskiä masennuslääkkeillä lumelääkkeeseen verrattuna yli 24-vuotiailla aikuisilla; 65-vuotiailla ja sitä vanhemmilla aikuisilla masennuslääkkeiden riski pieneni lumelääkkeeseen verrattuna. Masennus ja tietyt muut psykiatriset häiriöt liittyvät itsemurhariskin lisääntymiseen. Kaiken ikäisiä potilaita, jotka saavat masennuslääkehoitoa, tulee seurata asianmukaisesti ja tarkkailla kliinisen pahenemisen, itsemurha-ajattelun tai epätavallisten käyttäytymismuutosten varalta. Perheille ja omaishoitajille tulee kertoa, että heitä on tarkkailtava tarkasti ja kommunikoida lääkärin kanssa. Lexapro 5mg ei ole hyväksytty käytettäväksi alle 12-vuotiailla lapsipotilailla. [Katso VAROITUKSET JA VAROTOIMET Kliininen paheneminen ja itsemurhariski, POTILASTIEDOT , ja Käyttö tietyissä populaatioissa : Pediatric Use].
KUVAUS
Lexapro® (escitalopraamioksalaatti) on suun kautta annettava selektiivinen serotoniinin takaisinoton estäjä (SSRI). Essitalopraami on raseemisen bisyklisen ftalaanijohdannaisen sitalopraamin puhdas senantiomeeri (yksi isomeeri). Essitalopraamioksalaattia kutsutaan nimellä S-(+)-1-[3(dimetyyliamino)propyyli]-1-(p-fluorifenyyli)-5-ftalankarbonitriilioksalaatti, jolla on seuraava rakennekaava:
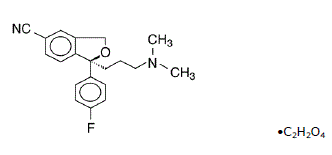
Molekyylikaava on C20H21FN2O • C2H2O4 ja molekyylipaino on 414,40.
Essitalopraamioksalaatti esiintyy hienojakoisena valkoisena tai hieman keltaisena jauheena ja liukenee vapaasti metanoliin ja dimetyylisulfoksidiin (DMSO), liukenee isotoniseen suolaliuokseen, liukenee niukasti veteen ja etanoliin, liukenee heikosti etyyliasetaattiin ja liukenee heptaaniin.
Lexapro (escitalopramioksalaatti) on saatavana tabletteina tai oraaliliuoksena.
Lexapro-tabletit ovat kalvopäällysteisiä, pyöreitä tabletteja, jotka sisältävät essitalopraamioksalaattia vahvuuksina, jotka vastaavat 5 mg, 10 mg ja 20 mg essitalopraamiemästä. 10 ja 20 mg:n tableteissa on jakouurre. Tabletit sisältävät myös seuraavia inaktiivisia aineita: talkki, kroskarmelloosinatrium, mikrokiteinen selluloosa/kolloidinen piidioksidi ja magnesiumstearaatti. Kalvopinnoite sisältää hypromelloosia, titaanidioksidia ja polyetyleeniglykolia.
Lexapro 5 mg oraaliliuos sisältää essitalopraamioksalaattia, joka vastaa 1 mg/ml essitalopraamiemästä. Se sisältää myös seuraavia inaktiivisia ainesosia: sorbitoli, puhdistettu vesi, sitruunahappo, natriumsitraatti, omenahappo, glyseriini, propyleeniglykoli, metyyliparabeeni, propyyliparabeeni ja luonnollinen piparminttuaromi.
INDIKAATIOT
Masennustila
Lexapro (escitalopraami) on tarkoitettu vakavan masennuksen akuuttiin ja ylläpitohoitoon aikuisilla ja 12–17-vuotiailla nuorilla [ks. Kliiniset tutkimukset ].
Vakava masennusjakso (DSM-IV) tarkoittaa näkyvää ja suhteellisen jatkuvaa (melkein joka päivä vähintään 2 viikon ajan) masentunutta tai dysforista mielialaa, joka yleensä häiritsee päivittäistä toimintaa ja sisältää vähintään viisi seuraavista yhdeksästä oireesta: masentunut mieliala, kiinnostuksen menetys tavanomaista toimintaa kohtaan, merkittävä painon ja/tai ruokahalun muutos, unettomuus tai hypersomnia, psykomotorinen kiihtyneisyys tai hidastuminen, lisääntynyt väsymys, syyllisyyden tai arvottomuuden tunne, hidastunut ajattelu tai keskittymiskyvyn heikkeneminen, itsemurhayritys tai itsemurha-ajatukset.
Yleistynyt ahdistuneisuushäiriö
Lexapro 20mg on tarkoitettu yleistyneen ahdistuneisuushäiriön (GAD) akuuttiin hoitoon aikuisilla [ks. Kliiniset tutkimukset ].
Yleistyneelle ahdistuneisuushäiriölle (DSM-IV) on ominaista liiallinen ahdistuneisuus ja huoli (pelkoinen odotus), joka kestää vähintään 6 kuukautta ja jota henkilön on vaikea hallita. Sen on liityttävä vähintään kolmeen seuraavista oireista: levottomuus tai levottomuus, väsymys, keskittymisvaikeudet tai mielen tyhjeneminen, ärtyneisyys, lihasjännitys ja unihäiriöt.
ANNOSTELU JA HALLINNOINTI
Lexapro 5 mg tulee ottaa kerran päivässä, aamulla tai illalla, ruoan kanssa tai ilman.
Masennustila
Alkuhoito
Nuoret
Suositeltu Lexapro-annos on 10 mg kerran päivässä. Lexapron joustava annoskoe (10-20 mg/vrk) osoitti Lexapron tehokkuuden [katso Kliiniset tutkimukset ]. Jos annosta suurennetaan 20 mg:aan, sen pitäisi tapahtua vähintään kolmen viikon kuluttua.
Aikuiset
Lexapro 10 mg:n suositeltu annos on 10 mg kerran vuorokaudessa. Kiinteän annoksen Lexapro-koe osoitti sekä 10 mg:n että 20 mg:n Lexapro 5 mg:n tehokkuuden, mutta ei osoittanut suurempaa hyötyä 20 mg:sta kuin 10 mg:sta [ks. Kliiniset tutkimukset ]. Jos annosta suurennetaan 20 mg:aan, tämän pitäisi tapahtua vähintään viikon kuluttua.
Ylläpitohoito
Yleisesti ollaan samaa mieltä siitä, että vakavan masennushäiriön akuutit jaksot vaativat useita kuukausia tai pidempään jatkuvaa farmakologista hoitoa akuutin episodin vastaisen vasteen lisäksi. Lexapron 10 tai 20 mg/vrk jatkuvan käytön systemaattinen arviointi aikuispotilailla, joilla oli vakava masennushäiriö ja jotka reagoivat Lexapron käytön aikana 8 viikon akuutin hoitovaiheen aikana, osoitti tällaisen ylläpitohoidon hyödyn [ks. Kliiniset tutkimukset ]. Lääkärin, joka päättää käyttää Lexapro 5 mg:aa pitkiä aikoja, tulee kuitenkin säännöllisesti arvioida uudelleen lääkkeen pitkän aikavälin hyödyllisyys yksittäiselle potilaalle. Potilaat tulee säännöllisesti arvioida uudelleen ylläpitohoidon tarpeen määrittämiseksi.
Yleistynyt ahdistuneisuushäiriö
Alkuhoito
Aikuiset
Lexapron suositeltu aloitusannos on 10 mg kerran vuorokaudessa. Jos annosta suurennetaan 20 mg:aan, tämän pitäisi tapahtua vähintään viikon kuluttua.
Ylläpitohoito
Yleistynyt ahdistuneisuushäiriö tunnustetaan krooniseksi sairaudeksi. Lexapron tehoa GAD:n hoidossa yli 8 viikon ajan ei ole tutkittu systemaattisesti. Lääkärin, joka päättää käyttää Lexaproa pitkiä aikoja, tulee säännöllisesti arvioida uudelleen lääkkeen pitkän aikavälin hyödyllisyys yksittäiselle potilaalle.
Kaksisuuntaisen mielialahäiriön näyttö ennen Lexapron käynnistämistä
Ennen kuin aloitat hoidon Lexaprolla tai muulla masennuslääkeellä, tarkista potilaiden suvussa kaksisuuntainen mielialahäiriö, mania tai hypomania [ks. VAROITUKSET JA VAROTOIMET ].
Erikoispopulaatiot
10 mg/vrk on suositusannos useimmille iäkkäille potilaille ja potilaille, joilla on maksan vajaatoiminta.
Annosta ei tarvitse muuttaa potilailla, joilla on lievä tai kohtalainen munuaisten vajaatoiminta. Lexaproa tulee käyttää varoen potilailla, joilla on vaikea munuaisten vajaatoiminta.
Lexapro-hoidon lopettaminen
Lexapro 5mg:n ja muiden SSRI- ja SNRI-lääkkeiden käytön lopettamiseen liittyviä oireita on raportoitu [ks. VAROITUKSET JA VAROTOIMET ]. Potilaita tulee seurata näiden oireiden varalta, kun hoito lopetetaan. Annoksen asteittaista pienentämistä äkillisen lopettamisen sijaan suositellaan aina kun mahdollista. Jos sietämättömiä oireita ilmaantuu annoksen pienentämisen tai hoidon lopettamisen jälkeen, voidaan harkita jatkamista aiemmin määrätyllä annoksella. Tämän jälkeen lääkäri voi jatkaa annoksen pienentämistä, mutta asteittain.
Potilaan vaihtaminen psykiatristen häiriöiden hoitoon tarkoitettuun monoamiinioksidaasin estäjään (MAOI)
Psykiatristen häiriöiden hoitoon tarkoitetun MAO-estäjän käytön lopettamisen ja Lexapro-hoidon aloittamisen välillä tulee kulua vähintään 14 päivää. Sitä vastoin Lexapro 20 mg:n lopettamisen jälkeen tulisi varata vähintään 14 päivää ennen MAO-estäjän aloittamista psykiatristen häiriöiden hoitoon [ks. VASTA-AIHEET ].
Lexapron käyttö muiden MAO-estäjien, kuten linetsolidin tai metyleenisinisen, kanssa
Älä aloita Lexapro 5 mg -hoitoa potilaalle, jota hoidetaan linetsolidilla tai suonensisäisellä metyleenisinisellä, koska serotoniinioireyhtymän riski on lisääntynyt. Potilaalla, joka tarvitsee psykiatrisen tilan kiireellistä hoitoa, tulee harkita muita toimenpiteitä, mukaan lukien sairaalahoitoa [ks. VASTA-AIHEET ].
Joissakin tapauksissa potilas, joka saa jo Lexapro 10 mg -hoitoa, saattaa vaatia kiireellistä linetsolidia tai suonensisäistä metyleenisinistä hoitoa. Jos hyväksyttäviä vaihtoehtoja linetsolidi- tai suonensisäiselle metyleenisinihoidolle ei ole saatavilla ja linetsolidi- tai suonensisäisen metyleenisinihoidon mahdollisten hyötyjen katsotaan olevan suurempia kuin serotoniinioireyhtymän riskit tietyllä potilaalla, Lexapro on lopetettava välittömästi ja linetsolidi tai suonensisäinen metyleenisininen voidaan antaa. Potilasta tulee tarkkailla serotoniinioireyhtymän oireiden varalta 2 viikon ajan tai 24 tunnin ajan viimeisen linetsolidin tai suonensisäisen metyleenisinisen annoksen jälkeen sen mukaan, kumpi tulee ensin. Lexapro-hoitoa voidaan jatkaa 24 tuntia viimeisen linetsolidin tai suonensisäisen metyleenisinisen annoksen jälkeen [ks. VAROITUKSET JA VAROTOIMET ].
Riski metyleenisinisen antamisesta ei-intravenoosisesti (kuten suun kautta otettavien tablettien tai paikallisten injektioiden kautta) tai suonensisäisinä annoksina, jotka ovat paljon pienempiä kuin 1 mg/kg Lexapro 10 mg:n kanssa, on epäselvä. Kliinikon tulee kuitenkin olla tietoinen serotoniinioireyhtymän oireiden mahdollisuudesta tällaisen käytön yhteydessä [ks. VAROITUKSET JA VAROTOIMET ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Tabletit
Lexapro 10 mg tabletit ovat kalvopäällysteisiä, pyöreitä tabletteja, jotka sisältävät essitalopraamioksalaattia vahvuuksina, jotka vastaavat 5 mg, 10 mg ja 20 mg essitalopraamiemästä. 10 ja 20 mg:n tableteissa on jakouurre. Toiselle puolelle painettu "FL" ja toiselle puolelle joko "5", "10" tai "20" niiden vahvuuksien mukaan.
Oraaliliuos
Lexapro oraaliliuos sisältää essitalopraamioksalaattia, joka vastaa 1 mg/ml essitalopraamiemästä (ei tällä hetkellä myynnissä).
Varastointi ja käsittely
Tabletit
5 mg tabletit
Pullo 100 - NDC # 0456-2005-01
Valkoinen tai luonnonvalkoinen, pyöreä, uurteeton, kalvopäällysteinen. Tabletin toiselle puolelle painatus "FL" ja toiselle puolelle "5".
10 mg tabletit
Pullo 100 - NDC 0456-2010-01 10 x 10 yksikköannos - NDC # 0456-2010-63
Valkoisesta luonnonvalkoiseen, pyöreä, uurrettu, kalvopäällysteinen. Uurretulla puolella painatus, jossa "F" vasemmalla puolella ja "L" oikealla puolella. Uurteittamattomalla puolella painatus "10".
20 mg tabletit
Pullo 100 - NDC # 0456-2020-01 10 x 10 yksikköannos - NDC # 0456-2020-63
Valkoisesta luonnonvalkoiseen, pyöreä, uurrettu, kalvopäällysteinen. Uurretulla puolella painatus, jossa "F" vasemmalla puolella ja "L" oikealla puolella. Uurteittamattomalla puolella painatus "20".
Oraaliliuos
5 mg/5 ml, piparminttuaromi (240 ml) - NDC # 0456-2101-08. Oraaliliuosta ei tällä hetkellä markkinoida.
Varastointi ja käsittely
Säilytä 20°C - 25°C (68°F - 77°F); 15 - 30 °C (59 - 86 °F) lämpötilat sallitaan.
Jakelija: Allergan USA, Inc. Madison, NJ 07940. Tarkistettu: syyskuu 2021
SIVUVAIKUTUKSET
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset tehdään hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutusten määrää ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Kliinisten tutkimusten tietolähteet
Pediatria (6-17 vuotta)
Haittatapahtumat kerättiin kaksoissokkoutetuissa lumekontrolloiduissa tutkimuksissa 576:lta lapsipotilaalta (286 Lexapro 5 mg, 290 lumelääkettä), joilla oli vakava masennushäiriö. Lexapro 5 mg:n turvallisuutta ja tehoa alle 12-vuotiailla lapsipotilailla ei ole osoitettu.
Aikuiset
Tiedot Lexapro 5 mg:n haittavaikutuksista kerättiin 715 potilaalta, joilla oli vaikea masennus ja jotka altistettiin essitalopraamille, ja 592 potilaalta, jotka altistettiin lumelääkettä kaksoissokkoutetuissa, lumekontrolloiduissa tutkimuksissa. Lisäksi 284 vakavaa masennusta sairastavaa potilasta altistui äskettäin essitalopraamille avoimissa tutkimuksissa. Tiedot Lexapron haittavaikutuksista GAD-potilailla kerättiin 429 essitalopraamille altistuneelta potilaalta ja 427 lumelääkettä saaneelta potilaalta kaksoissokkoutetuissa, lumekontrolloiduissa tutkimuksissa.
Haittatapahtumat altistumisen aikana saatiin ensisijaisesti yleisellä tiedustelulla, ja kliiniset tutkijat kirjasivat ne omalla terminologiallaan. Näin ollen ei ole mahdollista antaa mielekästä arviota haittatapahtumia kokeneiden henkilöiden osuudesta ilman, että samantyyppiset tapahtumat ensin ryhmitellään pienempään määrään standardoituja tapahtumaluokkia. Seuraavissa taulukoissa ja taulukoissa on käytetty Maailman terveysjärjestön (WHO) standarditerminologiaa raportoitujen haittatapahtumien luokittelussa.
Ilmoitetut haittavaikutusten esiintymistiheydet edustavat niiden henkilöiden osuutta, jotka ovat kokeneet vähintään kerran mainitun tyyppisen hoitoon liittyvän haittatapahtuman. Tapahtuma katsottiin hoitoon liittyväksi, jos se tapahtui ensimmäistä kertaa tai paheni hoidon aikana lähtötilanteen arvioinnin jälkeen.
Hoidon keskeyttämiseen liittyvät haittatapahtumat
Masennustila
Pediatria (6-17 vuotta)
Haittatapahtumat liittyivät hoidon lopettamiseen 3,5 %:lla Lexaproa saaneista 286 potilaasta ja 1 %:lla 290 lumelääkettä saaneesta potilaasta. Yleisin hoidon lopettamiseen liittyvä haittatapahtuma (vähintään 1 % Lexaprolla 10 mg ja enemmän kuin lumelääkkeellä) oli unettomuus (1 % Lexapro, 0 % lumelääke).
Aikuiset
Niistä 715 masentuneesta potilaasta, jotka saivat Lexaproa lumekontrolloiduissa tutkimuksissa, 6 % keskeytti hoidon haittatapahtuman vuoksi, kun taas 2 % lumelääkettä saaneesta 592 potilaasta. Kahdessa kiinteäannoksisessa tutkimuksessa 10 mg/vrk Lexapro 20 mg:aa saaneiden potilaiden haittatapahtumien keskeyttämisnopeus ei eronnut merkitsevästi haittatapahtumien keskeyttämisnopeudesta lumelääkettä saavilla potilailla. Haittatapahtumien keskeyttämisprosentti potilailla, joille oli annettu kiinteä annos 20 mg/vrk Lexaproa, oli 10 %, mikä erosi merkittävästi haittatapahtumien keskeyttämisasteesta potilailla, jotka saivat 10 mg/vrk Lexaproa (4 %) ja lumelääkettä. (3 %). Haittatapahtumat, jotka liittyivät vähintään 1 %:lla Lexapro 5 mg:lla hoidetuista potilaista lopettamiseen ja joiden esiintyvyys oli vähintään kaksinkertainen lumelääkkeeseen verrattuna, olivat pahoinvointi (2 %) ja siemensyöksyhäiriö (2 % miespotilaista).
Yleistynyt ahdistuneisuushäiriö
Aikuiset
Niistä 429 GAD-potilaasta, jotka saivat Lexaproa 10–20 mg/vrk lumekontrolloiduissa tutkimuksissa, 8 % keskeytti hoidon haittatapahtuman vuoksi, kun taas 4 % lumelääkettä saaneesta 427 potilaasta. Haittatapahtumat, jotka liittyivät vähintään 1 %:lla Lexapro 20 mg:lla hoidetuista potilaista lopettamiseen ja joiden esiintyvyys oli vähintään kaksinkertainen lumelääkkeeseen verrattuna, olivat pahoinvointi (2 %), unettomuus (1 %) ja väsymys (1 %).
Haittavaikutusten ilmaantuvuus lumekontrolloiduissa kliinisissä tutkimuksissa
Masennustila
Pediatria (6-17 vuotta)
Lapsipotilaiden haittavaikutusten kokonaisprofiili oli yleensä samanlainen kuin aikuistutkimuksissa havaittu, kuten taulukosta 2 käy ilmi. Kuitenkin seuraavat haittavaikutukset (lukuun ottamatta niitä, jotka näkyvät taulukossa 2 ja joiden koodatut termit eivät olleet informatiivisia tai harhaanjohtavia) ) ilmaantuvuus oli vähintään 2 % Lexaprossa ja suurempi kuin lumelääke: selkäkipu, virtsatietulehdus, oksentelu ja nenän tukkoisuus.
Aikuiset
Yleisimmin havaitut haittavaikutukset Lexapro 10 mg potilailla (esiintyvyys noin 5 % tai enemmän ja noin kaksinkertainen esiintyvyys lumelääkepotilailla) olivat unettomuus, siemensyöksyhäiriö (pääasiassa siemensyöksyn viivästyminen), pahoinvointi, lisääntynyt hikoilu, väsymys ja uneliaisuus.
Taulukossa 2 luetellaan lähimpään prosenttiin pyöristettynä hoidon aiheuttamien haittatapahtumien ilmaantuvuus 715 masentuneella potilaalla, jotka saivat Lexaproa 20 mg:n annoksilla 10-20 mg/vrk lumekontrolloiduissa tutkimuksissa. Mukana ovat tapahtumat, joita esiintyy vähintään 2 %:lla Lexapro 20 mg:lla hoidetuista potilaista ja joiden ilmaantuvuus Lexapro 10 mg:lla hoidetuilla potilailla oli suurempi kuin lumelääkettä saaneiden potilaiden ilmaantuvuus.
TAULUKKO 2 Hoitoon liittyvät haittavaikutukset, joiden esiintymistiheys on ≥ 2 % ja suurempi kuin lumelääke vakavassa masennushäiriössä
Yleistynyt ahdistuneisuushäiriö
Aikuiset
Yleisimmin havaitut haittavaikutukset Lexapro-potilailla (esiintyvyys noin 5 % tai enemmän ja noin kaksinkertainen esiintyvyys lumelääkepotilailla) olivat pahoinvointi, siemensyöksyhäiriö (pääasiassa siemensyöksyn viivästyminen), unettomuus, väsymys, libidon heikkeneminen ja anorgasmia.
luetellaan ilmaantuvuus pyöristettynä lähimpään prosenttiin hoidon aiheuttamista haittatapahtumista, joita esiintyi 429 GAD-potilaalla, jotka saivat Lexaproa 10-20 mg/vrk lumekontrolloiduissa tutkimuksissa. Mukana ovat tapahtumat, joita esiintyy 2 %:lla tai useammalla Lexaprolla hoidetuista potilaista ja joiden ilmaantuvuus Lexaprolla hoidetuilla potilailla oli suurempi kuin lumelääkettä saaneiden potilaiden ilmaantuvuus.
TAULUKKO 3 Yleistyneen ahdistuneisuushäiriön hoitoon liittyvät haittavaikutukset, joiden esiintymistiheys on ≥ 2 % ja suurempi kuin lumelääke
Annosriippuvuus haittavaikutuksista
Yleisten haittavaikutusten mahdollista annosriippuvuutta (määritelty ilmaantuvuusasteeksi ≥ 5 % joko 10 mg:n tai 20 mg:n Lexapro-ryhmissä) tutkittiin haittavaikutusten yhdistetyn ilmaantuvuuden perusteella kahdessa kiinteän annoksen tutkimuksessa. Haittavaikutusten yleinen ilmaantuvuus 10 mg Lexaprolla hoidetuilla potilailla (66 %) oli samanlainen kuin lumelääkettä saaneilla potilailla (61 %), kun taas ilmaantuvuus 20 mg/vrk Lexaprolla hoidetuilla potilailla oli suurempi (86 %). Taulukossa 4 on esitetty yleisiä haittavaikutuksia, joita esiintyi Lexapro-ryhmässä 20 mg/vrk ja joiden ilmaantuvuus oli noin kaksi kertaa suurempi kuin 10 mg/vrk Lexapro 10 mg:n ryhmässä ja noin kaksi kertaa lumelääkeryhmässä.
TAULUKKO 4 Yleisten haittavaikutusten ilmaantuvuus potilailla, joilla on vakava masennushäiriö
Miesten ja naisten seksuaalinen toimintahäiriö SSRI-lääkkeiden kanssa
Vaikka muutokset seksuaalisessa halussa, seksuaalisessa suorituskyvyssä ja seksuaalisessa tyytyväisyydessä esiintyvät usein psykiatrisen häiriön ilmenemismuotoina, ne voivat olla myös seurausta lääkehoidosta. Erityisesti jotkut todisteet viittaavat siihen, että SSRI-lääkkeet voivat aiheuttaa tällaisia epämiellyttäviä seksuaalisia kokemuksia.
Luotettavia arvioita seksuaaliseen haluun, suorituskykyyn ja tyytyväisyyteen liittyvien ei-toivottujen kokemusten esiintyvyydestä ja vakavuudesta on kuitenkin vaikea saada osittain siksi, että potilaat ja lääkärit saattavat olla haluttomia keskustelemaan niistä. Näin ollen tuotemerkinnöissä mainitut arviot epämiellyttävien seksuaalisten kokemusten ja suoritusten esiintyvyydestä aliarvioivat todennäköisesti niiden todellisen esiintyvyyden.
TAULUKKO 5 Seksuaalisten sivuvaikutusten ilmaantuvuus lumekontrolloiduissa kliinisissä tutkimuksissa
Ei ole olemassa riittävästi suunniteltuja tutkimuksia, joissa tutkittaisiin essitalopraamihoidon seksuaalisia toimintahäiriöitä.
Priapismia on raportoitu kaikkien SSRI-lääkkeiden yhteydessä.
Vaikka SSRI-lääkkeiden käyttöön liittyvän seksuaalisen toimintahäiriön tarkkaa riskiä on vaikea tietää, lääkäreiden tulee rutiininomaisesti tiedustella tällaisia mahdollisia sivuvaikutuksia.
Elintoimintojen muutokset
Lexapro 5 mg:n ja lumelääkkeen ryhmiä verrattiin suhteessa (1) elintoimintojen (pulssi, systolinen verenpaine ja diastolinen verenpaine) keskimääräiseen muutokseen lähtötasosta ja (2) sellaisten potilaiden ilmaantuvuuden suhteen, jotka täyttivät mahdollisesti kliinisesti merkittävien muutosten kriteerit lähtötasosta. nämä muuttujat. Nämä analyysit eivät paljastaneet kliinisesti merkittäviä muutoksia Lexapro 20 mg -hoitoon liittyvissä elintoiminnoissa. Lisäksi Lexapro 20 mg:aa saaneiden potilaiden elintoimintojen mittausten vertailu selässä ja seistessä osoitti, että Lexapro-hoitoon ei liity ortostaattisia muutoksia.
Painon muutokset
Kontrolloiduissa tutkimuksissa Lexaprolla hoidetut potilaat eivät eronneet lumelääkettä saaneista potilaista kliinisesti merkittävän painon muutoksen suhteen.
Laboratoriomuutokset
Lexapro 5 mg:n ja lumelääkeryhmiä verrattiin suhteessa (1) keskimääräiseen muutokseen lähtötilanteesta eri seerumin kemian, hematologian ja virtsan analyysimuuttujien osalta ja (2) niiden potilaiden ilmaantuvuuden suhteen, jotka täyttivät näiden muuttujien mahdollisesti kliinisesti merkittävien muutosten kriteerit lähtötasosta. Nämä analyysit eivät paljastaneet kliinisesti merkittäviä muutoksia Lexapro-hoitoon liittyvissä laboratoriotestien parametreissa.
EKG:n muutokset
Lexapro- (N=625) ja lumelääke (N=527) ryhmien elektrokardiogrammeja verrattiin poikkeaviin arvoihin, jotka määriteltiin koehenkilöiksi, joiden QTc:n muutokset olivat yli 60 ms lähtötasosta tai absoluuttiset arvot yli 500 ms annoksen jälkeen, ja henkilöihin, joiden syke nousi yli 100 lyöntiä minuutissa tai laskee alle 50 lyöntiä minuutissa 25 %:n muutoksella lähtötilanteesta (takykardian tai bradykardian poikkeavuudet, vastaavasti). Yhdelläkään Lexapro 20 mg -ryhmän potilaista ei ollut QTcF-aikaa > 500 ms tai pidentynyt > 60 ms verrattuna 0,2 %:iin lumeryhmässä. Takykardian poikkeamien ilmaantuvuus oli 0,2 % Lexapro 5 mg:n ja lumelääkeryhmässä. Bradykardian poikkeamien ilmaantuvuus oli 0,5 % Lexapro 10 mg:n ryhmässä ja 0,2 % lumeryhmässä.
QTcF-aikaa arvioitiin satunnaistetussa, lumelääke- ja aktiivisessa (400 mg moksifloksasiini) kontrolloidussa ristikkäistutkimuksessa, jossa toistuvaannostutkimukseen osallistui 113 tervettä henkilöä. Suurin keskimääräinen (95 %:n ylempi luottamusraja) ero lumeryhmästä oli 4,5 (6,4) ja 10,7 (12,7) ms, kun essitalopraami 10 mg annettiin kerran vuorokaudessa ja supraterapeuttinen 30 mg essitalopraami. Vakiintuneen altistus-vaste-suhteen perusteella ennustettu QTcF:n muutos lumeryhmästä (95 %:n luottamusväli) Cmax-arvon alle 20 mg:n annoksella on 6,6 (7,9) ms. Kun essitalopraami 30 mg kerran vuorokaudessa annettuna, keskimääräinen Cmax oli 1,7 kertaa korkeampi kuin keskimääräinen Cmax vakaassa tilassa suositellulla suurimmalla terapeuttisella annoksella (20 mg). Altistus supraterapeuttisella 30 mg:n annoksella on samanlainen kuin vakaan tilan pitoisuudet, joita odotetaan CYP2C19:n hitailla metaboloijilla 20 mg:n terapeuttisen annoksen jälkeen.
Muita Lexapron markkinointia edeltävän arvioinnin aikana havaittuja reaktioita
Seuraavassa on luettelo hoidon aiheuttamista haittatapahtumista, sellaisina kuin ne on määritelty julkaisun johdannossa HAITTAVAIKUTUKSET osa, jonka raportoivat 1428 potilasta, joita hoidettiin Lexaprolla enintään vuoden ajan kaksoissokkoutetuissa tai avoimissa kliinisissä tutkimuksissa sen markkinoille saattamista edeltävän arvioinnin aikana. Luettelo ei sisällä niitä tapahtumia, jotka on jo lueteltu niissä tapahtumissa, joissa huumeiden syy oli kaukainen ja alle 1 % tai vähemmän kuin lumelääke, tapahtumat, jotka olivat niin yleisiä, että ne eivät olleet informatiivisia, ja tapahtumat, jotka raportoitiin vain kerran, ei ollut merkittävää todennäköisyyttä olla akuuttisti hengenvaarallinen. Tapahtumat luokitellaan kehojärjestelmän mukaan. Kliinisesti merkittäviä tapahtumia kuvataan julkaisussa VAROITUKSET JA VAROTOIMET osio.
Kardiovaskulaarinen - verenpainetauti, sydämentykytys.
Keskus- ja ääreishermoston häiriöt - huimaus, migreeni.
Ruoansulatuskanavan häiriöt -vatsakrampit, närästys, gastroenteriitti.
Kenraali - allergia, rintakipu, kuume, kuumat aallot, raajakipu.
Aineenvaihdunta- ja ravitsemushäiriöt - lisääntynyt paino.
Tuki- ja liikuntaelimistön häiriöt - nivelkipu, myalgia leuan jäykkyys.
Psykiatriset häiriöt ruokahalun lisääntyminen, keskittymiskyvyn heikkeneminen, ärtyneisyys.
Lisääntymishäiriöt/nainen - kuukautiskipuja, kuukautiskiertohäiriöitä.
Hengityselinten häiriöt - keuhkoputkentulehdus, yskä, nenän tukkoisuus, poskionteloiden tukkoisuus, poskiontelopäänsärky.
Ihon ja umpilisäkkeiden häiriöt - ihottuma.
Erityiset aistit - näön hämärtyminen, tinnitus.
Virtsatiejärjestelmän häiriöt - virtsaamistiheys, virtsatietulehdus.
Markkinoinnin jälkeinen kokemus
Escitalopraamin markkinoinnin jälkeen raportoidut haittavaikutukset
Seuraavat haittavaikutukset on tunnistettu Lexapron hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Veri- ja imusolmukkeiden häiriöt: anemia, agranulosyytti, aplastinen anemia, hemolyyttinen anemia, idiopaattinen trombosytopeniapurppura, leukopenia, trombosytopenia.
Sydänhäiriöt: eteisvärinä, bradykardia, sydämen vajaatoiminta, sydäninfarkti, takykardia, torsade de pointes, kammiorytmia, kammiotakykardia.
Korvan ja labyrintin häiriöt: huimaus
Endokriiniset häiriöt: diabetes mellitus, hyperprolaktinemia, SIADH.
Silmäsairaudet: kulmaglaukooma, diplopia, mydriaasi, näköhäiriöt.
Ruoansulatuskanavan häiriö: dysfagia, maha-suolikanavan verenvuoto, gastroesofageaalinen refluksi, haimatulehdus, peräsuolen verenvuoto.
Yleiset häiriöt ja hallintosivuston ehdot: epänormaali kävely, voimattomuus, turvotus, kaatuminen, epänormaali olo, huonovointisuus.
Maksan ja sappien häiriöt: fulminantti hepatiitti, maksan vajaatoiminta, maksanekroosi, hepatiitti.
Immuunijärjestelmän häiriöt: allerginen reaktio, anafylaksia.
Tutkimukset: bilirubiinin nousu, painon lasku, elektrokardiogrammin QT-ajan pidentyminen, maksaentsyymiarvojen nousu, hyperkolesterolemia, INR-arvon nousu, protrombiinin lasku.
Aineenvaihdunta- ja ravitsemushäiriöt: hyperglykemia, hypoglykemia, hypokalemia, hyponatremia.
Tuki- ja liikuntaelimistön ja sidekudosten häiriöt: lihaskrampit, lihasjäykkyys, lihasheikkous, rabdomyolyysi.
Hermoston häiriöt: akatisia, muistinmenetys, ataksia, koreoatetoosi, aivoverisuonihäiriö, dysartria, dyskinesia, dystonia, ekstrapyramidaalihäiriöt, grand mal -kohtaukset (tai kouristukset), hypoestesia, myoklonus, nystagmus, Parkinsonismi, levottomat jalat, dystoria, kouristukset,
Raskaus, synnytys ja perinataalit tilat: spontaani abortti.
Psyykkiset häiriöt: akuutti psykoosi, aggressio, kiihtyneisyys, viha, ahdistuneisuus, apatia, valmistunut itsemurha, sekavuus, depersonalisaatio, masennus pahentunut, delirium, harha, sekavuus, epätodellinen tunne, hallusinaatiot (näkö- ja kuulo), mielialan vaihtelut, hermostuneisuus, painajainen, paniikkireaktio, vainoharhaisuus , levottomuus, itsensä vahingoittaminen tai ajatukset itsensä vahingoittamisesta, itsemurhayritys, itsemurha-ajatukset, itsemurhataipumus.
Munuaisten ja virtsateiden häiriöt: akuutti munuaisten vajaatoiminta, dysuria, virtsan kertymä.
Lisääntymisjärjestelmän ja rintojen häiriöt: menorragia, priapismi.
Hengityselinten, rintakehän ja välikarsinan häiriöt: hengenahdistus, nenäverenvuoto, keuhkoembolia, vastasyntyneen keuhkoverenpainetauti. Ihon ja ihonalaisten kudosten häiriöt: hiustenlähtö, angioödeema, dermatiitti, mustelma, erythema multiforme, valoherkkyysreaktio, Stevens Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi, urtikaria.
Verisuonihäiriöt: syvä laskimotukos, punoitus, hypertensiivinen kriisi, hypotensio, ortostaattinen hypotensio, flebiitti, tromboosi.
HUUMEIDEN VUOROVAIKUTUKSET
Monoamiinioksidaasin estäjät (MAOI)
[Katso ANNOSTELU JA HALLINNOINTI ja , VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
Serotonergiset lääkkeet
[Katso ANNOSTELU JA HALLINNOINTI ja , VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
Triptaanit
Markkinoille tulon jälkeen on raportoitu harvoin serotoniinioireyhtymää SSRI:n ja triptaanin käytön yhteydessä. Jos Lexapro 10 mg:n samanaikainen hoito triptaanin kanssa on kliinisesti perusteltua, potilaan huolellinen seuranta on suositeltavaa, erityisesti hoidon aloittamisen ja annosta suurennettaessa [ks. VAROITUKSET JA VAROTOIMET ].
Keskushermostolääkkeet
Essitalopraamin ensisijaiset keskushermostovaikutukset huomioon ottaen on noudatettava varovaisuutta, kun sitä käytetään yhdessä muiden keskushermostoon vaikuttavien lääkkeiden kanssa.
Alkoholi
Vaikka Lexapro ei voimistanut alkoholin kognitiivisia ja motorisia vaikutuksia kliinisessä tutkimuksessa, kuten muiden psykotrooppisten lääkkeiden kanssa, Lexaproa käyttävien potilaiden alkoholin käyttöä ei suositella.
Hemostaasia häiritsevät lääkkeet (NSAID:t, aspiriini, varfariini jne.)
Verihiutaleiden vapauttamalla serotoniinia on tärkeä rooli hemostaasissa. Epidemiologiset tutkimukset tapauskontrollista ja kohorttisuunnittelusta, jotka ovat osoittaneet yhteyden serotoniinin takaisinottoa häiritsevien psykotrooppisten lääkkeiden käytön ja ylemmän maha-suolikanavan verenvuodon välillä, ovat myös osoittaneet, että NSAID-lääkkeen tai aspiriinin samanaikainen käyttö voi lisätä verenvuotoriskiä. Muuttuneita antikoagulanttivaikutuksia, mukaan lukien lisääntynyt verenvuoto, on raportoitu, kun SSRI-lääkkeitä ja SNRI-lääkkeitä on annettu samanaikaisesti varfariinin kanssa. Varfariinihoitoa saavia potilaita tulee seurata huolellisesti, kun Lexapro-hoito aloitetaan tai lopetetaan.
Simetidiini
Koehenkilöillä, jotka olivat saaneet 21 päivän ajan raseemista sitalopraamia 40 mg/vrk, yhdistetty 400 mg:n simetidiinin antaminen kahdesti vuorokaudessa 8 päivän ajan johti sitalopraamin AUC:n nousuun 43 % ja Cmax:iin 39 %. Näiden löydösten kliinistä merkitystä ei tunneta.
Digoksiini
Koehenkilöillä, jotka olivat saaneet 21 päivän ajan raseemista sitalopraamia 40 mg/vrk, sitalopraamin ja digoksiinin yhdistetty anto (1 mg:n kerta-annos) ei vaikuttanut merkittävästi sitalopraamin tai digoksiinin farmakokinetiikkaan.
Litium
Raseemisen sitalopraamin (40 mg/vrk 10 päivän ajan) ja litiumin (30 mmol/vrk 5 päivän ajan) samanaikaisella antamisella ei ollut merkittävää vaikutusta sitalopraamin tai litiumin farmakokinetiikkaan. Plasman litiumpitoisuuksia on kuitenkin seurattava ja sovitettava litiumia asianmukaisesti tavallisen kliinisen käytännön mukaisesti. Koska litium voi voimistaa essitalopraamin serotonergisiä vaikutuksia, varovaisuutta tulee noudattaa käytettäessä Lexapro 5 mg:aa litiumin kanssa samanaikaisesti.
Pimotsidi ja Celexa
Kontrolloidussa tutkimuksessa pimotsidin 2 mg:n kerta-annos annettuna yhdessä raseemisen sitalopraamin 40 mg:n kanssa kerran vuorokaudessa 11 päivän ajan liittyi QTc-arvojen keskimääräiseen nousuun noin 10 ms verrattuna pelkkään pimotsidiin. Raseeminen sitalopraami ei muuttanut pimotsidin keskimääräistä AUC- tai Cmax-arvoa. Tämän farmakodynaamisen yhteisvaikutuksen mekanismia ei tunneta.
Sumatriptaani
Markkinoille tulon jälkeen on raportoitu harvoin potilaita, joilla on heikkoutta, hyperrefleksiaa ja koordinaatiohäiriöitä SSRI:n ja sumatriptaanin käytön jälkeen. Jos samanaikainen hoito sumatriptaanilla ja SSRI:llä (esim. fluoksetiini, fluvoksamiini, paroksetiini, sertraliini, sitalopraami, essitalopraami) on kliinisesti perusteltua, potilaan asianmukainen seuranta on suositeltavaa.
Teofylliini
Raseemisen sitalopraamin (40 mg/vrk 21 päivän ajan) ja CYP1A2-substraatin teofylliinin (300 mg:n kerta-annos) yhdistelmähoito ei vaikuttanut teofylliinin farmakokinetiikkaan. Teofylliinin vaikutusta sitalopraamin farmakokinetiikkaan ei arvioitu.
Varfariini
Raseemisen sitalopraamin antaminen 40 mg/vrk 21 päivän ajan ei vaikuttanut varfariinin, CYP3A4-substraatin, farmakokinetiikkaan. Protrombiiniaika nousi 5 %, jonka kliinistä merkitystä ei tunneta.
Karbamatsepiini
Raseemisen sitalopraamin (40 mg/vrk 14 päivän ajan) ja karbamatsepiinin (titrattu 400 mg/vrk 35 päivän ajan) yhdistelmä ei vaikuttanut merkitsevästi CYP3A4-substraatin karbamatsepiinin farmakokinetiikkaan. Vaikka sitalopraamin pitoisuudet plasmassa eivät muuttuneet, karbamatsepiinin entsyymejä indusoivat ominaisuudet huomioon ottaen on otettava huomioon mahdollisuus, että karbamatsepiini lisää essitalopraamin puhdistumaa, jos näitä kahta lääkettä annetaan samanaikaisesti.
Triatsolaami
Raseemisen sitalopraamin (titrattu annokseen 40 mg/vrk 28 päivän ajan) ja CYP3A4-substraattitriatsolaamin (0,25 mg:n kerta-annos) yhdistelmä ei vaikuttanut merkittävästi sitalopraamin tai triatsolaamin farmakokinetiikkaan.
Ketokonatsoli
Raseemisen sitalopraamin (40 mg) ja ketokonatsolin (200 mg), joka on voimakas CYP3A4:n estäjä, yhdistelmäkäyttö alensi ketokonatsolin Cmax-arvoa 21 % ja AUC 10 %, eikä se vaikuttanut merkittävästi sitalopraamin farmakokinetiikkaan.
Ritonaviiri
Ritonaviirin (600 mg), joka on CYP3A4:n substraatti ja voimakas CYP3A4:n estäjä, ja essitalopraamin (20 mg) kerta-annos ei vaikuttanut ritonaviirin eikä essitalopraamin farmakokinetiikkaan.
CYP3A4- ja -2C19-estäjät
In vitro -tutkimukset osoittivat, että CYP3A4 ja -2C19 ovat ensisijaiset entsyymit, jotka osallistuvat essitalopraamin metaboliaan. Essitalopraamin (20 mg) ja ritonaviirin (600 mg), joka on voimakas CYP3A4:n estäjä, samanaikainen anto ei kuitenkaan vaikuttanut merkitsevästi essitalopraamin farmakokinetiikkaan. Koska essitalopraami metaboloituu useiden entsyymijärjestelmien toimesta, yhden entsyymin estäminen ei välttämättä vähennä essitalopraamin puhdistumaa merkittävästi.
Sytokromi P4502D6:n metaboloimat lääkkeet
In vitro -tutkimukset eivät paljastaneet essitalopraamin CYP2D6:ta estävää vaikutusta. Lisäksi raseemisen sitalopraamin vakaan tilan tasot eivät eronneet merkitsevästi hitailla metaboloijilla ja voimakkailla CYP2D6-metabolioijilla sitalopraamin toistuvan annon jälkeen, mikä viittaa siihen, että CYP2D6:ta estävän lääkkeen samanaikaisella antamisella essitalopraamin kanssa ei todennäköisesti ole kliinisesti merkittäviä vaikutuksia. escitalopraamin aineenvaihdunta. In vivo -tietoja on kuitenkin rajoitetusti, joka viittaa essitalopraamin vähäiseen CYP2D6:ta estävään vaikutukseen, eli essitalopraamin (20 mg/vrk 21 päivän ajan) ja trisyklisen masennuslääkkeen desipramiinin (50 mg:n kerta-annos), CYP2D6:n substraatti, samanaikainen anto johti. desipramiinin Cmax-arvon nousu 40 % ja AUC 100 %. Tämän löydön kliinistä merkitystä ei tunneta. Varovaisuutta on kuitenkin noudatettava käytettäessä essitalopraamia samanaikaisesti CYP2D6:n kautta metaboloituvien lääkkeiden kanssa.
Metoprololi
Annos 20 mg/vrk 20 mg Lexaproa 21 päivän ajan terveille vapaaehtoisille johti beetasalpaajan metoprololin (100 mg:n kerta-annoksena) Cmax-arvon nousuun 50 % ja AUC-arvoon 82 %:iin. Plasman kohonneet metoprololipitoisuudet on yhdistetty vähentyneeseen kardioselektiivisyyteen. Lexapro 5 mg:n ja metoprololin yhteiskäytöllä ei ollut kliinisesti merkittäviä vaikutuksia verenpaineeseen tai sykeen.
Sähkökonvulsiivinen hoito (ECT)
ECT:n ja essitalopraamin yhteiskäytöstä ei ole tehty kliinisiä tutkimuksia.
Huumeiden väärinkäyttö ja riippuvuus
Väärinkäyttö ja riippuvuus
Fyysinen ja psyykkinen riippuvuus
Eläintutkimukset viittaavat siihen, että raseemisen sitalopraamin väärinkäyttöriski on pieni. Lexapro 10 mg:aa ei ole systemaattisesti tutkittu ihmisillä sen mahdollisen väärinkäytön, sietokyvyn tai fyysisen riippuvuuden suhteen. Ennen markkinoille saattamista saatu kliininen kokemus Lexaprosta ei paljastanut huumeiden etsintäkäyttäytymistä. Nämä havainnot eivät kuitenkaan olleet systemaattisia, eikä tämän rajallisen kokemuksen perusteella ole mahdollista ennustaa, missä määrin keskushermostoon vaikuttavaa lääkettä käytetään väärin, ohjataan muualle ja/tai väärinkäyttöön sen jälkeen, kun se on markkinoitu. Tästä syystä lääkäreiden tulee huolellisesti arvioida Lexapro-potilaita huumeiden väärinkäytön historian varalta ja seurata tällaisia potilaita tarkasti ja tarkkailla heitä väärinkäytön merkkien varalta (esim. toleranssin kehittyminen, annoksen lisäys, huumeiden etsintäkäyttäytyminen).
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Nuorten ja nuorten aikuisten itsemurha-ajatukset ja -käyttäytyminen
Plasebokontrolloitujen masennuslääkkeiden (SSRI-lääkkeiden ja muiden masennuslääkeryhmien) tutkimusten yhdistetyissä analyyseissä, joihin osallistui noin 77 000 aikuispotilasta ja 4 500 lapsipotilasta, itsemurha-ajatusten ja -käyttäytymisen ilmaantuvuus masennuslääkehoitoa saaneilla 24-vuotiailla ja sitä nuoremmilla potilailla oli suurempi kuin lumelääkettä saaneilla potilailla. Itsemurha-ajatusten ja -käyttäytymisen riskissä oli huomattavia eroja lääkkeiden välillä, mutta useimpien tutkittujen lääkkeiden kohdalla havaittiin lisääntynyt riski nuorilla potilailla. Itsemurha-ajatusten ja -käyttäytymisen absoluuttisessa riskissä oli eroja eri käyttöaiheissa, ja suurin ilmaantuvuus oli MDD-potilailla. Lääkkeen ja lumelääkkeen erot itsemurha-ajatusten ja -käyttäytymisten määrässä tuhatta hoidettua potilasta kohden on esitetty
Ei tiedetä, ulottuuko itsemurha-ajatusten ja -käyttäytymisen riski lapsilla, nuorilla ja nuorilla aikuisilla pitkäaikaiseen käyttöön, eli yli neljään kuukauteen. Kuitenkin lumekontrolloiduista ylläpitotutkimuksista aikuisilla, joilla on MDD, on olemassa merkittäviä todisteita siitä, että masennuslääkkeet viivästävät masennuksen uusiutumista ja että masennus itsessään on itsemurha-ajatusten ja -käyttäytymisen riskitekijä.
Seuraa kaikkia masennuslääkkeitä saaneita potilaita kliinisen pahenemisen ja itsemurha-ajatusten ja -käyttäytymisen ilmaantumisen varalta, erityisesti lääkehoidon ensimmäisten kuukausien aikana ja annosmuutosten aikoina. Neuvo potilaiden perheenjäseniä tai hoitajia seuraamaan käyttäytymisensä muutoksia ja varoittamaan terveydenhuollon tarjoajaa. Harkitse hoito-ohjelman muuttamista, mukaan lukien Lexapro-hoidon mahdollista lopettamista potilailla, joiden masennus on jatkuvasti pahentunut tai joilla on syntyviä itsemurha-ajatuksia tai -käyttäytymistä.
Serotoniinin oireyhtymä
Mahdollisesti hengenvaarallisen serotoniinioireyhtymän on raportoitu käytettäessä SNRI-lääkkeitä ja SSRI-lääkkeitä, mukaan lukien Lexapro, yksinään, mutta erityisesti käytettäessä samanaikaisesti muita serotonergisiä lääkkeitä (mukaan lukien triptaanit, trisykliset masennuslääkkeet, fentanyyli, litium, tramadoli, tryptofaani, buspironi, amfetamiinit, ja mäkikuisma) sekä lääkkeillä, jotka heikentävät serotoniinin aineenvaihduntaa (erityisesti MAO-estäjät, sekä psykiatristen häiriöiden hoitoon tarkoitetut että myös muut, kuten linetsolidi ja suonensisäinen metyleenisininen).
Serotoniinioireyhtymän oireita voivat olla mielentilan muutokset (esim. kiihtyneisyys, hallusinaatiot, delirium ja kooma), autonominen epävakaus (esim. takykardia, labiili verenpaine, huimaus, hikoilu, punoitus, hypertermia), hermo-lihasoireet (esim. vapina, jäykkyys, myoklonus, hyperrefleksia, koordinaatiohäiriöt) kohtaukset ja/tai maha-suolikanavan oireet (esim. pahoinvointi, oksentelu, ripuli). Potilaita tulee seurata serotoniinioireyhtymän ilmaantumisen varalta.
Lexapro 10 mg:n samanaikainen käyttö psykiatristen häiriöiden hoitoon tarkoitettujen MAO-estäjien kanssa on vasta-aiheista. Lexapro 5 mg -hoitoa ei myöskään saa aloittaa potilaalla, jota hoidetaan MAO-estäjillä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä. Kaikki metyleenisinistä koskevat raportit, jotka antoivat tietoa antoreitistä, koskivat suonensisäistä antoa annosalueella 1 mg/kg - 8 mg/kg. Ei raportoitu metyleenisinisen antamista muilla reiteillä (kuten oraalisilla tableteilla tai paikallisilla kudosinjektioilla) tai pienempinä annoksina. Saattaa olla tilanteita, joissa Lexaproa käyttävän potilaan hoito MAO:n estäjällä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä, voi olla tarpeen. Lexapro tulee lopettaa ennen MAOI-hoidon aloittamista [katso VASTA-AIHEET ja ANNOSTELU JA HALLINNOINTI ].
Jos Lexapro 5 mg:n samanaikainen käyttö muiden serotonergisten lääkkeiden, mukaan lukien triptaanien, trisyklisten masennuslääkkeiden, fentanyylin, litiumin, tramadolin, buspironin, tryptofaanin, amfetamiinin ja mäkikuisman kanssa on kliinisesti perusteltua, potilaille on kerrottava mahdollisesta lisääntyneestä serotoniinioireyhtymän riskistä. varsinkin hoidon aloittamisen ja annosta suurennettaessa.
Lexapro-hoito ja kaikki samanaikaiset serotonergiset aineet on lopetettava välittömästi, jos yllä mainitut tapahtumat ilmenevät, ja oireenmukainen tuki on aloitettava.
Lexapro-hoidon lopettaminen
Lexapron ja muiden SSRI-lääkkeiden ja SNRI-lääkkeiden (serotoniinin ja norepinefriinin takaisinoton estäjät) markkinoinnin aikana on raportoitu spontaaneja haittavaikutuksia, jotka ilmenevät näiden lääkkeiden käytön lopettamisen jälkeen, erityisesti äkillisesti, mukaan lukien seuraavat: dysforinen mieliala, ärtyneisyys, kiihtyneisyys, huimaus, sensorinen häiriöt (esim. parestesiat, kuten sähköiskun tuntemukset), ahdistuneisuus, sekavuus, päänsärky, letargia, emotionaalinen labilisuus, unettomuus ja hypomania. Vaikka nämä tapahtumat ovat yleensä itsestään ohimeneviä, on raportoitu vakavia keskeytysoireita.
Potilaita tulee seurata näiden oireiden varalta, kun he lopettavat Lexapro-hoidon. Annoksen asteittaista pienentämistä äkillisen lopettamisen sijaan suositellaan aina kun mahdollista. Jos sietämättömiä oireita ilmaantuu annoksen pienentämisen tai hoidon lopettamisen jälkeen, voidaan harkita jatkamista aiemmin määrätyllä annoksella. Myöhemmin lääkäri voi jatkaa annoksen pienentämistä, mutta asteittain [katso ANNOSTELU JA HALLINNOINTI ].
Kohtaukset
Vaikka raseemisen sitalopraamin antikonvulsiivisia vaikutuksia on havaittu eläinkokeissa, Lexaproa ei ole arvioitu systemaattisesti potilailla, joilla on kohtaushäiriö. Nämä potilaat suljettiin pois kliinisistä tutkimuksista tuotteen markkinointia edeltävän testauksen aikana. Lexapro 5 mg:n kliinisissä tutkimuksissa on raportoitu kouristuksia Lexapro-hoidon yhteydessä. Kuten muutkin vakavan masennushäiriön hoidossa tehokkaita lääkkeitä, Lexapro 20 mg tulee ottaa varoen käyttöön potilailla, joilla on ollut kouristuskohtauksia.
Manian tai hypomanian aktivointi
Kaksisuuntaista mielialahäiriötä sairastavilla potilailla masennusjakson hoitaminen Lexaprolla tai muulla masennuslääkkeellä voi saada aikaan sekalaisen/maanisen episodin. Lumekontrolloiduissa 20 mg:n Lexapro-tutkimuksissa vakavassa masennushäiriössä manian/hypomanian aktivaatiota raportoitiin yhdellä (0,1 %) 715 potilaasta, joita hoidettiin Lexapro 20 mg:lla, eikä yhdelläkään lumelääkettä saaneesta 592 potilaasta. Yksi ylimääräinen hypomaniatapaus on raportoitu Lexapro 10 mg -hoidon yhteydessä. Manian/hypomanian aktivaatiota on raportoitu myös pienellä osalla potilaista, joilla on vakavia mielialahäiriöitä ja joita on hoidettu raseemisella sitalopraamilla ja muilla markkinoiduilla lääkkeillä, jotka ovat tehokkaita vakavan masennushäiriön hoidossa. Ennen kuin aloitat Lexapro-hoidon, tarkista potilaat henkilökohtaisen tai perheen historian kaksisuuntaisen mielialahäiriön, manian tai hypomanian varalta [ks. ANNOSTELU JA HALLINNOINTI ].
Hyponatremia
Hyponatremiaa voi esiintyä SSRI- ja SNRI-hoidon seurauksena, mukaan lukien Lexapro. Monissa tapauksissa tämä hyponatremia näyttää olevan seurausta epäasianmukaisen antidiureettisen hormonin erityksen oireyhtymästä (SIADH), ja se palautui, kun Lexapro 20 mg:n käyttö lopetettiin. Tapauksia, joissa seerumin natrium on alle 110 mmol/l, on raportoitu. Iäkkäillä potilailla saattaa olla suurempi riski saada hyponatremia SSRI- ja SNRI-lääkkeiden käytön yhteydessä. Myös potilailla, jotka käyttävät diureetteja tai joilla on muuten nestevajaus, voi olla suurempi riski [ks Geriatrinen käyttö ]. Lexapro-hoidon lopettamista tulee harkita potilailla, joilla on oireinen hyponatremia, ja asianmukainen lääketieteellinen toimenpide on aloitettava.
Hyponatremian merkkejä ja oireita ovat päänsärky, keskittymisvaikeudet, muistin heikkeneminen, sekavuus, heikkous ja epävakaus, jotka voivat johtaa kaatumiseen. Vakavampiin ja/tai akuutimpiin tapauksiin liittyviä merkkejä ja oireita ovat olleet hallusinaatiot, pyörtyminen, kouristukset, kooma, hengityspysähdys ja kuolema.
Epänormaali verenvuoto
SSRI:t ja SNRI:t, mukaan lukien Lexapro 20 mg, voivat lisätä verenvuototapahtumien riskiä. Aspiriinin, ei-steroidisten tulehduskipulääkkeiden, varfariinin ja muiden antikoagulanttien samanaikainen käyttö voi lisätä riskiä. Tapausraportit ja epidemiologiset tutkimukset (tapauskontrolli ja kohorttisuunnittelu) ovat osoittaneet yhteyden serotoniinin takaisinottoa häiritsevien lääkkeiden käytön ja maha-suolikanavan verenvuodon välillä. SSRI- ja SNRI-lääkkeiden käyttöön liittyvät verenvuototapahtumat ovat vaihdelleet mustelmista, hematoomista, nenäverenvuotoista ja petekioista hengenvaarallisiin verenvuotoon.
Potilaita tulee varoittaa verenvuotoriskistä, joka liittyy Lexapro 20 mg:n ja tulehduskipulääkkeiden, aspiriinin tai muiden hyytymiseen vaikuttavien lääkkeiden samanaikaiseen käyttöön.
Häiriö kognitiiviseen ja motoriseen suorituskykyyn
Tavallisilla vapaaehtoisilla tehdyssä tutkimuksessa Lexapro 10 mg/vrk ei aiheuttanut älyllisen toiminnan tai psykomotorisen suorituskyvyn heikkenemistä. Koska kaikki psykoaktiiviset lääkkeet voivat heikentää harkintakykyä, ajattelua tai motorisia taitoja, potilaita tulee kuitenkin varoittaa käyttämästä vaarallisia koneita, mukaan lukien autot, kunnes he ovat kohtuullisen varmoja siitä, että Lexapro-hoito ei vaikuta heidän kykyynsä osallistua tällaisiin toimintoihin.
Kulman sulkeutuva glaukooma
Kulman sulkeutuva glaukooma: Pupillien laajentuminen, joka ilmenee monien masennuslääkkeiden, mukaan lukien Lexapro 20 mg, käytön jälkeen, voi laukaista kulman sulkemiskohtauksen potilaalla, jolla on anatomisesti kapeat kulmat ja jolle ei ole tehty avointa iridektomiaa.
Käyttö potilailla, joilla on samanaikainen sairaus
Kliininen kokemus Lexaprosta potilailla, joilla on tiettyjä samanaikaisia systeemisiä sairauksia, on rajallinen. Varovaisuutta tulee noudattaa käytettäessä Lexapro 5 mg:aa potilailla, joilla on sairauksia tai tiloja, jotka aiheuttavat muuttunutta aineenvaihduntaa tai hemodynaamisia vasteita.
Lexaproa ei ole arvioitu systemaattisesti potilailla, joilla on äskettäin ollut sydäninfarkti tai epävakaa sydänsairaus. Potilaat, joilla oli tällaisia diagnooseja, suljettiin yleensä pois kliinisistä tutkimuksista tuotteen markkinointia edeltävän testauksen aikana.
Potilailla, joilla oli maksan vajaatoiminta, raseemisen sitalopraamin puhdistuma pieneni ja plasman pitoisuudet suurenivat. Lexapron suositeltu annos maksan vajaatoimintaa sairastaville potilaille on 10 mg/vrk [katso ANNOSTELU JA HALLINNOINTI ].
Koska essitalopraami metaboloituu laajalti, muuttumattomana lääkkeen erittyminen virtsaan on vähäinen eliminaatioreitti. Kunnes riittävä määrä potilaita, joilla on vaikea munuaisten vajaatoiminta, on arvioitu pitkäaikaisen Lexapro 20 mg -hoidon aikana, sitä tulee kuitenkin käyttää varoen tällaisilla potilailla [ks. ANNOSTELU JA HALLINNOINTI ].
Seksuaalinen toimintahäiriö
SSRI-lääkkeiden käyttö, mukaan lukien Lexapro, voi aiheuttaa seksuaalisen toimintahäiriön oireita [katso HAITTAVAIKUTUKSET ]. Miespotilailla SSRI:n käyttö voi johtaa siemensyöksyssä viivästymiseen tai epäonnistumiseen, libidon heikkenemiseen ja erektiohäiriöihin. Naispotilailla SSRI-lääkkeiden käyttö voi heikentää libidoa ja hidastaa orgasmia tai orgasmin puuttumista.
On tärkeää, että lääkärit tiedustelevat seksuaalista toimintaa ennen Lexapro-hoidon aloittamista ja tiedustelevat erityisesti seksuaalisen toiminnan muutoksista hoidon aikana, koska seksuaalista toimintaa ei välttämättä raportoida spontaanisti. Seksuaalisen toiminnan muutoksia arvioitaessa yksityiskohtainen historia (mukaan lukien oireiden alkamisajankohta) on tärkeää, koska seksuaalisilla oireilla voi olla muita syitä, mukaan lukien taustalla oleva psykiatrinen häiriö. Keskustele mahdollisista hoitostrategioista potilaiden tukemiseksi tekemään tietoisia hoitopäätöksiä.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ).
Itsemurha-ajatukset ja -käyttäytymiset
Neuvo potilaita, heidän perheitään ja hoitajia etsimään itsemurha-ajatuksia ja -käyttäytymistä, erityisesti hoidon aikana ja kun annosta säädetään ylös- tai alaspäin, ja kehota heitä ilmoittamaan tällaisista oireista terveydenhuollon tarjoajalle [ks. LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ].
Serotoniinin oireyhtymä
Potilaita tulee varoittaa serotoniinioireyhtymän riskistä, kun Lexaproa käytetään samanaikaisesti muiden serotonergisten lääkkeiden kanssa, mukaan lukien triptaanit, trisykliset masennuslääkkeet, fentanyyli, litium, tramadoli, tryptofaani, buspironi, amfetamiinit ja mäkikuisma sekä aineenvaihduntaa heikentävien lääkkeiden kanssa. serotoniini (erityisesti MAO-estäjät, sekä psykiatristen häiriöiden hoitoon tarkoitetut että myös muut, kuten linetsolidi) [ks. VAROITUKSET JA VAROTOIMET ].
Manian tai hypomanian aktivointi
Neuvo potilaita ja heidän hoitajiaan tarkkailemaan manian/hypomanian aktivoitumisen merkkejä ja neuvoa heitä ilmoittamaan tällaisista oireista terveydenhuollon tarjoajalle [ks. VAROITUKSET JA VAROTOIMET ].
Epänormaali verenvuoto
Potilaita tulee varoittaa Lexapro 5 mg:n ja tulehduskipulääkkeiden, aspiriinin, varfariinin tai muiden hyytymiseen vaikuttavien lääkkeiden samanaikaisesta käytöstä, koska serotoniinin takaisinottoa häiritsevien psykotrooppisten lääkkeiden yhteiskäyttö on yhdistetty lisääntyneeseen verenvuotoriskiin [ks. VAROITUKSET JA VAROTOIMET ].
Kulman sulkeutuva glaukooma
Potilaille tulee kertoa, että Lexapro 5 mg:n ottaminen voi aiheuttaa lievää pupillien laajentumista, joka voi herkillä henkilöillä johtaa sulkeutumiskulmaglaukooman episodiin. Aiempi glaukooma on lähes aina avokulmaglaukooma, koska sulkukulmaglaukooma voidaan diagnosoituna hoitaa lopullisesti iridektomialla. Avokulmaglaukooma ei ole kulmaglaukooman riskitekijä. Potilaat saattavat haluta tulla tutkituksi sen määrittämiseksi, ovatko he alttiita kulman sulkemiselle, ja heille voidaan tehdä profylaktinen toimenpide (esim. iridektomia), jos he ovat alttiita [ks. VAROITUKSET JA VAROTOIMET ].
Seksuaalinen toimintahäiriö
Kerro potilaille, että Lexapron käyttö voi aiheuttaa seksuaalisen toimintahäiriön oireita sekä mies- että naispotilailla. Kerro potilaille, että heidän tulee keskustella kaikista seksuaalisen toiminnan muutoksista ja mahdollisista hoitostrategioista terveydenhuollon tarjoajan kanssa [katso VAROITUKSET JA VAROTOIMET ].
Samanaikaiset lääkkeet
Koska essitalopraami on raseemisen sitalopraamin (Celexa) aktiivinen isomeeri, näitä kahta ainetta ei tule antaa samanaikaisesti. Potilaita tulee neuvoa ilmoittamaan lääkärilleen, jos he käyttävät tai aikovat ottaa resepti- tai käsikauppalääkkeitä, koska yhteisvaikutukset ovat mahdollisia.
Määrätyn terapian jatkaminen
Vaikka potilaat saattavat havaita paranemista Lexapro 10 mg -hoidolla 1–4 viikossa, heitä tulee neuvoa jatkamaan hoitoa ohjeiden mukaan.
Psykomotorisen suorituskyvyn häiriöt
Koska psykoaktiiviset lääkkeet voivat heikentää harkintakykyä, ajattelua tai motorisia taitoja, potilaita tulee varoittaa vaarallisten koneiden, mukaan lukien autojen, käytöstä, kunnes he ovat kohtuullisen varmoja siitä, että Lexapro-hoito ei vaikuta heidän kykyynsä osallistua sellaiseen toimintaan.
Alkoholi
Potilaille tulee kertoa, että vaikka Lexapro 5 mg:n ei ole osoitettu kokeissa normaaleilla henkilöillä lisäävän alkoholin aiheuttamia henkisiä ja motorisia taitoja, Lexapro 20 mg:n ja alkoholin samanaikainen käyttö masentuneille potilaille ei ole suositeltavaa.
Raskaus
Kehota raskaana olevia naisia ilmoittamaan terveydenhuollon tarjoajilleen, jos he tulevat raskaaksi tai aikovat tulla raskaaksi LEXAPRO-hoidon aikana. Kerro potilaille, että LEXAPRO 10 mg:n käyttö myöhemmin raskauden aikana voi lisätä vastasyntyneen vastasyntyneiden komplikaatioiden riskiä, jotka vaativat pitkäaikaista sairaalahoitoa, hengitystukea, letkuruokintaa ja/tai vastasyntyneen jatkuvaa pulmonaalihypertensiota (PPHN) [ks. Käyttö tietyissä populaatioissa ].
Kerro naisille, että on olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet LEXAPRO:lle raskauden aikana [ks. Käyttö tietyissä populaatioissa ].
Imetys
Neuvo LEXAPRO-valmistetta käyttäviä imettäviä naisia seuraamaan imeväisten liiallista sedaatiota, levottomuutta, kiihtyneisyyttä, huonoa ruokintaa ja huonoa painonnousua sekä hakeutumaan lääkärin hoitoon, jos he huomaavat näitä merkkejä [ks. Käyttö tietyissä populaatioissa ].
Tarvitsee kattavan hoitoohjelman
Lexapro 20mg on tarkoitettu kiinteäksi osaksi MDD:n kokonaishoito-ohjelmaa, joka voi sisältää muita toimenpiteitä (psykologisia, kasvatuksellisia, sosiaalisia) potilaille, joilla on tämä oireyhtymä. Lääkehoitoa ei välttämättä ole tarkoitettu kaikille nuorille, joilla on tämä oireyhtymä. Lexapro 10 mg:n turvallisuutta ja tehokkuutta MDD:ssä ei ole osoitettu alle 12-vuotiailla lapsipotilailla. Masennuslääkkeitä ei ole tarkoitettu käytettäväksi nuorilla, joilla on ympäristötekijöistä ja/tai muista primaarisista psykiatrisista häiriöistä johtuvia oireita. Sopiva koulutuspaikka on välttämätön, ja psykososiaalinen interventio on usein hyödyllistä. Kun korjaavat toimenpiteet eivät yksinään riitä, päätös masennuslääkityksen määräämisestä riippuu lääkärin arviosta potilaan oireiden kroonisuudesta ja vakavuudesta.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Raseemista sitalopraamia annettiin ruokavaliossa NMRI/BOM-kannan hiirille ja COBS WI -kannan rotille vastaavasti 18 ja 24 kuukauden ajan. Raseemisen sitalopraamin karsinogeenisuudesta ei ollut näyttöä hiirillä, jotka saivat enintään 240 mg/kg/vrk. Ohutsuolen karsinooman ilmaantuvuus lisääntyi rotilla, jotka saivat raseemista sitalopraamia 8 tai 24 mg/kg/vrk. Vaikuttamatonta annosta tälle löydökselle ei vahvistettu. Näiden löydösten merkitystä ihmisille ei tunneta.
Mutageneesi
Raseeminen sitalopraami oli mutageeninen in vitro -bakteerien käänteismutaatiomäärityksessä (Ames-testi) kahdessa viidestä bakteerikannasta (Salmonella TA98 ja TA1537) ilman metabolista aktivaatiota. Se oli klastogeeninen in vitro kiinanhamsterin keuhkosolumäärityksessä kromosomipoikkeavuuksien toteamiseksi metabolisen aktivaation läsnä ollessa tai ilman. Raseeminen sitalopraami ei ollut mutageeninen in vitro nisäkkään eteenpäin suuntautuvassa geenimutaatiomäärityksessä (HPRT) hiiren lymfoomasoluissa tai kytketyssä in vitro/in vivo unscheduled DNA synthesis (UDS) -määrityksessä rotan maksassa. Se ei ollut klastogeeninen ihmisen lymfosyyttien in vitro kromosomipoikkeavuusmäärityksessä eikä kahdessa in vivo hiiren mikrotumamäärityksessä.
Hedelmällisyyden heikkeneminen
Kun raseemista sitalopraamia annettiin suun kautta 16 uros- ja 24 naarasrotalle ennen parittelua ja raskauden aikana ja sen aikana annoksilla 32, 48 ja 72 mg/kg/vrk, parittelu väheni kaikilla annoksilla ja hedelmällisyys heikkeni annoksilla ≥ 32 mg/kg/vrk. Raskauden kestoa pidennettiin annoksella 48 mg/kg/vrk.
Käyttö tietyissä populaatioissa
Raskaus
Raskausaltistusrekisteri
On olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet masennuslääkkeille raskauden aikana. Terveydenhuollon tarjoajia kehotetaan rekisteröimään potilaita soittamalla masennuslääkkeiden raskausrekisteriin numeroon 1-844-405-6185 tai käymällä verkossa osoitteessa https://womensmentalhealth.org/clnical-and-research-programs/pregnancyregistry/antidepressants/
Riskien yhteenveto
Saatavilla olevat tiedot julkaistuista epidemiologisista tutkimuksista ja markkinoille tulon jälkeisistä raporteista eivät ole osoittaneet suurentunutta vakavien synnynnäisten epämuodostumien tai keskenmenon riskiä. Vastasyntyneen jatkuvan keuhkoverenpainetaudin (PPHN) riskit ovat olemassa (ks Data ) ja vastasyntyneen huono sopeutuminen (katso Kliiniset näkökohdat ) altistuminen selektiivisille serotoniinin takaisinoton estäjille (SSRI), mukaan lukien LEXAPRO 5 mg, raskauden aikana. Hoitamattomaan masennukseen liittyy riskejä raskauden aikana (ks Kliiniset näkökohdat ).
Eläinten lisääntymistutkimuksissa sekä essitalopraamilla että raseemisella sitalopraamilla on osoitettu olevan haitallisia vaikutuksia alkion/sikiön ja syntymän jälkeiseen kehitykseen, mukaan lukien sikiön rakenteelliset poikkeavuudet, kun niitä on annettu ihmisille terapeuttisia annoksia suurempina annoksina (ks. Data ).
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Kliiniset näkökohdat
Sairauteen liittyvä äidin ja/tai alkion/sikiön riski
Naiset, jotka lopettavat masennuslääkkeiden käytön, todennäköisemmin kokevat vakavan masennuksen uusiutumisen kuin naiset, jotka jatkavat masennuslääkkeiden käyttöä. Tämä havainto on prospektiivisesta pitkittäistutkimuksesta, johon osallistui 201 raskaana olevaa naista, joilla on ollut vaikea masennus ja jotka olivat eutymia ja käyttivät masennuslääkkeitä raskauden alussa. Ota huomioon hoitamattoman masennuksen riski, kun lopetat tai vaihdat masennuslääkehoitoa raskauden ja synnytyksen aikana.
Sikiön/vastasyntyneen haittavaikutukset
Vastasyntyneille, jotka ovat altistuneet SSRI- tai SNRI-lääkkeille, mukaan lukien Lexapro 5 mg, kolmannen raskauskolmanneksen lopussa, on kehittynyt komplikaatioita, jotka vaativat pitkäaikaista sairaalahoitoa, hengitystukea ja letkuruokintaa. Tällaiset komplikaatiot voivat ilmaantua heti synnytyksen jälkeen. Raportoituja kliinisiä löydöksiä ovat olleet hengitysvaikeudet, syanoosi, apnea, kohtaukset, lämpötilan epävakaus, ruokintavaikeudet, oksentelu, hypoglykemia, hypotonia, hypertonia, hyperrefleksia, vapina, hermostuneisuus, ärtyneisyys ja jatkuva itku. Nämä ominaisuudet ovat yhdenmukaisia joko SSRI- ja SNRI-lääkkeiden suoran toksisen vaikutuksen kanssa tai mahdollisesti lääkkeen käytön lopetusoireyhtymän kanssa. On huomattava, että joissakin tapauksissa kliininen kuva on yhdenmukainen serotoniinioireyhtymän kanssa [katso VAROITUKSET JA VAROTOIMET ].
Data
Ihmistiedot
Altistuminen SSRI-lääkkeille, erityisesti myöhemmin raskauden aikana, voi lisätä PPHN-riskiä. PPHN:tä esiintyy 1-2:lla 1000 elävänä syntynyttä kohden yleispopulaatiossa, ja se liittyy huomattavaan vastasyntyneiden sairastuvuuteen ja kuolleisuuteen.
Eläinten tiedot
Rotan alkion/sikiön kehitystutkimuksessa essitalopraamin (56, 112 tai 150 mg/kg/vrk) oraalinen antaminen tiineille eläimille organogeneesin aikana johti sikiön painon laskuun ja siihen liittyvään luutumisen viivästymiseen kahdella suuremmalla annoksella. [noin ≥ 55 kertaa suurin suositeltu ihmisannos (MRHD) 20 mg/vrk mitattuna mg/m2]. Emotoksisuutta (kliiniset oireet ja vähentynyt painonnousu ja ruoankulutus), lievää annoksella 56 mg/kg/vrk, esiintyi kaikilla annostasoilla. Kehitykseen vaikuttamaton annos 56 mg/kg/vrk on noin 27 kertaa MRHD 20 mg/m2 laskettuna. Epämuodostumia ei havaittu millään testatuilla annoksilla (jopa 73 kertaa MRHD mg/m2:n perusteella).
Kun naarasrottia hoidettiin essitalopraamilla (6, 12, 24 tai 48 mg/kg/vrk) tiineyden ja vieroituksen aikana, havaittiin hieman lisääntynyt jälkeläisten kuolleisuus ja kasvun hidastuminen annoksella 48 mg/kg/vrk, mikä on noin 23 kertaa enemmän MRHD on 20 mg (mg/m2). Tällä annoksella havaittiin lievää toksisuutta emolle (kliiniset oireet ja vähentynyt painonnousu ja ruoankulutus). Hieman lisääntynyt jälkeläisten kuolleisuus havaittiin myös annoksella 24 mg/kg/vrk. Vaikutukseton annos oli 12 mg/kg/vrk, mikä on noin 6 kertaa MRHD 20 mg/m2 laskettuna.
Kahdessa rotan alkion/sikiön kehitystutkimuksessa raseemisen sitalopraamin (32, 56 tai 112 mg/kg/vrk) oraalinen antaminen tiineille eläimille organogeneesin aikana johti alkion/sikiön kasvun ja eloonjäämisen heikkenemiseen sekä sikiöiden lisääntyneeseen ilmaantumiseen. poikkeavuuksia (mukaan lukien sydän- ja verisuonivauriot ja luustovauriot) suurella annoksella, joka on noin 18 kertaa MRHD 60 mg/vrk mitattuna mg/m2. Tämä annos liittyi myös emolle toksisuuteen (kliiniset oireet, painonnousun väheneminen). Kehitysannos, jolla ei ollut vaikutusta, oli 56 mg/kg/vrk, mikä on noin 9 kertaa MRHD mg/m2:n perusteella. Kanitutkimuksessa ei havaittu haitallisia vaikutuksia alkion/sikiön kehitykseen raseemisen sitalopraamin annoksilla, jotka olivat enintään 16 mg/kg/vrk tai noin 5 kertaa MRHD mg/m2:n perusteella. Siten raseemisen sitalopraamin kehitysvaikutuksia havaittiin rotalla emolle toksisella annoksella, eikä niitä havaittu kanilla.
Kun naarasrottia hoidettiin raseemisella sitalopraamilla (4,8, 12,8 tai 32 mg/kg/vrk) raskauden lopusta vieroittamiseen asti, jälkeläisten kuolleisuus lisääntyi ensimmäisten 4 päivän aikana syntymän jälkeen ja jatkuva jälkeläisten kasvun hidastuminen suurimmalla annoksella. on noin 5 kertaa MRHD 60 mg mitattuna mg/m2. Vaikutukseton annos oli 12,8 mg/kg/vrk, mikä on noin 2 kertaa MRHD mg/m2:n perusteella. Samanlaisia vaikutuksia jälkeläisten kuolleisuuteen ja kasvuun havaittiin, kun emoja hoidettiin koko tiineyden ja varhaisen laktaation ajan annoksilla ≥ 24 mg/kg/vrk, mikä on noin 4 kertaa MRHD mg/m2:n perusteella. Tuossa tutkimuksessa ei määritetty vaikutuksetonta annosta.
Imetys
Riskien yhteenveto
Julkaistun kirjallisuuden tiedot raportoivat essitalopraamin ja desmetyyliesitalopraamin esiintymisestä äidinmaidossa (ks. Data ). On raportoitu liiallisesta sedaatiosta, levottomuudesta, levottomuudesta, huonosta ruokinnasta ja heikosta painonnoususta essitalopraamille rintamaidon kautta (ks. Kliiniset näkökohdat ),. Essitalopraamin tai sen metaboliittien vaikutuksista maidontuotantoon ei ole tietoa. Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon sekä äidin kliininen LEXAPRO 5 mg:n tarve ja LEXAPRO:n mahdolliset haitalliset vaikutukset imetettävään lapseen tai äidin taustalla oleva tila.
Kliiniset näkökohdat
LEXAPRO 20 mg:lle altistuneita imeväisiä tulee tarkkailla liiallisen sedaation, levottomuuden, kiihtyneisyyden, huonon ruokinnan ja vähäisen painonnousun varalta.
Data
Tutkimus, jossa 8 imettävää äitiä sai essitalopraamia vuorokausiannoksilla 10-20 mg/vrk, osoitti, että yksinomaan rintaruokitut lapset saavat noin 3,9 % äidin painon mukaan sovitetusta essitalopraamiannoksesta ja 1,7 % äidin painon mukaan sovitetusta desmetyylisitalopraamiannoksesta. .
Käyttö lapsille
Lexapro 10 mg:n turvallisuus ja tehokkuus on osoitettu nuorilla (12-17-vuotiailla) vakavan masennushäiriön hoidossa [ks. Kliiniset tutkimukset ]. Vaikka ylläpitotehoa ei ole arvioitu systemaattisesti nuorilla potilailla, joilla on vakava masennushäiriö, ylläpitotehoa voidaan ekstrapoloida aikuisten tiedoista sekä essitalopraamin farmakokineettisten parametrien vertailusta aikuisilla ja nuorilla potilailla.
Lexapron turvallisuutta ja tehokkuutta ei ole osoitettu lapsipotilailla (alle 12-vuotiailla), joilla on vakava masennushäiriö. 24 viikkoa kestäneessä avoimessa turvallisuustutkimuksessa, johon osallistui 118 lasta (7-11-vuotiaita), joilla oli vakava masennushäiriö, turvallisuushavainnot vastasivat Lexapron tunnettua turvallisuus- ja siedettävyysprofiilia.
Lexapron turvallisuutta ja tehokkuutta ei ole osoitettu alle 18-vuotiailla lapsipotilailla, joilla on yleistynyt ahdistuneisuushäiriö.
Vähentynyttä ruokahalua ja painon laskua on havaittu SSRI-lääkkeiden käytön yhteydessä. Tästä syystä SSRI-lääkkeillä, kuten Lexaprolla, hoidettujen lasten ja nuorten painoa ja kasvua on seurattava säännöllisesti.
Geriatrinen käyttö
Noin 6 % 1144 potilaasta, jotka saivat essitalopraamia kontrolloiduissa tutkimuksissa Lexapro 10 mg:lla vakavassa masennushäiriössä ja GAD:ssa, oli 60-vuotiaita tai vanhempia; Näissä tutkimuksissa iäkkäät potilaat saivat Lexaproa päivittäin 10-20 mg:n annoksina. Iäkkäiden potilaiden määrä näissä tutkimuksissa ei ollut riittävä arvioimaan riittävästi iän perusteella tehtäviä eroja ja turvallisuustoimenpiteitä. Joidenkin iäkkäiden henkilöiden suurempaa herkkyyttä Lexapron vaikutuksille ei kuitenkaan voida sulkea pois.
SSRI:t ja SNRI:t, mukaan lukien Lexapro 5 mg, on yhdistetty kliinisesti merkittävään hyponatremiatapauksiin iäkkäillä potilailla, joilla saattaa olla suurempi riski saada tämä haittatapahtuma [ks. Hyponatremia ].
Kahdessa farmakokineettisessä tutkimuksessa essitalopraamin puoliintumisaika piteni noin 50 % iäkkäillä koehenkilöillä verrattuna nuoriin ja Cmax pysyi muuttumattomana [ks. KLIININEN FARMAKOLOGIA ]. 10 mg/vrk on suositeltu annos iäkkäille potilaille [katso ANNOSTELU JA HALLINNOINTI ].
Raseemisen sitalopraamin kliinisissä tutkimuksissa 4422 potilaasta 1357 oli 60-vuotiaita tai sitä vanhempia, 1034 oli 65-vuotiaita tai vanhempia ja 457 oli 75-vuotiaita tai vanhempia. Yleisiä eroja turvallisuudessa tai tehokkuudessa ei havaittu näiden ja nuorempien koehenkilöiden välillä, ja muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta jälleen kerran, joidenkin iäkkäiden henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
YLIANNOSTUS
Seuraavia on raportoitu Lexapro-tabletin yliannostuksen yhteydessä:
- Kohtaukset, jotka voivat viivästyä, ja muuttunut henkinen tila mukaan lukien kooma.
- Kardiovaskulaarinen toksisuus, joka voi viivästyä, mukaan lukien QRS- ja QTc-ajan pidentyminen, laajat monimutkaiset takyarytmiat ja torsade de pointes. Hypertensio on yleisimmin havaittu, mutta harvoin hypotensiota voi esiintyä yksinään tai samanaikaisesti alkoholin kanssa.
- Serotoniinioireyhtymä (potilailla, joilla on useita muita proserotonergisiä lääkkeitä yliannostettuja, saattaa olla suurempi riski).
Pitkäaikaista sydämen toiminnan seurantaa suositellaan Lexapron yliannostuksen yhteydessä rytmihäiriöriskin vuoksi.
Ruoansulatuskanavan dekontaminaatiota aktiivihiilellä tulee harkita potilailla, jotka ilmaantuvat varhain Lexapro-yliannostuksen jälkeen.
Harkitse ottamista yhteyttä myrkytyskeskukseen (1-800-221-2222) tai lääketieteelliseen toksikologiin yliannostuksen hallintasuosituksia varten.
VASTA-AIHEET
Monoamiinioksidaasin estäjät (MAOI)
MAO-estäjien käyttö psykiatristen häiriöiden hoitoon Lexaprolla tai 14 päivän sisällä Lexapro 5mg -hoidon lopettamisesta on vasta-aiheista, koska se lisää serotoniinioireyhtymän riskiä. Lexapro 20 mg:n käyttö 14 päivän sisällä psykiatristen häiriöiden hoitoon tarkoitetun MAO-estäjän lopettamisesta on myös vasta-aiheista [ks. ANNOSTELU JA HALLINNOINTI , ja VAROITUKSET JA VAROTOIMET ].
Lexapro 20 mg:n aloittaminen potilaalla, jota hoidetaan MAO-estäjillä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä, on myös vasta-aiheista, koska serotoniinioireyhtymän riski on lisääntynyt (ks. ANNOSTELU JA HALLINNOINTI , ja VAROITUKSET JA VAROTOIMET ].
Pimotsidi
Samanaikainen käyttö pimotsidia käyttävillä potilailla on vasta-aiheista [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Yliherkkyys escitalopraamille tai sitalopraamille
Lexapro 20mg on vasta-aiheinen potilailla, jotka ovat yliherkkiä essitalopraamille tai sitalopraamille tai jollekin Lexapron inaktiiviselle aineosalle.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Essitalopraamin, raseemisen sitalopraamin S-enantiomeerin, masennusta ehkäisevän vaikutuksen mekanismin oletetaan liittyvän serotonergisen aktiivisuuden voimistumiseen keskushermostossa (CNS), joka johtuu sen serotoniinin (5-HT) keskushermoston hermosolujen takaisinoton estämisestä.
Farmakodynamiikka
Eläimillä tehdyt in vitro- ja in vivo -tutkimukset viittaavat siihen, että essitalopraami on erittäin selektiivinen serotoniinin takaisinoton estäjä (SSRI), jolla on minimaaliset vaikutukset noradrenaliinin ja dopamiinin hermosolujen takaisinottoon. Essitalopraami on vähintään 100 kertaa tehokkaampi kuin R-enantiomeeri mitä tulee 5-HT:n takaisinoton ja 5-HT-hermosolujen syttymisnopeuden estämiseen. Pitkäaikainen (enintään 5 viikkoa) essitalopraamihoito ei indusoinut rottien masennuslääkkeen mallin sietokykyä. Essitalopraamilla ei ole tai on erittäin alhainen affiniteetti serotonergisiin (5-HT1-7) tai muihin reseptoreihin, mukaan lukien alfa- ja beeta-adrenergiset reseptorit, dopamiini (D1-5), histamiini (H1-3), muskariini (M1-5) ja bentsodiatsepiini. reseptorit. Essitalopraami ei myöskään sitoudu useisiin ionikanaviin, mukaan lukien Na+-, K+-, Cl- ja Ca++-kanavat, tai sillä on alhainen affiniteetti niihin. Muskariini-, histaminergisten ja adrenergisten reseptorien antagonismin on oletettu liittyvän useisiin muiden psykotrooppisten lääkkeiden antikolinergisiin, rauhoittaviin ja kardiovaskulaarisiin sivuvaikutuksiin.
Farmakokinetiikka
Essitalopraamin kerta- ja usean annoksen farmakokinetiikka on lineaarinen ja suhteessa annokseen annosalueella 10-30 mg/vrk. Essitalopraamin biotransformaatio tapahtuu pääasiassa maksassa, ja sen keskimääräinen terminaalinen puoliintumisaika on noin 27-32 tuntia. Kerran vuorokaudessa otettaessa vakaan tilan plasmapitoisuudet saavutetaan noin viikossa. Vakaassa tilassa essitalopraamin kertyminen plasmaan nuorilla terveillä koehenkilöillä oli 2,2-2,5 kertaa suurempi kuin kerta-annoksen jälkeen havaitut plasmapitoisuudet. Essitalopraamioksalaatin tabletti ja oraaliliuos ovat bioekvivalentteja.
Imeytyminen ja jakautuminen
Essitalopraamin kerta-annoksen (20 mg tabletti tai liuos) oraalisen annoksen jälkeen veren huippupitoisuus saavutetaan noin 5 tunnin kuluttua. Ruoka ei vaikuta essitalopraamin imeytymiseen.
Sitalopraamin absoluuttinen hyötyosuus on noin 80 % suonensisäiseen annokseen verrattuna, ja sitalopraamin jakautumistilavuus on noin 12 l/kg. Essitalopraamia koskevia erityisiä tietoja ei ole saatavilla.
Essitalopraamin sitoutuminen ihmisen plasman proteiineihin on noin 56 %.
Aineenvaihdunta ja eliminaatio
Essitalopraamin oraalisen annostelun jälkeen virtsaan essitalopraamina ja S-demetyylisitalopraamina (S-DCT) erittyneen lääkkeen osuus on vastaavasti noin 8 % ja 10 %. Essitalopraamin oraalinen puhdistuma on 600 ml/min, josta noin 7 % johtuu munuaispuhdistumasta.
Essitalopraami metaboloituu S-DCT:ksi ja S-didemetyylisitalopraamiksi (S-DDCT). Ihmisillä muuttumaton essitalopraami on pääasiallinen yhdiste plasmassa. Vakaassa tilassa essitalopraamimetaboliitin S-DCT pitoisuus plasmassa on noin kolmasosa essitalopraamin pitoisuudesta. S-DDCT-taso ei ollut havaittavissa useimmissa koehenkilöissä. In vitro -tutkimukset osoittavat, että essitalopraami on vähintään 7 ja 27 kertaa tehokkaampi kuin S-DCT ja S-DDCT serotoniinin takaisinoton estämisessä, mikä viittaa siihen, että essitalopraamin metaboliitit eivät vaikuta merkittävästi essitalopraamin masennusta ehkäiseviin vaikutuksiin. S-DCT:llä ja SDDCT:llä ei myöskään ole lainkaan tai erittäin alhainen affiniteetti serotonergisiin (5-HT1-7) tai muihin reseptoreihin, mukaan lukien alfa- ja beeta-adrenergiset, dopamiini (D1-5), histamiini (H1-3), muskariinireseptori (M1- 5) ja bentsodiatsepiinireseptorit. S-DCT ja S-DDCT eivät myöskään sitoudu useisiin ionikanaviin, mukaan lukien Na+-, K+-, Cl- ja Ca++-kanavat.
Ihmisen maksan mikrosomeilla tehdyt in vitro -tutkimukset osoittivat, että CYP3A4 ja CYP2C19 ovat ensisijaiset isotsyymit, jotka osallistuvat essitalopraamin N-demetylaatioon.
Väestön alaryhmät
Ikä
Nuoret
Essitalopraamin 10 mg:n kerta-annostutkimuksessa essitalopraamin AUC pieneni 19 % ja Cmax nousi 26 % terveillä nuorilla (12–17-vuotiailla) aikuisiin verrattuna. Kun sitalopraamia annettiin toistuvasti 40 mg/vrk, essitalopraamin eliminaation puoliintumisaika, vakaan tilan Cmax ja AUC olivat samanlaiset MDD-potilailla (12-17-vuotiaat) kuin aikuispotilailla. Annosta ei tarvitse muuttaa nuorilla potilailla.
Vanhukset
Essitalopraamin farmakokinetiikkaa ≥ 65-vuotiailla koehenkilöillä verrattiin nuorempiin koehenkilöihin kerta- ja toistuvaannostutkimuksessa. Essitalopraamin AUC ja puoliintumisaika pidentyivät noin 50 % iäkkäillä henkilöillä, ja Cmax pysyi muuttumattomana. 10 mg on suositeltu annos iäkkäille potilaille [katso ANNOSTELU JA HALLINNOINTI ].
Sukupuoli
Essitalopraamia iäkkäillä, nuorilla aikuisilla ja nuorilla mittaavista kerta- ja usean annoksen tutkimuksista saatujen tietojen perusteella annosta ei tarvitse muuttaa sukupuolen perusteella.
Heikentynyt maksan toiminta
Sitalopraamin oraalinen puhdistuma pieneni 37 % ja puoliintumisaika kaksinkertaistui potilailla, joiden maksan toiminta oli heikentynyt normaaleihin koehenkilöihin verrattuna. 10 mg on suositeltu essitalopraamiannos useimmille maksan vajaatoimintapotilaille [katso ANNOSTELU JA HALLINNOINTI ].
Vähentynyt munuaisten toiminta
Potilailla, joilla oli lievä tai kohtalainen munuaisten vajaatoiminta, sitalopraamin oraalinen puhdistuma pieneni 17 % normaaleihin koehenkilöihin verrattuna. Tällaisten potilaiden annostusta ei suositella. Tietoja essitalopraamin farmakokinetiikasta ei ole saatavilla potilailla, joiden munuaisten toiminta on vakavasti heikentynyt (kreatiniinipuhdistuma
Huumeiden väliset vuorovaikutukset
In vitro -entsyymi-inhibitiotiedot eivät paljastaneet essitalopraamin CYP3A4-, -1A2-, -2C9-, -2C19- ja -2E1-entsyymejä estävää vaikutusta. In vitro -tietojen perusteella essitalopraamilla oletetaan olevan vain vähän estävää vaikutusta näiden sytokromien välittämään in vivo -metaboliaan. Vaikka in vivo -tiedot tämän kysymyksen käsittelemiseksi ovat rajalliset, lääkkeiden yhteisvaikutustutkimusten tulokset viittaavat siihen, että essitalopraamilla ei ole 20 mg:n annoksella 3A4:ää estävää vaikutusta ja se on vaatimaton 2D6:ta estävä vaikutus. Katso HUUMEIDEN VUOROVAIKUTUKSET lisätietoja saatavilla olevista lääkevuorovaikutustiedoista.
Eläinten toksikologia ja/tai farmakologia
Verkkokalvon muutokset rotilla
Patologisia muutoksia (degeneraatio/atrofia) havaittiin albiinorottien verkkokalvossa raseemisen sitalopraamin 2 vuoden karsinogeenisuustutkimuksessa. Verkkokalvon patologian ilmaantuvuus ja vakavuus lisääntyivät sekä uros- että naarasrotilla, jotka saivat 80 mg/kg/vrk. Samanlaisia löydöksiä ei havaittu rotilla, jotka saivat raseemista sitalopraamia 24 mg/kg/vrk kahden vuoden ajan, hiirillä, jotka saivat raseemista sitalopraamia enintään 240 mg/kg/vrk 18 kuukauden ajan, tai koirilla, jotka saivat enintään 20 mg/kg/vrk. raseemisen sitalopraamin päivä yhden vuoden ajan.
Lisätutkimuksia tämän patologian mekanismin selvittämiseksi ei ole tehty, eikä tämän vaikutuksen mahdollista merkitystä ihmisille ole osoitettu.
Sydän- ja verisuonimuutokset koirilla
Vuoden kestäneessä toksikologisessa tutkimuksessa viisi kymmenestä beagle-koiraasta, jotka saivat suun kautta raseemisen sitalopraamiannoksia 8 mg/kg/vrk, kuoli äkillisesti viikkojen 17 ja 31 välillä hoidon aloittamisen jälkeen. Rotilla ei havaittu äkillisiä kuolemia raseemisen sitalopraamiannoksilla 120 mg/kg/vrk asti, mikä aiheutti plasman sitalopraamin ja sen metaboliittien demetyylisitalopraamin ja didemetyylisitalopraamin (DDCT) pitoisuudet, jotka olivat samanlaisia kuin koirilla annoksella 8 mg/kg/vrk. Myöhempi suonensisäistä annostelua koskeva tutkimus osoitti, että beagle-koirilla raseeminen DDCT aiheutti QT-ajan pidentymistä, joka on tunnettu riskitekijä koirilla havaitulle tulokselle.
Kliiniset tutkimukset
Masennustila
Nuoret
Lexapron tehokkuus vakavan masennushäiriön akuutin hoitona nuorilla potilailla vahvistettiin 8 viikon, joustavan annoksen, lumekontrolloidussa tutkimuksessa, jossa verrattiin Lexaproa 10-20 mg/vrk lumelääkkeeseen 12-17-vuotiailla avohoitopotilailla. mukaan lukien, jotka täyttivät vakavan masennushäiriön DSM-IV-kriteerit. Ensisijainen tulos oli muutos lähtötilanteesta päätepisteeseen lasten masennuksen arviointiasteikko - tarkistetussa (CDRS-R). Tässä tutkimuksessa Lexapro 5 mg osoitti tilastollisesti merkitsevästi suurempaa keskimääräistä parannusta CDRS-R:n suhteen lumelääkkeeseen verrattuna.
Lexapron tehokkuus nuorten vakavan masennushäiriön akuutissa hoidossa määritettiin osittain ekstrapoloinnin perusteella 8 viikon, joustavan annoksen, lumekontrolloidusta tutkimuksesta, jossa käytettiin raseemista sitalopraamia 20-40 mg/vrk. Tässä avohoitotutkimuksessa 7–17-vuotiailla lapsilla ja nuorilla, jotka täyttivät vakavan masennushäiriön DSM-IV-kriteerit, sitalopraamihoito osoitti tilastollisesti merkitsevästi suurempaa keskimääräistä paranemista lähtötasosta verrattuna lumelääkkeeseen CDRS-R:ssä; tämän kokeen positiiviset tulokset tulivat suurelta osin nuorten alaryhmästä.
Kaksi muuta joustavan annoksen lumekontrolloitua MDD-tutkimusta (yksi Lexapro-tutkimus 7–17-vuotiailla potilailla ja yksi sitalopraamitutkimus nuorilla) eivät osoittaneet tehoa.
Vaikka ylläpitotehoa nuorilla potilailla ei ole arvioitu systemaattisesti, ylläpitotehoa voidaan ekstrapoloida aikuisten tiedoista sekä essitalopraamin farmakokineettisten parametrien vertailusta aikuisilla ja nuorilla potilailla.
Aikuiset
Lexapro 5 mg:n teho masennuksen hoidossa vahvistettiin kolmessa 8 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa avohoidossa 18–65-vuotiailla potilailla, jotka täyttivät vakavan masennuksen DSM-IV-kriteerit. Ensisijainen tulos kaikissa kolmessa tutkimuksessa oli muutos lähtötilanteesta päätepisteeseen Montgomery Asberg Depression Rating Scale (MADRS) -asteikolla.
Kiinteän annoksen tutkimuksessa verrattiin 10 mg/vrk Lexaproa ja 20 mg/vrk Lexaproa lumelääkkeeseen ja 40 mg/vrk sitalopraamiin. 10 mg/vrk ja 20 mg/vrk Lexapro 5 mg -hoitoryhmät osoittivat tilastollisesti merkitsevästi suurempaa keskimääräistä paranemista lumelääkkeeseen verrattuna MADRS-tutkimuksessa. 10 mg:n ja 20 mg:n Lexapro-ryhmät olivat samanlaisia tässä tulosmittauksessa.
Toisessa kiinteän annoksen 10 mg/vrk Lexapro- ja lumelääketutkimuksessa 10 mg/vrk Lexapro-hoitoryhmä osoitti tilastollisesti merkitsevästi suurempaa keskimääräistä parannusta lumelääkkeeseen verrattuna MADRS-tutkimuksessa.
Joustoannoksisessa tutkimuksessa, jossa verrattiin Lexaproa 20 mg, titrattu 10-20 mg/vrk, lumelääkkeeseen ja sitalopraamiin, titrattu 20-40 mg/vrk, Lexapro 5 mg:n hoitoryhmä osoitti tilastollisesti merkitsevästi enemmän keskimääräistä parannusta lumelääkkeeseen verrattuna. MADRS.
Analyysit hoitotuloksen ja iän, sukupuolen ja rodun välisestä suhteesta eivät osoittaneet mitään eroavaa vastetta näiden potilaan ominaisuuksien perusteella.
Pitkäaikaisessa tutkimuksessa 274 potilasta, jotka täyttivät vakavan masennushäiriön kriteerit (DSM-IV) ja jotka olivat reagoineet ensimmäisten 8 viikon avoimen hoitovaiheen aikana Lexaprolla 10 tai 20 mg/vrk, satunnaistettiin jatkamaan Lexaproa. samalla annoksella tai lumelääkettä 36 viikon ajan uusiutumisen varalta. Avoimen vaiheen vaste määriteltiin siten, että MADRS-kokonaispistemäärä laski arvoon ≤ 12. Relapsi kaksoissokkovaiheen aikana määriteltiin MADRS-kokonaispistemäärän nousuksi ≥ 22:een tai hoidon lopettamiseksi riittämättömän kliinisen vasteen vuoksi. . Jatkuvaa Lexapro-hoitoa saaneilla potilailla oli tilastollisesti merkitsevästi pidempi aika taudin uusiutumiseen verrattuna lumelääkettä saaneisiin.
Yleistynyt ahdistuneisuushäiriö
Lexapro 5 mg:n teho yleistyneen ahdistuneisuushäiriön (GAD) akuutissa hoidossa osoitettiin kolmessa, 8 viikkoa kestäneessä, monikeskustutkimuksessa, joustavalla annoksella, lumekontrolloidussa tutkimuksessa, joissa verrattiin Lexaproa 10-20 mg/vrk lumelääkkeeseen aikuisilla avohoitopotilailla. 18- ja 80-vuotiaat, jotka täyttivät GAD:n DSM-IV-kriteerit. Kaikissa kolmessa tutkimuksessa Lexapro osoitti tilastollisesti merkitsevästi suurempaa keskimääräistä parannusta verrattuna lumelääkkeeseen Hamiltonin ahdistusasteikolla (HAM-A).
Potilaita oli liian vähän eri etnisissä ja ikäryhmissä voidakseen arvioida riittävästi, onko Lexaprolla erilaisia vaikutuksia näissä ryhmissä. Lexapro-vasteessa ei ollut eroa miesten ja naisten välillä.
POTILASTIEDOT
Lexapro® (leks-a-pro) (escitalopraami) Tabletit/oraaliliuos
Lue Lexapron mukana tuleva lääkitysopas ennen kuin aloitat sen käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Tämä lääkitysopas ei korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi. Keskustele terveydenhuollon tarjoajan kanssa, jos et ymmärrä jotain tai haluat oppia lisää.
Mikä on tärkein tieto, joka minun pitäisi tietää Lexapro 20mg:sta?
Lexapro 10mg ja muut masennuslääkkeet voivat aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
Pidä kaikki seurantakäynnit terveydenhuollon tarjoajan kanssa ja soita käyntien välillä, jos olet huolissasi oireista.
Soita välittömästi terveydenhuollon tarjoajallesi, jos sinulla on jokin seuraavista oireista, tai soita hätänumeroon, varsinkin jos ne ovat uusia, pahempia tai huolestuttavia:
Soita heti terveydenhuollon tarjoajallesi, jos sinulla on jokin seuraavista oireista, tai soita hätänumeroon 911. Lexapro voi liittyä näihin vakaviin sivuvaikutuksiin:
Miehillä oireita voivat olla:
Naisilla oireita voivat olla:
Keskustele terveydenhuollon tarjoajan kanssa, jos sinulla on muutoksia seksuaalisessa toiminnassasi tai jos sinulla on kysyttävää tai huolenaiheita seksuaalisista ongelmista Lexapro-hoidon aikana. Terveydenhuollon tarjoajasi voi ehdottaa hoitoja.
- Lexapro 5 mg ja muut masennuslääkkeet voivat lisätä itsemurha-ajatuksia tai -toimia joillakin lapsilla, nuorilla tai nuorilla aikuisilla hoidon ensimmäisten kuukausien aikana tai kun annosta muutetaan.
- Masennus tai muut vakavat mielenterveysongelmat ovat tärkeimmät syyt itsemurha-ajatuksiin tai -toimiin.
- Tarkkaile näitä muutoksia ja soita heti terveydenhuollon tarjoajallesi, jos huomaat:
- Uudet tai äkilliset muutokset mielialassa, käyttäytymisessä, toimissa, ajatuksissa tai tunteissa, varsinkin jos ne ovat vakavia.
- Kiinnitä erityistä huomiota tällaisiin muutoksiin, kun Lexapro 5mg aloitetaan tai annosta muutetaan.
- yrittää itsemurhaa
- vaarallisten impulssien vaikutuksesta
- käyttäytyy aggressiivisesti tai väkivaltaisesti
- ajatuksia itsemurhasta tai kuolemasta
- uusi tai pahempi masennus
- uusia tai pahempia ahdistuneisuus- tai paniikkikohtauksia
- kiihtyneisyys, levottomuus, vihaisuus tai ärtyneisyys
- nukahtamisvaikeuksia
- aktiivisuuden lisääntyminen tai puhuminen enemmän kuin sinulle on normaalia
- muita epätavallisia muutoksia käyttäytymisessä tai mielialassa
- kiihtyneisyys, hallusinaatiot, kooma tai muut mielentilan muutokset
- koordinaatiohäiriöt tai lihasnykitykset (yliaktiiviset refleksit)
- syke, korkea tai matala verenpaine
- hikoilu tai kuume
- pahoinvointia, oksentelua tai ripulia
- lihasten jäykkyys
- vaikeuksia hengittää
- kasvojen, kielen, silmien tai suun turvotus
- ihottuma, kutisevat nokkosihottumat tai rakkulat yksinään tai kuumeen tai nivelkipujen kanssa
- huomattavasti lisääntynyt energia
- vakavia unihäiriöitä
- kilpailevia ajatuksia
- huolimaton käytös
- epätavallisen mahtavia ideoita
- liiallinen onnellisuus tai ärtyneisyys
- puhua enemmän tai nopeammin kuin tavallisesti
- päänsärky
- heikkous tai epävakaus
- sekavuus, keskittymis- tai ajattelu- tai muistiongelmat
Vain jotkut ihmiset ovat vaarassa saada nämä ongelmat. Haluat ehkä käydä silmätutkimuksessa nähdäksesi, oletko vaarassa, ja saada ehkäisevää hoitoa, jos olet.
- silmän kipu
- muutoksia näkökyvyssä
- turvotus tai punoitus silmässä tai sen ympärillä
- Viivästynyt siemensyöksy tai kyvyttömyys saada siemensyöksyä
- Vähentynyt seksihalu
- Ongelmia saada tai säilyttää erektio
- Vähentynyt seksihalu
- Viivästynyt orgasmi tai kyvyttömyys saada orgasmi
Älä lopeta Lexaproa keskustelematta ensin terveydenhuollon tarjoajan kanssa. Lexapro 5mg:n liian nopea lopettaminen voi aiheuttaa vakavia oireita, kuten:
- ahdistuneisuus, ärtyneisyys, korkea tai huono mieliala, levottomuus tai muutokset nukkumistottumuksissa
- päänsärky, hikoilu, pahoinvointi, huimaus
- sähköiskun kaltaiset tuntemukset, vapina, sekavuus
Mikä on Lexapro?
Lexapro 20mg on reseptilääke, jota käytetään masennuksen hoitoon. On tärkeää keskustella terveydenhuollon tarjoajan kanssa masennuksen hoidon riskeistä ja myös riskeistä, jos sitä ei hoideta. Sinun tulee keskustella kaikista hoitovaihtoehdoista terveydenhuollon tarjoajan kanssa. Lexaproa käytetään myös:
- Vakava masennushäiriö (MDD)
- Yleistynyt ahdistuneisuushäiriö (GAD)
Keskustele terveydenhuollon tarjoajasi kanssa, jos et usko, että tilasi paranee Lexapro-hoidon myötä.
Kuka ei saa ottaa Lexapro 5mg -valmistetta?
Älä ota Lexapro 10 mg:aa, jos:
Ihmisillä, jotka ottavat Lexapro 20 mg:aa lähellä MAOI:ta ajoissa, voi olla vakavia tai jopa hengenvaarallisia sivuvaikutuksia. Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin näistä oireista:
- olet allerginen escitalopraamille tai sitalopraamille tai jollekin Lexapron aineosalle. Katso tämän lääkitysoppaan lopusta täydellinen luettelo Lexapron ainesosista.
- Ota monoamiinioksidaasin estäjä (MAOI). Kysy terveydenhuollon tarjoajalta tai apteekista, jos et ole varma, käytätkö MAO-estäjää, mukaan lukien linetsolidi.
- Älä ota MAO-estäjää 2 viikon kuluessa Lexapro 10mg -hoidon lopettamisesta, ellei lääkärisi ole niin määrännyt
- Älä aloita Lexapro 20 mg:n käyttöä, jos olet lopettanut MAO-estäjän käytön viimeisen 2 viikon aikana, ellei lääkärisi ole niin kehottanut.
- korkea kuume
- hallitsemattomat lihasspasmit
- jäykät lihakset
- nopeat sydämen sykkeen tai verenpaineen muutokset
- hämmennystä
- tajunnan menetys (pyörtyminen)
- Älä ota Lexaproa Orapin® (pimotsidin) kanssa, koska näiden kahden lääkkeen ottaminen yhdessä voi aiheuttaa vakavia sydänongelmia.
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen Lexapro 20 mg:n ottamista? Kysy, jos et ole varma.
Ennen kuin aloitat Lexapro 20mg -hoidon, kerro terveydenhuollon tarjoajallesi, jos:
- Käytätkö tiettyjä lääkkeitä, kuten:
- Triptaanit, joita käytetään migreenipäänsäryn hoitoon
- mielialan, ahdistuneisuuden, psykoottisten tai ajatushäiriöiden hoitoon käytettävät lääkkeet, mukaan lukien trisykliset lääkkeet, litium, SSRI:t, SNRI:t, amfetamiinit tai psykoosilääkkeet
- Tramadol
- Reseptivapaat lisäravinteet, kuten tryptofaani tai mäkikuisma
- sinulla on maksaongelmia
- on munuaisongelmia
- on sydänongelmia
- sinulla on tai on ollut kohtauksia tai kouristuksia
- sinulla on kaksisuuntainen mielialahäiriö tai mania
- sinulla on alhainen natriumpitoisuus veressäsi
- sinulla on ollut aivohalvaus
- on korkea verenpaine
- sinulla on tai on ollut verenvuotoongelmia
- olet raskaana tai suunnittelet raskautta. LEXAPRO:n ottaminen raskauden loppuvaiheessa voi lisätä tiettyjen ongelmien riskiä vastasyntyneelläsi. Keskustele terveydenhuollon tarjoajan kanssa masennuksen hoidon hyödyistä ja riskeistä raskauden aikana
- Jos tulet raskaaksi LEXAPRO-hoidon aikana, keskustele terveydenhuollon tarjoajan kanssa rekisteröitymisestä National Pregnancy Registry for masennuslääkkeisiin. Voit rekisteröityä soittamalla numeroon 1-844-405-6185 tai menemällä osoitteeseen https://womensmentalhealth.org/clinicaland- researchprograms/ rasedusregistry/antidepressants/
- imetät tai aiot imettää. Lexapro saattaa erittyä äidinmaitoon. Keskustele terveydenhuollon tarjoajan kanssa parhaasta tavasta ruokkia vauvasi, jos käytät Lexaproa.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät. Lexapro 10mg ja jotkut lääkkeet voivat olla vuorovaikutuksessa keskenään, eivät ehkä toimi yhtä hyvin tai voivat aiheuttaa vakavia sivuvaikutuksia.
Terveydenhuollon tarjoaja tai apteekkihenkilökunta voi kertoa sinulle, onko turvallista ottaa Lexapro 20mg muiden lääkkeiden kanssa. Älä aloita tai lopeta mitään lääkettä Lexapro 10mg -hoidon aikana keskustelematta ensin terveydenhuollon tarjoajan kanssa.
Jos käytät Lexaproa, älä käytä muita lääkkeitä, jotka sisältävät escitalopraamia tai sitalopraamia, mukaan lukien: Celexa.
Miten minun pitäisi ottaa Lexaproa?
- Ota Lexapro juuri niin kuin on määrätty. Terveydenhuollon tarjoajasi saattaa joutua muuttamaan Lexapro-annosta, kunnes se on oikea annos sinulle.
- Lexapro 5mg voidaan ottaa ruoan kanssa tai ilman.
- Jos unohdat ottaa Lexapro-annoksen, ota unohtunut annos heti kun muistat. Jos on melkein seuraavan annoksen aika, jätä unohtunut annos väliin ja ota seuraava annos tavalliseen aikaan. Älä ota kahta annosta Lexaproa samanaikaisesti.
- Jos otat liikaa Lexaproa, soita välittömästi terveydenhuollon tarjoajalle tai myrkytyskeskukseen tai hakeudu hätähoitoon.
Mitä minun pitäisi välttää Lexapro-hoidon aikana?
Lexapro 5mg voi aiheuttaa uneliaisuutta tai vaikuttaa kykyysi tehdä päätöksiä, ajatella selkeästi tai reagoida nopeasti. Älä aja autoa, käytä raskaita koneita tai tee muuta vaarallista toimintaa, ennen kuin tiedät, miten Lexapro vaikuttaa sinuun. Älä juo alkoholia käyttäessäsi Lexaproa.
Mitkä ovat Lexapro 20mg:n mahdolliset sivuvaikutukset?
Lexapro 10mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien kaikki niistä, jotka on kuvattu osiossa "Mikä on tärkein tieto, joka minun pitäisi tietää Lexaprosta?"
Yleisiä mahdollisia sivuvaikutuksia ihmisillä, jotka käyttävät Lexapro 5 mg:aa, ovat:
- Pahoinvointi
- Uneliaisuus
- Heikkous
- Huimaus
- Ahdistunut olo
- Nukkumisen vaikeuksia
- Seksuaaliset ongelmat
- Hikoilu
- Vapina
- Ei tunne nälkää
- Kuiva suu
- Ummetus
- Infektio
- Ammottava
Muita sivuvaikutuksia lapsille ja nuorille ovat:
- lisääntynyt jano
- epänormaali lihasten liikkeen lisääntyminen tai kiihtyneisyys
- nenäverenvuoto
- vaikea virtsaaminen
- raskaat kuukautiset
- mahdollinen hidastunut kasvunopeus ja painonmuutos. Lapsesi pituutta ja painoa tulee seurata Lexapro-hoidon aikana.
Kerro terveydenhuollon tarjoajallesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei katoa. Nämä eivät ole kaikkia Lexapron mahdollisia sivuvaikutuksia. Lisätietoja saat terveydenhuollon tarjoajalta tai apteekista.
Soita Lääkärillesi HAITTAVAIKUTUKSIIN LIITTYVÄN LÄÄKETIETEELLISEN NEUVON saamiseksi. VOI ILMOITTAA HAITTAVAIKUTUKSISTA FDA:LLE NUMEROON 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää Lexapro 20mg?
- Säilytä Lexaproa 68 °F - 77 °F (20 °C - 25 °C); kierrokset sallitaan 59 °F - 86 °F (15 °C - 30 °C).
- Pidä Lexapro-pullo tiiviisti suljettuna.
Pidä Lexapro 10mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa Lexaprosta
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä Lexaproa sairauteen, johon sitä ei ole määrätty. Älä anna Lexapro 10 mg:aa muille ihmisille, vaikka heillä olisi sama sairaus. Se voi vahingoittaa heitä.
Tämä lääkitysopas sisältää yhteenvedon tärkeimmistä tiedoista Lexaprosta. Jos haluat lisätietoja, keskustele terveydenhuollon tarjoajasi kanssa. Voit kysyä terveydenhuollon tarjoajalta tai apteekista tietoja Lexaprosta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Lisätietoja Lexapro 20 mg:sta saat soittamalla 1-800-678-1605 tai mene osoitteeseen www.Lexapro.com.
Mitä ainesosia Lexapro 20mg sisältää?
Vaikuttava aine: escitalopraamioksalaatti Inaktiiviset aineet:
- talkki, kroskarmelloosinatrium, mikrokiteinen selluloosa/kolloidinen piidioksidi ja magnesiumstearaatti. Kalvopinnoite sisältää hypromelloosia, titaanidioksidia ja polyetyleeniglykolia.
- Oraaliliuos: sorbitoli, puhdistettu vesi, sitruunahappo, natriumsitraatti, omenahappo, glyseriini, propyleeniglykoli, metyyliparabeeni, propyyliparabeeni ja luonnollinen piparminttuaromi (oraaliliuosta ei tällä hetkellä markkinoida).
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
