Geodon 40mg, 80mg, 20mg Ziprasidone Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Geodon on ja miten sitä käytetään?
Geodon on reseptilääke, jota käytetään skitsofrenian oireiden, skitsofrenian akuutin levottomuuden ja kaksisuuntaisen mielialahäiriön I oireiden hoitoon. Geodonia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Geodon 20mg kuuluu psykoosilääkkeiden luokkaan.
Ei tiedetä, onko Geodon turvallinen ja tehokas lapsille.
Mitkä ovat Geodonin mahdolliset sivuvaikutukset?
Geodon 20mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nopeat tai jyskyttävät sydämenlyönnit,
- lepattaa rinnassasi,
- hengenahdistus,
- äkillinen huimaus,
- kasvojen hallitsemattomat lihasliikkeet (pureskelu, huulten lyöminen, kulmien rypistäminen, kielen liike, räpyttely tai silmien liike),
- mikä tahansa ihottuma,
- kuume,
- suun haavaumat,
- ihohaavat,
- kipeä kurkku,
- yskä,
- vaikeuksia hengittää,
- lisääntynyt jano,
- lisääntynyt virtsaaminen
- kuiva suu,
- hedelmäinen hengityksen tuoksu,
- erittäin jäykät lihakset,
- korkea kuume,
- hikoilu,
- agitaatio ja
- hämmennystä
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Geodon 40mg:n yleisimmät sivuvaikutukset ovat:
- huimaus,
- uneliaisuus,
- heikkous,
- pahoinvointi,
- oksentelua,
- nielemisvaikeuksia,
- levoton olo,
- vapina,
- näköongelmia,
- vuotava nenä ja
- uusi tai paheneva yskä
Kerro lääkärillesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei häviä.
Nämä eivät ole kaikkia Prometriumin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
DEMENTIAAN LIITTYVÄÄ psykoosia sairastavien iäkkäiden potilaiden lisääntynyt kuolleisuus
Iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi ja joita hoidetaan psykoosilääkkeillä, on lisääntynyt kuolemanriski. GEODON ei ole hyväksytty dementiaan liittyvän psykoosin hoitoon (ks. VAROITUKSET JA VAROTOIMET].
KUVAUS
GEODON 40mg on saatavana kapseleina (tsiprasidonihydrokloridi) suun kautta ja injektiona (tsiprasidonimesylaatti) vain lihaksensisäiseen käyttöön. Tsiprasidoni on psykotrooppinen aine, joka ei ole kemiallisesti sukua fenotiatsiinille tai butyrofenoni psykoosilääkkeille. Sen molekyylipaino on 412,94 (vapaa emäs), jolla on seuraava kemiallinen nimi: 5-[2-[4-(1,2-bentsisotiatsol-3-yyli)-1-piperatsinyyli]etyyli]-6-kloori-1 ,3-dihydro-2H-indol-2-oni. C21H21ClN4OS:n (tsiprasidonin vapaa emäs) empiirinen kaava edustaa seuraavaa rakennekaavaa:
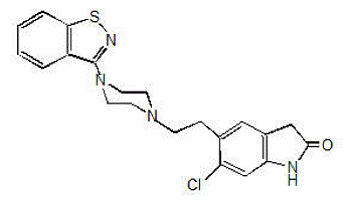
GEODON-kapselit sisältävät tsiprasidonin monohydrokloridia, monohydraattisuolaa. Tsiprasidonihydrokloridimonohydraatti on kemiallisesti 5-[2-[4-(1,2-bentsisotiatsol-3-yyli)-1-piperatsinyyli]etyyli]-6-kloori-1,3-dihydro-2H-indol-2-oni , monohydrokloridi, monohydraatti. Empiirinen kaava on C21H21ClN4OS• HCl• H2O ja sen molekyylipaino on 467,42. Ziprasidonihydrokloridimonohydraatti on valkoinen tai hieman vaaleanpunainen jauhe.
GEODON 20 mg kapselit toimitetaan suun kautta 20 mg (sininen/valkoinen), 40 mg (sininen/sininen), 60 mg (valkoinen/valkoinen) ja 80 mg (sininen/valkoinen) kapseleina. GEODON 40 mg kapselit sisältävät tsiprasidonihydrokloridimonohydraattia, laktoosia, esigelatinoitua tärkkelystä ja magnesiumstearaattia.
GEODON for Injection sisältää ziprasidonimesylaattitrihydraatin lyofilisoitua muotoa. Kemiallisesti tsiprasidonimesylaattitrihydraatti on 5-[2-[4-(1,2-bentsisotiatsol-3-yyli)-1-piperatsinyyli]etyyli]-6-kloori-1,3-dihydro-2H-indol-2-oni , metaanisulfonaatti, trihydraatti. Empiirinen kaava on C21H21ClN4OS • CH3SO3H • 3H2O ja sen molekyylipaino on 563,09.
GEODON 40mg injektiota varten on saatavana kerta-annosinjektiopullossa tsiprasidonimesylaattina (20 mg tsiprasidonia/ml, kun se valmistetaan etiketin ohjeiden mukaisesti) [ks. ANNOSTELU JA HALLINNOINTI ]. Jokainen ml tsiprasidonimesylaattia injektiota varten (kun se on liuotettu) sisältää 20 mg tsiprasidonia ja 4,7 mg metaanisulfonihappoa liuotettuna 294 mg:lla sulfobutyylieetteri-β-syklodekstriininatriumia (SBECD).
INDIKAATIOT
GEODON on tarkoitettu skitsofrenian hoitoon, monoterapiana kaksisuuntaisen mielialahäiriön maanisten tai sekamuotoisten jaksojen akuuttiin hoitoon ja litiumin tai valproaatin lisänä kaksisuuntaisen mielialahäiriön ylläpitohoitoon. GEODON intramuscular on tarkoitettu skitsofreniapotilaiden akuutin kiihtyneisyyden hoitoon. Päättäessään vaihtoehtoisista hoitomuodoista hoitoa vaativaan sairauteen, lääkärin tulee ottaa huomioon tsiprasidonin suurempi kyky pidentää QT/QTc-aikaa useisiin muihin psykoosilääkkeisiin verrattuna [ks. VAROITUKSET JA VAROTOIMET ]. QTc-ajan pidentyminen liittyy joissakin muissa lääkkeissä kykyyn aiheuttaa torsade de pointes -tyyppistä rytmihäiriötä, mahdollisesti kuolemaan johtavaa polymorfista kammiotakykardiaa ja äkillistä kuolemaa. Monissa tapauksissa tämä johtaisi siihen johtopäätökseen, että muita lääkkeitä tulisi kokeilla ensin. Ei ole vielä tiedossa, aiheuttaako tsiprasidoni torsade de pointesia tai lisää äkillistä kuolemaa [ks. VAROITUKSET JA VAROTOIMET ]
Skitsofrenia
- GEODON on tarkoitettu skitsofrenian hoitoon aikuisilla [katso Kliiniset tutkimukset ].
Kaksisuuntainen mielialahäiriö I (akuutit seka- tai maaniset jaksot ja ylläpitohoito litiumin tai valproaatin lisänä)
- GEODON on tarkoitettu monoterapiaan aikuisten akuuttiin hoitoon, jolla on kaksisuuntaiseen mielialahäiriöön I liittyviä maanisia tai sekajaksoja [ks. Kliiniset tutkimukset ].
- GEODON 40mg on tarkoitettu litiumin tai valproaatin lisäravinteeksi aikuisten kaksisuuntaisen mielialahäiriön ylläpitohoitoon [ks. Kliiniset tutkimukset ].
Agitaation akuutti hoito skitsofreniassa
- GEODON 40 mg lihakseen on tarkoitettu akuutin levottomuuden hoitoon skitsofreenisilla aikuispotilailla, joille tsiprasidonihoito on sopiva ja jotka tarvitsevat lihaksensisäistä antipsykoottista lääkitystä kiihtyneisyyden nopeaan hallintaan [ks. Kliiniset tutkimukset ].
Koska ei ole kokemusta tsiprasidonin lihaksensisäisen annon turvallisuudesta skitsofreniapotilaille, jotka jo käyttävät suun kautta otettavaa tsiprasidonia, yhteiskäyttöä ei suositella.
ANNOSTELU JA HALLINNOINTI
Skitsofrenia
Annoksen valinta
GEODON 40 mg kapselit tulee ottaa aloitusannoksella 20 mg kahdesti vuorokaudessa ruoan kanssa. Joillakin potilailla vuorokausiannosta voidaan myöhemmin muuttaa yksilöllisen kliinisen tilan perusteella enintään 80 mg:aan kahdesti vuorokaudessa. Annosta on tarvittaessa muutettava vähintään 2 päivän välein, koska vakaa tila saavutetaan 1-3 päivässä. Jotta varmistetaan pienimmän tehokkaan annoksen käyttö, potilaiden paranemista tulee tavallisesti tarkkailla useita viikkoja ennen annoksen suurentamista.
Teho skitsofrenian hoidossa osoitettiin annosalueella 20–100 mg kahdesti vuorokaudessa lyhytaikaisissa lumekontrolloiduissa kliinisissä tutkimuksissa. Suuntauksia kohti annosvastetta oli 20–80 mg kahdesti vuorokaudessa, mutta tulokset eivät olleet johdonmukaisia. Annosta suuremmaksi kuin 80 mg kahdesti vuorokaudessa ei yleensä suositella. Yli 100 mg kahdesti vuorokaudessa annettujen annosten turvallisuutta ei ole arvioitu systemaattisesti kliinisissä tutkimuksissa [ks. Kliiniset tutkimukset ].
Ylläpitohoito
Vaikka käytettävissä ei ole todisteita, jotka vastaisivat kysymykseen siitä, kuinka kauan tsiprasidonilla hoidetun potilaan tulisi jatkaa sitä, ylläpitotutkimus potilailla, joiden oireet olivat pysyneet vakaana ja jotka sitten satunnaistettiin jatkamaan tsiprasidonin käyttöä tai vaihtamaan lumelääkkeeseen, osoitti ajan viivästymisen. uusiutumiseen potilailla, jotka saavat GEODONia [katso Kliiniset tutkimukset ]. Yli 20 mg kahdesti vuorokaudessa annoksilla ei osoitettu lisähyötyä. Potilaat tulee säännöllisesti arvioida uudelleen ylläpitohoidon tarpeen määrittämiseksi.
Kaksisuuntainen mielialahäiriö I (akuutit seka- tai maaniset jaksot ja ylläpitohoito litiumin tai valproaatin lisänä)
Maanisten tai sekajaksojen akuutti hoito
Annoksen valinta - Suun kautta otettava tsiprasidoni tulee ottaa aloitusannoksena 40 mg kahdesti vuorokaudessa ruoan kanssa. Annosta voidaan tämän jälkeen nostaa 60 mg:aan tai 80 mg:aan kahdesti vuorokaudessa toisena hoitopäivänä ja sen jälkeen säätää siedettävyyden ja tehon perusteella välillä 40 mg–80 mg kahdesti vuorokaudessa. Joustavan annoksen kliinisissä tutkimuksissa keskimääräinen vuorokausiannos oli noin 120 mg [ks. Kliiniset tutkimukset ].
Ylläpitohoito (litiumin tai valproaatin lisänä)
Jatka hoitoa samalla annoksella, jolla potilas alun perin vakiintui, välillä 40 mg–80 mg kahdesti vuorokaudessa ruoan kanssa. Potilaat tulee säännöllisesti arvioida uudelleen ylläpitohoidon tarpeen määrittämiseksi [katso Kliiniset tutkimukset ].
Agitaation akuutti hoito skitsofreniassa
Lihaksensisäinen annostelu
Suositeltu annos on 10–20 mg tarpeen mukaan, enintään 40 mg vuorokaudessa. 10 mg:n annokset voidaan antaa kahden tunnin välein; 20 mg:n annokset voidaan antaa joka neljäs tunti, enintään 40 mg/vrk. Tsiprasidonin lihaksensisäistä antamista yli kolmena peräkkäisenä päivänä ei ole tutkittu.
Jos pitkäaikainen hoito on aiheellista, oraaliset tsiprasidonihydrokloridikapselit tulee korvata lihakseen annettavalla mahdollisimman pian.
Koska ei ole kokemusta tsiprasidonin lihaksensisäisen annon turvallisuudesta skitsofreniapotilaille, jotka jo käyttävät suun kautta otettavaa tsiprasidonia, yhteiskäyttöä ei suositella.
Lihaksensisäinen tsiprasidoni on tarkoitettu käytettäväksi vain lihakseen, eikä sitä tule antaa laskimoon.
Lihaksensisäinen valmistelu antoa varten
GEODON injektiota varten (tsiprasidonimesylaatti) tulee antaa vain lihakseen, eikä sitä tule antaa laskimoon. Kerta-annosinjektiopullot on saatettava käyttövalmiiksi ennen antamista.
Lisää 1,2 ml steriiliä injektionesteisiin käytettävää vettä injektiopulloon ja ravista voimakkaasti, kunnes kaikki lääkeaine on liuennut. Yksi ml käyttövalmiiksi saatettua liuosta sisältää 20 mg tsiprasidonia. Ota 10 mg:n annos 0,5 ml käyttövalmis liuosta. Ota 20 mg:n annos 1,0 ml käyttövalmis liuosta. Käyttämätön osa tulee hävittää. Koska tämä tuote ei sisällä säilöntä- tai bakteriostaattisia aineita, lopullisen liuoksen valmistuksessa on käytettävä aseptista tekniikkaa. Tätä lääkevalmistetta ei saa sekoittaa muiden lääkevalmisteiden tai liuottimien kuin steriilin injektionesteisiin käytettävän veden kanssa. Parenteraaliset lääkevalmisteet tulee tarkastaa silmämääräisesti hiukkasten ja värimuutosten varalta ennen antoa aina, kun liuos ja säiliö sen sallivat.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
GEODON kapselit ne erotetaan kapselin värin/koon mukaan, ja niihin on painettu mustalla musteella "Pfizer ja ZDX [annosteluvoima]" tai "Pfizer" ja yksilöllinen numero. GEODON 40 mg kapselit toimitetaan suun kautta 20 mg (sininen/valkoinen), 40 mg (sininen/sininen), 60 mg (valkoinen/valkoinen) ja 80 mg (sininen/valkoinen) kapseleina. Niitä toimitetaan seuraavissa vahvuuksissa ja pakkauskokoonpanoissa:
GEODON for Injection on saatavana kerta-annoksen injektiopullossa tsiprasidonimesylaattina (20 mg tsiprasidonia/ml, kun se valmistetaan etiketin ohjeiden mukaisesti) [ks. ANNOSTELU JA HALLINNOINTI ]. Jokainen ml tsiprasidonimesylaattia injektiota varten (kun se on liuotettu) tuottaa värittömän tai vaaleanpunaisen liuoksen, joka sisältää 20 mg tsiprasidonia ja 4,7 mg metaanisulfonihappoa liuotettuna 294 mg:lla sulfobutyylieetteri-β-syklodekstriininatriumia (SCECD).
Varastointi ja käsittely
GEODON kapselit ne erotetaan kapselin värin/koon mukaan ja niihin on painettu mustalla musteella "Pfizer ja ZDX [annosteluvoimakkuus]" tai "Pfizer" ja yksilöllinen numero. GEODON 20 mg kapselit toimitetaan suun kautta 20 mg (sininen/valkoinen), 40 mg (sininen/sininen), 60 mg (valkoinen/valkoinen) ja 80 mg (sininen/valkoinen) kapseleina. Niitä toimitetaan seuraavissa vahvuuksissa ja pakkauskokoonpanoissa:
Tai
GEODON-kapselit tulee säilyttää 25°C:ssa (77°F); retket sallitaan 15°C - 30°C (59°F - 86°F) [katso USP-ohjattu huonelämpötila ].
GEODON 80mg injektiota varten on saatavana kerta-annosinjektiopullossa tsiprasidonimesylaattina (20 mg tsiprasidonia/ml, kun se valmistetaan etiketin ohjeiden mukaisesti) [ks. ANNOSTELU JA HALLINNOINTI ]. Jokainen ml tsiprasidonimesylaattia injektiota varten (kun se on liuotettu) tuottaa värittömän tai vaaleanpunaisen liuoksen, joka sisältää 20 mg tsiprasidonia ja 4,7 mg metaanisulfonihappoa liuotettuna 294 mg:lla sulfobutyylieetteri-β-syklodekstriininatriumia (SCECD).
GEODON 40 mg injektiota varten tulee säilyttää 25 °C:ssa (77 °F); retket sallitaan 15°C - 30°C (59°F - 86°F) [katso USP-ohjattu huonelämpötila kuivassa muodossa. Suojaa valolta. Käyttövalmiiksi saattamisen jälkeen GEODON 40 mg injektiota voidaan säilyttää valolta suojattuna enintään 24 tuntia 15 °C - 30 °C (59 °F - 86 °F) tai enintään 7 päivää jääkaapissa, 2 °C - 8 °C (36–46 °F).
Jakelija: Pfizer Inc:n Roerig Division, NY, NY 10017. Tarkistettu: lokakuu 2020
SIVUVAIKUTUKSET
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Suun kautta otettavaa tsiprasidonia koskeviin kliinisiin tutkimuksiin osallistui noin 5 700 potilasta ja/tai normaalia henkilöä, jotka altistettiin yhdelle tai useammalle tsiprasidoniannokselle. Näistä 5 700:sta yli 4 800 oli potilaita, jotka osallistuivat usean annoksen tehokkuustutkimuksiin, ja heidän kokemuksensa vastasi noin 1 831 potilasvuotta. Näitä potilaita ovat: (1) 4 331 potilasta, jotka osallistuivat useisiin annoksiin perustuviin tutkimuksiin, pääasiassa skitsofreniassa, mikä edustaa noin 1 698 potilasvuotta altistumisesta 5. helmikuuta 2000; ja (2) 472 potilasta, jotka osallistuivat kaksisuuntaisen mielialahäiriön maniatutkimuksiin, jotka edustavat noin 133 potilasvuotta altistumista. Lisäksi 127 potilasta, joilla oli kaksisuuntainen mielialahäiriö, osallistui pitkäaikaiseen ylläpitohoitotutkimukseen, joka edusti noin 74,7 potilasvuotta tsiprasidonille. Tsiprasidonihoidon olosuhteisiin ja kestoon sisältyivät avoimet ja kaksoissokkotutkimukset, sairaala- ja avohoitotutkimukset sekä lyhyt- ja pitkäaikainen altistus.
Lihaksensisäistä tsiprasidonia koskeviin kliinisiin tutkimuksiin osallistui 570 potilasta ja/tai normaalia henkilöä, jotka saivat yhden tai useamman tsiprasidoni-injektion. Yli 325 näistä koehenkilöistä osallistui tutkimuksiin, joissa annettiin useita annoksia.
Altistumisen aikaiset haittavaikutukset saatiin keräämällä vapaaehtoisesti raportoituja haittavaikutuksia sekä fyysisten tutkimusten, elintoimintojen, painojen, laboratorioanalyysien, EKG:n ja oftalmologisten tutkimusten tuloksia.
Ilmoitetut haittavaikutusten esiintymistiheydet edustavat niiden henkilöiden osuutta, jotka ovat kokeneet vähintään kerran mainitun tyyppisen hoidon aiheuttaman haittavaikutuksen. Reaktion katsottiin olevan hoitoon liittyvä, jos se ilmeni ensimmäistä kertaa tai paheni hoidon aikana lähtötilanteen arvioinnin jälkeen.
Haitalliset löydökset, jotka havaittiin lyhytaikaisissa, lumekontrolloiduissa tutkimuksissa suun kautta otettavalla tsiprasidonilla
Seuraavat havainnot perustuvat lyhytaikaisiin lumekontrolloituihin esimarkkinointitutkimuksiin skitsofreniaa (kaksi 6 viikon ja kaksi 4 viikon kiinteän annoksen tutkimusta) ja kaksisuuntaista mielialamaniaa (kaksi 3 viikon joustavaa annosta sisältävää tutkimusta). tutkimukset), joissa tsiprasidonia annettiin annoksina 10-200 mg/vrk.
Yleisesti havaitut haittavaikutukset lyhytaikaisissa placebokontrolloiduissa kokeissa
Seuraavat haittavaikutukset olivat yleisimmin havaitut haittavaikutukset, jotka liittyvät tsiprasidonin käyttöön (esiintyvyys 5 % tai enemmän), eikä niitä havaittu vastaavalla ilmaantuvuusasteella lumelääkettä saaneiden potilaiden keskuudessa (tsiprasidonin ilmaantuvuus vähintään kaksi kertaa lumelääkettä saaneilla):
Skitsofreniatutkimukset (katso taulukko 11)
- Uneliaisuus
- Hengitysteiden tulehdus
Kaksisuuntaiset tutkimukset (katso taulukko 12)
- Uneliaisuus
- Ekstrapyramidaaliset oireet, joihin kuuluvat seuraavat haittavaikutustermit: ekstrapyramidaalinen oireyhtymä, hypertonia, dystonia, dyskinesia, hypokinesia, vapina, halvaus ja nykiminen. Mitään näistä haittavaikutuksista ei esiintynyt yksittäin yli 10 %:lla kaksisuuntaisen mielialahäiriön maniatutkimuksissa.
- Huimaus, joka sisältää haittavaikutustermit huimaus ja huimaus.
- Akathisia
- Epänormaali visio
- Astenia
- Oksentelu
Skitsofrenia
Haittavaikutukset, jotka liittyvät hoidon keskeyttämiseen lyhytaikaisissa, lumekontrolloiduissa suun kautta annettavan tsiprasidonin tutkimuksissa
Lyhytaikaisissa lumekontrolloiduissa tutkimuksissa noin 4,1 % (29/702) tsiprasidonilla hoidetuista potilaista keskeytti hoidon haittavaikutuksen vuoksi, kun taas lumelääkettä saaneista potilaista noin 2,2 % (6/273). Yleisin keskeyttämiseen liittyvä reaktio oli ihottuma, mukaan lukien 7 keskeytymistä ihottuman vuoksi tsiprasidonipotilailla (1 %) verrattuna lumelääkettä saamattomiin potilaisiin [ks. VAROITUKSET JA VAROTOIMET ].
Haittavaikutuksia, joita esiintyi vähintään 2 %:lla tsiprasidonilla hoidetuista potilaista lyhytaikaisissa, suun kautta annettavissa, lumekontrolloiduissa tutkimuksissa
Taulukossa 11 luetellaan lähimpään prosenttiin pyöristettynä hoidon aiheuttamien haittavaikutusten ilmaantuvuus akuutin hoidon aikana (enintään 6 viikkoa) pääasiassa skitsofreniapotilailla, mukaan lukien vain ne reaktiot, joita esiintyi vähintään 2 %:lla potilaista, jotka saivat tsiprasidoni ja joiden ilmaantuvuus tsiprasidonilla hoidetuilla potilailla oli suurempi kuin lumelääkettä saaneilla potilailla.
Haittavaikutusten annosriippuvuus lyhytaikaisissa, kiinteän annoksen ja lumelääkekontrolloiduissa tutkimuksissa
Analyysi annosvasteesta skitsofrenia-tutkimuksen poolissa paljasti haittavaikutusten ilmeisen yhteyden annokseen seuraavissa reaktioissa: voimattomuus, asentohypotensio, anoreksia, suun kuivuminen, lisääntynyt syljeneritys, nivelsärky, ahdistuneisuus, huimaus, dystonia, hypertonia, uneliaisuus , vapina, nuha, ihottuma ja epänormaali näkö.
Ekstrapyramidaaliset oireet (EPS)
Raportoitujen EPS:n (johon sisältyi haittavaikutustermit ekstrapyramidaalinen oireyhtymä, hypertonia, dystonia, dyskinesia, hypokinesia, vapina, halvaus ja nykiminen) ilmaantuvuus tsiprasidonilla hoidetuilla potilailla lyhytaikaisissa lumekontrolloiduissa skitsofreniatutkimuksissa oli 14 % vs. 8 % lumelääkettä varten. Näistä Simpson-Angus Rating Scale (EPS) ja Barnes Akathisia Scale (Akathisia) tutkimuksista saadut tiedot eivät yleensä osoittaneet eroa tsiprasidonin ja lumelääkkeen välillä.
Dystonia
Luokan vaikutus: Dystonian oireita, lihasryhmien pitkittyneitä epänormaaleja supistuksia, voi esiintyä herkillä henkilöillä muutaman ensimmäisen hoitopäivän aikana. Dystonisia oireita ovat: niskalihasten kouristukset, jotka joskus etenevät kurkun kireyteen, nielemisvaikeudet, hengitysvaikeudet ja/tai kielen ulkoneminen. Vaikka nämä oireet voivat ilmaantua pienillä annoksilla, niitä esiintyy useammin ja voimakkaammin suuren tehon ja suuremmilla ensimmäisen sukupolven psykoosilääkkeiden annoksilla. Miehillä ja nuoremmilla ikäryhmillä havaitaan kohonnut akuutin dystonian riski.
Elintoimintojen muutokset
Ziprasidoni liittyy ortostaattiseen hypotensioon [katso VAROITUKSET JA VAROTOIMET ]
EKG:n muutokset
Ziprasidoni liittyy QTc-ajan pidentymiseen [katso VAROITUKSET JA VAROTOIMET ]. Skitsofreniatutkimuksissa tsiprasidoni nosti sydämen sykettä keskimäärin 1,4 lyöntiä minuutissa verrattuna plasebopotilaiden 0,2 lyöntiä minuutissa laskuun.
Muut suun kautta otettavan tsiprasidonin markkinointia edeltävän arvioinnin aikana havaitut haittavaikutukset
Seuraavassa on luettelo COSTART-termeistä, jotka kuvastavat HAITTAVAIKUTUKSET-osion johdannossa määriteltyjä hoitoon liittyviä haittavaikutuksia, joita raportoivat potilaat, joita hoidettiin tsiprasidonilla skitsofreniatutkimuksissa useilla annoksilla > 4 mg/vrk 3834 potilaan tietokannassa. Kaikki raportoidut reaktiot sisältyvät lukuun ottamatta niitä, jotka on jo lueteltu taulukossa 11 tai muualla merkinnöissä, ne reaktiotermit, jotka olivat niin yleisiä, että ne eivät olleet informatiivisia, reaktiot, jotka on raportoitu vain kerran ja joilla ei ollut merkittävää todennäköisyyttä olla akuutisti hengenvaarallisia, reaktiot, jotka ovat osa hoidettavaa sairautta tai ovat muuten yleisiä taustareaktioina ja reaktiot, joiden katsotaan olevan epätodennäköisiä lääkkeisiin liittyviksi. On tärkeää korostaa, että vaikka raportoidut reaktiot ilmenivät tsiprasidonihoidon aikana, ne eivät välttämättä johtuneet siitä.
Haittavaikutukset luokitellaan edelleen kehojärjestelmän mukaan ja luetellaan esiintymistiheyden mukaan alenevassa järjestyksessä seuraavien määritelmien mukaisesti:
Usein - haittavaikutukset, joita esiintyy vähintään 1/100 potilaalla (≥ 1,0 % potilaista) (vain ne, joita ei ole jo mainittu lumekontrolloitujen tutkimusten taulukoituissa tuloksissa, näkyvät tässä luettelossa);
Harvinaiset – haittavaikutukset, joita esiintyy 1/100 - 1/1000 potilaalla (0,1-1,0 %:lla potilaista)
Harvinaiset – haittavaikutukset, joita esiintyy harvemmalla kuin 1/1000 potilaalla (
Keho kokonaisuutena
Toistuva vatsakipu, flunssaoireyhtymä, kuume, vahingossa kaatuminen, kasvojen turvotus, vilunväristykset, valoherkkyysreaktio, kylkikipu, hypotermia, moottoriajoneuvo-onnettomuus
Sydän- ja verisuonijärjestelmä
Toistuva takykardia, verenpainetauti, posturaalinen hypotensio
Harvinainen bradykardia, angina pectoris, eteisvärinä
Harvinainen ensimmäisen asteen AV-katkos, kimppuhaarakatkos, flebiitti, keuhkoembolia, kardiomegalia, aivoinfarkti, aivoverenkiertohäiriö, syvä tromboflebiitti, sydänlihastulehdus, tromboflebiitti
Ruoansulatuselimistö
Usein anoreksia, oksentelu
Harvinainen peräsuolen verenvuoto, dysfagia, kielen turvotus
Harvinainen ienverenvuoto, keltaisuus, ulosteen tukkeuma, lisääntynyt gammaglutamyylitranspeptidaasi, hematemesis, kolestaattinen keltaisuus, hepatiitti, hepatomegalia, suun leukoplakia, rasvamaksa, melena
Endokriininen
Harvinainen kilpirauhasen vajaatoiminta, hypertyreoosi, kilpirauhastulehdus
Hemic ja lymfaattinen järjestelmä
Harvinainen anemia, mustelma, leukosytoosi, leukopenia, eosinofilia, lymfadenopatia
Harvinainen trombosytopenia, hypokrominen anemia, lymfosytoosi, monosytoosi, basofilia, lymfedeema, polysytemia, trombosytemia
Aineenvaihdunta- ja ravitsemushäiriöt
Harvinainen jano, kohonnut transaminaasiarvo, perifeerinen turvotus, hyperglykemia, kohonnut kreatiinifosfokinaasi, lisääntynyt alkalinen fosfataasi, hyperkolesteremia, kuivuminen, kohonnut maitohappodehydrogenaasi, albuminuria, hypokalemia
Harvinainen kohonnut BUN, kohonnut kreatiniini, hyperlipemia, hypokolesteremia, hyperkalemia, hypokloemia, hypoglykemia, hyponatremia, hypoproteinemia, heikentynyt glukoosinsieto, kihti, hyperkloremia, hyperurikemia, hypokalsemia, hypoglykeeminen lisääntyminen, hypomagnesemia, ketoosi, hengitysteiden alkaloosi
Tuki- ja liikuntaelimistö
Usein myalgia
Harvinainen tenosynoviitti
Harvinainen myopatia
Hermosto
Toistuva kiihtyvyys, ekstrapyramidaalinen oireyhtymä, vapina, dystonia, hypertonia, dyskinesia, vihamielisyys, nykiminen, parestesia, sekavuus, huimaus, hypokinesia, hyperkinesia, epänormaali kävely, okulogyrinen kriisi, hypestesia, ataksia, muistinmenetys, hypotonia, jäykkyys, dyskinesia, vieroitusoireyhtymä, buccoglossal-oireyhtymä, koreoatetoosi, diplopia, koordinaatiohäiriö, neuropatia
Harvinainen halvaus
Harvinainen myoklonus, nystagmus, torticollis, ympärysmäinen parestesia, opisthotonos, lisääntyneet refleksit, trismus
Hengitysjärjestelmä
Toistuva hengenahdistus
Harvinainen keuhkokuume, nenäverenvuoto
Harvinainen hemoptysis, kurkunpäänsärky
Iho ja lisäkkeet
Harvinainen makulopapulaarinen ihottuma, nokkosihottuma, hiustenlähtö, ekseema, eksfoliatiivinen ihottuma, kosketusihottuma, vesiculobulloous ihottuma
Erityiset aistit
Usein sieni-ihottuma
Harvinainen sidekalvotulehdus, silmien kuivuminen, tinnitus, blefariitti, kaihi, valonarkuus
Harvinainen silmäverenvuoto, näkökenttävaurio, keratiitti, keratokonjunktiviitti
Urogenitaalinen järjestelmä
Harvinainen impotenssi, epänormaali siemensyöksy, amenorrea, hematuria, menorrhagia, naisen imetys, polyuria, virtsanpidätys metrorrhagia, miehen seksuaalinen toimintahäiriö, anorgasmia, glykosuria
Harvinainen gynekomastia, emättimen verenvuoto, nokturia, oliguria, naisten seksuaalinen toimintahäiriö, kohdun verenvuoto
Kaksisuuntainen mielialahäiriö
Maanisten tai sekajaksojen akuutti hoito
Lyhyen aikavälin hoidon keskeyttämiseen liittyvät haittavaikutukset, lumekontrolloidut tutkimukset
Lyhytaikaisissa lumekontrolloiduissa tutkimuksissa noin 6,5 % (18/279) tsiprasidonilla hoidetuista potilaista keskeytti hoidon haittavaikutuksen vuoksi, kun taas lumelääkettä saaneista potilaista noin 3,7 % (5/136). Yleisimmät reaktiot, jotka liittyvät keskeyttämiseen tsiprasidonilla hoidetuilla potilailla, olivat akatisia, ahdistuneisuus, masennus, huimaus, dystonia, ihottuma ja oksentelu, ja kustakin näistä reaktioista poistui 2 tsiprasidonipotilailla (1 %) verrattuna yhteen lumelääkepotilaan. dystoniaa ja ihottumaa (1 %) eikä lumepotilaita muita haittavaikutuksia varten.
Haittavaikutuksia, joita esiintyi vähintään 2 %:lla tsiprasidonilla hoidetuista potilaista lyhytaikaisissa, suun kautta annettavissa, lumekontrolloiduissa tutkimuksissa
Taulukossa 12 luetellaan lähimpään prosenttiin pyöristettynä hoidon aiheuttamien haittavaikutusten ilmaantuvuus akuutin hoidon aikana (enintään 3 viikkoa) potilailla, joilla on kaksisuuntainen mielialamania, mukaan lukien vain ne reaktiot, joita esiintyi vähintään 2 %:lla potilaista, jotka saivat tsiprasidoni ja joiden ilmaantuvuus tsiprasidonilla hoidetuilla potilailla oli suurempi kuin lumelääkettä saaneilla potilailla.
Sukupuolen perusteella tehdyt vuorovaikutustutkimukset eivät paljastaneet kliinisesti merkittäviä eroja haittavaikutusten esiintymisessä tämän demografisen tekijän perusteella.
Lihaksensisäinen ziprasidoni
Haittavaikutukset, joita esiintyi vähintään 1 %:lla tsiprasidonilla hoidetuista potilaista lyhytaikaisissa lihaksensisäisen tsiprasidonin tutkimuksissa
Taulukossa 13 luetellaan hoidon aiheuttamien haittavaikutusten ilmaantuvuus, pyöristettynä lähimpään prosenttiin, joita esiintyi akuutin intramuskulaarisen tsiprasidonihoidon aikana 1 %:lla tai useammalla potilaista.
Näissä tutkimuksissa yleisimmin havaitut haittavaikutukset, jotka liittyivät lihaksensisäisen tsiprasidonin käyttöön (esiintyvyys 5 % tai enemmän) ja jotka havaittiin lihaksensisäisellä tsiprasidonilla (suuremman annoksen ryhmissä) vähintään kaksinkertaisesti verrattuna pienimmän lihaksensisäisen tsiprasidonin ryhmään. päänsärkyä (13 %), pahoinvointia (12 %) ja uneliaisuutta (20 %).
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu GEODONin hyväksynnän jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Haittavaikutusraportit, joita ei ole lueteltu yllä ja jotka on saatu markkinoille tulon jälkeen, sisältävät harvoin seuraavia esiintymiä: Sydänhäiriöt: Takykardia, torsade de pointes (usean häiritsevän tekijän läsnä ollessa), [ks. VAROITUKSET JA VAROTOIMET ]; Ruoansulatuskanavan häiriöt: Turvonnut kieli; Lisääntymisjärjestelmän ja rintojen häiriöt: Galaktorrea, priapismi; Hermoston häiriöt: Kasvojen notkahdus, maligni neuroleptioireyhtymä, serotoniinioireyhtymä (yksin tai yhdessä serotonergisten lääkevalmisteiden kanssa), tardiivi dyskinesia; Psykiatriset häiriöt: Unettomuus, mania/hypomania; Ihon ja ihonalaisten kudosten häiriöt: Allergiset reaktiot (kuten allerginen ihotulehdus, angioödeema, suu-kasvojen turvotus, urtikaria), ihottuma, lääkereaktio eosinofilian ja systeemisten oireiden kanssa (DRESS); Virtsa- ja sukupuolielinten häiriöt: enureesi, virtsankarkailu; Verisuonihäiriöt: Posturaalinen hypotensio, pyörtyminen.
HUUMEIDEN VUOROVAIKUTUKSET
Lääkkeiden väliset yhteisvaikutukset voivat olla farmakodynaamisia (yhdistelmäfarmakologisia vaikutuksia) tai farmakokineettisiä (plasmapitoisuuksien muutos). Tsiprasidonin käytön riskit yhdessä muiden lääkkeiden kanssa on arvioitu alla kuvatulla tavalla. Kaikki yhteisvaikutustutkimukset on suoritettu suun kautta otettavalla tsiprasidonilla. Tsiprasidonin farmakodynaamisen ja farmakokineettisen profiilin perusteella voidaan odottaa mahdollisia yhteisvaikutuksia:
Metabolinen polku
Noin kaksi kolmasosaa tsiprasidonista metaboloituu glutationin aiheuttaman kemiallisen pelkistyksen ja aldehydioksidaasin entsymaattisen pelkistyksen yhdistelmän kautta. Ei ole olemassa kliinisesti merkittäviä aldehydioksidaasin estäjiä tai indusoijia. Alle kolmasosa tsiprasidonin metabolisesta puhdistumasta välittyy sytokromi P450:n katalysoiman hapettumisen kautta.
In vitro -tutkimukset
In vitro -entsyymien estotutkimus, jossa hyödynnettiin ihmisen maksan mikrosomeja, osoitti, että tsiprasidonilla oli vain vähän estävää vaikutusta CYP1A2-, CYP2C9-, CYP2C19-, CYP2D6- ja CYP3A4-entsyymeihin, joten se ei todennäköisesti häiritsisi pääasiassa näiden entsyymien kautta metaboloituvien lääkkeiden metaboliaa. Tsiprasidonin syrjäytymisen vuoksi on vain vähän mahdollista lääkevuorovaikutusta [katso KLIININEN FARMAKOLOGIA ].
Farmakodynaamiset vuorovaikutukset
Ziprasidonia ei tule käyttää minkään QT-aikaa pidentävän lääkkeen kanssa [katso VASTA-AIHEET ].
Tsiprasidonin ensisijaiset keskushermostovaikutukset huomioon ottaen on noudatettava varovaisuutta, kun sitä käytetään yhdessä muiden keskushermostoon vaikuttavien lääkkeiden kanssa.
Koska tsiprasidoni voi aiheuttaa hypotensiota, se voi voimistaa tiettyjen verenpainelääkkeiden vaikutuksia.
Ziprasidoni saattaa antagonisoida levodopan ja dopamiiniagonistien vaikutuksia.
Farmakokineettiset vuorovaikutukset
Karbamatsepiini
Karbamatsepiini on CYP3A4:n indusoija; 200 mg kahdesti vuorokaudessa 21 päivän ajan pienensi tsiprasidonin AUC-arvoa noin 35 %. Tämä vaikutus voi olla suurempi, kun annetaan suurempia annoksia karbamatsepiinia.
Ketokonatsoli
Ketokonatsoli, voimakas CYP3A4:n estäjä, lisäsi tsiprasidonin AUC- ja Cmax-arvoja noin 35-40 % annoksella 400 mg QD 5 päivän ajan. Muilla CYP3A4:n estäjillä odotetaan olevan samanlaisia vaikutuksia.
Simetidiini
Simetidiini annoksella 800 mg QD 2 päivän ajan ei vaikuttanut tsiprasidonin farmakokinetiikkaan.
Antacid
30 ml:n Maalox®:n samanaikainen antaminen tsiprasidonin kanssa ei vaikuttanut tsiprasidonin farmakokinetiikkaan.
Litium
Tsiprasidoni annoksena 40 mg kahdesti vuorokaudessa annettuna samanaikaisesti litiumin kanssa annoksella 450 mg kahdesti vuorokaudessa 7 päivän ajan ei vaikuttanut litiumin vakaan tilan tasoon tai munuaispuhdistumaan. Bipolaaripotilailla tehdyssä ylläpitotutkimuksessa litiumin lisäksi annettu tsiprasidoni ei vaikuttanut keskimääräisiin terapeuttisiin litiumpitoisuuksiin.
Ehkäisypillerit
In vivo -tutkimukset eivät ole paljastaneet tsiprasidonin vaikutusta estrogeeni- tai progesteronikomponenttien farmakokinetiikkaan. Ziprasidoni annoksella 20 mg kahdesti vuorokaudessa ei vaikuttanut samanaikaisesti käytettyjen oraalisten ehkäisyvalmisteiden, etinyyliestradiolin (0,03 mg) ja levonorgestreelin (0,15 mg) farmakokinetiikkaan.
Dekstrometorfaani
In vitro -tulosten mukaisesti normaaleilla terveillä vapaaehtoisilla tehty tutkimus osoitti, että tsiprasidoni ei muuttanut dekstrometorfaanin, CYP2D6-mallisubstraatin, metaboliaa sen päämetaboliitiksi, dekstrorfaaniksi. Virtsan dekstrometorfaani/dekstrorfaani-suhteessa ei havaittu tilastollisesti merkitsevää muutosta.
Valproaatti
Tsiprasidonin ja valproaatin farmakokineettinen yhteisvaikutus on epätodennäköinen, koska näillä kahdella lääkkeellä ei ole yhteisiä metaboliareittejä. Kaksisuuntaisen mielialahäiriön potilaiden ylläpitotutkimuksessa valproaatin lisäksi annettu tsiprasidoni ei vaikuttanut keskimääräisiin terapeuttisiin valproaattitasoihin.
Muu samanaikainen lääkehoito
Kontrolloituihin kliinisiin tutkimuksiin osallistuneiden skitsofreniapotilaiden populaatiofarmakokineettinen analyysi ei ole paljastanut kliinisesti merkittäviä farmakokineettisiä yhteisvaikutuksia bentstropiinin, propranololin tai loratsepaamin kanssa.
Ruoan vuorovaikutus
20 mg:n annoksen absoluuttinen biologinen hyötyosuus ruokailun yhteydessä on noin 60 %. Tsiprasidonin imeytyminen kasvaa jopa kaksinkertaiseksi ruoan kanssa [katso KLIININEN FARMAKOLOGIA ].
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Lisääntynyt kuolleisuus iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi
Iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi ja joita hoidetaan psykoosilääkkeillä, on lisääntynyt kuolemanriski. Analyysit 17 lumekontrolloidusta tutkimuksesta (modaalinen kesto 10 viikkoa), pääasiassa potilailla, jotka käyttivät epätyypillisiä psykoosilääkkeitä, osoittivat, että lääkehoitoa saaneiden potilaiden kuolemanriski on 1,6-1,7 kertaa suurempi kuin lumelääkettä saaneiden potilaiden riski. Tyypillisen 10 viikon kontrolloidun tutkimuksen aikana kuolleisuusaste lääkehoidetuilla potilailla oli noin 4,5 % verrattuna lumeryhmässä noin 2,6 %:iin.
Vaikka kuolinsyyt vaihtelivat, suurin osa kuolemista näytti olevan joko sydän- ja verisuoniperäisiä (esim. sydämen vajaatoiminta, äkillinen kuolema) tai tarttuvia (esim. keuhkokuume). GEODONia ei ole hyväksytty dementiaan liittyvän psykoosin potilaiden hoitoon. [katso LAATIKKO VAROITUS , Aivoverenkierron haittavaikutukset, mukaan lukien aivohalvaus, iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi ].
Aivoverenkierron haittavaikutukset, mukaan lukien aivohalvaus, iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi
Lumekontrolloiduissa tutkimuksissa iäkkäillä dementiapotilailla potilailla, jotka satunnaistettiin saamaan risperidonia, aripipratsolia ja olantsapiinia, oli suurempi aivohalvauksen ja ohimenevien iskeemisten kohtausten ilmaantuvuus, mukaan lukien kuolemaan johtanut aivohalvaus. GEODONia ei ole hyväksytty dementiaan liittyvän psykoosin potilaiden hoitoon [katso LAATIKKO VAROITUS ja Lisääntynyt kuolleisuus iäkkäillä potilailla, joilla on dementiaan liittyvä psykoosi ].
QT-ajan piteneminen ja äkillisen kuoleman riski
Ziprasidonin käyttöä tulee välttää yhdessä muiden lääkkeiden kanssa, joiden tiedetään pidentävän QTc-aikaa [katso VASTA-AIHEET ja HUUMEIDEN VUOROVAIKUTUKSET ]. Lisäksi lääkäreiden tulee olla valppaita tunnistamaan muita lääkkeitä, joiden on johdonmukaisesti havaittu pidentävän QTc-aikaa. Tällaisia lääkkeitä ei tule määrätä tsiprasidonin kanssa. Ziprasidonia tulee myös välttää potilailla, joilla on synnynnäinen pitkä QT-oireyhtymä, ja potilailla, joilla on ollut sydämen rytmihäiriöitä (ks. VASTA-AIHEET ].
Tutkimus, jossa verrattiin suoraan suun kautta otettavan tsiprasidonin QT/QTc-aikaa pidentävää vaikutusta useisiin muihin skitsofrenian hoidossa tehokkaisiin lääkkeisiin, suoritettiin vapaaehtoisilla potilailla. Kokeen ensimmäisessä vaiheessa EKG:t saatiin plasman maksimipitoisuuden aikaan, kun lääkettä annettiin yksinään. Tutkimuksen toisessa vaiheessa EKG:t saatiin plasman maksimipitoisuuden saavuttaessa, kun lääkettä annettiin samanaikaisesti lääkkeen CYP4503A4-metabolian estäjän kanssa.
Tutkimuksen ensimmäisessä vaiheessa laskettiin kullekin lääkkeelle QTc:n keskimääräinen muutos lähtötasosta käyttämällä näytepohjaista korjausta, joka poistaa sykkeen vaikutuksen QT-väliin. Keskimääräinen QTc-ajan pidentyminen lähtötasosta tsiprasidonilla oli noin 9–14 ms suurempi kuin neljällä vertailulääkkeellä (risperidoni, olantsapiini, ketiapiini ja haloperidoli), mutta se oli noin 14 ms vähemmän kuin tioridatsiinilla havaittu piteneminen.
Tutkimuksen toisessa vaiheessa tsiprasidonin vaikutusta QTc-aikaan ei lisännyt metabolisen estäjän (ketokonatsoli 200 mg kahdesti vuorokaudessa) läsnäolo.
Plasebokontrolloiduissa tutkimuksissa suun kautta otettu tsiprasidoni pidensi QTc-aikaa lumelääkkeeseen verrattuna noin 10 ms suurimmalla suositellulla vuorokausiannoksella 160 mg. Suun kautta otettavalla tsiprasidonilla tehdyissä kliinisissä tutkimuksissa 2/2988 (0,06 %) GEODON 80 mg:aa saaneesta potilaasta ja 1/440 (0,23 %) lumelääkettä saaneesta potilaasta paljasti QTc-ajan ylittävät mahdollisesti kliinisesti merkittävän 500 ms:n kynnyksen. Tsiprasidonilla hoidetuilla potilailla kumpikaan tapaus ei viitannut tsiprasidonin rooliin. Yhdellä potilaalla oli aiemmin ollut pitkittynyt QTc ja seulontamittaus 489 ms; QTc oli 503 ms tsiprasidonihoidon aikana. Toisen potilaan QTc-aika oli 391 ms tsiprasidonihoidon lopussa, ja tioridatsiiniin vaihtaessaan QTc-mittaukset olivat 518 ja 593 ms.
Jotkut lääkkeet, jotka pidentävät QT/QTc-aikaa, on yhdistetty torsade de pointesin esiintymiseen ja äkilliseen selittämättömään kuolemaan. QT-ajan pidentymisen suhde torsade de pointesiin on selkein suurempien lisäysten yhteydessä (20 ms ja enemmän), mutta on mahdollista, että pienemmät QT/QTc-ajan piteneminen voivat myös lisätä riskiä tai lisätä sitä herkillä yksilöillä. Vaikka tsiprasidonin käytön yhteydessä ei ole havaittu torsade de pointes -tapausta markkinoille saattamista edeltävissä tutkimuksissa ja kokemus on liian rajallinen suuren riskin sulkemiseksi pois, markkinoille tulon jälkeen on raportoitu harvoin (usean hämmentävän tekijän läsnä ollessa) [ks. HAITTAVAIKUTUKSET ].
Tutkimus, jossa arvioitiin lihaksensisäisen tsiprasidonin QT/QTc-aikaa pidentävää vaikutusta lihaksensisäisen haloperidolin kontrollina, suoritettiin vapaaehtoisilla potilailla. Kokeessa EKG:t otettiin plasman maksimipitoisuuden saavuttaessa kahden tsiprasidoni- (20 mg sitten 30 mg) tai haloperidolin (7,5 mg sitten 10 mg) injektion jälkeen, jotka annettiin neljän tunnin välein. Huomaa, että 30 mg:n annos lihakseen annettavaa tsiprasidonia on 50 % suurempi kuin suositeltu terapeuttinen annos. QTc:n keskimääräinen muutos lähtötilanteesta laskettiin kullekin lääkkeelle käyttämällä näytepohjaista korjausta, joka poistaa sykkeen vaikutuksen QT-väliin. Tsiprasidonin QTc-ajan keskimääräinen nousu lähtötasosta oli 4,6 ms ensimmäisen injektion jälkeen ja 12,8 ms toisen injektion jälkeen. Haloperidolin QTc-ajan keskimääräinen nousu lähtötasosta oli 6,0 ms ensimmäisen injektion jälkeen ja 14,7 ms toisen injektion jälkeen. Tässä tutkimuksessa yhdelläkään potilaalla QTc-aika ei ollut yli 500 ms.
Kuten muidenkin psykoosilääkkeiden ja lumelääkkeen yhteydessä, äkillisiä selittämättömiä kuolemantapauksia on raportoitu potilailla, jotka ovat käyttäneet tsiprasidonia suositelluilla annoksilla. Tsiprasidonin markkinoille saattamista edeltävä kokemus ei paljastanut suurempia kuolleisuusriskiä tsiprasidonille verrattuna muihin psykoosilääkkeisiin tai lumelääkkeeseen, mutta altistumisen laajuus oli rajallinen, erityisesti aktiivisina kontrolleina käytettävien lääkkeiden ja lumelääkkeen osalta. Siitä huolimatta tsiprasidonin suurempi QTc-ajan pidentyminen useisiin muihin psykoosilääkkeisiin verrattuna lisää mahdollisuutta, että äkillisen kuoleman riski voi olla suurempi tsiprasidonilla kuin muilla skitsofrenian hoitoon käytettävillä lääkkeillä. Tämä mahdollisuus on otettava huomioon valittaessa vaihtoehtoisia lääkevalmisteita [katso INDIKAATIOT ].
Tietyt olosuhteet voivat lisätä torsade de pointesin ja/tai äkillisen kuoleman riskiä QTc-aikaa pidentävien lääkkeiden käytön yhteydessä, mukaan lukien (1) bradykardia; (2) hypokalemia tai hypomagnesemia; (3) muiden QTc-aikaa pidentävien lääkkeiden samanaikainen käyttö; ja (4) QT-ajan synnynnäinen pidentyminen.
On suositeltavaa, että tsiprasidonihoitoa harkittaville potilaille, joilla on riski merkittävistä elektrolyyttihäiriöistä, erityisesti hypokalemiasta, tehdään seerumin kalium- ja magnesiumpitoisuudet. Hypokalemia (ja/tai hypomagnesemia) voi lisätä QT-ajan pitenemisen ja rytmihäiriön riskiä. Hypokalemia voi johtua diureettihoidosta, ripulista ja muista syistä. Potilaille, joilla on alhainen seerumin kalium- ja/tai magnesiumpitoisuus, on täytettävä nämä elektrolyytit ennen hoidon jatkamista. On tärkeää seurata säännöllisesti seerumin elektrolyyttejä potilailla, joille aloitetaan diureettihoito tsiprasidonihoidon aikana. Jatkuvasti pitkittyneet QTc-välit voivat myös lisätä riskiä pitenemisestä ja rytmihäiriöistä, mutta ei ole selvää, ovatko rutiiniseulonta-EKG-toimenpiteet tehokkaita tällaisten potilaiden havaitsemisessa. Tsiprasidonia tulee pikemminkin välttää potilailla, joilla on aiemmin ollut merkittäviä sydän- ja verisuonisairauksia, esim. QT-ajan pidentyminen, äskettäinen akuutti sydäninfarkti, kompensoimaton sydämen vajaatoiminta tai sydämen rytmihäiriö. Tsiprasidonihoito tulee lopettaa potilailla, joiden QTc-arvot jatkuvat yli 500 ms.
Tsiprasidonia käyttäville potilaille, joilla on oireita, jotka voivat viitata torsade de pointesin esiintymiseen, kuten huimausta, sydämentykytystä tai pyörtymistä, lääkärin tulee aloittaa lisäarviointi, esim. Holter-seuranta voi olla hyödyllistä.
Maligni neuroleptinen oireyhtymä (NMS)
Mahdollisesti kuolemaan johtava oireyhtymä, jota joskus kutsutaan maligniksi neuroleptioireyhtymäksi (NMS), on raportoitu psykoosilääkkeiden käytön yhteydessä. NMS:n kliinisiä oireita ovat hyperpyreksia, lihasjäykkyys, muuttunut henkinen tila ja todisteet autonomisesta epävakaudesta (epäsäännöllinen pulssi tai verenpaine, takykardia, hikoilu ja sydämen rytmihäiriö). Muita oireita voivat olla kohonnut kreatiniinifosfokinaasi, myoglobinuria (rabdomyolyysi) ja akuutti munuaisten vajaatoiminta.
Tätä oireyhtymää sairastavien potilaiden diagnostinen arviointi on monimutkaista. Diagnoosia tehtäessä on tärkeää sulkea pois tapaukset, joissa kliininen kuva sisältää sekä vakavan sairauden (esim. keuhkokuume, systeeminen infektio jne.) että hoitamattomia tai riittämättömästi hoidettuja ekstrapyramidaalisia merkkejä ja oireita (EPS). Muita tärkeitä näkökohtia erotusdiagnoosissa ovat keskushermoston antikolinerginen toksisuus, lämpöhalvaus, lääkekuume ja primaarinen keskushermoston (CNS) patologia.
NMS-taudin hoitoon tulisi kuulua: (1) psykoosilääkkeiden ja muiden samanaikaisen hoidon kannalta välttämättömien lääkkeiden välitön lopettaminen; (2) intensiivinen oireenmukainen hoito ja lääketieteellinen seuranta; ja (3) kaikkien samanaikaisten vakavien lääketieteellisten ongelmien hoito, joihin on saatavilla erityisiä hoitoja. Ei ole olemassa yleistä yksimielisyyttä NMS:n erityisistä farmakologisista hoito-ohjelmista.
Jos potilas tarvitsee psykoosilääkehoitoa NMS:stä toipumisen jälkeen, lääkehoidon mahdollista uudelleen aloittamista tulee harkita huolellisesti. Potilasta on seurattava huolellisesti, koska NMS-taudin uusiutumista on raportoitu.
Vakavat ihohaittavaikutukset
Lääkereaktio eosinofilian ja systeemisten oireiden kanssa (DRESS)
Eosinofilian ja systeemisten oireiden aiheuttamaa lääkereaktiota (DRESS) on raportoitu tsiprasidonille altistumisen yhteydessä. DRESS koostuu kolmen tai useamman seuraavista yhdistelmästä: ihoreaktio (kuten ihottuma tai hilseilevä dermatiitti), eosinofilia, kuume, lymfadenopatia ja yksi tai useampi systeeminen komplikaatio, kuten hepatiitti, nefriitti, keuhkotulehdus, sydänlihastulehdus ja perikardiitti. PUKU on joskus kohtalokasta. Lopeta ziprasidonin käyttö, jos epäilet DRESSiä.
Muut vakavat ihohaittavaikutukset
Muita vakavia ihohaittavaikutuksia, kuten Stevens-Johnsonin oireyhtymä, on raportoitu tsiprasidonille altistumisen yhteydessä. Vaikeat ihohaittavaikutukset ovat joskus kuolemaan johtavia. Lopeta ziprasidonin käyttö, jos epäillään vakavia ihohaittavaikutuksia.
Tardiivi dyskinesia
Mahdollisesti irreversiibelien, tahattomien, dyskineettisten liikkeiden oireyhtymä voi kehittyä potilaille, jotka saavat hoitoa psykoosilääkkeillä. Vaikka oireyhtymän esiintyvyys näyttää olevan korkein vanhuksilla, erityisesti iäkkäillä naisilla, on mahdotonta luottaa esiintyvyysarvioihin sen ennustamiseksi antipsykoottisen hoidon alussa, ketkä potilaat todennäköisesti saavat oireyhtymän. Ei tiedetä, eroavatko psykoosilääkkeet tardiivista dyskinesiasta.
Tardiivin dyskinesian kehittymisen riskin ja todennäköisyyden, että se muuttuu peruuttamattomaksi, uskotaan kasvavan hoidon keston ja potilaalle annettavien psykoosilääkkeiden kumulatiivisen kokonaisannoksen kasvaessa. Oireyhtymä voi kuitenkin kehittyä, vaikkakin paljon harvemmin, suhteellisen lyhyiden hoitojaksojen jälkeen pienillä annoksilla.
Tardiivin dyskinesian vakiintuneille tapauksille ei ole tunnettua hoitoa, vaikka oireyhtymä voi lievittyä osittain tai kokonaan, jos antipsykoottinen hoito lopetetaan. Antipsykoottinen hoito itsessään voi kuitenkin tukahduttaa (tai osittain tukahduttaa) oireyhtymän merkkejä ja oireita ja saattaa siten mahdollisesti peittää taustalla olevan prosessin. Oireisen suppression vaikutusta oireyhtymän pitkäaikaiseen kulumiseen ei tunneta.
Nämä näkökohdat huomioon ottaen tsiprasidonia tulee määrätä tavalla, joka todennäköisimmin minimoi tardiivin dyskinesian esiintymisen. Krooninen antipsykoottinen hoito tulisi yleensä varata potilaille, jotka kärsivät kroonisesta sairaudesta, jonka (1) tiedetään reagoivan psykoosilääkkeisiin ja (2) joille ei ole saatavilla tai sopivia vaihtoehtoisia, yhtä tehokkaita mutta mahdollisesti vähemmän haitallisia hoitoja. Potilailla, jotka tarvitsevat kroonista hoitoa, tulee pyrkiä pienintä annosta ja lyhyintä hoidon kestoa, joka tuottaa tyydyttävän kliinisen vasteen. Hoidon jatkamisen tarvetta tulee arvioida uudelleen säännöllisesti.
Jos tsiprasidonia saaneella potilaalla ilmenee tardiivin dyskinesian merkkejä ja oireita, lääkkeen käytön lopettamista tulee harkita. Jotkut potilaat saattavat kuitenkin tarvita tsiprasidonihoitoa oireyhtymästä huolimatta.
Metaboliset muutokset
Epätyypillisiin psykoosilääkkeisiin on liitetty metabolisia muutoksia, jotka voivat lisätä kardiovaskulaarista/aivoverisuoniriskiä. Näitä metabolisia muutoksia ovat hyperglykemia, dyslipidemia ja painonnousu. Vaikka kaikkien luokkaan kuuluvien lääkkeiden on osoitettu aiheuttavan joitain metabolisia muutoksia, jokaisella lääkkeellä on oma erityinen riskiprofiilinsa.
Hyperglykemia ja diabetes mellitus
Epätyypillisillä psykoosilääkkeillä hoidetuilla potilailla on raportoitu hyperglykemiaa ja diabetes mellitusta, jotka ovat joissakin tapauksissa äärimmäisiä ja jotka ovat liittyneet ketoasidoosiin tai hyperosmolaariseen koomaan tai kuolemaan. GEODON-hoitoa saaneilla potilailla on raportoitu vain vähän hyperglykemiaa tai diabetesta. Vaikka vähemmän potilaita on hoidettu GEODONilla, ei tiedetä, onko tämä rajoitetumpi kokemus ainoa syy tällaisten raporttien vähäisyyteen. Epätyypillisen psykoosilääkkeiden käytön ja glukoosipoikkeavuuksien välisen suhteen arviointia vaikeuttaa skitsofreniapotilaiden lisääntynyt diabeteksen taustariski ja yleisväestössä lisääntynyt diabetes mellituksen esiintyvyys. Kun otetaan huomioon nämä sekaannukset, epätyypillisen psykoosilääkkeen käytön ja hyperglykemiaan liittyvien haittavaikutusten välistä suhdetta ei täysin ymmärretä. Tarkkoja riskiarvioita hyperglykemiaan liittyvistä haittavaikutuksista potilailla, joita hoidetaan epätyypillisillä psykoosilääkkeillä, ei ole saatavilla.
Potilaita, joilla on todettu diabetes mellitus ja jotka aloittavat atyyppisten psykoosilääkkeiden käytön, tulee seurata säännöllisesti glukoositasapainon heikkenemisen varalta. Potilaille, joilla on diabetes mellituksen riskitekijöitä (esim. liikalihavuus, diabetes suvussa), jotka aloittavat hoidon atyyppisillä psykoosilääkkeillä, tulee tehdä paastoverensokerimittaus hoidon alussa ja määräajoin hoidon aikana. Potilaita, joita hoidetaan epätyypillisillä psykoosilääkkeillä, tulee seurata hyperglykemian oireiden varalta, mukaan lukien polydipsia, polyuria, polyfagia ja heikkous. Potilaille, joille kehittyy hyperglykemian oireita atyyppisten psykoosilääkkeiden käytön aikana, on tehtävä paastoverensokerimittaus. Joissakin tapauksissa hyperglykemia on parantunut, kun epätyypillinen antipsykootti on lopetettu; Jotkut potilaat kuitenkin tarvitsivat diabeteslääkityksen jatkamista huolimatta epäillyn lääkkeen lopettamisesta.
Taulukoissa 1-4 on koottu tiedot lyhytaikaisista lumekontrolloiduista skitsofrenian ja kaksisuuntaisen mielialahäiriön tutkimuksista. Huomaa, että sekä skitsofrenian että kaksisuuntaisen mielialahäiriön joustavan annoksen tutkimuksissa kukin koehenkilö luokitellaan saaneeksi joko pienen (20-40 mg BID) tai suuren (60-80 mg BID) annoksen potilaan modaalisen päivittäisen annoksen perusteella. Kategorisia muutoksia esittävissä taulukoissa prosentit (%-sarake) on laskettu 100x(n/N).

Pitkäaikaisissa (vähintään 1 vuoden) lumekontrolloiduissa, joustavan annoksen tutkimuksissa skitsofreniaa sairastavan tsiprasidonin 20–40 mg kahdesti vuorokaudessa satunnaisen glukoosin keskimääräinen muutos lähtötasosta oli -3,4 mg/dl (N=122); tsiprasidonille 60-80 mg BID oli +1,3 mg/dl (N = 10); ja lumelääkkeellä +0,3 mg/dl (N=71).
Dyslipidemia
Ei-toivottuja lipidien muutoksia on havaittu potilailla, joita on hoidettu epätyypillisillä psykoosilääkkeillä. Taulukoissa 5-8 on koottu tiedot lyhytaikaisista lumekontrolloiduista skitsofrenian ja kaksisuuntaisen mielialahäiriön tutkimuksista.
Pitkäaikaisissa (vähintään 1 vuoden) lumekontrolloiduissa, joustavilla annoksilla tehdyissä skitsofrenian tutkimuksissa satunnaisten triglyseridien keskimääräinen muutos lähtötilanteesta oli +26,3 mg/dl (N=15); tsiprasidonille 60-80 mg BID oli -39,3 mg/dl (N = 10); ja lumelääkkeellä +12,9 mg/dl (N=9). Pitkäaikaisissa (vähintään 1 vuoden) lumekontrolloiduissa, joustavan annoksen tutkimuksissa skitsofrenian hoidossa satunnaisen kokonaiskolesterolin keskimääräinen muutos lähtötilanteesta 20–40 mg kahdesti vuorokaudessa oli +2,5 mg/dl (N=14); tsiprasidonille 60-80 mg BID oli -19,7 mg/dl (N = 10); ja lumelääkettä sai -28,0 mg/dl (N=9).
Painonnousu
Painonnousua on havaittu epätyypillisen antipsykoottisen käytön yhteydessä. Painon seurantaa suositellaan. Taulukoissa 9-10 on koottu tiedot lyhytaikaisista lumekontrolloiduista skitsofrenian ja kaksisuuntaisen mielialahäiriön tutkimuksista.
Pitkäaikaisissa (vähintään 1 vuoden) lumekontrolloiduissa, joustavan annoksen skitsofrenian tutkimuksissa tsiprasidonin 20–40 mg kahdesti vuorokaudessa keskimääräinen painonmuutos lähtötilanteesta oli -2,3 kg (N=124); tsiprasidonille 60-80 mg BID oli +2,5 kg (N = 10); ja lumelääke -2,9 kg (N=72). Samoissa pitkäaikaistutkimuksissa potilaiden osuus, joiden paino nousi ≥ 7 % lähtötasosta tsiprasidonia 20-40 mg kahdesti vuorokaudessa, oli 5,6 % (N = 124); tsiprasidonilla 60-80 mg kahdesti vuorokaudessa oli 20,0 % (N=10) ja lumelääkettä saaneilla 5,6 % (N=72). Pitkäaikaisessa (vähintään 1 vuoden) lumekontrolloidussa kiinteäannoksisessa skitsofrenian tutkimuksessa tsiprasidonin 20 mg kahdesti vuorokaudessa keskimääräinen painonmuutos lähtötilanteesta oli -2,6 kg (N=72); tsiprasidonille 40 mg BID oli -3,3 kg (N = 69); tsiprasidonilla 80 mg kahdesti vuorokaudessa oli -2,8 kg (N = 70) ja lumelääkettä -3,8 kg (N = 70). Samassa pitkäaikaisessa kiinteän annoksen skitsofreniatutkimuksessa potilaiden osuus, joiden paino nousi ≥ 7 % lähtötasosta tsiprasidonia 20 mg kahdesti vuorokaudessa, oli 5,6 % (N = 72); tsiprasidonille 40 mg BID oli 2,9 % (N = 69); tsiprasidonilla 80 mg kahdesti vuorokaudessa oli 5,7 % (N = 70) ja lumelääkettä 2,9 % (N = 70).
Skitsofrenia
Niiden potilaiden osuutta, jotka täyttivät painonnousukriteerin ≥ 7 % kehon painosta, verrattiin neljän 4 ja 6 viikon lumekontrolloidun skitsofrenian kliinisen tutkimuksen poolissa, mikä paljasti tilastollisesti merkitsevästi suuremman painonnousun esiintyvyyden tsiprasidonilla (10 % ) verrattuna lumelääkkeeseen (4 %). Tsiprasidonia saaneilla potilailla havaittiin keskimäärin 0,5 kg:n painonnousua verrattuna lumelääkettä saaneiden potilaiden painon nousuun. Tässä kliinisissä tutkimuksissa painonnousua raportoitiin haittavaikutuksena 0,4 %:lla tsiprasidonia ja 0,4 %:lla lumelääkettä saaneista potilaista. Pitkäaikaisen tsiprasidonihoidon aikana potilaiden luokittelu lähtötilanteessa painoindeksin (BMI) perusteella paljasti suurimman keskimääräisen painonnousun ja suurimman kliinisesti merkittävän painonnousun (> 7 % painosta) potilailla, joilla oli alhainen painonnousu. BMI (27). Keskimääräinen painonnousu oli 1,4 kg niillä potilailla, joiden lähtötason BMI oli "matala", ei keskimääräistä muutosta potilailla, joilla oli "normaali" BMI, ja 1,3 kg:n keskimääräinen painonpudotus potilailla, jotka osallistuivat ohjelmaan "korkealla". BMI.
Kaksisuuntainen mielialahäiriö
Kuuden kuukauden lumekontrolloidussa kaksisuuntaisen mielialahäiriön ylläpitotutkimuksessa aikuisilla, joissa tsiprasidonia litiumin tai valproaatin lisänä, kliinisesti merkittävän painonnousun (≥ 7 % painosta) ilmaantuvuus kaksoissokkojakson aikana oli 5,6 % molemmilla tsiprasidonilla. ja lumelääkeryhmät, jotka suorittivat 6 kuukauden havainnoinnin uusiutumisen varalta. Näiden löydösten tulkinnassa tulee ottaa huomioon, että vain potilaat, jotka sietoivat riittävästi tsiprasidonia, pääsivät tutkimuksen kaksoissokkoutettuun vaiheeseen, ja avoimen vaiheen aikana oli merkittäviä keskeytyksiä.
Ihottuma
Tsiprasidonin markkinoille saattamista edeltävissä tutkimuksissa noin 5 %:lle potilaista kehittyi ihottuma ja/tai nokkosihottuma, ja hoito keskeytettiin noin kuudesosassa näistä tapauksista. Ihottuman ilmaantuminen liittyi tsiprasidoniannokseen, vaikka löydös saattoi selittää myös suuremman annoksen saaneiden potilaiden pitemmällä altistusajalla. Useilla potilailla, joilla oli ihottumaa, oli merkkejä ja oireita liittyvästä systeemisestä sairaudesta, esim. kohonneet valkosolut. Useimmat potilaat paranivat nopeasti antihistamiinien tai steroidien lisähoidolla ja/tai tsiprasidonihoidon lopettamisen jälkeen, ja kaikkien potilaiden, jotka kokivat näitä reaktioita, ilmoitettiin toipuvan kokonaan. Jos ilmenee ihottumaa, jolle ei voida tunnistaa vaihtoehtoista etiologiaa, tsiprasidonihoito on lopetettava.
Ortostaattinen hypotensio
Tsiprasidoni voi aiheuttaa ortostaattista hypotensiota, johon liittyy huimausta, takykardiaa ja joillakin potilailla pyörtymistä, erityisesti annoksen titrausvaiheen alussa, mikä todennäköisesti heijastaa sen α1-adrenergisiä antagonisteja. Pyörtymistä raportoitiin 0,6 %:lla tsiprasidonilla hoidetuista potilaista.
Ziprasidonia tulee käyttää erityisen varoen potilailla, joilla on tunnettu sydän- ja verisuonisairaus (aiemmin sydäninfarkti tai iskeeminen sydänsairaus, sydämen vajaatoiminta tai johtumishäiriöt), aivoverisuonitauti tai tilat, jotka altistavat potilaan hypotensiolle (dehydraatio, hypovolemia ja hoito verenpainelääke). lääkkeet).
Falls
Antipsykoottiset lääkkeet (mukaan lukien GEODON) voivat aiheuttaa uneliaisuutta, posturaalista hypotensiota sekä motorista ja sensorista epävakautta, mikä voi johtaa kaatumisiin ja sen seurauksena murtumiin tai muihin vammoihin. Potilaille, joilla on sairauksia, tiloja tai lääkkeitä, jotka voivat pahentaa näitä vaikutuksia, suorita putoamisriskin arvioinnit antipsykoottista hoitoa aloitettaessa ja toistuvasti potilailla, jotka saavat pitkäaikaista antipsykoottista hoitoa.
Leukopenia, neutropenia ja agranulosytoosi
Kliinisissä tutkimuksissa ja markkinoille tulon jälkeisessä kokemuksessa on raportoitu leukopeniaa/neutropeniaa, jotka liittyvät ajallisesti psykoosilääkkeisiin. Agranulosytoosia (mukaan lukien kuolemaan johtaneet tapaukset) on myös raportoitu.
Mahdollisia leukopenian/neutropenian riskitekijöitä ovat aiempi alhainen valkosolujen määrä (WBC) ja aiempi lääkkeiden aiheuttama leukopenia/neutropenia. Potilaiden, joilla on ennestään alhainen valkosolujen määrä tai joilla on aiemmin ollut lääkkeiden aiheuttama leukopenia/neutropenia, koko verenkuvaa (CBC) tulee tarkkailla usein muutaman ensimmäisen hoitokuukauden aikana, ja GEODON-hoito tulee keskeyttää ensimmäisten valkosolujen vähenemisen merkkien ilmaantuessa. muista aiheuttavista tekijöistä.
Potilaita, joilla on neutropenia, tulee tarkkailla huolellisesti kuumeen tai muiden oireiden tai infektion merkkien varalta, ja heitä tulee hoitaa välittömästi, jos tällaisia oireita tai merkkejä ilmaantuu. Potilaiden, joilla on vaikea neutropenia (absoluuttinen neutrofiilien määrä
Kohtaukset
Kliinisissä tutkimuksissa kouristuskohtauksia esiintyi 0,4 %:lla tsiprasidonilla hoidetuista potilaista. Oli hämmentäviä tekijöitä, jotka saattoivat vaikuttaa kohtausten esiintymiseen monissa näistä tapauksista. Kuten muitakin psykoosilääkkeitä, tsiprasidonia tulee käyttää varoen potilailla, joilla on ollut kouristuskohtauksia tai sairauksia, jotka mahdollisesti alentavat kohtauskynnystä, esim. Alzheimerin dementia. Kouristuskynnystä alentavat tilat voivat olla yleisempiä 65-vuotiailla tai vanhemmilla.
Dysfagia
Ruokatorven dysmotiliteetti ja aspiraatio on yhdistetty psykoosilääkkeiden käyttöön. Aspiraatiokeuhkokuume on yleinen sairastuvuuden ja kuolleisuuden syy iäkkäillä potilailla, erityisesti niillä, joilla on pitkälle edennyt Alzheimerin dementia. Ziprasidonia ja muita psykoosilääkkeitä tulee käyttää varoen potilailla, joilla on aspiraatiokeuhkokuumeen riski [ks. LAATIKKO VAROITUS ].
Hyperprolaktinemia
Kuten muutkin lääkkeet, jotka antagonisoivat dopamiini D2-reseptoreita, tsiprasidoni nostaa prolaktiinipitoisuutta ihmisillä. Lisääntyneitä prolaktiinipitoisuuksia havaittiin myös tällä yhdisteellä tehdyissä eläinkokeissa, ja se liittyi rintarauhasneoplasian lisääntymiseen hiirillä; samanlaista vaikutusta ei havaittu rotilla [katso Ei-kliininen toksikologia ]. Kudosviljelykokeet osoittavat, että noin kolmasosa ihmisen rintasyövistä on prolaktiinista riippuvaisia in vitro, mikä on mahdollisesti tärkeä tekijä, jos näiden lääkkeiden määrääminen harkitaan potilaalle, jolla on aiemmin todettu rintasyöpä. Tähän mennessä tehdyt kliiniset tutkimukset tai epidemiologiset tutkimukset eivät ole osoittaneet yhteyttä tämän lääkeluokan kroonisen annon ja kasvainten muodostumisen välillä ihmisillä; saatavilla olevaa näyttöä pidetään liian rajallisena ollakseen ratkaiseva tällä hetkellä.
Vaikka häiriöitä, kuten galaktorreaa, amenorreaa, gynekomastiaa ja impotenssia, on raportoitu käytettäessä prolaktiinia kohottavia yhdisteitä, seerumin kohonneiden prolaktiinipitoisuuksien kliinistä merkitystä ei tunneta useimmilla potilailla. Pitkäaikainen hyperprolaktinemia, joka liittyy hypogonadismiin, voi johtaa luun tiheyden laskuun.
Kognitiivisen ja motorisen vajaatoiminnan mahdollisuus
Uneliaisuus oli yleinen haittavaikutus tsiprasidonilla hoidetuilla potilailla. 4 ja 6 viikkoa kestäneissä lumekontrolloiduissa tutkimuksissa uneliaisuutta raportoitiin 14 %:lla tsiprasidonia saaneista potilaista ja 7 %:lla lumelääkettä saaneista potilaista. Uneliaisuus johti hoidon keskeyttämiseen 0,3 %:lla potilaista lyhytaikaisissa kliinisissä tutkimuksissa. Koska tsiprasidoni saattaa heikentää harkintakykyä, ajattelua tai motorisia taitoja, potilaita on varoitettava henkistä valppautta vaativien toimien suorittamisesta, kuten moottoriajoneuvon (mukaan lukien autot) tai vaarallisten koneiden käyttämisestä, kunnes he ovat kohtuullisen varmoja siitä, että tsiprasidonihoito ei vaikuttaa niihin haitallisesti.
Priapismi
Yksi priapismitapaus raportoitiin esimarkkinointitietokannassa. Vaikka reaktion yhteyttä tsiprasidonin käyttöön ei ole osoitettu, muiden lääkkeiden, joilla on alfa-adrenergisiä salpaavia vaikutuksia, on raportoitu aiheuttavan priapismia, ja on mahdollista, että tsiprasidonilla saattaa olla sama kapasiteetti. Vakava priapismi voi vaatia kirurgista toimenpidettä.
Kehon lämpötilan säätely
Vaikka tsiprasidonin kanssa ei raportoitu markkinointia edeltävissä tutkimuksissa, psykoosilääkkeiden on katsottu aiheuttavan häiriöitä kehon kyvyssä alentaa ruumiinlämpöä. Asianmukaista varovaisuutta suositellaan määrättäessä tsiprasidonia potilaille, joilla on tiloja, jotka voivat osaltaan kohottaa ruumiinlämpöä, esim. rasittava harjoittelu, altistuminen äärimmäiselle kuumuudelle, samanaikainen antikolinerginen lääke tai kuivuminen.
Itsemurha
Itsemurhayrityksen mahdollisuus on luontainen psykoottiselle sairaudelle tai kaksisuuntaiselle mielialahäiriölle, ja suuren riskin potilaiden tiivistä valvonnasta tulee seurata lääkehoitoa. Tsiprasidonin reseptit tulee kirjoittaa pienimmälle kapselimäärälle hyvän potilaan hoidon mukaisesti, jotta voidaan vähentää yliannostusriskiä.
Potilaat, joilla on samanaikaisia sairauksia
Kliininen kokemus tsiprasidonista potilailla, joilla on tiettyjä samanaikaisia systeemisiä sairauksia, on rajallinen [katso Käyttö tietyissä populaatioissa ].
Ziprasidonia ei ole arvioitu tai käytetty merkittävässä määrin potilailla, joilla on äskettäin ollut sydäninfarkti tai epävakaa sydänsairaus. Potilaat, joilla oli tällaisia diagnooseja, suljettiin pois markkinoille saattamista edeltävistä kliinisistä tutkimuksista. QTc-ajan pidentymisen ja ortostaattisen hypotension riskin vuoksi tsiprasidonin käytön yhteydessä on noudatettava varovaisuutta sydänpotilailla. [katso QT-ajan piteneminen ja äkillisen kuoleman riski, ortostaattinen hypotensio ].
Laboratoriotestit
Potilailta, joille harkitaan tsiprasidonihoitoa ja joilla on merkittävien elektrolyyttihäiriöiden riski, on mitattava seerumin kalium- ja magnesiumpitoisuudet. Alhainen seerumin kalium ja magnesium tulee vaihtaa ennen hoidon jatkamista. Potilaiden, joille aloitetaan diureettihoito tsiprasidonihoidon aikana, seerumin kalium- ja magnesiumpitoisuuksia on seurattava säännöllisesti. Ziprasidoni on lopetettava potilailla, joiden QTc-arvot jatkuvat >500 ms (ks. QT-ajan piteneminen ja äkillisen kuoleman riski ].
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ).
Antotiedot kapseleille
Neuvo potilaita ottamaan GEODON-kapselit kokonaisina. Älä avaa, murskaa tai pureskele kapseleita. Neuvo potilaita ottamaan GEODON-kapselit ruoan kanssa optimaalisen imeytymisen varmistamiseksi. Tsiprasidonin imeytyminen kasvaa jopa kaksinkertaiseksi ruoan kanssa [katso ANNOSTELU JA HALLINNOINTI , HUUMEIDEN VUOROVAIKUTUKSET , ja KLIININEN FARMAKOLOGIA ].
QTc-ajan pidentyminen
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajilleen seuraavista seikoista: QT-ajan piteneminen; äskettäinen akuutti sydäninfarkti; kompensoimaton sydämen vajaatoiminta; muiden lääkkeiden määrääminen, jotka ovat osoittaneet QT-ajan pidentymistä; merkittävien elektrolyyttihäiriöiden riski; ja sydämen rytmihäiriöhistoria [katso VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
Neuvo potilaita ilmoittamaan kaikista sellaisista tiloista, jotka saattavat heidät alttiiksi merkittäville elektrolyyttihäiriöille, erityisesti hypokalemialle, mukaan lukien, mutta niihin rajoittumatta, diureettihoidon aloittaminen tai pitkittynyt ripuli. Lisäksi kehota potilaita ilmoittamaan oireista, kuten huimauksesta, sydämentykytystä tai pyörtymisestä, lääkärille [ks. VAROITUKSET JA VAROTOIMET ].
Vakavat ihohaittavaikutukset
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen mahdollisimman varhaisessa vaiheessa kaikista merkeistä tai oireista, jotka voivat liittyä lääkereaktioon eosinofiliaa ja systeemisiä oireita (DRESS) tai vakaviin ihohaittavaikutuksiin, kuten Stevens-Johnsonin oireyhtymään [ks. VAROITUKSET JA VAROTOIMET ].
Raskaus
Kehota raskaana olevia naisia ilmoittamaan terveydenhuollon tarjoajalleen, jos he tulevat raskaaksi tai aikovat tulla raskaaksi GEODON-hoidon aikana. Kerro potilaille, että GEODON voi aiheuttaa ekstrapyramidaalisia ja/tai vieroitusoireita (levottomuus, hypertonia, hypotonia, vapina, uneliaisuus, hengitysvaikeudet ja syömishäiriöt) vastasyntyneellä. Kerro potilaille, että on olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet GEODONille raskauden aikana [ks. Käyttö tietyissä populaatioissa ].
Imetys
Neuvo imettäville naisille, jotka käyttävät GEODON 20 mg:aa, jotta he voivat tarkkailla imeväisiä liiallisen sedaation, ärtyneisyyden, huonon ruokinnan ja ekstrapyramidaalisten oireiden (vapina ja epänormaalit lihasliikkeet) varalta ja hakeutua lääkärin hoitoon, jos he huomaavat näitä merkkejä [ks. Käyttö tietyissä populaatioissa ].
Hedelmättömyys
Kerro lisääntymiskykyisille naisille, että GEODON 80 mg voi heikentää hedelmällisyyttä seerumin prolaktiinitason nousun vuoksi. Vaikutukset hedelmällisyyteen ovat palautuvia [katso VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Tsiprasidonilla suoritettiin elinikäisiä karsinogeenisuustutkimuksia Long Evans -rotilla ja CD-1-hiirillä. Ziprasidonia annettiin 24 kuukauden ajan ravinnon yhteydessä rotille annoksina 2, 6 tai 12 mg/kg/vrk ja hiirille 50, 100 tai 200 mg/kg/vrk (0,1-0,6 ja 1-5 kertaa suurempi kuin suurin suositeltu ihmisannos (MRHD) on 200 mg/vrk laskettuna mg/m2 kehon pinta-alasta). Rottatutkimuksessa ei havaittu todisteita kasvainten esiintyvyyden lisääntymisestä kontrolleihin verrattuna. Uroshiirillä kasvainten ilmaantuvuus ei lisääntynyt verrokkeihin verrattuna. Naarashiirillä aivolisäkkeen adenooman ja karsinooman sekä maitorauhasen adenokarsinooman ilmaantuvuus lisääntyi annoksesta riippuen kaikilla testatuilla annoksilla (50-200 mg/kg/vrk tai 1-5 kertaa MRHD perustuen mg/m2 kehon pinta-ala). Jyrsijöiden aivolisäkkeessä ja rintarauhasissa on havaittu proliferatiivisia muutoksia muiden psykoosilääkkeiden pitkäaikaisen annon jälkeen, ja niiden katsotaan olevan prolaktiinivälitteisiä. Seerumin prolaktiinipitoisuuden nousua havaittiin yhden kuukauden ruokavaliotutkimuksessa naarashiirillä, mutta ei uroshiirillä, 100 ja 200 mg/kg/vrk (tai 2,5 ja 5 kertaa MRHD perustuen mg/m2 kehon pinta-alaan). Ziprasidonilla ei ollut vaikutusta seerumin prolaktiiniin rotilla 5 viikkoa kestäneessä ruokavaliotutkimuksessa annoksilla, joita käytettiin karsinogeenisuustutkimuksessa. Jyrsijöillä esiintyvien prolaktiinivälitteisten endokriinisten kasvainten löydösten merkitystä ihmisen riskin kannalta ei tunneta [ks. VAROITUKSET JA VAROTOIMET ].
Mutageneesi
Ziprasidonia testattiin Amesin bakteerimutaatiomäärityksessä, nisäkässolujen geenimutaatioiden in vitro hiiren lymfoomamäärityksessä, in vitro kromosomipoikkeavuusmäärityksessä ihmisen lymfosyyteillä ja in vivo kromosomipoikkeavuusmäärityksessä hiiren luuytimessä. Amesin määrityksessä havaittiin toistettavissa oleva mutageeninen vaste yhdessä S. typhimurium -kannassa ilman metabolista aktivaatiota. Positiivisia tuloksia saatiin sekä nisäkässolujen geenimutaatiotestissä in vitro että ihmisen lymfosyyttien kromosomipoikkeavuusmäärityksessä.
Hedelmällisyyden heikkeneminen
Tsiprasidonin osoitettiin pidentävän paritteluaikaa Sprague-Dawley-rotilla kahdessa hedelmällisyystutkimuksessa ja varhaisessa alkionkehitystutkimuksessa annoksilla 10-160 mg/kg/vrk (0,5-8 kertaa MRHD 200 mg/vrk perustuen kehon mg/m2 pinta-ala). Hedelmällisyysaste laski annoksella 160 mg/kg/vrk (8 kertaa MRHD perustuen mg/m2 kehon pinta-alaan). Ei ollut vaikutusta hedelmällisyyteen annoksella 40 mg/kg/vrk (2 kertaa MRHD perustuen mg/m2 kehon pinta-alaan). Vaikutus hedelmällisyyteen näytti olevan naaraalla, koska hedelmällisyys ei heikentynyt, kun urokset, joille annettiin 160 mg/kg/vrk (8 kertaa MRHD perustuen mg/m2 kehon pinta-alaan), paritettiin hoitamattomien naaraiden kanssa.
Käyttö tietyissä populaatioissa
Raskaus
Raskausaltistusrekisteri
On olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet epätyypillisille psykoosilääkkeille, mukaan lukien GEODON 40 mg, raskauden aikana. Terveydenhuollon tarjoajia kehotetaan rekisteröimään potilaita ottamalla yhteyttä kansalliseen epätyypillisten antipsykoottien raskausrekisteriin numeroon 1-866-961-2388 tai verkossa osoitteessa http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/.
Riskien yhteenveto
Vastasyntyneillä, jotka ovat altistuneet antipsykoottisille lääkkeille, mukaan lukien GEODON, kolmannen raskauskolmanneksen aikana, on riski saada ekstrapyramidaalisia ja/tai vieroitusoireita synnytyksen jälkeen (ks. Kliiniset näkökohdat ). Tsiprasidonille altistuneiden raskaana olevien naisten julkaistuista epidemiologisista tutkimuksista saatavilla olevat tiedot eivät ole osoittaneet lääkkeeseen liittyvää vakavien synnynnäisten epämuodostumien, keskenmenon tai haitallisten äitien tai sikiön seurausten riskiä (ks. Data ). Hoitamaton skitsofrenia tai kaksisuuntainen mielialahäiriö I ja psykoosilääkkeille, mukaan lukien GEODON, raskauden aikana altistumiseen liittyvät riskit äidille (ks. Kliiniset näkökohdat ).
Eläinkokeissa tsiprasidonin antaminen tiineille rotille ja kaniineille organogeneesin aikana aiheutti kehitystoksisuutta annoksilla, jotka olivat samankaltaisia kuin suositeltuja ihmisannoksia, ja se oli teratogeeninen kaniineille 3 kertaa ihmiselle suositeltua enimmäisannostusta (MRHD) suuremmalla annoksella. Tsiprasidonille tiineyden ja laktaation aikana altistetuilla rotilla pentujen perinataalinen kuolleisuus lisääntyi ja jälkeläisten hermostollinen käyttäytyminen ja toiminnallinen kehitys viivästyi annoksilla, jotka olivat pienempiä tai samanlaisia kuin ihmisen terapeuttiset annokset (ks. Data ).
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski mainituilla väestöryhmillä ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Kliiniset näkökohdat
Sairauteen liittyvä äidin ja/tai alkion/sikiön riski
Äidille on olemassa riski hoitamattomasta skitsofreniasta tai kaksisuuntaisesta mielialahäiriöstä I, mukaan lukien lisääntynyt uusiutumisen, sairaalahoidon ja itsemurhan riski. Skitsofrenia ja kaksisuuntainen mielialahäiriö I liittyvät lisääntyneisiin perinataalisiin haittavaikutuksiin, mukaan lukien ennenaikainen synnytys. Ei tiedetä, onko tämä suora seuraus sairaudesta tai muista samanaikaisista tekijöistä.
Sikiön/vastasyntyneen haittavaikutukset
Ekstrapyramidaalisia ja/tai vieroitusoireita, mukaan lukien agitaatio, hypertonia, hypotonia, vapina, uneliaisuus, hengitysvaikeudet ja syömishäiriöt, on raportoitu vastasyntyneillä, jotka ovat altistuneet psykoosilääkkeille, mukaan lukien GEODON, raskauden kolmannen kolmanneksen aikana. Nämä oireet ovat vaihdelleet vakavuudeltaan. Tarkkaile vastasyntyneitä ekstrapyramidaalisten ja/tai vieroitusoireiden varalta ja hallitse oireita asianmukaisesti. Jotkut vastasyntyneet toipuivat tunneissa tai päivissä ilman erityistä hoitoa; toiset vaativat pitkäaikaista sairaalahoitoa.
Data
Ihmistiedot
Havaintotutkimuksista, syntymärekistereistä ja tapausraporteista saadut tiedot epätyypillisten psykoosilääkkeiden käytöstä raskauden aikana eivät kerro selkeää yhteyttä psykoosilääkkeisiin ja merkittäviin synnynnäisiin epämuodostumisiin. Medicaid-tietokannasta tehty retrospektiivinen kohorttitutkimus, jossa oli mukana 9 258 raskauden aikana psykoosilääkkeille altistunutta naista, ei osoittanut yleistä lisääntynyttä riskiä vakaville synnynnäisille epämuodostumille.
Eläinten tiedot
Kun tsiprasidonia annettiin tiineille kaneille organogeneesin aikana, sikiön rakenteellisten poikkeavuuksien (kammioväliseinän vaurioiden ja muiden sydän- ja verisuonihäiriöiden sekä munuaismuutosten) ilmaantuvuus havaittiin annoksella 30 mg/kg/vrk (3 kertaa MRHD). 200 mg/vrk laskettuna mg/m2 kehon pinta-alasta). Ei ollut näyttöä siitä, että nämä kehitysvaikutukset olisivat toissijaisia emolle aiheutuvan toksisuuden vuoksi. Kehitykseen vaikuttamaton annos oli 10 mg/kg/vrk (vastaa MRHD:tä, joka perustuu mg/m2 kehon pinta-alaan). Rotilla havaittiin alkio- ja sikiötoksisuutta (sikiön painon lasku, luuston luutumisen viivästyminen) 10–160 mg/kg/vrk (0,5–8 kertaa MRHD perustuen mg/m2 kehon pinta-alaan) antamisen jälkeen organogeneesin aikana tai koko tiineyden ajan, mutta teratogeenisuudesta ei ollut näyttöä. Annokset 40 ja 160 mg/kg/vrk (2 ja 8 kertaa MRHD perustuen mg/m2 kehon pinta-alaan) liittyivät äidin toksisuuteen. Kehitykseen vaikuttava annos on 5 mg/kg/vrk (0,2 kertaa MRHD perustuen mg/m2 kehon pinta-alaan).
Naarasrottien jälkeläisillä, joita hoidettiin tiineyden ja laktaation aikana annoksilla 10 mg/kg/vrk (0,5 kertaa MRHD:n perusteella), kuolleina syntyneiden pentujen määrä lisääntyi ja synnytyksen jälkeinen eloonjääminen pieneni imetyksen ensimmäisten neljän päivän aikana. mg/m2 kehon pinta-alaa) tai suurempi. Jälkeläisten kehityksen viivästymistä (pieni pentujen paino) ja hermostollisia käyttäytymishäiriöitä (silmien avaaminen ilmaan) havaittiin annoksilla 5 mg/kg/vrk (0,2 kertaa MRHD perustuen mg/m2 kehon pinta-alaan) tai suurempia annoksia. Näille vaikutuksille ei määritetty vaikutuksetonta tasoa.
Imetys
Riskien yhteenveto
Rajalliset tiedot julkaistusta tapausraportista osoittavat tsiprasidonin esiintyvän äidinmaidossa. Vaikka ei ole raportoitu haittavaikutuksia imetetylle lapselle, joka on altistunut tsiprasidonille äidinmaidon välityksellä, on raportoitu liiallisesta sedaatiosta, ärtyneisyydestä, huonosta ruokinnasta ja ekstrapyramidaalisista oireista (vapina ja epänormaalit lihasliikkeet) imeväisillä, jotka ovat altistuneet muille epätyypillisille psykoosilääkkeille rinnan kautta. maitoa (katso Kliiniset näkökohdat ). Tsiprasidonin vaikutuksista maidontuotantoon ei ole tietoa. Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon sekä äidin kliininen GEODON-tarve ja GEODON 20mg:n mahdolliset haitalliset vaikutukset imetettävään lapseen tai äidin taustalla oleva sairaus.
Kliiniset näkökohdat
GEODON-valmisteelle altistuneita imeväisiä tulee tarkkailla liiallisen sedaation, ärtyneisyyden, huonon ruokinnan ja ekstrapyramidaalisten oireiden (vapina ja epänormaalit lihasliikkeet) varalta.
Naaraat ja urokset, joilla on lisääntymispotentiaali
Hedelmättömyys
Naaraat
Tsiprasidonin farmakologisen vaikutuksen (D2-antagonismi) perusteella hoito GEODON 40 mg:lla voi johtaa seerumin prolaktiinipitoisuuden nousuun, mikä voi johtaa palautuvaan hedelmällisyyden heikkenemiseen lisääntymiskykyisillä naisilla [ks. VAROITUKSET JA VAROTOIMET ja Ei-kliininen toksikologia ].
Käyttö lapsille
Tsiprasidonin turvallisuutta ja tehoa lapsipotilailla ei ole varmistettu.
Geriatrinen käyttö
Tsiprasidonin kliinisissä tutkimuksissa koehenkilöiden kokonaismäärästä 2,4 prosenttia oli 65-vuotiaita tai vanhempia. Yleisiä eroja turvallisuudessa tai tehokkuudessa ei havaittu näiden ja nuorempien koehenkilöiden välillä, ja muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois. Useiden tekijöiden, jotka voivat lisätä tsiprasidonin farmakodynaamista vastetta tai heikentää toleranssia tai ortostaasia, tulisi kuitenkin johtaa pienemmän aloitusannoksen harkitsemiseen, hitaampaan titraukseen ja huolelliseen seurantaan aloitusannostuksen aikana joillakin iäkkäillä potilailla.
Lihaksensisäistä tsiprasidonia ei ole arvioitu systemaattisesti iäkkäillä potilailla (65-vuotiaat ja sitä vanhemmat).
Munuaisten vajaatoiminta
Koska tsiprasidoni metaboloituu voimakkaasti ja alle 1 % lääkkeestä erittyy muuttumattomana, pelkällä munuaisten vajaatoiminnalla ei todennäköisesti ole suurta vaikutusta tsiprasidonin farmakokinetiikkaan. Tsiprasidonin farmakokinetiikka 8 päivän 20 mg kahdesti vuorokaudessa annostelun jälkeen oli samanlainen eriasteista munuaisten vajaatoimintaa sairastavilla (n = 27) ja potilailla, joilla oli normaali munuaisten toiminta, mikä osoittaa, että annoksen muuttaminen munuaisten vajaatoiminnan asteen mukaan ei ole tarpeen. . Ziprasidoni ei poistu hemodialyysillä.
Lihaksensisäistä tsiprasidonia ei ole arvioitu systemaattisesti iäkkäillä potilailla tai potilailla, joilla on maksan tai munuaisten vajaatoiminta. Koska syklodekstriinin apuaine puhdistuu munuaissuodatuksella, tsiprasidonia lihakseen tulee antaa varoen potilaille, joilla on heikentynyt munuaisten toiminta [ks. KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
Koska tsiprasidoni puhdistuu olennaisesti maksan kautta, maksan vajaatoiminnan oletetaan suurentavan tsiprasidonin AUC-arvoa. toistuva tutkimus 20 mg kahdesti vuorokaudessa 5 päivän ajan koehenkilöillä (n=13), joilla oli kliinisesti merkittävä (Childs-Pugh-luokat A ja B) kirroosi, paljasti AUC 0-12:n kohoamisen 13 % ja 34 % Childs- Pugh-luokka A ja B verrattuna vastaavaan vertailuryhmään (n=14). Kirroosia sairastavilla koehenkilöillä havaittiin 7,1 tunnin puoliintumisaika verrattuna 4,8 tuntiin kontrolliryhmässä.
Ikä- ja sukupuolivaikutukset
Useita annoksia (8 päivää hoitoa) koskevassa tutkimuksessa, johon osallistui 32 henkilöä, tsiprasidonin farmakokinetiikassa ei ollut eroa miesten ja naisten välillä eikä iäkkäiden (>65-vuotiaiden) ja nuorten (18-45-vuotiaiden) välillä. Lisäksi kontrolloiduissa tutkimuksissa potilaiden populaatiofarmakokineettinen arviointi ei ole paljastanut kliinisesti merkittäviä ikään tai sukupuoleen liittyviä eroja tsiprasidonin farmakokinetiikassa. Siksi annoksen muuttamista iän tai sukupuolen mukaan ei suositella.
Tupakointi
Ihmisen maksaentsyymejä käyttävien in vitro -tutkimusten perusteella tsiprasidoni ei ole CYP1A2:n substraatti. tupakoinnin ei siksi pitäisi vaikuttaa tsiprasidonin farmakokinetiikkaan. Näiden in vitro -tulosten mukaisesti populaatiofarmakokineettinen arviointi ei ole paljastanut merkittäviä farmakokineettisiä eroja tupakoitsijoiden ja tupakoimattomien välillä.
YLIANNOSTUS
Inhimillinen kokemus
Markkinoille saattamista edeltävissä tutkimuksissa, joihin osallistui yli 5 400 potilasta ja/tai normaalia koehenkilöä, suun kautta otettavan tsiprasidonin tahaton tai tahallinen yliannostus dokumentoitiin 10 potilaalla. Kaikki nämä potilaat selvisivät ilman jälkitauteja. Potilaalla, joka otti suurimman vahvistetun määrän, 3 240 mg, ainoat raportoidut oireet olivat minimaalinen sedaatio, puheen sumea ja ohimenevä verenpainetauti (200/95).
Ziprasidonin yliannostuksen yhteydessä raportoituja haittavaikutuksia olivat ekstrapyramidaalioireet, uneliaisuus, vapina ja ahdistuneisuus. [katso HAITTAVAIKUTUKSET ]
Yliannostuksen hallinta
Akuutin yliannostuksen sattuessa on luotava ja ylläpidettävä hengitystiet sekä varmistettava riittävä hapetus ja tuuletus. Laskimonsisäinen pääsy tulee varmistaa ja mahahuuhtelua (intuboinnin jälkeen, jos potilas on tajuton) ja aktiivihiilen antamista yhdessä laksatiivin kanssa tulee harkita. Yliannostuksen jälkeinen tajunnanmenetys, kouristukset tai pään ja kaulan dystoniset reaktiot voivat aiheuttaa aspiraatioriskin, johon liittyy oksentelua.
Sydämen ja verisuonten seuranta on aloitettava välittömästi, ja siihen tulee sisältyä jatkuva elektrokardiografinen seuranta mahdollisten rytmihäiriöiden havaitsemiseksi. Jos rytmihäiriölääkitystä annetaan, disopyramidilla, prokaiiniamidilla ja kinidiinillä on teoreettinen riski additiivisista QT-aikaa pidentävistä vaikutuksista, jotka voivat olla additiivisia tsiprasidonin vaikutuksiin verrattuna.
Hypotensio ja verenkiertohäiriö tulee hoitaa asianmukaisilla toimenpiteillä, kuten suonensisäisellä nesteellä. Jos sympatomimeettisiä aineita käytetään verisuonten tukemiseen, epinefriiniä ja dopamiinia ei tule käyttää, koska beetastimulaatio yhdistettynä tsiprasidoniin liittyvään α1-antagonismiin voi pahentaa hypotensiota. Samoin on perusteltua olettaa, että bretyliumin alfa-adrenergisiä salpausominaisuuksia voidaan lisätä tsiprasidonin ominaisuuksiin nähden, mikä johtaa ongelmalliseen hypotensioon.
Vakavissa ekstrapyramidaalisissa oireissa tulee antaa antikolinergisiä lääkkeitä. Tsiprasidonille ei ole spesifistä vastalääkettä, eikä se ole dialysoitavissa. On harkittava useiden lääkkeiden vaikutusta. Tarkkaa lääketieteellistä valvontaa ja seurantaa tulee jatkaa, kunnes potilas toipuu.
VASTA-AIHEET
QT-ajan pidentyminen
Tsiprasidonin annoksesta riippuvan QT-ajan pidentymisen ja kuolemaan johtavien rytmihäiriöiden ja joidenkin muiden lääkkeiden aiheuttaman QT-ajan pidentymisen tunnetun yhteyden vuoksi tsiprasidoni on vasta-aiheinen:
- potilailla, joilla on aiemmin ollut QT-ajan pidentyminen (mukaan lukien synnynnäinen pitkän QT-ajan oireyhtymä)
- potilailla, joilla on äskettäin ollut akuutti sydäninfarkti
- potilailla, joilla on kompensoimaton sydämen vajaatoiminta
Tsiprasidonin ja muiden QT-aikaa pidentävien lääkkeiden välillä ei ole tehty farmakokineettisiä/farmakodynaamisia tutkimuksia. Tsiprasidonin ja muiden QT-aikaa pidentävien lääkkeiden additiivista vaikutusta ei voida sulkea pois. Siksi tsiprasidonia ei tule antaa seuraavien kanssa:
- dofetilidi, sotaloli, kinidiini, muut luokkien Ia ja III rytmihäiriölääkkeet, mesoridatsiini, tioridatsiini, klooripromatsiini, droperidoli, pimotsidi, sparfloksasiini, gatifloksasiini, moksifloksasiini, halofantriini, meflokiini, pentamidiini-prosesiinimetallaasi-, levo-,-,-,-,-
- muut lääkkeet, joiden on osoitettu pidentyneen QT-ajan yhdeksi farmakodynaamisista vaikutuksistaan ja joilla tämä vaikutus on kuvattu täydellisessä lääkemääräystiedoissa vasta-aiheena tai laatikoituna tai lihavoituna varoituksena [ks. VAROITUKSET JA VAROTOIMET ].
Yliherkkyys
Ziprasidoni on vasta-aiheinen henkilöille, joiden tiedetään olevan yliherkkiä tuotteelle.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Tsiprasidonin vaikutusmekanismi lueteltujen käyttöaiheiden hoidossa saattaa johtua dopamiinityypin 2 (D2) ja serotoniinityypin 2 (5HT2) antagonismin yhdistelmästä.
Farmakodynamiikka
Tsiprasidoni sitoutuu suhteellisen suurella affiniteetilla dopamiini D2- ja D3-, serotoniini-5HT2A-, 5HT2C-, 5HT1A-, 5HT1D- ja α1-adrenergisiin reseptoreihin (Ki 4,8, 7,2, 0,4, 1,3, 3,1, 0,0 ja ja jolla on kohtalainen affiniteetti histamiini H1-reseptoriin (Ki = 47 nM). Tsiprasidoni on D2-, 5HT2A- ja 5HT1D-reseptorien antagonisti ja 5HT1A-reseptorin agonisti. Ziprasidoni esti serotoniinin ja norepinefriinin synaptista takaisinottoa. Mitään merkittävää affiniteettia ei havaittu muihin testattuihin reseptoriin/sitoutumiskohtiin, mukaan lukien kolinergiseen muskariinireseptoriin (IC50 > 1 µM).
Farmakokinetiikka
Suun kautta otettava farmakokinetiikka
Ziprasidonin vaikutus johtuu ensisijaisesti emolääkkeestä. Tsiprasidonin usean annoksen farmakokinetiikka on suhteessa annokseen ehdotetulla kliinisellä annosalueella, ja tsiprasidonin kumuloituminen on ennustettavissa toistuvalla annostuksella. Tsiprasidoni eliminoituu pääasiassa maksassa tapahtuvan metabolian kautta, ja sen keskimääräinen terminaalinen puoliintumisaika on noin 7 tuntia ehdotetulla kliinisellä annosalueella. Vakaan tilan pitoisuudet saavutetaan yhdestä kolmeen vuorokauden kuluessa annostelusta. Keskimääräinen näennäinen systeeminen puhdistuma on 7,5 ml/min/kg. Tsiprasidoni ei todennäköisesti häiritse sytokromi P450 -entsyymien metaboloimien lääkkeiden metaboliaa.
Imeytyminen
Tsiprasidoni imeytyy hyvin oraalisen annon jälkeen ja saavuttaa huippupitoisuudet plasmassa 6-8 tunnissa. 20 mg:n annoksen absoluuttinen biologinen hyötyosuus ruokailun yhteydessä on noin 60 %. Tsiprasidonin imeytyminen lisääntyy jopa kaksinkertaiseksi ruoan kanssa.
Jakelu
Ziprasidonin näennäinen jakautumistilavuus on keskimäärin 1,5 l/kg. Se sitoutuu yli 99-prosenttisesti plasman proteiineihin ja sitoutuu ensisijaisesti albumiiniin ja happamaan α1-glykoproteiiniin. Varfariini tai propranololi, kaksi voimakkaasti proteiineihin sitoutuvaa lääkettä, eivät muuttaneet tsiprasidonin sitoutumista plasman proteiineihin in vitro, eikä tsiprasidoni muuttanut näiden lääkkeiden sitoutumista ihmisen plasmaan. Siten siprasidonin syrjäytymisestä johtuvien lääkeinteraktioiden mahdollisuus on minimaalinen.
Aineenvaihdunta ja eliminaatio
Tsiprasidoni metaboloituu laajalti suun kautta annetun annon jälkeen, ja vain pieni määrä erittyy virtsaan (
Lihaksensisäinen farmakokinetiikka
Systeeminen biologinen hyötyosuus
Lihakseen annettuna tsiprasidonin hyötyosuus on 100 %. Lihakseen annetun kerta-annoksen jälkeen huippupitoisuudet seerumissa saavutetaan tyypillisesti noin 60 minuuttia annoksen jälkeen tai aikaisemmin ja keskimääräinen puoliintumisaika (T½) on kahdesta viiteen tuntiin. Altistuminen lisääntyy annoksesta riippuvalla tavalla, ja kolmen päivän lihaksensisäisen annostelun jälkeen havaitaan vain vähän kertymistä.
Aineenvaihdunta ja eliminaatio
Vaikka intramuskulaarisen tsiprasidonin metaboliaa ja eliminaatiota ei ole arvioitu systemaattisesti, lihaksensisäisen antoreitin ei odoteta muuttavan metaboliareittejä.
Kliiniset tutkimukset
Skitsofrenia
Suun kautta otettavan tsiprasidonin tehoa skitsofrenian hoidossa arvioitiin viidessä lumekontrolloidussa tutkimuksessa, neljässä lyhytaikaisessa (4 ja 6 viikon) tutkimuksessa ja yhdessä ylläpitotutkimuksessa. Kaikki kokeet tehtiin aikuispotilailla, joista suurin osa täytti skitsofrenian DSM III-R -kriteerit. Kukin tutkimus sisälsi 2–3 kiinteää annosta tsiprasidonia sekä lumelääkettä. Neljä viidestä tutkimuksesta pystyi erottamaan tsiprasidonin lumelääkkeestä; yksi lyhytaikainen tutkimus ei. Vaikka yksi kiinteän annoksen haloperidolihaara sisällytettiin vertailuhoitona yhteen kolmesta lyhytaikaisesta tutkimuksesta, tämä yksittäinen tutkimus ei riittänyt tarjoamaan luotettavaa ja pätevää tsiprasidonin ja haloperidolin vertailua.
Näissä tutkimuksissa käytettiin useita instrumentteja psykiatristen merkkien ja oireiden arvioimiseen. Lyhyt Psychiatric Rating Scale (BPRS) ja Positive and Negative Syndrome Scale (PANSS) ovat molemmat yleisen psykopatologian moniosaisia luetteloita, joita käytetään yleensä arvioimaan skitsofrenian huumehoidon vaikutuksia. BPRS-psykoosiklusteria (käsitteellinen epäjärjestys, hallusinatorinen käyttäytyminen, epäluuloisuus ja epätavallinen ajatussisältö) pidetään erityisen hyödyllisenä osaryhmänä arvioitaessa aktiivisesti psykoottisia skitsofreniapotilaita. Toinen laajalti käytetty arviointi, Clinical Global Impression (CGI), heijastaa ammattitaitoisen tarkkailijan, joka on täysin perehtynyt skitsofrenian ilmenemismuotoihin, vaikutelman potilaan yleisestä kliinisestä tilasta. Lisäksi negatiivisten oireiden arvioinnissa käytettiin Scale for Assessing Negative Symptoms (SANS) -asteikkoa yhdessä tutkimuksessa.
Skitsofrenian oraalisen tsiprasidonikokeiden tulokset seuraavat
- Neljän viikon lumekontrolloidussa tutkimuksessa (n = 139), jossa verrattiin kahta kiinteää tsiprasidonin annosta (20 ja 60 mg kahdesti vuorokaudessa) lumelääkkeeseen, vain 60 mg:n annos oli parempi kuin lumelääke BPRS:n kokonaispisteytyksen ja CGI:n vaikeusasteen perusteella. pisteet. Tämä suuremman annoksen ryhmä ei ollut parempi kuin lumelääke BPRS-psykoosiklusterissa tai SANS-ryhmässä.
- Kuuden viikon lumekontrolloidussa tutkimuksessa (n = 302), jossa verrattiin kahta kiinteää annosta tsiprasidonia (40 ja 80 mg kahdesti vuorokaudessa) lumelääkkeeseen, molemmat annosryhmät olivat parempia kuin lumelääke BPRS-kokonaispisteissä eli BPRS-psykoosiklusterissa. CGI-vakavuuspisteet ja PANSS-kokonais- ja negatiiviset alaskaalan pisteet. Vaikka 80 mg:lla kahdesti vuorokaudessa oli numeerisesti suurempi vaikutus kuin 40 mg:lla kahdesti vuorokaudessa, ero ei ollut tilastollisesti merkitsevä.
- Kuuden viikon lumekontrolloidussa tutkimuksessa (n = 419), jossa verrattiin kolmea kiinteää annosta tsiprasidonia (20, 60 ja 100 mg kahdesti vuorokaudessa) lumelääkkeeseen, kaikki kolme annosryhmää olivat parempia kuin lumelääke PANSS-kokonaispisteissä. BPRS-kokonaispisteet, BPRS-psykoosiklusteri ja CGI-vakavuuspisteet. Vain 100 mg:n kahdesti vuorokaudessa annosryhmä oli parempi kuin lumelääke PANSS-negatiivisen ala-asteikon pistemäärässä. Ei ollut selvää näyttöä annos-vaste-suhteesta 20 mg kahdesti vuorokaudessa - 100 mg kahdesti vuorokaudessa.
- Neljän viikon lumekontrolloidussa tutkimuksessa (n = 200), jossa verrattiin kolmea kiinteää tsiprasidoniannosta (5, 20 ja 40 mg kahdesti vuorokaudessa), mikään annosryhmistä ei ollut tilastollisesti parempi kuin lumelääke minkään kiinnostavan tuloksen suhteen.
- Tutkimus suoritettiin stabiililla kroonisella tai subkroonisella (CGI-S ≤5 lähtötilanteessa) skitsofreniapotilailla (n = 294), jotka olivat olleet sairaalahoidossa vähintään kaksi kuukautta. Kolmen päivän kertasokkoutetun lumelääkeajon jälkeen koehenkilöt satunnaistettiin saamaan yhtä kolmesta kiinteästä tsiprasidoniannoksesta (20 mg, 40 mg tai 80 mg kahdesti vuorokaudessa) tai lumelääkettä ja tarkkailtiin uusiutumista. Potilailla havaittiin "uhkaava psykoottinen relapsi", joka määriteltiin CGI-parantumispisteinä ≤ 6 (paljon huonompi tai erittäin paljon huonompi) ja/tai pisteinä ≤ 6 (kohtalaisen vaikea) PANSS:n vihamielisyydestä tai yhteistyökyvyttömyydestä kahtena peräkkäisenä päivänä. . Ziprasidoni oli merkitsevästi parempi kuin lumelääke ajassa uusiutumiseen, eikä eri annosryhmien välillä ollut merkittävää eroa. Tietoa ei ollut riittävästi tutkiakseen väestön alajoukkoja iän ja rodun perusteella. Sukupuoleen perustuvien populaation alaryhmien tarkastelu ei paljastanut erilaista reagointikykyä.
Kaksisuuntainen mielialahäiriö I (akuutit seka- tai maaniset jaksot ja ylläpitohoito litiumin tai valproaatin lisänä)
Kaksisuuntaiseen mielialahäiriöön I liittyvät akuutit maaniset ja sekajaksot
Tsiprasidonin teho vahvistettiin kahdessa lumekontrolloidussa, kaksoissokkoutetussa, 3 viikon monoterapiatutkimuksessa potilailla, jotka täyttivät I-tyypin kaksisuuntaisen mielialahäiriön DSM-IV-kriteerit, maaniset tai sekajaksot, joihin liittyy tai ei ole psykoottisia piirteitä. Ensisijaiset luokitusinstrumentit, joita käytettiin maanisten oireiden arvioinnissa näissä kokeissa, olivat: (1) Mania Rating Scale (MRS), joka on johdettu Affective Disorders and Skitsofrenia-Change Version (SADS-CB) -luettelosta, jonka kohteet on ryhmitelty maaniseksi oireyhtymäksi. aliasteikko (kohonnut mieliala, vähemmän unentarve, liiallinen energia, liiallinen aktiivisuus, suurenmoisuus), käyttäytymisen ja ideoinnin alaasteikko (ärtyneisyys, motorinen yliaktiivisuus, kiihtynyt puhe, ajatukset, huono arvostelukyky) ja heikentynyt näkemys; ja (2) Clinical Global Impression-Severity of Illness Scale (CGI-S), jota käytettiin arvioimaan hoitovasteen kliinistä merkitystä.
Suun kautta annettujen tsiprasidonitutkimusten tulokset aikuisten kaksisuuntaisessa I-häiriössä, maanisessa/sekavaiheessa, ovat seuraavat: 3 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa (n=210) tsiprasidonin annos oli 40 mg kahdesti vuorokaudessa ensimmäisenä päivänä ja 80 mg kahdesti päivittäin päivänä 2. Titraus välillä 40-80 mg kahdesti vuorokaudessa (20 mg kahdesti vuorokaudessa) sallittiin tutkimuksen ajan. Ziprasidoni oli merkittävästi tehokkaampi kuin lumelääke MRS-kokonaispisteiden ja CGI-S-pisteiden pienentämisessä. Keskimääräinen tsiprasidonin vuorokausiannos tässä tutkimuksessa oli 132 mg. Toisessa 3 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa (n = 205) tsiprasidonin annos oli 40 mg kahdesti vuorokaudessa ensimmäisenä päivänä. Annoksen titraus 40-80 mg kahdesti vuorokaudessa (20 mg kahdesti vuorokaudessa) sallittiin opiskelun ajaksi (alkaen päivästä 2). Ziprasidoni oli merkittävästi tehokkaampi kuin lumelääke MRS-kokonaispisteiden ja CGI-S-pisteiden pienentämisessä. Tsiprasidonin keskimääräinen vuorokausiannos tässä tutkimuksessa oli 112 mg.
Ylläpitoterapia
Tsiprasidonin teho litiumin tai valproaatin lisähoitona I-tyypin kaksisuuntaisen mielialahäiriön ylläpitohoidossa vahvistettiin lumekontrolloidussa tutkimuksessa potilailla, jotka täyttivät I-tyypin kaksisuuntaisen mielialahäiriön DSM-IV-kriteerit. Tutkimukseen osallistui potilaita, joiden viimeisin episodi oli maaninen tai sekamuotoinen, joko psykoottisilla piirteillä tai ilman. Avoimessa vaiheessa potilaiden piti olla stabiloitunut tsiprasidonilla ja litiumilla tai valproiinihapolla vähintään 8 viikon ajan, jotta ne satunnaistettiin. Satunnaistetussa kaksoissokkovaiheessa potilaat jatkoivat hoitoa litium- tai valproiinihapolla ja satunnaistettiin saamaan joko tsiprasidonia (annettiin kahdesti vuorokaudessa yhteensä 80–160 mg päivässä) tai lumelääkettä. Yleensä ylläpitovaiheessa potilaat jatkoivat samalla annoksella, jolla heidät stabiloitiin stabilointivaiheen aikana. Tämän tutkimuksen ensisijainen päätetapahtuma oli aika interventiota vaativan mielialajakson (maaninen, sekalainen tai masentunut jakso) uusiutumiseen, mikä määriteltiin joksikin seuraavista: hoidon keskeyttäminen mielialajakson vuoksi, kliininen interventio mielialajakson vuoksi (esim. lääkityksen aloittaminen tai sairaalahoito) tai Mania Rating Scale -pistemäärä ≥ 18 tai MADRS-pistemäärä ≥ 18 (kahdessa peräkkäisessä arvioinnissa enintään 10 päivän välein). Yhteensä 584 henkilöä hoidettiin avoimen stabilointijakson aikana. Kaksoissokkoutetun satunnaistamisen aikana 127 henkilöä hoidettiin tsiprasidonilla ja 112 potilasta lumelääkettä. Ziprasidoni oli lumelääkettä parempi mielialajakson uusiutumiseen kuluvan ajan pidentämisessä. Havaittuihin uusiutumistapahtumiin kuuluivat masennus-, maaniset ja sekajaksot. Masennus-, maanis- ja sekajaksot muodostivat 53 %, 34 % ja 13 % tutkimuksen uusiutumistapahtumien kokonaismäärästä.
Agitaation akuutti hoito skitsofreniassa
Lihaksensisäisen tsiprasidonin teho kiihtyneiden skitsofreenisten potilaiden hoidossa varmistettiin kahdessa lyhytaikaisessa kaksoissokkotutkimuksessa skitsofreenisilla potilailla, jotka tutkijat pitivät "akuutisti kiihtyneinä" ja jotka tarvitsivat IM antipsykoottista lääkitystä. Lisäksi potilailta vaadittiin pistemäärä 3 tai enemmän vähintään kolmesta seuraavista PANSS-kohdasta: ahdistus, jännitys, vihamielisyys ja jännitys. Teho arvioitiin analysoimalla käyrän alla oleva pinta-ala (AUC) Behavioral Activity Rating Scale (BARS) ja Clinical Global Impression (CGI) vakavuusluokituksessa. BARS on seitsemän pisteen asteikko, jonka pisteet vaihtelevat 1:stä (vaikea tai ei pysty herättämään) 7:ään (väkivaltainen, vaatii hillintää). Potilaat' BARS-pisteet lähtötilanteessa olivat enimmäkseen 5 (merkkejä ilmeisestä aktiivisuudesta [fyysinen tai sanallinen], rauhoittuu ohjeiden avulla) ja tutkijoiden määrittämänä osoitti kiihtyneisyyttä, joka vaati lihaksensisäistä hoitoa. Harvoilla potilailla oli BARS-arvosana korkeampi kuin 5, koska vakavimmin kiihtyneet potilaat eivät yleensä pystyneet antamaan tietoista suostumusta osallistuakseen kliinisiin markkinointia edeltäviin tutkimuksiin.
Molemmissa tutkimuksissa verrattiin suurempia lihaksensisäisiä tsiprasidoniannoksia 2 mg:n kontrolliannokseen. Yhdessä tutkimuksessa suurempi annos oli 20 mg, joka voitiin antaa jopa 4 kertaa tutkimuksen 24 tunnin aikana vähintään 4 tunnin annosten välissä. Toisessa tutkimuksessa suurempi annos oli 10 mg, joka voitiin antaa jopa 4 kertaa tutkimuksen 24 tunnin aikana vähintään 2 tunnin annosten välissä.
Lihaksensisäisten tsiprasidonitutkimusten tulokset seuraavat
POTILASTIEDOT
GEODON® Kapselit (ziprasidoni)
Tietoa GEODONia käyttäville potilaille tai heidän hoitajilleen
Tämä yhteenveto sisältää tärkeitä tietoja GEODONista. Sen ei ole tarkoitus korvata lääkärisi ohjeita. Lue nämä tiedot huolellisesti ennen kuin otat GEODONia. Kysy lääkäriltäsi tai apteekista, jos et ymmärrä mitään näistä tiedoista tai jos haluat tietää lisää GEODONista.
Mikä on GEODON 80mg?
GEODON on eräänlainen reseptilääke, jota kutsutaan psykotrooppiseksi lääkkeeksi, joka tunnetaan myös epätyypillisenä psykoosilääkkeenä. GEODONia voidaan käyttää skitsofrenian ja kaksisuuntaiseen mielialahäiriöön liittyvien akuuttien maanisten tai sekajaksojen hoitoon. GEODON 80mg voidaan käyttää myös kaksisuuntaisen mielialahäiriön ylläpitohoitona litiumiin tai valproaattiin lisättynä.
Kenen pitäisi ottaa GEODON 20 mg?
Vain lääkärisi voi tietää, sopiiko GEODON sinulle. GEODON 20 mg voidaan määrätä sinulle, jos sinulla on skitsofrenia tai kaksisuuntainen mielialahäiriö.
Skitsofrenian oireita voivat olla:
- äänien kuuleminen, asioiden näkeminen tai asioiden aistiminen, joita ei ole olemassa (hallusinaatiot)
- uskomukset, jotka eivät ole totta (harhaluulot)
- epätavallinen epäluulo (vainoharhaisuus)
- vetäytyä perheestä ja ystävistä
Kaksisuuntaisen mielialahäiriön maanisten tai sekamuotoisten jaksojen oireita voivat olla:
- erittäin korkea tai ärtyisä mieliala
- lisääntynyt energia, aktiivisuus ja levottomuus
- ajatuksia tai puhua hyvin nopeasti
- helposti häiriintyvä
- vähän unen tarvetta
Jos saat vasteen GEODON 40mg:lle, oireesi voivat helpottaa. Jos jatkat GEODON 40 mg:n käyttöä, oireesi uusiutuminen on pienempi. Älä lopeta kapseleiden ottamista, vaikka tuntisit olosi paremmaksi keskustelematta asiasta ensin lääkärisi kanssa.
On myös tärkeää muistaa, että GEODON 40 mg kapselit tulee ottaa ruoan kanssa.
Mikä on tärkein turvallisuustieto, joka minun pitäisi tietää GEODON 20mg:sta?
GEODONia ei ole hyväksytty dementiaan liittyvän psykoosin potilaiden hoitoon. Iäkkäillä potilailla, joilla on diagnosoitu dementiaan liittyvä psykoosi ja joita hoidetaan psykoosilääkkeillä, on suurempi kuolemanriski verrattuna potilaisiin, jotka saavat lumelääkettä (sokeripilleri).
GEODON on tehokas lääke skitsofrenian oireiden ja kaksisuuntaisen mielialahäiriön maanisten tai sekajaksojen hoitoon. Yksi mahdollinen sivuvaikutus on kuitenkin, että se voi muuttaa tapaa, jolla sydämesi sähkövirta toimii enemmän kuin jotkut muut lääkkeet. Muutos on pieni, eikä tiedetä, onko siitä haittaa, mutta jotkut muut tällaista muutosta aiheuttavat lääkkeet ovat harvoin aiheuttaneet vaarallisia sydämen rytmihäiriöitä. Tästä syystä GEODONia tulee käyttää vasta sen jälkeen, kun lääkäri on arvioinut tämän GEODONin riskin suhteessa muiden skitsofrenian tai kaksisuuntaisen mielialahäiriön maanisten ja sekamuotoisten jaksojen hoitoon käytettävien lääkkeiden riskeihin ja hyötyihin.
Vaarallisten sydämen rytmimuutosten riski voi kasvaa, jos käytät tiettyjä muita lääkkeitä ja jos sinulla on jo tiettyjä epänormaaleja sydänsairauksia. Siksi on tärkeää kertoa lääkärillesi kaikista muista käyttämistäsi lääkkeistä, mukaan lukien reseptivapaat lääkkeet, lisäravinteet ja kasviperäiset lääkkeet. Sinun on myös kerrottava lääkärillesi kaikista sydänongelmistasi, joita sinulla on tai on ollut.
Kuka EI saa ottaa GEODON 40 mg:aa?
Iäkkäät potilaat, joilla on diagnosoitu dementiaan liittyvä psykoosi. GEODONia ei ole hyväksytty näiden potilaiden hoitoon.
Kaikkea, mikä voi lisätä sydämen rytmihäiriön mahdollisuutta, tulee välttää. Älä siksi ota GEODON 80 mg:aa, jos:
- Sinulla on tiettyjä sydänsairauksia, kuten pitkä QT-oireyhtymä, äskettäinen sydänkohtaus, vaikea sydämen vajaatoiminta tai tietyt sydämen rytmihäiriöt (keskustele yksityiskohdista lääkärisi kanssa)
- Käytät tällä hetkellä lääkkeitä, joita ei pidä ottaa yhdessä tsiprasidonin kanssa, esimerkiksi dofetilidi, sotaloli, kinidiini, muut luokan Ia ja III rytmihäiriölääkkeet, mesoridatsiini, tioridatsiini, klooripromatsiini, droperidoli, pimotsidi, sparfloksasiini, gatifloksasiini, moksifloksasiini, , meflokiini, pentamidiini, arseenitrioksidi, levometadyyliasetaatti, dolasetronimesylaatti, probukoli tai takrolimuusi.
Mitä sinun tulee kertoa lääkärillesi ennen kuin aloitat GEODONin
Vain lääkärisi voi päättää, sopiiko GEODON sinulle. Ennen kuin aloitat GEODON-hoidon, muista kertoa lääkärillesi, jos:
- sinulla on ollut ongelmia sydämesi sykkeessä tai mikä tahansa sydämeen liittyvä sairaus tai sairaus
- suvussa sydänsairaus, mukaan lukien äskettäinen sydänkohtaus
- sinulla on ollut ongelmia pyörtymisen tai huimauksen kanssa
- käytät tai olet äskettäin käyttänyt reseptilääkkeitä
- käytät reseptivapaita lääkkeitä, joita voit ostaa ilman reseptiä, mukaan lukien luonnolliset/yrttilääkkeet
- sinulla on ollut maksaongelmia
- olet raskaana, saattaa olla raskaana tai suunnittelee raskautta
- imetät tai aiot imettää
- ovat allergisia jollekin lääkkeelle
- sinulla on koskaan ollut allerginen reaktio tsiprasidonista tai jollekin muulle GEODON 20 mg kapseleiden aineosalle. Pyydä lääkäriltäsi tai apteekista luettelo näistä ainesosista
- sinulla on veresi alhainen kalium- tai magnesiumpitoisuus
Lääkärisi saattaa haluta sinulle lisälaboratoriotutkimuksia nähdäksesi, onko GEODON 40mg sopiva hoito sinulle.
GEODON ja muut lääkkeet
Jotkut lääkkeet voivat olla vaarallisia käyttää GEODONin käytön aikana, ja jotkut lääkkeet voivat vaikuttaa GEODON 40mg:n tehoon. Kun käytät GEODONia, tarkista lääkäriltäsi ennen kuin aloitat uusien resepti- tai käsikauppalääkkeiden, mukaan lukien luonnolliset/yrttilääkkeet.
Kuinka ottaa GEODON
- Ota GEODON-valmistetta vain lääkärisi ohjeiden mukaan.
- Niele GEODON-kapselit kokonaisina. Älä pureskele, murskaa tai avaa kapseleita.
- Ota GEODON 40 mg kapselit ruoan kanssa.
- On parasta ottaa GEODON 80 mg samaan aikaan joka päivä.
- GEODON 80 mg:n vaikutus voi kestää muutaman viikon. On tärkeää olla kärsivällinen.
- Älä muuta annostasi tai lopeta lääkkeen ottamista ilman lääkärisi lupaa.
- Muista jatkaa kapseleiden ottamista, vaikka tuntisit olosi paremmaksi.
Mahdolliset sivuvaikutukset
Koska nämä ongelmat voivat tarkoittaa, että sinulla on sydämen rytmihäiriö, ota yhteyttä lääkäriisi HETI jos sinä:
- Pyörryt tai menettää tajuntansa
- Tunne muutoksen sydämesi sykkeessä (tykytystykytys)
GEODONin yleisiä sivuvaikutuksia ovat seuraavat, ja niistä tulee myös keskustella lääkärisi kanssa, jos niitä esiintyy:
- Epätavallisen väsynyt tai unelias olo
- Pahoinvointi tai vatsavaivat
- Ummetus
- Huimaus
- Levottomuus
- Epänormaalit lihasliikkeet, mukaan lukien vapina, sekoitus ja hallitsemattomat tahattomat liikkeet
- Ripuli
- Ihottuma
- Lisääntynyt yskä / vuotava nenä
Jos sinulle ilmaantuu haittavaikutuksia, jotka koskevat sinua, keskustele lääkärisi kanssa. On erityisen tärkeää kertoa lääkärillesi, jos sinulla on ripulia, oksentelua tai muuta sairautta, joka voi aiheuttaa nesteen menetystä. Lääkärisi saattaa haluta tarkistaa verisi varmistaakseen, että sinulla on oikea määrä tärkeitä suoloja tällaisten sairauksien jälkeen.
Pyydä lääkäriltäsi tai apteekista GEODON Professional -pakkausseloste luettelo kaikista ilmoitetuista sivuvaikutuksista.
Mitä tehdä yliannostukseen
Yliannostustapauksessa soita heti lääkärillesi tai myrkytystietokeskukseen tai mene lähimpään ensiapuun.
Muita tärkeitä turvallisuustietoja
Vakava sairaus, jota kutsutaan maligniksi neuroleptisyndroomaksi (NMS), voi ilmetä kaikkien psykoosilääkkeiden, mukaan lukien GEODONin, käytön yhteydessä. MNS-oireita ovat erittäin korkea kuume, jäykät lihakset, vapina, sekavuus, hikoilu tai kohonnut syke ja verenpaine. NMS on harvinainen mutta vakava sivuvaikutus, joka voi olla kohtalokas. Kerro siksi lääkärillesi, jos saat jonkin näistä oireista.
Tsiprasidonin käytön yhteydessä voi esiintyä viivästynyttä lääkereaktiota, jota kutsutaan lääkereaktioksi, johon liittyy eosinofiliaa ja systeemisiä oireita (DRESS). DRESSin merkkejä voivat olla ihottuma, kuume ja imusolmukkeiden turvotus. Muita vakavia ihohaittavaikutuksia (SCAR), kuten Stevens-Johnsonin oireyhtymä, voi esiintyä tsiprasidonin käytön yhteydessä. Stevens-Johnsonin oireyhtymän merkkejä voivat olla ihottuma ja rakkuloita, jotka voivat sisältää haavaumia suussa, ihon irtoamista, kuumetta ja kohdemaisia täpliä iholla. MEKO ja muut SCAR ovat joskus kohtalokkaita; siksi kerro lääkärillesi välittömästi, jos saat jonkin näistä oireista.
Korkeaan verensokeriin (hyperglykemiaan) liittyviä haittavaikutuksia, jotka ovat joskus vakavia, on raportoitu potilailla, joita on hoidettu epätyypillisillä psykoosilääkkeillä. GEODON-hoitoa saaneilla potilailla on raportoitu vain vähän hyperglykemiaa tai diabetesta, eikä tiedetä, liittyykö GEODON näihin reaktioihin. Potilaita, joita hoidetaan epätyypillisellä antipsykootilla, tulee seurata hyperglykemian oireiden varalta.
Verenpaineen laskusta johtuva huimaus voi ilmaantua GEODONin käytön yhteydessä, varsinkin kun aloitat tämän lääkkeen käytön tai annosta suurennetaan. Jos näin tapahtuu, varo nousemasta ylös liian nopeasti ja keskustele lääkärisi kanssa ongelmasta.
Kerro lääkärillesi ennen GEODONin ottamista, jos
- olet raskaana tai suunnittelet raskautta.
- Jos tulet raskaaksi GEODON 80mg -hoidon aikana, keskustele terveydenhuollon tarjoajasi kanssa rekisteröitymisestä National Pregnancy Registry for Atyyppisten antipsykoottien rekisteriin. Voit rekisteröityä soittamalla numeroon 1-866-961-2388 tai menemällä osoitteeseen http://womensmentalhealth.org/clinical-and-research-programs/pregnancyregistry/
- imetät tai aiot imettää. GEODON 40 mg voi erittyä äidinmaitoon. Keskustele terveydenhuollon tarjoajan kanssa parhaasta tavasta ruokkia vauvasi, jos saat GEODONia.
Koska GEODON 80mg voi aiheuttaa uneliaisuutta, ole varovainen käyttäessäsi koneita tai ajaessasi moottoriajoneuvoa.
Koska GEODONin kanssa samaan lääkeluokkaan kuuluvat lääkkeet voivat häiritä kehon kykyä sopeutua lämpöön, on parasta välttää tilanteita, joihin liittyy korkea lämpötila tai kosteus.
On parasta välttää alkoholijuomien nauttimista GEODON-hoidon aikana.
Soita lääkärillesi heti jos otat enemmän GEODONia kuin lääkärisi on määrännyt.
GEODONin ei ole osoitettu olevan turvallinen tai tehokas alle 18-vuotiaiden lasten ja teini-ikäisten hoidossa.
Pidä GEODON 80mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Kuinka säilyttää GEODON
Säilytä GEODON 20 mg kapseleita huoneenlämmössä (59 °F - 86 °F tai 15 °C - 30 °C).
Lisätietoja GEODONista
Tämä lehti on vain yhteenveto. GEODON 20mg on reseptilääke, ja vain lääkärisi voi päättää, sopiiko se sinulle. Jos sinulla on kysyttävää tai haluat lisätietoja GEODONista, keskustele lääkärisi tai apteekkihenkilökunnan kanssa. Voit myös käydä osoitteessa www.geodon.com.
Tämän tuotteen merkinnät on saatettu päivittää. Uusimmat reseptitiedot ovat osoitteessa www.pfizer.com
