Remeron 15mg, 30mg Mirtazapine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Remeron ovat ja miten sitä käytetään?
Remeron on reseptilääke, jota käytetään masennuksen oireiden hoitoon. Remeron 30 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Remeron kuuluu lääkeryhmään, jota kutsutaan masennuslääkkeiksi, alfa-2-antagonisteiksi; Masennuslääkkeet, muut.
Ei tiedetä, onko Remeron 30 mg turvallinen ja tehokas lapsille.
Mitkä ovat Remeron 30mg:n mahdolliset sivuvaikutukset?
Remeron voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- levoton olo,
- kilpa ajatuksia,
- vähentynyt unen tarve,
- epätavallinen riskinotto,
- äärimmäisen onnen tai surun tunteita,
- olla puhuvampi kuin tavallisesti,
- näön hämärtyminen,
- putkinäkö,
- silmäkipu tai turvotus,
- nähdä haloja valojen ympärillä,
- huimaus,
- kuume,
- vilunväristykset,
- kipeä kurkku,
- suun haavaumat,
- painon tai ruokahalun muutokset,
- vaikea ihottuma, rakkuloita tai turvotus kämmenissäsi tai jalkapohjissa,
- kouristukset (kohtaus),
- päänsärky,
- hämmennystä,
- sammaltava puhe,
- vakava heikkous,
- oksentelua,
- koordinaation menetys ja
- epävakaa olo
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Remeronin yleisimpiä sivuvaikutuksia ovat:
- uneliaisuus,
- huimaus,
- outoja unia,
- kuiva suu,
- ummetus,
- lisääntynyt ruokahalu ja
- painonnousu
Kerro lääkärillesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei häviä.
Nämä eivät ole kaikkia Remeronin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Itsemurha- ja masennuslääkkeet
Masennuslääkkeet lisäsivät plaseboon verrattuna itsemurha-ajattelun ja -käyttäytymisen (itsetuhoisuuden) riskiä lapsilla, nuorilla ja nuorilla aikuisilla lyhytaikaisissa masennushäiriön (MDD) ja muiden psykiatristen häiriöiden tutkimuksissa. Jokaisen, joka harkitsee REMERON® (mirtatsapiini) -tablettien tai minkä tahansa muun masennuslääkkeen käyttöä lapsella, nuorella tai nuorella aikuisella, on tasapainotettava tämä riski kliinisen tarpeen kanssa. Lyhytaikaiset tutkimukset eivät osoittaneet lisääntynyttä itsemurhariskiä masennuslääkkeillä lumelääkkeeseen verrattuna yli 24-vuotiailla aikuisilla; 65-vuotiailla ja sitä vanhemmilla aikuisilla masennuslääkkeiden riski pieneni lumelääkkeeseen verrattuna. Masennus ja tietyt muut psykiatriset häiriöt liittyvät itsemurhariskin lisääntymiseen. Kaiken ikäisiä potilaita, jotka saavat masennuslääkehoitoa, tulee seurata asianmukaisesti ja tarkkailla kliinisen pahenemisen, itsemurha-ajattelun tai epätavallisten käyttäytymismuutosten varalta. Perheille ja omaishoitajille tulee kertoa, että heitä on tarkkailtava tarkasti ja kommunikoida lääkärin kanssa. REMERONia ei ole hyväksytty käytettäväksi lapsipotilailla. (Katso VAROITUKSET: Kliininen paheneminen ja itsemurhariski, POTILASTIEDOT ja VAROTOIMET: Käyttö lapsille)
KUVAUS
REMERON® (mirtatsapiini) -tabletit ovat suun kautta annettava lääke. Mirtatsapiinilla on tetrasyklinen kemiallinen rakenne ja se kuuluu piperatsinoatsepiiniyhdisteiden ryhmään. Sitä kutsutaan 1,2,3,4,10,14b-heksahydro-2-metyylipyratsino[2,1-a]pyrido[2,3-c]bentsatsepiiniksi ja sen empiirinen kaava on C17H19N3. Sen molekyylipaino on 265,36. Rakennekaava on seuraava ja se on raseeminen seos:
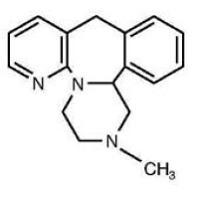
Mirtatsapiini on valkoinen tai kermanvalkoinen kiteinen jauhe, joka liukenee heikosti veteen.
REMERON toimitetaan suun kautta uurrettuina kalvopäällysteisinä tabletteina, jotka sisältävät 15 tai 30 mg mirtatsapiinia, ja jakouurtemattomina kalvopäällysteisinä tabletteina, jotka sisältävät 45 mg mirtatsapiinia. Jokainen tabletti sisältää myös maissitärkkelystä, hydroksipropyyliselluloosaa, magnesiumstearaattia, kolloidista piidioksidia, laktoosia ja muita inaktiivisia aineosia.
INDIKAATIOT
REMERON (mirtatsapiini) -tabletit on tarkoitettu vakavan masennushäiriön hoitoon.
REMERONin teho masennuksen hoidossa varmistettiin 6 viikkoa kestäneissä kontrolloiduissa tutkimuksissa avopotilailla, joiden diagnoosit vastasivat eniten mielisairaushäiriöiden diagnostisen ja tilastollisen käsikirjan 3. painos (DSM-III) vakavan masennuksen luokkaa (ks. KLIININEN FARMAKOLOGIA ).
Vakava masennusjakso (DSM-IV) tarkoittaa näkyvää ja suhteellisen jatkuvaa (melkein joka päivä vähintään 2 viikon ajan) masentunutta tai dysforista mielialaa, joka tavallisesti häiritsee päivittäistä toimintaa ja sisältää vähintään 5 seuraavista 9 oireesta: masentunut mieliala, kiinnostuksen menetys tavanomaista toimintaa kohtaan, merkittävä painon ja/tai ruokahalun muutos, unettomuus tai hypersomnia, psykomotorinen kiihtyneisyys tai hidastuminen, lisääntynyt väsymys, syyllisyyden tai arvottomuuden tunne, hidastunut ajattelu tai keskittymiskyvyn heikkeneminen, itsemurhayritys tai itsemurha-ajatukset.
REMERON 15 mg:n tehoa sairaalahoidossa masentuneilla potilailla ei ole tutkittu riittävästi.
REMERON 15 mg:n tehokkuus vasteen ylläpitämisessä potilailla, joilla on vaikea masennus jopa 40 viikon ajan 8–12 viikon avoimen hoidon jälkeen, osoitettiin lumekontrolloidussa tutkimuksessa. Lääkärin, joka päättää käyttää REMERON 15 mg:aa pitkiä aikoja, tulee kuitenkin säännöllisesti arvioida uudelleen lääkkeen pitkän aikavälin hyödyllisyys yksittäiselle potilaalle (ks. KLIININEN FARMAKOLOGIA ).
ANNOSTELU JA HALLINNOINTI
Alkuhoito
REMERON (mirtatsapiini) -tablettien suositeltu aloitusannos on 15 mg / vrk, annettuna yhtenä annoksena, mieluiten illalla ennen nukkumaanmenoa. Kontrolloiduissa kliinisissä tutkimuksissa, joissa vahvistettiin REMERONin teho masennuksen hoidossa, tehokas annosalue oli yleensä 15-45 mg/vrk. Vaikka annoksen ja tyydyttävän vasteen välistä suhdetta vakavan masennushäiriön hoidossa REMERON 15 mg:lla ei ole tutkittu riittävästi, potilaat, jotka eivät reagoi 15 mg:n alkuannokseen, voivat hyötyä annoksen nostamisesta enintään 45 mg/vrk asti. REMERONin eliminaation puoliintumisaika on noin 20-40 tuntia; siksi annosta ei tulisi muuttaa alle 1–2 viikon välein, jotta jää riittävästi aikaa terapeuttisen vasteen arvioimiseen tietylle annokselle.
Vanhukset ja potilaat, joilla on munuaisten tai maksan vajaatoiminta
Mirtatsapiinin puhdistuma on pienentynyt iäkkäillä potilailla ja potilailla, joilla on kohtalainen tai vaikea munuaisten tai maksan vajaatoiminta. Tästä syystä lääkettä määräävän lääkärin tulee olla tietoinen siitä, että plasman mirtatsapiinipitoisuudet voivat nousta näissä potilasryhmissä verrattuna tasoihin, jotka on havaittu nuoremmilla aikuisilla, joilla ei ole munuaisten tai maksan vajaatoimintaa (ks. VAROTOIMENPITEET ja KLIININEN FARMAKOLOGIA ).
Huolto/pidennetty hoito
Yleisesti ollaan samaa mieltä siitä, että akuutit masennuksen jaksot vaativat useita kuukausia tai pidempään jatkuvaa farmakologista hoitoa akuutin episodin jälkeen. REMERON (mirtatsapiini) -tablettien systemaattinen arviointi on osoittanut, että sen teho vakavassa masennuksessa säilyy 40 viikon ajan 8-12 viikon aloitushoidon jälkeen annoksella 15-45 mg/vrk (ks. KLIININEN FARMAKOLOGIA ). Näiden rajallisten tietojen perusteella ei tiedetä, onko ylläpitohoitoon tarvittava REMERON 30 mg -annos identtinen alkuperäisen vasteen saavuttamiseen tarvittavan annoksen kanssa. Potilaita tulee säännöllisesti arvioida uudelleen ylläpitohoidon tarpeen ja sopivan annoksen määrittämiseksi.
Potilaan vaihtaminen psykiatristen häiriöiden hoitoon tarkoitettuun monoamiinioksidaasin estäjään (MAOI)
Psykiatristen häiriöiden hoitoon tarkoitetun MAO-estäjän käytön lopettamisen ja REMERON (mirtatsapiini) -tablettien käytön aloittamisen välillä tulee kulua vähintään 14 päivää. Sitä vastoin REMERON 30 mg:n käytön lopettamisen jälkeen tulee varata vähintään 14 päivää ennen kuin aloitetaan MAO:n estäjä psykiatristen häiriöiden hoitoon (ks. VASTA-AIHEET ).
REMERON 15 mg:n käyttö muiden MAO-estäjien, kuten linetsolidin tai metyleenisinisen, kanssa
Älä aloita REMERON 15 mg -hoitoa potilaalle, jota hoidetaan linetsolidilla tai suonensisäisellä metyleenisinisellä, koska serotoniinioireyhtymän riski on lisääntynyt. Jos potilas tarvitsee psykiatrisen tilan kiireellistä hoitoa, muita toimenpiteitä, mukaan lukien sairaalahoitoa, tulee harkita (ks. VASTA-AIHEET ).
Joissakin tapauksissa potilas, joka saa jo REMERON 30 mg -hoitoa, saattaa tarvita kiireellistä hoitoa linetsolidilla tai suonensisäisellä metyleenisinisellä. Jos hyväksyttäviä vaihtoehtoja linetsolidi- tai suonensisäiselle metyleenisinihoidolle ei ole saatavilla ja linetsolidi- tai suonensisäisen metyleenisinihoidon mahdollisten hyötyjen katsotaan olevan suurempia kuin serotoniinioireyhtymän riskit tietyllä potilaalla, REMERON 30 mg:n käyttö tulee lopettaa välittömästi ja linetsolidin tai suonensisäisen metyleenin käyttö sinistä voidaan antaa. Potilasta tulee tarkkailla serotoniinioireyhtymän oireiden varalta 2 viikon ajan tai 24 tunnin ajan viimeisen linetsolidin tai suonensisäisen metyleenisinisen annoksen jälkeen sen mukaan, kumpi tulee ensin. REMERON 30 mg -hoitoa voidaan jatkaa 24 tunnin kuluttua viimeisen linetsolidin tai suonensisäisen metyleenisinisen annoksen jälkeen (ks. VAROITUKSET ).
Riski, että metyleenisinistä annetaan ei-intravenoosisesti (kuten suun kautta otettavina tabletteina tai paikallisena injektiona) tai suonensisäisinä annoksina, jotka ovat paljon pienempiä kuin 1 mg/kg REMERONin kanssa, on epäselvä. Kliinikon tulee kuitenkin olla tietoinen serotoniinioireyhtymän oireiden mahdollisuudesta tällaisen käytön yhteydessä (ks. VAROITUKSET ).
REMERON-hoidon lopettaminen
REMERON 15 mg tablettien käytön lopettamiseen tai annoksen pienentämiseen liittyviä oireita on raportoitu. Potilaita tulee tarkkailla näiden ja muiden oireiden varalta hoidon lopettamisen tai annosta pienennettäessä. Annoksen asteittaista pienentämistä useiden viikkojen aikana suositellaan äkillisen lopettamisen sijaan aina kun mahdollista. Jos sietämättömiä oireita ilmaantuu annoksen pienentämisen tai hoidon lopettamisen jälkeen, annoksen titraus tulee hoitaa potilaan kliinisen vasteen perusteella (ks. VAROTOIMENPITEET ja HAITTAVAIKUTUKSET ).
Tietoja potilaille
Potilaille tulee kertoa, että REMERONin ottaminen voi aiheuttaa lievää pupillien laajentumista, joka voi herkillä henkilöillä johtaa sulkeutumiskulmaglaukooman episodiin. Aiempi glaukooma on lähes aina avokulmaglaukooma, koska sulkukulmaglaukooma voidaan diagnosoituna hoitaa lopullisesti iridektomialla. Avokulmaglaukooma ei ole kulmaglaukooman riskitekijä. Potilaat saattavat haluta tulla tutkimuksiin sen määrittämiseksi, ovatko he alttiita kulman sulkemiselle, ja heille voidaan tehdä ennaltaehkäisevä toimenpide (esim. iridektomia), jos he ovat alttiita.
MITEN TOIMITETAAN
REMERON (mirtatsapiini) -tabletit toimitetaan seuraavasti:
15 mg tabletit - soikea, uurrettu, keltainen, päällystetty, toisella puolella "Organon" ja toisella puolella "T3Z".
Pullot 30 NDC 0052-0105-30
30 mg tabletit - soikea, uurrettu, punaruskea, päällystetty, toisella puolella "Organon" ja toisella puolella "T5Z".
Pullot 30 NDC 0052-0107-30
45 mg tabletit - soikea, valkoinen, päällystetty, toisella puolella "Organon" ja toisella puolella "T7Z".
Pullot 30 NDC 0052-0109-30
Varastointi
Säilytä 20°C - 25°C (68°F - 77°F); retket sallitaan 15°C - 30°C (59°F - 86°F) [katso USP-ohjattu huonelämpötila ]. Suojaa valolta ja kosteudelta.
Valmistettu: Merck Sharp & Dohme Corp., Merck & Co., Inc:n tytäryhtiö, Whitehouse Station, NJ 08889, USA. Valmistaja: NV Organon, Oss, Alankomaat, Merck & Co., Inc:n tytäryhtiö, Whitehouse Station, NJ 08889, USA. Tarkistettu: heinäkuuta 2016
SIVUVAIKUTUKSET
Liittyy hoidon keskeyttämiseen
Noin 16 % 453 potilaasta, jotka saivat REMERON (mirtatsapiini) tabletteja Yhdysvalloissa 6 viikon kontrolloiduissa kliinisissä tutkimuksissa, keskeytti hoidon haittavaikutusten vuoksi, verrattuna 7 %:iin 361 lumelääkettä saaneesta potilaasta näissä tutkimuksissa. Yleisimmät hoidon lopettamiseen liittyvät tapahtumat (≥ 1 %), joiden katsotaan liittyvän lääkkeisiin (eli tapahtumat, jotka liittyvät keskeyttämiseen vähintään kaksi kertaa lumelääkkeeseen verrattuna), on sisällytetty taulukkoon 2.
Yleisesti havaitut haittatapahtumat Yhdysvaltain kontrolloiduissa kliinisissä tutkimuksissa
Taulukossa on lueteltu yleisimmin havaitut haittatapahtumat, jotka liittyvät REMERON (mirtatsapiini) -tablettien käyttöön (esiintyvyys 5 % tai enemmän), joita ei ole havaittu vastaavalla ilmaantuvyydellä lumelääkettä saaneiden potilaiden keskuudessa (REMERONin ilmaantuvuus vähintään kaksi kertaa lumelääkettä saaneilla). 3.
Haittatapahtumat, joita esiintyy vähintään 1 %:lla REMERON-hoitoa saaneista potilaista
Taulukossa 4 luetellaan haittatapahtumat, joita esiintyi vähintään 1 %:lla ja jotka olivat yleisempiä kuin lumeryhmässä REMERON (mirtatsapiini) -tableteilla hoidetuilla potilailla, jotka osallistuivat lyhytaikaisiin lumelääkekontrolloituihin tutkimuksiin Yhdysvalloissa. 5-60 mg/vrk. Tämä taulukko näyttää niiden potilaiden prosenttiosuuden kussakin ryhmässä, joilla oli vähintään yksi tapahtuma jossain vaiheessa hoidon aikana. Raportoidut haittatapahtumat luokiteltiin käyttämällä standardia COSTART-pohjaista sanakirjaterminologiaa.
Lääkärin tulee olla tietoinen siitä, että näitä lukuja ei voida käyttää sivuvaikutusten esiintyvyyden ennustamiseen tavanomaisessa lääketieteellisessä käytännössä, kun potilaan ominaisuudet ja muut tekijät poikkeavat kliinisissä tutkimuksissa vallinneista. Samoin mainittuja esiintymistiheyksiä ei voida verrata lukuihin, jotka on saatu muista tutkimuksista, joissa on mukana erilaisia hoitoja, käyttöjä ja tutkijoita. Mainitut luvut antavat kuitenkin lääkkeen määräävälle lääkärille jonkinlaisen perustan arvioida lääkkeiden ja muiden tekijöiden suhteellista osuutta sivuvaikutusten ilmaantuvuusasteessa tutkitussa populaatiossa.
EKG:n muutokset
EKG-kuvat 338 potilaalle, jotka saivat REMERON (mirtatsapiini) -tabletteja, ja 261 potilaalle, jotka saivat lumelääkettä 6 viikon lumekontrolloiduissa tutkimuksissa, analysoitiin. QTc-ajan pidentymistä ≥ 500 ms ei havaittu mirtatsapiinilla hoidetuilla potilailla; QTc-ajan keskimääräinen muutos oli +1,6 ms mirtatsapiinilla ja -3,1 ms plasebolla. Mirtatsapiiniin liittyi sydämen sykkeen keskimääräinen nousu 3,4 lyöntiä minuutissa verrattuna lumelääkkeeseen 0,8 lyöntiin minuutissa. Näiden muutosten kliinistä merkitystä ei tunneta.
REMERONin (mirtatsapiini) vaikutusta QTc-väliin arvioitiin kliinisessä satunnaistetussa tutkimuksessa lumelääkkeellä ja positiivisilla (moksifloksasiini) kontrolleilla, joihin osallistui 54 tervettä vapaaehtoista käyttämällä altistusvasteanalyysiä. Tämä tutkimus osoitti positiivisen suhteen mirtatsapiinipitoisuuksien ja QTc-ajan pidentymisen välillä. Sekä 45 mg (terapeuttinen) että 75 mg (supraterapeuttinen) annoksilla mirtatsapiinia havaittu QT-ajan pitenemisen aste ei kuitenkaan ollut tasolla, jota yleensä pidettiin kliinisesti merkityksellisenä.
Muut REMERONin markkinointia edeltävän arvioinnin aikana havaitut haittatapahtumat
Markkinointia edeltävän arvioinnin aikana kliinisissä tutkimuksissa annettiin useita annoksia REMERON (mirtatsapiini) -tabletteja 2796 potilaalle. Mirtatsapiinille altistumisen olosuhteet ja kesto vaihtelivat suuresti, ja ne sisälsivät (päällekkäisissä luokissa) avoimet ja kaksoissokkotutkimukset, kontrolloimattomat ja kontrolloidut tutkimukset, sairaala- ja avohoitotutkimukset, kiinteäannos- ja titraustutkimukset. Kliiniset tutkijat kirjasivat tähän altistumiseen liittyvät epäsuotuisat tapahtumat käyttämällä omaa valintaansa. Näin ollen ei ole mahdollista antaa mielekästä arviota haittatapahtumia kokeneiden henkilöiden osuudesta ryhmittelemättä ensin samantyyppisiä ei-toivottuja tapahtumia pienempään määrään standardoituja tapahtumaluokkia.
Seuraavissa taulukoissa raportoidut haittatapahtumat luokiteltiin käyttämällä standardia COSTART-pohjaista sanakirjaterminologiaa. Esitetyt esiintymistiheydet edustavat siten osuutta niistä 2796 potilaasta, jotka olivat altistuneet useille REMERON-annoksille ja jotka kokivat mainitun tyyppisen tapahtuman vähintään kerran REMERON-hoidon aikana. Kaikki raportoidut tapahtumat sisältyvät lukuun ottamatta niitä, jotka on jo lueteltu taulukossa 4, COSTART-termeihin sisällytetyt haitalliset kokemukset, jotka ovat joko liian yleisiä tai liian spesifisiä, jotta ne eivät ole informatiivisia, ja tapahtumat, joiden huumeiden syy oli hyvin kaukainen.
On tärkeää korostaa, että vaikka raportoidut tapahtumat tapahtuivat REMERON 30 mg -hoidon aikana, ne eivät välttämättä johtuneet siitä.
Tapahtumat luokitellaan edelleen kehojärjestelmän mukaan ja luetellaan esiintymistiheyden mukaan alenevassa järjestyksessä seuraavien määritelmien mukaisesti: toistuvat haittatapahtumat ovat niitä, joita esiintyy yhden tai useamman kerran vähintään 1/100 potilaalla; harvinaiset haittatapahtumat ovat niitä, joita esiintyy 1/100 - 1/1000 potilaalla; harvinaisia tapahtumia esiintyy harvemmalla kuin 1/1000 potilaalla. Vain ne tapahtumat, joita ei ole vielä mainittu taulukossa 4, näkyvät tässä luettelossa. Kliinisesti merkittäviä tapahtumia kuvataan myös VAROITUKSET- ja VAROTOIMET-osissa.
Keho kokonaisuutena: usein: huonovointisuus, vatsakipu, akuutti vatsan oireyhtymä; harvinainen: vilunväristykset, kuume, kasvojen turvotus, haavauma, valoherkkyysreaktio, niskajäykkyys, niskakipu, vatsan suureneminen; harvinainen: selluliitti, rintakipu rintalastan alla.
Sydän- ja verisuonijärjestelmä: usein: kohonnut verenpaine, vasodilataatio; harvinainen: angina pectoris, sydäninfarkti, bradykardia, kammion ekstrasystolit, pyörtyminen, migreeni, hypotensio; harvinainen: eteinen rytmihäiriö, bigeminia, verisuonipäänsärky, keuhkoembolia, aivoiskemia, kardiomegalia, flebiitti, vasemman sydämen vajaatoiminta.
Ruoansulatuselimistö: usein: oksentelu, anoreksia; harvinainen: eryktaatio, glossiitti, kolekystiitti, pahoinvointi ja oksentelu, ienverenvuoto, suutulehdus, paksusuolentulehdus, maksan toimintakokeiden epänormaalit; harvinainen: kielen värimuutos, haavainen stomatiitti, sylkirauhasten suureneminen, lisääntynyt syljeneritys, suolen tukkeuma, haimatulehdus, aftoottinen suutulehdus, maksakirroosi, gastriitti, gastroenteriitti, suun moniliaasi, kielen turvotus.
Endokriiniset järjestelmä: harvinainen: struuma, kilpirauhasen vajaatoiminta.
Hemic ja lymfaattinen järjestelmä: harvinainen: lymfadenopatia, leukopenia, petekia, anemia, trombosytopenia, lymfosytoosi, pansytopenia.
Aineenvaihdunta- ja ravitsemushäiriöt: usein: jano; harvinainen: kuivuminen, laihtuminen; harvinainen: kihti, kohonnut SGOT, epänormaali paraneminen, kohonnut hapan fosfataasi, kohonnut SGPT, diabetes mellitus, hyponatremia.
Tuki- ja liikuntaelimistö: usein: myasthenia, nivelsärky; harvinainen: niveltulehdus, tenosynoviitti; harvinainen: patologinen murtuma, osteoporoosimurtuma, luukipu, myosiitti, jänteen repeämä, niveltulehdus, bursiitti.
Hermosto: usein: hypestesia, apatia, masennus, hypokinesia, huimaus, nykiminen, agitaatio, ahdistuneisuus, muistinmenetys, hyperkinesia, parestesia; harvinainen: ataksia, delirium, harhaluulot, depersonalisaatio, dyskinesia, ekstrapyramidaalinen oireyhtymä, lisääntynyt libido, epänormaali koordinaatio, dysartria, hallusinaatiot, maaninen reaktio, neuroosi, dystonia, vihamielisyys, lisääntyneet refleksit, emotionaalinen labilisuus, euforia, vainoharhainen reaktio; harvinainen: afasia, nystagmus, akatisia (psykomotorinen levottomuus), stupor, dementia, diplopia, lääkeriippuvuus, halvaus, grand mal -kouristukset, hypotonia, myoklonus, psykoottinen masennus, vieroitusoireyhtymä, serotoniinioireyhtymä.
Hengitysjärjestelmä: usein: lisääntynyt yskä, sinuiitti; harvinainen: nenäverenvuoto, keuhkoputkentulehdus, astma, keuhkokuume; harvinainen: asfyksia, kurkunpäätulehdus, ilmarinta, hikka.
Iho ja lisäkkeet: usein: kutina, ihottuma; harvinainen: akne, exfoliatiivinen dermatiitti, kuiva iho, herpes simplex, hiustenlähtö; harvinainen: nokkosihottuma, herpes zoster, ihon liikakasvu, seborrea, ihohaava.
Erityiset aistit: harvinainen: silmäkipu, akkomodaatiohäiriö, sidekalvotulehdus, kuurous, keratokonjunktiviitti, kyynelten erityshäiriö, sulkukulmaglaukooma, hyperakusia, korvakipu; harvinainen: blefariitti, osittainen ohimenevä kuurous, välikorvatulehdus, makuaistin menetys, parosmia.
Urogenitaaljärjestelmä: usein: virtsatietulehdus; harvinainen: munuaiskivi, kystiitti, dysuria, virtsanpidätyskyvyttömyys, virtsanpidätys, vaginiitti, hematuria, rintakipu, amenorrea, dysmenorrea, leukorrea, impotenssi; harvinainen: polyuria, virtsaputkentulehdus, metrorrhagia, menorragia, epänormaali siemensyöksy, rintojen turpoaminen, rintojen suureneminen, virtsaamispakko.
Muut REMERONin markkinoille tulon jälkeisen arvioinnin aikana havaitut haittatapahtumat
Markkinoille tulon jälkeen raportoituja haittatapahtumia, jotka liittyivät ajallisesti (mutta ei välttämättä kausaalisesti) mirtatsapiinihoitoon, ovat muun muassa kammiorytmihäiriötapaukset Torsades de Pointes. Suurimmassa osassa näistä tapauksista oli kuitenkin kyse samanaikaisista huumeista. Myös vakavia ihoreaktioita, mukaan lukien Stevens-Johnsonin oireyhtymä, rakkulainen ihottuma, erythema multiforme ja toksinen epidermaalinen nekrolyysi, on raportoitu. Veren kreatiinikinaasipitoisuuksien nousua ja rabdomyolyysiä on myös raportoitu.
Huumeiden väärinkäyttö ja riippuvuus
Valvottu aineluokka
REMERON (mirtatsapiini) -tabletit eivät ole valvottuja aineita.
Fyysinen ja psykologinen riippuvuus
REMERON (mirtatsapiini) -tabletteja ei ole tutkittu systemaattisesti eläimillä tai ihmisillä sen mahdollisen väärinkäytön, sietokyvyn tai fyysisen riippuvuuden suhteen. Vaikka kliiniset tutkimukset eivät paljastaneet minkäänlaista taipumusta huumeiden etsivään käyttäytymiseen, nämä havainnot eivät olleet systemaattisia, eikä tämän rajallisen kokemuksen perusteella ole mahdollista ennustaa, missä määrin keskushermostoon vaikuttavaa lääkettä käytetään väärin, ohjataan muualle tai muualle. /tai väärinkäytöksiä, kun ne on markkinoitu. Tästä syystä potilaat tulee arvioida huolellisesti anamneesin huumeiden väärinkäytön varalta, ja tällaisia potilaita tulee tarkkailla tarkasti REMERONin väärinkäytön merkkien varalta (esim. sietokyvyn kehittyminen, annoksen suurentaminen, huumeiden etsintäkäyttäytyminen).
HUUMEIDEN VUOROVAIKUTUKSET
Kuten muidenkin lääkkeiden kanssa, erilaisten mekanismien (esim. farmakodynaaminen, farmakokineettinen esto tai tehostuminen jne.) aiheuttama yhteisvaikutus on mahdollista (ks. KLIININEN FARMAKOLOGIA ).
Monoamiinioksidaasin estäjät
(Katso VASTA-AIHEET , VAROITUKSET , ja ANNOSTELU JA HALLINNOINTI .)
Serotonergiset lääkkeet
(Katso VASTA-AIHEET ja VAROITUKSET .)
Maksan aineenvaihduntaan vaikuttavat lääkkeet
REMERON (mirtatsapiini) -tablettien metaboliaan ja farmakokinetiikkaan voi vaikuttaa lääkettä metaboloivien entsyymien induktio tai esto.
Lääkkeet, jotka metaboloituvat sytokromi P450 -entsyymien kautta ja/tai estävät niitä
CYP-entsyymin indusoijat
(näissä tutkimuksissa käytettiin molempia lääkkeitä vakaassa tilassa)
Fenytoiini
Terveillä miespotilailla (n=18) fenytoiini (200 mg vuorokaudessa) lisäsi mirtatsapiinin (30 mg vuorokaudessa) puhdistumaa noin kaksinkertaiseksi, mikä johti plasman mirtatsapiinin keskimääräisten pitoisuuksien pienenemiseen 45 %. Mirtatsapiini ei vaikuttanut merkittävästi fenytoiinin farmakokinetiikkaan.
Karbamatsepiini
Terveillä miespotilailla (n = 24) karbamatsepiini (400 mg kahdesti) lisäsi mirtatsapiinin (15 mg kahdesti) puhdistumaa noin kaksinkertaiseksi, mikä johti plasman mirtatsapiinin keskimääräisten pitoisuuksien pienenemiseen 60 %.
Kun fenytoiinia, karbamatsepiinia tai muuta maksan metaboliaa indusoivaa ainetta (kuten rifampisiinia) lisätään mirtatsapiinihoitoon, mirtatsapiiniannosta voidaan joutua suurentamaan. Jos hoito tällaisella lääkevalmisteella lopetetaan, mirtatsapiiniannosta voi olla tarpeen pienentää.
CYP-entsyymin estäjät
Simetidiini
Terveille miespotilaille (n = 12), kun simetidiiniä, heikkoa CYP1A2:n, CYP2D6:n ja CYP3A4:n estäjänä, annettiin vakaassa tilassa 800 mg kahdesti päivässä, mirtatsapiinin (30 mg päivässä) kanssa vakaassa tilassa, käyrän alla oleva pinta-ala. mirtatsapiinin AUC nousi yli 50 %. Mirtatsapiini ei aiheuttanut merkittäviä muutoksia simetidiinin farmakokinetiikkaan. Mirtatsapiinin annosta voidaan joutua pienentämään, kun samanaikainen simetidiinihoito aloitetaan, tai suurentaa, kun simetidiinihoito lopetetaan.
Ketokonatsoli
Terveillä miehillä, valkoihoisilla potilailla (n=24) voimakkaan CYP3A4-estäjän ketokonatsolin (200 mg kahdesti 6,5 vuorokauden ajan) samanaikainen anto nosti mirtatsapiinin 30 mg:n kerta-annoksen huippupitoisuuksia plasmassa ja AUC-arvoa noin 40 %. vastaavasti 50 %.
Varovaisuutta tulee noudattaa annettaessa mirtatsapiinia yhdessä voimakkaiden CYP3A4-estäjien, HIV-proteaasin estäjien, atsolisienilääkkeiden, erytromysiinin tai nefatsodonin kanssa.
Paroksetiini
In vivo -interaktiotutkimuksessa terveillä, CYP2D6:ta laajalle metaboloijapotilailla (n=24), mirtatsapiini (30 mg/vrk) ei vakaassa tilassa aiheuttanut merkittäviä muutoksia vakaan tilan paroksetiinin (40 mg/vrk) farmakokinetiikkaan. CYP2D6:n estäjä.
Muut huumeiden väliset vuorovaikutukset
Amitriptyliini
Terveillä CYP2D6-entsyymin metaboloijapotilailla (n = 32) amitriptyliini (75 mg vuorokaudessa) ei vakaassa tilassa aiheuttanut merkittäviä muutoksia vakaan tilan mirtatsapiinin (30 mg päivässä) farmakokinetiikkaan. mirtatsapiini ei myöskään aiheuttanut merkittäviä muutoksia amitriptyliinin farmakokinetiikkaan.
Varfariini
Terveillä mieshenkilöillä (n=16) mirtatsapiini (30 mg päivässä) vakaassa tilassa aiheutti pienen (0,2), mutta tilastollisesti merkitsevän nousun kansainvälisessä normalisoidussa suhteessa (INR) varfariinilla hoidetuilla koehenkilöillä. Koska suurempia mirtatsapiiniannoksia käytettäessä, voimakkaampaa vaikutusta ei voida sulkea pois, on suositeltavaa seurata INR-arvoa, jos varfariinia käytetään samanaikaisesti mirtatsapiinin kanssa.
Litium
Merkittäviä kliinisiä vaikutuksia tai merkittäviä muutoksia farmakokinetiikassa ei ole havaittu terveillä miespuolisilla koehenkilöillä, jotka saivat samanaikaista hoitoa subterapeuttisilla litiumpitoisuuksilla (600 mg/vrk 10 päivän ajan) vakaassa tilassa ja kerta-annoksella 30 mg mirtatsapiinia. Suurempien litiumannosten vaikutuksia mirtatsapiinin farmakokinetiikkaan ei tunneta.
Risperidoni
In vivo, ei-satunnaistetussa yhteisvaikutustutkimuksessa psykoosi- ja masennuslääkehoidon tarpeessa olevat koehenkilöt (n=6) osoittivat, että mirtatsapiini (30 mg päivässä) vakaassa tilassa ei vaikuttanut risperidonin (3 mg:aan asti) farmakokinetiikkaan. tarjous).
Alkoholi
Samanaikainen alkoholin antaminen (vastaa 60 g) vaikutti minimaalisesti mirtatsapiinin (15 mg) pitoisuuksiin plasmassa 6 terveellä mieshenkilöllä. Kuitenkin REMERONin aiheuttamien kognitiivisten ja motoristen taitojen heikkenemisen osoitettiin olevan additiivinen alkoholin aiheuttamien taitojen kanssa. Tästä syystä potilaita tulee neuvoa välttämään alkoholia REMERONin käytön aikana.
Diatsepaami
Diatsepaamin (15 mg) samanaikainen antaminen vaikutti minimaalisesti mirtatsapiinin (15 mg) plasmapitoisuuteen 12 terveellä koehenkilöllä. REMERON 30mg:n aiheuttaman motoristen taitojen heikkenemisen on kuitenkin osoitettu olevan additiivinen diatsepaamin aiheuttamien häiriöiden kanssa. Tästä syystä potilaita tulee neuvoa välttämään diatsepaamia ja muita vastaavia lääkkeitä REMERONin käytön aikana.
QTc:tä pidentävät lääkkeet
QT-ajan pidentymisen ja/tai kammioiden rytmihäiriöiden (esim. Torsades de Pointes) riski voi lisääntyä käytettäessä samanaikaisesti QTc-aikaa pidentäviä lääkkeitä (esim. jotkin psykoosilääkkeet ja antibiootit) ja mirtatsapiinin yliannostuksen yhteydessä (ks. HAITTAVAIKUTUKSET ja YLIANNOSTUS osiot).
VAROITUKSET
Kliininen paheneminen ja itsemurhariski
Potilaat, joilla on vaikea masennushäiriö (MDD), sekä aikuisilla että lapsilla, voivat kokea masennuksensa pahenemista ja/tai itsemurha-ajatuksia ja -käyttäytymisen ilmaantumista (itsemurha-ajatuksia) tai epätavallisia muutoksia käyttäytymisessä riippumatta siitä, käyttävätkö he masennuslääkkeitä vai eivät, ja tämä riski voi jatkua, kunnes merkittävä remissio tapahtuu. Itsemurha on tunnettu masennuksen ja tiettyjen muiden psykiatristen häiriöiden riski, ja nämä häiriöt itsessään ovat vahvimpia itsemurhan ennustajia. Pitkään on kuitenkin ollut huolta siitä, että masennuslääkkeillä voi olla rooli masennuksen pahenemisessa ja itsetuhoisuuden syntymisessä tietyillä potilailla hoidon alkuvaiheessa. Lyhytaikaisten lumekontrolloitujen masennuslääkkeiden (SSRI-lääkkeiden ja muiden) tutkimusten yhdistetyt analyysit osoittivat, että nämä lääkkeet lisäävät itsemurha-ajattelun ja -käyttäytymisen (itsemurha-ajattelun) riskiä lapsilla, nuorilla ja nuorilla aikuisilla (18–24-vuotiaat), joilla on vakava masennus. häiriö (MDD) ja muut psykiatriset häiriöt. Lyhytaikaiset tutkimukset eivät osoittaneet lisääntynyttä itsemurhariskiä masennuslääkkeillä lumelääkkeeseen verrattuna yli 24-vuotiailla aikuisilla; 65-vuotiailla ja sitä vanhemmilla aikuisilla masennuslääkkeiden riski pieneni lumelääkkeeseen verrattuna.
Plasebokontrolloitujen tutkimusten yhdistetyt analyysit lapsilla ja nuorilla, joilla oli MDD, pakko-oireinen häiriö (OCD) tai muut psykiatriset häiriöt, sisälsivät yhteensä 24 lyhytaikaista tutkimusta 9 masennuslääkkeellä yli 4400 potilaalla. Plasebokontrolloitujen tutkimusten yhdistetyt analyysit aikuisilla, joilla oli MDD tai muita psykiatrisia häiriöitä, sisälsivät yhteensä 295 lyhytaikaista tutkimusta (mediaanikesto 2 kuukautta), joissa oli 11 masennuslääkettä yli 77 000 potilaalla. Itsemurhariskissä oli huomattavaa vaihtelua lääkkeiden välillä, mutta taipumus nuorempien potilaiden lisääntymiseen lähes kaikkien tutkittujen lääkkeiden kohdalla. Absoluuttisessa itsemurhariskissä oli eroja eri indikaatioiden välillä, ja suurin ilmaantuvuus MDD:ssä. Riskierot (lääke vs. lumelääke) olivat kuitenkin suhteellisen vakaita ikäryhmien sisällä ja eri käyttöaiheissa. Nämä riskierot (lääkkeen ja lumelääkkeen ero itsemurhatapausten määrässä 1000 hoidettua potilasta kohti) on esitetty taulukossa 1.
Yhtään itsemurhaa ei tapahtunut missään lapsitutkimuksessa. Aikuisten kokeissa oli itsemurhia, mutta määrä ei riittänyt päättämään lääkkeiden vaikutuksesta itsemurhaan.
Ei tiedetä, ulottuuko itsemurhariski pitkäaikaiseen käyttöön eli useiden kuukausien jälkeiseen käyttöön. Lumekontrolloiduista ylläpitotutkimuksista aikuisilla, joilla on masennus, on kuitenkin huomattavaa näyttöä siitä, että masennuslääkkeiden käyttö voi viivyttää masennuksen uusiutumista.
Kaikkia potilaita, joita hoidetaan masennuslääkkeillä missä tahansa indikaatiossa, on seurattava asianmukaisesti ja tarkkailtava tarkasti kliinisen pahenemisen, itsemurha-ajattelun ja epätavallisten käyttäytymismuutosten varalta, erityisesti lääkehoidon ensimmäisten kuukausien aikana tai annosta muutettaessa, joko annosta suurennetaan. tai pienenee.
Seuraavia oireita, ahdistusta, kiihtyneisyyttä, paniikkikohtauksia, unettomuutta, ärtyneisyyttä, vihamielisyyttä, aggressiivisuutta, impulsiivisuutta, akatisiaa (psykomotorista levottomuutta), hypomaniaa ja maniaa on raportoitu myös aikuisilla ja lapsipotilailla, joita on hoidettu masennuslääkkeillä vakavan masennuksen vuoksi. kuten muissakin indikaatioissa, sekä psykiatrisissa että ei-psykiatrisissa. Vaikka syy-yhteyttä tällaisten oireiden ilmaantumisen ja joko masennuksen pahenemisen ja/tai itsetuhoisten impulssien ilmaantumisen välillä ei ole osoitettu, on huolestuttavaa, että tällaiset oireet voivat olla syntyvän itsetuhoisuuden esiaste.
Hoito-ohjelman muuttamista, mukaan lukien lääkityksen mahdollista lopettamista, tulee harkita potilailla, joiden masennus pahenee jatkuvasti tai joilla on ilmennyt itsemurha tai oireita, jotka saattavat olla masennuksen tai itsemurha-ajatuksen pahenemisen edeltäjä, varsinkin jos nämä oireet ovat vakavia, äkillisiä. alkuvaiheessa tai eivät olleet osa potilaan ilmeneviä oireita.
Masennuslääkkeillä vakavan masennushäiriön tai muiden, sekä psykiatristen että ei-psykiatristen oireiden vuoksi hoidettavien potilaiden perheitä ja hoitajia tulee varoittaa tarpeesta seurata potilaita kiihtyneisyyden, ärtyneisyyden, epätavallisten käyttäytymismuutosten ja muiden edellä kuvattujen oireiden ilmaantumisen varalta. , sekä itsemurha-ajattelun ilmaantuminen ja ilmoittamaan tällaisista oireista välittömästi terveydenhuollon tarjoajille. Tällaiseen seurantaan tulisi sisältyä perheiden ja omaishoitajien päivittäinen tarkkailu. REMERON (mirtatsapiini) -tablettien reseptit tulee kirjoittaa pienimmälle määrälle tabletteja, jotka ovat hyvän potilaan hoidon mukaisia, jotta voidaan vähentää yliannostusriskiä.
Potilaiden seulonta kaksisuuntaisen mielialahäiriön varalta
Vakava masennusjakso voi olla kaksisuuntaisen mielialahäiriön ensimmäinen ilmentymä. Yleisesti uskotaan (vaikkakaan sitä ei ole vahvistettu kontrolloiduissa tutkimuksissa), että tällaisen episodin hoito pelkällä masennuslääkkeellä voi lisätä seka-/maanisen vaiheen esiintymisen todennäköisyyttä potilailla, joilla on kaksisuuntaisen mielialahäiriön riski. Ei tiedetä, edustavatko mikään yllä kuvatuista oireista tällaista muutosta. Ennen masennuslääkehoidon aloittamista masennusoireista kärsivät potilaat tulee kuitenkin seuloa riittävästi sen määrittämiseksi, onko heillä kaksisuuntaisen mielialahäiriön riski; Tällaiseen seulontaan tulee sisältyä yksityiskohtainen psykiatrinen historia, mukaan lukien suvussa itsemurhaa, kaksisuuntaista mielialahäiriötä ja masennusta esiintynyt historia. On huomattava, että REMERON (mirtatsapiini) -tabletteja ei ole hyväksytty käytettäväksi kaksisuuntaisen mielialahäiriön hoidossa.
Agranulosytoosi
Markkinointia edeltävissä kliinisissä tutkimuksissa 2 (1 Sjögrenin oireyhtymää sairastava) 2796 potilaasta, joita hoidettiin REMERON (mirtatsapiini) -tableteilla, kehittyi agranulosytoosiin [absoluuttinen neutrofiilien määrä (ANC)
Serotoniinin oireyhtymä
Mahdollisesti hengenvaarallisen serotoniinioireyhtymän kehittymistä on raportoitu käytettäessä SNRI-lääkkeitä ja SSRI-lääkkeitä, mukaan lukien REMERON 30 mg, yksinään, mutta erityisesti käytettäessä samanaikaisesti muita serotonergisia lääkkeitä (mukaan lukien triptaanit, trisykliset masennuslääkkeet, fentanyyli, litium, tramadoli, tryptofaani, buspironi ja mäkikuisma) ja lääkkeillä, jotka heikentävät serotoniinin aineenvaihduntaa (erityisesti MAO-estäjät, sekä psykiatristen häiriöiden hoitoon tarkoitetut, että myös muut, kuten linetsolidi ja suonensisäinen metyleenisininen).
Serotoniinioireyhtymän oireita voivat olla mielentilan muutokset (esim. kiihtyneisyys, hallusinaatiot, delirium ja kooma), autonominen epävakaus (esim. takykardia, labiili verenpaine, huimaus, hikoilu, punoitus, hypertermia), hermo-lihasoireet (esim. vapina, jäykkyys, myoklonus, hyperrefleksia, koordinaatiohäiriöt), kohtaukset ja/tai maha-suolikanavan oireet (esim. pahoinvointi, oksentelu, ripuli). Potilaita tulee seurata serotoniinioireyhtymän ilmaantumisen varalta.
REMERON 15 mg:n samanaikainen käyttö psykiatristen häiriöiden hoitoon tarkoitettujen MAO-estäjien kanssa on vasta-aiheista. REMERON-hoitoa ei myöskään saa aloittaa potilaalla, jota hoidetaan MAO-estäjillä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä. Kaikki metyleenisinistä koskevat raportit, jotka antoivat tietoa antoreitistä, koskivat suonensisäistä antoa annosalueella 1 mg/kg - 8 mg/kg. Ei raportoitu metyleenisinisen antamista muilla reiteillä (kuten oraalisilla tableteilla tai paikallisilla kudosinjektioilla) tai pienempinä annoksina. Joissain tilanteissa saattaa olla tarpeen aloittaa hoito MAO:n estäjällä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä REMERONia käyttävällä potilaalla. REMERON 15 mg -hoito tulee lopettaa ennen MAO-estäjän hoidon aloittamista (ks VASTA-AIHEET ja ANNOSTELU JA HALLINNOINTI ).
Jos REMERON 30 mg:n samanaikainen käyttö muiden serotonergisten lääkkeiden, kuten triptaanien, trisyklisten masennuslääkkeiden, fentanyylin, litiumin, tramadolin, buspironin, tryptofaanin ja mäkikuisman kanssa on kliinisesti perusteltua, ota huomioon mahdollinen lisääntynyt serotoniinioireyhtymän riski, erityisesti hoidon aloitus ja annosta suurennetaan.
Hoito REMERON 30 mg:lla ja kaikilla samanaikaisilla serotonergisilla aineilla on lopetettava välittömästi, jos yllä mainitut tapahtumat ilmenevät, ja oireenmukaista tukihoitoa on aloitettava.
Kulman sulkeutuva glaukooma
Monien masennuslääkkeiden, mukaan lukien REMERON 15 mg:n, käytön seurauksena esiintyvä pupillien laajentuminen voi laukaista kulman sulkemiskohtauksen potilaalla, jolla on anatomisesti kapeat kulmat ja jolle ei ole tehty iridektomiaa.
QT-ajan piteneminen ja torsades de pointes
REMERONin (mirtatsapiini) vaikutusta QTc-väliin arvioitiin kliinisessä satunnaistetussa tutkimuksessa lumelääkkeellä ja positiivisilla (moksifloksasiini) kontrolleilla, joihin osallistui 54 tervettä vapaaehtoista käyttämällä altistusvasteanalyysiä. Tämä tutkimus osoitti positiivisen suhteen mirtatsapiinipitoisuuksien ja QTc-ajan pidentymisen välillä. Sekä 45 mg (terapeuttinen) että 75 mg (supraterapeuttinen) annoksilla mirtatsapiinia havaittu QT-ajan pitenemisen aste ei kuitenkaan ollut tasolla, jota yleensä pidettiin kliinisesti merkityksellisenä. Mirtatsapiinin markkinoille tulon jälkeisen käytön aikana on raportoitu tapauksia QT-ajan pidentymisestä, torsade de pointesista, kammiotakykardiasta ja äkillisestä kuolemasta (ks. HAITTAVAIKUTUKSET ). Suurin osa raporteista esiintyi yliannostuksen yhteydessä tai potilailla, joilla oli muita QT-ajan pidentämisen riskitekijöitä, mukaan lukien QTc-aikaa pidentävien lääkkeiden samanaikainen käyttö (ks. HUUMEIDEN VUOROVAIKUTUKSET ja YLIANNOSTUS osiot). Varovaisuutta on noudatettava määrättäessä REMERONia potilaille, joilla on tunnettu sydän- ja verisuonisairaus tai suvussa esiintynyt QT-ajan pidentymistä, ja käytettäessä samanaikaisesti muita QTc-aikaa pidentävän lääkkeiden kanssa.
VAROTOIMENPITEET
Kenraali
Lopetuksen oireet
REMERON (mirtatsapiini) -tablettien käytön lopettamisen yhteydessä on raportoitu haittavaikutuksia (erityisesti äkillisesti), mukaan lukien, mutta niihin rajoittumatta: huimaus, epänormaalit unet, aistihäiriöt (mukaan lukien parestesia ja sähköiskun tunteet), kiihtyneisyys, ahdistuneisuus, väsymys, sekavuus, päänsärky, vapina, pahoinvointi, oksentelu ja hikoilu tai muut oireet, joilla voi olla kliinistä merkitystä. Suurin osa raportoiduista tapauksista on lieviä ja itsestään rajoittuvia. Vaikka näitä on raportoitu haittavaikutuksina, on otettava huomioon, että nämä oireet voivat liittyä taustalla olevaan sairauteen.
Potilaiden, jotka tällä hetkellä käyttävät REMERONia, EI tule lopettaa hoitoa äkillisesti keskeytysoireiden riskin vuoksi. Kun lääketieteellinen päätös REMERON-hoidon lopettamisesta tehdään, suositellaan annoksen asteittaista pienentämistä äkillisen lopettamisen sijaan.
Akatisia / psykomotorinen levottomuus
Masennuslääkkeiden käyttö on yhdistetty akatisian kehittymiseen, jolle on ominaista subjektiivisesti epämiellyttävä tai ahdistava levottomuus ja tarve liikkua, johon usein liittyy kyvyttömyys istua tai seistä paikallaan. Tämä tapahtuu todennäköisimmin muutaman ensimmäisen hoitoviikon aikana. Potilaille, joille kehittyy näitä oireita, annoksen suurentaminen voi olla haitallista.
Hyponatremia
Hyponatremiaa on raportoitu erittäin harvoin mirtatsapiinin käytön yhteydessä. Varovaisuutta on noudatettava riskiryhmissä, kuten iäkkäillä potilailla tai potilailla, joita hoidetaan samanaikaisesti hyponatremiaa aiheuttavilla lääkkeillä.
Uneliaisuus
Yhdysvalloissa kontrolloiduissa tutkimuksissa uneliaisuutta raportoitiin 54 %:lla REMERON (mirtatsapiini) tabletteilla hoidetuista potilaista verrattuna 18 %:iin lumelääkettä saaneiden ja 60 %:iin amitriptyliiniä saaneiden potilaiden kohdalla. Näissä tutkimuksissa uneliaisuus johti hoidon keskeyttämiseen 10,4 %:lla REMERON-hoitoa saaneista potilaista, kun taas lumelääkettä saaneista potilaista 2,2 %. On epäselvää, kehittyykö toleranssi REMERONin uneliaisille vaikutuksille vai ei. Koska REMERON 30 mg:lla voi olla merkittäviä suorituskykyä heikentäviä vaikutuksia, potilaita tulee varoittaa valppautta vaativien toimien harjoittamisesta, kunnes he ovat pystyneet arvioimaan lääkkeen vaikutuksen omaan psykomotoriseen suorituskykyynsä (ks. POTILASTIEDOT ).
Huimaus
Yhdysvalloissa kontrolloiduissa tutkimuksissa huimausta raportoitiin 7 %:lla REMERONilla hoidetuista potilaista verrattuna 3 %:iin lumelääkettä saaneiden ja 14 %:lla amitriptyliiniä saaneiden potilaiden kohdalla. On epäselvää, kehittyykö REMERONin käytön yhteydessä havaittu huimaus sietokykyä vai ei.
Lisääntynyt ruokahalu / painonnousu
Yhdysvalloissa tehdyissä kontrolloiduissa tutkimuksissa ruokahalun lisääntymistä raportoitiin 17 %:lla REMERON 30 mg:lla hoidetuista potilaista verrattuna 2 %:iin lumelääkettä saaneiden ja 6 %:lla amitriptyliiniä saaneiden potilaiden kohdalla. Näissä samoissa tutkimuksissa 7,5 %:lla mirtatsapiinilla hoidetuista potilaista ilmoitettiin painonnousua ≥ 7 % ruumiinpainosta verrattuna 0 %:iin lumelääkettä saaneiden ja 5,9 % amitriptyliiniä saaneiden potilaiden kohdalla. Yhdysvalloissa tehdyissä markkinointia edeltävissä tutkimuksissa, joihin osallistui monia potilaita pitkäaikaisessa avoimessa hoidossa, 8 % REMERON 30 mg:n potilaista keskeytti painonnousun vuoksi. Kahdeksan viikkoa kestäneessä kliinisessä lapsitutkimuksessa, jossa käytettiin 15–45 mg/vrk annoksia, 49 %:lla REMERON-hoitoa saaneista potilaista painonnousu oli vähintään 7 % verrattuna 5,7 %:iin lumelääkettä saaneista potilaista (ks. VAROTOIMENPITEET : Käyttö lapsille ).
Kolesteroli/triglyseridit
Yhdysvalloissa tehdyissä kontrolloiduissa tutkimuksissa kolesterolin nousu paaston aikana ≥ 20 % yli normaalin ylärajan havaittiin 15 %:lla REMERON 30 mg:lla hoidetuista potilaista verrattuna 7 %:iin lumelääkettä saaneiden ja 8 %:iin amitriptyliiniä saaneiden potilaiden kohdalla. Näissä samoissa tutkimuksissa triglyseridipitoisuuden paastossa ≥ 500 mg/dl havaittiin 6 %:lla mirtatsapiinilla hoidetuista potilaista verrattuna 3 %:iin lumelääkettä saaneiden ja 3 %:iin amitriptyliiniä saaneiden potilaiden kohdalla.
Transaminaasien nousu
Kliinisesti merkitseviä ALAT-arvojen (SGPT) nousuja (≥ 3 kertaa normaalin alueen yläraja) havaittiin 2,0 %:lla (8/424) REMERON 30 mg:lle altistuneista potilaista lyhytaikaisissa USA:n kontrolloiduissa tutkimuksissa, kun vastaava luku oli 0,3 %. (1/328) lumelääkepotilaista ja 2,0 % (3/181) amitriptyliinipotilaista. Suurin osa näistä potilaista, joilla oli kohonnut ALAT, ei kehittänyt maksan vajaatoimintaan liittyviä merkkejä tai oireita. Jotkut potilaat keskeytettiin ALAT-arvon nousun vuoksi, mutta toisissa tapauksissa entsyymitasot palautuivat normaaliksi huolimatta REMERON-hoidon jatkamisesta. REMERONia tulee käyttää varoen potilailla, joilla on heikentynyt maksan toiminta (ks KLIININEN FARMAKOLOGIA ja ANNOSTELU JA HALLINNOINTI ).
Manian/hypomanian aktivointi
Maniaa/hypomaniaa esiintyi noin 0,2 %:lla (3/1299 potilasta) REMERONilla hoidetuista potilaista Yhdysvalloissa tehdyissä tutkimuksissa. Vaikka manian/hypomanian ilmaantuvuus oli erittäin alhainen mirtatsapiinihoidon aikana, sitä tulee käyttää varoen potilailla, joilla on ollut mania/hypomania.
Kohtaus
Markkinoille saattamista edeltävissä kliinisissä tutkimuksissa vain yksi kohtaus raportoitiin REMERONilla hoidetuista 2796 yhdysvaltalaisesta ja muusta potilaasta. Kontrolloituja tutkimuksia ei kuitenkaan ole tehty potilailla, joilla on ollut kouristuskohtauksia. Siksi on noudatettava varovaisuutta, kun mirtatsapiinia käytetään näille potilaille.
Käyttö potilailla, joilla on samanaikainen sairaus
Kliininen kokemus REMERONin käytöstä potilailla, joilla on samanaikainen systeeminen sairaus, on rajallinen. Näin ollen varovaisuutta on suositeltavaa määrätä mirtatsapiinia potilaille, joilla on sairauksia tai tiloja, jotka vaikuttavat aineenvaihduntaan tai hemodynaamisiin vasteisiin.
REMERONia ei ole systemaattisesti arvioitu tai käytetty merkittävässä määrin potilailla, joilla on äskettäin ollut sydäninfarkti tai muu merkittävä sydänsairaus. REMERONin käyttöön liittyi merkittävä ortostaattinen hypotensio varhaisissa kliinisissä farmakologisissa tutkimuksissa normaaleilla vapaaehtoisilla. Ortostaattista hypotensiota havaittiin harvoin kliinisissä tutkimuksissa masentuneilla potilailla. REMERON 15 mg:aa tulee käyttää varoen potilailla, joilla on tunnettu sydän- tai aivoverisuonisairaus, jota hypotensio (aiemmin sydäninfarkti, angina pectoris tai iskeeminen aivohalvaus) voi pahentaa, ja tilat, jotka altistavat potilaat hypotensiolle (dehydraatio, hypovolemia ja hoito verenpainelääkkeillä) lääkitys).
Mirtatsapiinin puhdistuma pienenee potilailla, joilla on kohtalainen [glomerulussuodatusnopeus (GFR) = 11 - 39 ml/min/1,73 m²] ja vaikea [GFR KLIININEN FARMAKOLOGIA ja ANNOSTELU JA HALLINNOINTI ).
Tietoja potilaille
Lääkäreiden tai muiden terveydenhuollon ammattilaisten tulee kertoa potilaille, heidän perheilleen ja heidän hoitajilleen REMERON (mirtatsapiini) -tablettien hoitoon liittyvistä eduista ja riskeistä ja neuvoa heitä sen asianmukaisessa käytössä. Potilas Lääkitysopas Tietoja masennuslääkkeistä, masennuksesta ja muista vakavista mielenterveyssairauksista sekä itsetuhoisista ajatuksista tai toimista on saatavana REMERONille. Lääkkeen määräävän lääkärin tai terveydenhuollon ammattilaisen tulee neuvoa potilaita, heidän perheitään ja hoitajiaan lukemaan tämä Lääkitysopas ja sen pitäisi auttaa heitä ymmärtämään sen sisältö. Potilaille tulee antaa mahdollisuus keskustella hoidon sisällöstä Lääkitysopas ja saada vastauksia mahdollisiin kysymyksiinsä. Koko teksti Lääkitysopas on painettu uudelleen tämän asiakirjan lopussa.
Potilaita tulee kertoa seuraavista ongelmista ja pyytää heitä varoittamaan lääkäriään, jos näitä ilmenee REMERON-hoidon aikana.
Kliininen paheneminen ja itsemurhariski
Potilaita, heidän perheitään ja heidän omaisiaan tulee kannustaa olemaan valppaana ahdistuneisuuden, kiihtyneisyyden, paniikkikohtausten, unettomuuden, ärtyneisyyden, vihamielisyyden, aggressiivisuuden, impulsiivisuuden, akatisian (psykomotorinen levottomuus), hypomanian, manian ja muiden epätavallisten käyttäytymismuutosten ilmaantuessa. , masennuksen paheneminen ja itsemurha-ajatukset, erityisesti masennuslääkehoidon alkuvaiheessa ja kun annosta muutetaan ylös tai alas. Potilaiden perheitä ja hoitajia tulee neuvoa etsimään tällaisten oireiden ilmaantumista päivittäin, koska muutokset voivat olla äkillisiä. Tällaisista oireista tulee ilmoittaa potilaan määräävälle lääkärille tai terveydenhuollon ammattilaiselle, varsinkin jos ne ovat vakavia, alkavat äkillisesti tai eivät olleet osa potilaan oireita. Tällaiset oireet voivat liittyä lisääntyneeseen itsemurha-ajattelun ja -käyttäytymisen riskiin, ja ne voivat viitata erittäin tiiviin seurannan tarpeeseen ja mahdollisesti lääkityksen muutoksiin.
Agranulosytoosi
Potilaita, jotka saavat REMERONia, tulee varoittaa agranulosytoosin kehittymisriskistä. Potilaita tulee neuvoa ottamaan yhteyttä lääkäriin, jos heillä on merkkejä infektiosta, kuten kuumetta, vilunväristyksiä, kurkkukipua, limakalvon haavaumia tai muita mahdollisia infektion merkkejä. Erityistä huomiota tulee kiinnittää kaikkiin flunssan kaltaisiin vaivoihin tai muihin infektioon viittaaviin oireisiin.
Häiriö kognitiiviseen ja motoriseen suorituskykyyn
REMERON 15 mg voi heikentää harkintakykyä, ajattelua ja erityisesti motorisia taitoja sen huomattavan rauhoittavan vaikutuksen vuoksi. Mirtatsapiinin käyttöön liittyvä uneliaisuus voi heikentää potilaan kykyä ajaa autoa, käyttää koneita tai suorittaa valppautta vaativia tehtäviä. Potilaita tulee näin ollen varoittaa osallistumasta vaarallisiin toimintoihin, kunnes he ovat kohtuullisen varmoja siitä, että REMERON-hoito ei vaikuta haitallisesti heidän kykyynsä harjoittaa tällaista toimintaa.
Terapiakurssin suorittaminen
Vaikka potilaat saattavat havaita paranemista REMERON 15 mg -hoidolla 1–4 viikossa, heitä tulee neuvoa jatkamaan hoitoa ohjeiden mukaan.
Samanaikainen lääkitys
Potilaita tulee neuvoa ilmoittamaan lääkärilleen, jos he käyttävät tai aikovat ottaa resepti- tai käsikauppalääkkeitä, koska REMERONilla saattaa olla yhteisvaikutuksia muiden lääkkeiden kanssa.
Potilaat tulee kertoa mahdollisesta lisääntyneestä serotoniinioireyhtymän riskistä, jos REMERON 15 mg:n samanaikainen käyttö muiden serotonergisten lääkkeiden kanssa, mukaan lukien triptaanit, trisykliset masennuslääkkeet, fentanyyli, litium, tramadoli, buspironi, tryptofaani ja mäkikuisma, on kliinisesti perusteltua. varsinkin hoidon aloittamisen ja annoksen suurentamisen aikana.
Alkoholi
REMERONin aiheuttamien kognitiivisten ja motoristen taitojen heikkenemisen on osoitettu olevan additiivinen alkoholin aiheuttamien taitojen kanssa. Tästä syystä potilaita tulee neuvoa välttämään alkoholia mirtatsapiinin käytön aikana.
Raskaus
Potilaita tulee neuvoa ilmoittamaan lääkärilleen, jos he tulevat raskaaksi tai aikovat tulla raskaaksi REMERON-hoidon aikana.
Sairaanhoito
Potilaita tulee neuvoa ilmoittamaan lääkärilleen, jos he imettävät vauvaa.
Laboratoriotestit
Rutiinilaboratoriotutkimuksia ei suositella.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Karsinogeenisuustutkimukset suoritettiin mirtatsapiinilla, joka annettiin ruokavalion yhteydessä 2, 20 ja 200 mg/kg/vrk hiirille ja 2, 20 ja 60 mg/kg/vrk rotille. Suurimmat käytetyt annokset ovat noin 20 ja 12 kertaa suuremmat ihmisille suositeltuun enimmäisannokseen (MRHD) verrattuna, joka on 45 mg/vrk laskettuna mg/m²:n perusteella hiirillä ja rotilla, vastaavasti. Maksasoluadenooman ja karsinooman ilmaantuvuus lisääntyi uroshiirillä suurilla annoksilla. Rotilla lisääntyi maksasoluadenooma naarailla keskisuurilla ja suurilla annoksilla ja hepatosellulaariset kasvaimet sekä kilpirauhasen follikulaarinen adenooma/kystadenooma ja karsinooma uroksilla suurilla annoksilla. Tiedot viittaavat siihen, että yllä olevat vaikutukset voivat mahdollisesti välittyä ei-genotoksisten mekanismien kautta, joiden merkitystä ihmisille ei tunneta.
Hiiritutkimuksessa käytetyt annokset eivät ehkä olleet riittävän korkeita REMERON (mirtatsapiini) -tablettien syöpää aiheuttavan potentiaalin täydelliseksi karakterisoimiseksi.
Mutageneesi
Mirtatsapiini ei ollut mutageeninen tai klastogeeninen eikä aiheuttanut yleistä DNA-vauriota, kuten useissa genotoksisuustesteissä määritettiin: Ames-testi, in vitro -geenimutaatiomääritys kiinanhamsterin V 79 -soluissa, in vitro -sisarkromatidivaihtomääritys viljellyissä kaniinin lymfosyyteissä, in vivo luuydin mikrotumatesti rotilla ja suunnittelematon DNA-synteesimääritys HeLa-soluissa.
Hedelmällisyyden heikkeneminen
Rotilla tehdyssä hedelmällisyystutkimuksessa mirtatsapiinia annettiin annoksina 100 mg/kg asti [20 kertaa suurin suositeltu ihmisannos (MRHD) mg/m:n perusteella]. Lääke ei vaikuttanut pariutumiseen ja hedelmöittymiseen, mutta kiimakierto häiriintyi annoksilla, jotka olivat vähintään 3 kertaa MRHD:tä suuremmat, ja preimplantaatiohäviöitä tapahtui 20 kertaa MRHD:tä suuremmilla annoksilla.
Raskaus
Teratogeeniset vaikutukset
Raskausluokka C
Lisääntymistutkimukset raskaana olevilla rotilla annoksilla 100 mg/kg ja kaniineilla 40 mg/kg [20 ja 17 kertaa suurin suositeltu ihmisannos (MRHD) mg/m²:n perusteella laskettuna] eivät ole paljastaneet todisteita teratogeenisiä vaikutuksia. Kuitenkin rotilla mirtatsapiinilla hoidetuilla emoilla implantaation jälkeiset menetykset lisääntyivät. Pentukuolemien määrä lisääntyi imetyksen kolmen ensimmäisen päivän aikana ja pentujen syntymäpaino laski. Näiden kuolemien syytä ei tiedetä. Vaikutukset ilmenivät annoksilla, jotka olivat 20 kertaa MRHD, mutta eivät 3 kertaa MRHD, mg/m² perusteella. Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana oleville naisille. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, tätä lääkettä tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Imettävät äidit
Koska osa REMERONista voi erittyä äidinmaitoon, on noudatettava varovaisuutta, kun REMERON (mirtatsapiini) -tabletteja annetaan imettäville naisille.
Käyttö lapsille
Turvallisuutta ja tehokkuutta lapsiväestössä ei ole varmistettu (ks LAATIKKO VAROITUS ja VAROITUKSET : Kliininen paheneminen ja itsemurhariski ). Kaksi lumekontrolloitua tutkimusta 258 MDD:tä sairastavalla lapsipotilaalla on suoritettu REMERON (mirtatsapiini) -tableteilla, eivätkä tiedot riittäneet tukemaan väitettä käytöstä lapsipotilailla. Jokaisen, joka harkitsee REMERON 30 mg:n käyttöä lapselle tai nuorelle, on tasapainotettava mahdolliset riskit kliinisen tarpeen kanssa.
Kahdeksan viikkoa kestäneessä kliinisessä pediatrisessa tutkimuksessa, jossa käytettiin 15–45 mg/vrk annoksia, 49 %:lla REMERON-hoitoa saaneista potilaista painonnousu oli vähintään 7 % verrattuna 5,7 %:iin lumelääkettä saaneista potilaista. Keskimääräinen painon nousu oli 4 kg (2 kg SD) REMERON-hoitoa saaneilla potilailla ja 1 kg (2 kg SD) lumelääkettä saaneilla potilailla (ks. VAROTOIMENPITEET : Lisääntynyt ruokahalu / painonnousu ).
Geriatrinen käyttö
Noin 190 iäkkää henkilöä (≥ 65-vuotias) osallistui kliinisiin tutkimuksiin REMERON (mirtatsapiini) -tableteilla. Tämän lääkkeen tiedetään erittyvän olennaisesti munuaisten kautta (75 %), ja tämän lääkkeen puhdistuman alenemisen riski on suurempi potilailla, joilla on heikentynyt munuaisten toiminta. Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, annoksen valinnassa on oltava varovainen. Rauhoittavat lääkkeet voivat aiheuttaa hämmennystä ja liiallista sedaatiota vanhuksilla. Tässä ryhmässä ei havaittu epätavallisia haitallisia ikään liittyviä ilmiöitä. Farmakokineettiset tutkimukset osoittivat vähentyneen puhdistuman vanhuksilla. Varovaisuutta on noudatettava annettaessa REMERONia iäkkäille potilaille (ks KLIININEN FARMAKOLOGIA ja ANNOSTELU JA HALLINNOINTI ).
YLIANNOSTUS
Inhimillinen kokemus
REMERON (mirtazapine) -tablettien yliannostuksesta on hyvin vähän kokemusta. Markkinoille saattamista edeltävissä kliinisissä tutkimuksissa raportoitiin 8 REMERONin yliannostusta yksinään tai yhdessä muiden farmakologisten aineiden kanssa. Ainoa huumeiden yliannostuskuolema, joka raportoitiin REMERONin käytön aikana, oli yhdistelmä amitriptyliinin ja klooriprotikseenin kanssa ei-yhdysvaltalaisessa kliinisessä tutkimuksessa. Plasmapitoisuuksiin perustuen REMERON 15 mg:n annos oli 30-45 mg, kun taas amitriptyliinin ja klooriprotikseenin plasmapitoisuuksien todettiin olevan toksisia. Kaikki muut markkinointia edeltävät yliannostustapaukset johtivat täydelliseen paranemiseen. Yliannostuksen yhteydessä raportoituja merkkejä ja oireita olivat sekavuus, uneliaisuus, muistin heikkeneminen ja takykardia. EKG-poikkeavuuksia, koomaa tai kouristuksia ei raportoitu pelkän REMERONin yliannostuksen jälkeen.
Markkinoille tulon jälkeisten raporttien perusteella on kuitenkin olemassa mahdollisuus vakavampiin seurauksiin (mukaan lukien kuolemaan johtaneet) annoksilla, jotka ovat paljon suurempia kuin terapeuttinen annos, erityisesti seka-yliannostuksissa. Näissä tapauksissa on myös raportoitu QT-ajan pidentymistä ja torsade de pointes (ks HUUMEIDEN VUOROVAIKUTUKSET ja HAITTAVAIKUTUKSET osiot).
Yliannostuksen hallinta
Hoidon tulee koostua niistä yleisistä toimenpiteistä, joita käytetään yliannostuksen hallinnassa millä tahansa lääkkeellä, joka on tehokas vakavan masennushäiriön hoidossa. Varmista riittävät hengitystiet, hapetus ja ilmanvaihto. Tarkkaile EKG-parametreja (mukaan lukien sydämen rytmi) ja elintoimintoja. Yleisiä tuki- ja oireenmukaisia toimenpiteitä suositellaan myös. Oksentamisen aiheuttamista ei suositella. Mahahuuhtelu laajareikäisellä, sopivalla hengitysteiden suojalla varustetulla letkulla voi olla tarpeen, jos se suoritetaan pian nielemisen jälkeen tai potilaille, joilla on oireita. Aktiivihiiltä tulee antaa. Ei ole kokemusta pakkodiureesin, dialyysin, hemoperfuusion tai vaihtotransfuusion käytöstä mirtatsapiinin yliannostuksen hoidossa. Mirtatsapiinille ei tunneta spesifisiä vastalääkkeitä.
Yliannostuksen hallinnassa on otettava huomioon useiden lääkkeiden vaikutus. Lääkärin tulee harkita yhteydenottoa myrkytystietokeskukseen saadakseen lisätietoa yliannostuksen hoidosta. Sertifioitujen myrkytystietokeskusten puhelinnumerot on lueteltu Physicians' Desk Reference (PDR) -luettelossa.
VASTA-AIHEET
Yliherkkyys
REMERON (mirtatsapiini) -tabletit ovat vasta-aiheisia potilaille, joilla on tunnettu yliherkkyys mirtatsapiinille tai jollekin apuaineista.
Monoamiinioksidaasin estäjät
Psykiatristen häiriöiden hoitoon tarkoitettujen monoamiinioksidaasin estäjien (MAO-estäjien) käyttö REMERON 15 mg -tableteilla tai 14 päivän sisällä REMERON 15 mg -hoidon lopettamisesta on vasta-aiheista, koska serotoniinioireyhtymän riski on lisääntynyt. REMERON 15 mg:n käyttö 14 päivän sisällä psykiatristen häiriöiden hoitoon tarkoitetun MAO-estäjän käytön lopettamisesta on myös vasta-aiheista (ks. VAROITUKSET ja ANNOSTELU JA HALLINNOINTI ).
REMERON-hoidon aloittaminen potilaalla, jota hoidetaan MAO-estäjillä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä, on myös vasta-aiheista, koska se lisää serotoniinioireyhtymän riskiä (ks. VAROITUKSET ja ANNOSTELU JA HALLINNOINTI ).
KLIININEN FARMAKOLOGIA
Farmakodynamiikka
REMERON (mirtatsapiini) -tablettien, kuten muidenkin vakavan masennushäiriön hoidossa tehokkaiden lääkkeiden, vaikutusmekanismia ei tunneta.
Prekliinisissä tutkimuksissa kerätty näyttö viittaa siihen, että mirtatsapiini voimistaa sentraalista noradrenergistä ja serotonergistä aktiivisuutta. Nämä tutkimukset ovat osoittaneet, että mirtatsapiini toimii antagonistina sentraalisissa presynaptisissa α2-adrenergisiä inhiboivia autoreseptoreja ja heteroreseptoreja kohtaan, minkä oletetaan johtavan sentraalisen noradrenergisen ja serotonergisen aktiivisuuden lisääntymiseen.
Mirtatsapiini on voimakas 5-HT2- ja 5-HT3-reseptorien antagonisti. Mirtatsapiinilla ei ole merkittävää affiniteettia 5-HT1A- ja 5-HT1B-reseptoreihin.
Mirtatsapiini on voimakas histamiini (H1) -reseptorien antagonisti, mikä saattaa selittää sen huomattavat rauhoittavat vaikutukset.
Mirtatsapiini on kohtalainen perifeerinen α-adrenerginen antagonisti, ominaisuus, joka voi selittää satunnaisen ortostaattisen hypotension, joka on raportoitu sen käytön yhteydessä.
Mirtatsapiini on kohtalainen muskariinireseptoreiden antagonisti, mikä saattaa selittää sen käyttöön liittyvien antikolinergisten sivuvaikutusten suhteellisen alhaisen esiintyvyyden.
Farmakokinetiikka
REMERON (mirtatsapiini) -tabletit imeytyvät nopeasti ja täydellisesti suun kautta annetun annon jälkeen, ja niiden puoliintumisaika on noin 20-40 tuntia. Plasman huippupitoisuudet saavutetaan noin 2 tunnin kuluessa suun kautta otetun annoksen jälkeen. Ruoan läsnäolo mahalaukussa vaikuttaa minimaalisesti sekä imeytymisnopeuteen että -asteeseen, eikä se vaadi annostuksen säätämistä.
Mirtatsapiini metaboloituu laajalti suun kautta annetun annon jälkeen. Tärkeimmät biotransformaatioreitit ovat demetylaatio ja hydroksylaatio, jota seuraa glukuronidikonjugaatio. Ihmisen maksan mikrosomeista saadut in vitro -tiedot osoittavat, että sytokromi 2D6 ja 1A2 osallistuvat mirtatsapiinin 8-hydroksimetaboliitin muodostumiseen, kun taas sytokromi 3A:n katsotaan olevan vastuussa N-desmetyyli- ja N-oksidimetaboliitin muodostumisesta. Mirtatsapiinin absoluuttinen hyötyosuus on noin 50 %. Se erittyy pääasiassa virtsaan (75 %) ja 15 % ulosteeseen. Useilla konjugoimattomilla metaboliiteilla on farmakologista aktiivisuutta, mutta niitä on plasmassa hyvin vähän. (-)-enantiomeerin eliminaation puoliintumisaika on noin kaksi kertaa pidempi kuin (+)-enantiomeerin, ja siksi se saavuttaa plasmatasot, jotka ovat noin 3 kertaa korkeammat kuin (+)-enantiomeerin.
Plasman tasot ovat lineaarisesti suhteessa annokseen 15-80 mg:n annosalueella. Mirtatsapiinin keskimääräinen eliminaation puoliintumisaika suun kautta annetun annon jälkeen vaihtelee noin 20-40 tunnin välillä eri ikä- ja sukupuolialaryhmissä. Kaiken ikäisten naisten eliminaation puoliintumisajat ovat merkittävästi pidemmät kuin miehillä (keskimääräinen puoliintumisaika naisilla 37 tuntia vs. 26 tuntia). miehille). Mirtatsapiinin vakaan tilan plasmapitoisuudet saavutetaan 5 vuorokaudessa noin 50 %:n kumulaatiolla (kertymissuhde = 1,5).
Mirtatsapiinista noin 85 % sitoutuu plasman proteiineihin pitoisuuksilla 0,01-10 mikrog/ml.
Erikoispopulaatiot
Geriatric
Kun REMERON (mirtatsapiini) -tabletteja annettiin suun kautta 20 mg/vrk 7 päivän ajan eri-ikäisille (25-74-vuotiaille) koehenkilöille, mirtatsapiinin oraalinen puhdistuma väheni vanhuksilla verrattuna nuorempiin koehenkilöihin. Erot olivat silmiinpistävimmät miehillä, 40 % pienempi puhdistuma iäkkäillä miehillä kuin nuoremmilla miehillä, kun taas iäkkäillä naisilla puhdistuma oli vain 10 % pienempi kuin nuoremmilla naisilla. Varovaisuutta on noudatettava annettaessa REMERON 30 mg iäkkäille potilaille (ks VAROTOIMENPITEET ja ANNOSTELU JA HALLINNOINTI ).
Pediatria
Mirtatsapiinin turvallisuutta ja tehokkuutta lapsipotilailla ei ole varmistettu (ks VAROTOIMENPITEET ).
Sukupuoli
Mirtatsapiinin keskimääräinen eliminaation puoliintumisaika suun kautta annetun annon jälkeen vaihtelee noin 20–40 tunnin välillä eri ikä- ja sukupuolialaryhmissä, ja kaiken ikäisillä naisilla on merkittävästi pidemmät eliminaation puoliintumisajat kuin miehillä (keskimääräinen puoliintumisaika naisilla 37 tuntia vs. 26 tuntia miehille) (katso Farmakokinetiikka ).
Rotu
Ei ole tehty kliinisiä tutkimuksia rodun vaikutuksen arvioimiseksi REMERONin farmakokinetiikkaan.
Munuaisten vajaatoiminta
Mirtatsapiinin jakautumista tutkittiin potilailla, joilla oli eriasteinen munuaisten toiminta. Mirtatsapiinin eliminaatio korreloi kreatiniinipuhdistuman kanssa. Mirtatsapiinin kokonaispuhdistuma väheni noin 30 % potilailla, joilla oli kohtalainen (Clcr=11 - 39 ml/min/1,73 m²) ja noin 50 % potilailla, joilla oli vaikea (Clcr= VAROTOIMENPITEET ja ANNOSTELU JA HALLINNOINTI ).
Maksan vajaatoiminta
Yhden 15 mg:n suun kautta otettavan REMERON-annoksen jälkeen mirtatsapiinin oraalinen puhdistuma pieneni noin 30 % potilailla, joilla on maksan vajaatoiminta, verrattuna potilaisiin, joilla oli normaali maksan toiminta. Varovaisuutta on noudatettava annettaessa REMERONia potilaille, joiden maksan toiminta on heikentynyt (ks VAROTOIMENPITEET ja ANNOSTELU JA HALLINNOINTI ).
Kliiniset tutkimukset osoittavat tehokkuutta
REMERON (mirtatsapiini) -tablettien teho suuren masennushäiriön hoitona vahvistettiin neljässä lumekontrolloidussa 6 viikon tutkimuksessa aikuisilla avohoitopotilailla, jotka täyttivät vakavan masennuksen DSM-III-kriteerit. Potilaille titrattiin mirtatsapiiniannos 5–35 mg/vrk. Kaiken kaikkiaan nämä tutkimukset osoittivat mirtatsapiinin olevan lumelääkettä parempi vähintään kolmella seuraavista neljästä mittauksesta: 21-item Hamilton Depression Rating Scale (HDRS) kokonaispistemäärä; HDRS masentunut mieliala kohde; CGI:n vakavuuspisteet; sekä Montgomeryn ja Asbergin masennuksen luokitusasteikko (MADRS). Mirtatsapiinin parempana lumelääkkeeseen verrattuna havaittiin myös tietyt HDRS:n tekijät, mukaan lukien ahdistuneisuus/somatisaatiotekijä ja unihäiriötekijä. Keskimääräinen mirtatsapiiniannos potilailla, jotka suorittivat nämä 4 tutkimusta, vaihteli välillä 21-32 mg/vrk. Viidennessä samankaltaisessa tutkimuksessa käytettiin suurempaa annosta (jopa 50 mg) päivässä, ja se osoitti myös tehokkuutta.
Väestön ikä- ja sukupuolialaryhmien tarkastelu ei paljastanut mitään eroavaa vastetta näiden alaryhmien perusteella.
Pitkäaikaisessa tutkimuksessa potilaat, jotka täyttivät vakavan masennuksen kriteerit (DSM-IV) ja jotka olivat reagoineet ensimmäisten 8–12 viikon akuutin REMERON-hoidon aikana 30 mg:lla, satunnaistettiin jatkamaan REMERON 15 mg:n tai lumelääkettä enintään 40 viikon ajan. havainnointi uusiutumisen varalta. Avoimen vaiheen vaste määriteltiin saavuttaneen HAM-D 17 -kokonaispistemäärän ≤ 8 ja CGI-parantumispisteen 1 tai 2 kahdella peräkkäisellä käynnillä alkaen viikosta 6 avoimen vaiheen 8-12 viikon aikana. tutkimuksesta. Yksittäiset tutkijat määrittelivät uusiutumisen kaksoissokkovaiheen aikana. Potilailla, jotka saivat jatkuvaa REMERON 30 mg -hoitoa, uusiutumisen määrä oli huomattavasti pienempi seuraavien 40 viikon aikana verrattuna lumelääkettä saaneisiin potilaisiin. Tämä malli osoitettiin sekä mies- että naispotilailla.
POTILASTIEDOT
REMERON® (rem' - e - ron) (mirtatsapiini) Tabletit
Mikä on tärkein tieto, joka minun pitäisi tietää REMERON®ista?
REMERON 15 mg ja muut masennuslääkkeet voivat aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
1. Itsetuhoiset ajatukset tai teot :
- REMERON 30 mg ja muut masennuslääkkeet voivat lisätä itsemurha-ajatuksia tai -toimia joillakin lapsilla, teini-ikäisillä tai nuorilla aikuisilla hoidon ensimmäisten kuukausien aikana tai kun annosta muutetaan.
- Masennus tai muut vakavat mielenterveysongelmat ovat tärkeimmät syyt itsemurha-ajatuksiin tai -toimiin.
- Tarkkaile näitä muutoksia ja soita heti terveydenhuollon tarjoajallesi, jos huomaat:
- Uudet tai äkilliset muutokset mielialassa, käyttäytymisessä, toimissa, ajatuksissa tai tunteissa, varsinkin jos ne ovat vakavia.
- Kiinnitä erityistä huomiota tällaisiin muutoksiin, kun REMERON-hoito aloitetaan tai annosta muutetaan.
Pidä kaikki seurantakäynnit terveydenhuollon tarjoajan kanssa ja soita käyntien välillä, jos olet huolissasi oireista.
Soita välittömästi terveydenhuollon tarjoajallesi, jos sinulla on jokin seuraavista oireista, tai soita hätänumeroon, varsinkin jos ne ovat uusia, pahempia tai huolestuttavia:
- yrittää itsemurhaa
- vaarallisten impulssien vaikutuksesta
- käyttäytyy aggressiivisesti tai väkivaltaisesti
- ajatuksia itsemurhasta tai kuolemasta
- uusi tai pahempi masennus
- uusia tai pahempia ahdistuneisuus- tai paniikkikohtauksia
- kiihtyneisyys, levottomuus, vihaisuus tai ärtyneisyys
- nukahtamisvaikeuksia
- aktiivisuuden lisääntyminen tai puhuminen enemmän kuin sinulle on normaalia
- muita epätavallisia muutoksia käyttäytymisessä tai mielialassa
Soita heti terveydenhuollon tarjoajallesi, jos sinulla on jokin seuraavista oireista, tai soita hätänumeroon 911. REMERON saattaa liittyä näihin vakaviin sivuvaikutuksiin:
2. Maaniset jaksot:
- lisääntynyt huomattavasti energiaa
- huolimaton käytös
- puhua enemmän tai nopeammin kuin tavallisesti
- vakavia unihäiriöitä
- epätavallisen mahtavia ideoita
- kilpailevia ajatuksia
- liiallinen onnellisuus tai ärtyneisyys
3. Vähentynyt valkosolujen määrä kutsutaan neutrofiileiksi, joita tarvitaan torjumaan infektioita. Kerro lääkärillesi, jos sinulla on merkkejä infektiosta, kuten kuume, vilunväristykset, kurkkukipu tai suun tai nenän haavaumat, erityisesti flunssan kaltaiset oireet.
4. Serotoniinioireyhtymä. Tämä tila voi olla hengenvaarallinen ja voi sisältää:
- kiihtyneisyys, hallusinaatiot, kooma tai muut mielentilan muutokset
- syke, korkea tai matala verenpaine
- pahoinvointia, oksentelua tai ripulia
- koordinaatiohäiriöt tai lihasnykitykset (yliaktiiviset refleksit)
- hikoilu tai kuume
- lihasten jäykkyys
5. Visuaaliset ongelmat
- silmän kipu
- muutoksia näkökyvyssä
- turvotus tai punoitus silmässä tai sen ympärillä
Vain jotkut ihmiset ovat vaarassa saada nämä ongelmat. Haluat ehkä käydä silmätutkimuksessa nähdäksesi, oletko vaarassa, ja saada ehkäisevää hoitoa, jos olet.
6. Kohtaukset
7. Alhaiset suola- (natrium-) tasot veressä.
Iäkkäät ihmiset voivat olla alttiimpia tälle. Oireita voivat olla:
- päänsärky
- sekavuus, keskittymis- tai ajattelu- tai muistiongelmat
- heikkous tai epävakaus
8. Uneliaisuus. On parasta ottaa REMERON lähellä nukkumaanmenoa.
9. Vakavat ihoreaktiot: Soita lääkärillesi välittömästi, jos sinulla on jokin tai kaikki seuraavista oireista:
- vaikea ihottuma, johon liittyy ihon turvotusta (mukaan lukien kämmenissä ja jalkapohjissa)
- kivulias ihon punoitus, rakkuloita tai haavaumia kehossa tai suussa
10. Vakavat allergiset reaktiot: hengitysvaikeudet, kasvojen, kielen, silmien tai suun turvotus
- ihottuma, kutisevat nokkosihottumat tai rakkulat yksinään tai kuumeen tai nivelkipujen kanssa
11. Lisääntynyt ruokahalu tai paino. Lasten ja nuorten pituutta ja painoa tulee seurata hoidon aikana.
12. Veren kolesteroli- ja triglyseridipitoisuudet
Älä ota REMERON 15 mg:aa keskustelematta ensin terveydenhuollon tarjoajan kanssa. REMERON 15 mg:n liian nopea lopettaminen voi aiheuttaa mahdollisesti vakavia oireita, kuten:
- huimaus
- väsymys
- kihelmöintiä
- epänormaalit unet
- hämmennystä
- pahoinvointi oksentelu
- agitaatiota
- päänsärky
- hikoilu
- ahdistusta
- vapina
Mikä on REMERON 15 mg?
REMERON 15mg on reseptilääke, jota käytetään masennuksen hoitoon. On tärkeää keskustella terveydenhuollon tarjoajan kanssa masennuksen hoidon riskeistä ja myös riskeistä, jos sitä ei hoideta. Sinun tulee keskustella kaikista hoitovaihtoehdoista terveydenhuollon tarjoajan kanssa.
Keskustele terveydenhuollon tarjoajan kanssa, jos et usko, että tilasi paranee REMERON-hoidon myötä.
Kuka ei saa ottaa REMERON 15 mg -valmistetta?
Älä ota REMERONia:
- jos olet allerginen mirtatsapiinille tai jollekin REMERONin aineosalle. Katso tämän lääkitysoppaan lopusta täydellinen luettelo REMERONin ainesosista.
- jos käytät monoamiinioksidaasin estäjää (MAOI). Kysy terveydenhuollon tarjoajalta tai apteekista, jos et ole varma, käytätkö MAO-estäjää, mukaan lukien antibiootti linetsolidi.
- Älä ota MAO-estäjää 2 viikon kuluessa REMERON-hoidon lopettamisesta, ellei terveydenhuollon tarjoajasi kehota tekemään niin.
- Älä aloita REMERON-hoitoa, jos olet lopettanut MAO-estäjän käytön viimeisen 2 viikon aikana, ellei terveydenhuollon tarjoajasi kehota tekemään niin.
Ihmisillä, jotka ottavat REMERON 15 mg:aa lähellä MAO-estäjän käyttöä ajoissa, voi olla vakavia tai jopa hengenvaarallisia sivuvaikutuksia. Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin seuraavista oireista:
- korkea kuume
- nopeat sydämen sykkeen tai verenpaineen muutokset
- hallitsemattomat lihasspasmit
- hämmennystä
- jäykät lihakset
- tajunnan menetys (pyörtyminen)
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen REMERONin ottamista?
Ennen kuin otat REMERONia, kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, mukaan lukien jos:
- käytät tiettyjä lääkkeitä, kuten:
- Triptaanit, joita käytetään migreenipäänsäryn hoitoon
- Lääkkeet, joita käytetään mielialan, ahdistuneisuuden, psykoottisten tai ajatushäiriöiden hoitoon, mukaan lukien trisykliset lääkkeet, litium, SSRI:t, SNRI:t tai psykoosilääkkeet
- Tramadolia käytetään kivun hoitoon
- Reseptivapaat lisäravinteet, kuten tryptofaani tai mäkikuisma
- Fenytoiini, karbamatsepiini tai rifampisiini (nämä lääkkeet voivat alentaa veren REMERON-tasoa)
- Simetidiini tai ketokonatsoli (nämä lääkkeet voivat nostaa veren REMERON-pitoisuutta)
- Lääkkeet, jotka voivat vaikuttaa sydämesi rytmiin (kuten tietyt antibiootit ja jotkin psykoosilääkkeet)
- on tai ollut:
- maksaongelmia
- munuaisongelmia
- sydänongelmia tai tiettyjä tiloja, jotka voivat muuttaa sydämesi rytmiä
- kohtauksia tai kouristuksia
- kaksisuuntainen mielialahäiriö tai mania
- taipumus huimautua tai pyörtyä
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, vahingoittaako REMERON sikiötäsi. Keskustele terveydenhuollon tarjoajan kanssa masennuksen hoidon hyödyistä ja riskeistä raskauden aikana
- imetät tai aiot imettää. Osa REMERONista saattaa erittyä äidinmaitoon. Keskustele terveydenhuollon tarjoajan kanssa siitä, mikä on paras tapa ruokkia vauvasi REMERON-hoidon aikana
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät. REMERON ja jotkin lääkkeet voivat olla vuorovaikutuksessa keskenään, eivät ehkä toimi yhtä hyvin tai voivat aiheuttaa vakavia sivuvaikutuksia.
Terveydenhuollon tarjoaja tai apteekkihenkilökunta voi kertoa sinulle, onko REMERON 15 mg turvallista ottaa muiden lääkkeiden kanssa. Älä aloita tai lopeta mitään lääkettä REMERON-hoidon aikana keskustelematta ensin terveydenhuollon tarjoajan kanssa. Jos käytät REMERON 30mg -valmistetta, älä käytä muita mirtatsapiinia sisältäviä lääkkeitä, mukaan lukien REMERON 30mgSolTab®.
Miten minun pitäisi ottaa REMERON?
- Ota REMERON juuri niin kuin on määrätty. Terveydenhuollon tarjoajasi saattaa joutua muuttamaan REMERON 15 mg -annosta, kunnes se on oikea annos sinulle.
- Ota REMERON samaan aikaan joka päivä, mieluiten illalla nukkumaan mennessä.
- Niele REMERON 15 mg ohjeiden mukaan.
- On tavallista, että masennuslääkkeet, kuten REMERON, kestävät muutaman viikon ennen kuin alat tuntea olosi paremmaksi. Älä lopeta REMERON 15 mg:n käyttöä, jos et heti tunne tuloksia.
- Älä lopeta REMERON 15 mg:n ottamista tai muuta annosta keskustelematta ensin lääkärisi kanssa, vaikka tuntisit olosi paremmaksi.
- REMERON voidaan ottaa ruoan kanssa tai ilman.
- Jos unohdat ottaa REMERON 30 mg -annoksen, ota unohtunut annos heti kun muistat. Jos on melkein seuraavan annoksen aika, jätä unohtunut annos väliin ja ota seuraava annos tavalliseen aikaan. Älä ota kahta REMERON 15 mg annosta samanaikaisesti.
- Jos otat liikaa REMERON 15 mg, soita heti terveydenhuollon tarjoajalle tai myrkytystietokeskukseen tai hakeudu ensiapuun. REMERONin (ilman muita lääkkeitä tai alkoholia) yliannostuksen merkkejä ovat:
- hämmennystä,
- muistiongelmia
- uneliaisuus
- lisääntynyt syke.
Mahdollisen yliannostuksen oireita voivat olla sydämen rytmimuutokset (nopea, epäsäännöllinen syke) tai pyörtyminen, jotka voivat olla oireita hengenvaarallisesta tilasta, joka tunnetaan nimellä Torsades de Pointes.
Mitä minun tulee välttää REMERON 15mg -hoidon aikana?
- REMERON voi aiheuttaa uneliaisuutta tai vaikuttaa kykyysi tehdä päätöksiä, ajatella selkeästi tai reagoida nopeasti. Älä aja, käytä raskaita koneita tai tee muuta vaarallista toimintaa, ennen kuin tiedät, kuinka REMERON vaikuttaa sinuun.
- Vältä alkoholin juomista tai diatsepaamin (esimerkiksi ahdistuneisuuteen, unettomuuteen ja kouristuskohtauksiin käytettävä lääke) tai vastaavien lääkkeiden käyttöä REMERON-hoidon aikana. Jos olet epävarma siitä, voidaanko tiettyjä lääkkeitä ottaa REMERON 30 mg:n kanssa, keskustele asiasta lääkärisi kanssa.
Mitkä ovat REMERONin mahdolliset sivuvaikutukset?
REMERON voi aiheuttaa vakavia sivuvaikutuksia:
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää REMERONista?"
REMERONin yleisimpiä sivuvaikutuksia ovat:
- uneliaisuus
- ummetus
- lisääntynyt ruokahalu
- huimaus
- painonnousu
- suun kuivuminen epänormaalit unet
Nämä eivät ole kaikkia REMERONin mahdollisia sivuvaikutuksia.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi repiä REMERON?
- Säilytä REMERON 15 mg huoneenlämmössä 20 °C - 25 °C (68 °F - 77 °F).
- Pidä REMERON 15 mg poissa valolta.
- Pidä REMERON 30 mg pullo tiiviisti suljettuna.
Pidä REMERON 30 mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa REMERONin turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä REMERON 15 mg:aa sairauteen, johon sitä ei ole määrätty. Älä anna REMERONia muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä. Voit kysyä apteekista tai terveydenhuollon tarjoajalta tietoja REMERON 30 mg:sta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Mitä ainesosia REMERON 15mg sisältää?
Aktiivinen ainesosa: mirtatsapiini
Inaktiiviset ainesosat:
- 15 mg tabletit: Tärkkelys (maissi), hydroksipropyyliselluloosa, magnesiumstearaatti, kolloidinen piidioksidi, laktoosi, hypromelloosi, polyetyleeniglykoli 8000, titaanidioksidi, rautaoksidi (keltainen).
- 30 mg tabletit: Tärkkelys (maissi), hydroksipropyyliselluloosa, magnesiumstearaatti, kolloidinen piidioksidi, laktoosi, hypromelloosi, polyetyleeniglykoli 8000, titaanidioksidi, rautaoksidi (keltainen), rautaoksidi (punainen).
- 45 mg tabletit: Tärkkelys (maissi), hydroksipropyyliselluloosa, magnesiumstearaatti, kolloidinen piidioksidi, laktoosi, hypromelloosi, polyetyleeniglykoli 8000, titaanidioksidi.
