Effexor 37.5mg, 75mg Venlafaxine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
POTILASTIEDOT
Effexor (venlafaksiini) (ven-la-fax-een) Tabletit, USP
Lue venlafaksiinitablettien mukana toimitettu lääkitysopas, USP, ennen kuin aloitat sen käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Tämä lääkitysopas ei korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi. Keskustele terveydenhuollon tarjoajan kanssa, jos et ymmärrä jotain tai haluat oppia lisää.
Mikä on tärkein tieto, joka minun pitäisi tietää Venlafaxine-tableteista, USP?
Venlafaksiinitabletit, USP ja muut masennuslääkkeet voivat aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
1. Itsetuhoiset ajatukset tai teot:
- Venlafaksiinitabletit, USP ja muut masennuslääkkeet voivat lisätä itsemurha-ajatuksia tai -toimia joillakin lapsilla, teini-ikäisillä tai nuorilla aikuisilla hoidon ensimmäisten kuukausien aikana tai kun annosta muutetaan.
- Masennus tai muut vakavat mielenterveysongelmat ovat tärkeimmät syyt itsemurha-ajatuksiin tai -toimiin.
- Tarkkaile näitä muutoksia ja soita heti terveydenhuollon tarjoajallesi, jos huomaat:
- Uudet tai äkilliset muutokset mielialassa, käyttäytymisessä, toimissa, ajatuksissa tai tunteissa, varsinkin jos ne ovat vakavia.
- Kiinnitä erityistä huomiota tällaisiin muutoksiin, kun venlafaksiinitabletit, USP aloitetaan tai annosta muutetaan.
Pidä kaikki seurantakäynnit terveydenhuollon tarjoajan kanssa ja soita käyntien välillä, jos olet huolissasi oireista.
Soita välittömästi terveydenhuollon tarjoajallesi, jos sinulla on jokin seuraavista oireista, tai soita hätänumeroon, varsinkin jos ne ovat uusia, pahempia tai huolestuttavia:
- yrittää itsemurhaa
- vaarallisten impulssien vaikutuksesta
- käyttäytyy aggressiivisesti tai väkivaltaisesti
- ajatuksia itsemurhasta tai kuolemasta
- uusi tai pahempi masennus
- uusia tai pahempia ahdistuneisuus- tai paniikkikohtauksia
- kiihtyneisyys, levottomuus, vihaisuus tai ärtyneisyys
- nukahtamisvaikeuksia
- aktiivisuuden lisääntyminen tai puhuminen enemmän kuin sinulle on normaalia
- muita epätavallisia muutoksia käyttäytymisessä tai mielialassa
Soita heti terveydenhuollon tarjoajallesi, jos sinulla on jokin seuraavista oireista, tai soita hätänumeroon 911. Venlafaxine Tablets, USP voi liittyä näihin vakaviin sivuvaikutuksiin:
2. Serotoniinioireyhtymä
Tämä tila voi olla hengenvaarallinen ja voi sisältää:
- kiihtyneisyys, hallusinaatiot, kooma tai muut mielentilan muutokset
- koordinaatiohäiriöt tai lihasnykitykset (yliaktiiviset refleksit)
- syke, korkea tai matala verenpaine
- hikoilu tai kuume
- pahoinvointia, oksentelua tai ripulia
- lihasten jäykkyys
3. Verenpaineen muutokset. Venlafaxine Tablets, USP voi:
- nosta verenpainettasi. Hallitse korkeaa verenpainetta ennen hoidon aloittamista ja seuraa verenpainetta säännöllisesti
4. Suurentuneet pupillit (mydriaasi).
5. Ahdistuneisuus ja unettomuus.
6. Muutokset ruokahalussa tai painossa.
- lasten ja nuorten pituutta ja painoa tulee seurata hoidon aikana
7. Maaniset/hypomaaniset jaksot:
- lisääntynyt huomattavasti energiaa
- vakavia unihäiriöitä
- kilpailevia ajatuksia
- huolimaton käytös
- epätavallisen mahtavia ideoita
- liiallinen onnellisuus tai ärtyneisyys
- puhua enemmän tai nopeammin kuin tavallisesti
8. Alhaiset suola- (natrium-) tasot veressä.
Iäkkäät ihmiset voivat olla alttiimpia tälle. Oireita voivat olla:
- päänsärky
- heikkous tai epävakaus
- sekavuus, keskittymis- tai ajattelu- tai muistiongelmat
9. Kohtaukset tai kouristukset.
10. Epänormaali verenvuoto: venlafaksiinitabletit, USP ja muut masennuslääkkeet voivat lisätä verenvuodon tai mustelmien riskiä, varsinkin jos käytät verta ohentavaa varfariinia (Coumadin®, Jantoven®), ei-steroidista tulehduskipulääkettä (NSAID:t, kuten ibuprofeeni tai naprokseeni) tai aspiriini.
11. Kohonnut kolesteroli.
12. Keuhkosairaus ja keuhkokuume: venlafaksiinitabletit, USP voivat aiheuttaa harvinaisia keuhko-ongelmia. Oireita ovat:
- paheneva hengenahdistus
- yskä
- epämukavuus rinnassa
13. Vakavat allergiset reaktiot:
- vaikeuksia hengittää
- kasvojen, kielen, silmien tai suun turvotus
- ihottuma, kutisevat nokkosihottumat tai rakkulat yksinään tai kuumeen tai nivelkipujen kanssa
14. Visuaaliset ongelmat:
- silmän kipu
- muutoksia näkökyvyssä
- turvotus tai punoitus silmässä tai sen ympärillä
Vain jotkut ihmiset ovat vaarassa saada nämä ongelmat. Haluat ehkä käydä silmätutkimuksessa nähdäksesi, oletko vaarassa, ja saada ehkäisevää hoitoa, jos olet.
Älä lopeta Venlafaxine Tablets, USP:n käyttöä keskustelematta ensin terveydenhuollon tarjoajan kanssa. Venlafaksiinitablettien lopettaminen, USP liian nopeasti tai toisesta masennuslääkkeestä liian nopeasti vaihtaminen voi aiheuttaa vakavia oireita, kuten:
- ahdistus, ärtyneisyys
- väsymys, levottomuus tai unihäiriöt
- päänsärky, hikoilu, huimaus
- sähköiskun kaltaiset tuntemukset, vapina, sekavuus, painajaiset
- oksentelu, pahoinvointi, ripuli
Mikä on Venlafaxine Tablets, USP?
Venlafaxine tablets, USP on reseptilääke, jota käytetään masennuksen hoitoon. On tärkeää keskustella terveydenhuollon tarjoajan kanssa masennuksen hoidon riskeistä ja myös riskeistä, jos sitä ei hoideta. Sinun tulee keskustella kaikista hoitovaihtoehdoista terveydenhuollon tarjoajan kanssa.
Keskustele terveydenhuollon tarjoajan kanssa, jos et usko, että tilasi paranee venlafaksiinitablettien, USP-hoidon, avulla.
Kuka ei saa ottaa Venlafaxine-tabletteja, USP?
- Älä ota venlafaksiinitabletteja, USP, jos:
- olet allerginen venlafaksiinitableteille, USP:lle tai jollekin venlafaksiinitablettien, USP:n aineosalle. Katso tämän lääkitysoppaan lopusta täydellinen luettelo venlafaksiinitablettien ainesosista, USP.
- sinulla on hallitsematon ahdaskulmaglaukooma
- ota monoamiinioksidaasin estäjää (MAOI). Kysy terveydenhuollon tarjoajalta tai apteekista, jos et ole varma, käytätkö MAO-estäjää, mukaan lukien antibiootti linetsolidi.
- Älä ota MAOI:ta 7 päivän kuluessa venlafaksiinitablettien lopettamisesta, USP, ellei lääkärisi ole niin määrännyt.
- Älä aloita venlafaksiinitabletteja, USP, jos olet lopettanut MAOI:n käytön viimeisen 2 viikon aikana, ellei lääkärisi ole niin määrännyt.
Ihmisillä, jotka ottavat Venlafaxine-tabletteja, USP lähellä MAOI:ta, voi olla vakavia tai jopa hengenvaarallisia sivuvaikutuksia. Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin näistä oireista:
- korkea kuume
- hallitsemattomat lihasspasmit
- jäykät lihakset
- nopeat sydämen sykkeen tai verenpaineen muutokset
- hämmennystä
- tajunnan menetys (pyörtyminen)
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen Venlafaxine Tablets, USP:n ottamista? Kysy, jos et ole varma.
Ennen kuin aloitat venlafaxine-tablettien, USP:n, kerro terveydenhuollon tarjoajallesi, jos:
- Käytätkö tiettyjä lääkkeitä, kuten:
- Lääkkeet, joita käytetään migreenipäänsäryn hoitoon, kuten:
- triptaanit
- Lääkkeet, joita käytetään mielialan, ahdistuneisuuden, psykoottisten tai ajatushäiriöiden hoitoon, kuten:
- trisykliset masennuslääkkeet
- litium
- SSRI:t
- SNRI:t
- antipsykoottiset lääkkeet
- Kivun hoitoon käytettävät lääkkeet, kuten:
- tramadoli
- Lääkkeet, joita käytetään veren ohentamiseen, kuten:
- varfariini
- Närästyksen hoitoon käytettävät lääkkeet, kuten:
- Simetidiini
- Käsikauppalääkkeet tai lisäravinteet, kuten:
- Aspiriini tai muut tulehduskipulääkkeet
- Tryptofaani
- mäkikuisma
- on sydänongelmia
- on diabetes
- sinulla on maksaongelmia
- on munuaisongelmia
- sinulla on kilpirauhasen ongelmia
- on glaukooma
- sinulla on tai on ollut kohtauksia tai kouristuksia
- sinulla on kaksisuuntainen mielialahäiriö tai mania
- sinulla on alhainen natriumpitoisuus veressäsi
- on korkea verenpaine
- on korkea kolesteroli
- sinulla on tai on ollut verenvuotoongelmia
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, vahingoittavatko venlafaksiinitabletit, USP sikiötäsi. Keskustele terveydenhuollon tarjoajan kanssa masennuksen hoidon hyödyistä ja riskeistä raskauden aikana
- imetät tai aiot imettää. Jotkut venlafaksiinitabletit, USP, voivat kulkeutua rintamaitoon. Keskustele terveydenhuollon tarjoajasi kanssa parhaasta tavasta ruokkia vauvasi, kun käytät venlafaksiinitabletteja, USP.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät. Venlafaksiinitabletit, USP ja jotkut lääkkeet voivat olla vuorovaikutuksessa keskenään, eivät välttämättä toimi yhtä hyvin tai voivat aiheuttaa vakavia sivuvaikutuksia.
Terveydenhuollon tarjoaja tai apteekkihenkilökunta voi kertoa sinulle, onko turvallista ottaa venlafaksiinitabletteja, USP muiden lääkkeiden kanssa. Älä aloita tai lopeta mitään lääkettä, kun käytät venlafaksiinitabletteja, USP keskustelematta ensin terveydenhuollon tarjoajan kanssa.
Jos käytät venlafaksiinitabletteja, USP, älä ota muita lääkkeitä, jotka sisältävät (venlafaksiinia), mukaan lukien: venlafaksiini HCl.
Kuinka minun pitäisi ottaa Venlafaxine Tablets, USP?
- Ota venlafaksiinitabletit, USP täsmälleen kuten on määrätty. Terveydenhuollon tarjoajasi saattaa joutua muuttamaan venlafaksiinitablettien, USP, annosta, kunnes se on oikea annos sinulle.
- Venlafaxine-tabletit, USP on otettava ruoan kanssa.
- Jos unohdat annoksen venlafaksiinitabletteja, USP, ota unohtunut annos heti kun muistat. Jos on melkein seuraavan annoksen aika, jätä unohtunut annos väliin ja ota seuraava annos tavalliseen aikaan. Älä ota kahta annosta venlafaksiinitabletteja, USP samanaikaisesti.
- Jos otat liikaa venlafaksiinitabletteja, USP, soita heti terveydenhuollon tarjoajalle tai myrkytyskeskukseen tai hakeudu hätähoitoon.
- Kun vaihdat toisesta masennuslääkkeestä venlafaksiinitabletteihin, USP-lääkärisi saattaa haluta alentaa alkuperäisen masennuslääkkeen annosta ensin sivuvaikutusten välttämiseksi.
Mitä minun pitäisi välttää, kun käytän Venlafaxine-tabletteja, USP?
Venlafaxine-tabletit, USP voivat aiheuttaa uneliaisuutta tai vaikuttaa kykyysi tehdä päätöksiä, ajatella selkeästi tai reagoida nopeasti.
Älä aja, käytä raskaita koneita tai tee muuta vaarallista toimintaa, ennen kuin tiedät, kuinka venlafaxine-tabletit, USP vaikuttavat sinuun. Älä juo alkoholia, kun käytät venlafaksiinitabletteja, USP.
Mitkä ovat Venlafaxine-tablettien, USP, mahdolliset sivuvaikutukset?
Venlafaxine-tabletit, USP voivat aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää Venlafaxine-tableteista, USP?"
- Kohonnut kolesteroli – tarkista kolesteroliarvosi säännöllisesti
- Vastasyntyneillä, joiden äidit ottavat venlafaksiinitabletteja, USP kolmannella kolmanneksella, voi olla ongelmia heti syntymän jälkeen, mukaan lukien:
- syömis- ja hengitysongelmia
- kohtauksia
- vapina, ärtyneisyys tai jatkuva itku
- Kapeakulmaglaukooma/suurentuneet pupillit.
Tarkista silmänpaine säännöllisesti, jos:
- sinulla on ollut kohonnut silmänpaine
- ovat vaarassa sairastua tietyntyyppisiin glaukoomaan
Yleisiä mahdollisia sivuvaikutuksia ihmisillä, jotka käyttävät venlafaksiinitabletteja, USP ovat:
epätavallisia unia
- seksuaalisia ongelmia
- ruokahaluttomuus, ummetus, ripuli, pahoinvointi tai oksentelu tai suun kuivuminen
- väsynyt, väsynyt tai liian uninen
- unitottumusten muutos, unihäiriöt
- ammottava
- vapina tai vapina
- huimaus, näön hämärtyminen
- hikoilu
- ahdistuneisuus, hermostuneisuus tai hermostuneisuus
- päänsärky
- sykkeen nousu
Kerro terveydenhuollon tarjoajallesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei katoa.
Nämä eivät ole kaikkia venlafaksiinitablettien, USP, mahdollisia sivuvaikutuksia.
Lisätietoja saat terveydenhuollon tarjoajalta tai apteekista.
Soita Lääkärillesi HAITTAVAIKUTUKSIIN LIITTYVÄN LÄÄKETIETEELLISEN NEUVON saamiseksi. VOI ILMOITTAA HAITTAVAIKUTUKSISTA FDA:LLE NUMEROON 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää Venlafaxine Tablets, USP?
- Säilytä 20° - 25°C (68° - 77°F) sallitut kierrokset 15° - 30°C (59 - 86°F) [Katso USP-ohjattu huonelämpötila ].
- Säilytä velafaksiinitabletit, USP kuivassa paikassa.
Pidä Venlafaxine-tabletit, USP ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa venlafaksiinitableteista, USP Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä venlafaksiinitabletteja, USP, sairauteen, johon sitä ei ole määrätty. Älä anna venlafaksiinitabletteja, USP muille ihmisille, vaikka heillä olisi sama sairaus. Se voi vahingoittaa heitä.
Tämä lääkitysopas sisältää yhteenvedon tärkeimmistä tiedoista venlafaksiinitableteista, USP. Jos haluat lisätietoja, keskustele terveydenhuollon tarjoajasi kanssa. Voit kysyä terveydenhuollon tarjoajaltasi tai apteekista tietoja venlafaksiinitableteista, USP, joka on kirjoitettu terveydenhuollon ammattilaisille.
Ilmoita EpäILLEISTÄ HAITTAVAIKUTUKSISTA ottamalla yhteyttä Sun Pharmaceutical Industries, Inc:iin numeroon 1-800-818-4555.
Mitkä ovat Venlafaxine-tablettien, USP:n aineosat?
Vaikuttava aine: (venlafaksiini)
Inaktiiviset ainesosat:
- Tabletit: mikrokiteinen selluloosa, laktoosimonohydraatti, esigelatinoitu tärkkelys, natriumtärkkelysglykolaatti, rautaoksidi punainen, keltainen rautaoksidi, kolloidinen piidioksidi ja magnesiumstearaatti
Yhdysvaltain elintarvike- ja lääkevirasto on hyväksynyt tämän lääkitysoppaan kaikille masennuslääkkeille.
INDIKAATIOT
Masennustila
Effexor XR (venlafaksiinihydrokloridi) pitkitetysti vapauttavat kapselit on tarkoitettu vakavan masennushäiriön (MDD) hoitoon. Teho vahvistettiin kolmessa lyhytaikaisessa (4, 8 ja 12 viikkoa) ja kahdessa pitkäaikaisessa ylläpitotutkimuksessa.
Yleistynyt ahdistuneisuushäiriö
Effexor XR on tarkoitettu yleistyneen ahdistuneisuushäiriön (GAD) hoitoon. Teho vahvistettiin kahdessa 8 viikkoa ja kahdessa 26 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa.
Sosiaalinen ahdistuneisuushäiriö
Effexor XR on tarkoitettu sosiaalisen ahdistuneisuushäiriön (SAD), joka tunnetaan myös nimellä sosiaalinen fobia, hoitoon. Teho vahvistettiin neljässä 12 viikkoa ja yhdessä 26 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa.
Paniikkihäiriö
Effexor XR on tarkoitettu paniikkihäiriön (PD) hoitoon agorafobian kanssa tai ilman. Teho vahvistettiin kahdessa 12 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa.
ANNOSTELU JA HALLINNOINTI
Effexor 37,5 mg XR tulee antaa yhtenä annoksena ruoan kanssa, joko aamulla tai illalla suunnilleen samaan aikaan joka päivä [ks. KLIININEN FARMAKOLOGIA ]. Jokainen kapseli tulee niellä kokonaisena nesteen kera, eikä sitä saa jakaa, murskata, pureskella tai laittaa veteen, tai se voidaan antaa avaamalla kapseli varovasti ja ripottelemalla koko sisältö lusikalliseen omenasosetta. Tämä lääke/ruokaseos tulee niellä välittömästi pureskelematta ja sen jälkeen juoda lasillinen vettä, jotta pelletit (pallot) niellään täydellisesti.
Masennustila
Useimmille potilaille Effexor 37,5 mg XR:n suositeltu aloitusannos on 75 mg vuorokaudessa yhtenä annoksena. Joillekin potilaille voi olla toivottavaa aloittaa annoksella 37,5 mg vuorokaudessa 4–7 päivän ajan, jotta uudet potilaat voivat sopeutua lääkitykseen ennen kuin annoksen nostaminen 75 mg:aan päivässä. Potilaat, jotka eivät reagoi alkuperäiseen 75 mg:n vuorokausiannokseen, voivat hyötyä annoksen nostamisesta enintään 225 mg:aan vuorokaudessa. Annosta tulee suurentaa aina 75 mg:aan asti vuorokaudessa tarpeen mukaan ja vähintään 4 päivän välein, koska venlafaksiinin ja sen tärkeimpien metaboliittien vakaan tilan plasmatasot saavutetaan useimmilla potilailla 4. päivään mennessä. [katso KLIININEN FARMAKOLOGIA ]. Kliinisissä tutkimuksissa, joissa vahvistettiin tehoa, titraus ylöspäin sallittiin vähintään 2 viikon välein.
On huomattava, että vaikka suurin suositeltu annos keskivaikeasti masentuneille avohoitopotilaille on myös 225 mg päivässä Effexorille (välittömästi vapautuva), vakavammin masentuneet laitospotilaat reagoivat yhdessä kyseisen tuotteen kehitysohjelman tutkimuksessa keskimääräiseen annokseen 350 mg päivässä (vaihteluväli 150-375 mg päivässä). Ei tiedetä, tarvitaanko suurempia Effexor 37,5 mg XR -annoksia vaikeammin masentuneille potilaille. Kokemukset Effexor 75 mg XR -annoksilla, jotka ovat suurempia kuin 225 mg vuorokaudessa, ovat kuitenkin hyvin rajalliset.
Yleistynyt ahdistuneisuushäiriö
Useimmille potilaille suositeltu Effexor XR:n aloitusannos on 75 mg vuorokaudessa yhtenä annoksena. Joillekin potilaille voi olla toivottavaa aloittaa annoksella 37,5 mg vuorokaudessa 4–7 päivän ajan, jotta uudet potilaat voivat sopeutua lääkitykseen ennen kuin annoksen nostaminen 75 mg:aan päivässä. Potilaat, jotka eivät reagoi alkuperäiseen 75 mg:n vuorokausiannokseen, voivat hyötyä annoksen nostamisesta enintään 225 mg:aan vuorokaudessa. Annosta tulee suurentaa aina 75 mg:aan asti vuorokaudessa tarpeen mukaan ja vähintään 4 päivän välein, koska venlafaksiinin ja sen tärkeimpien metaboliittien vakaan tilan plasmatasot saavutetaan useimmilla potilailla 4. päivään mennessä. [katso KLIININEN FARMAKOLOGIA ].
Sosiaalinen ahdistuneisuushäiriö (sosiaalinen fobia)
Suositeltu annos on 75 mg vuorokaudessa yhtenä annoksena. Ei ollut näyttöä siitä, että suuremmista annoksista olisi lisähyötyä.
Paniikkihäiriö
Suositeltu aloitusannos on 37,5 mg päivässä Effexor 75 mg XR:ää 7 päivän ajan. Potilaat, jotka eivät reagoi 75 mg:aan vuorokaudessa, voivat hyötyä annoksen nostamisesta enintään noin 225 mg:aan vuorokaudessa. Annosta tulee suurentaa aina 75 mg:aan asti vuorokaudessa tarpeen mukaan, ja se tulee tehdä vähintään 7 päivän välein.
Potilaiden vaihtaminen Effexor 37,5 mg -tableteista
Masennuspotilaat, joita hoidetaan parhaillaan terapeuttisella annoksella Effexorilla (välittömästi vapautuva), voidaan vaihtaa Effexor 37,5 mg XR:ään lähimmällä vastaavalla annoksella (mg päivässä), esim. 37,5 mg venlafaksiinia kahdesti vuorokaudessa 75 mg:aan Effexor 75 mg XR:ää. kerran päivässä. Yksittäiset annosmuutokset voivat kuitenkin olla tarpeen.
Tietyt populaatiot
Potilaat, joilla on maksan vajaatoiminta
Päivittäistä kokonaisannosta tulee pienentää 50 % potilailla, joilla on lievä (Child-Pugh = 5-6) tai kohtalainen (Child-Pugh = 7-9) maksan vajaatoiminta. Potilailla, joilla on vaikea maksan vajaatoiminta (Child-Pugh = 10-15) tai maksakirroosi, saattaa olla tarpeen pienentää annosta 50 % tai enemmän [ks. Käyttö tietyissä populaatioissa ].
Potilaat, joilla on munuaisten vajaatoiminta
Päivittäistä kokonaisannosta tulee pienentää 25–50 % potilailla, joilla on lievä (CLcr=60–89 ml/min) tai kohtalainen (CLcr=30–59 ml/min) munuaisten vajaatoiminta. Hemodialyysihoitoa saavilla potilailla tai potilailla, joilla on vaikea munuaisten vajaatoiminta (CLcr Käyttö tietyissä populaatioissa ].
Ylläpitohoito
Kontrolloiduista tutkimuksista ei ole saatavilla näyttöä siitä, kuinka kauan MDD-, GAD-, SAD- tai PD-potilaita tulisi hoitaa Effexor 75 mg XR:llä.
Yleisesti ollaan samaa mieltä siitä, että MDD:n akuutit jaksot vaativat useita kuukausia tai pidempään jatkuvaa farmakologista hoitoa akuuttiin jaksoon kohdistuvan vasteen lisäksi. Effexor XR/Effexor on osoittanut vasteen jatkuvan kliinisissä tutkimuksissa 52 viikkoon asti samalla annoksella, jolla potilaat reagoivat alkuhoidon aikana [ks. Kliiniset tutkimukset ]. Ei tiedetä, onko ylläpitohoitoon tarvittava Effexor XR -annos identtinen alkuvasteen saavuttamiseen tarvittavan annoksen kanssa. Potilaita tulee säännöllisesti arvioida uudelleen ylläpitohoidon tarpeen ja sopivan annoksen määrittämiseksi.
GAD- ja SAD-potilailla Effexor 37,5 mg XR:n on osoitettu olevan tehokas 6 kuukauden kliinisissä tutkimuksissa. Lääkityksen jatkamisen tarve potilailla, joilla on GAD- ja SAD-potilaat, jotka paranevat Effexor XR -hoidon myötä, tulee arvioida säännöllisesti uudelleen.
Kliinisessä PD:n tutkimuksessa potilailla, jotka jatkoivat Effexor 75 mg XR:n käyttöä samalla annoksella, jolla he reagoivat ensimmäisten 12 hoitoviikon aikana, kokivat tilastollisesti merkitsevästi pitempään uusiutumista kuin lumelääkettä saaneilla potilailla [ks. Kliiniset tutkimukset ]. Lääkityksen jatkamisen tarve potilailla, joilla on PD, jotka paranevat Effexor XR -hoidon myötä, tulee arvioida säännöllisesti uudelleen.
Effexor XR:n lopettaminen
Kun Effexor 37,5 mg XR -hoito lopetetaan, suositellaan annoksen asteittaista pienentämistä äkillisen lopettamisen sijaan. Effexor 37,5 mg XR:llä tehdyissä kliinisissä tutkimuksissa kapeneminen saavutettiin pienentämällä vuorokausiannosta 75 mg:lla viikon välein. Kapenemisen yksilöllistäminen voi olla tarpeen [katso VAROITUKSET JA VAROTOIMET ]. Joillakin potilailla hoito saattaa olla tarpeen keskeyttää useiden kuukausien ajan.
Potilaiden vaihtaminen psykiatristen häiriöiden hoitoon tarkoitettuun monoamiinioksidaasin estäjään (MAOI)
MAO-estäjän (psykiatristen häiriöiden hoitoon tarkoitettu) lopettamisen ja Effexor XR -hoidon aloittamisen välillä tulee kulua vähintään 14 päivää. Lisäksi Effexor XR -hoidon lopettamisen jälkeen tulee kestää vähintään 7 päivää ennen MAO-estäjän aloittamista psykiatristen häiriöiden hoitoon [ks. VASTA-AIHEET , VAROITUKSET JA VAROTOIMET , ja HUUMEIDEN VUOROVAIKUTUKSET ].
Effexor XR:n käyttö muiden MAO-estäjien, kuten linetsolidin tai suonensisäisen metyleenisinisen kanssa
Älä aloita Effexor 75 mg XR -hoitoa potilaalle, jota hoidetaan linetsolidilla tai suonensisäisellä metyleenisinisellä, koska serotoniinioireyhtymän riski on lisääntynyt. Potilaalla, joka tarvitsee psykiatrisen tilan kiireellistä hoitoa, tulee harkita muita toimenpiteitä, mukaan lukien sairaalahoitoa [ks. VASTA-AIHEET ].
Joissakin tapauksissa potilas, joka jo saa Effexor 37,5 mg XR -hoitoa, saattaa vaatia kiireellistä hoitoa linetsolidilla tai suonensisäisellä metyleenisinisellä. Jos hyväksyttäviä vaihtoehtoja linetsolidille tai suonensisäiselle metyleenisiniselle ei ole saatavilla ja linetsolidi- tai suonensisäisen metyleenisinisen hoidon mahdollisten hyötyjen katsotaan olevan suurempia kuin serotoniinioireyhtymän riskit tietyllä potilaalla, Effexor XR -hoito tulee lopettaa välittömästi ja linetsolidi tai suonensisäinen metyleenisininen voidaan antaa. Seuraa potilasta serotoniinioireyhtymän oireiden varalta 7 päivän ajan tai 24 tunnin ajan viimeisen linetsolidin tai suonensisäisen metyleenisinisen annoksen jälkeen sen mukaan, kumpi tulee ensin. Effexor 75mg XR -hoitoa voidaan jatkaa 24 tuntia viimeisen linetsolidin tai suonensisäisen metyleenisinisen annoksen jälkeen [ks. VAROITUKSET JA VAROTOIMET ].
Riski, että metyleenisinistä annetaan ei-intravenoosisesti (kuten suun kautta otetuina tabletteina tai paikallisena injektiona) tai laskimonsisäisinä annoksina, jotka ovat paljon pienempiä kuin 1 mg/kg Effexor XR:n kanssa, on epäselvä. Kliinikon tulee kuitenkin olla tietoinen serotoniinioireyhtymän oireiden mahdollisuudesta tällaisen käytön yhteydessä [ks. VAROITUKSET JA VAROTOIMET ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Effexor 37,5 mg XR® (venlafaksiinihydrokloridi) pitkitetysti vapauttavia kapseleita on saatavana seuraavina vahvuuksina:
- 37,5 mg kapselit (harmaa kansi/persikka, runko-osa "W" ja "Effexor 75mg XR" kannessa ja "37.5")
- 75 mg kapselit (persikkakorkki ja runko-osa, joissa merkinnät W ja Effexor 37.5mg XR kansiosassa ja merkintä 75 rungossa)
- 150 mg kapselit (tummanoranssi kansi ja runko-osa, jossa merkinnät W ja Effexor 75mg XR korkissa ja 150 rungossa)
Varastointi ja käsittely
Effexor XR® (venlafaksiinihydrokloridi) pitkävaikutteiset kapselit ovat saatavilla seuraavasti:
NDC 0008-0837-20, 15 kapselin pullo käyttökertapakkauksessa. NDC 0008-0837-21, pullo, jossa 30 kapselia käyttökertapakkauksessa. NDC 0008-0837-22, 90 kapselin pullo käyttökertapakkauksessa. NDC 0008-0837-03, 10 Redipak®-läpipainoliuskaa, joissa kussakin 10 kapselia.
NDC 0008-0833-20, 15 kapselin pullo käyttökertapakkauksessa. NDC 0008-0833-21, 30 kapselin pullo käyttökertapakkauksessa. NDC 0008-0833-22, 90 kapselin pullo käyttökertapakkauksessa. NDC 0008-0833-03, 10 Redipak®-läpipainoliuskaa, joissa kussakin 10 kapselia.
NDC 0008-0836-20, 15 kapselin pullo käyttökertapakkauksessa. NDC 0008-0836-21, pullo, jossa 30 kapselia käyttökertapakkauksessa. NDC 0008-0836-22, 90 kapselin pullo käyttökertapakkauksessa. NDC 0008-0836-03, pahvipakkaus, jossa 10 Redipak®-läpipainoliuskaa, joissa kussakin 10 kapselia.
- 37,5 mg , harmaa korkki/persikka runko, jonka korkissa on "W" ja "Effexor XR" ja rungossa "37.5".
- 75 mg , persikkakorkki ja runko, jossa "W" ja "Effexor 37.5mg XR" korkissa ja "75" rungossa.
- 150 mg tummanoranssi korkki ja runko, jossa merkinnät W ja Effexor XR korkissa ja 150 rungossa.
Säilytä kontrolloidussa huoneenlämmössä, 20–25 °C (68–77 °F).
Käyttöyksikköpakkaus on tarkoitettu annosteltavaksi yksikkönä.
Jakelija: Wyeth Pharmaceuticals LLC, Pfizer Inc:n tytäryhtiö, Philadelpia, PA 19101. Tarkistettu: marraskuu 2021
SIVUVAIKUTUKSET
Seuraavia haittavaikutuksia käsitellään tarkemmin etiketin muissa osissa:
- Yliherkkyys [katso VASTA-AIHEET ]
- Itsemurha-ajatukset ja -käyttäytyminen lapsilla, nuorilla ja aikuisilla [ks. VAROITUKSET JA VAROTOIMET ]
- Serotoniinioireyhtymä [katso VAROITUKSET JA VAROTOIMET ]
- Verenpaineen nousu [katso VAROITUKSET JA VAROTOIMET ]
- Epänormaali verenvuoto [katso VAROITUKSET JA VAROTOIMET ]
- Kulman sulkeutuva glaukooma [katso VAROITUKSET JA VAROTOIMET ]
- Manian/hypomanian aktivointi [katso VAROITUKSET JA VAROTOIMET ]
- Keskeytysoireyhtymä [katso VAROITUKSET JA VAROTOIMET ]
- Kohtaus [katso VAROITUKSET JA VAROTOIMET ]
- Hyponatremia [katso VAROITUKSET JA VAROTOIMET ]
- Painon ja pituuden muutokset lapsipotilailla [katso VAROITUKSET JA VAROTOIMET ]
- Ruokahalun muutokset lapsipotilailla [katso VAROITUKSET JA VAROTOIMET ]
- Interstitiaalinen keuhkosairaus ja eosinofiilinen keuhkokuume [katso VAROITUKSET JA VAROTOIMET ]
- Seksuaalinen toimintahäiriö [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä tutkimuksista
Koska kliiniset tutkimukset tehdään hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutusten määrää ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Yleisimmät haittavaikutukset
Yleisimmin havaitut haittavaikutukset kliinisten tutkimusten tietokannassa Effexor XR:llä hoidetuilla potilailla MDD-, GAD-, SAD- ja PD-potilailla (esiintyvyys ≥ 5 % ja vähintään kaksi kertaa lumelääkkeeseen verrattuna) olivat: pahoinvointi (30,0 %), uneliaisuus (15,3). %), suun kuivuminen (14,8 %), hikoilu (11,4 %), epänormaali siemensyöksy (9,9 %), anoreksia (9,8 %), ummetus (9,3 %), impotenssi (5,3 %) ja alentunut libido (5,1 %).
Haittavaikutukset, jotka on ilmoitettu hoidon keskeyttämisen syinä
Lyhytaikaisten, lumekontrolloitujen, kaikkien käyttöaiheiden markkinoille saattamista koskeviin tutkimuksiin yhdistettynä 12 % 3 558 potilaasta, jotka saivat Effexor XR:ää (37,5–225 mg) keskeytti hoidon haittavaikutusten vuoksi, verrattuna 4 prosenttiin lumelääkettä saaneista 2 197 potilaasta. noissa tutkimuksissa.Taulukossa 7 on esitetty yleisimmät haittavaikutukset, jotka johtivat hoidon lopettamiseen ≥ 1 %:lla Effexor XR:llä hoidetuista potilaista lyhytaikaisissa tutkimuksissa (enintään 12 viikkoa).
Yleiset haittavaikutukset lumekontrolloiduissa tutkimuksissa
Niiden potilaiden määrä, jotka saivat useita Effexor XR -annoksia markkinoille saattamista edeltävän arvioinnin aikana kunkin hyväksytyn käyttöaiheen osalta, on esitetty taulukossa 8. Venlafaksiinille altistumisen olosuhteet ja kesto vaihtelivat suuresti kaikissa kehitysohjelmissa, ja niihin sisältyi (päällekkäisissä luokissa) avoin ja kaksoishoito. sokkotutkimukset, kontrolloimattomat ja kontrolloidut tutkimukset, sairaalahoidossa (vain Effexor) ja avohoidossa tehdyt tutkimukset, kiinteäannostutkimukset ja titraustutkimukset.
Yleisten haittavaikutusten ilmaantuvuus (ne, joita esiintyi ≥ 2 %:lla Effexor XR:llä hoidetuista potilaista [357 MDD-potilasta, 1381 GAD-potilasta, 819 SAD-potilasta ja 1001 PD-potilasta] ja useammin kuin lumelääkettä saaneilla) Effexor XR:llä hoidetuilla potilailla lyhyesti. Taulukossa 9 esitetään plasebokontrolloidut kliiniset tutkimukset kiinteä- ja joustavaannoksiin (annokset 37,5–225 mg päivässä).
Haittavaikutusprofiili ei eronnut merkittävästi eri potilaspopulaatioiden välillä.
Muut kliinisissä tutkimuksissa havaitut haittavaikutukset
Runko kokonaisuudessaan: Valoherkkyysreaktio, vilunväristykset
Sydän- ja verisuonijärjestelmä: Posturaalinen hypotensio, pyörtyminen, hypotensio, takykardia
Ruoansulatuselimistö: Ruoansulatuskanavan verenvuoto [katso VAROITUKSET JA VAROTOIMET ],
bruksismi Hemi/lymfaattinen järjestelmä: Ekkymoosi [katso VAROITUKSET JA VAROTOIMET ]
Aineenvaihdunta/ravitsemus: Hyperkolesterolemia, painonnousu [katso VAROITUKSET JA VAROTOIMET ], laihtuminen [katso VAROITUKSET JA VAROTOIMET ]
Hermosto: Kohtaukset [katso VAROITUKSET JA VAROTOIMET ], maaninen reaktio [katso VAROITUKSET JA VAROTOIMET ], levottomuus, sekavuus, akatisia, hallusinaatiot, hypertonia, myoklonus, depersonalisaatio, apatia
Iho ja lisäkkeet: Urtikaria, kutina, ihottuma, hiustenlähtö
Erityiset aistit: Mydriaasi, akkomodaatiohäiriöt, tinnitus, makuaistin vääristyminen
Urogenitaalinen järjestelmä: Virtsanpidätys, virtsaamisen heikkeneminen, virtsankarkailu, lisääntynyt virtsaamistiheys, kuukautiskierron häiriöt, joihin liittyy lisääntynyt verenvuoto tai lisääntynyt epäsäännöllinen verenvuoto (esim.
Elintoimintojen muutokset
Plasebokontrolloiduissa markkinointia edeltävissä tutkimuksissa havaittiin keskimääräisen verenpaineen nousua (ks. taulukko 10). Useimmissa käyttöaiheissa annoksesta riippuvainen keskimääräisen systolisen ja diastolisen verenpaineen nousu makuuasennossa oli ilmeistä potilailla, joita hoidettiin Effexor 37,5 mg XR:llä. Kaikissa kliinisissä MDD-, GAD-, SAD- ja PD-tutkimuksissa 1,4 %:lla potilaista Effexor XR -ryhmissä SDBP nousi ≥15 mmHg ja verenpaine ≥ 105 mmHg verrattuna 0,9 %:iin potilaista. lumeryhmät. Vastaavasti 1 %:lla potilaista Effexor 37,5 mg XR -ryhmissä SSBP nousi ≥ 20 mm Hg verenpaineen ollessa ≥ 180 mm Hg verrattuna 0,3 %:iin lumeryhmissä.
Effexor 37,5 mg XR -hoitoon liittyi pitkäkestoinen verenpainetauti (määritelty hoitoon liittyväksi diastoliseksi verenpaineeksi makuuasennossa [SDBP] ≥ 90 mm Hg ja ≥ 10 mm Hg lähtötason yläpuolella kolmella peräkkäisellä hoitokäynnillä (katso taulukko 11). Riittämätön määrä potilaista sai keskimääräisiä yli 300 mg:n Effexor XR:n vuorokausiannoksia kliinisissä tutkimuksissa, jotta voidaan arvioida täydellisesti jatkuvan verenpaineen nousun ilmaantuvuus näillä suuremmilla annoksilla.
Effexor 37,5 mg XR liittyi keskimääräiseen pulssin nousuun lumelääkkeeseen verrattuna lumelääkekontrolloiduissa tutkimuksissa (ks. taulukko 12) [ks. VAROITUKSET JA VAROTOIMET ].
Laboratoriomuutokset
Seerumin kolesteroli
Effexor XR liittyi seerumin kolesterolipitoisuuden keskimääräiseen lopulliseen nousuun verrattuna lumelääkkeen keskimääräiseen lopulliseen laskuun kliinisissä MDD-, GAD-, SAD- ja PD-tutkimuksissa (taulukko 13).
Effexor 75mg XR (venlafaksiinihydrokloridi) depotkapselit jopa 12 viikkoa ennen markkinoille tuloa lumekontrolloiduissa tutkimuksissa vakavan masennushäiriön osalta liittyi seerumin kolesterolipitoisuuden keskimääräiseen lopulliseen nousuun hoidon aikana noin 1,5 mg/dl verrattuna keskimääräinen lopullinen lasku 7,4 mg/dl lumelääkkeellä. Effexor XR -hoito jopa 8 viikkoa ja enintään 6 kuukautta ennen markkinoille tuloa lumekontrolloiduissa GAD-tutkimuksissa liittyi keskimääräiseen viimeiseen hoidon aikana seerumin kolesterolipitoisuuden nousuun noin 1,0 mg/dl ja 2,3 mg/dl lumelääkettä saaneiden potilaiden osalta. keskimääräinen lopullinen lasku 4,9 mg/dl ja 7,7 mg/dl. Effexor XR -hoito jopa 12 viikkoa ja enintään 6 kuukautta ennen markkinoille tuloa lumekontrolloiduissa sosiaalisten ahdistuneisuushäiriöiden tutkimuksissa liittyi keskimääräiseen viimeisen hoidon aikana seerumin kolesterolipitoisuuden nousuun, joka oli noin 7,9 mg/dl ja 5,6 mg/dl verrattuna. lumelääkettä saaneiden keskimääräisten lopullisten laskujen ollessa 2,9 ja 4,2 mg/dl. Enintään 12 viikon Effexor XR -hoitoon markkinoille tuloa edeltävissä lumekontrolloiduissa paniikkihäiriötutkimuksissa yhdistettiin seerumin kolesterolipitoisuuden keskimääräinen viimeinen nousu hoidon aikana noin 5,8 mg/dl verrattuna lumelääkkeen keskimääräiseen lopulliseen laskuun 3,7 mg/dl.
Potilailla, joita hoidettiin Effexorilla (välittömästi vapautuva) vähintään 3 kuukautta lumekontrolloiduissa 12 kuukauden jatkotutkimuksissa, kokonaiskolesterolin keskimääräinen viimeinen nousu hoidon aikana oli 9,1 mg/dl verrattuna 7,1 mg/dl:n laskuun lumelääkeryhmässä. hoidettuja potilaita. Tämä lisäys oli riippuvainen kestosta tutkimusjakson aikana, ja se oli yleensä suurempi suurempia annoksia käytettäessä. Kliinisesti merkittävä seerumin kolesterolin nousu, joka määritellään 1) seerumin kolesterolin viimeinen nousu hoidon aikana ≥ 50 mg/dl lähtötasosta ja arvo ≥ 261 mg/dl tai 2) seerumin kolesterolin keskimääräinen nousu hoidon aikana ≥ 50 mg/dl lähtötilanteesta ja arvoon ≥ 261 mg/dl, kirjattiin 5,3 %:lla venlafaksiinilla hoidetuista potilaista ja 0,0 %:lla lumelääkettä saaneista potilaista.
Seerumin triglyseridit
Effexor 75 mg XR liittyi seerumin triglyseridien paastotriglyseridien keskimääräiseen lopulliseen nousuun hoidon aikana verrattuna lumelääkkeeseen SAD:n ja PD:n markkinoille saattamista edeltävissä kliinisissä tutkimuksissa, jotka kestivät 12 viikkoa (yhdistetyt tiedot) ja 6 kuukautta (taulukko 14).
Pediatriset potilaat
Yleensä venlafaksiinin haittavaikutusprofiili (plasebokontrolloiduissa kliinisissä tutkimuksissa) lapsilla ja nuorilla (6–17-vuotiaat) oli samanlainen kuin aikuisilla. Kuten aikuisillakin, ruokahalun laskua, painon laskua, verenpaineen nousua ja seerumin kolesterolin nousua havaittiin [katso VAROITUKSET JA VAROTOIMET ja Käyttö tietyissä populaatioissa ].
Lapsille tehdyissä kliinisissä tutkimuksissa havaittiin haittavaikutus, itsemurha-ajatukset.
Erityisesti lapsipotilailla havaittiin seuraavia haittavaikutuksia: vatsakipu, kiihtyneisyys, dyspepsia, mustelma, nenäverenvuoto ja lihaskipu.
Hyväksynnän jälkeisen käytön aikana havaitut haittavaikutukset
Seuraavat haittavaikutukset on tunnistettu Effexor XR:n hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoiselta populaatiolta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeille altistumiseen:
Runko kokonaisuudessaan: Anafylaksia, angioödeema
Sydän- ja verisuonijärjestelmä: QT-ajan pidentyminen, kammiovärinä, kammiotakykardia (mukaan lukien torsade de pointes), takotsubo-kardiomyopatia
Ruoansulatuselimistö: Haimatulehdus
Hemic/lymfaattinen järjestelmä: Limakalvoverenvuoto [katso VAROITUKSET JA VAROTOIMET ], veren dyskrasiat (mukaan lukien agranulosytoosi, aplastinen anemia, neutropenia ja pansytopenia), pidentynyt vuotoaika, trombosytopenia
Aineenvaihdunta/ravitsemus: Hyponatremia [katso VAROITUKSET JA VAROTOIMET ], Sopimattoman antidiureettisen hormonin (SIADH) erityksen oireyhtymä [katso VAROITUKSET JA VAROTOIMET ], epänormaalit maksan toimintakokeet, hepatiitti, lisääntynyt prolaktiini
Tuki- ja liikuntaelimistö: Rabdomyolyysi
Hermosto: Maligni neuroleptinen oireyhtymä (NMS) [katso VAROITUKSET JA VAROTOIMET ], serotonerginen oireyhtymä [katso VAROITUKSET JA VAROTOIMET ], delirium, ekstrapyramidaaliset reaktiot (mukaan lukien dystonia ja dyskinesia), koordinaatio- ja tasapainohäiriö, tardiivi dyskinesia
Hengityselimet: Hengenahdistus, interstitiaalinen keuhkosairaus, keuhkojen eosinofilia [katso VAROITUKSET JA VAROTOIMET ]
Iho ja lisäkkeet: Stevens-Johnsonin oireyhtymä, toksinen epidermaalinen nekrolyysi, erythema multiforme
Erityiset aistit: Kulman sulkeutuva glaukooma [katso VAROITUKSET JA VAROTOIMET ]
HUUMEIDEN VUOROVAIKUTUKSET
Keskushermoston (CNS) aktiiviset lääkkeet
Venlafaksiinin käytön riskiä yhdessä muiden keskushermostoon vaikuttavien lääkkeiden kanssa ei ole arvioitu systemaattisesti. Tästä syystä varovaisuutta tulee noudattaa, kun Effexor XR:ää käytetään yhdessä muiden keskushermostoon vaikuttavien lääkkeiden kanssa.
Monoamiinioksidaasin estäjät
Haittavaikutuksia, joista osa oli vakavia, on raportoitu potilailla, jotka ovat äskettäin lopettaneet MAO:n estäjähoidon ja aloittaneet masennuslääkkeiden, joiden farmakologiset ominaisuudet ovat samankaltaiset kuin Effexor XR:n (SNRI- tai SSRI-lääkkeet), tai joille SNRI- tai SSRI-hoito on äskettäin lopetettu ennen MAOI:n aloittamiseen [katso ANNOSTELU JA HALLINNOINTI , VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
Serotonergiset lääkkeet
Effexor XR:n vaikutusmekanismin ja mahdollisen serotoniinioireyhtymän vuoksi varovaisuutta tulee noudattaa, kun Effexor XR:ää annetaan samanaikaisesti muiden lääkkeiden kanssa, jotka voivat vaikuttaa serotonergisiin välittäjäainejärjestelmiin, kuten triptaanit, SSRI:t, muut SNRI:t, linetsolidi (antibiootti, joka palautuva ei-selektiivinen MAOI), litium, tramadoli tai mäkikuisma. Jos samanaikainen hoito Effexor XR:n ja näiden lääkkeiden kanssa on kliinisesti perusteltua, potilaan huolellinen seuranta on suositeltavaa, erityisesti hoidon aloittamisen ja annosta suurennettaessa. Effexor 75mg XR:n samanaikaista käyttöä tryptofaanilisän kanssa ei suositella [ks. ANNOSTELU JA HALLINNOINTI , VASTA-AIHEET , ja VAROITUKSET JA VAROTOIMET ].
Hemostaasia häiritsevät lääkkeet (esim. tulehduskipulääkkeet, aspiriini ja varfariini)
Verihiutaleiden vapauttamalla serotoniinia on tärkeä rooli hemostaasissa. Serotoniinin takaisinottoa häiritsevien psykotrooppisten lääkkeiden käyttö liittyy ruoansulatuskanavan yläosan verenvuotoon, ja tulehduskipulääkkeiden tai aspiriinin samanaikainen käyttö voi voimistaa tätä verenvuotoriskiä [ks. VAROITUKSET JA VAROTOIMET ]. Muuttuneita antikoagulanttivaikutuksia, mukaan lukien lisääntynyt verenvuoto, on raportoitu, kun SSRI-lääkkeitä ja SNRI-lääkkeitä on annettu samanaikaisesti varfariinin kanssa. Varfariinihoitoa saavia potilaita tulee seurata huolellisesti, kun Effexor 37,5 mg XR aloitetaan tai lopetetaan.
Painonpudotusaineet
Venlafaksiinihoidon turvallisuutta ja tehoa yhdessä painonpudotusaineiden, mukaan lukien fentermiinin, kanssa ei ole osoitettu. Effexor XR:n ja painonpudotusaineiden yhteiskäyttöä ei suositella. Effexor XR ei ole tarkoitettu painonpudotukseen yksinään tai yhdessä muiden tuotteiden kanssa.
Muiden lääkkeiden vaikutukset Effexor XR:ään
Kuva 1: Vuorovaikutteisten lääkkeiden vaikutus venlafaksiinin ja aktiivisen metaboliitin O-desmetyylivenlafaksiinin (ODV) farmakokinetiikkaan.
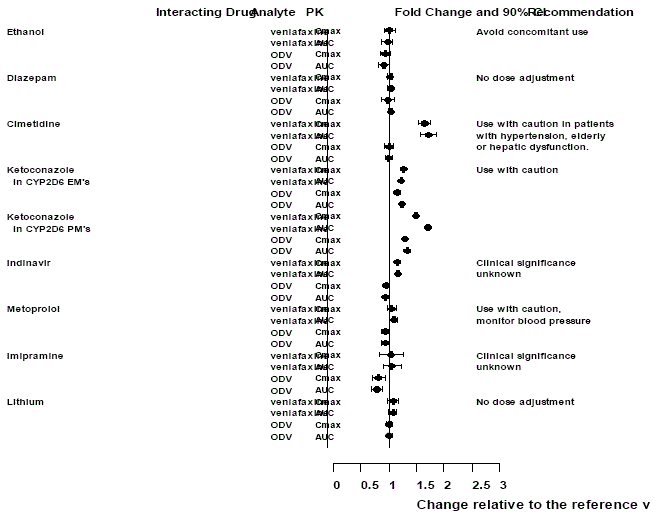
Effexor XR:n vaikutukset muihin lääkkeisiin
Kuva 2: Venlafaksiinin vaikutus farmakokinetiikkaan vaikuttaviin lääkkeisiin ja niiden aktiivisiin metaboliitteihin.
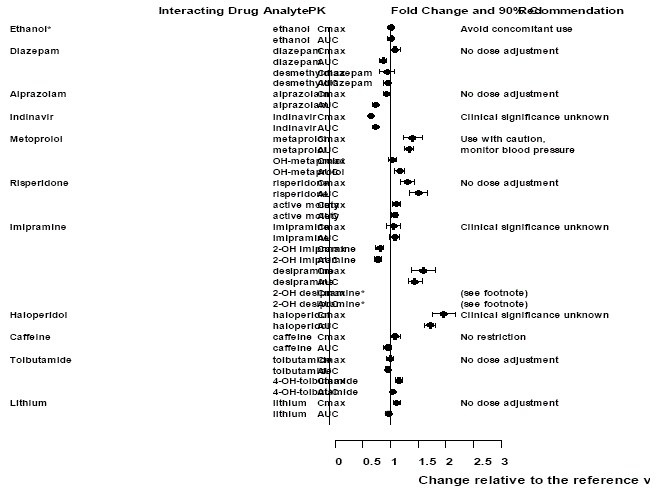
Merkintä

Venlafaksiinin anto vakaana hoito-ohjelmana ei liioittanut etanolin aiheuttamia psykomotorisia ja psykometrisiä vaikutuksia näillä samoilla henkilöillä, kun he eivät saaneet venlafaksiinia.
Lääkkeiden ja laboratoriotestien vuorovaikutukset
Väärin positiivisia virtsan immunomääritystestejä fensyklidiinin (PCP) ja amfetamiinin varalta on raportoitu venlafaksiinia käyttävillä potilailla. Tämä johtuu seulontatestien spesifisyyden puutteesta. Vääriä positiivisia testituloksia voidaan odottaa useiden päivien ajan venlafaksiinihoidon lopettamisen jälkeen. Vahvistavat testit, kuten kaasukromatografia/massaspektrometria, erottavat venlafaksiinin PCP:stä ja amfetamiinista.
Huumeiden väärinkäyttö ja riippuvuus
Valvottu aine
Effexor 75mg XR ei ole valvottu aine.
Väärinkäyttö
Vaikka venlafaksiinia ei ole systemaattisesti tutkittu kliinisissä tutkimuksissa sen mahdollisen väärinkäytön suhteen, kliinisissä tutkimuksissa ei ollut viitteitä lääkkeitä etsivästä käyttäytymisestä. Markkinointia edeltävän kokemuksen perusteella ei kuitenkaan ole mahdollista ennustaa, missä määrin keskushermostoon vaikuttavaa lääkettä käytetään väärin, ohjataan muualle ja/tai väärinkäyttöön sen jälkeen, kun se on markkinoitu. Tästä syystä lääkäreiden tulee huolellisesti arvioida potilaiden anamneesi huumeiden väärinkäytön varalta ja seurata tällaisia potilaita tarkasti ja tarkkailla heitä venlafaksiinin väärinkäytön merkkien varalta (esim. sietokyvyn kehittyminen, annoksen suurentaminen, huumeiden etsintäkäyttäytyminen).
Riippuvuus
In vitro -tutkimukset paljastivat, että venlafaksiinilla ei käytännössä ole affiniteettia opiaatti-, bentsodiatsepiini-, fensyklidiini- (PCP) tai N-metyyli-D-asparagiinihappo (NMDA) -reseptoreihin.
Venlafaksiinilla ei havaittu olevan merkittävää keskushermostoa stimuloivaa aktiivisuutta jyrsijöillä. Kädellisten huumeiden syrjintää koskevissa tutkimuksissa venlafaksiini ei osoittanut merkittävää stimulanttien tai masennusaineiden väärinkäyttövastuuta.
Hoidon lopetusvaikutuksia on raportoitu potilailla, jotka saavat venlafaksiinia [katso ANNOSTELU JA HALLINNOINTI ].
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Itsemurha-ajatukset ja -käyttäytyminen lapsilla, nuorilla ja nuorilla aikuisilla
Potilaat, joilla on vaikea masennushäiriö (MDD), sekä aikuisilla että lapsilla, voivat kokea masennuksensa pahenemista ja/tai itsemurha-ajatuksia ja -käyttäytymisen ilmaantumista (itsemurha-ajatuksia) tai epätavallisia muutoksia käyttäytymisessä riippumatta siitä, käyttävätkö he masennuslääkkeitä vai eivät, ja tämä riski voi jatkua, kunnes merkittävä remissio tapahtuu. Itsemurha on tunnettu masennuksen ja tiettyjen muiden psykiatristen häiriöiden riski, ja nämä häiriöt itsessään ovat vahvimpia itsemurhan ennustajia. Pitkään on kuitenkin ollut huolta siitä, että masennuslääkkeillä voi olla rooli masennuksen pahenemisessa ja itsetuhoisuuden syntymisessä tietyillä potilailla hoidon alkuvaiheessa. Lyhytaikaisten lumekontrolloitujen masennuslääkkeiden (SSRI:t ja muut) tutkimusten yhdistetyt analyysit osoittivat, että nämä lääkkeet lisäävät itsemurha-ajattelun ja -käyttäytymisen (itsemurha-ajattelun) riskiä lapsilla, nuorilla ja nuorilla aikuisilla (18–24-vuotiaat), joilla on MDD- ja muut psykiatriset häiriöt. Lyhytaikaiset tutkimukset eivät osoittaneet lisääntynyttä itsemurhariskiä masennuslääkkeillä lumelääkkeeseen verrattuna yli 24-vuotiailla aikuisilla; 65-vuotiailla ja sitä vanhemmilla aikuisilla masennuslääkkeet vähenivät lumelääkkeeseen verrattuna.
Plasebokontrolloitujen tutkimusten yhdistetyt analyysit lapsilla ja nuorilla, joilla oli MDD, pakko-oireinen häiriö (OCD) tai muita psykiatrisia häiriöitä, sisälsivät yhteensä 24 lyhytaikaista tutkimusta 9 masennuslääkettä yli 4 400 potilaalla. Plasebokontrolloitujen tutkimusten yhdistetyt analyysit aikuisilla, joilla oli MDD tai muita psykiatrisia häiriöitä, sisälsivät yhteensä 295 lyhytaikaista tutkimusta (mediaanikesto 2 kuukautta), joissa oli 11 masennuslääkettä yli 77 000 potilaalla. Itsemurhariskissä oli huomattavaa vaihtelua lääkkeiden välillä, mutta taipumus nuorempien potilaiden lisääntymiseen lähes kaikkien tutkittujen lääkkeiden kohdalla. Absoluuttisessa itsemurhariskissä oli eroja eri indikaatioiden välillä, ja suurin ilmaantuvuus MDD:ssä. Riskierot (lääke vs. lumelääke) olivat kuitenkin suhteellisen vakaita ikäryhmien sisällä ja eri käyttöaiheissa. Nämä riskierot (lääkkeen ja lumelääkkeen ero itsemurhatapausten määrässä 1 000 hoidettua potilasta kohti) on esitetty taulukossa 1.
Yhtään itsemurhaa ei tapahtunut missään lapsitutkimuksessa. Aikuisten tutkimuksissa oli itsemurhia, mutta määrä ei riittänyt johtopäätökseen lääkkeen vaikutuksesta itsemurhaan.
Ei tiedetä, ulottuuko itsemurhariski pitkäaikaiseen käyttöön eli useiden kuukausien jälkeiseen käyttöön. Lumekontrolloiduista ylläpitotutkimuksista aikuisilla, joilla on masennus, on kuitenkin huomattavaa näyttöä siitä, että masennuslääkkeiden käyttö voi viivyttää masennuksen uusiutumista.
Kaikkia potilaita, joita hoidetaan masennuslääkkeillä missä tahansa indikaatiossa, on seurattava asianmukaisesti ja tarkkailtava tarkasti kliinisen pahenemisen, itsemurha-ajattelun ja epätavallisten käyttäytymismuutosten varalta, erityisesti lääkehoidon ensimmäisten kuukausien aikana tai annosta muutettaessa, joko annosta suurennetaan. tai pienenee.
Seuraavia oireita, ahdistusta, kiihtyneisyyttä, paniikkikohtauksia, unettomuutta, ärtyneisyyttä, vihamielisyyttä, aggressiivisuutta, impulsiivisuutta, akatisiaa (psykomotorista levottomuutta), hypomaniaa ja maniaa on raportoitu aikuisilla ja lapsipotilailla, joita on hoidettu masennuslääkkeillä MDD:n vuoksi, sekä muihin indikaatioihin, sekä psykiatrisiin että ei-psykiatrisiin. Vaikka syy-yhteyttä tällaisten oireiden ilmaantumisen ja joko masennuksen pahenemisen ja/tai itsetuhoisten impulssien ilmaantumisen välillä ei ole osoitettu, on huolestuttavaa, että tällaiset oireet voivat olla syntyvän itsetuhoisuuden esiaste.
Hoito-ohjelman muuttamista, mukaan lukien lääkityksen mahdollista lopettamista, tulee harkita potilailla, joiden masennus pahenee jatkuvasti tai joilla on ilmennyt itsemurha tai oireita, jotka saattavat olla masennuksen tai itsemurha-ajatuksen pahenemisen edeltäjä, varsinkin jos nämä oireet ovat vakavia, äkillisiä. ovat alkaneet tai eivät olleet osa potilaan oireita.
Jos hoito on päätetty keskeyttää, lääkitystä tulee pienentää niin nopeasti kuin mahdollista, mutta huomioiden, että äkillinen lopettaminen voi liittyä tiettyihin oireisiin [ks. Keskeytysoireyhtymä ja ANNOSTELU JA HALLINNOINTI ].
MDD:n tai muiden, sekä psykiatristen että ei-psykiatristen, masennuslääkkeiden hoitoon saavien potilaiden perheitä ja hoitajia tulee varoittaa tarpeesta seurata potilaita kiihtyneisyyden, ärtyneisyyden, epätavallisten käyttäytymismuutosten ja muiden edellä kuvattujen oireiden ilmaantumisen varalta. sekä itsemurha-ajatuksen ilmaantumista ja ilmoittamaan tällaisista oireista välittömästi terveydenhuollon tarjoajille. Tällaiseen seurantaan tulisi sisältyä perheiden ja omaishoitajien päivittäinen tarkkailu. Yliannostusriskin vähentämiseksi Effexor XR:n reseptit tulee kirjoittaa pienintä kapselimäärää varten, mikä on hyvän potilashoidon mukaista.
Potilaiden seulonta kaksisuuntaisen mielialahäiriön varalta
Vakava masennusjakso voi olla kaksisuuntaisen mielialahäiriön ensimmäinen ilmentymä. Yleisesti uskotaan (vaikkakaan sitä ei ole vahvistettu kontrolloiduissa tutkimuksissa), että tällaisen episodin hoitaminen pelkällä masennuslääkkeellä voi lisätä seka-/maanisen vaiheen esiintymisen todennäköisyyttä potilailla, joilla on kaksisuuntaisen mielialahäiriön riski. Ei tiedetä, edustavatko mikään yllä kuvatuista oireista tällaista muutosta. Ennen masennuslääkehoidon aloittamista masennusoireista kärsivät potilaat tulee kuitenkin seuloa riittävästi sen määrittämiseksi, onko heillä kaksisuuntaisen mielialahäiriön riski; Tällaiseen seulontaan tulee sisältyä yksityiskohtainen psykiatrinen historia, mukaan lukien suvussa itsemurhaa, kaksisuuntaista mielialahäiriötä ja masennusta esiintynyt historia. On huomattava, että Effexor XR:ää ei ole hyväksytty käytettäväksi kaksisuuntaisen mielialahäiriön masennuksen hoidossa.
Serotoniinin oireyhtymä
Mahdollisesti henkeä uhkaavan serotoniinioireyhtymän kehittymistä on raportoitu käytettäessä serotoniini-norepinefriinin takaisinoton estäjiä (SNRI) ja SSRI-lääkkeitä, mukaan lukien pelkkä Effexor XR, mutta erityisesti käytettäessä samanaikaisesti muita serotonergisiä lääkkeitä (mukaan lukien triptaanit, trisykliset masennuslääkkeet, fentanyyli, litium, tramadoli, tryptofaani, buspironi, amfetamiinit ja mäkikuisma) ja erityisesti serotoniinin aineenvaihduntaa heikentävien lääkkeiden kanssa, MAO-estäjät, sekä psykiatristen häiriöiden hoitoon tarkoitetut että muut, kuten linetsolidi tai suonensisäinen metyleenisininen).
Serotoniinioireyhtymän oireita voivat olla mielentilan muutokset (esim. agitaatio, hallusinaatiot, delirium, kooma), autonominen epävakaus (esim. takykardia, labiili verenpaine, hypertermia, hikoilu, punoitus ja huimaus), hermo-lihasoireet (esim. vapina, jäykkyys, myoklonus , hyperrefleksia, koordinaatiohäiriö); kohtaukset ja maha-suolikanavan oireet (esim. pahoinvointi, oksentelu, ripuli). Potilaita tulee seurata serotoniinioireyhtymän ilmaantumisen varalta.
Effexor XR:n samanaikainen käyttö MAO-estäjien kanssa (tarkoitettu psykiatristen häiriöiden hoitoon) on vasta-aiheista. Effexor XR -hoitoa ei myöskään pidä aloittaa potilaalla, jota hoidetaan MAO-estäjillä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä. Kaikki metyleenisinistä koskevat raportit, jotka antoivat tietoa antoreitistä, koskivat suonensisäistä antoa annosalueella 1 mg/kg - 8 mg/kg. Ei raportoitu metyleenisinisen antamista muilla reiteillä (kuten oraalisilla tableteilla tai paikallisilla kudosinjektioilla) tai pienempinä annoksina. Joissakin tilanteissa Effexor 37,5 mg XR:ää saavan potilaan hoito MAO:n estäjällä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä, voi olla tarpeen aloittaa. Effexor XR tulee lopettaa ennen MAO-estäjän hoidon aloittamista [katso VASTA-AIHEET , ANNOSTELU JA HALLINNOINTI , ja HUUMEIDEN VUOROVAIKUTUKSET ].
Jos Effexor 37,5 mg XR:n samanaikainen käyttö muiden serotonergisten lääkkeiden (esim. triptaanit, trisykliset masennuslääkkeet, mirtatsapiini, fentanyyli, litium, tramadoli, buspironi, amfetamiinit, tryptofaani tai mäkikuisma) kanssa on kliinisesti perusteltua, huolellinen tarkkailu on perusteltua. Potilasta suositellaan erityisesti hoidon aloittamisen ja annoksen suurentamisen aikana [ks HUUMEIDEN VUOROVAIKUTUKSET ]. Potilaat tulee saada tietoisiksi mahdollisesta serotoniinioireyhtymän riskistä. Hoito Effexor XR:llä ja kaikilla samanaikaisilla serotonergisilla aineilla on lopetettava välittömästi, jos yllä mainitut tapahtumat ilmenevät, ja oireenmukaista tukihoitoa tulee aloittaa.
Verenpaineen nousu
Kontrolloiduissa tutkimuksissa havaittiin annoksesta riippuvaisia systolisen ja diastolisen verenpaineen nousuja sekä tapauksia jatkuvasta verenpaineesta [ks. HAITTAVAIKUTUKSET ].
Seuraa verenpainetta ennen Effexor 37,5 mg XR -hoidon aloittamista ja säännöllisesti hoidon aikana. Hallitse olemassa oleva verenpainetauti ennen Effexor 75mg XR -hoidon aloittamista. Ole varovainen hoidettaessa potilaita, joilla on aiempi verenpainetauti tai sydän- tai aivoverenkiertohäiriöt, joita verenpaineen nousu saattaa vaarantaa. Jatkuva verenpaineen nousu voi johtaa haitallisiin seurauksiin. Effexor XR:n käytön yhteydessä on raportoitu kohonneita verenpainetapauksia, jotka vaativat välitöntä hoitoa. Harkitse annoksen pienentämistä tai hoidon lopettamista potilailla, joilla on jatkuva verenpaineen nousu.
Kaikissa kliinisissä tutkimuksissa Effexor 37,5 mg:lla 1,4 %:lla potilaista Effexor XR:llä hoidetuissa ryhmissä makuuasennossa oleva diastolinen verenpaine (SDBP) nousi ≥ 15 mm Hg ≥ 105 mm Hg verrattuna 0,9 %:iin lumeryhmien potilaista. Vastaavasti 1 %:lla potilaista Effexor 75 mg XR:llä hoidetuissa ryhmissä systolinen verenpaine (SSBP) nousi ≥ 20 mm Hg, kun verenpaine oli ≥ 180 mm Hg, verrattuna 0,3 %:iin lumeryhmissä [ks. taulukko 10 sisään HAITTAVAIKUTUKSET ]. Effexor 75 mg XR -hoitoon liittyi pitkäkestoinen verenpainetauti (määritelty hoidon alkaneeksi SDBP:ksi ≥ 90 mm Hg ja ≥ 10 mm Hg lähtötason yläpuolelle kolmella peräkkäisellä hoitokäynnillä [ks. taulukko 11 HAITTAVAIKUTUKSET ]. Riittävä määrä potilaita sai kliinisissä tutkimuksissa Effexor 37,5 mg XR:n keskimääräisiä yli 300 mg:n vuorokausiannoksia, jotta pystyttäisiin arvioimaan täysin jatkuvan verenpaineen nousun ilmaantuvuus näillä suuremmilla annoksilla.
Epänormaali verenvuoto
SSRI-lääkkeet ja SNRI-lääkkeet, mukaan lukien Effexor 37,5 mg XR, voivat lisätä verenvuototapahtumien riskiä ekkymoosista, hematoomista, nenäverenvuotoista, petekioista ja maha-suolikanavan verenvuodosta hengenvaaralliseen verenvuotoon. Aspiriinin, steroideihin kuulumattomien tulehduskipulääkkeiden (NSAID), varfariinin ja muiden antikoagulanttien tai muiden verihiutaleiden toimintaan vaikuttavien lääkkeiden samanaikainen käyttö voi lisätä tätä riskiä. Tapausraportit ja epidemiologiset tutkimukset (tapauskontrolli ja kohorttisuunnittelu) ovat osoittaneet yhteyden serotoniinin takaisinottoa häiritsevien lääkkeiden käytön ja maha-suolikanavan verenvuodon välillä. Varo potilaita verenvuotoriskistä, joka liittyy Effexor 75 mg XR:n ja tulehduskipulääkkeiden, aspiriinin tai muiden hyytymiseen vaikuttavien lääkkeiden samanaikaiseen käyttöön.
Kulman sulkeutuva glaukooma
Monien masennuslääkkeiden, mukaan lukien Effexor XR:n, käytön seurauksena ilmenevä pupillien laajentuminen voi laukaista kulman sulkemiskohtauksen potilaalla, jolla on anatomisesti kapeat kulmat ja jolle ei ole tehty iridektomiaa.
Manian/hypomanian aktivointi
Maniaa tai hypomaniaa raportoitiin Effexor 37,5 mg XR:llä hoidetuilla potilailla MDD:n, SAD:n ja PD:n markkinoille saattamista edeltävissä tutkimuksissa (katso taulukko 2). Maniaa/hypomaniaa on raportoitu myös pienellä osalla mielialahäiriöistä kärsivistä potilaista, joita hoidettiin muilla markkinoiduilla lääkkeillä MDD:n hoitoon. Effexor 37,5 mg XR:ää tulee käyttää varoen potilailla, joilla on ollut mania tai hypomania.
Keskeytysoireyhtymä
Hoidon keskeyttämisoireita on arvioitu systemaattisesti venlafaksiinia käyttävillä potilailla, mukaan lukien prospektiiviset analyysit kliinisistä GAD-tutkimuksista ja retrospektiiviset tutkimukset MDD- ja SAD-tutkimuksista. Venlafaksiinin äkillisen lopettamisen tai annoksen pienentämisen eri annoksilla on havaittu liittyvän uusiin oireisiin, joiden esiintymistiheys lisääntyy annoksen suurentamisen ja hoidon pitenemisen myötä. Raportoituja oireita ovat agitaatio, ruokahaluttomuus, ahdistuneisuus, sekavuus, koordinaatio- ja tasapainohäiriö, ripuli, huimaus, suun kuivuminen, dysforinen mieliala, fascikulaatio, väsymys, flunssan kaltaiset oireet, päänsärky, hypomania, unettomuus, pahoinvointi, hermostuneisuus, painajaiset, aistihäiriöt ( mukaan lukien iskun kaltaiset sähköiset tuntemukset), uneliaisuus, hikoilu, vapina, huimaus ja oksentelu.
Markkinoille tulon jälkeen on raportoitu vakavista hoidon lopettamisen oireista, jotka voivat olla pitkittyneitä ja vaikeita. Täydellistä itsemurhaa, itsemurha-ajatuksia, aggressiota ja väkivaltaista käyttäytymistä on havaittu potilailla Effexor 75 mg XR -annoksen pienentämisen aikana, myös hoidon lopettamisen aikana. Muut markkinoille tulon jälkeiset raportit kuvaavat visuaalisia muutoksia (kuten näön hämärtymistä tai keskittymisvaikeuksia) ja kohonnutta verenpainetta Effexor XR:n lopettamisen tai annoksen pienentämisen jälkeen.
Effexor XR:n, muiden SNRI-lääkkeiden ja SSRI-lääkkeiden markkinoinnin aikana on raportoitu spontaanisti muista haittatapahtumista, jotka ilmenevät näiden lääkkeiden käytön lopettamisen jälkeen, erityisesti äkillisissä tapauksissa, mukaan lukien seuraavat: ärtyneisyys, letargia, tunnelääke, tinnitus ja kouristukset.
Potilaita tulee seurata näiden oireiden varalta, kun he lopettavat Effexor XR -hoidon. Annoksen asteittaista pienentämistä suositellaan äkillisen lopettamisen sijaan. Jos sietämättömiä oireita ilmaantuu annoksen pienentämisen tai hoidon lopettamisen jälkeen, voidaan harkita jatkamista aiemmin määrätyllä annoksella. Myöhemmin terveydenhuollon tarjoaja voi jatkaa annoksen pienentämistä, mutta asteittain. Joillakin potilailla saattaa olla tarpeen lopettaa hoito useiden kuukausien aikana [katso ANNOSTELU JA HALLINNOINTI ].
Kohtaukset
Kouristuskohtauksia on esiintynyt venlafaksiinihoidon yhteydessä. Effexor 75mg XR -valmistetta, kuten monia masennuslääkkeitä, tulee käyttää varoen potilailla, joilla on aiemmin esiintynyt kouristuskohtauksia, ja sen käyttö on lopetettava, jos potilaalle kehittyy kouristuskohtauksia. [On vähennettävä riskiä: riskitekijät, samanaikaiset lääkkeet, jotka alentavat kohtauskynnystä.]
Hyponatremia
Hyponatremiaa voi esiintyä SSRI- ja SNRI-hoidon seurauksena, mukaan lukien Effexor 37,5 mg XR. Monissa tapauksissa hyponatremia näyttää olevan seurausta sopimattoman antidiureettisen hormonin (SIADH) erityksen oireyhtymästä. Tapauksia, joissa seerumin natrium on alle 110 mmol/l, on raportoitu. Iäkkäillä potilailla voi olla suurempi riski kehittää hyponatremia SSRI- ja SNRI-lääkkeiden kanssa [katso Käyttö tietyissä populaatioissa ]. Myös potilailla, jotka käyttävät diureetteja tai joilla on muuten nestevajaus, voi olla suurempi riski. Harkitse Effexor 37,5 mg XR -hoidon lopettamista potilailla, joilla on oireinen hyponatremia, ja aloita asianmukainen lääketieteellinen toimenpide.
Hyponatremian merkkejä ja oireita ovat päänsärky, keskittymisvaikeudet, muistin heikkeneminen, sekavuus, heikkous ja epävakaus, jotka voivat johtaa kaatumiseen. Vakavampiin ja/tai akuutimpiin tapauksiin liittyviä merkkejä ja oireita ovat olleet hallusinaatiot, pyörtyminen, kouristukset, kooma, hengityspysähdys ja kuolema.
Painon ja pituuden muutokset lapsipotilailla
Painon muutokset
Keskimääräinen painonmuutos ja painonpudotuksen ilmaantuvuus (prosenttiosuus potilaista, jotka menettivät 3,5 % tai enemmän) lumekontrolloiduissa lapsitutkimuksissa MDD-, GAD- ja SAD-tutkimuksissa on esitetty taulukoissa 3 ja 4.
Painonpudotus ei rajoittunut potilaisiin, joilla oli hoitoon liittyvä anoreksia [katso Ruokahalun muutokset lapsipotilailla ].
Effexor 75 mg XR:n pitkäaikaiseen käyttöön liittyvät riskit arvioitiin avoimessa MDD-tutkimuksessa lapsilla ja nuorilla, jotka saivat Effexor XR:ää enintään kuuden kuukauden ajan. Tutkimukseen osallistuneiden lasten ja nuorten paino nousi odotettua vähemmän ikä- ja sukupuolitovereiden tietojen perusteella. Ero havaitun painonnousun ja odotetun painonnousun välillä oli suurempi lapsilla (
Korkeuden muutokset
Taulukko 5 esittää keskimääräisen pituuden nousun lapsipotilailla lyhytaikaisissa, lumekontrolloiduissa MDD-, GAD- ja SAD-tutkimuksissa. Erot pituuden nousussa GAD- ja MDD-tutkimuksissa olivat merkittävimmät alle 12-vuotiailla potilailla.
Kuuden kuukauden avoimessa MDD-tutkimuksessa lasten ja nuorten pituuden nousu oli odotettua pienempi ikä- ja sukupuolitovereiden tietojen perusteella. Ero havaitun ja odotetun kasvun välillä oli suurempi lapsilla (
Ruokahalun muutokset lapsipotilailla
Vähentynyttä ruokahalua (ilmoitettiin hoidosta johtuvana anoreksiana) havaittiin yleisemmin Effexor XR:llä hoidetuilla potilailla verrattuna lumelääkettä saaneilla potilailla Effexor XR:n markkinointia edeltävässä arvioinnissa MDD:n, GAD:n ja SAD:n hoitoon (katso taulukko 6).
Interstitiaalinen keuhkosairaus ja eosinofiilinen keuhkokuume
Venlafaksiinihoitoon liittyvää interstitiaalista keuhkosairautta ja eosinofiilistä keuhkokuumetta on raportoitu harvoin. Näiden haittavaikutusten mahdollisuus tulee ottaa huomioon venlafaksiinihoitoa saavilla potilailla, joilla on etenevää hengenahdistusta, yskää tai rintakipuja. Tällaisille potilaille on tehtävä pikainen lääketieteellinen arviointi, ja venlafaksiinihoidon lopettamista tulee harkita.
Seksuaalinen toimintahäiriö
SNRI-lääkkeiden käyttö, mukaan lukien Effexor XR, voi aiheuttaa seksuaalisen toimintahäiriön oireita [katso HAITTAVAIKUTUKSET ]. Miespotilailla SNRI:n käyttö voi aiheuttaa siemensyöksyn viivästymistä tai epäonnistumista, libidon heikkenemistä ja erektiohäiriöitä. Naispotilailla SNRI-lääkkeiden käyttö voi heikentää libidoa ja hidastaa orgasmia tai orgasmin puuttumista.
On tärkeää, että lääkärit tiedustelevat seksuaalista toimintaa ennen Effexor 37,5 mg XR -hoidon aloittamista ja tiedustelevat erityisesti seksuaalisen toiminnan muutoksista hoidon aikana, koska seksuaalista toimintaa ei välttämättä raportoida spontaanisti. Seksuaalisen toiminnan muutoksia arvioitaessa yksityiskohtainen historia (mukaan lukien oireiden alkamisajankohta) on tärkeää, koska seksuaalisilla oireilla voi olla muita syitä, mukaan lukien taustalla oleva psykiatrinen häiriö. Keskustele mahdollisista hoitostrategioista potilaiden tukemiseksi tekemään tietoisia hoitopäätöksiä.
Potilasneuvontatiedot
Katso FDA:n hyväksymä POTILASTIEDOT ( Lääkitysopas ).
Lääkäreiden tai muiden terveydenhuollon ammattilaisten tulee kertoa potilaille, heidän perheilleen ja heidän hoitajilleen Effexor 37,5 mg XR -hoidon eduista ja riskeistä ja neuvoa heitä sen asianmukaisessa käytössä. Effexor 75mg XR:lle on saatavana potilaan lääkitysopas "masennuslääkkeistä, masennuksesta ja muista vakavista mielenterveyssairauksista sekä itsemurha-ajatuksista tai -toimista". Lääkkeen määräävän lääkärin tai terveydenhuollon ammattilaisen tulee neuvoa potilaita, heidän perheitään ja huoltajiaan lukemaan lääkitysopas ja auttaa heitä ymmärtämään sen sisältö. Potilaille tulee antaa mahdollisuus keskustella lääkitysoppaan sisällöstä ja saada vastauksia mahdollisiin kysymyksiinsä. Lääkitysoppaan koko teksti on painettu uudelleen tämän asiakirjan lopussa. Potilaita tulee neuvoa seuraavista ongelmista, ja heitä tulee pyytää ilmoittamaan lääkärilleen, jos niitä ilmenee Effexor XR -hoidon aikana.
Itsemurha-ajatukset ja -käyttäytymiset
Neuvo potilaita, heidän perheitään ja hoitajia etsimään itsemurhaa, masennuksen pahenemista ja muita psykiatrisia oireita (ahdistus, kiihtyneisyys, paniikkikohtaukset, unettomuus, ärtyneisyys, vihamielisyys, aggressiivisuus, impulsiivisuus, akatisia, psykomotorinen levottomuus, hypomania, mania, muut epätavalliset muutokset käyttäytymisessä), erityisesti hoidon alussa ja annosta suurennettaessa tai pienennettäessä. Tällaisista oireista tulee ilmoittaa potilaan määräävälle lääkärille tai terveydenhuollon ammattilaiselle, varsinkin jos ne ovat vakavia, alkavat äkillisesti tai eivät olleet osa potilaan oireita. Tällaiset oireet voivat liittyä lisääntyneeseen itsemurha-ajattelun ja -käyttäytymisen riskiin, ja ne osoittavat, että tarvitaan erittäin tarkkaa seurantaa [ks. LAATIKKO VAROITUS ja VAROITUKSET JA VAROTOIMET ].
Samanaikainen lääkitys
Neuvo Effexor XR:ää käyttäviä potilaita olemaan käyttämättä samanaikaisesti muita venlafaksiinia tai desvenlafaksiinia sisältäviä tuotteita. Terveydenhuollon ammattilaisten tulee neuvoa potilaita olemaan käyttämättä Effexor XR:ää MAO:n estäjän kanssa tai 14 päivän sisällä MAO:n estäjähoidon lopettamisesta ja odottamaan 7 päivää Effexor XR:n lopettamisen jälkeen ennen MAO:n estäjähoidon aloittamista [ks. VASTA-AIHEET ].
Serotoniinin oireyhtymä
Potilaita tulee varoittaa serotoniinioireyhtymän riskistä, kun Effexor 75 mg XR:ää käytetään samanaikaisesti triptaanien, tramadolin, amfetamiinien, tryptofaanilisän, psykoosilääkkeiden tai muiden dopamiiniantagonistien tai muiden serotonergisten aineiden kanssa [ks. VAROITUKSET JA VAROTOIMET ja HUUMEIDEN VUOROVAIKUTUKSET ].
Kohonnut verenpaine
Neuvo potilaita, että heidän tulee seurata säännöllisesti verenpainetta Effexor XR:n käytön aikana [katso VAROITUKSET JA VAROTOIMET ].
Epänormaali verenvuoto
Potilaita tulee varoittaa Effexor 75mg XR:n ja tulehduskipulääkkeiden, aspiriinin, varfariinin tai muiden hyytymiseen vaikuttavien lääkkeiden samanaikaisesta käytöstä, koska serotoniinin takaisinottoa häiritsevien psykotrooppisten lääkkeiden yhteiskäyttö on yhdistetty lisääntyneeseen verenvuotoriskiin [ks. VAROITUKSET JA VAROTOIMET ].
Kulman sulkeutuva glaukooma
Potilaille tulee kertoa, että Effexor XR:n ottaminen voi aiheuttaa lievää pupillien laajentumista, joka voi herkillä henkilöillä johtaa sulkeutumiskulmaglaukooman episodiin. Aiempi glaukooma on lähes aina avokulmaglaukooma, koska sulkukulmaglaukooma voidaan diagnosoituna hoitaa lopullisesti iridektomialla. Avokulmaglaukooma ei ole kulmaglaukooman riskitekijä. Potilaat saattavat haluta tulla tutkituksi sen määrittämiseksi, ovatko he alttiita kulman sulkemiselle, ja heille voidaan tehdä profylaktinen toimenpide (esim. iridektomia), jos he ovat alttiita [ks. VAROITUKSET JA VAROTOIMET ].
Manian/hypomanian aktivointi
Neuvo potilaita, heidän perheitään ja hoitajia tarkkailemaan manian/hypomanian aktivoitumisen merkkejä [ks. VAROITUKSET JA VAROTOIMET ].
Sydän-/aivoverisuonitauti
Varovaisuutta suositellaan annettaessa Effexor XR:ää potilaille, joilla on sydän-, aivoverisuoni- tai rasva-aineenvaihduntahäiriöitä [ks. HAITTAVAIKUTUKSET ].
Seerumin kolesterolin ja triglyseridien nousu
Kerro potilaille, että kokonaiskolesteroli-, LDL- ja triglyseridiarvot voivat kohota ja että seerumin lipidien mittaamista voidaan harkita [ks. VAROITUKSET JA VAROTOIMET ].
Keskeytysoireyhtymä
Neuvo potilaita olemaan lopettamatta Effexor 75 mg XR:n käyttöä keskustelematta ensin terveydenhuollon ammattilaisen kanssa. Potilaiden tulee olla tietoisia siitä, että Effexor XR:n lopettamisen yhteydessä saattaa ilmetä keskeytysvaikutuksia [katso VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSET ].
Seksuaalinen toimintahäiriö
Kerro potilaille, että Effexor XR:n käyttö voi aiheuttaa seksuaalisen toimintahäiriön oireita sekä mies- että naispotilailla. Kerro potilaille, että heidän tulee keskustella kaikista seksuaalisen toiminnan muutoksista ja mahdollisista hoitostrategioista terveydenhuollon tarjoajan kanssa [katso VAROITUKSET JA VAROTOIMET ].
Häiriö kognitiiviseen ja motoriseen suorituskykyyn
Varo potilaita käyttämästä vaarallisia koneita, mukaan lukien autot, kunnes he ovat kohtuullisen varmoja siitä, että Effexor 37,5 mg XR -hoito ei vaikuta haitallisesti heidän kykyynsä osallistua tällaisiin toimintoihin.
Alkoholi
Neuvo potilaita välttämään alkoholia Effexor 37,5 mg XR:n käytön aikana [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Allergiset reaktiot
Neuvo potilaita ilmoittamaan lääkärilleen, jos heille ilmaantuu allergisia ilmiöitä, kuten ihottumaa, nokkosihottumaa, turvotusta tai hengitysvaikeuksia.
Raskaus
Neuvo potilaita ilmoittamaan lääkärilleen, jos he tulevat raskaaksi tai aikovat tulla raskaaksi hoidon aikana [katso Käyttö tietyissä populaatioissa ].
Sairaanhoito
Neuvo potilaita ilmoittamaan lääkärilleen, jos he imettävät vauvaa [katso Käyttö tietyissä populaatioissa ].
Jäännössferoidit
Effexor XR sisältää sferoideja, jotka vapauttavat lääkkeen hitaasti ruoansulatuskanavaan. Näiden sferoidien liukenematon osa eliminoituu, ja potilaat voivat huomata sferoideja kulkeutuvan ulosteessa tai kolostoman kautta. Potilaille tulee kertoa, että aktiivinen lääke on jo imeytynyt siihen mennessä, kun potilas näkee pallot.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Venlafaksiinihoito ei lisännyt kasvaimia hiirillä tai rotilla. Venlafaksiinia annettiin hiirille letkuruokinnalla 18 kuukauden ajan enintään 120 mg/kg:n vuorokausiannoksina, mikä oli 1,7 kertaa suurempi kuin ihmisille suositeltu enimmäisannos mg/m2:n perusteella. Venlafaksiinia annettiin myös rotille suun kautta letkulla 24 kuukauden ajan annoksina 120 mg/kg/vrk. Rotilla, jotka saivat 120 mg/kg annoksen, venlafaksiinin plasmapitoisuudet ruumiinavauksen yhteydessä olivat 1-kertaiset (urosrotat) ja 6-kertaiset (naarasrotat) plasmapitoisuudet potilailla, jotka saivat suurinta suositeltua ihmisannostusta. O-desmetyylimetaboliitin (ODV) pitoisuudet plasmassa olivat alhaisemmat rotilla kuin potilailla, jotka saivat suurinta suositeltua annosta. O-desmetyylivenlafaksiini (ODV), venlafaksiinin tärkein ihmisen metaboliitti, annettuna suun kautta letkulla hiirille ja rotille 2 vuoden ajan, ei lisännyt kasvainten ilmaantuvuutta kummassakaan tutkimuksessa. Hiiret saivat ODV:tä annoksilla 500/300 mg/kg/päivä (annosta pienennettiin 45 viikon annostelun jälkeen). Altistuminen annoksella 300 mg/kg/vrk on 9 kertaa suurempi kuin ihmisen annos 225 mg/vrk. Rotat saivat ODV:tä annoksina 300 mg/kg/vrk (urokset) tai 500 mg/kg/vrk (naaraat). Suurimmalla annoksella altistuminen on noin 8 (miehet) tai 11 (naiset) kertaa suurempi kuin ihmisen annos 225 mg/vrk.
Mutageneesi
Venlafaksiini ja pääasiallinen ihmisen metaboliitti, ODV, eivät olleet mutageenisia Amesin käänteismutaatiomäärityksessä Salmonella-bakteerilla tai kiinanhamsterin munasarja/HGPRT-nisäkässolun eteenpäin suuntautuvassa geenimutaatiomäärityksessä. Venlafaksiini ei myöskään ollut mutageeninen tai klastogeeninen hiiren in vitro BALB/c-3T3 solutransformaatiomäärityksessä, sisarkromatidinvaihtomäärityksessä viljellyissä kiinanhamsterin munasarjasoluissa tai in vivo kromosomipoikkeavuusmäärityksessä rotan luuytimessä. ODV ei ollut klastogeeninen in vitro kiinanhamsterin munasarjasolujen kromosomipoikkeavuusmäärityksessä tai in vivo -kromosomipoikkeavuusmäärityksessä rotilla.
Hedelmällisyyden heikkeneminen
Rotilla tehdyt venlafaksiinin lisääntymis- ja hedelmällisyystutkimukset eivät osoittaneet, että venlafaksiinilla olisi haitallisia vaikutuksia uros- tai naaraspuolisten hedelmällisyyteen suun kautta otetuilla annoksilla, jotka olivat enintään 2 kertaa suuremmat kuin ihmisille suositeltu enimmäisannos 225 mg/vrk mitattuna mg/m2:n perusteella. Hedelmällisyyden heikkenemistä havaittiin kuitenkin tutkimuksessa, jossa uros- ja naarasrottia hoidettiin O-desmetyylivenlafaksiinilla (ODV), joka on venlafaksiinin pääasiallinen metaboliitti ihmisessä, ennen parittelua ja raskausta sekä niiden aikana. Tämä tapahtui, kun ODV-altistus (AUC) oli noin 2–3 kertaa suurempi kuin ihmisen venlafaksiiniannoksella 225 mg/vrk.
Käyttö tietyissä populaatioissa
Raskaus
Teratogeeniset vaikutukset
Raskausluokka C
Venlafaksiini ei aiheuttanut epämuodostumia rottien tai kanien jälkeläisissä, kun annettiin enintään 2,5-kertaisia (rotta) tai 4-kertaisia (kaniini) annoksia ihmisille suositeltua enimmäisvuorokausiannosta mg/m2:n perusteella laskettuna. Rotilla pentujen paino kuitenkin laski, kuolleena syntyneiden pentujen määrä lisääntyi ja pentukuolemien määrä lisääntyi imetyksen ensimmäisen 5 päivän aikana, kun annostelu aloitettiin tiineyden aikana ja jatkui vieroittamiseen asti. Näiden kuolemien syytä ei tiedetä. Nämä vaikutukset ilmenivät 2,5-kertaisella (mg/m2) ihmisen enimmäisvuorokausiannoksella. Rotan pentujen kuolleisuuteen vaikuttamaton annos oli 0,25 kertaa ihmisen annos mg/m2:n perusteella. Rotilla ja kaniineilla tehdyissä lisääntymiskehitystutkimuksissa O-desmetyylivenlafaksiinilla (ODV), venlafaksiinin päämetaboliitilla ihmisellä, teratogeenisuutta ei havaittu altistusmarginaalilla 13 rotilla ja 0,3 kaniineilla. Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana oleville naisille. Effexor XR:ää tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan riskin. Koska eläinten lisääntymistutkimukset eivät aina ennusta ihmisen vastetta, tätä lääkettä tulee käyttää raskauden aikana vain, jos se on selvästi tarpeen.
Ei-teratogeeniset vaikutukset
Vastasyntyneille, jotka ovat altistuneet Effexor 37,5 mg XR:lle, muille SNRI-lääkkeille tai SSRI-lääkkeille kolmannen raskauskolmanneksen lopussa, on kehittynyt komplikaatioita, jotka vaativat pitkäaikaista sairaalahoitoa, hengitystukea ja letkuruokintaa. Tällaiset komplikaatiot voivat ilmaantua heti synnytyksen jälkeen. Raportoituja kliinisiä löydöksiä ovat olleet hengitysvaikeudet, syanoosi, apnea, kohtaukset, lämpötilan epävakaus, ruokintavaikeudet, oksentelu, hypoglykemia, hypotonia, hypertonia, hyperrefleksia, vapina, hermostuneisuus, ärtyneisyys ja jatkuva itku. Nämä ominaisuudet vastaavat joko SSRI- ja SNRI-lääkkeiden suoraa myrkyllistä vaikutusta tai mahdollisesti lääkkeen käytön lopettamisoireyhtymää. On huomattava, että joissakin tapauksissa kliininen kuva on yhdenmukainen serotoniinioireyhtymän kanssa [katso VAROITUKSET JA VAROTOIMET ja HUUMEIDEN VUOROVAIKUTUKSET ]. Kun raskaana olevaa naista hoidetaan Effexor XR:llä kolmannen raskauskolmanneksen aikana, lääkärin tulee harkita huolellisesti hoidon mahdollisia riskejä ja hyötyjä.
Työ ja toimitus
Venlafaksiinin vaikutusta synnytykseen ja synnytykseen ihmisillä ei tunneta.
Imettävät äidit
Venlafaksiinin ja ODV:n on raportoitu erittyvän äidinmaitoon. Koska Effexor XR voi aiheuttaa vakavia haittavaikutuksia imetettäville imeväisille, on tehtävä päätös, lopetetaanko imetys vai lopetetaanko lääkkeen käyttö ottaen huomioon lääkkeen merkitys äidille.
Käyttö lapsille
Effexor XR:llä on suoritettu kaksi lumekontrolloitua tutkimusta 766 MDD:tä sairastavalla lapsipotilaalla ja kaksi lumekontrolloitua tutkimusta 793 GAD-potilaalla, eivätkä tiedot riittäneet tukemaan väitettä käyttöä lapsipotilailla.
Jokaisen, joka harkitsee Effexor XR:n käyttöä lapsella tai nuorella, on tasapainotettava mahdolliset riskit kliinisen tarpeen kanssa [ks. LAATIKKO VAROITUS , VAROITUKSET JA VAROTOIMET ja HAITTAVAIKUTUKSET ].
Vaikka tutkimuksia ei ole suunniteltu ensisijaisesti arvioimaan Effexor 37,5 mg XR:n vaikutusta lasten ja nuorten kasvuun, kehitykseen ja kypsymiseen, tehdyt tutkimukset viittaavat siihen, että Effexor XR voi vaikuttaa haitallisesti painoon ja pituuteen [ks. VAROITUKSET JA VAROTOIMET ]. Jos lapsipotilasta päätetään hoitaa Effexor XR:llä, painon ja pituuden säännöllistä seurantaa suositellaan hoidon aikana, erityisesti jos hoitoa jatketaan pitkään [ks. VAROITUKSET JA VAROTOIMET ]. Effexor 75 mg XR -hoidon turvallisuutta lapsipotilaille ei ole arvioitu systemaattisesti kroonisessa hoidossa, joka kestää yli kuusi kuukautta. Lapsipotilailla (6–17-vuotiaat) tehdyissä tutkimuksissa kliinisesti merkityksellisiksi katsottujen verenpaineen ja kolesterolin nousujen esiintyminen lapsipotilailla oli samanlainen kuin aikuispotilailla. Näin ollen aikuisia koskevat varotoimet koskevat lapsipotilaita [katso VAROITUKSET JA VAROTOIMET ].
Geriatrinen käyttö
Effexor 37,5 mg XR:n kliinisissä tutkimuksissa MDD-, GAD-, SAD- ja PD-potilaiden prosenttiosuus, jotka olivat 65-vuotiaita tai vanhempia, on esitetty taulukossa 15.
Yleisiä eroja tehokkuudessa tai turvallisuudessa ei havaittu iäkkäiden ja nuorempien potilaiden välillä, ja muut raportoidut kliiniset kokemukset eivät yleensä ole tunnistaneet eroja iäkkäiden ja nuorempien potilaiden vasteessa. Joidenkin iäkkäiden henkilöiden suurempaa herkkyyttä ei kuitenkaan voida sulkea pois. SSRI:t ja SNRI:t, mukaan lukien Effexor XR, on yhdistetty kliinisesti merkitseviin hyponatremiatapauksiin iäkkäillä potilailla, joilla saattaa olla suurempi riski saada tämä haittatapahtuma [ks. VAROITUKSET JA VAROTOIMET ].
Venlafaksiinin ja ODV:n farmakokinetiikka ei ole merkittävästi muuttunut vanhuksilla [ks. KLIININEN FARMAKOLOGIA ] (katso kuva 3). Annoksen muuttamista ei suositella vanhuksille pelkästään iän perusteella, vaikka muut kliiniset olosuhteet, joista osa voi olla yleisempiä vanhuksilla, kuten munuaisten tai maksan vajaatoiminta, voivat edellyttää annoksen pienentämistä [ks. ANNOSTELU JA HALLINNOINTI ].
Ikä Ja Sukupuoli
Populaatiofarmakokineettinen analyysi 404 Effexorilla hoidetulle potilaalle kahdesta tutkimuksesta, joihin sisältyi sekä kahdesti vuorokaudessa että kolmesti vuorokaudessa annettuja hoito-ohjelmia, osoitti, että joko venlafaksiinin tai ODV:n annoksen mukaan normalisoidut plasman minimipitoisuudet eivät muuttuneet ikä- tai sukupuolierojen vuoksi. Annoksen muuttaminen potilaan iän tai sukupuolen perusteella ei yleensä ole tarpeen [katso ANNOSTELU JA HALLINNOINTI ] (katso taulukko 15).
Käyttö potilasalaryhmissä
Kuva 3: Venlafaksiinin ja sen metaboliitin O-desmetyylivenlafaksiinin (ODV) farmakokinetiikka erityisissä populaatioissa.
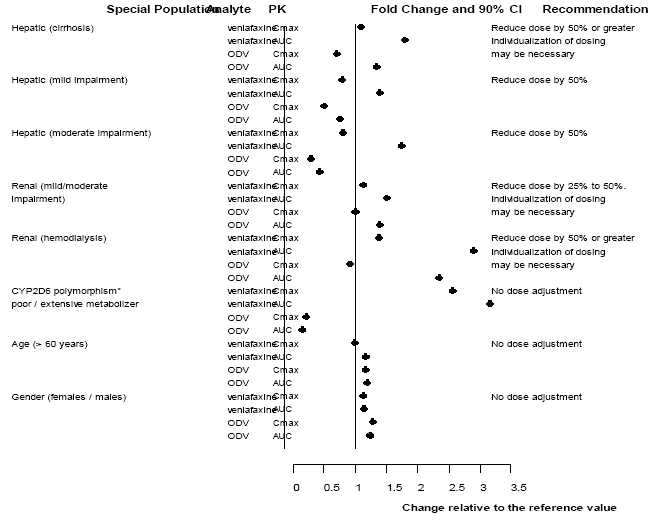
YLIANNOSTUS
Inhimillinen kokemus
Effexor 75 mg XR:n (MDD, GAD, SAD ja PD) ja Effexorin (MDD) markkinointia edeltävien arvioiden aikana raportoitiin 20 Effexorin akuuttia yliannostusta (6 ja 14 raporttia Effexor XR:n ja Effexor 75 mg:n potilailla). joko yksinään tai yhdessä muiden lääkkeiden ja/tai alkoholin kanssa.
Uneliaisuus oli yleisin raportoitu oire. Muita raportoituja oireita olivat kaikkien neljän raajan parestesia, kohtalainen huimaus, pahoinvointi, käsien ja jalkojen tunnottomuus sekä kuuma-kylmäjaksot 5 päivää yliannostuksen jälkeen. Useimmissa tapauksissa yliannostukseen ei liittynyt merkkejä tai oireita. Suurin osa raporteista koski nieltämistä, jossa venlafaksiinin kokonaisannoksen arvioitiin olevan enintään useita kertoja suurempi kuin tavallinen terapeuttinen annos. Yhdellä potilaalla, joka nieli 2,75 g venlafaksiinia, havaittiin kaksi yleistynyttä kouristusta ja QTc-ajan pidentyminen 500 ms:iin verrattuna 405 ms:iin lähtötilanteessa. Lievää sinustakykardiaa raportoitiin kahdella muulla potilaalla.
Yliannostuksen hoitamiseksi toteutettuihin toimenpiteisiin sisältyi hoidon puuttuminen, sairaalahoito ja oireenmukainen hoito sekä sairaalahoito sekä hoito aktiivihiilellä. Kaikki potilaat toipuivat.
Markkinoille tulon jälkeen venlafaksiinin yliannostusta on esiintynyt pääasiassa yhdessä alkoholin ja/tai muiden lääkkeiden kanssa. Yleisimmin raportoituja yliannostustapahtumia ovat takykardia, tajunnantason muutokset (vaihtelevat uneliaisuudesta koomaan), mydriaasi, kouristuskohtaukset ja oksentelu.
Elektrokardiogrammissa on raportoitu muutoksia (esim. QT-ajan pidentyminen, haarakatkos, QRS-ajan pidentyminen), kammiotakykardiaa, bradykardiaa, hypotensiota, rabdomyolyysiä, huimausta, maksanekroosia, serotoniinioireyhtymää ja kuolemaa.
Julkaistut retrospektiiviset tutkimukset raportoivat, että venlafaksiinin yliannostukseen saattaa liittyä suurentunut kuolemaan johtavien seurausten riski verrattuna SSRI-masennuslääkevalmisteilla havaittuun riskiin, mutta pienempi kuin trisyklisten masennuslääkkeiden kohdalla. Epidemiologiset tutkimukset ovat osoittaneet, että venlafaksiinilla hoidetuilla potilailla on suurempi itsemurhan riskitekijöiden taakka kuin SSRI-hoitoa saaneilla potilailla. Ei ole selvää, missä määrin kuolemantapausten lisääntyneen riskin havainto voidaan katsoa johtuvan venlafaksiinin toksisuudesta yliannostuksessa, toisin kuin eräissä venlafaksiinihoitoa saaneiden potilaiden ominaisuuksissa. Yliannostusriskin vähentämiseksi Effexor 75 mg XR:n reseptit tulee kirjoittaa pienimmälle kapselimäärälle, joka on hyvän potilaan hoidon mukainen.
Yliannostuksen hallinta
Pyydä ajantasaisia ohjeita ja neuvoja sertifioidulta myrkytyskeskukselta (1-800-222-1222 tai www.poison.org). Yliannostustapauksessa on annettava tukihoitoa, mukaan lukien tarkka lääkärin valvonta ja seuranta. Hoidon tulee koostua yleisistä toimenpiteistä, joita käytetään minkä tahansa lääkkeen yliannostuksen hallinnassa. Harkitse useiden lääkkeiden yliannostuksen mahdollisuutta. Varmista riittävät hengitystiet, hapetus ja ilmanvaihto. Tarkkaile sydämen rytmiä ja elintoimintoja. Tarjoa tuki- ja oireenmukaisia toimenpiteitä.
VASTA-AIHEET
Yliherkkyys
Yliherkkyys venlafaksiinihydrokloridille, desvenlafaksiinisukkinaatille tai jollekin valmisteen apuaineelle
Samanaikainen käyttö monoamiinioksidaasin estäjien (MAO-estäjien) kanssa
MAO-estäjien (psykiatristen häiriöiden hoitoon tarkoitettujen) käyttö samanaikaisesti Effexor 75 mg XR:n kanssa tai 7 päivän sisällä Effexor XR -hoidon lopettamisesta on vasta-aiheista, koska serotoniinioireyhtymän riski on lisääntynyt. Effexor 37,5 mg XR:n käyttö 14 päivän sisällä MAOI-hoidon lopettamisesta (tarkoitettu psykiatristen häiriöiden hoitoon) on myös vasta-aiheista [ks. ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET , ja HUUMEIDEN VUOROVAIKUTUKSET ].
Effexor XR:n aloittaminen potilaalla, jota hoidetaan MAO-estäjillä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä, on myös vasta-aiheista, koska serotoniinioireyhtymän riski on lisääntynyt (ks. ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET , ja HUUMEIDEN VUOROVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Venlafaksiinin masennusta ehkäisevän vaikutuksen tarkkaa mekanismia ihmisillä ei tunneta, mutta sen uskotaan liittyvän serotoniinin ja norepinefriinin tehostumiseen keskushermostossa niiden takaisinoton estymisen kautta. Ei-kliiniset tutkimukset ovat osoittaneet, että venlafaksiini ja sen aktiivinen metaboliitti, ODV, ovat tehokkaita ja selektiivisiä hermosolujen serotoniinin ja norepinefriinin takaisinoton estäjiä ja heikkoja dopamiinin takaisinoton estäjiä.
Farmakodynamiikka
Venlafaksiinilla ja ODV:llä ei ole merkittävää affiniteettia muskariini-kolinergisiin, H1-histamiinirgisiin tai α1-adrenergisiin reseptoreihin in vitro. Farmakologisen vaikutuksen näissä reseptoreissa oletetaan liittyvän erilaisiin antikolinergisiin, rauhoittaviin ja kardiovaskulaarisiin vaikutuksiin, joita on havaittu muilla psykotrooppisilla lääkkeillä. Venlafaksiinilla ja ODV:llä ei ole monoamiinioksidaasia (MAO) estävää vaikutusta.
Sydämen elektrofysiologia
Venlafaksiinin vaikutusta QT-aikaan arvioitiin satunnaistetussa, kaksoissokkoutetussa, lumelääke- ja positiivisesti kontrolloidussa kolmijaksoisessa risteävässä QT-tutkimuksessa 54 terveellä aikuisella henkilöllä. 450 mg:n venlafaksiiniannoksella ei havaittu merkittävää QT-aikaa pidentävää vaikutusta.
Farmakokinetiikka
Venlafaksiinin ja ODV:n vakaan tilan pitoisuudet plasmassa saavutetaan 3 vuorokauden kuluessa suun kautta otettavasta toistuvaannoshoidosta. Venlafaksiinin ja ODV:n kinetiikka oli lineaarinen annosalueella 75–450 mg/vrk. Venlafaksiinin ja ODV:n keskimääräinen ±SD vakaan tilan plasmapuhdistuma on 1,3 ± 0,6 ja 0,4 ± 0,2 l/h/kg; näennäinen eliminaation puoliintumisaika on 5±2 tuntia ja 11±2 tuntia; ja näennäinen (vakaan tilan) jakautumistilavuus on 7,5±3,7 ja 5,7±1,8 l/kg. Venlafaksiini ja ODV sitoutuvat minimaalisesti terapeuttisina pitoisuuksina plasman proteiineihin (27 % ja 30 %).
Imeytyminen ja jakautuminen
Venlafaksiini imeytyy hyvin ja metaboloituu laajalti maksassa. ODV on tärkein aktiivinen metaboliitti. Massatasetutkimusten perusteella vähintään 92 % venlafaksiinin kerta-annoksesta imeytyy. Venlafaksiinin absoluuttinen hyötyosuus on noin 45 %.
Effexor 37,5 mg XR:n (150 mg kerran vuorokaudessa) antaminen johti yleensä pienempään Cmax- ja myöhempään Tmax-arvoihin kuin Effexorin (välittömästi vapautuva) antaminen kahdesti vuorokaudessa (taulukko 16). Kun yhtä suuret päivittäiset venlafaksiiniannokset annettiin joko välittömästi vapautuvana tablettina tai depotkapselina, sekä venlafaksiinille että ODV:lle altistuminen oli samanlainen molemmilla hoidoilla, ja plasmapitoisuuksien vaihtelu oli hieman pienempi Effexor 37,5 mg -valmisteella. XR kapseli. Siksi Effexor XR imeytyy hitaammin, mutta imeytyy saman verran kuin välittömästi vapautuva tabletti.
Ruoka ei vaikuttanut venlafaksiinin tai sen aktiivisen metaboliitin, ODV:n, biologiseen hyötyosuuteen. Antoaika (AM vs. PM) ei vaikuttanut 75 mg:n Effexor 75 mg XR -kapselin venlafaksiinin ja ODV:n farmakokinetiikkaan.
Venlafaksiini ei sitoudu voimakkaasti plasman proteiineihin; Siksi Effexor 37,5 mg XR:n antaminen potilaalle, joka käyttää toista lääkettä, joka on voimakkaasti proteiiniin sitoutunut, ei saa lisätä toisen lääkkeen vapaita pitoisuuksia.
Aineenvaihdunta ja eliminaatio
Imeytymisen jälkeen venlafaksiini metaboloituu maksassa laajasti presysteemisesti, pääasiassa ODV:ksi, mutta myös N-desmetyylivenlafaksiiniksi, N,O-didesmetyylivenlafaksiiniksi ja muille vähäisemmille metaboliiteille. In vitro -tutkimukset osoittavat, että CYP2D6 katalysoi ODV:n muodostumista; tämä on vahvistettu kliinisessä tutkimuksessa, joka osoitti, että potilailla, joilla oli alhainen CYP2D6-taso (huonosti metaboloijat), venlafaksiinipitoisuudet olivat kohonneet ja ODV-tasot alentuneet verrattuna ihmisiin, joilla oli normaali CYP2D6-taso (laajuiset metaboloijat) [ks. Käyttö tietyissä populaatioissa ].
Noin 87 % venlafaksiiniannoksesta erittyy virtsaan 48 tunnin kuluessa muuttumattomana venlafaksiinina (5 %), konjugoimattomana ODV:nä (29 %), konjugoituna ODV:nä (26 %) tai muina vähäisinä inaktiivisina metaboliitteina (27 %). Venlafaksiinin ja sen metaboliittien eliminaatio munuaisten kautta on siten ensisijainen erittymisreitti.
Kliiniset tutkimukset
Masennustila
Effexor 75 mg XR (venlafaksiinihydrokloridi) pitkittyvästi vapautuvien kapseleiden teho masennushäiriön (MDD) hoitoon vahvistettiin kahdessa lumekontrolloidussa, lyhytaikaisessa (8 viikkoa tutkimuksessa 1; 12 viikkoa tutkimuksessa 2), joustavassa -annostutkimukset, joissa annokset alkavat 75 mg:sta vuorokaudessa ja vaihtelivat 225 mg:aan päivässä aikuisilla avohoitopotilailla, jotka täyttävät MDD:n DSM-III-R- tai DSM-IV-kriteerit. Keskivaikeasti masentuneilla avohoitopotilailla venlafaksiinin aloitusannos oli 75 mg vuorokaudessa. Molemmissa tutkimuksissa Effexor XR osoitti parempia lumelääkettä ensisijaisessa tehokkuusmittauksessa, joka määriteltiin muutoksena lähtötilanteesta HAM-D-21-kokonaispisteissä päätepisteen käyntiin. Effexor XR osoitti myös plaseboa paremman tehon keskeisessä toissijaisessa päätetapahtumassa, kliinisessä. Globaalit näyttökerrat (CGI) sairauden vakavuusasteikko. Tutkitun väestön sukupuolialaryhmien tarkastelu ei paljastanut sukupuolen perusteella eroavaa vastetta.
viikkoa kestänyt tutkimus laitospotilailla, jotka täyttivät DSM-III-R-kriteerit MDD-tautia sairastavalle melankolialle ja käyttivät Effexoria 37,5 mg 150-375 mg päivässä (jaettuna kolmeen kertaan päivässä annettavaan aikatauluun), osoitti Effexorin paremman. lumelääkettä HAM-D-21 kokonaispistemäärän perusteella. Keskimääräinen annos loppuun saaneilla oli 350 mg päivässä (tutkimus 3).
Pitkäaikaisessa tutkimuksessa aikuiset avopotilaat, joilla oli MDD ja jotka olivat vastanneet 8 viikon avoimessa tutkimuksessa Effexor 37,5 mg XR:llä (75, 150 tai 225 mg kerran päivässä joka aamu), satunnaistettiin jatkamaan samaa Effexor-hoitoaan. XR-annos tai lumelääke, jopa 26 viikon ajan uusiutumisen havainnointiin. Vaste avoimen vaiheen aikana määriteltiin CGI:n sairauden vakavuuden pistemääräksi ≤3 ja HAM-D-21-kokonaispisteeksi ≤10 päivän 56 arvioinnissa. Relapsi kaksoissokkovaiheen aikana määriteltiin seuraavasti: (1) vakavan masennushäiriön uusiutuminen DSM-IV-kriteerien mukaisesti ja sairauden vakavuuden CGI-pistemäärä ≥ 4 (kohtalaisen sairas), (2) 2 peräkkäistä CGI:tä Sairauden vakavuuden kohtauspisteet ≥4 tai (3) lopullinen CGI:n sairauden vakavuuden kohta ≥4 jokaiselle potilaalle, joka vetäytyi tutkimuksesta mistä tahansa syystä. Jatkuvaa Effexor 37,5 mg XR -hoitoa saaneilla potilailla todettiin tilastollisesti merkitsevästi vähemmän uusiutumista seuraavien 26 viikon aikana verrattuna lumelääkettä saaneisiin potilaisiin (tutkimus 4).
Toisessa pidemmän aikavälin tutkimuksessa aikuiset avopotilaat, joilla oli toistuva tyyppi MDD ja jotka olivat vastanneet (HAM-D21 kokonaispistemäärä ≤ 12 päivän 56 arvioinnissa) ja joiden tila parantui edelleen [määritelty seuraavien kriteerien täyttyessä päivinä 56-180 : (1) ei HAM-D-21 kokonaispistemäärää ≥ 20; (2) korkeintaan 2 HAM39 D-21 kokonaispistemäärää > 10 ja (3) ei yhtäkään sairauden vakavuuskohtaista CGI-arvoa ≥ 4 (kohtalaisen sairas)] ensimmäisten 26 viikon Effexor-hoidon aikana [100-200 mg per päivässä, kahdesti vuorokaudessa] satunnaistettiin jatkamaan samalla Effexor-annoksella tai lumelääkettä. Seurantajakso potilaiden uusiutumisen tarkkailemiseksi, joka määritellään sairauden vakavuuden CGI-pisteeksi ≥ 4, kesti enintään 52 viikkoa. Jatkuvaa Effexor-hoitoa saaneilla potilailla oli tilastollisesti merkitsevästi pienempi uusiutumisaste seuraavien 52 viikon aikana verrattuna lumelääkettä saaneisiin potilaisiin (tutkimus 5).
Yleistynyt ahdistuneisuushäiriö
Effexor XR:n tehokkuus yleistyneen ahdistuneisuushäiriön (GAD) hoidossa vahvistettiin kahdessa 8 viikon lumekontrolloidussa kiinteäannoksisessa tutkimuksessa (75-225 mg päivässä), yhdessä 6 kuukauden lumekontrolloidussa, joustavassa tutkimuksessa. -annostutkimus (75-225 mg päivässä) ja yksi 6 kuukauden lumekontrolloitu kiinteäannoksinen tutkimus (37,5, 75 ja 150 mg päivässä) aikuisilla avohoitopotilailla, jotka täyttävät GAD:n DSM-IV-kriteerit.
Yhdessä 8 viikkoa kestäneessä tutkimuksessa Effexor XR osoitti parempana lumelääkkeeseen 75, 150 ja 225 mg:n päiväannoksilla mitattuna Hamiltonin Ahdistuneisuusasteikon (HAM-A) kokonaispistemäärällä, sekä HAM-A-ahdistuksen että jännityksen suhteen. tuotteet ja CGI (Clinical Global Impressions) -asteikko. Vuorokausiannokset 75 ja 150 mg eivät kuitenkaan olleet yhtä tehokkaita kuin suurin annos (tutkimus 1). Toinen 8 viikkoa kestänyt tutkimus, jossa arvioitiin 75 ja 150 mg:n vuorokausiannoksia ja lumelääkettä, osoitti, että molemmat annokset olivat lumelääkettä tehokkaampia joissakin näistä samoista tuloksista; 75 mg:n vuorokausiannos oli kuitenkin johdonmukaisesti tehokkaampi kuin 150 mg:n päiväannos (tutkimus 2). Annos-vaste-suhdetta tehokkuuteen GAD:ssa ei pystytty selkeästi osoittamaan tutkitulla 75–225 mg:n vuorokausiannosalueella.
Kaksi 6 kuukauden tutkimusta, joista toisessa arvioitiin Effexor 75 mg XR -annoksia 37,5, 75 ja 150 mg päivässä (tutkimus 3) ja toisessa arvioitiin Effexor XR -annoksia 75 - 225 mg päivässä (tutkimus 4), osoittivat, että päivittäiset annokset 75 mg tai enemmän olivat tehokkaampia kuin lumelääke HAM-A-kokonaisarvossa, sekä HAM-A-ahdistus- ja jännityskohdissa että CGI-asteikossa 6 kuukauden hoidon aikana. Vaikka 37,5 mg:n vuorokausiannoksella oli myös näyttöä lumelääkkeeseen verrattuna, tämä annos ei ollut yhtä tehokas kuin suuremmat annokset.
Tutkitun väestön sukupuolialaryhmien tarkastelu ei paljastanut sukupuolen perusteella eroavaa vastetta.
Sosiaalinen ahdistuneisuushäiriö (tunnetaan myös nimellä sosiaalinen fobia)
Effexor 37,5 mg XR:n teho sosiaalisen ahdistuneisuushäiriön (SAD) hoidossa vahvistettiin neljässä kaksoissokkoutetussa rinnakkaisryhmätutkimuksessa, 12 viikkoa kestäneessä, monikeskustutkimuksessa, lumekontrolloidussa, joustavan annoksen tutkimuksessa (tutkimukset 1-4) ja yksi kaksoissokko, rinnakkaisryhmä, 6 kuukauden, lumekontrolloitu, kiinteän/joustavan annoksen tutkimus, joka sisälsi 75–225 mg:n vuorokausiannoksia aikuisilla avohoidossa, joka täytti SAD:n DSM-IV-kriteerit (tutkimus 5 ).
Näissä viidessä tutkimuksessa Effexor 75 mg XR oli tilastollisesti merkitsevästi tehokkaampi kuin lumelääke Liebowitzin sosiaalisen ahdistuneisuusasteikon (LSAS) kokonaispistemäärän muuttuessa lähtötasosta päätepisteeseen. Kuuden kuukauden tutkimuksessa ei ollut näyttöä 150–225 mg:n vuorokausiannoksen ryhmän paremmasta tehokkuudesta verrattuna 75 mg:n vuorokausiannoksen ryhmään.
Tutkitun väestön osajoukkojen tarkastelu ei paljastanut sukupuolen perusteella eroavaa vastetta. Näissä tutkimuksissa ei ollut riittävästi tietoa iän tai rodun vaikutuksen määrittämiseksi lopputulokseen.
Paniikkihäiriö
Effexor XR:n teho paniikkihäiriön (PD) hoidossa vahvistettiin kahdessa kaksoissokkoutetussa, 12 viikkoa kestäneessä, lumekontrolloidussa monikeskustutkimuksessa aikuisilla avohoitopotilailla, jotka täyttivät PD:n DSM-IV-kriteerit, agorafobialla tai ilman. Potilaat saivat kiinteät annokset 75 tai 150 mg päivässä yhdessä tutkimuksessa (tutkimus 1) ja 75 tai 225 mg päivässä toisessa tutkimuksessa (tutkimus 2).
Tehoa arvioitiin kolmen muuttujan tulosten perusteella: (1) potilaiden prosenttiosuus, joilla ei ollut täysi-oireisia paniikkikohtauksia paniikki- ja ennakointiahdistusasteikolla (PAAS); (2) keskimääräinen muutos lähtötilanteesta päätepisteeseen paniikkihäiriön vakavuusasteikon (PDSS) kokonaispistemäärässä; ja (3) potilaiden prosenttiosuus, jotka on arvioitu reagoineiksi (paljon parantuneet tai erittäin paljon parantuneet) kliinisen maailmanlaajuisen vaikutelman (CGI) paranemisasteikolla. Näissä kahdessa tutkimuksessa Effexor XR oli tilastollisesti merkitsevästi tehokkaampi kuin lumelääke (kullakin kiinteällä annoksella) kaikissa kolmessa päätepisteessä, mutta annos-vaste-suhdetta ei ollut selkeästi osoitettu.
Tutkitun väestön osajoukkojen tarkastelu ei paljastanut sukupuolen perusteella eroavaa vastetta. Näissä tutkimuksissa ei ollut riittävästi tietoa iän tai rodun vaikutuksen määrittämiseksi lopputulokseen.
Pitkäaikaisessa tutkimuksessa (tutkimus 3) aikuiset avopotilaat, jotka täyttivät PD:n DSM-IV-kriteerit ja jotka olivat vastanneet 12 viikon avoimen vaiheen aikana Effexor 75 mg XR:llä (75-225 mg päivässä), määrättiin satunnaisesti jatkamaan samaa Effexor 75 mg -annosta. XR-annos (75, 150 tai 225 mg) tai vaihda lumelääkkeeseen uusiutumisen havainnointia varten kaksoissokkoutetuissa olosuhteissa. Vaste avoimen vaiheen aikana määriteltiin ≤ 1 täysi-oireinen paniikkikohtaus viikossa avoimen vaiheen 2 viimeisen viikon aikana ja CGI:n paranemispistemääräksi 1 (erittäin parantunut) tai 2 (paljon parantunut). Relapsi kaksoissokkovaiheen aikana määriteltiin siten, että siinä oli 2 tai useampi täysi-oireinen paniikkikohtaus viikossa 2 peräkkäisen viikon ajan tai se keskeytettiin tehon menetyksen vuoksi, kuten tutkijat määrittelivät tutkimuksen aikana. Satunnaistetut potilaat olivat vastetilassa keskimäärin 34 päivää ennen satunnaistamista. 12 viikon avoimen jakson jälkeisessä satunnaistetussa vaiheessa potilailla, jotka saivat jatkuvaa Effexor 75 mg XR -hoitoa, oli tilastollisesti merkitsevästi pidempi aika uusiutumiseen.
Pediatriset potilaat
Effexor XR:llä on suoritettu kaksi lumekontrolloitua tutkimusta 766 MDD:tä sairastavalla lapsipotilaalla ja kaksi lumekontrolloitua tutkimusta 793 GAD-potilaalla, eivätkä tiedot riittäneet tukemaan väitettä käyttöä lapsipotilailla.
Mitä Effexor on ja miten sitä käytetään?
Effexor on reseptilääke, jota käytetään masennuksen, yleistyneen ahdistuneisuuden, sosiaalisen ahdistuksen ja paniikkihäiriön oireiden hoitoon. Effexoria voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Effexor kuuluu lääkeryhmään, jota kutsutaan masennuslääkkeiksi, selektiiviseksi serotoniiniksi ja norepinefriinin takaisinoton estäjiksi (SNRI).
Mitkä ovat Effexor 37,5 mg:n mahdolliset sivuvaikutukset?
Effexor voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- näön hämärtyminen,
- putkinäkö,
- silmäkipu tai turvotus,
- nähdä halot pyöreät valot,
- helposti syntyvät mustelmat tai verenvuodot (nenäverenvuoto, ikenet),
- verta virtsassa tai ulosteessa,
- yskii verta,
- yskä,
- puristava tunne rinnassa,
- vaikeuksia hengittää,
- kouristukset (kohtaus),
- päänsärky,
- hämmennystä,
- sammaltava puhe,
- vakava heikkous,
- oksentelua,
- koordinaation menetys,
- epävakaa olo,
- erittäin jäykkä (jäykkä) lihas,
- korkea kuume,
- hikoilu,
- hämmennystä,
- nopeat tai epätasaiset sydämenlyönnit,
- vapina ja
- huimaus
- Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
- Effexorin yleisimpiä sivuvaikutuksia ovat:
- huimaus,
- uneliaisuus,
- ahdistus,
- hermostunut olo,
- unihäiriöt (unettomuus),
- näkö muuttuu,
- pahoinvointi,
- oksentelua,
- ripuli,
- painon tai ruokahalun muutokset,
- kuiva suu,
- ammottava,
- lisääntynyt hikoilu,
- vähentynyt seksihalu,
- impotenssi,
- epänormaali siemensyöksy ja
- vaikeuksia saada orgasmi
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Effexorin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
Itsemurha- ja masennuslääkkeet
Masennuslääkkeet lisäsivät plaseboon verrattuna itsemurha-ajattelun ja -käyttäytymisen (itsetuhoisuuden) riskiä lapsilla, nuorilla ja nuorilla aikuisilla lyhytaikaisissa masennushäiriön (MDD) ja muiden psykiatristen häiriöiden tutkimuksissa. Jokaisen, joka harkitsee venlafaksiinitablettien, USP:n tai minkä tahansa muun masennuslääkkeen käyttöä lapsella, nuorella tai nuorella aikuisella, on tasapainotettava tämä riski kliinisen tarpeen kanssa. Lyhytaikaiset tutkimukset eivät osoittaneet lisääntynyttä itsemurhariskiä masennuslääkkeillä lumelääkkeeseen verrattuna yli 24-vuotiailla aikuisilla; 65-vuotiailla ja sitä vanhemmilla aikuisilla masennuslääkkeiden riski pieneni lumelääkkeeseen verrattuna. Masennus ja tietyt muut psykiatriset häiriöt liittyvät itsemurhariskin lisääntymiseen. Kaiken ikäisiä potilaita, jotka saavat masennuslääkehoitoa, tulee seurata asianmukaisesti ja tarkkailla kliinisen pahenemisen, itsemurha-ajattelun tai epätavallisten käyttäytymismuutosten varalta. Perheille ja omaishoitajille tulee kertoa, että heitä on tarkkailtava tarkasti ja kommunikoida lääkärin kanssa. Venlafaxine-tabletteja, USP ei ole hyväksytty käytettäväksi lapsipotilailla. (Katso VAROITUKSET : Kliininen paheneminen ja itsemurhariski , POTILASTIEDOT , ja VAROTOIMENPITEET : Käyttö lapsille ).
KUVAUS
Venlafaxine tablets, USP on rakenteellisesti uusi masennuslääke suun kautta annettavaksi. Se on nimetty (R/S)-1-[2-(dimetyyliamino)-1-(4-metoksifenyyli)etyyli]sykloheksanolihydrokloridiksi tai (±)-1-[a-[(dimetyyliamino)metyyli]-p- metoksibentsyyli]sykloheksanolihydrokloridi ja sen empiirinen kaava C17H27NO2 HCl. Sen molekyylipaino on 313,87. Rakennekaava on esitetty alla.
Venlafaksiinihydrokloridi on valkoinen tai luonnonvalkoinen kiteinen kiinteä aine, jonka liukoisuus veteen on 572 mg/ml (säädetty ionivahvuuteen 0,2 M natriumkloridilla). Sen oktanoli:vesi (0,2 M natriumkloridi) -jakaantumiskerroin on 0,43.
Puristetut tabletit sisältävät venlafaksiinihydrokloridia, USP, joka vastaa 25 mg, 37,5 mg, 50 mg, 75 mg tai 100 mg venlafaksiiniemästä ja seuraavia inaktiivisia aineosia: mikrokiteinen selluloosa, laktoosimonohydraatti, esigelatinoitu tärkkelys, natriumtärkkelysglykolaatti, rautatärkkelysglykolaatti, punainen, keltainen rautaoksidi, kolloidinen piidioksidi ja magnesiumstearaatti.
