Masennuslääkkeet: Celexa 10mg, 20mg Citalopram Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Celexa on ja miten sitä käytetään?
Celexa on reseptilääke, jota käytetään masennuksen oireiden hoitoon. Celexaa voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Celexa 20mg kuuluu lääkeryhmään, jota kutsutaan masennuslääkkeiksi, SSRI:iksi.
Mitkä ovat Celexan mahdolliset sivuvaikutukset?
Celexa voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- huimaus,
- näön hämärtyminen,
- putkinäkö,
- silmäkipu tai turvotus,
- nähdä haloja valojen ympärillä,
- päänsärky, johon liittyy rintakipua ja voimakasta huimausta,
- pyörtyminen,
- nopea tai jyskyttävä sydämenlyönti,
- erittäin jäykät (jäykät) lihakset,
- kuume tai korkea kuume,
- hikoilu,
- hämmennystä,
- vapina,
- agitaatio,
- hallusinaatiot,
- yliaktiiviset refleksit,
- pahoinvointi,
- oksentelua,
- ripuli,
- koordinaation menetys,
- päänsärky,
- sammaltava puhe,
- vakava heikkous ja
- epävakaa olo
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Celexa 20mg:n yleisimmät sivuvaikutukset ovat:
- muistiongelmia,
- keskittymisvaikeudet,
- päänsärky,
- uneliaisuus,
- kuiva suu,
- lisää hikoilua,
- tunnottomuus tai pistely,
- lisääntynyt ruokahalu,
- pahoinvointi,
- ripuli,
- kaasu,
- nopeat sydämenlyönnit,
- tärisevä olo,
- unihäiriö (unettomuus),
- väsynyt olo,
- vilustumisoireet (nenän tukkoisuus, aivastelu, kurkkukipu),
- painon muutokset ja
- vaikeuksia saada orgasmi
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Celexan mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Itsemurha- ja masennuslääkkeet
Masennuslääkkeet lisäsivät plaseboon verrattuna itsemurha-ajattelun ja -käyttäytymisen (itsetuhoisuuden) riskiä lapsilla, nuorilla ja nuorilla aikuisilla lyhytaikaisissa masennushäiriön (MDD) ja muiden psykiatristen häiriöiden tutkimuksissa. Jokaisen, joka harkitsee Celexan tai minkä tahansa muun masennuslääkkeen käyttöä lapsella, nuorella tai nuorella aikuisella, on tasapainotettava tämä riski kliinisen tarpeen kanssa. Lyhytaikaiset tutkimukset eivät osoittaneet lisääntynyttä itsemurhariskiä masennuslääkkeillä lumelääkkeeseen verrattuna yli 24-vuotiailla aikuisilla; 65-vuotiailla ja sitä vanhemmilla aikuisilla masennuslääkkeiden riski pieneni lumelääkkeeseen verrattuna. Masennus ja tietyt muut psykiatriset häiriöt liittyvät itsemurhariskin lisääntymiseen. Kaiken ikäisiä potilaita, jotka saavat masennuslääkehoitoa, tulee seurata asianmukaisesti ja tarkkailla kliinisen pahenemisen, itsemurha-ajattelun tai epätavallisten käyttäytymismuutosten varalta. Perheille ja omaishoitajille tulee kertoa tiiviin tarkkailun ja yhteydenpidon tarpeesta esimiehen kanssa. Celexa 10 mg ei ole hyväksytty käytettäväksi lapsipotilailla. (Katso VAROITUKSET: Kliininen paheneminen ja itsemurhariski, POTILASTIEDOT ja VAROTOIMET: Käyttö lapsille.)
KUVAUS
Celexa® (sitalopraami HBr) on suun kautta annettava selektiivinen serotoniinin takaisinoton estäjä (SSRI), jonka kemiallinen rakenne ei liity muiden SSRI-lääkkeiden tai trisyklisten, tetrasyklisten tai muiden saatavilla olevien masennuslääkkeiden rakenteeseen. Citalopram HBr on raseeminen bisyklinen ftalaanijohdannainen, jota kutsutaan nimellä (±)-1-(3-dimetyyliaminopropyyli)-1-(4-fluorifenyyli)-1,3-dihydroisobentsofuraani-5-karbonitriili, HBr, jolla on seuraava rakennekaava:
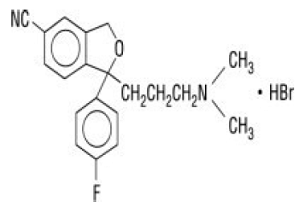
Molekyylikaava on C20H22BrFN2O ja sen molekyylipaino on 405,35.
Citalopram HBr esiintyy hienona, valkoisena tai luonnonvalkoisena jauheena. Citalopram HBr on niukkaliukoinen veteen ja liukenee etanoliin.
Celexa (sitalopraamihydrobromidi) on saatavana vain tabletin annosmuodossa.
Celexa 10 mg ovat kalvopäällysteisiä, soikeita tabletteja, jotka sisältävät sitalopraami HBr:a vahvuuksina, jotka vastaavat 10 mg sitalopraamiemästä. Celexa 20 mg ja 40 mg ovat kalvopäällysteisiä, soikeita, jakouurteisia tabletteja, jotka sisältävät sitalopraami-HBr:a vahvuuksina, jotka vastaavat 20 mg tai 40 mg sitalopraamiemästä. Tabletit sisältävät myös seuraavia inaktiivisia aineita: kopolyvidoni, maissitärkkelys, kroskarmelloosinatrium, glyseriini, laktoosimonohydraatti, magnesiumstearaatti, hypromelloosi, mikrokiteinen selluloosa, polyetyleeniglykoli ja titaanidioksidi. Rautaoksideja käytetään väriaineina beigeissä (10 mg) ja vaaleanpunaisissa (20 mg) tableteissa.
INDIKAATIOT
CELEXA 20 mg on tarkoitettu aikuisten vakavan masennushäiriön (MDD) hoitoon [ks. Kliiniset tutkimukset ].
ANNOSTELU JA HALLINNOINTI
Suositeltu annostus
Anna CELEXA kerran vuorokaudessa, ruuan kanssa tai ilman, aloitusannos 20 mg kerran vuorokaudessa ja nostamalla enimmäisannos 40 mg kerran vuorokaudessa vähintään viikon välein.
Yli 40 mg:n annoksia kerran päivässä ei suositella QT-ajan pidentymisen riskin vuoksi [katso VAROITUKSET JA VAROTOIMET ].
Kaksisuuntaisen mielialahäiriön näyttö ennen CELEXAn käynnistämistä
Ennen kuin aloitat hoidon CELEXA 20 mg:lla tai muulla masennuslääkkeellä, seulo potilaat henkilökohtaisen tai suvussa esiintyneen kaksisuuntaisen mielialahäiriön, manian tai hypomanian varalta [ks. VAROITUKSET JA VAROTOIMET ].
Suositeltu annostus tietyille väestöryhmille
Suurin suositeltu CELEXA 10 mg -annos yli 60-vuotiaille potilaille, potilaille, joilla on maksan vajaatoiminta ja CYP2C19-entsyymin heikko metaboloija, on 20 mg kerran päivässä [ks. VAROITUKSET JA VAROTOIMET , KLIININEN FARMAKOLOGIA ].
Annoksen muuttaminen CYP2C19-estäjien samanaikaisen käytön yhteydessä
Suurin suositeltu CELEXA-annos 20 mg, kun sitä käytetään samanaikaisesti CYP2C19-estäjän kanssa, on 20 mg kerran päivässä (ks. VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ].
Potilaiden vaihtaminen monoamiinioksidaasin estäjän masennuslääkkeeseen tai siitä pois
Monoamiinioksidaasin estäjän (MAOI) masennuslääkkeen käytön lopettamisen ja CELEXA-hoidon aloittamisen välillä on kuluttava vähintään 14 päivää. Sitä vastoin CELEXA-hoidon lopettamisen jälkeen on kuluttava vähintään 14 päivää ennen MAOI-masennuslääkehoidon aloittamista [ks. VASTA-AIHEET ja VAROITUKSET JA VAROTOIMET ].
CELEXA-hoidon lopettaminen
Haittavaikutuksia saattaa ilmetä, kun CELEXA-hoito lopetetaan [katso VAROITUKSET JA VAROTOIMET ]. Pienennä annosta vähitellen sen sijaan, että lopetat CELEXA-hoidon äkillisesti aina kun mahdollista.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
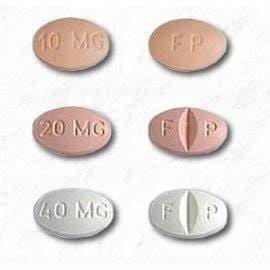
CELEXA 10 mg tabletteja on saatavana seuraavasti:
- 10 mg: beige, soikea, toiselle puolelle painettu "FP" ja toiselle puolelle "10 mg"
- 20 mg: vaaleanpunainen, soikea, jakouurre "F" painettu jakoviivan vasemmalle puolelle ja "P" painettu jakoviivan oikealle puolelle, "20 mg" painettu ei-uurteiselle puolelle
- 40 mg: valkoinen, soikea, jakouurre "F" painettu jakoviivan vasemmalle puolelle ja "P" painettu jakoviivan oikealle puolelle, "40 mg" painettu ei-uurteiselle puolelle
CELEXA (sitalopraami) -tabletit toimitetaan seuraavasti:
Varastointi ja käsittely
CELEXA 10 mg tabletit tulee säilyttää 20–25 °C:ssa (68–77 °F); retket sallitaan välillä 15-30 °C (59-86 °F) [katso USP-ohjattu huonelämpötila ].
Jakelija: Allergan USA, Inc. Tarkistettu: helmikuu 2022
SIVUVAIKUTUKSET
Seuraavia haittavaikutuksia käsitellään tarkemmin muissa merkintöjen osissa:
- Yliherkkyysreaktiot [ks VASTA-AIHEET ]
- Nuorten ja nuorten aikuisten itsemurha-ajatukset ja -käyttäytyminen [katso VAROITUKSET JA VAROTOIMET ]
- QT-ajan pidentyminen ja torsade de pointes [ks VAROITUKSET JA VAROTOIMET ]
- Serotoniinioireyhtymä [katso VAROITUKSET JA VAROTOIMET ]
- Lisääntynyt verenvuotoriski [katso VAROITUKSET JA VAROTOIMET ]
- Manian tai hypomanian aktivointi [katso VAROITUKSET JA VAROTOIMET ]
- Keskeytysoireyhtymä [katso VAROITUKSET JA VAROTOIMET ]
- Kohtaukset [katso VAROITUKSET JA VAROTOIMET ]
- Kulman sulkeutuva glaukooma [katso VAROITUKSET JA VAROTOIMET ]
- Hyponatremia [katso VAROITUKSET JA VAROTOIMET ]
- Seksuaalinen toimintahäiriö [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta kliinisessä käytännössä havaittuja nopeuksia.
CELEXA 20 mg:n turvallisuuteen sisältyi sitalopraamialtistukset potilailla ja/tai terveillä koehenkilöillä kolmesta eri tutkimusryhmästä: 429 tervettä henkilöä kliinisissä farmakologisissa/farmakokineettisissa tutkimuksissa; 4 422 altistusta potilailta kontrolloiduissa ja kontrolloimattomissa kliinisissä tutkimuksissa, mikä vastaa noin 1 370 potilasaltistusvuotta. Lisäksi oli yli 19 000 altistumista enimmäkseen avoimissa eurooppalaisissa markkinoille saattamisen jälkeisissä tutkimuksissa. CELEXA 10 mg -hoidon olosuhteet ja kesto vaihtelivat suuresti ja sisälsivät (päällekkäisissä luokissa) avoimet ja kaksoissokkotutkimukset, sairaala- ja avohoitotutkimukset, kiinteän annoksen ja annostitraustutkimukset sekä lyhyt- ja pitkäaikainen altistus .
Hoidon lopettamiseen liittyvät haittavaikutukset
Niistä 1 063 MDD-potilaasta, jotka saivat CELEXAa 10 mg 10 mg:n annoksilla 10 mg:n ja 80 mg:n välillä kerran päivässä lumekontrolloiduissa tutkimuksissa, jotka kestivät enintään 6 viikkoa, 16 % keskeytti hoidon haittavaikutuksen vuoksi, kun taas 8 % 446 potilaasta. saavat lumelääkettä. Taulukossa 2 on esitetty hoidon lopettamiseen liittyvät haittavaikutukset (eli hoidon lopettamiseen vähintään 1 %:lla CELEXA-hoitoa saaneista potilaista vähintään kaksinkertainen määrä lumelääkkeeseen verrattuna).
Taulukossa 3 luetellaan haittavaikutusten ilmaantuvuus 1 063 MDD-potilaalla, jotka saivat CELEXAa 20 mg annoksilla 10 mg - 80 mg kerran vuorokaudessa lumekontrolloiduissa tutkimuksissa, jotka kestivät enintään 6 viikkoa.
Yleisin CELEXA-hoitoa saaneilla potilailla esiintynyt haittavaikutus, jonka ilmaantuvuus oli vähintään 5 % ja vähintään kaksinkertainen lumelääkepotilailla, oli ejakulaatiohäiriö (pääasiassa siemensyöksyn viivästyminen) miespotilailla (katso taulukko 3).
Annosriippuvaiset haittavaikutukset
CELEXA 10 mg:n annoksen ja haittavaikutusten esiintyvyyden välistä mahdollista suhdetta tutkittiin kiinteän annoksen tutkimuksessa MDD-potilailla, jotka saivat lumelääkettä tai CELEXA 10 mg, 20 mg 40 mg tai 60 mg (1,5 kertaa suositeltu enimmäisannos). . Positiivinen annosvaste (p
Miesten ja naisten seksuaalinen toimintahäiriö SSRI-lääkkeiden kanssa
Vaikka muutokset seksuaalisessa halussa, seksuaalisessa suorituskyvyssä ja seksuaalisessa tyytyväisyydessä esiintyvät usein psykiatrisen häiriön ilmenemismuotoina, ne voivat olla myös seurausta SSRI-hoidosta. Luotettavia arvioita seksuaaliseen haluun, suorituskykyyn ja tyytyväisyyteen liittyvien ei-toivottujen kokemusten esiintyvyydestä ja vakavuudesta on kuitenkin vaikea saada osittain siksi, että potilaat ja terveydenhuollon tarjoajat saattavat olla haluttomia keskustelemaan niistä. Näin ollen arviot merkinnöissä mainituista ei-toivottujen seksuaalisten kokemusten ja suoritusten esiintyvyydestä voivat aliarvioida niiden todellisen esiintyvyyden.
Taulukossa 4 on esitetty seksuaalisten haittavaikutusten ilmaantuvuus, joita ilmoitti vähintään 2 % CELEXA 20 mg:aa saaneista miespotilaista lumekontrolloiduissa kliinisissä tutkimuksissa masennuksesta kärsivillä potilailla.
Naispuolisilla masentuneilla potilailla, jotka saivat CELEXAa 20 mg, alentunutta libidoa ja anorgasmiaa raportoitiin 1,3 %:lla (n = 638 naista) ja 1,1 %:lla (n = 252 naista).
Painon muutokset
Kontrolloiduissa tutkimuksissa CELEXA-hoitoa saaneiden potilaiden paino putosi noin 0,5 kg verrattuna lumelääkepotilaiden ei muutosta.
EKG:n muutokset
Perusteellisessa QT-tutkimuksessa CELEXAan todettiin liittyvän annoksesta riippuvaiseen QTc-ajan pidentymiseen.
CELEXA-ryhmien (N=802) ja lumelääkeryhmien (N=241) kardiogrammeja verrattiin poikkeaviin arvoihin, jotka määriteltiin koehenkilöiksi, joiden QTc:n muutokset olivat yli 60 ms lähtötasosta tai absoluuttiset arvot yli 500 ms annoksen jälkeen, ja henkilöt, joiden syke nousi yli 100 lyöntiä minuutissa tai laskee alle 50 lyöntiä minuutissa 25 %:n muutoksella lähtötilanteesta (takykardian tai bradykardian poikkeavuudet, vastaavasti). CELEXA-ryhmässä 1,9 %:lla potilaista QTcF muuttui lähtötilanteesta >60 ms, kun taas lumeryhmässä 1,2 %:lla potilaista. Yhdelläkään lumeryhmän potilailla ei ollut annoksen jälkeistä QTcF-arvoa >500 ms, verrattuna 0,5 %:iin CELEXA 10 mg -ryhmän potilaista. Takykardian poikkeamien ilmaantuvuus oli 0,5 % CELEXA-ryhmässä ja 0,4 % lumeryhmässä. Bradykardian poikkeamien ilmaantuvuus oli 0,9 % CELEXA 10 mg:n ryhmässä ja 0,4 % lumelääkeryhmässä.
Muut CELEXAn markkinointia edeltävän arvioinnin aikana havaitut haittavaikutukset
Seuraava luettelo haittavaikutuksista ei sisällä reaktioita, jotka ovat: 1) sisältyvät taulukkoon 3 tai muualla merkinnöissä, 2) joiden lääkkeen syy oli etäinen, 3) jotka olivat niin yleisiä, että ne eivät olleet informatiivisia ja jotka esiintyvät vain yksi potilas.
Haittavaikutukset on luokiteltu kehon järjestelmän mukaan ja lueteltu esiintymistiheyden mukaan alenevassa järjestyksessä seuraavien määritelmien mukaisesti: toistuvat haittavaikutukset ovat niitä, joita esiintyy yhden tai useamman kerran vähintään 1/100 potilaalla; Harvinaiset haittavaikutukset ovat niitä, joita esiintyy alle 1/100 potilaalla - 1/1000 potilaalla; Harvinaisia haittavaikutuksia ovat ne, joita esiintyy alle 1/1000 potilaalla.
Sydän- Usein: takykardia, posturaalinen hypotensio, hypotensio. Harvinainen: kohonnut verenpaine, bradykardia, turvotus (raajojen), angina pectoris, ekstrasystolat, sydämen vajaatoiminta, punoitus, sydäninfarkti, aivoverenkiertohäiriö, sydänlihaksen iskemia. Harvinainen: ohimenevä iskeeminen kohtaus, flebiitti, eteisvärinä, sydämenpysähdys, haarakatkos.
Keskus- ja ääreishermoston häiriöt - Usein: parestesia, migreeni. Harvinainen: hyperkinesia, huimaus, hypertonia, ekstrapyramidaalinen häiriö, jalkakrampit, tahattomat lihassupistukset, hypokinesia, neuralgia, dystonia, epänormaali kävely, hypoestesia, ataksia. Harvinaiset: epänormaali koordinaatio, hyperestesia, ptoosi, stupor.
Endokriiniset häiriöt - Harvinainen: kilpirauhasen vajaatoiminta, struuma, gynekomastia.
Ruoansulatuskanavan häiriöt Usein: lisääntynyt syljeneritys, ilmavaivat. Harvinainen: gastriitti, maha-suolitulehdus, suutulehdus, punoitus, peräpukamat, dysfagia, hampaiden narskuttelu, ientulehdus, ruokatorvitulehdus. Harvinaiset: paksusuolitulehdus, mahahaava, kolekystiitti, sappikivitauti, pohjukaissuolihaava, gastroesofageaalinen refluksi, glossiitti, keltaisuus, divertikuliitti, peräsuolen verenvuoto, hikka.
Yleistä - Harvoin : kuumat aallot, jäykkyys, alkoholi-intoleranssi, pyörtyminen, influenssan kaltaiset oireet. Harvinainen: heinänuha.
Hemic ja lymfaattiset häiriöt -Harvinainen: purppura, anemia, nenäverenvuoto, leukosytoosi, leukopenia, lymfadenopatia. Harvinainen: keuhkoembolia, granulosytopenia, lymfosytoosi, lymfopenia, hypokrominen anemia, hyytymishäiriö, ienverenvuoto.
Aineenvaihdunta- ja ravitsemushäiriöt - Usein: painon lasku, painon nousu. Harvinainen: kohonneet maksaentsyymiarvot, jano, silmien kuivuminen, alkalisen fosfataasin lisääntyminen, epänormaali glukoositoleranssi. Harvinainen: bilirubinemia, hypokalemia, liikalihavuus, hypoglykemia, hepatiitti, nestehukka.
Tuki- ja liikuntaelimistön häiriöt -Harvinainen: niveltulehdus, lihasheikkous, luurankokipu. Harvinainen: bursiitti, osteoporoosi.
Psykiatriset häiriöt -Usein: keskittymiskyvyn heikkeneminen, muistinmenetys, apatia, masennus, lisääntynyt ruokahalu, pahentunut masennus, itsemurhayritys, sekavuus. Harvinainen: lisääntynyt libido, aggressiivinen reaktio, paroniria, huumeriippuvuus, depersonalisaatio, hallusinaatiot, euforia, psykoottinen masennus, harhaluulo, vainoharhainen reaktio, emotionaalinen labilisuus, paniikkireaktio, psykoosi. Harvinaiset: katatoninen reaktio, melankolia.
Lisääntymishäiriöt/nainen* - Usein: amenorrea. Harvinainen: galaktorrea, rintojen kipu, rintojen suureneminen, emättimen verenvuoto. (*% perustuu vain naisiin: 2955)
Hengityselinten häiriöt - Usein: yskä. Harvinainen: keuhkoputkentulehdus, hengenahdistus, keuhkokuume. Harvinainen: astma, kurkunpäätulehdus, bronkospasmi, keuhkoputkentulehdus, lisääntynyt yskös.
Iho- ja lisäsairaudet - Usein: ihottuma, kutina. Harvinainen: valoherkkyysreaktio, nokkosihottuma, akne, ihon värimuutos, ekseema, hiustenlähtö, dermatiitti, ihon kuivuminen, psoriaasi. Harvinainen: hypertrichosis, vähentynyt hikoilu, melanoosi, keratiitti, selluliitti, kutina.
Erityiset aistit - Usein: epänormaali majoitus, makuaistin vääristyminen. Harvinainen: tinnitus, sidekalvotulehdus, silmäkipu. Harvinaiset: mydriaasi, valonarkuus, diplopia, epänormaali kyyneleritys, kaihi, makuaistin menetys.
Virtsatiejärjestelmän häiriöt - Usein: polyuria. Harvinainen: virtsaamistiheys, virtsanpidätyskyvyttömyys, virtsanpidätys, dysuria. Harvinainen: kasvojen turvotus, hematuria, oliguria, pyelonefriitti, munuaiskivi, munuaiskipu.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu sitalopraamin, rasemaatin tai escitalopraamin, sitalopraamin S-enantiomeerin, hyväksymisen jälkeen. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Veri- ja imusolmukkeiden häiriöt: hemolyyttinen anemia, trombosytopenia, protrombiinin lasku
Sydänhäiriöt: torsade de pointes, ventrikulaarinen rytmihäiriö, QT-ajan piteneminen
Endokriiniset häiriöt: hyperprolaktinemia
Silmäsairaudet: sulkukulmaglaukooma
Ruoansulatuskanavan häiriöt: maha-suolikanavan verenvuoto, haimatulehdus
Yleiset häiriöt ja hallinnolliset sivuston ehdot: vieroitusoireyhtymä
Maksan ja sappien häiriöt: maksanekroosi
Immuunijärjestelmän häiriöt: anafylaksia, allerginen reaktio
Tuki- ja liikuntaelimistön ja sidekudosten häiriöt: rabdomyolyysi
Hermoston häiriöt: grand mal -kouristukset, myoklonus, koreoatetoosi, dyskinesia, akatisia, nystagmus
Raskaus, synnytys ja perinataalit tilat: spontaani abortti
Psyykkiset häiriöt: delirium
Munuaisten ja virtsateiden häiriöt: akuutti munuaisten vajaatoiminta
Lisääntymisjärjestelmän ja rintojen häiriöt: priapismi
Ihon ja ihonalaisten kudosten häiriöt: Stevens Johnsonin oireyhtymä, epidermaalinen nekrolyysi, angioödeema, erythema multiforme, mustelma
Verisuonihäiriöt: tromboosi
HUUMEIDEN VUOROVAIKUTUKSET
Taulukossa 5 on esitetty kliinisesti tärkeät lääkeinteraktiot CELEXAn kanssa.
Huumeiden väärinkäyttö ja riippuvuus
Valvottu aine
CELEXA (sitalopraami HBr) ei ole valvottu aine.
Väärinkäyttö
Eläintutkimukset viittaavat siihen, että CELEXA 20 mg:n väärinkäyttöriski on pieni. CELEXAa ei ole tutkittu systemaattisesti ihmisillä sen mahdollisen väärinkäytön, sietokyvyn tai fyysisen riippuvuuden suhteen. Ennen markkinoille saattamista saatu kliininen kokemus CELEXAsta ei paljastanut mitään lääkkeitä etsivää käyttäytymistä. Nämä havainnot eivät kuitenkaan olleet systemaattisia, eikä tämän rajallisen kokemuksen perusteella ole mahdollista ennustaa, missä määrin keskushermostoon vaikuttavaa lääkettä käytetään väärin, ohjataan muualle ja/tai väärinkäyttöön sen jälkeen, kun se on markkinoille tullut. Tästä syystä terveydenhuollon tarjoajien tulee arvioida huolellisesti CELEXA 20 mg:n potilaiden anamneesi huumeiden väärinkäytön varalta ja seurata tällaisia potilaita tarkasti ja tarkkailla heitä väärinkäytön merkkien varalta (esim. sietokyvyn kehittyminen, annoksen suurentaminen, huumeiden etsintäkäyttäytyminen).
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Nuorten ja nuorten aikuisten itsemurha-ajatukset ja -käyttäytyminen
Plasebokontrolloitujen masennuslääkkeiden (SSRI-lääkkeiden ja muiden masennuslääkeryhmien) tutkimusten yhdistetyissä analyyseissä, joihin osallistui noin 77 000 aikuispotilasta ja 4 500 lapsipotilasta, itsemurha-ajatusten ja -käyttäytymisen ilmaantuvuus masennuslääkehoitoa saaneilla 24-vuotiailla ja sitä nuoremmilla potilailla oli suurempi kuin lumelääkettä saaneilla potilailla. Itsemurha-ajatusten ja -käyttäytymisen riskissä huumeiden välillä oli huomattavaa vaihtelua, mutta useimpien tutkittujen lääkkeiden kohdalla havaittiin lisääntynyt riski nuorilla potilailla. Itsemurha-ajatusten ja -käyttäytymisen absoluuttisessa riskissä oli eroja eri käyttöaiheissa, ja suurin ilmaantuvuus oli MDD-potilailla. Lääkkeen ja lumelääkkeen erot itsemurha-ajatusten ja -käyttäytymisen tapausten määrässä tuhatta hoidettua potilasta kohden on esitetty taulukossa 1.
Ei tiedetä, ulottuuko itsemurha-ajatusten ja -käyttäytymisen riski lapsilla, nuorilla ja nuorilla aikuisilla pitkäaikaiseen käyttöön, eli yli neljään kuukauteen. Kuitenkin lumekontrolloiduista ylläpitotutkimuksista aikuisilla, joilla on MDD, on olemassa merkittäviä todisteita siitä, että masennuslääkkeet viivästävät masennuksen uusiutumista ja että masennus itsessään on itsemurha-ajatusten ja -käyttäytymisen riskitekijä.
Seuraa kaikkia masennuslääkkeitä saaneita potilaita kliinisen pahenemisen ja itsemurha-ajatusten ja -käyttäytymisen varalta, erityisesti muutaman ensimmäisen lääkehoidon kuukausien aikana ja annosmuutosten aikana. Neuvo potilaiden perheenjäseniä tai hoitajia seuraamaan käyttäytymisensä muutoksia ja varoittamaan terveydenhuollon tarjoajaa. Harkitse hoito-ohjelman muuttamista, mukaan lukien CELEXA-hoidon mahdollista lopettamista potilailla, joiden masennus on jatkuvasti pahentunut tai joilla on ilmentäviä itsemurha-ajatuksia tai -käyttäytymistä.
QT-ajan pidentyminen ja torsade de pointes
CELEXA aiheuttaa annoksesta riippuvaa QTc-ajan pidentymistä ja EKG-poikkeavuutta, johon on liittynyt torsade de pointes (TdP), kammiotakykardia ja äkillinen kuolema, joita kaikkia on havaittu sitalopraamin markkinoille tulon jälkeisissä raporteissa [ks. HAITTAVAIKUTUKSET ].
QTc-ajan pidentymisen riskin vuoksi suuremmilla CELEXA-annoksilla 20 mg, CELEXAa ei suositella annettavaksi yli 40 mg:n annoksilla kerran vuorokaudessa (ks. ANNOSTELU JA HALLINNOINTI , KLIININEN FARMAKOLOGIA ].
CELEXAa tulee välttää potilailla, joilla on synnynnäinen pitkän QT-ajan oireyhtymä, bradykardia, hypokalemia tai hypomagnesemia, äskettäinen akuutti sydäninfarkti tai kompensoimaton sydämen vajaatoiminta, elleivät hyödyt ole suuremmat kuin riskit tietylle potilaalle. CELEXAa tulee myös välttää potilailla, jotka käyttävät muita QTc-aikaa pidentäviä lääkkeitä [ks HUUMEIDEN VUOROVAIKUTUKSET ]. Tällaisia lääkkeitä ovat luokan 1A (esim. kinidiini, prokaiiniamidi) tai luokan III (esim. amiodaroni, sotaloli) rytmihäiriölääkkeet, psykoosilääkkeet (esim. klooripromatsiini, tioridatsiini), antibiootit (esim. gatifloksasiini, moksifloksasiini) tai mikä tahansa muu lääkeluokka joiden tiedetään pidentävän QTc-aikaa (esim. pentamidiini, levometadyyliasetaatti, metadoni).
Sitalopraamin annosta tulee rajoittaa tietyissä populaatioissa. Enimmäisannos tulee rajoittaa 20 mg:aan kerran vuorokaudessa potilailla, jotka metaboloivat CYP2C19:tä heikosti tai saavat samanaikaisesti simetidiiniä tai muuta CYP2C19:n estäjää, koska sitalopraamialtistuksen odotetaan olevan suurempi. Enimmäisannos tulee myös rajoittaa 20 mg:aan kerran vuorokaudessa potilailla, joilla on maksan vajaatoiminta, ja potilailla, jotka ovat yli 60-vuotiaita odotettavissa olevan korkeamman altistuksen vuoksi [ks. ANNOSTELU JA HALLINNOINTI , HUUMEIDEN VUOROVAIKUTUKSET , Käyttö tietyissä populaatioissa , KLIININEN FARMAKOLOGIA ].
Elektrolyytti- ja/tai EKG-seuranta on suositeltavaa tietyissä olosuhteissa. Potilailta, joita harkitaan CELEXA 20 mg -hoitoa ja joilla on merkittävien elektrolyyttihäiriöiden riski, seerumin kalium- ja magnesiumpitoisuudet tulee mitata lähtötilanteessa ja seurata säännöllisesti. Hypokalemia (ja/tai hypomagnesemia) voi lisätä QTc-ajan pidentymisen ja rytmihäiriön riskiä, ja se on korjattava ennen hoidon aloittamista ja sitä on seurattava säännöllisesti. EKG-seurantaa suositellaan potilaille, joille CELEXA 10 mg:n käyttöä ei suositella, elleivät hyödyt ole selvästi suuremmat kuin riskit tietylle potilaalle (ks. edellä ). Näitä ovat potilaat, joilla on edellä mainitut sydänsairaudet, ja ne, jotka käyttävät muita lääkkeitä, jotka voivat pidentää QTc-aikaa.
Lopeta CELEXA 10 mg:n käyttö potilailla, joiden QTc-arvot jatkuvat >500 ms. Jos CELEXAa käyttävillä potilailla ilmenee oireita, jotka voivat viitata sydämen rytmihäiriöihin, kuten huimausta, sydämentykytystä tai pyörtymistä, lääkärin tulee aloittaa lisäarviointi, mukaan lukien sydämen seuranta.
Serotoniinin oireyhtymä
SSRI-lääkkeet, mukaan lukien CELEXA 20 mg, voivat laukaista serotoniinioireyhtymän, mahdollisesti hengenvaarallisen tilan. Riski kasvaa muiden serotonergisten lääkkeiden (mukaan lukien triptaanit, trisykliset masennuslääkkeet, fentanyyli, litium, tramadoli, tryptofaani, buspironi, amfetamiinit ja mäkikuisma) sekä serotoniinin aineenvaihduntaa heikentävien lääkkeiden, esim. MAOI:t [katso VASTA-AIHEET , HUUMEIDEN VUOROVAIKUTUKSET ]. Serotoniinioireyhtymä voi myös ilmaantua, kun näitä lääkkeitä käytetään yksinään. Serotoniinioireyhtymän oireita havaittiin 0,1 %:lla MDD-potilaista, joita hoidettiin CELEXA 20 mg:lla kliinisissä markkinoille tuloa edeltävissä tutkimuksissa.
Serotoniinioireyhtymän merkkejä ja oireita voivat olla mielentilan muutokset (esim. kiihtyneisyys, hallusinaatiot, delirium ja kooma), autonominen epävakaus (esim. takykardia, labiili verenpaine, huimaus, hikoilu, punoitus, hypertermia), hermo-lihasoireet (esim. jäykkyys, myoklonus, hyperrefleksia, koordinaatiohäiriöt), kohtaukset ja maha-suolikanavan oireet (esim. pahoinvointi, oksentelu, ripuli).
CELEXAn samanaikainen käyttö MAO-estäjien kanssa on vasta-aiheista. Älä myöskään aloita CELEXA 20 mg -hoitoa potilaalle, jota hoidetaan MAO-estäjillä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä. Mikään raportti ei koskenut metyleenisinisen antamista muilla reiteillä (kuten oraalisilla tableteilla tai paikallisilla kudosinjektioilla). Jos on tarpeen aloittaa MAO-estäjillä, kuten linetsolidilla tai suonensisäisellä metyleenisinisellä, potilaalla, joka käyttää CELEXA 10 mg:aa, keskeytä CELEXA 20 mg ennen MAO:n estäjähoidon aloittamista [ks. VASTA-AIHEET , HUUMEIDEN VUOROVAIKUTUKSET ].
Seuraa kaikkia CELEXA 20 mg:n potilaita serotoniinioireyhtymän ilmaantumisen varalta. Lopeta CELEXA-hoito ja kaikki samanaikaiset serotonergiset aineet välittömästi, jos yllä olevia oireita ilmaantuu, ja aloita tukeva oireenmukainen hoito. Jos CELEXAn samanaikainen käyttö muiden serotonergisten lääkkeiden kanssa on kliinisesti perusteltua, kerro potilaille lisääntyneestä serotoniinioireyhtymän riskistä ja seuraa oireita.
Lisääntynyt verenvuotoriski
Serotoniinin takaisinoton estoa häiritsevät lääkkeet, mukaan lukien CELEXA 20 mg, lisäävät verenvuototapahtumien riskiä. Aspiriinin, ei-steroidisten tulehduskipulääkkeiden (NSAIDS), muiden verihiutaleiden, varfariinin ja muiden antikoagulanttien samanaikainen käyttö voi lisätä tätä riskiä. Tapausraportit ja epidemiologiset tutkimukset (tapauskontrolli ja kohorttisuunnittelu) ovat osoittaneet yhteyden serotoniinin takaisinottoa häiritsevien lääkkeiden käytön ja maha-suolikanavan verenvuodon välillä. Serotoniinin takaisinottoa häiritseviin lääkkeisiin liittyvät verenvuototapahtumat ovat vaihdelleet mustelmasta, hematoomasta, nenäverenvuotosta ja petekioista hengenvaarallisiin verenvuotoon.
Kerro potilaille lisääntyneestä verenvuotoriskistä, joka liittyy CELEXA 20 mg:n ja verihiutaleiden estäjien tai antikoagulanttien samanaikaiseen käyttöön. Potilaille, jotka käyttävät varfariinia, tarkkaile huolellisesti kansainvälistä normalisoitua suhdetta [katso HUUMEIDEN VUOROVAIKUTUKSET ].
Manian tai hypomanian aktivointi
Potilailla, joilla on kaksisuuntainen mielialahäiriö, masennusjakson hoitaminen CELEXAlla tai muulla masennuslääkkeellä voi saada aikaan seka-/maanisen jakson. Kontrolloiduissa kliinisissä tutkimuksissa kaksisuuntaista mielialahäiriötä sairastavat potilaat suljettiin pois; manian tai hypomanian oireita raportoitiin kuitenkin 0,1 %:lla CELEXA-hoitoa saaneista diagnosoimattomista potilaista. Ennen kuin aloitat CELEXA 10 mg -hoidon, tarkista potilaat henkilökohtaisen tai suvussa esiintyneen kaksisuuntaisen mielialahäiriön, manian tai hypomanian varalta [ks. ANNOSTELU JA HALLINNOINTI ].
Keskeytysoireyhtymä
Haittavaikutuksia serotonergisten masennuslääkkeiden käytön lopettamisen jälkeen, erityisesti äkillisen lopettamisen jälkeen, ovat: pahoinvointi, hikoilu, dysforinen mieliala, ärtyneisyys, kiihtyneisyys, huimaus, aistihäiriöt (esim. parestesia, kuten sähköiskun tuntemukset), vapina, ahdistuneisuus, sekavuus, päänsärky, letargia, emotionaalinen labilisuus, unettomuus, hypomania, tinnitus ja kohtaukset. Annoksen asteittaista pienentämistä äkillisen lopettamisen sijaan suositellaan aina kun mahdollista [katso ANNOSTELU JA HALLINNOINTI ].
Kohtaukset
CELEXA 20 mg:aa ei ole arvioitu systemaattisesti potilailla, joilla on kohtaushäiriöitä. Potilaat, joilla on ollut kouristuskohtauksia, suljettiin pois kliinisistä tutkimuksista. CELEXA 20 mg:n kliinisissä tutkimuksissa kouristuskohtauksia esiintyi 0,3 %:lla CELEXA-hoitoa saaneista potilaista (yksi potilas 98 altistusvuotta kohden) ja 0,5 %:lla lumelääkettä saaneista potilaista (yksi potilas 50 altistusvuotta kohden). CELEXA 10 mg:aa tulee määrätä varoen potilaille, joilla on kohtaushäiriö.
Kulman sulkeutuva glaukooma
Pupillien laajentuminen, joka ilmenee monien masennuslääkkeiden, mukaan lukien CELEXA, käytön jälkeen, voi laukaista kulman sulkemiskohtauksen potilaalla, jolla on anatomisesti kapeat kulmat ja jolle ei ole tehty iridektomiaa. Vältä masennuslääkkeiden, mukaan lukien CELEXA, käyttöä potilailla, joiden anatomisesti kapeat kulmat ovat hoitamattomia.
Hyponatremia
Hyponatremiaa voi esiintyä SSRI-lääkkeiden, mukaan lukien CELEXA-hoidon, seurauksena. Tapauksia, joissa seerumin natriumpitoisuus on alle 110 mmol/l, on raportoitu. Hyponatremian merkkejä ja oireita ovat päänsärky, keskittymisvaikeudet, muistin heikkeneminen, sekavuus, heikkous ja epävakaus, jotka voivat johtaa kaatumiseen. Vakavampiin ja/tai akuutimpiin tapauksiin liittyviä merkkejä ja oireita ovat olleet hallusinaatiot, pyörtyminen, kouristukset, kooma, hengityspysähdys ja kuolema. Monissa tapauksissa tämä hyponatremia näyttää olevan seurausta epäasianmukaisen antidiureettisen hormonin erityksen oireyhtymästä (SIADH).
Jos potilaalla on oireinen hyponatremia, CELEXA-hoito on lopetettava ja asianmukainen lääketieteellinen toimenpide aloitettava. Iäkkäillä potilailla, diureetteja käyttävillä potilailla ja niillä, joilla on nestevajaus, voi olla suurempi riski saada hyponatremia SSRI-lääkkeiden käytön yhteydessä [ks. Käyttö tietyissä populaatioissa ].
Seksuaalinen toimintahäiriö
SSRI-lääkkeiden käyttö, mukaan lukien CELEXA, voi aiheuttaa seksuaalisen toimintahäiriön oireita [katso HAITTAVAIKUTUKSET ]. Miespotilailla SSRI:n käyttö voi johtaa siemensyöksyssä viivästymiseen tai epäonnistumiseen, libidon heikkenemiseen ja erektiohäiriöihin. Naispotilailla SSRI-lääkkeiden käyttö voi heikentää libidoa ja hidastaa orgasmia tai orgasmin puuttumista.
On tärkeää, että lääkärit tiedustelevat seksuaalista toimintaa ennen CELEXA-hoidon aloittamista ja tiedustelevat erityisesti seksuaalisen toiminnan muutoksista hoidon aikana, koska seksuaalista toimintaa ei välttämättä raportoida spontaanisti. Seksuaalisen toiminnan muutoksia arvioitaessa yksityiskohtainen historia (mukaan lukien oireiden alkamisajankohta) on tärkeää, koska seksuaalisilla oireilla voi olla muita syitä, mukaan lukien taustalla oleva psykiatrinen häiriö. Keskustele mahdollisista hoitostrategioista potilaiden tukemiseksi tekemään tietoisia hoitopäätöksiä.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ).
Itsemurha-ajatukset ja -käyttäytymiset
Neuvo potilaita ja omaishoitajia etsimään itsetuhoisuuden ilmaantumista, erityisesti hoidon alkuvaiheessa ja annosta säädettäessä ylös tai alas, ja neuvoa heitä ilmoittamaan tällaisista oireista terveydenhuollon tarjoajalle [ks. LAATIKKO VAROITUS , VAROITUKSET JA VAROTOIMET ].
QT-ajan pidentyminen ja torsade de pointes
Neuvo potilaita ottamaan yhteyttä terveydenhuollon tarjoajaan välittömästi, jos he tuntevat pyörtymistä, menettävät tajuntansa tai heillä on sydämentykytys. Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen, että he käyttävät CELEXAa ennen uusien lääkkeiden ottamista [katso VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ].
Serotoniinin oireyhtymä
Varo potilaita serotoniinioireyhtymän riskistä, erityisesti käytettäessä CELEXA 20 mg:aa samanaikaisesti muiden serotonergisten lääkkeiden kanssa, mukaan lukien triptaanit, trisykliset masennuslääkkeet, fentanyyli, litium, tramadoli, tryptofaani, buspironi, amfetamiinit, mäkikuisma ja lääkkeet, jotka heikentävät serotoniinin aineenvaihduntaa (erityisesti MAO-estäjät, sekä psykiatristen häiriöiden hoitoon tarkoitetut että muut, kuten linetsolidi). Neuvo potilaita ottamaan yhteyttä terveydenhuollon tarjoajaansa tai ilmoittamaan ensiapuun, jos heillä on serotoniinioireyhtymän merkkejä tai oireita [ks. VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ].
Lisääntynyt verenvuotoriski
Kerro potilaille CELEXA 10 mg:n samanaikaisesta käytöstä aspiriinin, tulehduskipulääkkeiden, muiden verihiutalelääkkeiden, varfariinin tai muiden antikoagulanttien kanssa, koska yhdistettyyn käyttöön on liittynyt lisääntynyt verenvuotoriski. Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajilleen, jos he käyttävät tai suunnittelevat ottavansa mitä tahansa resepti- tai käsikauppalääkkeitä, jotka lisäävät verenvuotoriskiä [ks. VAROITUKSET JA VAROTOIMET ].
Manian tai hypomanian aktivointi
Neuvo potilaita ja heidän hoitajiaan tarkkailemaan manian/hypomanian aktivoitumisen merkkejä ja neuvoa heitä ilmoittamaan tällaisista oireista terveydenhuollon tarjoajalle [ks. VAROITUKSET JA VAROTOIMET ].
Keskeytysoireyhtymä
Neuvo potilaita olemaan keskeyttämättä CELEXA-hoitoa äkillisesti ja keskustelemaan kaikista kapenevista hoito-ohjelmista terveydenhuollon tarjoajan kanssa. Kerro potilaille, että haittavaikutuksia voi ilmetä, kun CELEXA 20 mg -hoito lopetetaan [katso VAROITUKSET JA VAROTOIMET ].
Seksuaalinen toimintahäiriö
Kerro potilaille, että CELEXAn käyttö voi aiheuttaa seksuaalisen toimintahäiriön oireita sekä mies- että naispotilailla. Kerro potilaille, että heidän tulee keskustella kaikista seksuaalisen toiminnan muutoksista ja mahdollisista hoitostrategioista terveydenhuollon tarjoajan kanssa [katso VAROITUKSET JA VAROTOIMET ].
Raskaus
- Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen, jos he tulevat raskaaksi tai aikovat tulla raskaaksi CELEXA-hoidon aikana [ks. Käyttö tietyissä populaatioissa ].
- Kerro potilaille, että CELEXA:n käyttö raskauden loppuvaiheessa voi lisätä vastasyntyneiden komplikaatioiden riskiä, jotka vaativat pitkäaikaista sairaalahoitoa, hengitystukea, letkuruokintaa ja/tai vastasyntyneen jatkuvaa keuhkoverenpainetautia (PPHN) [ks. Käyttö tietyissä populaatioissa ].
- Kerro naisille, että on olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet sitalopraamille raskauden aikana [ks. Käyttö tietyissä populaatioissa ].
Imetys
Neuvo imettäviä naisia tarkkailemaan imeväisten liiallista sedaatiota, levottomuutta, kiihtyneisyyttä, huonoa ruokintaa ja huonoa painonnousua ja hakeutumaan lääkärin hoitoon, jos he huomaavat nämä merkit [ks. Käyttö tietyissä populaatioissa ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Sitalopraami lisäsi ohutsuolen karsinooman ilmaantuvuutta rotilla, joita hoidettiin 24 kuukauden ajan annoksilla 8 ja 24 mg/kg/vrk ruokavalion yhteydessä, jotka ovat noin 2 ja 6 kertaa 40 mg:n suurin suositeltu ihmisannos (MRHD). perustuu mg/m² kehon pinta-alaan. Ei-vaikutustasoa (NOEL) tälle löydökselle ei määritetty.
Sitalopraami ei lisännyt kasvainten ilmaantuvuutta hiirillä, joita hoidettiin 18 kuukauden ajan annoksilla 240 mg/kg/vrk, mikä on noin 30 kertaa MRDH 40 mg laskettuna mg/m² kehon pinta-alasta.
Mutageneesi
Sitalopraami oli mutageeninen in vitro bakteerien käänteismutaatiomäärityksessä (Ames-testi) kahdessa viidestä bakteerikannasta (Salmonella TA98 ja TA1537) ilman metabolista aktivaatiota. Se oli klastogeeninen in vitro kiinanhamsterin keuhkosolumäärityksessä kromosomipoikkeavuuksien toteamiseksi metabolisen aktivaation läsnä ollessa tai ilman. Sitalopraami ei ollut mutageeninen in vitro nisäkkään eteenpäin suuntautuvassa geenimutaatiomäärityksessä (HPRT) hiiren lymfoomasoluissa eikä in vitro/in vivo unscheduled DNA synthesis (UDS) -määrityksessä rotan maksassa. Se ei ollut klastogeeninen ihmisen lymfosyyttien in vitro kromosomipoikkeavuusmäärityksessä eikä kahdessa in vivo hiiren mikrotumamäärityksessä.
Hedelmällisyyden heikkeneminen
Sitalopraamia annettiin suun kautta naaras- ja urosrotille annoksina 32, 48 ja 72 mg/kg/vrk ennen parittelua ja sen ajan ja tiineyden jatkuessa. Nämä annokset ovat noin 8, 12 ja 17 kertaa MRHD 40 mg laskettuna mg/m² kehon pinta-alasta. Parittelu ja hedelmällisyys vähenivät annoksilla ≥ 32 mg/kg/vrk, mikä on noin 8 kertaa MRHD.
Raskauden kestoa pidennettiin annoksella 48 mg/kg/vrk, mikä on noin 12 kertaa MRHD.
Käyttö tietyissä populaatioissa
Raskaus
Raskausaltistusrekisteri
On olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet masennuslääkkeille raskauden aikana. Terveydenhuollon tarjoajia kannustetaan rekisteröimään potilaita soittamalla National Pregnancy Registry for Antidepressants numeroon 1-844-405-6185 tai käymällä verkossa osoitteessa https://womensmentalhealth.org/research/pregnancyregistry/antidepressants.
Riskien yhteenveto
Saatavilla olevat tiedot julkaistuista epidemiologisista tutkimuksista ja markkinoille tulon jälkeisistä raporteista sitalopraamin käytöstä raskauden aikana eivät ole osoittaneet suurentunutta vakavien synnynnäisten epämuodostumien tai keskenmenon riskiä. Julkaistut tutkimukset osoittivat, että sitalopraamipitoisuudet sekä napanuoraveressä että lapsivedessä ovat samanlaisia kuin äidin seerumissa. Vastasyntyneen jatkuvan keuhkoverenpainetaudin (PPHN) riskit ovat olemassa (ks Data ) ja/tai vastasyntyneen huono sopeutuminen raskauden aikana altistumiseen selektiivisille serotoniinin takaisinoton estäjille (SSRI), mukaan lukien CELEXA. Hoitamattomaan masennukseen liittyy myös riskejä raskauden aikana (ks Kliiniset näkökohdat ).
Eläinten lisääntymistutkimuksissa sitalopraami aiheutti haitallisia alkio-/sikiövaikutuksia annoksilla, jotka aiheuttivat toksisuutta emolle (ks. Data ).
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Kaikilla raskauksilla on taustalla riski synnynnäisistä epämuodostumista, menetyksestä tai muista haitallisista seurauksista. Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 prosenttia ja 15–20 prosenttia.
Kliiniset näkökohdat
Äidin ja/tai alkion/sikiön sairauteen liittyvä riski
Naiset, jotka lopettavat masennuslääkkeiden käytön raskauden aikana, kokevat todennäköisemmin vakavan masennuksen uusiutumisen kuin naiset, jotka jatkavat masennuslääkkeiden käyttöä. Tämä havainto on prospektiivisesta pitkittäistutkimuksesta, johon osallistui 201 raskaana olevaa naista, joilla on ollut vakava masennushäiriö ja jotka olivat eutymia ja käyttivät masennuslääkkeitä raskauden alussa. Ota huomioon hoitamattoman masennuksen riski, kun lopetat tai vaihdat masennuslääkehoitoa raskauden ja synnytyksen aikana.
Sikiön/vastasyntyneen haittavaikutukset
Vastasyntyneille, jotka ovat altistuneet CELEXAlle ja muille SSRI-lääkkeille kolmannen raskauskolmanneksen lopussa, on kehittynyt komplikaatioita, jotka vaativat pitkäaikaista sairaalahoitoa, hengitystukea ja letkuruokintaa. Tällaiset komplikaatiot voivat ilmaantua heti synnytyksen jälkeen. Raportoituja kliinisiä löydöksiä ovat olleet hengitysvaikeudet, syanoosi, apnea, kohtaukset, lämpötilan epävakaus, ruokintavaikeudet, oksentelu, hypoglykemia, hypotonia, hypertonia, hyperrefleksia, vapina, hermostuneisuus, ärtyneisyys ja jatkuva itku. Nämä löydökset ovat yhdenmukaisia joko SSRI-lääkkeiden suoran toksisen vaikutuksen tai mahdollisesti lääkkeen lopettamisen oireyhtymän kanssa. On huomattava, että joissakin tapauksissa kliininen kuva on yhdenmukainen serotoniinioireyhtymän kanssa [katso VAROITUKSET JA VAROTOIMET ].
Data
Ihmistiedot
Altistuminen SSRI-lääkkeille raskauden loppuvaiheessa saattaa lisätä vastasyntyneen keuhkoverenpainetaudin (PPHN) riskiä. PPHN:tä esiintyy 1–2:lla 1 000 elävänä syntynyttä kohden väestössä, ja se liittyy huomattavaan vastasyntyneiden sairastuvuuteen ja kuolleisuuteen.
Eläinten tiedot
Sitalopraamia annettiin suun kautta tiineille rotille organogeneesin aikana annoksilla 32, 56 ja 112 mg/kg/vrk, jotka ovat noin 8, 14 ja 27 kertaa 40 mg:n suurin suositeltu ihmisannos (MRHD). mg/m² kehon pinta-alasta. Sitalopraami aiheutti emolle CNS-kliinisten oireiden toksisuutta ja vähensi painonnousua annoksella 112 mg/kg/vrk, mikä on 27 kertaa MRHD. Tällä emolle toksisella annoksella sitalopraami vähensi alkion/sikiön kasvua ja eloonjäämistä ja lisäsi sikiön poikkeavuuksia (mukaan lukien sydän- ja verisuoni- ja luustovauriot). Ei havaittu haitallinen vaikutus (NOAEL) emolle ja alkiosikiölle toksisuudelle on 56 mg/kg/vrk, mikä on noin 14 kertaa MRHD.
Sitalopraamia annettiin suun kautta tiineille kaniineille organogeneesin aikana annoksina 16 mg/kg/vrk asti, mikä on noin 8 kertaa MRHD 40 mg laskettuna mg/m² kehon pinta-alasta. Ei havaittu toksisuutta äidille tai sikiölle. Äidin ja alkion ja sikiön toksisuuden NOAEL on 16 mg/kg/vrk, mikä on noin 8 kertaa MRHD.
Sitalopraamia annettiin suun kautta raskaana oleville rotille myöhään tiineyden ja imetyksen aikana annoksilla 4,8, 12,8 ja 32 mg/kg/vrk, jotka ovat noin 1, 3 ja 8 kertaa MRHD 40 mg, laskettuna mg/m² kehosta. pinta-ala. Sitalopraami lisäsi jälkeläisten kuolleisuutta ensimmäisten neljän syntymäpäivän aikana ja hidasti jälkeläisten kasvua annoksella 32 mg/kg/vrk, mikä on noin 8 kertaa MRHD. Kehitystoksisuuden NOAEL on 12,8 mg/kg/vrk, mikä on noin 3 kertaa MRHD. Erillisessä tutkimuksessa havaittiin samanlaisia vaikutuksia jälkeläisten kuolleisuuteen ja kasvuun, kun emoja hoidettiin koko tiineyden ja varhaisen imetyksen ajan annoksilla ≥ 24 mg/kg/vrk, mikä on noin 6 kertaa MRHD. NOAEL-arvoa ei määritetty tässä tutkimuksessa.
Imetys
Riskien yhteenveto
Julkaistun kirjallisuuden tiedot raportoivat sitalopraamin esiintyvän äidinmaidossa suhteellisilla imeväisten annoksilla, jotka vaihtelevat välillä 0,7 - 9,4 % äidin painon mukaan sovitetusta annoksesta ja maito/plasma-suhteen välillä 0,78 - 4,3. On raportoitu, että sitalopraamille altistuneet imeväiset ovat kokeneet ärtyneisyyttä, levottomuutta, liiallista uneliaisuutta, vähentynyttä ruokintaa ja painon laskua (ks. Kliiniset näkökohdat ). Sitalopraamin vaikutuksista maidontuotantoon ei ole tietoa.
Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon, äidin kliininen CELEXA 20 mg:n tarve ja CELEXA 20 mg:n mahdolliset haitalliset vaikutukset imetettävään lapseen tai äidin taustalla oleva tila.
Kliiniset näkökohdat
Tarkkaile imettäviä vauvoja haittavaikutusten varalta, kuten ärtyneisyys, levottomuus, liiallinen uneliaisuus, vähentynyt ruokinta ja painonpudotus.
Käyttö lapsille
CELEXAn turvallisuutta ja tehoa ei ole osoitettu lapsipotilailla. CELEXA 20 mg:n annoksella on suoritettu kaksi lumekontrolloitua tutkimusta 407:llä MDD-potilaalla, eivätkä tiedot riittäneet tukemaan käyttöä lapsipotilailla.
Masennuslääkkeet lisäävät itsemurha-ajatusten ja -käyttäytymisen riskiä lapsipotilailla [katso LAATIKKO VAROITUS , VAROITUKSET JA VAROTOIMET ]. Vähentynyttä ruokahalua ja painon laskua on havaittu SSRI-lääkkeiden käytön yhteydessä lapsipotilailla.
Geriatrinen käyttö
CELEXA 20 mg:n kliinisissä tutkimuksissa 4422 potilaasta 1357 oli 60-vuotiaita tai sitä vanhempia, 1034 oli 65-vuotiaita tai vanhempia ja 457 oli 75-vuotiaita tai vanhempia. Kahdessa farmakokineettisessä tutkimuksessa sitalopraamin AUC nousi 23 % ja 30 % ≥ 60-vuotiailla koehenkilöillä nuorempiin koehenkilöihin verrattuna, ja sen puoliintumisaika piteni 30 % ja 50 % (ks. KLIININEN FARMAKOLOGIA ]. Siksi suurin suositeltu annos 60-vuotiaille ja sitä vanhemmille potilaille on pienempi kuin nuoremmilla potilailla [katso ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET ].
SSRI-lääkkeitä, mukaan lukien CELEXA, on yhdistetty kliinisesti merkittäviin hyponatremiatapauksiin iäkkäillä potilailla, joilla saattaa olla suurempi riski saada tämä haittavaikutus [ks. VAROITUKSET JA VAROTOIMET ].
Maksan vajaatoiminta
Lisääntynyttä sitalopraamialtistusta esiintyy potilailla, joilla on maksan vajaatoiminta. Suurin suositeltu CELEXA 10 mg:n annos on pienempi potilailla, joilla on maksan vajaatoiminta [ks. ANNOSTELU JA HALLINNOINTI , KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Seuraavia on raportoitu Celexa-tabletin yliannostuksen yhteydessä:
- Kohtaukset, jotka voivat viivästyä, ja muuttunut henkinen tila mukaan lukien kooma.
- Kardiovaskulaarinen toksisuus, joka voi viivästyä, mukaan lukien QRS- ja QTc-ajan pidentyminen, laajat monimutkaiset takyarytmiat ja torsade de pointes. Hypertensio on yleisimmin havaittu, mutta harvoin hypotensiota voi esiintyä yksinään tai samanaikaisesti alkoholin kanssa.
- Serotoniinioireyhtymä (potilailla, joilla on useita muita proserotonergisiä lääkkeitä yliannostettuja, saattaa olla suurempi riski).
Sydämen pitkittynyttä seurantaa suositellaan Celexan yliannostuksen yhteydessä rytmihäiriöriskin vuoksi. Ruoansulatuskanavan dekontaminaatiota aktiivihiilellä tulee harkita potilailla, jotka ilmaantuvat varhain Celexa 10 mg:n yliannostuksen jälkeen. Ota yhteyttä myrkytyskeskukseen (1-800-221-2222) tai lääketieteelliseen toksikologian saadaksesi yliannostuksen hallintaa koskevia lisäsuosituksia.
VASTA-AIHEET
CELEXA on vasta-aiheinen potilailla:
- MAO-estäjien (mukaan lukien MAO-estäjät, kuten linetsolidi tai suonensisäinen metyleenisininen) ottaminen tai 14 päivän kuluessa sen lopettamisesta serotoniinioireyhtymän lisääntyneen riskin vuoksi (ks. VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ].
- pimotsidin ottaminen QT-ajan pidentymisen riskin vuoksi [ks HUUMEIDEN VUOROVAIKUTUKSET ].
- joiden tiedetään olevan yliherkkiä sitalopraamille tai jollekin CELEXAn inaktiiviselle aineelle. Reaktioihin on kuulunut angioödeema ja anafylaksia [katso HAITTAVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Sitalopraamin vaikutusmekanismi on epäselvä, mutta sen oletetaan liittyvän serotonergisen aktiivisuuden voimistumiseen keskushermostossa (CNS), joka johtuu sen serotoniinin (5-HT) keskushermoston hermosolujen takaisinoton estämisestä.
Farmakodynamiikka
Eläimillä tehdyt in vitro- ja in vivo -tutkimukset viittaavat siihen, että sitalopraami on selektiivinen serotoniinin takaisinoton estäjä (SSRI), jolla on minimaaliset vaikutukset norepinefriinin (NE) ja dopamiinin (DA) hermosolujen takaisinottoon.
Sitalopraamilla ei ole tai on erittäin alhainen affiniteetti 5-HT1A-, 5-HT2A-, dopamiini D1- ja D2-, α1-, α2- ja β-adrenergisiin reseptoreihin, histamiini H1:een, gamma-aminovoihappoon (GABA), muskariinikolinergisiin reseptoreihin ja bentsodiatsepiinireseptoreihin.
Sydämen elektrofysiologia
Yksilöllisesti korjattu QTc-aika (QTcNi) arvioitiin satunnaistetussa, lumelääke- ja aktiivisessa (moksifloksasiini 400 mg) kontrolloidussa ristikkäistutkimuksessa, jossa oli 119 tervettä henkilöä. Suurin keskimääräinen (95 %:n yksipuolisen luottamusvälin yläraja) ero lumelääkkeeseen oli 8,5 (10,8) ja 18,5 (21,0) ms sitalopraamilla 20 mg:lla ja 60 mg:lla (1,5 kertaa suositeltu enimmäisannos). Vakiintuneen altistus-vaste-suhteen perusteella ennustettu QTcNi-muutos lumelääkkeestä (95 %:n yksipuolisen luottamusvälin yläraja) Cmax-arvon alapuolella 40 mg:n annoksella on 12,6 (14,3) ms [ks. VAROITUKSET JA VAROTOIMET ].
Farmakokinetiikka
Sitalopraamin kerta- ja usean annoksen farmakokinetiikka on lineaarinen ja suhteessa annokseen annosalueella 10-40 mg/vrk. Sitalopraamin biotransformaatio tapahtuu pääasiassa maksassa, ja sen keskimääräinen terminaalinen puoliintumisaika on noin 35 tuntia. Kerran vuorokaudessa otetulla annoksella vakaan tilan plasmapitoisuudet saavutetaan noin viikossa. Vakaassa tilassa sitalopraamin plasmaan kertymisen määrän odotetaan puoliintumisajan perusteella olevan 2,5 kertaa kerta-annoksen jälkeen havaitut plasmapitoisuudet.
Imeytyminen
Yhden oraalisen sitalopraamin (40 mg:n tabletti) annoksen jälkeen veren huippupitoisuus saavutetaan noin 4 tunnin kuluttua. Sitalopraamin absoluuttinen biologinen hyötyosuus oli noin 80 % suonensisäiseen annokseen verrattuna, eikä ruoka vaikuta imeytymiseen.
Jakelu
Sitalopraamin jakautumistilavuus on noin 12 l/kg ja sitalopraamin (CT), demetyylisitalopraamin (DCT) ja didemetyylisitalopraamin (DDCT) sitoutuminen ihmisen plasman proteiineihin on noin 80 %.
Eliminointi
Aineenvaihdunta
Sitalopraami metaboloituu demetyylisitalopraamiksi (DCT), didemetyylisitalopraamiksi (DDCT), sitalopraami-N-oksidiksi ja deaminoiduksi propionihappojohdannaiseksi. Ihmisillä muuttumaton sitalopraami on pääasiallinen yhdiste plasmassa. Vakaassa tilassa sitalopraamin metaboliittien, DCT:n ja DDCT:n, pitoisuudet plasmassa ovat noin puolet ja vastaavasti kymmenesosa alkuperäisen lääkkeen pitoisuudesta. In vitro -tutkimukset osoittavat, että sitalopraami on vähintään 8 kertaa tehokkaampi kuin sen metaboliitit serotoniinin takaisinoton estämisessä, mikä viittaa siihen, että arvioidut metaboliitit eivät todennäköisesti vaikuta merkittävästi sitalopraamin masennusta ehkäiseviin vaikutuksiin.
Ihmisen maksan mikrosomeilla tehdyt in vitro -tutkimukset osoittivat, että CYP3A4 ja CYP2C19 ovat ensisijaiset isotsyymit, jotka osallistuvat sitalopraamin N-demetylaatioon.
Erittyminen
Sitalopraamin suonensisäisen annostelun jälkeen lääkkeen osuus virtsasta sitalopraamina ja DCT:nä oli vastaavasti noin 10 % ja 5 %. Sitalopraamin systeeminen puhdistuma oli 330 ml/min, josta noin 20 % johtui munuaispuhdistumasta.
Tietyt populaatiot
Geriatriset potilaat
Sitalopraamin farmakokinetiikkaa ≥ 60-vuotiailla koehenkilöillä verrattiin nuorempiin koehenkilöihin kahdessa normaalissa vapaaehtoistutkimuksessa. Kerta-annostutkimuksessa sitalopraamin AUC ja puoliintumisaika pidentyivät ≥ 60-vuotiailla koehenkilöillä 30 % ja 50 %, kun taas toistuvan annoksen tutkimuksessa ne nousivat 23 % ja 30 %. katso ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET , Käyttö tietyissä populaatioissa ].
Mies- ja naispotilaat
Kolmessa farmakokineettisessä tutkimuksessa (yhteensä N=32) sitalopraamin AUC oli naisilla puolitoista-kaksi kertaa miehiin verrattuna. Tätä eroa ei havaittu viidessä muussa farmakokineettisessä tutkimuksessa (yhteensä N = 114). Kliinisissä tutkimuksissa ei havaittu eroja vakaan tilan seerumin sitalopraamitasoissa miesten (N=237) ja naisten (N=388) välillä. DCT:n ja DDCT:n farmakokinetiikassa ei ollut sukupuolten välisiä eroja.
Potilaat, joilla on maksan vajaatoiminta
Sitalopraamin oraalinen puhdistuma pieneni 37 % ja puoliintumisaika kaksinkertaistui potilailla, joiden maksan toiminta oli heikentynyt normaaleihin koehenkilöihin verrattuna [ks. ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET , Käyttö tietyissä populaatioissa ].
Potilaat, joilla on munuaisten vajaatoiminta
Potilailla, joilla oli lievä tai kohtalainen munuaisten vajaatoiminta, sitalopraamin oraalinen puhdistuma pieneni 17 % normaaleihin koehenkilöihin verrattuna. Tällaisten potilaiden annostusta ei suositella. Sitalopraamin farmakokinetiikasta ei ole saatavilla tietoja potilailla, joilla on vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma
CYP2C19 Huonosti metaboloijat
CYP2C19:n hitailla metaboloijilla sitalopraamin vakaan tilan Cmax nousi 68 % ja AUC 107 % [ks. ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET ].
CYP2D6 Huonosti metaboloijat
Sitalopraamin vakaan tilan pitoisuudet eivät eronneet merkitsevästi hitailla ja nopeilla CYP2D6:n metaboloijilla.
Huumeiden vuorovaikutustutkimukset
In vitro -entsyymien estotiedot eivät paljastaneet sitalopraamilla estävää vaikutusta CYP3A4-, -2C9- tai -2E1-entsyymeihin, mutta viittasivat siihen, että se on heikko CYP1A2-, -2D6- ja -2C19-estäjä. Sitalopraamilla oletetaan olevan vain vähän estävää vaikutusta näiden entsyymien välittämään in vivo -metaboliaan. In vivo -tiedot tämän kysymyksen ratkaisemiseksi ovat kuitenkin rajallisia.
CYP3A4- ja CYP2C19-estäjät
Koska CYP3A4 ja CYP2C19 ovat ensisijaiset entsyymit, jotka osallistuvat sitalopraamin metaboliaan, on odotettavissa, että voimakkaat CYP3A4:n estäjät (esim. ketokonatsoli, itrakonatsoli ja makrolidiantibiootit) ja CYP2C19:n estäjät (esim. omepratsoli, simetidiini) saattavat vähentää sitalopraamin puhdistumaa. sitalopraami. Sitalopraamin ja voimakkaan CYP3A4-estäjän ketokonatsolin samanaikainen anto ei kuitenkaan vaikuttanut merkittävästi sitalopraamin farmakokinetiikkaan. 20 mg/vrk on suurin suositeltu sitalopraamiannos potilailla, jotka käyttävät samanaikaisesti simetidiiniä tai muuta CYP2C19-estäjää QT-ajan pidentymisen riskin vuoksi [ks. ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET ].
Simetidiini
Koehenkilöillä, jotka olivat saaneet 21 päivän ajan 40 mg/vrk CELEXA 10 mg, yhdistetty 400 mg:n simetidiinin antaminen kahdesti päivässä 8 päivän ajan johti sitalopraamin AUC-arvon nousuun 43 % ja Cmax:iin 39 % [ks. ANNOSTELU JA HALLINNOINTI , VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ].
CYP2D6:n estäjät
CYP2D6:ta estävän lääkkeen antamisella samanaikaisesti sitalopraamin kanssa ei todennäköisesti ole kliinisesti merkittäviä vaikutuksia sitalopraamin metaboliaan, mikä perustuu tutkimustuloksiin CYP2D6:n hitailla metaboloijilla.
Digoksiini
Koehenkilöillä, jotka olivat saaneet 21 päivää 40 mg/vrk CELEXA 20 mg, CELEXA:n ja digoksiinin (1 mg:n kerta-annos) yhdistetty anto ei vaikuttanut merkitsevästi sitalopraamin tai digoksiinin farmakokinetiikkaan.
Litium
CELEXAn (40 mg/vrk 10 päivän ajan) ja litiumin (30 mmol/vrk 5 päivän ajan) samanaikaisella antamisella ei ollut merkittävää vaikutusta sitalopraamin tai litiumin farmakokinetiikkaan.
Pimotsidi
Kontrolloidussa tutkimuksessa pimotsidin 2 mg:n kerta-annos annettuna kerran vuorokaudessa 40 mg:n sitalopraamin kanssa 11 päivän ajan liittyi QTc-arvojen keskimääräiseen nousuun noin 10 ms verrattuna pelkkään pimotsidiin. Sitalopraami ei muuttanut pimotsidin keskimääräistä AUC- tai Cmax-arvoa. Tämän farmakodynaamisen yhteisvaikutuksen mekanismia ei tunneta [katso VASTA-AIHEET , VAROITUKSET JA VAROTOIMET ].
Teofylliini
CELEXAn (40 mg/vrk 21 päivän ajan) ja CYP1A2-substraatin teofylliinin (300 mg:n kerta-annos) yhdistelmähoito ei vaikuttanut teofylliinin farmakokinetiikkaan. Teofylliinin vaikutusta sitalopraamin farmakokinetiikkaan ei arvioitu.
Varfariini
CELEXA-annos 40 mg/vrk 21 päivän ajan ei vaikuttanut varfariinin, CYP3A4-substraatin, farmakokinetiikkaan. Protrombiiniaika nousi 5 %, jonka kliinistä merkitystä ei tunneta.
Karbamatsepiini
CELEXAn (40 mg/vrk 14 päivän ajan) ja karbamatsepiinin (titrattu 400 mg/vrk 35 päivän ajan) yhdistelmähoito ei vaikuttanut merkitsevästi CYP3A4-substraatin, karbamatsepiinin, farmakokinetiikkaan. Vaikka sitalopraamin pitoisuudet plasmassa eivät muuttuneet, karbamatsepiinin entsyymejä indusoivat ominaisuudet huomioon ottaen on otettava huomioon mahdollisuus, että karbamatsepiini lisää sitalopraamin puhdistumaa, jos näitä kahta lääkettä annetaan samanaikaisesti.
Triatsolaami
CELEXAn (titrattu annokseen 40 mg/vrk 28 päivän ajan) ja CYP3A4-substraattitriatsolaamin (0,25 mg:n kerta-annos) yhdistelmä ei vaikuttanut merkittävästi sitalopraamin tai triatsolaamin farmakokinetiikkaan.
Ketokonatsoli
CELEXA:n (40 mg) ja ketokonatsolin (200 mg) yhdistelmäkäyttö pienensi ketokonatsolin Cmax-arvoa 21 % ja AUC 10 %, eikä se vaikuttanut merkittävästi sitalopraamin farmakokinetiikkaan.
Metoprololi
CELEXA 20 mg:n 40 mg/vrk antaminen 22 päivän ajan johti kaksinkertaiseen beeta-adrenergisen salpaajan metoprololin pitoisuuden nousuun plasmassa. Plasman kohonneet metoprololipitoisuudet on yhdistetty vähentyneeseen kardioselektiivisyyteen. CELEXA 10 mg:n ja metoprololin yhteiskäytöllä ei ollut kliinisesti merkittäviä vaikutuksia verenpaineeseen tai sykeen.
Imipramiini ja muut trisykliset masennuslääkkeet (TCA)
In vitro -tutkimukset viittaavat siihen, että sitalopraami on suhteellisen heikko CYP2D6:n estäjä. CELEXAn (40 mg/vrk 10 päivän ajan) samanaikainen anto TCA-imipramiinin (100 mg:n kerta-annos), joka on CYP2D6:n substraatti, ei vaikuttanut merkittävästi plasman imipramiinin tai sitalopraamin pitoisuuksiin. Imipramiinimetaboliitin desipramiinin pitoisuus kuitenkin kasvoi noin 50 %. Desipramiinimuutoksen kliinistä merkitystä ei tunneta.
Eläinten toksikologia ja/tai farmakologia
Verkkokalvon muutokset rotilla
Patologisia muutoksia (degeneraatio/atrofia) havaittiin albiinorottien verkkokalvossa sitalopraamilla tehdyssä kaksivuotisessa karsinogeenisuustutkimuksessa. Verkkokalvon patologian ilmaantuvuus ja vakavuus lisääntyivät sekä uros- että naarasrotilla, jotka saivat 80 mg/kg/vrk, mikä on noin 19 kertaa suurempi kuin MRHD 40 mg laskettuna mg/m² kehon pinta-alasta. Samanlaisia löydöksiä ei havaittu rotilla, joita hoidettiin kahden vuoden ajan annoksella 24 mg/kg/vrk, hiirillä, joita hoidettiin 18 kuukauden ajan annoksilla 240 mg/kg/vrk, eikä koirilla, joita hoidettiin yhden vuoden ajan annoksilla enintään 20 mg/kg/vrk, jotka ovat noin 6, 29 ja 17 kertaa MRHD, vastaavasti, laskettuna mg/m² kehon pinta-alasta.
Lisätutkimuksia tämän patologian mekanismin selvittämiseksi ei ole tehty, eikä tämän vaikutuksen mahdollista merkitystä ihmisille ole osoitettu.
Kliiniset tutkimukset
CELEXAn teho masennuksen hoidossa vahvistettiin kahdessa lumekontrolloidussa tutkimuksessa (kesto 4–6 viikkoa) aikuisilla avohoidoilla (18–66-vuotiaat), jotka täyttivät vakavan masennuksen DSM-III- tai DSM-III-R-kriteerit. häiriö (MDD) (tutkimukset 1 ja 2).
Tutkimus 1, 6 viikkoa kestänyt tutkimus, jossa potilaat saivat kiinteitä CELEXA 10 mg annoksia 10 mg, 20 mg, 40 mg ja 60 mg päivässä, osoitti, että CELEXA 40 mg päivässä ja 60 mg päivässä (1,5 kertaa suurin suositeltu päiväannos) tehokas mitattuna Hamilton Depression Rating Scalen (HAMD) kokonaispistemäärällä, joka on ensisijainen tehon päätetapahtuma. HAMD-17 on 17 kohdan kliinikon arvioima asteikko, jota käytetään masennuksen oireiden vakavuuden arvioimiseen. HAMD-17:n pisteet vaihtelevat välillä 0–52, korkeammat pisteet osoittavat vakavampaa masennusta. Tämä tutkimus ei osoittanut selvää vaikutusta 10 mg:n ja 20 mg:n vuorokausiannoksilla, eikä 60 mg:n vuorokausiannos ollut tehokkaampi kuin 40 mg:n vuorokausiannos. QTc-ajan pidentymisen ja kammiorytmihäiriöiden riskin vuoksi CELEXA 10 mg:n suurin suositeltu annos on 40 mg kerran vuorokaudessa.
Tutkimuksessa 2, 4 viikkoa kestäneessä lumekontrolloidussa tutkimuksessa MDD-potilailla, aloitusannos oli 20 mg vuorokaudessa, jota seurasi titraus suurimmaksi siedetyksi annokseksi tai enimmäisannokseksi 80 mg päivässä (2 kertaa suurin suositeltu päiväannos). ). CELEXA 20 mg:lla hoidetut potilaat paransivat tilastollisesti merkitsevästi enemmän kuin lumelääkepotilaat HAMD-kokonaispisteydessä, joka on ensisijainen tehon päätetapahtuma. Kolmessa muussa lumekontrolloidussa tutkimuksessa MDD-potilailla CELEXA- ja lumelääkettä saaneiden potilaiden hoitovasteen ero ei ollut tilastollisesti merkitsevä.
Kahdessa pitkäaikaistutkimuksessa MDD-potilaat, jotka olivat reagoineet CELEXA 10 mg:aan ensimmäisten 6 tai 8 viikon akuutin hoidon aikana, satunnaistettiin jatkamaan CELEXA 10 mg:n tai lumelääkettä. Yhdessä tutkimuksessa potilaat saivat kiinteitä CELEXA-annoksia 20 mg tai 40 mg päivässä, ja toisessa tutkimuksessa potilaat saivat joustavia CELEXA-annoksia 20–60 mg päivässä (1,5 kertaa suurin suositeltu päiväannos). Molemmissa tutkimuksissa potilailla, jotka saivat jatkuvaa CELEXA-hoitoa, todettiin tilastollisesti merkitsevästi vähemmän uusiutumista seuraavien kuuden kuukauden aikana verrattuna lumelääkettä saaneisiin potilaisiin. Kiinteän annoksen tutkimuksessa masennuksen uusiutumisen vähentyminen oli samanlaista potilailla, jotka saivat 20 mg tai 40 mg CELEXAa päivässä. QTc-ajan pidentymisen ja kammiorytmihäiriöiden riskin vuoksi CELEXA 20 mg:n suurin suositeltu annos on 40 mg kerran vuorokaudessa.
Analyysit hoitotuloksen ja iän, sukupuolen ja rodun välisestä suhteesta eivät osoittaneet mitään eroavaa vastetta näiden potilaan ominaisuuksien perusteella.
POTILASTIEDOT
CELEXA® (Suh-leks-uh) (sitalopraami) Tabletit, suun kautta käytettäväksi
Mikä on tärkein tieto, joka minun pitäisi tietää CELEXAsta?
CELEXA 20mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Lisääntynyt itsemurha-ajatusten ja -toimien riski. CELEXA 10 mg ja muut masennuslääkkeet voivat lisätä itsemurha-ajatuksia ja -toimia joillakin lapsilla, nuorilla ja nuorilla aikuisilla varsinkin hoidon ensimmäisten kuukausien aikana tai kun annosta muutetaan. CELEXA ei ole tarkoitettu lapsille.
- Masennus ja muut mielen sairaudet ovat tärkeimmät syyt itsemurha-ajatuksiin ja -toimiin.
Miten voin tarkkailla ja yrittää estää itsetuhoisia ajatuksia ja tekoja itsessäni tai perheenjäsenessäni?
- Kiinnitä huomiota kaikkiin muutoksiin, erityisesti äkillisiin mielialan, käyttäytymisen, ajatusten tai tunteiden muutoksiin tai jos sinulla on itsemurha-ajatuksia tai -toimia. Tämä on erittäin tärkeää, kun masennuslääke aloitetaan tai annosta muutetaan.
- Soita välittömästi terveydenhuollon tarjoajallesi ilmoittaaksesi uusista tai äkillisistä mielialan, käyttäytymisen, ajatusten tai tunteiden muutoksista.
- Pidä kaikki seurantakäynnit terveydenhuollon tarjoajan kanssa aikataulun mukaisesti. Soita terveydenhuollon tarjoajallesi käyntien välillä tarvittaessa, varsinkin jos olet huolissasi oireista.
Soita terveydenhuollon tarjoajallesi tai hakeudu välittömästi ensiapuun, jos sinulla tai perheenjäsenelläsi on jokin seuraavista oireista, varsinkin jos ne ovat uusia, pahempia tai huolestuttavia:
- ajatuksia itsemurhasta tai kuolemasta
- uusi tai pahempi masennus
- hyvin kiihtynyt tai levoton olo
- unihäiriöt (unettomuus)
- käyttäytyy aggressiivisesti, on vihainen tai väkivaltainen
- äärimmäinen lisääntynyt aktiivisuus tai puhuminen (mania)
- yrittää itsemurhaa
- uusi tai pahempi ahdistus
- vaarallisten impulssien vaikutuksesta
- paniikkikohtaukset
- uusi tai pahempi ärtyneisyys
- muita epätavallisia muutoksia käyttäytymisessä tai mielialassa
Mikä on CELEXA?
CELEXA 10mg on reseptilääke, jota käytetään tietyntyyppisen masennuksen hoitoon aikuisilla.
Ei tiedetä, onko CELEXA 10 mg turvallinen ja tehokas käytettäväksi lapsille.
Kuka ei saa ottaa CELEXAa?
Älä ota CELEXAa, jos:
- ottaa monoamiinioksidaasin estäjää (MAOI)
- olet lopettanut MAO-estäjän käytön viimeisten 14 päivän aikana
- joita hoidetaan linetsolid-antibiootilla tai suonensisäisellä metyleenisinisellä
- ota pimotsidi
- olet allerginen sitalopraamille tai jollekin CELEXAn aineosalle. Katso tämän lääkitysoppaan lopusta täydellinen luettelo CELEXAn ainesosista.
Kysy terveydenhuollon tarjoajalta tai apteekista, jos et ole varma, käytätkö MAO:n estäjiä, mukaan lukien MAO-estäjät, kuten linetsolidi tai suonensisäinen metyleenisininen.
Älä aloita MAO-estäjän käyttöä vähintään 14 päivään CELEXA-hoidon lopettamisen jälkeen.
Ennen kuin otat CELEXAa, kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, mukaan lukien jos:
- sinulla tai suvussa on ollut itsemurhaa, masennusta, kaksisuuntaista mielialahäiriötä, maniaa tai hypomaniaa
- sinulla on epänormaali sydämen rytmi, jota kutsutaan QT-ajan pitenemiseksi
- sinulla on tai on ollut sydänongelmia, mukaan lukien sydänkohtaus, sydämen vajaatoiminta, epänormaali sydämen rytmi tai pitkä QT-oireyhtymä
- sinulla on alhainen kalium-, magnesium- tai natriumpitoisuus veressäsi
- sinulla on tai on ollut verenvuotoongelmia
- sinulla on tai on ollut kohtauksia (kouristuksia)
- sinulla on korkea silmänpaine (glaukooma)
- sinulla on tai on ollut munuais- tai maksaongelmia
- olet raskaana tai suunnittelet raskautta. CELEXA 20 mg voi vahingoittaa sikiötäsi. CELEXAn ottaminen raskauden loppuvaiheessa voi lisätä tiettyjen ongelmien riskiä vastasyntyneelläsi. Keskustele terveydenhuollon tarjoajan kanssa masennuksen hoidon riskeistä ja hyödyistä raskauden aikana.
- Kerro heti terveydenhuollon tarjoajallesi, jos tulet raskaaksi tai epäilet olevasi raskaana CELEXA-hoidon aikana.
- On olemassa raskausrekisteri naisille, jotka ovat altistuneet CELEXAlle raskauden aikana. Rekisterin tarkoitus on kerätä tietoja CELEXAlle altistuneiden naisten ja heidän vauvansa terveydestä. Jos tulet raskaaksi CELEXA 10mg -hoidon aikana, keskustele terveydenhuollon tarjoajasi kanssa rekisteröitymisestä National Pregnancy Registry for masennuslääkerekisteriin. Voit rekisteröityä soittamalla numeroon 1-844-405-6185 tai käymällä verkossa osoitteessa https://womensmentalhealth.org/research/pregnancyregistry/antidepressants.
- imetät tai aiot imettää. Ei tiedetä, erittyykö CELEXA äidinmaitoon. Keskustele terveydenhuollon tarjoajan kanssa parhaasta tavasta ruokkia vauvasi CELEXA-hoidon aikana.
- Jos imetät CELEXA 20 mg -hoidon aikana, soita välittömästi terveydenhuollon tarjoajallesi, jos vauvaasi ilmenee uneliaisuutta tai hermostuneisuutta tai jos vauvasi ei syö tai lihoa hyvin.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät.
CELEXA 10 mg ja muut lääkkeet voivat vaikuttaa toisiinsa aiheuttaen mahdollisia vakavia sivuvaikutuksia. CELEXA voi vaikuttaa muiden lääkkeiden tehoon, ja muut lääkkeet voivat vaikuttaa CELEXA:n tehoon.
Kerro erityisesti terveydenhuollon tarjoajallesi, jos otat:
- migreenipäänsäryn hoitoon käytettävät lääkkeet, joita kutsutaan triptaaneiksi
- trisykliset masennuslääkkeet
- fentanyyli
- litium
- tramadoli
- tryptofaani
- buspironi
- amfetamiinit
- mäkikuisma
- lääkkeet, jotka voivat vaikuttaa veren hyytymiseen, kuten aspiriini, ei-steroidiset tulehduskipulääkkeet (NSAID) ja varfariini
- diureetteja
- metadonia
- gatifloksasiini tai moksifloksasiini
- lääkkeet, joita käytetään säätelemään sykettäsi tai rytmiäsi (rytmihäiriölääkkeet)
- mieliala-, ahdistuneisuus-, psykoottisten tai ajatushäiriöiden hoitoon käytettävät lääkkeet, mukaan lukien selektiiviset serotoniinin takaisinoton estäjät (SSRI) ja serotoniinin norepinefriinin takaisinoton estäjät (SNRI)
Kysy terveydenhuollon tarjoajaltasi, jos et ole varma, käytätkö jotakin näistä lääkkeistä. Terveydenhuollon tarjoaja voi kertoa sinulle, onko CELEXA 10 mg:n ottaminen muiden lääkkeiden kanssa turvallista.
Älä aloita tai lopeta muita lääkkeitä CELEXA-hoidon aikana keskustelematta ensin terveydenhuollon tarjoajan kanssa. CELEXAn äkillinen lopettaminen voi aiheuttaa vakavia sivuvaikutuksia. Katso, "Mitä ovat CELEXAn mahdolliset sivuvaikutukset?"
Tunne käyttämäsi lääkkeet. Pidä niistä luetteloa näytettäväksi terveydenhuollon tarjoajalle ja apteekkihenkilökunnalle, kun hankit uuden lääkkeen.
Miten minun pitäisi ottaa CELEXA 10 mg?
- Ota CELEXA 20 mg juuri sen verran kuin lääkärisi on määrännyt. Älä muuta annostasi tai lopeta CELEXAn käyttöä keskustelematta ensin terveydenhuollon tarjoajan kanssa.
- Terveydenhuollon tarjoajasi saattaa joutua muuttamaan CELEXA-annosta, kunnes se on sinulle oikea annos.
- Ota CELEXA 1 kerran päivässä ruoan kanssa tai ilman.
- Jos otat liian paljon CELEXA 20 mg -valmistetta, soita terveydenhuollon tarjoajalle tai myrkytystietokeskukseen numeroon 1-800-222-1222 tai mene välittömästi lähimmän sairaalan ensiapuun.
Mitkä ovat CELEXA 20mg:n mahdolliset sivuvaikutukset?
CELEXA voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Katso, "Mikä on tärkein tieto, joka minun pitäisi tietää CELEXAsta?"
- Sydämen rytmihäiriöt. CELEXA voi aiheuttaa vakavan sydämenlyöntimuutoksen (nopea tai epäsäännöllinen syke), joka voi aiheuttaa kuoleman. Kerro heti terveydenhuollon tarjoajalle, jos tunnet pyörrytystä tai pyörtymistä tai jos sydämesi syke muuttuu.
- Serotoniinin oireyhtymä. CELEXAn ottaminen voi aiheuttaa mahdollisesti hengenvaarallisen ongelman, jota kutsutaan serotoniinioireyhtymäksi. Serotoniinioireyhtymän kehittymisriski kasvaa, kun CELEXA 20 mg:aa käytetään tiettyjen muiden lääkkeiden kanssa. Katso, "Kuka ei saa ottaa CELEXAa?" Soita terveydenhuollon tarjoajallesi tai mene välittömästi lähimmän sairaalan ensiapuun jos sinulla on jokin seuraavista serotoniinioireyhtymän merkeistä ja oireista:
- agitaatiota
- nähdä tai kuulla asioita, jotka eivät ole todellisia (hallusinaatiot)
- hämmennystä
- kooma
- nopea sydämen syke
- verenpaineen muutoksia
- huimaus
- hikoilu
- punoitus
- korkea ruumiinlämpö (hypertermia)
- vapina, jäykät lihakset tai lihasten nykiminen
- koordinaation menetys
- kohtauksia
- pahoinvointi, oksentelu, ripuli
- Lisääntynyt verenvuotoriski. CELEXA 20 mg:n ottaminen yhdessä aspiriinin, steroideihin kuulumattomien tulehduskipulääkkeiden (NSAID), varfariinin tai verenohennusaineiden kanssa voi lisätä tätä riskiä. Kerro välittömästi terveydenhuollon tarjoajallesi kaikista epätavallisista verenvuodoista tai mustelmista.
- Manisia jaksoja. Maniakohtauksia voi esiintyä ihmisillä, joilla on kaksisuuntainen mielialahäiriö ja jotka käyttävät CELEXAa. Oireita voivat olla:
- lisääntynyt huomattavasti energiaa
- vakavia unihäiriöitä
- kilpailevia ajatuksia
- huolimaton käytös
- epätavallisen mahtavia ideoita
- liiallinen onnellisuus tai ärtyneisyys
- puhua enemmän tai nopeammin kuin tavallisesti
- Keskeytysoireyhtymä. CELEXA 20 mg:n käytön äkillinen lopettaminen voi aiheuttaa vakavia sivuvaikutuksia. Terveydenhuollon tarjoaja saattaa haluta pienentää annostasi hitaasti. Oireita voivat olla:
- pahoinvointi
- hikoilu
- muutoksia mielialassasi
- päänsärky
- ärtyneisyys ja kiihtyneisyys
- väsymys
- huimaus
- ongelmia nukkumisessa
- sähköiskun tunne (parestesia)
- hypomania
- ahdistusta
- korvien soiminen (tinnitus)
- hämmennystä
- kohtauksia
- Kohtaukset (kouristukset).
- Silmäongelmat (sulkukulmaglaukooma). Monet masennuslääkkeet, mukaan lukien CELEXA, voivat aiheuttaa tietyn tyyppistä silmäongelmaa, jota kutsutaan sulkukulmaglaukoomaksi. Soita terveydenhuollon tarjoajallesi, jos sinulla on muutoksia näkössäsi tai silmäkipussa.
- Matala natriumpitoisuus veressäsi (hyponatremia). Veresi alhainen natriumpitoisuus voi olla vakava ja voi aiheuttaa kuoleman. Iäkkäät ihmiset voivat olla alttiimpia tälle. Kerro heti terveydenhuollon tarjoajallesi, jos sinulle ilmaantuu merkkejä tai oireita veresi alhaisista natriumpitoisuuksista CELEXA-hoidon aikana. Veren alhaisten natriumpitoisuuksien merkkejä ja oireita voivat olla:
- päänsärky
- keskittymisvaikeuksia
- muisti muuttuu
- hämmennystä
- jalkojen heikkous ja epävakaus, mikä voi johtaa kaatumisiin
Vaikeissa tai äkillisissä tapauksissa merkkejä ja oireita ovat:
-
- hallusinaatiot (epätodellisten asioiden näkeminen tai kuuleminen)
- pyörtyminen
- kohtauksia
- kooma
- hengityksen lopettaminen
- kuolema
- Seksuaaliset ongelmat (häiriöt). Selektiivisten serotoniinin takaisinoton estäjien (SSRI) käyttö, mukaan lukien CELEXA, voi aiheuttaa seksuaalisia ongelmia.
Miehillä oireita voivat olla:
- Viivästynyt siemensyöksy tai kyvyttömyys saada siemensyöksyä
- Vähentynyt seksihalu
- Ongelmia saada tai säilyttää erektio
Naisilla oireita voivat olla:
- Vähentynyt seksihalu
- Viivästynyt orgasmi tai kyvyttömyys saada orgasmi
Keskustele terveydenhuollon tarjoajan kanssa, jos sinulla on muutoksia seksuaalisessa toiminnassasi tai jos sinulla on kysyttävää tai huolenaiheita seksuaalisista ongelmista DRIZALMA SPRINKLE -hoidon aikana. Terveydenhuollon tarjoajasi voi ehdottaa hoitoja.
CELEXAn yleisin sivuvaikutus on viivästynyt siemensyöksy.
Nämä eivät ole kaikkia CELEXAn mahdollisia sivuvaikutuksia.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää CELEXA?
- Säilytä CELEXA huoneenlämmössä välillä 68 °F - 77 °F (20 °C - 25 °C).
- Pidä CELEXA 20 mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa CELEXAn turvallisesta ja tehokkaasta käytöstä
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä CELEXA 20 mg:aa sairauteen, johon sitä ei ole määrätty. Älä anna CELEXAa muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä. Voit kysyä terveydenhuollon tarjoajaltasi tai apteekista CELEXAa koskevia tietoja, jotka on kirjoitettu terveydenhuollon ammattilaisille.
Mitä ainesosia CELEXA sisältää?
Aktiivinen ainesosa: sitalopraamihydrobromidi
Inaktiiviset ainesosat: kopolyvidoni, maissitärkkelys, kroskarmelloosinatrium, glyseriini, laktoosimonohydraatti, magnesiumstearaatti, hypromelloosi, mikrokiteinen selluloosa, polyetyleeniglykoli, titaanidioksidi ja rautadioksidi värjäykseen.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
