Provera 5mg, 10mg Medroxyprogesterone Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Provera on ja miten sitä käytetään?
Provera 10mg on reseptilääke, jota käytetään voimakkaan kuukautisvuodon, poissaolon tai epäsäännöllisen kuukautisvuodon oireiden hoitoon ja ehkäisyyn. Provera 10mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Provera 5mg kuuluu lääkeryhmään, jota kutsutaan antineoplastiksi, hormoneiksi, progestiineiksi.
Ei tiedetä, onko Provera turvallinen ja tehokas lapsille.
Mitkä ovat Provera 10mg:n mahdolliset sivuvaikutukset?
Provera 5mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- emättimen verenvuoto (jos olet jo käynyt läpi vaihdevuodet),
- huimaus,
- rintojen kyhmy,
- masennus,
- unihäiriöt (unettomuus),
- huimaus,
- mielialan muutoksia,
- päänsärky,
- kuume,
- ihon tai silmien keltaisuus (keltatauti),
- turvotus käsissäsi, nilkoissasi tai jaloissasi,
- rintakipu tai paine,
- kipu leviää leukaan tai olkapäähän,
- pahoinvointi,
- hikoilu,
- äkillinen tunnottomuus tai heikkous,
- äkillinen kova päänsärky,
- sammaltava puhe,
- näköongelmia,
- ongelmia tasapainosi kanssa,
- äkillinen yskä,
- hengityksen vinkuminen,
- nopea hengitys,
- veren yskiminen ja
- kipu jalassasi (tai molemmissa), johon liittyy turvotusta, lämpöä ja punoitusta
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Provera 10mg:n yleisimmät sivuvaikutukset ovat:
- tiputtelu- tai läpäisyverenvuoto,
- muutokset kuukautiskierrossasi,
- emättimen kutina tai vuoto,
- rintojen arkuus tai vuoto,
- päänsärky,
- huimaus,
- hermostunut tai masentunut olo,
- mustelmat tai suonten turvotus,
- turvotus,
- nesteen kertyminen,
- mielialan muutoksia,
- unihäiriöt (unettomuus),
- kutina,
- ihottuma,
- akne,
- hiusten kasvu,
- päänahan hiustenlähtö,
- vatsakipu,
- turvotus,
- pahoinvointi,
- painonnousu ja
- näkömuutokset tai piilolinssien käyttövaikeudet
VAROITUS
SYDÄN- JA VERENSUUNIKUVAIKUTUKSET, RINTASyöVÄ JA TODENNÄKÖINEN DEMENTIA ESTROGEN PLUS PROGESTIN -HOIDON KÄYTTÖÖN
Sydän- ja verisuonihäiriöt ja todennäköinen dementia
Estrogeeni- ja progestiinihoitoa ei tule käyttää sydän- ja verisuonitautien tai dementian ehkäisyyn. (Katso Kliiniset tutkimukset ja VAROITUKSET , Sydän- ja verisuonihäiriöt ja todennäköinen dementia .)
Women's Health Initiative (WHI) estrogeenin ja progestiinin alatutkimus raportoi lisääntyneen syvän laskimotromboosin (DVT), keuhkoembolian (PE), aivohalvauksen ja sydäninfarktin (MI) riskin postmenopausaalisilla naisilla (50–79-vuotiaat). ) 5,6 vuotta kestäneen hoidon aikana päivittäin suun kautta otettavalla konjugoidulla estrogeenilla (CE) [0,625 mg] yhdistettynä medroksiprogesteroniasetaattiin (MPA) [2,5 mg] lumelääkkeeseen verrattuna. (Katso Kliiniset tutkimukset ja VAROITUKSET , Sydän- ja verisuonihäiriöt .)
WHI Memory Study (WHIMS) -estrogeenia ja progestiinia koskeva lisätutkimus raportoi lisääntyneestä todennäköisen dementian kehittymisen riskistä 65-vuotiailla tai sitä vanhemmilla postmenopausaalisilla naisilla 4 vuoden ajan päivittäisellä CE:llä (0,625 mg) yhdistettynä MPA:han (2,5 mg), suhteellinen. lumelääkkeeseen. Ei tiedetä, koskeeko tämä löydös nuorempia postmenopausaalisia naisia. (Katso Kliiniset tutkimukset ja VAROITUKSET , Todennäköinen dementia ja VAROTOIMENPITEET , Geriatrinen käyttö .)
Rintasyöpä
WHI-estrogeeni plus progestiini -alatutkimus osoitti lisääntyneen invasiivisen rintasyövän riskin. (Katso Kliiniset tutkimukset ja VAROITUKSET , Pahanlaatuinen kasvain , Rintasyöpä .)
Vertailukelpoisten tietojen puuttuessa näiden riskien pitäisi olettaa olevan samanlaisia muilla CE- ja MPA-annoksilla sekä muilla estrogeenien ja progestiinien yhdistelmillä ja annosmuodoilla.
Progestiineja estrogeenien kanssa tulee määrätä pienimmillä tehokkailla annoksilla ja lyhyimmän keston ajan, mikä vastaa hoidon tavoitteita ja yksittäisen naisen riskejä.
KUVAUS
PROVERA®-tabletit sisältävät medroksiprogesteroniasetaattia, joka on progesteronin johdannainen. Se on valkoinen tai luonnonvalkoinen, hajuton kiteinen jauhe, joka on stabiili ilmassa ja sulaa 200 - 210 °C:ssa. Se liukenee vapaasti kloroformiin, liukenee asetoniin ja dioksaaniin, liukenee niukasti alkoholiin ja metanoliin, liukenee heikosti eetteriin ja liukenee veteen.
Medroksiprogesteroniasetaatin kemiallinen nimi on pregn-4-eeni-3,20-dioni, 17-(asetyylioksi)-6-metyyli-, (6α)-. Rakennekaava on:
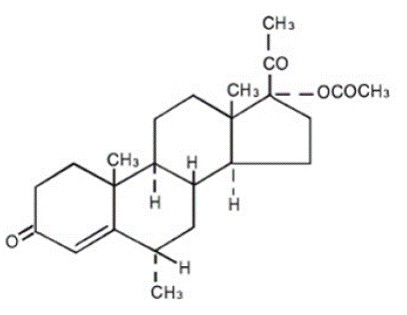
Jokainen suun kautta annettava PROVERA 5 mg tabletti sisältää 2,5 mg, 5 mg tai 10 mg medroksiprogesteroniasetaattia ja seuraavia inaktiivisia aineosia: kalsiumstearaatti, maissitärkkelys, laktoosi, mineraaliöljy, sorbiinihappo, sakkaroosi ja talkki. 2,5 mg:n tabletti sisältää FD&C Yellow No. 6:ta.
INDIKAATIOT
PROVERA 5mg -tabletit on tarkoitettu hormonaalisesta epätasapainosta johtuvan sekundaarisen kuukautisvuodon ja epänormaalin kohdun verenvuodon hoitoon orgaanisen patologian, kuten fibroidin tai kohdun syövän, puuttuessa. Ne on myös tarkoitettu käytettäväksi kohdun limakalvon liikakasvun ehkäisyyn naisilla, joilla ei ole kohdunpoistoa postmenopausaalisilla naisilla ja jotka saavat päivittäin suun kautta konjugoituja estrogeenitabletteja 0,625 mg.
ANNOSTELU JA HALLINNOINTI
Toissijainen amenorrea
PROVERA 10 mg tabletteja voidaan antaa 5 tai 10 mg:n annoksina vuorokaudessa 5-10 päivän ajan. Annos optimaalisen erittyvän transformaation indusoimiseksi kohdun limakalvossa, joka on riittävästi esikäsitelty joko endogeenisellä tai eksogeenisellä estrogeenilla, on 10 mg PROVERA 10 mg päivässä 10 päivän ajan. Toissijaisen amenorrean tapauksessa hoito voidaan aloittaa milloin tahansa. Progestiinin vieroitusvuotoa esiintyy yleensä 3–7 päivän kuluessa PROVERA 10 mg -hoidon lopettamisesta.
Epänormaali kohdun verenvuoto, joka johtuu hormonaalisesta epätasapainosta orgaanisen patologian puuttuessa
Kuukautiskierron lasketusta 16. tai 21. päivästä alkaen PROVERA 10 mg voidaan antaa 5 tai 10 mg päivittäin 5-10 päivän ajan. Optimaalisen erittyvän transformaation aikaansaamiseksi kohdun limakalvossa, joka on riittävästi esikäsitelty joko endogeenisellä tai eksogeenisellä estrogeenilla, suositellaan 10 mg PROVERA 10 mg päivässä 10 päivän ajan kierron 16. päivästä alkaen. Progestiinin vieroitusvuoto ilmaantuu yleensä 3–7 päivän kuluessa PROVERA-hoidon lopettamisesta. Potilaat, joilla on aiemmin esiintynyt toistuvia epänormaalin kohdun verenvuotojaksoja, voivat hyötyä suunnitellun kuukautiskierron PROVERAn kanssa.
Endometriumin hyperplasian vähentäminen postmenopausaalisilla naisilla, jotka saavat päivittäin 0,625 mg konjugoituja estrogeenia
Kun estrogeenia määrätään postmenopausaaliselle naiselle, jolla on kohtu, myös progestiinihoito on aloitettava kohdun limakalvosyövän riskin vähentämiseksi. Nainen, jolla ei ole kohtua, ei tarvitse progestiinia. Estrogeenia tulee käyttää yksinään tai yhdessä progestiinin kanssa pienimmällä tehokkaalla annoksella ja lyhimmän keston ajan, joka on yhdenmukainen hoidon tavoitteiden ja yksittäisen naisen riskien kanssa. Potilaat tulee arvioida uudelleen säännöllisin väliajoin kliinisesti tarkoituksenmukaisesti (esimerkiksi 3–6 kuukauden välein) sen määrittämiseksi, onko hoito edelleen tarpeen (ks. VAROITUKSET ). Naisilla, joilla on kohtu, on tarpeen mukaan ryhdyttävä asianmukaisiin diagnostisiin toimenpiteisiin, kuten kohdun limakalvon näytteenottoon, jotta voidaan sulkea pois pahanlaatuisuus diagnosoimattoman jatkuvan tai toistuvan epänormaalin emättimen verenvuodon yhteydessä.
PROVERA-tabletteja voidaan antaa 5 tai 10 mg:n annoksina vuorokaudessa 12-14 peräkkäisenä päivänä kuukaudessa postmenopausaalisille naisille, jotka saavat päivittäin 0,625 mg konjugoituja estrogeenia joko syklin 1. päivästä tai 16. päivästä alkaen.
Potilaiden hoito tulee aloittaa pienimmällä annoksella.
PROVERAn pienintä tehokasta annosta ei ole määritetty.
MITEN TOIMITETAAN
PROVERA 10 mg tabletit niitä on saatavana seuraavina vahvuuksina ja pakkauskokoina:
2,5 mg (pisteellinen, pyöreä, oranssi)
Pullot 30 NDC 0009-0064-06 100 pullot NDC 0009-0064-04
5 mg (uurrettu, kuusikulmainen, valkoinen)
Pullot 100 NDC 0009-0286-03
10 mg (pisteellinen, pyöreä, valkoinen)
Pullot 100 NDC 0009-0050-02 500 pullot NDC 0009-0050-11
Säilytä kontrolloidussa huoneenlämmössä 20–25 °C (68–77 °F) [katso USP ].
"Pitää poissa lasten ulottuvilta"
Jakelija: Pharmacia & Upjohn Company, Division of Pfizer Inc., NY, NY 10017. Tarkistettu: elokuu 2015
SIVUVAIKUTUKSET
Katso LAATIUKSET VAROITUKSET , VAROITUKSET , ja VAROTOIMENPITEET .
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Seuraavia haittavaikutuksia on raportoitu naisilla, jotka ovat käyttäneet PROVERA 10 mg tabletteja ilman samanaikaista estrogeenihoitoa:
Urogenitaalinen järjestelmä
Epänormaali kohdun verenvuoto (epäsäännöllinen, lisääntynyt, vähentynyt), kuukautiskierron muutos, läpäisyverenvuoto, tiputtelu, kuukautiset, muutokset kohdunkaulan eroosiossa ja kohdunkaulan eritteissä.
Rinnat
Rintojen arkuutta, mastodyniaa tai galaktorreaa on raportoitu.
Kardiovaskulaarinen
Tromboembolisia häiriöitä, mukaan lukien tromboflebiitti ja keuhkoembolia, on raportoitu.
Ruoansulatuskanava
Pahoinvointi, kolestaattinen keltaisuus.
Iho
Herkkyysreaktioita, joihin kuuluu nokkosihottuma, kutina, turvotus ja yleistynyt ihottuma, on esiintynyt. Akne, Herkkyysreaktioita, jotka koostuvat urtikariasta, kutinasta, turvotuksesta ja yleistyneestä ihottumasta, on esiintynyt. Aknea, hiustenlähtöä ja hirsutismia on raportoitu.
Silmät
Neuro-silmävauriot, esimerkiksi verkkokalvon tromboosi ja näköhermon tulehdus.
Keskushermosto
Henkinen masennus, unettomuus, uneliaisuus, huimaus, päänsärky, hermostuneisuus.
Sekalaista
Yliherkkyysreaktiot (esim. anafylaksia ja anafylaktoidireaktiot, angioödeema), ihottuma (allerginen) kutinalla tai ilman, painonmuutos (lisäys tai lasku), kuume, turvotus/nesteen kertymä, väsymys, heikentynyt glukoositoleranssi.
Seuraavia haittavaikutuksia on raportoitu estrogeeni- ja progestiinihoidon yhteydessä.
Urogenitaalinen järjestelmä
Epänormaali kohdun verenvuoto/tiputtelu tai vuoto; läpimurto verenvuoto; tarkkailu; dysmenorrheal/lantiokipu; kohdun leiomyoomien koon kasvu; vaginiitti, mukaan lukien emättimen kandidiaasi; kohdunkaulan eritteen määrän muutos; muutokset kohdunkaulan ektropionissa; munasarjasyöpä; kohdun limakalvon liikakasvu; endometriumin syöpä.
Rinnat
Arkuus, laajentuminen, kipu, nännivuoto, galaktorrea; fibrokystiset rintojen muutokset; rintasyöpä.
Kardiovaskulaarinen
syvä ja pinnallinen laskimotukos; keuhkoveritulppa; tromboflebiitti; sydäninfarkti; aivohalvaus; verenpaineen nousu.
Ruoansulatuskanava
Pahoinvointi oksentelu; vatsakrampit, turvotus; kolestaattinen keltaisuus; lisääntynyt sappirakon sairauden esiintyvyys; haimatulehdus; maksan hemangioomien suureneminen.
Iho
Chloasma tai melasma, joka saattaa jatkua, kun lääke lopetetaan; erythema multiforme; erythema nodosum; verenvuoto; päänahan hiusten menetys; hirsutismi; kutina, ihottuma.
Silmät
Verkkokalvon verisuonitukos, piilolinssien intoleranssi.
Keskushermosto
Päänsärky; migreeni; huimaus; henkinen masennus; korea; hermostuneisuus; mielialan häiriöt; ärtyneisyys; epilepsian paheneminen, dementia.
Sekalaista
Painon nousu tai lasku; heikentynyt hiilihydraattitoleranssi; porfyrian paheneminen; turvotus; artalgiat; jalkakrampit; muutokset libidossa; urtikaria, angioödeema, anafylaktoidi/anafylaktiset reaktiot; hypokalsemia; astman paheneminen; kohonneet triglyseridit.
HUUMEIDEN VUOROVAIKUTUKSET
Lääkkeiden ja laboratoriotestien vuorovaikutukset
Seuraavat laboratoriotulokset voivat muuttua käytettäessä estrogeeni- ja progestiinihoitoa:
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
Katso LAATIUKSET VAROITUKSET .
Sydän- ja verisuonihäiriöt
Suurentunutta PE, DVT, aivohalvauksen ja MI:n riskiä on raportoitu estrogeeni- ja progestiinihoidon yhteydessä. Jos jokin näistä tapahtumista ilmenee tai sitä epäillään, estrogeeni- ja progestiinihoito on lopetettava välittömästi.
Valtimoverisuonisairauden (esimerkiksi kohonnut verenpaine, diabetes mellitus, tupakan käyttö, hyperkolesterolemia ja liikalihavuus) ja/tai laskimotromboembolian (VTE) riskitekijät (esimerkiksi laskimotromboembolian, liikalihavuuden ja systeemisen lupus erythematosuksen henkilökohtainen tai suvussa) tulee hallita asianmukaisesti.
Aivohalvaus
WHI-estrogeeni plus progestiini -alatutkimuksessa raportoitiin tilastollisesti merkitsevästi lisääntynyt aivohalvauksen riski 50–79-vuotiailla naisilla, jotka saivat CE:tä (0,625 mg) plus MPA:ta (2,5 mg) verrattuna samaan ikäryhmään kuuluviin naisiin, jotka saivat lumelääkettä (33 vs. 25 per 10 000 naisvuotta). (Katso Kliiniset tutkimukset .) Riskin kasvu havaittiin ensimmäisen vuoden jälkeen ja jatkui. Jos aivohalvaus ilmenee tai sitä epäillään, estrogeeni- ja progestiinihoito on lopetettava välittömästi.
Sepelvaltimotauti
WHI-estrogeeni plus progestiini -alatutkimuksessa CHD-tapahtumien riski oli tilastollisesti merkityksetön lisääntynyt naisilla, jotka saivat päivittäin CE:tä (0,625 mg) plus MPA:ta (2,5 mg) verrattuna lumelääkettä saaneisiin naisiin (41 vs. 34 10 000 naisvuotta kohden). ). Suhteellisen riskin kasvu osoitettiin vuonna 1 ja suuntaus suhteellisen riskin pienenemiseen vuosina 2–5.
Postmenopausaalisilla naisilla, joilla oli dokumentoitu sydänsairaus (n = 2 763, keski-ikä 66,7 vuotta), kontrolloidussa kliinisessä tutkimuksessa sydän- ja verisuonitautien sekundaarisesta ehkäisystä (Heart and Estrogen/Progestin Replacement Study [HERS]), hoito päivittäisellä CE:llä (0,625 mg) ) plus MPA (2,5 mg) ei osoittanut mitään hyötyä sydän- ja verisuonisairauksille. Keskimääräisen 4,1 vuoden seurannan aikana CE- ja MPA-hoito ei vähentänyt CHD-tapahtumien yleistä määrää postmenopausaalisilla naisilla, joilla oli todettu sepelvaltimotauti. CHD-tapahtumia esiintyi enemmän CE- ja MPA-hoitoryhmässä kuin lumeryhmässä vuonna 1, mutta ei seuraavina vuosina. Kaksituhatta kolmesataakaksikymmentäyksi (2 321) naista alkuperäisestä HERS-tutkimuksesta suostui osallistumaan avoimeen HERS-tutkimukseen, HERS II:een. Keskimääräinen seuranta HERS II:ssa oli vielä 2,7 vuotta, yhteensä 6,8 vuotta. Sepelvaltimotautitapahtumien määrät olivat vertailukelpoisia naisilla CE plus MPA -ryhmässä ja lumeryhmässä HERS:ssä, HERS II:ssa ja yleisesti.
Laskimotromboembolia
WHI-estrogeeni plus progestiini -alatutkimuksessa laskimotromboemboliaa (syvävenähdys ja PE) raportoitiin tilastollisesti merkitsevästi kaksinkertaiseksi naisilla, jotka saivat päivittäin CE:tä (0,625 mg) plus MPA:ta (2,5 mg) verrattuna lumelääkettä saaneisiin naisiin (35 vs. 17 henkilöä kohti). 10 000 naisvuotta). Sekä syvän laskimotukoksen (26 vs. 13 per 10 000 naisvuotta) että PE (18 vs. 8 per 10 000 naisvuotta) riskin lisääntyminen on myös osoitettu tilastollisesti merkitsevästi. Laskimotautiriskin kasvu todettiin ensimmäisen vuoden aikana ja jatkui. (Katso Kliiniset tutkimukset .) Jos laskimotromboembolia ilmenee tai sitä epäillään, estrogeeni- ja progestiinihoito tulee lopettaa välittömästi.
Jos mahdollista, estrogeenien ja progestiinien käyttö tulee lopettaa vähintään 4–6 viikkoa ennen leikkausta, joka liittyy suurentuneeseen tromboembolian riskiin, tai pitkittyneen immobilisaation aikana.
Pahanlaatuiset kasvaimet
Rintasyöpä
Tärkein satunnaistettu kliininen tutkimus, joka tarjoaa tietoa rintasyövästä estrogeenin ja progestiinin käyttäjillä, on WHI-alatutkimus päivittäisestä CE:stä (0,625 mg) ja MPA:sta (2,5 mg). Keskimääräisen 5,6 vuoden seurannan jälkeen estrogeeni plus progestiini -alatutkimuksessa raportoitiin lisääntynyttä invasiivisen rintasyövän riskiä naisilla, jotka ottivat päivittäin CE:tä ja MPA:ta.
Tässä alatutkimuksessa 26 prosenttia naisista ilmoitti aiemmin käyttäneen pelkän estrogeenihoitoa tai estrogeeni- ja progestiinihoitoa. Invasiivisen rintasyövän suhteellinen riski oli 1,24, ja absoluuttinen riski oli 41 tapausta vastaan 33 tapausta 10 000 naisvuotta kohden CE:llä ja MPA:lla verrattuna lumelääkkeeseen. Naisilla, jotka ilmoittivat aiemmin käyttäneensä hormonihoitoa, invasiivisen rintasyövän suhteellinen riski oli 1,86 ja absoluuttinen riski oli 46 vs. 25 tapausta 10 000 naisvuotta kohden CE:n ja MPA:n osalta lumelääkkeeseen verrattuna. Naisilla, jotka eivät ilmoittaneet käyttävänsä aiempaa hormonihoitoa, invasiivisen rintasyövän suhteellinen riski oli 1,09, ja absoluuttinen riski oli 40 vs. 36 tapausta 10 000 naisvuotta kohden CE:llä ja MPA:lla verrattuna lumelääkkeeseen. Samassa alatutkimuksessa invasiiviset rintasyövät olivat suurempia, ne olivat todennäköisemmin solmupositiivisia, ja ne diagnosoitiin edenneemmässä vaiheessa CE (0,625 mg) plus MPA (2,5 mg) ryhmässä verrattuna plaseboryhmään. Metastaattinen sairaus oli harvinainen ilman selvää eroa kahden ryhmän välillä. Muut prognostiset tekijät, kuten histologinen alatyyppi, luokka ja hormonireseptorin tila, eivät eronneet ryhmien välillä. (Katso Kliiniset tutkimukset .)
WHI:n kliinisen tutkimuksen mukaisesti havainnointitutkimukset ovat myös raportoineet lisääntyneen rintasyövän riskin estrogeeni- ja progestiinihoidon yhteydessä ja pienemmän riskin pelkällä estrogeenihoidolla useiden vuosien käytön jälkeen. Riski kasvoi käytön keston myötä ja näytti palautuvan lähtötasolle noin 5 vuoden kuluttua hoidon lopettamisesta (vain havainnointitutkimuksissa on merkittäviä tietoja riskistä lopettamisen jälkeen). Havainnointitutkimukset viittaavat myös siihen, että rintasyövän riski oli suurempi ja tuli ilmeiseksi aiemmin estrogeeni- ja progestiinihoidolla verrattuna pelkkään estrogeenihoitoon. Näissä tutkimuksissa ei kuitenkaan ole löydetty merkittävää vaihtelua rintasyövän riskissä eri estrogeeni- ja progestiiniyhdistelmien tai antoreittien välillä.
Estrogeenin ja progestiinin käytön on raportoitu lisäävän epänormaaleja mammografioita, jotka vaativat lisäarviointia. Kaikkien naisten tulee käydä vuosittain rintojen tarkastuksessa terveydenhuollon tarjoajan toimesta ja tehdä rintojen itsetarkastus kuukausittain. Lisäksi mammografiatutkimukset tulee ajoittaa potilaan iän, riskitekijöiden ja aikaisempien mammografiatulosten perusteella.
Endometriumin syöpä
Kohdun limakalvosyövän riskin on raportoitu lisääntyneen käytettäessä vastakohtaista estrogeenihoitoa naisilla, joilla on kohtu. Raportoitu kohdun limakalvon syövän riski niillä, joilla ei ole estrogeenia, on noin 2–12 kertaa suurempi kuin ei-käyttäjillä, ja se näyttää riippuvan hoidon kestosta ja estrogeeniannoksesta. Useimmat tutkimukset osoittavat, ettei estrogeenien käyttöön liittyvää merkittävää lisääntynyttä riskiä ole alle vuoden ajan. Suurin riski näyttää liittyvän pitkäaikaiseen käyttöön, ja riskit lisääntyvät 15-24-kertaisesti 5-10 vuoden ajan tai kauemmin. Tämän riskin on osoitettu jatkuvan vähintään 8–15 vuotta estrogeenihoidon lopettamisen jälkeen.
Kaikkien estrogeeni- ja progestiinihoitoa käyttävien naisten kliininen seuranta on tärkeää. Asianmukaiset diagnostiset toimenpiteet, mukaan lukien kohdun limakalvon näytteenotto tarvittaessa, tulee suorittaa maligniteetin poissulkemiseksi kaikissa diagnosoimattomien jatkuvien tai toistuvien epänormaalien sukupuolielinten verenvuodon tapauksissa. Ei ole näyttöä siitä, että luonnollisten estrogeenien käyttö johtaisi erilaiseen kohdun limakalvon riskiprofiiliin kuin synteettiset estrogeenit, joiden estrogeeniannos on sama. Progestiinin lisäämisen estrogeenihoitoon on osoitettu vähentävän kohdun limakalvon liikakasvun riskiä, joka voi olla kohdun limakalvosyövän esiaste.
Munasarjasyöpä
WHI-estrogeeni plus progestiini -alatutkimus raportoi tilastollisesti merkityksettömän lisääntyneen munasarjasyövän riskin. Keskimääräisen 5,6 vuoden seurannan jälkeen munasarjasyövän suhteellinen riski CE:llä ja MPA:lla verrattuna lumelääkkeeseen oli 1,58 (95 prosentin luottamusväli, 0,77–3,24). CE:n ja MPA:n absoluuttinen riski oli 4 tapausta 3 tapausta 10 000 naisvuotta kohden. Joissakin epidemiologisissa tutkimuksissa estrogeenin sekä progestiinin ja vain estrogeenia sisältävien tuotteiden käyttö, erityisesti vähintään 5 vuoden ajan, on yhdistetty lisääntyneeseen munasarjasyövän riskiin. Suurempaan riskiin liittyvä altistuksen kesto ei kuitenkaan ole johdonmukainen kaikissa epidemiologisissa tutkimuksissa, ja jotkut eivät raportoi mitään yhteyttä.
Todennäköinen dementia
WHIMS-estrogeeni plus progestiini -apututkimuksessa WHI:n 4 532 postmenopausaalisella naisella, jotka olivat iältään 65–79 vuotta, satunnaistettiin saamaan päivittäistä CE:tä (0,625 mg) plus MPA:ta (2,5 mg) tai lumelääkettä. Keskimääräisen 4 vuoden seurannan jälkeen 40 naisella CE- ja MPA-ryhmässä ja 21 naisella lumeryhmässä diagnosoitiin todennäköinen dementia. Todennäköisen dementian suhteellinen riski CE- ja MPA-ryhmässä lumelääkkeeseen verrattuna oli 2,05 (95 prosentin luottamusväli, 1,21–3,48). Todennäköisen dementian absoluuttinen riski CE- ja MPA-ryhmässä lumelääkkeeseen verrattuna oli 45 tapausta vastaan 22 tapausta 10 000 naisvuotta kohden. Ei tiedetä, pätevätkö nämä havainnot nuoremmille postmenopausaalisille naisille. (Katso Kliiniset tutkimukset ja VAROTOIMENPITEET , Geriatrinen käyttö .)
Näköhäiriöt
Lopeta estrogeeni- ja progestiinihoito tutkimusta odotettaessa, jos näön äkillinen osittainen tai täydellinen menetys tai äkillinen proptoosi, diplopia tai migreeni alkavat. Jos tutkimuksessa paljastuu papilledeema tai verkkokalvon verisuonivaurioita, estrogeeni- ja progestiinihoito tulee lopettaa pysyvästi.
VAROTOIMENPITEET
Kenraali
Progestiinin lisääminen, kun naiselta ei ole tehty kohdunpoistoa
Tutkimukset progestiinin lisäämisestä 10 tai useamman päivän estrogeenin antosyklin aikana tai päivittäin estrogeenin kanssa jatkuvassa hoito-ohjelmassa ovat raportoineet endometriumin liikakasvun vähentyneestä ilmaantumisesta kuin pelkällä estrogeenihoidolla. Endometriumin hyperplasia voi olla kohdun limakalvosyövän esiaste.
On kuitenkin olemassa mahdollisia riskejä, jotka voivat liittyä progestiinien käyttöön estrogeenien kanssa verrattuna pelkkään estrogeenihoitoon. Näihin kuuluu lisääntynyt rintasyövän riski.
Odottamaton epänormaali verenvuoto emättimestä
Jos emättimestä ilmaantuu odottamaton epänormaali verenvuoto, riittävät diagnostiset toimenpiteet ovat aiheellisia.

Kohonnut verenpaine
Verenpainetta tulee seurata säännöllisin väliajoin estrogeeni- ja progestiinihoidolla.
Hypertriglyseridemia
Naisilla, joilla on aiemmin hypertriglyseridemia, estrogeeni- ja progestiinihoito voi liittyä plasman triglyseridien nousuun, mikä johtaa haimatulehdukseen. Harkitse hoidon lopettamista, jos haimatulehdus ilmenee.
Maksan vajaatoiminta ja/tai kolestaattinen keltaisuus
Estrogeenit ja progestiinit voivat metaboloitua heikosti naisilla, joilla on maksan vajaatoiminta. Varovaisuutta on noudatettava naisilla, joilla on aiemmin esiintynyt kolestaattista keltaisuutta, joka liittyy estrogeenien käyttöön tai raskauteen, ja lääkitys tulee lopettaa, jos se uusiutuu.
Nesteenpidätys
Progestiinit voivat aiheuttaa jonkinasteista nesteen kertymistä. Naiset, joilla on sairauksia, joihin tämä tekijä saattaa vaikuttaa, kuten sydämen tai munuaisten vajaatoiminta, on syytä tarkkailla, kun estrogeenia ja progestiinia määrätään.
Hypokalsemia
Estrogeeni- ja progestiinihoitoa tulee käyttää varoen naisilla, joilla on hypoparatyreoosi, koska estrogeenin aiheuttamaa hypokalsemiaa voi esiintyä.
Muiden tilojen paheneminen
Estrogeeni- ja progestiinihoito voi aiheuttaa astman, diabeteksen, epilepsian, migreenin, porfyrian, systeemisen lupus erythematosuksen ja maksan hemangioomien pahenemista, ja sitä tulee käyttää varoen naisilla, joilla on näitä sairauksia.
Potilastiedot
Lääkäreitä kehotetaan keskustelemaan POTILASTIEDOT seloste naisille, joille he määräävät PROVERAa.
Pienten synnynnäisten epämuodostumien riski voi olla lisääntynyt lapsilla, joiden äidit altistuvat progestiineille raskauden ensimmäisen kolmanneksen aikana. Mahdollinen riski poikalapselle on hypospadias, tila, jossa peniksen aukko on alapuolella eikä peniksen kärjessä. Tätä tilaa esiintyy luonnollisesti noin 5–8:lla 1000 urossyntynyttä kohden. Riski voi kasvaa PROVERA-altistuminen. Klitoriksen suurenemista ja häpyhuulien fuusiota voi esiintyä naispuolisilla vauvoilla. Selkeää yhteyttä hypospadioiden, klitoriksen suurenemisen ja huulien fuusioitumisen välillä PROVERAn käytön välillä ei kuitenkaan ole osoitettu.
Kerro potilaalle, että on tärkeää ilmoittaa altistumisesta PROVERA 5 mg:lle raskauden alkuvaiheessa.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeenisuus
Medroksiprogesteroniasetaatin pitkäaikaisen lihaksensisäisen annon on osoitettu aiheuttavan beagle-koirilla rintarauhaskasvaimia. Rotille ja hiirille oraaliseen medroksiprogesteroniasetaatin antoon liittyvää karsinogeenista vaikutusta ei havaittu.
Pitkäaikainen jatkuva estrogeeni- ja progestiinihoito on osoittanut lisääntyneen rintasyövän ja munasarjasyövän riskin. (Katso VAROITUKSET ja VAROTOIMENPITEET .)
Genotoksisuus
Medroksiprogesteroniasetaatti ei ollut mutageeninen in vitro tai in vivo geneettisen toksisuuden määrityksissä.
Hedelmällisyys
Medroksiprogesteroniasetaatti suurina annoksina on hedelmällisyyttä estävä lääke, ja suurten annosten odotetaan heikentävän hedelmällisyyttä hoidon lopettamiseen saakka.
Raskaus
Raskausluokka X
PROVERAa ei tule käyttää raskauden aikana. (Katso VASTA-AIHEET .)
Lapsilla, joiden äidit ovat altistuneet PROVERA 10 mg:lle ensimmäisen raskauskolmanneksen aikana, voi olla lisääntynyt hypospadioiden, klitoriksen suurenemisen ja huulien fuusioriski. Selkeää yhteyttä näiden tilojen ja PROVERAn käytön välillä ei kuitenkaan ole osoitettu.
Imettävät äidit
PROVERAa ei tule käyttää imetyksen aikana. Progestiinia saavien imettävien äitien rintamaidosta on tunnistettu havaittavia määriä progestiinia.
Käyttö lapsille
PROVERA 10 mg tabletteja ei ole tarkoitettu lapsille. Lapsiväestöllä ei ole tehty kliinisiä tutkimuksia.
Geriatrinen käyttö
Pelkästään PROVERAa käyttäviin kliinisiin tutkimuksiin ei ole osallistunut riittävästi iäkkäitä naisia sen määrittämiseksi, eroavatko yli 65-vuotiaat nuoremmista koehenkilöistä pelkän PROVERA-vasteen suhteen.
The Women's Health Initiative Studies
WHI-estrogeeni plus progestiini -alatutkimuksessa (päivittäinen CE [0,625 mg] plus MPA [2,5 mg] plaseboon verrattuna) ei-fataalin aivohalvauksen ja invasiivisen rintasyövän suhteellinen riski oli suurempi yli 65-vuotiailla naisilla. (Katso Kliiniset tutkimukset .)
Naisten terveysaloitteen muistitutkimus
WHIMS-apututkimuksissa postmenopausaalisilla 65–79-vuotiailla naisilla todennäköisen dementian riski oli suurempi naisilla, jotka saivat pelkkää estrogeenia tai estrogeenia plus progestiinia verrattuna lumelääkkeeseen. (Katso VAROITUKSET , Todennäköinen dementia .)
Koska molemmat liitännäistutkimukset suoritettiin 65–79-vuotiailla naisilla, ei tiedetä, koskevatko nämä havainnot nuorempia postmenopausaalisilla naisilla. (Katso VAROITUKSET , Todennäköinen dementia .)
YLIANNOSTUS
Estrogeenin ja progestiinihoidon yliannostus voi aiheuttaa pahoinvointia ja oksentelua, rintojen arkuutta, huimausta, vatsakipua, uneliaisuutta/uupumusta ja vieroitusvuotoa naisilla. Yliannostuksen hoito koostuu CE- ja MPA-hoidon keskeyttämisestä sekä asianmukaisen oireenmukaisen hoidon aloittamisesta.
VASTA-AIHEET
PROVERA 10mg on vasta-aiheinen naisille, joilla on jokin seuraavista sairauksista:
KLIININEN FARMAKOLOGIA
Medroksiprogesteroniasetaatti (MPA) annettuna suun kautta tai parenteraalisesti suositeltuina annoksina naisille, joilla on riittävästi endogeenistä estrogeenia, muuttaa proliferatiivisen endometriumiksi. Androgeenisiä ja anabolisia vaikutuksia on havaittu, mutta lääkkeellä ei ilmeisesti ole merkittävää estrogeenistä aktiivisuutta. Vaikka parenteraalisesti annettu MPA estää gonadotropiinin tuotantoa, mikä puolestaan estää follikkelien kypsymisen ja ovulaation, saatavilla olevat tiedot osoittavat, että näin ei tapahdu, kun tavallisesti suositeltu oraalinen annos annetaan kerta-annoksina.
Farmakokinetiikka
MPA:n farmakokinetiikka määritettiin 20 postmenopausaalisella naisella kahdeksan PROVERA 2,5 mg:n tabletin kerta-annoksen tai kahden PROVERA 10 mg:n tabletin kerta-annoksen jälkeen paasto-olosuhteissa. Toisessa tutkimuksessa MPA:n vakaan tilan farmakokinetiikka määritettiin paasto-olosuhteissa 30 postmenopausaalisella naisella sen jälkeen, kun annettiin päivittäin yksi PROVERA 10 mg tabletti 7 päivän ajan. Molemmissa tutkimuksissa MPA kvantifioitiin seerumissa käyttäen validoitua kaasukromatografia-massaspektrometria (GC-MS) menetelmää. Arviot MPA:n farmakokineettisistä parametreista PROVERA-tablettien kerta- ja toistuvien annosten jälkeen vaihtelivat suuresti, ja niistä on yhteenveto taulukossa 1.
Imeytyminen
MPA:n absoluuttisesta biologisesta hyötyosuudesta ihmisillä ei ole tehty erityisiä tutkimuksia. MPA imeytyy nopeasti maha-suolikanavasta, ja MPA:n maksimipitoisuudet saavutetaan 2-4 tunnin kuluttua oraalisen annon jälkeen.
PROVERA:n antaminen ruoan kanssa lisää MPA:n biologista hyötyosuutta. 10 mg:n PROVERA 10 mg:n annos, joka otettiin välittömästi ennen ateriaa tai sen jälkeen, nosti MPA:n Cmax-arvoa (50-70 %) ja AUC-arvoa (18-33 %). MPA:n puoliintumisaika ei muuttunut ruoan myötä.
Jakelu
MPA:sta noin 90 % sitoutuu proteiineihin, pääasiassa albumiiniin; sukupuolihormonia sitovan globuliinin kanssa ei tapahdu MPA-sitoutumista.
Aineenvaihdunta
Suun kautta antamisen jälkeen MPA metaboloituu laajalti maksassa hydroksylaation kautta, minkä jälkeen se konjugoituu ja eliminoituu virtsaan.
Erittyminen
Useimmat MPA-metaboliitit erittyvät virtsaan glukuronidikonjugaatteina, mutta vain vähäiset määrät erittyvät sulfaatteina.
Tietyt populaatiot
Maksan vajaatoiminta
MPA eliminoituu lähes yksinomaan maksan metabolian kautta. 14 potilaalla, joilla oli pitkälle edennyt maksasairaus, MPA:n jakautuminen muuttui merkittävästi (eliminaatio väheni). Potilailla, joilla on rasvamaksa, 24 tunnin virtsaan muuttumattomana mykofenolihapona erittyneen annoksen keskimääräinen prosenttiosuus 10 mg:n tai 100 mg:n annoksen jälkeen oli 7,3 % ja 6,4 %.
Munuaisten vajaatoiminta
Munuaisten vajaatoiminnan vaikutusta PROVERA 5 mg:n farmakokinetiikkaan ei ole tutkittu.
Huumeiden vuorovaikutukset
Medroksiprogesteroniasetaatti (MPA) metaboloituu in vitro pääasiassa hydroksylaatiolla CYP3A4:n kautta. Spesifisiä lääkkeiden yhteisvaikutustutkimuksia, joissa olisi arvioitu CYP3A4:n indusoijien tai estäjien kliinisiä vaikutuksia MPA:han, ei ole tehty. CYP3A4:n induktorit ja/tai estäjät voivat vaikuttaa mykofenolihapon metaboliaan.
Kliiniset tutkimukset
Vaikutukset kohdun limakalvoon
Kolmivuotisessa kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa 356:lla 45–64-vuotiaalla postmenopausaalisella naisella, joilla ei ollut kohdunpoistoa, satunnaistettiin saamaan lumelääkettä (n=119), 0,625 mg konjugoitua estrogeenia (n=119) tai 0,625. mg konjugoitua estrogeenia plus syklinen PROVERA (n=118), tulokset osoittivat pienentyneen kohdun limakalvon liikakasvun riskin hoitoryhmässä, joka sai 10 mg PROVERA 5 mg plus 0,625 mg konjugoituja estrogeeneja verrattuna ryhmään, joka sai vain 0,625 mg konjugoituja estrogeeneja. Katso taulukko 2.
Toisessa yhden vuoden tutkimuksessa 832 postmenopausaalista 45–65-vuotiasta naista hoidettiin päivittäin 0,625 mg:lla konjugoitua estrogeenia (päivät 1–28) sekä joko 5 mg:lla syklistä PROVERAa tai 10 mg:lla syklistä PROVERAa (päivät 15–28). tai vain päivittäin 0,625 mg konjugoitua estrogeenia. Hoitoryhmissä, jotka saivat 5 tai 10 mg syklistä PROVERAa (päivät 15–28) plus päivittäisiä konjugoituja estrogeeneja, havaittiin merkittävästi alhaisempi hyperplasiaa verrattuna pelkkään konjugoituja estrogeenia saaneeseen ryhmään. Katso taulukko 3.
Naisten terveysaloitetutkimukset
WHI otti noin 27 000 pääosin tervettä postmenopausaalista naista kahteen alatutkimukseen arvioidakseen päivittäin suun kautta otettavan CE:n (0,625 mg) riskejä ja hyötyjä – yksin tai yhdessä MPA:n (2,5 mg) kanssa verrattuna lumelääkkeeseen tiettyjen kroonisten sairauksien ehkäisyssä. Ensisijainen päätetapahtuma oli sepelvaltimotaudin (CHD) ilmaantuvuus (määritelty ei-fataaliseksi sydäninfarktiksi, hiljaiseksi sydäninfarktiksi ja sepelvaltimotautikuolemaksi), ja invasiivinen rintasyöpä oli ensisijainen haittavaikutus. "Globaaliindeksi" sisälsi sepelvaltimotaudin, invasiivisen rintasyövän, aivohalvauksen, PE, endometriumin syövän (vain CE plus MPA -alatutkimuksessa), paksusuolensyövän, lonkkamurtuman tai muusta syystä johtuvan kuoleman aikaisimman esiintymisen. Nämä alatutkimukset eivät arvioineet pelkän CE:n tai CE:n ja MPA:n vaikutuksia vaihdevuosien oireisiin.
WHI Estrogen Plus Progestin -alatutkimus
WHI estrogeeni plus progestiini -alatutkimus lopetettiin aikaisin. Ennalta määritellyn lopetussäännön mukaan keskimääräisen 5,6 vuoden hoidon seurannan jälkeen invasiivisen rintasyövän ja sydän- ja verisuonitapahtumien riski ylitti "globaaliin indeksiin" sisältyvät määritellyt hyödyt. "Globalin indeksiin" sisältyvien tapahtumien absoluuttinen ylimääräinen riski oli 19 per 10 000 naisvuotta.
Niille WHI:n "globaaliin indeksiin" sisältyville tuloksille, jotka saavuttivat tilastollisen merkitsevyyden 5,6 vuoden seurannan jälkeen, absoluuttinen ylimääräinen riski 10 000 naisvuotta kohden CE:llä ja MPA:lla hoidetussa ryhmässä oli 7 CHD-tapahtumaa enemmän, 8 aivohalvausta enemmän, 10 peräsuolen syöpää ja 8 invasiivista rintasyöpää lisää, kun taas absoluuttinen riskin väheneminen 10 000 naisvuotta kohden oli 6 vähemmän paksusuolen syöpää ja 5 vähemmän lonkkamurtumia.
Tulokset CE plus MPA -alatutkimuksesta, johon osallistui 16 608 naista (keski-ikä 63 vuotta, vaihteluväli 50–79; 83,9 prosenttia valkoisia, 6,8 prosenttia mustia, 5,4 prosenttia latinalaisamerikkalaisia, 3,9 prosenttia muita) on esitetty taulukossa 4. Nämä tulokset heijastavat keskitetysti arvioidut tiedot keskimäärin 5,6 vuoden seurannan jälkeen.
Estrogeeni- ja progestiinihoidon aloittamisen ajoitus suhteessa vaihdevuosien alkamiseen voi vaikuttaa yleiseen riski-hyötyprofiiliin. Iän mukaan ositettu WHI-estrogeeni plus progestiini -alatutkimus osoitti 50–59-vuotiailla naisilla ei-merkittävän suuntauksen pienentyneen riskin kokonaiskuolleisuudessa [riskisuhde (HR) 0,69 (95 prosentin luottamusväli, 0,44–1,07)].
Naisten terveysaloitteen muistitutkimus
WHIMS-estrogeenin ja progestiinin oheistutkimukseen osallistui 4 532 pääosin tervettä vaihdevuodet yli 65-vuotiasta naista (47 prosenttia oli 65-69-vuotiaita, 35 prosenttia 70-74-vuotiaita ja 18 prosenttia 75-vuotiaita). ikä ja vanhemmat) arvioida päivittäisen CE:n (0,625 mg) ja MPA:n (2,5 mg) vaikutuksia todennäköisen dementian ilmaantuvuuteen (ensisijainen tulos) lumelääkkeeseen verrattuna.
Keskimääräisen 4 vuoden seurannan jälkeen todennäköisen dementian suhteellinen riski CE- ja MPA-potilailla verrattuna lumelääkkeeseen oli 2,05 (95 prosentin luottamusväli, 1,21–3,48). Todennäköisen dementian absoluuttinen riski CE- ja MPA-ryhmässä lumelääkkeeseen verrattuna oli 45 vs. 33 10 000 naisvuotta kohden. Tässä tutkimuksessa määritelty todennäköinen dementia sisälsi Alzheimerin taudin (AD), vaskulaarisen dementian (VaD) ja sekatyypin (joissa on sekä AD:n että VaD:n piirteitä). Yleisin todennäköisen dementian luokitus hoitoryhmässä ja lumeryhmässä oli AD. Koska liitännäistutkimus tehtiin 65–79-vuotiailla naisilla, ei tiedetä, pätevätkö nämä havainnot nuoremmille postmenopausaalisille naisille. (Katso VAROITUKSET , Todennäköinen dementia ja VAROTOIMENPITEET , Geriatrinen käyttö ).
POTILASTIEDOT
PROVERA (pro-VE-rah) (medroksiprogesteroniasetaatti) -tabletit, USP
Lue nämä potilastiedot ennen kuin aloitat PROVERA-hoidon ja lue, mitä saat joka kerta, kun täytät PROVERA-reseptisi. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi.
Mikä on tärkein tieto, joka minun pitäisi tietää PROVERAsta (progestiinihormoni)?
- Älä käytä estrogeenia progestiinien kanssa sydänsairauksien, sydänkohtausten, aivohalvausten tai dementian (aivojen toiminnan heikkenemisen) ehkäisemiseksi.
- Estrogeenien käyttö progestiinien kanssa voi lisätä mahdollisuutta saada sydänkohtauksia, aivohalvauksia, rintasyöpää ja verihyytymiä.
- Estrogeenien käyttö progestiinien kanssa voi lisätä dementian riskiä 65-vuotiailla tai sitä vanhemmilla naisilla tehdyn tutkimuksen perusteella.
- Sinun ja terveydenhuollon tarjoajasi tulee keskustella säännöllisesti siitä, tarvitsetko edelleen PROVERA-hoitoa.
Mikä on PROVERA 10mg?
PROVERA on lääke, joka sisältää medroksiprogesteroniasetaattia, progestiinihormonia.
Mihin PROVERA 5 mg:aa käytetään?
PROVERAa käytetään:
- Hoitaa kuukautisia, jotka ovat pysähtyneet tai hoitaa epänormaalia kohdun verenvuotoa. Naisilla, joilla on kohtu ja jotka eivät ole raskaana, joilla on säännölliset kuukautiset tai alkavat olla epäsäännölliset kuukautiset, progesteronitaso voi laskea. Keskustele terveydenhuollon tarjoajan kanssa siitä, onko PROVERA 10mg oikea sinulle.
- Vähennä mahdollisuuttasi saada kohdun (kohdun) syöpä. Postmenopausaalisilla naisilla, joilla on kohtu ja jotka käyttävät estrogeenejä, progestiinin ottaminen yhdessä estrogeenin kanssa vähentää mahdollisuutta saada kohtusyöpä.
Kuka ei saa ottaa PROVERAa?
Älä aloita PROVERA-hoitoa, jos:
- sinulla on epätavallista emättimen verenvuotoa
- joilla on tai on ollut tiettyjä syöpiä Estrogeeni ja progestiini voivat lisätä mahdollisuuttasi saada tietyntyyppisiä syöpiä, mukaan lukien rintasyöpä. Jos sinulla on tai on ollut syöpä, keskustele terveydenhuollon tarjoajan kanssa siitä, pitäisikö sinun käyttää PROVERAa.
- sairastui aivohalvaukseen tai sydänkohtaukseen
- on tai on ollut veritulppia
- sinulla on tai on ollut maksaongelmia
- olet allerginen PROVERA 10mg:lle tai jollekin sen ainesosalle Katso PROVERAn ainesosien luettelo tämän pakkausselosteen lopusta.
- luulet olevasi raskaana PROVERA ei ole tarkoitettu raskaana oleville naisille. Jos epäilet olevasi raskaana, sinun tulee tehdä raskaustesti ja tietää tulokset. Älä käytä PROVERAa, jos testi on positiivinen, ja keskustele terveydenhuollon tarjoajan kanssa. Pienten synnynnäisten epämuodostumien riski saattaa olla suurentunut lapsilla, joiden äidit ottavat PROVERAa raskauden ensimmäisen 4 kuukauden aikana. PROVERAa ei tule käyttää raskaustestinä.
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen PROVERA 10 mg:n ottamista? Ennen kuin otat PROVERA 5 mg -valmistetta, kerro terveydenhuollon tarjoajallesi, jos:
- sinulla on muita lääketieteellisiä ongelmia Terveydenhuollon tarjoaja saattaa joutua tarkistamaan sinut huolellisemmin, jos sinulla on tiettyjä sairauksia, kuten astma (hengityksen vinkuminen), epilepsia (kohtaukset), diabetes, migreeni, endometrioosi (vaikea lantiokipu), lupus tai sydän-, maksa-, kilpirauhasenvaivoja, munuaiset tai sinulla on korkea kalsium veressäsi.
- ovat menossa leikkaukseen tai ovat vuodelevossa Terveydenhuollon tarjoajasi kertoo sinulle, jos sinun on lopetettava PROVERA-hoito.
- imettävät PROVERAn hormoni voi erittyä äidinmaitoon.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät. Jotkut lääkkeet voivat vaikuttaa PROVERAn vaikutukseen. PROVERA voi myös vaikuttaa muiden lääkkeiden tehoon.
Kuinka minun pitäisi ottaa PROVERA 10mg?
Aloita pienimmällä annoksella ja keskustele terveydenhuollon tarjoajan kanssa siitä, kuinka hyvin tämä annos toimii sinulle. PROVERAn pienintä tehokasta annosta ei ole määritetty. Sinun ja terveydenhuollon tarjoajasi tulee keskustella säännöllisesti (3–6 kuukauden välein) käyttämäsi annoksesta ja siitä, tarvitsetko edelleen PROVERA-hoitoa.
Mitkä ovat PROVERAn mahdolliset sivuvaikutukset?
Seuraavia haittavaikutuksia on raportoitu käytettäessä PROVERA 10 mg yksinään:
- rintojen arkuus
- rintamaidon eritystä
- läpimurtoverenvuoto
- tiputtelu (pieni verenvuoto emättimestä)
- epäsäännölliset kuukautiset
- amenorrea (kuukautisten puuttuminen)
- emättimen eritteet
- päänsäryt
- hermostuneisuus
- huimaus
- masennus
- unettomuus, uneliaisuus, väsymys
- premenstruaalisen oireyhtymän kaltaiset oireet
- tromboflebiitti (tulehtuneet suonet)
- veritulppa
- kutina, nokkosihottuma, ihottuma
- akne
- hiustenlähtö, hiusten kasvu
- vatsan epämukavuus
- pahoinvointi
- turvotus
- kuume
- painon nousu
- turvotus
- muutokset näkökyvyssä ja herkkyys piilolinsseille
Soita välittömästi terveydenhuollon tarjoajalle, jos saat nokkosihottumaa, hengitysvaikeuksia, kasvojen, suun, kielen tai kaulan turvotusta
Seuraavia sivuvaikutuksia on raportoitu käytettäessä PROVERA 5 mg:aa estrogeenin kanssa.
Haittavaikutukset on ryhmitelty sen mukaan, kuinka vakavia ne ovat ja kuinka usein niitä esiintyy hoidon aikana.
Vakavia, mutta vähemmän yleisiä sivuvaikutuksia ovat:
- sydänkohtaus
- aivohalvaus
- verihyytymiä
- dementia
- rintasyöpä
- kohdun syöpä
- munasarjasyöpä
- korkea verenpaine
- korkea verensokeri
- sappirakon sairaus
- maksaongelmia
- muutokset kilpirauhashormonitasoissasi
- hyvänlaatuisten kasvainten ("fibroidien") suureneminen
Soita välittömästi terveydenhuollon tarjoajallesi, jos saat jonkin seuraavista varoitusmerkeistä tai muista epätavallisista oireista, jotka koskevat sinua:
- uusia kyhmyjä rinnassa
- epätavallinen emättimen verenvuoto
- näön ja puheen muutokset
- äkilliset uudet vakavat päänsäryt
- voimakkaat kivut rinnassa tai jaloissa, joihin liittyy tai ei ole hengenahdistusta, heikkoutta ja väsymystä
- muistin menetys tai sekavuus
Vähemmän vakavia, mutta yleisiä sivuvaikutuksia ovat:
- päänsärky
- rintojen kipu
- epäsäännöllinen emättimen verenvuoto tai tiputtelu
- maha- tai vatsakrampit, turvotus
- pahoinvointia ja oksentelua
- hiustenlähtö
- nesteenpidätys
- emättimen hiivatulehdus
Nämä eivät ole kaikkia PROVERAn mahdollisia sivuvaikutuksia estrogeenin kanssa tai ilman. Lisätietoja sivuvaikutuksista saa terveydenhuollon tarjoajalta tai apteekista. Kerro terveydenhuollon tarjoajallesi, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai eivät häviä. Voit ilmoittaa sivuvaikutuksista Pfizerille numerossa 1-800-438-1985 tai FDA:lle numerossa 1-800-FDA-1088.
Mitä voin tehdä vähentääkseni mahdollisuuksiani saada PROVERA 10mg vakavia sivuvaikutuksia?
- Keskustele säännöllisesti terveydenhuollon tarjoajan kanssa siitä, pitäisikö sinun jatkaa PROVERA-valmisteen käyttöä. Progestiinin lisäämistä suositellaan yleensä naisille, joilla on kohtu, jotta vähennetään mahdollisuutta saada kohtusyöpä.
- Ota välittömästi yhteyttä terveydenhuollon tarjoajaan, jos saat emättimen verenvuotoa PROVERA-hoidon aikana.
- Tee lantiontutkimus, rintojen tutkimus ja mammografia (rintojen röntgenkuva) joka vuosi, ellei terveydenhuollon tarjoaja kerro sinulle jotain muuta. Jos perheesi jäsenillä on ollut rintasyöpä tai jos sinulla on koskaan ollut rintasyövän tai poikkeavia mammografiatutkimuksia, sinun on ehkä tehtävä rintatutkimuksia useammin.
- Jos sinulla on korkea verenpaine, korkea kolesteroli (veren rasva), diabetes, olet ylipainoinen tai jos käytät tupakkaa, sinulla voi olla suurempi mahdollisuus saada sydänsairaus. Kysy terveydenhuollon tarjoajalta tapoja vähentää mahdollisuuttasi saada sydänsairaus.
Yleistä tietoa PROVERAn turvallisesta ja tehokkaasta käytöstä
- Lääkkeitä määrätään joskus sairauksiin, joita ei ole mainittu potilasohjeissa.
- Älä käytä PROVERAa sairauksiin, joihin sitä ei ole määrätty.
- Älä anna PROVERAa muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Pidä PROVERA 10mg poissa lasten ulottuvilta.
Tämä pakkausseloste sisältää yhteenvedon tärkeimmistä PROVERA-tiedoista. Jos haluat lisätietoja, keskustele terveydenhuollon tarjoajan tai apteekkihenkilökunnan kanssa. Voit pyytää tietoa PROVERA 10mg:sta, joka on kirjoitettu terveydenhuollon ammattilaisille. Saat lisätietoja soittamalla maksuttomaan numeroon 1-800-438-1985.
Mitä ainesosia PROVERA sisältää?
Jokainen PROVERA 5 mg tabletti suun kautta annettavaksi sisältää 2,5 mg, 5 mg tai 10 mg medroksiprogesteroniasetaattia.
Ei-aktiiviset aineet: kalsiumstearaatti, maissitärkkelys, laktoosi, mineraaliöljy, sorbiinihappo, sakkaroosi, talkki. 2,5 mg:n tabletti sisältää FD&C Yellow No. 6:ta.
Tämän tuotteen etiketti on saatettu päivittää. Katso nykyiset täydelliset reseptitiedot osoitteesta www.pfizer.com
