Ponstel 250mg, 500mg Mefenamic Acid Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
PONSTEL® (mefenamiinihappo) Kapselit, USP 250 mg
Kardiovaskulaarinen riski
- Tulehduskipulääkkeet voivat lisätä vakavien kardiovaskulaaristen tromboottisten tapahtumien, sydäninfarktin ja aivohalvauksen riskiä, jotka voivat olla kohtalokkaita. Tämä riski voi kasvaa käytön keston myötä. Potilailla, joilla on sydän- ja verisuonitauti tai sydän- ja verisuonitautien riskitekijöitä, voi olla suurempi riski (ks VAROITUKSET ).
- PONSTEL® (mefenaamihappo) on vasta-aiheinen perioperatiivisen kivun hoitoon sepelvaltimon ohitusleikkauksen (CABG) yhteydessä (katso VAROITUKSET ).
Ruoansulatuskanavan riski
- Tulehduskipulääkkeet lisäävät vakavien maha-suolikanavan haittatapahtumien riskiä, mukaan lukien verenvuoto, haavaumat ja mahalaukun tai suoliston perforaatiot, jotka voivat olla hengenvaarallisia. Nämä tapahtumat voivat tapahtua milloin tahansa käytön aikana ja ilman varoittavia oireita. Iäkkäillä potilailla on suurempi riski saada vakavia maha-suolikanavan tapahtumia (ks VAROITUKSET ).
KUVAUS
Ponstel® (mefenaamihappo) kuuluu ei-steroidisten tulehduskipulääkkeiden (NSAID) fenamaattiryhmään. Jokainen sininauhainen norsunluukapseli sisältää 250 mg mefenaamihappoa suun kautta annettavaksi. Mefenaamihappo on valkoisesta harmaanvalkoiseen, hajuton, mikrokiteinen jauhe, jonka sulamispiste on 230–231 °C ja vesiliukoisuus 0,004 % pH:ssa 7,1. Kemiallinen nimi on N-2,3-ksylyyliantraniilihappo. Molekyylipaino on 241,29. Sen molekyylikaava on C15H15NO2 ja mefenaamihapon rakennekaava on:
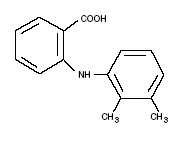
Jokainen kapseli sisältää myös laktoosia, NF. Kapselin kuori ja/tai nauha sisältää sitruunahappoa, USP; D&C keltainen nro 10; FD&C sininen nro 1; FD&C punainen nro 3; FD&C keltainen nro 6; gelatiini, NF; glyserolimono-oleaatti; piidioksidi, NF; natriumbentsoaatti, NF; natriumlauryylisulfaatti, NF; titaanidioksidi, USP.
INDIKAATIOT
Harkitse huolellisesti PONSTELin (mefenaamihapon) ja muiden hoitovaihtoehtojen mahdollisia hyötyjä ja riskejä ennen kuin päätät käyttää PONSTELia (mefenaamihappoa). Käytä pienintä tehokasta annosta lyhimmän ajan potilaan yksilöllisten hoitotavoitteiden mukaisesti (katso VAROITUKSET ).
PONSTEL (mefenamiinihappo) on tarkoitettu:
- Lievän tai keskivaikean kivun lievitykseen potilailla =14-vuotiaat, jolloin hoito ei ylitä viikkoa (7 päivää).
- Primaarisen dysmenorrean hoitoon.
ANNOSTELU JA HALLINNOINTI
Harkitse huolellisesti PONSTELin (mefenaamihapon) ja muiden hoitovaihtoehtojen mahdollisia hyötyjä ja riskejä ennen kuin päätät käyttää PONSTELia (mefenaamihappoa). Käytä pienintä tehokasta annosta lyhimmän ajan potilaan yksilöllisten hoitotavoitteiden mukaisesti (katso VAROITUKSET ).
Sen jälkeen, kun on tarkkailtava vaste PONSTEL-hoitoon (mefenaamihappo), annos ja tiheys on sovitettava kunkin potilaan tarpeiden mukaan.
Aikuisten ja =14-vuotiaiden nuorten akuutin kivun lievittämiseksi suositeltu annos on 500 mg aloitusannoksena ja sen jälkeen 250 mg 6 tunnin välein tarpeen mukaan, yleensä enintään viikon ajan.4
Primaarisen dysmenorrean hoidossa suositeltu annos on 500 mg aloitusannoksena ja sen jälkeen 250 mg 6 tunnin välein suun kautta verenvuodon ja siihen liittyvien oireiden alkamisesta alkaen. Kliiniset tutkimukset osoittavat, että tehokas hoito voidaan aloittaa kuukautisten alkaessa, eikä sen pitäisi kestää yli 2–3 päivää.5
MITEN TOIMITETAAN
Ponstel (mefenaamihappo) on saatavana 250 mg:n siniraitaisina norsunluun kapseleina, joihin on painettu "FHPC 400" ja "PONSTEL® (mefenaamihappo)".
SIVUVAIKUTUKSET
Ponstelia (mefenaamihappoa) tai muita tulehduskipulääkkeitä käyttävillä potilailla yleisimmin raportoidut haittavaikutukset, joita esiintyy noin 1-10 %:lla potilaista, ovat:
Ruoansulatuskanavan kokemukset, mukaan lukien - vatsakipu, ummetus, ripuli, dyspepsia, ilmavaivat, runsas verenvuoto/perforaatio, närästys, pahoinvointi, maha-/pohjukaissuolihaava, oksentelu, munuaisten toimintahäiriöt, anemia, huimaus, entsyymihäiriöt, maksan turvotus, kohonnut päänsärky lisääntynyt verenvuotoaika, kutina, ihottuma, tinnitus
Muita haitallisia kokemuksia, jotka on raportoitu satunnaisesti ja jotka on lueteltu tässä kehon järjestelmäkohtaisesti, ovat:
Runko kokonaisuutena - kuume, infektio, sepsis
Sydän- ja verisuonijärjestelmä - sydämen vajaatoiminta, verenpainetauti, takykardia, pyörtyminen
Ruoansulatuselimistö - suun kuivuminen, ruokatorven tulehdus, maha-/peptiset haavat, gastriitti, maha-suolikanavan verenvuoto, glossiitti, hematemesis, hepatiitti, keltaisuus
Hemic ja lymfaattinen järjestelmä - mustelma, eosinofilia, leukopenia, melena, purppura, peräsuolen verenvuoto, stomatiitti, trombosytopenia
Metabolinen ja ravitsemus -painon muutokset
Hermosto ahdistus, voimattomuus, sekavuus, masennus, unihäiriöt, uneliaisuus; unettomuus, huonovointisuus, hermostuneisuus, parestesia, uneliaisuus, vapina, huimaus
Hengitysjärjestelmä - astma, hengenahdistus
Iho ja lisäkkeet - hiustenlähtö, valoherkkyys, kutina, hikoilu
Erityiset aistit - näön hämärtyminen
Urogenitaalinen järjestelmä - kystiitti, dysuria, hematuria, interstitiaalinen nefriitti, oliguria/polyuria, proteinuria, munuaisten vajaatoiminta
Muita harvoin esiintyviä haittavaikutuksia ovat:
Runko kokonaisuutena - anafylaktiset reaktiot, ruokahalun muutokset, kuolema
Sydän- ja verisuonijärjestelmä - rytmihäiriöt, hypotensio, sydäninfarkti, sydämentykytys, vaskuliitti
Ruoansulatuselimistö - punoitus, maksan vajaatoiminta, haimatulehdus
Hemic ja lymfaattinen järjestelmä - agranulosytoosi, hemolyyttinen anemia, aplastinen anemia, lymfaattinen adenopatia, pansytopenia
Metabolinen ja ravitsemus - hyperglykemia
Hermosto - kouristukset, kooma, hallusinaatiot, aivokalvontulehdus.
Hengitys hengityslama, keuhkokuume
Iho ja lisäkkeet - angioödeema, toksinen epidermaalinen nekroosi, erythema multiforme, eksfoliatiivinen ihottuma, Stevens-Johnsonin oireyhtymä, urtikaria
Erityiset aistit - sidekalvotulehdus, kuulon heikkeneminen
HUUMEIDEN VUOROVAIKUTUKSET
Monet yhdisteet ovat CYP2C9:n estäjiä. Mefenaamihapon ja näiden yhdisteiden yhteisvaikutustutkimuksia ei ole tehty. Turvallisuuden ja tehon muuttumisen mahdollisuus on otettava huomioon, kun Ponstelia (mefenaamihappoa) käytetään samanaikaisesti näiden lääkkeiden kanssa.
ACE:n estäjät
Raportit viittaavat siihen, että tulehduskipulääkkeet voivat heikentää ACE:n estäjien verenpainetta alentavaa vaikutusta. Tämä yhteisvaikutus tulee ottaa huomioon potilailla, jotka käyttävät tulehduskipulääkkeitä samanaikaisesti ACE:n estäjien kanssa.
Aspiriini
Kun PONSTEL (mefenaamihappo) annetaan aspiriinin kanssa, sen sitoutuminen proteiineihin vähenee, vaikka vapaan PONSTELin (mefenaamihapon) puhdistuma ei muutu. Tämän yhteisvaikutuksen kliinistä merkitystä ei tunneta; Kuten muidenkin tulehduskipulääkkeiden kanssa, mefenaamihapon ja aspiriinin samanaikaista käyttöä ei yleensä suositella, koska haittavaikutukset voivat lisääntyä.
Diureetit
Kliiniset tutkimukset sekä markkinoille tulon jälkeiset havainnot ovat osoittaneet, että PONSTEL (mefenaamihappo) voi vähentää furosemidin ja tiatsidien natriureettista vaikutusta joillakin potilailla. Tämän vasteen on katsottu johtuvan munuaisten prostaglandiinisynteesin estämisestä. Tulehduskipulääkkeiden samanaikaisen hoidon aikana potilasta tulee tarkkailla tarkoin munuaisten vajaatoiminnan oireiden varalta (ks. VAROTOIMET, Munuaisvaikutukset ), sekä varmistaa diureettisen tehon.
Litium
Tulehduskipulääkkeet ovat nostaneet plasman litiumpitoisuuksia ja vähentäneet munuaisten litiumin puhdistumaa. Keskimääräinen minimilitiumpitoisuus nousi 15 % ja munuaispuhdistuma pieneni noin 20 %. Näiden vaikutusten on katsottu johtuvan NSAID:n aiheuttamasta munuaisten prostaglandiinisynteesin estämisestä. Siten, kun tulehduskipulääkkeitä ja litiumia annetaan samanaikaisesti, koehenkilöitä tulee tarkkailla huolellisesti litiumin toksisuuden merkkien varalta.
Metotreksaatti
Tulehduskipulääkkeiden on raportoitu estävän kilpailevasti metotreksaatin kertymistä kanin munuaisviipaleisiin. Tämä saattaa viitata siihen, että ne voivat lisätä metotreksaatin toksisuutta. Varovaisuutta tulee noudattaa, kun tulehduskipulääkkeitä annetaan samanaikaisesti metotreksaatin kanssa.
Varfariini
Varfariinin ja tulehduskipulääkkeiden vaikutukset ruoansulatuskanavan verenvuotoon ovat synergistisiä, joten molempien lääkkeiden käyttäjillä on vakavan maha-suolikanavan verenvuodon riski suurempi kuin kummankaan lääkkeen käyttäjillä yksinään.
Antasidit
Kerta-annostutkimuksessa (n=6) antasidin, joka sisälsi 1,7 grammaa magnesiumhydroksidia ja 500 mg mefenamiinihappoa, nauttiminen nosti mefenamiinihapon Cmax-arvoa 125 % ja AUC-arvoa 36 %.1
Lääke/laboratoriotestien vuorovaikutukset
Ponstel (mefenaamihappo) saattaa pidentää protrombiiniaikaa.4 Sen vuoksi, kun lääkettä annetaan potilaille, jotka saavat oraalisia antikoagulantteja, protrombiiniaikaa on seurattava säännöllisesti.
Väärin positiivinen reaktio virtsan sapelle diatsotablettitestillä voi saada aikaan mefenaamihapon annon jälkeen. Jos epäillään biliuriaa, on suoritettava muita diagnostisia toimenpiteitä, kuten Harrison-pistetesti.
VIITTEET
4. Glazko AJ: Flufenaami-, mefenaami- ja meklofenaamihappojen kokeelliset havainnot. Osa III. Aineenvaihdunta, julkaisussa Fenamates in Medicine. A Symposium, Lontoo, 1966. Annals of Physical Medicine, Supplement, s. 23-36, 1967.
VAROITUKSET
Sydän- ja verisuonivaikutukset
Kardiovaskulaariset tromboottiset tapahtumat
Useiden COX-2-selektiivisten ja ei-selektiivisten tulehduskipulääkkeiden kliiniset tutkimukset, jotka kestivät enintään kolme vuotta, ovat osoittaneet lisääntyneen vakavien kardiovaskulaaristen tromboottisten tapahtumien, sydäninfarktin ja aivohalvauksen riskin, jotka voivat olla kohtalokkaita. Kaikilla tulehduskipulääkkeillä, sekä COX-2-selektiivisillä että ei-selektiivisillä, voi olla samanlainen riski. Potilailla, joilla on tunnettu sydän- ja verisuonitauti tai sen riskitekijöitä, voi olla suurempi riski. Mahdollisen haitallisen CV-tapahtuman riskin minimoimiseksi potilailla, joita hoidetaan NSAID-lääkkeillä, tulee käyttää pienintä tehokasta annosta mahdollisimman lyhyen ajan. Lääkäreiden ja potilaiden tulee pysyä valppaina tällaisten tapahtumien kehittymisen suhteen, vaikka aiempia CV-oireita ei olisikaan. Potilaille tulee kertoa vakavien CV-tapahtumien merkeistä ja/tai oireista ja toimenpiteistä, joihin on ryhdyttävä, jos niitä ilmenee.
Ei ole olemassa johdonmukaista näyttöä siitä, että aspiriinin samanaikainen käyttö pienentäisi NSAID-lääkkeiden käyttöön liittyvien vakavien sydän- ja verisuonitautitapahtumien riskiä. Aspiriinin ja tulehduskipulääkkeen samanaikainen käyttö lisää vakavien GI-tapahtumien riskiä (ks GI-VAROITUKSET ).
Kahdessa suuressa, kontrolloidussa kliinisessä tutkimuksessa COX-2-selektiivisellä tulehduskipulääkkeellä kivun hoitoon ensimmäisten 10–14 päivän aikana CABG-leikkauksen jälkeen havaittiin lisääntynyt sydäninfarktin ja aivohalvauksen ilmaantuvuus (ks. VASTA-AIHEET ).
Hypertensio
Tulehduskipulääkkeet, mukaan lukien PONSTEL (mefenaamihappo), voivat johtaa uuden verenpainetaudin puhkeamiseen tai olemassa olevan verenpainetaudin pahenemiseen, mikä voi lisätä sydän- ja verisuonitapahtumien ilmaantuvuutta. Tiatsideja tai loop-diureetteja käyttävien potilaiden vaste näihin hoitoihin voi olla heikentynyt, kun he käyttävät tulehduskipulääkkeitä. Tulehduskipulääkkeitä, mukaan lukien PONSTEL (mefenaamihappo), tulee käyttää varoen potilailla, joilla on korkea verenpaine. Verenpainetta (BP) tulee seurata tarkasti NSAID-hoidon aloittamisen aikana ja koko hoidon ajan.
Kongestiivinen sydämen vajaatoiminta ja turvotus
Joillakin tulehduskipulääkkeitä käyttävillä potilailla on havaittu nesteretentiota ja turvotusta. PONSTELia (mefenaamihappoa) tulee käyttää varoen potilailla, joilla on nesteen kertyminen tai sydämen vajaatoiminta.
Ruoansulatuskanavan vaikutukset – haavaumien, verenvuodon ja perforaation riski
Tulehduskipulääkkeet, mukaan lukien PONSTEL (mefenaamihappo), voivat aiheuttaa vakavia maha-suolikanavan (GI) haittavaikutuksia, kuten tulehdusta, verenvuotoa, haavaumia ja mahalaukun, ohutsuolen tai paksusuolen perforaatiota, jotka voivat olla kohtalokkaita. Näitä vakavia haittavaikutuksia voi esiintyä milloin tahansa varoittavien oireiden kanssa tai ilman niitä potilailla, joita hoidetaan tulehduskipulääkkeillä. Vain joka viides potilas, jolle kehittyy vakava ylemmän maha-suolikanavan haittatapahtuma NSAID-hoidon aikana, on oireellinen. NSAID-lääkkeiden aiheuttamia ylemmän maha-suolikanavan haavaumia, voimakasta verenvuotoa tai perforaatiota esiintyy noin 1 %:lla potilaista, joita hoidettiin 3–6 kuukautta ja noin 2–4 %:lla vuoden ajan. Nämä suuntaukset jatkuvat pidemmän käytön myötä, mikä lisää todennäköisyyttä vakavan GI-tapahtuman kehittymiselle joskus hoidon aikana. Edes lyhytaikainen hoito ei kuitenkaan ole vaaratonta.
Tulehduskipulääkkeitä tulee määrätä äärimmäisen varoen niille, joilla on aiemmin ollut haavaumatauti tai maha-suolikanavan verenvuoto. Potilailla, joilla on aiemmin ollut mahahaava ja/tai maha-suolikanavan verenvuotoa ja jotka käyttävät tulehduskipulääkkeitä, on yli 10-kertainen riski saada maha-suolikanavan verenvuoto verrattuna potilaisiin, joilla ei ole kumpaakaan näistä riskitekijöistä. Muita tekijöitä, jotka lisäävät ruoansulatuskanavan verenvuodon riskiä tulehduskipulääkkeillä hoidetuilla potilailla, ovat suun kautta otettavien kortikosteroidien tai antikoagulanttien samanaikainen käyttö, tulehduskipulääkkeiden pidempi kesto, tupakointi, alkoholin käyttö, vanhempi ikä ja huono yleinen terveydentila. Useimmat spontaanit ilmoitukset kuolemaan johtavista maha-suolikanavan tapahtumista ovat iäkkäillä tai heikkokuntoisilla potilailla, ja siksi tämän väestön hoidossa on oltava erityisen varovainen.
Mahdollisen GI-tapahtuman mahdollisen riskin minimoimiseksi tulehduskipulääkkeitä saavilla potilailla tulee käyttää pienintä tehokasta annosta mahdollisimman lyhyen ajan. Potilaiden ja lääkäreiden tulee pysyä valppaana GI-haavan ja verenvuodon merkkien ja oireiden varalta NSAID-hoidon aikana ja aloittaa viipymättä lisäarviointi ja -hoito, jos epäillään vakavaa ruoansulatuskanavan haittatapahtumaa. Tähän tulisi sisältyä NSAID-lääkityksen lopettaminen, kunnes vakava GI-haittatapahtuma on suljettu pois. Suuren riskin potilailla tulee harkita vaihtoehtoisia hoitoja, joihin ei liity tulehduskipulääkkeitä.
Munuaisvaikutukset
Tulehduskipulääkkeiden pitkäaikainen käyttö on johtanut munuaisten papillaarinekroosiin ja muihin munuaisvaurioihin. Munuaistoksisuutta on havaittu myös potilailla, joilla munuaisten prostaglandiineilla on kompensoiva rooli munuaisten perfuusion ylläpitämisessä. Näillä potilailla ei-steroidisen tulehduskipulääkkeen anto voi aiheuttaa annoksesta riippuvaisen prostaglandiinin muodostumisen ja toissijaisesti munuaisten verenkierron vähenemisen, mikä voi aiheuttaa ilmeistä munuaisten vajaatoimintaa. Suurin tämän reaktion riski on potilailla, joilla on munuaisten vajaatoiminta, sydämen vajaatoiminta, maksan toimintahäiriö, diureetteja ja ACE:n estäjiä käyttävillä sekä vanhuksilla. NSAID-hoidon lopettamista seuraa yleensä palautuminen hoitoa edeltävään tilaan.
Pitkälle edennyt munuaissairaus
Ei ole saatavilla tietoja kontrolloiduista tutkimuksista PONSTELin (mefenaamihapon) käytöstä potilailla, joilla on pitkälle edennyt munuaissairaus. Siksi PONSTEL-hoitoa (mefenaamihappo) ei suositella näille potilaille, joilla on pitkälle edennyt munuaissairaus (ks. VASTA-AIHEET ).
Anafylaktoidiset reaktiot
Kuten muidenkin tulehduskipulääkkeiden yhteydessä, anafylaktisia reaktioita voi esiintyä potilailla, jotka eivät ole aiemmin altistuneet PONSTEL-valmisteelle (mefenamiinihappo). PONSTELia (mefenaamihappoa) ei pidä antaa potilaille, joilla on aspiriinikolmio. Tätä oireyhtymää esiintyy tyypillisesti astmapotilailla, joilla on nuha, johon liittyy tai ei ole nenäpolyyppeja, tai joilla on vaikea, mahdollisesti kuolemaan johtava bronkospasmi aspiriinin tai muiden tulehduskipulääkkeiden ottamisen jälkeen (ks. VASTA-AIHEET ja VAROTOIMET - Aiempi astma ). Hätäapua tulee hakea tapauksissa, joissa anafylaktinen reaktio ilmenee.
Ihoreaktiot
Tulehduskipulääkkeet, mukaan lukien PONSTEL (mefenaamihappo), voivat aiheuttaa vakavia ihohaittavaikutuksia, kuten eksfoliatiivisen ihotulehduksen, Stevens-Johnsonin oireyhtymän (SJS) ja toksisen epidermaalisen nekrolyysin (TEN), jotka voivat olla kohtalokkaita. Nämä vakavat tapahtumat voivat tapahtua ilman varoitusta. Potilaille tulee kertoa vakavien iho-oireiden merkeistä ja oireista, ja lääkkeen käyttö tulee lopettaa heti, kun ihottumaa tai muita yliherkkyysmerkkejä ilmaantuu.
Raskaus
Raskauden loppuvaiheessa, kuten muiden tulehduskipulääkkeiden kanssa, PONSTEL-valmistetta (mefenaamihappoa) tulee välttää, koska se voi aiheuttaa valtimotiehyen ennenaikaisen sulkeutumisen.
VAROTOIMENPITEET
Kenraali
PONSTELin (mefenaamihapon) ei voida odottaa korvaavan kortikosteroideja tai hoitavan kortikosteroidien vajaatoimintaa. Kortikosteroidien käytön äkillinen lopettaminen voi johtaa taudin pahenemiseen. Pitkäaikaista kortikosteroidihoitoa saavien potilaiden hoitoa tulee lyhentää hitaasti, jos päätetään lopettaa kortikosteroidihoito.
PONSTELin (mefenaamihapon) farmakologinen aktiivisuus kuumetta ja tulehdusta alentaessaan voi heikentää näiden diagnostisten oireiden käyttökelpoisuutta oletetun ei-tarttuvien, kivuliaita tilojen komplikaatioiden havaitsemisessa.
Maksavaikutukset
Yhden tai useamman maksakokeen rajan kohoamista voi esiintyä jopa 15 %:lla potilaista, jotka käyttävät tulehduskipulääkkeitä, mukaan lukien PONSTEL (mefenaamihappo). Nämä laboratorioarvojen poikkeavuudet voivat edetä, pysyä ennallaan tai olla ohimeneviä hoidon jatkuessa. NSAID-lääkkeillä tehdyissä kliinisissä tutkimuksissa noin 1 %:lla potilaista on raportoitu huomattavaa ALAT- tai ASAT-arvon nousua (noin kolme kertaa tai enemmän normaalin ylärajaan verrattuna). Lisäksi harvoissa tapauksissa on raportoitu vakavia maksareaktioita, mukaan lukien keltaisuus ja kuolemaan johtava fulminantti hepatiitti, maksanekroosi ja maksan vajaatoiminta, joista osa on johtanut kuolemaan.
Potilas, jolla on oireita ja/tai merkkejä, jotka viittaavat maksan toimintahäiriöön, tai jos maksatestissä on esiintynyt epänormaalia, tulee arvioida vakavamman maksareaktion kehittymisen varalta PONSTEL-hoidon (mefenaamihappo) aikana. Jos kliinisiä merkkejä ja oireita ilmenee maksasairauden kanssa tai jos systeemisiä oireita (esim. eosinofilia, ihottuma jne.) ilmenee, PONSTEL (mefenaamihappo) on lopetettava.

Hematologiset vaikutukset
Anemiaa havaitaan joskus potilailla, jotka saavat tulehduskipulääkkeitä, mukaan lukien PONSTEL (mefenaamihappo). Tämä voi johtua nesteretentiosta, ruoansulatuskanavan verenhukasta tai epätäydellisesti kuvatusta vaikutuksesta erytropoieesiin. Potilaiden, jotka saavat pitkäaikaista hoitoa tulehduskipulääkkeillä, mukaan lukien PONSTEL (mefenaamihappo), tulee tarkistaa hemoglobiini tai hematokriitti, jos heillä on anemian merkkejä tai oireita. Tulehduskipulääkkeet estävät verihiutaleiden aggregaatiota ja niiden on osoitettu pidentävän vuotoaikaa joillakin potilailla. Toisin kuin aspiriini, niiden vaikutus verihiutaleiden toimintaan on kvantitatiivisesti pienempi, lyhytkestoisempi ja palautuva. Potilaita, jotka saavat PONSTEL-hoitoa (mefenaamihappoa), joihin verihiutaleiden toiminnan muutokset voivat vaikuttaa haitallisesti, kuten potilaita, joilla on hyytymishäiriöitä tai potilaita, jotka saavat antikoagulantteja, on seurattava huolellisesti.
Aiempi astma
Astmapotilailla voi olla aspiriinille herkkä astma. Aspiriinin käyttö potilailla, joilla on aspiriinille herkkä astma, on yhdistetty vaikeaan bronkospasmiin, joka voi olla kohtalokas. Koska ristireaktiivisuutta, mukaan lukien bronkospasmi, aspiriinin ja muiden ei-steroidisten tulehduskipulääkkeiden välillä on raportoitu tällaisilla aspiriinille herkillä potilailla, PONSTEL-valmistetta (mefenaamihappoa) ei tule antaa potilaille, joilla on tällainen aspiriiniherkkyys, ja sitä tulee käyttää varoen potilaille, joilla on aiemmin ollut astma.
Tietoa potilaille
Potilaille tulee kertoa seuraavista tiedoista ennen NSAID-hoidon aloittamista ja ajoittain meneillään olevan hoidon aikana. Potilaita tulee myös kannustaa lukemaan NSAID Lääkitysopas joka tulee jokaisen jaetun reseptin mukana.
Laboratoriotestit
Koska vakavia maha-suolikanavan haavaumia ja verenvuotoa voi esiintyä ilman varoittavia oireita, lääkäreiden tulee seurata maha-suolikanavan verenvuodon merkkejä tai oireita. Pitkäaikaista NSAID-hoitoa saavien potilaiden CBC ja kemiallinen profiili tulee tarkistaa säännöllisesti. Jos maksa- tai munuaissairauden mukaisia kliinisiä merkkejä ja oireita kehittyy, ilmenee systeemisiä oireita (esim. eosinofiliaa, ihottumaa jne.) tai jos epänormaalit maksakokeiden tulokset jatkuvat tai pahenevat, Ponstel-hoito (mefenaamihappo) on lopetettava.
Raskaus
Teratogeeniset vaikutukset
Raskausluokka C
Rotilla ja kaniineilla tehdyt lisääntymistutkimukset eivät ole osoittaneet näyttöä kehityshäiriöistä. Eläinten lisääntymistutkimukset eivät kuitenkaan aina ennusta ihmisen vastetta. Ei ole olemassa riittäviä tai hyvin kontrolloituja tutkimuksia raskaana oleville naisille. Postelia tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan riskin.
Ei-teratogeeniset vaikutukset
Koska ei-steroidisilla tulehduskipulääkkeillä on tunnettuja vaikutuksia sikiön sydän- ja verisuonijärjestelmään (valtimotiehyen sulkeutuminen), käyttöä raskauden aikana (erityisesti myöhään raskauden aikana) tulee välttää.
Työ ja toimitus
Rotilla tehdyissä tulehduskipulääkkeillä, kuten muillakin prostaglandiinien synteesiä estävillä lääkkeillä, tehdyissä tutkimuksissa havaittiin lisääntynyttä dystokian, viivästyneen synnytyksen ja poikasten eloonjäämisen ilmaantuvuutta. Ponstelin (mefenaamihapon) vaikutuksia raskaana olevien naisten synnytykseen ja synnytykseen ei tunneta.
Imettävät äidit
Pieniä määriä Ponstelia (mefenaamihappoa) voi esiintyä äidinmaidossa ja siirtyä imetettävään lapseen.7 Koska PONSTEL (mefenaamihappo) voi aiheuttaa vakavia haittavaikutuksia imeväisille, on tehtävä päätös, lopetetaanko imetys vai lopettaa lääkkeen käyttö ottaen huomioon lääkkeen merkityksen äidille.
Käyttö lapsille
Turvallisuutta ja tehoa alle 14-vuotiailla lapsipotilailla ei ole varmistettu.
Geriatrinen käyttö
Ponstelin (mefenaamihappo) kliinisissä tutkimuksissa ei ollut riittävästi 65-vuotiaita ja sitä vanhempia koehenkilöitä sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat. Kuten kaikkien tulehduskipulääkkeiden kohdalla, varovaisuutta on noudatettava hoidettaessa iäkkäitä (65-vuotiaita ja sitä vanhempia).
Tämän lääkkeen tiedetään erittyvän olennaisesti munuaisten kautta, ja tämän lääkkeen toksisten reaktioiden riski voi olla suurempi potilailla, joilla on heikentynyt munuaisten toiminta. Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, annoksen valinnassa on oltava varovainen, ja munuaisten toiminnan seuranta voi olla hyödyllistä (ks. KLIININEN FARMAKOLOGIA ja VASTOINKÄYMISET).
VIITTEET
7. Buchanan RA, et ai. Mefenaamihapon erittyminen rintamaitoon. Curr Ther Res. 10:592, 1968.
YLIANNOSTUS
Akuutin tulehduskipulääkkeiden yliannostuksen jälkeiset oireet rajoittuvat yleensä letargiaan, uneliaisuuteen, pahoinvointiin, oksenteluun ja ylävatsan kipuun, jotka yleensä korjaantuvat tukihoidolla. Ruoansulatuskanavan hypertensio, akuutti munuaisten vajaatoiminta, hengityslama ja kooma voivat ilmaantua, mutta ne ovat harvinaisia. Anafylaktoidisia reaktioita on raportoitu tulehduskipulääkkeiden terapeuttisen nauttimisen yhteydessä, ja niitä voi esiintyä yliannostuksen jälkeen.
NSAID-yliannostuksen jälkeen potilaita tulee hoitaa oireenmukaisella ja tukevalla hoidolla. Spesifisiä vastalääkkeitä ei ole. Oksentelu ja/tai aktiivihiili (60-100 g aikuisilla, 1-2 g/kg lapsilla) ja/tai osmoottinen katarsinen voi olla aiheellisia potilaille, joilla on oireita tai suuren yliannoksen (5-10) jälkeen 4 tunnin kuluessa nielemisestä. kertaa tavallinen annos). Pakotettu diureesi, virtsan alkalisointi, hemodialyysi tai hemoperfuusio eivät ehkä ole hyödyllisiä korkean proteiinisitoutumisen vuoksi.
VASTA-AIHEET
PONSTEL (mefenaamihappo) on vasta-aiheinen potilailla, joiden tiedetään olevan yliherkkiä mefenaamihapolle.
PONSTELia (mefenaamihappoa) ei pidä antaa potilaille, joilla on ollut astmaa, nokkosihottumaa tai allergisia reaktioita aspiriinin tai muiden tulehduskipulääkkeiden ottamisen jälkeen. Tällaisilla potilailla on raportoitu vakavia, harvoin kuolemaan johtaneita, anafylaksia muistuttavia reaktioita tulehduskipulääkkeille (ks. VAROITUKSET – Anafylaktiset reaktiot ja VAROTOIMET – Aiempi astma ).
PONSTEL (mefenaamihappo) on vasta-aiheinen perioperatiivisen kivun hoitoon sepelvaltimon ohitusleikkauksen (CABG) yhteydessä (ks. VAROITUKSET ).
Ponstel (mefenaamihappo) on vasta-aiheinen potilaille, joilla on akuutti aktiivinen haavauma tai krooninen tulehdus joko ylemmän tai alemman maha-suolikanavan alueella.
Ponstel-valmistetta (mefenaamihappoa) ei tule käyttää potilailla, joilla on aiempi munuaissairaus.
KLIININEN FARMAKOLOGIA
Farmakodynamiikka
Ponstel (mefenaamihappo) on ei-steroidinen tulehduskipulääke (NSAID), jolla on tulehdusta, kipua lievittävää ja kuumetta alentavaa vaikutusta eläinmalleissa. Ponstelin (mefenaamihapon) vaikutusmekanismia, kuten muiden tulehduskipulääkkeiden, ei täysin tunneta, mutta se voi liittyä prostaglandiinisyntetaasin estoon.
Farmakokinetiikka
Imeytyminen
Mefenaamihappo imeytyy nopeasti oraalisen annon jälkeen. Kahdessa 500 mg:n oraalisen kerta-annoksen tutkimuksessa keskimääräinen imeytymisaste oli 30,5 mcg/h/ml (17 % CV).1,2 Kapselin biologista hyötyosuutta suhteessa IV-annokseen tai oraaliseen liuokseen ei ole tutkittu.
Yhden gramman oraalisen kerta-annoksen jälkeen on raportoitu keskimääräisiä huippupitoisuuksia plasmassa 10-20 mcg/ml3. Plasman huippupitoisuus saavutetaan 2–4 tunnissa ja eliminaation puoliintumisaika on noin 2 tuntia. Useiden annosten jälkeen plasmapitoisuudet ovat verrannollisia annokseen, eikä lääkkeiden kertymisestä ole näyttöä. Moniannostutkimuksessa normaaleilla aikuisilla koehenkilöillä (n = 6), jotka saivat 1 gramman annoksia mefenaamihappoa neljästi päivässä, vakaan tilan pitoisuudet 20 mikrogrammaa/ml saavutettiin toisena antopäivänä, mikä on yhdenmukainen lyhyen puolivälin kanssa. elämää.
Ruoan vaikutusta mefenaamihapon imeytymisnopeuteen ja -asteeseen ei ole tutkittu. Magnesiumhydroksidia sisältävien antasidien samanaikaisen nauttimisen on osoitettu lisäävän merkittävästi mefenaamihapon imeytymisnopeutta ja laajuutta (ks. VAROTOIMENPITEET: LÄÄKKEIDEN VUOROVAIKUTUKSET ).1
Jakelu
Mefenaamihapon on raportoitu sitoutuneen yli 90 % albumiiniin.9 Sitoutumattoman fraktion suhdetta lääkeainepitoisuuteen ei ole tutkittu. Näennäinen jakautumistilavuus (Vzss/F) arvioitu 500 mg:n oraalisen mefenamiinihapon annoksen jälkeen oli 1,06 l/kg.2
Fysikaalisten ja kemiallisten ominaisuuksiensa perusteella Ponstelin (mefenaamihapon) odotetaan erittyvän ihmisen rintamaitoon.
Aineenvaihdunta
Mefenaamihappo metaboloituu sytokromi P450 -entsyymin CYP2C9 vaikutuksesta 3-hydroksimetyylimefenaamihapoksi (aineenvaihdunta I). Hapettumista 3-karboksimefenaamihapoksi (Metaboliitti II) voi tapahtua edelleen.10 Näiden metaboliittien aktiivisuutta ei ole tutkittu. Metaboliitit voivat glukuronidoitua ja mefenaamihappo glukuronidoituu myös suoraan. Plasman huippupitoisuus, joka on noin 20 mikrog/ml, havaittiin 3 tunnin kuluttua hydroksimetaboliitista ja sen glukuronidista (n=6) yhden gramman kerta-annoksen jälkeen. Vastaavasti karboksimetaboliitin ja sen glukuronidin huippupitoisuus plasmassa 8 mcg/ml havaittiin 6-8 tunnin kohdalla.3
Erittyminen
Noin 52 prosenttia mefenaamihappoannoksesta erittyy virtsaan pääasiassa mefenaamihapon (6 %), 3-hydroksimefenaamihapon (25 %) ja 3-karboksimefenaamihapon (21 %) glukuronideina. Ulosteen kautta poistumisreitti vastaa jopa 20 % annoksesta, pääasiassa konjugoimattomana 3-karboksimefenaamihapona.3
Mefenaamihapon eliminaation puoliintumisaika on noin kaksi tuntia. Metaboliittien I ja II puoliintumisaikoja ei ole raportoitu tarkasti, mutta ne näyttävät olevan pidempiä kuin alkuperäisen yhdisteen.3 Metaboliitit voivat kertyä potilaille, joilla on munuaisten tai maksan vajaatoiminta. Mefenaamihappoglukuronidi voi sitoutua palautumattomasti plasman proteiineihin. Koska sekä munuaisten että maksan erittyminen ovat merkittäviä eliminaatioreittejä, annostuksen muuttaminen potilailla, joilla on munuaisten tai maksan toimintahäiriö, saattaa olla tarpeen. Ponstelia (mefenaamihappoa) ei tule antaa potilaille, joilla on aiempi munuaissairaus tai potilaille, joilla on merkittävästi heikentynyt munuaisten toiminta.
TAULUKKO 1: Farmakokineettisten parametrien arviot mefenaamihapolle
Erikoispopulaatiot
Pediatriset
Ponstelia (mefenaamihappoa) ei ole tutkittu riittävästi alle 14-vuotiailla lapsipotilailla. Tutkimus 17 keskosella, joille annettiin 2 mg/kg, osoitti, että puoliintumisaika oli noin viisi kertaa pidempi kuin aikuisilla, mikä vastaa vastasyntyneiden metabolisten entsyymien vähäistä aktiivisuutta. Keskimääräinen Cmax tässä tutkimuksessa oli 4 mcg/ml (vaihteluväli 2,9-6,1). Keskimääräinen aika huippupitoisuuteen (Tmax) oli 8 tuntia (vaihteluväli 2-18 tuntia).11
Rotu
Rotuun johtuvia farmakokineettisiä eroja ei ole tunnistettu.
Maksan vajaatoiminta
Mefenaamihapon farmakokinetiikkaa ei ole tutkittu potilailla, joilla on maksan vajaatoiminta. Koska maksaaineenvaihdunta on merkittävä mefenaamihapon eliminaatioreitti, potilaat, joilla on akuutti ja krooninen maksasairaus, saattavat tarvita pienempiä Ponstel-annoksia (mefenaamihappoa) verrattuna potilaisiin, joiden maksatoiminta on normaali.
Munuaisten vajaatoiminta
Mefenaamihapon farmakokinetiikkaa ei ole tutkittu potilailla, joilla on munuaisten vajaatoiminta. Koska mefenaamihappo, sen metaboliitit ja konjugaatit erittyvät pääasiassa munuaisten kautta, mefenaamihappometaboliitit voivat kerääntyä. Ponstelia (mefenaamihappoa) ei tule antaa potilaille, joilla on aiempi munuaissairaus tai potilaille, joilla on merkittävästi heikentynyt munuaisten toiminta.
Kliiniset tutkimukset
Kontrolloiduissa kaksoissokkoutetuissa kliinisissä tutkimuksissa Ponstel (mefenaamihappo) arvioitiin primaarisen puuskittaisen dysmenorrean hoitoon. Tehon määrittämisessä käytetyt parametrit sisälsivät sekä potilaan että tutkijan tekemän kivun arvioinnin; samanaikaisen analgeettisen lääkityksen tarve; ja puuskittaiselle dysmenorrealle ominaisten oireiden esiintymistiheyden ja vakavuuden muutoksen arviointi. Potilaat saivat joko Ponstelia (mefenaamihappoa), 500 mg (2 kapselia) aloitusannoksena 250 mg 6 tunnin välein tai lumelääkettä verenvuodon tai kivun alkaessa sen mukaan, kumpi alkoi ensin. Kolmen kuukautiskierron jälkeen potilaat siirrettiin vaihtoehtoiseen hoitoon vielä kolmeksi kuukaudeksi. Ponstel (mefenaamihappo) oli merkitsevästi parempi kuin lumelääke kaikissa parametreissa, ja molemmat hoidot (lääke ja lumelääke) olivat yhtä siedettyjä.
VIITTEET
1. Neuvonen PJ, Kivisto KT: Lääkkeiden imeytymisen tehostaminen antasidien avulla. Tuntematon lääkevuorovaikutus. Clin Pharmacokinet. 27:120-8, elokuu 1994.
2. Tall AR, Mistilits SP: Ponstanin (mefenaamihappo) tutkimukset: I. Ruoansulatuskanavan verenhukka; II. Uuden formulaation imeytyminen ja erittyminen. J Int Med Res (Iso-Britannia). 1975, 3 (3) s. 176-82.
3. Winder CV, Kaupp DH, Glazko et ai.: Flufenaami-, mefenaami- ja meklofenaamihappojen kokeelliset havainnot. AnnPhys Med (Eng), Suppl s. 7-49.1967.
9. Champion GD, Graham GG: Ei-steroidisten tulehduskipulääkkeiden farmakokinetiikka. Aust NZ J Med. 8 (Supp 1): 94-100, kesäkuu 1978.
10. McGurk KA, Remmel RP, Hosagrahara VP, Tosh D, Burchell B: Mefenaamihappo-1-o-asyyliglukuronidin reaktiivisuus proteiinien kanssa in vitro ja ex vivo. Drug Metab Dispos. elokuu 1996, 24 (8) s. 842-9.
11. Ito K, Niida Y, Sato J et ai.: Mefenaamihapon farmakokinetiikka keskosilla, joilla on avoin valtimotiehye. Acta Paediatr JPN. 36 (4): 387-91, 1994.
POTILASTIEDOT
Lääkitysopas ei-steroidiset tulehduskipulääkkeet (NSAID)
(Katso tämän lääkitysoppaan lopusta luettelo NSAID-reseptilääkkeistä.)
Mikä on tärkein tieto, joka minun pitäisi tietää steroideihin kuulumattomista tulehduskipulääkkeistä (NSAID)?
NSAID-lääkkeet voivat lisätä sydänkohtauksen tai aivohalvauksen mahdollisuutta, joka voi johtaa kuolemaan. Tämä mahdollisuus kasvaa:
- NSAID-lääkkeiden pidempiaikainen käyttö
- ihmisillä, joilla on sydänsairaus
NSAID-lääkkeitä ei tule koskaan käyttää juuri ennen tai jälkeen sydänleikkauksen, jota kutsutaan "sepelvaltimon ohitusleikkaukseksi (CABG).
NSAID-lääkkeet voivat aiheuttaa haavaumia ja verenvuotoa mahassa ja suolistossa milloin tahansa hoidon aikana.
Haavaumat ja verenvuoto:
- voi tapahtua ilman varoittavia oireita
- voi aiheuttaa kuoleman
Mahdollisuus saada haavauma tai verenvuoto lisääntyy, kun:
- "kortikosteroideiksi" ja "antikoagulantteiksi" kutsuttujen lääkkeiden ottaminen
- pidempään käyttöön
- tupakointi-
- juoda alkoholia
- vanhempi ikä
- joilla on huono terveys
NSAID-lääkkeitä tulee käyttää vain:
- juuri niin kuin määrätään
- pienimmällä mahdollisella annoksella hoitoasi
- lyhimmän tarvittavan ajan
Mitä ovat ei-steroidiset tulehduskipulääkkeet (NSAID)?
NSAID-lääkkeitä käytetään kivun ja punoituksen, turvotuksen ja lämmön (tulehduksen) hoitoon sairauksista, kuten:
- erilaisia niveltulehduksia
- kuukautiskipuja ja muita lyhytaikaisia kipuja
Kuka ei saa käyttää steroideihin kuulumatonta tulehduskipulääkettä (NSAID)?
Älä käytä NSAID-lääkettä:
- jos sinulla on ollut astmakohtaus, nokkosihottuma tai muu allerginen reaktio aspiriinin tai muun NSAID-lääkkeen kanssa
- kipuihin juuri ennen tai jälkeen sydämen ohitusleikkauksen
Kerro terveydenhuollon tarjoajallesi:
- kaikista sairauksistasi.
- kaikista käyttämistäsi lääkkeistä. Tulehduskipulääkkeet ja jotkut muut lääkkeet voivat olla vuorovaikutuksessa keskenään ja aiheuttaa vakavia sivuvaikutuksia. Pidä luetteloa lääkkeistäsi näytettäväksi terveydenhuollon tarjoajalle ja apteekkihenkilökunnalle.
- jos olet raskaana. Raskaana olevat naiset eivät saa käyttää NSAID-lääkkeitä raskauden loppuvaiheessa.
- jos imetät. Keskustele lääkärisi kanssa.
Mitkä ovat ei-steroidisten tulehduskipulääkkeiden (NSAID) mahdolliset sivuvaikutukset?
Hae heti hätäapua, jos sinulla on jokin seuraavista oireista:
- hengenahdistus tai hengitysvaikeudet
- rintakipu
- heikkous jossakin kehon osassa tai puolella
- sammaltava puhe
- kasvojen tai kurkun turvotus
Lopeta NSAID-lääkitys ja soita heti terveydenhuollon tarjoajalle, jos sinulla on jokin seuraavista oireista:
Nämä eivät ole kaikkia NSAID-lääkkeiden sivuvaikutuksia. Keskustele terveydenhuollon tarjoajaltasi tai apteekistasi saadaksesi lisätietoja NSAID-lääkkeistä.
Muita tietoja ei-steroidisista tulehduskipulääkkeistä (NSAID)
- Aspiriini on NSAID-lääke, mutta se ei lisää sydänkohtauksen mahdollisuutta. Aspiriini voi aiheuttaa verenvuotoa aivoissa, mahassa ja suolistossa. Aspiriini voi myös aiheuttaa haavaumia mahassa ja suolistossa.
- Joitakin näistä NSAID-lääkkeistä myydään pienempinä annoksina ilman reseptiä (reseptivapaa). Keskustele terveydenhuollon tarjoajan kanssa ennen kuin käytät reseptivapaa tulehduskipulääkkeitä yli 10 päivää.
NSAID-lääkkeet, jotka tarvitsevat reseptin
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto. Voimaantulopäivä: 19.02.2008
