Fosamax 35mg, 70mg Alendronate Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Fosamax 70mg on ja miten sitä käytetään?
Fosamax 35mg on reseptilääke, jota käytetään tietyntyyppisen luukadon (osteoporoosin) ehkäisyyn ja hoitoon aikuisilla. Fosamax 70 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Fosamax on kalsiumin aineenvaihdunnan modifiointiaine, bisfosfonaattijohdannainen.
Ei tiedetä, onko Fosamax turvallinen ja tehokas lapsille.
Mitkä ovat Fosamaxin mahdolliset sivuvaikutukset?
Fosamax voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- rintakipu
- uusi tai paheneva närästys
- kipua tai polttamista kylkiluiden alla tai selässä
- vaikea närästys
- polttava kipu ylävatsassa tai veren yskiminen
- uusi tai epätavallinen kipu reidessä tai lonkassa
- leuan kipu
- tunnottomuus
- turvotus
- vaikea nivel-, luu- tai lihaskipu
- lihaskouristukset tai -krampit
- tunnottomuus tai pistely suun ympärillä tai sormissa tai varpaissa
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Fosamaxin yleisimmät sivuvaikutukset ovat:
- närästys
- ärtynyt vatsa
- vatsakipu
- pahoinvointi
- ripuli
- ummetus
- luukipu
- lihaskipu
- nivelkipu
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Fosamaxin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
FOSAMAX (alendronaattinatrium) on bisfosfonaatti, joka toimii spesifisenä osteoklastivälitteisen luun resorption estäjänä. Bisfosfonaatit ovat pyrofosfaatin synteettisiä analogeja, jotka sitoutuvat luussa olevaan hydroksiapatiittiin.
Alendronaattinatrium kuvataan kemiallisesti (4-amino-1-hydroksibutylideeni)bisfosfonihapon mononatriumsuolan trihydraattina.
Alendronaattinatriumin empiirinen kaava on C4H12NNaO7P2 •3H2O ja sen kaavapaino on 325,12. Rakennekaava on:
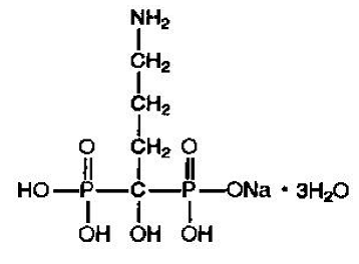
Alendronaattinatrium on valkoinen, kiteinen, ei-hygroskooppinen jauhe. Se liukenee veteen, liukenee hyvin vähän alkoholiin ja käytännössä liukenematon kloroformiin.
Suun kautta annettavat FOSAMAX 70 mg tabletit sisältävät 91,37 mg alendronaattimononatriumsuolatrihydraattia, joka vastaa 70 mg vapaata happoa, ja seuraavia inaktiivisia aineosia: mikrokiteinen selluloosa, vedetön laktoosi, kroskarmelloosinatrium ja magnesiumstearaatti.
INDIKAATIOT
Osteoporoosin hoito® postmenopausaalisilla naisilla
FOSAMAX on tarkoitettu postmenopausaalisten naisten osteoporoosin hoitoon. Postmenopausaalisilla naisilla FOSAMAX 70 mg lisää luumassaa ja vähentää murtumien ilmaantuvuutta, mukaan lukien lonkka- ja selkärangan murtumat (nikamamurtumat). [Katso Kliiniset tutkimukset ]
Osteoporoosin ehkäisy postmenopausaalisilla naisilla
FOSAMAX 70 mg on tarkoitettu postmenopausaalisen osteoporoosin ehkäisyyn [katso Kliiniset tutkimukset ].
Hoito luumassan lisäämiseksi miehillä, joilla on osteoporoosi
FOSAMAX on tarkoitettu hoitoon luumassan lisäämiseksi miehillä, joilla on osteoporoosi [katso Kliiniset tutkimukset ].
Glukokortikoidien aiheuttaman osteoporoosin hoito
FOSAMAX on tarkoitettu glukokortikoidien aiheuttaman osteoporoosin hoitoon miehillä ja naisilla, jotka saavat glukokortikoideja vuorokausiannoksena, joka vastaa vähintään 7,5 mg prednisonia ja joilla on alhainen luun mineraalitiheys [ks. Kliiniset tutkimukset ].
Pagetin luutaudin hoito
FOSAMAX 35 mg on tarkoitettu Pagetin luutaudin hoitoon miehillä ja naisilla. Hoito on tarkoitettu potilaille, joilla on Pagetin luutautia sairastavat potilaat, joiden alkalinen fosfataasi on vähintään kaksi kertaa normaalin ylärajaa suurempi, tai potilaille, jotka ovat oireettomia tai joilla on riski saada sairautensa myöhempiä komplikaatioita. [Katso Kliiniset tutkimukset ]
Tärkeitä käytön rajoituksia
Optimaalista käyttöaikaa ei ole määritetty. FOSAMAXin turvallisuus ja tehokkuus osteoporoosin hoidossa perustuvat neljän vuoden kliinisiin tietoihin. Kaikkien bisfosfonaattihoitoa saavien potilaiden hoidon jatkamisen tarve tulee arvioida uudelleen säännöllisin väliajoin. Potilaiden, joilla on pieni murtumariski, tulee harkita lääkkeen lopettamista 3–5 vuoden käytön jälkeen. Potilaiden, jotka lopettavat hoidon, murtumariski tulee arvioida uudelleen säännöllisesti.
ANNOSTELU JA HALLINNOINTI
Vaikka markkinoilla on saatavilla 5 mg, 10 mg, 35 mg ja 40 mg alendronaattitabletteja, FOSAMAX 35 mg:aa ei enää markkinoida vahvuuksina 5 mg, 10 mg, 35 mg ja 40 mg.
Vaikka alendronaatin oraaliliuosta saattaa olla saatavilla markkinoilla, FOSAMAX 35 mg oraaliliuosta ei enää markkinoida.
Osteoporoosin hoito postmenopausaalisilla naisilla
Suositeltu annostus on:
- yksi 70 mg:n tabletti kerran viikossa tai
- yksi pullo 70 mg:n oraaliliuosta kerran viikossa tai
- yksi 10 mg tabletti kerran päivässä
Osteoporoosin ehkäisy postmenopausaalisilla naisilla
Suositeltu annostus on:
- yksi 35 mg:n tabletti kerran viikossa tai
- yksi 5 mg:n tabletti kerran päivässä
Hoito luumassan lisäämiseksi miehillä, joilla on osteoporoosi
Suositeltu annostus on:
- yksi 70 mg:n tabletti kerran viikossa tai
- yksi pullo 70 mg:n oraaliliuosta kerran viikossa tai
- yksi 10 mg tabletti kerran päivässä
Glukokortikoidien aiheuttaman osteoporoosin hoito
Suositeltu annos on yksi 5 mg:n tabletti kerran vuorokaudessa, paitsi postmenopausaalisilla naisilla, jotka eivät saa estrogeenia, joille suositeltu annos on yksi 10 mg:n tabletti kerran vuorokaudessa.
Pagetin luutaudin hoito
Suositeltu hoito-ohjelma on 40 mg kerran päivässä kuuden kuukauden ajan.
Pagetin taudin uusintahoito
Uusintahoitoa FOSAMAX 35 mg:lla voidaan harkita kuuden kuukauden hoidon jälkeisen arviointijakson jälkeen potilailla, joilla on uusiutuminen. Tämä perustuu seerumin alkalisen fosfataasin nousuun, joka tulee mitata säännöllisesti. Uusintahoitoa voidaan harkita myös niille, jotka eivät onnistuneet normalisoimaan seerumin alkalista fosfataasia.
Tärkeät hallintaohjeet
Neuvo potilaita tekemään seuraavat:
- Ota FOSAMAX vähintään puoli tuntia ennen päivän ensimmäistä ruokaa, juomaa tai lääkettä pelkän veden kera [ks. Potilasneuvontatiedot ]. Muut juomat (mukaan lukien kivennäisvesi), ruoka ja jotkut lääkkeet todennäköisesti vähentävät FOSAMAXin imeytymistä [ks. HUUMEIDEN VUOROVAIKUTUKSET ]. Alle 30 minuutin odottaminen tai FOSAMAX 70 mg:n ottaminen ruoan, juomien (muiden kuin pelkän veden) tai muiden lääkkeiden kanssa heikentää FOSAMAX 70 mg:n vaikutusta vähentämällä sen imeytymistä elimistöön.
- Ota FOSAMAX päivän noustessa. Mahaan kulkeutumisen helpottamiseksi ja siten ruokatorven ärsytyksen mahdollisen vähentämiseksi FOSAMAX 35 mg -tabletti tulee niellä täyden vesilasillisen kera (6-8 unssia). Mahalaukun tyhjenemisen helpottamiseksi FOSAMAX 70 mg oraaliliuoksen jälkeen tulee juoda vähintään 2 unssia (neljännes kupillista) vettä. Potilaat eivät saa mennä makuulle vähintään 30 minuuttiin ja vasta päivän ensimmäisen aterian jälkeen. FOSAMAXia ei tule ottaa nukkumaan mennessä tai ennen nousemista ylös. Näiden ohjeiden noudattamatta jättäminen voi lisätä ruokatorven haitallisten kokemusten riskiä [katso VAROITUKSET JA VAROTOIMET ja Potilasneuvontatiedot ].
Kalsium- ja D-vitamiinilisäsuositukset
Neuvo potilaita ottamaan lisäkalsiumia, jos ravinnon saanti on riittämätön [katso VAROITUKSET JA VAROTOIMET ]. Potilaat, joilla on lisääntynyt D-vitamiinin vajaatoiminnan riski (esim. yli 70-vuotiaat, hoitokodissa olevat tai kroonisesti sairaat) saattavat tarvita D-vitamiinilisää. Potilaat, joilla on maha-suolikanavan imeytymishäiriö, saattavat tarvita suurempia D-vitamiinilisäannoksia, ja 25-hydroksi-D-vitamiinin mittaamista tulee harkita.
Potilaiden, joita hoidetaan glukokortikoideilla, tulee saada riittävä määrä kalsiumia ja D-vitamiinia.
Anto-ohjeet väliin jääneitä annoksia varten
Jos kerran viikossa annettava FOSAMAX-annos unohtuu, neuvo potilaita ottamaan yksi annos seuraavana aamuna sen jälkeen, kun he muistavat. Heidän ei tule ottaa kahta annosta samana päivänä, vaan heidän on palattava ottamaan yksi annos kerran viikossa, kuten alun perin oli suunniteltu heidän valitsemanaan päivänä.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
- 70 mg tabletit ovat valkoisia, soikeita, päällystämättömiä tabletteja, joiden toisella puolella on koodi 31 ja toisella puolella luukuva.
Varastointi ja käsittely
Nro 3814 – FOSAMAX-tabletit, 70 mg, ovat valkoisia, soikeita, päällystämättömiä tabletteja, joiden toisella puolella on koodi 31 ja toisella puolella luun kuva:
NDC 0006-0031-44 4 kpl läpipainopakkaus.
Varastointi
FOSAMAX-tabletit
Säilytä hyvin suljetussa astiassa huoneenlämmössä, 15-30°C (59-86°F).
Jakelija: Merck Sharp & Dohme Corp., MERCK & CO., INC.:n tytäryhtiö, Whitehouse Station, NJ 08889, USA. Tarkistettu: elokuu 2019
SIVUVAIKUTUKSET
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida verrata suoraan toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta kliinisissä käytännöissä havaittuja nopeuksia.
Osteoporoosin hoito postmenopausaalisilla naisilla
Päivittäinen annostelu
FOSAMAX 35 mg:n turvallisuutta postmenopausaalisen osteoporoosin hoidossa arvioitiin neljässä kliinisessä tutkimuksessa, joihin osallistui 7453 44–84-vuotiasta naista. Tutkimus 1 ja tutkimus 2 olivat identtisesti suunniteltuja, kolmivuotisia, lumekontrolloituja, kaksoissokkoutettuja, monikeskustutkimuksia (Yhdysvallat ja monikansalliset n = 994); Tutkimus 3 oli murtumainterventiotutkimuksen [FIT] kolmen vuoden nikamamurtumakohortti (n=2027) ja tutkimus 4 oli FIT:n neljän vuoden kliininen murtumakohortti (n=4432). Kaiken kaikkiaan 3 620 potilasta altistui lumelääkkeelle ja 3 432 potilaalle FOSAMAXille. Näihin kliinisiin tutkimuksiin otettiin mukaan potilaat, joilla oli aiemmin ollut maha-suolikanavan sairaus ja jotka käyttivät samanaikaisesti ei-steroidisia tulehduskipulääkkeitä. Tutkimuksissa 1 ja 2 kaikki naiset saivat 500 mg alkuainekalsiumia karbonaattina. Tutkimuksissa 3 ja 4 kaikki naiset, joiden kalsiumin saanti oli alle 1000 mg päivässä, saivat 500 mg kalsiumia ja 250 kansainvälistä yksikköä D-vitamiinia päivässä.
Potilaiden joukossa, joita hoidettiin alendronaatilla 10 mg tai lumelääkettä tutkimuksissa 1 ja 2 sekä kaikista potilaista tutkimuksessa 3 ja 4, kaikista syistä johtuvan kuolleisuuden ilmaantuvuus oli 1,8 % lumeryhmässä ja 1,8 % FOSAMAX 35 mg -ryhmässä. Vakavien haittavaikutusten ilmaantuvuus oli 30,7 % lumelääkeryhmässä ja 30,9 % FOSAMAX-ryhmässä. Niiden potilaiden prosenttiosuus, jotka keskeyttivät tutkimuksen minkä tahansa kliinisen haittatapahtuman vuoksi, oli 9,5 % lumelääkeryhmässä ja 8,9 % FOSAMAX 70 mg -ryhmässä. Näistä tutkimuksista saadut haittavaikutukset, joita tutkijat pitivät mahdollisesti, todennäköisinä tai ehdottomasti lääkkeisiin liittyvinä vähintään 1 %:lla joko FOSAMAX 35 mg:lla tai lumelääkettä saaneista potilaista, on esitetty taulukossa 1.
Ihottumaa ja punoitusta on esiintynyt.
Ruoansulatuskanavan haittavaikutukset
Yhdelle FOSAMAXilla (10 mg/vrk) hoidetulle potilaalle, jolla oli aiemmin ollut peptinen haavatauti ja mahalaukun poisto ja joka käytti samanaikaisesti aspiriinia, kehittyi anastomoottinen haava, johon liittyi lievä verenvuoto, jonka katsottiin liittyvän lääkkeeseen. Aspiriinin ja FOSAMAXin käyttö lopetettiin ja potilas toipui. Tutkimuksen 1 ja tutkimuksen 2 populaatioissa 49-54 %:lla oli ollut maha-suolikanavan häiriöitä lähtötilanteessa ja 54-89 % käytti ei-steroidisia tulehduskipulääkkeitä tai aspiriinia jossain vaiheessa tutkimusten aikana. [Katso VAROITUKSET JA VAROTOIMET ]
Laboratoriokokeiden tulokset
Kaksoissokkoutetuissa monikeskustutkimuksissa seerumin kalsium- ja fosfaattipitoisuuksien oireetonta, lievää ja ohimenevää laskua havaittiin noin 18 %:lla ja 10 %:lla FOSAMAXia saaneista potilaista verrattuna noin 12 %:lla ja 3 %:lla lumelääkettä saaneista potilaista. Kuitenkin seerumin kalsiumpitoisuuden aleneminen alle 8,0 mg/dl:aan (2,0 mM) ja seerumin fosfaatin aleneminen alle tai 2,0 mg/dl:aan (0,65 mM) oli samanlainen molemmissa hoitoryhmissä.
Viikoittainen annostus
FOSAMAXin 70 mg kerran viikossa annoksen turvallisuutta postmenopausaalisen osteoporoosin hoidossa arvioitiin vuoden kestäneessä kaksoissokkoutetussa monikeskustutkimuksessa, jossa verrattiin FOSAMAXia 70 mg kerran viikossa ja FOSAMAXia 10 mg päivässä. Kerran viikossa annettujen FOSAMAX 70 mg:n ja FOSAMAX 10 mg vuorokausiannosten yleiset turvallisuus- ja siedettävyysprofiilit olivat samanlaiset. Taulukossa 2 on esitetty haittavaikutukset, jotka tutkijat pitävät mahdollisesti, todennäköisinä tai ehdottomasti lääkkeisiin liittyvinä vähintään 1 %:lla kummankin hoitoryhmän potilaista.
Osteoporoosin ehkäisy postmenopausaalisilla naisilla
Päivittäinen annostelu
FOSAMAXin 5 mg/vrk turvallisuutta postmenopausaalisilla 40–60-vuotiailla naisilla on arvioitu kolmessa kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa, joihin osallistui yli 1 400 potilasta, jotka satunnaistettiin saamaan FOSAMAXia joko kahdeksi tai kolmeksi vuodeksi. Näissä tutkimuksissa FOSAMAXin 5 mg/vrk ja lumelääkkeen yleiset turvallisuusprofiilit olivat samanlaiset. Hoidon keskeyttäminen kliinisen haittatapahtuman vuoksi tapahtui 7,5 %:lla 642 potilaasta, joita hoidettiin FOSAMAXilla 5 mg/vrk, ja 5,7 %:lla 648 potilaasta, jotka saivat lumelääkettä.
Viikoittainen annostus
FOSAMAXin 35 mg kerran viikossa annoksen turvallisuutta verrattuna FOSAMAXin 5 mg:n vuorokausiannokseen arvioitiin vuoden mittaisessa kaksoissokkoutetussa monikeskustutkimuksessa, johon osallistui 723 potilasta. Kerran viikossa annettujen FOSAMAX 35 mg:n ja FOSAMAX 5 mg vuorokausiannosten yleiset turvallisuus- ja siedettävyysprofiilit olivat samanlaiset.
Näistä tutkimuksista saadut haittavaikutukset, jotka tutkijat pitivät mahdollisesti, todennäköisimmin tai varmasti lääkkeeseen liittyvinä vähintään 1 %:lla potilaista, jotka saivat joko kerran viikossa FOSAMAX 35 mg, FOSAMAX 5 mg/vrk tai lumelääkettä, on esitetty taulukossa 3. .
Samanaikainen käyttö estrogeeni-/hormonikorvaushoidon kanssa
Kahdessa tutkimuksessa (kesto yksi ja kaksi vuotta) postmenopausaalisilla osteoporoosia sairastavilla naisilla (yhteensä: n=853) FOSAMAXin 10 mg kerran vuorokaudessa ja estrogeenin ± progestiinin (n=354) yhdistelmähoidon turvallisuus- ja siedettävyysprofiili oli yhdenmukainen yksittäisten hoitojen kanssa.
Osteoporoosi miehillä
Kahdessa lumekontrolloidussa, kaksoissokkoutetussa, monikeskustutkimuksessa miehillä (kaksivuotinen tutkimus FOSAMAXilla 10 mg/vrk ja yhden vuoden tutkimus, jossa FOSAMAX 70 mg kerran viikossa) havaittiin hoidon keskeyttämisen määrä kliinisen haittavaikutuksen vuoksi. Tapahtumat olivat 2,7 % FOSAMAX 10 mg/vrk vs. 10,5 % lumelääkettä saaneilla ja 6,4 % kerran viikossa FOSAMAX 70 mg vs. 8,6 % lumelääkettä saaneilla. Taulukossa 4 on esitetty haittavaikutukset, jotka tutkijat pitävät mahdollisesti, todennäköisimmin tai ehdottomasti lääkkeeseen liittyvinä vähintään 2 %:lla FOSAMAX 70 mg:lla tai lumelääkettä saaneista potilaista.
Glukokortikoidien aiheuttama osteoporoosi
Kahdessa yhden vuoden lumekontrolloidussa, kaksoissokkoutetussa monikeskustutkimuksessa glukokortikoidihoitoa saavilla potilailla FOSAMAXin 5 ja 10 mg/vrk kokonaisturvallisuus- ja siedettävyysprofiilit olivat yleensä samanlaiset kuin lumelääkkeen. Taulukossa 5 on esitetty haittavaikutukset, jotka tutkijat pitävät mahdollisesti, todennäköisimmin tai varmasti lääkkeeseen liittyvinä vähintään 1 %:lla potilaista, joita on hoidettu joko FOSAMAX 5 tai 10 mg/vrk tai lumelääkettä saavilla potilailla.
Yleinen turvallisuus- ja siedettävyysprofiili glukokortikoidien aiheuttamassa osteoporoosipopulaatiossa, joka jatkoi hoitoa tutkimusten toisena vuonna (FOSAMAX: n=147), vastasi ensimmäisenä vuonna havaittua profiilia.
Pagetin luutauti
Kliinisissä tutkimuksissa (osteoporoosi ja Pagetin tauti) 175 potilaalla, jotka ottivat FOSAMAXia 40 mg/vrk 3–12 kuukauden ajan, raportoitiin samanlaisia haittavaikutuksia kuin postmenopausaalisilla naisilla, joita hoidettiin FOSAMAXilla 10 mg/vrk. Ylempien maha-suolikanavan haittavaikutusten ilmaantuvuus oli kuitenkin ilmeisesti lisääntynyt potilailla, jotka käyttivät FOSAMAXia 40 mg/vrk (17,7 % FOSAMAX vs. 10,2 % lumelääke). Yksi ruokatorvitulehdus ja kaksi gastriittitapausta johtivat hoidon keskeyttämiseen.
Lisäksi tuki- ja liikuntaelimistön (luu-, lihas- tai nivel-) kipua, jota on kuvattu muilla bisfosfonaateilla hoidetuilla Pagetin tautia sairastavilla potilailla, tutkijat pitivät mahdollisesti, todennäköisesti tai varmasti lääkkeisiin liittyvänä noin 6 %:lla potilaista. FOSAMAXilla 40 mg/vrk verrattuna noin 1 %:iin lumelääkettä saaneista potilaista, mutta harvoin johtivat hoidon keskeyttämiseen. Hoito keskeytettiin kliinisten haittavaikutusten vuoksi 6,4 %:lla Pagetin tautia sairastavista potilaista, joita hoidettiin FOSAMAXilla 40 mg/vrk, ja 2,4 %:lla potilaista, jotka saivat lumelääkettä.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu FOSAMAXin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Keho kokonaisuutena: yliherkkyysreaktiot, mukaan lukien urtikaria ja angioedeema. FOSAMAXin käytön yhteydessä on raportoitu ohimeneviä myalgiaa, huonovointisuutta, voimattomuutta ja kuumetta, tyypillisesti hoidon aloittamisen yhteydessä. Oireista hypokalsemiaa on esiintynyt yleensä altistavien tilojen yhteydessä. Perifeerinen turvotus.
Ruoansulatuskanava: ruokatorven tulehdus, ruokatorven eroosiot, ruokatorven haavaumat, ruokatorven ahtauma tai perforaatio ja suunielun haavaumat. Myös maha- tai pohjukaissuolihaavoja, joista osa on vakavia ja joihin liittyy komplikaatioita, on raportoitu [ks ANNOSTELU JA HALLINNOINTI ; VAROITUKSET JA VAROTOIMET ].
Paikallista leuan osteonekroosia, joka liittyy yleensä hampaan poistoon ja/tai paikalliseen infektioon, johon liittyy viivästynyt paraneminen, on raportoitu [ks. VAROITUKSET JA VAROTOIMET ].
Tuki- ja liikuntaelimistö: luu-, nivel- ja/tai lihaskipu, toisinaan vaikea ja toimintakyvytön [ks VAROITUKSET JA VAROTOIMET ]; nivelten turvotus; matalaenergiaiset reisiluun varsi ja subtrokanteeriset murtumat [katso VAROITUKSET JA VAROTOIMET ].
Hermosto: huimaus ja huimaus.
Keuhko: akuutteja astman pahenemisvaiheita.
Iho: ihottuma (ajoittain valoherkkyys), kutina, hiustenlähtö, vakavat ihoreaktiot, mukaan lukien Stevens-Johnsonin oireyhtymä ja toksinen epidermaalinen nekrolyysi.
Erityiset aistit: uveiitti, skleriitti tai episkleriitti. Ulkoisen kuulokäytävän kolesteatomi (fokusaalinen osteonekroosi).
HUUMEIDEN VUOROVAIKUTUKSET
Kalsiumlisät / antasidit
FOSAMAXin ja kalsiumin, antasidien tai suun kautta otettavien, moniarvoisia kationeja sisältävien lääkkeiden samanaikainen käyttö häiritsee FOSAMAXin imeytymistä. Tästä syystä kehota potilaita odottamaan vähintään puoli tuntia FOSAMAX 35 mg:n ottamisen jälkeen ennen muiden suun kautta otettavien lääkkeiden ottamista.
Aspiriini
Kliinisissä tutkimuksissa ylemmän maha-suolikanavan haittavaikutusten ilmaantuvuus lisääntyi potilailla, jotka saivat samanaikaisesti yli 10 mg:n FOSAMAXin 35 mg:n päiväannoksia ja aspiriinia sisältäviä tuotteita.
Ei-steroidiset tulehduskipulääkkeet
FOSAMAX 35 mg voidaan antaa potilaille, jotka käyttävät ei-steroidisia tulehduskipulääkkeitä (NSAID). Kolme vuotta kestäneessä kontrolloidussa kliinisessä tutkimuksessa (n = 2027), jonka aikana suurin osa potilaista sai samanaikaisesti tulehduskipulääkkeitä, ylemmän maha-suolikanavan haittavaikutusten ilmaantuvuus oli samanlainen potilailla, jotka saivat FOSAMAXia 5 tai 10 mg/vrk verrattuna lumelääkettä saaneisiin potilaisiin. Koska tulehduskipulääkkeiden käyttöön kuitenkin liittyy maha-suolikanavan ärsytystä, varovaisuutta tulee noudattaa käytettäessä samanaikaisesti FOSAMAXia.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Ruoansulatuskanavan yläosan haittavaikutukset
FOSAMAX 35 mg, kuten muutkin suun kautta annetut bisfosfonaatit, voi aiheuttaa paikallista ärsytystä maha-suolikanavan yläosassa. Näiden mahdollisten ärsyttävien vaikutusten ja perussairauden mahdollisen pahenemisen vuoksi on noudatettava varovaisuutta, kun FOSAMAXia annetaan potilaille, joilla on aktiivisia ylemmän maha-suolikanavan ongelmia (kuten tunnettu Barrettin ruokatorvi, dysfagia, muut ruokatorven sairaudet, gastriitti, duodeniitti tai haavaumat).
Ruokatorven haittavaikutuksia, kuten ruokatorven tulehdusta, ruokatorven haavaumia ja ruokatorven eroosioita, joihin on joskus liittynyt verenvuotoa ja harvoin ruokatorven ahtaumaa tai perforaatiota, on raportoitu potilailla, jotka ovat saaneet hoitoa oraalisilla bisfosfonaateilla, mukaan lukien FOSAMAX. Joissakin tapauksissa ne ovat olleet vakavia ja vaatineet sairaalahoitoa. Lääkäreiden tulee siksi olla varuillaan mahdollisista ruokatorven reaktioista kertovista merkeistä tai oireista, ja potilaita tulee neuvoa lopettamaan FOSAMAX 70 mg -valmisteen käyttö ja hakeutumaan lääkärin hoitoon, jos heille ilmaantuu dysfagiaa, odynofagiaa, rintalastan takaista kipua tai uutta tai pahenevaa närästystä.
Vakavien ruokatorven haittavaikutusten riski näyttää olevan suurempi potilailla, jotka asettuvat makuulle oraalisten bisfosfonaattien, mukaan lukien FOSAMAX 70 mg, ottamisen jälkeen ja/tai jotka eivät pysty nielemään oraalisia bisfosfonaatteja, mukaan lukien FOSAMAX 35 mg, suositellun täyden lasillisen (6-8 unssia) kanssa vettä, ja / tai jotka jatkavat oraalisten bisfosfonaattien, mukaan lukien FOSAMAX 70 mg, ottamista sen jälkeen, kun heille on kehittynyt ruokatorven ärsytykseen viittaavia oireita. Siksi on erittäin tärkeää, että potilaalle annetaan täydelliset annosteluohjeet ja että potilas ymmärtää ne [katso ANNOSTELU JA HALLINNOINTI ]. FOSAMAX-hoitoa tulee käyttää asianmukaisessa valvonnassa potilailla, jotka eivät voi noudattaa annostusohjeita mielenterveyden vamman vuoksi.
Markkinoille tulon jälkeen on raportoitu maha- ja pohjukaissuolihaavoja suun kautta otetun bisfosfonaatin käytön yhteydessä, joista osa on vakavia ja joihin liittyy komplikaatioita, vaikkakaan kontrolloiduissa kliinisissä tutkimuksissa ei havaittu lisääntynyttä riskiä [ks. HAITTAVAIKUTUKSET ].
Mineraaliaineenvaihdunta
Hypokalsemia on korjattava ennen FOSAMAX-hoidon aloittamista [katso VASTA-AIHEET ]. Myös muut kivennäisaineenvaihduntahäiriöt (kuten D-vitamiinin puutos) tulee hoitaa tehokkaasti. Potilailla, joilla on tällaisia sairauksia, seerumin kalsiumpitoisuutta ja hypokalsemian oireita on seurattava FOSAMAX-hoidon aikana.
Oletettavasti johtuen FOSAMAXin vaikutuksista luun mineraalipitoisuuteen, seerumin kalsium- ja fosfaattipitoisuuksissa saattaa esiintyä pieniä, oireettomia laskuja, erityisesti Pagetin tautia sairastavilla potilailla, joilla luun vaihtuvuus ennen hoitoa voi olla huomattavasti kohonnut. glukokortikoideja saavat potilaat, joilla kalsiumin imeytyminen saattaa heikentyä.
Kalsiumin ja D-vitamiinin riittävän saannin varmistaminen on erityisen tärkeää potilailla, joilla on Pagetin luutauti ja glukokortikoideja.
Tuki- ja liikuntaelimistön kipu
Markkinoille tulon jälkeisessä kokemuksessa on raportoitu vaikeaa ja satunnaisesti toimintakyvyttömyyttä aiheuttavaa luu-, nivel- ja/tai lihaskipua potilailla, jotka käyttävät osteoporoosin ehkäisyyn ja hoitoon hyväksyttyjä bisfosfonaatteja [ks. HAITTAVAIKUTUKSET ]. Tähän lääkeluokkaan kuuluu FOSAMAX (alendronaatti). Suurin osa potilaista oli postmenopausaalisia naisia. Aika oireiden alkamiseen vaihteli yhdestä päivästä useisiin kuukausiin lääkkeen aloittamisen jälkeen. Lopeta käyttö, jos ilmenee vakavia oireita. Useimmilla potilailla oireet helpottivat lopettamisen jälkeen. Jollakin alaryhmällä oireet uusiutuivat, kun ne altistettiin uudelleen samalla lääkkeellä tai toisella bisfosfonaatilla.
Lumekontrolloiduissa FOSAMAXin kliinisissä tutkimuksissa näitä oireita sairastavien potilaiden prosenttiosuudet olivat samanlaiset FOSAMAX 35 mg:n ja lumelääkeryhmissä.
Leuan osteonekroosi
Leuan osteonekroosi (ONJ), joka voi ilmaantua spontaanisti, liittyy yleensä hampaan poistoon ja/tai paikalliseen infektioon, johon liittyy viivästynyt paraneminen, ja sitä on raportoitu potilailla, jotka käyttävät bisfosfonaatteja, mukaan lukien FOSAMAXia. Tunnettuja leuan osteonekroosin riskitekijöitä ovat invasiiviset hammastoimenpiteet (esim. hampaan poisto, hammasimplantaatti, luukirurgia), syövän diagnoosi, samanaikaiset hoidot (esim. kemoterapia, kortikosteroidit, angiogeneesin estäjät), huono suuhygienia ja muut sairaudet sairaudet (esim. parodontaali ja/tai muu olemassa oleva hammassairaus, anemia, koagulopatia, infektio, huonosti istuvat hammasproteesit). ONJ-riski voi kasvaa bisfosfonaateille altistumisen keston myötä.
Bisfosfonaattihoidon lopettaminen voi vähentää ONJ-riskiä potilailla, jotka tarvitsevat invasiivisia hammashoitoja. Hoitavan lääkärin ja/tai suukirurgin kliinisen arvioinnin tulee ohjata kunkin potilaan hoitosuunnitelmaa yksilöllisen hyöty/riskiarvioinnin perusteella.
Potilaiden, joille kehittyy leuan osteonekroosi bisfosfonaattihoidon aikana, tulee saada suukirurgin hoitoa. Näillä potilailla laaja hammaskirurgia ONJ:n hoitamiseksi voi pahentaa tilaa. Bisfosfonaattihoidon lopettamista tulee harkita yksilöllisen hyöty/riskiarvioinnin perusteella.
Epätyypilliset subtrokanteeriset ja diafyysiset reisiluun murtumat
Bisfosfonaatilla hoidetuilla potilailla on raportoitu epätyypillisiä, vähän energiaa vaativia tai vähän traumoja aiheuttavia reisiluun murtumia. Nämä murtumat voivat tapahtua missä tahansa reisiluun varressa, juuri alemman trochanter-leikkauksen alapuolelta suprakondylaarisen leikkauksen yläpuolelle, ja ne ovat poikittaissuuntaisia tai lyhyitä vinosuuntaisia ilman merkkejä murtumisesta. Syy-yhteyttä ei ole varmistettu, koska näitä murtumia esiintyy myös osteoporoottisilla potilailla, joita ei ole hoidettu bisfosfonaateilla.
Epätyypilliset reisiluun murtumat ilmenevät useimmiten niin, että vaurioituneen alueen trauma on vähäinen tai ei ollenkaan. Ne voivat olla molemminpuolisia, ja monet potilaat raportoivat prodromaalista kipua vaurioituneella alueella, joka ilmenee yleensä tylsänä, kipeänä reisikipuna viikkoja tai kuukausia ennen täydellistä murtumaa. Useissa raporteissa todetaan, että potilaat saivat myös glukokortikoidihoitoa (esim. prednisoni) murtuman aikaan.
Jokaisella potilaalla, jolla on aiemmin ollut bisfosfonaateille altistus ja jolla on kipua reisissä tai nivusissa, tulee epäillä epätyypillistä murtumaa, ja heidät tulee arvioida epätäydellisen reisiluun murtuman sulkemiseksi pois. Potilailta, joilla on epätyypillinen murtuma, tulee myös arvioida vastapuolen raajan murtuman oireet ja merkit. Bisfosfonaattihoidon keskeyttämistä tulee harkita yksilöllisesti, kunnes riski/hyötyarvio on tehty.
Munuaisten vajaatoiminta
FOSAMAX 35 mg:aa ei suositella potilaille, joiden kreatiniinipuhdistuma on alle 35 ml/min.
Glukokortikoidien aiheuttama osteoporoosi
FOSAMAXin riski-hyötysuhdetta hoidettaessa glukokortikoidien päivittäisillä annoksilla alle 7,5 mg prednisonia tai vastaavaa ei ole varmistettu [ks. KÄYTTÖAIHEET JA KÄYTTÖ ]. Ennen hoidon aloittamista sekä miesten että naisten sukurauhasten hormonaalinen tila tulee varmistaa ja harkita asianmukaista korvaamista.
Luun mineraalitiheys tulee mitata hoidon alussa ja toistaa 6–12 kuukauden FOSAMAX- ja glukokortikoidiyhdistelmähoidon jälkeen.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ).
Neuvo potilaita lukemaan lääkitysopas ennen FOSAMAX-hoidon aloittamista ja lukemaan se uudelleen aina, kun resepti uusitaan.
Osteoporoosisuositukset, mukaan lukien kalsium- ja D-vitamiinilisä
Neuvo potilaita ottamaan lisäkalsiumia ja D-vitamiinia, jos päivittäinen ruokavalion saanti on riittämätön. Painoa kantavaa liikuntaa tulee harkita yhdessä tiettyjen käyttäytymistekijöiden, kuten tupakoinnin ja/tai liiallisen alkoholinkäytön, muuttamisen kanssa, jos näitä tekijöitä on.
Annosteluohjeet
Kerro potilaille, että FOSAMAX 70 mg:n odotetut hyödyt voidaan saavuttaa vain, kun se otetaan pelkän veden kanssa ensimmäisenä noustessa päivän aikana vähintään 30 minuuttia ennen päivän ensimmäistä ruokaa, juomaa tai lääkettä. Jopa appelsiinimehun tai kahvin antamisen on osoitettu vähentävän huomattavasti FOSAMAXin imeytymistä [ks. KLIININEN FARMAKOLOGIA ].
Neuvo potilaita olemaan pureskelematta tai imeskelemättä tablettia suunielun haavaumien mahdollisuuden vuoksi.
Neuvo potilaita nielemään jokainen FOSAMAX-tabletti täyden vesilasillisen (6-8 unssia) kera, mikä helpottaa sen kulkua mahalaukkuun ja vähentää siten ruokatorven ärsytyksen mahdollisuutta. Neuvo potilaita juomaan vähintään 2 unssia (neljännes kupillista) vettä FOSAMAX 70 mg oraaliliuoksen ottamisen jälkeen mahalaukun tyhjenemisen helpottamiseksi.
Pyydä potilaita olemaan makuulla vähintään 30 minuuttia ja ennen päivän ensimmäisen aterian jälkeen.
Pyydä potilaita olemaan ottamatta FOSAMAXia ennen nukkumaanmenoa tai ennen päivän nousua. Potilaille tulee kertoa, että näiden ohjeiden noudattamatta jättäminen voi lisätä heidän ruokatorviongelmien riskiä.
Neuvo potilaita lopettamaan FOSAMAXin käyttö ja kääntymään lääkärin puoleen, jos heille ilmaantuu ruokatorven sairauden oireita (kuten nielemisvaikeuksia tai kipua, rintalastan takaista kipua tai uutta tai pahenevaa närästystä).
Jos potilas unohtaa ottaa kerran viikossa 70 mg:n FOSAMAX-annoksen, kehota potilasta ottamaan yksi annos seuraavana aamuna, kun he muistavat. Heidän ei tule ottaa kahta annosta samana päivänä, vaan heidän on palattava ottamaan yksi annos kerran viikossa, kuten alun perin oli suunniteltu heidän valitsemanaan päivänä.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Harderian rauhanen (retro-orbitaalinen rauhanen, jota ei esiinny ihmisillä) adenoomat lisääntyivät suuriannoksilla saaneilla naarashiirillä (p=0,003) 92 viikkoa kestäneessä karsinogeenisuustutkimuksessa alendronaattiannoksilla 1, 3 ja 10 mg/kg/kg. vuorokaudessa (urokset) tai 1, 2 ja 5 mg/kg/vrk (naaraat). Nämä annokset vastaavat noin 0,1-1 kertaa suurinta suositeltua kliinistä vuorokausiannosta 40 mg pinta-alasta, mg/m². Tämän löydön merkitystä ihmisille ei tunneta.
Parafollikulaaristen solujen (kilpirauhasen) adenoomat lisääntyivät suuria annoksia saaneilla urosrotilla (p=0,003) 2 vuotta kestäneessä oraalisessa karsinogeenisuustutkimuksessa annoksilla 1 ja 3,75 mg/kg. Nämä annokset vastaavat noin 0,3 ja 1 kertaa kliinistä 40 mg:n vuorokausiannosta pinta-alan, mg/m² perusteella. Tämän löydön merkitystä ihmisille ei tunneta.
Alendronaatti ei ollut genotoksinen in vitro mikrobimutageneesimäärityksessä metabolisen aktivaation kanssa ja ilman sitä, in vitro nisäkässolumutageneesimäärityksessä, in vitro emäksisessä eluutiomäärityksessä rotan hepatosyyteillä eikä in vivo kromosomipoikkeavuusmäärityksessä hiirillä. Kiinanhamsterin munasarjasoluilla tehdyssä in vitro kromosomipoikkeavuusmäärityksessä alendronaatti antoi kuitenkin epäselviä tuloksia.
Alendronaatilla ei ollut vaikutusta hedelmällisyyteen (uros- tai naarasrotilla) oraalisilla annoksilla 5 mg/kg/vrk asti (noin 1 kertaa kliininen 40 mg:n vuorokausiannos pinta-alan perusteella, mg/m²).
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Saatavilla olevat tiedot FOSAMAXin käytöstä raskaana oleville naisille eivät riitä kertomaan lääkkeeseen liittyvästä haitallisista äidille tai sikiölle aiheutuvista riskeistä. Lopeta FOSAMAX 35 mg:n käyttö, kun raskaus havaitaan.
Eläinten lisääntymistutkimuksissa alendronaatin päivittäinen oraalinen antaminen rotille ennen parittelua tiineyden tai laktaation loppuun osoitti eloonjäämisen vähentymistä implantaation jälkeen ja poikasten painonnousun vähentymistä alkaen annoksilla, jotka vastasivat alle puolta suurimmasta suositellusta kliinisestä 40 mg:n päiväannoksesta. kehon pinta-alan perusteella, mg/m²). Alendronaatin oraalinen antaminen rotille organogeneesin aikana vähensi sikiön luutumista alkaen annoksilla, jotka olivat 3 kertaa suuremmat kuin kliininen 40 mg:n vuorokausiannos. Samanlaisia sikiövaikutuksia ei havaittu tiineillä kaneilla, jotka annettiin oraalisesti organogeneesin aikana annoksilla, jotka vastaavat noin 10 kertaa kliinistä 40 mg:n vuorokausiannosta.
Viivästynyttä tai epäonnistunutta jälkeläisten synnytystä, pitkittynyttä synnytystä ja emon hypokalsemiasta johtuvia raskauden myöhäisiä kuolemantapauksia esiintyi rotilla, kun suun kautta annettiin niinkin alhaisia annoksia kuin yksi kymmenesosa kliinisestä 40 mg:n vuorokausiannoksesta (ks. Data ).
Bisfosfonaatit liitetään luumatriisiin, josta ne vapautuvat vähitellen vuosien kuluessa. Aikuisen luuhun sitoutuneen ja systeemiseen verenkiertoon vapautuvan bisfosfonaatin määrä on suoraan verrannollinen bisfosfonaatin annokseen ja käytön kestoon. Näin ollen bisfosfonaattien vaikutusmekanismin perusteella on olemassa sikiövaurion, pääasiassa luuston, riski, jos nainen tulee raskaaksi bisfosfonaattihoitojakson päätyttyä. Muuttujien, kuten bisfosfonaattihoidon lopettamisen ja hedelmöittymisen välisen ajan, käytetyn tietyn bisfosfonaatin ja antoreitin (laskimonsisäinen vs. suun kautta) vaikutusta riskiin ei ole tutkittu.
Vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski ilmoitetulle väestölle ei ole tiedossa. Kaikilla raskauksilla on taustariski synnynnäisille epämuodostumille, menetyksille tai muille haitallisille seurauksille. Yhdysvalloissa yleisessä väestössä vakavien syntymävikojen ja keskenmenon taustariski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %.
Data
Eläinten tiedot
Rotilla tehdyt lisääntymistutkimukset, joille annosteltiin suun kautta ennen parittelua tiineyden tai laktaation loppuun, osoittivat eloonjäämisen vähentymistä implantaation jälkeisessä annoksessa 2 mg/kg/vrk alkaen ja painonnousun vähentymistä alkaen annoksella 1 mg/kg/vrk, annoksilla, jotka vastaavat alle puolta 40:stä mg kliininen vuorokausiannos kehon pinta-alan perusteella, mg/m². Epätäydellisen sikiön luutumisen ilmaantuvuus nikamien, kallon ja rintarangan luissa lisääntyi rotilla, jotka saivat oraalisesti organogeneesin aikana annoksella 10 mg/kg/vrk (noin 3 kertaa kliininen 40 mg:n vuorokausiannos). Samanlaisia sikiövaikutuksia ei havaittu tiineillä kaniineilla, jotka annettiin oraalisesti organogeneesin aikana enintään 35 mg/kg/vrk (vastaa noin 10 kertaa kliinistä 40 mg:n vuorokausiannosta).
Sekä kokonais- että ionisoitu kalsium vähenivät raskaana olevilla rotilla, joille annettiin suun kautta 15 mg/kg/vrk alendronaattia (noin 4 kertaa kliininen 40 mg:n päiväannos), mikä johti synnytyksen viivästymiseen ja epäonnistumiseen. Emon hypokalsemiasta johtuva pitkittynyt synnytys havaittiin, kun rottia hoidettiin ennen parittelua tiineyden aikana alkaen annoksella 0,5 mg/kg/vrk (noin kymmenesosa kliinisestä 40 mg:n vuorokausiannoksesta). Maternotoksisuutta (myöhäisiä raskauden kuolemia) esiintyi myös naarasrotilla, joita hoidettiin suun kautta annoksella 15 mg/kg/vrk (noin 4 kertaa kliininen 40 mg:n vuorokausiannos) vaihtelevien raskausajanjaksojen ajan. Nämä äitiyskuolemat vähenivät, mutta eivät poistuneet hoidon lopettamisesta. Kalsiumlisä juomavedessä tai ihonalaisella minipumpulla rotille, joille annosteltiin suun kautta 15 mg/kg/vrk alendronaattia, ei voinut parantaa hypokalsemiaa tai estää dystociaan liittyviä emojen ja vastasyntyneiden kuolemia. Suonensisäinen kalsiumlisä esti kuitenkin äitien, mutta ei vastasyntyneiden kuoleman.
Imetys
Riskien yhteenveto
Ei tiedetä, erittyykö alendronaattia ihmisen rintamaitoon, vaikuttaako se äidinmaidon tuotantoon vai onko sillä vaikutuksia imetettävään lapseen. Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon, äidin kliininen FOSAMAX 70 mg:n tarve ja FOSAMAXin mahdolliset haitalliset vaikutukset imetettävään lapseen tai äidin taustalla oleva tila.
Käyttö lapsille
FOSAMAX 70 mg ei ole tarkoitettu käytettäväksi lapsipotilailla.
FOSAMAXin turvallisuutta ja tehoa tutkittiin satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa kaksivuotisessa tutkimuksessa, johon osallistui 139 iältään 4–18-vuotiasta lapsipotilasta, joilla oli vaikea osteogenesis imperfecta (OI). Satayhdeksän potilasta satunnaistettiin saamaan 5 mg FOSAMAXia 35 mg päivässä (paino alle 40 kg) tai 10 mg FOSAMAXia 70 mg päivässä (paino suurempi tai yhtä suuri kuin 40 kg) ja 30 potilasta lumelääkkeeseen. Potilaiden keskimääräinen lähtötason lannerangan BMD Z-pistemäärä oli -4,5. Keskimääräinen muutos lannerangan BMD:n Z-pisteessä lähtötasosta 24. kuukauteen oli 1,3 FOSAMAXilla 35 mg hoidetuilla potilailla ja 0,1 lumelääkettä saaneilla potilailla. Hoito FOSAMAX 35 mg:lla ei vähentänyt murtumariskiä. Kuusitoista prosentilla FOSAMAX-potilaista, joilla oli radiologisesti varmistettu murtuma tutkimuksen 12. kuukauteen mennessä, oli viivästynyt murtumien paraneminen (kallusin uudelleenmuodostaminen) tai murtuman yhtymättömyys arvioituna radiografisesti 24. kuukaudessa verrattuna 9 prosenttiin lumelääkettä saaneista potilaista. FOSAMAXilla hoidetuilla potilailla 24. kuukaudella saadut luun histomorfometriatiedot osoittivat luun vaihtuvuuden vähenemistä ja mineralisaatioajan viivästymistä; Mineralisaatiovirheitä ei kuitenkaan ollut. FOSAMAX 35 mg:n ja lumelääkeryhmän välillä ei ollut tilastollisesti merkitseviä eroja luukivun vähentämisessä. Oraalinen hyötyosuus lapsilla oli samanlainen kuin aikuisilla.
FOSAMAXin yleinen turvallisuusprofiili osteogenesis imperfecta -potilailla, joita hoidettiin enintään 24 kuukautta, oli yleensä samanlainen kuin FOSAMAXilla hoidetuilla osteoporoosia sairastavilla aikuisilla. FOSAMAXilla hoidetuilla osteogenesis imperfecta -potilailla oksentelua esiintyi kuitenkin enemmän kuin lumelääkettä saaneilla. 24 kuukauden hoitojakson aikana oksentelua havaittiin 32:lla 109:stä (29,4 %) FOSAMAX 70 mg:lla hoidetusta potilaasta ja 3:lla 30:stä (10 %) lumelääkettä saaneesta potilaasta.
Farmakokineettisessä tutkimuksessa 6 24 osteogenesis imperfecta -lapsipotilaasta, jotka saivat kerta-annoksen FOSAMAXia 35 tai 70 mg:n suun kautta, sai kuumetta, flunssan kaltaisia oireita ja/tai lievää lymfosytopeniaa 24–48 tunnin kuluessa annon jälkeen. Nämä tapahtumat, jotka kestävät korkeintaan 2–3 päivää ja reagoivat asetaminofeenille, vastaavat akuutin vaiheen vastetta, joka on raportoitu potilailla, jotka saavat bisfosfonaatteja, mukaan lukien FOSAMAXia. [Katso HAITTAVAIKUTUKSET ]
Geriatrinen käyttö
71 % (n = 2 302) potilaista, jotka saivat FOSAMAXia Fracture Intervention Trial (FIT) -tutkimuksessa, oli vähintään 65-vuotiaita ja 17 % (n = 550) oli vähintään 75-vuotiaita. Potilaista, jotka saivat FOSAMAX 70 mg Yhdysvalloissa ja monikansallisia osteoporoosin hoitotutkimuksia naisilla, osteoporoositutkimuksia miehillä, glukokortikoidien aiheuttamaa osteoporoositutkimuksia ja Pagetin tautia koskevia tutkimuksia [ks. Kliiniset tutkimukset ], 45 %, 54 %, 37 % ja 70 %, vastaavasti, olivat 65-vuotiaita tai vanhempia. Näiden potilaiden ja nuorempien potilaiden välillä ei havaittu yleisiä eroja tehossa tai turvallisuudessa, mutta joidenkin vanhempien henkilöiden suurempaa herkkyyttä ei voida sulkea pois.
Munuaisten vajaatoiminta
FOSAMAX 70 mg:aa ei suositella potilaille, joiden kreatiniinipuhdistuma on alle 35 ml/min. Annosta ei tarvitse muuttaa potilailla, joiden kreatiniinipuhdistuma on välillä 35-60 ml/min [ks. KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
Koska on näyttöä siitä, että alendronaatti ei metaboloidu tai erity sappeen, tutkimuksia ei ole tehty potilailla, joilla on maksan vajaatoiminta. Annoksen muuttaminen ei ole tarpeen [katso KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Merkittävää kuolleisuutta havaittiin naarasrotilla 552 mg/kg (3256 mg/m²) ja 966 mg/kg (2898 mg/m²) naarasrotilla oraalisten kerta-annosten jälkeen. Miehillä nämä arvot olivat hieman korkeammat, 626 ja 1280 mg/kg, vastaavasti. Koirilla ei havaittu kuolleisuutta oraalisilla annoksilla 200 mg/kg (4000 mg/m²) asti.
FOSAMAXin yliannostuksen hoidosta ei ole saatavilla erityistä tietoa. Hypokalsemia, hypofosfatemia ja ylemmän ruoansulatuskanavan haittatapahtumat, kuten vatsavaivoja, närästystä, esofagiittia, gastriittia tai haavaumaa, voivat johtua suun kautta otettavasta yliannostuksesta. Maitoa tai antasideja tulee antaa alendronaatin sitomiseksi. Ruokatorven ärsytysvaaran vuoksi potilaan on pysyttävä täysin pystyasennossa, eikä sitä saa oksentaa.
Dialyysistä ei olisi hyötyä.
VASTA-AIHEET
FOSAMAX 35 mg on vasta-aiheinen potilailla, joilla on seuraavat sairaudet:
- Ruokatorven poikkeavuudet, jotka hidastavat ruokatorven tyhjenemistä, kuten ahtauma tai akalasia [ks. VAROITUKSET JA VAROTOIMET ]
- Kyvyttömyys seistä tai istua pystyssä vähintään 30 minuuttia [katso ANNOSTELU JA HALLINNOINTI ; VAROITUKSET JA VAROTOIMET ]
- Älä anna FOSAMAX 35 mg oraaliliuosta potilaille, joilla on lisääntynyt aspiraatioriski.
- Hypokalsemia [katso VAROITUKSET JA VAROTOIMET ]
- Yliherkkyys jollekin tämän tuotteen komponentille. Yliherkkyysreaktioita, mukaan lukien urtikaria ja angioedeema, on raportoitu [ks HAITTAVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Eläintutkimukset ovat osoittaneet seuraavan toimintatavan. Solutasolla alendronaatti sijoittuu ensisijaisesti luun resorptiokohtiin, erityisesti osteoklastien alle. Osteoklastit kiinnittyvät normaalisti luun pintaan, mutta niiltä puuttuu ryppyinen reuna, joka viittaa aktiiviseen resorptioon. Alendronaatti ei häiritse osteoklastien kerääntymistä tai kiinnittymistä, mutta se estää osteoklastien toimintaa. Hiirillä tehdyt tutkimukset radioaktiivisen [3H]alendronaatin paikantamisesta luussa osoittivat noin 10 kertaa suuremman oton osteoklastien pinnoilla kuin osteoblastien pinnoilla. Luut, jotka tutkittiin 6 ja 49 päivää [3H]alendronaatin annon jälkeen rotilla ja hiirillä, osoittivat, että normaali luu muodostui alendronaatin päälle, joka oli sisällytetty matriisin sisään. Vaikka alendronaatti sisältyy luumatriisiin, se ei ole farmakologisesti aktiivinen. Siten alendronaattia on annettava jatkuvasti estämään osteoklastien muodostumista vasta muodostuneilla resorptiopinnoilla. Histomorfometria paviaaneissa ja rotissa osoitti, että alendronaattihoito vähentää luun kiertokulkua (eli niiden kohtien määrää, joissa luu uusiutuu). Lisäksi luun muodostuminen ylittää luun resorption näissä uudelleenmuotoilukohdissa, mikä johtaa progressiiviseen luumassan kasvuun.

Farmakodynamiikka
Alendronaatti on bisfosfonaatti, joka sitoutuu luun hydroksiapatiittiin ja estää spesifisesti osteoklastien, luuta resorboivien solujen, toimintaa. Alendronaatti vähentää luun resorptiota ilman suoraa vaikutusta luun muodostumiseen, vaikka jälkimmäinen prosessi lopulta vähenee, koska luun resorptio ja muodostuminen liittyvät toisiinsa luun vaihtuvuuden aikana.
Osteoporoosi postmenopausaalisilla naisilla
Osteoporoosille on ominaista alhainen luumassa, mikä lisää murtumariskiä. Diagnoosi voidaan vahvistaa löydöksellä alhainen luumassa, todisteet murtumasta röntgenkuvassa, aiempi osteoporoottinen murtuma tai pituuden lasku tai kyfoosi, jotka viittaavat nikamamurtumaan. Osteoporoosia esiintyy sekä miehillä että naisilla, mutta se on yleisin naisilla vaihdevuosien jälkeen, jolloin luun vaihtuvuus lisääntyy ja luun resorptionopeus ylittää luun muodostumisen. Nämä muutokset johtavat progressiiviseen luukadon ja johtavat osteoporoosiin merkittävällä osalla yli 50-vuotiaista naisista. Yleisimpiä seurauksia ovat selkärangan, lonkan ja ranteen murtumat. 50-90-vuotiaana valkoisten naisten lonkkamurtuman riski kasvaa 50-kertaiseksi ja nikamamurtuman riski 15-30-kertaiseksi. On arvioitu, että noin 40 % 50-vuotiaista naisista kärsii yhden tai useamman osteoporoosiin liittyvän selkärangan, lonkan tai ranteen murtuman jäljellä olevan elämänsä aikana. Erityisesti lonkkamurtumiin liittyy huomattavaa sairastuvuutta, vammaisuutta ja kuolleisuutta.
Päivittäiset oraaliset alendronaatin annokset (5, 20 ja 40 mg kuuden viikon ajan) postmenopausaalisilla naisilla aiheuttivat biokemiallisia muutoksia, jotka viittaavat annoksesta riippuvaiseen luun resorption estoon, mukaan lukien virtsan kalsiumin ja luun kollageenin hajoamisen merkkiaineiden (kuten deoksipyridinoliinin ja ristiin) tyypin I kollageenin kytketyt N-telopeptidit). Näillä biokemiallisilla muutoksilla oli taipumus palata lähtöarvoihin jo 3 viikon kuluttua alendronaattihoidon lopettamisesta, eivätkä ne eronneet lumelääkkeestä 7 kuukauden jälkeen.
Osteoporoosin pitkäaikainen hoito FOSAMAXilla 10 mg/vrk (enintään viisi vuotta) vähensi luun resorption merkkiaineiden, deoksipyridinoliinin ja silloittuneiden tyypin I kollageenin N-telopeptidien erittymistä virtsaan noin 50 % ja 70 %. , saavuttaakseen samanlaiset tasot kuin terveillä premenopausaalisilla naisilla. Samanlaisia laskuja havaittiin osteoporoosin ehkäisytutkimuksissa potilailla, jotka saivat FOSAMAXia 5 mg/vrk. Näiden merkkiaineiden osoittama luun resorption hidastuminen oli ilmeistä jo kuukauden kuluttua, ja 3–6 kuukauden kohdalla saavutettiin tasanne, joka säilyi koko FOSAMAX-hoidon ajan. Osteoporoosin hoitotutkimuksissa FOSAMAX 10 mg/vrk vähensi luun muodostumisen markkereita, osteokalsiinia ja luuspesifistä alkalista fosfataasia noin 50 % ja seerumin alkalisen fosfataasin kokonaisarvoa noin 25-30 % saavuttaen tasanne 6-12 kuukauden kuluttua. Osteoporoosin ehkäisytutkimuksissa FOSAMAX 5 mg/vrk alensi osteokalsiinia noin 40 % ja seerumin alkalisen fosfataasin kokonaisarvoa 15 %. Samanlainen luun vaihtuvuuden väheneminen havaittiin postmenopausaalisilla naisilla vuoden kestäneiden tutkimusten aikana, kun FOSAMAXia 70 mg kerran viikossa annettiin osteoporoosin hoitoon ja FOSAMAXia 35 mg kerran viikossa osteoporoosin ehkäisyyn. Nämä tiedot osoittavat, että luun vaihtumisnopeus saavutti uuden vakaan tilan huolimatta luuhun kertyneen alendronaatin kokonaismäärän asteittaisesta kasvusta.
Luun resorption eston seurauksena seerumin kalsium- ja fosfaattipitoisuuksien oireetonta laskua havaittiin myös FOSAMAX-hoidon jälkeen. Pitkäaikaisissa tutkimuksissa seerumin kalsiumpitoisuuden (noin 2 %) ja fosfaattipitoisuuden (noin 4–6 %) lasku lähtötasosta oli ilmeistä ensimmäisen kuukauden kuluttua FOSAMAX 10 mg -annoksen aloittamisesta. Seerumin kalsiumpitoisuuden laskua ei havaittu enää viiden vuoden hoidon aikana; seerumin fosfaatti palasi kuitenkin tutkimusta edeltäville tasoille vuosina 3–5. Samanlaisia vähennyksiä havaittiin käytettäessä FOSAMAXia 5 mg/vrk. Vuoden kestäneissä tutkimuksissa, joissa FOSAMAXia annettiin kerran viikossa 35 ja 70 mg, havaittiin samanlainen väheneminen 6 ja 12 kuukauden kohdalla. Seerumin fosfaattipitoisuuden väheneminen saattaa heijastaa FOSAMAX 70 mg:n aiheuttaman positiivisen luun mineraalitasapainon lisäksi myös munuaisten fosfaatin takaisinabsorption vähenemistä.
Osteoporoosi miehillä
Osteoporoosia sairastavien miesten hoito FOSAMAXilla 10 mg/vrk kahden vuoden ajan vähensi tyypin I kollageenin silloittuneiden N-telopeptidien erittymistä virtsaan noin 60 % ja luuspesifistä alkalista fosfataasia noin 40 %. Samanlaisia laskuja havaittiin yhden vuoden tutkimuksessa osteoporoosia sairastavilla miehillä, jotka saivat kerran viikossa 70 mg FOSAMAXia.
Glukokortikoidien aiheuttama osteoporoosi
Glukokortikoidien jatkuva käyttö liittyy yleisesti osteoporoosin kehittymiseen ja siitä aiheutuviin murtumiin (erityisesti nikama-, lonkka- ja kylkiluumurtumiin). Sitä esiintyy kaiken ikäisillä miehillä ja naisilla. Osteoporoosi johtuu luun muodostumisen estymisestä ja lisääntyneestä luun resorptiosta, mikä johtaa nettoluun häviämiseen. Alendronaatti vähentää luun resorptiota estämättä suoraan luun muodostumista.
Kliinisissä tutkimuksissa jopa kaksi vuotta' kesto, FOSAMAX 5 ja 10 mg/vrk vähensi tyypin I kollageenin (luun resorption merkkiaine) silloittuneita N-telopeptidejä noin 60 % ja luuspesifistä alkalista fosfataasia ja seerumin alkalista kokonaisfosfataasia (luunmuodostuksen merkkiaineet) noin 15-30 % ja vastaavasti 8-18 %. Luun resorption eston seurauksena FOSAMAX 5 ja 10 mg/vrk aiheutti oireettoman seerumin kalsiumpitoisuuden (noin 1-2 %) ja seerumin fosfaattipitoisuuden (noin 1-8 %) laskun.
Pagetin luutauti
Pagetin luusairaus on krooninen, fokaalinen luuston sairaus, jolle on tunnusomaista huomattavasti lisääntynyt ja häiriötön luun uusiutuminen. Liiallista osteoklastista luun resorptiota seuraa osteoblastinen uuden luun muodostuminen, mikä johtaa normaalin luun arkkitehtuurin korvautumiseen epäorganisoituneella, laajentuneella ja heikentyneellä luurakenteella.
Pagetin taudin kliiniset ilmenemismuodot vaihtelevat oireettomuudesta vakavaan sairastumiseen, joka johtuu luukivusta, luun epämuodostumista, patologisista murtumista sekä neurologisista ja muista komplikaatioista. Seerumin alkalinen fosfataasi, yleisimmin käytetty sairauden aktiivisuuden biokemiallinen indeksi, tarjoaa objektiivisen mittauksen sairauden vaikeudesta ja hoitovasteesta.
FOSAMAX 70 mg hidastaa luun resorption nopeutta suoraan, mikä johtaa epäsuoraan luunmuodostuksen vähenemiseen. Kliinisissä tutkimuksissa FOSAMAX 40 mg kerran vuorokaudessa kuuden kuukauden ajan aiheutti merkittävän seerumin alkalisen fosfataasin sekä luun kollageenin hajoamisen merkkiaineiden laskun virtsassa. Luun resorption eston seurauksena FOSAMAX aiheutti yleensä lievää, ohimenevää ja oireetonta seerumin kalsium- ja fosfaattipitoisuuden laskua.
Farmakokinetiikka
Imeytyminen
Verrattuna suonensisäiseen vertailuannokseen alendronaatin keskimääräinen oraalinen hyötyosuus naisilla oli 0,64 % 5–70 mg:n annoksilla, kun se annettiin yön yli paaston jälkeen ja kaksi tuntia ennen standardoitua aamiaista. Oraalisen 10 mg:n tabletin biologinen hyötyosuus miehillä (0,59 %) oli samanlainen kuin naisilla, kun ne annettiin yön yli paaston jälkeen ja 2 tuntia ennen aamiaista.
FOSAMAX 70 mg oraaliliuos ja FOSAMAX 70 mg tabletti ovat yhtä biosaatavia.
Tutkimus, jossa tutkittiin aterian ajoituksen vaikutusta alendronaatin hyötyosuuteen, suoritettiin 49 postmenopausaalisella naisella. Biologinen hyötyosuus pieneni (noin 40 %), kun 10 mg alendronaattia annettiin joko 0,5 tai 1 tunti ennen standardoitua aamiaista verrattuna annokseen 2 tuntia ennen ateriaa. Osteoporoosin hoitoa ja ehkäisyä koskevissa tutkimuksissa alendronaatti oli tehokas, kun se annettiin vähintään 30 minuuttia ennen aamiaista.
Biologinen hyötyosuus oli mitätön riippumatta siitä, annettiinko alendronaattia standardoidun aamiaisen yhteydessä tai enintään kaksi tuntia sen jälkeen. Alendronaatin samanaikainen käyttö kahvin tai appelsiinimehun kanssa pienensi biologista hyötyosuutta noin 60 %.
Jakelu
Prekliiniset tutkimukset (urosrotilla) osoittavat, että alendronaatti jakautuu ohimenevästi pehmytkudoksiin laskimonsisäisen annoksen 1 mg/kg jälkeen, mutta jakautuu sitten nopeasti uudelleen luuhun tai erittyy virtsaan. Keskimääräinen vakaan tilan jakautumistilavuus, luuta lukuun ottamatta, on ihmisillä vähintään 28 l. Lääkeainepitoisuudet plasmassa terapeuttisten oraalisten annosten jälkeen ovat liian pieniä (alle 5 ng/ml) analyyttiseen havaitsemiseen. Ihmisen plasman proteiineihin sitoutuminen on noin 78 %.
Aineenvaihdunta
Ei ole näyttöä siitä, että alendronaatti metaboloituisi eläimissä tai ihmisissä.
Erittyminen
Yhden suonensisäisen [14C]alendronaatin annoksen jälkeen noin 50 % radioaktiivisuudesta erittyi virtsaan 72 tunnin kuluessa ja radioaktiivisuutta havaittiin vain vähän tai ei ollenkaan ulosteissa. Yhden 10 mg:n laskimonsisäisen annoksen jälkeen alendronaatin munuaispuhdistuma oli 71 ml/min (64, 78; 90 %:n luottamusväli [CI]), eikä systeeminen puhdistuma ylittänyt arvoa 200 ml/min. Plasman pitoisuudet laskivat yli 95 % 6 tunnin sisällä suonensisäisen annon jälkeen. Terminaalisen puoliintumisajan ihmisillä arvioidaan olevan yli 10 vuotta, mikä todennäköisesti heijastaa alendronaatin vapautumista luurangosta. Edellä esitetyn perusteella on arvioitu, että 10 vuoden suun kautta annetun FOSAMAX-hoidon jälkeen (10 mg vuorokaudessa) päivittäin luurangosta vapautuvan alendronaatin määrä on noin 25 % ruuansulatuskanavasta imeytyneestä määrästä.
Tietyt populaatiot
Sukupuoli
Biologinen hyötyosuus ja suonensisäisen annoksen virtsaan erittyvä osuus olivat samanlaiset miehillä ja naisilla.
Geriatric
Biologinen hyötyosuus ja jakautuminen (eritys virtsaan) olivat samanlaiset vanhuksilla ja nuoremmilla potilailla. Annosta ei tarvitse muuttaa iäkkäillä potilailla.
Rotu
Rotuun johtuvia farmakokineettisiä eroja ei ole tutkittu.
Munuaisten vajaatoiminta
Prekliiniset tutkimukset osoittavat, että rotilla, joilla on munuaisten vajaatoiminta, plasmassa, munuaisissa, pernassa ja sääriluussa on yhä suurempia määriä lääkettä. Terveillä kontrolleilla lääke, joka ei kerrostu luuhun, erittyy nopeasti virtsaan. Näyttöä luun imeytymisen kyllästymisestä ei havaittu 3 viikon kumulatiivisen laskimonsisäisen annoksen 35 mg/kg jälkeen nuorilla urosrotilla. Vaikka muodollisia munuaisten vajaatoiminnan farmakokineettisiä tutkimuksia ei ole tehty potilailla, on todennäköistä, että kuten eläimillä, alendronaatin eliminaatio munuaisten kautta vähenee potilailla, joilla on heikentynyt munuaisten toiminta. Siksi alendronaatin jonkin verran suurempaa kertymistä luuhun saattaa olla odotettavissa potilailla, joilla on munuaisten vajaatoiminta.
Annosta ei tarvitse muuttaa potilailla, joiden kreatiniinipuhdistuma on 35–60 ml/min. FOSAMAX 35 mg:aa ei suositella potilaille, joiden kreatiniinipuhdistuma on alle 35 ml/min, koska alendronaatista ei ole kokemusta munuaisten vajaatoiminnan hoidossa.
Maksan vajaatoiminta
Koska on näyttöä siitä, että alendronaatti ei metaboloidu tai erity sappeen, tutkimuksia ei ole tehty potilailla, joilla on maksan vajaatoiminta. Annoksen säätäminen ei ole tarpeen.
Huumeiden vuorovaikutukset
Laskimonsisäisen ranitidiinin osoitettiin kaksinkertaisen suun kautta otettavan alendronaatin biologisen hyötyosuuden. Tämän lisääntyneen biologisen hyötyosuuden kliinistä merkitystä ja sitä, tapahtuuko samanlaista nousua potilailla, jotka saavat suun kautta otettavia H2-antagonisteja, ei tiedetä.
Terveillä koehenkilöillä oraalinen prednisoni (20 mg kolme kertaa vuorokaudessa viiden päivän ajan) ei aiheuttanut kliinisesti merkittävää muutosta alendronaatin oraalisessa biologisessa hyötyosuudessa (keskimääräinen nousu vaihteli 20–44 %).
Kalsiumia ja muita moniarvoisia kationeja sisältävät tuotteet saattavat häiritä alendronaatin imeytymistä.
Eläinten toksikologia ja/tai farmakologia
Alendronaatin ja etidronaatin suhteellisia luun resorptiota ja mineralisaatiota estäviä aktiivisuuksia verrattiin Schenk-määrityksessä, joka perustuu kasvavien rottien epifyysien histologiseen tutkimukseen. Tässä määrityksessä pienin alendronaattiannos, joka häiritsi luun mineralisaatiota (johti osteomalasiaan), oli 6 000-kertainen antiresorptioon verrattuna. Vastaava etidronaatin suhde oli yksi: yksi. Nämä tiedot viittaavat siihen, että terapeuttisina annoksina annettu alendronaatti ei todennäköisesti aiheuta osteomalasiaa.
Kliiniset tutkimukset
Osteoporoosin hoito postmenopausaalisilla naisilla
Päivittäinen annostelu
FOSAMAXin tehoa 10 mg päivässä arvioitiin neljässä kliinisessä tutkimuksessa. Tutkimus 1, kolmivuotinen, monikeskus, kaksoissokkoutettu, lumekontrolloitu kliininen yhdysvaltalainen tutkimus, johon osallistui 478 potilasta, joiden BMD T-pistemäärä oli miinus 2,5 tai alle 2,5 ja joilla oli aikaisempi nikamamurtuma tai ei; Tutkimus 2, kolmivuotinen, monikeskus, kaksoissokkoutettu, lumekontrolloitu monikansallinen kliininen tutkimus, johon osallistui 516 potilasta, joiden BMD T-pisteet olivat miinus 2,5 tai alle 2,5 ja joilla oli aikaisempi nikamamurtuma tai ei; Study 3, Three-Year Study of the Fracture Intervention Trial (FIT) -tutkimus, johon otettiin mukaan 2027 postmenopausaalista potilasta, joilla oli vähintään yksi nikamamurtuma; ja Study 4, Four-Year Study of FIT: tutkimus, johon osallistui 4432 postmenopausaalista potilasta, joilla oli alhainen luumassa, mutta joilla ei ollut lähtötilanteessa nikamamurtumaa.
Vaikutus murtumien ilmaantuvuuteen
Arvioidakseen FOSAMAXin vaikutuksia nikamamurtumien ilmaantuvuuteen (havaittu digitoidulla radiografialla; noin kolmasosa näistä oli kliinisesti oireellisia), yhdysvaltalaiset ja monikansalliset tutkimukset yhdistettiin analyysissä, jossa verrattiin lumelääkettä yhdistettyihin FOSAMAX-annosryhmiin (5). tai 10 mg kolmen vuoden ajan tai 20 mg kahden vuoden ajan ja sen jälkeen 5 mg yhden vuoden ajan). FOSAMAX 70 mg:lla hoidettujen potilaiden osuus, joille tuli yksi tai useampi uusi nikamamurtuma, väheni tilastollisesti merkitsevästi lumelääkettä saaneisiin verrattuna (3,2 % vs. 6,2 %; suhteellinen riski pieneni 48 %). Myös uusien nikamamurtumien kokonaismäärän väheneminen (4,2 vs. 11,3/100 potilasta) havaittiin. Yhdistetyssä analyysissä FOSAMAXia saaneiden potilaiden pituuden lasku oli tilastollisesti merkitsevästi pienempi kuin lumelääkettä saaneiden potilaiden (-3,0 mm vs. -4,6 mm).
Fracture Intervention Trial (FIT) koostui kahdesta tutkimuksesta postmenopausaalisilla naisilla: kolmen vuoden tutkimuksesta potilailla, joilla oli lähtötilanteessa vähintään yksi radiografinen nikamamurtuma, ja neljän vuoden tutkimuksesta potilailla, joilla oli alhainen luumassa, mutta joilla ei ollut lähtötilanteessa nikamamurtuma. Molemmissa FIT-tutkimuksissa 96 % satunnaistetuista potilaista suoritti tutkimukset (eli heillä oli loppukäynti tutkimuksen suunnitellussa lopussa); noin 80 % potilaista käytti edelleen tutkimuslääkitystä valmistumisen jälkeen.
Murtumien interventiokoe: Kolmen vuoden tutkimus (potilaat, joilla on vähintään yksi radiografinen nikamamurtuma)
Tämä satunnaistettu, kaksoissokkoutettu, lumekontrolloitu, 2027 potilaan tutkimus (FOSAMAX 70 mg, n = 1022; lumelääke, n = 1005) osoitti, että FOSAMAX-hoito johti tilastollisesti merkitsevään murtumien ilmaantuvuuden vähenemiseen kolmen vuoden kuluttua taulukon 6 mukaisesti. .
Lisäksi tässä potilaiden populaatiossa, joilla oli lähtötilanteessa nikamamurtuma, FOSAMAX-hoito vähensi merkittävästi sairaalahoitojen ilmaantuvuutta (25,0 % vs. 30,7 %).
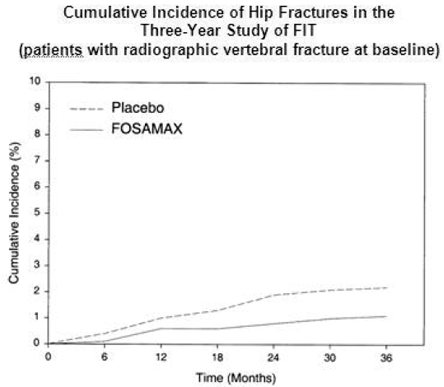
Kolmivuotisessa FIT-tutkimuksessa lonkkamurtumia esiintyi 22:lla (2,2 %) lumelääkettä saaneesta 1005 potilaasta ja 11:llä (1,1 %) 1022 FOSAMAXia saaneesta potilaasta, p = 0,047. Kuvassa 1 on esitetty lonkkamurtumien kumulatiivinen ilmaantuvuus tässä tutkimuksessa.
Kuva 1: Lonkkamurtumien kumulatiivinen ilmaantuvuus kolmivuotisessa FIT-tutkimuksessa (potilaat, joilla on röntgenkuvaus nikamamurtuma lähtötilanteessa)
Murtumainterventiokoe: Neljän vuoden tutkimus (potilaat, joilla on alhainen luumassa, mutta joilla ei ole radiografista nikamamurtumaa)
Tässä satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa, 4432 potilaan tutkimuksessa (FOSAMAX 70 mg, n = 2214; lumelääke, n = 2218) tutkittiin edelleen FOSAMAXin aiheuttamaa murtumien ilmaantuvuuden vähenemistä. Tutkimuksen tarkoituksena oli rekrytoida naisia, joilla on osteoporoosi, joka määritellään reisiluun kaulan BMD:ksi vähintään kaksi standardipoikkeamaa alle nuorten aikuisten naisten keskiarvon. Reisiluun kaulan BMD:n normatiivisten arvojen myöhempien tarkistusten vuoksi 31 % potilaista ei kuitenkaan täyttänyt tätä pääsykriteeriä, joten tähän tutkimukseen osallistui sekä osteoporoottisia että ei-nosteoporoottisia naisia. Tulokset on esitetty taulukossa 7 potilaille, joilla on osteoporoosi.
Murtumatulokset tutkimuksissa
FIT:n kolmivuotistutkimuksessa FOSAMAX 35 mg vähensi vähintään yhden uuden radiografisen nikamamurtuman saaneiden naisten prosenttiosuutta 15,0 %:sta 7,9 %:iin (suhteellinen riskin lasku 47 %, p
FOSAMAX vähensi useiden (kaksi tai useampia) uusia nikamamurtumia kokeneiden naisten prosenttiosuutta 4,2 %:sta 0,6 %:iin (suhteellinen riskin lasku 87 %, p
Siten FOSAMAX 35 mg vähensi röntgenkuvattujen nikamamurtumien ilmaantuvuutta osteoporoosia sairastavilla naisilla riippumatta siitä, oliko heillä aiempi röntgenkuvaus nikamamurtuma.
Vaikutus luun mineraalitiheyteen
FOSAMAXin 10 mg kerran vuorokaudessa luun mineraalitiheyden tehokkuus postmenopausaalisilla, 44–84-vuotiailla naisilla, joilla oli osteoporoosi (lannerangan luun mineraalitiheys [BMD] on vähintään 2 standardipoikkeamaa alle menopaussin keskiarvon) osoitettiin neljässä kaksoisvaiheessa sokeat, lumekontrolloidut kliiniset tutkimukset kahden tai kolmen vuoden ajan' kesto.
Kuvassa 2 on esitetty lannerangan, reisiluun kaulan ja trochanterin BMD:n keskimääräinen nousu potilailla, jotka saivat FOSAMAXia 10 mg/vrk verrattuna lumelääkettä saaneisiin potilaisiin kolmen vuoden kohdalla kussakin näistä tutkimuksista.
Kuva 2: Osteoporoosin hoitotutkimukset postmenopausaalisilla naisilla BMD:n nousu FOSAMAX 10 mg/vrk kolmen vuoden jälkeen
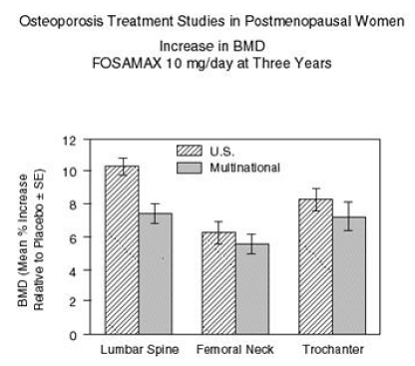
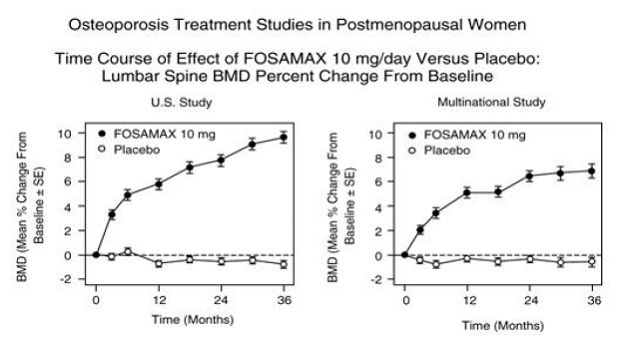
Kolmen vuoden kuluttua FOSAMAXia 10 mg/vrk saaneiden potilaiden jokaisessa mittauskohdassa havaittiin merkittävää BMD:n nousua suhteessa lähtötasoon ja lumelääkkeeseen. Koko kehon BMD lisääntyi myös merkittävästi kussakin tutkimuksessa, mikä viittaa siihen, että selkärangan ja lonkan luumassan kasvu ei tapahtunut muiden luuston alueiden kustannuksella. BMD:n nousu oli ilmeistä jo kolmen kuukauden kuluttua ja jatkui kolmen hoidon ajan. (Katso lannerangan tulokset kuvasta 3.) Näiden tutkimusten kahden vuoden jatkossa 147 potilaan hoito FOSAMAXilla 10 mg/vrk johti luun mineraalitiheyden jatkuvaan nousuun lannerangassa ja trochanterissa (absoluuttinen lisänousu vuoden 3 ja sarven välillä). 5: lanneselkä, 0,94 %; trochanter, 0,88 %). Reisiluun kaulan, kyynärvarren ja koko kehon BMD säilyi. FOSAMAX oli yhtä tehokas iästä, rodusta, luun aineenvaihdunnan lähtötasosta ja lähtötilanteen BMD:stä riippumatta tutkitulla alueella (vähintään 2 standardipoikkeamaa alle menopaussin keskiarvon).
Kuva 3: Osteoporoosin hoitotutkimukset postmenopausaalisilla naisilla FOSAMAXin 10 mg/vrk vaikutusaika verrattuna lumelääkkeeseen: lannerangan BMD:n prosentuaalinen muutos lähtötasosta
Potilailla, joilla oli postmenopausaalinen osteoporoosi ja joita hoidettiin FOSAMAXilla 10 mg/vrk yhden tai kahden vuoden ajan, hoidon lopettamisen vaikutuksia arvioitiin. Lääkkeen lopettamisen jälkeen luumassa ei enää lisääntynyt, ja luukadon määrä oli samanlainen kuin lumeryhmässä.
Luun histologia
Luun histologia 270 postmenopausaalisella osteoporoosipotilaalla, joita hoidettiin FOSAMAXilla annoksilla 1–20 mg/vrk yhden, kahden tai kolmen vuoden ajan, paljasti normaalin mineralisaation ja rakenteen sekä odotetun luun vaihtuvuuden vähenemisen lumelääkkeeseen verrattuna. Nämä tiedot yhdessä normaalin luun histologian ja lisääntyneen luun lujuuden kanssa, joita havaittiin rotilla ja paviaanilla, jotka altistettiin pitkäaikaiselle alendronaattihoidolle, tukevat johtopäätöstä, että FOSAMAX 35 mg -hoidon aikana muodostunut luu on normaalilaatuista.
Vaikutus korkeuteen
FOSAMAXin käyttöön liittyi kolmen tai neljän vuoden aikana tilastollisesti merkitsevä pituuden aleneminen verrattuna lumelääkkeeseen potilailla, joilla oli tai ei ollut lähtötilanteessa radiografisia nikamamurtumia. FIT-tutkimusten lopussa hoitoryhmien väliset erot olivat kolmen vuoden tutkimuksessa 3,2 mm ja neljän vuoden tutkimuksessa 1,3 mm.
Viikoittainen annostus
Kerran viikossa annettavien FOSAMAX 70 mg (n=519) ja FOSAMAX 10 mg vuorokausiannosten (n=370) terapeuttinen vastaavuus osoitettiin vuoden kestäneessä kaksoissokkoutetussa monikeskustutkimuksessa postmenopausaalisilla osteoporoosia sairastavilla naisilla. Täyttäneiden ensisijaisessa analyysissä lannerangan BMD:n keskimääräinen nousu lähtötasosta yhden vuoden aikana oli 5,1 % (4,8, 5,4 %; 95 % CI) 70 mg:n kerran viikossa saaneiden ryhmässä (n = 440) ja 5,4 % ( 5,0, 5,8 %; 95 % CI) 10 mg:n päivittäisessä ryhmässä (n = 330). Nämä kaksi hoitoryhmää olivat myös samanlaisia luun mineraalitiheyden nousun suhteen muissa luuston kohdissa. Hoitoaiko-analyysin tulokset olivat yhdenmukaisia loppuun saaneiden ensisijaisen analyysin kanssa.
Samanaikainen käyttö estrogeeni-/hormonikorvaushoidon (HRT) kanssa
FOSAMAXin 10 mg kerran vuorokaudessa ja konjugoidun estrogeenin (0,625 mg/vrk) vaikutukset joko yksin tai yhdistelmänä arvioitiin kaksivuotisessa kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa postmenopausaalisilla osteoporoottisilla naisilla, joilta oli poistettu kohdun poisto (n = 425). Kahden vuoden kuluttua lannerangan BMD:n nousu lähtötasosta oli merkittävästi suurempi yhdistelmällä (8,3 %) kuin joko estrogeenilla tai FOSAMAXilla yksinään (molemmat 6,0 %).
Vaikutukset BMD:hen, kun FOSAMAX 35 mg lisättiin vakiintuneisiin annoksiin (vähintään yhden vuoden ajan) hormonikorvaushoitoa (estrogeeni ± progestiini), arvioitiin yhden vuoden kaksoissokkoutetussa lumekontrolloidussa tutkimuksessa postmenopausaalisilla osteoporoottisilla naisilla (n = 428). FOSAMAXin 10 mg kerran vuorokaudessa lisääminen hormonikorvaushoitoon aiheutti yhden vuoden kuluttua merkittävästi enemmän lannerangan BMD:n nousua (3,7 %) verrattuna pelkkään hormonikorvaushoitoon (1,1 %).
Näissä tutkimuksissa luun mineraalitiheyden merkittävää nousua tai suotuisaa suuntausta havaittiin yhdistelmähoidossa verrattuna pelkkään hormonikorvaushoitoon koko lonkassa, reisiluun kaulassa ja trokanterissa. Koko kehon BMD:hen ei havaittu merkittävää vaikutusta.
Transiliakbiopsioiden histomorfometriset tutkimukset 92 koehenkilöllä osoittivat normaalin luurakenteen. Verrattuna lumelääkkeeseen luun vaihtuminen väheni 98 % (mineralisoituvan pinnan mukaan) 18 kuukauden yhdistelmähoidon jälkeen FOSAMAX 35 mg:lla ja hormonikorvaushoidolla, 94 % pelkällä FOSAMAX 35 mg:lla ja 78 % pelkällä hormonikorvaushoidolla. FOSAMAX 35 mg:n ja hormonikorvaushoidon yhdistelmän pitkäaikaisia vaikutuksia murtumien esiintymiseen ja murtumien paranemiseen ei ole tutkittu.
Osteoporoosin ehkäisy postmenopausaalisilla naisilla
Päivittäinen annostelu
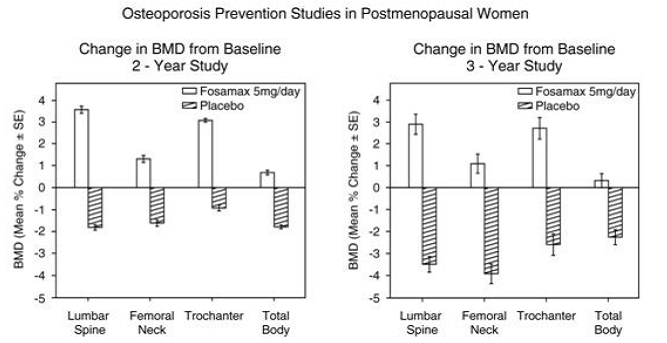
Luukadon ehkäisy osoitettiin kahdessa kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa vaihdevuodet ohittaneilla 40–60-vuotiailla naisilla. Tuhatkuusisataayhdeksän potilasta (FOSAMAX 5 mg/vrk; n = 498), jotka olivat menopaussin jälkeen vähintään kuusi kuukautta, osallistuivat kahden vuoden tutkimukseen ottamatta huomioon heidän lähtötasonsa BMD:tä. Toisessa tutkimuksessa 447 potilasta (FOSAMAX 5 mg/vrk; n=88), jotka olivat kuuden kuukauden ja kolmen vuoden välillä vaihdevuosien jälkeen, saivat hoitoa enintään kolmen vuoden ajan. Lumeella hoidetuilla potilailla luun mineraalitiheys pieneni noin 1 % vuodessa selkärangassa, lonkassa (reisiluun kaula ja trochanter) ja koko kehossa. Sitä vastoin FOSAMAX 5 mg/vrk esti luukatoa suurimmalla osalla potilaista ja aiheutti merkittävän keskimääräisen luumassan kasvun kussakin näistä kohdista (katso kuva 4). Lisäksi FOSAMAX 5 mg/vrk vähensi kyynärvarren luukatoa noin puoleen lumelääkkeeseen verrattuna. FOSAMAX 5 mg/vrk oli yhtä tehokas tässä populaatiossa riippumatta iästä, vaihdevuosien jälkeisestä ajasta, rodusta ja luun vaihtuvuuden lähtötasosta.
Kuva 4: Osteoporoosin ehkäisytutkimukset postmenopausaalisilla naisilla
Luun histologia
Luun histologia oli normaali niillä 28 potilaalla, jotka otettiin biopsiaan kolmen vuoden lopussa ja jotka saivat FOSAMAXia enintään 10 mg/vrk.
Viikoittainen annostus
Kerran viikossa annettavien FOSAMAX 35 mg (n=362) ja FOSAMAX 5 mg/vrk (n=361) terapeuttinen vastaavuus osoitettiin vuoden kestäneessä kaksoissokkoutetussa monikeskustutkimuksessa postmenopausaalisilla naisilla, joilla ei ollut osteoporoosia. Täydellisten potilaiden primaarisessa analyysissä lannerangan BMD:n keskimääräinen nousu lähtötasosta yhden vuoden aikana oli 2,9 % (2,6, 3,2 %; 95 % CI) 35 mg:n kerran viikossa saaneiden ryhmässä (n = 307) ja 3,2 % ( 2,9, 3,5 %; 95 % CI) 5 mg:n päivittäisessä ryhmässä (n = 298). Nämä kaksi hoitoryhmää olivat myös samanlaisia luun mineraalitiheyden nousun suhteen muissa luuston kohdissa. Hoitoaiko-analyysin tulokset olivat yhdenmukaisia loppuun saaneiden ensisijaisen analyysin kanssa.
Hoito luumassan lisäämiseksi miehillä, joilla on osteoporoosi
FOSAMAX 35 mg:n teho miehillä, joilla on hypogonadaalinen tai idiopaattinen osteoporoosi, osoitettiin kahdessa kliinisessä tutkimuksessa.
Päivittäinen annostelu
Kaksivuotisessa kaksoissokkoutetussa, lumekontrolloidussa, monikeskustutkimuksessa FOSAMAXia 10 mg kerran vuorokaudessa otettiin yhteensä 241 31–87-vuotiasta miestä (keskiarvo 63). Kaikilla tutkimuksessa osallistuneilla potilailla oli joko BMD-T-pistemäärä, joka oli pienempi tai yhtä suuri kuin -2 reisiluun kaulassa ja pienempi tai yhtä suuri kuin -1 lannerangassa, tai lähtötilanteen osteoporoottinen murtuma ja BMD-T-pistemäärä pienempi kuin tai yhtä suuri kuin -1 reisiluun kaulassa. Kahden vuoden kuluttua BMD:n keskimääräinen nousu plaseboon verrattuna miehillä, jotka saivat FOSAMAXia 10 mg/vrk, oli merkitsevää seuraavissa kohdissa: lanneselkä, 5,3 %; reisiluun kaula, 2,6 %; trochanter, 3,1 %; ja koko keho, 1,6 %. Hoito FOSAMAX 70 mg:lla vähensi myös pituuden menetystä (FOSAMAX, -0,6 mm vs. lumelääke, -2,4 mm).
Viikoittainen annostus
Yhden vuoden, kaksoissokkoutetussa, lumekontrolloidussa, monikeskustutkimuksessa, jossa FOSAMAXia annettiin kerran viikossa 70 mg, osallistui yhteensä 167 38–91-vuotiasta miestä (keskiarvo 66). Tutkimukseen osallistuneiden potilaiden BMD T-pistemäärä oli joko pienempi tai yhtä suuri kuin -2 reisiluun kaulassa ja pienempi tai yhtä suuri kuin -1 lannerangassa tai BMD T-pisteet pienempi tai yhtä suuri kuin -2 lannerangan ja pienempi tai yhtä suuri kuin -1 reisiluun kaulassa tai perustilan osteoporoottinen murtuma ja BMD T-pistemäärä, joka on pienempi tai yhtä suuri kuin -1 reisiluun kaulassa. Yhden vuoden kuluttua keskimääräinen BMD-lisäys lumelääkkeeseen verrattuna miehillä, jotka saivat FOSAMAXia 70 mg kerran viikossa, olivat merkitseviä seuraavissa kohdissa: lanneselkä, 2,8 %; reisiluun kaula, 1,9 %; trochanter, 2,0 %; ja koko keho, 1,2 %. Nämä BMD:n nousut olivat samanlaisia kuin vuoden kuluttua 10 mg:n kerran vuorokaudessa annetussa tutkimuksessa.
Molemmissa tutkimuksissa BMD-vasteet olivat samanlaiset iästä riippumatta (yli tai yhtä suuri kuin 65 vuotta vs. alle 65 vuotta), sukurauhasten toiminnasta (lähtötason testosteroni alle 9 ng/dl vs. suurempi tai yhtä suuri kuin 9 ng/dl) , tai lähtötason BMD (reisiluun kaulan ja lannerangan T-pisteet pienempi tai yhtä suuri kuin -2,5 vs. suurempi kuin -2,5).
Glukokortikoidien aiheuttaman osteoporoosin hoito
FOSAMAXin 5 ja 10 mg kerran vuorokaudessa tehokkuus miehillä ja naisilla, jotka saivat glukokortikoideja (vähintään 7,5 mg/vrk prednisonia tai vastaavaa) osoitettiin kahdessa, yhden vuoden, kaksoissokkoutetussa, satunnaistetussa, lumekontrolloidussa, monikeskustutkimuksessa. käytännöllisesti katsoen identtinen suunnittelu, yksi suoritettiin Yhdysvalloissa ja toinen 15 eri maassa (monikansallinen [johon sisältyi myös FOSAMAX 2,5 mg/vrk]). Näihin tutkimuksiin osallistui 232 ja 328 17-83-vuotiasta potilasta, joilla oli erilaisia glukokortikoideja vaativia sairauksia. Potilaat saivat lisäkalsiumia ja D-vitamiinia. Kuva 5 näyttää keskimääräisen nousun plaseboon verrattuna lannerangan, reisiluun kaulan ja trochanterissa potilailla, jotka saivat FOSAMAXia 5 mg/vrk jokaisessa tutkimuksessa.
Kuva 5: Tutkimukset glukokortikoidilla hoidetuilla potilailla BMD:n nousu FOSAMAX 5 mg/vrk yhden vuoden kohdalla
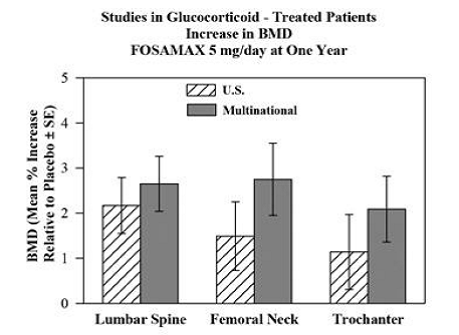
Yhden vuoden kuluttua BMD:n havaittiin lisääntyneen merkitsevästi plaseboon verrattuna yhdistetyissä tutkimuksissa kussakin näistä kohdista potilailla, jotka saivat FOSAMAXia 5 mg/vrk. Plasebolla hoidetuilla potilailla luun mineraalitiheys väheni merkittävästi reisiluun kaulassa (-1,2 %), ja pienempiä laskua havaittiin lannerangassa ja trochanterissa. Koko kehon luun mineraalitiheys ylläpidettiin FOSAMAXilla 5 mg/vrk. BMD:n nousu FOSAMAXilla 10 mg/vrk oli samanlainen kuin FOSAMAXin 5 mg/vrk kohdalla kaikilla potilailla, paitsi postmenopausaalisilla naisilla, jotka eivät saaneet estrogeenihoitoa. Näillä naisilla lisääntyminen (suhteessa lumelääkkeeseen) FOSAMAXilla 10 mg/vrk oli suurempi kuin FOSAMAXilla 5 mg/vrk lannerangassa (4,1 % vs. 1,6 %) ja trochanterissa (2,8 % vs. 1,7 %). mutta ei muilla sivustoilla. FOSAMAX 35 mg oli tehokas annoksesta tai glukokortikoidien käytön kestosta riippumatta. Lisäksi FOSAMAX oli yhtä tehokas riippumatta iästä (alle 65 vs. suurempi tai yhtä suuri kuin 65 vuotta), rodusta (valkoihoinen vs. muut rodut), sukupuolesta, perussairaudesta, lähtötasosta BMD:stä, lähtötilanteen luun vaihtumisesta ja käytöstä erilaisia yleisiä lääkkeitä.
Luun histologia oli normaali niillä 49 potilaalla, jotka otettiin biopsiaan vuoden lopussa ja jotka saivat FOSAMAXia enintään 10 mg/vrk.
Näiden tutkimusten alkuperäisistä 560 potilaasta 208 potilasta, jotka saivat vähintään 7,5 mg/vrk prednisonia tai vastaavaa, jatkoivat vuoden kaksoissokkoutetussa jatkotutkimuksessa. Kahden vuoden hoidon jälkeen selkärangan luun mineraalitiheys kasvoi 3,7 % ja 5,0 % lumelääkkeeseen verrattuna, kun FOSAMAXia annettiin 5 ja 10 mg/vrk. Merkittäviä BMD:n nousuja (suhteessa lumelääkkeeseen) havaittiin myös reisiluun kaulassa, trochanterissa ja koko kehossa.
Vuoden kuluttua 2,3 %:lla potilaista, joita hoidettiin FOSAMAXilla 5 tai 10 mg/vrk (yhdistetty), vs. 3,7 % lumelääkettä saaneista, koki uuden nikamamurtuman (ei merkitsevä). Kuitenkin kahden vuoden ajan tutkitussa populaatiossa FOSAMAX-hoito (yhdistetyt annosryhmät: 5 tai 10 mg kahden vuoden ajan tai 2,5 mg yhden vuoden ajan, jota seurasi 10 mg yhden vuoden ajan) vähensi merkittävästi uusien nikamamurtumien ilmaantuvuutta. (FOSAMAX 0,7 % vs. lumelääke 6,8 %).
Pagetin luutaudin hoito
FOSAMAXin teho 40 mg kerran päivässä kuuden kuukauden ajan osoitettiin kahdessa kaksoissokkoutetussa kliinisessä tutkimuksessa mies- ja naispotilailla, joilla oli kohtalainen tai vaikea Pagetin tauti (alkalinen fosfataasi vähintään kaksi kertaa normaalin ylärajaa korkeampi): lumelääke. -kontrolloitu, monikansallinen tutkimus ja yhdysvaltalainen vertaileva tutkimus etidronaattidinatriumilla 400 mg/vrk. Kuvio 6 esittää keskimääräisiä prosentuaalisia muutoksia perustasosta seerumin alkalisessa fosfataasissa jopa kuuden kuukauden satunnaistetun hoidon aikana.
Kuva 6: Tutkimukset Pagetin taudin luuston vaikutuksesta seerumin alkaliseen fosfataasiin FOSAMAX 40 mg/vrk vs. lumelääke tai etidronaatti 400 mg/vrk
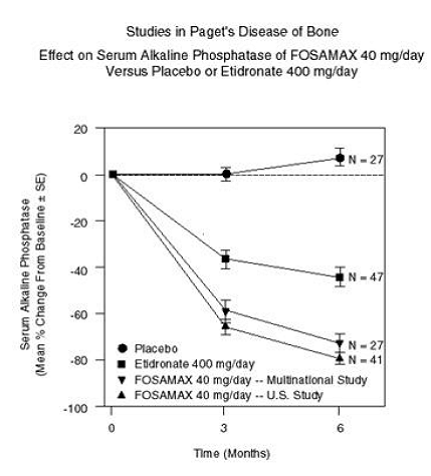
Kuuden kuukauden kohdalla alkalisen fosfataasin suppressio FOSAMAXilla hoidetuilla potilailla oli merkittävästi suurempi kuin etidronaatilla saavutettu ja vastakohtana lumelääkettä saaneiden potilaiden täydelliselle vasteen puutteelle. Vaste (määritelty joko seerumin alkalisen fosfataasin normalisoitumiseksi tai laskemiseksi lähtötasosta vähintään 60 %) esiintyi noin 85 %:lla FOSAMAXilla hoidetuista potilaista yhdistetyissä tutkimuksissa verrattuna 30 %:iin etidronaattiryhmässä ja 0 %:lla lumelääkeryhmässä. ryhmä. FOSAMAX 70 mg oli yhtä tehokas riippumatta iästä, sukupuolesta, rodusta, muiden bisfosfonaattien aikaisemmasta käytöstä tai alkalisesta fosfataasista tutkitulla alueella (vähintään kaksi kertaa normaalin yläraja).
Luun histologiaa arvioitiin 33 potilaalla, joilla oli Pagetin tauti ja joita hoidettiin FOSAMAXilla 40 mg/vrk kuuden kuukauden ajan. Kuten potilailla, joita hoidetaan osteoporoosin vuoksi [ks Kliiniset tutkimukset ], FOSAMAX ei heikentänyt mineralisaatiota, ja havaittiin odotettu luun vaihtumisnopeuden lasku. Normaali lamelliluu muodostui FOSAMAX-hoidon aikana, vaikka olemassa oleva luu oli kudottu ja sekaisin. Kaiken kaikkiaan luun histologiset tiedot tukevat päätelmää, että FOSAMAX 35 mg -hoidon aikana muodostunut luu on normaalilaatuista.
POTILASTIEDOT
FOSAMAX® (FOSS-ah-max) (alendronaattinatrium) Tabletit
Lue FOSAMAX 70 mg:n mukana tuleva lääkitysopas ennen kuin aloitat sen käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Tämä lääkitysopas ei korvaa sitä, että keskustelet lääkärisi kanssa terveydentilastasi tai hoidostasi. Keskustele lääkärisi kanssa, jos sinulla on kysyttävää FOSAMAXista.
Mikä on tärkein tieto, joka minun pitäisi tietää FOSAMAX 70 mg:sta?
FOSAMAX 70 mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
1. Ruokatorven ongelmat.
Joillekin FOSAMAX 35 mg -valmistetta käyttäville ihmisille saattaa kehittyä ongelmia ruokatorvessa (suun ja mahan yhdistävä putki).
Näitä ongelmia ovat ruokatorven ärsytys, tulehdus tai haavaumat, jotka voivat joskus vuotaa verta.
- On tärkeää, että otat FOSAMAX 70 mg -valmistetta juuri niin kuin on määrätty, jotta vähennät mahdollisuutta saada ruokatorviongelmia. (Katso kohta "Miten minun tulee ottaa FOSAMAXia?")
- Lopeta FOSAMAXin käyttö ja ota heti yhteys lääkäriin, jos saat rintakipua, uutta tai pahenevaa närästystä tai nielemisvaikeuksia tai kipua.
2. Alhaiset kalsiumpitoisuudet veressäsi (hypokalsemia).
FOSAMAX voi alentaa veren kalsiumpitoisuutta. Jos sinulla on alhainen veren kalsium ennen FOSAMAX-hoidon aloittamista, se voi pahentua hoidon aikana. Matala veren kalsiumtasi on hoidettava ennen FOSAMAXin ottamista. Useimmilla ihmisillä, joilla on alhainen veren kalsiumtaso, ei ole oireita, mutta joillakin ihmisillä voi olla oireita. Soita lääkärillesi heti, jos sinulla on alhaisen veren kalsiumin oireita, kuten:
- Kouristuksia, nykimistä tai kouristuksia lihaksissasi
- Tunnottomuus tai pistely sormissa, varpaissa tai suun ympärillä
Lääkärisi saattaa määrätä kalsiumia ja D-vitamiinia estämään veren alhaisia kalsiumpitoisuuksia, kun käytät FOSAMAXia. Ota kalsiumia ja D-vitamiinia lääkärisi ohjeiden mukaan.
3. Luu-, nivel- tai lihaskipu.
Joillekin FOSAMAXia käyttäville ihmisille kehittyy vaikea luu-, nivel- tai lihaskipu.
4. Vakavat leukaluun ongelmat (ostenekroosi).
Vakavia leukaluuongelmia voi ilmetä, kun otat FOSAMAXia. Lääkärisi tulee tutkia suusi ennen kuin aloitat FOSAMAXin käytön. Lääkärisi saattaa kehottaa sinua käymään hammaslääkärissäsi ennen kuin aloitat FOSAMAXin käytön. On tärkeää, että harjoitat hyvää suun hoitoa FOSAMAX-hoidon aikana.
5. Epätavalliset reisiluun murtumat.
Jotkut ihmiset ovat kehittäneet epätavallisia murtumia reisiluussaan. Murtuman oireita voivat olla uusi tai epätavallinen kipu lonkassa, nivusissa tai reidessä.
Soita lääkärillesi välittömästi, jos sinulla on jokin näistä sivuvaikutuksista.
Mikä on FOSAMAX 70mg?
- FOSAMAX 70mg on reseptilääke, jota käytetään:
- Hoida tai ehkäistä osteoporoosia naisilla vaihdevuosien jälkeen. Se auttaa vähentämään lonkka- tai selkärangan murtuman mahdollisuutta.
- Lisää luumassaa miehillä, joilla on osteoporoosi.
- Hoida osteoporoosia miehillä tai naisilla, jotka käyttävät kortikosteroidilääkkeitä.
Hoida tiettyjä miehiä ja naisia, joilla on Pagetin luutauti.
Ei tiedetä, kuinka kauan FOSAMAX 70 mg toimii osteoporoosin hoidossa ja ehkäisyssä. Sinun tulee käydä lääkärissä säännöllisesti selvittääksesi, onko FOSAMAX 70 mg edelleen oikea sinulle.
FOSAMAX ei ole tarkoitettu lapsille.
Kuka ei saa ottaa FOSAMAX 70 mg -valmistetta?
Älä ota FOSAMAXia, jos:
- Sinulla on tiettyjä ongelmia ruokatorvessasi, putkessa, joka yhdistää suusi vatsaasi
- Ei pysty seisomaan tai istumaan pystyssä vähintään 30 minuuttia
- Veressäsi on alhainen kalsiumpitoisuus
- olet allerginen FOSAMAX 70mg:lle tai jollekin sen ainesosalle. Ainesosien luettelo on tämän pakkausselosteen lopussa.
Mitä minun pitäisi kertoa lääkärilleni ennen FOSAMAX 35 mg:n ottamista?
Ennen kuin aloitat FOSAMAXin käytön, keskustele lääkärisi kanssa, jos:
- On nielemisongelmia
- Sinulla on maha- tai ruoansulatusongelmia
- Sinulla on alhainen veren kalsium
- Suunnittele hammasleikkaus tai hampaiden poisto
- On munuaisongelmia
- Sinulle on kerrottu, että sinulla on ongelmia mineraalien imeytymisessä mahassasi tai suolistossasi (imeytymishäiriö)
- olet raskaana, yrität tulla raskaaksi tai epäilet olevasi raskaana. Jos tulet raskaaksi FOSAMAXin käytön aikana, lopeta sen käyttö ja ota yhteyttä lääkäriisi. Ei tiedetä, voiko FOSAMAX vahingoittaa sikiötäsi.
- Imetät tai aiot imettää. Ei tiedetä, erittyykö FOSAMAX maitoon ja voiko se vahingoittaa vauvaasi.
Kerro lääkärillesi erityisesti, jos otat:
- antasidit
- aspiriini
- Ei-steroidiset tulehduskipulääkkeet (NSAID).
Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät. Tietyt lääkkeet voivat vaikuttaa FOSAMAX 70 mg:n tehoon.
Tunne käyttämäsi lääkkeet. Pidä niistä luetteloa ja näytä se lääkärillesi ja apteekkiin aina, kun saat uuden lääkkeen.
Miten minun pitäisi ottaa FOSAMAX 35 mg?
- Ota FOSAMAX 35 mg juuri sen verran kuin lääkärisi on määrännyt.
- FOSAMAX toimii vain, jos se otetaan tyhjään mahaan.
- Ota FOSAMAX 35 mg, kun nouset päivän ajaksi ja ennen kuin otat ensimmäistä ruokaa, juomaa tai muuta lääkettä.
- Ota FOSAMAX istuessasi tai seisten.
- Älä pureskele tai imeskele FOSAMAX-tablettia.
- Niele FOSAMAX-tabletti vain täyden lasillisen (6-8 unssia) kanssa pelkkää vettä.
- Älä ota FOSAMAX kivennäisveden, kahvin, teen, soodan tai mehun kanssa.
- Jos otat Alendronate Daily -valmistetta:
- Ota 1 alendronaattitabletti kerran päivässä, joka päivä heräämisen jälkeen ja ennen ensimmäisen ruokailun, juoman tai muun lääkkeen ottamista.
- Jos otat Once Weekly FOSAMAXia:
- Valitse viikonpäivä, joka sopii parhaiten aikatauluusi.
- Ota 1 annos FOSAMAXia joka viikko valitsemasi päivänä heräämisen jälkeen ja ennen kuin otat ensimmäisen ruoan, juoman tai muun lääkkeen.
- Jos otat Alendronate Daily -valmistetta:
Odota vähintään 30 minuuttia FOSAMAX 35 mg tabletin nielemisen jälkeen:
- Ennen kuin makaat. Voit istua, seistä tai kävellä ja tehdä normaaleja toimintoja, kuten lukemista.
- Ennen kuin otat ensimmäisen ruoan tai juoman, paitsi pelkkää vettä.
- Ennen kuin otat muita lääkkeitä, mukaan lukien antasidit, kalsium ja muut lisäravinteet ja vitamiinit.
Älä mene makuulle vähintään 30 minuuttia FOSAMAXin ottamisen ja päivän ensimmäisen aterian syömisen jälkeen.
Jos unohdat ottaa FOSAMAX 70 mg -annoksen, älä ota sitä myöhemmin samana päivänä. Ota unohtunut annos seuraavana aamuna sen jälkeen, kun muistat, ja palaa sitten normaaliin aikatauluusi. Älä ota 2 annosta samana päivänä.
Jos otat liikaa FOSAMAX 70 mg -valmistetta, ota yhteys lääkäriisi. Älä yritä oksentaa. Älä mene makuulle.
Mitkä ovat FOSAMAX 70mg:n mahdolliset sivuvaikutukset?
FOSAMAX voi aiheuttaa vakavia sivuvaikutuksia.
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää FOSAMAXista?"
FOSAMAX 70 mg:n yleisimmät sivuvaikutukset ovat:
- Vatsan alueen (vatsan) kipu
- Närästys
- Ummetus
- Ripuli
- Ärtynyt vatsa
- Kipu luissa, nivelissä tai lihaksissa
- Pahoinvointi
Saatat saada allergisia reaktioita, kuten nokkosihottumaa tai kasvojen, huulten, kielen tai kurkun turvotusta.
Astman pahenemista on raportoitu.
Kerro lääkärillesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei häviä.
Nämä eivät ole kaikkia FOSAMAXin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka säilytän FOSAMAXia?
- Säilytä FOSAMAX 35 mg huoneenlämmössä, 59 °F - 86 °F (15 °C - 30 °C).
- Säilytä FOSAMAX tiiviisti suljetussa astiassa.
Pidä FOSAMAX ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa FOSAMAXin turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä FOSAMAX 35 mg:aa sairauteen, johon sitä ei ole määrätty. Älä anna FOSAMAX 35 mg:aa muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tämä lääkitysopas tiivistää tärkeimmät tiedot FOSAMAXista. Jos haluat lisätietoja, keskustele lääkärisi kanssa. Voit kysyä lääkäriltäsi tai apteekista tietoja FOSAMAXista, joka on kirjoitettu terveydenhuollon ammattilaisille. Lisätietoja saat osoitteesta: www.FOSAMAX.com tai soittamalla numeroon 1-800-622-4477 (maksuton).
Mitä ainesosia FOSAMAX sisältää?
Vaikuttava aine: alendronaattinatrium
Ei-aktiiviset aineet: mikrokiteinen selluloosa, vedetön laktoosi, kroskarmelloosinatrium, magnesiumstearaatti.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
