Estrace 1mg, 2mg Estradiol Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Estrace on ja miten sitä käytetään?
Estrace on reseptilääke, jota käytetään metastasoituneen rintasyövän, osteoporoosin, alhaisen estrogeenin (hypoestrogenismi), vulva- ja emättimen atrofian oireiden hoitoon vaihdevuosien aikana. Estrace 1mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Estrace 1mg kuuluu estrogeenijohdannaisten ryhmään.
Ei tiedetä, onko Estrace 1mg turvallinen ja tehokas lapsille.
Mitkä ovat Estrace 1mg:n mahdolliset sivuvaikutukset?
Estrace voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- rintakipu tai paine,
- kipu leviää leukaan tai olkapäähän,
- pahoinvointi,
- hikoilu,
- äkillinen puutuminen tai heikkous (etenkin toisella kehon puolella),
- äkillinen kova päänsärky,
- sammaltava puhe,
- ongelmia näkösi tai tasapainosi kanssa,
- äkillinen näönmenetys,
- pistävä rintakipu,
- hengenahdistuksen tunne,
- yskii verta,
- kipu tai lämpö toisessa tai molemmissa jaloissa,
- vatsan turvotus tai arkuus,
- ihon tai silmien keltaisuus (keltatauti),
- muistiongelmia,
- hämmennystä,
- epätavallinen käytös,
- epätavallinen emättimen verenvuoto,
- lantiokipu,
- kyhmy rinnassasi,
- oksentelua,
- ummetus,
- lisääntynyt jano tai virtsaaminen,
- lihas heikkous,
- luukipu, an
- d
- energian puute
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Estracen yleisimpiä sivuvaikutuksia ovat:
- pahoinvointi,
- oksentelua,
- ripuli,
- vatsakramppeja,
- mielialan muutoksia,
- unihäiriöt (unettomuus),
- päänsärky,
- selkäkipu,
- rintojen kipu,
- vilustumisoireet (nenän tukkoisuus, poskiontelokipu, kurkkukipu),
- painonnousu,
- hiusten oheneminen,
- emättimen kutina tai vuoto,
- muutokset kuukautiskierrossasi ja
- läpimurtoverenvuoto
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikki Estracen mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
ESTROGENIT LISÄÄVÄT ENDOMETRIUMSyövän RISKiä
Kaikkien estrogeenia käyttävien naisten tiivis kliininen seuranta on tärkeää. Asianmukaiset diagnostiset toimenpiteet, mukaan lukien kohdun limakalvon näytteenotto tarvittaessa, tulee suorittaa pahanlaatuisuuden sulkemiseksi pois kaikissa diagnosoimattomien jatkuvan tai toistuvan epänormaalin emättimen verenvuodon tapauksissa. Ei ole näyttöä siitä, että "luonnollisten" estrogeenien käyttö johtaisi erilaiseen kohdun limakalvon riskiprofiiliin kuin "synteettiset" estrogeenit vastaavilla estrogeeniannoksilla. (Katso VAROITUKSET , Pahanlaatuiset kasvaimet , Endometriumin syöpä .)
SYDÄN-VERIÖN JA MUUT RISKIT
Estrogeenia progestiinien kanssa tai ilman niitä ei tule käyttää sydän- ja verisuonitautien ehkäisyyn. (Katso VAROITUKSET , Sydän- ja verisuonihäiriöt .)
Women's Health Initiative (WHI) -tutkimuksessa raportoitiin lisääntyneestä sydäninfarktin, aivohalvauksen, invasiivisen rintasyövän, keuhkoembolian ja syvän laskimotukoksen riskistä postmenopausaalisilla naisilla (50–79-vuotiaat) viiden vuoden suun kautta annettavan hoidon aikana. konjugoidut estrogeenit (CE 0,625 mg) yhdistettynä medroksiprogesteroniasetaattiin (MPA 2,5 mg) verrattuna lumelääkkeeseen. (Katso KLIININEN FARMAKOLOGIA , Kliiniset tutkimukset .)
Women's Health Initiative Memory Study (WHIMS), WHI:n alatutkimus, raportoi lisääntyneen todennäköisen dementian riskin 65-vuotiailla tai sitä vanhemmilla postmenopausaalisilla naisilla 4 vuoden hoidon aikana oraalisilla konjugoiduilla estrogeeneillä ja medroksiprogesteroniasetaatilla verrattuna lumelääkkeeseen. . Ei tiedetä, koskeeko tämä löydös nuorempia postmenopausaalisia naisia vai naisia, jotka saavat pelkkää estrogeenihoitoa. (Katso KLIININEN FARMAKOLOGIA , Kliiniset tutkimukset .)
Muita oraalisia konjugoituja estrogeeniannoksia medroksiprogesteroniasetaatilla ja muita estrogeenien ja progestiinien yhdistelmiä ja annosmuotoja ei tutkittu WHI-kliinisissä tutkimuksissa, ja vertailukelpoisten tietojen puuttuessa näiden riskien pitäisi olettaa olevan samanlaisia. Näistä riskeistä johtuen estrogeenejä, joissa on tai ei ole progestiineja, tulee määrätä pienimmillä tehokkailla annoksilla ja lyhyimmän keston ajan, mikä on yhdenmukainen yksittäisen naisen hoitotavoitteiden ja riskien kanssa.
KUVAUS
ESTRACE ® (estradiolitabletit, USP) suun kautta annettavaksi sisältää 0,5, 1 tai 2 mg mikronisoitua estradiolia tablettia kohden. Estradioli (17o-estradioli) on valkoinen, kiteinen kiinteä aine, kemiallisesti kuvattu estra-1,3,5,(10)-trieeni-3,17o-dioliksi. Rakennekaava on:
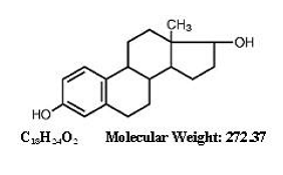
Ei-aktiiviset ainesosat: Kolloidinen piidioksidi, maissitärkkelys, kaksiemäksinen kalsiumfosfaatti, laktoosimonohydraatti, magnesiumstearaatti ja natriumtärkkelysglykolaatti. Lisäksi 1 mg sisältää myös FD&C blue no. 1 alumiinijärvi ja D&C punainen nro. 27 alumiinijärvi. 2 mg sisältää myös FD&C blue no. 1 alumiinijärvi ja FD&C keltainen nro. 5 (tartratsiini) alumiinijärvi.
INDIKAATIOT
ESTRACE (estradiolitabletit, USP) on merkitty seuraaviin:
ANNOSTELU JA HALLINNOINTI
Kun estrogeenia määrätään postmenopausaaliselle naiselle, jolla on kohtu, myös progestiinihoito on aloitettava kohdun limakalvosyövän riskin vähentämiseksi. Nainen, jolla ei ole kohtua, ei tarvitse progestiinia. Estrogeenia tulee käyttää yksinään tai yhdessä progestiinin kanssa pienimmällä tehokkaalla annoksella ja lyhimmän keston ajan, joka on yhdenmukainen hoidon tavoitteiden ja yksittäisen naisen riskien kanssa. Potilaat tulee arvioida uudelleen säännöllisin väliajoin kliinisesti tarkoituksenmukaisesti (esim. 3-6 kuukauden välein) sen määrittämiseksi, onko hoito edelleen tarpeen (ks. LAATIUKSET VAROITUKSET ja VAROITUKSET ). Naisilla, joilla on kohtu, on tarpeen mukaan ryhdyttävä asianmukaisiin diagnostisiin toimenpiteisiin, kuten kohdun limakalvon näytteenottoon, jotta voidaan sulkea pois pahanlaatuisuus diagnosoimattoman jatkuvan tai toistuvan epänormaalin emättimen verenvuodon yhteydessä.
Potilaiden hoito tulee aloittaa käyttöaiheen pienimmällä annoksella.
1. Vaihdevuosiin liittyvän keskivaikeiden tai vaikeiden vasomotoristen oireiden sekä vulvaan ja emättimen atrofian hoitoon tulee valita pienin annos ja hoito-ohjelma, joka hallitsee oireita, ja lääkitys tulee lopettaa mahdollisimman pian.
Lääkityksen lopettamista tai vähentämistä on yritettävä tehdä 3–6 kuukauden välein. Tavanomainen aloitusannosalue on 1–2 mg estradiolia vuorokaudessa, jota muutetaan tarpeen mukaan oireiden hallitsemiseksi. Ylläpitohoidon pienin tehokas annos tulee määrittää titraamalla. Annon tulee olla syklistä (esim. 3 viikkoa päällä ja 1 viikko tauko).
2. Hypogonadismista, kastraatiosta tai primaarisesta munasarjojen vajaatoiminnasta johtuvan naisten hypoestrogenismin hoitoon.
Hoito aloitetaan tavallisesti 1–2 mg:n estradioliannoksella vuorokaudessa, jota muutetaan tarpeen mukaan oireiden hallitsemiseksi. Ylläpitohoidon pienin tehokas annos tulee määrittää titraamalla.
3. Rintasyövän hoitoon, vain lievitykseen, asianmukaisesti valituille naisille ja miehille, joilla on metastaattinen sairaus.
Suositeltu annos on 10 mg kolme kertaa päivässä vähintään kolmen kuukauden ajan.
4. Pitkälle edenneen androgeeniriippuvaisen eturauhassyövän hoitoon, vain lievitykseen.
Suositeltu annos on 1-2 mg kolme kertaa päivässä. Hoidon tehokkuutta voidaan arvioida fosfataasimäärityksistä sekä potilaan oireiden paranemisesta.
5. Osteoporoosin ehkäisyyn.
Kun lääkettä määrätään yksinomaan postmenopausaalisen osteoporoosin ehkäisyyn, hoitoa tulee harkita vain naisille, joilla on merkittävä osteoporoosin riski ja joille ei-estrogeenisiä lääkkeitä ei pidetä sopivina.
ESTRACE 2 mg:n pienintä tehokasta annosta ei ole määritetty.
MITEN TOIMITETAAN
ESTRACE® (estradiolitabletit, USP) ovat saatavilla seuraavasti:
0,5 mg Valkoinen tai luonnonvalkoinen, soikea, tasapintainen, viistoreunainen, jakouurteinen tabletti. Kaiverrus 720 / ½ jakopuolella ja WC toisella puolella. Saatavilla pulloissa:
100 tablettia NDC 0430-0720-24
1 mg : Vaalean violetti, soikea, tasapintainen, viistoreunainen, jakouurteinen tabletti. Kaiverrus 721 / 1 pisteytyspuolella ja WC toisella puolella. Saatavilla pulloissa:
100 tablettia NDC 0430-0721-24
2 mg : Vihreä, soikea, tasapintainen, viistoreunainen, jakouurteinen tabletti. Kaiverrus 722 / 2 pisteytyspuolella ja WC toisella puolella. Saatavilla pulloissa:
100 tablettia NDC 0430-0722-24
Säilytä 20–25 °C:ssa (68–77 °F) [Katso USP-ohjattu huonelämpötila ].
Annostele tiiviiseen, valonkestävään astiaan USP:n mukaisesti, jossa on lapsiturvallinen suljin (tarvittaessa).
PIDÄ TÄMÄ JA KAIKKI LÄÄKKEET POISSA LASTEN ULOTTUVILTA.
Valmistaja: TEVA PHARMACEUTICALS USA Sellersville, PA 18960. Markkinoija: Warner Chilcott (US), LLC, Rockaway, NJ 07866, 1-800-521-8813. Tarkistettu: syyskuuta 2013
SIVUVAIKUTUKSET
Katso LAATIUKSET VAROITUKSET , VAROITUKSET ja VAROTOIMENPITEET .
Seuraavia muita haittavaikutuksia on raportoitu estrogeeni- ja/tai progestiinihoidon yhteydessä.
Urogenitaalinen järjestelmä
Muutokset emättimen verenvuotokuviossa ja epänormaali vieroitusvuoto tai -virtaus; läpimurtoverenvuoto, tiputtelu, dysmenorrea Kohdun leiomyoomaan koon suureneminen Emätintulehdus, mukaan lukien emättimen kandidiaasi Kohdunkaulan erityksen määrä Muutokset kohdunkaulan ektropionissa Munasarjasyöpä; kohdun limakalvon liikakasvu; endometriumin syöpä
Rinnat
Arkuus, laajentuminen, kipu, nännivuoto, galaktorrea; fibrokystiset rintojen muutokset; rintasyöpä
Kardiovaskulaarinen
syvä ja pinnallinen laskimotukos; keuhkoveritulppa; tromboflebiitti; sydäninfarkti; aivohalvaus; verenpaineen nousu
Ruoansulatuskanava
Pahoinvointi, oksentelu Vatsan kouristukset, turvotus Kolestaattinen keltaisuus Sappirakon sairauden ilmaantuvuuden lisääntyminen Haimatulehdus Maksan hemangioomien suureneminen
Iho
Chloasma tai melasma, joka saattaa jatkua lääkkeen käytön lopettamisen jälkeen Erythema multiforme Erythema nodosum Hemorraginen eruptio Päänahan hiustenlähtö Hirsutismi Kutina, ihottuma
Silmät
Verkkokalvon verisuonitukos sarveiskalvon kaarevuuden jyrkkeneminen Piilolinssien intoleranssi
Keskushermosto
Päänsärky, migreeni, huimaus Mielen masennus Korea Hermostuneisuus, mielialahäiriöt, ärtyneisyys Epilepsian paheneminen Dementia
Sekalaista
Painon nousu tai lasku Vähentynyt hiilihydraattitoleranssi Porfyrian paheneminen Turvotus Nivelkivut; jalkakrampit Libidon muutokset Urtikaria Angioödeema Anafylaktoidiset/anafylaktiset reaktiot Hypokalsemia Astman paheneminen Triglyseridien nousu
HUUMEIDEN VUOROVAIKUTUKSET
Lääke/laboratoriotestien vuorovaikutukset
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
Katso LAATIUKSET VAROITUKSET .
Sydän- ja verisuonihäiriöt
Estrogeeni- ja estrogeeni/progestiinihoitoon on liitetty lisääntynyt sydän- ja verisuonitapahtumien, kuten sydäninfarktin ja aivohalvauksen, sekä laskimotromboosin ja keuhkoembolian (laskimotromboembolia tai VTE) riski. Jos jokin näistä ilmenee tai sitä epäillään, estrogeenihoito on lopetettava välittömästi.
Valtimoverisuonisairauden (esim. verenpainetauti, diabetes mellitus, tupakan käyttö, hyperkolesterolemia ja liikalihavuus) ja/tai laskimotromboembolian (esim. henkilökohtainen tai suvussa esiintynyt laskimotromboembolia, liikalihavuus ja systeeminen lupus erythematosus) riskitekijöitä on hoidettava asianmukaisesti.
Sepelvaltimotauti ja aivohalvaus
Women's Health Initiative (WHI) -tutkimuksessa sydäninfarktien ja aivohalvausten määrän on havaittu lisääntyneen CE:tä saaneilla naisilla lumelääkkeeseen verrattuna. Nämä havainnot ovat alustavia, ja tutkimus jatkuu. (Katso KLIININEN FARMAKOLOGIA , Kliiniset tutkimukset .)
WHI:n CE/MPA-alatutkimuksessa sepelvaltimotaudin (CHD) tapahtumien (määritelty ei-kuolemaan johtavaksi sydäninfarktiksi ja sepelvaltimotautikuolemaksi) riski havaittiin CE/MPA:ta saaneilla naisilla verrattuna lumelääkettä saaneisiin naisiin (37 vs 30/10 000 henkilöä vuotta). Riskin kasvu havaittiin ensimmäisenä vuonna ja jatkui.
Samassa WHI:n alatutkimuksessa havaittiin lisääntynyt aivohalvauksen riski CE/MPA:ta saaneilla naisilla verrattuna lumelääkettä saaviin naisiin (29 vs 21/10 000 naisvuotta). Riskin kasvu havaittiin ensimmäisen vuoden jälkeen ja jatkui.
Postmenopausaalisilla naisilla, joilla oli dokumentoitu sydänsairaus (n = 2 763, keski-ikä 66,7 vuotta), kontrolloitu kliininen tutkimus sydän- ja verisuonitautien sekundaarisesta ehkäisystä (Heart and Estrogen/Progestin Replacement Study; HERS) hoidettiin CE/MPA:lla (0,625 mg/2,5 mg per). päivä) ei osoittanut mitään hyötyä sydän- ja verisuonisairauksille. Keskimääräisen 4,1 vuoden seurannan aikana CE/MPA-hoito ei vähentänyt sepelvaltimotautitapahtumien yleistä määrää postmenopausaalisilla naisilla, joilla oli todettu sepelvaltimotauti. Sepelvaltimotautitapahtumia oli enemmän CE/MPA:lla hoidetussa ryhmässä kuin lumeryhmässä vuonna 1, mutta ei seuraavina vuosina. Kaksituhatta kolmesataakaksikymmentäyksi naista alkuperäisestä HERS-tutkimuksesta suostui osallistumaan avoimeen HERS-tutkimukseen, HERS II:een. Keskimääräinen seuranta HERS II:ssa oli vielä 2,7 vuotta, yhteensä 6,8 vuotta. Sepelvaltimotautitapahtumien määrä oli vertailukelpoinen naisten joukossa CE/MPA-ryhmässä ja lumeryhmässä HERS:ssä, HERS II:ssa ja yleisesti.
Suurien estrogeeniannosten (5 mg konjugoituja estrogeenia päivässä), jotka ovat verrattavissa eturauhas- ja rintasyövän hoitoon käytettyihin annoksiin, on osoitettu miehillä tehdyssä laajassa prospektiivisessa kliinisessä tutkimuksessa lisäävän ei-fataalin sydäninfarktin, keuhkoembolian ja tromboflebiitti.
Laskimotromboembolia (VTE).
Women's Health Initiative (WHI) -tutkimuksessa laskimotromboembolia on havaittu lisääntyneen CE:tä saavilla naisilla lumelääkkeeseen verrattuna. Nämä havainnot ovat alustavia, ja tutkimus jatkuu. (Katso KLIININEN FARMAKOLOGIA , Kliiniset tutkimukset .)
WHI:n CE/MPA-alatutkimuksessa laskimotromboemboliaa, mukaan lukien syvä laskimotukos ja keuhkoembolia, havaittiin kaksinkertaisesti CE/MPA:ta saaneilla naisilla verrattuna lumelääkettä saaneisiin naisiin. Laskimotautien esiintyvyys oli 34 tapausta 10 000 naisvuotta kohden CE/MPA-ryhmässä verrattuna 16 tapaukseen 10 000 naisvuotta kohden lumeryhmässä. VTE-riskin kasvu havaittiin ensimmäisen vuoden aikana ja se jatkui.
Jos mahdollista, estrogeenihoito tulee lopettaa vähintään 4–6 viikkoa ennen leikkausta, joka liittyy suurentuneeseen tromboembolian riskiin, tai pitkittyneen immobilisaation aikana.
Pahanlaatuiset kasvaimet
Endometriumin syöpä
Yksinkertaisten estrogeenien käyttö naisilla, joilla on ehjä kohtu, on yhdistetty lisääntyneeseen kohdun limakalvosyövän riskiin. Raportoitu kohdun limakalvon syövän riski niillä, joilla ei ole estrogeenia, on noin 2–12 kertaa suurempi kuin ei-käyttäjillä, ja se näyttää riippuvan hoidon kestosta ja estrogeeniannoksesta. Useimmat tutkimukset osoittavat, että estrogeenien käyttöön ei liity merkittävää riskiä alle vuoden ajan. Suurin riski liittyy pitkäaikaiseen käyttöön – riski kasvaa 15–24-kertaiseksi 5–10 vuoden ajan tai kauemmin – ja tämä riski säilyy 8–15 vuoden ajan estrogeenihoidon lopettamisen jälkeen.
Kaikkien estrogeeni/progestiiniyhdistelmiä käyttävien naisten kliininen seuranta on tärkeää (ks VAROTOIMENPITEET ). Asianmukaiset diagnostiset toimenpiteet, mukaan lukien kohdun limakalvon näytteenotto tarvittaessa, tulee suorittaa pahanlaatuisuuden sulkemiseksi pois kaikissa diagnosoimattomien jatkuvan tai toistuvan epänormaalin emättimen verenvuodon tapauksissa. Ei ole näyttöä siitä, että luonnollisten estrogeenien käyttö johtaisi erilaiseen kohdun limakalvon riskiprofiiliin kuin synteettiset estrogeenit, joiden estrogeeniannos on sama. Progestiinin lisäämisen estrogeenihoitoon on osoitettu vähentävän kohdun limakalvon liikakasvun riskiä, joka voi olla kohdun limakalvosyövän esiaste.
Rintasyöpä
Estrogeenien ja progestiinien käytön postmenopausaalisilla naisilla on raportoitu lisäävän rintasyövän riskiä. Tärkein satunnaistettu kliininen tutkimus, joka tarjoaa tietoa tästä asiasta, on Women's Health Initiative (WHI) -alatutkimus CE/MPA:sta (ks. KLIININEN FARMAKOLOGIA , Kliiniset tutkimukset ). Havaintotutkimusten tulokset ovat yleensä yhdenmukaisia WHI:n kliinisen tutkimuksen tulosten kanssa, eivätkä ne raportoi merkittävää vaihtelua rintasyövän riskissä eri estrogeenien tai progestiinien, annosten tai antoreittien välillä.
WHI:n CE/MPA-alatutkimuksessa raportoitiin lisääntynyttä rintasyövän riskiä naisilla, jotka käyttivät CE/MPA-hoitoa keskimäärin 5,6 vuoden seurannan ajan. Havaintotutkimukset ovat myös raportoineet suurentuneen estrogeeni/progestiini-yhdistelmähoidon riskin ja pienemmän lisääntyneen riskin pelkän estrogeenihoidon jälkeen useiden vuosien käytön jälkeen. WHI-tutkimuksessa ja havainnointitutkimuksissa ylimääräinen riski kasvoi käytön keston myötä. Havaintotutkimusten perusteella riski näytti palaavan lähtötasolle noin viiden vuoden kuluttua hoidon lopettamisesta. Lisäksi havainnointitutkimukset viittaavat siihen, että rintasyövän riski oli suurempi ja tuli ilmeiseksi aiemmin estrogeeni/progestiini-yhdistelmähoidolla verrattuna pelkkään estrogeenihoitoon.
CE/MPA-alatutkimuksessa 26 % naisista ilmoitti aiemmin käyttäneensä yksinään estrogeenia ja/tai estrogeeni/progestiini-yhdistelmähormonihoitoa. Keskimääräisen 5,6 vuoden seurannan jälkeen kliinisen tutkimuksen aikana invasiivisen rintasyövän suhteellinen kokonaisriski oli 1,24 (95 %:n luottamusväli 1,01-1,54) ja kokonaisabsoluuttinen riski oli 41 vs 33 tapausta 10 000 naisvuotta kohden. CE/MPA verrattuna lumelääkkeeseen. Naisilla, jotka ilmoittivat aiemmin käyttäneensä hormonihoitoa, invasiivisen rintasyövän suhteellinen riski oli 1,86, ja absoluuttinen riski oli 46 vs. 25 tapausta 10 000 naisvuotta kohden CE/MPA:lla verrattuna lumelääkkeeseen. Naisilla, jotka eivät ilmoittaneet käyttävänsä aiempaa hormonihoitoa, invasiivisen rintasyövän suhteellinen riski oli 1,09, ja absoluuttinen riski oli 40 vs. 36 tapausta 10 000 naisvuotta kohden CE/MPA:lla verrattuna lumelääkkeeseen. Samassa alatutkimuksessa invasiiviset rintasyövät olivat suurempia ja ne diagnosoitiin pidemmälle edenneessä vaiheessa CE/MPA-ryhmässä verrattuna plaseboryhmään. Metastaattinen sairaus oli harvinainen ilman selvää eroa kahden ryhmän välillä. Muut prognostiset tekijät, kuten histologinen alatyyppi, luokka ja hormonireseptorin tila, eivät eronneet ryhmien välillä.
Estrogeenin ja progestiinin käytön on raportoitu lisäävän epänormaaleja mammografioita, jotka vaativat lisäarviointia. Kaikkien naisten tulee käydä vuosittain rintojen tarkastuksessa terveydenhuollon tarjoajan toimesta ja tehdä rintojen itsetarkastus kuukausittain. Lisäksi mammografiatutkimukset tulee ajoittaa potilaan iän, riskitekijöiden ja aikaisempien mammografiatulosten perusteella.
Dementia
WHIMS-tutkimuksessa (Women's Health Initiative Memory Study) tutkittiin 4 532 yleisesti tervettä postmenopausaalista yli 65-vuotiasta naista, joista 35 % oli 70-74-vuotiaita ja 18 % 75-vuotiaita tai vanhempia. Keskimääräisen 4 vuoden seurannan jälkeen 40 CE/MPA:lla hoidettua naista (1,8 %, n = 2 229) ja 21 naista lumeryhmässä (0,9 %, n = 2 303) saivat todennäköisen dementian diagnoosin. CE/MPA:n suhteellinen riski plaseboon verrattuna oli 2,05 (95 %:n luottamusväli 1,21 – 3,48), ja se oli samanlainen naisilla, joilla oli tai ei ollut vaihdevuosihormonien käyttöä ennen WHIMS:ää. CE/MPA:n todennäköisen dementian absoluuttinen riski plaseboon verrattuna oli 45 tapausta vastaan 22 tapausta 10 000 naisvuotta kohden, ja CE/MPA:n absoluuttinen ylimääräinen riski oli 23 tapausta 10 000 naisvuotta kohden. Ei tiedetä, pätevätkö nämä havainnot nuoremmille postmenopausaalisille naisille. (Katso KLIININEN FARMAKOLOGIA , Kliiniset tutkimukset ja VAROTOIMENPITEET , Geriatrinen käyttö .)
Ei tiedetä, pätevätkö nämä havainnot pelkkään estrogeenihoitoon.
Sappirakon sairaus
Estrogeenia saavilla postmenopausaalisilla naisilla on raportoitu 2–4-kertaisen leikkausta vaativan sappirakon sairauden riskin lisääntymistä.
Hyperkalsemia
Estrogeenin antaminen voi johtaa vakavaan hyperkalsemiaan potilailla, joilla on rintasyöpä ja luumetastaasseja. Jos hyperkalsemiaa ilmenee, lääkkeen käyttö on lopetettava ja ryhdyttävä asianmukaisiin toimenpiteisiin seerumin kalsiumpitoisuuden alentamiseksi.
Näköhäiriöt
Verkkokalvon verisuonitromboosia on raportoitu estrogeenia saavilla potilailla. Lopeta lääkitys tutkimuksen ajaksi, jos näön äkillinen osittainen tai täydellinen menetys tai äkillinen proptoosi, diplopia tai migreeni alkavat. Jos tutkimuksessa paljastuu papilledema tai verkkokalvon verisuonivaurioita, estrogeenihoito tulee lopettaa pysyvästi.
VAROTOIMENPITEET
Kenraali
Progestiinin lisääminen, kun naiselta ei ole tehty kohdunpoistoa
Tutkimukset progestiinin lisäämisestä 10 tai useamman päivän estrogeenin antosyklin aikana tai päivittäin estrogeenin kanssa jatkuvassa hoito-ohjelmassa ovat raportoineet endometriumin liikakasvun vähentyneestä ilmaantumisesta kuin pelkällä estrogeenihoidolla. Endometriumin hyperplasia voi olla kohdun limakalvosyövän esiaste.
On kuitenkin olemassa mahdollisia riskejä, jotka voivat liittyä progestiinien käyttöön estrogeenien kanssa verrattuna pelkkään estrogeenihoitoon. Näihin kuuluu mahdollinen lisääntynyt rintasyövän riski.
Kohonnut verenpaine
Pienessä määrässä tapausraportteja verenpaineen huomattavan nousun on katsottu johtuvan idiosynkraattisista estrogeenireaktioista. Suuressa, satunnaistetussa, lumekontrolloidussa kliinisessä tutkimuksessa estrogeenien ei havaittu yleistä vaikutusta verenpaineeseen. Verenpainetta tulee seurata säännöllisin väliajoin estrogeenia käytettäessä.
Hypertriglyseridemia
Potilailla, joilla on aiemmin ollut hypertriglyseridemia, estrogeenihoitoon voi liittyä plasman triglyseridien kohoamista, mikä voi johtaa haimatulehdukseen ja muihin komplikaatioihin.
Maksan vajaatoiminta ja kolestaattisen keltaisuuden historia
Estrogeenit saattavat metaboloitua heikosti potilailla, joilla on maksan vajaatoiminta. Varovaisuutta on noudatettava potilailla, joilla on aiemmin esiintynyt kolestaattista keltaisuutta, joka liittyy estrogeenien käyttöön tai raskauteen, ja lääkitys tulee lopettaa uusiutuessa.
Kilpirauhasen vajaatoiminta
Estrogeenin antaminen lisää kilpirauhasta sitovan globuliinin (TBG) tasoa. Potilaat, joilla on normaali kilpirauhasen toiminta, voivat kompensoida kohonnutta TBG:tä tuottamalla enemmän kilpirauhashormonia, mikä pitää seerumin vapaan T4- ja T3-pitoisuudet normaalialueella. Kilpirauhashormonikorvaushoidosta riippuvaiset potilaat, jotka saavat myös estrogeenia, saattavat tarvita suurempia annoksia kilpirauhaskorvaushoitoaan. Näiden potilaiden kilpirauhasen toimintaa tulee seurata, jotta vapaan kilpirauhashormonitaso pysyy hyväksyttävällä alueella.
Nesteenpidätys
Koska estrogeenit voivat aiheuttaa jonkinasteista nesteretentiota, potilaiden, joilla on sairauksia, joihin tämä tekijä saattaa vaikuttaa, kuten astma, epilepsia, migreeni ja sydämen tai munuaisten vajaatoiminta, on syytä tarkkailla huolellisesti, kun estrogeenia määrätään.
Hypokalsemia
Estrogeenia tulee käyttää varoen henkilöillä, joilla on vaikea hypokalsemia.
Munasarjasyöpä
WHI:n CE/MPA-alatutkimuksen mukaan estrogeeni plus progestiini lisäsi munasarjasyövän riskiä. Keskimääräisen 5,6 vuoden seurannan jälkeen CE/MPA:n suhteellinen munasarjasyövän riski plaseboon verrattuna oli 1,58 (95 %:n luottamusväli 0,77–3,24), mutta se ei ollut tilastollisesti merkitsevä. CE/MPA:n absoluuttinen riski plaseboon verrattuna oli 4,2 ja 2,7 tapausta 10 000 naisvuotta kohden. Joissakin epidemiologisissa tutkimuksissa pelkän estrogeenin käyttö, erityisesti kymmenen tai useamman vuoden ajan, on yhdistetty lisääntyneeseen munasarjasyövän riskiin. Muut epidemiologiset tutkimukset eivät ole löytäneet näitä assosiaatioita.
Endometrioosin paheneminen
Endometrioosi voi pahentua estrogeenien antamisen myötä. Joitakin tapauksia jäljelle jääneiden kohdun limakalvon implanttien pahanlaatuisesta transformaatiosta on raportoitu naisilla, joita on hoidettu kohdunpoiston jälkeen pelkällä estrogeenihoidolla. Progestiinin lisäämistä tulee harkita potilailla, joilla tiedetään olevan jäljellä oleva endometrioosi kohdunpoiston jälkeen.
Muiden tilojen paheneminen
Estrogeenit voivat pahentaa astmaa, diabetes mellitusta, epilepsiaa, migreeniä tai porfyriaa, systeemistä lupus erythematosusta ja maksan hemangioomia, ja niitä tulee käyttää varoen naisilla, joilla on näitä sairauksia.
ESTRACE (estradiolitabletit, USP), 2 mg, sisältää FD&C Yellow No. 5:tä (tartratsiinia), joka voi aiheuttaa allergisen tyyppisiä reaktioita (mukaan lukien keuhkoastma) tietyillä herkillä henkilöillä. Vaikka FD&C Yellow No. 5 (tartratsiini) -herkkyyden yleinen ilmaantuvuus yleisväestössä on alhainen, sitä havaitaan usein potilailla, joilla on myös yliherkkyys aspiriinille.
Potilastiedot
Lääkäreitä kehotetaan keskustelemaan POTILASTIEDOT seloste potilaille, joille he määräävät ESTRACEa.
Laboratoriotestit
Estrogeenin anto tulee aloittaa pienimmällä käyttöaiheeseen hyväksytyllä annoksella ja sen jälkeen ohjata kliinistä vastetta eikä seerumin hormonitasoja (esim. estradioli, FSH). (Katso ANNOSTELU JA HALLINNOINTI jakso.)
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Pitkäaikainen jatkuva estrogeenin antaminen progestiinin kanssa ja ilman sitä naisilla, joilla on kohtu ja ilman, on osoittanut lisääntyneen kohdun limakalvosyövän, rintasyövän ja munasarjasyövän riskin. (Katso LAATIUKSET VAROITUKSET , VAROITUKSET ja VAROTOIMENPITEET .)
Luonnollisten ja synteettisten estrogeenien pitkäaikainen jatkuva antaminen tietyille eläinlajeille lisää rinta-, kohtu-, kohdunkaulan-, emättimen, kiveksen ja maksan karsinoomien esiintyvyyttä.
Raskausluokka X
Estrace 2 mg -valmistetta ei tule käyttää raskauden aikana. (Katso VASTA-AIHEET .)
Imettävät äidit
Estrogeenin antamisen imettäville äideille on osoitettu vähentävän maidon määrää ja laatua. Tätä lääkettä saavien äitien maidosta on tunnistettu havaittavissa olevia estrogeenimääriä. Varovaisuutta tulee noudattaa, kun ESTRACE 1 mg -valmistetta annetaan imettäville naisille.
Käyttö lapsille
Turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu. Suuret ja toistuvat estrogeeniannokset pitkän ajan kuluessa on osoitettu nopeuttavan epifyysin sulkeutumista, mikä johtaa lyhyeen aikuisen kasvuun, jos hoito aloitetaan ennen fysiologisen murrosiän päättymistä normaalisti kehittyvillä lapsilla. Potilailla, joilla luun kasvu ei ole täydellistä, luun kypsymisen ja epifyysikeskuksiin kohdistuvien vaikutusten säännöllistä seurantaa suositellaan.
Esimurrosikäisten lasten estrogeenihoito aiheuttaa myös ennenaikaista rintojen kehittymistä ja emättimen sarveistumista, ja se voi mahdollisesti aiheuttaa emättimen verenvuotoa tytöillä. Pojilla estrogeenihoito voi muuttaa normaalia murrosikää. Kaikki muut fysiologiset ja haittavaikutukset, joiden on osoitettu liittyvän aikuisten estrogeenihoitoon, voivat mahdollisesti esiintyä lapsiväestössä, mukaan lukien tromboemboliset häiriöt ja tiettyjen kasvainten kasvun stimulaatio. Siksi estrogeenejä tulee antaa lapsipotilaille vain, kun se on selvästi aiheellista, ja aina tulee käyttää pienintä tehokasta annosta.
Geriatrinen käyttö
ESTRACE-tablettien turvallisuutta ja tehoa iäkkäillä potilailla ei ole varmistettu. Yleensä iäkkään potilaan annoksen valinnassa tulee olla varovainen, yleensä alkaen annosalueen alimmasta päästä, mikä heijastaa suurinta heikentynyttä maksan, munuaisten tai sydämen toimintaa sekä samanaikaista sairautta tai muuta lääkehoitoa.
Women's Health Initiative Memory Study -tutkimuksessa, johon osallistui 4 532 vähintään 65-vuotiasta naista, seurattiin keskimäärin 4 vuoden ajan, 82 % (n = 3 729) oli 65-74-vuotiaita ja 18 % (n = 803) oli 75-vuotiaita tai vanhempia. Suurin osa naisista (80 %) ei ollut aiemmin käyttänyt hormonihoitoa. Naisilla, joita hoidettiin konjugoiduilla estrogeeneillä ja medroksiprogesteroniasetaatilla, todennäköisen dementian riskin raportoitiin kaksinkertaiseksi. Alzheimerin tauti oli yleisin todennäköisen dementian luokittelu sekä konjugoitujen estrogeenien ja medroksiprogesteroniasetaattien ryhmässä että lumeryhmässä. 90 prosenttia todennäköisestä dementiatapauksista esiintyi 54 prosentilla yli 70-vuotiaista naisista. VAROITUKSET , Dementia .)
Ei tiedetä, pätevätkö nämä havainnot pelkkään estrogeenihoitoon.
YLIANNOSTUS
Vakavia haittavaikutuksia ei ole raportoitu, kun pienet lapset ovat ottaneet akuutisti suuria annoksia estrogeenia sisältäviä oraalisia ehkäisyvalmisteita. Estrogeenin yliannostus voi aiheuttaa pahoinvointia ja oksentelua, ja naisilla voi esiintyä vieroitusvuotoa.
VASTA-AIHEET
Estrogeenia ei tule käyttää henkilöille, joilla on jokin seuraavista sairauksista:
KLIININEN FARMAKOLOGIA
Endogeeniset estrogeenit ovat suurelta osin vastuussa naisten lisääntymisjärjestelmän ja toissijaisten seksuaalisten ominaisuuksien kehityksestä ja ylläpidosta. Vaikka kiertävät estrogeenit esiintyvät metabolisten keskinäisten muutosten dynaamisessa tasapainossa, estradioli on tärkein solunsisäinen ihmisen estrogeeni ja se on reseptoritasolla huomattavasti tehokkaampi kuin sen metaboliitit, estroni ja estrioli.
Normaalisti pyöräilevien aikuisten naisten ensisijainen estrogeenin lähde on munasarjafollikkelia, joka erittää 70-500 mikrogrammaa estradiolia päivässä kuukautiskierron vaiheesta riippuen. Vaihdevuosien jälkeen useimmat endogeeniset estrogeenit tuotetaan muuttamalla lisämunuaiskuoren erittämää androsteenidionia estroniksi ääreiskudoksissa. Siten estroni ja sulfaattikonjugoitu muoto, estronisulfaatti, ovat runsaimmat verenkierrossa olevat estrogeenit postmenopausaalisilla naisilla.
Estrogeenit vaikuttavat sitoutumalla estrogeeniresponsiivisten kudosten tumareseptoreihin. Tähän mennessä on tunnistettu kaksi estrogeenireseptoria. Nämä vaihtelevat suhteessa kudoksiin.
Kierrettävät estrogeenit säätelevät gonadotropiinien, luteinisoivan hormonin (LH) ja follikkelia stimuloivan hormonin (FSH) aivolisäkkeen eritystä negatiivisen palautemekanismin kautta. Estrogeenit vähentävät näiden hormonien kohonneita tasoja postmenopausaalisilla naisilla.
Farmakokinetiikka
Jakelu
Eksogeenisten estrogeenien jakautuminen on samanlainen kuin endogeenisten estrogeenien. Estrogeenit ovat laajalti jakautuneita kehossa, ja niitä löytyy yleensä suurempina pitoisuuksina sukupuolihormonien kohde-elimissä. Estrogeenit kiertävät veressä suurelta osin sitoutuneena sukupuolihormoneja sitovaan globuliiniin (SHBG) ja albumiiniin.
Aineenvaihdunta
Eksogeeniset estrogeenit metaboloituvat samalla tavalla kuin endogeeniset estrogeenit. Kierrettävät estrogeenit esiintyvät metabolisten keskinäisten muuntumisten dynaamisessa tasapainossa. Nämä muutokset tapahtuvat pääasiassa maksassa. Estradioli muuttuu palautuvasti estroniksi, ja molemmat voivat muuttua estrioliksi, joka on tärkein virtsan metaboliitti. Estrogeenit käyvät läpi myös enterohepaattisen kierrätyksen sulfaatti- ja glukuronidikonjugaation kautta maksassa, konjugaattien erittymisen sappiteitse suolistossa ja hydrolyysin kautta suolistossa, mitä seuraa uudelleen imeytyminen. Postmenopausaalisilla naisilla merkittävä osa verenkierrossa olevista estrogeeneistä esiintyy sulfaattikonjugaatteina, erityisesti estronisulfaattina, joka toimii kiertävänä säiliönä aktiivisempien estrogeenien muodostumiselle.
Erittyminen
Estradioli, estroni ja estrioli erittyvät virtsaan yhdessä glukuronidi- ja sulfaattikonjugaattien kanssa.
Erikoispopulaatiot
Farmakokineettisiä tutkimuksia ei ole tehty erityisryhmillä, mukaan lukien potilaat, joilla on munuaisten tai maksan vajaatoiminta.
Huumeiden vuorovaikutukset
In vitro ja in vivo -tutkimukset ovat osoittaneet, että estrogeenit metaboloituvat osittain sytokromi P450 3A4:n (CYP3A4) vaikutuksesta. Siksi CYP3A4:n indusoijat tai estäjät voivat vaikuttaa estrogeenin lääkeaineenvaihduntaan. CYP3A4:n induktorit, kuten mäkikuismavalmisteet (Hypericum perforatum), fenobarbitaali, karbamatsepiini ja rifampiini, voivat alentaa plasman estrogeenipitoisuuksia, mikä mahdollisesti heikentää terapeuttisia vaikutuksia ja/tai muuttaa kohdun verenvuotoprofiilia. CYP3A4:n estäjät, kuten erytromysiini, klaritromysiini, ketokonatsoli, itrakonatsoli, ritonaviiri ja greippimehu, voivat suurentaa plasman estrogeenipitoisuuksia ja aiheuttaa sivuvaikutuksia.
Kliiniset tutkimukset
Osteoporoosi
Useimmat tämän käyttöaiheen prospektiiviset tehoa koskevat tutkimukset on tehty valkoisilla vaihdevuosi-ikäisillä naisilla ilman muiden riskitekijöiden osoitusta, ja niillä on taipumus osoittaa yleisesti terveellistä vaikutusta luuhun.
Kaksivuotisen, satunnaistetun, lumekontrolloidun, kaksoissokkoutetun, annosvälitteisen tutkimuksen tulokset ovat osoittaneet, että hoito 0,5 mg:lla estradiolia päivässä 23 päivän ajan (28 päivän syklissä) estää nikamien luumassan vähenemisen postmenopausaalisilla naisilla. Kun estrogeenihoito lopetetaan, luumassa pienenee nopeudella, joka on verrattavissa välittömään postmenopausaaliseen ajanjaksoon. Ei ole näyttöä siitä, että estrogeenikorvaushoito palauttaisi luumassan menopaussia edeltävälle tasolle.
Naisten terveysaloitetutkimukset
Women's Health Initiative (WHI) otti mukaan yhteensä 27 000 pääosin tervettä postmenopausaalista naista arvioimaan riskejä ja hyötyjä joko suun kautta annettavien 0,625 mg konjugoitujen estrogeenien (CE) vuorokaudessa yksinään käytöstä tai suun kautta annettavien 0,625 mg konjugoitujen estrogeenien käytöstä. estrogeenit plus 2,5 mg medroksiprogesteroniasetaattia (MPA) päivässä verrattuna lumelääkkeeseen tiettyjen kroonisten sairauksien ehkäisyssä. Ensisijainen päätetapahtuma oli sepelvaltimotaudin (CHD) ilmaantuvuus (ei kuolemaan johtanut sydäninfarkti ja sepelvaltimotautikuolema), ja invasiivinen rintasyöpä oli ensisijainen tutkittu haittavaikutus. "Globaaliindeksi" sisälsi sepelvaltimotaudin, invasiivisen rintasyövän, aivohalvauksen, keuhkoembolian (PE), kohdun limakalvosyövän, paksusuolensyövän, lonkkamurtuman tai muusta syystä johtuvan kuoleman aikaisimman esiintymisen. Tutkimuksessa ei arvioitu CE:n tai CE/MPA:n vaikutuksia vaihdevuosien oireisiin.
CE/MPA-alatutkimus lopetettiin aikaisin, koska ennalta määritellyn lopetussäännön mukaan lisääntynyt rintasyövän ja sydän- ja verisuonitapahtumien riski ylitti "globaaliin indeksiin" sisältyvät määritellyt hyödyt. CE/MPA-alatutkimuksen tulokset, joihin osallistui 16 608 naista (keski-ikä 63 vuotta, vaihteluväli 50–79; 83,9 % valkoisia, 6,5 % mustia, 5,5 % latinalaisamerikkalaisia), keskimääräisen 5,2 vuoden seurannan jälkeen on esitetty taulukossa. 1 alla:
Niille tuloksille, jotka sisältyvät "globaaliin indeksiin", absoluuttinen ylimääräinen riski 10 000 naisvuotta kohden CE/MPA:lla hoidetussa ryhmässä oli 7 enemmän sepelvaltimotautitapahtumaa, 8 enemmän aivohalvausta, 8 enemmän PE: tä ja 8 enemmän invasiivista rintasyöpää. absoluuttiset riskin alenemat 10 000 naisvuotta kohden olivat 6 vähemmän paksusuolen syöpää ja 5 vähemmän lonkkamurtumia. "Globalin indeksiin" sisältyvien tapahtumien absoluuttinen ylimääräinen riski oli 19 per 10 000 naisvuotta. Ryhmien välillä ei ollut eroa kaikista syistä johtuvan kuolleisuuden suhteen. (Katso LAATIUKSET VAROITUKSET , VAROITUKSET , ja VAROTOIMENPITEET .)
Naisten terveysaloitteen muistitutkimus
WHIMS-tutkimukseen, WHIMS:n alatutkimukseen, osallistui 4 532 pääosin tervettä postmenopausaalista 65-vuotiasta ja sitä vanhempaa naista (47 % oli 65-69-vuotiaita, 35 % 70-74-vuotiaita ja 18-vuotiaita). % oli 75-vuotiaita tai vanhempia) arvioidakseen CE/MPA:n (0,625 mg konjugoituja estrogeenia plus 2,5 mg medroksiprogesteroniasetaattia) vaikutusta todennäköisen dementian ilmaantuvuuteen (ensisijainen tulos) lumelääkkeeseen verrattuna.
Keskimääräisen 4 vuoden seurannan jälkeen 40 naisella estrogeeni/progestiiniryhmässä (45/10 000 naisvuotta) ja 21 naisella lumeryhmässä (22/10 000 naisvuotta) diagnosoitiin todennäköinen dementia. Todennäköisen dementian suhteellinen riski hormonihoitoryhmässä oli 2,05 (95 % luottamusväli, 1,21-3,48) lumelääkkeeseen verrattuna. Erot ryhmien välillä ilmenivät ensimmäisen hoitovuoden aikana. Ei tiedetä, pätevätkö nämä havainnot nuoremmille postmenopausaalisille naisille. (Katso LAATIKKO VAROITUS ja VAROITUKSET , Dementia .)
POTILASTIEDOT
JOHDANTO
Lue nämä potilastiedot ennen kuin aloitat ESTRACE 2 mg:n käytön ja lue, mitä saat joka kerta, kun lisäät ESTRACEa. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi.
MIKÄ ON TÄRKEIN TIETO, JOITA MINUN TULISI TIETÄÄ ESTRACESTA (ESTROGENIHORMONI)?
- Estrogeenit lisäävät mahdollisuuksia saada kohtusyöpä.
Ilmoita epätavallisista emättimen verenvuodoista heti, kun käytät estrogeenia. Emättimen verenvuoto vaihdevuosien jälkeen voi olla varoitusmerkki kohtusyövästä. Terveydenhuollon tarjoajan tulee tarkistaa epätavallinen emättimen verenvuoto syyn selvittämiseksi.
- Älä käytä estrogeenia progestiinien kanssa tai ilman estääksesi sydänsairauksia, sydänkohtauksia tai aivohalvauksia.
Estrogeenien käyttö progestiinien kanssa tai ilman sitä voi lisätä mahdollisuuksiasi saada sydänkohtauksia, aivohalvauksia, rintasyöpää ja veritulppia. Estrogeenien käyttö progestiinien kanssa voi lisätä dementian riskiä. Sinun ja terveydenhuollon tarjoajasi tulee keskustella säännöllisesti siitä, tarvitsetko edelleen ESTRACE-hoitoa.
MIKÄ ESTRACE ON?
ESTRACE on lääke, joka sisältää estrogeenihormoneja.
MIHIN ESTRACEA KÄYTETÄÄN?
ESTRACE 1 mg:aa käytetään:
- vähentää kohtalaisia tai vaikeita kuumia aaltoja
Estrogeenit ovat naisen munasarjojen tuottamia hormoneja. 45-55-vuotiaana munasarjat lakkaavat yleensä tuottamasta estrogeenia. Tämä johtaa kehon estrogeenitasojen laskuun, mikä aiheuttaa "elämänmuutoksen" tai vaihdevuodet (kuukautisten loppuminen). Joskus molemmat munasarjat poistetaan leikkauksen aikana ennen luonnollista vaihdevuodet. Äkillinen estrogeenitason lasku aiheuttaa "kirurgisen vaihdevuodet".
Kun estrogeenitasot alkavat laskea, jotkut naiset kehittävät erittäin epämiellyttäviä oireita, kuten lämmön tunnetta kasvoissa, kaulassa ja rinnassa tai äkillisiä voimakkaita lämmön ja hikoilun tunteita ("kuumia aaltoja" tai "kuumia aaltoja"). Joillakin naisilla oireet ovat lieviä, eivätkä he tarvitse estrogeenia. Muilla naisilla oireet voivat olla vakavampia. Sinun ja terveydenhuollon tarjoajasi tulee keskustella säännöllisesti siitä, tarvitsetko edelleen ESTRACE-hoitoa.
Painoa kantava liikunta, kuten kävely tai juoksu, ja kalsiumin ottaminen D-vitamiinilisän kanssa voivat myös vähentää mahdollisuuksiasi saada vaihdevuosien jälkeinen osteoporoosi. On tärkeää keskustella harjoituksista ja ravintolisistä terveydenhuollon tarjoajan kanssa ennen niiden aloittamista.
hoitaa kuivumista, kutinaa ja polttamista emättimessä tai sen ympärillä, vaihdevuosiin liittyvää virtsaamisvaikeutta tai polttamista
Sinun ja terveydenhuollon tarjoajasi tulee keskustella säännöllisesti siitä, tarvitsetko edelleen ESTRACE-hoitoa näiden ongelmien hallitsemiseksi. Jos käytät ESTRACEa vain emättimessäsi ja sen ympäristössä esiintyvän kuivuuden, kutinan ja polttamisen hoitoon, keskustele terveydenhuollon ammattilaisen kanssa siitä, olisiko paikallisesti käytettävä emätintuote sinulle parempi.
- hoitaa tiettyjä tiloja, joissa nuoren naisen munasarjat eivät tuota riittävästi estrogeenia luonnollisesti
- hoitaa tietyntyyppisiä hormonaalisesta epätasapainosta johtuvaa epänormaalia emättimen verenvuotoa, kun lääkärisi ei ole löytänyt vakavaa syytä verenvuotoon
- hoitaa tiettyjä syöpiä erityistilanteissa, miehillä ja naisilla
- estää luiden ohenemista
Vaihdevuosista johtuva osteoporoosi on luuston ohenemista, joka tekee niistä heikompia ja helpommin murtuvia. Jos käytät ESTRACE 1mg -valmistetta vain ehkäisemään vaihdevuosien aiheuttamaa osteoporoosia, keskustele terveydenhuollon ammattilaisen kanssa siitä, voisiko jokin muu hoito tai lääke ilman estrogeenia olla parempi sinulle. Sinun ja terveydenhuollon tarjoajasi tulee keskustella säännöllisesti siitä, pitäisikö sinun jatkaa ESTRACE-hoitoa.
KENEN EI PIDÄ KÄYTTÄÄ ESTRACE 2 mg:aa?
Älä aloita ESTRACE 2 mg:n käyttöä, jos:
- sinulla on epätavallinen verenvuoto emättimestä, jota lääkärisi ei ole arvioinut (katso VAROITUKSET)
Epätavallinen verenvuoto emättimestä voi olla varoitusmerkki kohtusyövästä, varsinkin jos se tapahtuu vaihdevuosien jälkeen. Lääkärin on selvitettävä verenvuodon syy, jotta hän voi suositella oikeaa hoitoa. Estrogeenien ottaminen käymättä lääkärissä voi aiheuttaa sinulle vakavaa haittaa, jos emättimen verenvuoto johtuu kohtusyövästä.
- joilla on tai on ollut tiettyjä syöpiä
Estrogeenit voivat lisätä tiettyjen syöpien riskiä, mukaan lukien rinta- tai kohtusyöpä. Jos sinulla on tai on ollut syöpä, keskustele terveydenhuollon tarjoajan kanssa siitä, pitäisikö sinun ottaa ESTRACEa.
(Estrogeenit voivat auttaa tietyille potilaille, joilla on rinta- tai eturauhassyöpä.)
- sairastui aivohalvaukseen tai sydänkohtaukseen viimeisen vuoden aikana
- on tai on ollut veritulppia
- sinulla on tai on ollut maksaongelmia
- olet allerginen ESTRACElle tai jollekin sen ainesosalle
Katso tämän pakkausselosteen lopusta luettelo ESTRACEn ainesosista.
ESTRACE 2 mg tabletit sisältävät tartratsiinia, joka voi aiheuttaa allergisia reaktioita (mukaan lukien keuhkoastma) tietyillä herkillä henkilöillä. Vaikka FD&C Yellow No. 5 (tartratsiini) -herkkyyden yleinen ilmaantuvuus yleisväestössä on alhainen, sitä havaitaan usein potilailla, joilla on myös yliherkkyys aspiriinille.
- luulet olevasi raskaana
Kerro terveydenhuollon tarjoajallesi:
- jos imetät
ESTRACE 1mg:n sisältämä hormoni voi erittyä maitoon
- kaikista lääketieteellisistä ongelmistasi
Terveydenhuollon tarjoaja saattaa joutua tarkistamaan sinut tarkemmin, jos sinulla on tiettyjä sairauksia, kuten astma (hengityksen vinkuminen), epilepsia (kouristuskohtaukset), migreeni, endometrioosi, lupus, sydän-, maksa-, kilpirauhasen- tai munuaisongelmia tai sinulla on korkeat kalsiumtasot. veressäsi.
- kaikista käyttämistäsi lääkkeistä
Tämä sisältää reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät. Jotkut lääkkeet voivat vaikuttaa ESTRACE 1mg:n toimintaan. ESTRACE 1mg voi myös vaikuttaa muiden lääkkeiden tehoon.
- jos olet menossa leikkaukseen tai olet vuodelevossa
Sinun on ehkä lopetettava estrogeenien käyttö.
MITEN MINUN PITÄÄ OTTAA ESTRACEA?
1. Aloita pienimmällä annoksella ja keskustele terveydenhuollon tarjoajan kanssa siitä, kuinka hyvin tämä annos toimii sinulle.
2. Estrogeenia tulee käyttää pienimmällä mahdollisella annoksella hoidossasi vain niin kauan kuin on tarpeen. Sinun ja terveydenhuollon tarjoajasi tulee keskustella säännöllisesti (esimerkiksi 3–6 kuukauden välein) käyttämäsi annoksesta ja siitä, tarvitsetko edelleen ESTRACE-hoitoa.
MITÄ OVAT ESTROGEENIEN MAHDOLLISET HAITTAVAIKUTUKSET?
Harvemmin yleisiä mutta vakavia sivuvaikutuksia ovat:
- Rintasyöpä
- Kohdun syöpä
- Aivohalvaus
- Sydänkohtaus
- Verihyytymiä
- Dementia
- Sappirakon sairaus
- Munasarjasyöpä
Nämä ovat joitakin varoitusmerkkejä vakavista sivuvaikutuksista:
- Rintojen kyhmyt
- Epätavallinen verenvuoto emättimestä
- Huimaus ja pyörtyminen
- Muutoksia puheessa
- Kovat päänsäryt
- Rintakipu
- Hengenahdistus
- Kivut jaloissasi
- Muutokset näkökyvyssä
- Oksentelu
Soita välittömästi terveydenhuollon tarjoajallesi, jos saat jonkin näistä varoitusmerkeistä tai muista epätavallisista oireista, jotka koskevat sinua.
Yleisiä sivuvaikutuksia ovat:
- Päänsärky
- Rintojen kipu
- Epäsäännöllinen verenvuoto emättimestä tai tiputtelu
- Vatsa-/vatsakrampit, turvotus
- Pahoinvointi ja oksentelu
- Hiustenlähtö
Muita sivuvaikutuksia ovat:
- Korkea verenpaine
- Maksaongelmat
- Korkea verensokeri
- Nesteenpidätys
- Kohdun hyvänlaatuisten kasvainten ("fibroidien") suureneminen
- Ihon pilkullinen tummuminen, erityisesti kasvoilla
- Emättimen hiivatulehdus
Nämä eivät ole kaikki ESTRACEn mahdollisia sivuvaikutuksia. Lisätietoja saat terveydenhuollon tarjoajalta tai apteekista.
MITÄ VOIN TEHDÄ VÄHENTÄN TODENNÄKÖISYYTTÄNI ESTRACEN VAKAVAT HAITTAVAIKUTUKSET?
Jos käytät estrogeeneja, voit vähentää riskejäsi tekemällä seuraavat asiat:
- Keskustele terveydenhuollon tarjoajan kanssa:
- Ole varuillasi ongelmien varalta
Jos jokin näistä varoitussignaaleista (tai muista epätavallisista oireista) ilmenee, kun käytät estrogeenia, ota välittömästi yhteys lääkäriisi:
Epänormaali verenvuoto emättimestä (mahdollinen kohdun syöpä)
Kivut pohkeissa tai rinnassa, äkillinen hengenahdistus tai veren yskiminen (mahdollinen hyytymä jaloissa tai keuhkoissa)
Vaikea päänsärky tai oksentelu, huimaus, pyörtyminen, näkö- tai puhemuutokset, käsivarren tai jalan heikkous tai tunnottomuus (mahdollinen hyytymä aivoissa tai silmässä)
Rintojen kyhmyt (mahdollinen rintasyöpä; pyydä lääkäriäsi tai terveydenhuollon ammattilaista näyttämään sinulle, kuinka rintasi tutkitaan kuukausittain)
Ihon tai silmien keltaisuus (mahdollinen maksasairaus)
Vatsan kipu, turvotus tai arkuus (mahdollinen sappirakon ongelma)
YLEISTIETOA ESTRACE:N TURVALLISTA JA TEHOKASTA KÄYTTÖÄ
Lääkkeitä määrätään joskus sairauksiin, joita ei ole mainittu potilasohjeissa. Älä käytä ESTRACE 2 mg:aa sairauksiin, joihin sitä ei ole määrätty. Älä anna ESTRACE 1 mg:aa muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
PIDÄ ESTRACE POISSA LASTEN ULOTTUVILTA
Tämä pakkausseloste sisältää yhteenvedon tärkeimmistä ESTRACE-tiedoista. Jos haluat lisätietoja, keskustele terveydenhuollon tarjoajan tai apteekkihenkilökunnan kanssa. Voit kysyä ESTRACE-tietoa, joka on kirjoitettu terveydenhuollon ammattilaisille. Saat lisätietoja soittamalla maksuttomaan numeroon 1-800-521-8813.
MITÄ AINEOSAT ESTRACESSA OVAT?
Ei-aktiiviset ainesosat: Kolloidinen piidioksidi, maissitärkkelys, kaksiemäksinen kalsiumfosfaatti, laktoosimonohydraatti, magnesiumstearaatti ja natriumtärkkelysglykolaatti. Lisäksi 1 mg sisältää myös FD&C blue no. 1 alumiinijärvi ja D&C punainen nro. 27 alumiinijärvi. 2 mg sisältää myös FD&C blue no. 1 alumiinijärvi ja FD&C keltainen nro. 5 (tartratsiini) alumiinijärvi.
