Parlodel 2.5mg Bromocriptine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Parlodel on ja miten sitä käytetään?
Parlodel 2,5 mg on reseptilääke, jota käytetään hyperprolaktinemiaan liittyvien toimintahäiriöiden, Parkinsonin taudin ja akromegalian oireiden hoitoon. Parlodel 2,5 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Parlodel 2,5 mg kuuluu lääkeryhmään, jota kutsutaan antiparkinson-aineiksi, dopamiiniagonisteiksi; hyperprolaktinemia; Metabolia ja endokriininen, muut.
Ei tiedetä, onko Parlodel 2,5 mg turvallinen ja tehokas alle 10-vuotiaille lapsille.
Mitkä ovat Parlodelin mahdolliset sivuvaikutukset?
Parlodel voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nokkosihottuma,
- vaikeuksia hengittää,
- kasvojen, huulten, kielen tai kurkun turvotus,
- näköongelmia,
- jatkuva nuha,
- rintakipu,
- kipua hengitettäessä,
- nopea syke,
- nopea hengitys,
- hengenahdistus,
- selkäkipu,
- turvotus nilkoissasi tai jaloissasi,
- virtsaa vähemmän tai ei ollenkaan,
- hämmennystä,
- hallusinaatiot,
- huimaus,
- päänsärky,
- nälkä,
- heikkous,
- hikoilu,
- vapina,
- ärtyneisyys,
- keskittymisvaikeuksia,
- tahattomat lihasliikkeet,
- tasapainon tai koordinaation menetys,
- veriset tai tervamaiset ulosteet,
- yskii verta,
- oksennusta, joka näyttää kahvinporolta,
- kova päänsärky,
- näön hämärtyminen,
- surina korvissasi,
- ahdistus,
- hämmennystä,
- rintakipu,
- hengenahdistus,
- epätasaiset sydämenlyönnit ja
- kohtauksia
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Parlodel 2,5 mg:n yleisimmät sivuvaikutukset ovat:
- huimaus,
- pyörivä tunne,
- lievä uneliaisuus,
- väsymys,
- lievä päänsärky,
- masentunut,
- unihäiriöt (unettomuus),
- kuiva suu,
- tukkoinen nenä,
- ärtynyt vatsa,
- pahoinvointi,
- oksentelua,
- vatsakipu,
- ruokahalun menetys,
- ripuli,
- ummetus ja
- kylmä tunne tai tunnottomuus sormissa
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikki Parlodelin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
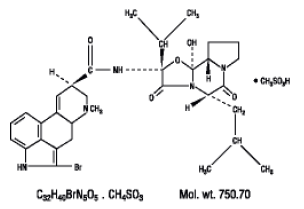
Parlodel® (bromikriptiinimesylaatti) on torajyväjohdannainen, jolla on voimakas dopamiinireseptoriagonistivaikutus. Jokainen Parlodel® (bromikriptiinimesylaatti) SnapTabs® -tabletti suun kautta annettavaksi sisältää 2½ mg ja jokainen kapseli sisältää 5 mg bromokriptiiniä (mesylaattina). Bromokriptiinimesylaatti on kemiallisesti nimetty Ergotaman-3',6',18-trioni, 2-bromi-12'-hydroksi-2'-(1-metyylietyyli)-5'-( 2-metyylipropyyli)-, (5'a)-monometaanisulfonaatti (suola).
Rakennekaava on:
2½ mg SnapTabs®
Aktiivinen ainesosa: bromokriptiinimesylaatti, USP
Ei-aktiiviset ainesosat: kolloidinen piidioksidi, laktoosi, magnesiumstearaatti, povidoni, tärkkelys ja toinen ainesosa
5 mg kapselit
Aktiivinen ainesosa: bromokriptiinimesylaatti, USP
Ei-aktiiviset ainesosat: kolloidinen piidioksidi, gelatiini, laktoosi, magnesiumstearaatti, punainen rautaoksidi, piidioksidi, natriumlauryylisulfaatti, tärkkelys, titaanidioksidi, keltainen rautaoksidi ja muu ainesosa
INDIKAATIOT
Hyperprolaktinemiaan liittyvät toimintahäiriöt
Parlodel (bromikriptiinimesylaatti) on tarkoitettu hoitoon liittyvien toimintahäiriöiden hoitoon hyperprolaktinemia mukaan lukien amenorrea kanssa tai ilman galaktorrea, hedelmättömyys tai hypogonadismi . Parlodel 2,5 mg -hoito on tarkoitettu potilaille, joilla on prolaktiinia erittävät adenoomat , joka voi olla taustalla oleva endokrinopatia, joka myötävaikuttaa yllä mainittuihin kliinisiin oireisiin. Vähentäminen sisään kasvaimen koko on osoitettu sekä mies- että naispotilailla, joilla on makroadenooma. Tapauksissa, joissa adenektomia valitaan, Parlodel 2,5 mg -hoitokuuria voidaan käyttää tuumorin massan vähentämiseen ennen leikkausta.
Akromegalia
Parlodel 2,5 mg -hoito on tarkoitettu akromegalian hoitoon. Parlodel-hoito yksinään tai lisähoitona aivolisäkkeen säteilytyksen tai leikkauksen kanssa alentaa seerumin kasvuhormonitasoa 50 % tai enemmän noin puolella hoidetuista potilaista, vaikkakaan ei yleensä normaalille tasolle.
Koska aivolisäkkeen ulkoisen säteilyn vaikutukset eivät ehkä ole maksimaalisia useisiin vuosiin, Parlodel 2,5 mg:n lisähoito tarjoaa potentiaalista hyötyä ennen kuin säteilytyksen vaikutukset näkyvät.
Parkinsonin tauti
Parlodel 2,5 mg SnapTabs tai kapselit on tarkoitettu idiopaattisen tai postenkefaliittisen Parkinsonin taudin merkkien ja oireiden hoitoon. Levodopan (yksin tai perifeerisen dekarboksylaasi-inhibiittorin) lisähoitona Parlodel-hoito voi tarjota terapeuttisia lisähyötyjä potilaille, jotka ovat tällä hetkellä optimaalisilla levodopaannoksilla, joilla on alkamassa heikentyä (kehittää sietokyky) levodopahoitoa kohtaan ja ne, jotka kokevat levodopahoidon aikana "annoksen loppumisen epäonnistumisen". Parlodel 2,5 mg -hoito saattaa mahdollistaa levodopan ylläpitoannoksen pienentämisen ja voi siten parantaa pitkäaikaiseen levodopahoitoon liittyvien haittavaikutusten, kuten epänormaalien tahattomien liikkeiden (esim. moottoritoiminto ("on-off" -ilmiö). Parlodel 2,5 mg -hoidon jatkuvaa tehoa yli 2 vuoden hoidon aikana ei ole osoitettu.
Tiedot eivät riitä arvioimaan äskettäin diagnosoidun Parkinsonin taudin Parlodel-hoidosta saatavaa mahdollista hyötyä. Tutkimukset ovat kuitenkin osoittaneet merkittävästi enemmän haittavaikutuksia (erityisesti pahoinvointia, hallusinaatioita, sekavuutta ja hypotensiota) Parlodel-hoitoa saaneilla potilailla kuin levodopa/karbidopa-hoitoa saaneilla potilailla. Potilaat, jotka eivät reagoi levodopaan, ovat huonoja ehdokkaita Parlodel-hoitoon.
ANNOSTELU JA HALLINNOINTI
Kenraali
On suositeltavaa, että Parlodel (bromikriptiinimesylaatti) otetaan ruoan kanssa. Potilaita tulee arvioida usein annoksen nostamisen aikana, jotta voidaan määrittää pienin annos, joka tuottaa terapeuttisen vasteen.
Hyperprolaktineemiset indikaatiot
Parlodel SnapTabsin aloitusannos aikuisille on yksi ½–1 2½ mg:n tabletti päivässä. Hoito-ohjelmaan voidaan lisätä yksi 2½ mg:n tabletti siedettävän 2–7 päivän välein, kunnes saavutetaan optimaalinen terapeuttinen vaste. Terapeuttinen annos vaihteli 2,5-15 mg päivässä kliinisesti tutkituilla aikuisilla.
Perustuu rajoitettuun tietoon 11–15-vuotiaista lapsista (ks Käyttö lapsille ) aloitusannos on yksi ½ - yksi 2½ mg:n tabletti vuorokaudessa. Annosta voidaan joutua suurentamaan siedetyksi, kunnes terapeuttinen vaste saavutetaan. Terapeuttinen annos vaihteli 2,5-10 mg päivässä lapsille, joilla oli prolaktiinia erittävät aivolisäkkeen adenoomat.
Pitkittyneen Parlodel-altistuksen todennäköisyyden vähentämiseksi, jos epäilty raskaus tulee, Parlodel 2,5 mg -hoidon yhteydessä tulee käyttää mekaanista ehkäisyä, kunnes normaalit ovulaatiokuukautiskierrot ovat palautuneet. Ehkäisy voidaan sitten lopettaa potilailta, jotka haluavat raskautta.
Jos kuukautiset eivät tämän jälkeen tule 3 päivän kuluessa odotetusta päivämäärästä, Parlodel 2,5 mg -hoito tulee keskeyttää ja tehdä raskaustesti.
Akromegalia
Käytännössä kaikilla akromegaliapotilailla, jotka saavat terapeuttista hyötyä Parlodel 2,5 mg:sta, on myös alentunut verenkierrossa oleva kasvuhormonitaso. Siksi säännöllinen verenkierron kasvuhormonitasojen arviointi toimii useimmissa tapauksissa oppaana määritettäessä Parlodelin terapeuttista potentiaalia. Jos lyhyen Parlodel-hoidon kokeilun jälkeen kasvuhormonitasot eivät ole laskeneet merkittävästi, sairauden kliiniset piirteet on arvioitava huolellisesti ja jos muutoksia ei ole tapahtunut, annoksen muuttamista tai hoidon lopettamista tulee harkita. .
Suositeltu aloitusannos on yksi ½–1 2½ mg:n Parlodel SnapTabs -tabletti, kun lopetat (ruoan kanssa) 3 päivän ajan. Hoito-ohjelmaan tulee lisätä yksi ½–1 SnapTabs-tabletti 3–7 päivän välein, kunnes potilas saa optimaalisen terapeuttisen hyödyn. Potilaat tulee arvioida uudelleen kuukausittain ja annosta muuttaa kasvuhormonin vähenemisen tai kliinisen vasteen perusteella. Parlodelin tavallinen optimaalinen terapeuttinen annosalue vaihtelee 20-30 mg/vrk useimmilla potilailla. Suurin annos ei saa ylittää 100 mg/vrk.
Potilaat, joita hoidetaan aivolisäkkeen säteilytyksellä, tulee keskeyttää Parlodel 2,5 mg -hoidosta vuosittain, jotta voidaan arvioida sekä säteilyn kliinisiä vaikutuksia sairausprosessiin että Parlodel-hoidon vaikutuksia. Yleensä 4-8 viikon varoaika on riittävä tähän tarkoitukseen. Merkkien/oireiden uusiutuminen tai kasvuhormonin nousu viittaa siihen, että tautiprosessi on edelleen aktiivinen, ja lisähoitoa Parlodel-hoitoon tulee harkita.
Parkinsonin tauti
Parlodel 2,5 mg -hoidon perusperiaate on aloittaa hoito pienellä annoksella ja päivittäistä annosta nostetaan yksilöllisesti hitaasti, kunnes saavutetaan maksimaalinen terapeuttinen vaste. Levodopa-annostusta tulee säilyttää tämän aloitusjakson aikana, jos mahdollista. Parlodel 2,5 mg:n aloitusannos on yksi ½ 2½ mg:n SnapTabs-tabletista kahdesti päivässä aterioiden yhteydessä. Arvioinnit suositellaan 2 viikon välein annostitrauksen aikana sen varmistamiseksi, ettei pienintä annosta, joka tuottaa optimaalisen terapeuttisen vasteen, ylitetä. Tarvittaessa annosta voidaan suurentaa 14–28 päivän välein 2½ mg/vrk aterioiden yhteydessä. Jos levodopan annosta on suositeltavaa pienentää haittavaikutusten vuoksi, Parlodelin vuorokausiannos, jos sitä nostetaan, tulee saavuttaa vähitellen pienin (2½ mg) lisäyksin.
Parlodelin turvallisuutta ei ole osoitettu yli 100 mg/vrk annoksilla.
MITEN TOIMITETAAN
Parlodel (bromikriptiinimesylaatti) SnapTabs
2½ mg
Parlodel on saatavana pulloissa, joissa on 30 ja 100 2 ½ mg tablettia, jokainen pullo sisältää kuivausainetta.
Pyöreät, luonnonvalkoiset, viistoreunaiset SnapTab-kortit, joista jokainen sisältää 2½ mg bromokriptiiniä (mesylaattina). Toiselle puolelle kaiverrettu "PARLODEL 2½" ja uurteiselle puolelle "017". Täyttää USP:n liukenemistestiä 1.
Paketit 30 - NDC 30698-202-30 100 kappaleen paketit - NDC 30698-202-01
Parlodel (bromokriptiinimesylaatti) -kapselit
5 mg
Karamelli-valkoiset kapselit, joista jokainen sisältää 5 mg bromokriptiiniä (mesylaattina). Toiselle puolelle punaisella musteella painettu "PARLODEL 5 mg" ja toiselle puolelle "102".
Paketit 30 - NDC 30698-201-30 100 kappaleen paketit - NDC 30698-201-01
Säilytä Ja Annostele
Säilytä 68° - 77°F (20° - 25°C); 15 - 30 °C (59–86 °F) sallitut retket [Katso USP:n ohjaama huonelämpötila].
Annostele tiiviiseen, valonkestävään astiaan.
Valmistaja ja jakelija: Validus Pharmaceuticals LLC Parsippany, NJ 07054. Tarkistettu: heinäkuu 2021
SIVUVAIKUTUKSET
Kliinisistä tutkimuksista saadut haittavaikutukset
Hyperprolaktineemiset indikaatiot
Haittavaikutusten ilmaantuvuus on melko korkea (69 %), mutta ne ovat yleensä lieviä tai kohtalaisia. Hoito keskeytettiin noin 5 %:lla potilaista haittavaikutusten vuoksi. Näitä ovat alenevassa järjestyksessä: pahoinvointi (49 %), päänsärky (19 %), huimaus (17 %), väsymys (7 %), huimaus (5 %), oksentelu (5 %), vatsakrampit (4 %) , nenän tukkoisuus (3 %), ummetus (3 %), ripuli (3 %) ja uneliaisuus (3 %).
Parlodel-hoitoon (bromikriptiinimesylaatti) voi liittyä lievää verenpainetta alentavaa vaikutusta. Haittavaikutusten esiintymistä voidaan vähentää pienentämällä annosta tilapäisesti ½ SnapTabs-tablettiin 2 tai 3 kertaa päivässä. Joitakin aivo-selkäydinnesteen rinorreatapauksia on raportoitu potilailla, jotka ovat saaneet Parlodel 2,5 mg:aa suurten prolaktinoomien hoitoon. Tätä on esiintynyt harvoin, yleensä vain potilailla, jotka ovat saaneet aiemmin transsfenoidaalista leikkausta, aivolisäkkeen säteilyä tai molempia ja jotka ovat saaneet Parlodel 2,5 mg kasvaimen uusiutumisen hoitoon. Sitä voi esiintyä myös aiemmin hoitamattomilla potilailla, joiden kasvain ulottuu sivuonteloon.
Akromegalia
Yleisimmät Parlodel 2,5 mg:lla hoidetuilla akromegaliapotilailla havaitut haittavaikutukset olivat: pahoinvointi (18 %), ummetus (14 %), posturaalinen/ortostaattinen hypotensio (6 %), anoreksia (4 %), suun kuivuminen/nenän tukkoisuus (4 %). %), ruoansulatushäiriöt/dyspepsia (4 %), digitaalinen vasospasmi (3 %), uneliaisuus/väsymys (3 %) ja oksentelu (2 %).
Harvempia haittavaikutuksia (alle 2 %) olivat maha-suolikanavan verenvuoto, huimaus, Raynaud'n oireyhtymän paheneminen, päänsärky ja pyörtyminen. Harvinainen (alle 1 %) hiustenlähtö, alkoholin voimistuminen, pyörtyminen, huimaus, rytmihäiriöt, kammiotakykardia, vähentynyt unen tarve, näköharhot, väsymys, hengenahdistus, bradykardia, huimaus, parestesia, hitaus, vasovagaalkohtaus, harhaluuloinen psykoosi, paranoia , unettomuutta, voimakasta huimausta, heikentynyttä kylmänsietokykyä, korvien pistelyä, kasvojen kalpeutta ja lihaskramppeja on raportoitu.
Parkinsonin tauti
Kliinisissä tutkimuksissa, joissa Parlodel 2,5 mg annettiin samanaikaisesti levodopa/karbidopa-annoksen pienentämisen kanssa, yleisimmät uudet haittavaikutukset olivat: pahoinvointi, epänormaalit tahattomat liikkeet, hallusinaatiot, sekavuus, "on-off" -ilmiö, huimaus, uneliaisuus, pyörtyminen/pyörtyminen, oksentelu, voimattomuus, epämukavuus vatsassa, näköhäiriöt, ataksia, unettomuus, masennus, hypotensio, hengenahdistus, ummetus ja huimaus.
Harvemmin esiintyviä haittavaikutuksia ovat: anoreksia, ahdistuneisuus, blefarospasmi, suun kuivuminen, dysfagia, jalkojen ja nilkkojen turvotus, erytromelalgia, epileptinen kohtaus, väsymys, päänsärky, uneliaisuus, ihon laikkuminen, nenän tukkoisuus, hermostuneisuus, painajaiset, parestesia, ihottuma, virtsaamistiheys, virtsankarkailu, virtsanpidätys ja harvoin ergotismin merkit ja oireet, kuten sormien pistely, kylmät jalat, puutuminen, jalkojen lihaskrampit tai Raynaud'n oireyhtymän paheneminen.
Laboratoriokokeiden poikkeavuuksia voivat olla veren ureatypen, SGOT:n, SGPT:n, GGPT:n, CPK:n, alkalisen fosfataasin ja virtsahapon nousut, jotka ovat yleensä ohimeneviä eikä niillä ole kliinistä merkitystä.
Haittavaikutukset markkinoinnin jälkeisestä kokemuksesta
Seuraavia haittavaikutuksia on raportoitu Parlodel-valmisteen (kaikki indikaatiot yhdistettynä) hyväksynnän jälkeen. Koska spontaanisti raportoiduista haittavaikutuksista ilmoitetaan vapaaehtoisesti epävarman kokoisesta populaatiosta, niiden esiintymistiheyttä ei yleensä voida luotettavasti arvioida tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Psyykkiset häiriöt: Sekavuus, psykomotorinen kiihtyneisyys/kiihtyneisyys, hallusinaatiot, psykoottiset häiriöt, unettomuus, libidon lisääntyminen, hyperseksuaalisuus ja impulssihallinta/pakonomaiset käytökset (mukaan lukien uhkapelaaminen, kuluttaminen ja muut voimakkaat halut).
Hermoston häiriöt: Päänsärky, uneliaisuus, huimaus, dyskinesia, uneliaisuus, parestesia, liiallinen päiväsaikainen uneliaisuus, äkillinen nukahtaminen.
Silmäsairaudet: Näköhäiriö, näön hämärtyminen.
Korvan ja labyrintin häiriöt: Tinnitus.
Sydämen häiriöt: Perikardiaalinen effuusio, supistava perikardiitti, takykardia, bradykardia, rytmihäiriöt, sydänläppäfibroosi.
Verisuonihäiriöt: Hypotensio, ortostaattinen hypotensio (erittäin harvoin pyörtymiseen johtava), kylmän aiheuttama sormien ja varpaiden palautuva kalpeus (erityisesti potilailla, joilla on ollut Raynaud'n ilmiö).
Hengityselimet, rintakehä ja välikarsina: Nenän tukkoisuus, pleuraeffuusio, keuhkopussin fibroosi, keuhkopussintulehdus, keuhkofibroosi, hengenahdistus.
Ruoansulatuskanavan häiriöt: Pahoinvointi, ummetus, oksentelu, suun kuivuminen, ripuli, vatsakipu, retroperitoneaalinen fibroosi, maha-suolikanavan haavauma, maha-suolikanavan verenvuoto.
Ihon ja ihonalaisen kudoksen häiriöt: Allergiset ihoreaktiot, hiustenlähtö.
Tuki- ja liikuntaelimistön ja sidekudoksen häiriöt: Jalkakrampit.
Yleiset häiriöt ja antopaikan haitat: Väsymys, perifeerinen turvotus, pahanlaatuista neuroleptioireyhtymää muistuttava oireyhtymä Parlodel-hoidon äkillisen lopettamisen yhteydessä, vieroitusoireet (mukaan lukien apatia, ahdistuneisuus, masennus, väsymys, unettomuus, hikoilu ja kipu) hoidon vähentyessä tai lopettamisen jälkeen (ks. VAROTOIMENPITEET ).
Muissa olosuhteissa havaitut haittatapahtumat
Synnytyksen jälkeiset potilaat (katso yllä VAROITUKSET )
Parlodel 2,5 mg:n synnytyksen jälkeisissä tutkimuksissa 23 prosentilla hoidetuista synnytyksen jälkeisistä potilaista oli vähintään yksi sivuvaikutus, mutta ne olivat yleensä lieviä tai kohtalaisia. Hoito keskeytettiin noin 3 %:lla potilaista. Yleisimmin esiintyneet haittavaikutukset olivat: päänsärky (10 %), huimaus (8 %), pahoinvointi (7 %), oksentelu (3 %), väsymys (1,0 %), pyörtyminen (0,7 %), ripuli (0,4 %) ja kouristukset (0,4 %). Verenpaineen laskua (≥ 20 mm Hg systolinen ja ≥ 10 mm Hg diastolinen) esiintyi 28 %:lla potilaista vähintään kerran ensimmäisten 3 synnytyksen jälkeisen päivän aikana; nämä olivat yleensä ohimeneviä. Raportit pyörtymisestä synnytyksen aikana voivat mahdollisesti liittyä tähän vaikutukseen. Markkinoille tulon jälkeen Yhdysvalloissa raportoituihin vakaviin haittavaikutuksiin kuuluu 72 kohtauskohtausta (mukaan lukien 4 status epilepticus -tapausta), 30 aivohalvaustapausta ja 9 sydäninfarktitapausta synnytyksen jälkeen. Kohtauksiin ei välttämättä liittynyt verenpainetaudin kehittymistä. Lakkaamaton ja usein asteittain vaikea päänsärky, johon joskus liittyy näköhäiriöitä, joita usein edeltää tunteja tai päiviä useita kohtauksia ja/tai aivohalvauksia. Useimmilla potilailla ei ollut näyttöä mistään raskauden hypertensiivisistä häiriöistä, mukaan lukien eklampsia, preeklampsia tai raskauden aiheuttama hypertensio. Yksi aivohalvaustapaus liittyi sagittaalisiin poskiontelotukoksiin ja toinen aivo- ja pikkuaivojen vaskuliittiin. Yksi sydäninfarktitapaus liittyi selittämättömään disseminoituneeseen intravaskulaariseen koagulaatioon ja toinen tapahtui toisen torajyväalkaloidin käytön yhteydessä. Näiden haittavaikutusten yhteyttä Parlodel-hoitoon ei ole varmistettu.
Harvinaisissa tapauksissa on raportoitu vakavia haittavaikutuksia, kuten kohonnutta verenpainetta, sydäninfarktia, kohtauksia, aivohalvausta tai psyykkisiä häiriöitä Parlodel-hoitoa saaneilla synnytyksen jälkeen. Joillakin potilailla kohtausten tai aivohalvauksen kehittymistä edelsi vaikea päänsärky ja/tai ohimenevät näköhäiriöt. Vaikka näiden tapahtumien syy-yhteys lääkkeeseen on epävarma, Parlodel-hoitoa saavilla synnytyksen jälkeen naisilla on suositeltavaa seurata verenpainetta säännöllisesti. Jos ilmenee kohonnutta verenpainetta, vaikeaa, etenevää tai hellittämätöntä päänsärkyä (näköhäiriöineen tai ilman) tai merkkejä keskushermostotoksisuudesta, Parlodel 2,5 mg:n anto tulee lopettaa ja potilas on arvioitava viipymättä.
Erityistä varovaisuutta on noudatettava potilailla, joita on äskettäin hoidettu tai jotka saavat samanaikaista hoitoa lääkkeillä, jotka voivat muuttaa verenpainetta, esim. vasokonstriktorit, kuten sympatomimeetit tai torajyväalkaloidit, mukaan lukien ergometriini tai metyyliergometriini, eikä niiden samanaikaista käyttöä synnytyksen aikana suositella.
Jos haluat ilmoittaa EPÄILLEISTÄ HAITTAVAIKUTUKSISTA, ota yhteyttä Validus Pharmaceuticals LLC:hen numeroon 1-866-982-5438 tai FDA:han numeroon 1-800-FDA-1088 tai www.fda.gov/medwatch.
HUUMEIDEN VUOROVAIKUTUKSET
Parlodelin käytön riskiä yhdessä muiden lääkkeiden kanssa ei ole arvioitu systemaattisesti, mutta alkoholi saattaa voimistaa Parlodelin sivuvaikutuksia. Parlodel 2,5 mg voi olla vuorovaikutuksessa dopamiiniantagonistien, butyrofenonien ja tiettyjen muiden aineiden kanssa. Näihin luokkiin kuuluvat yhdisteet heikentävät Parlodelin tehoa: fenotiatsiinit, haloperidoli, metoklopramidi ja pimotsidi. Bromokriptiini on CYP3A4:n substraatti. Siksi on noudatettava varovaisuutta annettaessa samanaikaisesti lääkkeitä, jotka ovat voimakkaita tämän entsyymin estäjiä (kuten atsoliantimykootit, HIV-proteaasin estäjät). Makrolidiantibioottien, kuten erytromysiinin, samanaikaisen käytön on osoitettu nostavan bromokriptiinin pitoisuutta plasmassa (keskimääräiset AUC- ja Cmax-arvot nousivat 3,7-kertaisesti ja 4,6-kertaiset).1 Akromegaliapotilaiden samanaikainen hoito bromokriptiinillä ja oktreotidilla johti plasman nousuun. bromokriptiinipitoisuudet (bromokriptiinin AUC nousi noin 38 %).4 Parlodelin samanaikaista käyttöä muiden torajyväalkaloidien kanssa ei suositella. Annoksen säätäminen voi olla tarpeen tapauksissa, joissa käytetään suuria bromokriptiiniannoksia (kuten Parkinsonin taudin indikaatio).
VAROITUKSET
Koska hyperprolaktinemiaa, johon liittyy amenorrea/galaktorrea ja hedelmättömyyttä, on havaittu potilailla, joilla on aivolisäkkeen kasvaimia, aivolisäkkeen täydellinen arviointi on aiheellista ennen Parlodel-hoitoa (bromikriptiinimesylaatti).
Jos raskaus tulee Parlodel-hoidon aikana, näiden potilaiden huolellinen seuranta on pakollista. Prolaktiinia erittävät adenoomat voivat laajentua ja näköhermojen tai muiden kallon hermojen puristuminen voi tapahtua, jolloin aivolisäkkeen hätäleikkaus tulee tarpeelliseksi. Useimmissa tapauksissa pakkaus poistuu toimituksen jälkeen. Parlodel 2,5 mg -hoidon uudelleen aloittamisen on raportoitu parantavan näkökenttiä potilailla, joilla hermopuristus on tapahtunut raskauden aikana. Parlodel 2,5 mg -hoidon turvallisuutta äidille ja sikiölle raskauden aikana ei ole osoitettu.
Parlodel 2,5 mg:n käyttöön on liittynyt uneliaisuutta ja äkillisiä nukahtamisjaksoja, erityisesti Parkinsonin tautia sairastavilla potilailla. Äkillistä nukahtamista päivittäisten toimien aikana, joissain tapauksissa ilman tietoisuutta tai varoitusmerkkejä, on raportoitu. Potilaille on kerrottava tästä ja heitä on kehotettava olemaan ajamatta autoa tai käyttämättä koneita bromokriptiinihoidon aikana. Potilaat, jotka ovat kokeneet uneliaisuutta ja/tai äkillistä nukahtamista, eivät saa ajaa autoa tai käyttää koneita. Lisäksi voidaan harkita annoksen pienentämistä tai hoidon lopettamista.
Oireista hypotensiota voi esiintyä potilailla, joita hoidetaan Parlodelilla missä tahansa indikaatiossa. Parlodelilla tehdyissä synnytyksen jälkeisissä tutkimuksissa lähes 30 %:lla Parlodel-hoitoa saaneista potilaista on havaittu makuuasennossa yli 20 mm:n ja diastolisen paineen laskua yli 10 mm Hg. Toisinaan makuuasennossa systolinen paine laski jopa 50-59 mmHg.
Koska varsinkin hoidon ensimmäisten päivien aikana saattaa toisinaan esiintyä verenpainetta alentavia reaktioita, jotka heikentävät vireyttä, on noudatettava erityistä varovaisuutta ajoneuvoa ajaessa tai koneita käytettäessä.
Vaikka joillakin potilailla esiintyy hypotensiota Parlodel 2,5 mg -hoidon alussa, harvoissa tapauksissa vakavia haittatapahtumia, mukaan lukien verenpainetauti, sydäninfarkti, kohtaukset ja aivohalvaus, on raportoitu synnytyksen jälkeen saaneilla naisilla, joita on hoidettu Parlodel 2,5 mg imetyksen estoon. Hypertensiota on raportoitu, joskus hoidon alussa, mutta usein kehittyy hoidon toisella viikolla; kouristuskohtauksia on myös raportoitu sekä aiemman hypertension kehittymisen kanssa että ilman sitä; aivohalvausta on raportoitu enimmäkseen synnytyksen jälkeisillä potilailla, joiden synnytystä edeltävä ja synnytysvaihe on ollut mutkaton. Monet näistä potilaista, jotka kokivat kohtauksia (mukaan lukien status epilepticus -tapaukset) ja/tai aivohalvauksia, ilmoittivat kehittävänsä jatkuvan ja usein asteittain vaikean päänsäryn tunteja tai päiviä ennen akuuttia tapahtumaa. Joitakin aivohalvauksia ja kohtauksia edelsi myös näköhäiriöt (näön hämärtyminen ja ohimenevä aivokuoren sokeus). Myös akuutteja sydäninfarktitapauksia on raportoitu.
Vaikka syy-yhteyttä Parlodel-annon ja synnyttäneiden naisten verenpainetaudin, kohtausten, aivohalvausten ja sydäninfarktin välillä ei ole osoitettu, lääkkeen käyttöä fysiologisen imetyksen ehkäisyyn tai hallitsematonta verenpainetautia sairastaville potilaille ei suositella. Potilailta, joita hoidetaan hyperprolaktinemiaan, Parlodel 2,5 mg:n käyttö tulee keskeyttää, kun raskaus todetaan (ks. VAROTOIMENPITEET , Hyperprolaktineemiset tilat ). Siinä tapauksessa, että Parlodel 2,5 mg otetaan uudelleen käyttöön nopeasti laajenevan makroadenooman hallintaan (ks. VAROTOIMENPITEET , Hyperprolaktineemiset tilat ja potilaalla on raskauden hypertensiivinen häiriö, Parlodel-hoidon jatkamisen hyötyjä on punnittava sen käytön mahdolliseen riskiin raskauden hypertensiivisen häiriön aikana. Kun Parlodelia käytetään akromegalian tai Parkinsonin taudin hoitoon potilailla, jotka myöhemmin tulevat raskaaksi, on tehtävä päätös siitä, onko hoito edelleen lääketieteellisesti tarpeellista vai voidaanko se keskeyttää. Jos sitä jatketaan, lääke on lopetettava niiltä, joilla saattaa esiintyä raskauden hypertensiivisiä häiriöitä (mukaan lukien eklampsia, preeklampsia tai raskauden aiheuttama hypertensio), ellei Parlodel-hoidon lopettamista pidetä lääketieteellisesti vasta-aiheisena. Koska Parlodelin ja muiden torajyväalkaloidien välillä voi olla yhteisvaikutuksia, näiden lääkkeiden samanaikaista käyttöä ei suositella. Verenpaineen säännöllinen seuranta, erityisesti hoidon ensimmäisten viikkojen aikana, on järkevää. Jos ilmenee kohonnutta verenpainetta, vaikeaa, etenevää tai hellittämätöntä päänsärkyä (näköhäiriön kanssa tai ilman) tai merkkejä keskushermostotoksisuudesta, lääkehoito on lopetettava ja potilas on arvioitava viipymättä. Erityistä huomiota tulee kiinnittää potilaisiin, joita on äskettäin hoidettu tai jotka saavat samanaikaista hoitoa verenpainetta muuttavilla lääkkeillä. Niiden samanaikaista käyttöä synnytyksen aikana ei suositella.
Parlodel-hoitoa saaneilla potilailla, erityisesti pitkäaikaisessa ja suuriannoksisessa hoidossa, on raportoitu keuhkopussin ja sydänpussin effuusiota sekä keuhkopussin ja keuhkofibroosia ja supistavaa perikardiittia. Potilaat, joilla on selittämättömiä pleeuropulmonaalisia häiriöitä, tulee tutkia perusteellisesti ja Parlodel 2,5 mg -hoidon lopettamista tulee harkita. Niissä tapauksissa, joissa Parlodel 2,5 mg -hoito lopetettiin, muutokset palautuivat hitaasti kohti normaaleja.
Joillakin Parlodel-hoitoa saaneilla potilailla, erityisesti pitkäaikaisessa ja suuriannoksisessa hoidossa, on raportoitu retroperitoneaalista fibroosia. Retroperitoneaalisen fibroosin tunnistamisen varmistamiseksi varhaisessa palautuvassa vaiheessa on suositeltavaa, että sen ilmenemismuotoja (esim. selkäkipu, alaraajojen turvotus, munuaisten vajaatoiminta) seurataan tässä potilasryhmässä. Parlodel-lääkitys tulee keskeyttää, jos retroperitoneumissa todetaan tai epäillään fibroottisia muutoksia.
VAROTOIMENPITEET
Kenraali
On raportoitu potilaista, jotka ovat kokeneet voimakasta halua pelata uhkapeliä, lisääntynyttä seksuaalista halua, voimakasta halua käyttää rahaa hallitsemattomasti ja/tai muita voimakkaita haluja ja kyvyttömyyttä hallita näitä haluja yhden tai useamman lääkkeen käytön aikana, mukaan lukien Parlodel 2,5 mg , jotka lisäävät keskushermoston dopaminergistä sävyä. Joissakin tapauksissa, vaikkakaan ei kaikissa, näiden halujen ilmoitettiin loppuneen, kun annosta pienennettiin tai lääkitys lopetettiin. Koska potilaat eivät välttämättä tunnista näitä käyttäytymismalleja epänormaaliksi, on tärkeää, että lääkärit kysyvät potilailta tai heidän hoitajilta erityisesti uusien tai lisääntyneiden pelihimojen, seksuaalisten halujen, hallitsemattomien kulujen tai muiden halujen kehittymistä Parkinsonin taudin Parlodel 2,5 mg:n hoidon aikana. tai hyperprolaktinemiaan liittyvät toimintahäiriöt. Lääkäreiden tulee harkita annoksen pienentämistä tai lääkityksen lopettamista, jos potilaalla ilmenee tällaisia haluja Parlodel-hoidon aikana.
Parlodelin (bromikriptiinimesylaatti) turvallisuutta ja tehoa ei ole osoitettu potilailla, joilla on munuais- tai maksasairaus. Varovaisuutta tulee noudattaa, kun Parlodel-hoitoa annetaan samanaikaisesti muiden verenpainetta alentavien lääkkeiden kanssa.
Lääkettä tulee käyttää varoen potilailla, joilla on ollut psykoosi tai sydän- ja verisuonitauti. Jos akromegaliapotilaita tai potilaita, joilla on prolaktinooma tai Parkinsonin tauti, hoidetaan Parlodel 2,5 mg:lla raskauden aikana, heitä tulee tarkkailla varoen, erityisesti synnytyksen jälkeisenä aikana, jos heillä on ollut sydän- ja verisuonitauti.
Potilaiden, joilla on harvinainen perinnöllinen galaktoosi-intoleranssi, vaikea laktaasinpuutos tai glukoosi-galaktoosi-imeytymishäiriö, ei tule käyttää tätä lääkettä.
Hyperprolaktineemiset tilat
Näkökentän heikkeneminen on makroprolaktinooman tunnettu komplikaatio. Tehokas hoito Parlodel 2,5 mg:lla vähentää hyperprolaktinemiaa ja usein myös näön heikkenemistä. Joillakin potilailla voi kuitenkin myöhemmin kehittyä sekundaarista näkökenttien heikkenemistä huolimatta normalisoituneista prolaktiinitasoista ja kasvaimen kutistumisesta, mikä voi johtua optisen kiasman vedosta, joka vedetään alas nyt osittain tyhjään sellaan. Näissä tapauksissa näkökenttävika voi parantua bromokriptiiniannoksen pienentämisessä, kun taas prolaktiinin määrä kohoaa jonkin verran ja kasvain laajenee uudelleen. Sen vuoksi makroprolaktinoomapotilaiden näkökenttien seurantaa suositellaan, jotta voidaan havaita varhaisessa vaiheessa kiasmaalisen hernian aiheuttama toissijainen kentän menetys ja mukauttaa lääkeannostusta.
Parlodelin suhteellinen tehokkuus näkökenttien säilyttämiseen verrattuna kirurgiaan ei ole tiedossa. Potilaat, joilla on nopeasti etenevä näkökentän menetys, tulee arvioida neurokirurgin toimesta sopivimman hoidon päättämiseksi.
Koska raskaus on usein terapeuttinen tavoite monille hyperprolaktineemisille potilaille, joilla on amenorrea/galaktorrea ja hypogonadismi (hedelmättömyys), aivolisäkkeen huolellinen arviointi on välttämätöntä prolaktiinia erittävän adenooman havaitsemiseksi. Potilaita, jotka eivät halua raskautta, tai potilaita, joilla on suuria adenoomat, tulee neuvoa käyttämään muita ehkäisymenetelmiä kuin suun kautta otettavia ehkäisymenetelmiä Parlodel-hoidon aikana. Koska raskaus voi tulla ennen kuukautisten alkamista uudelleen, raskaustestiä suositellaan vähintään 4 viikon välein amenorreajakson aikana ja kuukautisten uudelleen alkaessa aina, kun potilaalta jää kuukautiset väliin. Parlodel SnapTabs tai -kapselit on lopetettava heti, kun raskaus on todettu. Potilaita on seurattava tarkasti koko raskauden ajan sellaisten merkkien ja oireiden varalta, jotka voivat viitata aiemmin havaitsemattoman tai olemassa olevan prolaktiinia erittävän kasvaimen suurenemiseen. Parlodel-hoidon keskeyttämiseen potilailla, joilla on tunnettuja makroadenoomia, on useimmissa tapauksissa liitetty kasvaimen nopeaa uudelleenkasvua ja seerumin prolaktiinipitoisuuden nousua.
Aivo-selkäydinnesteen rinorreaa on havaittu joillakin Parlodelilla hoidetuilla potilailla, joilla on prolaktiinia erittävät adenoomat.
Akromegalia
Kylmäherkkää digitaalista vasospasmia on havaittu joillakin Parlodelilla hoidetuilla akromegaliapotilailla. Jos vaste ilmenee, se voidaan kääntää pienentämällä Parlodel 2,5 mg:n annosta, ja se voidaan estää pitämällä sormet lämpiminä. Vakavia maha-suolikanavan verenvuototapauksia peptisten haavaumien vuoksi on raportoitu, joista osa on johtanut kuolemaan. Vaikka ei ole näyttöä siitä, että Parlodel 2,5 mg lisää peptisten haavaumien ilmaantuvuutta akromegaliapotilailla, peptiseen haavaan viittaavat oireet on tutkittava perusteellisesti ja hoidettava asianmukaisesti. Potilaita, joilla on ollut peptinen haava tai maha-suolikanavan verenvuoto, tulee tarkkailla huolellisesti Parlodel-hoidon aikana.
Mahdollista kasvaimen laajenemista Parlodel-hoidon aikana on raportoitu muutamilla potilailla. Koska kasvuhormonia erittävien kasvainten luonnollista historiaa ei tunneta, kaikkia potilaita on seurattava huolellisesti, ja jos kasvaimen laajenemista ilmenee, hoidon lopettamista ja muita toimenpiteitä on harkittava.
Parkinsonin tauti
Turvallisuutta pitkäaikaisen yli 2 vuoden käytön aikana parkinsonismiin tarvittavilla annoksilla ei ole osoitettu.
Kuten minkä tahansa kroonisen hoidon yhteydessä, maksan, hematopoieettisen, sydän- ja verisuonijärjestelmän ja munuaisten toiminnan säännöllistä arviointia suositellaan. Oireista hypotensiota voi esiintyä, ja siksi varovaisuutta on noudatettava hoidettaessa potilaita, jotka saavat verenpainelääkkeitä.
Suuriin Parlodel 2,5 mg -annoksiin voi liittyä sekavuutta ja mielenterveyshäiriöitä. Koska parkinson-potilailla voi ilmetä lievää dementiaa, varovaisuutta tulee noudattaa hoidettaessa tällaisia potilaita.
Yksin tai yhdessä levodopan kanssa annettu Parlodel voi aiheuttaa hallusinaatioita (näkö- tai kuulo). Hallusinaatiot yleensä häviävät annosta pienentämällä; toisinaan Parlodel 2,5 mg:n käyttö on lopetettava. Harvoin suurten annosten jälkeen hallusinaatiot ovat jatkuneet useita viikkoja Parlodel-hoidon lopettamisen jälkeen.
Kuten levodopaa käytettäessä, varovaisuutta on noudatettava annettaessa Parlodel-valmistetta potilaille, joilla on ollut sydäninfarkti ja joilla on jäljellä oleva eteis-, solmu- tai kammiorytmi.
Retroperitoneaalista fibroosia on raportoitu muutamilla potilailla, jotka ovat saaneet pitkäaikaista hoitoa (2–10 vuotta) Parlodel 2,5 mg:n annoksilla 30–140 mg päivässä.
Epidemiologiset tutkimukset ovat osoittaneet, että Parkinsonin tautia sairastavilla potilailla on suurempi riski (noin 2 kertaa suurempi) sairastua melanoomaan kuin muulla väestöllä. On epäselvää, johtuuko havaittu lisääntynyt riski Parkinsonin taudista vai muista tekijöistä, kuten Parkinsonin taudin hoitoon käytetyistä lääkkeistä. Yllä mainituista syistä potilaita ja palveluntarjoajia kehotetaan tarkkailemaan melanooman varalta usein ja säännöllisesti käytettäessä Parlodelia mihin tahansa käyttöaiheeseen. Ihannetapauksessa säännölliset ihotutkimukset tulisi suorittaa asianmukaisen pätevyyden omaavien henkilöiden (esim. ihotautilääkärien) toimesta.
Parlodel-hoito tulee lopettaa asteittain aina kun mahdollista, vaikka potilas jatkaisikin levodopahoitoa. Malignia neuroleptisyndroomaa muistuttavaa oireyhtymää (jolle on ominaista kohonnut lämpötila, lihasjäykkyys, muuttunut tajunta ja autonominen epävakaus), jolla ei ole muuta ilmeistä etiologiaa, on raportoitu nopean annoksen pienentämisen, hoidon lopettamisen tai Parkinson-lääkityksen muuttamisen yhteydessä.
Oireita, kuten apatiaa, ahdistusta, masennusta, väsymystä, unettomuutta, hikoilua ja kipua, on raportoitu dopamiiniagonistien, mukaan lukien Parlodel-hoidon, kapenemisen aikana tai lopettamisen jälkeen. Nämä oireet eivät yleensä reagoi levodopaan. Ennen Parlodel-hoidon lopettamista potilaille tulee kertoa mahdollisista vieroitusoireista, ja heitä tulee seurata tarkasti Parlodel-hoidon aikana ja sen jälkeen. Vakavien vieroitusoireiden ilmetessä voidaan harkita dopamiiniagonistin antoa uudelleen pienimmällä tehokkaalla annoksella.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
74 viikkoa kestänyt tutkimus suoritettiin hiirillä käyttämällä ravinnosta bromokriptiinimesylaattia, joka vastasi oraalisia annoksia 10 ja 50 mg/kg/vrk. 100 viikkoa kestänyt tutkimus rotilla suoritettiin käyttämällä ruokavaliotasoja, jotka vastaavat suun kautta otettavia annoksia 1,7, 9,8 ja 44 mg/kg/vrk. Suurimmat hiirillä ja rotilla testatut annokset olivat noin 2,5 ja 4,4 kertaa suuremmat kuin kontrolloiduissa kliinisissä tutkimuksissa ihmiselle annettu enimmäisannos (100 mg/vrk) kehon pinta-alan perusteella. Pahanlaatuisia kohdun kohdun kasvaimia, kohdun limakalvon ja myometriumin kasvaimia, havaittiin rotilla seuraavasti: 0/50 kontrollinaaraasta, 2/50 naaraspuolta 1,7 mg/kg päivässä, 7/49 naaraspuolista 9,8 mg/kg päivässä ja 9/50 naaraasta 44 mg/kg päivittäin. Näiden kasvainten esiintyminen johtuu todennäköisesti korkeasta estrogeeni/progesteroni-suhteesta, jota esiintyy rotilla bromokriptiinimesylaatin prolaktiinia estävän vaikutuksen seurauksena. Endokriiniset mekanismit, joiden uskotaan liittyvän rottien toimintaan, eivät esiinny ihmisissä. Bromokriptiinilla hoidetuilla rotilla esiintyvien kohdun pahanlaatuisten kasvainten ja ihmisten riskin välillä ei ole tunnettua korrelaatiota. Toisin kuin rotilla tehdyissä löydöksissä, 74 viikon hoidon jälkeen tapettujen hiirten kohduissa ei ollut näyttöä lääkkeeseen liittyvistä muutoksista.
Bromokriptiinimesylaatin mutageenisuus arvioitiin testisarjassa, joka sisälsi Amesin bakteerimutaatiomäärityksen, mutageenisen aktiivisuuden in vitro kiinanhamsterin V79 fibroblasteissa, kiinanhamsterin luuydinsolujen sytogeneettisen analyysin in vivo -käsittelyn jälkeen ja in vivo -mikronukleustestin mutageenisten vaikutusten varalta. potentiaalia hiirissä.
Mutageenisia vaikutuksia ei havaittu missään näistä testeistä.
Bromokriptiinihoito ei vaikuttanut haitallisesti naarasrottien hedelmällisyyteen ja lisääntymiskykyyn enempää kuin pentujen ennustetun painon laskun laktaation suppressiosta johtuen. Uroksilla, joita hoidettiin annoksella 50 mg/kg tätä lääkettä, parittelu ja hedelmällisyys olivat normaalin alueen sisällä. Lisääntynyt perinataalinen menetys tuotettiin emojen alaryhmissä, jotka lopetettiin päivänä 21 synnytyksen jälkeen (pp) pariutumisen jälkeen suurimmalla annoksella (50 mg/kg) käsiteltyjen urosten kanssa.
Raskaus
Luokka B
Bromokriptiinin anto 10-30 mg/kg kahdelle rottakannalle 6-15 päivänä postcoitum (pc) sekä kerta-annos 10 mg/kg päivänä 5 pc häiritsi nidaatiota. Päivinä 6-15 annettu 3 mg/kg ei vaikuttanut nidaatioon eikä aiheuttanut mitään poikkeavuuksia. Eläimillä, joita hoidettiin vuorokaudesta 8-15, eli istutuksen jälkeen, 30 mg/kg lisäsi syntymää edeltävää kuolleisuutta lisääntyneen alkion resorption ilmaantuvuuden muodossa. Yksi poikkeama, selkänikamien ja kylkiluiden aplasia, löydettiin 262 sikiön ryhmästä, jotka olivat peräisin 30 mg/kg bromokriptiinilla hoidetuista emoista. Sikiötoksisia vaikutuksia ei havaittu peri- tai postnataalisen ajanjakson aikana käsiteltyjen emojen jälkeläisillä.
Kaneilla (2 kantaa) suoritettiin kaksi tutkimusta nidaation mahdollisen häiritsemisen määrittämiseksi. Annostasot 100 tai 300 mg/kg/vrk päivästä 1 päivään 6 pc eivät vaikuttaneet haitallisesti nidaatioon. Suuri annos oli noin 63 kertaa suurempi kuin ihmisille kontrolloiduissa kliinisissä tutkimuksissa annettu enimmäisannos (100 mg/vrk) kehon pinta-alan perusteella. Uuden-Seelannin valkoisilla kaniineilla havaittiin jonkin verran alkiokuolleisuutta annoksella 300 mg/kg, mikä heijasti ilmeistä emomyrkyllisyyttä. Kolme tutkimusta suoritettiin kahdella kanikannalla bromokriptiinin teratologisen potentiaalin määrittämiseksi annoksilla 3, 10, 30, 100 ja 300 mg/kg annettaessa päivästä 6 päivään 18 pc kahdessa tutkimuksessa Yellow-silver -kannan kanssa. , suulakihalkio löydettiin 3 ja 2 sikiöstä emolle toksisilla annoksilla 100 ja 300 mg/kg. Yhdellä kontrollisikiöllä oli myös tämä poikkeama. Kolmannessa tutkimuksessa, joka suoritettiin Uuden-Seelannin valkoisilla kaniineilla käyttäen identtistä protokollaa, suulakihalkeamia ei syntynyt.
Bromokriptiinin teratologisia tai embryotoksisia vaikutuksia ei ilmennyt missään kuudesta 6 apinan jälkeläisestä annostasolla 2 mg/kg.
Tietoja on kerätty 1 276 raskaudesta Parlodel-hoitoa saavilla naisilla. Useimmissa tapauksissa Parlodel-hoito lopetettiin 8 viikon sisällä raskauden alkamisesta (keskiarvo 28,7 päivää), mutta 8 potilasta sai lääkettä jatkuvasti koko raskauden ajan. Keskimääräinen vuorokausiannos kaikille potilaille oli 5,8 mg (vaihteluväli 1-40 mg).
Näistä 1276 raskaudesta oli 1088 täysiaikaista synnytystä (4 kuolleena syntynyttä), 145 spontaania aborttia (11,4 %) ja 28 aborttia (2,2 %). Lisäksi 12 kohdunulkoista raskautta ja 3 hydatidiformista luomaa (kahdesti samalla potilaalla) aiheuttivat raskauden ennenaikaisen keskeytyksen. Nämä tiedot ovat verrattavissa klomifeenisitraatin, menopausaalisen gonadotropiinin ja koriongonadotropiinin aiheuttamiin raskauksiin mainittuun aborttiasteeseen (11–25 %).
Vaikka spontaanit abortit jäävät usein ilmoittamatta, etenkin ennen 20 raskausviikkoa, niiden esiintymistiheydeksi on arvioitu 15 %.
Synnynnäisten epämuodostumien ilmaantuvuus väestössä vaihtelee 2–4,5 prosentin välillä. Bromokriptiinia saaneiden potilaiden 1 109 elävänä syntymän ilmaantuvuus on 3,3 %.
Ei ole viitteitä siitä, että Parlodel 2,5 mg olisi vaikuttanut synnynnäisten epämuodostumien tyyppiin tai ilmaantuvuuteen tässä lapsiryhmässä.
Imettävät äidit
Parlodel 2,5 mg -valmistetta ei tule käyttää imetyksen aikana synnyttäneille naisille.
Käyttö lapsille
Bromokriptiinin turvallisuus ja tehokkuus prolaktiinia erittävien aivolisäkkeen adenoomien hoidossa on osoitettu 16-vuotiailla ja aikuisilla potilailla. Tietoja bromokriptiinin käytöstä alle 8-vuotiailla lapsipotilailla ei ole saatavilla. Yksittäinen 8-vuotias potilas, jota on hoidettu bromokriptiinillä prolaktiinia erittävän aivolisäkkeen makroadenooman vuoksi, on raportoitu ilman terapeuttista vastetta.
Bromokriptiinin käyttöä prolaktiinia erittävien adenoomien hoitoon lapsipotilailla ikäryhmässä 11–16 vuotta tukevat todisteet hyvin kontrolloiduista tutkimuksista aikuisilla, ja lisätietoa rajoitetusta määrästä (n=14) lapsista ja 11–15-vuotiaat nuoret, joilla on prolaktiinia erittävät aivolisäkkeen makro- ja mikroadenoomit, joita on hoidettu bromokriptiinillä. Ilmoitetuista 14 potilaasta 9 onnistui, 3 osittaista vastetta ja 2 ei vastannut bromokriptiinihoitoon. Krooninen hypopituitarismi vaikeutti makroadenooman hoitoa viidellä vasteen saaneista potilaista, jotka saivat vain bromokriptiiniä, sekä potilailla, jotka saivat bromokriptiiniä yhdessä kirurgisen hoidon ja/tai aivolisäkkeen säteilytyksen kanssa.
Bromokriptiinin turvallisuutta ja tehokkuutta lapsipotilailla ei ole varmistettu minkään muun osiossa KÄYTTÖAIHEET ja käyttöaiheet luetellut käyttöaiheet.
Geriatrinen käyttö
Parlodel 2,5 mg:n kliinisissä tutkimuksissa ei ollut riittävästi 65-vuotiaita ja sitä vanhempia koehenkilöitä sen määrittämiseksi, reagoivatko vanhukset eri tavalla kuin nuoremmat. Muissa raportoiduissa kliinisissä kokemuksissa, mukaan lukien markkinoille tulon jälkeiset haittatapahtumien raportit, ei kuitenkaan ole havaittu eroja vasteessa tai siedettävyydessä iäkkäiden ja nuorempien potilaiden välillä. Vaikka Parlodel 2,5 mg -annosta saaneiden iäkkäiden potilaiden tehossa tai haittavaikutusten profiilissa ei ole havaittu vaihtelua, joidenkin iäkkäiden henkilöiden suurempaa herkkyyttä ei voida kategorisesti sulkea pois. Yleensä iäkkäiden potilaiden annoksen valinnassa tulee olla varovainen, alkaen annosalueen alemmasta päästä, mikä kuvastaa maksan, munuaisten tai sydämen toiminnan heikkenemisen sekä samanaikaisen sairauden tai muun lääkehoidon yleisyyttä tässä populaatiossa.
YLIANNOSTUS
Yleisimmin raportoidut akuuttiin Parlodelin (bromikriptiinimesylaatin) yliannostukseen liittyvät merkit ja oireet ovat: pahoinvointi, oksentelu, ummetus, hierominen, huimaus, kalpeus, vaikea hypotensio, huonovointisuus, sekavuus, letargia, uneliaisuus, harhaluulot, hallusinaatiot ja toistuvat näkemykset. Tappavaa annosta ei ole vahvistettu, ja lääkkeellä on erittäin laaja turvallisuusmarginaali. Kuitenkin yksi kuolema tapahtui potilaalla, joka teki itsemurhan tuntemattomalla määrällä Parlodel 2,5 mg:aa ja klorokiinia.
Yliannostuksen hoito koostuu lääkkeen poistamisesta oksentamalla (jos hän on tajuissaan), mahahuuhtelulla, aktiivihiilellä tai suolaliuoksella. Nesteen saannin ja ulostulon huolellinen valvonta ja kirjaaminen on välttämätöntä. Hypotensio tulee hoitaa asettamalla potilas Trendelenburg-asentoon ja antamalla laskimonsisäisiä nesteitä. Jos hypotension tyydyttävää lievitystä ei voida saavuttaa käyttämällä yllä olevia toimenpiteitä täysimääräisesti, vasopressoreita tulee harkita.
On yksittäisiä raportteja lapsista, jotka ovat vahingossa nauttineet Parlodel-valmistetta. Oksentelua, uneliaisuutta ja kuumetta raportoitiin haittavaikutuksina. Potilaat toipuivat joko spontaanisti muutaman tunnin kuluessa tai asianmukaisen hoidon jälkeen.
VASTA-AIHEET
Yliherkkyys bromokriptiinille tai jollekin Parlodelin apuaineelle (bromikriptiinimesylaatti), hallitsematon verenpainetauti ja herkkyys torajyväalkaloideille. Potilailta, joita hoidetaan hyperprolaktinemiaan, Parlodel 2,5 mg:n käyttö tulee keskeyttää, kun raskaus todetaan (ks. VAROTOIMENPITEET , Hyperprolaktineemiset tilat ). Siinä tapauksessa, että Parlodel 2,5 mg otetaan uudelleen käyttöön nopeasti laajenevan makroadenooman hallintaan (ks. VAROTOIMENPITEET , Hyperprolaktineemiset tilat ja potilaalla on raskauden hypertensiivinen häiriö, Parlodel-hoidon jatkamisen hyötyjä on punnittava sen käytön mahdolliseen riskiin raskauden hypertensiivisen häiriön aikana. Kun Parlodelia käytetään akromegalian, prolaktinooman tai Parkinsonin taudin hoitoon potilailla, jotka myöhemmin tulevat raskaaksi, on tehtävä päätös siitä, onko hoito edelleen lääketieteellisesti tarpeellista vai voidaanko se keskeyttää. Jos sitä jatketaan, lääke on lopetettava niiltä, joilla saattaa esiintyä raskauden hypertensiivisiä häiriöitä (mukaan lukien eklampsia, preeklampsia tai raskauden aiheuttama hypertensio), ellei Parlodel-hoidon lopettamista pidetä lääketieteellisesti vasta-aiheisena.
Lääkettä ei tule käyttää synnytyksen jälkeisenä aikana naisille, joilla on ollut sepelvaltimotauti ja muita vakavia sydän- ja verisuonisairauksia, ellei lääkkeen lopettamista pidetä lääketieteellisesti vasta-aiheisena. Jos lääkettä käytetään synnytyksen jälkeisenä aikana, potilasta tulee tarkkailla varoen.
KLIININEN FARMAKOLOGIA
Parlodel (bromokriptiinimesylaatti) on dopamiinireseptoriagonisti, joka aktivoi postsynaptisia dopamiinireseptoreita. Tuberoinfundibulaarisen prosessin dopaminergiset hermosolut moduloivat prolaktiinin eritystä aivolisäkkeen etuosasta erittämällä prolaktiinia estävää tekijää (joka luullaan olevan dopamiinia); corpus striatumissa dopaminergiset neuronit osallistuvat motorisen toiminnan säätelyyn. Kliinisesti Parlodel 2,5 mg alentaa merkittävästi plasman prolaktiinipitoisuutta potilailla, joilla on fysiologisesti kohonnut prolaktiini, sekä potilailla, joilla on hyperprolaktinemia. Fysiologisen laktaation ja galaktorrean esto patologisissa hyperprolaktineemisissa tiloissa saadaan aikaan annoksilla, jotka eivät vaikuta muiden trooppisten hormonien erittymiseen aivolisäkkeen etuosasta. Kokeet ovat osoittaneet, että bromokriptiini indusoi pitkäkestoista stereotyyppistä käyttäytymistä jyrsijöissä ja kääntymiskäyttäytymistä rotilla, joilla on yksipuolisia vaurioita musta-aineessa. Dopamiiniantagonistit estävät näitä vaikutuksia, jotka ovat ominaisia dopamiinin tuottamille vaikutuksille, ja ne viittaavat bromokriptiinin suoraan vaikutukseen striataalisen dopamiinireseptoreihin.
Bromokriptiinimesylaatti on ei-hormonaalinen, ei-nestrogeeninen aine, joka estää prolaktiinin erittymistä ihmisillä, mutta jolla on vain vähän tai ei ollenkaan vaikutusta muihin aivolisäkkeen hormoneihin, paitsi potilailla, joilla on akromegalia, jossa se alentaa veren kasvuhormonin pitoisuuksia suurimmalla osalla potilaista.
Bromokriptiinimesylaatti tuottaa terapeuttisen vaikutuksensa Parkinsonin taudin hoidossa, kliinisen tilan, jolle on tunnusomaista etenevä dopamiinisynteesin puutos substantia nigrassa, stimuloimalla suoraan corpus striatumin dopamiinireseptoreita. Sitä vastoin levodopa saa terapeuttisen vaikutuksensa vasta sen jälkeen, kun mustasubstan hermosolut ovat muuttaneet dopamiiniksi, joiden tiedetään olevan numeerisesti vähentynyt tässä potilaspopulaatiossa.
Farmakokinetiikka
Imeytyminen
Kun Parlodel 2,5 mg tabletteja annettiin kerta-annoksena 2 x 2,5 mg 5 terveelle vapaaehtoiselle paastotilassa, bromokriptiinin keskimääräiset huippupitoisuudet plasmassa, aika huippupitoisuuksien saavuttamiseen plasmassa ja eliminaation puoliintumisaika olivat 465 pg/ml ± 226, 2,5 t ± 2 ja 4,85 h, vastaavasti.1 Lineaarinen suhde havaittiin Parlodel 2,5 mg:n kerta-annosten sekä Cmax- ja AUC-annosten välillä 1-7,5 mg.2 Bromokriptiinimetaboliittien farmakokinetiikkaa ei ole raportoitu.
Ruoka ei vaikuttanut merkitsevästi systeemiseen bromokriptiinialtistukseen 2,5 mg:n Parlodel-tablettien antamisen jälkeen.3 Parlodel 2,5 mg:n suositellaan ottamista ruoan kanssa, koska suuri osa potilaista oksentaa bromokriptiinia saaessaan paastotilassa.
Kun Parlodel 5 mg annettiin kahdesti päivässä 14 päivän ajan, bromokriptiinin Cmax ja AUC vakaassa tilassa olivat 628 ± 375 pg/ml ja 2377 ± 1186 pg*h/ml.4
Jakelu
In vitro -kokeet osoittivat, että bromokriptiini sitoutui 90-96-prosenttisesti seerumin albumiiniin.
Aineenvaihdunta
Bromokriptiini käy läpi laajan ensikierron biotransformaation, mikä näkyy monimutkaisina metaboliittiprofiileina ja lähes täydellisenä alkuperäisen lääkkeen puuttumisena virtsassa ja ulosteessa.
In vitro -tutkimukset, joissa käytettiin ihmisen maksan mikrosomeja, osoittivat, että bromokriptiinillä on suuri affiniteetti CYP3A:han ja että syklopeptidiosan proliinirenkaan hydroksylaatiot muodostivat pääasiallisen aineenvaihduntareitin.5 CYP3A4:n estäjät ja/tai tehokkaat substraatit saattavat siksi estää bromokriptiinin ja lyijyn puhdistumaa. kohonneille tasoille. (katso VAROTOIMENPITEET , HUUMEIDEN VUOROVAIKUTUKSET jakso). Muiden tärkeimpien CYP-entsyymien, kuten 2D6, 2C8 ja 2C19, osallistumista bromokriptiinin metaboliaan ei ole arvioitu. Bromokriptiini on myös CYP3A4:n estäjä, jonka laskennallinen IC50-arvo on 1,69 µM.6 Ottaen huomioon bromokriptiinin alhaiset terapeuttiset pitoisuudet potilaissa (Cmax = 0,82 nM), toisen lääkkeen, jonka puhdistuma on CYP3A4:n välittämä, ei pitäisi muuttaa merkittävästi metaboliaa. odotetaan. Bromokriptiinin ja sen metaboliittien mahdollista vaikutusta CYP-entsyymien indusoijina ei ole raportoitu.
Erittyminen
Suun kautta annetusta radioaktiivisesta annoksesta noin 82 % erittyi ulosteeseen ja 5,6 % virtsaan. Bromolysergihapon ja bromiisolysergihapon osuus virtsan radioaktiivisuudesta oli puolet.
Tietyt populaatiot
Munuaisten vajaatoiminnan vaikutus
Munuaisten toiminnan vaikutusta bromokriptiinin farmakokinetiikkaan ei ole arvioitu.
Koska emolääke ja metaboliitit erittyvät lähes kokonaan metabolian kautta ja vain 6 % eliminoituu munuaisten kautta, munuaisten vajaatoiminnalla ei välttämättä ole merkittävää vaikutusta bromokriptiinin ja sen metaboliittien PK-arvoon (ks. VAROTOIMENPITEET , Kenraali ).
Maksan vajaatoiminnan vaikutus
Maksan vajaatoiminnan vaikutusta Parlodelin ja sen metaboliittien PK-arvoon ei ole arvioitu. Koska Parlodel eliminoituu pääasiassa metabolian kautta, maksan vajaatoiminta voi suurentaa plasman bromokriptiinipitoisuuksia, joten varovaisuus saattaa olla tarpeen (ks. VAROTOIMENPITEET , Kenraali ).
Iän, rodun ja sukupuolen vaikutusta bromokriptiinin ja sen metaboliittien farmakokinetiikkaan ei ole arvioitu.
Kliiniset tutkimukset
Noin 75 %:ssa kuukautisten ja galaktorrean tapauksista Parlodel 2,5 mg -hoito tukahduttaa galaktorrean kokonaan tai lähes kokonaan ja käynnistää normaalit ovulaation kuukautiskierrot.
Kuukautiset alkavat yleensä uudelleen ennen galaktorrean täydellistä tukahduttamista; tämä aika on keskimäärin 6-8 viikkoa. Jotkut potilaat reagoivat kuitenkin muutaman päivän kuluessa, ja toisilla voi kestää jopa 8 kuukautta.
Galaktorrean hallinta voi kestää kauemmin riippuen rintakudoksen stimulaatioasteesta ennen hoitoa. Erityksen väheneminen vähintään 75 % havaitaan yleensä 8–12 viikon kuluttua. Jotkut potilaat eivät välttämättä reagoi edes 12 kuukauden hoidon jälkeen.
Monilla akromegaliapotilailla Parlodel 2,5 mg alentaa nopeasti ja pysyvästi seerumin kasvuhormonitasoja.
1 Nelson, M. et. al. (1990). Bromokriptiinin kanssa annetun erytromysiinin ja kofeiinin farmakokineettinen arviointi. Clin Pharmacol Ther; 47(6):694-7.
Schran, HF, Bhuta, SI, Schwartz, et ai. (1980). Bromokriptiinin farmakokinetiikka ihmisellä. Julkaisussa: Golstein, M. Calne, DB, et. Al (toim.). Ergot-yhdiste ja aivojen toiminta: Neuroendokriiniset ja neuropsykiatriset näkökohdat, s. 125-139, New York, Rave Press.
3 Kopitar, Z., Vrhovac, B., Povsic, L., Plavsic, F., Francetic, I., Urbancic, J. (1991). Ruoan ja metoklopramidin vaikutus bromokriptiinin farmakokinetiikkaan ja sivuvaikutuksiin. Eur J Drug Metab Pharmacokinet; 16(3):177-81
4 Flogstad, AK, Halse, J., Grass, P., Abisch, E., Djoseland, O., Kutz, K., Bodd, E. ja Jervell, J., (1994). Oktreotidin, bromokriptiinin tai molempien lääkkeiden yhdistelmän vertailu akromegaliassa. Journal of Clinical Endocrinology & Metabolism; Voi 79, 461-465
5 Peyronneau MA, Delaforge M, Riviere R et ai. 1994. Ergopeptidien korkea affiniteetti CYP P450 3A:lle. Niiden peptidiosan merkitys P450:n tunnistamiselle ja bromokriptiinin hydroksylaatiolle. Eur J Biochem 223:947-56.
Wynalda, MA, Wienkers, LC (1997). Dopamiinireseptoriagonistien ja erilaisten ihmisen sytokromi P450 -entsyymien välisten mahdollisten vuorovaikutusten arviointi käyttämällä yksinkertaista in vitro estoseulontaa. Drug Metab Dispos; 25:1211-14.
POTILASTIEDOT
Kliinisissä tutkimuksissa Parlodel 2,5 mg -hoidon alkuvaiheessa on raportoitu huimausta, uneliaisuutta, pyörtymistä, pyörtymistä ja pyörtymistä. Markkinoille tulon jälkeisissä raporteissa Parlodel on yhdistetty uneliaisuuteen ja äkillisiin nukahtamisjaksoihin, erityisesti Parkinsonin tautia sairastavilla potilailla. Äkillistä nukahtamista päivittäisten toimien aikana, joissain tapauksissa ilman tietoisuutta tai varoitusmerkkejä, on raportoitu hyvin harvoin. Kaikkia Parlodel-hoitoa saavia potilaita tulee varoittaa sellaisista toimista, jotka edellyttävät nopeita ja tarkkoja reaktioita, kuten autolla ajamista tai koneiden käyttöä. Potilaita, joita hoidetaan Parlodel 2,5 mg:lla ja joilla on uneliaisuutta ja/tai äkillisiä unihäiriöitä, tulee neuvoa olemaan ajamatta autoa tai ryhtymättä sellaisiin toimiin, joissa heikentynyt vireys voi vaarantaa itsensä tai muut vakavan loukkaantumisen tai kuoleman vaarassa (esim. koneiden käyttö).
Potilaita, jotka saavat Parlodel 2,5 mg:aa makroadenoomaan liittyvien hyperprolaktineemisten tilojen hoitoon, tai potilaita, joille on tehty transsfenoidaalinen leikkaus, tulee kertoa lääkärilleen kaikista jatkuvasta vetisestä nenän vuoteesta. Potilaille, jotka saavat Parlodel 2,5 mg:aa makroadenooman hoitoon, tulee kertoa, että lääkkeen lopettaminen voi liittyä kasvaimen nopeaan uudelleenkasvuun ja alkuperäisten oireiden uusiutumiseen.
Potilaita ja heidän hoitajiaan on varoitettava mahdollisuudesta, että potilaat voivat kokea voimakkaita haluja käyttää rahaa hallitsemattomasti, voimakkaita haluja pelata rahapelejä, lisääntynyttä seksuaalista halua ja muita voimakkaita haluja ja kyvyttömyyttä hallita näitä haluja Parlodel-hoidon aikana. Neuvo potilaita ja heidän hoitajiaan ilmoittamaan terveydenhuollon tarjoajalleen, jos heille kehittyy uusia tai lisääntyviä hallitsemattomia kuluja, uhkapelaamisen haluja, seksuaalisia haluja tai muita haluja Parlodel-hoidon aikana [ks. VAROTOIMENPITEET ].
Erityisesti hoidon ensimmäisten päivien aikana saattaa toisinaan esiintyä hypotensiivisiä reaktioita, jotka heikentävät valppautta. Erityistä varovaisuutta tulee noudattaa ajoneuvoa ajaessa tai koneita käytettäessä.
Neuvo potilaita ottamaan yhteyttä terveydenhuollon tarjoajaansa, jos he haluavat lopettaa Parlodel-hoidon tai pienentää Parlodel-annosta. Neuvo potilaita, joille on määrätty pienempi annos tai jotka on lopetettu lääkkeen käytöstä, ilmoittamaan terveydenhuollon tarjoajalle, jos heillä on vieroitusoireita, kuten kuumetta, lihasjäykkyyttä, tajunnanhäiriötä, apatiaa, ahdistusta, masennusta, väsymystä, unettomuutta, hikoilua tai kipu (ks VAROTOIMENPITEET ).
