Prometrium 100mg, 200mg Progesterone Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Prometrium 100mg on ja miten sitä käytetään?
Prometrium 200mg on reseptilääke, jota käytetään ehkäisemään kohdun limakalvon liikakasvun oireita ja sekundaarisen amenorrean oireita (kuukautisten tai kuukautisten puuttuminen). Prometriumia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Prometrium kuuluu lääkeryhmään nimeltä Progestins.
Ei tiedetä, onko Prometrium 200 mg turvallinen ja tehokas lapsille.
Mitkä ovat Prometriumin mahdolliset sivuvaikutukset?
Prometrium voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- epätavallinen emättimen verenvuoto,
- kipu tai polttaminen virtsatessa,
- rintojen kyhmy,
- äkilliset näköongelmat,
- kova päänsärky,
- kipu silmien takana,
- masennus,
- unihäiriöt,
- heikkous,
- mielialan muutoksia,
- vaikea huimaus,
- uneliaisuus,
- pyörivä tunne,
- hämmennystä,
- hengenahdistus,
- rintakipu tai paine,
- kipu leviää leukaan tai olkapäähän,
- pahoinvointi,
- hikoilu,
- ylävatsakipu,
- kutina,
- väsymys,
- ruokahalun menetys,
- tumma virtsa,
- savenväriset ulosteet,
- ihon tai silmien keltaisuus (keltatauti),
- äkillinen tunnottomuus tai heikkous,
- äkillinen kova päänsärky,
- sammaltava puhe ,
- vaikeus puhua tai tasapainottaa,
- äkillinen yskä,
- hengityksen vinkuminen,
- nopea hengitys,
- yskii verta,
- jalkakipu,
- jalan turvotus ja
- lämpöä tai punoitusta toisessa tai molemmissa jaloissa
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Prometrium 100mg:n yleisimmät sivuvaikutukset ovat:
- uneliaisuus,
- huimaus,
- rintojen kipu,
- mielialan muutoksia,
- päänsärky,
- ummetus,
- ripuli,
- närästys,
- turvotus,
- turvotusta käsissäsi tai jaloissasi,
- nivelkipu,
- kuumat aallot ja
- emätinvuoto
Kerro lääkärillesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei häviä.
Nämä eivät ole kaikkia Prometriumin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
SYDÄN- JA VERENSUUNIKUVAIKUTUKSET, RINTASyöVÄ ja TODENNÄKÖINEN DEMENTIA ESTROGEN PLUS PROGESTIN -HOIDON KÄYTTÖÖN
Sydän- ja verisuonihäiriöt ja todennäköinen dementia
Estrogeeni- ja progestiinihoitoa ei tule käyttää sydän- ja verisuonitautien tai dementian ehkäisyyn. (Katso Kliiniset tutkimukset ja VAROITUKSET , Sydän- ja verisuonihäiriöt ja todennäköinen dementia. )
Women's Health Initiative (WHI) estrogeeni- ja progestiinialatutkimuksessa raportoitiin lisääntyneestä syvälaskimotromboosin, keuhkoembolian, aivohalvauksen ja sydäninfarktin riskistä vaihdevuosien ylittäneillä naisilla (50–79-vuotiaat) 5,6 vuoden hoidon aikana päivittäin suun kautta annetulla konjugoidulla konjugaatiolla. estrogeenit (CE) [0,625 mg] yhdistettynä medroksiprogesteroniasetaattiin (MPA) [2,5 mg] verrattuna lumelääkkeeseen. (Katso Kliiniset tutkimukset ja VAROITUKSET , Sydän- ja verisuonihäiriöt. )
WHI:n WHI-muistitutkimuksessa (WHIMS) estrogeenia ja progestiinia koskeva lisätutkimus raportoi lisääntyneestä todennäköisen dementian kehittymisen riskistä 65-vuotiailla tai sitä vanhemmilla postmenopausaalisilla naisilla 4 vuoden ajan päivittäisellä CE:llä (0,625 mg) yhdistettynä MPA:han (2,5 mg) ), verrattuna lumelääkkeeseen. Ei tiedetä, koskeeko tämä löydös nuorempia postmenopausaalisia naisia. (Katso Kliiniset tutkimukset ja VAROITUKSET , Todennäköinen dementia ja VAROTOIMENPITEET , Geriatrinen käyttö .)
Rintasyöpä
WHI-estrogeeni plus progestiini -alatutkimus osoitti myös lisääntyneen invasiivisen rintasyövän riskin. (Katso Kliiniset tutkimukset ja VAROITUKSET , Pahanlaatuiset kasvaimet, rintasyöpä .)
Vertailukelpoisten tietojen puuttuessa näiden riskien pitäisi olettaa olevan samanlaisia muilla CE- ja MPA-annoksilla sekä muilla estrogeenien ja progestiinien yhdistelmillä ja annosmuodoilla.
Progestiineja estrogeenien kanssa tulee määrätä pienimmillä tehokkailla annoksilla ja lyhyimmän keston ajan, mikä vastaa hoidon tavoitteita ja yksittäisen naisen riskejä.
KUVAUS
PROMETRIUM (progesteroni, USP) Kapselit sisältävät mikronisoitua progesteronia suun kautta annettavaksi. Progesteronin molekyylipaino on 314,47 ja molekyylikaava C21H30O2. Progesteroni (pregn-4-eeni-3, 20-dioni) on valkoinen tai kermanvalkoinen, hajuton, kiteinen jauhe, joka on käytännössä veteen liukenematon, liukenee alkoholiin, asetoniin ja dioksaaniin ja liukenee niukasti kasviöljyihin, stabiili ilmassa, sulaa välillä 126° ja 131°C. Rakennekaava on:
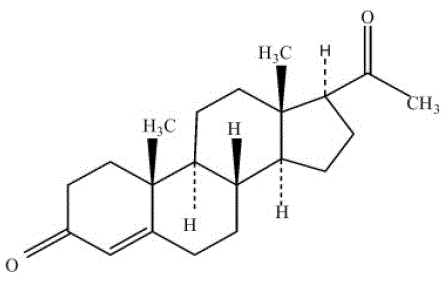
Progesteroni syntetisoidaan kasvilähteestä peräisin olevasta lähtöaineesta ja on kemiallisesti identtinen ihmisen munasarjaalkuperää olevan progesteronin kanssa. PROMETRIUM-kapseleita on saatavana useissa vahvuuksissa, mikä mahdollistaa annostelun joustavuuden optimaalista hoitoa varten. PROMETRIUM-kapselit sisältävät 100 mg tai 200 mg mikronisoitua progesteronia.
PROMETRIUM 100 mg kapseleiden inaktiivisia aineosia ovat: maapähkinäöljy NF, gelatiini NF, glyseriini USP, lesitiini NF, titaanidioksidi USP, FD&C Red No. 40 ja D&C Yellow No. 10. PROMETRIUMin inaktiiviset ainesosat sisältävät 100mg kapselia. : maapähkinäöljy NF, gelatiini NF, glyseriini USP, lesitiini NF, titaanidioksidi USP, D&C Yellow No. 10 ja FD&C Yellow No. 6.
INDIKAATIOT
PROMETRIUM 200 mg -kapselit on tarkoitettu käytettäväksi kohdun limakalvon liikakasvun ehkäisyyn naisilla, joilla ei ole kohdunpoistoa ja jotka saavat konjugoituja estrogeenitabletteja. Ne on myös tarkoitettu käytettäväksi sekundaarisen amenorrean hoidossa.
ANNOSTELU JA HALLINNOINTI
Endometriumin hyperplasian ehkäisy
PROMETRIUM 100 mg -kapseleita tulee antaa yhtenä vuorokautisena annoksena ennen nukkumaanmenoa, 200 mg suun kautta 12 päivän ajan peräkkäin 28 päivän jakson aikana postmenopausaaliselle naiselle, jolla on kohtu ja joka saa päivittäin konjugoituja estrogeenitabletteja.
Toissijaisen amenorrean hoito
PROMETRIUM 100 mg kapseleita voidaan antaa 400 mg:n kerta-annoksena vuorokaudessa ennen nukkumaanmenoa 10 päivän ajan.
Joillakin naisilla voi olla vaikeuksia niellä PROMETRIUM-kapseleita. Näille naisille PROMETRIUM-kapselit tulee ottaa vesilasillisen kera seisoma-asennossa.
MITEN TOIMITETAAN
PROMETRIUM (progesteroni, USP) kapselit 100 mg ovat pyöreitä persikanvärisiä kapseleita, joissa on musta merkintä "SV".
NDC 0032-1708-01 (100 pullo)
PROMETRIUM (progesteroni, USP) kapselit 200 mg ovat soikeita, vaaleankeltaisia kapseleita, joissa on musta merkintä "SV2".
NDC 0032-1711-01 (100 pullo)
Säilytä 25°C (77°F); sallitaan 15° - 30°C (59° - 86°F) [Katso USP Controlled Room Temperature].
Suojaa liialliselta kosteudelta.
Annostele tiiviiseen, valonkestävään astiaan USP/NF:n määritelmän mukaisesti, ja mukana tulee potilassisä.
Pitää poissa lasten ulottuvilta.
Valmistaja: Catalent Pharma Solutions, St. Petersburg, FL 33716. Tarkistettu: syyskuu 2013
SIVUVAIKUTUKSET
Katso LAATIKKO VAROITUS , VAROITUKSET ja VAROTOIMENPITEET .
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Monikeskustutkimuksessa, satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa kliinisessä tutkimuksessa PROMETRIUM 100 mg -kapseleiden vaikutuksia kohdun limakalvoon tutkittiin yhteensä 875 postmenopausaalisella naisella. Taulukossa 6 luetellaan haittavaikutukset, jotka ovat suurempia tai yhtä suuria kuin 2 prosenttia naisista, jotka saivat syklisiä PROMETRIUM-kapseleita 200 mg päivässä (12 päivää kalenterikuukauden aikana) 0,625 mg:n konjugoitujen estrogeenien tai lumelääkkeen kanssa.
TAULUKKO 6. Haittavaikutukset (≥ 2 %), jotka raportoitiin 875 potilaan lumekontrolloidussa tutkimuksessa postmenopausaalisilla naisilla 3 vuoden aikana [ilmoittaneiden potilaiden prosenttiosuus (%)]
Vaikutukset sekundaariseen amenorreaan
Monikeskustutkimuksessa, satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa kliinisessä tutkimuksessa PROMETRIUM-kapseleiden vaikutuksia sekundaariseen kuukautistenkiertoon tutkittiin 49:llä estrogeenivalmisteisella postmenopausaalisella naisella. Taulukossa 7 luetellaan haittavaikutukset, jotka ovat suurempia tai yhtä suuria kuin 5 prosenttia naisista, jotka saivat PROMETRIUM 100 mg kapseleita tai lumelääkettä.
TAULUKKO 7. Haittavaikutukset (≥ 5 %), jotka on raportoitu potilailla, jotka käyttivät 400 mg/vrk lumekontrolloidussa tutkimuksessa estrogeenivalmisteisilla postmenopausaalisilla naisilla
Monikeskustutkimuksessa, rinnakkaisryhmissä, avoimessa markkinoille tulon jälkeisessä annostustutkimuksessa, joka koostui kolmesta peräkkäisestä 28 päivän hoitojaksosta, 220 premenopausaalista naista, joilla oli sekundaarinen amenorrea, satunnaistettiin saamaan päivittäistä konjugoitua estrogeenihoitoa (0,625 mg konjugoituja estrogeenejä) ja PROMETRIUM 100 mg3 kapselia 0,0 mg3. päivässä (n=113) tai PROMETRIUM-kapselit, 400 mg/vrk (n=107) 10 päivän ajan kustakin hoitosyklistä. Kaiken kaikkiaan yleisimmin raportoidut hoidon aiheuttamat haittavaikutukset, joita raportoitiin vähintään 5 prosentilla tutkimushenkilöistä, olivat pahoinvointi, väsymys, emättimen mykoosi, nenänielun tulehdus, ylempien hengitysteiden tulehdus, päänsärky, huimaus, rintojen arkuus, vatsan turvotus, akne dysmenorrea, mielialan vaihtelut ja virtsatietulehdus.
Markkinoinnin jälkeinen kokemus
Seuraavia muita haittavaikutuksia on raportoitu PROMETRIUM 200 mg kapseleilla. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei aina ole mahdollista luotettavasti arvioida esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Urogenitaalinen järjestelmä
kohdun limakalvon karsinooma, hypospadia, kohdunsisäinen kuolema, menorragia, kuukautiskiertohäiriö, metrorragia, munasarjakysta, spontaani abortti.
Kardiovaskulaarinen
verenkierron romahdus, synnynnäinen sydänsairaus (mukaan lukien kammioväliseinävaurio ja avoin valtimotiehyt), verenpainetauti, hypotensio, takykardia.
Ruoansulatuskanava
akuutti haimatulehdus, kolestaasi, kolestaattinen hepatiitti, dysfagia, maksan vajaatoiminta, maksanekroosi, hepatiitti, kohonneet maksan toimintakokeet (mukaan lukien kohonnut alaniiniaminotransferaasi, lisääntynyt aspartaattiaminotransferaasi, lisääntynyt gamma-glutamyylitransferaasi), keltaisuus, kielen turvotus.
Iho
hiustenlähtö, kutina, urtikaria.
Silmät
näön hämärtyminen, diplopia, näköhäiriöt.
Keskushermosto
aggressio, kouristukset, depersonalisaatio, tajunnanhäiriö, disorientaatio, dysartria, tajunnan menetys, parestesia, sedaatio, stupor, pyörtyminen (hypotensiolla tai ilman), ohimenevä iskeeminen kohtaus, itsemurha-ajatukset.
Alkuhoidon aikana muutamat naiset ovat kokeneet monia tai kaikkia seuraavista oireista: voimakas huimaus ja/tai uneliaisuus, näön hämärtyminen, epäselvä puhe, kävelyvaikeudet, tajunnan menetys, huimaus, sekavuus, sekavuus, humalassa ja hengenahdistus.
Sekalaista
epänormaali kävely, anafylaktinen reaktio, nivelkipu, kohonnut verensokeri, tukehtuminen, huulihalkeama, kitalakihalkeama, kävelyvaikeudet, hengenahdistus, kasvojen turvotus, epänormaali olo, humalassa, yliherkkyys, astma, lihaskrampit, kurkun kireys, tinnitus, huimaus, painon lasku , paino nousi.
HUUMEIDEN VUOROVAIKUTUKSET
Lääkkeiden ja laboratoriotestien vuorovaikutukset
Seuraavat laboratoriotulokset voivat muuttua käytettäessä estrogeeni- ja progestiinihoitoa:
- Lisääntynyt sulfobromoftaleiiniretentio ja muut maksan toimintakokeet.
- Koagulaatiotestit: protrombiinitekijöiden VII, VIII, IX ja X nousu.
- Pregnanediolin määritys.
- Kilpirauhasen toiminta: PBI:n ja butanolilla uutettavaan proteiiniin sitoutuneen jodin lisääntyminen ja T3:n lasku ottoarvot.
VAROITUKSET
Katso LAATIKKO VAROITUS .
Kardiovaskulaariset häiriöt
Suurentunutta keuhkoembolian, syvän laskimotromboosin (DVT), aivohalvauksen ja sydäninfarktin riskiä on raportoitu käytettäessä estrogeeni- ja progestiinihoitoa. Jos jotain näistä ilmenee tai sitä epäillään, estrogeenihoito progestiinihoidon kanssa on lopetettava välittömästi.
Valtimoverisuonisairauden (esimerkiksi verenpainetaudin, diabetes mellitus, tupakoinnin, hyperkolesterolemia ja liikalihavuus) ja/tai laskimotromboembolian (esimerkiksi laskimotromboembolian [VTE], liikalihavuuden ja systeemisen lupus erythematosuksen) riskitekijät ) tulee hallita asianmukaisesti.
Aivohalvaus
Women's Health Initiativen (WHI) estrogeenin ja progestiinin alatutkimuksessa raportoitiin tilastollisesti merkitsevästi lisääntynyt aivohalvauksen riski 50–79-vuotiailla naisilla, jotka saivat päivittäin CE:tä (0,625 mg) plus MPA:ta (2,5 mg) verrattuna samanikäisiin naisiin. ryhmässä, joka sai lumelääkettä (33 vs. 25 per 10 000 naisvuotta). Riskin kasvu havaittiin ensimmäisen vuoden jälkeen ja jatkui. (Katso Kliiniset tutkimukset .) Jos aivohalvaus ilmenee tai sitä epäillään, estrogeeni- ja progestiinihoito tulee lopettaa välittömästi.
Sepelvaltimotauti
WHI-estrogeeni plus progestiini -alatutkimuksessa todettiin tilastollisesti merkityksetön lisääntynyt sepelvaltimotaudin (CHD) riski (määritelty ei-fataaliseksi sydäninfarktiksi [MI], hiljaiseksi sydäninfarktiksi tai sepelvaltimotautikuolemaksi) naisilla, jotka saivat päivittäistä CE:tä (0,625). mg) plus MPA (2,5 mg) verrattuna lumelääkettä saaviin naisiin (41 vs. 34/10 000 naisvuotta). Suhteellisen riskin lisääntyminen osoitettiin vuonna 1 ja suuntaus suhteellisen riskin pienenemiseen vuosina 2–5. (Katso Kliiniset tutkimukset .)
Postmenopausaalisilla naisilla, joilla on dokumentoitu sydänsairaus (n = 2 763, keski-ikä 66,7 vuotta), kontrolloidussa kliinisessä tutkimuksessa sydän- ja verisuonitautien sekundaarisesta ehkäisystä (Heart and Estrogen/Progestin Replacement Study [HERS]), hoito päivittäisellä CE:llä (0,625 mg) plus MPA (2,5 mg) ei osoittanut mitään hyötyä sydän- ja verisuonisairauksille. Keskimääräisen 4,1 vuoden seurannan aikana CE- ja MPA-hoito ei vähentänyt CHD-tapahtumien yleistä määrää postmenopausaalisilla naisilla, joilla oli todettu sepelvaltimotauti. CHD-tapahtumia esiintyi enemmän CE- ja MPA-hoitoryhmässä kuin lumeryhmässä vuonna 1, mutta ei seuraavina vuosina. Kaksituhatta kolmesataakaksikymmentäyksi (2 321) naista alkuperäisestä HERS-tutkimuksesta suostui osallistumaan avoimeen HERS-tutkimukseen, HERS II. Keskimääräinen seuranta HERS II:ssa oli vielä 2,7 vuotta, yhteensä 6,8 vuotta. Sepelvaltimotautitapahtumien määrät olivat vertailukelpoisia naisilla CE plus MPA -ryhmässä ja lumeryhmässä HERS:ssä, HERS II:ssa ja yleisesti.
Laskimotromboembolia
WHI-estrogeeni plus progestiini -alatutkimuksessa laskimotromboembolia (DVT ja keuhkoembolia [PE]) raportoitiin tilastollisesti merkitsevästi kaksinkertaiseksi naisilla, jotka saivat päivittäin CE:tä (0,625 mg) plus MPA:ta (2,5 mg) verrattuna lumelääkettä saaneisiin naisiin. 35 vs. 17 per 10 000 naisvuotta). Sekä syvän laskimotukoksen (26 vs. 13 per 10 000 naisvuotta) että PE (18 vs. 8 per 10 000 naisvuotta) riskin lisääntyminen on myös osoitettu tilastollisesti merkitsevästi. Laskimotautiriskin kasvu todettiin ensimmäisen vuoden aikana ja jatkui. (Katso Kliiniset tutkimukset .) Jos laskimotromboembolia ilmenee tai sitä epäillään, estrogeeni- ja progestiinihoito tulee lopettaa välittömästi.
Jos mahdollista, estrogeenin ja progestiinien käyttö tulee lopettaa vähintään 4–6 viikkoa ennen leikkausta, joka liittyy suurentuneeseen tromboembolian riskiin, tai pitkittyneen immobilisaation aikana.
Pahanlaatuiset kasvaimet
Rintasyöpä
Tärkein satunnaistettu kliininen tutkimus, joka tarjoaa tietoa rintasyövästä estrogeenin ja progestiinin käyttäjillä, on Women's Health Initiative (WHI) -alatutkimus päivittäinen CE (0,625 mg) ja MPA (2,5 mg). Keskimääräisen 5,6 vuoden seurannan jälkeen estrogeeni plus progestiini -alatutkimuksessa raportoitiin lisääntynyttä invasiivisen rintasyövän riskiä naisilla, jotka ottivat päivittäin CE:tä ja MPA:ta. Tässä alatutkimuksessa 26 prosenttia naisista ilmoitti aiemmin käyttäneen pelkän estrogeenihoitoa tai estrogeeni- ja progestiinihoitoa. Invasiivisen rintasyövän suhteellinen riski oli 1,24 (95 prosentin nCI, 1,01-1,54), ja absoluuttinen riski oli 41 vs. 33 tapausta 10 000 naisvuotta kohden CE:llä ja MPA:lla lumelääkkeeseen verrattuna. Naisilla, jotka ilmoittivat aiemmin käyttäneensä hormonihoitoa, invasiivisen rintasyövän suhteellinen riski oli 1,86 ja absoluuttinen riski oli 46 vs. 25 tapausta 10 000 naisvuotta kohden estrogeenin ja progestiinin suhteen lumelääkkeeseen verrattuna. Naisilla, jotka eivät ilmoittaneet käyttävänsä aiempaa hormonihoitoa, invasiivisen rintasyövän suhteellinen riski oli 1,09, ja absoluuttinen riski oli 40 vs. 36 tapausta 10 000 naisvuotta kohden CE:n ja MPA:n suhteen lumelääkkeeseen verrattuna. Samassa alatutkimuksessa invasiiviset rintasyövät olivat suurempia, ne olivat todennäköisemmin solmupositiivisia, ja ne diagnosoitiin edenneemmässä vaiheessa CE (0,625 mg) plus MPA (2,5 mg) ryhmässä verrattuna plaseboryhmään. Metastaattinen sairaus oli harvinainen, eikä kahden ryhmän välillä ilmennyt eroa. Muut prognostiset tekijät, kuten histologinen alatyyppi, luokka ja hormonireseptorin tila, eivät eronneet ryhmien välillä. (Katso Kliiniset tutkimukset .)
WHI:n kliinisten tutkimusten mukaisesti havainnointitutkimukset ovat myös raportoineet lisääntyneen rintasyövän riskin estrogeeni- ja progestiinihoidon yhteydessä ja pienemmän lisääntyneen riskin pelkällä estrogeenihoidolla useiden vuosien käytön jälkeen. Riski kasvoi käytön keston myötä ja näytti palautuvan lähtötasolle noin 5 vuoden kuluttua hoidon lopettamisesta (vain havainnointitutkimuksissa on merkittäviä tietoja riskistä lopettamisen jälkeen). Havainnointitutkimukset viittaavat myös siihen, että rintasyövän riski oli suurempi ja tuli ilmeiseksi aiemmin estrogeeni- ja progestiinihoidolla verrattuna pelkkään estrogeenihoitoon. Näissä tutkimuksissa ei kuitenkaan yleensä ole havaittu merkittävää vaihtelua rintasyövän riskissä eri estrogeeni- ja progestiiniyhdistelmien, -annosten tai antoreittien välillä.
Estrogeenin ja progestiinin käytön on raportoitu lisäävän epänormaaleja mammografioita, jotka vaativat lisäarviointia. Kaikkien naisten tulee käydä vuosittain rintojen tarkastuksessa terveydenhuollon tarjoajan toimesta ja tehdä rintojen itsetarkastus kuukausittain. Lisäksi mammografiatutkimukset tulee ajoittaa potilaan iän, riskitekijöiden ja aikaisempien mammografiatulosten perusteella.
Endometriumin syöpä
Kohdun limakalvosyövän riskin on raportoitu lisääntyneen, jos naisella on kohtuullinen estrogeenihoito. Raportoitu kohdun limakalvon syövän riski niillä, joilla ei ole estrogeenia, on noin 2–12 kertaa suurempi kuin ei-käyttäjillä, ja se näyttää riippuvan hoidon kestosta ja estrogeeniannoksesta. Useimmat tutkimukset osoittavat, ettei estrogeenien käyttöön liittyvää merkittävää lisääntynyttä riskiä ole alle vuoden ajan. Suurin riski liittyy pitkäaikaiseen käyttöön, ja riski kasvaa 15-24-kertaiseksi vähintään 5-10 vuoden ajan, ja tämän riskin on osoitettu jatkuvan vähintään 8-15 vuotta estrogeenihoidon lopettamisen jälkeen.
Kaikkien estrogeeni- ja progestiinihoitoa käyttävien naisten kliininen seuranta on tärkeää. Asianmukaiset diagnostiset toimenpiteet, mukaan lukien kohdennettu tai satunnainen kohdun limakalvonäyte tarvittaessa, tulee suorittaa pahanlaatuisten sairauksien poissulkemiseksi kaikissa diagnosoimattomien jatkuvien tai toistuvien epänormaalien sukuelinten verenvuodon tapauksissa. Ei ole näyttöä siitä, että luonnollisten estrogeenien käyttö johtaisi erilaiseen kohdun limakalvon riskiprofiiliin kuin synteettiset estrogeenit, joiden estrogeeniannos on sama. Progestiinin lisäämisen estrogeenihoitoon postmenopausaalisilla naisilla on osoitettu vähentävän kohdun limakalvon liikakasvun riskiä, joka voi olla kohdun limakalvosyövän esiaste.
Munasarjasyöpä
WHI-estrogeeni plus progestiini -alatutkimus raportoi tilastollisesti merkityksettömän lisääntyneen munasarjasyövän riskin. Keskimääräisen 5,6 vuoden seurannan jälkeen munasarjasyövän suhteellinen riski CE:llä ja MPA:lla verrattuna lumelääkkeeseen oli 1,58 (95 prosentin nCI, 0,77 – 3,24). CE plus MPA:n absoluuttinen riski lumelääkkeeseen verrattuna oli 4 tapausta 3 tapausta 10 000 naisvuotta kohden. Joissakin epidemiologisissa tutkimuksissa estrogeenin sekä progestiinin ja vain estrogeenia sisältävien tuotteiden käyttö, erityisesti vähintään 5 vuoden ajan, on yhdistetty lisääntyneeseen munasarjasyövän riskiin. Suurempaan riskiin liittyvä altistuksen kesto ei kuitenkaan ole johdonmukainen kaikissa epidemiologisissa tutkimuksissa, ja jotkut eivät raportoi mitään yhteyttä.
Todennäköinen dementia
Estrogeenin ja progestiinin Women's Health Initiative Memory Study (WHIMS) -tutkimuksessa, WHI:n apututkimuksessa, 4 532 postmenopausaalisella naisella, jotka olivat iältään 65–79 vuotta, satunnaistettiin saamaan päivittäistä CE:tä (0,625 mg) plus MPA:ta (2,5 mg) tai lumelääkettä.
WHIMS-estrogeeni plus progestiini -apututkimuksessa keskimääräisen 4 vuoden seurannan jälkeen 40 naisella CE- ja MPA-ryhmässä ja 21 naisella lumeryhmässä diagnosoitiin todennäköinen dementia. Todennäköisen dementian suhteellinen riski estrogeenin ja progestiinin suhteen lumelääkkeeseen verrattuna oli 2,05 (95 prosentin luottamusväli, 1,21-3,48). Todennäköisen dementian absoluuttinen riski CE- ja MPA-ryhmässä lumelääkkeeseen verrattuna oli 45 tapausta vastaan 22 tapausta 10 000 naisvuotta kohden. Ei tiedetä, pätevätkö nämä havainnot nuoremmille postmenopausaalisille naisille. (Katso Kliiniset tutkimukset ja VAROTOIMENPITEET , Geriatrinen käyttö .)
Näön poikkeavuudet
Verkkokalvon verisuonitromboosia on raportoitu estrogeenia saavilla potilailla. Lopeta estrogeeni- ja progestiinihoito tutkimusta odotettaessa, jos näön äkillinen osittainen tai täydellinen menetys tai jos äkillisesti puhkeaa proptoosi, diplopia tai migreeni. Jos tutkimuksessa paljastuu papilledeema tai verkkokalvon verisuonivaurioita, estrogeeni- ja progestiinihoito tulee lopettaa pysyvästi.
VAROTOIMENPITEET
Kenraali
Progestiinin lisääminen, kun naiselta ei ole tehty kohdunpoistoa
Tutkimukset progestiinin lisäämisestä 10 tai useamman päivän estrogeenin antosyklin aikana tai päivittäin estrogeenin kanssa jatkuvassa hoito-ohjelmassa ovat raportoineet endometriumin liikakasvun vähentyneestä ilmaantumisesta kuin pelkällä estrogeenihoidolla. Endometriumin hyperplasia voi olla kohdun limakalvosyövän esiaste.
On kuitenkin olemassa mahdollisia riskejä, jotka voivat liittyä progestiinien käyttöön estrogeenien kanssa verrattuna pelkkään estrogeenihoitoon. Näihin kuuluu lisääntynyt rintasyövän riski.
Nesteenpidätys
Progesteroni voi aiheuttaa jonkinasteista nesteen kertymistä. Naisia, joilla on sairauksia, joihin tämä tekijä saattaa vaikuttaa, kuten sydämen tai munuaisten vajaatoiminta, on syytä tarkkailla huolellisesti.
Huimaus ja uneliaisuus
PROMETRIUM-kapselit voivat aiheuttaa ohimenevää huimausta ja uneliaisuutta, ja niitä tulee käyttää varoen ajettaessa moottoriajoneuvoa tai käytettäessä koneita. PROMETRIUM-kapselit tulee ottaa yhtenä vuorokautisena annoksena ennen nukkumaanmenoa.
Potilastiedot
Kenraali
Tämä tuote sisältää maapähkinäöljyä, eikä sitä pidä käyttää, jos olet allerginen maapähkinöille.
Lääkäreitä kehotetaan keskustelemaan potilastiedotteen sisällöstä potilaiden kanssa, joille he määräävät PROMETRIUM 100 mg -kapseleita.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Progesteronin karsinogeenisuutta ei ole testattu eläimillä suun kautta annettaessa. Kun progesteroni istutettiin naarashiiriin, se aiheutti rintasyöpää, munasarjagranulosasolukasvaimia ja endometriumin stroomasarkoomia. Koirilla pitkäaikaiset lihaksensisäiset injektiot aiheuttivat nodulaarista hyperplasiaa ja hyvän- ja pahanlaatuisia rintasyöpäkasvaimia. Progesteronin ihonalaiset tai lihaksensisäiset injektiot lyhensivät latenssiaikaa ja lisäsivät rintarauhaskasvainten ilmaantuvuutta rotilla, joita oli aiemmin käsitelty kemiallisella karsinogeenillä.
Progesteroni ei osoittanut genotoksisuutta pistemutaatioiden tai kromosomivaurioiden in vitro -tutkimuksissa. Kromosomivaurioiden in vivo -tutkimukset ovat tuottaneet positiivisia tuloksia hiirillä oraalisilla annoksilla 1000 mg/kg ja 2000 mg/kg. Eksogeenisesti annetun progesteronin on osoitettu estävän ovulaatiota useissa lajeissa, ja on odotettavissa, että pitkäkestoiset suuret annokset heikentävät hedelmällisyyttä hoidon lopettamiseen saakka.
Raskaus
PROMETRIUM-kapseleita ei tule käyttää raskauden aikana. (Katso VASTA-AIHEET ).
Raskausluokka B
Lisääntymistutkimuksia on suoritettu hiirillä annoksilla, jotka ovat jopa 9-kertaisia ihmisen oraaliseen annokseen verrattuna, rotilla annoksilla, jotka ovat jopa 44-kertaisia ihmisen suun kautta otetuilla annoksilla, ja kaniineilla annoksella 10 mikrogrammaa/vrk, joka on annettu paikallisesti kohtuun implantoidulla laitteella. , marsuilla annoksilla, jotka ovat noin puolet ihmisen oraalisesta annoksesta ja reesusapinoilla annoksilla, jotka ovat suunnilleen ihmisen annoksia, kaikki perustuen kehon pinta-alaan, ja niillä on havaittu vain vähän tai ei ollenkaan merkkejä hedelmällisyyden heikkenemisestä tai sikiölle aiheutuneista haitoista. progesteroni.
Imettävät Naiset
Progestiinia saavien imettävien naisten maidosta on tunnistettu havaittavia määriä progestiinia. Varovaisuutta tulee noudattaa, kun PROMETRIUM 100 mg kapseleita annetaan imettävälle naiselle.
Käyttö lapsille
PROMETRIUM-kapseleita ei ole tarkoitettu lapsille. Lapsiväestöllä ei ole tehty kliinisiä tutkimuksia.
Geriatrinen käyttö
Kliinisissä tutkimuksissa, joissa käytettiin PROMETRIUM-kapseleita, ei ole osallistunut riittävästi iäkkäitä naisia sen määrittämiseksi, eroavatko yli 65-vuotiaat nuoremmista koehenkilöistä vastauksessaan PROMETRIUM 200 mg -kapseleille.
Naisten terveysaloitetutkimus
Women's Health Initiativen (WHI) estrogeenin ja progestiinin alatutkimuksessa (päivittäinen CE [0,625 mg] plus MPA [2,5 mg] plaseboon verrattuna) ei-fataalin aivohalvauksen ja invasiivisen rintasyövän suhteellinen riski oli suurempi yli 65-vuotiailla naisilla. . (Katso Kliiniset tutkimukset ja VAROITUKSET , Sydän- ja verisuonihäiriöt ja Pahanlaatuiset kasvaimet. )
Naisten terveysaloitteen muistitutkimus
Women's Health Initiative Memory Study (WHIMS) -tutkimuksessa postmenopausaalisilla 65–79-vuotiailla naisilla todennäköisen dementian riski oli suurempi estrogeenin ja progestiinin apututkimuksessa verrattuna lumelääkkeeseen. (Katso Kliiniset tutkimukset ja VAROITUKSET , Todennäköinen dementia. )
YLIANNOSTUS
Yliannostusta koskevia tutkimuksia ihmisillä ei ole tehty. Yliannostustapauksessa PROMETRIUM-kapseleiden käyttö on lopetettava ja potilasta tulee hoitaa oireenmukaisesti.
VASTA-AIHEET
PROMETRIUM-kapseleita ei tule käyttää naisille, joilla on jokin seuraavista sairauksista:
KLIININEN FARMAKOLOGIA
PROMETRIUM 200 mg kapselit ovat mikronisoidun progesteronin suun kautta otettava annosmuoto, joka on kemiallisesti identtinen munasarjaperäisen progesteronin kanssa. Progesteronin oraalinen hyötyosuus lisääntyy mikronisoinnin ansiosta.
Farmakokinetiikka
Imeytyminen
Progesteronin oraalisen annon jälkeen mikronisoituna pehmeägelatiinikapseliformulaationa maksimipitoisuudet seerumissa saavutettiin 3 tunnin kuluessa. Mikronisoidun progesteronin absoluuttista biologista hyötyosuutta ei tunneta. Taulukossa 1 on yhteenveto keskimääräisistä farmakokineettisistä parametreista postmenopausaalisilla naisilla viiden oraalisen 100 mg:n PROMETRIUM-kapseleiden päivittäisen annoksen jälkeen mikronisoiduna pehmeägelatiinikapseliformulaationa.
TAULUKKO 1. PROMETRIUM 200 mg -kapseleiden farmakokineettiset parametrit
Seerumin progesteronipitoisuudet näyttivät lineaarisilta ja suhteessa annokseen, kun PROMETRIUM 200 mg kapseleita annettiin 100 mg toistuvasti annosalueella 100 mg/vrk - 300 mg/vrk postmenopausaalisilla naisilla. Vaikka naisilla ei tutkittu suurempia kuin 300 mg:n vuorokausiannoksia, miehillä tehdyssä vapaaehtoisessa tutkimuksessa saadut seerumipitoisuudet näyttivät lineaarisista ja annoksesta verrannollisia välillä 100 mg/vrk ja 400 mg/vrk. Farmakokineettiset parametrit miehillä vapaaehtoisilla olivat yleensä yhdenmukaisia postmenopausaalisilla naisilla havaittujen parametrien kanssa.
Jakelu
Progesteronista noin 96–99 prosenttia sitoutuu seerumin proteiineihin, pääasiassa seerumin albumiiniin (50–54 prosenttia) ja transkortiiniin (43–48 prosenttia).
Aineenvaihdunta
Progesteroni metaboloituu pääasiassa maksassa suurelta osin pregnanedioleiksi ja pregnanoloneiksi. Pregnanediolit ja pregnanolonit konjugoituvat maksassa glukuronidi- ja sulfaattimetaboliiteiksi. Progesteronimetaboliitit, jotka erittyvät sappeen, voivat dekonjugoitua ja metaboloitua edelleen suolistossa pelkistyksen, dehydroksyloinnin ja epimeroinnin kautta.
Erittyminen
Pregnanediolin ja pregnanolonin glukuronidi- ja sulfaattikonjugaatit erittyvät sappeen ja virtsaan. Progesteronimetaboliitit eliminoituvat pääasiassa munuaisten kautta. Progesteronin metaboliitit, jotka erittyvät sappeen, voivat joutua enterohepaattiseen kierrätykseen tai ne voivat erittyä ulosteisiin.
Erikoispopulaatiot
PROMETRIUM-kapseleiden farmakokinetiikkaa ei ole arvioitu pienipainoisilla tai lihavilla potilailla.
Maksan vajaatoiminta
Maksan vajaatoiminnan vaikutusta PROMETRIUM 100 mg kapseleiden farmakokinetiikkaan ei ole tutkittu.
Munuaisten vajaatoiminta
Munuaisten vajaatoiminnan vaikutusta PROMETRIUM-kapseleiden farmakokinetiikkaan ei ole tutkittu.
Ruoan ja lääkkeen vuorovaikutus
Samanaikainen ruoan nauttiminen lisäsi PROMETRIUM 100 mg -kapseleiden biologista hyötyosuutta verrattuna paastotilaan, kun niitä annettiin postmenopausaalisille naisille 200 mg:n annoksella.
Huumeiden vuorovaikutukset
Ketokonatsoli esti progesteronin metaboliaa ihmisen maksan mikrosomeissa (IC50
Konjugoitujen estrogeenien ja PROMETRIUM 200 mg kapseleiden samanaikainen antaminen 29 postmenopausaaliselle naiselle 12 päivän aikana johti kokonaisestronipitoisuuksien (Cmax 3,68 ng/ml - 4,93 ng/ml) nousuun ja ekviliinin kokonaispitoisuuksien nousuun (Cmax 2,2 ng/ml). ng/ml) ja verenkierron 17β-estradiolipitoisuuksien lasku (Cmax 0,037 ng/ml - 0,030 ng/ml). Konjugoitujen estrogeenien puoliintumisaika oli samanlainen, kun PROMETRIUM-kapseleita annettiin samanaikaisesti. Taulukossa 2 on yhteenveto farmakokineettisistä parametreista.
TAULUKKO 2. Estradiolin, estronin ja ekviliinin farmakokineettisten parametrien keskiarvo (± SD) 0,625 mg:n konjugoitujen estrogeenien ja 200 mg:n PROMETRIUM-kapseleiden samanaikaisen annon jälkeen vaihdevuodet ohittaneille naisille
Kliiniset tutkimukset
Vaikutukset kohdun limakalvoon
Satunnaistetussa kaksoissokkoutetussa kliinisessä tutkimuksessa 358 postmenopausaalista naista, joilla kullakin oli ehjä kohtu, sai hoitoa jopa 36 kuukauden ajan. Hoitoryhmät olivat: PROMETRIUM-kapselit annoksella 200 mg päivässä 12 päivän ajan 28 päivän sykliä kohti yhdistettynä konjugoitujen estrogeenien kanssa 0,625 mg päivässä (n = 120); konjugoidut estrogeenit vain 0,625 mg päivässä (n = 119); tai lumelääkettä (n = 119). Koehenkilöt kaikissa kolmessa hoitoryhmässä olivat pääasiassa valkoihoisia naisia (87 prosenttia tai enemmän kustakin ryhmästä). Tulokset kohdun limakalvon liikakasvun esiintyvyydestä naisilla, jotka saivat korkeintaan 3 vuotta hoitoa, on esitetty taulukossa 3. PROMETRIUM-kapseleita ja konjugoituja estrogeenia saaneiden ryhmän vertailu vain konjugoituja estrogeeneja saaneeseen ryhmään osoitti, että hyperplasia oli huomattavasti pienempi (6 prosenttia). yhdistelmätuote verrattuna 64-prosenttiseen estrogeeniin yksinään) PROMETRIUM-kapselit ja konjugoidut estrogeenit -hoitoryhmässä 36 kuukauden hoidon ajan.
TAULUKKO 3. Endometriumin hyperplasian ilmaantuvuus naisilla, jotka ovat saaneet 3 vuoden hoitoa
Kohdun limakalvon liikakasvun diagnosointiaika 36 kuukauden hoidon aikana on esitetty kuvassa 1. Tämä kuva havainnollistaa graafisesti, että hyperplasiaa sairastavien potilaiden osuus oli merkittävästi suurempi konjugoitujen estrogeenien ryhmässä (64 prosenttia) verrattuna konjugoitujen estrogeenien ja PROMETRIUM-kapseleiden ryhmään. (6 prosenttia).
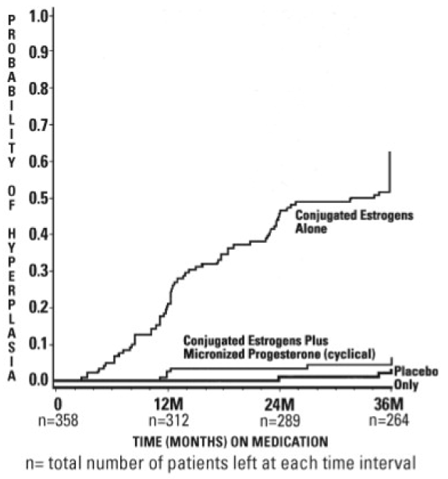
Kuva 1. Aika hyperplasiaan naisilla, jotka saavat enintään 36 kuukautta hoitoa
Hyperplasiasta johtuvat hoidon keskeyttämisluvut 36 kuukauden hoidon aikana on esitetty taulukossa 4. Kaikenasteisen hyperplasian tapauksessa konjugoituja estrogeeneja plus PROMETRIUM 100 mg kapseleita saaneiden potilaiden keskeyttämisprosentti oli samanlainen kuin lumelääkeryhmässä, kun taas Pelkästään konjugoituja estrogeeneja saaneiden potilaiden keskeyttämisprosentti oli merkittävästi korkeampi. Naiset, jotka lopettivat hoidon pysyvästi hyperplasian vuoksi, olivat demografiltaan samanlaisia kuin koko tutkimuspopulaatio.
TAULUKKO 4. Hyperplasiasta johtuva keskeyttämisprosentti yli 36 kuukauden hoidon aikana
Vaikutukset sekundaariseen amenorreaan
Yhden keskuksen, satunnaistetussa, kaksoissokkoutetussa kliinisessä tutkimuksessa, johon osallistui premenopausaalisilla naisilla, joilla oli sekundaarinen kuukautiset vähintään 90 päivän ajan, 10 päivän PROMETRIUM 200 mg kapseleita sisältävä hoito johti siihen, että 80 prosentilla naisista ilmeni vieroitusvuotoa 7 päivän sisällä viimeisestä annos PROMETRIUM 100 mg kapseleita, 300 mg päivässä (n = 20), verrattuna 10 prosenttiin naisista, jotka kokivat vieroitusvuotoa lumeryhmässä (n = 21).
Monikeskustutkimuksessa, rinnakkaisryhmissä, avoimessa markkinoille tulon jälkeisessä annostustutkimuksessa, johon kuului premenopausaalisilla naisilla, joilla oli sekundaarista kuukautisia vähintään 90 päivän ajan, 10 päivän ajan PROMETRIUM 100 mg -kapseleita kahden 28 päivän hoitojakson aikana, 300 mg päivässä (n= 107) tai 400 mg päivässä (n = 99) johti siihen, että 73,8 prosenttia ja 76,8 prosenttia naisista koki vieroitusvuotoa.
Erittymismuutosten nopeutta arvioitiin monikeskustutkimuksessa, satunnaistetussa, kaksoissokkoutetussa kliinisessä tutkimuksessa estrogeenivalmisteisilla postmenopausaalisilla naisilla. PROMETRIUM 100 mg:n kapselit, jotka annettiin suun kautta 10 päivän ajan annoksella 400 mg päivässä (n=22), aiheuttivat täydelliset eritysmuutokset kohdun limakalvossa 45 prosentilla naisista verrattuna 0 prosenttiin lumeryhmässä (n=23).
Toisessa monikeskustutkimuksessa, rinnakkaisryhmissä, avoimessa markkinoille tulon jälkeisessä annostustutkimuksessa premenopausaalisilla naisilla, joilla oli sekundaarinen kuukautiset vähintään 90 päivän ajan, arvioitiin myös eritysten muutoksen nopeus. Kaikki koehenkilöt saivat päivittäin oraalisia konjugoituja estrogeenejä 3 peräkkäisen 28 päivän hoitojakson aikana ja PROMETRIUM-kapseleita, 300 mg päivässä (n=107) tai 400 mg päivässä (n=99) 10 päivän ajan kustakin hoitosyklistä. Täydellisen erittyneen transformaation nopeus oli 21,5 prosenttia ja 28,3 prosenttia.
Naisten terveysaloitetutkimukset
Women's Health Initiative (WHI) otti noin 27 000 pääosin tervettä postmenopausaalista naista kahteen alatutkimukseen arvioidakseen päivittäin suun kautta otettavien konjugoitujen estrogeenien (CE) [0,625 mg] – yksinään tai yhdessä medroksiprogesteroniasetaatin (MPA) kanssa [2. lumelääkkeeseen verrattuna tiettyjen kroonisten sairauksien ehkäisyssä. Ensisijainen päätetapahtuma oli sepelvaltimotaudin [(CHD), joka määritellään ei-fataaliseksi sydäninfarktiksi (MI), hiljaiseksi sydäninfarktiksi ja sepelvaltimotautikuolemaksi] ilmaantuvuus, ja invasiivinen rintasyöpä oli ensisijainen haittavaikutus. "Maailmanlaajuiseen indeksiin" sisältyi sepelvaltimotaudin, invasiivisen rintasyövän, aivohalvauksen, keuhkoembolian (PE), kohdun limakalvosyövän (vain CE plus MPA -alatutkimuksessa), paksusuolensyövän, lonkkamurtuman tai muusta syystä johtuvan kuoleman varhaisimman esiintymisen. Näissä alatutkimuksissa ei arvioitu pelkän CE:n tai CE:n ja MPA:n vaikutuksia vaihdevuosien oireisiin.
WHI Estrogen Plus Progestin -alatutkimus
WHI estrogeeni plus progestiini -alatutkimus lopetettiin aikaisin. Ennalta määritellyn lopetussäännön mukaan keskimääräisen 5,6 vuoden hoidon seurannan jälkeen lisääntynyt rintasyövän ja sydän- ja verisuonitapahtumien riski ylitti "globaaliin indeksiin" sisältyvät määritellyt hyödyt. Tapahtumien absoluuttinen ylimääräinen riski "globaaliindeksissä" oli 19 per 10 000 naisvuotta.
Niille WHI:n "globaaliin indeksiin" sisältyville tuloksille, jotka saavuttivat tilastollisen merkitsevyyden 5,6 vuoden seurannan jälkeen, absoluuttinen ylimääräinen riski 10 000 naisvuotta kohden CE:llä ja MPA:lla hoidetussa ryhmässä oli 7 CHD-tapahtumaa enemmän, 8 aivohalvausta enemmän, 10 PE:tä lisää ja 8 invasiivista rintasyöpää lisää, kun taas absoluuttinen riskin väheneminen 10 000 naisvuotta kohden oli 6 vähemmän paksusuolen syöpää ja 5 vähemmän lonkkamurtumia.
Tulokset estrogeeni plus progestiini -alatutkimuksesta, johon osallistui 16 608 naista (keski-ikä 63 vuotta, vaihteluväli 50–79; 83,9 prosenttia valkoisia, 6,8 prosenttia mustia, 5,4 prosenttia latinalaisamerikkalaisia, 3,9 prosenttia muita) on esitetty taulukossa 5. Nämä tulokset heijastavat keskitetysti arvioidut tiedot keskimäärin 5,6 vuoden seurannan jälkeen.
TAULUKKO 5. Suhteellinen ja absoluuttinen riski WHI:n Estrogen Plus Progestin -alatutkimuksessa keskimäärin 5,6 vuoden iässä a, b
Estrogeeni- ja progestiinihoidon aloittamisen ajoitus suhteessa vaihdevuosien alkamiseen voi vaikuttaa yleiseen riski-hyötyprofiiliin. Iän mukaan ositettu WHI-estrogeeni plus progestiini -alatutkimus osoitti 50–59-vuotiailla naisilla ei-merkittävän suuntauksen kokonaiskuolleisuusriskin pienentämiseen [riskisuhde (HR) 0,69 (95 prosentin luottamusväli, 0,44–1,07)].
Naisten terveysaloitteen muistitutkimus
Estrogeeni ja progestiini WHIMS-tutkimukseen, WHI:n lisätutkimukseen, WHIMS-tutkimukseen osallistui 4 532 pääosin tervettä postmenopausaalista 65-vuotiasta ja sitä vanhempaa naista (47 prosenttia oli 65–69-vuotiaita ja 35 prosenttia 70–74-vuotiaita). ikä ja 18 prosenttia oli 75-vuotiaita ja vanhempia) arvioidakseen päivittäisen CE:n (0,625 mg) ja MPA:n (2,5 mg) vaikutuksia todennäköisen dementian ilmaantuvuuteen (ensisijainen tulos) lumelääkkeeseen verrattuna.
Keskimääräisen 4 vuoden seurannan jälkeen todennäköisen dementian suhteellinen riski CE- ja MPA-ryhmässä lumelääkkeeseen verrattuna oli 2,05 (95 prosentin luottamusväli, 1,21–3,48). Todennäköisen dementian absoluuttinen riski CE- ja MPA-ryhmässä lumelääkkeeseen verrattuna oli 45 vs. 22/10 000 naisvuotta. Tässä tutkimuksessa määritelty todennäköinen dementia sisälsi Alzheimerin taudin (AD), vaskulaarisen dementian (VaD) ja sekatyypin (joissa on sekä AD:n että VaD:n piirteitä). Yleisin todennäköisen dementian luokitus hoitoryhmässä ja lumeryhmässä oli AD. Koska liitännäistutkimus tehtiin 65–79-vuotiailla naisilla, ei tiedetä, pätevätkö nämä havainnot nuoremmille postmenopausaalisille naisille. (Katso VAROITUKSET , Todennäköinen dementia ja VAROTOIMENPITEET , Geriatrinen käyttö .)
POTILASTIEDOT
PROMETRIUM® (progesteroni, USP) Kapselit 100 mg & 200 mg
Lue nämä POTILASTIEDOT ennen kuin aloitat PROMETRIUM 200 mg -kapseleiden käytön ja lue, mitä saat joka kerta, kun täytät PROMETRIUM 100 mg -kapseleita. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi.
MIKÄ ON TÄRKEIN TIETO, JOITA MINUN TULISI TIETÄÄ PROMETRIUM 100 mg KAPSELEISTA (progesteronihormoni)?
- Progestiineja estrogeenien kanssa ei tule käyttää sydänsairauksien, sydänkohtausten, aivohalvausten tai dementian ehkäisyyn.
- Progestiinien käyttö estrogeenien kanssa voi lisätä mahdollisuutta saada sydänkohtauksia, aivohalvauksia, rintasyöpää ja verihyytymiä.
- Progestiinien käyttö estrogeenien kanssa voi lisätä dementian riskiä 65-vuotiailla ja sitä vanhemmilla naisilla tehdyn tutkimuksen perusteella.
- Sinun ja terveydenhuollon tarjoajasi tulee keskustella säännöllisesti siitä, tarvitsetko vielä hoitoa PROMETRIUM 100 mg kapseleilla.
TÄMÄ TUOTE SISÄLTÄÄ MAAPÄHKINÄÖLJYÄ EIKÄ TULE KÄYTTÄÄ, JOS OLET ALLERGINEN MAAPÄHKINÖILLE.
Mikä on PROMETRIUM 200 mg kapselit?
PROMETRIUM 100 mg kapselit sisältävät naishormonia nimeltä progesteroni.
Mihin PROMETRIUM 100 mg kapseleita käytetään?
Kuukautiskiertohäiriöiden hoito
PROMETRIUM 200 mg kapseleita käytetään sekundaarisen amenorrean (kuukautisten puuttuminen naisilla, joilla on aiemmin ollut kuukautiset) hoitoon, joka johtuu progesteronin vähenemisestä. Jos et tuota tarpeeksi progesteronia, kuukautiskierron epäsäännöllisyys voi ilmetä. Jos terveydenhuollon tarjoaja on todennut, että kehosi ei tuota riittävästi progesteronia yksinään, PROMETRIUM 200 mg kapseleita voidaan määrätä tarvitsemasi progesteronin saamiseksi.
Endometriumin suojaaminen (kohdun limakalvo)
PROMETRIUM 200 mg kapseleita käytetään yhdessä estrogeenia sisältävien lääkkeiden kanssa postmenopausaalisilla naisilla, joilla on kohtu. Pelkän estrogeenin ottaminen lisää todennäköisyyttä sairastua kohdun limakalvon liikakasvuksi ja joka voi johtaa kohdun limakalvon syöpään. Progestiinin lisäämistä suositellaan yleensä naisille, joilla on kohtu, jotta vähennetään mahdollisuutta saada kohtusyöpä.
Kuka ei saa ottaa PROMETRIUM-kapseleita?
Älä aloita PROMETRIUM-kapseleiden käyttöä, jos:
- Ovat allergisia maapähkinöille
- Sinulla on epätavallista emättimen verenvuotoa
- Sinulla on tällä hetkellä tai on ollut tiettyjä syöpiä Estrogeeni- ja progestiinihoito voi lisätä mahdollisuutta saada tietyntyyppiset syövät, mukaan lukien rinta- tai kohtusyöpä. Jos sinulla on tai on ollut syöpä, keskustele terveydenhuollon tarjoajan kanssa siitä, pitäisikö sinun ottaa PROMETRIUM-kapseleita.
- Sai aivohalvauksen tai sydänkohtauksen
- Sinulla on tällä hetkellä tai on ollut veritulppia
- Sinulla on tällä hetkellä tai on ollut maksaongelmia
- olet allerginen PROMETRIUM-kapseleille tai jollekin sen ainesosalle Katso PROMETRIUM 200 mg kapseleiden ainesosien luettelo tämän pakkausselosteen lopusta.
- Ajattele olevasi raskaana
Kerro terveydenhuollon tarjoajallesi:
- Jos imetät. PROMETRIUM 100 mg kapseleissa oleva hormoni voi erittyä äidinmaitoon.
- Kaikista lääketieteellisistä ongelmistasi. Terveydenhuollon tarjoajasi saattaa joutua tarkistamaan sinut tarkemmin, jos sinulla on tiettyjä sairauksia, kuten astma (hengityksen vinkuminen), epilepsia (kohtaukset), diabetes, migreeni, endometrioosi, lupus, sydämesi, maksan, kilpirauhasen tai munuaisten toimintahäiriöt tai sinulla on korkea kalsiumtaso veressäsi.
- Kaikista käyttämistäsi lääkkeistä. Tämä sisältää reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät. Jotkut lääkkeet voivat vaikuttaa PROMETRIUM 100 mg kapseleiden toimintaan. PROMETRIUM-kapselit voivat myös vaikuttaa muiden lääkkeiden tehoon.
Kuinka minun pitäisi ottaa PROMETRIUM 200 mg kapseleita?
Mitkä ovat PROMETRIUM-kapseleiden mahdolliset sivuvaikutukset?
Haittavaikutukset on ryhmitelty sen mukaan, kuinka vakavia ne ovat ja kuinka usein niitä esiintyy hoidon aikana:
Vakavia, mutta vähemmän yleisiä sivuvaikutuksia ovat:
- Riski sikiölle: Tapaukset, joissa on suulakihalkeama, huulihalkio, hypospadias, kammioväliseinävaurio, avoin valtimotiehye ja muut synnynnäiset sydänvauriot.
- Epänormaali veren hyytyminen: Aivohalvaus, sydänkohtaus, keuhkoembolia, näönmenetys tai sokeus.
Joitakin vakavien sivuvaikutusten varoitusmerkkejä ovat:
- Näön tai puheen muutokset
- Äkilliset uudet vakavat päänsäryt
- Vakavat kivut rinnassa tai jaloissa, joihin liittyy hengenahdistusta, heikkoutta ja väsymystä tai ei
- Huimaus ja pyörtyminen
- Oksentelu
Soita välittömästi terveydenhuollon tarjoajallesi, jos saat jonkin näistä varoitusmerkeistä tai muista epätavallisista oireista, jotka koskevat sinua.
Vähemmän vakavia, mutta yleisiä sivuvaikutuksia ovat:
- Päänsärkyä
- Rintojen kipu
- Epäsäännöllinen verenvuoto emättimestä tai tiputtelu
- Vatsa- tai vatsakrampit, turvotus
- Pahoinvointi ja oksentelu
- Hiustenlähtö
- Nesteenpidätys
- Emättimen hiivatulehdus
Nämä eivät ole kaikkia PROMETRIUM 200 mg kapseleiden mahdollisia sivuvaikutuksia. Lisätietoja sivuvaikutuksista saa terveydenhuollon tarjoajalta tai apteekista. Voit ilmoittaa sivuvaikutuksista AbbVie Inc:lle numerossa 1-800-633-9110 tai FDA:lle numerossa 1-800-FDA-1088.
Mitä voin tehdä vähentääkseni mahdollisuuksiani saada vakava sivuvaikutus PROMETRIUM 100 mg kapseleilla?
- Keskustele säännöllisesti terveydenhuollon tarjoajan kanssa siitä, pitäisikö sinun jatkaa PROMETRIUM 100 mg -kapseleiden käyttöä.
- Ota välittömästi yhteyttä terveydenhuollon tarjoajaan, jos saat epätavallista emättimen verenvuotoa PROMETRIUM-kapseleiden käytön aikana.
- Tee lantiontutkimus, rintojen tutkimus ja mammografia (rintojen röntgenkuva) joka vuosi, ellei terveydenhuollon tarjoaja kerro sinulle jotain muuta. Jos perheesi jäsenillä on ollut rintasyöpä tai jos sinulla on koskaan ollut rintasyövän tai poikkeavia mammografiatutkimuksia, sinun on ehkä tehtävä rintatutkimuksia useammin.
- Jos sinulla on korkea verenpaine, korkea kolesteroli (veren rasva), diabetes, olet ylipainoinen tai jos käytät tupakkaa, sinulla voi olla suurempi mahdollisuus saada sydänsairaus. Kysy terveydenhuollon tarjoajalta tapoja pienentää mahdollisuuksiasi saada sydänsairaus.
Yleistä tietoa PROMETRIUM-kapseleiden turvallisesta ja tehokkaasta käytöstä
- Lääkkeitä määrätään joskus sairauksiin, joita ei ole mainittu potilasohjeissa. Älä käytä PROMETRIUM-kapseleita sairauksiin, joihin sitä ei ole määrätty.
- Terveydenhuollon tarjoaja on määrännyt tämän lääkkeen sinulle ja sinulle yksin. Älä anna PROMETRIUM-kapseleita muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
- PROMETRIUM 200 mg kapselit tulee ottaa kerta-annoksena vuorokaudessa nukkumaan mennessä. Jotkut naiset voivat kokea voimakasta huimausta ja/tai uneliaisuutta hoidon alussa. Joissakin tapauksissa oireita voivat olla näön hämärtyminen, puhevaikeudet, kävelyvaikeudet ja epänormaali olo. Jos sinulla on näitä oireita, keskustele niistä välittömästi terveydenhuollon tarjoajan kanssa.
- Ole varovainen ajaessasi moottoriajoneuvoa tai käyttäessäsi koneita, koska huimausta tai uneliaisuutta voi esiintyä.
Pidä PROMETRIUM-kapselit poissa lasten ulottuvilta.
Tämä pakkausseloste sisältää yhteenvedon tärkeimmistä tiedoista PROMETRIUM 100 mg kapseleista. Jos haluat lisätietoja, keskustele terveydenhuollon tarjoajan tai apteekkihenkilökunnan kanssa. Voit kysyä tietoa PROMETRIUM 100mg -kapseleista, jotka on kirjoitettu terveydenhuollon ammattilaisille. Saat lisätietoja soittamalla maksuttomaan numeroon 1-800-633-9110.
Mitkä ovat PROMETRIUM-kapseleiden ainesosat?
Vaikuttava aine: 100 mg tai 200 mg mikronisoitua progesteronia
PROMETRIUM 100 mg kapseleiden inaktiivisia ainesosia ovat: maapähkinäöljy NF, gelatiini NF, glyseriini USP, lesitiini NF, titaanidioksidi USP, FD&C Red No. 40 ja D&C Yellow No. 10.
PROMETRIUM 200 mg kapseleiden inaktiivisia ainesosia ovat: maapähkinäöljy NF, gelatiini NF, glyseriini USP, lesitiini NF, titaanidioksidi USP, D&C Yellow No. 10 ja FD&C Yellow No. 6.
MITEN TOIMITETAAN
PROMETRIUM 200 mg kapselit 100 mg ovat pyöreitä, persikanvärisiä kapseleita, joissa on musta merkintä "SV".
PROMETRIUM 100 mg kapselit 200 mg ovat soikeita, vaaleankeltaisia kapseleita, joissa on musta merkintä ”SV2”.
Säilytä 25°C (77°F); sallitaan 15° - 30°C (59° - 86°F) [Katso USP Controlled Room Temperature].
