Arimidex 1mg Anastrozole Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Arimidex on ja miten sitä käytetään?
Arimidex 1mg on reseptilääke, jota käytetään rintasyövän oireiden hoitoon postmenopausaalisilla naisilla. Arimidexiä voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Arimidex kuuluu lääkeryhmään, jota kutsutaan antineoplastiksi, aromataasi-inhibiittoriksi.
Ei tiedetä, onko Arimidex turvallinen ja tehokas lapsille.
Mitkä ovat Arimidexin mahdolliset sivuvaikutukset?
Arimidex voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- hengenahdistus,
- luunmurtuma,
- turvonneet rauhaset,
- pahoinvointi,
- ylävatsakipu,
- kutina,
- väsymys,
- ruokahalun menetys,
- tumma virtsa,
- savenväriset ulosteet,
- ihon tai silmien keltaisuus (keltatauti),
- äkillinen puutuminen tai heikkous (etenkin toisella kehon puolella),
- äkillinen kova päänsärky,
- sammaltava puhe,
- näkö- tai tasapainoongelmia,
- kuume,
- kipeä kurkku,
- turvotus kasvoissasi tai kielessäsi,
- polttaa silmissäsi,
- ihokipu ja
- punainen tai violetti ihottuma, joka leviää (erityisesti kasvoille tai ylävartaloon), johon liittyy rakkuloita ja hilseilyä
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Arimidexin yleisimpiä sivuvaikutuksia ovat:
- heikkous,
- kuumia aaltoja,
- puutumista tai kihelmöintiä ihossasi,
- turvotus nilkoissasi tai jaloissasi,
- nivelkipu tai jäykkyys,
- ongelmia sormiesi kanssa tarttuessasi,
- kipeä kurkku,
- päänsärky,
- selkäkipu,
- luukipu,
- masennus,
- mielialan muutoksia,
- unihäiriöt (unettomuus),
- korkea verenpaine,
- kova päänsärky,
- näön hämärtyminen,
- hakkaa niskassasi tai korvissasi,
- pahoinvointi,
- oksentelua ja
- lievä ihottuma
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Arimidexin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
Suun kautta annettavat ARIMIDEX (anastrotsoli) tabletit sisältävät 1 mg anastrotsolia, ei-steroidista aromataasi-inhibiittoria. Sitä kuvataan kemiallisesti 1,3-bentseenidiasetonitriilinä, a, a, a', a'-tetrametyyli-5-(1 H-1,2,4-triatsol-1-yylimetyyli). Sen molekyylikaava on C17H19N5 ja sen rakennekaava on:
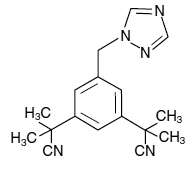
Anastrotsoli on luonnonvalkoinen jauhe, jonka molekyylipaino on 293,4. Anastrotsolilla on kohtalainen vesiliukoisuus (0,5 mg/ml 25 °C:ssa); liukoisuus on riippumaton pH:sta fysiologisella alueella. Anastrotsoli liukenee vapaasti metanoliin, asetoniin, etanoliin ja tetrahydrofuraaniin ja liukenee hyvin asetonitriiliin.
Jokainen tabletti sisältää inaktiivisina ainesosina: laktoosia, magnesiumstearaattia, hydroksipropyylimetyyliselluloosaa, polyetyleeniglykolia, povidonia, natriumtärkkelysglykolaattia ja titaanidioksidia.
INDIKAATIOT
Adjuvanttihoito
ARIMIDEX on tarkoitettu adjuvanttihoitoon postmenopausaalisilla naisilla, joilla on hormonireseptoripositiivinen varhainen rintasyöpä.
Ensilinjan hoito
ARIMIDEX 1mg on tarkoitettu ensilinjan hoitoon postmenopausaalisilla naisilla, joilla on hormonireseptoripositiivinen tai tuntematon paikallisesti edennyt tai metastaattinen rintasyöpä.
Toisen linjan hoito
ARIMIDEX 1mg on tarkoitettu pitkälle edenneen rintasyövän hoitoon postmenopausaalisilla naisilla, joiden sairaus etenee tamoksifeenihoidon jälkeen. Potilaat, joilla oli ER-negatiivinen sairaus ja potilaat, jotka eivät saaneet vastetta aikaisempaan tamoksifeenihoitoon, reagoivat harvoin ARIMIDEXiin.
ANNOSTELU JA HALLINNOINTI
Suositeltu annos
ARIMIDEX-annos on yksi 1 mg:n tabletti kerran vuorokaudessa. Potilaille, joilla on pitkälle edennyt rintasyöpä, ARIMIDEX 1 mg:n käyttöä tulee jatkaa kasvaimen etenemiseen asti. ARIMIDEX voidaan ottaa ruoan kanssa tai ilman.
Varhaisen rintasyövän adjuvanttihoidossa postmenopausaalisilla naisilla hoidon optimaalinen kesto ei ole tiedossa. ATAC-tutkimuksessa ARIMIDEX 1 mg annettiin viiden vuoden ajan [katso Kliiniset tutkimukset ].
Annoksen muuttaminen ei ole tarpeen potilaille, joilla on munuaisten vajaatoiminta tai iäkkäille potilaille [ks Käyttö tietyissä populaatioissa ].
Potilaat, joilla on maksan vajaatoiminta
Annoksen muuttamista ei suositella potilaille, joilla on lievä tai keskivaikea maksan vajaatoiminta. ARIMIDEXiä ei ole tutkittu potilailla, joilla on vaikea maksan vajaatoiminta [ks Käyttö tietyissä populaatioissa ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Tabletit ovat valkoisia, kaksoiskuperia, kalvopäällysteisiä, sisältävät 1 mg anastrotsolia. Tablettien toiselle puolelle on painettu logo, joka koostuu kirjaimesta "A" (iso kirjain) ja nuolenpää, joka on kiinnitetty "A":n pidennetyn oikean jalan jalkaan ja toiselle puolelle tabletin vahvuusmerkintä "Adx 1". ”.
Varastointi ja käsittely
Nämä tabletit toimitetaan 30 tabletin pulloissa ( NDC 0310-0201-30).
Varastointi
Säilytä kontrolloidussa huoneenlämmössä, 20-25 °C (68-77 °F) [katso USP ].
Jakelija: AstraZeneca Pharmaceuticals LP Wilmington, DE 19850. Tarkistettu: toukokuu 2014
SIVUVAIKUTUKSET
ARIMIDEXin aiheuttamat vakavat haittavaikutukset, joita esiintyy harvemmalla kuin yhdellä potilaalla 10 000:sta, ovat: 1) ihoreaktiot, kuten leesiot, haavaumat tai rakkulat; 2) allergiset reaktiot, joihin liittyy kasvojen, huulten, kielen ja/tai kurkun turvotusta. Tämä voi aiheuttaa nielemis- ja/tai hengitysvaikeuksia; ja 3) muutokset maksan toiminnan verikokeissa, mukaan lukien maksatulehdus, jonka oireita voivat olla yleinen huonovointisuus, keltatuksella tai ilman, maksakipua tai maksan turvotusta.
Yleisiä haittavaikutuksia (joiden ilmaantuvuus on ≥ 10 %) ARIMIDEX 1 mg:a saaneilla naisilla olivat: kuumat aallot, voimattomuus, niveltulehdus, kipu, nivelsärky, kohonnut verenpaine, masennus, pahoinvointi ja oksentelu, ihottuma, osteoporoosi, murtumat, selkäkipu, unettomuus, päänsärky, luukipu, perifeerinen turvotus, lisääntynyt yskä, hengenahdistus, nielutulehdus ja lymfaödeema.
ATAC-tutkimuksessa yleisin raportoitu haittavaikutus (> 0,1 %), joka johti hoidon lopettamiseen molemmissa hoitoryhmissä, olivat kuumat aallot, vaikka ARIMIDEX 1 mg -ryhmässä oli vähemmän potilaita, jotka keskeyttivät hoidon kuumien aaltojen vuoksi.
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Kokemus kliinisistä kokeista
Adjuvanttiterapia
Adjuvanttihoidon haittavaikutustiedot perustuvat ATAC-tutkimukseen [katso Kliiniset tutkimukset ]. Adjuvanttihoidon keston mediaani turvallisuusarvioinnissa oli 59,8 kuukautta ja 59,6 kuukautta potilailla, jotka saivat ARIMIDEXia 1 mg ja tamoksifeenia 20 mg.
Haittavaikutukset, joiden ilmaantuvuus on vähintään 5 % kummassakin hoitoryhmässä hoidon aikana tai 14 päivän sisällä hoidon päättymisestä, on esitetty taulukossa 1.
Tietyt haittavaikutukset ja haittavaikutusten yhdistelmät määriteltiin ennakoivasti analysoitavaksi perustuen näiden kahden lääkkeen tunnettuihin farmakologisiin ominaisuuksiin ja sivuvaikutusprofiileihin (katso taulukko 2).
Iskeemiset sydän- ja verisuonitapahtumat
Hoitoryhmien välillä 6186 potilaan kokonaispopulaatiossa ei ollut tilastollista eroa iskeemisissä kardiovaskulaarisissa tapahtumissa (4 % ARIMIDEX vs. 3 % tamoksifeeni).
Koko väestössä angina pectorista raportoitiin 71/3092 (2,3 %) potilaalla ARIMIDEX 1 mg:n ryhmässä ja 51/3094 (1,6 %) tamoksifeenihaarassa. sydäninfarkti raportoitiin 37/3092 (1,2 %) potilaalla ARIMIDEX 1 mg -haarassa ja 34 3094 (1,1 %) potilaalla tamoksifeenihaarassa.
Naisilla, joilla oli aiempaa iskeeminen sydänsairaus 465/6186 (7,5 %), iskeemisten kardiovaskulaaristen tapahtumien ilmaantuvuus oli 17 % ARIMIDEXia saaneilla potilailla ja 10 % tamoksifeenipotilailla. Tässä potilaspopulaatiossa angina pectorista raportoitiin 25/216 (11,6 %) ARIMIDEX-hoitoa saaneella potilaalla ja 13/249 (5,2 %) tamoksifeenia saaneella potilaalla. sydäninfarkti raportoitiin kahdella 216:sta (0,9 %) ARIMIDEXia saaneesta potilaasta ja 8:lla 249 (3,2 %) tamoksifeenia saaneesta potilaasta.
Luun mineraalitiheystulokset
ATAC-tutkimuksen luun alatutkimuksen tulokset 12 ja 24 kuukauden kohdalla osoittivat, että potilailla, jotka saivat 1 mg ARIMIDEXiä, sekä lannerangan että lonkan luun mineraalitiheyden (BMD) keskimääräinen lasku lähtötasoon verrattuna. Tamoksifeenia saaneilla potilailla oli sekä lannerangan että lonkan kokonais-BMD:n keskimääräinen nousu lähtötasoon verrattuna.
Koska ARIMIDEX alentaa verenkierron estrogeenitasoja, se voi vähentää luun mineraalitiheyttä.
Markkinoille tulon jälkeisessä tutkimuksessa arvioitiin ARIMIDEX 1 mg:n ja bisfosfonaattirisedronaatin yhteisvaikutuksia BMD:n muutoksiin lähtötilanteesta sekä luun resorption ja muodostumisen markkereihin postmenopausaalisilla naisilla, joilla oli hormonireseptoripositiivinen varhainen rintasyöpä. Kaikki potilaat saivat kalsium- ja D-vitamiinilisää. 12 kuukauden kohdalla havaittiin lannerangan luun mineraalitiheyden vähäistä laskua potilailla, jotka eivät saaneet bisfosfonaatteja. Bisfosfonaattihoito säilytti luun tiheyden useimmilla murtumariskissä olevilla potilailla.
Postmenopausaalisilla naisilla, joilla on varhainen rintasyöpä, jota on tarkoitus hoitaa ARIMIDEX 1 mg:lla, luuston tilaa tulee hoitaa hoitosuositusten mukaisesti, jotka ovat jo saatavilla postmenopausaalisilla naisilla, joilla on samanlainen haurausmurtuman riski.
Kolesteroli
ATAC-tutkimuksen aikana useammilla potilailla, jotka saivat 1 mg ARIMIDEXia, ilmoitettiin kohonneen seerumin kolesteroli verrattuna tamoksifeenia saaneisiin potilaisiin (9 % vs. 3,5 %).
Markkinoille tulon jälkeisessä tutkimuksessa arvioitiin myös ARIMIDEXin mahdollisia vaikutuksia lipidiprofiiliin. Lipidien ensisijaisessa analyysipopulaatiossa (pelkästään ARIMIDEX 1 mg) ei havaittu kliinisesti merkitsevää muutosta LDL-kolesteroliarvossa lähtötasosta 12 kuukauteen eikä HDL-kolesteroliarvossa lähtötasosta 12 kuukauteen.
Toissijaisessa lipidien populaatiossa (ARIMIDEX+risedronaatti) LDL-kolesteroli- ja HDL-kolesteroliarvoissa ei myöskään havaittu kliinisesti merkitseviä muutoksia lähtötilanteesta 12 kuukauteen.
Molemmissa lipidipopulaatioissa ei ollut kliinisesti merkitsevää eroa kokonaiskolesterolissa (TC) tai seerumin triglyserideissä (TG) 12 kuukauden kohdalla lähtötasoon verrattuna.
Tässä tutkimuksessa 12 kuukauden hoidolla pelkällä ARIMIDEX 1 mg:lla oli neutraali vaikutus lipidiprofiiliin. Myös ARIMIDEXin ja risedronaatin yhdistelmähoidolla oli neutraali vaikutus lipidiprofiiliin.
Tutkimus tarjoaa todisteita siitä, että vaihdevuodet ohittaneita naisia, joilla on varhainen rintasyöpä, jota on tarkoitus hoitaa ARIMIDEX 1 mg:lla, tulee hoitaa nykyisten kansallisen kolesterolikasvatusohjelman ohjeiden mukaisesti yksittäisten potilaiden, joilla on kohonnut LDL:n, sydän- ja verisuoniriskiin perustuva hoito.
Muut haittavaikutukset
ARIMIDEXia saaneilla potilailla nivelsairauksia (mukaan lukien niveltulehdus, niveltulehdus ja nivelkipu) esiintyi enemmän kuin tamoksifeenia saaneilla potilailla. ARIMIDEXia saaneilla potilailla oli lisääntynyt kaikkien murtumien (erityisesti selkärangan, lonkka- ja ranteenmurtumien) ilmaantuvuus [315 (10 %)] verrattuna tamoksifeenia saaneisiin potilaisiin [209 (7 %)].
Potilailla, jotka saivat ARIMIDEXia 1 mg, oli suurempi rannekanavaoireyhtymän ilmaantuvuus [78 (2,5 %)] verrattuna potilaisiin, jotka saivat tamoksifeenia [22 (0,7 %)].
Emättimen verenvuotoa esiintyi useammin tamoksifeenilla hoidetuilla potilailla kuin ARIMIDEX-hoitoa saaneilla potilailla 317 (10 %) ja vastaavasti 167 (5 %).
ARIMIDEXia saaneilla potilailla oli vähemmän kuumia aaltoja, emättimen verenvuotoa, emätinvuotoa, kohdun limakalvon syöpää, laskimotromboembolisia tapahtumia ja iskeemisiä aivoverisuonitapahtumia verrattuna tamoksifeenia saaneisiin potilaisiin.
10 vuoden mediaaniseurantaturvallisuustulokset ATAC-kokeesta
Tulokset ovat yhdenmukaisia aiempien analyysien kanssa.
Vakavat haittavaikutukset olivat samanlaisia ARIMIDEXin (50 %) ja tamoksifeenin (51 %) välillä.
- Kardiovaskulaariset tapahtumat vastasivat ARIMIDEXin ja tamoksifeenin tunnettuja turvallisuusprofiileja.
- Kaikkien ensimmäisten murtumien (sekä vakavien että ei-vakavien, joko hoidon aikana tai sen jälkeen) kumulatiivinen ilmaantuvuus oli korkeampi ARIMIDEX-ryhmässä (15 %) verrattuna tamoksifeeniryhmään (11 %). Tämä lisääntynyt ensimmäisten murtumien määrä hoidon aikana ei jatkunut hoidon jälkeisenä seurantajaksona.
- Uusien primaaristen syöpien kumulatiivinen ilmaantuvuus oli samanlainen ARIMIDEX 1 mg -ryhmässä (13,7 %) verrattuna tamoksifeeniryhmään (13,9 %). Aiempien analyysien mukaisesti kohdun limakalvosyöpä oli korkeampi tamoksifeeniryhmässä (0,8 %) verrattuna ARIMIDEX-ryhmään (0,2 %).
- Kuolemien kokonaismäärä (hoidon aikana tai sen ulkopuolella) oli samanlainen hoitoryhmissä. Tamoksifeeniryhmässä oli enemmän rintasyöpään liittyviä kuolemia kuin ARIMIDEX 1 mg -hoitoryhmässä.
Ensilinjan terapia
Haittavaikutukset, joiden ilmaantuvuus on vähintään 5 % kummassakin hoitoryhmässä tutkimuksissa 0030 ja 0027 hoidon aikana tai kahden viikon sisällä hoidon päättymisestä, on esitetty taulukossa 3.
Harvemmin raportoidut haittavaikutukset potilailla, jotka saivat ARIMIDEXia 1 mg l mg joko tutkimuksessa 0030 tai tutkimuksessa 0027, olivat samanlaisia kuin toisen linjan hoidossa raportoidut.
Toisen linjan hoidon tulosten ja tamoksifeenin vakiintuneen turvallisuusprofiilin perusteella analysoitiin tilastollisesti yhdeksän ennalta määritellyn haittatapahtumakategorian ilmaantuvuus, jotka mahdollisesti liittyivät yhteen tai molempiin hoitomuotoihin farmakologiansa vuoksi. Hoitoryhmien välillä ei havaittu merkittäviä eroja.
Toisen linjan terapia
ARIMIDEX 1mg siedettiin kahdessa kontrolloidussa kliinisessä tutkimuksessa (eli tutkimukset 0004 ja 0005), ja alle 3,3 % ARIMIDEX-hoitoa saaneista potilaista ja 4,0 % megestroliasetaattia saaneista potilaista lopetti hoidon haittavaikutuksen vuoksi.
Pääasiallinen haittavaikutus, joka oli yleisempi ARIMIDEXillä kuin megestroliasetaatilla, oli ripuli. Haittavaikutukset, joita raportoitiin yli 5 %:lla potilaista missä tahansa hoitoryhmässä näissä kahdessa kontrolloidussa kliinisessä tutkimuksessa, syy-yhteydestä riippumatta, on esitetty alla:
Keho kokonaisuutena: flunssa-oireyhtymä; kuume; Niskakipu; huonovointisuus; tapaturmavamma; infektio
Sydän: Hypertensio; tromboflebiitti
Maksa: Gamma GT lisääntynyt; SGOT kasvoi; SGPT lisääntynyt Hematologinen: Anemia; leukopenia
Aineenvaihdunta ja ravitsemus: Alkalinen fosfataasi lisääntynyt; painonpudotus
Seerumin keskimääräinen kokonaiskolesterolitaso nousi 0,5 mmol/l potilailla, jotka saivat ARIMIDEXia. LDL-kolesterolin nousun on osoitettu vaikuttavan näihin muutoksiin.
Tuki- ja liikuntaelimistö: myalgia; nivelkipu; patologinen murtuma
Hermostunut: Uneliaisuus; hämmennys; unettomuus; ahdistuneisuus; hermostuneisuus
Hengitys: Sinuiitti; keuhkoputkentulehdus; nuha
Iho ja lisäkkeet: Hiusten oheneminen (alopecia); kutina
Urogenitaaliset: Virtsatieinfektio; rintojen kipu
Seuraavien haittavaikutusryhmien ilmaantuvuus, joka voi olla syy-yhteydessä toiseen tai molempiin hoitoihin farmakologiansa vuoksi, analysoitiin tilastollisesti: painonnousu, turvotus, tromboembolinen sairaus, ruoansulatuskanavan häiriöt, kuumat aallot ja emättimen kuivuus. Nämä kuusi ryhmää ja ryhmissä havaitut haittavaikutukset määriteltiin ennakoivasti. Tulokset näkyvät alla olevassa taulukossa.
Markkinoinnin jälkeinen kokemus
Nämä haittavaikutukset on raportoitu vapaaehtoisesti epävarman kokoiselta populaatiolta. Siksi ei aina ole mahdollista arvioida luotettavasti niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeille altistumiseen. Seuraavia on raportoitu Arimidexin käytön jälkeen:
- Maksa-sappitapahtumat mukaan lukien alkalisen fosfataasin, alaniiniaminotransferaasin, aspartaattiaminotransferaasin, gamma-GT:n ja bilirubiinin kohoaminen; hepatiitti
- Ihottuma mukaan lukien tapaukset limakalvon häiriöistä, kuten erythema multiforme ja Stevens-Johnsonin oireyhtymä
- Allergisten reaktioiden tapaukset, mukaan lukien angioedeema, urtikaria ja anafylaksia [katso VASTA-AIHEET ]
- Myalgia, liipaisinsormi ja hyperkalsemia (lisäkilpirauhashormonin lisääntymisen kanssa tai ilman)
HUUMEIDEN VUOROVAIKUTUKSET
Tamoksifeeni
Anastrotsolin ja tamoksifeenin samanaikainen käyttö rintasyöpäpotilailla alensi anastrotsolin plasmapitoisuutta 27 %. Anastrotsolin ja tamoksifeenin samanaikainen anto ei kuitenkaan vaikuttanut tamoksifeenin tai N-desmetyylitamoksifeenin farmakokinetiikkaan. Keskimäärin 33 kuukauden seurantajaksolla ARIMIDEXin ja tamoksifeenin yhdistelmä ei osoittanut tehoa verrattuna tamoksifeeniin kaikilla potilailla eikä hormonireseptoripositiivisessa alapopulaatiossa. Tämä hoitohaara keskeytettiin tutkimuksesta [katso Kliiniset tutkimukset ]. ATAC-tutkimuksen kliinisten ja farmakokineettisten tulosten perusteella tamoksifeenia ei tule antaa anastrotsolin kanssa.
Estrogeeni
Estrogeenia sisältäviä hoitoja ei tule käyttää ARIMIDEX 1 mg:n kanssa, koska ne voivat heikentää sen farmakologista vaikutusta.
Varfariini
Tutkimuksessa, joka tehtiin 16 miespuolisella vapaaehtoisella, anastrotsoli ei muuttanut sekä R- että S-altistusta (mitattuna C max:lla ja AUC:lla) eikä antikoagulanttiaktiivisuutta (mitattuna protrombiiniajalla, aktivoidulla osittaisella tromboplastiiniajalla ja trombiiniajalla). varfariini.
Sytokromi P450 In vitro ja in vivo -tulosten perusteella on epätodennäköistä, että ARIMIDEX 1 mg:n samanaikainen anto vaikuttaisi muihin lääkkeisiin sytokromi P450:n eston seurauksena [ks. KLIININEN FARMAKOLOGIA ].
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Iskeemiset sydän- ja verisuonitapahtumat
Naisilla, joilla oli aiempaa iskeeminen sydänsairaus, iskeemisten kardiovaskulaaristen tapahtumien ilmaantuvuus havaittiin ARIMIDEXin käytön yhteydessä ATAC-tutkimuksessa (17 % potilaista, jotka saivat ARIMIDEX 1 mg:aa ja 10 % potilaista, jotka saivat tamoksifeenia). Harkitse ARIMIDEX-hoidon riskiä ja hyötyjä potilailla, joilla on aiempaa iskeeminen sydänsairaus [katso HAITTAVAIKUTUKSET ]
Bone Effects
ATAC-tutkimuksen luun alatutkimuksen tulokset 12 ja 24 kuukauden kohdalla osoittivat, että ARIMIDEX-hoitoa saaneilla potilailla oli keskimääräinen lasku sekä lannerangassa että lonkan kokonaisluun mineraalitiheydessä (BMD) lähtötasoon verrattuna. Tamoksifeenia saaneilla potilailla oli sekä lannerangan että lonkan kokonais-BMD:n keskimääräinen nousu lähtötasoon verrattuna. Harkitse luun mineraalitiheyden seurantaa potilailla, joita hoidetaan ARIMIDEXillä [katso HAITTAVAIKUTUKSET ].
Kolesteroli
ATAC-tutkimuksen aikana useammilla potilailla, jotka saivat 1 mg ARIMIDEXia, ilmoitettiin olevan kohonnut seerumin kolesteroli verrattuna potilaisiin, jotka saivat tamoksifeenia (9 % vs. 3,5 %) [ks. HAITTAVAIKUTUKSET ].
Potilasneuvontatiedot
Katso FDA:n hyväksymä potilasmerkintä (POTILASTIEDOT).
Raskaus
Potilaille tulee kertoa, että ARIMIDEX 1mg voi aiheuttaa haittaa sikiölle. Heille tulee myös kertoa, että ARIMIDEX 1mg ei ole tarkoitettu käytettäväksi premenopausaalisille naisille. siksi, jos he tulevat raskaaksi, heidän tulee lopettaa ARIMIDEXin käyttö ja ottaa välittömästi yhteyttä lääkäriin.
Allergiset (yliherkkyys) reaktiot
Potilaille tulee kertoa mahdollisista vakavista allergisista reaktioista, joihin liittyy kasvojen, huulten, kielen ja/tai kurkun turvotusta (angioödeema), jotka voivat aiheuttaa nielemis- ja/tai hengitysvaikeuksia, ja hakeuduttava välittömästi lääkärin hoitoon.
Iskeemiset sydän- ja verisuonitapahtumat
Potilaille, joilla on aiempaa iskeeminen sydänsairaus, tulee kertoa, että kardiovaskulaaristen tapahtumien ilmaantuvuuden on havaittu lisääntyneen ARIMIDEX 1 mg:n käytön yhteydessä verrattuna tamoksifeenin käyttöön. Jos potilaalla on uutta tai pahenevaa rintakipua tai hengenahdistusta, heidän on hakeuduttava välittömästi lääkärin hoitoon.
Bone Effects
Potilaille tulee kertoa, että ARIMIDEX alentaa estrogeenitasoa. Tämä voi johtaa luiden mineraalipitoisuuden menettämiseen, mikä saattaa heikentää luun lujuutta. Luiden mineraalipitoisuuden vähenemisen mahdollinen seuraus on murtumariskin lisääntyminen.
Kolesteroli
Potilaille tulee kertoa, että ARIMIDEX-hoidon aikana voidaan havaita kohonnutta kolesterolitasoa.
Kutitus, pistely tai tunnottomuus
Potilaille tulee kertoa, että jos he kokevat kutinaa, pistelyä tai puutumista, heidän tulee ilmoittaa asiasta terveydenhuollon tarjoajalleen.
Tamoksifeeni
Potilaita tulee neuvoa olemaan käyttämättä ARIMIDEXia tamoksifeenin kanssa.
Unohtuneet annokset
Kerro potilaille, että jos he unohtavat annoksen, ota se heti kun he muistavat. Jos on melkein aika ottaa seuraava annos, jätä unohtunut annos väliin ja ota seuraava säännöllisesti suunniteltu annos. Potilaat eivät saa ottaa kahta annosta samanaikaisesti.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Perinteinen karsinogeneesitutkimus rotilla 1,0 - 25 mg/kg/vrk (noin 10 - 243 kertaa ihmisen suurin suositeltu päivittäinen annos mg/m²:n perusteella) annettaessa suun kautta letkulla enintään 2 vuoden ajan, osoitti, että rotilla hepatosellulaarisen adenooman ja karsinooman ja kohdun stroomapolyyppien ilmaantuvuus naisilla ja kilpirauhasen adenooman ilmaantuvuus miehillä suurilla annoksilla. Naisilla havaittiin annoksesta riippuvaa munasarjojen ja kohdun hyperplasian ilmaantuvuuden lisääntymistä. Annoksella 25 mg/kg/vrk plasman AUC0-24 h -tasot rotilla olivat 110-125 kertaa korkeammat kuin postmenopausaalisilla vapaaehtoisilla suositellulla annoksella. Erillinen karsinogeenisuustutkimus hiirillä suun kautta annetuilla annoksilla 5–50 mg/kg/vrk (noin 24–243 kertaa suurempi suositeltu päivittäinen suurin annos mg/m²:n perusteella) enintään 2 vuoden ajan, lisäsi hyvänlaatuisten sairauksien ilmaantuvuutta. munasarjojen strooma-, epiteelisolu- ja granulosasolukasvaimet kaikilla annostasoilla. Naarashiirillä havaittiin myös annoksesta riippuvaa munasarjojen liikakasvun ilmaantuvuuden lisääntymistä. Näiden munasarjamuutosten katsotaan olevan aromataasin eston jyrsijäspesifisiä vaikutuksia, ja niiden merkitys ihmisille on kyseenalainen. Lymfosarkooman ilmaantuvuus lisääntyi miehillä ja naisilla suurilla annoksilla. Annoksella 50 mg/kg/vrk plasman AUC-arvot hiirillä olivat 35-40 kertaa korkeammat kuin postmenopausaalisilla vapaaehtoisilla suositellulla annoksella.
ARIMIDEX 1mg:n ei ole osoitettu olevan mutageeninen in vitro -testeissä (Ames- ja E. coli -bakteeritestit, CHO-K1-geenimutaatiomääritys) tai klastogeeninen joko in vitro (kromosomipoikkeamat ihmisen lymfosyyteissä) tai in vivo (mikrotumatesti rotilla) .
Anastrotsolin oraalinen antaminen naarasrotille (kahdesta viikosta ennen parittelua 7. raskauspäivään) aiheutti merkittävän hedelmättömyyden ilmaantumisen ja vähensi elinkelpoisten raskauksien määrää annoksella 1 mg/kg/vrk (noin 10 kertaa suositeltu ihmisannos mg/m²:n perusteella). ja 9 kertaa korkeampi kuin AUC0-24 h, joka havaittiin postmenopausaalisilla vapaaehtoisilla suositellulla annoksella). Ennen implantaatiota tapahtuvaa munasolujen tai sikiön menetystä lisääntyi annoksilla, jotka olivat yhtä suuria tai suurempia kuin 0,02 mg/kg/vrk (noin viidesosa ihmiselle suositellusta annoksesta mg/m²:n perusteella). Hedelmällisyyden palautuminen havaittiin 5 viikon annostelujakson jälkeen, jota seurasi 3 viikon annostelu. Ei tiedetä, viittaavatko nämä naarasrotilla havaitut vaikutukset ihmisen hedelmällisyyden heikkenemiseen.
Toistuvaannostutkimukset rotilla, joille annettiin anastrotsolia 6 kuukauden ajan annoksilla, jotka olivat yhtä suuria tai suurempia kuin 1 mg/kg/vrk (joka tuotti plasman anastrotsolin Cssmax- ja AUC 0-24 h -arvot, jotka olivat 19 ja 9 kertaa korkeammat kuin vastaavat postmenopausaalisilla arvoilla havaitut arvot vapaaehtoiset suositellulla annoksella) johti munasarjojen liikakasvuun ja follikulaaristen kystojen esiintymiseen. Lisäksi kohdun liikakasvua havaittiin kuuden kuukauden tutkimuksissa naaraskoirilla, joille annettiin annoksia, jotka olivat yhtä suuria tai suurempia kuin 1 mg/kg/vrk (jotka tuottivat plasman anastrotsoli Cssmax- ja AUC0-24 h -arvot, jotka olivat 22 kertaa ja 16 kertaa suuremmat kuin vastaavat arvot postmenopausaalisilla naisilla suositellulla annoksella). Ei tiedetä, liittyvätkö nämä eläinten lisääntymiselimiin kohdistuvat vaikutukset heikentyneeseen hedelmällisyyteen premenopausaalisilla naisilla.
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka X [katso VASTA-AIHEET ]
ARIMIDEX voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle, eikä siitä ole kliinistä hyötyä premenopausaalisille naisille, joilla on rintasyöpä. ARIMIDEX on vasta-aiheinen naisille, jotka ovat tai voivat tulla raskaaksi. Eläinkokeissa anastrotsoli aiheutti raskauden epäonnistumista, lisäsi raskauden katkeamista ja merkkejä sikiön kehityksen viivästymisestä. ARIMIDEX 1 mg:n käytöstä raskaana oleville naisille ei ole tehty tutkimuksia. Jos ARIMIDEX 1mg -valmistetta käytetään raskauden aikana tai jos potilas tulee raskaaksi tämän lääkkeen saamisen aikana, potilasta on informoitava mahdollisesta vaarasta sikiölle ja mahdollisesta raskauden menetyksen riskistä.
Lisääntymistutkimuksissa eläimillä raskaana olevat rotat ja kanit saivat anastrotsolia organogeneesin aikana annoksina, jotka olivat yhtä suuria tai suurempia kuin 1 (rotat) ja 1/3 (kanit) ihmisille suositellusta annoksesta mg/m²:n perusteella. Molemmissa lajeissa anastrotsoli läpäisi istukan, ja raskauden menetys lisääntyi (lisääntynyt ennen ja/tai sen jälkeen implantaatiota, lisääntynyt resorptio ja vähentynyt elävien sikiöiden lukumäärä). Rotilla nämä vaikutukset olivat annoksesta riippuvaisia, ja istukan painot lisääntyivät merkittävästi. Sikiötoksisuutta, mukaan lukien viivästynyt sikiön kehitys (eli epätäydellistä luutumista ja sikiön painon laskua), esiintyi rotilla anastrotsoliannoksilla, jotka tuottivat plasman huippupitoisuudet 19 kertaa korkeammat kuin seerumipitoisuudet ihmisillä terapeuttisella annoksella (AUC 0-24 tuntia 9 kertaa korkeampi). . Kaneissa anastrotsoli aiheutti tiineyden epäonnistumisen annoksilla, jotka olivat vähintään 16 kertaa ihmisille suositeltu annos mg/m²:n perusteella [ks. Eläinten toksikologia ja/tai farmakologia ].
Imettävät äidit
Ei tiedetä, erittyykö anastrotsoli äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon ja koska anastrotsolilla on eläinkokeissa todettu tuumorigeenisiä vaikutuksia tai koska imeväisillä voi esiintyä vakavia haittavaikutuksia, on päätettävä, lopetetaanko imetys vai lopetetaanko lääkehoito ottaen huomioon lääkkeen merkitys äidille.
Käyttö lapsille
Lapsipotilailla tehdyt kliiniset tutkimukset sisälsivät lumekontrolloidun tutkimuksen murrosikäisillä murrosikäisillä, gynekomastiaa sairastavilla pojilla ja yhden käden tutkimuksen tytöillä, joilla oli McCune-Albrightin oireyhtymä ja etenevä varhainen murrosikä. ARIMIDEX 1 mg:n tehoa murrosikäisen gynekomastian hoidossa nuorilla pojilla ja varhaisen murrosiän hoidossa tytöillä, joilla on McCune-Albrightin oireyhtymä, ei ole osoitettu.
Gynekomastiatutkimus
Satunnaistettuun, kaksoissokkoutettuun, lumekontrolloituun, monikeskustutkimukseen otettiin mukaan 80 murrosikäistä gynekomastiaa sairastavaa 11–18-vuotiasta poikaa. Potilaat satunnaistettiin saamaan joko 1 mg ARIMIDEXia tai lumelääkettä päivittäin. Kuuden kuukauden hoidon jälkeen ei ollut tilastollisesti merkitsevää eroa niiden potilaiden prosenttiosuudessa, joilla gynekomastia väheni ≥ 50 % (ensisijainen tehokkuusanalyysi). Toissijaiset tehokkuusanalyysit (absoluuttinen muutos rintojen tilavuudessa, niiden potilaiden prosenttiosuus, joilla gynekomastian laskettu tilavuus väheni, rintojen kivun erottuminen) olivat yhdenmukaisia ensisijaisen tehokkuusanalyysin kanssa. Seerumin estradiolipitoisuudet 6. hoitokuukaudella laskivat 15,4 % ARIMIDEX-ryhmässä ja 4,5 % lumelääkeryhmässä.
Haittavaikutuksia, jotka tutkijat arvioivat hoitoon liittyviksi, esiintyi 16,3 %:lla ARIMIDEX-hoitoa saaneista potilaista ja 8,1 %:lla lumelääkettä saaneista potilaista. Yleisimpiä olivat akne (7 % ARIMIDEX ja 2,7 % lumelääke) ja päänsärky (7 % ARIMIDEX 1 mg ja 0 % lumelääkettä); Kaikki muut haittavaikutukset osoittivat pieniä eroja hoitoryhmien välillä. Yksi ARIMIDEX 1 mg:lla hoidettu potilas keskeytti tutkimuksen kivesten laajentumisen vuoksi. Keskimääräinen lähtötasosta vähennetty kivesten tilavuuden muutos 6 kuukauden hoidon jälkeen oli + 6,6 ± 7,9 cm³ ARIMIDEX-hoitoa saaneilla potilailla ja + 5,2 ± 8,0 cm³ lumeryhmässä.
McCune-Albrightin oireyhtymätutkimus
Monikeskus, yksihaarainen, avoin tutkimus suoritettiin 28 tytölle, joilla oli McCune-Albrightin oireyhtymä ja etenevä varhaiskasvainen murrosikä 2–
Viisi potilasta (18 %) koki haittavaikutuksia, joiden katsottiin mahdollisesti liittyvän ARIMIDEXiin. Näitä olivat pahoinvointi, akne, raajakipu, kohonnut alaniinitransaminaasi- ja aspartaattitransaminaasiarvo sekä allerginen ihotulehdus.
Farmakokinetiikka lapsipotilailla
Kun lapsipotilaille annettiin 1 mg kerran vuorokaudessa toistuvasti, keskimääräinen aika anastrotsolin enimmäispitoisuuden saavuttamiseen oli 1 tunti. Anastrotsolin keskimääräiset (alue) jakautumisparametrit lapsipotilailla kuvattiin CL/F-arvolla 1,54 l/h (0,77-4,53 l/h) ja V/F-arvolla 98,4 l (50,7-330,0 l). Terminaalinen eliminaation puoliintumisaika oli 46,8 tuntia, mikä oli samanlainen kuin postmenopausaalisilla naisilla, joita hoidettiin anastrotsolilla rintasyöpään. Populaatiofarmakokineettisen analyysin perusteella anastrotsolin farmakokinetiikka oli samanlainen pojilla, joilla oli murrosikäinen gynekomastia, ja tytöillä, joilla oli McCune-Albrightin oireyhtymä.
Geriatrinen käyttö
Tutkimuksissa 0030 ja 0027 noin 50 % potilaista oli 65-vuotiaita tai vanhempia. ≥ 65-vuotiailla potilailla oli kohtalaisen parempi kasvainvaste ja aika kasvaimen etenemiseen kuin alle 65-vuotiailla potilailla satunnaistetusta hoidosta riippumatta. Tutkimuksissa 0004 ja 0005 50 % potilaista oli 65-vuotiaita tai vanhempia. Yli 65-vuotiailla ja nuoremmilla potilailla vasteprosentti ja etenemisaika olivat samanlaiset.
ATAC-tutkimuksessa 45 % potilaista oli 65-vuotiaita tai vanhempia. ARIMIDEXin 1 mg:n teho verrattuna tamoksifeeniin 65-vuotiailla tai sitä vanhemmilla potilailla (N=1413 ARIMIDEXillä ja N=1410 tamoksifeenilla, taudista vapaan eloonjäämisen riskisuhde oli 0,93 [95 % CI: 0,80, 1,08]). tehoa pienempi kuin alle 65-vuotiailla potilailla (N = 1712 ARIMIDEXilla ja N = 1706 tamoksifeenilla, sairaudettoman eloonjäämisen riskisuhde oli 0,79 [95 % CI: 0,67, 0,94]).
Ikä ei vaikuta anastrotsolin farmakokinetiikkaan.
Munuaisten vajaatoiminta
Koska vain noin 10 % anastrotsolista erittyy muuttumattomana virtsaan, munuaisten vajaatoiminta ei vaikuta kehon kokonaispuhdistumaan. Annoksen muuttaminen potilailla, joilla on munuaisten vajaatoiminta, ei ole tarpeen [katso ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
Maksan vajaatoiminta
Plasman anastrotsolipitoisuudet maksakirroosipotilailla olivat normaaleilla koehenkilöillä havaittujen pitoisuuksien alueella kaikissa kliinisissä tutkimuksissa. Siksi annoksen muuttaminen ei myöskään ole tarpeen potilailla, joilla on stabiili maksakirroosi. ARIMIDEXiä ei ole tutkittu potilailla, joilla on vaikea maksan vajaatoiminta [ks ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
ARIMIDEXillä on tehty kliinisiä tutkimuksia, enintään 60 mg kerta-annoksena terveille vapaaehtoisille miehille ja enintään 10 mg päivässä vaihdevuodet ohittaneille naisille, joilla on pitkälle edennyt rintasyöpä. nämä annokset olivat siedettyjä. Henkeä uhkaavia oireita aiheuttavaa kerta-annosta ARIMIDEX 1 mg ei ole vahvistettu. Yliannostukselle ei ole spesifistä vastalääkettä, ja hoidon tulee olla oireenmukaista. Ota huomioon yliannostuksen hoidossa, että useita lääkkeitä on saatettu ottaa. Jos potilas on hereillä, se voi oksentaa. Dialyysistä voi olla apua, koska ARIMIDEX ei ole voimakkaasti sitoutunut proteiineihin. Yleistä tukihoitoa, mukaan lukien säännöllinen elintoimintojen seuranta ja potilaan tarkka seuranta, on aiheellista.
VASTA-AIHEET
Raskaus ja Premenopausaaliset naiset
ARIMIDEX 1mg voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana oleville naisille, eikä siitä ole kliinistä hyötyä premenopausaalisille naisille, joilla on rintasyöpä. ARIMIDEX 1mg on vasta-aiheinen naisille, jotka ovat tai voivat tulla raskaaksi. Raskaana olevilla naisilla ei ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia ARIMIDEXin käytöstä. Jos ARIMIDEX 1mg -valmistetta käytetään raskauden aikana tai jos potilas tulee raskaaksi tämän lääkkeen käytön aikana, potilasta on informoitava mahdollisesta vaarasta sikiölle tai mahdollisesta raskauden menetyksen vaarasta [ks. Käyttö tietyissä populaatioissa ].
Yliherkkyys
ARIMIDEX 1mg on vasta-aiheinen kaikille potilaille, jotka ovat osoittaneet yliherkkyysreaktion lääkkeelle tai jollekin apuaineista. Havaittuihin reaktioihin kuuluvat anafylaksia, angioödeema ja urtikaria [katso HAITTAVAIKUTUKSET ]
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Monien rintasyöpien kasvua stimuloivat tai ylläpitävät estrogeenit.
Postmenopausaalisilla naisilla estrogeenit ovat pääasiassa peräisin aromataasientsyymin vaikutuksesta, joka muuttaa lisämunuaisen androgeenit (pääasiassa androsteenidionin ja testosteronin) estroniksi ja estradioliksi. Estrogeenin biosynteesin suppressio perifeerisissä kudoksissa ja itse syöpäkudoksessa voidaan siksi saada aikaan estämällä spesifisesti aromataasientsyymiä.
Anastrotsoli on selektiivinen ei-steroidinen aromataasin estäjä. Se alentaa merkittävästi seerumin estradiolipitoisuutta, eikä sillä ole havaittavissa olevaa vaikutusta lisämunuaisen kortikosteroidien tai aldosteronin muodostumiseen.
Farmakodynamiikka
Vaikutus estradioliin
Estradiolin keskimääräisiä seerumipitoisuuksia arvioitiin useissa päivittäisissä annostustutkimuksissa 0,5, 1, 3, 5 ja 10 mg:lla ARIMIDEXiä postmenopausaalisilla naisilla, joilla oli pitkälle edennyt rintasyöpä. Kliinisesti merkitsevä seerumin estradiolin suppressio havaittiin kaikilla annoksilla. 1 mg:n ja sitä suuremmat annokset johtivat estradiolin keskimääräisten seerumipitoisuuksien suppressioon havaitsemisen alarajalle (3,7 pmol/l). Suositeltu vuorokausiannos, ARIMIDEX 1 mg, alensi estradiolia noin 70 % 24 tunnin kuluessa ja noin 80 % 14 päivän päivittäisen annostelun jälkeen. Seerumin estradiolin esto säilyi 6 päivää ARIMIDEX 1 mg:n päivittäisen annostelun lopettamisen jälkeen.
ARIMIDEX 1 mg:n vaikutusta premenopausaalisilla naisilla, joilla on varhainen tai edennyt rintasyöpä, ei ole tutkittu. Koska lisämunuaisen androgeenien aromatisointi ei ole merkittävä estradiolin lähde premenopausaalisilla naisilla, ARIMIDEXin ei odoteta alentavan estradiolitasoja premenopausaalisilla naisilla.
Vaikutus kortikosteroideihin
Useissa päivittäisissä 3, 5 ja 10 mg:n annostustutkimuksissa anastrotsolin selektiivisyys arvioitiin tutkimalla vaikutuksia kortikosteroidisynteesiin. Anastrotsoli ei vaikuttanut kaikilla annoksilla kortisolin tai aldosteronin eritykseen lähtötilanteessa tai vasteena ACTH:lle. Anastrotsolin kanssa ei tarvita glukokortikoidi- tai mineralokortikoidikorvaushoitoa.
Muut endokriiniset vaikutukset
Useissa päivittäisissä annostustutkimuksissa 5 ja 10 mg:lla mitattiin kilpirauhasta stimuloivaa hormonia (TSH); TSH ei lisääntynyt ARIMIDEXin annon aikana. ARIMIDEXillä ei ole suoraa progestogeenista, androgeenista tai estrogeenista aktiivisuutta eläimissä, mutta se häiritsee verenkierrossa olevien progesteronin, androgeenien ja estrogeenien määrää.
Farmakokinetiikka
Imeytyminen
Aromataasiaktiivisuuden estyminen johtuu ensisijaisesti anastrotsolista, emolääkkeestä. Anastrotsolin imeytyminen on nopeaa ja plasman huippupitoisuudet saavutetaan tyypillisesti 2 tunnin sisällä annoksesta paastotilassa. Radioaktiivisella lääkkeellä tehdyt tutkimukset ovat osoittaneet, että suun kautta annettu anastrotsoli imeytyy hyvin systeemiseen verenkiertoon. Ruoka hidastaa anastrotsolin imeytymistä, mutta ei sen kokonaismäärää. Anastrotsolin keskimääräinen C max laski 16 % ja mediaani Tmax viivästyi 2 tunnista 5 tuntiin, kun anastrotsoli annettiin 30 minuuttia ruokailun jälkeen. Anastrotsolin farmakokinetiikka on lineaarinen annosalueella 1–20 mg, eikä se muutu toistuvien annosten yhteydessä. Anastrotsolin farmakokinetiikka oli samanlainen potilailla ja terveillä vapaaehtoisilla.
Jakelu
Vakaan tilan plasmapitoisuudet ovat noin 3-4 kertaa korkeammat kuin kerta-annoksen ARIMIDEX jälkeen havaitut tasot. Plasman pitoisuudet lähestyvät vakaan tilan tasoja noin 7 vuorokauden kuluttua annostelusta kerran päivässä. Anastrotsoli sitoutuu 40 % plasman proteiineihin terapeuttisella alueella.
Aineenvaihdunta
Anastrotsolin metabolia tapahtuu N-dealkylaatiolla, hydroksylaatiolla ja glukuronidaatiolla. Kolme anastrotsolin metaboliittia (triatsoli, hydroksi-anastrotsolin glukuronidikonjugaatti ja itse anastrotsolin glukuronidikonjugaatti) on tunnistettu ihmisen plasmasta ja virtsasta. Anastrotsolin tärkeimmällä kiertävällä metaboliitilla, triatsolilla, ei ole farmakologista aktiivisuutta.
Anastrotsoli esti sytokromi P450 1A2, 2C8/9 ja 3A4 katalysoimia reaktioita in vitro Ki-arvoilla, jotka olivat noin 30 kertaa korkeammat kuin keskimääräiset vakaan tilan Cmax-arvot, jotka havaittiin 1 mg:n vuorokausiannoksen jälkeen. Anastrotsolilla ei ollut estävää vaikutusta sytokromi P450 2A6:n tai 2D6:n katalysoimiin reaktioihin in vitro. Anastrotsolin kerta-annos 30 mg/kg tai useita 10 mg/kg anastrotsoliannoksia terveille koehenkilöille ei vaikuttanut antipyriinin puhdistumaan tai antipyriinimetaboliittien erittymiseen virtsaan.
Erittyminen
85 prosenttia radioleimatusta anastrotsolista löydettiin ulosteista ja virtsasta. Maksametabolia vastaa noin 85 % anastrotsolin eliminaatiosta. Munuaisten kautta tapahtuvan eliminaation osuus kokonaispuhdistumasta on noin 10 %. Anastrotsolin keskimääräinen eliminaation puoliintumisaika on 50 tuntia.
Sukupuolen ja iän vaikutus
Anastrotsolin farmakokinetiikkaa on tutkittu postmenopausaalisilla vapaaehtoisilla naisilla ja rintasyöpäpotilailla. Ikään liittyviä vaikutuksia ei havaittu alle 50-> 80-vuotiailla.
Rodun vaikutus
Estradiolin ja estronisulfaatin seerumipitoisuudet olivat samanlaiset japanilaisilla ja valkoihoisilla postmenopausaalisilla naisilla, jotka saivat 1 mg anastrotsolia päivittäin 16 päivän ajan. Anastrotsolin keskimääräiset vakaan tilan vähimmäispitoisuudet plasmassa valkoihoisilla ja japanilaisilla postmenopausaalisilla naisilla olivat 25,7 ja 30,4 ng/ml.
Munuaisten vajaatoiminnan vaikutus
Anastrotsolin farmakokinetiikkaa on tutkittu potilailla, joilla on munuaisten vajaatoiminta. Anastrotsolin munuaispuhdistuma pieneni suhteessa kreatiniinipuhdistumaan ja oli noin 50 % pienempi vapaaehtoisilla, joilla oli vaikea munuaisten vajaatoiminta (kreatiniinipuhdistuma ANNOSTELU JA HALLINNOINTI ja Käyttö tietyissä populaatioissa ].
Maksan vajaatoiminnan vaikutus
Anastrotsolin farmakokinetiikkaa on tutkittu henkilöillä, joilla on alkoholin väärinkäyttöön liittyvä maksakirroosi. Anastrotsolin näennäinen oraalinen puhdistuma (CL/F) oli noin 30 % pienempi potilailla, joilla oli stabiili maksakirroosi kuin kontrollihenkilöillä, joiden maksatoiminta oli normaali. Nämä plasmapitoisuudet olivat kuitenkin edelleen normaaleilla koehenkilöillä havaittujen arvojen alueella. Vaikean maksan vajaatoiminnan vaikutusta ei ole tutkittu. Annosta ei tarvitse muuttaa vakaan maksakirroosin vuoksi [katso ANNOSTELU JA HALLINNOINTI ja Käyttö tietyissä populaatioissa ].
Eläinten toksikologia ja/tai farmakologia
Lisääntymistoksikologia
Anastrotsolin on todettu läpäisevän istukan rotille ja kaniineille suun kautta annetun annoksen 0,1 mg/kg jälkeen (noin 1 ja 1,9-kertainen ihmiselle suositeltuun annokseen verrattuna mg/m²:n perusteella). Tutkimukset sekä rotilla että kaniineilla annoksilla, jotka ovat yhtä suuria tai suurempia kuin 0,1 ja 0,02 mg/kg/vrk (noin 1 ja 1/3 ihmisen suositellusta annoksesta mg/m²:n perusteella), jotka annettiin hoidon aikana. organogeneesi osoitti, että anastrotsoli lisäsi raskauden menetystä (lisääntyi ennen ja/tai sen jälkeen implantaatiota, lisääntynyt resorptio ja vähentynyt elävien sikiöiden lukumäärä); vaikutukset olivat annosriippuvaisia rotilla. Istukan painot lisääntyivät merkittävästi rotilla annoksilla 0,1 mg/kg/vrk tai enemmän.
Todisteita sikiötoksisuudesta, mukaan lukien viivästynyt sikiön kehitys (eli epätäydellinen luustuminen ja sikiön painon lasku), havaittiin rotilla, joille annettiin 1 mg/kg/vrk annoksia (joka tuotti plasman anastrotsoli Cssmax- ja AUC 0-24 tuntia, jotka olivat 19-kertaiset ja 9 kertaa korkeampi kuin vastaavat arvot, jotka havaittiin postmenopausaalisilla vapaaehtoisilla suositellulla annoksella). Rotilla ei ollut näyttöä teratogeenisuudesta, kun annettiin annoksia enintään 1,0 mg/kg/vrk. Kaneissa anastrotsoli aiheutti tiineyden epäonnistumisen annoksilla, jotka olivat yhtä suuria tai suurempia kuin 1,0 mg/kg/vrk (noin 16 kertaa suositeltu ihmisannos mg/m²:n perusteella laskettuna); ei ollut näyttöä teratogeenisuudesta kaniineilla, kun annettiin 0,2 mg/kg/vrk (noin 3 kertaa ihmiselle suositeltu annos mg/m²:n perusteella).
Kliiniset tutkimukset
Rintasyövän adjuvanttihoito postmenopausaalisilla naisilla
Monikeskus, kaksoissokkotutkimus (ATAC) satunnaistettiin 9 366 postmenopausaalista naista, joilla oli leikattavissa oleva rintasyöpä, lisähoitoon ARIMIDEX 1 mg vuorokaudessa, tamoksifeeni 20 mg vuorokaudessa tai näiden kahden hoidon yhdistelmä viiden vuoden ajan tai taudin uusiutumiseen saakka.
Tutkimuksen ensisijainen päätetapahtuma oli sairaudesta vapaa eloonjääminen (eli aika etäisen tai paikallisen uusiutumisen esiintymiseen tai vastapuolen rintasyöpään tai kuolemaan mistä tahansa syystä). Tutkimuksen toissijaisiin päätepisteisiin kuuluivat taudista vapaa eloonjääminen, kontralateraalisen rintasyövän ilmaantuvuus ja kokonaiseloonjääminen. Keskimäärin 33 kuukauden seurantajaksolla ARIMIDEXin ja tamoksifeenin yhdistelmä ei osoittanut minkäänlaista tehokkuusetua verrattuna tamoksifeeniin kaikilla potilailla eikä hormonireseptoripositiivisessa alapopulaatiossa. Tämä hoitohaara keskeytettiin tutkimuksesta. ATAC-tutkimuksen kliinisten ja farmakokineettisten tulosten perusteella tamoksifeenia ei tule antaa anastrotsolin kanssa [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Demografiset ja muut lähtötilanteen ominaisuudet olivat samanlaiset kolmen hoitoryhmän välillä (katso taulukko 7).
ATAC-tutkimuksen kahdessa monoterapiahaarassa olevia potilaita hoidettiin keskimäärin 60 kuukautta (5 vuotta), ja niitä seurattiin keskimäärin 68 kuukauden ajan. Taudista vapaa eloonjääminen intent-to-treat -populaatiossa parani tilastollisesti merkitsevästi [hazard Ratio (HR) = 0,87, 95 % CI: 0,78, 0,97, p = 0,0127] ARIMIDEX-haarassa verrattuna tamoksifeeniryhmään. Hormonireseptoripositiivisessa alapopulaatiossa, joka edusti noin 84 % tutkimuksen potilaista, sairaudesta vapaa eloonjääminen parani myös tilastollisesti merkitsevästi (HR = 0,83, 95 % CI: 0,73, 0,94, p = 0,0049) ARIMIDEX 1 mg -ryhmässä verrattuna tamoksifeeni käsi.
Kuva 1: Kaplan Meierin eloonjäämiskäyrä sairaudesta kaikille potilaille, jotka on satunnaistettu saamaan 1 mg ARIMIDEX- tai tamoksifeenimonoterapiaa ATAC-tutkimuksessa (Intent-to-Treat) 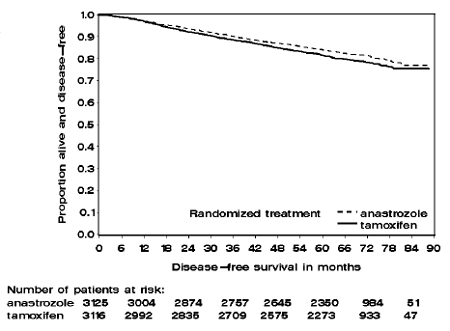
Kuva 2: ATAC-tutkimuksessa ARIMIDEX- tai tamoksifeenimonoterapiaan satunnaistettujen potilaiden hormonireseptoripositiivisten osapopulaatioiden taudista vapaa eloonjääminen 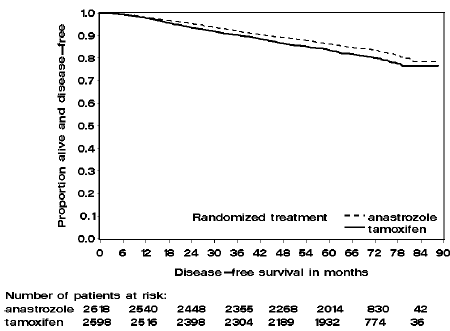
Eloonjäämistiedot 68 kuukauden seurannassa on esitetty taulukossa 9.
Potilasryhmässä, joka oli aiemmin saanut adjuvanttia kemoterapiaa (N = 698 ARIMIDEX 1 mg:lle ja N = 647 tamoksifeenille), riskisuhde taudista vapaalle eloonjäämiselle oli 0,91 (95 % CI: 0,73 - 1,13) ARIMIDEX-haarassa verrattuna tamoksifeenivarsi.
Yksittäisten tapahtumien esiintymistiheys intent-to-treat -populaatiossa ja hormonireseptoripositiivisessa alapopulaatiossa on kuvattu taulukossa 8.
Yhteenveto tutkimuksen tehokkuudesta on taulukossa 9.
10 vuoden mediaaniseuranta Tehokkuustulokset ATAC-tutkimuksesta
Myöhemmässä ATAC-tutkimuksen analyysissä potilaita seurattiin molemmissa monoterapiahaaroissa keskimäärin 120 kuukautta (10 vuotta). Potilaat saivat tutkimushoitoa keskimäärin 60 kuukautta (5 vuotta) (ks. taulukko 10).
Kuva 3: Taudista selviytymiskäyrä Kaplan Meierin eloonjäämiskäyrä kaikille potilaille, jotka on satunnaistettu ARIMIDEX- tai tamoksifeenimonoterapiaan ATAC-tutkimuksessa (Intent-to-Treat)a 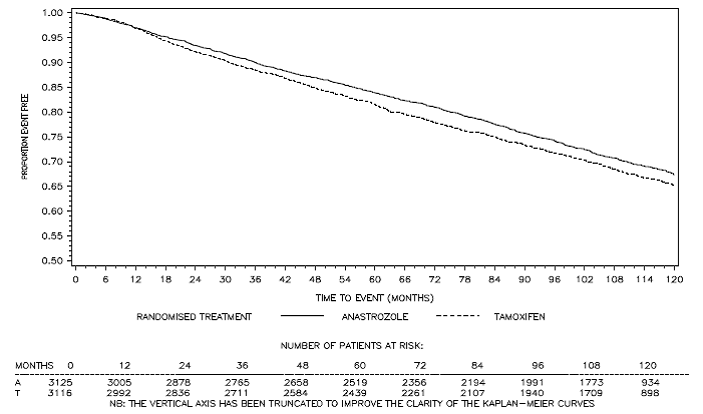
a Potilaiden osuus, joita seurattiin 120 kuukautta, oli 29,4 %.
Kuva 4: Tautiton eloonjääminen hormonireseptoripositiivisille potilaille, jotka on satunnaistettu saamaan 1 mg ARIMIDEX- tai tamoksifeenimonoterapiaa ATAC-tutkimuksessa 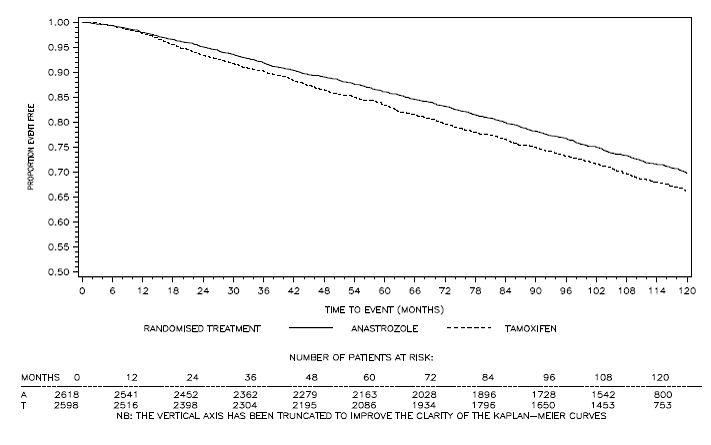
b Potilaiden osuus, joita seurattiin 120 kuukautta, oli 29,8 %.
Ensilinjan hoito postmenopausaalisille naisille, joilla on pitkälle edennyt rintasyöpä
Kaksi samankaltaista kaksoissokkoutettua, kontrolloitua kliinistä tutkimusta (0030, pohjoisamerikkalainen tutkimus ja 0027, pääasiassa eurooppalainen tutkimus) suoritettiin arvioimaan ARIMIDEX 1mg:n tehoa verrattuna tamoksifeenin ensilinjan hoitona hormonireseptoripositiivisille tai hormonireseptoripositiivisille potilaille. tuntematon paikallisesti levinnyt tai metastaattinen rintasyöpä postmenopausaalisilla naisilla. Yhteensä 1021 30–92-vuotiasta potilasta satunnaistettiin saamaan koehoitoa. Potilaat satunnaistettiin saamaan 1 mg ARIMIDEXiä 1 mg kerran vuorokaudessa tai 20 mg tamoksifeenia kerran päivässä. Molempien tutkimusten ensisijaiset päätetapahtumat olivat aika kasvaimen etenemiseen, objektiivinen tuumorivaste ja turvallisuus.
Demografiset ja muut lähtötilanteen ominaisuudet, mukaan lukien potilaat, joilla oli mitattavissa oleva sairaus ja ei mitattavissa olevaa sairautta, potilaat, joille annettiin aiempaa liitännäishoitoa, etäpesäkkeisen taudin paikka ja etninen alkuperä olivat samanlaiset molemmissa hoitoryhmissä molemmissa tutkimuksissa. Seuraavassa taulukossa on yhteenveto hormonireseptorin tilasta tulohetkellä kaikille satunnaistetuille potilaille tutkimuksissa 0030 ja 0027.
Ensisijaisten päätepisteiden osalta tutkimus 0030 osoitti, että ARIMIDEXillä oli tilastollisesti merkitsevä etu tamoksifeeniin verrattuna (p=0,006) kasvaimen etenemiseen kuluvan ajan suhteen; objektiiviset kasvainvasteet olivat samanlaiset ARIMIDEX 1 mg:n ja tamoksifeenin kohdalla. Koe 0027 osoitti, että ARIMIDEX 1 mg:lla ja tamoksifeenilla oli samanlainen objektiivinen kasvainvaste ja aika kasvaimen etenemiseen (katso taulukko 12 ja kuvat 5 ja 6).
Alla olevassa taulukossa 12 on yhteenveto kokeiden 0030 ja 0027 tuloksista ensisijaisten tehokkuuden päätepisteiden osalta.
Kuva 5: Kaplan-Meier-ajan todennäköisyys taudin etenemiseen kaikilla satunnaistetuilla potilailla (intent-to-treat) tutkimuksessa 0030 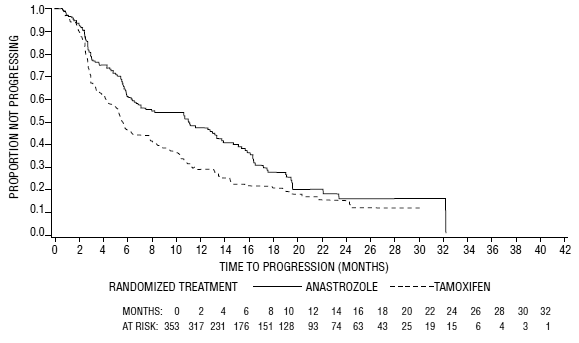
Kuva 6: Kaplan-Meier-ajan todennäköisyys etenemiseen kaikilla satunnaistetuilla potilailla (intent-to-treat) tutkimuksessa 0027 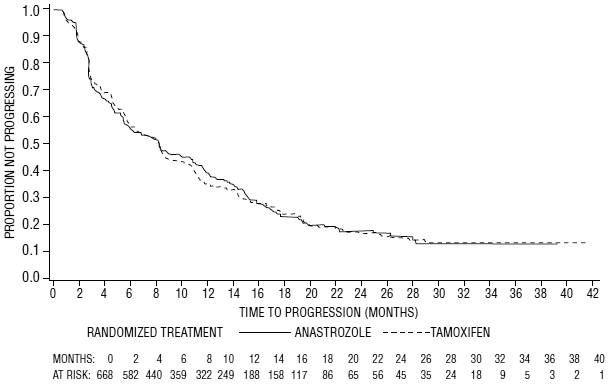
Toissijaisten päätetapahtumien tulokset tukivat ensisijaisten tehokkuuspäätemuuttujien tuloksia. Kummankin tutkimuksen hoitoryhmissä esiintyi liian vähän kuolemantapauksia, jotta voitaisiin tehdä johtopäätöksiä kokonaiseloonjäämiseroista.
Toisen linjan hoito postmenopausaalisilla naisilla, joilla on pitkälle edennyt rintasyöpä ja joilla oli taudin eteneminen tamoksifeenihoidon jälkeen
Anastrotsolia tutkittiin kahdessa kontrolloidussa kliinisessä tutkimuksessa (0004, pohjoisamerikkalainen tutkimus; 0005, pääasiassa eurooppalainen tutkimus) postmenopausaalisilla naisilla, joilla oli pitkälle edennyt rintasyöpä ja joiden sairaus eteni joko edenneen tai varhaisen rintasyövän tamoksifeenihoidon jälkeen. Jotkut potilaista olivat myös saaneet aikaisempaa sytotoksista hoitoa. Useimmat potilaat olivat ER-positiivisia; pienempi osa oli ER-tuntematonta tai ER-negatiivista; ER-negatiiviset potilaat olivat kelvollisia vain, jos heillä oli ollut positiivinen vaste tamoksifeenille. Tukikelpoiset potilaat, joilla oli mitattavissa oleva ja ei-mitattavissa oleva sairaus, satunnaistettiin saamaan joko kerta-annoksena 1 mg tai 10 mg ARIMIDEXiä tai 40 mg megestroliasetaattia neljä kertaa päivässä. Tutkimukset tehtiin kaksoissokkoutettuina ARIMIDEXin suhteen. Etenemiseen kuluva aika ja objektiivinen vaste (vain mitattavissa olevaa sairautta sairastavia potilaita voidaan pitää osittaisina vasteina) olivat ensisijaiset tehon muuttujat. Objektiiviset vasteprosentit laskettiin Union Internationale Contre le Cancer (UICC) -kriteerien perusteella. Pitkittyneen (yli 24 viikkoa) vakaan taudin nopeus, etenemisnopeus ja eloonjääminen laskettiin myös.
Molemmissa tutkimuksissa oli mukana yli 375 potilasta; demografiset ja muut lähtötilanteen ominaisuudet olivat samanlaiset kaikissa kolmessa hoitoryhmässä kussakin tutkimuksessa. 0005-tutkimuksen potilaat olivat reagoineet paremmin aikaisempaan tamoksifeenihoitoon. Niistä potilaista, jotka olivat aiemmin saaneet tamoksifeenihoitoa edenneen taudin vuoksi (58 % tutkimuksessa 0004; 57 % tutkimuksessa 0005), 18 %:lla näistä potilaista tutkimuksessa 0004 ja 42 %:lla tutkimuksessa 0005 oli ensisijainen tutkija reagoinut. Tutkimuksessa 0004 81 % potilaista oli ER-positiivisia, 13 % oli ER-positiivisia ja 6 % oli ER-negatiivisia. Tutkimuksessa 0005 58 % potilaista oli ER-positiivisia, 37 % oli ER-tuntemattomia ja 5 % oli ER-negatiivisia. Tutkimuksessa 0004 62 %:lla potilaista oli mitattavissa oleva sairaus verrattuna 79 %:iin tutkimuksessa 0005. Metastaattisen taudin paikat olivat samanlaiset hoitoryhmissä jokaisessa tutkimuksessa. Keskimäärin 40 %:lla potilaista oli pehmytkudoksen etäpesäkkeitä; 60 %:lla oli luumetastaaseja; ja 40 %:lla oli viskeraalisia (15 % maksa) etäpesäkkeitä.
Kahden tutkimuksen tehokkuustulokset olivat samanlaisia kuin taulukossa 13. Kummassakaan tutkimuksessa ei havaittu merkittäviä eroja hoitoryhmien välillä minkään alla olevassa taulukossa lueteltujen tehokkuusparametrien suhteen.
Kun kahdesta kontrolloidusta tutkimuksesta saadut tiedot yhdistetään, objektiiviset vasteet ja mediaaniajat etenemiseen ja kuolemaan olivat samanlaiset potilailla, jotka oli satunnaistettu saamaan ARIMIDEX 1 mg ja megestroliasetaattia. Nämä tiedot eivät viittaa siihen, että ARIMIDEX 10 mg olisi parempi kuin ARIMIDEX 1 mg.
POTILASTIEDOT
ARIMIDEX® A-rim-eh-dex (anastrotsoli) tabletit suun kautta
Mikä on tärkein tieto, joka minun pitäisi tietää ARIMIDEXistä?
ARIMIDEX voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- sydänsairaus. Varhaisvaiheessa rintasyöpää sairastavilla naisilla, joilla on ollut sydänvaltimoiden tukos (iskeeminen sydänsairaus) ja jotka käyttävät ARIMIDEX 1 mg:aa, voivat lisääntyä sydämen verenkierron heikkenemisen oireet verrattuna vastaaviin tamoksifeenia käyttäviin naisiin.
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on uutta tai pahenevaa rintakipua tai hengenahdistusta ARIMIDEX-hoidon aikana.
Mikä on ARIMIDEX?
ARIMIDEX 1mg on reseptilääke, jota käytetään naisilla vaihdevuosien ("elämän muutoksen") jälkeen:
- varhaisen rintasyövän hoitoon
- leikkauksen jälkeen
- naisilla, joiden rintasyöpä on hormonireseptoripositiivinen
- rintasyövän ensimmäinen hoito, joka on levinnyt lähikudokseen tai imusolmukkeisiin (paikallisesti edennyt) tai muihin kehon osiin (metastaattinen), naisilla, joiden rintasyöpä on hormonireseptoripositiivinen tai hormonireseptoreita ei tunneta
- edenneen rintasyövän hoitoon, jos syöpä on kasvanut tai tauti on levinnyt tamoksifeenihoidon jälkeen
ARIMIDEX 1mg ei tehoa naisilla, joilla on rintasyöpä ja jotka eivät ole käyneet läpi vaihdevuodet (premenopausaalisilla naisilla).
Kuka ei saa ottaa ARIMIDEXiä?
Älä ota ARIMIDEX 1 mg:aa, jos:
- ovat raskaana tai voivat tulla raskaaksi. ARIMIDEX voi vahingoittaa sikiötäsi. Jos tulet raskaaksi ARIMIDEX-hoidon aikana, kerro siitä heti lääkärillesi.
- eivät ole käyneet läpi vaihdevuodet (ovat premenopausaalisia)
- sinulla on ollut vakava allerginen reaktio anastrotsolille tai jollekin ARIMIDEXin aineosalle. Katso tämän pakkausselosteen lopusta täydellinen luettelo ARIMIDEXin ainesosista. ARIMIDEXin aiheuttaman vakavan allergisen reaktion oireita ovat: kasvojen, huulten, kielen tai kurkun turvotus, hengitys- tai nielemisvaikeudet, nokkosihottuma ja kutina.
Mitä minun pitäisi kertoa lääkärilleni ennen ARIMIDEX 1 mg:n ottamista?
Ennen kuin otat ARIMIDEXia, kerro lääkärillesi, jos:
- eivät ole käyneet läpi vaihdevuodet. Keskustele lääkärisi kanssa, jos et ole varma.
- sinulla on tai on ollut sydänvaivoja
- sinulle on kerrottu, että sinulla on luun ohenemista tai heikkoutta (osteoporoosi)
- on korkea kolesteroli
- sinulla on muita sairauksia
- olet raskaana tai suunnittelet raskautta. ARIMIDEX voi vahingoittaa sikiötäsi. Katso "Kuka ei saa ottaa ARIMIDEXiä?"
- imetät tai aiot imettää. Ei tiedetä, erittyykö ARIMIDEX äidinmaitoon. Sinun ja lääkärisi tulee päättää, otatko ARIMIDEX 1 mg -valmistetta vai imetätkö. Sinun ei pitäisi tehdä molempia.
Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät. Kerro lääkärillesi erityisesti, jos otat:
- tamoksifeeni. Sinun ei pitäisi ottaa ARIMIDEX jos käytät tamoksifeenia. ARIMIDEX 1mg:n ottaminen tamoksifeenin kanssa voi alentaa ARIMIDEX 1mg:n määrää veressäsi ja saattaa aiheuttaa sen, että ARIMIDEX 1mg ei toimi yhtä hyvin.
- Estrogeenia sisältävät lääkkeet. ARIMIDEX 1mg ei välttämättä tehoa, jos sitä otetaan jonkin seuraavista lääkkeistä:
- hormonikorvaushoito
- ehkäisypillerit
- estrogeenivoiteet
- emättimen renkaat
- emättimen peräpuikot
Tunne käyttämäsi lääkkeet. Pidä niistä luetteloa näyttääksesi lääkärillesi ja apteekkiin, kun saat uuden lääkkeen.
Miten minun pitäisi ottaa ARIMIDEX?
- Ota ARIMIDEXiä juuri sen verran kuin lääkärisi on määrännyt.
- Jatka ARIMIDEXin käyttöä, kunnes lääkärisi kehottaa sinua lopettamaan.
- ARIMIDEX 1mg voidaan ottaa ruoan kanssa tai ilman.
- Jos unohdat ottaa annoksen, ota se heti kun muistat. Jos on melkein aika ottaa seuraava annos, jätä unohtunut annos väliin. Ota seuraava säännöllinen annos. Älä ota kahta annosta samanaikaisesti.
Jos otat liikaa ARIMIDEX 1mg -valmistetta, soita heti lääkärillesi tai mene lähimmän sairaalan ensiapuun.
Mitkä ovat ARIMIDEXin mahdolliset sivuvaikutukset?
ARIMIDEX voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- Katso "Mikä on tärkein tieto, joka minun pitäisi tietää ARIMIDEXistä?"
- luun oheneminen tai heikkous (osteoporoosi). ARIMIDEX 1mg alentaa estrogeenia elimistössäsi, mikä voi aiheuttaa luusi ohenemista ja heikkenemistä. Tämä voi lisätä murtumariskiäsi, erityisesti selkärangan, lonkan ja ranteen. Lääkärisi voi määrätä luun mineraalitiheystestin
- ennen kuin aloitat ARIMIDEX-hoidon ja sen aikana, jotta voit tarkistaa luumuutosten varalta.
- kohonnut veren kolesteroli (rasva veressä). Lääkärisi voi tehdä verikokeita kolesterolin tarkistamiseksi, kun käytät ARIMIDEXia.
- ihoreaktiot. Lopeta ARIMIDEX 1 mg:n käyttö ja ota heti yhteys lääkäriin, jos saat ihovaurioita, haavaumia tai rakkuloita.
- vakavia allergisia reaktioita. Hakeudu välittömästi lääkärin hoitoon, jos saat:
- kasvojen, huulten, kielen tai kurkun turvotus
- nielemis- tai hengitysvaikeuksia
- maksaongelmia. ARIMIDEX 1mg voi aiheuttaa maksatulehdusta ja muutoksia maksan toiminnan verikokeissa. Lääkärisi voi tarkistaa sinut tämän varalta. Lopeta ARIMIDEX 1 mg:n käyttö ja ota heti yhteys lääkäriin jos sinulla on jokin näistä maksaongelman merkeistä tai oireista:
- yleinen huonovointisuus
- ihosi tai silmänvalkuaisten keltaisuus
- kipu vatsan alueen oikealla puolella (vatsa)
Yleisiä sivuvaikutuksia ARIMIDEX 1mg -valmistetta käyttävillä naisilla ovat:
- kuumia aaltoja
- heikkous
- nivelkivut
- nivelkipu, jäykkyys tai turvotus (niveltulehdus)
- kipu
- kipeä kurkku
- korkea verenpaine
- masennus
- pahoinvointia ja oksentelua
- ihottuma
- selkäkipu
- unihäiriöt
- luukipu
- päänsärky
- jalkojen, nilkkojen tai jalkojen turvotus
- lisääntynyt yskä
- hengenahdistus
- imusolmukkeen kerääntyminen sairastuneen käsivarren kudoksiin (lymfedeema)
ARIMIDEX voi myös aiheuttaa ihosi kutinaa, pistelyä tai puutumista.
Kerro lääkärillesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei häviä.
Nämä eivät ole kaikkia ARIMIDEXin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää ARIMIDEX 1mg?
- Säilytä ARIMIDEX 1 mg huoneenlämmössä 20 °C - 25 °C (68 °F - 77 °F).
Pidä ARIMIDEX ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa ARIMIDEXin turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin tarkoituksiin kuin potilasohjeessa lueteltuihin tarkoituksiin. Älä käytä ARIMIDEX 1 mg -valmistetta sairauteen, johon sitä ei ole määrätty. Älä anna ARIMIDEXia muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Jos haluat lisätietoja, keskustele lääkärisi kanssa. Voit kysyä apteekista tai lääkäriltä tietoja ARIMIDEXistä, joka on kirjoitettu terveydenhuollon ammattilaisille. Lisätietoja saat soittamalla numeroon 1-866-992-9276 tai siirtymällä osoitteeseen www.ARIMIDEX.com.
Mitä ainesosia ARIMIDEX sisältää?
Aktiivinen ainesosa: anastrotsoli
Inaktiiviset ainesosat: laktoosi, magnesiumstearaatti, hydroksipropyylimetyyliselluloosa, polyetyleeniglykoli, povidoni, natriumtärkkelysglykolaatti ja titaanidioksidi.
