Diflucan 50mg, 100mg, 150mg, 200mg Fluconazole Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Diflucan on ja miten sitä käytetään?
Diflucan on reseptilääke, jota käytetään sieni-infektioiden oireiden hoitoon. Diflucan 50 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Diflucan 100mg kuuluu sienilääkkeiksi kutsuttujen lääkkeiden luokkaan.
Mitä sivuvaikutuksia Diflucan 150 mg:lla on?
Diflucan 100mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- nopea tai jyskyttävä sydämenlyönti,
- lepatus rinnassasi,
- hengenahdistus,
- äkillinen huimaus,
- kuume,
- vilunväristykset,
- kehon kivut,
- flunssan oireet,
- helppo mustelma tai verenvuoto,
- epätavallinen heikkous,
- kohtaukset (kouristukset),
- ihottuma tai vauriot,
- ruokahalun menetys,
- ylävatsakipu,
- tumma virtsa,
- savenvärinen jakkara ja
- silmien tai ihon keltaisuus (keltaisuus)
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Diflucanin yleisimpiä sivuvaikutuksia ovat:
- pahoinvointi,
- vatsakipu,
- ripuli,
- ärtynyt vatsa,
- päänsärky,
- huimaus ja
- muutoksia makuaistisi
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Diflucanin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
DIFLUCAN® (flukonatsoli), ensimmäinen synteettisten triatsolien antifungaalisten aineiden uudesta alaluokasta, on saatavana tabletteina oraaliseen annostukseen, jauheena oraalisuspensiota varten.
Flukonatsoli on kemiallisesti nimetty 2,4-difluori-a,a1-bis(1H-1,2,4-triatsol-1-yylimetyyli)bentsyylialkoholiksi, jonka empiirinen kaava on C13H12F2N6O ja molekyylipaino 306,3. Rakennekaava on:
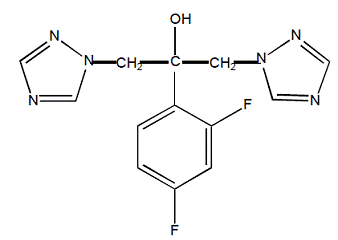
Flukonatsoli on valkoinen kiteinen kiinteä aine, joka liukenee heikosti veteen ja suolaliuokseen.
DIFLUCAN-tabletit sisältävät 50, 100, 150 tai 200 mg flukonatsolia ja seuraavia inaktiivisia ainesosia: mikrokiteinen selluloosa, vedetön kaksiemäksinen kalsiumfosfaatti, povidoni, kroskarmelloosinatrium, FD&C Red No. 40 ja alumiininen magnesiumstearaatti.
DIFLUCAN oraalisuspensio sisältää 350 mg tai 1400 mg flukonatsolia ja seuraavia inaktiivisia aineosia: sakkaroosi, natriumsitraattidihydraatti, vedetön sitruunahappo, natriumbentsoaatti, titaanidioksidi, kolloidinen piidioksidi, ksantaanikumi ja luonnollinen appelsiiniaromi. Kun käyttövalmiiksi saatettu 24 ml tislattua vettä tai puhdistettua vettä (USP), jokainen ml liuotettua suspensiota sisältää 10 mg tai 40 mg flukonatsolia.
INDIKAATIOT
DIFLUCAN (flukonatsoli) on tarkoitettu seuraavien sairauksien hoitoon:
- Emättimen kandidiaasi (Candidasta johtuva emättimen hiivatulehdus).
- Suunnielun ja ruokatorven kandidoosi. Avoimissa ei-vertailevissa tutkimuksissa, joissa oli mukana suhteellisen pieni määrä potilaita, DIFLUCAN oli tehokas myös Candida-virtsatieinfektioiden, peritoniitin ja systeemisten Candida-infektioiden, mukaan lukien kandidemia, disseminoitunut kandidiaasi ja keuhkokuume, hoidossa.
- Kryptokokin aiheuttama aivokalvontulehdus. Ennen kuin määräät DIFLUCANia (flukonatsolia) AIDS-potilaille, joilla on kryptokokkimeningiitti, katso Kliiniset tutkimukset osio. Ei ole tehty tutkimuksia, joissa DIFLUCAN 150 mg:aa on verrattu amfoterisiini B:hen potilailla, joilla ei ole HIV-tartuntaa.
Ennaltaehkäisy
DIFLUCAN on myös tarkoitettu vähentämään kandidiaasin ilmaantuvuutta potilailla, joille tehdään luuytimensiirto ja jotka saavat sytotoksista kemoterapiaa ja/tai sädehoitoa.
Näytteitä sieniviljelmää ja muita asiaankuuluvia laboratoriotutkimuksia varten (serologia, histopatologia) on otettava ennen hoitoa taudinaiheuttajat eristämiseksi ja tunnistamiseksi. Hoito voidaan aloittaa ennen kuin viljelmien ja muiden laboratoriotutkimusten tulokset ovat tiedossa; kuitenkin, kun nämä tulokset ovat saatavilla, infektionvastaista hoitoa tulee säätää vastaavasti.
ANNOSTELU JA HALLINNOINTI
Annostus ja antotapa aikuisille
Yksittäinen annos
Emättimen kandidiaasi
Suositeltu DIFLUCAN-annos emättimen kandidiaasissa on 150 mg kerta-annoksena suun kautta.
Useita annoksia
KOSKA SUUN kautta imeytyminen ON NOPEA JA LÄHTEISTÄ TÄYDELLINEN, DIFLUKANIN (FLUKONATSOLIN) PÄIVITTÄINEN ANNOS ON SAMA ORALALLISESSA (TABLETIT JA SUSPENSIOT) JA LASKINOISSA ANNOSSA. Yleensä ensimmäisenä hoitopäivänä suositellaan kyllästysannosta, joka on kaksinkertainen vuorokausiannos, jotta plasmapitoisuudet olisivat lähellä vakaata tilaa toisena hoitopäivänä.
Muiden infektioiden kuin emättimen kandidiaasin hoitoon käytettävän DIFLUCAN 100 mg:n päivittäisen annoksen tulee perustua tartunnan aiheuttavaan organismiin ja potilaan hoitovasteeseen. Hoitoa tulee jatkaa, kunnes kliiniset parametrit tai laboratoriokokeet osoittavat, että aktiivinen sieni-infektio on laantunut. Riittämätön hoitojakso voi johtaa aktiivisen infektion uusiutumiseen. Potilaat, joilla on AIDS ja kryptokokkimeningiitti tai toistuva suunnielun kandidiaasi, tarvitsevat yleensä ylläpitohoitoa uusiutumisen estämiseksi.
Suunnielun kandidiaasi
Suositeltu DIFLUCAN-annos suunnielun kandidiaasin hoitoon on 200 mg ensimmäisenä päivänä, jonka jälkeen 100 mg kerran vuorokaudessa. Kliiniset todisteet suunielun kandidiaasista häviävät yleensä useissa päivissä, mutta hoitoa tulee jatkaa vähintään 2 viikkoa uusiutumisen todennäköisyyden vähentämiseksi.
Ruokatorven kandidiaasi
Suositeltu DIFLUCAN 200 mg -annos ruokatorven kandidiaasissa on 200 mg ensimmäisenä päivänä ja sen jälkeen 100 mg kerran vuorokaudessa. Voidaan käyttää jopa 400 mg/vrk annoksia potilaan hoitovasteen lääketieteellisen arvion perusteella. Potilaita, joilla on ruokatorven kandidiaasi, tulee hoitaa vähintään kolmen viikon ajan ja vähintään kaksi viikkoa oireiden häviämisen jälkeen.
Systeemiset Candida-infektiot
Systeemisille Candida-infektioille, mukaan lukien kandidemia, disseminoitunut kandidiaasi ja keuhkokuume, optimaalista terapeuttista annosta ja hoidon kestoa ei ole vahvistettu. Avoimissa, ei-vertailevissa tutkimuksissa pienellä määrällä potilaita on käytetty jopa 400 mg:n vuorokausiannoksia.
Virtsatieinfektiot ja peritoniitti
Candida-virtsatieinfektioiden ja peritoniitin hoidossa on käytetty 50–200 mg:n päivittäisiä annoksia avoimissa, ei-vertailevissa tutkimuksissa pienellä määrällä potilaita.
Kryptokokin aiheuttama aivokalvontulehdus
Suositeltu annostus akuutin kryptokokkimeningiitin hoitoon on 400 mg ensimmäisenä päivänä ja sen jälkeen 200 mg kerran vuorokaudessa. Voidaan käyttää 400 mg:n annosta kerran vuorokaudessa lääketieteellisen arvion perusteella potilaan hoitovasteesta. Kryptokokin aiheuttaman aivokalvontulehduksen aloitushoidon suositeltu hoidon kesto on 10–12 viikkoa sen jälkeen, kun aivo-selkäydinnesteestä tulee viljelynegatiivinen. Suositeltu DIFLUCAN 150 mg -annos AIDS-potilailla kryptokokkimeningiitin uusiutumisen estämiseksi on 200 mg kerran vuorokaudessa.
Ennaltaehkäisy potilailla, joille tehdään luuydinsiirto
Suositeltu DIFLUCANin vuorokausiannos kandidiaasin ehkäisyyn potilailla, joille tehdään luuytimensiirto, on 400 mg kerran vuorokaudessa. Potilaiden, joilla odotetaan olevan vaikea granulosytopenia (alle 500 neutrofiilisolua/mm³), tulee aloittaa DIFLUCAN-profylaksia useita päiviä ennen ennakoitua neutropenian puhkeamista ja jatkaa 7 päivää sen jälkeen, kun neutrofiilien määrä on noussut yli 1000 solua/mm³.
Annostus ja anto lapsille
Seuraavan annosekvivalenssijärjestelmän pitäisi yleensä tarjota vastaava altistuminen lapsi- ja aikuispotilaille:
Kokemus DIFLUCANin käytöstä vastasyntyneillä rajoittuu farmakokineettisiin tutkimuksiin ennenaikaisilla vastasyntyneillä. (Katso KLIININEN FARMAKOLOGIA .) Keskosilla (raskausaika 26-29 viikkoa) havaitun pidentyneen puoliintumisajan perusteella näille lapsille tulee kahden ensimmäisen elinviikon aikana saada sama annos (mg/kg) kuin vanhemmille lapsille, mutta 72 tunnin välein. Kahden ensimmäisen viikon jälkeen näille lapsille on annettava annos kerran päivässä. DIFLUCANin farmakokinetiikasta täysiaikaisilla vastasyntyneillä ei ole tietoa.
Suunnielun kandidiaasi
Suositeltu DIFLUCAN 150 mg -annos lasten suun ja nielun kandidiaasin hoitoon on 6 mg/kg ensimmäisenä päivänä ja sen jälkeen 3 mg/kg kerran vuorokaudessa. Hoitoa tulee antaa vähintään 2 viikkoa uusiutumisen todennäköisyyden vähentämiseksi.
Ruokatorven kandidiaasi
Ruokatorven kandidiaasin hoidossa suositeltu DIFLUCAN-annos lapsille on 6 mg/kg ensimmäisenä päivänä ja sen jälkeen 3 mg/kg kerran vuorokaudessa. Voidaan käyttää annoksia 12 mg/kg/vrk asti potilaan hoitovasteen lääketieteellisen arvion perusteella. Potilaita, joilla on ruokatorven kandidiaasi, tulee hoitaa vähintään kolmen viikon ajan ja vähintään 2 viikkoa oireiden häviämisen jälkeen.
Systeemiset Candida-infektiot
Kandidemian ja leviäneiden Candida-infektioiden hoitoon on käytetty 6-12 mg/kg/vrk päivittäisiä annoksia pienellä määrällä lapsia tehdyssä avoimessa ei-vertailevassa tutkimuksessa.
Kryptokokin aiheuttama aivokalvontulehdus
Akuutin kryptokokkimeningiitin hoidossa suositeltu annos on 12 mg/kg ensimmäisenä päivänä ja sen jälkeen 6 mg/kg kerran vuorokaudessa. Annostusta 12 mg/kg kerran päivässä voidaan käyttää potilaan hoitovasteen lääketieteellisen arvion perusteella. Kryptokokin aiheuttaman aivokalvontulehduksen aloitushoidon suositeltu hoidon kesto on 10–12 viikkoa sen jälkeen, kun aivo-selkäydinnesteestä tulee viljelynegatiivinen. Suositeltu DIFLUCAN-annos on 6 mg/kg kerran vuorokaudessa kryptokokkimeningiitin uusiutumisen estämiseksi AIDSia sairastavilla lapsilla.
Annostus potilaille, joilla on heikentynyt munuaisten toiminta
Flukonatsoli poistuu pääasiassa munuaisten kautta muuttumattomana lääkkeenä. Emättimen kandidiaasin kerta-annoshoitoa ei tarvitse muuttaa munuaisten vajaatoiminnan vuoksi. Potilaille, joilla on munuaisten vajaatoiminta ja jotka saavat useita DIFLUCAN-annoksia, aloitusannos on 50–400 mg. Kyllästysannoksen jälkeen vuorokausiannoksen (aiheen mukaan) tulee perustua seuraavaan taulukkoon:
Hemodialyysipotilaiden tulee saada 100 % suositellusta annoksesta jokaisen hemodialyysin jälkeen. Muina kuin dialyysipäivinä potilaiden tulee saada pienempi annos kreatiniinipuhdistuman mukaan.
Nämä ovat ehdotettuja annoksen muutoksia, jotka perustuvat farmakokinetiikkaan useiden annosten jälkeen. Lisäsäätö saattaa olla tarpeen kliinisestä tilasta riippuen.
Kun seerumin kreatiniini on ainoa käytettävissä oleva munuaisten toiminnan mitta, seuraavaa kaavaa (potilaan sukupuolen, painon ja iän perusteella) tulee käyttää kreatiniinipuhdistuman arvioimiseksi aikuisilla:
Miehet: Paino (kg) × (140 – ikä) / 72 × seerumin kreatiniini (mg/100 ml)
Naiset: 0,85 × arvoa korkeampi
Vaikka flukonatsolin farmakokinetiikkaa ei ole tutkittu munuaisten vajaatoimintaa sairastavilla lapsilla, munuaisten vajaatoimintaa sairastavien lasten annosta tulee pienentää samaan tapaan kuin aikuisille suositellaan. Seuraavaa kaavaa voidaan käyttää kreatiniinipuhdistuman arvioimiseen lapsilla:
× lineaarinen pituus tai korkeus (cm) / seerumin kreatiniini (mg/100 ml)
(Missä K = 0,55 yli 1-vuotiaille lapsille ja 0,45 vauvoille.)
Hallinto
DIFLUCAN 100 mg annetaan suun kautta. DIFLUCAN voidaan ottaa ruoan kanssa tai ilman.
Ohjeet oraalisuspension sekoittamiseen
Valmista suspensio annostelun yhteydessä seuraavasti: napauta pulloa, kunnes kaikki jauhe valuu vapaasti. Liuottamista varten lisää 24 ml tislattua vettä tai puhdistettua vettä (USP) flukonatsolipulloon ja ravista voimakkaasti jauheen suspendoimiseksi. Jokaisesta pullosta tulee 35 ml suspensiota. Käyttövalmiiksi saatettujen suspensioiden pitoisuudet ovat seuraavat:
Huomautus: Ravista oraalisuspensiota hyvin ennen käyttöä. Säilytä käyttövalmiiksi valmistettua suspensiota 86 °F (30 °C) ja 41 °F (5 °C) välillä ja hävitä käyttämätön osa 2 viikon kuluttua. Suojaa jäätymiseltä.
MITEN TOIMITETAAN
DIFLUCAN 100 mg tabletit Vaaleanpunaiset puolisuunnikkaan muotoiset tabletit, jotka sisältävät 50, 100 tai 200 mg flukonatsolia, on pakattu pulloihin tai kerta-annoksen läpipainopakkauksiin. 150 mg:n flukonatsolitabletit ovat vaaleanpunaisia ja soikeita, ja ne on pakattu kerta-annoksen läpipainopakkaukseen.
DIFLUCAN-tabletit toimitetaan seuraavasti:
DIFLUCAN 50 mg tabletit : Kaiverrus "DIFLUCAN" ja "50" edessä ja "ROERIG" takana.
NDC 0049-3410-30 30 pullot
DIFLUCAN 100 mg tabletit : Kaiverrus "DIFLUCAN" ja "100" edessä ja "ROERIG" takana.
NDC 0049-3420-30 Pullot 30 NDC 0049-3420-41 100 yksikköannospakkaus
DIFLUCAN 150 mg tabletit : Kaiverrus "DIFLUCAN" ja "150" edessä ja "ROERIG" takana.
NDC 0049-3500-79 Yksikköannospakkaus, jossa on 1
DIFLUCAN 200 mg tabletit : Kaiverrus "DIFLUCAN" ja "200" edessä ja "ROERIG" takana.
NDC 0049-3430-30 Pullot 30 NDC 0049-3430-41 100 yksikköannospakkaus
Varastointi
Säilytä tabletit alle 30 °C:ssa.
DIFLUCAN 100 mg oraalisuspensiota varten : DIFLUCAN oraalisuspensiota varten toimitetaan appelsiinin makuisena jauheena, joka tuottaa 35 ml pulloa kohden seuraavasti:
NDC 0049-3440-19 Flukonatsoli 350 mg per pullo NDC 0049-3450-19 Flukonatsoli 1400 mg per pullo
Varastointi
Säilytä kuivajauhe alle 30 °C:ssa. Säilytä käyttövalmiiksi valmistettua suspensiota 86 °F (30 °C) ja 41 °F (5 °C) välillä ja hävitä käyttämätön osa 2 viikon kuluttua. Suojaa jäätymiseltä.
Jakelija: Roerig Division of Pfizer Inc., NY, NY 10017. Tarkistettu: lokakuu 2021
SIVUVAIKUTUKSET
DIFLUCAN on yleensä hyvin siedetty.
Joillakin potilailla, erityisesti niillä, joilla on vakavia perussairauksia, kuten AIDS ja syöpä, on havaittu muutoksia munuais- ja hematologisten toimintakokeiden tuloksissa ja maksan poikkeavuuksia flukonatsolihoidon ja vertailuaineiden käytön aikana, mutta kliininen merkitys ja suhde hoitoon ovat epävarmoja.
Potilailla, jotka saavat kerta-annoksen emättimen kandidiaasi
Yhdysvalloissa suoritetuissa vertailevissa kliinisissä tutkimuksissa 448 emättimen kandidiaasipotilasta hoidettiin DIFLUCANilla, 150 mg kerta-annoksena. DIFLUCANiin mahdollisesti liittyvien sivuvaikutusten kokonaisilmaantuvuus oli 26 %. 422 potilaalla, jotka saivat aktiivisia vertailuaineita, ilmaantuvuus oli 16 %. Yleisimmät hoitoon liittyvät haittatapahtumat, jotka raportoitiin potilailla, jotka saivat 150 mg:n kerta-annoksen flukonatsolia vaginiittiin, olivat päänsärky (13 %), pahoinvointi (7 %) ja vatsakipu (6 %). Muita sivuvaikutuksia, joiden ilmaantuvuus on yhtä suuri tai suurempi kuin 1 %, olivat ripuli (3 %), dyspepsia (1 %), huimaus (1 %) ja makuaistin vääristymä (1 %). Suurin osa raportoiduista sivuvaikutuksista oli vaikeusasteeltaan lieviä tai kohtalaisia. Angioedeemaa ja anafylaktista reaktiota on raportoitu harvoin markkinointikokemuksessa.
Potilailla, jotka saavat useita annoksia muihin infektioihin
16 prosenttia yli 4000 potilaasta, joita hoidettiin DIFLUCANilla (flukonatsoli) kliinisissä tutkimuksissa, jotka kestivät vähintään 7 päivää, koki haittavaikutuksia. Hoito keskeytettiin 1,5 %:lla potilaista haittavaikutusten vuoksi ja 1,3 %:lla potilaista laboratoriotestien poikkeavuuksien vuoksi.
Kliiniset haittatapahtumat raportoitiin useammin HIV-tartunnan saaneilla potilailla (21 %) kuin ei-HIV-tartunnan saaneilla potilailla (13 %); HIV-tartunnan saaneiden ja ei-HIV-tartunnan saaneiden potilaiden mallit olivat kuitenkin samanlaisia. Hoidon kliinisten haittatapahtumien vuoksi keskeyttäneiden potilaiden osuudet olivat samat kahdessa ryhmässä (1,5 %).
Seuraavia hoitoon liittyviä kliinisiä haittavaikutuksia esiintyi vähintään 1 %:lla 4048 potilaalla, jotka saivat DIFLUCANia 50 mg vähintään 7 päivän ajan kliinisissä tutkimuksissa: pahoinvointi 3,7 %, päänsärky 1,9 %, ihottuma 1,8 %, oksentelu 1,7 %, vatsan alue. kipu 1,7 % ja ripuli 1,5 %.
Maksa-sappi
Yhdistetyissä kliinisissä tutkimuksissa ja myyntikokemuksessa on harvoin esiintynyt vakavia maksareaktioita DIFLUCAN-hoidon aikana. (Katso VAROITUKSET .) Näiden maksareaktioiden kirjo on vaihdellut lievästä ohimenevästä transaminaasiarvojen noususta kliiniseen hepatiittiin, kolestaasiin ja fulminanttiin maksan vajaatoimintaan, mukaan lukien kuolemantapaukset. Kuolemaan johtaneita maksareaktioita havaittiin pääasiassa potilailla, joilla oli vakavia perussairauksia (pääasiassa AIDS tai pahanlaatuinen kasvain) ja usein useiden samanaikaisten lääkkeiden käytön yhteydessä. Ohimeneviä maksareaktioita, mukaan lukien hepatiitti ja keltaisuus, on esiintynyt potilailla, joilla ei ole muita tunnistettavissa olevia riskitekijöitä. Kaikissa näissä tapauksissa maksan toiminta palasi lähtötasolle, kun DIFLUCAN-hoito lopetettiin.
Kahdessa vertailevassa tutkimuksessa, joissa arvioitiin DIFLUCANin tehoa kryptokokkimeningiitin uusiutumisen estämisessä, todettiin tilastollisesti merkitsevä AST (SGOT) mediaanitason nousu lähtötasosta 30 IU/L arvoon 41 IU/l yhdessä tutkimuksessa ja 34. IU/L - 66 IU/L toisessa. Kliinisissä tutkimuksissa seerumin transaminaasiarvojen nousu yli 8 kertaa normaalin ylärajan yläpuolella oli noin 1 % flukonatsolihoitoa saaneilla potilailla. Näitä nousuja esiintyi potilailla, joilla oli vakava perussairaus, pääasiassa AIDS tai pahanlaatuisia kasvaimia, ja joista useimmat saivat samanaikaisesti useita lääkkeitä, joista monet olivat maksatoksisia. Epänormaalin kohonneiden seerumin transaminaasiarvojen ilmaantuvuus oli suurempi potilailla, jotka käyttivät DIFLUCANia samanaikaisesti yhden tai useamman seuraavista lääkkeistä: rifampiini, fenytoiini, isoniatsidi, valproiinihappo tai oraaliset sulfonyyliurea-hypoglykeemiset aineet.
Markkinoinnin jälkeinen kokemus
Lisäksi seuraavat haittatapahtumat ovat ilmenneet markkinoille tulon jälkeen.
Immunologinen: Harvinaisissa tapauksissa on raportoitu anafylaksiaa (mukaan lukien angioödeema, kasvojen turvotus ja kutina).
Keho kokonaisuutena: Astenia, väsymys, kuume, huonovointisuus.
Sydän: QT-ajan pidentyminen, torsade de pointes. (Katso VAROTOIMENPITEET .)
Keskushermosto: Kohtaukset, huimaus.
Hematopoieettinen ja lymfaattinen: Leukopenia, mukaan lukien neutropenia ja agranulosytoosi, trombosytopenia.
Metabolinen: Hyperkolesterolemia, hypertriglyseridemia, hypokalemia.
Ruoansulatuskanava: Kolestaasi, suun kuivuminen, maksasoluvauriot, dyspepsia, oksentelu.
Muut aistit: Makuperversio.
Tuki- ja liikuntaelimistö: myalgia.
Hermosto: Unettomuus, parestesia, uneliaisuus, vapina, huimaus.
Iho ja lisäkkeet: Akuutti yleistynyt eksantematoottinen pustuloosi, lääkepurkaus, mukaan lukien kiinteä lääkepurkaus, lisääntynyt hikoilu, hilseilevät ihosairaudet, mukaan lukien Stevens-Johnsonin oireyhtymä ja toksinen epidermaalinen nekrolyysi, lääkereaktio eosinofilian ja systeemisten oireiden kanssa (DRESS) (ks. VAROITUKSET ), hiustenlähtö.
Haittavaikutukset lapsilla
Lapsille tehdyissä kliinisissä tutkimuksissa havaittujen haittatapahtumien ja laboratorioarvojen poikkeavuuksien malli ja ilmaantuvuus ovat verrattavissa aikuisilla havaittuihin.
Yhdysvalloissa ja Euroopassa tehdyissä faasin II/III kliinisissä tutkimuksissa 577 lapsipotilasta, iältään 1 vuorokaudesta 17 vuoteen, sai DIFLUCANia annoksilla 15 mg/kg/vrk enintään 1 616 päivän ajan. Kolmetoista prosenttia lapsista koki hoitoon liittyviä haittavaikutuksia. Yleisimmin raportoidut tapahtumat olivat oksentelu (5 %), vatsakipu (3 %), pahoinvointi (2 %) ja ripuli (2 %). Hoito keskeytettiin 2,3 %:lla potilaista kliinisten haittatapahtumien vuoksi ja 1,4 %:lla potilaista laboratoriotestien poikkeavuuksien vuoksi. Suurin osa hoitoon liittyvistä laboratorioarvojen poikkeavuuksista oli transaminaasien tai alkalisen fosfataasin kohoamista.
Niiden potilaiden prosenttiosuus, joilla on hoitoon liittyviä sivuvaikutuksia
HUUMEIDEN VUOROVAIKUTUKSET
(Katso VASTA-AIHEET .) Flukonatsoli on kohtalainen CYP2C9- ja CYP3A4-estäjä. Flukonatsoli on myös vahva CYP2C19:n estäjä. DIFLUCANilla hoidettuja potilaita, joita hoidetaan myös lääkkeillä, joilla on kapea terapeuttinen ikkuna, jotka metaboloituvat CYP2C9:n ja CYP3A4:n kautta, tulee seurata samanaikaisesti käytettyjen lääkkeiden haittavaikutusten varalta. Alla mainittujen havaittujen/dokumentoitujen yhteisvaikutusten lisäksi muiden CYP2C9:n, CYP2C19:n ja CYP3A4:n kautta metaboloituvien yhdisteiden plasmapitoisuuksien suurenemisen riski on olemassa, kun flukonatsolia annetaan samanaikaisesti. Siksi näitä yhdistelmiä käytettäessä on noudatettava varovaisuutta ja potilaita on seurattava huolellisesti. Flukonatsolin entsyymejä estävä vaikutus säilyy 4-5 päivää flukonatsolihoidon lopettamisen jälkeen flukonatsolin pitkän puoliintumisajan vuoksi. Kliinisesti tai mahdollisesti merkittäviä lääkeinteraktioita DIFLUCAN 200 mg:n ja seuraavien aineiden/luokkien välillä on havaittu, ja ne kuvataan yksityiskohtaisemmin alla:
alfentaniili
Tutkimuksessa havaittiin alfentaniilin puhdistuman ja jakautumistilavuuden pienenemistä sekä t½-ajan pidentymistä samanaikaisen flukonatsolihoidon jälkeen. Mahdollinen vaikutusmekanismi on flukonatsolin CYP3A4:n esto. Alfentaniilin annosta voi olla tarpeen muuttaa.
Amiodaroni
Flukonatsolin ja amiodaronin samanaikainen käyttö voi pidentää QT-ajan pidentymistä. Varovaisuutta on noudatettava, jos flukonatsolin ja amiodaronin samanaikainen käyttö on välttämätöntä, erityisesti suuria flukonatsoliannoksia (800 mg) käytettäessä.
Amitriptyliini, Nortriptyliini
Flukonatsoli lisää amitriptyliinin ja nortriptyliinin vaikutusta. 5-nortriptyliini ja/tai S-amitriptyliini voidaan mitata yhdistelmähoidon alussa ja 1 viikon kuluttua. Amitriptyliinin/nortriptyliinin annosta tulee muuttaa tarvittaessa.
Amfoterisiini B
Flukonatsolin ja amfoterisiini B:n samanaikainen anto infektoituneille normaaleille ja immunosuppressoituneille hiirille osoitti seuraavat tulokset: pieni additiivinen antifungaalinen vaikutus systeemisessä Candida albicans -infektiossa, ei yhteisvaikutusta kallonsisäisessä infektiossa Cryptococcus neoformansin kanssa ja näiden kahden lääkkeen antagonismi systeemisessä A-infektiossa. fumigatus. Näissä tutkimuksissa saatujen tulosten kliinistä merkitystä ei tunneta.
Atsitromysiini
Avoimessa, satunnaistetussa, kolmisuuntaisessa ristikkäistutkimuksessa 18 terveellä koehenkilöllä arvioitiin yhden 1200 mg:n suun kautta otettavan atsitromysiiniannoksen vaikutusta yhden 800 mg:n suun kautta otettavan flukonatsoliannoksen farmakokinetiikkaan sekä flukonatsolin vaikutuksia farmakokinetiikkaan. atsitromysiinistä. Flukonatsolin ja atsitromysiinin välillä ei ollut merkittävää farmakokineettistä yhteisvaikutusta.
Kalsiumkanavan salpaajat
Tietyt kalsiumkanavasalpaajat (nifedipiini, isradipiini, amlodipiini, verapamiili ja felodipiini) metaboloituvat CYP3A4:n vaikutuksesta. Flukonatsoli saattaa lisätä kalsiumkanavaantagonistien systeemistä altistusta. Haittavaikutusten säännöllistä seurantaa suositellaan.
Karbamatsepiini
Flukonatsoli estää karbamatsepiinin metaboliaa, ja seerumin karbamatsepiinin on havaittu nousevan 30 %. On olemassa karbamatsepiinitoksisuuden riski. Karbamatsepiinin annoksen muuttaminen voi olla tarpeen pitoisuusmittauksista/vaikutuksesta riippuen.
Selekoksibi
Flukonatsolin (200 mg päivässä) ja selekoksibin (200 mg) samanaikaisen hoidon aikana selekoksibin Cmax nousi 68 % ja AUC 134 %. Puolet selekoksibiannoksesta voi olla tarpeen, kun sitä käytetään yhdessä flukonatsolin kanssa.
Kumariinityyppiset antikoagulantit
Protrombiiniaika saattaa pidentyä potilailla, jotka saavat samanaikaisesti DIFLUCAN 150 mg:aa ja kumariinityyppisiä antikoagulantteja. Markkinoille tulon jälkeen, kuten muidenkin atsoli-sienilääkkeiden kohdalla, verenvuototapahtumia (mustelmia, nenäverenvuotoa, maha-suolikanavan verenvuotoa, hematuriaa ja melena) on raportoitu protrombiiniajan pidentymisen yhteydessä potilailla, jotka ovat saaneet flukonatsolia samanaikaisesti varfariinin kanssa. Protrombiiniajan huolellista seurantaa suositellaan potilaille, jotka saavat 50 mg DIFLUCANia ja kumariinityyppisiä antikoagulantteja. Varfariiniannoksen muuttaminen saattaa olla tarpeen. (Katso KLIININEN FARMAKOLOGIA : Huumeiden vuorovaikutustutkimukset .)
Syklofosfamidi
Yhdistelmähoito syklofosfamidin ja flukonatsolin kanssa johtaa seerumin bilirubiini- ja kreatiniinipitoisuuden nousuun. Yhdistelmää voidaan käyttää ottaen huomioon lisääntynyt seerumin bilirubiini- ja kreatiniiniarvojen riski.
Syklosporiini
DIFLUCAN 100 mg lisää merkittävästi siklosporiinipitoisuutta munuaisensiirtopotilailla, joilla on tai ei ole munuaisten vajaatoimintaa. Siklosporiinipitoisuuksien ja seerumin kreatiniinin huolellista seurantaa suositellaan potilaille, jotka saavat DIFLUCANia ja siklosporiinia. (Katso KLIININEN FARMAKOLOGIA : Huumeiden vuorovaikutustutkimukset .) Tätä yhdistelmää voidaan käyttää vähentämällä syklosporiinin annosta riippuen syklosporiinipitoisuudesta.
fentanyyli
Yksi kuolemaan johtanut tapaus mahdollisesta fentanyyli-flukonatsolin yhteisvaikutuksesta raportoitiin. Kirjoittaja arvioi, että potilas kuoli fentanyylimyrkytykseen. Lisäksi satunnaistetussa ristikkäistutkimuksessa, jossa oli mukana 12 tervettä vapaaehtoista, osoitettiin, että flukonatsoli viivästytti fentanyylin eliminaatiota merkittävästi. Kohonnut fentanyylipitoisuus voi johtaa hengityslamaan.
HMG-CoA-reduktaasin estäjät
Myopatian ja rabdomyolyysin riski kasvaa, kun flukonatsolia annetaan samanaikaisesti CYP3A4:n kautta metaboloituvien HMG-CoA-reduktaasin estäjien, kuten atorvastatiinin ja simvastatiinin, tai CYP2C9:n, kuten fluvastatiinin, kanssa. Jos samanaikainen hoito on tarpeen, potilasta on tarkkailtava myopatian ja rabdomyolyysin oireiden varalta ja kreatiniinikinaasia on seurattava. HMG-CoA-reduktaasin estäjien käyttö tulee lopettaa, jos kreatiniinikinaasin havaitaan lisääntyvän huomattavasti tai myopatiaa/rabdomyolyysiä diagnosoidaan tai epäillään.
Hydroklooritiatsidi
Farmakokineettisessä yhteisvaikutustutkimuksessa toistuvan hydroklooritiatsidin antaminen samanaikaisesti terveille vapaaehtoisille, jotka saivat flukonatsolia, nosti plasman flukonatsolin pitoisuuksia 40 %. Tämän suuruisen vaikutuksen ei pitäisi edellyttää flukonatsolin annostusohjelman muuttamista potilailla, jotka saavat samanaikaisesti diureetteja.
Ibrutinibi
Kohtalaiset CYP3A4:n estäjät, kuten flukonatsoli, voivat suurentaa plasman ibrutinibipitoisuuksia ja lisätä ibrutinibiin liittyvien haittavaikutusten riskiä. Jos ibrutinibia ja flukonatsolia annetaan samanaikaisesti, pienennä ibrutinibin annosta ibrutinibin reseptitietojen mukaisesti ja potilasta tulee seurata säännöllisesti ibrutinibiin liittyvien haittavaikutusten varalta.
Lemboreksantti
Flukonatsolin samanaikainen anto suurensi lemboreksantin Cmax-arvoa noin 1,6-kertaiseksi ja AUC-arvoa 4,2-kertaiseksi, minkä odotetaan lisäävän haittavaikutusten, kuten uneliaisuuden, riskiä. Vältä DIFLUCANin samanaikaista käyttöä lemboreksantin kanssa.
Losartaani
Flukonatsoli estää losartaanin metaboliaa sen aktiiviseksi metaboliitiksi (E-31 74), joka on vastuussa suurimmasta osasta losartaanihoidon aikana tapahtuvasta angiotensiini II -reseptoriantagonismista. Potilaiden verenpainetta tulee seurata jatkuvasti.
Metadoni
Flukonatsoli saattaa lisätä metadonin pitoisuutta seerumissa. Metadonin annoksen muuttaminen voi olla tarpeen.
Ei-steroidiset tulehduskipulääkkeet
Flurbiprofeenin Cmax-arvo suureni 23 % ja AUC 81 %, kun sitä annettiin samanaikaisesti flukonatsolin kanssa verrattuna pelkän flurbiprofeenin käyttöön. Vastaavasti farmakologisesti aktiivisen isomeerin [S-(+)-ibuprofeeni] Cmax ja AUC kasvoivat 15 % ja AUC 82 %, kun flukonatsolia annettiin samanaikaisesti raseemisen ibuprofeenin (400 mg) kanssa verrattuna pelkän raseemisen ibuprofeenin antamiseen.
Vaikka flukonatsolia ei ole erityisesti tutkittu, se saattaa lisätä muiden ei-steroidisten tulehduskipulääkkeiden (NSAID) systeemistä altistusta, jotka metaboloituvat CYP2C9:n kautta (esim. naprokseeni, lornoksikaami, meloksikaami, diklofenaakki). Tulehduskipulääkkeisiin liittyvien haittatapahtumien ja toksisuuden toistuvaa seurantaa suositellaan. Tulehduskipulääkkeiden annostusta voi olla tarpeen muuttaa.
Olaparib
Kohtalaiset CYP3A4:n estäjät, kuten flukonatsoli, lisäävät olaparibin pitoisuutta plasmassa; samanaikaista käyttöä ei suositella. Jos yhdistelmää ei voida välttää, pienennä olaparibin annosta LYNPARZA® (Olaparib) -valmistetta koskevien ohjeiden mukaisesti.
Ehkäisypillerit
Kaksi farmakokineettistä tutkimusta yhdistelmäehkäisyvalmisteella on suoritettu käyttämällä useita flukonatsolin annoksia. Flukonatsolitutkimuksessa 50 mg:lla ei havaittu merkittäviä vaikutuksia hormonitasoon, kun taas 200 mg:n vuorokausiannoksella etinyyliestradiolin ja levonorgestreelin AUC-arvot nousivat 40 % ja levonorgestreelin AUC-arvot 24 %. Näin ollen flukonatsolin usean annoksen käyttö näillä annoksilla ei todennäköisesti vaikuta suun kautta otettavan yhdistelmäehkäisyvalmisteen tehoon.
Suun hypoglykemiat
Kliinisesti merkittävä hypoglykemia voi nousta, jos DIFLUCANia käytetään yhdessä suun kautta otettavien hypoglykeemisten aineiden kanssa. yksi kuolemaan johtanut hypoglykemia on raportoitu yhdistettynä DIFLUCAN 150 mg:n ja glyburidin käyttöön. DIFLUCAN vähentää tolbutamidin, glyburidin ja glipitsidin metaboliaa ja lisää näiden aineiden pitoisuutta plasmassa. Kun DIFLUCAN 100 mg -valmistetta käytetään samanaikaisesti näiden tai muiden oraalisten hypoglykeemisten sulfonyyliurealääkkeiden kanssa, veren glukoosipitoisuutta on seurattava huolellisesti ja sulfonyyliurean annosta on muutettava tarvittaessa. (Katso KLIININEN FARMAKOLOGIA : Huumeiden vuorovaikutustutkimukset .)
Fenytoiini
DIFLUCAN lisää fenytoiinin pitoisuuksia plasmassa. Fenytoiinipitoisuuksien huolellista seurantaa suositellaan potilaille, jotka saavat 50 mg DIFLUCANia ja fenytoiinia. (Katso KLIININEN FARMAKOLOGIA : Huumeiden vuorovaikutustutkimukset .)
Pimotsidi
Vaikka flukonatsolin ja pimotsidin samanaikainen käyttö ei ole tutkittu in vitro tai in vivo, se saattaa estää pimotsidin metaboliaa. Suurentuneet pimotsidipitoisuudet plasmassa voivat johtaa QT-ajan pidentymiseen ja harvoin torsade de pointesin esiintymiseen. Flukonatsolin ja pimotsidin samanaikainen käyttö on vasta-aiheista.
Prednisoni
Oli tapausraportti, jonka mukaan prednisonilla hoidetulle maksansiirtopotilaalle kehittyi akuutti lisämunuaiskuoren vajaatoiminta, kun kolmen kuukauden flukonatsolihoito lopetettiin. Flukonatsolin käytön lopettaminen aiheutti oletettavasti CYP3A4-aktiivisuuden lisääntymisen, mikä johti prednisonin metabolian lisääntymiseen. Pitkäaikaista flukonatsoli- ja prednisonihoitoa saavia potilaita tulee seurata huolellisesti lisämunuaiskuoren vajaatoiminnan varalta, kun flukonatsolihoito lopetetaan.
Kinidiini
Vaikka flukonatsolin ja kinidiinin samanaikainen anto ei ole tutkittu in vitro tai in vivo, se saattaa estää kinidiinin metaboliaa. Kinidiinin käyttö on yhdistetty QT-ajan pidentymiseen ja harvoin torsade de pointesin esiintymiseen. Flukonatsolin ja kinidiinin samanaikainen käyttö on vasta-aiheista. (Katso VASTA-AIHEET .)
Rifabutiini
On raportoitu, että yhteisvaikutuksia esiintyy, kun flukonatsolia annetaan samanaikaisesti rifabutiinin kanssa, mikä johtaa seerumin rifabutiinin pitoisuuden nousuun jopa 80 %. Uveiittia on raportoitu potilailla, joille on annettu samanaikaisesti flukonatsolia ja rifabutiinia. Rifabutiinia ja flukonatsolia samanaikaisesti saavia potilaita tulee seurata huolellisesti. (Katso KLIININEN FARMAKOLOGIA : Huumeiden vuorovaikutustutkimukset .)
Rifampiini
Rifampiini tehostaa samanaikaisesti annetun DIFLUCANin metaboliaa. Kliinisistä olosuhteista riippuen on harkittava DIFLUCAN 200 mg:n annoksen suurentamista, kun sitä annetaan rifampiinin kanssa. (Katso KLIININEN FARMAKOLOGIA : Huumeiden vuorovaikutustutkimukset .)
Sakinaviiri
Flukonatsoli suurentaa sakinaviirin AUC-arvoa noin 50 %, Cmax-arvoa noin 55 % ja vähentää sakinaviirin puhdistumaa noin 50 %, koska CYP3A4 estää sakinaviirin maksametaboliaa ja P-glykoproteiinia. Sakinaviirin annosta voi olla tarpeen muuttaa.
Lyhytvaikutteiset bentsodiatsepiinit
Midatsolaamin oraalisen annon jälkeen flukonatsoli lisäsi huomattavasti midatsolaamin pitoisuuksia ja psykomotorisia vaikutuksia. Tämä vaikutus midatsolaamiin näyttää olevan selvempi flukonatsolin oraalisen annon jälkeen kuin laskimoon annetun flukonatsolin kohdalla. Jos lyhytvaikutteisia bentsodiatsepiineja, jotka metaboloituvat sytokromi P450 -järjestelmän kautta, annetaan samanaikaisesti flukonatsolin kanssa, bentsodiatsepiiniannoksen pienentämistä on harkittava ja potilaita on seurattava asianmukaisesti. (Katso KLIININEN FARMAKOLOGIA : Huumeiden vuorovaikutustutkimukset .)
Sirolimus
Flukonatsoli lisää sirolimuusin pitoisuuksia plasmassa oletettavasti estämällä sirolimuusin metaboliaa CYP3A4:n ja P-glykoproteiinin kautta. Tätä yhdistelmää voidaan käyttää sirolimuusin annosta säädettäessä vaikutuksen/pitoisuuden mittausten mukaan.
Takrolimuusi
Flukonatsoli saattaa nostaa suun kautta annetun takrolimuusin pitoisuudet seerumissa jopa 5-kertaiseksi, koska takrolimuusin metabolia CYP3A4:n kautta estyy suolistossa. Merkittäviä farmakokineettisiä muutoksia ei ole havaittu, kun takrolimuusi annetaan laskimoon. Takrolimuusipitoisuuden nousu on yhdistetty munuaistoksisuuteen. Suun kautta annettavan takrolimuusin annosta tulee pienentää takrolimuusipitoisuuden mukaan. (Katso KLIININEN FARMAKOLOGIA : Huumeiden vuorovaikutustutkimukset .)
Teofylliini
DIFLUCAN 50 mg lisää teofylliinin pitoisuutta seerumissa. Seerumin teofylliinipitoisuuksien huolellinen seuranta on suositeltavaa potilailla, jotka saavat 100 mg DIFLUCANia ja teofylliiniä. (Katso KLIININEN FARMAKOLOGIA : Huumeiden vuorovaikutustutkimukset .)
Tofasitinibi
Systeeminen tofasitinibille altistuminen lisääntyy, kun tofasitinibia annetaan samanaikaisesti flukonatsolin kanssa. Pienennä tofasitinibin annosta, kun sitä annetaan samanaikaisesti flukonatsolin kanssa (eli 5 mg:sta kahdesti vuorokaudessa 5 mg:aan kerran vuorokaudessa XELJANZ [tofasitinibi] -etiketissä olevien ohjeiden mukaisesti). (Katso KLIININEN FARMAKOLOGIA : Huumeiden vuorovaikutustutkimukset .)
Tolvaptaani
Plasman altistuminen tolvaptaanille lisääntyy merkittävästi (200 % AUC:ssa; 80 % Cmax:ssa), kun tolvaptaania, CYP3A4-substraattia, annetaan samanaikaisesti flukonatsolin, kohtalaisen CYP3A4-estäjän, kanssa. Tämä yhteisvaikutus saattaa lisätä tolvaptaaniin liittyvien haittavaikutusten, erityisesti merkittävän diureesin, kuivumisen ja akuutin munuaisten vajaatoiminnan, riskiä. Jos tolvaptaania ja flukonatsolia annetaan samanaikaisesti, tolvaptaanin annosta on pienennettävä tolvaptaanin ohjeiden mukaisesti ja potilasta on seurattava säännöllisesti tolvaptaaniin liittyvien haittavaikutusten varalta.
Triatsolaami
Flukonatsoli suurentaa triatsolaamin AUC-arvoa (kerta-annos) noin 50 %, Cmax-arvoa 20 % - 32 % ja lisää t½ -arvoa 25 % - 50 % triatsolaamin metabolian estymisen vuoksi. Triatsolaamin annoksen muuttaminen saattaa olla tarpeen.
Vinca-alkaloidit
Vaikka flukonatsolia ei ole tutkittu, se saattaa nostaa vinka-alkaloidien (esim. vinkristiinin ja vinblastiinin) pitoisuuksia plasmassa ja johtaa hermotoksisuuteen, joka saattaa johtua CYP3A4:ää estävästä vaikutuksesta.
A-vitamiini
Tapausraportin perusteella yhdestä potilaasta, joka sai yhdistelmähoitoa all-trans-retinoidihapon (A-vitamiinin hapan muoto) ja flukonatsolin kanssa, keskushermostoon (CNS) liittyviä haittavaikutuksia on kehittynyt pseudotumor cerebrin muodossa, joka hävisi flukonatsolihoidon lopettaminen. Tätä yhdistelmää voidaan käyttää, mutta keskushermostoon liittyvien haittavaikutusten esiintyvyys on pidettävä mielessä.
Vorikonatsoli
Vältä vorikonatsolin ja flukonatsolin samanaikaista käyttöä. Vorikonatsoliin liittyvien haittatapahtumien ja toksisuuden seurantaa suositellaan. varsinkin jos vorikonatsolihoito aloitetaan 24 tunnin sisällä viimeisen flukonatsoliannoksen jälkeen. (Katso KLIININEN FARMAKOLOGIA : Huumeiden vuorovaikutustutkimukset .)
Zidovudiini
Flukonatsoli suurentaa tsidovudiinin Cmax-arvoa 84 % ja AUC 74 %, koska suun kautta otettava tsidovudiinin puhdistuma pienenee noin 45 %. Tsidovudiinin puoliintumisaika piteni myös noin 128 % flukonatsolin yhdistelmähoidon jälkeen. Tätä yhdistelmää saavia potilaita tulee seurata tsidovudiiniin liittyvien haittavaikutusten kehittymisen varalta. Tsidovudiiniannoksen pienentämistä voidaan harkita.

Lääkäreiden tulee olla tietoisia siitä, että yhteisvaikutustutkimuksia muiden kuin KLIININEN FARMAKOLOGIAN osiossa lueteltujen lääkkeiden kanssa ei ole tehty, mutta tällaisia yhteisvaikutuksia saattaa esiintyä.
VAROITUKSET
VAROTOIMENPITEET
Kenraali
Jotkut atsolit, mukaan lukien flukonatsoli, on liitetty QT-ajan pidentymiseen EKG:ssa. Flukonatsoli aiheuttaa QT-ajan pidentymistä estämällä Rectifier Potassium Channel -virtaa (Ikr). Muiden lääkevalmisteiden (kuten amiodaroni) aiheuttama QT-ajan pidentyminen voi voimistua sytokromi P450 (CYP) 3A4:n eston kautta. (Katso VAROTOIMENPITEET : Huumeiden vuorovaikutukset .) Markkinoille tulon jälkeisen seurannan aikana flukonatsolia käyttävillä potilailla on esiintynyt harvinaisia tapauksia QT-ajan pidentymisestä ja torsade de pointesista. Suurin osa näistä raporteista koski vakavasti sairaita potilaita, joilla oli useita hämmentäviä riskitekijöitä, kuten rakenteellinen sydänsairaus, elektrolyyttihäiriöt ja samanaikaiset lääkkeet, jotka saattoivat vaikuttaa asiaan. Potilailla, joilla on hypokalemia ja pitkälle edennyt sydämen vajaatoiminta, on suurempi riski saada hengenvaarallisia kammiorytmihäiriöitä ja torsade de pointes -oireita.
Flukonatsolia tulee antaa varoen potilaille, joilla on näitä mahdollisesti proarytmisia sairauksia.
Flukonatsolin ja erytromysiinin samanaikainen käyttö saattaa lisätä kardiotoksisuuden (QT-ajan piteneminen, torsade de pointes) ja sen seurauksena äkillisen sydänkuoleman riskiä. Tätä yhdistelmää tulee välttää.
Flukonatsolia tulee antaa varoen potilaille, joilla on munuaisten vajaatoiminta.
Lisämunuaisten vajaatoimintaa on raportoitu potilailla, jotka ovat saaneet atsoleja, mukaan lukien flukonatsolia. Flukonatsolia saaneilla potilailla on raportoitu palautuvia lisämunuaisten vajaatoimintatapauksia.
DIFLUCAN 100 mg jauhe oraalisuspensiota varten sisältää sakkaroosia, eikä sitä tule käyttää potilailla, joilla on perinnöllinen fruktoosin, glukoosin/galaktoosin imeytymishäiriö tai sakkaroosi-isomaltaasin puutos.
Ajoneuvoja ajettaessa tai koneita käytettäessä on otettava huomioon, että toisinaan saattaa esiintyä huimausta tai kouristuskohtauksia.
Yksittäinen annos
Yksittäisen oraalisen flukonatsolitablettiannoksen mukavuutta ja tehokkuutta emättimen hiivatulehdusten hoidossa tulee punnita verrattuna siihen, onko DIFLUCANilla (26 %) verrattuna emättimensisäisiin lääkkeisiin (16 %) suurempi ilmaantuvuus. vertailevat kliiniset tutkimukset. (Katso HAITTAVAIKUTUKSET ja Kliiniset tutkimukset .)
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi ja hedelmällisyyden heikkeneminen
Flukonatsoli ei osoittanut syöpää aiheuttavaa potentiaalia hiirillä ja rotilla, joita hoidettiin suun kautta 24 kuukauden ajan annoksilla 2,5 mg/kg/vrk, 5 mg/kg/vrk tai 10 mg/kg/vrk (noin 2–7 kertaa suositeltu ihmisannos). ). Urosrotilla, joita hoidettiin 5 mg/kg/vrk ja 10 mg/kg/vrk, hepatosellulaaristen adenoomien ilmaantuvuus lisääntyi.
Flukonatsoli, joko metabolisen aktivaation kanssa tai ilman sitä, oli negatiivinen mutageenisuustesteissä neljässä S. typhimurium -kannassa ja hiiren lymfooma L5178Y -järjestelmässä. Sytogeneettiset tutkimukset in vivo (hiiren luuydinsolut, flukonatsolin oraalisen annon jälkeen) ja in vitro (ihmisen lymfosyytit altistettiin flukonatsolille pitoisuudella 1000 mcg/ml) eivät osoittaneet merkkejä kromosomimutaatioista.
Flukonatsoli ei vaikuttanut niiden uros- tai naarasrottien hedelmällisyyteen, joita hoidettiin suun kautta 5 mg/kg, 10 mg/kg tai 20 mg/kg päivittäisillä annoksilla tai parenteraalisilla annoksilla 5 mg/kg, 25 mg/kg tai 75 mg. /kg, vaikka synnytyksen alkaminen viivästyi hieman annoksella 20 mg/kg PO. Suonensisäisessä perinataalisessa tutkimuksessa rotilla 5 mg/kg, 20 mg/kg ja 40 mg/kg dystokiaa ja synnytyksen pitenemistä havaittiin muutamilla emoilla annoksella 20 mg/kg (noin 5-15 kertaa suositeltu annos ihmiselle ) ja 40 mg/kg, mutta ei 5 mg/kg. Synnytyshäiriöt heijastuivat lievänä kuolleena syntyneiden pentujen määrän kasvuna ja vastasyntyneiden eloonjäämisen vähenemisenä näillä annostasoilla. Vaikutukset rottien synnytykseen ovat yhdenmukaisia suurten flukonatsoliannosten aiheuttaman lajispesifisen estrogeenia alentavan ominaisuuden kanssa. Tällaista hormonimuutosta ei ole havaittu flukonatsolilla hoidetuilla naisilla. (Katso KLIININEN FARMAKOLOGIA .)
Raskaus
Teratogeeniset vaikutukset
Mahdollinen sikiövaurio
Käyttöä raskauden aikana tulee välttää paitsi potilailla, joilla on vaikea tai mahdollisesti hengenvaarallinen sieni-infektio, joille flukonatsolia voidaan käyttää, jos odotettu hyöty on suurempi kuin mahdollinen riski sikiölle. Muutamat julkaistut tapausraportit kuvaavat erilaisia synnynnäisiä poikkeavuuksia vauvoilla, jotka ovat altistuneet in utero suurelle annokselle äidin flukonatsolia (400-800 mg/vrk) suurimman osan tai koko ensimmäisen raskauskolmanneksen aikana. Nämä raportoidut poikkeavuudet ovat samanlaisia kuin eläinkokeissa havaitut. Tehokasta ehkäisyä tulee harkita hedelmällisessä iässä oleville naisille, joita hoidetaan 400–800 mg/vrk DIFLUCANilla, ja sitä tulee jatkaa koko hoitojakson ajan ja noin 1 viikon ajan (5–6 puoliintumisaikaa) viimeisen annoksen jälkeen. Jos DIFLUCANia käytetään raskauden aikana tai jos potilas tulee raskaaksi lääkkeen käytön aikana, potilaalle on kerrottava mahdollisesta sikiölle aiheutuvasta vaarasta. Retrospektiivisten epidemiologisten tutkimusten perusteella spontaaneja abortteja ja synnynnäisiä poikkeavuuksia on ehdotettu mahdollisiksi riskeiksi, jotka liittyvät 150 mg:n flukonatsolin kerta- tai toistuvaan annokseen raskauden ensimmäisen kolmanneksen aikana. DIFLUCAN 150 mg:n käytöstä raskaana oleville naisille ei ole tehty riittäviä ja hyvin kontrolloituja tutkimuksia. (Katso VAROITUKSET : Sikiövaurion mahdollisuus .)
Ihmistiedot
Tapausraportit kuvaavat erottuvaa ja harvinaista synnynnäisten epämuodostumien mallia vauvoilla, joiden äidit saivat suuria annoksia (400–800 mg/vrk) flukonatsolia suurimman osan tai koko raskauden ensimmäisen kolmanneksen aikana. Näillä vauvoilla havaittuja piirteitä ovat brakykefalia, epänormaalit faasiat, epänormaali kalvarian kehitys, suulakihalkio, reisiluun taipuminen, ohuet kylkiluut ja pitkät luut, arthrogryposis ja synnynnäinen sydänsairaus. Nämä vaikutukset ovat samanlaisia kuin eläinkokeissa havaitut.
Epidemiologiset tutkimukset viittaavat mahdolliseen spontaanin abortin ja synnynnäisten epämuodostumien riskiin vauvoilla, joiden äitejä hoidettiin 150 mg:lla flukonatsolia kerta-annoksena tai toistuvana annoksena ensimmäisen raskauskolmanneksen aikana, mutta näillä epidemiologisilla tutkimuksilla on rajoituksia, eikä näitä löydöksiä ole vahvistettu kontrolloiduissa kliinisissä tutkimuksissa. koettelemuksia.
Eläinten tiedot
Flukonatsolia annettiin suun kautta tiineille kaneille organogeneesin aikana kahdessa tutkimuksessa annoksilla 5 mg/kg, 10 mg/kg ja 20 mg/kg ja 5 mg/kg, 25 mg/kg ja 75 mg/kg. Äidin painonnousu heikkeni kaikilla annostasoilla (noin 0,25-4 kertaa kliininen 400 mg:n annos kehon pinta-alan [BSA] vertailun perusteella), ja abortteja tapahtui annoksella 75 mg/kg (noin 4 kertaa kliininen 400 mg:n annos perustuen BSA); haitallisia sikiövaikutuksia ei havaittu.
Useissa tutkimuksissa, joissa raskaana olevat rotat saivat flukonatsolia suun kautta organogeneesin aikana, emon painonnousu heikkeni ja istukan paino nousi annoksella 25 mg/kg. Ei havaittu sikiövaikutuksia annoksilla 5 mg/kg tai 10 mg/kg; sikiön anatomisten varianttien (ylimääräiset kylkiluut, munuaisaltaan laajentuminen) lisääntymistä ja luutumisen viivästymistä havaittiin annoksilla 25 mg/kg ja 50 mg/kg ja suuremmilla annoksilla. Annoksilla 80–320 mg/kg (noin 2–8 kertaa kliininen 400 mg:n annos BSA:n perusteella) rottien alkiokuolleisuus lisääntyi ja sikiön poikkeavuuksia olivat aaltoilevat kylkiluut, suulakihalkeama ja epänormaali kallon ja kasvojen luutuminen. Nämä vaikutukset ovat yhdenmukaisia estrogeenisynteesin eston kanssa rotilla ja voivat johtua alentuneen estrogeenin tunnetuista vaikutuksista tiineyteen, organogeneesiin ja synnytykseen.
Imettävät äidit
Flukonatsolia esiintyi rintamaidossa pieninä määrinä 150 mg:n kerta-annoksen antamisen jälkeen, mikä perustui tutkimukseen, jossa oli 10 imettävää naista, jotka keskeyttivät imetyksen tilapäisesti tai pysyvästi 5 päivän - 19 kuukauden kuluttua synnytyksestä. Arvioitu päivittäinen flukonatsolin annos rintamaidosta (olettaen, että maidonkulutus on keskimäärin 150 ml/kg/vrk) perustuu maidon keskimääräiseen huippupitoisuuteen (2,61 mcg/ml [vaihteluväli: 1,57 - 3,65 mikrog/ml] 5,2 tunnin kuluttua annos) oli 0,39 mg/kg/vrk, mikä on noin 13 % suunielun kandidiaasissa suositellusta lasten annoksesta. (Lasille merkitty annos on 6 mg/kg/vrk ensimmäisenä päivänä ja sen jälkeen 3 mg/kg/vrk; arvioitu imeväisten annos on 13 % 3 mg/kg/vrk ylläpitoannoksesta). Ei ole tietoa flukonatsolipitoisuuksista maidon toistuvan käytön tai suurten flukonatsoliannosten jälkeen. Julkaistussa tutkimuksessa 96 imettävästä naisesta, joita hoidettiin 150 mg:lla flukonatsolia joka toinen päivä (keskimäärin 7,3 kapselia [vaihteluväli 1–29 kapselia]) imetykseen liittyvän rintojen kandidoosin vuoksi, ei raportoitu vakavia haittavaikutuksia imeväisille. Varovaisuutta tulee noudattaa, kun DIFLUCANia annetaan imettävälle naiselle.
Käyttö lapsille
Avoin, satunnaistettu, kontrolloitu tutkimus on osoittanut DIFLUCAN 100 mg:n olevan tehokas suunnielun kandidiaasin hoidossa 6 kuukauden–13-vuotiailla lapsilla. (Katso Kliiniset tutkimukset .)
DIFLUCAN 200 mg:n käyttöä lapsille, joilla on kryptokokkimeningiitti, Candida esophagitis tai systeemiset Candida-infektiot, tukevat näissä käyttöaiheissa osoitettu tehokkuus aikuisilla ja tulokset useista pienistä ei-vertailevista pediatrisista kliinisistä tutkimuksista. Lisäksi farmakokineettiset tutkimukset lapsilla (ks KLIININEN FARMAKOLOGIA ) ovat vahvistaneet annossuhteen lasten ja aikuisten välillä. (Katso ANNOSTELU JA HALLINNOINTI .)
Ei-vertailevassa tutkimuksessa lapsilla, joilla oli vakavia systeemisiä sieni-infektioita, joista suurin osa oli kandidemiaa, DIFLUCANin tehokkuus oli samanlainen kuin raportoitu kandidemian hoidossa aikuisilla. Niistä 17 koehenkilöstä, joilla oli viljelyllä varmistettu kandidemia, 11:llä 14:stä (79 %), joilla oli lähtötilanteen oireita (3 oli oireettomia), parani kliinisesti; 13/15 (87 %) arvioitavista potilaista paransi mykologisesti hoidon lopussa, mutta kaksi näistä potilaista uusiutui 10 ja 18 päivän kohdalla hoidon lopettamisen jälkeen.
DIFLUCANin teho kryptokokkimeningiitin estämisessä onnistui neljällä viidestä lapsesta, joita hoidettiin flukonatsolin erityiskäyttötutkimuksessa hengenvaarallisen tai vakavan mykoosin hoidossa. Flukonatsolin tehosta lasten kryptokokkiaivokalvontulehduksen ensisijaisessa hoidossa ei ole tietoa.
DIFLUCAN 200 mg:n turvallisuusprofiilia lapsilla on tutkittu 577 lapsella iältään 1 vuorokaudesta 17-vuotiaaksi, jotka saivat 1 - 15 mg/kg/vrk annoksia 1 - 1 616 päivän ajan. (Katso HAITTAVAIKUTUKSET .)
DIFLUCANin tehoa ei ole osoitettu alle 6 kuukauden ikäisillä imeväisillä. (Katso KLIININEN FARMAKOLOGIA .) Pieni määrä potilaita (29), joiden ikä vaihtelee 1 päivästä 6 kuukauteen, on hoidettu turvallisesti DIFLUCANilla.
Geriatrinen käyttö
Muilla kuin AIDS-potilailla flukonatsolihoitoon mahdollisesti liittyviä sivuvaikutuksia raportoitiin harvemmilla 65-vuotiailla ja sitä vanhemmilla potilailla (9 %, n = 339) kuin nuoremmilla potilailla (14 %, n = 2240). Ikääntyneiden ja nuorempien potilaiden välillä ei kuitenkaan ollut johdonmukaista eroa yksittäisten sivuvaikutusten suhteen. Yleisimmin raportoiduista (> 1 %) sivuvaikutuksista ihottumaa, oksentelua ja ripulia esiintyi suuremmalla osalla iäkkäitä potilaita. Samanlaiset osuudet vanhemmista potilaista (2,4 %) ja nuoremmista potilaista (1,5 %) keskeyttivät flukonatsolihoidon sivuvaikutusten vuoksi. Markkinoille tulon jälkeen spontaaneja anemiaa ja akuuttia munuaisten vajaatoimintaa raportoitiin useammin 65-vuotiailla tai sitä vanhemmilla potilailla kuin 12-65-vuotiailla. Koska raportit ovat vapaaehtoisia ja anemian ja munuaisten vajaatoiminnan ilmaantuvuus lisääntyy luonnollisesti vanhuksilla, syy-yhteyttä lääkkeille altistumiseen ei kuitenkaan voida osoittaa.
Flukonatsolin kontrolloidut kliiniset tutkimukset eivät sisältäneet riittävää määrää 65-vuotiaita tai vanhempia potilaita arvioimaan, reagoivatko he eri tavalla kuin nuoremmat potilaat kussakin käyttöaiheessa. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa.
Flukonatsoli poistuu pääasiassa munuaisten kautta muuttumattomana lääkkeenä. Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, on huolehdittava annoksen säätämisestä kreatiniinipuhdistuman perusteella. Munuaisten toiminnan seuranta voi olla hyödyllistä. (Katso KLIININEN FARMAKOLOGIA ja ANNOSTELU JA HALLINNOINTI .)
YLIANNOSTUS
Flukonatsolin yliannostusta on raportoitu, johon on liittynyt hallusinaatioita ja vainoharhaista käyttäytymistä.
Yliannostustapauksissa on aloitettava oireenmukainen hoito (tukitoimenpiteillä ja mahahuuhtelulla, jos se on kliinisesti aiheellista).
Flukonatsoli erittyy suurelta osin virtsaan. 3 tunnin hemodialyysihoito laskee plasman pitoisuuksia noin 50 %.
Hiirillä ja rotilla, jotka saivat erittäin suuria annoksia flukonatsolia, molemmilla lajeilla esiintyi kliinisiä vaikutuksia heikentyneeseen liikkuvuuteen ja hengitykseen, ptoosiin, kyyneleritykseen, syljeneritykseen, virtsanpidätyskyvyttömyyteen, oikaisevan refleksin menettämiseen ja syanoosiin; kuolemaa edelsi joskus klooniset kouristukset.
VASTA-AIHEET
DIFLUCAN (flukonatsoli) on vasta-aiheinen potilailla, jotka ovat osoittaneet yliherkkyyttä flukonatsolille tai jollekin sen apuaineista. Flukonatsolin ja muiden atsoli-sienilääkkeiden välisestä ristikkäisyliherkkyydestä ei ole tietoa. Varovaisuutta tulee noudattaa määrättäessä DIFLUCANia potilaille, jotka ovat yliherkkiä muille atsoleille. Muiden lääkkeiden, joiden tiedetään pidentävän QT-aikaa ja jotka metaboloituvat CYP3A4-entsyymin kautta, kuten erytromysiinin, pimotsidin ja kinidiinin, samanaikainen käyttö on vasta-aiheista flukonatsolia saavilla potilailla. (Katso KLIININEN FARMAKOLOGIA : Huumeiden vuorovaikutustutkimukset ja VAROTOIMENPITEET .)
KLIININEN FARMAKOLOGIA
Farmakokinetiikka ja aineenvaihdunta
Flukonatsolin farmakokineettiset ominaisuudet ovat samanlaiset laskimonsisäisen tai oraalisen annostelun jälkeen. Tavallisilla vapaaehtoisilla suun kautta annetun flukonatsolin biologinen hyötyosuus on yli 90 % suonensisäiseen antoon verrattuna. Bioekvivalenssi todettiin 100 mg:n tabletin ja molempien suspensiovahvuuksien välillä, kun ne annettiin 200 mg:n kerta-annoksena.
Plasman huippupitoisuudet (Cmax) paastotuilla normaaleilla vapaaehtoisilla saavutetaan 1–2 tunnin kuluttua ja terminaalinen eliminaation puoliintumisaika plasmassa on noin 30 tuntia (vaihteluväli: 20–50 tuntia) suun kautta otetun annon jälkeen.
Paastonneilla normaaleille vapaaehtoisille kerta-annos DIFLUCANia (flukonatsolia) suun kautta 400 mg johtaa keskimääräiseen Cmax-arvoon 6,72 mcg/ml (vaihteluväli: 4,12-8,08 mcg/ml) ja flukonatsolin kerta-annosten jälkeen suun kautta 50-400 mg plasmapitoisuudet ja plasman pitoisuus-aikakäyrän alla oleva pinta-ala (AUC) ovat suhteessa annokseen.
Cmax- ja AUC-tiedot ruoan vaikutustutkimuksesta, jossa DIFLUCAN (flukonatsoli) -tabletteja annettiin terveille vapaaehtoisille paastoolosuhteissa ja runsasrasvaisen aterian yhteydessä, osoittivat, että ruoka ei vaikuta altistumiseen lääkkeelle. Siksi DIFLUCAN voidaan ottaa ruokailusta riippumatta. (Katso ANNOSTELU JA HALLINNOINTI .)
Vakaan tilan pitoisuudet saavutetaan 5–10 vuorokaudessa kerran vuorokaudessa otetun 50–400 mg:n oraalisen annoksen jälkeen. Kaksinkertaisen tavanomaisen vuorokausiannoksen kyllästysannoksen antaminen (päivänä 1) johtaa plasman pitoisuuksiin, jotka ovat lähellä vakaata tilaa toisena päivänä. Flukonatsolin näennäinen jakautumistilavuus on suunnilleen sama kuin kehon kokonaisvesimäärä. Sitoutuminen plasman proteiineihin on vähäistä (11-12 %). Flukonatsoli tunkeutuu kaikkiin tutkittuihin kehon nesteisiin, kun flukonatsoli on annettu joko kerran tai useasti suun kautta enintään 14 päivän ajan (ks. pöytä alla ). Normaaleilla vapaaehtoisilla flukonatsolin sylkipitoisuudet olivat yhtä suuret tai hieman suuremmat kuin plasman pitoisuudet annoksesta, reitistä tai annostelun kestosta riippumatta. Potilailla, joilla oli keuhkoputkentulehdus, flukonatsolin ysköspitoisuudet oraalisen 150 mg:n kerta-annoksen jälkeen olivat yhtä suuret kuin plasman pitoisuudet sekä 4 että 24 tunnin kuluttua annoksesta. Sieniaivokalvontulehdusta sairastavilla potilailla flukonatsolipitoisuudet aivo-selkäydinnesteessä (CSF) ovat noin 80 % vastaavista plasmapitoisuuksista.
27 potilaalle annettu 150 mg:n kerta-annos flukonatsolia tunkeutui emättimen kudokseen, jolloin kudos:plasma -suhteet vaihtelivat välillä 0,94-1,14 ensimmäisten 48 tunnin aikana annostelun jälkeen.
14 potilaalle annettu 150 mg:n kerta-annos flukonatsolia tunkeutui emättimen nesteeseen, jolloin neste:plasma-suhteet vaihtelivat välillä 0,36-0,71 ensimmäisten 72 tunnin aikana annostelun jälkeen.
Tavallisilla vapaaehtoisilla flukonatsoli poistuu pääasiassa munuaisten kautta, ja noin 80 % annetusta annoksesta erittyy virtsaan muuttumattomana lääkkeenä. Noin 11 % annoksesta erittyy virtsaan metaboliitteina.
Munuaisten toiminnan heikkeneminen vaikuttaa merkittävästi flukonatsolin farmakokinetiikkaan. Eliminaation puoliintumisajan ja kreatiniinipuhdistuman välillä on käänteinen suhde. DIFLUCAN-annosta voi olla tarpeen pienentää potilailla, joilla on munuaisten vajaatoiminta. (Katso ANNOSTELU JA HALLINNOINTI .) 3 tunnin hemodialyysihoito laskee plasman pitoisuuksia noin 50 %.
Tavallisilla vapaaehtoisilla DIFLUCANin antaminen (annokset vaihtelevat 200–400 mg kerran vuorokaudessa enintään 14 päivän ajan) liittyi pieniin ja epäjohdonmukaisiin vaikutuksiin testosteronipitoisuuksiin, endogeenisten kortikosteroidipitoisuuksien ja adrenokortikotrooppisen hormonin (ACTH) stimuloimaan kortisolivasteeseen.
Farmakokinetiikka lapsilla
Lapsilla on raportoitu seuraavat farmakokineettiset tiedot {Mean (%cv)}:
Näissä tutkimuksissa ikä ei vaikuttanut ruumiinpainoon korjattuun puhdistumaan. Aikuisten keskimääräisen kehon puhdistuman on raportoitu olevan 0,23 (17 %) ml/min/kg.
Keskosilla (raskausaika 26-29 viikkoa) keskimääräinen (%cv) puhdistuma 36 tunnin sisällä syntymästä oli 0,180 (35 %, N = 7) ml/min/kg, mikä nousi ajan myötä keskimäärin 0,218 ( 31 %, N = 9) ml/min/kg kuusi päivää myöhemmin ja 0,333 (56 %, N = 4) ml/min/kg 12 päivää myöhemmin. Vastaavasti puoliintumisaika oli 73,6 tuntia, joka pieneni ajan myötä keskimäärin 53,2 tuntiin kuusi päivää myöhemmin ja 46,6 tuntiin 12 päivää myöhemmin.
Farmakokinetiikka vanhuksilla
Farmakokineettinen tutkimus suoritettiin 22:lla, vähintään 65-vuotiaalla henkilöllä, jotka saivat kerta-annoksen 50 mg flukonatsolia suun kautta. Kymmenen näistä potilaista sai samanaikaisesti diureetteja. Cmax oli 1,54 mcg/ml ja se saavutettiin 1,3 tuntia annoksen jälkeen. Keskimääräinen AUC oli 76,4 ± 20,3 mcg•h/ml ja keskimääräinen terminaalinen puoliintumisaika 46,2 tuntia. Nämä farmakokineettisten parametrien arvot ovat korkeampia kuin normaaleilla nuorilla vapaaehtoisilla miehillä raportoidut analogiset arvot. Diureettien samanaikainen käyttö ei muuttanut merkittävästi AUC- tai Cmax-arvoa. Lisäksi kreatiniinin puhdistuma (74 ml/min), virtsaan muuttumattomana erittyneen lääkkeen prosenttiosuus (0–24 tuntia, 22 %) ja flukonatsolin munuaispuhdistumaarviot (0,124 ml/min/kg) vanhuksilla olivat yleensä alhaisemmat. kuin nuoremmilla vapaaehtoisilla. Siten flukonatsolin jakautumisen muutos iäkkäillä näyttää liittyvän tälle ryhmälle ominaiseen heikentyneeseen munuaisten toimintaan. Kunkin koehenkilön terminaalisen eliminaation puoliintumisajan ja kreatiniinipuhdistuman välinen kaavio verrattuna ennustettuun puoliintumisaikaan – kreatiniinin puhdistumakäyrään, joka on johdettu normaaleista koehenkilöistä ja koehenkilöistä, joilla oli eriasteinen munuaisten vajaatoiminta, osoitti, että 21 potilaasta 22:sta kuului ennustetun puoliintumisajan kreatiniinipuhdistumakäyrien 95 %:n luottamusraja. Nämä tulokset ovat yhdenmukaisia sen hypoteesin kanssa, että korkeammat arvot farmakokineettisille parametreille, jotka havaitaan iäkkäillä koehenkilöillä verrattuna normaaleihin nuoriin vapaaehtoisiin miehiin, johtuvat heikentyneestä munuaistoiminnasta, joka on odotettavissa vanhuksilla.
Huumeiden vuorovaikutustutkimukset
(Katso HUUMEIDEN VUOROVAIKUTUKSET )
Ehkäisypillerit
Suun kautta otettavia ehkäisyvalmisteita annettiin kerta-annoksena sekä ennen 50 mg DIFLUCANin oraalista antoa kerran vuorokaudessa että sen jälkeen 10 päivän ajan 10 terveelle naiselle. Etinyyliestradiolin tai levonorgestreelin AUC-arvoissa ei ollut merkitsevää eroa 50 mg:n DIFLUCAN-annoksen jälkeen. Etinyyliestradiolin AUC:n keskimääräinen nousu oli 6 % (vaihteluväli: -47 - 108 %) ja levonorgestreelin AUC kasvoi 17 % (vaihteluväli: -33 - 141 %).
Toisessa tutkimuksessa 25 normaalia naista sai päivittäin 200 mg DIFLUCAN 150 mg tabletteja tai lumelääkettä kahden kymmenen päivän ajan. Hoitosyklien välissä oli yksi kuukausi, ja kaikki koehenkilöt saivat DIFLUCANia yhden syklin aikana ja lumelääkettä toisen syklin aikana. Tutkimuskäsittelyn järjestys oli satunnainen. Molempien syklien viimeisenä hoitopäivänä (päivä 10) annettiin kerta-annokset levonorgestreeliä ja etinyyliestradiolia sisältävää ehkäisytablettia. 200 mg:n DIFLUCAN-annoksen jälkeen levonorgestreelin AUC:n keskimääräinen prosentuaalinen nousu lumelääkkeeseen verrattuna oli 25 % (vaihteluväli: 12–82 %) ja etinyyliestradiolin keskimääräinen prosenttiosuus lumelääkkeeseen verrattuna oli 38 % (vaihteluväli: –11-101 %). Molemmat nousut erosivat tilastollisesti merkitsevästi lumelääkkeestä.
Kolmannessa tutkimuksessa arvioitiin flukonatsolin kerran viikossa 300 mg:n annostelun mahdollista yhteisvaikutusta 21 normaalille naiselle, jotka käyttivät etinyyliestradiolia ja noretindronia sisältävää oraalista ehkäisyä. Tässä lumekontrolloidussa, kaksoissokkoutetussa, satunnaistetussa, kaksisuuntaisessa ristikkäistutkimuksessa, joka suoritettiin kolmen suun kautta otettavan ehkäisyhoidon syklin aikana, flukonatsolin annostelu johti pieneen nousuun etinyyliestradiolin ja noretindronin keskimääräisissä AUC-arvoissa verrattuna vastaavaan lumelääkkeeseen. Etinyyliestradiolin ja noretindronin keskimääräiset AUC-arvot nousivat 24 % (95 %:n luottamusväli: 18-31 %) ja 13 % (95 %:n luottamusväli: 8-18 %) lumelääkkeeseen verrattuna. Flukonatsolihoito ei pienentänyt etinyyliestradiolin AUC-arvoa tässä tutkimuksessa yhdelläkään yksilöllä lumelääkkeeseen verrattuna. Noretindronin yksittäiset AUC-arvot pienenivät hyvin hieman (
Simetidiini
DIFLUCAN 100 mg annettiin kerta-annoksena suun kautta yksinään ja kaksi tuntia simetidiinin 400 mg kerta-annoksen jälkeen kuudelle terveelle miespuoliselle vapaaehtoiselle. Simetidiinin annon jälkeen flukonatsolin AUC- ja Cmax-arvot pienenivät merkittävästi. Flukonatsolin AUC-arvo pieneni keskimäärin ± SD 13 % ± 11 % (vaihteluväli: 3,4 - 31 %) ja Cmax laski 19 % ± 14 % (väli: 5 - 40 %). Simetidiinin 600–900 mg suonensisäinen anto neljän tunnin aikana (tunti ennen 200 mg DIFLUCANin oraalista kerta-annosta 3 tuntia sen jälkeen) ei kuitenkaan vaikuttanut flukonatsolin biologiseen hyötyosuuteen tai farmakokinetiikkaan 24 terveellä miespuolisella vapaaehtoisella. .
Antacid
Maalox®:n (20 ml) antaminen 14 normaalille vapaaehtoiselle miespuoliselle henkilölle välittömästi ennen kerta-annosta DIFLUCAN 100 mg ei vaikuttanut flukonatsolin imeytymiseen tai eliminoitumiseen.
Hydroklooritiatsidi
100 mg:n DIFLUCANin ja 50 mg:n hydroklooritiatsidin samanaikainen oraalinen antaminen 10 päivän ajan 13 normaalille vapaaehtoiselle johti flukonatsolin AUC- ja Cmax-arvojen merkittävään nousuun verrattuna yksinään annettuun DIFLUCANiin. Flukonatsolin AUC ja Cmax nousivat keskimäärin ± SD 45 % ± 31 % (vaihteluväli: 19 - 114 %) ja 43 % ± 31 % (vaihteluväli: 19 - 122 %). Nämä muutokset johtuvat 30 % ± 12 %:n keskimääräisestä ± SD pienenemisestä munuaispuhdistumassa (vaihteluväli: 10 - 50 %).
Rifampiini
Yhden 200 mg:n DIFLUCAN 200 mg:n kerta-annos suun kautta sen jälkeen, kun rifampiinia annettiin 600 mg päivässä 15 päivän ajan kahdeksalle terveelle miespuoliselle vapaaehtoiselle, pienensi merkittävästi flukonatsolin AUC-arvoa ja suureni merkittävästi flukonatsolin näennäistä oraalista puhdistumaa. Flukonatsolin AUC pieneni keskimäärin ± SD 23 % ± 9 % (vaihteluväli: 13 - 42 %). Flukonatsolin näennäinen oraalinen puhdistuma lisääntyi 32 % ± 17 % (vaihteluväli: 16-72 %). Flukonatsolin puoliintumisaika lyheni 33,4 ± 4,4 tunnista 26,8 ± 3,9 tuntiin. (Katso VAROTOIMENPITEET .)
Varfariini
Protrombiiniaikavaste (protrombiiniaika-aikakäyrän alla oleva pinta-ala) lisääntyi merkittävästi sen jälkeen, kun varfariinia annettiin kerta-annoksena (15 mg) 13 normaalille vapaaehtoiselle miehelle suun kautta 200 mg DIFLUCANia annettaessa päivittäin 14 päivän ajan verrattuna annokseen. pelkällä varfariinilla. Protrombiiniaikavasteessa (protrombiiniaika-aikakäyrän alla oleva pinta-ala) oli keskimääräinen ± SD nousu 7 % ± 4 % (vaihteluväli: 2–13 %). (Katso VAROTOIMENPITEET .) Keskiarvo perustuu 12 kohteen tietoihin, koska yksi 13 koehenkilöstä koki kaksinkertaisen protrombiiniaikavasteensa.
Fenytoiini
Fenytoiinin AUC määritettiin 4 päivän fenytoiiniannoksen jälkeen (200 mg päivässä, suun kautta 3 päivän ajan, minkä jälkeen 250 mg laskimoon yksi annos) sekä flukonatsolin kanssa että ilman (200 mg DIFLUCAN-suun kautta 16 päivän ajan) 10 normaalilla miehellä. vapaaehtoisia. Fenytoiinin AUC nousi merkittävästi. Fenytoiinin AUC:n keskimääräinen nousu ± SD oli 88 % ± 68 % (vaihteluväli: 16 - 247 %). Tämän vuorovaikutuksen absoluuttista suuruutta ei tunneta, koska fenytoiini on luonnostaan epälineaarinen. (Katso VAROTOIMENPITEET .)
Syklosporiini
Siklosporiinin AUC ja Cmax määritettiin ennen ja jälkeen 200 mg flukonatsolia vuorokaudessa 14 päivän ajan kahdeksalla munuaisensiirtopotilaalla, jotka olivat saaneet siklosporiinihoitoa vähintään 6 kuukauden ajan ja stabiililla siklosporiiniannoksella vähintään 6 viikon ajan. Flukonatsolin annon jälkeen siklosporiinin AUC, Cmax, Cmin (24 tunnin pitoisuus) suurenivat merkittävästi ja näennäinen oraalinen puhdistuma pieneni merkittävästi. AUC:n keskimääräinen nousu ± SD oli 92 % ± 43 % (vaihteluväli: 18-147 %). Cmax nousi 60 % ± 48 % (väli: 5–133 %). C nousi 157 % ± 96 % (vaihteluväli: 33 - 360 %). Näennäinen oraalinen puhdistuma pieneni 45 % ± 15 % (vaihteluväli: 15 - 60 %). (Katso VAROTOIMENPITEET .)
Zidovudiini
Plasman tsidovudiinipitoisuudet määritettiin kahdesti (ennen 200 mg flukonatsolia vuorokaudessa ja sen jälkeen 15 päivän ajan) 13 vapaaehtoisella, joilla oli AIDS tai ARC ja jotka saivat vakaata tsidovudiiniannosta vähintään kahden viikon ajan. Tsidovudiinin AUC suureni merkittävästi flukonatsolin annon jälkeen. AUC:n keskimääräinen nousu ± SD oli 20 % ± 32 % (vaihteluväli: -27 - 104 %). Metaboliitin, GZDV:n, suhde emolääkkeeseen pieneni merkittävästi flukonatsolin annon jälkeen, 7,6 ± 3,6:sta 5,7 ± 2,2:een.
Teofylliini
Teofylliinin farmakokinetiikka määritettiin kerta-annos aminofylliiniä (6 mg/kg) ennen ja jälkeen flukonatsolin 200 mg suun kautta vuorokaudessa 14 päivän ajan 16 normaalilla vapaaehtoisella miespuolisella vapaaehtoisella. Teofylliinin AUC, Cmax ja puoliintumisaika pitenevät merkittävästi ja puhdistuma pieneni vastaavasti. Teofylliinin AUC:n keskiarvo ± SD kasvoi 21 % ± 16 % (vaihteluväli: -5 - 48 %). Cmax nousi 13 % ± 17 % (väli: 13 - 40 %). Teofylliinin puhdistuma laski 16 % ± 11 % (vaihteluväli: 32–5 %). Teofylliinin puoliintumisaika piteni 6,6 ± 1,7 tunnista 7,9 ± 1,5 tuntiin. (Katso VAROTOIMENPITEET .)
Kinidiini
Vaikka flukonatsolin ja kinidiinin samanaikainen anto ei ole tutkittu in vitro tai in vivo, se saattaa estää kinidiinin metaboliaa. Kinidiinin käyttö on yhdistetty QT-ajan pidentymiseen ja harvoin torsade de pointesin esiintymiseen. Flukonatsolin ja kinidiinin samanaikainen käyttö on vasta-aiheista. (Katso VASTA-AIHEET ja VAROTOIMENPITEET .)
Suun hypoglykemiat
Flukonatsolin vaikutuksia sulfonyyliurean oraalisten hypoglykeemisten aineiden tolbutamidin, glipitsidin ja glyburidin farmakokinetiikkaan arvioitiin kolmessa lumekontrolloidussa tutkimuksessa normaaleilla vapaaehtoisilla. Kaikki koehenkilöt saivat sulfonyyliureaa yksinään yhtenä annoksena ja jälleen yhtenä annoksena sen jälkeen, kun DIFLUCANia annettiin 100 mg päivässä 7 päivän ajan. Näissä kolmessa tutkimuksessa 22/46 (47,8 %) DIFLUCAN-hoitoa saaneista potilaista ja 9/22 (40,1 %) lumelääkettä saaneista potilaista koki hypoglykemian oireita. (Katso VAROTOIMENPITEET .)
tolbutamidi
13 normaalilla vapaaehtoisella miespuolisella vapaaehtoisella tolbutamidin (500 mg kerta-annos) AUC- ja Cmax-arvot suurenivat merkittävästi flukonatsolin annon jälkeen. Tolbutamidin AUC nousi keskimäärin ± SD 26 % ± 9 % (vaihteluväli: 12 - 39 %). Tolbutamidin Cmax nousi 11 % ± 9 % (vaihteluväli: 6–27 %). (Katso VAROTOIMENPITEET .)
Glipitsidi
Glipitsidin (2,5 mg:n kerta-annos) AUC- ja Cmax-arvot suurenivat merkittävästi flukonatsolin annon jälkeen 13 normaalilla miespuolisella vapaaehtoisella. AUC nousi keskimäärin ± SD 49 % ± 13 % (vaihteluväli: 27 - 73 %) ja Cmax nousi 19 % ± 23 % (vaihteluväli: 11 - 79 %). (Katso VAROTOIMENPITEET .)
Glyburidi
Glyburidin (5 mg:n kerta-annos) AUC- ja Cmax-arvot nousivat merkittävästi flukonatsolin antamisen jälkeen 20 normaalille miespuoliselle vapaaehtoiselle. AUC nousi keskimäärin ± SD 44 % ± 29 % (vaihteluväli: -13 - 115 %) ja Cmax nousi 19 % ± 19 % (vaihteluväli: -23 - 62 %). Viisi koehenkilöä tarvitsi suun kautta glukoosia glyburidin nauttimisen jälkeen 7 päivän flukonatsolin antamisen jälkeen. (Katso VAROTOIMENPITEET .)
Rifabutiini
On julkaistu raportteja, joiden mukaan flukonatsolia ja rifabutiinia annetaan yhteisvaikutuksia, mikä johtaa seerumin rifabutiinipitoisuuden nousuun. (Katso VAROTOIMENPITEET .)
Takrolimuusi
On julkaistu raportteja, joiden mukaan flukonatsolin ja takrolimuusin samanaikaisessa käytössä on yhteisvaikutuksia, mikä johtaa takrolimuusin seerumipitoisuuksien nousuun. (Katso VAROTOIMENPITEET .)
Midatsolaami
Flukonatsolin vaikutusta midatsolaamin farmakokinetiikkaan ja farmakodynamiikkaan tutkittiin satunnaistetussa, ristikkäistutkimuksessa, johon osallistui 12 vapaaehtoista. Tutkimuksessa koehenkilöt nauttivat lumelääkettä tai 400 mg flukonatsolia päivänä 1 ja sen jälkeen 200 mg päivässä päivästä 2 päivään 6. Lisäksi 7,5 mg:n annos midatsolaamia otettiin suun kautta ensimmäisenä päivänä, 0,05 mg/kg annettiin laskimoon neljäntenä päivänä ja 7,5 mg suun kautta kuudentena päivänä. Flukonatsoli vähensi IV midatsolaamin puhdistumaa 51 %. Ensimmäisenä annostelupäivänä flukonatsoli suurensi midatsolaamin AUC-arvoa 259 % ja C-arvoa 150 %. Kuudentena annostelupäivänä flukonatsoli suurensi midatsolaamin AUC-arvoa 259 % ja C-arvoa 74 %. Midatsolaamin psykomotoriset vaikutukset lisääntyivät merkittävästi suun kautta otetun midatsolaamin jälkeen, mutta eivät merkittävästi laskimonsisäisen midatsolaamin antamisen jälkeen.
Toinen satunnaistettu, kaksinkertainen, lumekontrolloitu, ristikkäinen, kolmevaiheinen tutkimus suoritettiin määrittämään flukonatsolin antoreitin vaikutus flukonatsolin ja midatsolaamin väliseen yhteisvaikutukseen. Kussakin vaiheessa koehenkilöille annettiin suun kautta 400 mg flukonatsolia ja suonensisäistä suolaliuosta; suun kautta otettava plasebo ja suonensisäinen flukonatsoli 400 mg; ja oraalinen plasebo ja IV suolaliuos. Suun kautta otettava 7,5 mg:n midatsolaamiannos otettiin flukonatsoli/plasebon jälkeen. Midatsolaamin AUC- ja Cmax-arvot olivat merkittävästi korkeammat oraalisen flukonatsolin annon jälkeen kuin laskimoon. Suun kautta otettava flukonatsoli suurensi midatsolaamin AUC-arvoa 272 % ja Cmax-arvoa 129 %. IV flukonatsoli suurensi midatsolaamin AUC-arvoa 244 % ja Cmax 79 %. Sekä oraalinen että IV flukonatsoli lisäsivät midatsolaamin farmakodynaamisia vaikutuksia. (Katso VAROTOIMENPITEET .)
Atsitromysiini
Avoimessa, satunnaistetussa, kolmisuuntaisessa ristikkäistutkimuksessa 18 terveellä koehenkilöllä arvioitiin yhden 800 mg:n suun kautta otettavan flukonatsolin kerta-annoksen vaikutusta atsitromysiinin 1 200 mg:n kerta-annoksen farmakokinetiikkaan sekä atsitromysiinin vaikutuksia farmakokinetiikkaan. flukonatsolista. Flukonatsolin ja atsitromysiinin välillä ei ollut merkittävää farmakokineettistä yhteisvaikutusta.
Vorikonatsoli
Vorikonatsoli on sekä CYP2C9- että CYP3A4-isoentsyymien substraatti. Suun kautta otettavan vorikonatsolin (400 mg Q12h 1 vuorokauden ajan, sitten 200 mg Q12h 2,5 vuorokauden ajan) ja oraalisen flukonatsolin (400 mg päivänä 1, sitten 200 mg Q24h 4 päivän ajan) samanaikainen anto kuudelle terveelle mieshenkilölle johti Cmax:n nousuun ja vorikonatsolin AUCτ keskimäärin 57 % (90 % CI: 20 % - 107 %) ja 79 % (90 % CI: 40 % - 128 %), vastaavasti. Kliinisessä jatkotutkimuksessa, johon osallistui 8 tervettä miespuolista koehenkilöä, vorikonatsolin ja flukonatsolin annostuksen ja/tai käyttötiheyden pienentäminen ei poistanut tai vähentänyt tätä vaikutusta. Vorikonatsolin ja flukonatsolin samanaikaista käyttöä millään annoksilla ei suositella. Vorikonatsoliin liittyvien haittatapahtumien tarkkaa seurantaa suositellaan, jos vorikonatsolia käytetään peräkkäin flukonatsolin jälkeen, erityisesti 24 tunnin sisällä viimeisestä flukonatsoliannoksesta. (Katso VAROTOIMENPITEET .)
Tofasitinibi
Flukonatsolin (400 mg päivänä 1 ja 200 mg kerran vuorokaudessa 6 päivän ajan [päivät 2–7]) ja tofasitinibin (30 mg kerta-annos päivänä 5) samanaikainen anto terveillä koehenkilöillä nosti tofasitinibin keskimääräisiä AUC- ja Cmax-arvoja noin 79 % (90 % CI: 64 % - 96 %) ja 27 % (90 % CI: 12 % - 44 %) verrattuna pelkän tofasitinibin antamiseen. (Katso VAROTOIMENPITEET .)
Mikrobiologia
Toimintamekanismi
Flukonatsoli on erittäin selektiivinen sienen sytokromi P450 -riippuvaisen lanosteroli-14-α-demetylaasientsyymin estäjä. Tämä entsyymi toimii muuntaen lanosterolin ergosteroliksi. Myöhempi normaalien sterolien häviäminen korreloi 14-α-metyylisterolien kerääntymisen kanssa sieniin ja voi olla vastuussa flukonatsolin fungistaattisesta aktiivisuudesta. Nisäkässolujen demetylaatio on paljon vähemmän herkkä flukonatsolin estämiselle.
Resistanssi
Mahdollisuus resistenssin kehittymiseen flukonatsolille tunnetaan hyvin. Sieni-isolaateilla, joiden herkkyys muille atsoleille on heikentynyt, voi myös olla vähentynyt herkkyys flukonatsolille. Eri sienten, joille tämä lääke on tarkoitettu, lääkeresistenssin kehittymisen esiintymistiheyttä ei tunneta.
Flukonatsoliresistenssi voi johtua kohteena olevan entsyymin (lanosteroli-14-α-demetylaasi) laadun tai määrän muuttamisesta, lääkkeen kohteen pääsyn heikkenemisestä tai näiden mekanismien jostakin yhdistelmästä.
Kohdeentsyymiä koodaavan geenin (ERG11) pistemutaatiot johtavat muuttuneeseen kohteeseen, jolla on vähentynyt affiniteetti atsoleihin. ERG11:n yli-ilmentyminen johtaa korkeiden kohdeentsyymipitoisuuksien tuotantoon, mikä luo tarpeen korkeammille solunsisäisille lääkeainepitoisuuksille kaikkien solun entsyymimolekyylien estämiseksi.
Toinen pääasiallinen lääkeresistenssin mekanismi sisältää flukonatsolin aktiivisen ulosvirtauksen solusta kahden tyyppisen usean lääkkeen ulosvirtauksen kuljettajan aktivoitumisen kautta; tärkeimmät fasilitaattorit (koodaavat MDR-geenit) ja ATP:tä sitovan kasetin superperheen (CDR-geenien koodaamat) fasilitaattorit. MDR-geenin lisääntynyt säätely johtaa flukonatsoliresistenssiin, kun taas CDR-geenien lisääntynyt säätely voi johtaa resistenssiin useille atsoleille.
Candida glabratan resistenssi sisältää yleensä CDR-geenien lisääntymisen, mikä johtaa resistenssiin useille atsoleille. Isolaatille, jonka pienin estävä pitoisuus (MIC) on luokiteltu välituotteeksi (16-32 mcg/ml), suositellaan suurinta flukonatsoliannosta.
Candida krusein tulisi katsoa olevan resistentti flukonatsolille. C. krusein resistenssi näyttää välittyvän kohdeentsyymin heikentyneestä herkkyydestä aineen estämiselle.
Muiden Candida-lajien kuin C. albicansin aiheuttamia superinfektioita on raportoitu, jotka eivät usein ole luonnostaan herkkiä DIFLUCANille (esim. Candida krusei). Tällaiset tapaukset voivat vaatia vaihtoehtoista sienilääkitystä.
Antimikrobinen aktiivisuus
Flukonatsolin on osoitettu olevan aktiivinen useimpia seuraavien mikro-organismien isolaatteja vastaan sekä in vitro että kliinisissä infektioissa.
Candida albicans Candida glabrata (Monet isolaatit ovat keskiherkkiä) Candida parapsilosis Candida tropicalis Cryptococcus neoformans
Seuraavat in vitro -tiedot ovat saatavilla, mutta niiden kliinistä merkitystä ei tunneta. Vähintään 90 %:lla seuraavista sienistä in vitro MIC on pienempi tai yhtä suuri kuin flukonatsolin herkkä raja-arvo (https://www.fda.gov/STIC) saman suvun tai organismiryhmän isolaatteja vastaan. Flukonatsolin tehoa näiden sienten aiheuttamien kliinisten infektioiden hoidossa ei kuitenkaan ole osoitettu riittävissä ja hyvin kontrolloiduissa kliinisissä tutkimuksissa.
Candida dubliniensis Candida guilliermondii Candida kefyr Candida lusitaniae
Candida krusein tulisi katsoa olevan resistentti flukonatsolille. C. krusein resistenssi näyttää välittyvän kohdeentsyymin heikentyneestä herkkyydestä aineen estämiselle.
Muiden Candida-lajien kuin C. albicansin aiheuttamia superinfektioita on raportoitu, jotka eivät usein ole luonnostaan herkkiä DIFLUCANille (esim. Candida krusei). Tällaiset tapaukset voivat vaatia vaihtoehtoista sienilääkitystä.
Herkkyystestaus
Tarkempia tietoja herkkyystestin tulkintakriteereistä ja niihin liittyvistä testimenetelmistä ja laadunvalvontastandardeista, jotka FDA on tunnustanut tälle lääkkeelle, on osoitteessa https://www.fda.gov/STIC.
Kliiniset tutkimukset
Kryptokokin aiheuttama aivokalvontulehdus
Monikeskustutkimuksessa, jossa verrattiin DIFLUCANia (200 mg/vrk) amfoterisiini B:hen (0,3 mg/kg/vrk) kryptokokkimeningiitin hoidossa AIDS-potilailla, monimuuttujaanalyysi paljasti kolme hoitoa edeltävää tekijää, jotka ennustivat kuoleman hoidon aikana: epänormaali henkinen tila, aivo-selkäydinnesteen kryptokokkiantigeenitiitteri yli 1:1024 ja aivo-selkäydinnesteen valkosolujen määrä alle 20 solua/mm³. Korkean riskin potilaiden kuolleisuus oli 33 % ja 40 % amfoterisiini B -potilailla ja DIFLUCAN-potilailla (p = 0,58), ja kokonaiskuolleisuus oli 14 % (9 potilaasta 63:sta) ja 18 % (24 potilaasta 131:stä) kahdessa haarassa. tutkimuksessa (p=0,48). Optimaaliset annokset ja hoito-ohjelmat potilaille, joilla on akuutti kryptokokkimeningiitti ja joilla on suuri riski hoidon epäonnistumisesta, on vielä määrittämättä. (Saag et ai. N Engl J Med 1992; 326:83-9.)
Emättimen kandidiaasi
Yhdysvalloissa tehtiin kaksi riittävää ja hyvin kontrolloitua tutkimusta 150 mg:n tabletilla. Molemmissa flukonatsolihoito-ohjelman tulokset olivat verrattavissa kontrolli-ohjelmaan (klotrimatsoli tai mikonatsoli intravaginaalisesti 7 päivän ajan) sekä kliinisesti että tilastollisesti kuukauden hoidon jälkeen.
Terapeuttinen paranemisaste, joka määritellään emättimen kandidiaasin merkkien ja oireiden täydelliseksi häviämiseksi (kliininen parantuminen) sekä negatiivinen KOH-tutkimus ja negatiivinen Candida-viljely (mikrobiologinen hävitys), oli 55 % sekä flukonatsoliryhmässä että emätinvalmisteissa. ryhmä.
Noin kolmella neljäsosalla tutkimuspotilaista oli akuutti vaginiitti (
Ruoansulatuskanavan tapahtumia raportoitiin huomattavasti enemmän flukonatsoliryhmässä kuin emätinvalmisteryhmässä. Suurin osa tapahtumista oli lieviä tai kohtalaisia. Koska flukonatsolia annettiin kerta-annoksena, hoitoa ei keskeytetty.
Pediatriset tutkimukset
Suunnielun kandidiaasi
Avoin, vertaileva tutkimus DIFLUCANin (2–3 mg/kg/vrk) ja suun kautta otettavan nystatiinin (400 000 IU 4 kertaa päivässä) tehosta ja turvallisuudesta suunnielun kandidiaasipotilailla, joilla on immuunipuutos, suoritettiin. Kliiniset ja mykologiset vasteet olivat korkeampia flukonatsolilla hoidetuilla lapsilla.
Kliinisen parantumisen ilmoitettiin hoidon lopussa 86 %:lla flukonatsolihoitoa saaneista potilaista verrattuna 46 %:iin nystatiinilla hoidetuista potilaista. Mykologisesti 76 %:lla flukonatsolilla hoidetuista potilaista tartunnan aiheuttava organismi oli hävinnyt verrattuna 11 %:iin nystatiinilla hoidetuista potilaista.
Niiden potilaiden osuus, joilla oli kliininen uusiutuminen 2 viikkoa hoidon päättymisen jälkeen, oli 14 % DIFLUCANia saaneista ja 16 % nystatiinia saaneista potilaista. Neljän viikon kuluttua hoidon päättymisestä kliinistä uusiutumista sairastavien potilaiden prosenttiosuudet olivat 22 % DIFLUCAN 150 mg:n ja 23 % nystatiinin kohdalla.
POTILASTIEDOT
DIFLUCAN® (väriaine-FLEW-kan) (flukonatsoli) Tabletit
Tämä pakkausseloste sisältää tärkeitä tietoja DIFLUCANista. Sen ei ole tarkoitus korvata terveydenhuollon tarjoajan ohjeita. Lue nämä tiedot huolellisesti ennen kuin otat DIFLUCANia. Kysy terveydenhuollon tarjoajaltasi, jos et ymmärrä mitään näistä tiedoista tai jos haluat tietää lisää DIFLUCANista.
Mikä on DIFLUCAN 100mg?
DIFLUCAN on reseptilääke, jota käytetään Candida-nimisen hiivasienen aiheuttamien emättimen hiivatulehdusten hoitoon. DIFLUCAN 150mg auttaa estämään liiallisen hiivan kasvun emättimessä, jolloin hiivatulehdus häviää.
DIFLUCAN 150 mg eroaa muista emättimen hiivatulehdusten hoidoista, koska se on suun kautta otettava tabletti. DIFLUCANia käytetään myös muihin sairauksiin. Tämä pakkausseloste koskee kuitenkin vain DIFLUCAN 50 mg:n käyttöä emättimen hiivatulehdusten hoitoon. Pyydä terveydenhuollon tarjoajalta tietoja DIFLUCAN 200 mg:n käytöstä muista syistä. Katso tämän pakkausselosteen osiosta tietoja emättimen hiivainfektioista.
Mikä on emättimen hiivatulehdus?
On normaalia, että emättimestä löytyy tietty määrä hiivaa. Joskus emättimessä alkaa kasvaa liikaa hiivaa, mikä voi aiheuttaa hiivainfektion. Emättimen hiivainfektiot ovat yleisiä. Noin kolme neljästä aikuisesta naisesta saa elämänsä aikana vähintään yhden emättimen hiivainfektion.
Jotkut lääkkeet ja sairaudet voivat lisätä mahdollisuuttasi saada hiivainfektio. Jos olet raskaana, sinulla on diabetes, käytät ehkäisypillereitä tai käytät antibiootteja, saatat saada hiivainfektioita useammin kuin muut naiset. Henkilökohtainen hygienia ja tietyntyyppiset vaatteet voivat lisätä mahdollisuuksiasi saada hiivatulehdus. Kysy terveydenhuollon tarjoajalta vinkkejä siitä, mitä voit tehdä estääksesi emättimen hiivainfektioita. Jos saat emättimen hiivainfektion, sinulla voi olla jokin seuraavista oireista:
- kutina
- polttava tunne virtsatessa
- punoitus
- arkuus
- paksu valkoinen emätinvuoto, joka näyttää raejuustolta
Älä ota DIFLUCANia, jos.
- ota seuraavat lääkkeet:
- kinidiini
- erytromysiini
- pimotsidi
- olet allerginen flukonatsolille, DIFLUCAN 50 mg:n vaikuttavalle aineelle tai jollekin DIFLUCANin aineosalle. Katso tämän potilastiedotteen lopusta täydellinen luettelo DIFLUCANin ainesosista.
Ennen kuin otat DIFLUCANia, kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, jos:
- sinulla on maksaongelmia
- on munuaisongelmia
- sinulla on sydänongelmia, mukaan lukien sydämen rytmihäiriöt
- sinulla on hypokalemia (alhainen kalium)
- olet raskaana tai suunnittelet raskautta. Kerro heti terveydenhuollon tarjoajallesi, jos tulet raskaaksi DIFLUCAN-hoidon aikana. Sinä ja terveydenhuollon tarjoaja päätät, sopiiko DIFLUCAN 100 mg sinulle. Jos saatat tulla raskaaksi, sinun tulee käyttää ehkäisymenetelmää DIFLUCAN-hoidon aikana ja viikon ajan viimeisen annoksen jälkeen.
- imetät tai aiot imettää. DIFLUCAN voi erittyä äidinmaitoon. Keskustele terveydenhuollon tarjoajan kanssa parhaasta tavasta ruokkia vauva, kun käytät DIFLUCANia.
Ennen kuin aloitat DIFLUCANin käytön, kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä. mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät. Kerro erityisesti terveydenhuollon tarjoajallesi, jos otat:
- diabeteslääkkeet, kuten glyburidi, tolbutamidi, glipitsidi
- verenpainelääkkeet, kuten hydroklooritiatsidi, losartaani, amlodipiini, verapamiilinifedipiini tai felodipiini
- verenohennuslääkkeitä, kuten varfariinia
- siklosporiini, takrolimuusi tai sirolimuusi (käytetään estämään elinsiirtojen hylkimistä)
- rifampiini tai rifabutiini tuberkuloosiin
- fenytoiinia tai karbamatsepiinia kouristuskohtausten hallintaan
- teofylliini astman hallintaan
- kinidiini (käytetään korjaamaan sydämen rytmihäiriöitä)
- amiodaroni (käytetään epätasaisten sydämenlyöntien "rytmihäiriöiden" hoitoon)
- amitriptyliini tai nortriptyliini masennukseen
- pimotsidi psykiatrisiin sairauksiin
- amfoterisiini B tai vorikonatsoli sieni-infektioiden hoitoon
- erytromysiini bakteeri-infektioihin
- olaparibi, syklofosfamidi tai vinka-alkaloidit, kuten vinkristiini tai vinblastiini syövän hoitoon
- fentanyyliä, alfentaniilia tai metadonia kroonisen kivun hoitoon
- ibrutinibi, jota käytetään verisyövän hoitoon
- lemboreksantti, jota käytetään unettomuuden hoitoon
- lipidejä alentavat lääkkeet, kuten atorvastatiini, simvastatiini ja fluvastatiini
- ei-steroidiset tulehduskipulääkkeet, mukaan lukien selekoksibi, ibuprofeeni ja naprokseeni
- prednisoni, steroidi, jota käytetään ihon, maha-suolikanavan, hematologisten tai hengityselinten sairauksien hoitoon
- HIV:n hoitoon käytettävät viruslääkkeet, kuten sakinaviiri tai tsidovudiini
- tofasitinibi nivelreuman hoitoon
- A-vitamiinin ravintolisä
- tolvaptaania käytetään hyponatremian (veren alhainen natriumpitoisuus) hoitoon tai munuaistoiminnan heikkenemisen hidastamiseen
Koska näillä lääkkeillä on monia tuotenimiä, kysy terveydenhuollon tarjoajalta tai apteekista, jos sinulla on kysyttävää.
Miten minun pitäisi ottaa DIFLUCANia?
- Ota DIFLUCAN juuri sen verran kuin terveydenhuollon tarjoajasi on määrännyt.
- Ota DIFLUCAN 100 mg suun kautta ruoan kanssa tai ilman.
- Jos otat liikaa DIFLUCAN 50 mg -valmistetta, soita välittömästi terveydenhuollon tarjoajalle tai mene lähimpään ensiapuun.
Mitä minun pitäisi välttää DIFLUCAN 150mg -hoidon aikana?
DIFLUCAN voi aiheuttaa huimausta ja kouristuskohtauksia. Älä aja tai käytä koneita, ennen kuin tiedät, kuinka DIFLUCAN vaikuttaa sinuun.
Mitkä ovat DIFLUCAN 150 mg:n mahdolliset sivuvaikutukset?
DIFLUCAN 50 mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- vakavia maksaongelmia. Joillekin ihmisille, joilla on vakavia lääketieteellisiä ongelmia, on kehittynyt vakavia maksaongelmia, jotka ovat tulleet hengenvaarallisiksi tai aiheuttaneet kuoleman DIFLUCAN-hoidon aikana. Joskus nämä maksaongelmat voivat poistua, kun lopetat DIFLUCANin käytön. Kerro heti terveydenhuollon tarjoajallesi, jos sinulla on oireita vakavista maksaongelmista, mukaan lukien:
- tumma virtsa
- vaikea ihon kutina
- ihon ja silmien keltaisuus (keltatauti)
- vaaleat ulosteet
- väsymys
- oksentelua
- ruokahalun menetys
- vakavat allergiset reaktiot: Harvinaisissa tapauksissa DIFLUCANin käytön aikana on esiintynyt vakavia allergisia reaktioita (anafylaksia). Lopeta DIFLUCAN 50 mg:n käyttö, soita terveydenhuollon tarjoajalle tai mene lähimmän sairaalan ensiapuun heti, jos saat merkkejä tai oireita allergisesta reaktiosta, mukaan lukien:
- hengenahdistus
- kuume
- silmäluomien turvotus
- yskiminen
- ihottuma, nokkosihottuma, rakkulat tai ihon hilseily
- kasvot, suu, kaula tai jokin muu kehon osa
- vinkuna
- sydämen tai korvien jyskytys
- vilunväristykset
- vakavia iho-ongelmia. Joillekin ihmisille, joilla on vakavia lääketieteellisiä ongelmia, on kehittynyt vakavia iho-ongelmia, jotka ovat aiheuttaneet kuoleman DIFLUCANin käytön aikana. Kerro heti terveydenhuollon tarjoajallesi, jos sinulle ilmaantuu ihottumaa DIFLUCAN-hoidon aikana.
DIFLUCAN 200 mg:n yleisimmät sivuvaikutukset ovat:
- päänsärky
- huimaus
- ripuli
- vatsakipu
- pahoinvointia tai vatsavaivoja
- muutoksia ruoan makutottumuksissa
Muita sivuvaikutuksia ovat:
- lisämunuaisten vajaatoiminta: Joillekin DIFLUCANia käyttäneille ihmisille kehittyi lisämunuaisten vajaatoiminta, joka oli palautuva. Kerro heti terveydenhuollon tarjoajallesi, jos sinulla on lisämunuaisten vajaatoiminnan oireita, mukaan lukien:
- pitkäkestoinen väsymys
- lihas heikkous
- ruokahalun menetys
- painonpudotus
- vatsakipu
- huimaus
- pahoinvointi
- oksentelua
- huimausta tai kouristuksia.
Nämä eivät ole kaikkia DIFLUCANin mahdollisia sivuvaikutuksia.
Soita terveydenhuollon tarjoajallesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää DIFLUCAN?
Säilytä DIFLUCAN-tabletit alle 30 °C:ssa.
Pidä DIFLUCAN 50 mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa DIFLUCANin turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin tarkoituksiin kuin potilasohjeessa lueteltuihin tarkoituksiin. Älä käytä DIFLUCAN 50 mg -valmistetta sairauteen, johon sitä ei ole määrätty. Älä anna DIFLUCANia muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä. Voit kysyä terveydenhuollon tarjoajalta tietoja DIFLUCAN 200 mg:sta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Mitä ainesosia DIFLUCAN 150mg sisältää?
Aktiivinen ainesosa: flukonatsoli
Inaktiiviset ainesosat: mikrokiteinen selluloosa, vedetön kaksiemäksinen kalsiumfosfaatti, povidoni, kroskarmelloosinatrium, FD&C Red No. 40 alumiinijärviväri ja magnesiumstearaatti.
Yhdysvaltain elintarvike- ja lääkevirasto on hyväksynyt nämä potilastiedot
