Naisten hoito: Clomid 100mg, 25mg, 50mg Clomiphene Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mikä Clomid 50mg on ja miten sitä käytetään?
Clomid 100mg on reseptilääke, jota käytetään hedelmättömyyden oireiden hoitoon naisilla, joilla on ovulaation vajaatoiminta. Clomidia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Clomid kuuluu lääkeryhmään, jota kutsutaan selektiivisiksi estrogeenireseptorimodulaattoreiksi.
Ei tiedetä, onko Clomid turvallinen ja tehokas lapsille.
Mitkä ovat Clomidin mahdolliset sivuvaikutukset?
Clomid voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- vatsakipu,
- turvotus,
- pahoinvointi,
- oksentelua,
- ripuli,
- nopea painonnousu (erityisesti kasvoissasi ja keskiosassa),
- vähän tai ei ollenkaan virtsaamista,
- kipua hengitettäessä,
- nopea syke ja
- hengenahdistus
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Clomidin yleisimpiä sivuvaikutuksia ovat:
- punoitus (lämpö, punoitus tai pistely tunne),
- pahoinvointi,
- oksentelua,
- turvotus,
- rintojen kipu tai arkuus,
- päänsärkyä ja
- läpäisyverenvuoto tai tiputtelu
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Clomidin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
CLOMID (clomiphene citrate tablets USP) on suun kautta annettava, ei-steroidinen, ovulaatiota stimuloiva aine, joka on kemiallisesti nimetty 2-[p-(2-kloori-1,2-difenyylivinyyli)fenoksi]trietyyliamiinisitraattiksi (1:1). Sen molekyylikaava on C26H28ClNO • C6H8O7 ja molekyylipaino 598,09. Se esitetään rakenteellisesti seuraavasti:
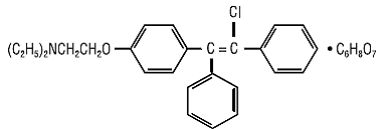
Klomifeenisitraatti on valkoisesta vaaleankeltaiseen, olennaisesti hajuton, kiteinen jauhe. Se liukenee vapaasti metanoliin; liukenee etanoliin; liukenee heikosti asetoniin, veteen ja kloroformiin; ja liukenematon eetteriin.
CLOMID 50mg on seos kahdesta geometrisestä isomeeristä [cis (tsuklomifeeni) ja trans (enklomifeeni)], jotka sisältävät 30–50 % cis-isomeeriä.
Jokainen valkoinen jakouurteinen tabletti sisältää 50 mg klomifeenisitraattia USP. Tabletti sisältää myös seuraavia inaktiivisia aineita: maissitärkkelys, laktoosi, magnesiumstearaatti, esigelatinoitu maissitärkkelys ja sakkaroosi.
INDIKAATIOT
CLOMID 100mg on tarkoitettu ovulaatiohäiriöiden hoitoon naisilla, jotka haluavat raskautta. Raskauden saavuttamisen esteet on suljettava pois tai hoidettava riittävästi ennen CLOMID 50 mg -hoidon aloittamista. Potilaita, jotka todennäköisimmin saavuttavat menestystä klomifeenihoidolla, ovat potilaat, joilla on munasarjojen monirakkulatauti (ks VAROITUKSET : Munasarjojen hyperstimulaatio-oireyhtymä ), amenorrea-galaktorrea-oireyhtymä, psykogeeninen amenorrea, oraalisen ehkäisyn jälkeinen amenorrea ja tietyt sekundaariset kuukautiset, joiden etiologia on määrittelemätön.
Ovulaatioon nähden oikein ajoitettu yhdyntä on tärkeää. Peruskehon lämpötilakäyrä tai muut sopivat testit voivat auttaa potilasta ja hänen lääkäriään määrittämään, tapahtuiko ovulaatio. Kun ovulaatio on todettu, jokainen CLOMID 100mg -kuori tulee aloittaa kierron viidentenä päivänä tai suunnilleen. Pitkäaikaista syklistä hoitoa ei suositella yli yhteensä noin kuuden syklin (mukaan lukien kolme ovulaatiosykliä). (Katso ANNOSTELU JA HALLINNOINTI ja VAROTOIMENPITEET .)
CLOMID on tarkoitettu vain potilaille, joilla on osoitettu ovulaation toimintahäiriö ja jotka täyttävät alla kuvatut ehdot:
Lisäksi CLOMID-hoitoon valitut potilaat tulee arvioida seuraavien seikkojen osalta:
Ei ole olemassa riittäviä tai hyvin kontrolloituja tutkimuksia, jotka osoittaisivat CLOMID 100 mg:n tehokkuuden miesten hedelmättömyyden hoidossa. Lisäksi klomifeenia käyttävillä miehillä on raportoitu kiveskasvaimia ja gynekomastiaa. Syy-seuraussuhdetta kiveskasvainten ja CLOMID 25 mg:n annon välillä ei tunneta.
Vaikka lääketieteellisessä kirjallisuudessa ehdotetaan erilaisia menetelmiä, ei ole olemassa yleisesti hyväksyttyä standardihoito-ohjelmaa yhdistelmähoidolle (eli CLOMID yhdessä muiden ovulaation indusoivien lääkkeiden kanssa). Vastaavasti ei ole olemassa standardia CLOMID-hoitoa ovulaation induktiolle koeputkihedelmöitysohjelmissa munasolujen tuottamiseksi hedelmöitystä ja uudelleen viemistä varten. Siksi CLOMID 50 mg:aa ei suositella näihin käyttötarkoituksiin.
ANNOSTELU JA HALLINNOINTI
Yleisiä huomioita
CLOMID 100 mg -hoitoon ehdokkaiden käsittelyä ja hoitoa tulee valvoa gynekologisten tai endokriinisten häiriöiden hoitoon perehtyneen lääkärin valvonnassa. Potilaat tulee valita CLOMID 50 mg -hoitoon vasta huolellisen diagnostisen arvioinnin jälkeen (ks INDIKAATIOT ). Hoitosuunnitelma tulee hahmotella etukäteen. Hoidon tavoitteen saavuttamisen esteet on suljettava pois tai hoidettava riittävästi ennen CLOMID-hoidon aloittamista. Terapeuttinen tavoite tulee tasapainottaa mahdollisten riskien kanssa ja keskustella potilaan ja muiden raskauden saavuttamiseen osallistuvien kanssa.
Ovulaatio tapahtuu useimmiten 5-10 päivää CLOMID-hoidon jälkeen. Yhdyntä tulee ajoittaa samaan aikaan odotetun ovulaation kanssa. Asianmukaiset testit ovulaation määrittämiseksi voivat olla hyödyllisiä tänä aikana.
Suositeltu annostus
Valitun potilaan hoito tulee aloittaa pienellä annoksella, 50 mg päivässä (1 tabletti) 5 päivän ajan. Annosta tulee suurentaa vain niillä potilailla, joilla ei tapahdu ovulaatiota vasteena sykliselle 50 mg CLOMID-annokselle. Pieni annos tai hoitojakson kesto on erityisen suositeltavaa, jos epäillään epätavallista herkkyyttä aivolisäkkeen gonadotropiinille, kuten potilailla, joilla on munasarjojen monirakkulatauti (ks. VAROITUKSET ; Munasarjojen hyperstimulaatio-oireyhtymä ).
Potilas tulee arvioida huolellisesti raskauden, munasarjojen suurenemisen tai munasarjakystojen muodostumisen sulkemiseksi pois jokaisen hoitojakson välillä.
Jos progestiinin aiheuttamaa verenvuotoa suunnitellaan tai jos spontaania kohdun verenvuotoa ilmaantuu ennen hoitoa, 50 mg:n vuorokausiannos 5 päivän ajan tulee aloittaa kierron viidentenä päivänä tai suunnilleen. Hoito voidaan aloittaa milloin tahansa potilaalla, jolla ei ole viime aikoina ollut kohdun verenvuotoa. Kun ovulaatio tapahtuu tällä annoksella, ei ole hyötyä annoksen suurentamisesta seuraavissa hoitojaksoissa.
Jos ovulaatiota ei ilmene tapahtuvan ensimmäisen hoitojakson jälkeen, tulee antaa toinen 100 mg:n vuorokausiannos (kaksi 50 mg:n tablettia kerta-annoksena) 5 päivän ajan. Tämä kurssi voidaan aloittaa jo 30 päivän kuluttua edellisestä sen jälkeen, kun on ryhdytty varotoimenpiteisiin raskauden poissulkemiseksi. Annoksen tai hoidon keston lisäämistä yli 100 mg:aan/vrk 5 päivän ajan ei suositella.
Suurin osa potilaista, jotka aikovat ovuloida, tekee sen ensimmäisen hoitojakson jälkeen. Jos ovulaatiota ei tapahdu kolmen hoitojakson jälkeen, jatkohoitoa CLOMID 50 mg:lla ei suositella ja potilas on arvioitava uudelleen. Jos ilmenee kolme ovulaatiovastetta, mutta raskautta ei ole saavutettu, jatkohoitoa ei suositella. Jos kuukautisia ei tapahdu ovulaation jälkeen, potilas on arvioitava uudelleen. Pitkäaikaista syklistä hoitoa ei suositella yli kuuden syklin (ks VAROTOIMENPITEET ).
MITEN TOIMITETAAN
NDC 0068-0226-30: 50 mg:n tabletit 30 tabletin laatikoissa. Tabletit ovat pyöreitä, valkoisia, jakouurteisia ja niissä on kaiverrus CLOMID 50. Säilytä tabletit valvotussa huoneenlämpötilassa 15-30 °C. Suojaa lämmöltä, valolta ja liialliselta kosteudelta ja säilytä suljetuissa astioissa.
Valmistaja: A SANOFI COMPANY, sanofi-aventis US LLC, Bridgewater, NJ 08807. Tarkistettu: heinäkuuta 2017
SIVUVAIKUTUKSET
Kliinisen tutkimuksen haittatapahtumat.
CLOMID on suositelluilla annoksilla yleensä hyvin siedetty. Haittavaikutukset ovat yleensä olleet lieviä ja ohimeneviä, ja useimmat ovat hävinneet heti hoidon lopettamisen jälkeen. Kliinisten tutkimusten aikana klomifeenisitraatilla hoidetuilla potilailla raportoidut haittavaikutukset on esitetty taulukossa 2.
Seuraavia haittavaikutuksia on raportoitu alle 1 %:lla potilaista kliinisissä tutkimuksissa: Akuutti vatsa, ruokahalun lisääntyminen, ummetus, ihottuma tai ihottuma, masennus, ripuli, huimaus, väsymys, hiustenlähtö/kuivuvat hiukset, lisääntynyt virtsaamistiheys/tilavuus, unettomuus, huimaus, hermostunut jännitys, emättimen kuivuus, huimaus, painonnousu/-lasku.
Potilailla, jotka saavat pitkäaikaista CLOMID 25 mg -hoitoa, seerumin desmosterolitasot voivat olla kohonneita. Tämä johtuu todennäköisesti suorasta häiriöstä kolesterolisynteesiin. Seerumin steroliarvot eivät kuitenkaan muutu merkittävästi potilailla, jotka saavat suositeltua CLOMID 50 mg -annosta. Munasarjasyöpää on raportoitu harvoin potilailla, jotka ovat saaneet hedelmällisyyslääkkeitä. Lapsettomuus on munasarjasyövän ensisijainen riskitekijä; epidemiologiset tiedot viittaavat kuitenkin siihen, että klomifeenin pitkäaikainen käyttö voi lisätä raja- tai invasiivisen munasarjakasvaimen riskiä.
Markkinoinnin jälkeiset haittatapahtumat
Seuraavat haittavaikutukset on tunnistettu Clomidin hyväksymisen jälkeisen käytön aikana. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Keho kokonaisuutena: Kuume, tinnitus, heikkous
Sydän: Rytmihäiriö, rintakipu, turvotus, kohonnut verenpaine, sydämentykytys, flebiitti, keuhkoembolia, hengenahdistus, takykardia, tromboflebiitti
Keskushermosto: Migreenipäänsärky, parestesia, kohtaus, aivohalvaus, pyörtyminen
Ihotauti: Akne, allerginen reaktio, eryteema, erythema multiforme, erythema nodosum, hypertrichosis, kutina, urtikaria
Sikiön/vastasyntyneen poikkeavuudet:
- Epänormaali luuston kehitys: kallon, kasvojen, nenäkäyrien, leuan, käden, raajan (ektromelia mukaan lukien amelia, hemimelia ja fokomelia), jalan (lonkerojalka), selkärangan ja nivelten luuston epämuodostumat
- Sydämen poikkeavuudet: sydämen väliseinävauriot, lihaksikas kammioväliseinävaurio, avoin valtimotiehye, Fallotin tetralogia ja aortan koarktaatio
- Kromosomihäiriöt: Downin oireyhtymä
- Korvan poikkeavuudet ja kuurous
- Ruoansulatuskanavan poikkeavuudet: huuli- ja kitalakihalkio, epämuodostunut peräaukko, henkitorven fisteli, palleatyrä, omfalokele
- Sukuelinten poikkeavuudet: hypospadiat, kloakaan eksstrofia
- Keuhkokudoksen epämuodostumat
- Silmän ja linssin epämuodostumat (kaihi)
- Kasvaimet: neuroektodermaalinen kasvain, kilpirauhaskasvain, hepatoblastooma, lymfaattinen leukemia
- Hermoston poikkeavuudet: hermoputken viat (anenkefalia, meningomyelocele), mikrokefalia ja vesipää
- Munuaisten poikkeavuudet: munuaisten ageneesi ja munuaisten dysgeneesi
- Muut: kääpiö, henkinen jälkeenjääneisyys
Ruoansulatuskanava: Haimatulehdus
Sukuelimet: Endometrioosi, munasarjakysta (munasarjojen suureneminen tai kystat voivat sellaisenaan komplisoitua adnexaalisen vääntymisen vuoksi), munasarjan verenvuoto, munanjohtimen raskaus, kohdun verenvuoto, kohdun limakalvon paksuuden väheneminen
Maksa: Transaminaasien nousu, hepatiitti
Aineenvaihduntahäiriöt: Hypertriglyseridemia, joissakin tapauksissa haimatulehdus
Tuki- ja liikuntaelimistö: Nivelkipu, selkäkipu, myalgia
Kasvaimet: Maksa (maksan hemangiosarkooma, maksasoluadenooma, hepatosellulaarinen syöpä); rinta (fibrokystinen sairaus, rintasyöpä); kohdun limakalvo (endometriumin karsinooma); hermosto (astrosytooma, aivolisäkkeen kasvain, prolaktinooma, neurofibromatoosi, glioblastoma multiforme, aivojen paise); munasarja (raskauden luteooma, munasarjan dermoidinen kysta, munasarjasyöpä); trofoblastinen (hydatiforminen mooli, koriokarsinooma); sekalaiset (melanooma, myelooma, perianaaliset kystat, munuaissolukarsinooma, Hodgkinin lymfooma, kielen syöpä, virtsarakon syöpä)
Psykiatrinen: Ahdistuneisuus, ärtyneisyys, mielialan muutokset, psykoosi
Näköhäiriöt: Epänormaali akkomodaatio, kaihi, silmäkipu, makulaturvotus, näköhermotulehdus, fotopsia, lasiaisen takaosan irtoaminen, verkkokalvon verenvuoto, verkkokalvon tromboosi, verkkokalvon verisuonten kouristukset, tilapäinen tai pitkittynyt näönmenetys, mahdollisesti peruuttamaton.
Muuta: Leukosytoosi, kilpirauhasen toimintahäiriö
HUUMEIDEN VUOROVAIKUTUKSET
Lääkkeiden yhteisvaikutuksia CLOMIDin kanssa ei ole dokumentoitu.
Huumeiden väärinkäyttö ja riippuvuus
CLOMIDin toleranssia, väärinkäyttöä tai riippuvuutta ei ole raportoitu.
VAROITUKSET
Visuaaliset oireet
Potilaita tulee kertoa, että CLOMID-hoidon aikana saattaa toisinaan esiintyä hämärtymistä tai muita näköoireita, kuten täpliä tai välähdyksiä (tuikkuva scotomata). Nämä visuaaliset oireet lisääntyvät kokonaisannoksen tai hoidon keston pidentyessä. Nämä näköhäiriöt ovat yleensä palautuvia; pitkittyneitä näköhäiriöitä on kuitenkin raportoitu, joista osa on ilmaantunut CLOMID 50 mg -hoidon lopettamisen jälkeen. Näköhäiriöt voivat olla peruuttamattomia, etenkin jos annostusta tai hoidon kestoa suurennetaan. Potilaita tulee varoittaa, että nämä visuaaliset oireet voivat tehdä sellaisista toiminnoista kuin autolla ajamisesta tai koneiden käyttämisestä tavallista vaarallisempaa, erityisesti vaihtelevissa valaistusolosuhteissa.
Nämä visuaaliset oireet näyttävät johtuvan jälkikuvien voimistumisesta ja pitkittymisestä. Oireet ilmaantuvat usein ensimmäisen kerran tai ne korostuvat altistuessa kirkkaalle valaistulle ympäristölle. Vaikka mitattu näöntarkkuus ei yleensä ole muuttunut, tutkimuspotilaalle, joka otti 200 mg CLOMIDia päivässä, kehittyi näön hämärtymistä 7. hoitopäivänä, joka eteni vakavaksi näöntarkkuuden heikkenemiseen 10. päivänä. Muita poikkeavuuksia ei havaittu, ja näöntarkkuus palautui normaaliksi 3. päivänä hoidon lopettamisen jälkeen.
Oftalmologisesti määriteltävissä olevia skotomaatteja ja verkkokalvon solutoimintoja (elektroretinografia) on myös raportoitu. Kliinisissä tutkimuksissa hoidetulle potilaalle kehittyi fosfeeneja ja skotomaatteja pitkäaikaisen CLOMID 50 mg:n annon aikana, ja ne hävisivät 32. päivänä hoidon lopettamisen jälkeen.
Markkinoille tulon jälkeinen haittatapahtumien seuranta on paljastanut myös muita visuaalisia merkkejä ja oireita CLOMID-hoidon aikana (ks. HAITTAVAIKUTUKSET ).
Vaikka näiden visuaalisten oireiden etiologiaa ei vielä tunneta, potilaiden, joilla on näköoireita, tulee lopettaa hoito ja suorittaa täydellinen oftalmologinen arviointi viipymättä.
Munasarjojen hyperstimulaatio-oireyhtymä
Munasarjojen hyperstimulaatio-oireyhtymän (OHSS) on raportoitu esiintyvän potilailla, jotka saavat klomifeenisitraattihoitoa ovulaation induktioon. OHSS voi edetä nopeasti (24 tunnin kuluessa useisiin päiviin) ja muodostua vakavaksi lääketieteelliseksi häiriöksi. Joissakin tapauksissa OHSS esiintyi klomifeenisitraattihoidon syklisen käytön jälkeen tai kun klomifeenisitraattia käytettiin yhdessä gonadotropiinien kanssa. OHSS:n yhteydessä on raportoitu ohimeneviä maksan toimintahäiriöihin viittaavia poikkeavuuksia maksan toimintakokeissa, joihin voi liittyä morfologisia muutoksia maksabiopsiassa.
OHSS on lääketieteellinen tapahtuma, joka eroaa komplisoitumattomasta munasarjojen laajentumisesta. Tämän oireyhtymän kliinisiä oireita vaikeissa tapauksissa voivat olla munasarjojen voimakas suureneminen, maha-suolikanavan oireet, askites, hengenahdistus, oliguria ja keuhkopussin effuusio. Tämän oireyhtymän yhteydessä on lisäksi raportoitu seuraavia oireita: sydänpussin effuusio, anasarca, vesirinta, akuutti vatsa, hypotensio, munuaisten vajaatoiminta, keuhkopöhö, intraperitoneaalinen ja munasarjojen verenvuoto, syvä laskimotukos, munasarjan vääntyminen ja akuutti hengitystie tuskaa. OHSS:n varhaisia varoitusmerkkejä ovat vatsakipu ja vatsan turvotus, pahoinvointi, oksentelu, ripuli ja painonnousu. Kohonneita virtsan steroiditasoja, vaihtelevaa elektrolyyttitasapainoa, hypovolemiaa, hemokonsentraatiota ja hypoproteinemiaa voi esiintyä. Hypovoleemisesta sokista, hemokonsentraatiosta tai tromboemboliasta johtuva kuolema on tapahtunut. Vakavissa tapauksissa laajentuneiden munasarjojen haurauden vuoksi vatsan ja lantion alueen tutkimus tulee suorittaa erittäin varovasti. Jos hedelmöitys johtaa, oireyhtymän nopea eteneminen vaikeaan muotoon voi tapahtua.
CLOMID 100 mg -hoitoon liittyvän satunnaiseen epänormaaliin munasarjojen suurenemiseen liittyvän riskin minimoimiseksi tulee käyttää pienintä annosta, joka vastaa odotettuja kliinisiä tuloksia. Munasarjojen maksimaalinen suureneminen, olipa se fysiologinen tai epänormaali, saattaa tapahtua vasta useita päiviä suositellun CLOMID-annoksen lopettamisen jälkeen. Joillakin potilailla, joilla on munasarjojen monirakkulatauti ja jotka ovat epätavallisen herkkiä gonadotropiinille, voi olla liioiteltu vaste tavallisille CLOMID-annoksille. Siksi munasarjojen monirakkulatautia sairastavien potilaiden hoito tulee aloittaa pienimmällä suositellulla annoksella ja lyhimmällä hoidon kestolla ensimmäisellä hoitojaksolla (ks. ANNOSTELU JA HALLINNOINTI ).
Jos munasarjat suurentuvat, CLOMID-lisähoitoa ei pidä antaa ennen kuin munasarjat ovat palautuneet hoitoa edeltävään kokoon, ja seuraavan hoitojakson annosta tai kestoa on pienennettävä. CLOMID 50 mg -hoitoon liittyvä munasarjojen suurentuminen ja kystojen muodostuminen regressoituvat yleensä spontaanisti muutaman päivän tai viikon kuluessa hoidon lopettamisesta. Tällaisissa tapauksissa myöhemmän CLOMID 25 mg -hoidon mahdollisen hyödyn pitäisi olla riskiä suurempi. Ellei kirurgista aihetta laparotomiaan ole, tällainen kystinen laajentuminen tulee aina hoitaa konservatiivisesti.
Syy-yhteyttä munasarjojen hyperstimulaation ja munasarjasyövän välillä ei ole määritetty. Kuitenkin, koska munasarjasyövän ja tyhjäkäynnin, hedelmättömyyden ja iän välistä korrelaatiota on ehdotettu, jos munasarjakystat eivät taandu spontaanisti, on tehtävä perusteellinen arviointi munasarjojen neoplasian sulkemiseksi pois.
VAROTOIMENPITEET
Kenraali
CLOMID-hoidon ehdokkaiden valintaan tulee kiinnittää erityistä huomiota. Lantion tutkimus on tarpeen ennen CLOMID-hoitoa ja ennen jokaista seuraavaa hoitokertaa (ks VASTA-AIHEET ja VAROITUKSET ).
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Eläimillä ei ole tehty pitkäaikaisia toksisuustutkimuksia klomifeenisitraatin karsinogeenisen tai mutageenisen potentiaalin arvioimiseksi.
CLOMID 25 mg:n oraalinen antaminen urosrotille annoksina 0,3 tai 1 mg/kg/vrk aiheutti heikentyneen hedelmällisyyden, kun taas suuremmat annokset aiheuttivat tilapäistä hedelmättömyyttä. Oraaliset annokset 0,1 mg/kg/vrk naarasrotilla keskeyttivät tilapäisesti normaalin syklisen emättimen sivelykuvion ja estivät hedelmöittymisen. Annokset 0,3 mg/kg/vrk vähensivät hieman ovuloituneiden munasolujen ja keltasolujen määrää, kun taas 3 mg/kg/vrk esti ovulaation.
Raskaus
Sikiön riskien yhteenveto
CLOMID 100 mg:n käyttö raskaana oleville naisille on vasta-aiheista, koska CLOMID 25 mg -hoidosta ei ole hyötyä tässä populaatiossa.
Saatavilla olevat ihmisiltä saadut tiedot eivät viittaa siihen, että synnynnäisten epämuodostumien riski olisi suurempi kuin taustapopulaatioriski. Eläinten lisääntymistoksikologiset tutkimukset osoittivat kuitenkin lisääntynyttä alkio-sikiön menetystä ja rakenteellisia epämuodostumia jälkeläisissä. Jos tätä lääkettä käytetään raskauden aikana tai jos potilas tulee raskaaksi tämän lääkkeen käytön aikana, potilaan tulee olla tietoinen mahdollisista riskeistä sikiölle.
Kliiniset näkökohdat
Jotta vältetään CLOMID 25 mg:n tahaton antaminen raskauden alkuvaiheessa, asianmukaisia testejä tulee käyttää kunkin hoitojakson aikana sen määrittämiseksi, tapahtuuko ovulaatiota ja/tai raskautta. Potilaat tulee arvioida huolellisesti, jotta vältetään munasarjojen suureneminen tai munasarjakystien muodostuminen kunkin hoitojakson välillä. Seuraavaa CLOMID-hoitojaksoa tulee lykätä, kunnes nämä sairaudet on suljettu pois.
Ihmistiedot
Saatavilla olevat epidemiologisista tutkimuksista saadut ihmisillä tehdyt tiedot eivät osoita mitään ilmeistä syy-seuraussuhdetta klomifeenisitraatin perikonseptuaalisen altistuksen ja lisääntyneen yleisen synnynnäisten epämuodostumien tai minkään erityisen poikkeavuuden välillä. Koska klomifeenisitraatilla hoidetuilla naisilla esiintyi kuitenkin vain vähän synnynnäisiä epämuodostumia, nämä epidemiologiset tutkimukset pystyivät sulkemaan pois suuret riskierot. Tutkimuksissa ei otettu huomioon naisten hedelmällisyyteen liittyviä tekijöitä, eivätkä ne pystyneet sopeutumaan muihin tärkeisiin hämmennyksiin. Lisäksi saatavilla olevat tiedot eivät tue lisääntynyttä spontaanin abortin määrää heikommilla naisilla, joita on hoidettu klomifeenisitraatilla ovulaation induktiossa.
Eläinten tiedot
Klomifeenisitraatin oraalinen antaminen tiineille rotille organogeneesin aikana annoksilla 1–2 mg/kg/vrk johti hydramnioniin ja heikkoihin, turvottuviin sikiöihin, joissa oli aaltoilevia kylkiluita ja muita tilapäisiä luumuutoksia. Annokset 8 mg/kg/vrk tai suuremmat aiheuttivat myös lisääntynyttä resorptiota ja kuolleita sikiöitä, dystokiaa ja synnytyksen viivästymistä, ja 40 mg/kg/vrk lisäsi äitien kuolleisuutta. Yksittäiset annokset 50 mg/kg aiheuttivat sikiön kaihia, kun taas 200 mg/kg aiheutti suulakihalkeamaa. Kun hiirille ja rotille tiineyden aikana annettiin klomifeenisitraattia 2 mg/kg, jälkeläisillä esiintyi metaplastisia muutoksia lisääntymiskanavassa. Vastasyntyneille hiirille ja rotille, jotka injektoitiin muutaman ensimmäisen elinpäivän aikana, kehittyi myös metaplastisia muutoksia kohdun ja emättimen limakalvoihin sekä ennenaikaista emättimen avautumista ja anovulatorisia munasarjoja. Nämä löydökset ovat samanlaisia kuin muiden estrogeenien ja antiestrogeenien yhteydessä kuvattu epänormaali lisääntymiskäyttäytyminen ja hedelmättömyys.
Kaneilla havaittiin joitain tilapäisiä luumuutoksia emojen sikiöissä, joille annettiin suun kautta annoksia 20 tai 40 mg/kg/vrk tiineyden aikana, mutta ei 8 mg/kg/vrk jälkeen. Näissä tutkimuksissa ei havaittu pysyviä epämuodostumia. Myöskään reesusapinoilla, joille annettiin suun kautta annoksia 1,5-4,5 mg/kg/vrk eri ajanjaksoina raskauden aikana, ei syntynyt epänormaalia jälkeläistä.
Imettävät äidit
Ei tiedetä, erittyykö CLOMID äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon, on noudatettava varovaisuutta, jos CLOMIDia annetaan imettävälle naiselle. Joillakin potilailla CLOMID voi vähentää imetystä.
Munasarjasyöpä
Klomifeenisitraattitablettien pitkäaikainen käyttö USP voi lisätä raja- tai invasiivisen munasarjakasvaimen riskiä (ks. HAITTAVAIKUTUKSET ).
YLIANNOSTUS
Merkit ja oireet
CLOMID 50 mg:n akuutin yliannostuksen aiheuttamia toksisia vaikutuksia ei ole raportoitu. Yliannostuksen merkkejä ja oireita, jotka johtuvat suositeltua suuremman annoksen käytöstä CLOMID 100 mg -hoidon aikana, ovat pahoinvointi, oksentelu, vasomotoriset punoitukset, näön hämärtyminen, täplät tai välähdykset, scotomata, munasarjojen suureneminen ja lantion tai vatsakipu. (Katso VASTA-AIHEET : Munasarjakysta .)
Suun kautta LD50
CLOMID 25 mg:n akuutti oraalinen LD50 on 1700 mg/kg hiirillä ja 5750 mg/kg rotilla. Myrkyllistä annosta ihmisille ei tunneta.
Dialyysi
Ei tiedetä, onko CLOMID dialysoitavissa.
Hoito
Yliannostustapauksissa tulee käyttää asianmukaisia tukitoimenpiteitä maha-suolikanavan dekontaminoinnin lisäksi.
VASTA-AIHEET
Yliherkkyys
CLOMID 100mg on vasta-aiheinen potilailla, jotka ovat yliherkkiä tai allergisia klomifeenisitraatille tai jollekin sen aineosalle.
Raskaus
CLOMIDin käyttö raskaana oleville naisille on vasta-aiheista, koska CLOMIDista ei ole hyötyä tälle väestölle.
Saatavilla olevat ihmisiltä saadut tiedot eivät viittaa siihen, että synnynnäisten epämuodostumien riski kasvaisi yli taustapopulaatioriskin, kun sitä käytetään ohjeiden mukaisesti. Eläinten lisääntymistoksikologiset tutkimukset osoittivat kuitenkin lisääntynyttä alkio-sikiön menetystä ja rakenteellisia epämuodostumia jälkeläisissä. Jos tätä lääkettä käytetään raskauden aikana tai jos potilas tulee raskaaksi tämän lääkkeen käytön aikana, potilaan tulee olla tietoinen mahdollisista riskeistä sikiölle. (Katso VAROTOIMENPITEET : Raskaus .)
Maksasairaus
CLOMID 25 mg -hoito on vasta-aiheinen potilailla, joilla on maksasairaus tai joilla on anamneesissa maksan toimintahäiriö (katso myös INDIKAATIOT ja HAITTAVAIKUTUKSET ).
Epänormaali kohdun verenvuoto
CLOMID 25mg on vasta-aiheinen potilaille, joilla on epänormaalia kohdun verenvuotoa, jonka alkuperä ei ole määritelty (ks. INDIKAATIOT ).
Munasarjakystat
CLOMID on vasta-aiheinen potilaille, joilla on munasarjojen kysta tai munasarjan suurentuminen, joka ei johdu munasarjojen monirakkulatautioireyhtymästä (ks. INDIKAATIOT ja VAROITUKSET ).
muu
CLOMID on vasta-aiheinen potilaille, joilla on hallitsematon kilpirauhasen tai lisämunuaisen toimintahäiriö tai joilla on orgaaninen kallonsisäinen vaurio, kuten aivolisäkkeen kasvain (ks. INDIKAATIOT ).
KLIININEN FARMAKOLOGIA
Toiminta
CLOMID 25mg on lääke, jolla on huomattava farmakologinen teho. Potilaan huolellisella valinnalla ja asianmukaisella hoidolla CLOMID 100 mg:n on osoitettu olevan hyödyllinen hoito anovulaatiopotilaalle, joka haluaa raskautta.
Klomifeenisitraatti pystyy olemaan vuorovaikutuksessa estrogeenireseptoreita sisältävien kudosten kanssa, mukaan lukien hypotalamus, aivolisäke, munasarja, kohdun limakalvo, emätin ja kohdunkaula. Se voi kilpailla estrogeenin kanssa estrogeenireseptoreita sitovista kohdista ja saattaa viivyttää solunsisäisten estrogeenireseptorien täyttymistä. Klomifeenisitraatti käynnistää sarjan endokriinisiä tapahtumia, jotka huipentuvat preovulatoriseen gonadotropiinin nousuun ja sitä seuraavaan follikkelien repeämiseen. Ensimmäinen endokriininen tapahtuma vasteena klomifeenihoitoon on aivolisäkkeen gonadotropiinien vapautumisen lisääntyminen. Tämä käynnistää steroidogeneesin ja follikulogeneesin, mikä johtaa munasarjan follikkelien kasvuun ja verenkierron estradiolin tason nousuun. Ovulaation jälkeen plasman progesteroni ja estradioli nousevat ja laskevat kuten normaalissa ovulaatiosyklissä.
Saatavilla olevat tiedot viittaavat siihen, että klomifeenin sekä estrogeeniset että antiestrogeeniset ominaisuudet voivat osallistua ovulaation alkamiseen. Kahdella klomifeeni-isomeerillä on havaittu olevan sekalaisia estrogeenisiä ja antiestrogeenisiä vaikutuksia, jotka voivat vaihdella lajista toiseen. Jotkut tiedot viittaavat siihen, että zuklomifeenillä on suurempi estrogeeninen aktiivisuus kuin enklomifeenillä.
Klomifeenisitraatilla ei ole ilmeisiä progestatiivisia, androgeenisiä tai antiandrogeenisiä vaikutuksia, eikä se näytä häiritsevän aivolisäkkeen ja lisämunuaisen tai aivolisäkkeen ja kilpirauhasen toimintaa. Vaikka CLOMIDin "siirtymävaikutuksesta" ei ole näyttöä, joillakin potilailla on havaittu spontaaneja ovulaatiokuukautisia CLOMID 100 mg -hoidon jälkeen.
Farmakokinetiikka
14C-leimatulla klomifeenisitraatilla tehtyjen varhaisten tutkimusten perusteella lääkkeen osoitettiin imeytyvän helposti suun kautta ihmisiin ja erittyvän pääasiassa ulosteisiin. 14C:n kumulatiivinen erittyminen virtsaan ja ulosteeseen oli keskimäärin noin 50 % suun kautta annetusta annoksesta ja 37 % suonensisäisestä annoksesta 5 päivän jälkeen. Keskimääräinen virtsan erittyminen oli noin 8 % ja ulosteeseen noin 42 %.
Jonkin verran 14C:tä leimaa ulosteessa oli vielä 6 viikkoa annon jälkeen. Myöhemmät kerta-annostutkimukset normaaleilla vapaaehtoisilla osoittivat, että zuklomifeenillä (cis) on pidempi puoliintumisaika kuin enklomifeenillä (trans). Havaittavissa olevat zuklomifeenitasot säilyivät näissä koehenkilöissä yli kuukauden. Tämä voi viitata stereospesifiseen enterohepaattiseen kierrätykseen tai zuklomifeenin eristämiseen. Näin ollen on mahdollista, että CLOMID-hoidon aikana kuukautiskierron aikana tulleiden naisten elimistöön saattaa jäädä jonkin verran aktiivista lääkettä raskauden alkuvaiheessa.
Kliiniset tutkimukset
Kliinisten tutkimusten aikana 7578 potilasta sai CLOMIDia, joista osalla oli muita ovulaation esteitä kuin ovulaation toimintahäiriö (ks. INDIKAATIOT ). Näissä kliinisissä tutkimuksissa noin 30 %:lla näistä potilaista onnistui raskaushoito.
Kliinisen kokeen aikana raportoitiin yhteensä 2635 raskautta. Näistä raskauksista tietoa tuloksista oli saatavilla vain 2369 tapauksesta. Taulukossa 1 on yhteenveto näiden tapausten tuloksista.
Raportoiduista raskauksista moninkertaisten raskauksien ilmaantuvuus oli 7,98 %: 6,9 % kaksoisraskaus, 0,5 % kolmikko, 0,3 % nelikko ja 0,1 % viidennes. Niistä 165 kaksosraskaudesta, joista oli saatavilla riittävästi tietoa, yksitsygoottisten ja kaksitsygoottisten kaksosten suhde oli noin 1:5. Taulukossa 1 on esitetty elävänä moninkertaissyntyneiden eloonjäämisaste.
Alkuperäisten kliinisten tutkimusten päätyttyä ilmoitettiin kuusenpojan syntymä; yksikään kuusitoista ei selvinnyt hengissä (kukin painoi alle 400 g), vaikka jokainen vaikutti erittäin normaalilta.
Imeväisten kokonaiseloonjääminen monisikiöistä, mukaan lukien spontaanit abortit, kuolleena syntyneet ja vastasyntyneiden kuolemat, on 73 %.
Sikiön/vastasyntyneen poikkeavuudet ja kuolleisuus
Seuraavia sikiön poikkeavuuksia on raportoitu kliinisissä tutkimuksissa CLOMID-ovulaation induktiohoidon jälkeen raskauksien jälkeen. Jokaista seuraavista sikiön poikkeavuuksista raportoitiin alle 1 % (kokemukset on lueteltu esiintymistiheyden mukaan): Synnynnäiset sydänleesiot, Downin oireyhtymä, mailajalka, synnynnäiset suolistovauriot, hypospadiat, mikrokefalia, jänishuuli ja suulakihalkio, synnynnäinen lonkka, hemangiooma, laskeutumattomat kivekset, polydactyly, liittyneet kaksoset ja teratomaattinen epämuodostuma, avoin valtimotiehye, amaurosis, arteriovenoosinen fisteli, nivustyrä, napatyrä, syndactyly, pectus excavatum, myopatia, biitalookuloosi, spina-loculosiittimyopatia ja jatkuva kielifrenulum. Vastasyntyneiden kuolemaa ja sikiökuolemaa/kuolemansyntymistä on myös raportoitu alle 1 %:lla. Kliinisissä tutkimuksissa raportoitujen synnynnäisten epämuodostumien esiintyvyys raskauksista, jotka liittyvät äidin CLOMID 50 mg:n nauttimiseen, oli kliinisissä tutkimuksissa yleisen väestön raportoitujen rajojen sisällä.
Lisäksi CLOMIDin markkinoille tulon jälkeisen seurannan aikana on saatu raportteja synnynnäisistä epämuodostumista (ks. HAITTAVAIKUTUKSET ).
POTILASTIEDOT
CLOMID-hoidon tarkoitus ja riskit on esitettävä potilaalle ennen hoidon aloittamista. On syytä korostaa, että CLOMID-hoidon tavoitteena on ovulaatio myöhempää raskautta varten. Lääkärin tulee neuvoa potilasta erityisesti seuraavista mahdollisista riskeistä:
Visuaaliset oireet
Neuvoa, että CLOMID-hoidon aikana tai pian sen jälkeen saattaa joskus esiintyä hämärtymistä tai muita visuaalisia oireita. Potilaalle tulee tehdä selväksi, että joissakin tapauksissa näköhäiriöt voivat olla pitkittyneitä ja mahdollisesti peruuttamattomia, erityisesti jos annostusta tai hoidon kestoa suurennetaan. Varoita, että visuaaliset oireet voivat tehdä sellaisista toimista kuin autolla ajaminen tai koneiden käyttö tavallista vaarallisemmaksi, erityisesti vaihtelevissa valaistusolosuhteissa (ks. VAROITUKSET ).
Potilasta tulee neuvoa ilmoittamaan lääkärille epätavallisista näköoireista. Jos potilaalla on näköoireita, hoito tulee keskeyttää ja suorittaa täydellinen oftalmologinen arviointi.
Vatsan/lantion kipu tai turvotus
Munasarjat voivat laajentua CLOMID-hoidon aikana tai pian sen jälkeen. Munasarjojen suurenemiseen liittyvien riskien minimoimiseksi potilasta tulee neuvoa ilmoittamaan lääkärille kaikista vatsa- tai lantionkivuista, painon noususta, epämukavuudesta tai turvotuksesta CLOMIDin ottamisen jälkeen (ks. VAROITUKSET ).
Moninkertainen raskaus
Kerro potilaalle, että CLOMID-hoidon yhteydessä on lisääntynyt moninkertaisen raskauden mahdollisuus, mukaan lukien molemminpuolinen munanjohtimen raskaus ja rinnakkainen munanjohtimen ja kohdunsisäinen raskaus. Monisikiöraskauden mahdolliset komplikaatiot ja vaarat tulee selittää.
Spontaani abortti ja synnynnäiset epämuodostumat
Kerro potilaalle, että saatavilla olevat tiedot viittaavat siihen, että äidin CLOMID 50 mg:n käytön yhteydessä spontaanin abortin (keskenmenon) tai synnynnäisten epämuodostumien määrä ei lisääntynyt verrattuna yleiseen väestöön.
Kliinisen tutkimuksen aikana kokemus potilaista, joilla on tiedossa raskauden lopputulos (taulukko 1), osoittaa spontaanin abortin olevan 20,4 % ja kuolleena syntyneen 1,0 %. (Katso Kliiniset tutkimukset ). Clomidin kaupallisen saatavuuden jälkeen spontaanisti yksittäistapauksina raportoiduista synnynnäishäiriöistä hermoputkivikojen osuus on ollut korkea Clomidin aiheuttamaan ovulaatioon liittyvissä raskauksissa, mutta tätä ei ole tuettu väestöpohjaisista tutkimuksista saaduilla tiedoilla.
