Maxalt 5mg, 10mg Rizatriptan Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Maxalt on ja miten sitä käytetään?
Maxalt on reseptilääke, jota käytetään migreenipäänsärkyn oireiden hoitoon. Maxalt 10 mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Maxalt kuuluu lääkeluokkaan, jota kutsutaan serotoniini-5-HT-reseptoriagonisteiksi; Migreeniä estävät aineet.
Ei tiedetä, onko Maxalt 5 mg turvallinen ja tehokas alle 6-vuotiaille lapsille.
Mitkä ovat Maxaltin mahdolliset sivuvaikutukset?
Maxalt voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- äkillinen ja voimakas vatsakipu,
- verinen ripuli,
- kylmä tunne,
- tunnottomuus jaloissasi ja käsissäsi,
- kova päänsärky,
- näön hämärtyminen,
- hakkaa niskassasi tai korvissasi,
- rintakipu tai paine,
- kipu leviää leukaan tai olkapäähän,
- pahoinvointi,
- hikoilu,
- agitaatio,
- hallusinaatiot,
- kuume,
- vapina,
- nopea syke,
- lihasten jäykkyys,
- nykiminen,
- koordinaation menetys,
- pahoinvointi,
- koordinaation menetys,
- oksentelua,
- ripuli,
- äkillinen puutuminen tai heikkous (etenkin toisella kehon puolella),
- äkillinen kova päänsärky,
- epäselvä puhe ja
- näkö- tai tasapainoongelmia
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Maxaltin yleisimpiä sivuvaikutuksia ovat:
- huimaus,
- uneliaisuus,
- väsynyt olo ja
- kipua tai paineen tunnetta kurkussa tai rinnassa
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Maxaltin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
MAXALT 10 mg sisältää ritsatriptaanibentsoaattia, selektiivistä 5-hydroksitryptamiini1B/1D (5-HT1B/1D) -reseptoriagonistia.
Rizatriptaanibentsoaattia kuvataan kemiallisesti seuraavasti: N,N-dimetyyli-5-(1H-1,2,4-triatsol-1-yylimetyyli)-1 hindoli-3-etaaniamiinimonobentsoaatti ja sen rakennekaava on:
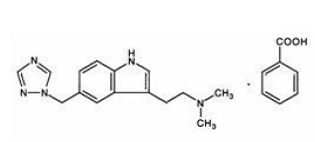
Sen empiirinen kaava on C15H19N5•C7H6O2, joka edustaa vapaan emäksen molekyylipainoa 269,4. Rizatriptaanibentsoaatti on valkoinen tai luonnonvalkoinen, kiteinen kiinteä aine, joka liukenee veteen noin 42 mg/ml (ilmaistuna vapaana emäksenä) 25 °C:ssa.
MAXALT 5 mg tabletteja ja MAXALT-MLT suun kautta hajoavia tabletteja on saatavilla suun kautta 5 ja 10 mg vahvuuksina (vastaa 7,265 mg tai 14,53 mg bentsoaattisuolaa). Jokainen puristettu tabletti sisältää seuraavat inaktiiviset aineosat: laktoosimonohydraatti, mikrokiteinen selluloosa, esigelatinoitu tärkkelys, rautaoksidi (punainen) ja magnesiumstearaatti. Jokainen lyofilisoitu suussa hajoava tabletti sisältää seuraavat inaktiiviset aineosat: gelatiini, mannitoli, glysiini, aspartaami ja piparminttuaromi.
INDIKAATIOT
MAXALT® ja MAXALT-MLT® on tarkoitettu aurallisen tai aurattoman migreenin akuuttiin hoitoon aikuisilla ja 6–17-vuotiailla lapsipotilailla.
Käyttörajoitukset
- MAXALTia tulee käyttää vain, jos migreenin selkeä diagnoosi on määritetty. Jos potilas ei saa vastetta ensimmäiseen MAXALT 10 mg:lla hoidettuun migreenikohtaukseen, migreenin diagnoosia on harkittava uudelleen ennen MAXALT 5 mg:n antamista myöhempien kohtausten hoitoon.
- MAXALT 10 mg ei ole tarkoitettu käytettäväksi hemiplegisen tai basilaarisen migreenin hoitoon (ks. VASTA-AIHEET ].
- MAXALT 10 mg ei ole tarkoitettu migreenikohtausten ehkäisyyn.
- MAXALT 5 mg:n turvallisuutta ja tehokkuutta klusteripäänsärkyssä ei ole osoitettu.
ANNOSTELU JA HALLINNOINTI
Annostustiedot aikuisille
MAXALTin suositeltu aloitusannos on joko 5 mg tai 10 mg aikuisten migreenin akuutin hoitoon. 10 mg:n annoksella voi olla suurempi vaikutus kuin 5 mg:n annoksella, mutta sillä voi olla suurempi haittavaikutusten riski [ks. Kliiniset tutkimukset ].
Uudelleen annostelu aikuisilla
Vaikka toisen annoksen tai sitä seuraavien annosten tehokkuutta ei ole osoitettu lumekontrolloiduissa tutkimuksissa, jos migreenipäänsärky palaa, toinen annos voidaan antaa 2 tuntia ensimmäisen annoksen jälkeen. Suurin vuorokausiannos ei saa ylittää 30 mg minkään 24 tunnin ajanjakson aikana. Keskimäärin yli neljän päänsäryn hoidon turvallisuutta 30 päivän aikana ei ole varmistettu.
Annostustiedot lapsipotilaille (6–17-vuotiaat)
Lapsipotilaiden annostus perustuu potilaan painoon. Suositeltu MAXALT 10 mg -annos on 5 mg potilailla, jotka painavat alle 40 kg (88 lb), ja 10 mg potilailla, jotka painavat 40 kg (88 lb) tai enemmän.
Hoidon tehokkuutta ja turvallisuutta useammalla kuin yhdellä MAXALT-annoksella 24 tunnin sisällä 6–17-vuotiailla lapsipotilailla ei ole varmistettu.
Suun kautta hajoavien MAXALT-MLT-tablettien anto
Suun kautta hajoavien MAXALT-MLT-tablettien anto nesteen kanssa ei ole välttämätöntä. Suun kautta hajoavat tabletit on pakattu läpipainopakkaukseen ulompaan alumiinipussiin, ja potilaiden ei tule poistaa läpipainopakkaus ulkopussista ennen kuin juuri ennen annostelua. Läpipainopakkaus tulee tämän jälkeen irrottaa kuivin käsin ja suun kautta hajoava tabletti asettaa kielelle, jossa se liukenee ja niellään syljen mukana.
Annoksen säätäminen propranololia saaville potilaille
Aikuiset potilaat
Aikuisille potilaille, jotka käyttävät propranololia, suositellaan vain 5 mg:n MAXALT 5 mg:n annosta, enintään 3 annosta minkä tahansa 24 tunnin aikana (15 mg) [ks. HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA ].
Pediatriset potilaat
Lapsipotilaille, jotka painavat 40 kg (88 lb) tai enemmän ja jotka käyttävät propranololia, suositellaan vain kerta-annosta 5 mg MAXALTia (maksimiannos 5 mg 24 tunnin aikana). MAXALTia ei tule määrätä propranololilla hoidetuille lapsipotilaille, jotka painavat alle 40 kg (88 lb) [ks. HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA ].
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
MAXALT-tabletit
- mg:n tabletit ovat vaaleanpunaisia, kapselin muotoisia puristettuja tabletteja, joiden toisella puolella on koodi MRK ja toisella puolella 266.
- 10 mg:n tabletit ovat vaaleanpunaisia, kapselin muotoisia puristettuja tabletteja, joiden toisella puolella on koodi MAXALT 5 mg ja toisella puolella MRK 267.
MAXALT-MLT suussa hajoavat tabletit
- 5 mg:n suussa hajoavat tabletit ovat valkoisia tai luonnonvalkoisia, pyöreitä, kylmäkuivattuja tabletteja, joiden toisella puolella on muunnettu kolmio.
- 10 mg:n suun kautta hajoavat tabletit ovat valkoisia tai luonnonvalkoisia, pyöreitä kylmäkuivattuja tabletteja, joiden toisella puolella on kaiverrettu neliö.
Varastointi ja käsittely
Nro 3732 - MAXALT-tabletit, 5 mg , ovat vaaleanpunaisia, kapselin muotoisia puristettuja tabletteja, jotka on koodattu
MRK toisella puolella ja 266 toisella:
NDC 0006-0266-18, 18 tabletin pahvi.
Nro 3733 - MAXALT 5 mg tabletit, 10 mg , ovat vaaleanpunaisia, kapselin muotoisia puristettuja tabletteja, joiden toisella puolella on koodi MAXALT 10 mg ja toisella puolella MRK 267:
NDC 0006-0267-18, 18 tabletin pahvi.
Nro 3800 - MAXALT-MLT suussa hajoavat tabletit, 5 mg ovat valkoisia tai luonnonvalkoisia, pyöreitä, lyofilisoituja, suussa hajoavia tabletteja, joiden toiselle puolelle on kaiverrettu muunneltu kolmio ja joiden mitat ovat 10,0–11,5 mm (sivulta sivulle), piparmintun makuisia. Jokainen suussa hajoava tabletti on pakattu yksittäin läpipainopakkaukseen alumiinipussin (pussin) sisällä. Ne toimitetaan seuraavasti:
NDC 0006-3800-18, 6 x käyttöyksikköä sisältävä kantolaukku, jossa on 3 suussa hajoavaa tablettia (yhteensä 18 tablettia).
Nro 3801 - MAXALT-MLT suussa hajoavat tabletit, 10 mg , ovat valkoisia tai luonnonvalkoisia, pyöreitä, lyofilisoituja, suussa hajoavia tabletteja, joiden toisella puolella on muotoiltu neliö ja joiden mitat ovat 12,0-13,8 mm (sivulta sivulle), piparmintun makuisia. Jokainen suussa hajoava tabletti on pakattu yksittäin läpipainopakkaukseen alumiinipussin (pussin) sisällä. Ne toimitetaan seuraavasti:
NDC 0006-3801-18, 6 x käyttöyksikköä sisältävä kantolaukku, jossa on 3 suussa hajoavaa tablettia (yhteensä 18 tablettia).
Varastointi
Säilytä MAXALT 5 mg -tabletit huoneenlämmössä, 15°C-30°C (59°F-86°F).
Säilytä MAXALT-MLT suun kautta hajoavat tabletit huoneenlämmössä, 15°C-30°C (59°F-86°F).
Jakelija: Merck Sharp & Dohme Corp., MERCK & CO.,INC:n tytäryhtiö, Whitehouse Station, NJ 08889, USA. Tarkistettu: lokakuuta 2019
SIVUVAIKUTUKSET
Seuraavia haittavaikutuksia käsitellään tarkemmin muissa merkintöjen osissa:
- Sydänlihasiskemia, sydäninfarkti ja Prinzmetalin angina [ks. VAROITUKSET JA VAROTOIMET ].
- Rytmihäiriöt [katso VAROITUKSET JA VAROTOIMET ].
- Rinta-, kurkku-, niska- ja/tai leukakipu/kiristys/paine [katso VAROITUKSET JA VAROTOIMET ].
- Aivoverisuonitapahtumat [katso VAROITUKSET JA VAROTOIMET ].
- Muut vasospasmireaktiot [katso VAROITUKSET JA VAROTOIMET ].
- Lääkkeiden liiallinen päänsärky [katso VAROITUKSET JA VAROTOIMET ].
- Serotoniinioireyhtymä [katso VAROITUKSET JA VAROTOIMET ].
- Verenpaineen nousu [katso VAROITUKSET JA VAROTOIMET ].
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset tehdään hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutusten määrää ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Aikuiset
Ilmaantuvuus kontrolloiduissa kliinisissä tutkimuksissa
MAXALTin haittavaikutuksia arvioitiin kontrolloiduissa kliinisissä tutkimuksissa, joihin osallistui yli 3700 aikuista potilasta, jotka saivat kerta- tai useita annoksia MAXALT-tabletteja. Yleisimmät haittavaikutukset MAXALT-hoidon aikana (≥ 5 % molemmissa hoitoryhmissä ja enemmän kuin lumelääke) olivat voimattomuus/väsymys, uneliaisuus, kipu-/painetuntuma ja huimaus. Nämä haittavaikutukset näyttivät olevan annosriippuvaisia.
Taulukossa 1 on lueteltu haittavaikutukset (esiintyvyys ≥ 2 % ja suurempi kuin lumelääke) MAXALT 5 mg:n kerta-annoksen jälkeen aikuisilla.
Kliinisissä tutkimuksissa haittavaikutusten esiintymistiheys ei lisääntynyt, kun otettiin enintään kolme annosta 24 tunnin sisällä. Haittavaikutusten esiintymistiheys pysyi muuttumattomana myös migreenin ehkäisyyn yleisesti käytettävien lääkkeiden (mukaan lukien propranololin), oraalisten ehkäisyvalmisteiden tai kipulääkkeiden samanaikainen käyttö. Ikä tai sukupuoli ei vaikuttanut haittavaikutusten esiintyvyyteen. Ei ollut riittävästi tietoa rodun vaikutuksen arvioimiseksi haittavaikutusten ilmaantuvuuteen.
Muut tapahtumat, jotka on havaittu yhdessä MAXALTin hallinnon kanssa aikuisilla
Seuraavassa osiossa on esitetty harvemmin raportoitujen haittavaikutusten esiintymistiheydet, joita ei ole raportoitu muissa merkintöjen osissa. Koska raportit sisältävät avoimissa tutkimuksissa havaittuja tapahtumia, MAXALT 5 mg:n roolia niiden syy-yhteydessä ei voida luotettavasti määrittää. Lisäksi haittatapahtumien raportointiin liittyvä vaihtelu, haittatapahtumien kuvaamiseen käytetty terminologia, rajoittaa annettujen kvantitatiivisten esiintymistiheysestimaattien arvoa. Tapahtumien tiheys lasketaan jakamalla MAXALT-hoitoa käyttäneiden ja tapahtuman raportoineiden potilaiden lukumäärä MAXALT-valmisteelle altistuneiden potilaiden kokonaismäärällä (N=3716). Kaikki raportoidut tapahtumat esiintyivät ≥ 1 %:lla tai niiden uskotaan liittyvän kohtuullisesti lääkkeen käyttöön. Tapahtumat luokitellaan edelleen kehon järjestelmäluokkiin ja luetellaan esiintymistiheyden mukaisessa järjestyksessä seuraavien määritelmien mukaisesti: toistuvat haittatapahtumat ovat niitä, jotka määritellään sellaisiksi, joita esiintyy vähintään (>) 1/100 potilaalla; harvinaisia haittavaikutuksia esiintyy 1/100 - 1/1000 potilaalla; ja harvinaisia haittavaikutuksia ovat ne, joita esiintyy alle 1/1000 potilaalla.
Yleistä: Harvoin oli kasvojen turvotus. Harvinaisia olivat pyörtyminen ja turvotus/turvotus.
Epätyypilliset tuntemukset: Usein oli lämpimiä tuntemuksia.
Sydän: Usein oli sydämentykytys. Harvinaisia olivat takykardia, kylmät raajat ja bradykardia.
Ruoansulatus: Usein esiintyi ripulia ja oksentelua. Harvinaisia olivat dyspepsia, kielen turvotus ja vatsan turvotus.
Tuki- ja liikuntaelimistö: Harvinaisia olivat lihasheikkous, jäykkyys, lihaskipu ja lihaskrampit/spasmi.
Neurologiset/psykiatriset: Usein esiintyi hypoestesiaa, euforiaa ja vapinaa. Harvinaisia olivat huimaus, unettomuus, sekavuus/häiriö, kävelyhäiriöt, muistin heikkeneminen ja kiihtyneisyys.
Hengitys: Usein oli hengenahdistus. Harvinainen oli nielun turvotus.
Erityiset aistit: Harvoin ilmeni näön hämärtymistä ja tinnitusta. Harvinainen oli silmien turvotus.
Iho ja ihon lisäosa: Usein oli punoitusta. Harvoin esiintyi hikoilua, kutinaa, ihottumaa ja urtikariaa. Harvinainen oli punoitus, kuumat aallot.
Haittavaikutusprofiili, joka havaittiin MAXALT-MLT:n suun kautta hajoavilla tableteilla, oli samanlainen kuin MAXALT 10 mg -tablettien kohdalla.
6–17-vuotiaat lapsipotilaat
Ilmaantuvuus kontrolloiduissa kliinisissä tutkimuksissa lapsipotilailla
MAXALT-MLT:n haittavaikutuksia arvioitiin migreenin akuutin hoidon kontrolloidussa kliinisessä tutkimuksessa (tutkimus 7), johon osallistui yhteensä 1382 6–17-vuotiasta lapsipotilasta, joista 977 (72 %) sai vähintään yhden annoksen. tutkimushoidosta (MAXALT-MLT ja/tai lumelääke) [ks Kliiniset tutkimukset ]. Lapsipotilailla akuutissa kliinisessä tutkimuksessa raportoitujen haittavaikutusten ilmaantuvuus oli samanlainen potilailla, jotka saivat MAXALTia kuin lumelääkettä saaneilla potilailla. Lapsipotilaiden haittavaikutusten oletetaan olevan samanlainen kuin aikuisilla.
Muut tapahtumat, jotka on havaittu MAXALT-MLT:n hoidon yhteydessä lapsipotilailla
Seuraavassa osiossa on esitetty harvemmin raportoitujen haittavaikutusten esiintymistiheydet. Koska raportit sisältävät avoimissa tutkimuksissa havaittuja tapahtumia, MAXALT-MLT:n roolia niiden syy-yhteydessä ei voida luotettavasti määrittää. Lisäksi haittatapahtumien raportointiin liittyvä vaihtelu, haittatapahtumien kuvaamiseen käytetty terminologia, rajoittaa annettujen kvantitatiivisten esiintymistiheysestimaattien arvoa.
Tapahtumien esiintymistiheys lasketaan jakamalla MAXALT-MLT:tä käyttäneiden ja tapahtuman raportoineiden 6–17-vuotiaiden lapsipotilaiden lukumäärä MAXALT-MLT:lle altistuneiden potilaiden kokonaismäärällä (N=1068). Kaikki raportoidut tapahtumat esiintyivät ≥ 1 %:lla tai niiden uskotaan liittyvän kohtuullisesti lääkkeen käyttöön. Tapahtumat luokitellaan edelleen elinjärjestelmäluokkiin ja luetellaan esiintymistiheyden mukaan alenevassa järjestyksessä seuraavien määritelmien mukaisesti: toistuvat haittatapahtumat ovat niitä, joita esiintyy (>)1/100 lapsipotilaalla; harvinaiset haittavaikutukset ovat niitä, joita esiintyy 1/100 - 1/1000 lapsipotilaalla; ja harvinaisia haittavaikutuksia ovat ne, joita esiintyy alle 1/1000 potilaalla.
Yleistä: Usein oli väsymys.
Korvan ja labyrintin häiriöt: Harvoin oli hypoakusia.
Ruoansulatuskanavan häiriöt: Usein oli vatsakipua.
Hermoston häiriöt: Harvoin esiintyi koordinaatiohäiriöitä, huomiohäiriöitä ja presynkooppia.
Psyykkiset häiriöt: Harvoin oli hallusinaatioita.
Markkinoinnin jälkeinen kokemus
Seuraavassa osiossa luetellaan mahdollisesti tärkeät haittatapahtumat, joita on esiintynyt kliinisessä käytännössä ja joista on raportoitu spontaanisti eri valvontajärjestelmille. Luetteloidut tapahtumat sisältävät kaikki paitsi ne, jotka on jo lueteltu muissa merkintöjen osissa, tai ne, jotka ovat liian yleisiä ollakseen informatiivisia. Koska raporteissa viitataan spontaanisti maailmanlaajuisista markkinoille tulon jälkeisistä kokemuksista raportoituihin tapahtumiin, tapahtumien tiheyttä ja MAXALT 5 mg:n merkitystä niiden syy-yhteydessä ei voida määrittää luotettavasti.
Neurologiset/psykiatriset: Kohtaus.
Yleistä: Allergiset tilat mukaan lukien anafylaksia/anafylaktoidinen reaktio, angioödeema, hengityksen vinkuminen ja toksinen epidermaalinen nekrolyysi [ks. VASTA-AIHEET ].
Erityiset aistit: Dysgeusia.
HUUMEIDEN VUOROVAIKUTUKSET
Propranololi
MAXALT 5 mg:n annosta tulee säätää propranololilla hoidetuilla potilailla, koska propranololin on osoitettu lisäävän risatriptaanin plasman AUC-arvoa 70 % [ks. ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
Ergot sisältävät lääkkeet
Ergota sisältävien lääkkeiden on raportoitu aiheuttavan pitkittyneitä vasospastisia reaktioita. Koska nämä vaikutukset voivat olla additiivisia, ergotamiinia sisältävien tai ergot-tyyppisten lääkkeiden (kuten dihydroergotamiinin tai metysergidin) ja MAXALT 5 mg:n käyttö 24 tunnin sisällä on vasta-aiheista [ks. VASTA-AIHEET ].
Muut 5-HT1-agonistit
Koska niiden vasospastiset vaikutukset voivat olla additiivisia, MAXALT 10 mg:n ja muiden 5-HT1-agonistien samanaikainen anto 24 tunnin sisällä toisistaan on vasta-aiheista [ks. VASTA-AIHEET ].
SSRI:t/SNRI:t ja serotoniinioireyhtymä
Serotoniinioireyhtymän tapauksia on raportoitu annettaessa samanaikaisesti triptaaneja ja selektiivisiä serotoniinin takaisinoton estäjiä (SSRI) tai serotoniininorepinefriinin takaisinoton estäjiä (SNRI) [ks. VAROITUKSET JA VAROTOIMET ].
Monoamiinioksidaasin estäjät
MAXALT on vasta-aiheinen potilaille, jotka käyttävät MAO-A:n estäjiä ja ei-selektiivisiä MAO-estäjiä. Erityinen MAO-A:n estäjä lisäsi systeemistä altistusta ritatriptaanille ja sen metaboliitille [katso VASTA-AIHEET ja KLIININEN FARMAKOLOGIA ].
VAROITUKSET
Mukana osana "VAROTOIMENPITEET" osio
VAROTOIMENPITEET
Sydänlihasiskemia, sydäninfarkti ja Prinzmetalin angina
MAXALTia ei tule antaa potilaille, joilla on iskeeminen tai vasospastinen sepelvaltimotauti. Vakavista sydämeen kohdistuvista haittavaikutuksista, mukaan lukien akuutti sydäninfarkti, on raportoitu harvoin muutaman tunnin sisällä MAXALTin annon jälkeen. Jotkut näistä reaktioista ilmenivät potilailla, joilla ei ollut tunnettua sepelvaltimotautia (CAD). 5-HT1-agonistit, mukaan lukien MAXALT 5 mg, voivat aiheuttaa sepelvaltimon vasospasmia (Prinzmetalin angina), jopa potilailla, joilla ei ole aiemmin ollut sepelvaltimotautia.
Potilaille, jotka eivät ole aiemmin saaneet triptaania ja joilla on useita kardiovaskulaarisia riskitekijöitä (esim. iän nousu, diabetes, verenpainetauti, tupakointi, liikalihavuus, vahva suvussa esiintynyt sepelvaltimotauti), tulee tehdä kardiovaskulaarinen arviointi ennen MAXALT-hoitoa. Jos on näyttöä CAD- tai sepelvaltimon vasospasmista, MAXALTia ei pidä antaa [ks. VASTA-AIHEET ]. Potilaille, joiden kardiovaskulaarinen arviointi on negatiivinen, tulee harkita ensimmäisen MAXALT-annoksen antamista lääketieteellisesti valvotussa ympäristössä ja EKG:n tekemistä välittömästi MAXALT 10 mg:n annon jälkeen. Säännöllistä kardiovaskulaarista arviointia tulee harkita pitkäaikaisilla MAXALT-käyttäjillä, joilla on kardiovaskulaarisia riskitekijöitä.
Rytmihäiriöt
Henkeä uhkaavia sydämen rytmihäiriöitä, mukaan lukien kammiotakykardia ja kuolemaan johtanut kammiovärinä, on raportoitu muutaman tunnin sisällä 5-HT1-agonistien annon jälkeen. Lopeta MAXALT 10 mg:n käyttö, jos näitä häiriöitä ilmenee.
Rinta-, kurkku-, niska- ja/tai leukakipu/puristus/paine
Kuten muidenkin 5-HT1-agonistien kohdalla, puristavaa, kipua, painetta ja raskauden tunnetta sydänlihaksessa, kurkussa, niskassa ja leuassa esiintyy yleensä MAXALT 5 mg -hoidon jälkeen, ja ne eivät yleensä ole peräisin sydämestä. Jos kuitenkin epäillään sydänperäistä alkuperää, potilaat tulee arvioida. Potilaiden, joilla on CAD, ja potilaiden, joilla on Prinzmetalin variantti angina pectoris, ei tulisi saada 5-HT1-agonisteja.
Aivoverisuonitapahtumat
Aivoverenvuotoa, subarachnoidaalista verenvuotoa ja aivohalvausta on esiintynyt potilailla, joita on hoidettu 5-HT1-agonisteilla, ja jotkut ovat johtaneet kuolemaan. Useissa tapauksissa näyttää mahdolliselta, että aivoverisuonitapahtumat olivat ensisijaisia, kun 5-HT1-agonistia on annettu siinä väärässä uskossa, että koetut oireet olivat seurausta migreenistä, vaikka niitä ei ollutkaan. Myös migreenipotilailla saattaa olla lisääntynyt riski saada tiettyjä aivoverisuonitapahtumia (esim. aivohalvaus, verenvuoto, ohimenevä iskeeminen kohtaus). Lopeta MAXALT-hoito, jos ilmenee aivoverisuonitapahtuma.
Kuten muidenkin akuutin migreenin hoitojen yhteydessä, ennen päänsäryn hoitoa potilailla, joilla ei ole aiemmin diagnosoitu migreeniä, ja migreenipotilailla, joilla on epätyypillisiä oireita, on huolehdittava muiden mahdollisesti vakavien neurologisten sairauksien sulkemisesta pois. MAXALTia ei tule antaa potilaille, joilla on ollut aivohalvaus tai ohimenevä iskeeminen kohtaus (ks. VASTA-AIHEET ].
Muut vasospasmireaktiot
5-HT1-agonistit, mukaan lukien MAXALT, voivat aiheuttaa ei-sepelvaltimon vasospastisia reaktioita, kuten perifeeristä verisuoniiskemiaa, maha-suolikanavan verisuoniiskemiaa ja infarktia (johon liittyy vatsakipua ja veristä ripulia), pernainfarktia ja Raynaud'n oireyhtymää. Potilailla, joilla ilmenee ei-sepelvaltimon vasospasmireaktioon viittaavia oireita tai merkkejä minkä tahansa 5-HT1-agonistin käytön jälkeen, epäilty vasospasmireaktio on suljettava pois ennen MAXALT 10 mg:n lisäannoksia.
5-HT1-agonistien käytön yhteydessä on raportoitu ohimenevää ja pysyvää sokeutta ja merkittävää osittaista näönmenetystä. Koska näköhäiriöt voivat olla osa migreenikohtausta, syy-yhteyttä näiden tapahtumien ja 5-HT1-agonistien käytön välillä ei ole selkeästi osoitettu.
Lääkkeiden liikakäyttö Päänsärky
Akuutin migreenilääkkeiden (esim. ergotamiinin, triptaanien, opioidien tai lääkkeiden yhdistelmän yli 10 päivää kuukaudessa) liikakäyttö voi johtaa päänsäryn pahenemiseen (lääkkeiden liikakäyttöinen päänsärky). Lääkkeiden liikakäyttöinen päänsärky voi ilmetä migreenin kaltaisena päivittäisenä päänsärynä tai migreenikohtausten esiintymistiheyden huomattavana lisääntymisenä. Potilaiden vieroitus, mukaan lukien liiallisesti käytettyjen lääkkeiden lopettaminen, ja vieroitusoireiden hoito (joihin usein sisältyy päänsäryn ohimenevä paheneminen) voi olla tarpeen.
Serotoniinin oireyhtymä
Serotoniinioireyhtymää saattaa esiintyä triptaanien, mukaan lukien MAXALT 10 mg, kanssa, erityisesti käytettäessä samanaikaisesti selektiivisiä serotoniinin takaisinoton estäjiä (SSRI), serotoniinin norepinefriinin takaisinoton estäjiä (SNRI), trisyklisiä masennuslääkkeitä (TCA) ja MAO-estäjiä [ks. HUUMEIDEN VUOROVAIKUTUKSET ]. Serotoniinioireyhtymän oireita voivat olla mielentilan muutokset (esim. kiihtyneisyys, hallusinaatiot, kooma), autonominen epävakaus (esim. takykardia, labiili verenpaine, hypertermia), hermo-lihaspoikkeavuuksia (esim. hyperrefleksia, koordinaatiohäiriö) ja/tai maha-suolikanavan oireita (esim. pahoinvointia). , oksentelu, ripuli). Oireet voivat ilmaantua minuuteissa tai tunneissa uuden tai suuremman serotonergisen lääkkeen annoksen saamisesta. MAXALT-hoito on lopetettava, jos epäillään serotoniinioireyhtymää (ks HUUMEIDEN VUOROVAIKUTUKSET ja POTILASTIEDOT ].
Verenpaineen nousu
Merkittävää verenpaineen nousua, mukaan lukien hypertensiivinen kriisi, johon liittyy akuutti elinjärjestelmien vajaatoiminta, on raportoitu harvoin potilailla, joilla on tai ei ole ollut hypertensiota ja jotka ovat saaneet 5-HT1-agonisteja, mukaan lukien MAXALTia. Terveillä nuorilla aikuisilla mies- ja naispotilailla, jotka saivat maksimiannoksia MAXALTia (10 mg joka toinen tunti 3 annosta kohti), havaittiin lievää verenpaineen nousua (noin 2-3 mmHg). MAXALT on vasta-aiheinen potilailla, joilla on hallitsematon verenpaine (ks VASTA-AIHEET ].
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ).
Sydäniskemian ja/tai infarktin, Prinzmetalin angina pectoris, muiden vasospasmiin liittyvien tapahtumien ja aivoverisuonitapahtumien riski
Kerro potilaille, että MAXALT voi aiheuttaa vakavia kardiovaskulaarisia sivuvaikutuksia, kuten sydäninfarktin tai aivohalvauksen. Vaikka vakavia sydän- ja verisuonitapahtumia voi ilmaantua ilman varoittavia oireita, potilaiden tulee olla varuillaan rintakivun, hengenahdistuksen, heikkouden, puhehäiriön merkeissä ja oireissa, ja heidän tulee kysyä lääkäriltä neuvoa, kun he havaitsevat merkkejä tai oireita. Potilaiden tulee olla tietoisia tämän seurannan tärkeydestä [katso VAROITUKSET JA VAROTOIMET ].
Serotoniinin oireyhtymä
Potilaita tulee varoittaa serotoniinioireyhtymän riskistä käytettäessä MAXALT 10 mg:aa tai muita triptaaneja, erityisesti käytettäessä yhdessä selektiivisten serotoniinin takaisinoton estäjien (SSRI) tai serotoniininorepinefriinin takaisinoton estäjien (SNRI) kanssa [ks. VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET , ja KLIININEN FARMAKOLOGIA ].
Raskaus
Kerro potilaille, että MAXALTIa ei tule käyttää raskauden aikana, ellei mahdollinen hyöty oikeuta sikiölle mahdollisesti aiheutuvaa riskiä (ks. Käyttö tietyissä populaatioissa ].
Imetys
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen, jos he imettävät tai suunnittelevat imetystä [katso Käyttö tietyissä populaatioissa ].
Kyky suorittaa monimutkaisia tehtäviä
Koska migreeni tai hoito MAXALT 10 mg:lla voi aiheuttaa uneliaisuutta ja huimausta, neuvo potilaita arvioimaan kykyään suorittaa monimutkaisia tehtäviä migreenikohtausten aikana ja MAXALTin annon jälkeen.
Lääkkeiden liikakäyttö Päänsärky
Kerro potilaille, että akuutin migreenilääkkeiden käyttö vähintään 10 päivää kuukaudessa voi johtaa päänsäryn pahenemiseen, ja rohkaise potilaita kirjaamaan päänsäryn esiintymistiheys ja huumeiden käyttö (esim. pitämällä päänsärkypäiväkirjaa) [ks. VAROITUKSET JA VAROTOIMET ].
Suun kautta hajoavien tablettipakkausten käsittely
Neuvo potilaita olemaan poistamatta läpipainopakkausta uloimmasta alumiinipussista ennen kuin olet valmis käyttämään sisällä olevaa suussa hajoavaa tablettia [ks. ANNOSTELU JA HALLINNOINTI ].
Potilaat, joilla on fenyyliketonuria
Ilmoita fenyyliketonuriapotilaille, että MAXALT-MLT suun kautta hajoavat tabletit sisältävät fenyylialaniinia (aspartaamin ainesosa). Jokainen 5 mg:n suussa hajoava tabletti sisältää 1,1 mg fenyylialaniinia ja jokainen 10 mg:n suussa hajoava tabletti sisältää 2,1 mg fenyylialaniinia [ks. Käyttö tietyissä populaatioissa ].
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Ritsatriptaanin karsinogeenisuustutkimukset suun kautta suoritettiin hiirillä (100 viikkoa) ja rotilla (106 viikkoa) annoksilla 125 mg/kg/vrk. Ritsatriptaaniin liittyvää kasvainten ilmaantuvuuden lisääntymistä ei havaittu kummallakaan lajilla. Plasmaaltistukset (AUC) suurimmalla testatulla annoksella olivat noin 150 (hiiret) ja 240 kertaa (rotat) verrattuna ihmisiin ihmisille suositellulla enimmäisannoksella (MRHD) 30 mg/vrk.
Mutageneesi
Rizatriptaani ei ollut mutageeninen eikä klastogeeninen useissa in vitro ja in vivo geneettisen toksisuustutkimuksissa, mukaan lukien: mikrobiaalinen mutageneesi (Ames) -määritys, in vitro nisäkässolujen mutageneesi- ja kromosomipoikkeavuuskokeet ja in vivo -kromosomipoikkeavuusmääritys hiirellä.
Hedelmällisyyden heikkeneminen
Ritsatriptaanin oraalinen antaminen (0, 2, 10 tai 100 mg/kg/vrk) naarasrotille ennen parittelua ja sen aikana ja jatkuminen koko tiineyden ja imetyksen aikana ei vaikuttanut hedelmällisyyteen. kuitenkin, muuttunut kiiman syklisyys ja pariutumisen viivästyminen havaittiin suurimmalla testatulla annoksella. Plasman altistuminen vaikutuksettomalla annoksella (10 mg/kg/vrk) lisääntymistoksisuuden vuoksi oli noin 15 kertaa suurempi kuin ihmisillä MRHD:ssä.
Ritsatriptaanin (0, 5, 35 tai 250 mg/kg/vrk) oraalinen antaminen urosrotille ennen parittelua ja sen aikana ei heikentänyt hedelmällisyyttä tai lisääntymiskykyä. Plasmaaltistus (AUC) suurimmalla testatulla annoksella oli noin 550 kertaa suurempi kuin ihmisillä MRHD:llä.
Käyttö tietyissä populaatioissa
Raskaus
Riskien yhteenveto
Saatavilla olevat ihmisillä tehdyt tiedot MAXALTin käytöstä raskaana oleville naisille eivät riitä tekemään johtopäätöksiä lääkkeisiin liittyvästä vakavien synnynnäisten epämuodostumien ja keskenmenon riskistä.
Eläinkokeissa havaittiin kehitystoksisuutta, kun ritsatriptaania annettiin suun kautta tiineyden aikana (sikiön painon lasku rotilla) tai koko raskauden ja imetyksen aikana (lisääntynyt kuolleisuus, alentunut ruumiinpaino ja hermokäyttäytymisen heikkeneminen rotan jälkeläisillä), kun emon plasma-altistus oli suurempi kuin odotettavissa terapeuttisilla annoksilla ihmisillä [ks Eläinten tiedot ].
Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon taustariski kliinisesti tunnistetuissa raskauksissa on 2–4 % ja 15–20 %. Raportoitu vakavien synnynnäisten epämuodostumien määrä migreeniä sairastaville naisille on 2,2–2,9 prosenttia ja keskenmenojen raportoitu osuus oli 17 prosenttia, mikä on samanlainen kuin naisilla, joilla ei ole migreeniä.
Kliiniset näkökohdat
Äidin ja/tai alkion/sikiön sairauteen liittyvä riski
Migreeniä sairastavilla naisilla on lisääntynyt riski saada äidillä haitallisia perinataalisia seurauksia, mukaan lukien pre-eklampsia ja raskausajan hypertensio.
Data
Ihmistiedot
MAXALTin raskausrekisteri ei havainnut synnynnäisten epämuodostumien tai muiden haitallisten synnytystulosten kaavaa vuosina 1998–2018. Minkään mallin tunnistamisen puutetta on kuitenkin suhtauduttava varoen, sillä mahdollisten tulostietoja sisältävien raporttien määrä oli alhainen, eikä se riittänyt havaitsemaan MAXALTin käyttöön liittyvää lisääntynyttä yksittäisten synnynnäisten epämuodostumien riskiä. Lisäksi mahdollisten raskausraporttien seuranta heikkeni merkittävästi, mikä vaikeutti entisestään MAXALTin ja mahdollisten synnynnäisten epämuodostumien tai muiden haitallisten synnytystulosten välisen yhteyden arviointia.
Tutkimuksessa, jossa käytettiin Ruotsin lääketieteellisen syntymärekisterin tietoja, eläviä syntymiä naisille, jotka ilmoittivat käyttäneensä triptaaneja tai torajyviä raskauden aikana, verrattiin naisten, jotka eivät käyttäneet sitä. Niistä 157 synnytyksestä, jotka olivat altistuneet ritsatriptaanille ensimmäisen raskauskolmanneksen aikana, 7 lapsella syntyi epämuodostumia (suhteellinen riski 1,01 [95 % CI: 0,40 - 2,08]). Tutkimuksessa, jossa käytettiin linkitettyjä tietoja Norjan lääketieteellisestä syntymärekisteristä Norjan reseptitietokantaan, verrattiin raskauden tuloksia naisilla, jotka lunastivat triptaanireseptin raskauden aikana, sekä migreenitautien vertailuryhmässä, joka lunasti triptaanireseptit vain ennen raskautta, verrattuna väestökontrolliryhmä. Niistä 310 naisesta, jotka lunastivat ritsatriptaanin reseptin ensimmäisen raskauskolmanneksen aikana, 10:llä oli vauvoja, joilla oli vakavia synnynnäisiä epämuodostumia (OR 1,03 [95 % CI: 0,55 - 1,93]), kun taas 271 naisella, jotka lunastivat ritsatriptaanireseptin ennen, mutta ei sen aikana 12:lla lapsilla oli vakavia synnynnäisiä epämuodostumia (OR 1,48 [95 % CI: 0,83 - 2,64]), jokaisella verrattuna väestön vertailuryhmään.
Eläinten tiedot
Kun ritsatriptaania (0, 2, 10 tai 100 mg/kg/vrk) annettiin suun kautta raskaana oleville rotille koko organogeneesin ajan, havaittiin sikiön painon laskua suurimmilla testatuilla annoksilla. Keskiannoksella (10 mg/kg/vrk), joka ei vaikuttanut sikiön ja sikiön kehitykseen kohdistuviin haittavaikutuksiin, plasman altistus (AUC) oli noin 15 kertaa suurempi kuin ihmisillä, kun suurin suositeltu ihmisannos (MRHD) oli 30 mg/päivä. Kun ritsatriptaania (0, 5, 10 tai 50 mg/kg/vrk) annettiin suun kautta tiineille kaneille koko organogeneesin ajan, ei havaittu haitallisia vaikutuksia sikiöön. Plasmaaltistus (AUC) suurimmalla testatulla annoksella oli 115 kertaa suurempi kuin ihmisillä MRHD:llä. Lääkkeen siirtyminen istukan kautta sikiöön osoitettiin molemmissa lajeissa.
Ritsatriptaanin oraalinen anto (0, 2, 10 tai 100 mg/kg/vrk) naarasrotille ennen parittelua ja sen aikana sekä jatkuminen koko tiineyden ja laktaation ajan johti jälkeläisten ruumiinpainon laskuun syntymästä lähtien ja koko laktaation ajan, paitsi pienimmällä tasolla. testattu annos (2 mg/kg/vrk). Plasmaaltistus (AUC) vaikutuksettomalla annoksella (2 mg/kg/vrk) synnytyksen jälkeiseen kehitykseen kohdistuvien haittavaikutusten osalta oli samanlainen kuin ihmisillä MRHD:n aikana.
Ritsatriptaanin oraalinen antaminen (0, 5, 100 tai 250 mg/kg/vrk) koko organogeneesin ja imetyksen aikana johti vastasyntyneiden kuolleisuuteen, painon laskuun (joka säilyi aikuisikään asti) ja jälkeläisten hermokäyttäytymistoiminnan heikkenemistä pienimmällä annoksella. testattu. Plasmaaltistus (AUC) vaikutuksettomalla annoksella synnytyksen jälkeiseen kehitykseen kohdistuvien haittavaikutusten vuoksi (5 mg/kg/vrk) oli noin 8 kertaa suurempi kuin ihmisillä MRHD:n aikana.
Imetys
Riskien yhteenveto
Ei ole tietoa ritsatriptaanin tai sen aktiivisten metaboliittien esiintymisestä äidinmaidossa tai ritsatriptaanin vaikutuksista imetettävään lapseen tai maidontuotantoon.
Ritsatriptaani erittyi rotan maitoon, ja sen pitoisuudet maidossa olivat noin 6 kertaa suuremmat kuin äidin plasmassa.
Imetyksen kehitys- ja terveyshyötyjä tulee harkita sekä äidin kliinistä MAXALT- tai MAXALT-MLT-tarvetta ja mahdollisia MAXALT- tai MAXALT-MLT-valmisteen tai äidin taustalla olevista haitallisista vaikutuksista imetettävään lapseen.
Data
Kun ritsatriptaania annettiin imettäville rotille suun kautta annoksella 100 mg/kg/vrk, sen pitoisuudet maitonäytteissä ylittivät emon plasman lääkepitoisuudet noin 6-kertaisesti.
Käyttö lapsille
Turvallisuutta ja tehoa alle 6-vuotiailla lapsipotilailla ei ole varmistettu. MAXALT 5 mg:n teho ja turvallisuus migreenin akuutissa hoidossa 6–17-vuotiailla potilailla vahvistettiin riittävässä ja hyvin kontrolloidussa tutkimuksessa [ks. Kliiniset tutkimukset ].
Lapsipotilailla akuutissa kliinisessä tutkimuksessa raportoitujen haittavaikutusten ilmaantuvuus oli samanlainen potilailla, jotka saivat MAXALT 5 mg:aa kuin lumelääkettä saaneilla potilailla. Lapsipotilaiden haittavaikutusten oletetaan olevan samanlainen kuin aikuisilla.
Geriatrinen käyttö
MAXALT 5 mg:n kliinisissä tutkimuksissa ei ollut riittävästi 65-vuotiaita ja sitä vanhempia koehenkilöitä sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa.
Vaikka ritsatriptaanin farmakokinetiikka oli samanlainen iäkkäillä (ikä ≥ 65 vuotta) ja nuoremmilla aikuisilla (n = 17), yleensä iäkkäiden potilaiden annoksen valinnassa tulee olla varovainen alkaen annosalueen alimmasta päästä. Tämä kuvastaa maksan, munuaisten tai sydämen toiminnan heikkenemisen sekä samanaikaisen sairauden tai muun lääkehoidon yleisempää esiintymistä.
Ikäpotilailla, joilla on muita kardiovaskulaarisia riskitekijöitä (esim. diabetes, verenpainetauti, tupakointi, liikalihavuus, vahva suvussa sepelvaltimotauti), tulee tehdä kardiovaskulaarinen arviointi ennen MAXALT-hoitoa [ks. VAROITUKSET JA VAROTOIMET ].
Potilaat, joilla on fenyyliketonuria
Suun kautta hajoavat tabletit sisältävät fenyylialaniinia (aspartaamin komponenttia). 5 mg:n ja 10 mg:n suussa hajoavat tabletit sisältävät 1,1 mg ja 2,1 mg fenyylialaniinia.
YLIANNOSTUS
Kliinisissä tutkimuksissa aikuisilla ei raportoitu MAXALTin yliannostuksia.
Joillakin aikuispotilailla, jotka saivat 40 mg MAXALT 5 mg:aa joko kerta-annoksena tai kahtena annoksena 2 tunnin välein, esiintyi huimausta ja uneliaisuutta.
Kliinisfarmakologisessa tutkimuksessa, jossa 12 aikuista sai MAXALTIa 5 mg kumulatiivisilla kokonaisannoksilla 80 mg (annettiin neljän tunnin sisällä), kahdella koehenkilöstä ilmeni pyörtymistä, huimausta, bradykardiaa mukaan lukien kolmannen asteen AV-katkos, oksentelua ja/tai inkontinenssia. .
Pitkäaikaisessa avoimessa tutkimuksessa, johon osallistui 606 hoidettua 12–17-vuotiasta migreenipotilasta (joista 432:ta hoidettiin vähintään 12 kuukauden ajan), 151 potilasta (25 %) otti kaksi 10 mg:n annosta MAXALT-MLT:tä. 24 tunnin sisällä. Kolmella näistä potilaista haittavaikutuksia olivat vatsakipu, väsymys ja hengenahdistus.
Lisäksi MAXALT 10 mg:n farmakologian perusteella yliannostuksen jälkeen saattaa ilmetä kohonnutta verenpainetta tai sydänlihasiskemiaa. Ruoansulatuskanavan dekontaminaatiota (eli mahahuuhtelua ja sen jälkeen aktiivihiiltä) tulee harkita potilailla, joiden epäillään saaneen MAXALTin yliannostusta. Kliinistä ja elektrokardiografista seurantaa tulee jatkaa vähintään 12 tuntia, vaikka kliinisiä oireita ei havaittaisikaan.
Hemo- tai peritoneaalidialyysin vaikutuksia seerumin ritsatriptaanipitoisuuksiin ei tunneta.
VASTA-AIHEET
MAXALT 5 mg on vasta-aiheinen potilailla, joilla on:
- Iskeeminen sepelvaltimotauti (angina pectoris, sydäninfarkti tai dokumentoitu hiljainen iskemia) tai muu merkittävä taustalla oleva sydän- ja verisuonitauti [ks. VAROITUKSET JA VAROTOIMET ].
- Sepelvaltimon vasospasmi mukaan lukien Prinzmetalin angina [katso VAROITUKSET JA VAROTOIMET ].
- Aiemmin aivohalvaus tai ohimenevä iskeeminen kohtaus (TIA) [katso VAROITUKSET JA VAROTOIMET ].
- Perifeerinen verisuonisairaus (PVD) [katso VAROITUKSET JA VAROTOIMET ].
- Iskeeminen suolistosairaus [katso VAROITUKSET JA VAROTOIMET ].
- Hallitsematon verenpainetauti [katso VAROITUKSET JA VAROTOIMET ].
- Toisen 5-HT1-agonistin, ergotamiinia sisältävän lääkkeen tai ergot-tyyppisen lääkkeen (kuten dihydroergotamiinin tai metysergidin) viimeaikainen käyttö (eli 24 tunnin sisällä) [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
- Hemipleginen tai basilaarinen migreeni [katso INDIKAATIOT ].
- MAO-A-estäjän samanaikainen antaminen tai äskettäinen lopettaminen (eli 2 viikon sisällä) [ks. HUUMEIDEN VUOROVAIKUTUKSET ja KLIININEN FARMAKOLOGIA ].
- Yliherkkyys ritsatriptaanille tai jollekin apuaineista (angioödeema ja anafylaksia havaittu) [ks. HAITTAVAIKUTUKSET ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Rizatriptaani sitoutuu suurella affiniteetilla ihmisen kloonattuihin 5-HT1B/1D-reseptoreihin. MAXALT 10 mg:lla oletetaan olevan terapeuttisia vaikutuksia migreenipäänsäryn hoidossa sitoutumalla 5-HT1B/1D-reseptoreihin, jotka sijaitsevat kallonsisäisissä verisuonissa ja kolmoishermojärjestelmän tuntohermoissa.
Farmakokinetiikka
Imeytyminen
Rizatriptaani imeytyy täysin oraalisen annon jälkeen. Suun kautta otettavan MAXALT 10 mg -tabletin keskimääräinen absoluuttinen hyötyosuus on noin 45 %, ja keskimääräiset huippupitoisuudet plasmassa (Cmax) saavutetaan noin 1-1,5 tunnissa (Tmax). Migreenipäänsäryn esiintyminen ei näyttänyt vaikuttavan ritsatriptaanin imeytymiseen tai farmakokinetiikkaan. Ruoalla ei ole merkittävää vaikutusta ritsatriptaanin biologiseen hyötyosuuteen, mutta se viivästyttää huippupitoisuuden saavuttamiseen kuluvaa aikaa tunnilla. Kliinisissä tutkimuksissa MAXALT 10 mg annettiin ruokailusta riippumatta.
Ritsatriptaanin hyötyosuus ja Cmax olivat samanlaiset MAXALT-tablettien ja suun kautta hajoavien MAXALT-MLT-tablettien antamisen jälkeen, mutta MAXALT-MLT:n imeytymisnopeus on hieman hitaampi, ja Tmax viivästyy jopa 0,7 tuntia. Ritsatriptaanin AUC on noin 30 % suurempi naisilla kuin miehillä. Kertymistä ei esiintynyt useilla annostuksilla.
Jakelu
Keskimääräinen jakautumistilavuus on noin 140 litraa miehillä ja 110 litraa naisilla. Rizatriptaani sitoutuu vain vähän (14 %) plasman proteiineihin.
Aineenvaihdunta
Ritsatriptaani metaboloituu ensisijaisesti monoamiinioksidaasin (MAO-A) aiheuttaman oksidatiivisen deaminaation kautta indolietikkahappometaboliitiksi, joka ei ole aktiivinen 5-HT1B/1D-reseptorissa. N-monodesmetyyliritsatriptaania, metaboliittia, jonka aktiivisuus on samanlainen kuin emoyhdisteellä 5-HT1B/1D-reseptorissa, muodostuu vähäisessä määrin. N-monodesmetyyliritsatriptaanin pitoisuudet plasmassa ovat noin 14 % alkuperäisen yhdisteen pitoisuuksista, ja se eliminoituu samalla nopeudella. Muut vähäiset metaboliitit, N-oksidi, 6-hydroksiyhdiste ja 6-hydroksimetaboliitin sulfaattikonjugaatti eivät ole aktiivisia 5-HT1B/1D-reseptorissa.
Eliminointi
Annetun annoksen kokonaisradioaktiivisuus palautui 120 tunnin aikana virtsaan ja ulosteeseen 82 % ja 12 %, kun 14C-ritsatriptaania annettiin kerran 10 mg:n suun kautta. 14C-ritsatriptaanin oraalisen annon jälkeen ritatriptaanin osuus oli noin 17 % kiertävästä plasman radioaktiivisuudesta. Noin 14 % oraalisesta annoksesta erittyy virtsaan muuttumattomana ritsatriptaanina ja 51 % indolietikkahappometaboliitina, mikä viittaa merkittävään ensikierron metaboliaan.
Ritsatriptaanin puoliintumisaika plasmassa on miehillä ja naisilla keskimäärin 2-3 tuntia.
Sytokromi P450 isoformit
Rizatriptaani ei estä ihmisen maksan sytokromi P450:n isoformien 3A4/5, 1A2, 2C9, 2C19 tai 2E1 aktiivisuutta; ritsatriptaani on sytokromi P450 2D6:n kilpaileva estäjä (Ki = 1400 nM), mutta vain korkeina, kliinisesti merkityksettöminä pitoisuuksina.
Erikoispopulaatiot
Geriatric
Rizatriptaanin farmakokinetiikka terveillä iäkkäillä vapaaehtoisilla, jotka eivät sairastaa migreeniä (ikä 65-77 vuotta) oli samanlainen kuin nuoremmilla vapaaehtoisilla, jotka eivät sairastaa migreeniä (ikä 18-45 vuotta).
Pediatriset
Ritsatriptaanin farmakokinetiikka määritettiin 6–17-vuotiailla migreenipotilailla. Altistuminen kerta-annoksena 5 mg MAXALT-MLT:tä 20–39 kg (44–87 lb) painaville lapsipotilaille tai 10 mg MAXALT-MLT:ta ≥ 40 kg (88 lb) painaville lapsipotilaille oli samanlainen kuin kerta-annoksen jälkeen. 10 mg MAXALT-MLT:tä aikuisille.
Sukupuoli
Ritsatriptaanin (10 mg suun kautta) keskimääräinen AUC0-∞ ja Cmax olivat naisilla noin 30 % ja 11 % korkeammat kuin miehillä, kun taas Tmax saavutettiin suunnilleen samaan aikaan.
Maksan vajaatoiminta
Oraalisen annostelun jälkeen potilaille, joilla oli lievän tai keskivaikean alkoholin aiheuttama maksakirroosin aiheuttama maksan vajaatoiminta, plasman ritsatriptaanin pitoisuudet olivat samanlaiset potilailla, joilla oli lievä maksan vajaatoiminta, verrattuna vertailuryhmään, jossa oli normaali maksan toiminta. plasman ritatriptaanipitoisuudet olivat noin 30 % suuremmat potilailla, joilla oli kohtalainen maksan vajaatoiminta.
Munuaisten vajaatoiminta
Potilailla, joilla oli munuaisten vajaatoiminta (kreatiniinipuhdistuma 10-60 ml/min/1,73 m2), ritsatriptaanin AUC0-∞ ei eronnut merkittävästi potilaiden, joiden munuaisten toiminta oli normaali, arvosta. Hemodialyysipotilailla (kreatiniinipuhdistuma
Rotu
Farmakokineettiset tiedot eivät paljastaneet merkittäviä eroja afroamerikkalaisten ja valkoihoisten koehenkilöiden välillä.
Huumeiden vuorovaikutukset
[Katso myös HUUMEIDEN VUOROVAIKUTUKSET ]
Monoamiinioksidaasin estäjät
Ritsatriptaani metaboloituu pääasiassa monoamiinioksidaasin A-alatyypin (MAO-A) kautta. Ritsatriptaanin pitoisuuksia plasmassa voivat lisätä lääkkeet, jotka ovat selektiivisiä MAO-A:n estäjiä (esim. moklobemidi) tai ei-selektiivisiä MAO-estäjiä [tyyppi A ja B] (esim. isokarboksatsidi, feneltsiini, tranyylisypromiini ja pargyliini). Lääkkeiden yhteisvaikutustutkimuksessa, kun MAXALTia 10 mg annettiin koehenkilöille (n=12), jotka saivat samanaikaista hoitoa selektiivisellä, reversiibelillä MAO-A:n estäjällä, moklobemidilla 150 mg tid, ritatriptaanin AUC- ja Cmax-arvot nousivat keskimäärin 119 %. 41 %; ja ritsatriptaanin aktiivisen N-monodesmetyylimetaboliitin AUC nousi yli 400 %. Yhteisvaikutuksen odotetaan olevan suurempi käytettäessä irreversiibeliä MAO-estäjää. Farmakokineettistä yhteisvaikutusta ei odoteta potilailla, jotka saavat selektiivisiä MAO-B:n estäjiä [katso VASTA-AIHEET ja HUUMEIDEN VUOROVAIKUTUKSET ].
Propranololi
Tutkimuksessa, jossa annettiin samanaikaisesti propranololia 240 mg/vrk ja kerta-annos 10 mg ritsatriptaania terveillä aikuisilla (n=11), ritsatriptaanin keskimääräinen plasman AUC nousi 70 % propranololin annon aikana ja nelinkertaistui. havaittiin yhdessä aiheessa. Propranololi ei vaikuttanut ritsatriptaanin aktiivisen N-monodesmetyylimetaboliitin AUC-arvoon [ks. ANNOSTELU JA HALLINNOINTI ja HUUMEIDEN VUOROVAIKUTUKSET ].
Nadolol/Metoprolol
Lääkkeiden yhteisvaikutustutkimuksessa arvioitiin terveillä koehenkilöillä (n=12) toistuvien nadololin 80 mg:n tai 100 mg:n metoprololin 12 tunnin välein vaikutusta 10 mg:n kerta-annoksen farmakokinetiikkaan. Farmakokineettisiä yhteisvaikutuksia ei havaittu.
Paroksetiini
Selektiivisen serotoniinin takaisinoton estäjän (SSRI) paroksetiinin 20 mg/vrk kahden viikon ajan ja MAXALT 10 mg:n kerta-annoksen välistä yhteisvaikutusta terveillä koehenkilöillä (n=12) ei tutkittu risatriptaanin plasmapitoisuuksia eikä sen turvallisuusprofiilia. paroksetiini vaikutti niihin [ks VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET , ja POTILASTIEDOT ].
Ehkäisypillerit
Tutkimuksessa, jossa MAXALT-valmistetta (10-30 mg/vrk) annettiin 6 päivän ajan terveillä vapaaehtoisilla naisilla (n=18), ritatriptaani ei vaikuttanut etinyyliestradiolin tai noretindronipitoisuuksiin plasmassa.
Kliiniset tutkimukset
Aikuiset
MAXALT 5 mg -tablettien teho vahvistettiin neljässä monikeskustutkimuksessa, satunnaistetussa, lumekontrolloidussa tutkimuksessa. Näihin tutkimuksiin osallistuneet potilaat olivat pääasiassa naisia (84 %) ja valkoihoisia (88 %), ja heidän keski-ikä oli 40 vuotta (vaihteluväli 18–71). Potilaita neuvottiin hoitamaan kohtalaista tai vaikeaa päänsärkyä. Päänsärkyvaste, joka määritellään kohtalaisen tai vaikean päänsärkykivun vähentymisenä ilman tai lievään päänsärkykipuun, arvioitiin enintään 2 tunnin ajan (tutkimus 1) tai enintään 4 tunnin ajan annostelun jälkeen (tutkimukset 2, 3 ja 4). Niihin liittyvät pahoinvoinnin, valonarkuus ja fonofobian oireet ja vasteen säilyminen 24 tunnin ajan annoksen jälkeen arvioitiin. Toinen annos MAXALT 10 mg tabletteja annettiin 2–24 tunnin kuluttua annostelusta toistuvan päänsäryn hoitoon tutkimuksissa 1 ja 2. Ylimääräisiä kipulääkkeitä ja/tai pahoinvointilääkkeitä annettiin 2 tuntia ensimmäisen hoidon jälkeen pelastamiseksi kaikissa neljässä tutkimuksessa.
Kaikissa tutkimuksissa päänsärkyvasteen saavuttaneiden potilaiden prosenttiosuus 2 tuntia hoidon jälkeen oli merkitsevästi suurempi potilailla, jotka saivat joko 5 tai 10 mg MAXALTia, verrattuna lumelääkettä saaneisiin potilaisiin. Erillisessä tutkimuksessa 2,5 mg:n annokset eivät eronneet lumelääkkeestä. Yli 10 mg:n annoksilla haittavaikutusten ilmaantuvuus lisääntyi. Neljän kontrolloidun tutkimuksen tulokset on koottu taulukkoon 2.
Eri kliinisissä tutkimuksissa saatuihin tuloksiin perustuvat lääkkeiden tehokkuuden vertailut eivät välttämättä ole luotettavia. Koska tutkimukset suoritetaan eri aikoina, eri potilasnäytteillä, eri tutkijoiden toimesta, käyttäen erilaisia kriteerejä ja/tai eri tulkintoja samoista kriteereistä, eri olosuhteissa (annos, annostusohjelma jne.), kvantitatiiviset arviot hoitovasteesta ja vasteen ajoituksen voidaan olettaa vaihtelevan huomattavasti tutkimuksesta toiseen.
Arvioitu todennäköisyys saada alkupäänsärkyvaste 2 tunnin sisällä hoidon jälkeen yhdistetyissä tutkimuksissa 1, 2, 3 ja 4 on esitetty kuvassa 1.
Kuva 1: Arvioitu todennäköisyys saada ensimmäinen päänsärkyvaste 2 tunnissa yhdistetyissä tutkimuksissa 1, 2, 3 ja 4* 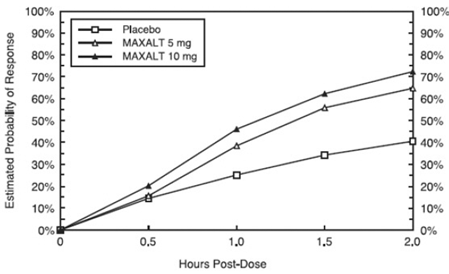
Potilailla, joilla oli migreeniin liittyvä valonarkuus, fonofobia ja pahoinvointi lähtötilanteessa, näiden oireiden ilmaantuvuus oli pienempi MAXALTin annon jälkeen verrattuna lumelääkkeeseen.
Kaksi - 24 tuntia tutkimushoidon aloitusannoksen jälkeen potilaiden annettiin käyttää lisähoitoa kivunvasteeseen toisen annoksen tutkimushoitoa tai muuta lääkettä muodossa. Kuvassa 2 on yhteenveto arvioitu todennäköisyys, että potilaat ottavat toisen annoksen tai muuta lääkettä migreeniin 24 tunnin aikana tutkimushoidon aloitusannoksen jälkeen.
Kuva 2: Arvioitu todennäköisyys, että potilaat ottavat toisen annoksen MAXALT 10 mg -tabletteja tai muita migreenilääkkeitä 24 tunnin aikana tutkimushoidon aloitusannoksen jälkeen yhdistetyissä tutkimuksissa 1, 2, 3 ja 4* 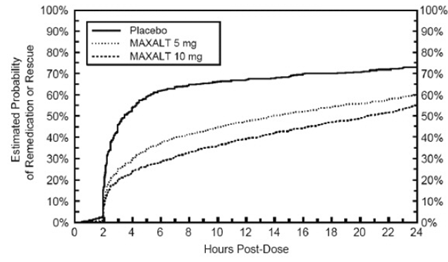
Auran läsnäolo ei vaikuttanut tehokkuuteen; potilaan sukupuolen tai iän perusteella; tai käyttämällä samanaikaisesti yleisiä migreeniä ehkäiseviä lääkkeitä (esim. beetasalpaajia, kalsiumkanavasalpaajia, trisyklisiä masennuslääkkeitä) tai ehkäisyvalmisteita. Kahdessa muussa samanlaisessa tutkimuksessa suhde kuukautisiin ei vaikuttanut tehoon. Ei ollut riittävästi tietoa rodun vaikutuksen arvioimiseksi tehoon.
MAXALT-MLT suussa hajoavat tabletit
MAXALT-MLT:n teho vahvistettiin kahdessa monikeskustutkimuksessa, satunnaistetussa, lumekontrolloidussa tutkimuksessa, jotka olivat rakenteeltaan samanlaisia kuin MAXALT-tabletteja koskevat tutkimukset (tutkimukset 5 ja 6). Potilaita neuvottiin hoitamaan kohtalaista tai vaikeaa päänsärkyä. Näissä tutkimuksissa hoidetut potilaat olivat pääasiassa naisia (88 %) ja valkoihoisia (95 %), ja heidän keski-ikä oli 42 vuotta (vaihteluväli 18–72).
Molemmissa tutkimuksissa päänsärkyvasteen saavuttaneiden potilaiden prosenttiosuus 2 tuntia hoidon jälkeen oli merkitsevästi suurempi potilailla, jotka saivat joko MAXALT-MLT:tä 5 tai 10 mg, verrattuna lumelääkettä saaneisiin potilaisiin. Taulukossa 3 on yhteenveto tutkimusten 5 ja 6 tuloksista.
Arvioitu todennäköisyys saada alkupäänsärkyvaste 2 tunnin kuluessa MAXALT-MLT-hoidon jälkeen yhdistetyissä tutkimuksissa 5 ja 6 on esitetty kuvassa 3.
Kuva 3: Arvioitu todennäköisyys saada ensimmäinen päänsärkyvaste MAXALT-MLT:llä 2 tunnilla yhdistetyissä tutkimuksissa 5 ja 6* 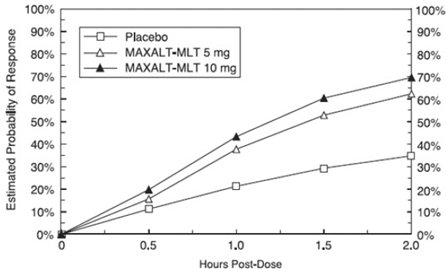
Potilailla, joilla oli migreeniin liittyvä valonarkuus ja fonofobia lähtötilanteessa, näiden oireiden ilmaantuvuus oli pienempi MAXALT-MLT:n annon jälkeen lumelääkkeeseen verrattuna.
Kaksi - 24 tuntia tutkimushoidon aloitusannoksen jälkeen potilaiden annettiin käyttää lisähoitoa kivunvasteeseen toisen annoksen tutkimushoitoa tai muuta lääkettä muodossa. Kuvassa 4 on yhteenveto arvioitu todennäköisyys, että potilaat ottavat toisen annoksen tai muuta lääkettä migreeniin 24 tunnin aikana tutkimushoidon aloitusannoksen jälkeen.
Kuva 4: Arvioitu todennäköisyys, että potilaat ottavat toisen annoksen MAXALT-MLT:tä tai muuta migreenilääkettä 24 tunnin aikana tutkimushoidon aloitusannoksen jälkeen yhdistetyissä tutkimuksissa 5 ja 6* 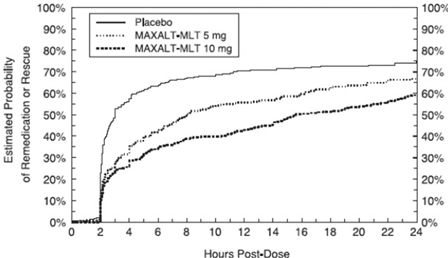
6–17-vuotiaat lapsipotilaat
MAXALT-MLT:n tehoa 6–17-vuotiailla lapsipotilailla arvioitiin monikeskustutkimuksessa, satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa, rinnakkaisryhmätutkimuksessa (tutkimus 7). Potilailla oli oltava vähintään 6 kuukauden migreenikohtauksia (auralla tai ilman), jotka kestivät yleensä vähintään 3 tuntia (hoitamattomana). Potilaspopulaatio ei historiallisesti reagoinut tulehduskipulääkkeisiin ja asetaminofeenihoitoon.
Potilaita neuvottiin hoitamaan yksittäinen migreenikohtaus, johon liittyi keskivaikeaa tai vaikeaa päänsäryn kipua. Tutkimuksen hoitovaiheessa oli kaksi vaihetta. Vaihe 1 käytettiin tunnistamaan lumelääkkeeseen reagoimattomat, jotka sitten siirtyivät vaiheeseen 2, jossa potilaat satunnaistettiin saamaan MAXALT-MLT:tä tai lumelääkettä. Käytettäessä painoon perustuvaa annostusstrategiaa potilaat, joiden paino oli 20–
Tutkitun potilaspopulaation keski-ikä oli 13 vuotta. 61 prosenttia potilaista oli valkoihoisia ja 56 prosenttia potilaista oli naisia. Niiden potilaiden prosenttiosuus, jotka saavuttivat ensisijaisen tehokkuuden päätetapahtuman eli ei päänsärkykipua 2 tunnin kuluttua hoidosta, oli merkitsevästi suurempi potilailla, jotka saivat MAXALT-MLT:tä, verrattuna lumelääkettä saaneisiin potilaisiin (33 % vs. 24 %). Taulukossa 4 on yhteenveto tutkimuksen 7 tuloksista.
Havaittu prosenttiosuus lapsipotilaista, jotka eivät saaneet päänsärkykipua 2 tunnin sisällä MAXALT-MLT-hoidon aloittamisesta, on esitetty kuvassa 5.
Kuva 5: Havaittu prosenttiosuus potilaista, jotka eivät raportoineet päänsärkykipua 2 tuntia annoksen jälkeen tutkimuksessa 7 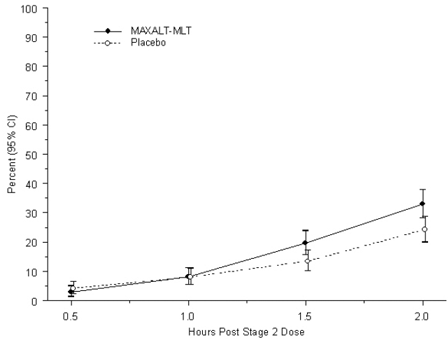
Tutkimuspäätepisteiden esiintyvyys migreeniin liittyvien oireiden (pahoinvointi, valonarkuus ja fonofobia) puuttuminen 2 tunnin kuluttua annoksen ottamisesta ei eronnut tilastollisesti merkitsevästi MAXALT-MLT:tä saaneiden potilaiden ja lumelääkettä saaneiden potilaiden välillä.
POTILASTIEDOT
MAXALT® (max-awlt)
MAXALT-MLT® (risatriptaanibentsoaatti) Tabletit ja suun kautta hajoavat tabletit
Lue nämä potilastiedot ennen kuin aloitat MAXALT®-hoidon ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa sitä, että keskustelet lääkärisi kanssa terveydentilastasi tai hoidostasi.
Ellei toisin mainita, tämän potilasohjeen tiedot koskevat sekä MAXALT 10 mg -tabletteja että MAXALT-MLT® suussa hajoavia tabletteja.
Mikä on MAXALT?
MAXALT on reseptilääke, joka kuuluu lääkeryhmään nimeltä Triptans. MAXALTia on saatavana perinteisenä tablettina (MAXALT) ja suussa hajoavana tablettina (MAXALT-MLT).
MAXALT 5 mg:aa ja MAXALT-MLT:tä käytetään aurallisen tai aurattoman migreenikohtauksen hoitoon aikuisilla ja 6–17-vuotiailla lapsilla.
MAXALT 5 mg:aa ei saa käyttää migreenikohtausten ehkäisyyn.
MAXALTia ei ole tarkoitettu hemiplegisen tai basilaarisen migreenin hoitoon.
Ei tiedetä, onko MAXALT turvallinen ja tehokas klusteripäänsäryn hoidossa.
Ei tiedetä, onko useamman kuin yhden MAXALT-annoksen ottaminen 24 tunnin aikana turvallista ja tehokasta 6–17-vuotiaille lapsille.
Ei tiedetä, onko MAXALT turvallinen ja tehokas alle 6-vuotiaille lapsille.
Kuka ei saa ottaa MAXALTia?
Älä ota MAXALTia, jos:
- sinulla on tai on ollut sydänongelmia
- sinulla on tai on ollut aivohalvaus tai ohimenevä iskeeminen kohtaus (TIA)
- sinulla on tai on ollut verisuoniongelmia, mukaan lukien iskeeminen suolistosairaus
- sinulla on hallitsematon korkea verenpaine
- olet käyttänyt muita Triptan-lääkkeitä viimeisten 24 tunnin aikana
- olet käyttänyt torajyviä sisältäviä lääkkeitä viimeisen 24 tunnin aikana
- sinulla on hemipleginen tai basilaarinen migreeni
- käytät monoamiinioksidaasin (MAO) estäjää tai olet käyttänyt MAO-estäjää viimeisen kahden viikon aikana
- olet allerginen ritsatriptaanibentsoaatille tai jollekin MAXALTin aineosalle. Katso tämän pakkausselosteen lopusta täydellinen luettelo MAXALTin ainesosista.
Keskustele lääkärin kanssa ennen tämän lääkkeen ottamista, jos sinulla on jokin yllä luetelluista tiloista tai jos et ole varma, käytätkö jotakin näistä lääkkeistä.
Mitä minun tulee kertoa lääkärilleni ennen MAXALTin ottamista?
Ennen kuin otat MAXALTia, kerro lääkärillesi, jos:
- sinulla on tai on ollut sydänongelmia, korkea verenpaine, rintakipu tai hengenahdistus
- sinulla on sydän- tai verisuoniongelmien riskitekijöitä, kuten:
- korkea verenpaine
- korkea kolesteroli
- tupakointi-
- lihavuus
- diabetes
- suvussa sydänongelmia
- olet menopaussin jälkeinen
- olet yli 40-vuotias mies
- sinulla on fenyyliketonuria (PKU). MAXALT-MLT suussa hajoavat tabletit sisältävät fenyylialaniinia.
- sinulla on munuais- tai maksaongelmia
- sinulla on jokin muu sairaus
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, vahingoittaako MAXALT sikiötäsi. Jos tulet raskaaksi MAXALT 5 mg -hoidon aikana, keskustele terveydenhuollon tarjoajan kanssa.
- imetät tai aiot imettää. Ei tiedetä, erittyykö MAXALT 10 mg rintamaitoon. Keskustele lääkärisi kanssa siitä, mikä on paras tapa ruokkia vauvasi, jos otat MAXALTia.
Kerro lääkärillesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät.
MAXALT 10 mg ja muut lääkkeet voivat vaikuttaa toisiinsa aiheuttaen sivuvaikutuksia. MAXALT voi vaikuttaa muiden lääkkeiden tehoon, ja muut lääkkeet voivat vaikuttaa MAXALT 5 mg:n tehoon.
Kerro lääkärillesi erityisesti, jos otat:
- propranololia sisältävät lääkkeet, kuten Inderal®, Inderal® LA tai Innopran® XL
- mielialahäiriöiden hoitoon käytettävät lääkkeet, mukaan lukien selektiiviset serotoniinin takaisinoton estäjät (SSRI) tai serotoniinin norepinefriinin takaisinoton estäjät (SNRI).
Pyydä lääkäriltäsi tai apteekista luettelo näistä lääkkeistä, jos et ole varma.
Tunne käyttämäsi lääkkeet. Pidä niistä luetteloa näyttääksesi lääkärillesi ja apteekkiin, kun saat uuden lääkkeen.
Miten minun pitäisi ottaa MAXALTia?
- Ota MAXALTia juuri sen verran kuin lääkärisi on määrännyt.
- Lääkärisi kertoo sinulle, kuinka paljon MAXALT 5 mg -valmistetta sinun tulee ottaa ja milloin se tulee ottaa.
- MAXALT-MLT:n ottaminen:
- Jätä MAXALT-MLT suussa hajoavat tabletit pakkaukseen, kunnes olet valmis ottamaan sen. Kun olet valmis ottamaan sen:
- Poista läpipainopakkaus foliopussista. Älä työnnä suussa hajoavaa MAXALT-MLT-tablettia läpipainopakkauksen läpi.
- Avaa läpipainopakkaus kuivin käsin ja aseta suussa hajoava MAXALT-MLT-tabletti kielellesi. Tabletti liukenee ja niellään syljen kanssa. Suussa hajoavan tabletin ottamiseksi ei tarvita nestettä.
- Jätä MAXALT-MLT suussa hajoavat tabletit pakkaukseen, kunnes olet valmis ottamaan sen. Kun olet valmis ottamaan sen:
- Jos päänsärky palaa ensimmäisen MAXALT 10 mg -annoksen jälkeen:
- Aikuiset: Toinen annos voidaan ottaa 2 tuntia ensimmäisen annoksen jälkeen. Älä ota enempää kuin 30 mg MAXALTia 24 tunnin aikana (älä esimerkiksi ota enempää kuin 3 10 mg:n tablettia 24 tunnin aikana).
- 6–17-vuotiaat lapset: Ei tiedetä, onko useamman kuin yhden MAXALT 5 mg:n annoksen ottaminen 24 tunnin aikana turvallista ja tehokasta. Keskustele lääkärisi kanssa siitä, mitä tehdä, jos päänsärky ei häviä tai palaa.
- Jos otat liikaa MAXALT 5 mg -valmistetta, ota välittömästi yhteys lääkäriin tai mene lähimmän sairaalan ensiapuun.
Mitä minun tulee välttää MAXALT-hoidon aikana?
MAXALT 5 mg voi aiheuttaa huimausta, heikkoutta tai pyörtymistä. Jos sinulla on näitä oireita, älä aja autoa, käytä koneita tai tee mitään, mikä vaatii sinulta valppautta.
Mitkä ovat MAXALT 5 mg:n mahdolliset sivuvaikutukset?
MAXALT 5 mg voi aiheuttaa vakavia sivuvaikutuksia. Soita lääkärillesi tai mene lähimmän sairaalan ensiapuun välittömästi, jos epäilet, että sinulla on jokin MAXALTin vakavista sivuvaikutuksista, mukaan lukien:
- sydänkohtaus. Sydänkohtauksen oireita voivat olla:
- rintakipu rintakehän keskellä, joka kestää yli muutaman minuutin tai menee ohi ja palaa
- rintakipu, joka tuntuu epämukavalta paineelta, puristamiselta, täyteläiseltä tai kivulta
- kipua tai epämukavuutta käsivarsissa, selässä, niskassa, leuassa tai vatsassa
- hengenahdistus rintakivun kanssa tai ilman
- puhjeta kylmä hiki
- pahoinvointia tai oksentelua
- pyörryttävä olo
- aivohalvaus. Aivohalvauksen oireita voivat olla seuraavat äkilliset oireet:
- tunnottomuus tai heikkous kasvoissasi, käsivarsissasi tai jaloissasi, erityisesti vartalon toisella puolella
- hämmennystä, puhe- tai ymmärtämisvaikeuksia
- ongelmia näkemisessä yhteen tai molempiin silmiin
- kävelyongelmat, huimaus, tasapainon tai koordinaation menetys
- vaikea päänsärky ilman tunnettua syytä
- verisuoniongelmia. Verisuoniongelmien oireita voivat olla:
- vatsakipu
- verinen ripuli
- näköongelmia
- käsien ja jalkojen kylmyys ja puutuminen
- serotoniinioireyhtymä. Serotoniinioireyhtymäksi kutsuttu tila voi ilmaantua, kun Triptan-lääkkeitä, kuten MAXALTia, käytetään tiettyjen muiden lääkkeiden kanssa. Serotoniinioireyhtymän oireita voivat olla:
- agitaatiota
- hallusinaatioita
- kooma
- nopea sydämenlyönti
- nopeat verenpaineesi muutokset
- kohonnut kehon lämpötila
- lihaskouristus
- koordinaation menetys
- pahoinvointia, oksentelua tai ripulia
- kohonnut verenpaine.
MAXALTin yleisimpiä sivuvaikutuksia aikuisilla ovat:
- uneliaisuus tai väsymys
- kipua tai painetta rinnassa tai kurkussa
- huimaus
Kerro lääkärillesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei häviä.
Jos otat MAXALT 10 mg liian usein, seurauksena voi olla krooninen päänsärky. Tällaisissa tapauksissa sinun tulee ottaa yhteyttä lääkäriisi, sillä saatat joutua lopettamaan MAXALTin käytön.
Nämä eivät ole kaikki MAXALTin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA1088.
Kuinka minun pitäisi säilyttää MAXALT?
- Säilytä MAXALT huoneenlämmössä 59 °F - 86 °F (15 °C - 30 °C).
- Hävitä vanhentuneet tai tarpeettomat lääkkeet turvallisesti.
Pidä MAXALT 10 mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa MAXALTin turvallisesta ja tehokkaasta käytöstä.
Lääkkeitä määrätään joskus muihin tarkoituksiin kuin potilasohjeessa lueteltuihin tarkoituksiin. Älä käytä MAXALTia sairauksiin, joihin sitä ei ole määrätty. Älä anna MAXALTia muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tämä potilastietolehtinen sisältää yhteenvedon tärkeimmistä tiedoista MAXALTista. Jos haluat lisätietoja, keskustele lääkärisi kanssa. Voit kysyä apteekista tai lääkäriltä tietoja MAXALTista, jotka on kirjoitettu terveydenhuollon ammattilaisille.
Lisätietoja saat osoitteesta www.maxalt.com.
Mitä ainesosia MAXALT sisältää?
MAXALT 10mg ja MAXALT-MLT suussa hajoavien tablettien vaikuttava ainesosa:
ritsatriptaanibentsoaatti.
MAXALTin inaktiiviset ainesosat: laktoosimonohydraatti, mikrokiteinen selluloosa, esigelatinoitu tärkkelys, rautaoksidi (punainen) ja magnesiumstearaatti.
MAXALT-MLT suussa hajoavien tablettien inaktiiviset aineosat: gelatiini, mannitoli, glysiini, aspartaami ja piparminttuaromi.
MAXALT-MLT suussa hajoavat tabletit sisältävät aspartaamia, fenyylialaniinin lähdettä.
Fenyyliketonuurit:
MAXALT-MLT suussa hajoavat 5 mg tabletit sisältävät 1,1 mg fenyylialaniinia. MAXALT-MLT suussa hajoavat 10 mg tabletit sisältävät 2,1 mg fenyylialaniinia.
Yhdysvaltain elintarvike- ja lääkevirasto on hyväksynyt nämä potilastiedot.
