Ditropan 2.5mg, 5mg Oxybutynin Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Ditropan on ja miten sitä käytetään?
Ditropan on reseptilääke, jota käytetään yliaktiivisen virtsarakon oireiden hoitoon. Ditropan 5mg voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Ditropan kuuluu lääkeryhmään nimeltä Antispasmodic Agents, Urinary.
Ei tiedetä, onko Ditropan turvallinen ja tehokas alle 5-vuotiaille lapsille.
Mitkä ovat Ditropanin mahdolliset sivuvaikutukset?
Ditropan voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- kova vatsakipu,
- ummetus,
- näön hämärtyminen,
- putkinäkö,
- silmäkipu,
- nähdä haloja valojen ympärillä,
- vähän tai ei ollenkaan virtsaamista,
- kivulias tai vaikea virtsaaminen,
- jano tai kuuma,
- kyvyttömyys virtsata,
- voimakas hikoilu ja
- kuuma ja kuiva iho
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Ditropanin yleisimpiä sivuvaikutuksia ovat:
- huimaus,
- uneliaisuus,
- näön hämärtyminen,
- kuiva suu,
- ripuli ja
- ummetus
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Ditropanin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
Jokainen uurrettu kaksoiskupera, kaiverrettu sininen DITROPAN® (oksibutyniinikloridi) -tabletti sisältää 5 mg oksibutyniinikloridia. Kemiallisesti oksibutyniinikloridi on d,l (raseeminen) 4-dietyyliamino-2-butynyylifenyylisykloheksyyliglykolaattihydrokloridi. The
oksibutyniinikloridin empiirinen kaava on C22H31NO3•HCl. Rakennekaava näkyy alla:
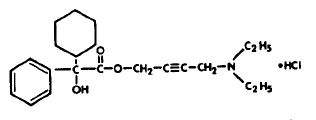
Oksibutyniinikloridi on valkoinen kiteinen kiinteä aine, jonka molekyylipaino on 393,9. Se liukenee helposti veteen ja happoihin, mutta suhteellisen liukenematon emäksiin.
DITROPAN-tabletit sisältävät myös kalsiumstearaattia, FD&C Blue #1 Lakea, laktoosia ja mikrokiteistä selluloosaa.
DITROPAN-tabletit on tarkoitettu annettavaksi suun kautta.
Terapeuttinen luokka: Antispasmodinen, antikolinerginen.
INDIKAATIOT
DITROPAN 2,5 mg XL® (oksibutyniinikloridi) on muskariiniantagonisti, joka on tarkoitettu yliaktiivisen virtsarakon hoitoon, kun oireita ovat pakkoinkontinenssi, kiireellisyys ja tiheys.
DITROPAN XL® on tarkoitettu myös sellaisten yli 6-vuotiaiden lapsipotilaiden hoitoon, joilla on neurologiseen tilaan (esim. spina bifida) liittyviä detrusorin yliaktiivisuuden oireita.
ANNOSTELU JA HALLINNOINTI
DITROPAN 2,5 mg XL® on nieltävä kokonaisena nesteen avulla, eikä sitä saa pureskella, jakaa tai murskata.
DITROPAN XL® voidaan antaa ruoan kanssa tai ilman.
Aikuiset
DITROPAN 5mg XL®:n suositeltu aloitusannos on 5 tai 10 mg kerran vuorokaudessa suunnilleen samaan aikaan joka päivä. Annosta voidaan säätää 5 mg:n välein tehon ja siedettävyyden tasapainon saavuttamiseksi (enintään 30 mg/vrk). Yleensä annosta voidaan muuttaa noin viikon välein.
6-vuotiaat ja sitä vanhemmat lapsipotilaat
DITROPAN 5mg XL®:n suositeltu aloitusannos on 5 mg kerran vuorokaudessa suunnilleen samaan aikaan joka päivä. Annosta voidaan säätää 5 mg:n välein tehon ja siedettävyyden tasapainon saavuttamiseksi (enintään 20 mg/vrk).
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
DITROPAN 5 mg XL® depottabletit ovat saatavilla 5 ja 10 mg tabletteina suun kautta:
5 mg : Vaaleankeltainen, pyöreä, tabletti, jonka toiselle puolelle on painettu mustalla musteella ”5 XL”.
10 mg Vaaleanpunainen, pyöreä, tabletti, jonka toiselle puolelle on painettu mustalla musteella ”10 XL”.
Varastointi ja käsittely
DITROPAN XL® pitkitetysti vapauttavat tabletit on saatavana kahdessa annosvahvuudessa, 5 mg (vaaleankeltainen) ja 10 mg (vaaleanpunainen), ja niiden toiselle puolelle on painettu mustalla musteella "5 XL" tai "10 XL". DITROPAN XL® depottabletit toimitetaan 100 tabletin pulloissa.
Varastointi
Säilytä 25°C (77°F); retket sallitaan 15–30 °C (59–86 °F) [katso USP-ohjattu huonelämpötila ]. Suojaa kosteudelta ja kosteudelta.
Pitää poissa lasten ulottuvilta.
Valmistaja: ALZA Corporation, Vacaville, CA 95688, ALZA OROS -teknologiatuote. Valmistettu: Janssen Pharmaceuticals, Inc., Titusville, NJ 08560. Tarkistettu: syyskuu 2019
SIVUVAIKUTUKSET
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutusten määrää ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta kliinisessä käytännössä havaittuja määriä.
DITROPAN 2,5 mg XL®:n (5-30 mg/vrk) turvallisuutta ja tehoa arvioitiin 774 aikuisella henkilöllä, jotka osallistuivat viiteen kaksoissokkoutettuun, kontrolloituun kliiniseen tutkimukseen. Neljässä viidestä tutkimuksesta Ditropan 5 mg IR (5-20 mg/vrk 199 koehenkilöllä) oli aktiivinen vertailuvalmiste. Haittavaikutukset, jotka ≥ 1 % tutkittavista ilmoitti, on esitetty taulukossa 1.
Haittavaikutuksista johtuen keskeyttämisprosentti oli 4,4 % DITROPAN XL®:llä ja 0 % Ditropan IR:llä. Yleisin tutkimuslääkityksen lopettamisen aiheuttanut haittavaikutus oli suun kuivuminen (0,7 %).
Seuraavia haittavaikutuksia raportoitiin kliinisissä tutkimuksissa Aineenvaihdunta- ja ravitsemushäiriöt: anoreksia, nesteen kertyminen; Verisuonihäiriöt: kuumat aallot; Hengityselimet, rintakehä ja välikarsina: dysfonia; Ruoansulatuskanavan häiriöt: dysfagia, tiheä suolen liikkeet; Yleiset häiriöt ja antopaikan haitat: epämukava tunne rinnassa, jano.
Markkinoinnin jälkeinen kokemus
Seuraavia lisähaittavaikutuksia on raportoitu maailmanlaajuisesti markkinoille tulon jälkeen DITROPAN 5 mg XL®:stä. Koska markkinoille tulon jälkeisiä reaktioita on raportoitu vapaaehtoisesti epävarman kokoiselta populaatiolta, ei aina ole mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Infektiot ja infektiot: Virtsatieinfektio; Psyykkiset häiriöt: psykoottinen häiriö, agitaatio, sekavuustila, hallusinaatiot, muistin heikkeneminen, epänormaali käyttäytyminen; Hermoston häiriöt: kouristukset; Silmäsairaudet: glaukooma; Hengityselinten, rintakehän ja välikarsinan häiriöt: nenän tukkoisuus; Sydänhäiriöt: rytmihäiriö, takykardia, sydämentykytys, QT-ajan pidentyminen; Verisuonihäiriöt: punoitus, verenpainetauti; Ihon ja ihonalaisten kudosten häiriöt: ihottuma; Munuaisten ja virtsateiden häiriöt: impotenssi; Yleiset häiriöt ja hallintosivuston ehdot: yliherkkyysreaktiot, mukaan lukien angioödeema, johon liittyy hengitysteiden tukkeutumista, urtikaria ja kasvojen turvotus; anafylaktiset reaktiot, jotka vaativat sairaalahoitoa kiireellistä hoitoa varten; Loukkaantumiset, myrkytykset ja toimenpiteeseen liittyvät komplikaatiot: kaatuminen.
Muita joidenkin muiden oksibutyniinikloridivalmisteiden yhteydessä raportoituja haittavaikutuksia ovat: sykloplegia, mydriaasi ja imetyksen estyminen. Yhdessä raportoidussa tapauksessa oksibutyniinin samanaikainen käyttö karbamatsepiinin ja dantroleenin kanssa liittyi karbamatsepiinin toksisuuteen viittaaviin haittatapahtumiin, kuten oksentelu, uneliaisuus, sekavuus, epävakaus, epäselvä puhe ja nystagmus.
HUUMEIDEN VUOROVAIKUTUKSET
Oksibutyniinin samanaikainen käyttö muiden antikolinergisten lääkkeiden tai muiden aineiden kanssa, jotka aiheuttavat suun kuivumista, ummetusta, uneliaisuutta ja/tai muita antikolinergisen kaltaisia vaikutuksia, voi lisätä tällaisten vaikutusten esiintymistiheyttä ja/tai vakavuutta.
Antikolinergiset aineet voivat mahdollisesti muuttaa joidenkin samanaikaisesti annettujen lääkkeiden imeytymistä ruoansulatuskanavan motiliteettiin kohdistuvien antikolinergisten vaikutusten vuoksi. Tämä voi olla huolestuttavaa lääkkeissä, joilla on kapea terapeuttinen indeksi. Antikolinergiset aineet voivat myös antagonisoida prokineettisten aineiden, kuten metoklopramidin, vaikutuksia.
Keskimääräiset oksibutyniinipitoisuudet plasmassa olivat noin 2 kertaa korkeammat, kun DITROPAN 5 mg XL®:ää annettiin ketokonatsolin kanssa, joka on voimakas CYP3A4:n estäjä. Muut sytokromi P450 3A4 -entsyymijärjestelmän estäjät, kuten antimykoottiset aineet (esim. itrakonatsoli ja mikonatsoli) tai makrolidiantibiootit (esim. erytromysiini ja klaritromysiini), voivat muuttaa oksibutyniinin keskimääräisiä farmakokineettisiä parametreja (eli Cmax ja AUC). Tällaisten mahdollisten yhteisvaikutusten kliinistä merkitystä ei tunneta. Varovaisuutta on noudatettava, kun tällaisia lääkkeitä annetaan samanaikaisesti.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Angioedeema
Kasvojen, huulten, kielen ja/tai kurkunpään angioedeemaa on raportoitu oksibutyniinin käytön yhteydessä. Joissakin tapauksissa angioedeemaa ilmaantui ensimmäisen annoksen jälkeen. Ylempien hengitysteiden turvotukseen liittyvä angioödeema voi olla hengenvaarallinen. Jos kielen, hypofarynksin tai kurkunpään vaurioita esiintyy, oksibutyniinin käyttö on lopetettava välittömästi ja asianmukainen hoito ja/tai tarvittavat toimenpiteet hengitysteiden avoimien varmistamiseksi on annettava viipymättä.
Keskushermoston vaikutukset
Oksibutyniini liittyy antikolinergisiin keskushermostoon (CNS) vaikuttaviin vaikutuksiin [katso HAITTAVAIKUTUKSET ]. Useita keskushermoston antikolinergisiä vaikutuksia on raportoitu, mukaan lukien hallusinaatiot, kiihtyneisyys, sekavuus ja uneliaisuus. Potilaita tulee tarkkailla antikolinergisten keskushermostovaikutusten merkkien varalta, erityisesti muutaman ensimmäisen kuukauden aikana hoidon aloittamisen tai annoksen suurentamisen jälkeen. Neuvo potilaita olemaan ajamatta autoa tai käyttämättä raskaita koneita, ennen kuin he tietävät, kuinka DITROPAN XL® vaikuttaa heihin. Jos potilaalla ilmenee antikolinergisiä keskushermostovaikutuksia, annoksen pienentämistä tai lääkkeen käytön lopettamista tulee harkita.
DITROPAN XL® -valmistetta tulee käyttää varoen potilailla, joilla on dementia ja joita hoidetaan koliiniesteraasin estäjillä oireiden pahenemisriskin vuoksi.
DITROPAN XL® -valmistetta tulee käyttää varoen Parkinsonin tautia sairastavilla potilailla oireiden pahenemisriskin vuoksi.
Myasthenia Gravis -oireiden paheneminen
DITROPAN XL® -valmistetta tulee käyttää varoen potilailla, joilla on myasthenia gravis oireiden pahenemisriskin vuoksi.
Maha-suolikanavan heikentyneen liikkuvuuden oireiden paheneminen potilailla, joilla on autonominen neuropatia
DITROPAN 2,5 mg XL® -valmistetta tulee käyttää varoen potilailla, joilla on autonominen neuropatia, koska maha-suolikanavan motiliteetin heikkenemisen oireet voivat pahentua.
Virtsanpidätys
DITROPAN 5mg XL® -valmistetta tulee antaa varoen potilaille, joilla on kliinisesti merkittävä virtsarakon ulosvirtaustukos virtsaretentioriskin vuoksi [ks. VASTA-AIHEET ].
Ruoansulatuskanavan haittavaikutukset
DITROPAN 2,5 mg XL® -valmistetta tulee antaa varoen potilaille, joilla on maha-suolikanavan ahtauttavia sairauksia mahalaukun retentioriskin vuoksi [ks. VASTA-AIHEET ].
DITROPAN XL®, kuten muutkin antikolinergiset lääkkeet, voi vähentää maha-suolikanavan motiliteettia, ja sitä tulee käyttää varoen potilailla, joilla on sellaisia sairauksia kuin haavainen paksusuolitulehdus ja suoliston atonia.
DITROPAN 2,5 mg XL® -valmistetta tulee käyttää varoen potilailla, joilla on gastroesofageaalinen refluksi ja/tai jotka käyttävät samanaikaisesti lääkkeitä (kuten bisfosfonaatteja), jotka voivat aiheuttaa tai pahentaa esofagiittia.
Kuten mitä tahansa muuta muotoutumatonta materiaalia käytettäessä, varovaisuutta tulee noudattaa annettaessa DITROPAN XL® -valmistetta potilaille, joilla on aiemmin ollut vakava maha-suolikanavan ahtauma (patologinen tai iatrogeeninen). Ahtauttavia oireita on raportoitu harvoin potilailla, joilla on tiedossa olevat ahtaumat muiden ei-muodostumattomien, kontrolloidusti vapauttavien lääkkeiden nauttimisen yhteydessä.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Rotilla tehty 24 kuukauden tutkimus oksibutyniinikloridin annoksilla 20, 80 ja 160 mg/kg/vrk ei osoittanut todisteita karsinogeenisuudesta. Nämä annokset ovat noin 6, 25 ja 50 kertaa ihmisen enimmäisaltistus, joka perustuu ihmisen vastaavaan annokseen ottaen huomioon kehon pinta-alan normalisoitumisen.
Oksibutyniinikloridi ei osoittanut lisäystä mutageenisessa aktiivisuudessa, kun sitä testattiin Schizosaccharomyces pompholiciformis-, Saccharomyces cerevisiae- ja Salmonella typhimurium -testijärjestelmissä.
Lisääntymistutkimukset oksibutyniinikloridilla hiirellä, rotalla, hamsterilla ja kaniinilla eivät osoittaneet merkkejä hedelmällisyyden heikkenemisestä.
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka B
Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia DITROPAN 5mg XL®:n käytöstä raskaana oleville naisille. DITROPAN XL® -valmistetta tulee käyttää raskauden aikana vain, jos mahdollinen hyöty potilaalle on suurempi kuin riski potilaalle ja sikiölle. Naisia, jotka tulevat raskaaksi DITROPAN XL® -hoidon aikana, kehotetaan ottamaan yhteyttä lääkäriin.
Riskien yhteenveto
Eläintietojen perusteella oksibutyniinin ennustetaan lisäävän haitallisten kehitysvaikutusten riskiä taustariskin yläpuolelle.
Eläinten tiedot
Lisääntymistutkimukset oksibutyniinikloridilla hiirellä, rotalla, hamsterilla ja kaniinilla eivät osoittaneet merkkejä heikentyneestä hedelmällisyydestä tai haitasta eläimen sikiölle.
Imettävät äidit
Ei tiedetä, erittyykö oksibutyniini äidinmaitoon. Koska monet lääkkeet erittyvät äidinmaitoon, on noudatettava varovaisuutta, kun DITROPAN 5 mg XL® -valmistetta annetaan imettäville naisille.
Käyttö lapsille
DITROPAN XL®:n turvallisuutta ja tehoa tutkittiin 60 lapsella 24 viikkoa kestäneessä avoimessa, ei-satunnaistetussa tutkimuksessa. Potilaat olivat iältään 6–15-vuotiaita, kaikilla oli neurologiseen sairauteen (esim. spina bifida) liittyviä detrusorin yliaktiivisuuden oireita, kaikki käyttivät puhdasta ajoittaista katetrointia ja kaikki olivat nykyisin oksibutyniinikloridin käyttäjiä. Tutkimustulokset osoittivat, että DITROPAN 2,5 mg XL® 5 - 20 mg/vrk liittyi keskimääräisen virtsan määrän kasvuun lähtötasosta katetrointia kohden 108 ml:sta 136 ml:aan, mikä nousi lähtötasosta keskimääräisessä virtsan tilavuudessa aamun heräämisen jälkeen 148:sta. ml:sta 189 ml:aan ja lisäys perusarvosta katetrointien keskimääräiseen prosenttiosuuteen ilman vuotokohtausta 34 %:sta 51 %:iin.
Urodynaamiset tulokset olivat yhdenmukaisia kliinisten tulosten kanssa. DITROPAN XL®:n antaminen johti keskimääräisen maksimikystometrisen kapasiteetin nousuun lähtötilanteesta 185 ml:sta 254 ml:aan, keskimääräisen detrusor-paineen laskuun lähtötasosta maksimikystometrisen kapasiteetin 44 cm H2O:sta 33 cm H2O:iin ja prosenttiosuuden pienenemiseen. potilaista, joilla on estymättömiä detrusorin supistuksia (vähintään 15 cm HO) 60 %:sta 28 %:iin.
DITROPAN 5mg XL®:n farmakokinetiikka näillä potilailla oli yhdenmukainen aikuisilla raportoitujen kanssa [ks. KLIININEN FARMAKOLOGIA ].
DITROPAN 5mg XL® -valmistetta ei suositella lapsipotilaille, jotka eivät voi niellä tablettia kokonaisena pureskelematta, jakamatta tai murskaamatta, eikä alle 6-vuotiaille lapsille.
Geriatrinen käyttö
Alle 65-vuotiaiden ja 65-vuotiaiden ja sitä vanhempien potilaiden raportoimien antikolinergisten vaikutusten määrä ja vakavuus olivat samanlaisia. DITROPAN XL®:n farmakokinetiikka oli samanlainen kaikilla tutkituilla potilailla (78-vuotiaisiin asti).
Munuaisten vajaatoiminta
DITROPAN XL®:llä ei ole tehty tutkimuksia potilailla, joilla on munuaisten vajaatoiminta.
Maksan vajaatoiminta
DITROPAN 2,5 mg XL®:llä ei ole tehty tutkimuksia potilailla, joilla on maksan vajaatoiminta.
YLIANNOSTUS
Oksibutyniinin jatkuvaa vapautumista DITROPAN 5mg XL®:stä tulee harkita yliannostuksen hoidossa. Potilaita tulee seurata vähintään 24 tunnin ajan. Hoidon tulee olla oireenmukaista ja tukevaa. Katartic voidaan antaa.
Oksibutyniinikloridin yliannostukseen on liitetty antikolinergisiä vaikutuksia, kuten keskushermoston kiihtymistä, punoitusta, kuumetta, kuivumista, sydämen rytmihäiriöitä, oksentelua ja virtsan kertymistä.
100 mg:n oksibutyniinikloridin nauttimista alkoholin yhteydessä on raportoitu 13-vuotiaalla pojalla, joka kärsi muistin heikkenemisestä, ja 34-vuotiaasta naisesta, jolle kehittyi tokkuraisuus, jota seurasi desorientaatio ja agitaatio heräämisen yhteydessä, pupillien laajentuminen, kuivuminen. iho, sydämen rytmihäiriöt ja virtsan kertyminen. Molemmat potilaat toipuivat täysin oireenmukaisella hoidolla.
VASTA-AIHEET
DITROPAN 2,5 mg XL® on vasta-aiheinen potilaille, joilla on virtsanpidätys, mahalaukun retentio ja muut vakavat maha-suolikanavan motiliteettihäiriöt, hallitsematon ahdaskulmaglaukooma.
DITROPAN 2,5 mg XL® on myös vasta-aiheinen potilaille, jotka ovat osoittaneet yliherkkyyttä lääkeaineelle tai muille tuotteen komponenteille. Yliherkkyysreaktioita, mukaan lukien anafylaksia ja angioödeema, on raportoitu.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Oksibutyniini rentouttaa virtsarakon sileää lihasta. Oksibutyniinikloridilla on suora antispasmodinen vaikutus sileään lihakseen ja se estää asetyylikoliinin muskariinivaikutusta sileään lihakseen. Luuston neuromuskulaarisissa liitoksissa tai autonomisissa hermosolmuissa ei esiinny estäviä vaikutuksia (antinikotiinivaikutus).
Antimuskariiniaktiivisuus on pääasiassa R-isomeerissä. Metaboliitilla, desetyylioksibutyniinilla, on in vitro -tutkimuksissa samanlainen farmakologinen vaikutus kuin oksibutyniinilla.
Farmakodynamiikka
Kystometriset tutkimukset ovat osoittaneet, että oksibutyniini lisää virtsarakon (rakkuloiden) kapasiteettia, vähentää detrusorlihaksen estymättömien supistusten esiintymistiheyttä ja viivästyttää alkuvaiheen halukkuutta virtsarakon supistuksiin.
Farmakokinetiikka
Imeytyminen
Ensimmäisen DITROPAN XL® -annoksen jälkeen plasman oksibutyniinipitoisuudet nousevat 4–6 tuntia; sen jälkeen vakaat pitoisuudet säilyvät jopa 24 tuntia, mikä minimoi oksibutyniiniin liittyvien huippu- ja alipitoisuuksien väliset vaihtelut.
DITROPAN XL®:n R- ja S-oksibutyniinin suhteellinen hyötyosuus on 156 % ja 187 % oksibutyniiniin verrattuna. R- ja S-oksibutyniinin keskimääräiset farmakokineettiset parametrit on esitetty taulukossa 2. R- ja S-oksibutyniinin plasmakonsentraatio-aikaprofiilit ovat muodoltaan samanlaisia; Kuvio 1 esittää R-oksibutyniinin profiilia.
Kuva 1: Keskimääräiset R-oksibutyniinin plasmapitoisuudet DITROPAN XL® 10 mg:n ja 5 mg:n oksibutyniinin kerta-annoksen jälkeen annettuna joka 8. tunti (n = 23 kullekin hoidolle).
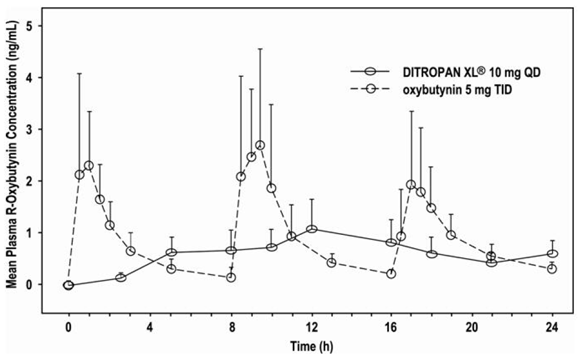
Vakaan tilan oksibutyniinipitoisuudet plasmassa saavutetaan DITROPAN XL®:n toistuvan annostelun 3. päivänä ilman havaittua lääkkeen kertymistä tai muutosta oksibutyniinin ja desetyylioksibutyniinin farmakokineettisissä parametreissa.
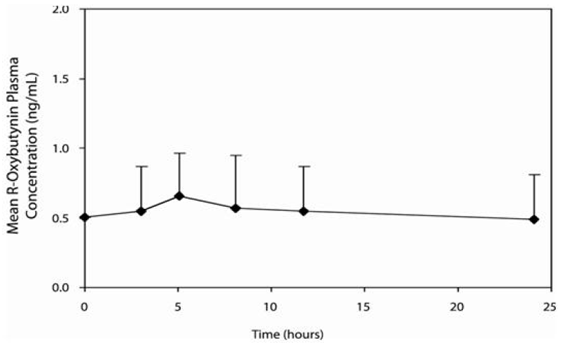
DITROPAN 5 mg XL® vakaan tilan farmakokinetiikkaa tutkittiin 19 lapsella iältään 5–15 vuotta, joilla oli neurologiseen sairauteen (esim. spina bifida) liittyvä detrusorin yliaktiivisuus. Lapset saivat DITROPAN 2,5 mg XL®:n päivittäisen kokonaisannoksen välillä 5-20 mg (0,10-0,77 mg/kg). Seeruminäytteiden saamiseksi käytettiin harvaa näytteenottotekniikkaa. Kun kaikki saatavilla olevat tiedot on normalisoitu vastaamaan 5 mg:aa DITROPAN XL®:ää päivässä, R- ja S-oksibutyniinille sekä R- ja S-desetyylioksibutyniinille johdetut keskimääräiset farmakokineettiset parametrit on esitetty taulukossa 3. Plasman aikaiset pitoisuusprofiilit R- ja S-oksibutyniinit ovat muodoltaan samanlaisia; Kuva 2 esittää R-oksibutyniinin profiilia, kun kaikki saatavilla olevat tiedot on normalisoitu 5 mg:aan vuorokaudessa.
Kuva 2: Keskimääräiset vakaan tilan (± SD) R-oksibutyniinipitoisuudet plasmassa 5–20 mg DITROPAN 5 mg XL®:n kerran vuorokaudessa antamisen jälkeen 5–15-vuotiaille lapsille. Käyrä edustaa kaikkia saatavilla olevia tietoja normalisoituna DITROPAN XL® 5 mg:n annoksella kerran päivässä.
Ruoan vaikutukset
Oksibutyniinin imeytymisnopeus ja -aste ja metabolia ovat samanlaisia ruokailun ja paaston aikana.
Jakelu
Oksibutyniini jakautuu laajalti kehon kudoksiin systeemisen imeytymisen jälkeen. Jakaantumistilavuus on 193 l 5 mg:n oksibutyniinikloridin laskimonsisäisen annon jälkeen. Molemmat oksibutyniinin enantiomeerit sitoutuvat voimakkaasti (> 99 %) plasman proteiineihin. N-desetyylioksibutyniinin molemmat enantiomeerit sitoutuvat myös voimakkaasti (> 97 %) plasman proteiineihin. Pääasiallinen sitoutuva proteiini on alfa-1-glykoproteiini.
Aineenvaihdunta
Oksibutyniini metaboloituu ensisijaisesti sytokromi P450 -entsyymijärjestelmien kautta, erityisesti CYP3A4, jota esiintyy enimmäkseen maksassa ja suoliston seinämässä. Sen aineenvaihduntatuotteita ovat fenyylisykloheksyyliglykolihappo, joka on farmakologisesti inaktiivinen, ja desetyylioksibutyniini, joka on farmakologisesti aktiivinen. DITROPAN 2,5 mg XL®:n antamisen jälkeen R- ja S-desetyylioksibutyniinin pitoisuudet plasmassa ovat 73 % ja 92 % oksibutyniinin yhteydessä havaituista pitoisuuksista.
Erittyminen
Oksibutyniini metaboloituu laajalti maksassa, ja alle 0,1 % annetusta annoksesta erittyy muuttumattomana virtsaan. Lisäksi alle 0,1 % annetusta annoksesta erittyy metaboliittina desetyylioksibutyniinina.
Annoksen suhteellisuus
Oksibutyniinin ja desetyylioksibutyniinin farmakokineettiset parametrit (Cmax ja AUC) 5–20 mg DITROPAN 5 mg XL®:n antamisen jälkeen ovat suhteessa annokseen.
Käyttö tietyissä populaatioissa
Pediatriset
DITROPAN 2,5 mg XL®:n farmakokinetiikkaa arvioitiin 19 lapsella iältään 5–15 vuotta, joilla oli neurologiseen sairauteen (esim. spina bifida) liittyvä detrusorin yliaktiivisuus. DITROPAN 2,5 mg XL®:n farmakokinetiikka näillä lapsipotilailla vastasi aikuisilla raportoituja (ks. taulukot 2 ja 3 sekä kuvat 1 ja 2 yllä).
Sukupuoli
Oksibutyniinin farmakokinetiikassa ei ole merkittäviä eroja terveillä vapaaehtoisilla miehillä ja naisilla DITROPAN 2,5 mg XL®:n antamisen jälkeen.
Rotu
Saatavilla olevat tiedot viittaavat siihen, että oksibutyniinin farmakokinetiikassa ei ole merkittäviä eroja rodun perusteella terveillä vapaaehtoisilla DITROPAN 2,5 mg XL®:n antamisen jälkeen.
Kliiniset tutkimukset
DITROPAN 5mg XL® arvioitiin kolmessa kontrolloidussa tehokkuustutkimuksessa potilaiden hoitoon, joilla oli yliaktiivinen virtsarakko ja joilla oli virtsanpidätyskyvyttömyyden, kiireellisyyden ja tiheyden oireita. Suurin osa potilaista oli valkoihoisia (89,0 %) ja naisia (91,9 %), joiden keski-ikä oli 59 vuotta (vaihteluväli 18–98 vuotta). Osallistumiskriteerit edellyttivät, että potilailla on pakko- tai sekainkontinenssi (ensisijaisesti pakkoinkontinenssi), mistä on osoituksena ≥ 6 pakkoinkontinenssijaksoa viikossa ja ≥ 10 virtsaamiskertaa päivässä. Tutkimus 1 oli kiinteän annoksen nostosuunnitelma, kun taas kahdessa muussa tutkimuksessa käytettiin annoksen säätösuunnitelmaa, jossa kunkin potilaan lopullinen annos säädettiin tasapainoon inkontinenssin oireiden paranemisen ja sivuvaikutusten siedettävyyden välillä. Kaikkiin kolmeen tutkimukseen osallistui potilaita, joiden tiedettiin reagoivan oksibutyniiniin tai muihin antikolinergisiin lääkkeisiin, ja näitä potilaita pidettiin viimeisellä annoksella enintään 2 viikkoa.
Kolmen kontrolloidun tutkimuksen tehokkuustulokset on esitetty seuraavissa taulukoissa 4, 5 ja 6 sekä kuvissa 3, 4 ja 5.
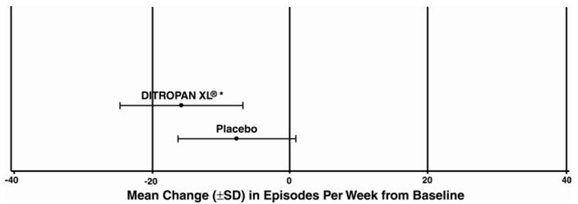
Kuva 3: Keskimääräinen muutos (±SD) virtsankarkailujaksoissa viikossa lähtötilanteesta (tutkimus 1)
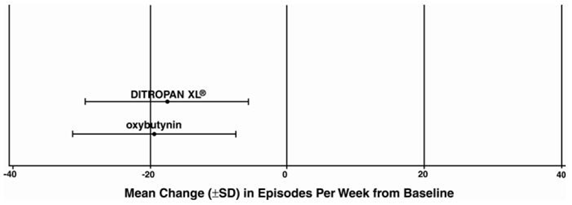
Kuva 4: Keskimääräinen muutos (±SD) virtsankarkailujaksoissa viikossa lähtötilanteesta (tutkimus 2)
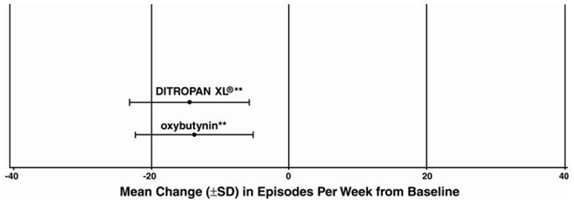
Kuva 5: Keskimääräinen muutos (±SD) virtsankarkailujaksoissa viikossa lähtötilanteesta (tutkimus 3)
POTILASTIEDOT
- Potilaille tulee kertoa, että oksibutyniini voi aiheuttaa angioedeeman, joka voi johtaa hengenvaaralliseen hengitysteiden tukkeutumiseen. Potilaita tulee neuvoa lopettamaan viipymättä oksibutyniinihoito ja hakeutumaan välittömästi lääkärin hoitoon, jos heillä on kielen turvotusta, kurkunpään turvotusta tai hengitysvaikeuksia.
- Potilaille tulee kertoa, että antikolinergiset (antimuskariiniset) aineet, kuten DITROPAN XL®, voivat aiheuttaa kliinisesti merkittäviä antikolinergiseen aktiivisuuteen liittyviä haittavaikutuksia, kuten:
- Virtsanpidätys ja ummetus
- Kuuma uupumus vähentyneen hikoilun vuoksi. Kuumuutta voi esiintyä, kun antikolinergisiä lääkkeitä annetaan korkeassa ympäristön lämpötilassa.
- Potilaille tulee kertoa, että antikolinergiset lääkkeet, kuten DITROPAN 5 mg XL®, voivat aiheuttaa uneliaisuutta (unieliaisuutta), huimausta tai näön hämärtymistä. Potilaita tulee neuvoa olemaan varovaisia tehdessään päätöksiä mahdollisesti vaarallisista toimista, kunnes DITROPAN XL®:n vaikutukset on määritetty.
- Potilaille tulee kertoa, että alkoholi voi lisätä antikolinergisten aineiden, kuten DITROPAN XL®:n, aiheuttamaa uneliaisuutta.
- Potilaita tulee kertoa, että DITROPAN 5mg XL® tulee niellä kokonaisena nesteen avulla. Potilaat eivät saa pureskella, jakaa tai murskata tabletteja. Lääke on imeytymättömän kuoren sisällä, joka on suunniteltu vapauttamaan lääkettä kontrolloidulla nopeudella. Tabletin kuori poistuu kehosta; potilaiden ei pitäisi olla huolissaan, jos he huomaavat toisinaan ulosteessa jotain, joka näyttää tabletilta.
- DITROPAN 5mg XL® tulee ottaa suunnilleen samaan aikaan joka päivä.
