Imitrex 100mg, 25mg, 50mg Sumatriptan Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Imitrex 25mg on ja miten sitä käytetään?
Imitrex 100mg on reseptilääke, jota käytetään migreenipäänsäryn ja klusteripäänsäryn oireiden hoitoon. Imitrexiä voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Imitrex 50mg on migreenin vastainen aine, seratoniini 5-HT-reseptoriagonisti.
Ei tiedetä, onko Imitrex 50 mg turvallinen ja tehokas alle 18-vuotiaille lapsille, eikä käyttöä suositella iäkkäille potilaille.
Mitkä ovat Imitrex 50mg:n mahdolliset sivuvaikutukset?
Imitrex 25 mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- äkillinen, voimakas vatsakipu,
- ripuli veren kanssa tai ilman,
- kova rintakipu,
- kipu leuassa tai olkapäässä,
- hengenahdistus,
- epäsäännölliset sydämenlyönnit,
- kohtaukset (kouristukset),
- jalkakrampit,
- tunnottomuus tai pistely jaloissasi,
- polttava kipu jaloissasi,
- kylmä tunne jaloissasi,
- värimuutoksia jaloissasi,
- lonkkakipu,
- pahoinvointi,
- oksentelua,
- hikoilu tai vilunväristykset,
- agitaatio,
- hallusinaatiot,
- kuume,
- lihasten jäykkyys,
- koordinaation menetys,
- äkillinen puutuminen tai heikkous toisella kehon puolella,
- sammaltava puhe,
- vaikeus nähdä,
- huono tasapaino ja
- äkillinen voimakas päänsärky
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Imitrexin yleisimpiä sivuvaikutuksia ovat:
- kipua tai puristavaa tunnetta rinnassa, kurkussa tai leuassa,
- paine missä tahansa kehon osassa,
- tunnottomuus tai pistely,
- kuuma tai kylmä tunne,
- huimaus,
- uneliaisuus,
- heikkous,
- epämiellyttävä maku nenälääkkeen käytön jälkeen,
- kipu, polttava tunne, puutuminen tai pistely nenässäsi tai kurkussasi nenälääkkeen käytön jälkeen, ja
- vuotava tai tukkoinen nenä nenälääkkeen käytön jälkeen
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Imitrexin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
IMITREX 50 mg injektio sisältää sumatriptaanisukkinaattia, selektiivistä 5-HT1B/1D-reseptorin agonistia. Sumatriptaanisukkinaatti on kemiallisesti nimetty 3-[2-(dimetyyliamino)etyyli]-N-metyyli-indoli-5-metaanisulfonamidisukkinaatiksi (1:1), ja sillä on seuraava rakenne:
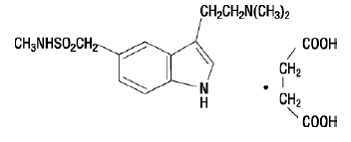
Empiirinen kaava on C14H21N3O2S•C4H6O4, joka edustaa molekyylipainoa 413,5. Sumatriptaanisukkinaatti on valkoinen tai luonnonvalkoinen jauhe, joka liukenee helposti veteen ja suolaliuokseen.
IMITREX-injektio on kirkas, väritön tai vaaleankeltainen, steriili, ei-pyrogeeninen liuos ihonalaiseen injektioon. Jokainen 0,5 ml IMITREX-injektioliuosta 8 mg/ml sisältää 4 mg sumatriptaania (emästä) sukkinaattisuolana ja 3,8 mg natriumkloridia, USP injektiovedessä, USP. Jokainen 0,5 ml IMITREX-injektioliuosta 12 mg/ml sisältää 6 mg sumatriptaania (emästä) sukkinaattisuolana ja 3,5 mg natriumkloridia, USP injektiovedessä, USP. Molempien liuosten pH-alue on noin 4,2 - 5,3. Molempien injektioiden osmolaliteetti on 291 mOsmol.
INDIKAATIOT
IMITREX®-injektio on tarkoitettu aikuisille (1) auran kanssa tai ilman migreenin akuuttiin hoitoon ja (2) klusteripäänsäryn akuuttiin hoitoon.
Käyttörajoitukset
- Käytä vain, jos migreenin tai ryhmäpäänsäryn selkeä diagnoosi on määritetty. Jos potilas ei reagoi ensimmäiseen IMITREX 50 mg -injektiolla hoidettuun migreeni- tai klusteripäänsärkykohtaukseen, harkitse diagnoosia uudelleen ennen kuin IMITREX-injektio annetaan myöhempien kohtausten hoitamiseksi.
- IMITREX-injektio ei ole tarkoitettu migreenin tai klusteripäänsärkykohtausten ehkäisyyn.
ANNOSTELU JA HALLINNOINTI
Annostelutiedot
Suurin suositeltu IMITREX 25 mg -injektion kerta-annos aikuisille migreenin tai klusteripäänsäryn akuutin hoitoon on 6 mg ihonalaisesti ruiskutettuna. Jos sivuvaikutukset ovat annosta rajoittavia, migreenin hoidossa voidaan käyttää pienempiä annoksia (1–5 mg) [ks. Kliiniset tutkimukset ]. Klusteripäänsäryn hoidossa pienempien annosten tehoa ei ole osoitettu.
Suurin kumulatiivinen annos, joka voidaan antaa 24 tunnissa, on 12 mg, kaksi 6 mg:n injektiota, joiden välillä on vähintään 1 tunti. Toista 6 mg:n annosta tulee harkita vain, jos havaitaan jonkinlainen vaste ensimmäiseen injektioon.
Anto IMITREX STATdose Pen® -kynällä
Autoinjektori (IMITREX 25 mg STATdose Pen) on saatavana käytettäväksi 4 mg:n ja 6 mg:n esitäytettyjen ruiskujen kanssa. Tällä laitteella neula tunkeutuu noin 1/4 tuumaa (5–6 mm). Injektio on tarkoitettu annettavaksi ihon alle, ja lihaksensisäistä tai suonensisäistä antoa on vältettävä. Opeta potilaita käyttämään IMITREX 100 mg STATdose Pen -kynää oikein ja ohjaa heitä käyttämään pistoskohtia, joissa iho ja ihonalainen paksuus on riittävä neulan pituuden mukaiseksi.
Muiden kuin 4 tai 6 mg IMITREX-annosten anto
Potilaille, jotka saavat muita kuin 4 mg tai 6 mg annoksia, käytä 6 mg:n kerta-annoksen injektiopulloa; älä käytä IMITREX 50 mg STATdose Pen -kynää. Tarkista silmämääräisesti, ettei injektiopullossa ole hiukkasia ja värimuutoksia ennen antoa. Älä käytä, jos havaitset hiukkasia tai värimuutoksia.
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
- Injektio: 4 mg:n ja 6 mg:n kerta-annoksen esitäytetyt ruiskupatruunat käytettäväksi IMITREX STATdose Pen -kynän kanssa.
- Injektio: 6 mg:n kerta-annospullo.
Varastointi ja käsittely
IMITREX 100 mg injektio sisältää sumatriptaania (emästä) sukkinaattisuolana ja toimitetaan kirkkaana, värittömänä tai vaaleankeltaisena, steriilinä, ei-pyrogeenisenä liuoksena seuraavasti:
Esitäytetty ruisku ja/tai automaattinen injektorikynä
Jokainen pakkaus sisältää potilastiedot ja potilasohjeet.
IMITREX 100 mg STATdose System®, 4 mg , sisältää 1 IMITREX 25 mg STATdose Pen, 2 esitäytettyä kerta-annosruiskun sylinteriampullia ja 1 kantolaukun ( NDC 0173-0739-00).
IMITREX 100mg STATdose System, 6 mg sisältää 1 IMITREX STATdose Pen, 2 esitäytettyä kerta-annosruiskun sylinteriampullia ja 1 kantolaukun ( NDC 0173-0479-00).
Kaksi 4 mg:n kerta-annoksen esitäytettyä ruiskua patruunat käytettäväksi IMITREX STATdose Systemin kanssa ( NDC 0173-0739-02).
Kaksi 6 mg:n kerta-annoksen esitäytettyä ruiskua patruunat käytettäväksi IMITREX 25mg STATdose Systemin kanssa ( NDC 0173-0478-00).
Yhden annoksen injektiopullo
IMITREX 25 mg kerta-annos injektiopullo (6 mg/0,5 ml) laatikoissa, joissa on 5 injektiopulloa ( NDC 01730449-02).
Säilytä 2–30 °C (36–86 °F). Suojaa valolta.
GlaxoSmithKline, Research Triangle Park, NC 27709
SIVUVAIKUTUKSET
Seuraavat vakavat haittavaikutukset on kuvattu alla ja muualla merkinnöissä:
- Sydänlihasiskemia, sydäninfarkti ja Prinzmetalin angina pectoris [ks. VAROITUKSET JA VAROTOIMET ]
- Rytmihäiriöt [katso VAROITUKSET JA VAROTOIMET ]
- Rinta, kurkku, niska ja/tai leuan kipu/puristus/paine [katso VAROITUKSET JA VAROTOIMET ]
- Aivoverisuonitapahtumat [katso VAROITUKSET JA VAROTOIMET ]
- Muut vasospasmireaktiot [katso VAROITUKSET JA VAROTOIMET ]
- Lääkkeiden liiallinen päänsärky [katso VAROITUKSET JA VAROTOIMET ]
- Serotoniinioireyhtymä [katso VAROITUKSET JA VAROTOIMET ]
- Verenpaineen nousu [katso VAROITUKSET JA VAROTOIMET ]
- Yliherkkyysreaktiot [ks VASTA-AIHEET , VAROITUKSET JA VAROTOIMET ]
- Kohtaukset [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Migreeni
Taulukossa 1 luetellaan haittavaikutukset, jotka ilmenivät kahdessa USA:n lumekontrolloidussa kliinisessä tutkimuksessa migreenipotilailla (tutkimukset 2 ja 3) joko kerta-annoksen 6 mg:n IMITREX 100 mg -injektiota tai lumelääkettä jälkeen. Taulukkoon 1 on sisällytetty vain reaktiot, joiden esiintymistiheys oli vähintään 2 % ryhmissä, joita hoidettiin IMITREX-injektiolla 6 mg ja jotka esiintyivät useammin kuin lumeryhmässä.
Potilaiden sukupuoli tai ikä ei vaikuttanut haittavaikutusten ilmaantumiseen kontrolloiduissa kliinisissä tutkimuksissa. Ei ollut riittävästi tietoa rodun vaikutuksen arvioimiseksi haittavaikutusten ilmaantuvuuteen.
Klusterin päänsärky
Kontrolloiduissa kliinisissä tutkimuksissa, joissa arvioitiin IMITREX 50 mg -injektion tehoa klusteripäänsäryn hoidossa (tutkimukset 4 ja 5), ei havaittu uusia merkittäviä haittavaikutuksia, joita ei olisi jo tunnistettu IMITREX 100 mg:n tutkimuksissa migreenipotilailla.
Kaiken kaikkiaan klusteripäänsärkytutkimuksissa raportoitujen haittavaikutusten esiintymistiheys oli yleensä pienempi kuin migreenitutkimuksissa. Poikkeuksia ovat raportoidut tuntohäiriöt (5 % IMITREX, 0 % lumelääke), pahoinvointi ja oksentelu (4 % IMITREX, 0 % lumelääke) ja bronkospasmi (1 % IMITREX 50 mg, 0 % lumelääke).
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu IMITREX 50 mg -tablettien, IMITREX-nenäsumutteen ja IMITREX 50 mg -injektion hyväksymisen jälkeen. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Kardiovaskulaarinen
Hypotensio, sydämentykytys.
Neurologinen
Dystonia, vapina.
HUUMEIDEN VUOROVAIKUTUKSET
Ergot sisältävät lääkkeet
Ergota sisältävien lääkkeiden on raportoitu aiheuttavan pitkittyneitä vasospastisia reaktioita. Koska nämä vaikutukset voivat olla additiivisia, ergotamiinia sisältävien tai ergot-tyyppisten lääkkeiden (kuten dihydroergotamiinin tai metysergidin) ja IMITREX 25 mg -injektion käyttö 24 tunnin sisällä toisistaan on vasta-aiheista.
Monoamiinioksidaasi-A:n estäjät
MAO-A:n estäjät lisäävät systeemistä altistusta kaksinkertaiseksi. Siksi IMITREX-injektion käyttö potilailla, jotka saavat MAO-A:n estäjiä, on vasta-aiheista [ks. KLIININEN FARMAKOLOGIA ].
Muut 5-HT1-agonistit
Koska niiden vasospastiset vaikutukset voivat olla additiivisia, IMITREX-injektion ja muiden 5-HT1-agonistien (esim. triptaanien) samanaikainen anto 24 tunnin sisällä toisistaan on vasta-aiheista.
Selektiiviset serotoniinin takaisinoton estäjät / serotoniinin norepinefriinin takaisinoton estäjät ja serotoniinioireyhtymä
Serotoniinioireyhtymän tapauksia on raportoitu, kun triptaaneja ja SSRI-lääkkeitä, SNRI-lääkkeitä, TCA:ita ja MAO-estäjiä on annettu samanaikaisesti [ks. VAROITUKSET JA VAROTOIMET ].
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Sydänlihasiskemia, sydäninfarkti ja Prinzmetalin angina
IMITREX-injektion käyttö on vasta-aiheista potilailla, joilla on iskeeminen tai vasospastinen CAD. Vakavista sydämeen kohdistuvista haittavaikutuksista, mukaan lukien akuutti sydäninfarkti, on raportoitu harvoin muutaman tunnin sisällä IMITREX-injektion antamisesta. Jotkut näistä reaktioista esiintyivät potilailla, joilla ei ollut tiedossa olevaa sepelvaltimotautia. IMITREX 100mg -injektio voi aiheuttaa sepelvaltimon vasospasmin (Prinzmetalin angina pectoris), jopa potilailla, joilla ei ole aiemmin ollut sepelvaltimotautia.
Suorita kardiovaskulaarinen arviointi potilaille, jotka eivät ole aiemmin saaneet triptaania ja joilla on useita kardiovaskulaarisia riskitekijöitä (esim. iän nousu, diabetes, verenpainetauti, tupakointi, liikalihavuus, vahva suvussa esiintynyt sepelvaltimotauti) ennen IMITREX-injektion saamista. Jos on näyttöä CAD- tai sepelvaltimon vasospasmista, IMITREX 100 mg -injektio on vasta-aiheinen. Potilaille, joilla on useita kardiovaskulaarisia riskitekijöitä ja joiden kardiovaskulaarinen arviointi on negatiivinen, harkitse ensimmäisen IMITREX-annoksen antamista lääketieteellisesti valvotussa ympäristössä ja EKG:n tekemistä välittömästi IMITREX-injektion annon jälkeen. Harkitse tällaisilla potilailla säännöllistä kardiovaskulaarista arviointia IMITREX 100 mg -injektion satunnaisten ja pitkäaikaisten käyttäjien kohdalla.
Rytmihäiriöt
Henkeä uhkaavia sydämen rytmihäiriöitä, mukaan lukien kammiotakykardia ja kuolemaan johtanut kammiovärinä, on raportoitu muutaman tunnin sisällä 5-HT1-agonistien annon jälkeen. Lopeta IMITREX-injektio, jos näitä häiriöitä ilmenee. IMITREX-injektio on vasta-aiheinen potilailla, joilla on Wolff-Parkinson-Whiten oireyhtymä tai rytmihäiriöt, jotka liittyvät muihin sydämen johtavuushäiriöihin.
Rinta-, kurkku-, niska- ja/tai leuan kipu/kireys/paine
Puristavaa, kipua, painetta ja raskauden tunnetta sydänlihaksessa, kurkussa, niskassa ja leuassa esiintyy yleensä IMITREX-injektiohoidon jälkeen, ja ne eivät yleensä ole peräisin sydämestä. Suorita kuitenkin sydänarviointi, jos näillä potilailla on suuri sydänriski. IMITREX-injektion käyttö on vasta-aiheista potilailla, joilla on sepelvaltimotauti ja Prinzmetalin variantti angina pectoris.
Aivoverisuonitapahtumat
Aivoverenvuotoa, subarachnoidaalista verenvuotoa ja aivohalvausta on esiintynyt potilailla, joita on hoidettu 5-HT1-agonisteilla, ja jotkut ovat johtaneet kuolemaan. Useissa tapauksissa näyttää mahdolliselta, että aivoverisuonitapahtumat olivat ensisijaisia, kun 5-HT1-agonistia on annettu siinä väärässä uskossa, että koetut oireet olivat seurausta migreenistä, vaikka niitä ei ollutkaan. Myös migreenipotilailla saattaa olla lisääntynyt riski saada tiettyjä aivoverisuonitapahtumia (esim. aivohalvaus, verenvuoto, TIA). Lopeta IMITREX-injektio, jos ilmenee aivoverisuonitapahtuma.
Ennen päänsäryn hoitoa potilailla, joilla ei ole aiemmin diagnosoitu migreeniä tai klusteripäänsärkyä, tai potilailla, joilla on epätyypillisiä oireita, sulje pois muut mahdollisesti vakavat neurologiset sairaudet. IMITREX-injektio on vasta-aiheinen potilaille, joilla on ollut aivohalvaus tai TIA.
Muut vasospasmireaktiot
IMITREX 25 mg -injektio voi aiheuttaa ei-sepelvaltimoiden vasospastisia reaktioita, kuten perifeeristä verisuoniiskemiaa, maha-suolikanavan verisuoniiskemiaa ja infarktia (johon liittyy vatsakipua ja veristä ripulia), pernainfarktin ja Raynaud'n oireyhtymän. Jos potilaalla ilmenee ei-sepelvaltimon vasospasmireaktioon viittaavia oireita tai merkkejä minkä tahansa 5-HT1-agonistin käytön jälkeen, sulje pois vasospastinen reaktio ennen kuin saa uusia IMITREX-injektioita.
5-HT1-agonistien käytön yhteydessä on raportoitu ohimenevää ja pysyvää sokeutta ja merkittävää osittaista näönmenetystä. Koska näköhäiriöt voivat olla osa migreenikohtausta, syy-yhteyttä näiden tapahtumien ja 5-HT1-agonistien käytön välillä ei ole selkeästi osoitettu.
Lääkkeiden liikakäyttö Päänsärky
Akuutin migreenilääkkeiden (esim. ergotamiinin, triptaanien, opioidien tai näiden lääkkeiden yhdistelmän) liiallinen käyttö vähintään 10 päivää kuukaudessa voi johtaa päänsäryn pahenemiseen (lääkkeiden liikakäyttöpäänsärky). Lääkkeiden liikakäyttöinen päänsärky voi ilmetä migreenin kaltaisena päivittäisenä päänsärynä tai migreenikohtausten esiintymistiheyden huomattavana lisääntymisenä. Potilaiden vieroitus, mukaan lukien liiallisesti käytettyjen lääkkeiden lopettaminen, ja vieroitusoireiden hoito (joihin usein sisältyy päänsäryn ohimenevä paheneminen) voi olla tarpeen.
Serotoniinin oireyhtymä
Serotoniinioireyhtymää voi esiintyä IMITREX-injektion yhteydessä, erityisesti käytettäessä samanaikaisesti selektiivisiä serotoniinin takaisinoton estäjiä (SSRI), serotoniinin norepinefriinin takaisinoton estäjiä (SNRI), trisyklisiä masennuslääkkeitä (TCA) ja MAO-estäjiä [ks. HUUMEIDEN VUOROVAIKUTUKSET ]. Serotoniinioireyhtymän oireita voivat olla mielentilan muutokset (esim. kiihtyneisyys, hallusinaatiot, kooma), autonominen epävakaus (esim. takykardia, labiili verenpaine, hypertermia), hermo-lihaspoikkeavuuksia (esim. hyperrefleksia, koordinaatiohäiriö) ja/tai maha-suolikanavan oireet (esim. pahoinvointi, oksentelu, ripuli). Oireet alkavat yleensä minuuteissa tai tunneissa uuden tai suuremman serotonergisen lääkkeen annoksen saamisesta. Lopeta IMITREX-injektio, jos epäillään serotoniinioireyhtymää.
Verenpaineen nousu
Merkittävää verenpaineen nousua, mukaan lukien hypertensiivinen kriisi ja akuutti elinjärjestelmien vajaatoiminta, on raportoitu harvoin potilailla, joita on hoidettu 5-HT1-agonisteilla, mukaan lukien potilaat, joilla ei ole ollut hypertensiota. Seuraa verenpainetta potilailla, joita hoidetaan IMITREXillä. IMITREX-injektio on vasta-aiheinen potilaille, joilla on hallitsematon verenpaine.
Anafylaktiset/anafylaktoidiset reaktiot
Anafylaktisia/anafylaktoidisia reaktioita on esiintynyt potilailla, jotka ovat saaneet IMITREXiä. Tällaiset reaktiot voivat olla hengenvaarallisia tai tappavia. Yleisesti ottaen anafylaktisia reaktioita lääkkeisiin esiintyy todennäköisemmin henkilöillä, jotka ovat olleet herkkiä useille allergeeneille. IMITREX 50 mg -injektio on vasta-aiheinen potilaille, joilla on aiemmin ollut yliherkkyysreaktio IMITREXille.
Kohtaukset
Kouristuskohtauksia on raportoitu IMITREXin annon jälkeen. Joitakin on esiintynyt potilailla, joilla on ollut kouristuskohtauksia tai samanaikaisia kouristuskohtauksille alttiita tiloja. On myös raportoitu potilaista, joilla ei ole ilmeisiä tällaisia altistavia tekijöitä. IMITREX-injektiota tulee käyttää varoen potilailla, joilla on aiemmin ollut epilepsia tai sairauksia, joihin liittyy alentunut kohtauskynnys.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( POTILASTIEDOT ja käyttöohjeet ).
Sydäniskemian ja/tai infarktin, Prinzmetalin angina pectoriksen, muiden vasospasmiin liittyvien tapahtumien, rytmihäiriöiden ja aivoverisuonitapahtumien riski
Kerro potilaille, että IMITREX 50 mg -injektio voi aiheuttaa vakavia kardiovaskulaarisia sivuvaikutuksia, kuten sydäninfarktin tai aivohalvauksen. Vaikka vakavia sydän- ja verisuonitapahtumia voi ilmaantua ilman varoittavia oireita, potilaiden tulee olla varuillaan rintakivun, hengenahdistuksen, epäsäännöllisen sydämen sykkeen, merkittävän verenpaineen nousun, heikkouden ja puheen sumeistumisen merkeissä ja oireissa, ja heidän tulee kysyä lääkärin apua, jos viittaavia merkkejä tai oireita havaitaan. Ilmoita potilaille tämän seurannan tärkeydestä [katso VAROITUKSET JA VAROTOIMET ].
Anafylaktiset/anafylaktoidiset reaktiot
Kerro potilaille, että anafylaktisia/anafylaktoidisia reaktioita on esiintynyt potilailla, jotka ovat saaneet IMITREX 100 mg -injektiota. Tällaiset reaktiot voivat olla hengenvaarallisia tai tappavia. Yleensä anafylaktisia reaktioita lääkkeisiin esiintyy todennäköisemmin henkilöillä, jotka ovat aiemmin olleet herkkiä useille allergeeneille [ks. VASTA-AIHEET , VAROITUKSET JA VAROTOIMET ].
Samanaikainen käyttö muiden triptaanien tai torajyvälääkkeiden kanssa
Kerro potilaille, että IMITREX 50 mg -injektion käyttö 24 tunnin sisällä toisesta triptaanista tai torajyvätyyppisestä lääkkeestä (mukaan lukien dihydroergotamiini tai metysergidi) on vasta-aiheista [ks. VASTA-AIHEET , HUUMEIDEN VUOROVAIKUTUKSET ].
Serotoniinin oireyhtymä
Varo potilaita serotoniinioireyhtymän riskistä käytettäessä IMITREX-injektiota tai muita triptaaneja, erityisesti käytettäessä yhdessä SSRI-, SNRI-, TCA- ja MAO-estäjien kanssa [ks. VAROITUKSET JA VAROTOIMET , HUUMEIDEN VUOROVAIKUTUKSET ].
Lääkkeiden liikakäyttö Päänsärky
Kerro potilaille, että akuutin migreenilääkkeiden käyttö vähintään 10 päivää kuukaudessa voi johtaa päänsäryn pahenemiseen ja rohkaista potilaita kirjaamaan päänsäryn esiintymistiheys ja huumeiden käyttö (esim. pitämällä päänsärkypäiväkirjaa) [ks. VAROITUKSET JA VAROTOIMET ].
Raskaus
Kerro potilaille, että IMITREX 25 mg -injektiota ei tule käyttää raskauden aikana, ellei mahdollinen hyöty oikeuta sikiölle mahdollisesti aiheutuvaa riskiä [ks. Käyttö tietyissä populaatioissa ].
Imettävät äidit
Neuvo potilaita ilmoittamaan terveydenhuollon tarjoajalleen, jos he imettävät tai suunnittelevat imetystä [katso Käyttö tietyissä populaatioissa ].
Kyky suorittaa monimutkaisia tehtäviä
Hoito IMITREX 25 mg injektiolla voi aiheuttaa uneliaisuutta ja huimausta; neuvoa potilaita arvioimaan kykyään suorittaa monimutkaisia tehtäviä IMITREX 25 mg -injektion jälkeen.
Kuinka käyttää IMITREX 100 mg -injektiota
Anna potilaille ohjeet IMITREX 100 mg -injektion oikeasta käytöstä, jos he voivat antaa IMITREX 50 mg -injektion itse lääketieteellisesti valvomattomissa tilanteissa.
Kerro potilaille, että IMITREX STATdose Pen -kynän neula tunkeutuu noin 1/4 tuumaa (5–6 mm). Kerro potilaille, että injektio on tarkoitettu annettavaksi ihon alle ja että intramuskulaarista tai suonensisäistä antamista tulee välttää. Neuvo potilaita käyttämään pistoskohtia, joissa iho ja ihonalainen paksuus on riittävä neulan pituuden mukaiseksi.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Karsinogeenisuustutkimuksissa hiirillä ja rotilla, joissa sumatriptaania annettiin suun kautta 78 viikon ajan ja 104 viikon ajan, annoksina 160 mg/kg/vrk (suurin annos rotalla pienennettiin 360 mg/kg/vrk viikolla 21) ). Suurin annos hiirille ja rotille oli noin 130 ja 260 kertaa suurempi kuin yksittäinen MRHD 6 mg annettuna ihonalaisesti mg/m²:n perusteella. Kummallakaan lajilla ei havaittu näyttöä sumatriptaanin antamiseen liittyvästä kasvainten lisääntymisestä.
Mutageneesi
Sumatriptaani oli negatiivinen in vitro (bakteerien käänteismutaatio [Ames], geenisolumutaatio kiinanhamsterin V79/HGPRT, kromosomipoikkeavuus ihmisen lymfosyyteissä) ja in vivo (rotan mikrotuma) määrityksissä.
Hedelmällisyyden heikkeneminen
Kun sumatriptaania annettiin ihonalaisena injektiona uros- ja naarasrotille ennen parittelujaksoa ja sen aikana, ei havaittu hedelmällisyyden heikkenemistä annoksilla 60 mg/kg/vrk tai noin 100 kertaa ihmisen 6 mg:n kerta-annoksiin verrattuna. mg/m² perusteella. Kun sumatriptaania (5, 50, 500 mg/kg/vrk) annettiin suun kautta uros- ja naarasrotille ennen parittelujaksoa ja koko sen ajan, havaittiin hoitoon liittyvä hedelmällisyyden heikkeneminen parittelun vähenemisen seurauksena annoksilla hoidetuilla eläimillä. yli 5 mg/kg/vrk. Ei ole selvää, johtuiko tämä löydö vaikutuksesta miehiin vai naisiin vai molempiin.
Käyttö tietyissä populaatioissa
Raskaus
Raskausluokka C
Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia IMITREX 50 mg -injektiosta raskaana oleville naisille. Rotilla ja kaniineilla tehdyissä kehitystoksisuustutkimuksissa sumatriptaanin oraalinen antaminen tiineille eläimille liittyi alkiokuolleisuuteen, sikiön poikkeavuuksiin ja pentujen kuolleisuuteen. Kun sumatriptaani annettiin suonensisäisesti tiineille kaniineille, se oli alkiokuolettava. IMITREX 100 mg -injektiota tulee käyttää raskauden aikana vain, jos mahdollinen hyöty oikeuttaa sikiölle mahdollisesti aiheutuvan riskin.
Sumatriptaanin oraalinen antaminen tiineille rotille organogeneesin aikana johti lisääntyneeseen sikiön verisuonten (kohdunkaulan ja napa-alueen) poikkeavuuksien ilmaantumiseen. Suurin vaikutukseton annos alkion ja sikiön kehitystoksisuuteen oli 60 mg/kg/vrk eli noin 100 kertaa suurempi kuin ihmiselle suositeltu kerta-annos (MRHD) 6 mg ihonalaisesti annettuna mg/m²:n perusteella. Sumatriptaanin oraalinen antaminen tiineille kaniineille organogeneesin aikana johti lisääntyneeseen alkiokuolleisuuden ja sikiön kohdunkaulan verisuonten ja luuston poikkeavuuksien ilmaantumiseen. Sumatriptaanin suonensisäinen antaminen tiineille kaniineille organogeneesin aikana johti lisääntyneeseen alkiokuolleisuuden ilmaantumiseen. Suurimmat suun kautta ja suonensisäisesti vaikuttamattomat annokset kehitysmyrkyllisyydelle kaneilla olivat 15 ja 0,75 mg/kg/vrk tai vastaavasti noin 50 ja 2 kertaa suurempi kuin kerta-annos 6 mg annettuna ihonalaisesti mg/m²:n perusteella.
Sumatriptaanin oraalinen antaminen rotille ennen tiineyttä ja sen aikana johti alkio- ja sikiötoksisuuteen (kehon painon lasku, luutumisen vähentyminen, luuston poikkeavuuksien lisääntyminen). Suurin vaikutukseton annos oli 50 mg/kg/vrk eli noin 80 kertaa suurempi kuin yksittäinen MRHD 6 mg annettuna ihonalaisesti mg/m²:n perusteella. Sumatriptaanilla oraalisesti oraalisesti organogeneesin aikana saaneiden rottien jälkeläisillä poikasten eloonjääminen väheni. Suurin vaikutukseton annos tälle vaikutukselle oli 60 mg/kg/vrk tai noin 100 kertaa suurempi kuin yksittäinen MRHD 6 mg annettuna ihonalaisesti mg/m²:n perusteella. Raskaana olevien rottien oraalinen hoito sumatriptaanilla tiineyden loppupuolella ja koko laktaation ajan johti poikasten eloonjäämisen vähenemiseen. Suurin vaikutukseton annos tälle löydökselle oli 100 mg/kg/vrk eli noin 160 kertaa suurempi kuin yksittäinen MRHD 6 mg annettuna ihonalaisesti mg/m²:n perusteella.
Imettävät äidit
Sumatriptaani erittyy äidinmaitoon ihonalaisen annon jälkeen. Vauvan altistus sumatriptaanille voidaan minimoida välttämällä imetystä 12 tunnin ajan IMITREX 50 mg -injektiohoidon jälkeen.
Käyttö lapsille
Turvallisuutta ja tehokkuutta lapsipotilailla ei ole osoitettu. IMITREX 100 mg -injektiota ei suositella käytettäväksi alle 18-vuotiaille potilaille.
Kahdessa kontrolloidussa kliinisessä tutkimuksessa arvioitiin IMITREX-nenäsumutetta (5–20 mg) 1 248:lla 12–17-vuotiaalla migreenipotilaalla, jotka hoidettiin yhtä kohtausta. Kokeet eivät osoittaneet IMITREX-nenäsumutteen tehoa plaseboon verrattuna migreenin hoidossa lapsipotilailla. Näissä kliinisissä tutkimuksissa havaitut haittavaikutukset olivat luonteeltaan samanlaisia kuin aikuisilla tehdyissä kliinisissä tutkimuksissa raportoidut haittavaikutukset.
Viiteen kontrolloituun kliiniseen tutkimukseen (2 yksittäisen hyökkäyksen tutkimusta, 3 usean hyökkäyksen tutkimusta), joissa arvioitiin oraalista IMITREXiä (25–100 mg) 12–17-vuotiailla lapsipotilailla, otettiin yhteensä 701 migreenipotilasta. Nämä tutkimukset eivät osoittaneet oraalisen IMITREX 25 mg:n tehoa plaseboon verrattuna migreenin hoidossa lapsipotilailla. Näissä kliinisissä tutkimuksissa havaitut haittavaikutukset olivat luonteeltaan samanlaisia kuin aikuisilla tehdyissä kliinisissä tutkimuksissa raportoidut haittavaikutukset. Kaikkien haittavaikutusten esiintymistiheys näillä potilailla näytti olevan sekä annoksesta että iästä riippuvaista, ja nuoremmat potilaat ilmoittivat reaktioista yleisemmin kuin vanhemmat lapsipotilaat.
Markkinoille tulon jälkeiset kokemukset osoittavat, että lapsilla on esiintynyt vakavia haittavaikutuksia ihonalaisen, oraalisen ja/tai intranasaalisen IMITREXin käytön jälkeen. Nämä raportit sisältävät reaktioita, jotka ovat luonteeltaan samanlaisia kuin aikuisilla harvoin raportoidut reaktiot, mukaan lukien aivohalvaus, näönmenetys ja kuolema. Sydäninfarkti on raportoitu 14-vuotiaalla miehellä suun kautta otettavan IMITREXin käytön jälkeen; kliiniset oireet ilmaantuvat vuorokauden sisällä lääkkeen antamisesta. Tällä hetkellä ei ole saatavilla kliinisiä tietoja vakavien haittavaikutusten esiintyvyyden määrittämiseksi lapsipotilailla, jotka saattavat saada ihonalaista, suun kautta tai intranasaalista IMITREXiä.
Geriatrinen käyttö
IMITREX 100 mg -injektion kliinisissä tutkimuksissa ei ollut riittävästi 65-vuotiaita tai vanhempia potilaita sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat potilaat. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa. Yleensä iäkkään potilaan annoksen valinnassa tulee olla varovaista, yleensä aloitetaan annosalueen alimmasta päästä, mikä heijastaa maksan, munuaisten tai sydämen toiminnan heikkenemisen sekä samanaikaisen sairauden tai muun lääkehoidon yleisyyttä.
Kardiovaskulaarista arviointia suositellaan iäkkäille potilaille, joilla on muita kardiovaskulaarisia riskitekijöitä (esim. diabetes, verenpainetauti, tupakointi, liikalihavuus, vahva suvussa esiintynyt CAD) ennen IMITREX-injektion saamista [ks. VAROITUKSET JA VAROTOIMET ].
YLIANNOSTUS
Sepelvaltimon vasospasmi havaittiin suonensisäisen IMITREX 50 mg -injektion jälkeen [ks. VASTA-AIHEET ]. Eläintietojen perusteella (koirat 0,1 g/kg, rotat 2 g/kg) yliannostusten odotetaan mahdollisesti aiheuttavan kouristuksia, vapinaa, passiivisuutta, raajojen punoitusta, hengitystiheyden vähenemistä, syanoosia, ataksiaa, mydriaasia, pistoskohdan reaktioita ( hilseily, hiustenlähtö ja rupien muodostuminen) ja halvaantuminen.
Sumatriptaanin eliminaation puoliintumisaika on noin 2 tuntia [katso KLIININEN FARMAKOLOGIA ]; Siksi potilaiden seurantaa IMITREX-injektion yliannostuksen jälkeen tulee jatkaa vähintään 10 tuntia tai niin kauan kuin oireet tai merkit jatkuvat.
Hemodialyysin tai peritoneaalidialyysin vaikutusta seerumin sumatriptaanipitoisuuksiin ei tiedetä.
VASTA-AIHEET
IMITREX-injektio on vasta-aiheinen potilailla, joilla on:
- Iskeeminen sepelvaltimotauti (CAD) (angina pectoris, sydäninfarkti tai dokumentoitu hiljainen iskemia) tai sepelvaltimon vasospasmi, mukaan lukien Prinzmetalin angina [ks. VAROITUKSET JA VAROTOIMET ].
- Wolff-Parkinson-Whiten oireyhtymä tai rytmihäiriöt, jotka liittyvät muihin sydämen johtamisreitin häiriöihin [ks. VAROITUKSET JA VAROTOIMET ].
- Aiemmin aivohalvaus tai ohimenevä iskeeminen kohtaus (TIA) tai hemipleginen tai basilaarinen migreeni, koska näillä potilailla on suurempi aivohalvauksen riski [ks. VAROITUKSET JA VAROTOIMET ].
- Perifeerinen verisuonisairaus [katso VAROITUKSET JA VAROTOIMET ].
- Iskeeminen suolistosairaus [katso VAROITUKSET JA VAROTOIMET ].
- Hallitsematon verenpainetauti [katso VAROITUKSET JA VAROTOIMET ].
- Ergotamiinia sisältävän lääkkeen, ergot-tyyppisen lääkkeen (kuten dihydroergotamiinin tai metysergidin) tai muun 5-hydroksitryptamiini1 (5-HT1) -agonistin viimeaikainen käyttö (eli 24 tunnin sisällä) [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
- Monoamiinioksidaasin (MAO)-A:n estäjän samanaikainen anto tai äskettäinen (2 viikon sisällä) MAO-A-estäjän käyttö [ks. HUUMEIDEN VUOROVAIKUTUKSET , KLIININEN FARMAKOLOGIA ].
- Yliherkkyys IMITREXille (angioödeema ja anafylaksia havaittu) [ks VAROITUKSET JA VAROTOIMET ].
- Vaikea maksan vajaatoiminta [ks KLIININEN FARMAKOLOGIA ].
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Sumatriptaani sitoutuu suurella affiniteetilla ihmisen kloonattuihin 5-HT1B/1D-reseptoreihin. Sumatriptaanilla oletetaan olevan terapeuttisia vaikutuksia migreenin ja klusteripäänsäryn hoidossa agonistivaikutusten kautta 5-HT1B/1D-reseptoreissa kallonsisäisissä verisuonissa ja kolmoishermojärjestelmän tuntohermoissa, mikä johtaa kallon verisuonten supistumiseen ja tulehdusta edistävän neuropeptidin estoon. vapauttaa.
Farmakodynamiikka
Verenpaine
Merkittävää verenpaineen nousua, mukaan lukien hypertensiivinen kriisi, on raportoitu potilailla, joilla on tai ei ole aiemmin ollut verenpainetauti [ks. VAROITUKSET JA VAROTOIMET ].
Perifeeriset (pienet) valtimot
Terveillä vapaaehtoisilla (N = 18) tehdyssä tutkimuksessa, jossa arvioitiin sumatriptaanin vaikutuksia perifeeristen (pienten verisuonten) valtimoiden reaktiivisuuteen, ei havaittu kliinisesti merkitsevää perifeerisen vastuksen lisääntymistä.
Syke
Joillakin potilailla havaittu ohimenevä verenpaineen nousu kliinisissä tutkimuksissa, jotka suoritettiin sumatriptaanin kehittämisen aikana migreenin hoitona, ei liittynyt kliinisesti merkittäviä sydämen sykkeen muutoksia.
Farmakokinetiikka
Imeytyminen ja biologinen hyötyosuus
Sumatriptaanin hyötyosuus ihonalaisen injektion kautta 18 terveelle mieshenkilölle oli 97 % ± 16 % laskimonsisäisen injektion jälkeen saadusta hyötyosuudesta.
Kun 18 terveelle miehelle (ikä: 24 ± 6 vuotta, paino: 70 kg) annettiin yksi 6 mg ihonalainen manuaalinen injektio käsivarren hartialihakseen, sumatriptaanin maksimipitoisuus seerumissa (Cmax) oli (keskiarvo ± standardipoikkeama) 74 ± 15 ng/ml ja aika huippupitoisuuteen (Tmax) oli 12 minuuttia injektion jälkeen (vaihteluväli: 5-20 minuuttia). Tässä tutkimuksessa sama annos injektoituna ihonalaisesti reiteen antoi Cmax:ksi 61 ± 15 ng/ml manuaalisella injektiolla verrattuna 52 ± 15 ng/ml autoinjektoritekniikoilla. Injektiopaikka tai -tekniikka ei muuttanut merkittävästi Tmax-arvoa tai imeytyvää määrää.
Jakelu
Proteiinin sitoutuminen tasapainodialyysillä määritettynä konsentraatioalueella 10-1000 ng/ml on alhainen, noin 14-21 %. Sumatriptaanin vaikutusta muiden lääkkeiden proteiineihin sitoutumiseen ei ole arvioitu.
Kun 6 mg:n ihonalainen injektio annettiin käsivarren hartialihakseen 9 miehelle (keski-ikä: 33 vuotta, keskipaino: 77 kg), sumatriptaanin jakautumistilavuus keskusosaston tilavuus oli 50 ± 8 litraa ja jakautumisen puoliintumisaika oli 15 ± 2 minuuttia.
Aineenvaihdunta
Ihmisen mikrosomeilla tehdyt in vitro -tutkimukset viittaavat siihen, että sumatriptaani metaboloituu MAO:n, pääasiassa A-isoentsyymin, vaikutuksesta. Suurin osa virtsaan erittyneestä radioaktiivisesti leimatusta sumatriptaaniannoksesta on päämetaboliitti indolietikkahappoa (IAA) tai IAA-glukuronidia, jotka molemmat ovat inaktiivisia.
Eliminointi
Ihonalaisen 6 mg:n kerta-annoksen jälkeen 22 % ± 4 % erittyi virtsaan muuttumattomana sumatriptaanina ja 38 % ± 7 % IAA-metaboliitina.
Kun 6 mg:n ihonalainen injektio annettiin käsivarren hartialihakseen, sumatriptaanin systeeminen puhdistuma oli 1 194 ± 149 ml/min ja terminaalinen puoliintumisaika 115 ± 19 minuuttia.
Tietyt populaatiot
Ikä
Sumatriptaanin farmakokinetiikka vanhuksilla (keski-ikä: 72 vuotta, 2 miestä ja 4 naista) ja migreenipotilailla (keski-ikä: 38 vuotta, 25 miestä ja 155 naista) oli samanlainen kuin terveillä miespuolisilla koehenkilöillä (keski-ikä: 30 vuotta).
Maksan vajaatoiminta
Lievän tai kohtalaisen maksasairauden vaikutusta ihon alle annetun sumatriptaanin farmakokinetiikkaan on arvioitu. Ihon alle annetun sumatriptaanin farmakokinetiikassa ei ollut merkittäviä eroja kohtalaisen maksan vajaatoiminnassa terveisiin verrokkeihin verrattuna. Ihon alle annetun sumatriptaanin farmakokinetiikkaa potilailla, joilla on vaikea maksan vajaatoiminta, ei ole tutkittu. IMITREX-injektion käyttö tässä populaatiossa on vasta-aiheista [katso VASTA-AIHEET ].
Rotu
Ihonalaisen sumatriptaanin systeeminen puhdistuma ja Cmax olivat samanlaiset mustilla (n = 34) ja valkoihoisilla (n = 38) terveillä miehillä.
Huumeiden vuorovaikutustutkimukset
Monoamiinioksidaasi-A:n estäjät
Tutkimuksessa, johon osallistui 14 tervettä naista, esihoito MAO-A:n estäjillä vähensi ihonalaisen sumatriptaanin puhdistumaa, mikä johti kaksinkertaiseen pinta-alaan sumatriptaanin plasman pitoisuus-aikakäyrän (AUC) alapuolella, mikä vastasi 40 %:n lisäystä. eliminaation puoliintumisajassa.
Eläinten toksikologia ja/tai farmakologia
Sarveiskalvon opasteet
Suun kautta sumatriptaania saaneille koirille kehittyi sarveiskalvon sameutta ja vikoja sarveiskalvon epiteelissä. Sarveiskalvon sameutta havaittiin pienimmällä testatulla annoksella, 2 mg/kg/vrk, ja niitä havaittiin 1 kuukauden hoidon jälkeen. Vikoja sarveiskalvon epiteelissä havaittiin 60 viikkoa kestäneessä tutkimuksessa. Aikaisempia tutkimuksia näiden toksisuuksien varalta ei tehty eikä vaikutusttomia annoksia vahvistettu; suhteellinen plasma-altistus pienimmällä testatulla annoksella oli kuitenkin noin 3 kertaa suurempi kuin ihmisen altistus 6 mg:n ihonalaisen annoksen jälkeen.
Kliiniset tutkimukset
Migreeni
Kontrolloiduissa kliinisissä tutkimuksissa, joihin otettiin mukaan yli 1 000 potilasta migreenikohtausten aikana, jotka kokivat kohtalaista tai voimakasta kipua ja yhtä tai useampaa taulukossa 3 luetelluista oireista, helpotus alkoi jo 10 minuuttia 6 mg IMITREX 50 mg -injektion jälkeen. Pienemmät IMITREX 100 mg -injektion annokset voivat myös osoittautua tehokkaiksi, vaikka riittävän helpotuksen saaneiden potilaiden osuus pieneni ja helpotuksen latenssi on suurempi pienemmillä annoksilla.
Tutkimuksessa 1 6 erilaista IMITREX 100 mg -injektion annosta (n = 30 kussakin ryhmässä) verrattiin lumelääkkeeseen (n = 62), yhden hyökkäyksen rinnakkaisten ryhmien suunnittelussa annos-vaste-suhteen havaittiin olevan kuvan mukainen. taulukossa 2.
Kahdessa satunnaistetussa, lumekontrolloidussa kliinisessä tutkimuksessa IMITREX 25 mg injektiolla 6 mg 1 104 potilaalla, joilla oli kohtalainen tai vaikea migreenikipu (tutkimukset 2 ja 3), helpotus alkoi alle 10 minuutissa. Päänsärky lievittyi, mikä määritellään kivun vähenemisenä vaikeasta tai kohtalaisen vaikeasta lievään tai ei ollenkaan päänsärkyä, saavutettiin 70 %:lla potilaista 1 tunnin kuluessa 6 mg:n ihonalaisesta IMITREX-injektio-annoksesta. Noin 82 %:lla potilaista, joita hoidettiin IMITREX 6 mg:lla, päänsärky helpottui, ja vastaavasti 65 % oli kivuton 2 tunnin kuluessa.
Taulukossa 3 on esitetty 6 mg:n IMITREX-injektion 1 ja 2 tunnin tehokkuustulokset tutkimuksissa 2 ja 3.
IMITREX 100 mg injektio lievitti myös migreenikohtauksiin liittyvää valonarkuus, fonofobia (ääniherkkyys), pahoinvointi ja oksentelu. Samanlainen teho havaittiin, kun potilaat antoivat itse IMITREX 50 mg -injektion käyttämällä IMITREX 100 mg STATdose Pen -kynää.
IMITREX-injektion tehoon ei vaikuttanut se, liittyikö migreeni auraan, kohtauksen kesto, potilaan sukupuoli tai ikä tai tavallisten migreeniä ehkäisevien lääkkeiden (esim. beetasalpaajien) samanaikainen käyttö.
Klusterin päänsärky
IMITREX-injektion tehokkuus klusteripäänsäryn akuutissa hoidossa osoitettiin kahdessa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa, 2-jaksoisessa crossover-tutkimuksessa (tutkimukset 4 ja 5). Mukaan otettiin 21–65-vuotiaat potilaat, ja heitä neuvottiin hoitamaan kohtalainen tai erittäin vaikea päänsärky 10 minuutin kuluessa sen puhkeamisesta. Päänsäryn lievitys määriteltiin päänsäryn vaikeuden vähentymisenä lieväksi tai ei ollenkaan. Molemmissa tutkimuksissa niiden potilaiden osuus, jotka saivat helpotusta 10 tai 15 minuutin kohdalla, oli merkittävästi suurempi potilailla, jotka saivat 6 mg IMITREX-injektiota verrattuna lumelääkettä saaneisiin (katso taulukko 4).
Kuvassa 1 on arvio kumulatiivisesta todennäköisyydestä, että klusteripäänsärkyä sairastava potilas saa helpotuksen joko IMITREX 25 mg -injektiolla tai lumelääkehoidon jälkeen.
Kuva 1: Aika klusteripäänsärkyn lievitykseen injektiohetkestä 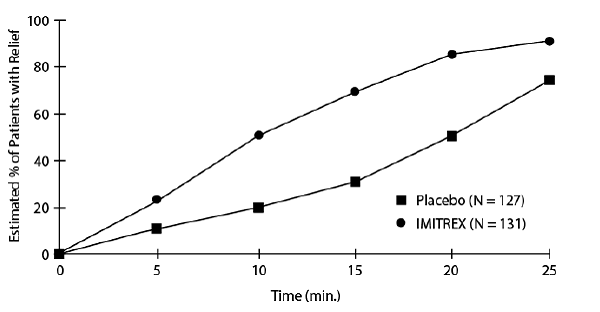
a Kuvassa on käytetty Kaplan-Meier (tuoteraja) Survivorship Plot -kuvausta. Pelastuslääkitystä saaneet potilaat sensuroitiin 15 minuutin kohdalla.
Kaavio koottiin potilaiden tiedoista, jotka joko kokivat helpotusta tai eivät ole tarvinneet (pyydänneet) pelastuslääkitystä 2 tunnin kuluessa hoidon jälkeen. Tämän seurauksena käyrän tiedot ovat peräisin vain osajoukosta 258 hoidetusta päänsärystä (pelastuslääkitystä vaadittiin 52:ssa 127:stä lumelääkehoidosta ja 18:ssa 131:stä IMITREX 50 mg -injektiolla hoidetusta päänsärystä).
Muut tiedot viittaavat siihen, että IMITREX 25 mg -injektiohoitoon ei liity päänsäryn varhaisen uusiutumisen lisääntymistä ja että sillä on vain vähän vaikutusta myöhempien päänsäryjen ilmaantuvuuteen (ts. päänsäryn, joka ilmaantuu 2 tunnin kuluttua, mutta ennen 18 tai 24 tuntia).
POTILASTIEDOT
IMITREX® (IM-i-trex) (sumatriptaanisukkinaatti) Injektio
Lue nämä potilastiedot ennen kuin aloitat IMITREXin käytön ja aina, kun saat täyttöä. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi.
Mikä on tärkein tieto, joka minun pitäisi tietää IMITREXistä?
IMITREX voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
Sydänkohtaus ja muut sydänongelmat. Sydänongelmat voivat johtaa kuolemaan.
Lopeta IMITREX 25 mg:n käyttö ja hakeudu välittömästi ensiapuun, jos sinulla on jokin seuraavista sydänkohtauksen oireista:
- epämukavuus rintakehän keskellä, joka kestää yli muutaman minuutin tai menee pois ja palaa
- voimakas puristava tunne, kipu, paine tai raskaus rinnassa, kurkussa, niskassa tai leuassa
- kipua tai epämukavuutta käsivarsissa, selässä, niskassa, leuassa tai vatsassa
- hengenahdistus rintakivun kanssa tai ilman
- puhjeta kylmä hiki
- pahoinvointia tai oksentelua
- pyörryttävä olo
IMITREX ei ole tarkoitettu ihmisille, joilla on sydänsairauksien riskitekijöitä, ellei sydäntutkimusta ole tehty eikä se osoita ongelmia. Sinulla on suurempi sydänsairauksien riski, jos:
- on korkea verenpaine
- on korkea kolesterolitaso
- savu
- ovat ylipainoisia
- on diabetes
- sinulla on suvussa sydänsairauksia
Mikä on IMITREX?
IMITREX-injektio on reseptilääke, jota käytetään akuutin migreenipäänsäryn hoitoon aurallisen tai ilman ja akuutin klusteripäänsäryn hoitoon aikuisilla, joilla on diagnosoitu migreeni tai klusteripäänsärky.
IMITREX 50 mg ei käytetä muun tyyppisen päänsäryn, kuten hemiplegisen (jotka eivät pysty liikkumaan toisella kehon puolella) tai basilaarisen (harvinainen aurallinen migreenin muoto) migreenin hoitoon.
IMITREX 100 mg ei käytetä migreenin tai klusteripäänsäryn estämiseen tai vähentämiseen.
Ei tiedetä, onko IMITREX 100 mg turvallinen ja tehokas alle 18-vuotiaille lapsille.
Kuka ei saa ottaa IMITREX 100 mg -valmistetta?
Älä ota IMITREX 50 mg:aa, jos sinulla on:
- sydänongelmia tai sydänongelmia
- jalkojen, käsivarsien, mahalaukun tai munuaisten verisuonten kaventuminen (perifeerinen verisuonisairaus)
- hallitsematon korkea verenpaine
- vakavia maksaongelmia
- hemipleginen migreeni tai basilaarinen migreeni. Jos et ole varma, onko sinulla tämäntyyppisiä migreeniä, kysy terveydenhuollon tarjoajaltasi.
- sinulla on ollut aivohalvaus, ohimenevät iskeemiset kohtaukset (TIA) tai verenkiertohäiriöitä
- olet ottanut jotain seuraavista lääkkeistä viimeisen 24 tunnin aikana:
- almotriptaani (AXERT®)
- eletriptaani (RELPAX®)
- frovatriptaani (FROVA®)
- naratriptaani (AMERGE®)
- ritsatriptaani (MAXALT®, MAXALT-MLT®)
- sumatriptaani ja naprokseeni (TREXIMET®)
- ergotamiinit (CAFERGOT®, ERGOMAR®, MIGERGOT®)
- dihydroergotamiini (DHE 45®, MIGRANAL®) Kysy terveydenhuollon tarjoajaltasi, jos et ole varma, onko lääkkeesi luettelossa yllä.
- allergia sumatriptaanille tai jollekin IMITREXin aineosalle. Katso tämän pakkausselosteen lopusta täydellinen luettelo IMITREXin ainesosista.
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen IMITREXin ottamista?
Ennen kuin otat IMITREXiä, kerro terveydenhuollon tarjoajallesi kaikista sairauksistasi, mukaan lukien jos:
- on korkea verenpaine
- on korkea kolesteroli
- on diabetes
- savu
- ovat ylipainoisia
- sinulla on sydänongelmia tai suvussa sydänongelmia tai aivohalvaus
- on munuaisongelmia
- sinulla on maksaongelmia
- sinulla on ollut epilepsia tai kohtauksia
- eivät käytä tehokasta ehkäisyä
- tulla raskaaksi IMITREX-hoidon aikana
- imetät tai aiot imettää. IMITREX 25 mg erittyy rintamaitoon ja voi vahingoittaa vauvaasi. Keskustele terveydenhuollon tarjoajan kanssa parhaasta tavasta ruokkia vauvasi, jos käytät IMITREXiä.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien reseptilääkkeet ja ilman reseptiä saatavat lääkkeet, vitamiinit ja yrttilisät.
IMITREX ja tietyt muut lääkkeet voivat vaikuttaa toisiinsa ja aiheuttaa vakavia sivuvaikutuksia.
Kerro varsinkin terveydenhuollon ammattilaiselle, jos käytät masennuslääkkeitä, joita kutsutaan:
- selektiiviset serotoniinin takaisinoton estäjät (SSRI)
- serotoniinin norepinefriinin takaisinoton estäjät (SNRI)
- trisykliset masennuslääkkeet (TCA)
- monoamiinioksidaasin estäjät (MAO:t)
Pyydä terveydenhuollon tarjoajaltasi tai apteekista luettelo näistä lääkkeistä, jos et ole varma.
Tunne käyttämäsi lääkkeet. Pidä niistä luetteloa näyttääksesi terveydenhuollon tarjoajalle tai apteekkihenkilökunnalle, kun hankit uuden lääkkeen.
Miten minun pitäisi ottaa IMITREX 100mg?
- Joidenkin ihmisten tulee ottaa ensimmäinen IMITREX 25 mg -annos terveydenhuollon tarjoajan vastaanotolla tai muussa lääketieteellisessä ympäristössä. Kysy terveydenhuollon tarjoajalta, pitäisikö sinun ottaa ensimmäinen annos lääketieteellisessä ympäristössä.
- Käytä IMITREX 50mg -valmistetta juuri niin kuin terveydenhuollon tarjoajasi on neuvonut käyttämään sitä.
- Terveydenhuollon tarjoaja voi muuttaa annostasi. Älä muuta annostasi keskustelematta ensin terveydenhuollon tarjoajan kanssa.
- Aikuisille tavallinen annos on kertainjektio ihon alle.
- Sinun tulee antaa injektio heti, kun päänsäryn oireet alkavat, mutta se voidaan antaa milloin tahansa migreeni- tai klusteripäänsärkykohtauksen aikana.
- Jos et saa helpotusta ensimmäisen pistoksen jälkeen, älä anna toista injektiota keskustelematta ensin terveydenhuollon tarjoajan kanssa.
- Jos päänsärky palaa tai saat helpotusta vasta ensimmäisen pistoksen jälkeen, voit ottaa toisen injektion tunnin kuluttua ensimmäisestä pistoksesta, mutta ei aikaisemmin.
- Älä ota enempää kuin 12 mg 24 tunnin aikana.
- Jos käytät liikaa IMITREX 25 mg -valmistetta, soita heti terveydenhuollon tarjoajalle tai mene lähimmän sairaalan ensiapuun.
- Sinun tulee kirjoittaa muistiin, milloin sinulla on päänsärkyä ja milloin otat IMITREXiä, jotta voit keskustella terveydenhuollon tarjoajan kanssa siitä, kuinka IMITREX 25 mg toimii sinulle.
Mitä minun pitäisi välttää IMITREX-hoidon aikana?
IMITREX voi aiheuttaa huimausta, heikkoutta tai uneliaisuutta. Jos sinulla on näitä oireita, älä aja autoa, käytä koneita tai tee mitään, missä sinun on oltava valpas.
Mitkä ovat IMITREX 25mg:n mahdolliset sivuvaikutukset?
IMITREX voi aiheuttaa vakavia sivuvaikutuksia. Katso "Mikä on tärkein tieto, joka minun pitäisi tietää IMITREXistä?"
Näitä vakavia sivuvaikutuksia ovat:
- sormien ja varpaiden värin tai tuntemuksen muutokset (Raynaudin oireyhtymä)
- maha- ja suolisto-ongelmat (maha-suolikanavan ja paksusuolen iskeemiset tapahtumat). Ruoansulatuskanavan ja paksusuolen iskeemisten tapahtumien oireita ovat:
- äkillinen tai voimakas vatsakipu
- vatsakipu aterian jälkeen
- painonpudotus
- pahoinvointia tai oksentelua
- ummetus tai ripuli
- verinen ripuli
- kuume
- jalkojen verenkiertoon liittyvät ongelmat (perifeerinen verisuoniiskemia). Perifeerisen verisuonten iskemian oireita ovat:
- kouristuksia ja kipua jaloissa tai lantiossa
- raskauden tai kireyden tunne jalkalihaksissasi
- polttava tai kipeä kipu jaloissasi tai varpaissasi levossa
- tunnottomuutta, pistelyä tai heikkoutta jaloissasi
- kylmä tunne tai värimuutoksia yhdessä tai molemmissa jaloissa tai jaloissa
- nokkosihottuma (kutiavat näppylät); kielen, suun tai kurkun turvotus
- lääkkeiden liiallinen päänsärky. Joillakin ihmisillä, jotka käyttävät liian monta IMITREX 100 mg -injektiota, voi olla pahempaa päänsärkyä (lääkkeiden liikakäyttöinen päänsärky). Jos päänsäryt pahenevat, terveydenhuollon tarjoaja voi päättää lopettaa IMITREX-hoidon.
- serotoniinioireyhtymä. Serotoniinioireyhtymä on harvinainen mutta vakava ongelma, joka voi ilmetä IMITREXiä käyttävillä ihmisillä, varsinkin jos IMITREX 50 mg:aa käytetään yhdessä masennuslääkkeiden kanssa, joita kutsutaan SSRI- tai SNRI-lääkkeiksi. Soita välittömästi terveydenhuollon tarjoajallesi, jos sinulla on jokin seuraavista serotoniinioireyhtymän oireista:
- henkiset muutokset, kuten sellaisten asioiden näkeminen, joita ei ole olemassa (hallusinaatiot), kiihtyneisyys tai kooma
- nopea sydämenlyönti
- verenpaineen muutokset
- korkea ruumiinlämpö
- tiukat lihakset
- vaikeuksia kävellä
- kohtauksia. Kouristuskohtauksia on esiintynyt IMITREXiä käyttävillä ihmisillä, joilla ei ole koskaan ollut kouristuskohtauksia. Keskustele terveydenhuollon tarjoajan kanssa mahdollisuudesta saada kohtauksia IMITREX-hoidon aikana.
IMITREX 50mg -injektion yleisimmät sivuvaikutukset ovat:
- kipua tai punoitusta pistoskohdassa
- pistely tai tunnottomuus sormissa tai varpaissa
- huimaus
- lämmin, kuuma, polttava tunne kasvoissasi (punoitus)
- epämukavuutta tai jäykkyyttä niskassa
- heikkouden, uneliaisuuden tai väsymyksen tunne
Kerro terveydenhuollon tarjoajallesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei katoa.
Nämä eivät ole kaikkia IMITREXin mahdollisia sivuvaikutuksia. Lisätietoja saat terveydenhuollon tarjoajalta tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää IMITREX-injektio?
- Säilytä IMITREXiä 2 °C - 30 °C (36–86 °F) lämpötilassa.
- Säilytä lääkkeesi valolta suojassa.
- Säilytä lääkettä sen mukana toimitetussa pakkauksessa tai kantolaukussa.
Pidä IMITREX ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa IMITREXin turvallisesta ja tehokkaasta käytöstä
Lääkkeitä määrätään joskus muihin kuin potilasohjeissa lueteltuihin tarkoituksiin. Älä käytä IMITREXiä sairauteen, johon sitä ei ole määrätty. Älä anna IMITREX 25 mg -valmistetta muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tämä potilastietolehtinen sisältää yhteenvedon tärkeimmistä tiedoista IMITREXistä. Jos haluat lisätietoja, keskustele terveydenhuollon tarjoajasi kanssa. Voit kysyä terveydenhuollon tarjoajalta tai apteekista terveydenhuollon ammattilaisille kirjoitettuja tietoja IMITREXistä.
Lisätietoja saat osoitteesta www.gsk.com tai soittamalla numeroon 1-888-825-5249.
Mitkä ovat IMITREX-injektion ainesosat?
Vaikuttava aine: sumatriptaanisukkinaatti
Ei-aktiiviset aineet: natriumkloridi, injektionesteisiin käytettävä vesi
Nämä potilastiedot ja käyttöohjeet ovat Yhdysvaltain elintarvike- ja lääkeviraston hyväksymiä.
Potilasohjeet
IMITREX STAT -annosjärjestelmä
Lue nämä potilasohjeet ennen kuin alat käyttää IMITREX STATdose -järjestelmää. Saattaa tulla uutta tietoa. Nämä tiedot eivät korvaa terveydenhuollon tarjoajan kanssa puhumista terveydentilastasi tai hoidostasi. Sinun ja terveydenhuollon tarjoajasi tulee keskustella IMITREX 25 mg -injektiosta, kun aloitat sen käytön ja säännöllisissä tarkastuksissa.
Pidä IMITREX STATdose System poissa lasten ulottuvilta.
Ennen kuin käytät IMITREX STATdose -järjestelmää
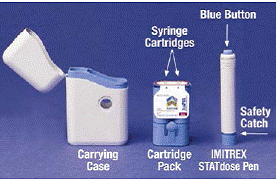
Kun avaat IMITREX 25mg STATdose System -laatikon ensimmäisen kerran, kasettipakkaus ja IMITREX STATdose Pen® ovat jo kantolaukussa avuksesi.
Harmaa ja sininen Kantolaukku käytetään lataamattoman kynän ja kasettipakkauksen säilyttämiseen, kun niitä ei käytetä.
The Kasettipakkaus mahtuu 2 yksittäin suljettuna Ruiskun patruunat Jokaiseen ruiskupatruunaan mahtuu 1 annos IMITREX® (sumatriptaanisukkinaatti) -injektiota. Tämän lääkkeen 4 mg:n vahvuuden sylinteriampullipakkaus on keltainen ja 6 mg:n vahvuuden patruunapakkaus on sininen (kuten kuvassa). Täyttökasettipakkauksia on saatavilla.
Harmaa ja sininen Kynä käytetään pistämään automaattisesti yksi lääkeannos ruiskupatruunasta. Älä koske Sininen painike kunnes olet painanut kynää ihoasi vasten antaaksesi annoksen. Jos painat sitä milloin tahansa, saatat menettää annoksen. The Turvasaalis estää kynää vahingossa laukeamasta, kunnes olet valmis. Kynä toimii vain, kun liu'utat piipun harmaan osan siniseen osaan. Varmista aina ennen kuin asetat uuden ruiskupatruunan, että valkoinen esitäyttötanko ei työnty ulos kynän päästä (kuten kuvassa B). Jos se työntyy ulos, menetät sen annoksen.
IMITREX STATdose Pen -kynän lataaminen
Älä lataa kynää ennen kuin olet valmis antamaan itsellesi pistoksen. Älä koske kynän päällä olevaa sinistä painiketta (katso kuva A), kun asetat kynää.
Kuva A 
Kuva B 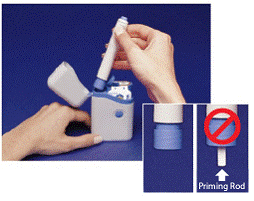
1. Avaa kantolaukun kansi. Kahden ruiskupatruunan peitelevyissä on merkinnät "A" ja "B" (katso Kuva A upotettu ).
Käytä aina ”A”-merkillä varustettua ruiskupatruunaa ennen ”B”-merkintää, jotta voit seurata annoksiasi. Älä käytä, jos jompikumpi sinetistä on rikki tai puuttuu, kun avaat kantolaukun ensimmäisen kerran.
2. Repäise yksi peukalointia osoittavista sinetistä (katso Kuva A ). Heitä sinetti pois. Avaa ruiskupatruunan kansi.
3. Pidä kynää yläosassa olevista harjoista. Ota kynä pois kantolaukusta (katso Kuva B ).
Varmista, että valkoinen esitäyttötanko ei työnty ulos kynän alapäästä (katso Kuva B upotettu ). Jos se työntyy ulos, aseta kynä takaisin kantolaukkuun ja paina lujasti alaspäin, kunnes tunnet sen napsahtavan. Ota kynä pois kantolaukusta.
Kuva C 
4. Aseta kynä kasettipakkaukseen. Käännä sitä oikealle (myötäpäivään), kunnes se ei enää käänny (noin puoli kierrosta) (katso Kuva C ).
5. Pitele ladattua kynää harjoista ja vedä se suoraan ulos (katso Kuva D ). Saatat joutua vetämään kynästä lujasti, mutta tämä on normaalia. Älä vielä paina sinistä painiketta.
Kuva D 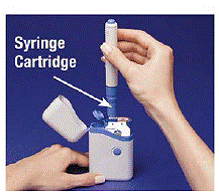
Kynä on nyt käyttövalmis. Älä laita ladattu kynä takaisin kantolaukkuun, koska se vahingoittaa neulaa.
Kuinka käyttää IMITREX STAT -annoskynää lääkkeen ottamiseen
Ennen kuin pistät lääkkeesi, valitse alue, jossa on rasvakudoskerros (katso kuva E tai kuva F). Kysy terveydenhuollon tarjoajaltasi, jos sinulla on kysyttävää lääkkeesi pistämisestä.
Valmistele ihoalue, jolle IMITREX pistetään, pyyhkimällä pistoskohta alkoholipyyhkeellä. Älä koske tähän alueeseen uudelleen ennen pistoksen antamista.
Kuva E tai kuva F Kuva G 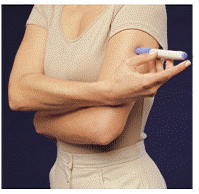
6. Painamatta sinistä painiketta, paina ladattua kynää tiukasti ihoa vasten niin, että harmaa piippu liukuu alas kohti sinistä osaa, joka pitää ruiskupatruunan (katso Kuva D ). (Tämä vapauttaa turvasalvan, joka estää kynää laukeamasta vahingossa, kunnes olet valmis.)
7. Paina sinistä painiketta. Pidä kynää paikallaan vähintään 5 sekuntia . Jos kynä otetaan pois iholta liian aikaisin, kaikki lääke ei tule ulos.
8 5 sekunnin kuluttua , ota kynä varovasti pois iholtasi. Neula tulee näkyviin (katso Kuva G ). Älä koske neulaan.
Kuinka poistaa IMITREX STAT -annoskynä lääkkeen ottamisen jälkeen
Heti kun olet ottanut annoksen kynällä, sinun on palautettava käytetty ruiskupatruuna säiliöpakkaukseen.
Kuva H Kuva I ja Kuva J 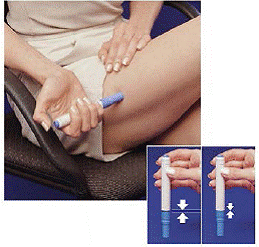
9. Työnnä kynä alas kasettipakkauksen tyhjälle puolelle niin pitkälle kuin se menee (katso Kuva H ).
10. Käännä kynää vasemmalle (vastapäivään) noin puoli kierrosta, kunnes se vapautuu ruiskupatruunasta (katso Kuva I ).
11. Vedä tyhjä kynä ulos kasettipakkauksesta (katso Kuva J ).
Koska kynä on nyt käytetty, valkoinen pohjustustanko työntyy ulos kynän alapäästä (katso Kuva J ).
12. Sulje kasettipakkauksen kansi käytetyn ruiskupatruunan päälle. Kun käytetyt ruiskupatruunat asetetaan oikein, kasettipakkaus on kertakäyttöinen suojakotelo, joka auttaa välttämään neulanpistoja ja käyttämään ruiskuja oikein.
13. Aseta kynä takaisin kantolaukkuun ja paina sitä lujasti alaspäin, kunnes tunnet sen napsahtavan. Sulje kantolaukun kansi. Näin kynä on valmis seuraavaa käyttöä varten.
Jos kansi ei sulkeudu, paina kynää alaspäin, kunnes tunnet sen naksahtavan. Sulje sitten kansi.
Kuinka ottaa käytetty kasettipakkaus pois
Kun molemmat ruiskupatruunat on käytetty, ota kasettipakkaus pois kantolaukusta. Älä koskaan käytä uudelleen tai kierrätä ruiskupatruunaa.
Kuva K Kuva L 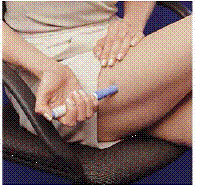
14. Avaa kantolaukun kansi.
15. Pidä kantolaukusta yhdellä kädellä ja paina kantolaukun molemmin puolin kahta painiketta (katso Kuva K ).
16. Vedä kasettipakkaus varovasti ulos toisella kädellä (katso Kuva L ).
17. Heitä kasettipakkaus pois tai hävitä se terveydenhuollon tarjoajan ohjeiden mukaisesti. Käytettyjen neulojen ja ruiskujen hävittämistä koskevia valtion ja paikallisia lakeja saattaa olla voimassa. Pidä aina poissa lasten ulottuvilta.
Kuinka asettaa uusi kasettipakkaus
Kuva M Kuva N ja Kuva O 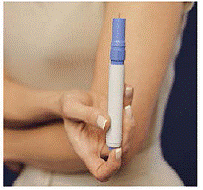
18. Ota uusi kasettipakkaus laatikostaan. Älä poista peukaloinnin osoittavia sinettejä (katso kuva M).
19. Aseta kasettipakkaus kantolaukkuun. Liu'uta sitä tasaisesti alas (katso Kuva N ).
20. Kasettipakkaus napsahtaa paikalleen, kun 2 painiketta näkyvät kantolaukun reikien läpi (katso Kuva O ). Sulje kansi.
Nämä potilastiedot ja käyttöohjeet ovat Yhdysvaltain elintarvike- ja lääkeviraston hyväksymiä.
