Imuran 50mg, 25mg Azathioprine Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Imuran on ja miten sitä käytetään?
Imuran 25mg on reseptilääke, jota käytetään nivelreuman oireiden hoitoon ja elinsiirron hylkimisreaktion ehkäisyyn. Imurania voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Imuran 25 mg kuuluu lääkeluokkaan, jota kutsutaan DMARD:iksi, immunomodulaattoreiksi; Immunosuppressantit.
Mitkä ovat Imuranin mahdolliset sivuvaikutukset?
Imuran 25 mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- kuume,
- turvonneet rauhaset,
- kehon kivut,
- yöhikoilut,
- ei voi hyvin,
- kalpea iho,
- ihottuma,
- helppo mustelma tai verenvuoto,
- kylmät kädet ja jalat,
- huimaus,
- hengenahdistus,
- kipu ylävatsassa, joka voi levitä olkapäälle,
- kylläisyyden tunne, kun olet syönyt vain pienen määrän,
- painonpudotus,
- infektion merkkejä (kuume, vilunväristykset, heikkous, flunssan oireet, kurkkukipu, yskä, kipu tai polttaminen virtsatessa),
- vaikea pahoinvointi,
- oksentelua,
- ripuli,
- nopeat sydämenlyönnit,
- tumma virtsa ja
- ihon tai silmien keltaisuus (keltatauti)
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Imuran 50mg:n yleisimmät sivuvaikutukset ovat:
- pahoinvointi,
- ripuli,
- vatsakipu,
- hiustenlähtö ja
- ihottuma
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Imuranin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
VAROITUS
MÄÄRITYS
Krooninen immunosuppressio IMURANilla, puriiniantimetaboliitilla, lisää pahanlaatuisten kasvainten riskiä ihmisillä. Raportteja pahanlaatuisista kasvaimista ovat muun muassa transplantaation jälkeinen lymfooma ja hepatospleeninen T-solulymfooma (HSTCL) potilailla, joilla on tulehduksellinen suolistosairaus. Tätä lääkettä käyttävien lääkäreiden tulee tuntea hyvin tämä riski sekä mutageeniset mahdollisuudet sekä miehille että naisille ja mahdolliset hematologiset toksisuusvaikutukset. Lääkäreiden tulee kertoa potilaille pahanlaatuisten kasvainten riskistä IMURANin käytön yhteydessä. Katso VAROITUKSET .
KUVAUS
IMURAN (atsatiopriini), immunosuppressiivinen antimetaboliitti, on saatavana tablettimuodossa suun kautta annettavaksi. Yksi jakouurteinen tabletti sisältää 50 mg atsatiopriinia ja inaktiivisia aineita laktoosia, magnesiumstearaattia, perunatärkkelystä, povidonia ja steariinihappoa.
Atsatiopriini on kemiallisesti 6-[(1-metyyli-4-nitro-1 H-imidatsol-5-yyli)tio]-1 H-puriini. Atsatiopriinin rakennekaava on:
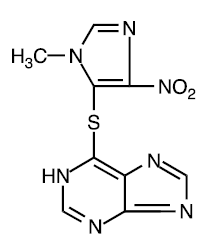
Se on 6-merkaptopuriinin imidatsolyylijohdannainen, ja monet sen biologisista vaikutuksista ovat samanlaisia kuin emoyhdisteen.
Atsatiopriini on veteen liukenematon, mutta se voidaan liuottaa lisäämällä yksi mooliekvivalentti alkalia. Atsatiopriini on stabiili liuoksessa neutraalissa tai happamassa pH:ssa, mutta hydrolysoitumista merkaptopuriiniksi tapahtuu ylimäärässä natriumhydroksidia (0,1 N), erityisesti lämmitettäessä. Muuntumista merkaptopuriiniksi tapahtuu myös sulfhydryyliyhdisteiden, kuten kysteiinin, glutationin ja vetysulfidin, läsnä ollessa.
INDIKAATIOT
IMURAN on tarkoitettu lisälääkkeeksi hylkimisreaktion ehkäisyyn munuaisten homotransplantaatiossa. Se on tarkoitettu myös aktiivisen nivelreuman hoitoon merkkien ja oireiden vähentämiseksi.
Munuaisten homotransplantaatio
IMURAN on tarkoitettu lisälääkkeeksi hylkimisreaktion ehkäisyyn munuaisten homotransplantaatiossa. Yli 16 000 siirrosta saadut kokemukset osoittavat, että 5 vuoden potilaan eloonjääminen on 35–55 %, mutta tämä riippuu luovuttajasta, HLA-antigeenien vastaavuudesta, anti-luovuttaja- tai anti-B-solu-alloantigeenivasta-aineesta ja muista muuttujista. IMURANin vaikutusta näihin muuttujiin ei ole testattu kontrolloiduissa tutkimuksissa.
Nivelreuma
IMURAN on tarkoitettu aktiivisen nivelreuman (RA) hoitoon merkkien ja oireiden vähentämiseksi. Aspiriinin, ei-steroidisten tulehduskipulääkkeiden ja/tai pieniannoksisten glukokortikoidien käyttöä voidaan jatkaa IMURAN-hoidon aikana. IMURAN 25 mg:n yhteiskäyttöä sairautta modifioivien reumalääkkeiden (DMARD) kanssa ei ole tutkittu lisähyötyjen tai odottamattomien haittavaikutusten suhteen. IMURANin käyttöä näiden aineiden kanssa ei voida suositella.
ANNOSTELU JA HALLINNOINTI
TPMT-TESTAUS EI VOI KORVATA IMURANIA SAATAVILLA POTILAATILLE TÄYDELLISEN VERENLUKENNAN (CBC) SEURANTAA. TPMT-genotyypitystä tai fenotyypitystä voidaan käyttää sellaisten potilaiden tunnistamiseen, joilla TPMT-aktiivisuus puuttuu tai heikkenee. Potilailla, joilla on alhainen tai puuttuva TPMT-aktiivisuus, on lisääntynyt vakavan, hengenvaarallisen myelotoksisuuden riski IMURANin käytöstä, jos niitä annetaan tavanomaisia annoksia. Lääkärit voivat harkita vaihtoehtoisia hoitomuotoja potilaille, joilla on alhainen tai puuttuva TPMT-aktiivisuus (homotsygoottinen ei-funktionaalisille alleeleille). IMURAN 25 mg:aa tulee antaa varoen potilaille, joilla on yksi ei-toiminnallinen alleeli (heterotsygoottinen), ja joilla on riski TPMT-aktiivisuuden vähenemisestä, mikä voi johtaa toksisuuteen, jos tavanomaisia annoksia annetaan. Annoksen pienentämistä suositellaan potilaille, joilla on alentunut TPMT-aktiivisuus. Lääkkeen varhaista lopettamista voidaan harkita potilailla, joilla on epänormaaleja CBC-tuloksia, jotka eivät reagoi annoksen pienentämiseen.
Munuaisten homotransplantaatio
Hyljintäreaktion estämiseen ja toksisuuden minimoimiseen tarvittava IMURAN 50 mg -annos vaihtelee yksittäisten potilaiden mukaan; tämä vaatii huolellista hallintaa. Aloitusannos on yleensä 3-5 mg/kg vuorokaudessa elinsiirrosta alkaen. IMURANia annetaan yleensä kerta-annoksena vuorokaudessa elinsiirtopäivänä ja harvoissa tapauksissa 1–3 päivää ennen sitä. Annoksen pienentäminen ylläpitotasolle 1–3 mg/kg päivässä on yleensä mahdollista. IMURAN 50 mg annosta ei saa suurentaa toksiselle tasolle hylkimisreaktion uhan vuoksi. Hoidon keskeyttäminen voi olla tarpeen vakavan hematologisen tai muun toksisuuden vuoksi, vaikka homograftin hylkääminen olisi seurausta lääkkeen lopettamisesta.
Nivelreuma
IMURAN 50 mg annetaan yleensä päivittäin. Aloitusannoksen tulee olla noin 1,0 mg/kg (50-100 mg) kerta-annoksena tai kahdesti vuorokaudessa. Annosta voidaan suurentaa alkaen 6–8 viikon välein ja sen jälkeen portaittain 4 viikon välein, jos vakavia toksisuuksia ei esiinny ja jos ensimmäinen vaste on epätyydyttävä. Annoksen lisäyksen tulee olla 0,5 mg/kg vuorokaudessa, enintään 2,5 mg/kg vuorokaudessa. Terapeuttinen vaste ilmenee useiden viikkojen hoidon jälkeen, yleensä 6-8; riittävän kokeen tulisi olla vähintään 12 viikkoa. Potilaiden, jotka eivät ole parantuneet 12 viikon jälkeen, voidaan katsoa olevan tulenkestäviä. IMURAN 50 mg:n käyttöä voidaan jatkaa pitkään potilailla, joilla on kliininen vaste, mutta potilaita on seurattava huolellisesti ja annoksen asteittaista pienentämistä on pyrittävä vähentämään toksisuusriskiä.
Ylläpitohoidossa tulee olla pienin tehokas annos, ja annettua annosta voidaan pienentää asteittain muuttamalla 0,5 mg/kg tai noin 25 mg vuorokaudessa 4 viikon välein samalla, kun muu hoito pidetään vakiona. IMURAN 50 mg:n ylläpitohoidon optimaalista kestoa ei ole määritetty. IMURAN-hoito voidaan lopettaa äkillisesti, mutta viivästyneet vaikutukset ovat mahdollisia.
Käyttö munuaisten vajaatoiminnassa
Suhteellisen oligurisilla potilailla, erityisesti niillä, joilla on tubulusnekroosi välittömässä kadaverisen siirtojakson aikana, voi olla viivästynyt IMURANin tai sen metaboliittien puhdistuma, he voivat olla erityisen herkkiä tälle lääkkeelle, ja heille annetaan yleensä pienempiä annoksia.
Tämän immunosuppressiivisen antimetaboliittilääkkeen asianmukaista käsittelyä ja hävittämistä koskevia toimenpiteitä tulee harkita. Tästä aiheesta on julkaistu useita ohjeita.25-31 Ei ole olemassa yleistä yksimielisyyttä siitä, että kaikki ohjeissa suositellut menettelyt ovat tarpeellisia tai asianmukaisia.
MITEN TOIMITETAAN
50 mg päällekkäiset ympyränmuotoiset, keltaiset tai luonnonvalkoiset, jakouurteiset tabletit, joihin on painettu "IMURAN" ja "50" jokaiseen tablettiin; pullo 100 ( NDC 65483-590-10).
Säilytä 15° - 25°C (59° - 77°F) kuivassa paikassa valolta suojattuna.
VIITTEET
25. Suositukset parenteraalisten antineoplastisten lääkkeiden turvalliseen käsittelyyn. Washington, DC: Turvallisuusosasto; Kliinisen keskuksen apteekkiosasto ja syövänhoitopalvelut, Kansallinen terveyslaitos; 1992. Yhdysvaltain terveys- ja henkilöstöosasto. Kansanterveyspalvelujen julkaisu NIH 92-2621.
26. AMA:n tieteellisten asioiden neuvosto. Ohjeet parenteraalisten antineoplastisten lääkkeiden käsittelyyn. JAMA. 1985; 253:15901592.
27. National Study Commission on Cytotoxic Exposure. Suositukset sytotoksisten aineiden käsittelyyn. 1987. Saatavilla Louis P. Jeffreyltä, puheenjohtajalta, National Study Commission on Cytotoxic Exposure. Massachusetts College of Pharmacy and Allied Health Sciences, 179 Longwood Avenue, Boston, MA 02115.
28. Clinical Oncological Society of Australia. Ohjeet ja suositukset antineoplastisten aineiden turvalliseen käsittelyyn. Med J Aust. 1983; 1:426-428.
29. Jones RB, Frank R, Mass T. Kemoterapeuttisten aineiden turvallinen käsittely: raportti Mount Sinai Medical Centeristä. CA Cancer J kliinikoille. 1983; 33:258-263.
30. American Society of Hospital Pharmacists. ASHP:n teknisen tuen tiedote sytotoksisten ja vaarallisten lääkkeiden käsittelystä. Olen J Hosp Pharm. 1990; 47:1033-1049.
31. Yodaiken RE, Bennett D. OSHA Work-Practice -ohjeet sytotoksisia (antineoplastisia) lääkkeitä käsitteleville henkilöille. Am J. Hosp Pharm, 1996; 43:1193-1204.
Valmistaja Pharmaceutics International, Inc. Hunt Valley, MD 21031, Prometheus Laboratories Inc. San Diego, CA 92121. Tarkistettu: helmikuu 2014
SIVUVAIKUTUKSET
IMURANin tärkeimmät ja mahdollisesti vakavat toksiset vaikutukset ovat hematologiset ja ruoansulatuskanavan aiheuttamat vaikutukset. Sekundaarisen infektion ja pahanlaatuisuuden riskit ovat myös merkittäviä (ks VAROITUKSET ). Haittavaikutusten esiintymistiheys ja vakavuus riippuvat IMURAN-annoksesta ja kestosta sekä potilaan perussairaudesta tai samanaikaisista hoidoista. Hematologisten toksisuuksien ja neoplasian ilmaantuvuus munuaishomografiaan saaneiden ryhmissä on merkittävästi suurempi kuin tutkimuksissa, joissa käytettiin IMURANia 25 mg nivelreuman hoitoon. Suhteellinen ilmaantuvuus kliinisissä tutkimuksissa on yhteenveto alla:
Hematologinen
Leukopenia ja/tai trombosytopenia ovat annoksesta riippuvaisia ja voivat ilmaantua IMURAN-hoidon myöhään. Annoksen pienentäminen tai väliaikainen keskeyttäminen voi johtaa näiden toksisuuksien palautumiseen. Infektio voi ilmaantua luuydinsuppression tai leukopenian toissijaisena ilmentymänä, mutta munuaisten homotransplantaatiossa infektion ilmaantuvuus on 30-60 kertaa nivelreumassa. Anemioita, mukaan lukien makrosyyttinen anemia, ja/tai verenvuotoa on raportoitu.
TPMT-genotyypitys tai fenotyypitys voi auttaa tunnistamaan potilaita, joilla on alhainen tai puuttuva TPMT-aktiivisuus (homotsygoottinen ei-funktionaalisille alleeleille), joilla on suurentunut riski saada IMURANin aiheuttama vakava, henkeä uhkaava myelosuppressio. Katso KLIININEN FARMAKOLOGIA , VAROITUKSET ja VAROTOIMENPITEET : Laboratoriotestit . Pansytopeniaan liittyvää kuolemaa on raportoitu potilailla, joilla ei ole TPMT-aktiivisuutta ja jotka saavat atsatiopriinia.6,20
Ruoansulatuskanava
Pahoinvointia ja oksentelua saattaa esiintyä muutaman ensimmäisen kuukauden aikana IMURAN 50 mg -hoidon aikana, ja niitä esiintyi noin 12 %:lla 676 nivelreumapotilaasta. Vatsahäiriöiden esiintymistiheyttä voidaan usein vähentää antamalla lääke jaettuna annoksina ja/tai aterioiden jälkeen. Joillakin potilailla pahoinvointi ja oksentelu voivat kuitenkin olla vakavia ja niihin voi liittyä oireita, kuten ripulia, kuumetta, huonovointisuutta ja lihaskipuja (ks. VAROTOIMENPITEET ). Oksentelua ja vatsakipua voi harvoin esiintyä yliherkkyyshaimatulehduksen yhteydessä. Maksatoksisuutta, joka ilmenee seerumin alkalisen fosfataasin, bilirubiinin ja/tai seerumin transaminaasiarvojen nousuna, tiedetään esiintyvän atsatiopriinin käytön jälkeen, pääasiassa allograftin saajilla. Maksatoksisuus on ollut harvinaista (alle 1 %) nivelreumapotilailla. Elinsiirron jälkeinen maksatoksisuus ilmenee useimmiten 6 kuukauden kuluessa siirrosta ja on yleensä palautuva IMURAN-hoidon keskeyttämisen jälkeen. Harvinainen, mutta hengenvaarallinen maksan laskimotukossairaus, joka liittyy krooniseen atsatiopriinin antamiseen, on kuvattu elinsiirtopotilailla ja yhdellä potilaalla, joka sai IMURANia panuveiitin vuoksi.21,22,23 Seerumin transaminaasien, alkalisen fosfataasin ja bilirubiinin säännöllinen mittaus on tarkoitettu maksatoksisuuden varhaiseen havaitsemiseen. Jos maksan laskimotukoksen aiheuttamaa sairautta epäillään kliinisesti, IMURAN-hoito tulee lopettaa pysyvästi.
muut
Muita alhaisen esiintymistiheyden sivuvaikutuksia on raportoitu. Näitä ovat ihottumat, hiustenlähtö, kuume, nivelkivut, ripuli, steatorrea, negatiivinen typpitasapaino, palautuva interstitiaalinen pneumoniitti, hepatospleeninen T-solulymfooma (ks. VAROITUKSET – Pahanlaatuisuus ) ja Sweetin oireyhtymä (akuutti kuumeinen neutrofiilinen dermatoosi).
HUUMEIDEN VUOROVAIKUTUKSET
Käytä Allopurinolin kanssa
Allopurinoli estää yhden atsatiopriinin inaktivoinnin reiteistä. Potilaiden, jotka saavat IMURANia 50 mg ja allopurinolia samanaikaisesti, tulee pienentää IMURAN 50 mg annosta noin 1/3 - 1/4 tavallisesta annoksesta. On suositeltavaa, että annoksen pienentämistä tai vaihtoehtoisia hoitoja harkitaan potilailla, joilla on alhainen tai puuttuva TPMT-aktiivisuus ja jotka saavat 50 mg IMURANia ja allopurinolia, koska se vaikuttaa sekä TPMT- että XO-inaktivaatioreitteihin. Katso KLIININEN FARMAKOLOGIA , VAROITUKSET , VAROTOIMENPITEET : Laboratoriotestit ja HAITTAVAIKUTUKSET osiot.
Käytä aminosalisylaattien kanssa
In vitro on näyttöä siitä, että aminosalisylaattijohdannaiset (esim. sulfasalatsiini, mesalatsiini tai olsalatsiini) estävät TPMT-entsyymiä. Näitä aineita käytettäessä samanaikaisesti IMURAN 50 mg:n kanssa tulee noudattaa varovaisuutta.
Käytä muiden myelopoeesiin vaikuttavien aineiden kanssa
Lääkkeet, jotka voivat vaikuttaa leukosyyttien tuotantoon, mukaan lukien kotrimoksatsoli, voivat johtaa liialliseen leukopeniaan, erityisesti munuaissiirtopotilailla.
Käytä angiotensiiniä konvertoivan entsyymin estäjien kanssa
Angiotensiinia konvertoivan entsyymin estäjien käytön verenpaineen hallintaan atsatiopriinipotilailla on raportoitu aiheuttavan anemiaa ja vaikeaa leukopeniaa.
Käytä varfariinin kanssa
IMURAN saattaa estää varfariinin antikoagulanttivaikutuksen.
Käytä ribaviriinin kanssa
Ribaviriinin käytön hepatiitti C:n hoitoon atsatiopriinia saavilla potilailla on raportoitu aiheuttavan vaikeaa pansytopeniaa ja saattaa lisätä atsatiopriiniin liittyvän myelotoksisuuden riskiä. Inosiinimonofosfaattidehydrogenaasia (IMDH) tarvitaan yhdelle atsatiopriinin metaboliareiteistä. Ribaviriinin tiedetään estävän IMDH:ta, mikä johtaa atsatiopriinimetaboliitin, 6-metyylitioionosiinimonofosfaatin (6MTITP) kertymiseen, mikä liittyy myelotoksisuuteen (neutropenia, trombosytopenia ja anemia). Atsatiopriinia ja ribaviriinia saavien potilaiden täydellinen verenkuva, mukaan lukien verihiutaleiden määrä, tulee seurata viikoittain ensimmäisen kuukauden ajan, kahdesti kuukaudessa toisen ja kolmannen hoitokuukauden ajan, sitten kuukausittain tai useammin, jos annostusta tai muita hoitomuutoksia tarvitaan.
VIITTEET
6. Tiedostossa olevat tiedot, Prometheus Laboratories Inc.
20. Schutz E, Gummert J, Mohr F, Oellerich M. Atsatiopriinin aiheuttama myelosuppressio tiopuriinimetyylitransferaasipuutteellisilla sydämensiirtopotilailla. Lansetti. 1993; 341:436.
21. Lue AE, Wiesner RH, LaBrecque DR, et ai. Munuaisensiirtoon ja atsatiopriinihoitoon liittyvä maksan laskimotukossairaus. Ann Intern Med. 1986; 104:651-655.
22. Katzka DA, Saul SH, Jorkasky D, et ai. Atsatiopriini ja maksan veno-okklusiivinen sairaus munuaisensiirtopotilailla. Gastroenterologia. 1986; 90:446-454.
23. Weitz H, Gokel JM, Loeshke K, et ai. Maksan laskimotukoksen aiheuttama sairaus potilailla, jotka saavat immunosuppressiivista hoitoa. Virchows Arch A Pathol Anat Histol. 1982; 395:245-256.
VAROITUKSET
Pahanlaatuisuus
Potilailla, jotka saavat immunosuppressantteja, mukaan lukien IMURAN 50 mg, on lisääntynyt riski saada lymfooma ja muita pahanlaatuisia kasvaimia, erityisesti ihossa. Lääkäreiden tulee kertoa potilaille pahanlaatuisten kasvainten riskistä IMURANin käytön yhteydessä. Kuten tavallista potilailla, joilla on suurentunut ihosyövän riski, altistumista auringonvalolle ja ultraviolettivalolle tulee rajoittaa käyttämällä suojavaatetusta ja korkean suojakertoimen omaavaa aurinkovoidetta.
Siirron jälkeinen
Munuaisensiirtopotilailla tiedetään olevan lisääntynyt riski saada pahanlaatuisia kasvaimia, pääasiassa ihosyöpää ja verkkosolu- tai lymfomatoottisia kasvaimia. Transplantation jälkeisten lymfoomien riski voi lisääntyä potilailla, jotka saavat aggressiivista hoitoa immunosuppressiivisilla lääkkeillä, mukaan lukien IMURAN. Siksi immunosuppressiivinen lääkehoito on pidettävä alhaisimman tehokkaan tason tasolla.
Nivelreuma
Saatavilla on tietoa pahanlaatuisten kasvainten riskistä käytettäessä IMURAN 50 mg nivelreumassa (ks. HAITTAVAIKUTUKSET ). IMURANin aiheuttamaa pahanlaatuisuuden tarkkaa riskiä ei ole voitu määrittää. Tiedot viittaavat siihen, että riski voi olla kohonnut potilailla, joilla on nivelreuma, vaikkakin pienempi kuin munuaisensiirtopotilailla. Akuuttia myelooista leukemiaa sekä kiinteitä kasvaimia on kuitenkin raportoitu nivelreumapotilailla, jotka ovat saaneet IMURANia.
Tulehduksellinen suolistosairaus
IMURANilla hoidetuilla potilailla on raportoitu markkinoille tulon jälkeen hepatospleenistä T-solulymfoomaa (HSTCL), joka on harvinainen T-solulymfooman tyyppi. Näillä tapauksilla on ollut erittäin aggressiivinen sairauden kulku ja ne ovat johtaneet kuolemaan. Suurin osa raportoiduista tapauksista on esiintynyt potilailla, joilla on Crohnin tauti tai haavainen paksusuolitulehdus, ja suurin osa niistä oli nuorilla ja nuorilla aikuisilla miehillä. Joitakin potilaita hoidettiin IMURAN-valmisteella monoterapiana ja jotkut olivat saaneet samanaikaista hoitoa TNFα-salpaajalla diagnoosin yhteydessä tai ennen sitä. IMURAN 25 mg:n turvallisuutta ja tehoa Crohnin taudin ja haavaisen paksusuolitulehduksen hoidossa ei ole osoitettu.
Sytopeniat
Vaikeaa leukopeniaa, trombosytopeniaa, anemioita, mukaan lukien makrosyyttinen anemia, ja/tai pansytopenia voi esiintyä IMURAN-hoitoa saavilla potilailla. Voi myös esiintyä vakavaa luuytimen suppressiota. Potilailla, joilla on keskimääräinen tiopuriini-S-metyylitransferaasi (TPMT) aktiivisuus, saattaa olla lisääntynyt myelotoksisuuden riski, jos he saavat tavanomaisia IMURAN-annoksia. Potilailla, joilla on alhainen tai puuttuva TPMT-aktiivisuus, on suurentunut vakavan, hengenvaarallisen myelotoksisuuden riski, jos he saavat tavanomaisia IMURAN-annoksia. TPMT-genotyypitys tai fenotyypitys voi auttaa tunnistamaan potilaat, joilla on lisääntynyt riski saada IMURAN 50 mg:n toksisuus.2-9 (katso VAROTOIMENPITEET : Laboratoriotestit ). Hematologiset toksisuudet ovat annoksesta riippuvaisia ja voivat olla vakavampia munuaisensiirtopotilailla, joiden homografti on hylkimisreaktiovaiheessa. On ehdotettu, että IMURAN-hoitoa saavien potilaiden täydellinen verenkuva, mukaan lukien verihiutaleiden määrä, mitataan viikoittain ensimmäisen kuukauden aikana, kahdesti kuukaudessa toisen ja kolmannen hoitokuukauden aikana, sitten kuukausittain tai useammin, jos annosmuutoksia tai muita hoitomuutoksia tarvitaan. Viivästynyttä hematologista suppressiota voi esiintyä. Nopea annoksen pienentäminen tai lääkkeen tilapäinen lopettaminen voi olla tarpeen, jos leukosyyttien määrä laskee nopeasti tai se on jatkuvasti alhainen tai jos on muita todisteita luuytimen lamasta. Leukopenia ei korreloi terapeuttisen vaikutuksen kanssa; siksi annosta ei pidä suurentaa tarkoituksellisesti valkosolujen määrän alentamiseksi.
Vakavat infektiot
Potilailla, jotka saavat immunosuppressantteja, mukaan lukien 25 mg Imurania, on lisääntynyt bakteeri-, virus-, sieni-, alkueläin- ja opportunististen infektioiden riski, mukaan lukien piilevien infektioiden uudelleenaktivoituminen. Nämä infektiot voivat johtaa vakaviin, mukaan lukien kuolemaan johtaviin seurauksiin.
Progressiivinen multifokaalinen leukoenkefalopatia
Immunosuppressiivisilla lääkkeillä, mukaan lukien Imuranilla, hoidetuilla potilailla on raportoitu JC-virukseen liittyvää infektiotapauksia, jotka ovat johtaneet progressiiviseen multifokaaliseen leukoenkefalopatiaan (PML), joskus kuolemaan. PML:n riskitekijöitä ovat hoito immunosuppressiivisilla hoidoilla ja immuunitoiminnan heikkeneminen. Harkitse PML-diagnoosia jokaisella potilaalla, jolla on uusia neurologisia oireita, ja harkitse neurologin puoleen kääntymistä kliinisen tarpeen mukaan. Harkitse immunosuppression määrän vähentämistä potilailla, joille kehittyy PML. Elinsiirtopotilailla ota huomioon riski, että heikentynyt immunosuppressio edustaa siirrännäistä.
Vaikutus siittiöihin eläimissä
IMURANin on raportoitu aiheuttavan tilapäistä spermatogeneesin heikkenemistä ja siittiöiden elinkelpoisuuden ja siittiöiden määrän alenemista hiirillä annoksilla, jotka olivat 10-kertaisia ihmisen terapeuttiseen annokseen verrattuna.
Raskaus
Raskausluokka D
IMURAN voi aiheuttaa sikiövaurioita, kun sitä annetaan raskaana olevalle naiselle. IMURAN 50 mg -valmistetta ei tule antaa raskauden aikana ilman, että riski-hyötysuhdetta on punnittu huolellisesti. Aina kun mahdollista, IMURANin käyttöä raskaana oleville potilaille tulee välttää. Tätä lääkettä ei tule käyttää raskaana olevien naisten nivelreuman hoitoon.12
IMURAN on teratogeeninen kaneilla ja hiirillä annettuna annoksia, jotka vastaavat ihmisen annosta (5 mg/kg päivässä). Poikkeavuuksia olivat luuston epämuodostumat ja sisäelinten poikkeavuudet.11
Muutamilla imeväisillä, jotka ovat syntyneet IMURAN-hoitoa saaneista munuaissiirteen saajista, on esiintynyt rajoitetusti immunologisia ja muita poikkeavuuksia. Yksityiskohtaisessa tapausraportissa13 dokumentoitua lymfopeniaa, alentuneet IgG- ja IgM-tasot, CMV-infektio ja vähentynyt kateenkorvan varjo havaittiin lapsella, jonka äiti sai 150 mg atsatiopriinia ja 30 mg prednisonia päivässä koko raskauden ajan. Viikon 10 kohdalla useimmat ominaisuudet normalisoituivat. DeWitte ym. raportoivat pansytopeniasta ja vakavasta immuunivajauksesta keskosella, jonka äiti sai 125 mg atsatiopriinia ja 12,5 mg prednisonia päivittäin.14 Epänormaaleista fyysisistä löydöksistä on julkaistu kaksi raporttia. Williamson ja Karp kuvasivat vauvaa, joka syntyi preaksiaalisella polydaktylialla ja jonka äiti sai atsatiopriinia 200 mg päivässä ja prednisonia 20 mg joka toinen päivä raskauden aikana.15 Tallent ym. kuvasivat lapsen, jolla oli suuri myelomeningosele ylemmässä lannerangan alueella, molemminpuolinen sijoiltaan siirtynyt lantio ja molemminpuolinen talipes equinovarus. Isä oli pitkäaikaisessa atsatiopriinihoidossa.16
Hyöty-riskisuhde on punnittava huolellisesti ennen IMURANin käyttöä lisääntymiskykyisille potilaille. Ei ole olemassa riittäviä ja hyvin kontrolloituja tutkimuksia raskaana oleville naisille. Jos tätä lääkettä käytetään raskauden aikana tai jos potilas tulee raskaaksi tämän lääkkeen käytön aikana, potilasta on informoitava mahdollisesta vaarasta sikiölle. Hedelmällisessä iässä olevia naisia tulee neuvoa välttämään raskaaksi tulemista.
VAROTOIMENPITEET
Kenraali
Ruoansulatuskanavan yliherkkyysreaktiota, jolle on ominaista vaikea pahoinvointi ja oksentelu, on raportoitu. Näihin oireisiin voi liittyä myös ripulia, ihottumaa, kuumetta, huonovointisuutta, lihaskipuja, maksaentsyymiarvojen nousua ja toisinaan hypotensiota. Ruoansulatuskanavan toksisuuden oireet ilmaantuvat useimmiten useiden ensimmäisten viikkojen aikana IMURAN 25 mg -hoidon aikana, ja ne palautuvat lääkkeen käytön lopettamisen jälkeen. Reaktio voi uusiutua muutamassa tunnissa sen jälkeen, kun se on altistettu uudelleen yhdellä IMURAN-annoksella.
Laboratoriotestit
Täydellinen verenkuvan (CBC) seuranta
Potilailta, jotka saavat IMURAN 25 mg, tulee mitata täydellinen verenkuva, mukaan lukien verihiutaleiden määrä, viikoittain ensimmäisen kuukauden aikana, kahdesti kuukaudessa toisen ja kolmannen hoitokuukauden aikana, sitten kuukausittain tai useammin, jos annosmuutoksia tai muita hoitomuutoksia tarvitaan.
TPMT-testaus
On suositeltavaa ottaa huomioon joko genotyyppi- tai fenotyyppipotilaat TPMT:n varalta. Fenotyypitys- ja genotyypitysmenetelmiä on kaupallisesti saatavilla. Yleisimmät ei-toiminnalliset alleelit, jotka liittyvät alentuneeseen TPMT-aktiivisuuden tasoon, ovat TPMT*2, TPMT*3A ja TPMT*3C. Potilailla, joilla on kaksi ei-funktionaalista alleelia (homotsygoottinen), TPMT-aktiivisuus on alhainen tai puuttuu, ja potilailla, joilla on yksi ei-toiminnallinen alleeli (heterotsygoottinen), aktiivisuus on keskitasoa. Tarkat fenotyyppitulokset (punasolujen TPMT-aktiivisuus) eivät ole mahdollisia potilailla, jotka ovat saaneet äskettäin verensiirtoja. TPMT-testiä voidaan harkita myös potilailla, joilla on epänormaaleja CBC-tuloksia, jotka eivät reagoi annoksen pienentämiseen. Lääkkeen varhainen lopettaminen näillä potilailla on suositeltavaa. TPMT-TESTAUS EI VOI KORVATA IMURANIA SAATAVILLA POTILAATILLE TÄYDELLISEN VERENLUKENNAN (CBC) SEURANTAA. Katso KLIININEN FARMAKOLOGIA , VAROITUKSET , HAITTAVAIKUTUKSET ja ANNOSTELU JA HALLINNOINTI osiot.
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Katso VAROITUKSET osio.
Raskaus
Teratogeeniset vaikutukset
Raskausluokka D. Katso VAROITUKSET osio.
Imettävät äidit
IMURAN 25 mg:n käyttöä imettäville äideille ei suositella. Atsatiopriini tai sen metaboliitit siirtyvät pieninä määrinä sekä istukan kautta että äidinmaitoon.17,18,19 Koska atsatiopriinilla on todettu tuumorigeenisyyttä, on päätettävä, lopetetaanko imetys vai lopetetaanko lääkehoito ottaen huomioon lääkkeen merkitys äidille.
Käyttö lapsille
Atsatiopriinin turvallisuutta ja tehoa lapsipotilailla ei ole varmistettu.
VIITTEET
2. Weinshilboum R. Tiopuriinin farmakogenetiikka: tiopuriinimetyylitransferaasin kliiniset ja molekyylitutkimukset. Drug Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. Tiopuriini S-metyylitransferaasigeenin lokus -- vaikutukset kliiniseen farmakogenomiikkaan. Farmakogenomiikka. 2002;3:89-98.
4. Anstey A, Lennard L, Mayou SC, et ai. Atsatiopriiniin liittyvä pansytopenia – yleisen geneettisen polymorfismin aiheuttama entsyymipuutos: katsaus. JR Soc Med. 1992; 85:752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et ai. Vähentynyt tiopuriinimetyylitransferaasiaktiivisuus ja atsatiopriinihoidon sivuvaikutusten kehittyminen potilailla, joilla on nivelreuma. Rheum-niveltulehdus. 1998; 41:18581866.
6. Tiedostossa olevat tiedot, Prometheus Laboratories Inc.
7. Yates CR, Krynetski EY, Loennechen T, et ai. Tiopuriini-S-metyylitransferaasin puutteen molekyylidiagnoosi: geneettinen perusta atsatiopriini- ja merkaptopuriini-intoleranssille. Ann Intern Med. 1997; 126:608-614.
8. Black AJ, McLeod HL, Capell HA, et ai. Tiopuriinimetyylitransferaasin genotyyppi ennustaa atsatiopriinin hoitoa rajoittavan vakavan toksisuuden. Ann Intern Med. 1998; 129:716-718.
9. Clunie GP, Lennard L. Tiopuriinimetyylitransferaasistatuksen merkitys reumatologiapotilailla, jotka saavat atsatiopriinia. Reumatologia. 2004; 43:13-18.
10. Clark JM. Atsatiopriinin mutageenisuus hiirissä, Drosophila melanogasterissa ja Neurospora crassassa. Mutat Res. 1975; 28:87-99.
11. Tiedostossa olevat tiedot, Prometheus Laboratories Inc.
12. Tagatz GE, Simmons RL. Raskaus munuaisensiirron jälkeen. Ann Intern Med. 1975; 82:113-114. Toimitukselliset huomautukset.
13. Cote' CJ, Meuwissen HJ, Pickering RJ. Äidille raskauden aikana annetun prednisonin ja atsatiopriinin vaikutukset vastasyntyneeseen. J Pediatr. 1974; 85:324-328.
14. DeWitte DB, Buick MK, Cyran SE, et ai. Vastasyntyneen pansytopenia ja vaikea yhdistetty immuunipuutos, joka liittyy atsatiopriinin ja prednisonin synnytystä edeltävään antoon. J Pediatr. 1984; 105:625-628.
15. Williamson RA, Karp LE. Atsatiopriinin teratogeenisuus: kirjallisuuden katsaus ja tapausraportti. Obstet Gynecol. 1981; 58:247-250.
16. Tallent MB, Simmons RL, Najarian JS. Munuaisensiirron saaneen miespuolisen lapsen synnynnäisiä epämuodostumia. JAMA. 1970; 211: 1854-1855.
17. Tiedostossa olevat tiedot, Prometheus Laboratories Inc.
18. Saarikoski S, Seppälä M. Immunosuppressio raskauden aikana: atsatiopriinin ja sen metaboliittien siirtyminen äidistä sikiöön. Olen J Obstet Gynecol. 1973; 115:1100-1106.
19. Coulam CB, Moyer TP, Jiang NS, et ai. Imetys munuaisensiirron jälkeen. Transplant Proc. 1982; 14: 605-609.
YLIANNOSTUS
Suun kautta otettavat LD50-arvot IMURANin kerta-annoksilla 50 mg hiirillä ja rotilla ovat 2500 mg/kg ja 400 mg/kg. Tämän antimetaboliitin erittäin suuret annokset voivat johtaa luuytimen hypoplasiaan, verenvuotoon, infektioon ja kuolemaan. Noin 30 % IMURANista sitoutuu seerumin proteiineihin, mutta noin 45 % poistuu 8 tunnin hemodialyysin aikana.24 Yksittäinen tapaus on raportoitu munuaisensiirtopotilaasta, joka nautti kerta-annoksen 7500 mg IMURANia. Välittömät toksiset reaktiot olivat pahoinvointi, oksentelu ja ripuli, joita seurasi lievä leukopenia ja lieviä poikkeavuuksia maksan toiminnassa. Valkosolujen määrä, SGOT ja bilirubiini palautuivat normaaliksi 6 päivää yliannostuksen jälkeen.
VASTA-AIHEET
IMURAN 25 mg -valmistetta ei tule antaa potilaille, jotka ovat osoittaneet yliherkkyyttä lääkkeelle. IMURANia ei tule käyttää raskaana olevien naisten nivelreuman hoitoon. Nivelreumapotilailla, joita on aiemmin hoidettu alkyloivilla aineilla (syklofosfamidilla, klorambusiililla, melfalaanilla tai muilla), voi olla kohtuullinen pahanlaatuisuusriski, jos heitä hoidetaan IMURAN-valmisteella.
VIITTEET
24. Schusziarra V, Ziekursch V, Schlamp R, et ai. Atsatiopriinin farmakokinetiikka hemodialyysissä. Int J Clin Pharmacol Biopharm. 1976; 14:298-302.
KLIININEN FARMAKOLOGIA
Atsatiopriini imeytyy hyvin oraalisen annon jälkeen. Suurin seerumin radioaktiivisuus ilmaantuu 1-2 tunnin kuluttua oraalisen 35S-atsatiopriinin annosta, ja se laskee puoliintumisajalla 5 tuntia. Tämä ei ole arvio atsatiopriinin puoliintumisajasta, vaan se on kaikkien lääkkeen 35S:tä sisältävien metaboliittien hajoamisnopeus. Laajan metabolian vuoksi vain murto-osa radioaktiivisuudesta on atsatiopriinina. Tavalliset annokset aiheuttavat atsatiopriinin ja siitä peräisin olevan merkaptopuriinin pitoisuudet veressä, jotka ovat alhaisia ( YLIANNOSTUS .
Atsatiopriini metaboloituu 6-merkaptopuriiniksi (6-MP). Molemmat yhdisteet poistuvat nopeasti verestä ja hapettuvat tai metyloituvat erytrosyyteissä ja maksassa; atsatiopriinia tai merkaptopuriinia ei ole havaittavissa virtsassa 8 tunnin kuluttua. 6-merkaptopuriini aktivoituu hypoksantiini-guaniinifosforibosyylitransferaasin (HGPRT) ja useiden monientsymaattisten prosessien kautta, joissa kinaasit muodostavat 6-tioguaniininukleotideja (6-TGN:t) päämetaboliitteina (katso Aineenvaihduntakaavio kuvassa 1 ). Atsatiopriinin sytotoksisuus johtuu osittain 6-TGN:n liittymisestä DNA:han.
6-MP käy läpi kaksi pääasiallista inaktivointireittiä (kuva 1). Yksi niistä on tiolin metylaatio, jota tiopuriini-S-metyylitransferaasi (TPMT) -entsyymi katalysoi, jolloin muodostuu inaktiivinen metaboliitti metyyli-6-MP (6-MeMP). TPMT-aktiivisuutta säätelee geneettinen polymorfismi.1,2,3 Valkoihoisilla ja afroamerikkalaisilla noin 10 % väestöstä perii yhden ei-funktionaalisen TPMT-alleelin (heterotsygoottinen), joka antaa välivaiheen TPMT-aktiivisuuden, ja 0,3 % perii kaksi ei-toiminnallista TPMT-alleelia. alleelit (homotsygoottiset) alhaisen tai puuttuvan TPMT-aktiivisuuden vuoksi. Ei-toiminnalliset alleelit ovat harvinaisempia aasialaisilla. TPMT-aktiivisuus korreloi käänteisesti 6-TGN-tasojen kanssa erytrosyyteissä ja oletettavasti muissa hematopoieettisissa kudoksissa, koska näillä soluilla on mitätön ksantiinioksidaasi (joka liittyy toiseen inaktivaatioreittiin) aktiivisuus, jolloin TPMT-metylaatio on ainoa inaktivaatioreitti. Potilailla, joilla on keskitasoinen TPMT-aktiivisuus, voi olla lisääntynyt myelotoksisuuden riski, jos he saavat tavanomaisia IMURAN-annoksia. Potilailla, joilla on alhainen tai puuttuva TPMT-aktiivisuus, on lisääntynyt vakavan, hengenvaarallisen myelotoksisuuden riski, jos he saavat tavanomaisia IMURAN-annoksia. 4-9 TPMT-genotyypitys tai -fenotyypitys (punasolujen TPMT-aktiivisuus) voi auttaa tunnistamaan potilaita, joilla on lisääntynyt riski IMURANin 25 mg:n toksisuuden kehittymiselle.2,3,7,8,9 Tarkat fenotyypitystulokset (punasolujen TPMT-aktiivisuus) eivät ole mahdollisia potilailla, jotka ovat saaneet äskettäin verensiirtoja. Katso VAROITUKSET , VAROTOIMENPITEET : HUUMEIDEN VUOROVAIKUTUKSET , VAROTOIMENPITEET : Laboratoriotestit ja HAITTAVAIKUTUKSET osiot.
Kuvio 1 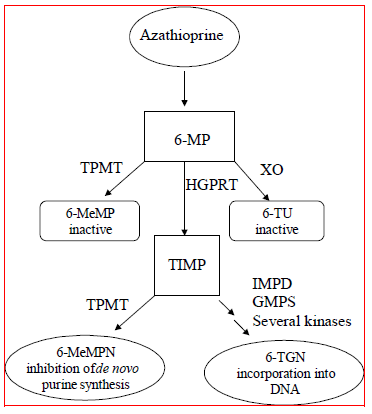 Kuva 1. Atsatiopriinin aineenvaihduntareitti: kilpailevat reitit johtavat TPMT:n tai XO:n inaktivaatioon tai sytotoksisten nukleotidien sisällyttämiseen DNA:han.
Kuva 1. Atsatiopriinin aineenvaihduntareitti: kilpailevat reitit johtavat TPMT:n tai XO:n inaktivaatioon tai sytotoksisten nukleotidien sisällyttämiseen DNA:han.
GMPS: guanosiinimonofosfaattisyntetaasi; HGPRT: Hypoksantiini-guaniini-fosforibosyyli-transferaasi; IMPD: inosiinimonofosfaattidehydrogenaasi; MeMP: metyylimerkaptopuriini; MeMPN: Metyylimerkaptopuriininukleotidi; TGN: tioguaniininukleotidit; TIMP: Tioinosiinimonofosfaatti; TPMT: tiopuriini-S-metyylitransferaasi; TU Tiouric happo; XO: Ksantiinioksidaasi (muokattu julkaisusta Pharmacogenomics 2002; 3:89-98; and Cancer Res 2001; 61:5810-5816.)
Toinen inaktivaatioreitti on hapettuminen, jota ksantiinioksidaasi (XO) katalysoi muodostaen 6-tiourihappoa. Ksantiinioksidaasin esto allopurinolia (ZYLOPRIM®) saavilla potilailla on perusta näillä potilailla vaadittavalle atsatiopriinin annoksen pienentämiselle (ks. VAROTOIMENPITEET : HUUMEIDEN VUOROVAIKUTUKSET ). Metaboliittien osuudet ovat erilaisia yksittäisillä potilailla, ja tämä oletettavasti selittää lääkkeen vaikutusten vaihtelevan suuruuden ja keston. Munuaispuhdistuma ei todennäköisesti ole tärkeä biologisen tehokkuuden tai toksisuuden ennustamisessa, vaikka annosta pienennetään potilailla, joiden munuaisten toiminta on heikko.
Homograftin selviytyminen
Atsatiopriinin käyttö munuaisten homograftin hylkimisreaktion estämiseen on vakiintunut, ja tämän vaikutuksen mekanismi(t) ovat hieman epäselviä. Lääke estää soluvälitteisen tyypin yliherkkyydet ja aiheuttaa vaihtelevia muutoksia vasta-ainetuotannossa. T-soluvaikutusten tukahduttaminen, mukaan lukien T-solusuppression poistaminen, riippuu ajallisesta suhteesta antigeeniseen ärsykkeeseen tai istutukseen. Tällä aineella on vain vähän vaikutusta vakiintuneisiin siirteen hylkimisreaktioihin tai toissijaisiin vasteisiin.
Siirteen saajien spesifisten immuunivasteiden tai immunologisten toimintojen muutoksia on vaikea liittää spesifisesti atsatiopriinin aiheuttamaan immunosuppressioon. Näillä potilailla on epänormaalit vasteet rokotteisiin, pieni määrä T-soluja ja perifeeristen verisolujen epänormaali fagosytoosi, mutta heidän mitogeeniset vasteensa, seerumin immunoglobuliinit ja sekundaariset vasta-ainevasteet ovat yleensä normaaleja.
Immuno-inflammatorinen vaste
Atsatiopriini estää sairauden ilmenemismuotoja sekä taustalla olevia patologioita autoimmuunitautien eläinmalleissa. Esimerkiksi atsatiopriini vähentää adjuvanttiartriitin vakavuutta.
Mekanismeja, joilla atsatiopriini vaikuttaa autoimmuunisairauksiin, ei tunneta. Atsatiopriini on immuunivastetta heikentävä, viivästynyt yliherkkyys ja solujen sytotoksisuustestit estyvät enemmän kuin vasta-ainevasteet. Adjuvanttiniveltulehduksen rottamallissa atsatiopriinin on osoitettu estävän imusolmukkeiden liikakasvua, joka edeltää taudin oireiden ilmaantumista. Sekä immunosuppressiiviset että terapeuttiset vaikutukset eläinmalleissa ovat annosriippuvaisia. Atsatiopriinia pidetään hitaasti vaikuttavana lääkkeenä, ja vaikutukset voivat jatkua lääkkeen käytön lopettamisen jälkeen.
VIITTEET
1. Lennard L. 6-merkaptopuriinin kliininen farmakologia. Eur J Clin Pharmacol. 1992;43:329-339.
2. Weinshilboum R. Tiopuriinin farmakogenetiikka: tiopuriinimetyylitransferaasin kliiniset ja molekyylitutkimukset. Drug Metab Dispos. 2001;29:601-605.
3. McLeod HL, Siva C. Tiopuriini S-metyylitransferaasigeenin lokus -- vaikutukset kliiniseen farmakogenomiikkaan. Farmakogenomiikka. 2002;3:89-98.
4. Anstey A, Lennard L, Mayou SC, et ai. Atsatiopriiniin liittyvä pansytopenia – yleisen geneettisen polymorfismin aiheuttama entsyymipuutos: katsaus. JR Soc Med. 1992; 85:752-756.
5. Stolk JN, Beorbooms AM, de Abreu RA, et ai. Vähentynyt tiopuriinimetyylitransferaasiaktiivisuus ja atsatiopriinihoidon sivuvaikutusten kehittyminen potilailla, joilla on nivelreuma. Rheum-niveltulehdus. 1998; 41:18581866.
6. Tiedostossa olevat tiedot, Prometheus Laboratories Inc.
7. Yates CR, Krynetski EY, Loennechen T, et ai. Tiopuriini-S-metyylitransferaasin puutteen molekyylidiagnoosi: geneettinen perusta atsatiopriini- ja merkaptopuriini-intoleranssille. Ann Intern Med. 1997; 126:608-614.
8. Black AJ, McLeod HL, Capell HA, et ai. Tiopuriinimetyylitransferaasin genotyyppi ennustaa atsatiopriinin hoitoa rajoittavan vakavan toksisuuden. Ann Intern Med. 1998; 129:716-718.
9. Clunie GP, Lennard L. Tiopuriinimetyylitransferaasistatuksen merkitys reumatologiapotilailla, jotka saavat atsatiopriinia. Reumatologia. 2004; 43:13-18.
POTILASTIEDOT
Potilaita, jotka aloittavat IMURAN-hoidon, tulee kertoa säännöllisten verenkuvausten tarpeellisuudesta lääkkeen käytön aikana, ja heitä tulee rohkaista ilmoittamaan lääkärilleen kaikista epätavallisista verenvuodoista tai mustelmista. Heille on kerrottava infektiovaarasta IMURAN-hoidon aikana ja heitä tulee pyytää ilmoittamaan infektion merkeistä ja oireista lääkärilleen. Potilaalle tulee antaa tarkkoja annostusohjeita, erityisesti silloin, kun IMURANia annetaan munuaisten vajaatoiminnalle tai samanaikaisesti allopurinolin kanssa (ks. HUUMEIDEN VUOROVAIKUTUKSET alakohta ja ANNOSTELU JA HALLINNOINTI ). Potilaita tulee kertoa IMURAN 50 mg:n käytön mahdollisista riskeistä raskauden ja imetyksen aikana. IMURAN-hoidon jälkeinen lisääntynyt pahanlaatuisuusriski on selitettävä potilaalle.
