Neurontin 100mg, 300mg, 400mg, 600mg Gabapentin Käyttö, sivuvaikutukset ja annostus. Hinta verkkoapteekissa. Geneeriset lääkkeet ilman reseptiä.
Mitä Neurontin on ja miten sitä käytetään?
Neurontin 400mg on reseptilääke, jota käytetään hermokivun ja kouristuskohtausten oireiden hoitoon. Neurontinia voidaan käyttää yksinään tai muiden lääkkeiden kanssa.
Neurontin on GABA-analogi, epilepsialääke.
Ei tiedetä, onko Neurontin turvallinen ja tehokas alle 3-vuotiaille lapsille.
Mitkä ovat Neurontin 400mg:n mahdolliset sivuvaikutukset?
Neurontin voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
- lisääntyneet kohtaukset
- voimakas heikkous tai väsymys
- ongelmia tasapainossa tai lihasten liikkeessä
- ylävatsan kipu
- rintakipu
- uusi tai paheneva yskä ja kuume
- vaikeuksia hengittää
- vaikea pistely tai puutuminen
- nopeat silmien liikkeet
- vähän tai ei ollenkaan virtsaamista
- kivulias tai vaikea virtsaaminen
- turvotusta jaloissasi tai nilkoissasi
Hakeudu välittömästi lääkärin hoitoon, jos sinulla on jokin yllä mainituista oireista.
Neurontinin yleisimpiä sivuvaikutuksia ovat:
- päänsärky
- huimaus
- uneliaisuus
- väsymys
- turvotusta käsissäsi tai jaloissasi
- ongelmia silmiesi kanssa
- koordinaatioongelmia
- Neurontin 600mg:n yleisimmät sivuvaikutukset lapsilla ovat:
- kuume
- pahoinvointi
- oksentelua
- muutoksia käyttäytymisessä
- muistiongelmia
- keskittymisvaikeuksia
- levoton, vihamielinen tai aggressiivinen
Kerro lääkärille, jos sinulla on haittavaikutuksia, jotka häiritsevät sinua tai jotka eivät häviä.
Nämä eivät ole kaikkia Neurontinin mahdollisia sivuvaikutuksia. Lisätietoja saat lääkäriltäsi tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
KUVAUS
NEURONTIN-kapseleiden, tablettien ja oraaliliuoksen vaikuttava aine on gabapentiini, jonka kemiallinen nimi on 1-(aminometyyli)sykloheksaanietikkahappo.
Gabapentiinin molekyylikaava on C9H17NO2 ja molekyylipaino on 171,24. Gabapentiinin rakennekaava on:
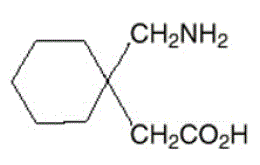
Gabapentiini on valkoinen tai luonnonvalkoinen kiteinen kiinteä aine, jonka pKa1 on 3,7 ja pKa2 10,7. Se liukenee vapaasti veteen ja sekä emäksisiin että happamiin vesiliuoksiin. Jakautumiskertoimen logaritmi (noktanoli/0,05 M fosfaattipuskuri) pH:ssa 7,4 on –1,25.
Jokainen Neurontin 100 mg kapseli sisältää 100 mg, 300 mg tai 400 mg gabapentiiniä ja seuraavia inaktiivisia aineosia: laktoosi, maissitärkkelys, talkki, gelatiini, titaanidioksidi, FD&C Blue No. 2, keltainen rautaoksidi (vain 300 mg ja 400 mg) ja punainen rautaoksidi (vain 400 mg).
Jokainen Neurontin-tabletti sisältää 600 mg tai 800 mg gabapentiinia ja seuraavia inaktiivisia aineosia: poloksameeri 407, kopovidoni, maissitärkkelys, magnesiumstearaatti, hydroksipropyyliselluloosa, talkki ja kandelillavaha
Neurontin-oraaliliuos sisältää 250 mg gabapentiiniä 5 ml:ssa (50 mg/ml) ja seuraavia inaktiivisia aineosia: glyseriini, ksylitoli, puhdistettu vesi ja keinotekoinen viileä mansikkaaniksen maku.
INDIKAATIOT
NEURONTIN® on tarkoitettu:
- Postherpeettisen neuralgian hoito aikuisilla
- Lisähoito epilepsiaa sairastavilla aikuisilla ja vähintään 3-vuotiailla lapsipotilailla osittaisten kohtausten hoidossa sekundaarisella yleistymisellä tai ilman
ANNOSTELU JA HALLINNOINTI
Annostus postherpeettiseen neuralgiaan
Aikuisilla, joilla on postherpeettinen neuralgia, NEURONTIN-hoito voidaan aloittaa päivänä 1 kerta-annoksena 300 mg, päivänä 2 annoksella 600 mg/vrk (300 mg kahdesti päivässä) ja päivänä 3 annoksella 900 mg/vrk (300 mg kolmesti). kertaa päivässä). Annosta voidaan myöhemmin titrata tarpeen mukaan kivun lievittämiseksi annokseen 1800 mg/vrk (600 mg kolme kertaa vuorokaudessa). Kliinisissä tutkimuksissa teho osoitettiin annoksilla 1800 mg/vrk - 3600 mg/vrk, ja vaikutukset olivat vertailukelpoisia koko annosalueella; näissä kliinisissä tutkimuksissa ei kuitenkaan osoitettu lisähyötyä yli 1800 mg/vrk annosten käytöstä.
Annostus epilepsiaan ja osittaiseen kohtaukseen
12-vuotiaat ja sitä vanhemmat potilaat
Aloitusannos on 300 mg kolme kertaa vuorokaudessa. NEURONTINin suositeltu ylläpitoannos on 300–600 mg kolme kertaa vuorokaudessa. Annokset 2400 mg/vrk asti ovat olleet hyvin siedettyjä pitkäaikaisissa kliinisissä tutkimuksissa. Myös 3 600 mg:n vuorokausiannoksia on annettu pienelle määrälle potilaita suhteellisen lyhyen ajan, ja ne ovat olleet hyvin siedettyjä. Anna NEURONTIN kolme kertaa päivässä 300 mg tai 400 mg kapseleina tai 600 mg tai 800 mg tabletteina. Annosten välinen enimmäisaika ei saa ylittää 12 tuntia.
Lapsipotilaat 3–11-vuotiaat
Aloitusannosalue on 10 mg/kg/vrk - 15 mg/kg/vrk jaettuna kolmeen annokseen, ja suositeltu ylläpitoannos saavutetaan titraamalla ylöspäin noin 3 päivän aikana. Suositeltu NEURONTINin ylläpitoannos 3–4-vuotiaille potilaille on 40 mg/kg/vrk jaettuna kolmeen annokseen. Suositeltu NEURONTIN 100 mg ylläpitoannos 5–11-vuotiaille potilaille on 25–35 mg/kg/vrk jaettuna kolmeen annokseen. NEURONTIN 300 mg voidaan antaa oraaliliuoksena, kapselina tai tablettina tai käyttämällä näiden formulaatioiden yhdistelmiä. Annokset 50 mg/kg/vrk asti ovat olleet hyvin siedettyjä pitkäaikaisessa kliinisessä tutkimuksessa. Annosten välinen enimmäisaika ei saa ylittää 12 tuntia.
Annoksen säätäminen potilailla, joilla on munuaisten vajaatoiminta
Annoksen muuttamista 12-vuotiaille ja sitä vanhemmille potilaille, joilla on munuaisten vajaatoiminta tai hemodialyysihoitoa suositellaan seuraavasti (katso yllä olevat annossuositukset tehokkaat annokset kussakin indikaatiossa):
TAULUKKO 1: NEURONTIN-annostus munuaisten toiminnan perusteella
Kreatiniinipuhdistumaa (CLCr) on vaikea mitata avohoidossa. Potilailla, joiden munuaisten toiminta on vakaa, kreatiniinipuhdistuma voidaan arvioida kohtuullisen hyvin käyttämällä Cockcroftin ja Gaultin yhtälöä:
NEURONTINin käyttöä alle 12-vuotiailla potilailla, joilla on munuaisten vajaatoiminta, ei ole tutkittu.
Annostus iäkkäille
Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, annoksen valinnassa on oltava varovainen ja annosta tulee säätää kreatiniinipuhdistuma-arvojen perusteella näillä potilailla.
Hallintotiedot
Anna NEURONTIN suun kautta ruoan kanssa tai ilman.
NEURONTIN 100 mg kapselit tulee niellä kokonaisina veden kera.
Kerro potilaille, että jos he jakavat 600 mg:n tai 800 mg:n NEURONTIN-tabletin puolikkaan tabletin ottamiseksi, heidän tulee ottaa seuraavana annoksena käyttämätön tabletin puolikas. Puolikkaat tabletit, joita ei ole käytetty 28 päivän kuluessa jakouurteisen tabletin jakamisesta, tulee hävittää.
Jos NEURONTIN-annosta pienennetään, se lopetetaan tai korvataan toisella lääkkeellä, tämä tulee tehdä vähitellen vähintään 1 viikon aikana (pidempi aika saattaa olla tarpeen lääkärin harkinnan mukaan).
MITEN TOIMITETAAN
Annostusmuodot ja vahvuudet
Kapselit
- 100 mg: valkoiset kovat liivatekapselit, joissa painatus ”PD” runkoon ja ”Neurontin/100 mg” kanteen
- 300 mg: keltaiset kovat gelatiinikapselit, joissa runkoon painettu ”PD” ja kanteen ”Neurontin/300 mg”
- 400 mg: oranssi kova gelatiinikapseli, jonka runkoon on painettu ”PD” ja kanteen ”Neurontin/400 mg”
Tabletit
- 600 mg: valkoiset elliptiset kalvopäällysteiset jakouurteiset tabletit, joiden toiselle puolelle on kaiverrettu "NT" ja "16"
- 800 mg: valkoiset elliptiset kalvopäällysteiset jakouurteiset tabletit, joiden toiselle puolelle on kaiverrettu "NT" ja "26"
Oraaliliuos
- 250 mg / 5 ml (50 mg / ml), kirkas väritön tai hieman kellertävä liuos
Varastointi ja käsittely
NEURONTIN (gabapentiini) kapselit, tabletit ja oraaliliuos toimitetaan seuraavasti:
100 mg kapselit
Valkoiset kovat liivatekapselit, joiden runkoon on painettu ”PD” ja kanteen ”Neurontin/100 mg”; saatavilla:
100 pullot: NDC 0071-0803-24
300 mg kapselit
Keltaiset kovat liivatekapselit, joiden runkoon on painettu ”PD” ja kanteen ”Neurontin/300 mg”; saatavilla:
100 pullot: NDC 0071-0805-24 Yksikköannos 50 s: NDC 0071-0805-40
400 mg kapselit
Oranssit kovat liivatekapselit, joiden runkoon on painettu ”PD” ja kanteen ”Neurontin/400 mg”; saatavilla:
100 pullot: NDC 0071-0806-24 Yksikköannos 50 s: NDC 0071-0806-40
600 mg tabletit
Valkoinen elliptinen kalvopäällysteinen jakouurteinen tabletti, jonka toiselle puolelle on kaiverrettu "NT" ja "16"; saatavilla:
100 pullot: NDC 0071-0513-24
800 mg tabletit
Valkoiset elliptiset kalvopäällysteiset jakouurteiset tabletit, joiden toiselle puolelle on kaiverrettu "NT" ja "26"; saatavilla:
100 pullot: NDC 0071-0401-24
250 mg per 5 ml oraaliliuosta
Kirkas väritön tai hieman kellertävä liuos; jokainen 5 ml oraaliliuosta sisältää 250 mg gabapentiinia; saatavilla:
470 ml:n lasipullot: NDC 0071-2012-23 470 ml:n pullot: NDC 0071-2012-44
Säilytä NEURONTIN 400 mg tabletteja ja kapseleita 25 °C:ssa (77 °F); retket sallitaan 15°C - 30°C (59°F - 86°F) [katso USP-ohjattu huonelämpötila ].
Säilytä NEURONTIN-oraaliliuos jääkaapissa, 2°C - 8°C (36°F - 46°F).
Jakelija: Parke-Davis, Division of Pfizer Inc., NY, NY 10017. Tarkistettu: joulukuu 2020
SIVUVAIKUTUKSET
Seuraavia vakavia haittavaikutuksia käsitellään tarkemmin muissa osissa:
- Lääkereaktio eosinofilian ja systeemisten oireiden kanssa (DRESS) / monielinyliherkkyys [ks. VAROITUKSET JA VAROTOIMET ]
- Anafylaksia ja angioödeema [katso VAROITUKSET JA VAROTOIMET ]
- Uneliaisuus/sedaatio ja huimaus [katso VAROITUKSET JA VAROTOIMET ]
- Epilepticus-tila [katso VAROITUKSET JA VAROTOIMET ]
- Itsemurhakäyttäytyminen ja -ajatukset [katso VAROITUKSET JA VAROTOIMET ]
- Hengityslama [katso VAROITUKSET JA VAROTOIMET ]
- Neuropsykiatriset haittavaikutukset (3–12-vuotiaat lapsipotilaat) [ks. VAROITUKSET JA VAROTOIMET ]
- Äkillinen ja selittämätön kuolema epilepsiapotilailla [katso VAROITUKSET JA VAROTOIMET ]
Kokemus kliinisistä kokeista
Koska kliiniset tutkimukset suoritetaan hyvin vaihtelevissa olosuhteissa, lääkkeen kliinisissä tutkimuksissa havaittuja haittavaikutuksia ei voida suoraan verrata toisen lääkkeen kliinisissä tutkimuksissa havaittuihin nopeuksiin, eivätkä ne välttämättä kuvasta käytännössä havaittuja nopeuksia.
Postherpeettinen neuralgia
Yleisimmät NEURONTINin käyttöön aikuisilla liittyvät haittavaikutukset, joita ei esiintynyt yhtä usein lumelääkettä saaneiden potilaiden keskuudessa, olivat huimaus, uneliaisuus ja perifeerinen turvotus.
Kahdessa kontrolloidussa postherpeettisen neuralgian tutkimuksessa 16 % 336 potilaasta, jotka saivat NEURONTINia, ja 9 % 227 potilaasta, jotka saivat lumelääkettä, keskeytti hoidon haittavaikutuksen vuoksi. Haittavaikutukset, jotka useimmiten johtivat lopettamiseen NEURONTIN-hoitoa saaneilla potilailla, olivat huimaus, uneliaisuus ja pahoinvointi.
Taulukossa 3 luetellaan haittavaikutukset, joita esiintyi vähintään 1 %:lla NEURONTINilla hoidetuista potilaista, joilla oli postherpeettinen neuralgia, jotka osallistuivat lumekontrolloituihin tutkimuksiin ja jotka olivat numeerisesti yleisempiä NEURONTIN-ryhmässä kuin lumeryhmässä.
TAULUKKO 3: Haittavaikutukset yhdistetyissä lumelääkekontrolloiduissa kokeissa postherpeettisessä neuralgiassa
Muita reaktioita yli 1 %:lla potilaista, mutta yhtä tai useammin lumeryhmässä, olivat kipu, vapina, neuralgia, selkäkipu, dyspepsia, hengenahdistus ja flunssaoireyhtymä.
Miesten ja naisten välillä ei ollut kliinisesti merkittäviä eroja haittavaikutusten tyypeissä ja ilmaantuvuuksissa. Koska oli vain vähän potilaita, joiden rodun ilmoitettiin olevan muu kuin valkoihoinen, ei ole riittävästi tietoa tukemaan väitettä haittavaikutusten jakautumisesta rodun mukaan.
Epilepsia ja osittaiset kohtaukset (lisähoito)
Yleisimmät NEURONTIN 300 mg:n haittavaikutukset yhdessä muiden epilepsialääkkeiden kanssa yli 12-vuotiailla potilailla, joita ei esiintynyt yhtä usein lumelääkettä saaneiden potilaiden keskuudessa, olivat uneliaisuus, huimaus, ataksia, väsymys ja nystagmus.
NEURONTINin ja muiden epilepsialääkkeiden yhdistelmän yleisimmät haittavaikutukset 3–12-vuotiailla lapsipotilailla, joita ei esiintynyt yhtä usein lumelääkettä saaneiden potilaiden keskuudessa, olivat virusinfektio, kuume, pahoinvointi ja/tai oksentelu, uneliaisuus ja vihamielisyys [katso VAROITUKSET JA VAROTOIMET ].
Noin 7 % 2074 yli 12-vuotiaasta potilaasta ja noin 7 % 449:stä 3–12-vuotiaista lapsipotilaista, jotka saivat NEURONTINia kliinisissä tutkimuksissa ennen markkinoille saattamista, keskeytti hoidon haittavaikutuksen vuoksi. Yleisimmin yli 12-vuotiaiden potilaiden vieroittamiseen liittyvät haittavaikutukset olivat uneliaisuus (1,2 %), ataksia (0,8 %), väsymys (0,6 %), pahoinvointi ja/tai oksentelu (0,6 %) ja huimaus (0,6 %). . Lapsipotilaiden vieroittamiseen liittyvät yleisimmät haittavaikutukset olivat emotionaalinen labilisuus (1,6 %), vihamielisyys (1,3 %) ja hyperkinesia (1,1 %).
Taulukossa 4 on lueteltu haittavaikutukset, joita esiintyi vähintään 1 %:lla NEURONTINilla hoidetuista yli 12-vuotiaista epilepsiapotilaista, jotka osallistuivat lumekontrolloituihin tutkimuksiin ja jotka olivat numeerisesti yleisempiä NEURONTIN-ryhmässä. Näissä tutkimuksissa joko NEURONTIN 300 mg tai lumelääke lisättiin potilaan nykyiseen epilepsialääkehoitoon.
TAULUKKO 4: Haittavaikutukset yhdistetyissä lumelääkekontrolloiduissa lisätutkimuksissa yli 12-vuotiailla epilepsiapotilailla
Niistä haittavaikutuksista, joita esiintyi vähintään 10 %:lla NEURONTIN-hoitoa saaneilla potilailla, uneliaisuus ja ataksia näyttivät osoittavan positiivista annos-vastesuhdetta.
Haittavaikutusten yleinen ilmaantuvuus ja havaittujen haittavaikutusten tyypit olivat samanlaisia NEURONTIN-hoitoa saaneiden miesten ja naisten välillä. Haittavaikutusten ilmaantuvuus lisääntyi hieman iän kasvaessa potilailla, joita hoidettiin joko NEURONTINilla tai lumelääkettä saavilla potilailla. Koska lumekontrolloiduissa tutkimuksissa vain 3 % potilaista (28/921) tunnistettiin ei-valkoisiksi (mustiksi tai muiksi), ei ole riittävästi tietoa tukemaan väitettä haittavaikutusten jakautumisesta rodun mukaan.
Taulukossa 5 luetellaan haittavaikutukset, joita esiintyi vähintään 2 %:lla NEURONTINilla hoidetuista 3–12-vuotiaista epilepsiapotilaista, jotka osallistuivat lumekontrolloituihin tutkimuksiin ja jotka olivat numeerisesti yleisempiä NEURONTIN-ryhmässä.
TAULUKKO 5: Haittavaikutukset plasebokontrolloidussa lisätutkimuksessa 3–12-vuotiailla lapsiepilepsiapotilailla
Muita reaktioita yli 2 %:lla 3–12-vuotiaista lapsipotilaista, mutta yhtä tai useammin lumeryhmässä, olivat: nielutulehdus, ylempien hengitysteiden tulehdus, päänsärky, nuha, kouristukset, ripuli, ruokahaluttomuus, yskä ja välikorvatulehdus.
Markkinoinnin jälkeinen kokemus
Seuraavat haittavaikutukset on tunnistettu NEURONTINin markkinoille tulon jälkeen. Koska nämä reaktiot on raportoitu vapaaehtoisesti epävarman kokoisesta populaatiosta, ei ole aina mahdollista luotettavasti arvioida niiden esiintymistiheyttä tai määrittää syy-yhteyttä lääkkeelle altistumiseen.
Maksa-sappihäiriöt: keltaisuus
Tutkimukset: kohonnut kreatiinikinaasi, kohonneet maksan toimintakokeet
Aineenvaihdunta- ja ravitsemushäiriöt: hyponatremia
Tuki- ja liikuntaelimistön ja sidekudoksen häiriöt: rabdomyolyysi
Hermoston häiriöt: liikehäiriö
Psyykkiset häiriöt: agitaatiota
Sukuelinten ja rintojen häiriöt: rintojen suureneminen, muutokset libidossa, siemensyöksyhäiriöt ja anorgasmia
Ihon ja ihonalaisen kudoksen häiriöt: angioödeema [katso VAROITUKSET JA VAROTOIMET ], rakkula pemfigoidi, erythema multiforme, Stevens-Johnsonin oireyhtymä.
Markkinoille tulon jälkeen on raportoitu hengenvaarallista tai kuolemaan johtanutta hengityslamaa potilailla, jotka käyttävät NEURONTINia opioidien tai muiden keskushermostoa lamaavien aineiden kanssa, tai jos taustalla on hengitysvajaus [ks. VAROITUKSET JA VAROTOIMET ].
Gabapentiinihoidon äkillisen lopettamisen jälkeen on myös raportoitu haittavaikutuksia. Yleisimmin raportoidut reaktiot olivat ahdistuneisuus, unettomuus, pahoinvointi, kipu ja hikoilu.
HUUMEIDEN VUOROVAIKUTUKSET
Opioidit
Hengityslamaa ja sedaatiota, jotka joskus johtavat kuolemaan, on raportoitu gabapentiinin ja opioidien (esim. morfiini, hydrokodoni, oksikodoni, buprenorfiini) samanaikaisen annon jälkeen [ks. VAROITUKSET JA VAROTOIMET ].
Hydrokodoni
NEURONTIN 300 mg:n samanaikainen käyttö hydrokodonin kanssa vähentää hydrokodonin altistumista [ks. KLIININEN FARMAKOLOGIA ]. Mahdolliset muutokset hydrokodonille altistumisessa ja vaikutuksessa tulee ottaa huomioon, kun NEURONTIN 100 mg aloitetaan tai lopetetaan potilaalla, joka käyttää hydrokodonia.
Morfiini
Kun gabapentiiniä annetaan morfiinin kanssa, potilaita on tarkkailtava keskushermoston laman oireiden, kuten uneliaisuuden, sedaation ja hengityslaman varalta [ks. KLIININEN FARMAKOLOGIA ].
Muut epilepsialääkkeet
Gabapentiini ei metaboloidu merkittävästi eikä se häiritse yleisesti käytettyjen epilepsialääkkeiden metaboliaa [ks. KLIININEN FARMAKOLOGIA ].
Maalox® (alumiinihydroksidi, magnesiumhydroksidi)
Gabapentiinin keskimääräinen hyötyosuus pieneni noin 20 %, kun samanaikaisesti käytettiin magnesium- ja alumiinihydroksidia sisältävää antasidia (Maalox). On suositeltavaa, että gabapentiini otetaan vähintään 2 tuntia Maalox-annon jälkeen [katso KLIININEN FARMAKOLOGIA ].
Lääke/laboratoriotestien vuorovaikutukset
Koska Ames N-Multistix SG -mittatikkutestillä virtsan proteiinille ilmoitettiin vääriä positiivisia lukemia, kun gabapentiiniä lisättiin muihin epilepsialääkkeisiin, suositellaan tarkempaa sulfosalisyylihapon saostusmenetelmää virtsan proteiinin määrittämiseksi.
Huumeiden väärinkäyttö ja riippuvuus
Valvottu aine
Gabapentiini ei ole aikataulun mukainen lääke.
Väärinkäyttö
Väärinkäyttö on huumeen tahallista, ei-terapeuttista käyttöä edes kerran sen toivottujen psykologisten tai fysiologisten vaikutusten vuoksi. Väärinkäyttö on lääkkeen tahallista käyttöä terapeuttisiin tarkoituksiin muulla kuin terveydenhuollon tarjoajan määräämällä tavalla tai jolle sitä ei ole määrätty.
Gabapentiini ei osoita affiniteettia bentsodiatsepiini-, opioidi- (mu, delta tai kappa) tai kannabinoidi 1 -reseptorikohtiin. Gabapentiinin väärinkäyttöä ja väärinkäyttöä on raportoitu markkinoille tulon jälkeen ja julkaistussa kirjallisuudessa. Suurimmalla osalla näissä raporteissa kuvatuista henkilöistä on ollut monien aineiden väärinkäyttöä. Jotkut näistä henkilöistä käyttivät suositeltua suurempia gabapentiiniannoksia ei-hyväksyttyihin käyttötarkoituksiin. Kun määräät NEURONTINia, arvioi huolellisesti potilaiden anamneesi huumeiden väärinkäytön varalta ja tarkkaile heitä gabapentiinin väärinkäytön merkkien ja oireiden varalta (esim. itse annoksen lisääminen ja huumeiden etsintäkäyttäytyminen). Gabapentiinin väärinkäyttöpotentiaalia ei ole arvioitu ihmistutkimuksissa.
Riippuvuus
Fyysinen riippuvuus on tila, joka kehittyy fysiologisen sopeutumisen seurauksena vastauksena toistuvaan huumeiden käyttöön ja joka ilmenee vieroitusoireina äkillisen lääkkeen käytön lopettamisen tai merkittävän annoksen pienentämisen jälkeen. Markkinoille tulon jälkeen on harvinaisia raportteja henkilöistä, joilla on vieroitusoireita pian sen jälkeen, kun he ovat lopettaneet suositeltua suurempien gabapentiiniannosten käytön sellaisten sairauksien hoitoon, joihin lääkettä ei ole hyväksytty. Tällaisia oireita olivat levottomuus, sekavuus ja sekavuus gabapentiinihoidon äkillisen lopettamisen jälkeen, jotka hävisivät gabapentiinihoidon uudelleen aloittamisen jälkeen. Gabapentiinin riippuvuuspotentiaalia ei ole arvioitu ihmistutkimuksissa.
VAROITUKSET
Mukana osana VAROTOIMENPITEET osio.
VAROTOIMENPITEET
Lääkereaktio eosinofilian ja systeemisten oireiden kanssa (DRESS) / monielinyliherkkyys
NEURONTINin käytön yhteydessä on esiintynyt lääkereaktiota, johon liittyy eosinofiliaa ja systeemisiä oireita (DRESS), joka tunnetaan myös monielinten yliherkkyytenä. Jotkut näistä reaktioista ovat olleet kohtalokkaita tai hengenvaarallisia. DRESS sisältää tyypillisesti, vaikkakaan ei yksinomaan, kuumetta, ihottumaa ja/tai lymfadenopatiaa yhdessä muiden elinjärjestelmien kanssa, kuten hematiitti, nefriitti, hematologiset poikkeavuudet, sydänlihastulehdus tai myosiitti, joka joskus muistuttaa akuuttia virusinfektiota. Eosinofiliaa esiintyy usein. Tämän häiriön ilmentyminen vaihtelee, ja muut elinjärjestelmät, joita ei ole mainittu tässä, voivat olla mukana.
On tärkeää huomata, että yliherkkyyden varhaisia ilmenemismuotoja, kuten kuumetta tai lymfadenopatiaa, voi esiintyä, vaikka ihottumaa ei olisikaan ilmeistä. Jos tällaisia merkkejä tai oireita ilmenee, potilas on arvioitava välittömästi. NEURONTIN-hoito tulee lopettaa, jos oireiden tai oireiden vaihtoehtoista etiologiaa ei voida määrittää.
Anafylaksia ja angioödeema
NEURONTIN voi aiheuttaa anafylaksiaa ja angioedeemaa ensimmäisen annoksen jälkeen tai milloin tahansa hoidon aikana. Ilmoitettujen tapausten merkkejä ja oireita ovat olleet hengitysvaikeudet, huulten, kurkun ja kielen turvotus sekä hätähoitoa vaativa hypotensio. Potilaita tulee neuvoa lopettamaan NEURONTIN 300 mg:n käyttö ja hakeutumaan välittömästi lääkärin hoitoon, jos heillä ilmenee anafylaksia tai angioedeeman merkkejä tai oireita.
Vaikutukset raskaiden koneiden ajamiseen ja käyttöön
NEURONTINia käyttävien potilaiden ei tule ajaa autoa ennen kuin heillä on riittävästi kokemusta arvioidakseen, haittaako NEURONTIN 100 mg heidän ajokykyään. Ajokykytutkimukset, jotka on suoritettu gabapentiinin aihiolääkkeellä (gabapentiini-enakarbiilitabletti, pitkävaikutteinen), osoittavat, että gabapentiini saattaa aiheuttaa merkittävää ajohäiriötä. Lääkkeen määrääjien ja potilaiden tulee olla tietoisia siitä, että potilaat' kyky arvioida omaa ajotaitoaan sekä kykynsä arvioida NEURONTINin aiheuttaman uneliaisuuden astetta voivat olla epätäydellisiä. Ajokyvyn heikkenemisen kestoa NEURONTIN 300 mg -hoidon aloittamisen jälkeen ei tunneta. Liittyykö heikkeneminen uneliaisuuteen [katso VAROITUKSET JA VAROTOIMET ] tai muita NEURONTINin vaikutuksia ei tunneta.
Lisäksi koska NEURONTIN 300mg aiheuttaa uneliaisuutta ja huimausta [katso VAROITUKSET JA VAROTOIMET ], potilaita tulee neuvoa olemaan käyttämättä monimutkaisia koneita ennen kuin heillä on riittävästi kokemusta NEURONTIN-hoidosta arvioidakseen, haittaako NEURONTIN 300 mg heidän kykyään suorittaa tällaisia tehtäviä.
Uneliaisuus/sedaatio ja huimaus
Kontrolloiduissa epilepsiatutkimuksissa yli 12-vuotiailla potilailla, jotka saivat NEURONTINia 100 mg - 1800 mg päivässä, uneliaisuutta, huimausta ja ataksiaa raportoitiin useammin NEURONTINia saaneilla potilailla kuin lumelääkettä saaneilla potilailla: 19 % lääkkeistä verrattuna 9 % lumelääkettä saaneeseen uneliaisuuteen, 17 % lääkkeisiin verrattuna 7 % lumelääkeryhmään huimauksen vuoksi ja 13 % lääkkeillä ja 6 % lumelääkettä saaneilla ataksialla. Näissä tutkimuksissa uneliaisuus, ataksia ja väsymys olivat yleisiä haittavaikutuksia, jotka johtivat NEURONTIN-hoidon keskeyttämiseen yli 12-vuotiailla potilailla. Vastaavasti 1,2 %, 0,8 % ja 0,6 % keskeyttivät hoidon näiden tapahtumien vuoksi.
Kontrolloiduissa tutkimuksissa potilailla, joilla oli postherpeettinen neuralgia, uneliaisuutta ja huimausta raportoitiin lumelääkettä saaneilla potilailla, jotka saivat NEURONTINia enintään 3600 mg:n vuorokausiannoksilla: eli 21 % NEURONTIN-hoitoa saaneista potilaista verrattuna 5:een. % lumelääkettä saaneista potilaista uneliaisuuden vuoksi ja 28 % NEURONTIN-hoitoa saaneista potilaista verrattuna 8 % lumelääkettä saaneista potilaista huimaukseen. Huimaus ja uneliaisuus olivat yleisimpiä NEURONTIN-hoidon lopettamiseen johtaneita haittavaikutuksia.
Potilaita tulee tarkkailla keskushermoston laman oireiden, kuten uneliaisuuden ja sedaatioiden, varalta, kun NEURONTIN 400 mg:aa käytetään muiden rauhoittavien ominaisuuksien kanssa mahdollisen synergian vuoksi. Lisäksi potilaat, jotka tarvitsevat samanaikaista morfiinihoitoa, voivat kokea gabapentiinipitoisuuksien nousua ja saattavat tarvita annoksen muuttamista [ks. HUUMEIDEN VUOROVAIKUTUKSET ].
Vetäytymiskohtaus, Status Epilepticus
Epilepsialääkkeiden käyttöä ei pidä lopettaa äkillisesti, koska kohtausten esiintymistiheys saattaa lisääntyä.
Lumekontrolloiduissa epilepsiatutkimuksissa yli 12-vuotiailla potilailla Status epilepticuksen ilmaantuvuus NEURONTINia saaneilla potilailla oli 0,6 % (3/543) verrattuna 0,5 % lumelääkettä saaneisiin potilaisiin (2/378). Niistä 2074 yli 12-vuotiaasta potilaasta, joita hoidettiin NEURONTINilla 300 mg kaikissa epilepsiatutkimuksissa (kontrolloidut ja kontrolloimattomat), 31:llä (1,5 %) oli status epilepticus. Näistä 14 potilaalla ei ollut aiempaa status epilepticusta ennen hoitoa tai muiden lääkkeiden käytön aikana. Koska riittäviä historiallisia tietoja ei ole saatavilla, on mahdotonta sanoa, liittyykö NEURONTIN-hoitoon korkeampi vai pienempi status epilepticus kuin mitä olisi odotettavissa vastaavassa populaatiossa, jota ei ole hoidettu NEURONTINilla.
Itsemurhakäyttäytyminen ja -ajatukset
Epilepsialääkkeet (AED), mukaan lukien NEURONTIN 100 mg, lisäävät itsemurha-ajatusten tai -käyttäytymisen riskiä potilailla, jotka käyttävät näitä lääkkeitä mihin tahansa käyttöaiheeseen. Potilaita, joita hoidetaan AED:llä minkä tahansa indikaation vuoksi, tulee seurata masennuksen ilmaantumisen tai pahenemisen, itsemurha-ajatusten tai -käyttäytymisen ja/tai epätavallisten mielialan tai käyttäytymisen muutosten varalta.
Yhdistelmäanalyysit 199 lumekontrolloidusta kliinisestä tutkimuksesta (mono- ja lisähoito), joissa oli 11 erilaista AED:tä, osoittivat, että potilailla, jotka oli satunnaistettu johonkin AED:stä, oli noin kaksinkertainen itsemurhariski (mukautettu suhteellinen riski 1,8, 95 % CI:1,2, 2,7). ajattelua tai käyttäytymistä verrattuna lumelääkkeeseen satunnaistettuihin potilaisiin. Näissä tutkimuksissa, joiden keskimääräinen hoidon kesto oli 12 viikkoa, itsemurhakäyttäytymisen tai -ajatusten arvioitu ilmaantuvuus 27 863 AED:llä hoidetulla potilaalla oli 0,43 % verrattuna 0,24 prosenttiin 16 029 lumelääkettä saaneella potilaalla, mikä merkitsee noin yhden lisäystä. itsemurha-ajatusten tai -käyttäytymisen tapaus jokaista 530 hoidettua potilasta kohti. Lääkehoitoa saaneilla potilailla tutkimuksissa tehtiin neljä itsemurhaa ja lumelääkettä saaneilla ei yhtään, mutta määrä on liian pieni, jotta voitaisiin tehdä johtopäätöksiä lääkkeen vaikutuksesta itsemurhaan.
Itsemurha-ajatusten tai -käyttäytymisen lisääntynyt riski AED-lääkkeiden yhteydessä havaittiin jo viikon kuluttua AED-lääkehoidon aloittamisesta, ja se säilyi arvioidun hoidon ajan. Koska useimmat analyysiin sisältyvät tutkimukset eivät kestäneet yli 24 viikkoa, itsemurha-ajatusten tai -käyttäytymisen riskiä 24 viikon jälkeen ei voitu arvioida.
Itsemurha-ajatusten tai -käyttäytymisen riski oli yleisesti ottaen yhtenäinen huumeiden välillä analysoiduissa tiedoissa. Havainnot lisääntyneestä riskistä eri vaikutusmekanismien ja eri käyttöaiheiden AED-lääkkeiden kanssa viittaavat siihen, että riski koskee kaikkia AED-lääkkeitä, joita käytetään mihin tahansa käyttöaiheeseen. Riski ei vaihdellut merkittävästi iän (5–100 vuotta) mukaan analysoiduissa kliinisissä tutkimuksissa. Taulukossa 2 esitetään absoluuttinen ja suhteellinen riski indikaatioittain kaikille arvioiduille AED:ille.
TAULUKKO 2: Riski indikaatioittain epilepsialääkkeille yhdistetyssä analyysissä
Itsemurha-ajatusten tai -käyttäytymisen suhteellinen riski oli suurempi epilepsiaa koskevissa kliinisissä tutkimuksissa kuin psykiatristen tai muiden sairauksien kliinisissä tutkimuksissa, mutta absoluuttiset riskierot olivat samanlaiset epilepsian ja psykiatristen käyttöaiheiden osalta.
Jokaisen, joka harkitsee NEURONTIN 100 mg:n tai minkä tahansa muun AED:n määräämistä, on tasapainotettava itsemurha-ajatusten tai -käyttäytymisen riski ja hoitamattoman sairauden riski. Epilepsia ja monet muut sairaudet, joihin AED-lääkkeitä määrätään, liittyvät itse sairastuvuuteen ja kuolleisuuteen sekä lisääntyneeseen itsemurha-ajatusten ja -käyttäytymisen riskiin. Jos itsemurha-ajatuksia ja -käyttäytymistä ilmaantuu hoidon aikana, lääkärin on harkittava, voiko näiden oireiden ilmaantuminen jollain potilaalla liittyä hoidettavaan sairauteen.
Potilaille, heidän omaishoitajilleen ja perheille tulee kertoa, että AED-lääkkeet lisäävät itsemurha-ajatusten ja -käyttäytymisen riskiä, ja heitä tulee kertoa tarpeesta olla varuillaan masennuksen merkkien ja oireiden ilmaantuessa tai pahenemisen sekä epätavallisten mielialan tai käyttäytymisen muutosten varalta. tai itsetuhoisten ajatusten, käytöksen tai itsensä vahingoittamista koskevien ajatusten ilmaantuminen. Huolestuttavasta käytöksestä tulee ilmoittaa välittömästi terveydenhuollon tarjoajille.
Hengityselinten masennus
Tapausraporteista, ihmistutkimuksista ja eläintutkimuksista on saatu näyttöä siitä, että gabapentiini liittyy vakavaan, henkeä uhkaavaan tai kuolemaan johtavaan hengityslamaan, kun sitä annetaan samanaikaisesti keskushermostoa lamaavien aineiden, mukaan lukien opioidien, kanssa tai taustalla olevan hengitysvajeen yhteydessä. Kun päätetään määrätä NEURONTIN 100 mg samanaikaisesti muun keskushermostoa lamaavan lääkkeen, erityisesti opioidin kanssa, tai määrätä NEURONTIN 100 mg potilaille, joilla on taustalla hengitysvajaus, tarkkaile potilaita hengityslaman ja sedaation oireiden varalta ja harkitse NEURONTIN-hoidon aloittamista pienellä annoksella. . Hengityslaman hoitoon voi kuulua tarkka seuranta, tukitoimenpiteet ja keskushermostoa lamaavien lääkkeiden (mukaan lukien NEURONTIN) vähentäminen tai lopettaminen.
Neuropsykiatriset haittavaikutukset (3–12-vuotiaat lapsipotilaat)
Gabapentiinin käyttöön epilepsiaa sairastavilla 3–12-vuotiailla lapsipotilailla liittyy keskushermostoon liittyviä haittavaikutuksia. Merkittävimmät niistä voidaan luokitella seuraaviin luokkiin: 1) emotionaalinen labilisuus (pääasiassa käyttäytymisongelmat), 2) vihamielisyys, mukaan lukien aggressiivinen käyttäytyminen, 3) ajatteluhäiriö, mukaan lukien keskittymishäiriöt ja koulumenestyksen muutokset, ja 4) hyperkinesia ( ensisijaisesti levottomuus ja yliaktiivisuus). Gabapentiinillä hoidetuilla potilailla useimmat reaktiot olivat voimakkuudeltaan lieviä tai kohtalaisia.
Kontrolloiduissa kliinisissä epilepsiatutkimuksissa 3–12-vuotiailla lapsipotilailla näiden haittavaikutusten ilmaantuvuus oli: emotionaalinen labilisuus 6 % (gabapentiinilla hoidetut potilaat) vs. 1,3 % (plaseboa saaneet potilaat); vihamielisyys 5,2 % vs. 1,3 %; hyperkinesia 4,7 % vs. 2,9 %; ja ajatushäiriö 1,7 % vs. 0 %. Yhtä näistä reaktioista, ilmoitusta vihamielisyydestä, pidettiin vakavana. Gabapentiinihoidon keskeyttäminen tapahtui 1,3 %:lla potilaista, jotka ilmoittivat emotionaalista labiilisuutta ja hyperkinesiaa, ja 0,9 %:lla gabapentiinihoitoa saaneista potilaista, jotka ilmoittivat vihamielisyydestä ja ajatteluhäiriöstä. Yksi lumelääkettä saanut potilas (0,4 %) vetäytyi emotionaalisen labiliteetin vuoksi.
Tumorogeeninen potentiaali
Suun kautta annetussa karsinogeenisuustutkimuksessa gabapentiini lisäsi haiman akinaarisolukasvainten ilmaantuvuutta rotilla [ks. Ei-kliininen toksikologia ]. Tämän löydön kliinistä merkitystä ei tunneta. Kliiniset kokemukset gabapentiinin esimarkkinointikehityksestä eivät tarjoa suoria keinoja arvioida sen mahdollisuuksia aiheuttaa kasvaimia ihmisissä.
Epilepsian lisähoitoa koskevissa kliinisissä tutkimuksissa, jotka käsittivät 2 085 potilasvuoden altistuksen yli 12-vuotiailla potilailla, uusia kasvaimia raportoitiin 10 potilaalla (2 rinta-, 3 aivo-, 2 keuhko-, 1 lisämunuainen, 1 non-Hodgkinin; s-lymfooma, 1 endometriumin syöpä in situ) ja olemassa olevat kasvaimet pahenivat 11 potilaalla (9 aivot, 1 rinta, 1 eturauhanen) NEURONTIN-hoidon lopettamisen aikana tai enintään 2 vuotta sen jälkeen. Ilman tietoa taustan esiintyvyydestä ja uusiutumisesta samanlaisessa populaatiossa, jota ei ole hoidettu NEURONTIN 100 mg:lla, on mahdotonta tietää, vaikuttaako hoito tässä kohortissa havaittuun ilmaantuvuuteen vai ei.
Äkillinen ja selittämätön kuolema epilepsiapotilailla
NEURONTIN 400 mg:n markkinoille saattamista edeltävän kehityksen aikana kirjattiin 8 äkillistä ja selittämätöntä kuolemaa 2 203 NEURONTINilla hoidetun epilepsiapotilaan kohortin joukossa (altistus 2 103 potilasvuotta).
Jotkut näistä voivat edustaa kohtauksiin liittyviä kuolemantapauksia, joissa kohtausta ei havaittu esim. yöllä. Tämä edustaa 0,0038 kuolemantapausta potilasvuotta kohden. Vaikka tämä määrä ylittää odotetun iän ja sukupuolen mukaan sopivan terveen väestön, se on arvioiden rajoissa selittämättömien äkillisten kuolemantapausten ilmaantuvuuden osalta epilepsiapotilailla, jotka eivät saa NEURONTIN-hoitoa (vaihtelee 0,0005:stä yleisen epileptikkopopulaation ja 0,003:n välillä. kliinisen tutkimuksen populaatio, joka on samanlainen kuin NEURONTIN-ohjelmassa, 0,005:een potilailla, joilla on refraktaarinen epilepsia). Näin ollen se, ovatko nämä luvut rohkaisevia vai lisäävätkö huolenaiheita, riippuu NEURONTIN-kohorttiin raportoitujen populaatioiden vertailukelpoisuudesta ja annettujen arvioiden tarkkuudesta.
Potilasneuvontatiedot
Neuvo potilasta lukemaan FDA:n hyväksymä potilasmerkintä ( Lääkitysopas ).
Hallintotiedot
Kerro potilaille, että NEURONTIN otetaan suun kautta ruoan kanssa tai ilman. Kerro potilaille, että jos he jakavat jakouurteisen 600 mg:n tai 800 mg:n tabletin puolikkaan tabletin ottamiseksi, heidän tulee ottaa seuraavana annoksena käyttämätön tabletin puolikas. Neuvo potilaita hävittämään puolikkaat tabletit, joita ei ole käytetty 28 päivän kuluessa jakouurteisen tabletin jakamisesta.
Lääkereaktio eosinofilian ja systeemisten oireiden kanssa (DRESS) / monielinyliherkkyys
Ennen kuin aloitat NEURONTIN-hoidon, kerro potilaille, että ihottuma tai muut yliherkkyyden merkit tai oireet (kuten kuume tai lymfadenopatia) voivat olla vakava lääketieteellinen tapahtuma, ja että potilaan tulee ilmoittaa kaikista sellaisista tapahtumista välittömästi lääkärille [ks. VAROITUKSET JA VAROTOIMET ].
Anafylaksia ja angioödeema
Neuvo potilaita lopettamaan NEURONTIN 300 mg:n käyttö ja hakeutumaan lääkärin hoitoon, jos heille kehittyy anafylaksia tai angioedeeman merkkejä tai oireita [ks. VAROITUKSET JA VAROTOIMET ].
Huimaus ja uneliaisuus ja vaikutukset ajamiseen ja raskaiden koneiden käyttöön
Kerro potilaille, että NEURONTIN 100 mg voi aiheuttaa huimausta, uneliaisuutta ja muita keskushermoston laman oireita ja merkkejä. Muut lääkkeet, joilla on rauhoittavia ominaisuuksia, voivat lisätä näitä oireita. Näin ollen, vaikka potilaat' kyky määrittää vammansa voi olla epäluotettavaa, neuvoa heitä olemaan ajamatta autoa tai käyttämättä muita monimutkaisia koneita, ennen kuin heillä on riittävästi kokemusta NEURONTIN-hoidosta arvioidakseen, vaikuttaako se haitallisesti henkiseen ja/tai motoriseen suorituskykyyn. Kerro potilaille, että ei tiedetä, kuinka kauan tämä vaikutus kestää [katso VAROITUKSET JA VAROTOIMET ja VAROITUKSET JA VAROTOIMET ].
Itsemurha-ajattelu ja -käyttäytyminen
Neuvo potilasta, heidän hoitajiaan ja perheitä siitä, että AED:t, mukaan lukien NEURONTIN, voivat lisätä itsemurha-ajatusten ja -käyttäytymisen riskiä. Kerro potilaille, että he ovat varuillaan masennuksen oireiden ilmaantumisen tai pahenemisen, epätavallisten mielialan tai käytöksen muutosten tai itsemurha-ajatusten, -käyttäytymisen tai itsensä vahingoittamista koskevien ajatusten ilmaantuessa. Neuvo potilaita ilmoittamaan huolestuttavasta käyttäytymisestä välittömästi terveydenhuollon tarjoajille [katso VAROITUKSET JA VAROTOIMET ].
Hengityselinten masennus
Kerro potilaille hengityslaman vaarasta. Sisällytä tiedot, että riski on suurin niillä, jotka käyttävät samanaikaisesti keskushermostoa lamaavia lääkkeitä (kuten opioidikipulääkkeitä) tai niillä, joilla on taustalla hengitysvajaus. Opeta potilaita tunnistamaan hengityslama ja neuvoo heitä hakeutumaan välittömästi lääkärin hoitoon, jos se ilmenee [katso VAROITUKSET JA VAROTOIMET ].
Käyttö Raskauden aikana
Neuvo potilaita ilmoittamaan lääkärilleen, jos he tulevat raskaaksi tai aikovat tulla raskaaksi hoidon aikana, ja ilmoittamaan lääkärilleen, jos he imettävät tai aikovat imettää hoidon aikana [ks. Käyttö tietyissä populaatioissa ].
Kannusta potilaita ilmoittautumaan NAAED-raskausrekisteriin, jos he tulevat raskaaksi. Tämä rekisteri kerää tietoa epilepsialääkkeiden turvallisuudesta raskauden aikana. Ilmoittautuakseen potilaat voivat soittaa maksuttomaan numeroon 1-888-233-2334 [katso Käyttö tietyissä populaatioissa ].
Tämän tuotteen merkinnät on saatettu päivittää. Uusimmat reseptitiedot ovat osoitteessa www.pfizer.com.
Ei-kliininen toksikologia
Karsinogeneesi, mutageneesi, hedelmällisyyden heikkeneminen
Karsinogeneesi
Gabapentiiniä annettiin suun kautta hiirille ja rotille 2 vuoden karsinogeenisuustutkimuksissa. Mitään näyttöä lääkkeeseen liittyvästä karsinogeenisuudesta ei havaittu hiirillä, joita hoidettiin annoksilla 2000 mg/kg/vrk. Annoksella 2000 mg/kg plasman gabapentiinialtistus (AUC) hiirillä oli noin 2 kertaa suurempi kuin ihmisillä MRHD:llä 3600 mg/vrk. Rotilla haiman akinaarisoluadenooman ja karsinooman ilmaantuvuus lisääntyi urosrotilla, jotka saivat suurimman annoksen (2000 mg/kg), mutta ei annoksilla 250 tai 1000 mg/kg/vrk. Annoksella 1000 mg/kg plasman gabapentiinialtistus (AUC) oli rotilla noin 5 kertaa suurempi kuin ihmisillä MRHD:llä.
Tutkimukset, jotka on suunniteltu tutkimaan gabapentiinin aiheuttaman haiman karsinogeneesin mekanismia rotilla, osoittavat, että gabapentiini stimuloi DNA-synteesiä rotan haiman akinaarisoluissa in vitro ja saattaa siten toimia kasvaimen promoottorina lisäämällä mitogeenistä aktiivisuutta. Ei tiedetä, pystyykö gabapentiini lisäämään solujen lisääntymistä muissa solutyypeissä tai muissa lajeissa, mukaan lukien ihmiset.
Mutageneesi
Gabapentiini ei osoittanut mutageenista tai genotoksista potentiaalia in vitro (Ames-testi, HGPRT-mutaatiotesti kiinanhamsterin keuhkosoluissa) ja in vivo (kromosomipoikkeavuus ja mikrotumatesti kiinanhamsterin luuytimessä, hiiren mikrotuma, suunnittelematon DNA-synteesi rotan maksasoluissa) määritykset.
Hedelmällisyyden heikkeneminen
Rotilla ei havaittu haitallisia vaikutuksia hedelmällisyyteen tai lisääntymiseen annoksilla 2000 mg/kg asti. Annoksella 2000 mg/kg plasman gabapentiinialtistus (AUC) on rotilla noin 8 kertaa suurempi kuin ihmisillä MRHD:llä.
Käyttö tietyissä populaatioissa
Raskaus
Raskausaltistusrekisteri
On olemassa raskausaltistusrekisteri, joka seuraa raskauden tuloksia naisilla, jotka ovat altistuneet epilepsialääkkeille (AED), kuten NEURONTIN 300 mg, raskauden aikana. Kannusta naisia, jotka käyttävät NEURONTINia raskauden aikana, ilmoittautumaan North American Antiepileptic Drug (NAAED) -raskausrekisteriin soittamalla maksuttomaan numeroon 1-888-233-2334 tai käymällä osoitteessa http://www.aedpregnancyregistry.org/.
Riskien yhteenveto
NEURONTINin käyttöön raskaana oleville naisille liittyvistä kehitysriskeistä ei ole riittävästi tietoa. Hiirillä, rotilla ja kaniineilla tehdyissä ei-kliinisissä tutkimuksissa gabapentiini oli kehitystoksinen (lisääntyi sikiön luuston ja sisäelinten poikkeavuuksia ja lisääntynyt alkiosikiökuolleisuus), kun sitä annettiin tiineille eläimille samanlaisina tai pienempinä annoksina kuin kliinisesti käytetyt [ks. Data ].
Yhdysvaltain väestössä vakavien synnynnäisten epämuodostumien ja keskenmenon arvioitu taustariski kliinisesti tunnistetuissa raskauksissa on 2-4 % ja 15-20 %. Vakavien synnynnäisten epämuodostumien ja keskenmenon taustariskiä mainitulla väestöllä ei tunneta.
Data
Eläinten tiedot
Kun tiineille hiirille annettiin oraalisia annoksia gabapentiiniä (500, 1000 tai 3000 mg/kg/vrk) organogeneesin aikana, kahdella suurimmalla annoksella havaittiin alkio- ja sikiötoksisuutta (lisääntynyt luuston vaihteluiden esiintyvyys). Vaikutukseton annos alkion ja sikiön kehitystoksisuuteen hiirillä (500 mg/kg/vrk) on pienempi kuin ihmisille suositeltu enimmäisannos (MRHD) 3600 mg kehon pinta-alalla (mg/m²) laskettuna.
Tutkimuksissa, joissa rotat saivat oraalisia gabapentiiniannoksia (500-2000 mg/kg/vrk) tiineyden aikana, kaikilla annoksilla havaittiin haitallisia vaikutuksia jälkeläisten kehitykseen (lisääntynyt virtsaputken ja/tai hydronefroosin ilmaantuvuus). Pienin testattu annos on samanlainen kuin MRHD (mg/m²).
Kun tiineitä kaneja käsiteltiin gabapentiinillä organogeneesin aikana, alkiosikiökuolleisuuden havaittiin lisääntyneen kaikilla testatuilla annoksilla (60, 300 tai 1500 mg/kg). Pienin testattu annos on pienempi kuin MRHD (mg/m²).
Julkaistussa tutkimuksessa gabapentiiniä (400 mg/kg/vrk) annettiin vatsaontelonsisäisenä injektiona vastasyntyneille hiirille ensimmäisen syntymän jälkeisen viikon aikana, jolloin jyrsijöillä tapahtui synaptogeneesi (vastaten ihmisillä raskauden viimeistä kolmannesta). Gabapentiini aiheutti huomattavan vähenemisen hermosolujen synapsien muodostumisessa ehjien hiirten aivoissa ja epänormaalin hermosolujen synapsien muodostumisen synaptisen korjauksen hiirimallissa. Gabapentiinin on osoitettu in vitro häiritsevän jänniteaktivoitujen kalsiumkanavien α2δ-alayksikön, hermosolujen synaptogeneesiin osallistuvan reseptorin, toimintaa. Näiden löydösten kliinistä merkitystä ei tunneta.
Imetys
Riskien yhteenveto
Gabapentiini erittyy äidinmaitoon suun kautta annetun annon jälkeen. Vaikutuksia imetettävään lapseen ja maidontuotantoon ei tunneta. Imetyksen kehitys- ja terveyshyödyt tulee ottaa huomioon sekä äidin kliininen NEURONTIN-tarve ja kaikki mahdolliset NEURONTINin tai äidin taustalla olevan sairauden haittavaikutukset imetettävään lapseen.
Käyttö lapsille
NEURONTIN 600 mg:n turvallisuutta ja tehoa postherpeettisen neuralgian hoidossa lapsipotilailla ei ole osoitettu.
Turvallisuutta ja tehokkuutta lisähoitona osittaisten kohtausten hoidossa alle 3-vuotiailla lapsipotilailla ei ole varmistettu [ks. Kliiniset tutkimukset ].
Geriatrinen käyttö
NEURONTINilla hoidettujen potilaiden kokonaismäärä kontrolloiduissa kliinisissä tutkimuksissa postherpeettistä neuralgiaa sairastavilla potilailla oli 336, joista 102 (30 %) oli 65–74-vuotiaita ja 168 (50 %) 75-vuotiaita tai vanhempia. Hoitovaikutus oli suurempi 75-vuotiailla ja sitä vanhemmilla potilailla kuin nuoremmilla potilailla, jotka saivat saman annoksen. Koska gabapentiini eliminoituu lähes yksinomaan munuaisten kautta, suurempi hoitovaikutus, joka havaitaan ≥75-vuotiailla potilailla, voi johtua lisääntyneestä gabapentiinialtistuksesta tietyllä annoksella, mikä johtuu ikääntymisestä johtuvasta munuaisten toiminnan heikkenemisestä. Muita tekijöitä ei kuitenkaan voida sulkea pois. Haittavaikutusten tyypit ja ilmaantuvuus olivat samanlaisia eri ikäryhmissä lukuun ottamatta perifeeristä turvotusta ja ataksiaa, joiden ilmaantuvuus lisääntyi iän myötä.
NEURONTINin kliinisissä epilepsian tutkimuksissa ei ollut riittävästi 65-vuotiaita ja sitä vanhempia koehenkilöitä sen määrittämiseksi, reagoivatko he eri tavalla kuin nuoremmat. Muut raportoidut kliiniset kokemukset eivät ole osoittaneet eroja iäkkäiden ja nuorempien potilaiden vasteissa. Yleensä iäkkään potilaan annoksen valinnassa tulee olla varovainen, yleensä alkaen annosalueen alimmasta päästä, mikä heijastaa maksan, munuaisten tai sydämen toiminnan heikkenemisen sekä samanaikaisen sairauden tai muun lääkehoidon yleisyyttä.
Tämän lääkkeen tiedetään erittyvän olennaisesti munuaisten kautta, ja tämän lääkkeen toksisten reaktioiden riski voi olla suurempi potilailla, joilla on heikentynyt munuaisten toiminta. Koska iäkkäillä potilailla on todennäköisemmin heikentynyt munuaisten toiminta, annoksen valinnassa on oltava varovainen ja annosta tulee säätää kreatiniinipuhdistuma-arvojen perusteella näillä potilailla [ks. ANNOSTELU JA HALLINNOINTI , HAITTAVAIKUTUKSET , ja KLIININEN FARMAKOLOGIA ].
Munuaisten vajaatoiminta
Annoksen muuttaminen aikuispotilailla, joiden munuaisten toiminta on heikentynyt, on tarpeen [katso ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ]. Munuaisten vajaatoimintaa sairastavia lapsipotilaita ei ole tutkittu.
Hemodialyysihoitoa saavien potilaiden annostuksen muuttaminen on tarpeen [katso ANNOSTELU JA HALLINNOINTI ja KLIININEN FARMAKOLOGIA ].
YLIANNOSTUS
Akuutin toksisuuden merkkejä eläimillä olivat ataksia, hengitysvaikeudet, ptoosi, sedaatio, hypoaktiivisuus tai kiihtyneisyys.
NEURONTIN 300 mg:n akuutteja oraalisia yliannostuksia on raportoitu. Oireita ovat olleet kaksoisnäkö, vapina, epäselvä puhe, uneliaisuus, muuttunut henkinen tila, huimaus, letargia ja ripuli. Kuolemaan johtavaa hengityslamaa on raportoitu NEURONTIN 400 mg:n yliannostuksen yhteydessä yksinään ja yhdessä muiden keskushermostoa lamaavien lääkkeiden kanssa.
Gabapentiini voidaan poistaa hemodialyysillä.
Jos ylialtistuminen tapahtuu, soita myrkytystietokeskukseen numeroon 1-800-222-1222.
VASTA-AIHEET
NEURONTIN on vasta-aiheinen potilaille, jotka ovat osoittaneet yliherkkyyttä lääkkeelle tai sen aineosille.
KLIININEN FARMAKOLOGIA
Toimintamekanismi
Tarkkoja mekanismeja, joilla gabapentiini tuottaa kipua lievittäviä ja epilepsialääkkeitä, ei tunneta. Gabapentiini on rakenteellisesti sukua välittäjäaineelle gammaaminovoihapolle (GABA), mutta sillä ei ole vaikutusta GABA:n sitoutumiseen, ottoon tai hajoamiseen. In vitro -tutkimukset ovat osoittaneet, että gabapentiini sitoutuu suurella affiniteetilla jänniteaktivoitujen kalsiumkanavien α2δ-alayksikköön; tämän sitoutumisen yhteyttä gabapentiinin terapeuttisiin vaikutuksiin ei kuitenkaan tunneta.
Farmakokinetiikka
Kaikki gabapentiinin annon jälkeiset farmakologiset vaikutukset johtuvat lähtöyhdisteen aktiivisuudesta; gabapentiini ei metaboloidu merkittävästi ihmisellä.
Oraalinen biologinen hyötyosuus
Gabapentiinin hyötyosuus ei ole suhteessa annokseen; eli kun annosta suurennetaan, biologinen hyötyosuus pienenee. Gabapentiinin biologinen hyötyosuus on noin 60 %, 47 %, 34 %, 33 % ja 27 %, kun annokset 900, 1200, 2400, 3600 ja 4800 mg/vrk jaettuna 3 annokseen, vastaavasti. Ruoalla on vain vähäinen vaikutus gabapentiinin imeytymisnopeuteen ja laajuuteen (AUC:n ja Cmax:n nousu 14 %).
Jakelu
Alle 3 % gabapentiinista kiertää plasman proteiineihin sitoutuneena. Gabapentiinin näennäinen jakautumistilavuus 150 mg:n laskimonsisäisen annon jälkeen on 58±6 l (keskiarvo ±SD). Epilepsiapotilailla gabapentiinin vakaan tilan pitoisuudet ennen annosta (Cmin) aivo-selkäydinnesteessä olivat noin 20 % vastaavista plasmapitoisuuksista.
Eliminointi
Gabapentiini eliminoituu systeemisestä verenkierrosta erittymällä munuaisten kautta muuttumattomana lääkkeenä. Gabapentiini ei metaboloidu merkittävästi ihmisissä.
Gabapentiinin eliminaation puoliintumisaika on 5-7 tuntia, eikä se muutu annoksen tai toistuvan annostelun jälkeen. Gabapentiinin eliminaationopeusvakio, plasmapuhdistuma ja munuaispuhdistuma ovat suoraan verrannollisia kreatiniinipuhdistumaan. Iäkkäillä potilailla ja potilailla, joilla on munuaisten vajaatoiminta, gabapentiinin plasmapuhdistuma on pienentynyt. Gabapentiini voidaan poistaa plasmasta hemodialyysillä.
Tietyt populaatiot
Ikä
Iän vaikutusta tutkittiin 20–80-vuotiailla. Gabapentiinin näennäinen oraalinen puhdistuma (CL/F) pieneni iän noustessa, noin 225 ml/min alle 30-vuotiailla noin 125 ml/min yli 70-vuotiailla. Munuaispuhdistuma (CLr) ja kehon pinta-alaan mukautettu CLr laskivat myös iän myötä; Gabapentiinin munuaispuhdistuman heikkeneminen iän myötä voidaan kuitenkin suurelta osin selittää munuaisten toiminnan heikkenemisellä. [katso ANNOSTELU JA HALLINNOINTI ja Käyttö tietyissä populaatioissa ].
Sukupuoli
Vaikka muodollista tutkimusta gabapentiinin farmakokinetiikan vertailemiseksi miehillä ja naisilla ei ole tehty, näyttää siltä, että miesten ja naisten farmakokineettiset parametrit ovat samankaltaisia eikä merkittäviä sukupuolieroja ole.
Rotu
Rotuun johtuvia farmakokineettisiä eroja ei ole tutkittu. Koska gabapentiini erittyy pääasiassa munuaisten kautta eikä kreatiniinin puhdistumassa ole merkittäviä rodullisia eroja, rodusta johtuvia farmakokineettisiä eroja ei odoteta.
Pediatriset
Gabapentiinin farmakokinetiikka määritettiin 48:lla 1 kuukauden ja 12 vuoden ikäisellä lapsipotilaalla noin 10 mg/kg annoksen jälkeen. Plasman huippupitoisuudet olivat samanlaiset koko ikäryhmässä ja esiintyivät 2–3 tuntia annoksen ottamisen jälkeen. Yleensä 1 kuukauden ja alle 5 vuoden ikäiset lapsipotilaat saavuttivat noin 30 % pienemmän altistuksen (AUC) kuin 5-vuotiailla ja sitä vanhemmilla. Näin ollen ruumiinpainoa kohti normalisoitunut oraalinen puhdistuma oli suurempi nuoremmilla lapsilla. Gabapentiinin näennäinen oraalinen puhdistuma oli suoraan verrannollinen kreatiniinipuhdistumaan. Gabapentiinin eliminaation puoliintumisaika oli keskimäärin 4,7 tuntia ja se oli samanlainen kaikissa tutkituissa ikäryhmissä.
Populaatiofarmakokineettinen analyysi suoritettiin 253 lapselle, joiden ikä oli 1 kuukauden ja 13 vuoden välillä. Potilaat saivat 10-65 mg/kg/vrk kolme kertaa päivässä. Näennäinen oraalinen puhdistuma (CL/F) oli suoraan verrannollinen kreatiniinipuhdistumaan, ja tämä suhde oli samanlainen kerta-annoksen jälkeen ja vakaassa tilassa. Alle 5-vuotiailla lapsilla havaittiin korkeampia oraalisia puhdistuma-arvoja kuin 5-vuotiailla ja sitä vanhemmilla lapsilla, kun ne oli normalisoitu painon mukaan. Puhdistus oli erittäin vaihteleva alle 1-vuotiailla pikkulapsilla. 5-vuotiailla ja sitä vanhemmilla lapsipotilailla havaitut normalisoidut CL/F-arvot vastasivat aikuisilla kerta-annoksen jälkeen havaittuja arvoja. Oraalinen jakautumistilavuus, joka on normalisoitu ruumiinpainoa kohti, oli vakio koko ikäjakauman alueella.
Nämä farmakokineettiset tiedot osoittavat, että tehokkaan vuorokausiannoksen 3- ja 4-vuotiailla epilepsiaa sairastavilla lapsipotilailla tulisi olla 40 mg/kg/vrk, jotta saavutetaan samanlaiset keskimääräiset plasmapitoisuudet kuin 5-vuotiailla ja sitä vanhemmilla potilailla, jotka saavat 30 mg/vrk gabapentiinia. kg/päivä [katso ANNOSTELU JA HALLINNOINTI ].
Aikuiset potilaat, joilla on munuaisten vajaatoiminta
Koehenkilöille (N=60), joilla oli munuaisten vajaatoiminta (keskimääräinen kreatiniinipuhdistuma 13–114 ml/min), annettiin gabapentiiniä suun kautta kerta-annoksena 400 mg. Gabapentiinin keskimääräinen puoliintumisaika vaihteli noin 6,5 tunnista (potilaat, joiden kreatiniinipuhdistuma >60 ml/min) 52 tuntiin (kreatiniinipuhdistuma 60 ml/min). ryhmä) noin 10 ml/min ( ANNOSTELU JA HALLINNOINTI ja Käyttö tietyissä populaatioissa ]. Munuaisten vajaatoimintaa sairastavia lapsipotilaita ei ole tutkittu.
Hemodialyysi
Tutkimuksessa, jossa tehtiin anurisia aikuisia (N=11), gabapentiinin näennäinen eliminaation puoliintumisaika ei-dialyysipäivinä oli noin 132 tuntia; dialyysin aikana gabapentiinin näennäinen puoliintumisaika lyheni 3,8 tuntiin. Hemodialyysillä on siten merkittävä vaikutus gabapentiinin eliminaatioon anuriapotilailla [katso ANNOSTELU JA HALLINNOINTI ja Käyttö tietyissä populaatioissa ].
Maksasairaus
Koska gabapentiini ei metaboloidu, potilailla, joilla on maksan vajaatoiminta, ei tehty tutkimuksia.
Huumeiden vuorovaikutukset
In vitro -tutkimukset
In vitro -tutkimuksissa tutkittiin gabapentiinin potentiaalia estää tärkeimpiä sytokromi P450 -entsyymejä (CYP1A2, CYP2A6, CYP2C9, CYP2C19, CYP2D6, CYP2E1 ja CYP3A4), jotka välittävät lääkeaine- ja ksenobioottista aineenvaihduntaa käyttämällä isoformiselektiivisiä merkkiainesubstraatteja ja ihmisen maksan mikroja. . Vain korkeimmalla testatulla pitoisuudella (171 mcg/ml; 1 mM) havaittiin CYP2A6-isoformin lievä inhibitioaste (14 % - 30 %). Mitään muiden testattujen isoformien estoa ei havaittu CYP2A6-isoformin gabapentiinipitoisuuksilla 171 mcg/ml asti (noin 15 kertaa C annoksella 3600 mg/vrk). Minkään muun testatun isoformin estoa ei havaittu gabapentiinipitoisuuksilla 171 mcg/ml asti (noin 15 kertaa Cmax annoksella 3600 mg/vrk).
In vivo -tutkimukset
Tässä osiossa kuvatut lääkkeiden yhteisvaikutustiedot on saatu tutkimuksista, joihin osallistui terveitä aikuisia ja aikuisia epilepsiapotilaita.
Fenytoiini
Yksittäisessä (400 mg) ja toistuvassa annoksessa (400 mg kolmesti päivässä) tehdyssä tutkimuksessa NEURONTIN 400 mg epilepsiapotilailla (N=8), jotka saivat fenytoiinimonoterapiaa vähintään 2 kuukauden ajan, gabapentiinilla ei ollut vaikutusta vakaan tilan pohjaan. plasman fenytoiinin ja fenytoiinin pitoisuudet eivät vaikuttaneet gabapentiinin farmakokinetiikkaan.
Karbamatsepiini
Samanaikainen gabapentiinin (400 mg kolme kertaa vuorokaudessa; N = 12) anto ei vaikuttanut vakaan tilan plasman karbamatsepiinin ja karbamatsepiini 10, 11 epoksidin pitoisuuksiin. Vastaavasti gabapentiinin farmakokinetiikka ei muuttunut karbamatsepiinin antamisen jälkeen.
Valproiinihappo
Keskimääräiset vakaan tilan seerumin valproiinihappopitoisuudet ennen samanaikaista gabapentiinin antoa ja sen aikana (400 mg kolme kertaa vuorokaudessa; N = 17) eivät olleet erilaisia, eikä valproiinihappo vaikuttanut gabapentiinin farmakokineettisiin parametreihin.
Fenobarbitaali
Fenobarbitaalin tai gabapentiinin (300 mg kolme kertaa vuorokaudessa; N=12) vakaan tilan farmakokineettisten parametrien arviot ovat samat riippumatta siitä, annetaanko lääkkeet yksin vai yhdessä.
Naprokseeni
Naprokseeninatriumkapseleiden (250 mg) samanaikainen anto (N=18) NEURONTINin (125 mg) kanssa näyttää lisäävän imeytyneen gabapentiinin määrää 12–15 %. Gabapentiinilla ei ollut vaikutusta naprokseenin farmakokineettisiin parametreihin. Nämä annokset ovat pienempiä kuin molempien lääkkeiden terapeuttiset annokset. Yhteisvaikutuksen suuruutta kummankaan lääkkeen suositeltujen annosten rajoissa ei tunneta.
Hydrokodoni
NEURONTINin (125-500 mg; N=48) samanaikainen anto alentaa hydrokodonin (10 mg; N=50) Cmax- ja AUC-arvoja annoksesta riippuvaisella tavalla verrattuna pelkän hydrokodonin antamiseen; Cmax- ja AUC-arvot ovat 3–4 % pienemmät 125 mg:n NEURONTIN-annoksen jälkeen ja 21–22 % pienemmät 500 mg:n NEURONTIN-annoksen jälkeen. Tämän yhteisvaikutuksen mekanismia ei tunneta. Hydrokodoni lisää gabapentiinin AUC-arvoja 14 %. Yhteisvaikutuksen suuruutta muilla annoksilla ei tunneta.
Morfiini
Kirjallisuusartikkelissa kerrottiin, että kun 60 mg:n kontrolloidusti vapauttava morfiinikapseli annettiin 2 tuntia ennen 600 mg:n NEURONTIN-kapselia (N = 12), gabapentiinin keskimääräinen AUC kasvoi 44 % verrattuna gabapentiiniin, joka annettiin ilman morfiinia. NEURONTINin antaminen 2 tuntia morfiinin jälkeen ei vaikuttanut morfiinin farmakokineettisiin parametreihin. Yhteisvaikutuksen suuruutta muilla annoksilla ei tunneta.
Simetidiini
Kun simetidiiniä annettiin 300 mg neljästi vuorokaudessa (N=12), gabapentiinin keskimääräinen näennäinen oraalinen puhdistuma laski 14 % ja kreatiniinipuhdistuma 10 %. Näin ollen simetidiini näytti muuttavan sekä gabapentiinin että kreatiniinin, endogeenisen munuaisten toiminnan merkkiaineen, erittymistä munuaisten kautta. Tämän simetidiinin aiheuttaman gabapentiinin erittymisen vähäisen vähenemisen ei odoteta olevan kliinistä merkitystä. Gabapentiinin vaikutusta simetidiiniin ei arvioitu.
Suun kautta otettava ehkäisy
AUC:n ja puoliintumisajan perusteella noretindroni- ja etinyyliestradiolin toistuvan annoksen farmakokineettiset profiilit 2,5 mg noretindroniasetaattia ja 50 mikrogrammaa etinyyliestradiolia sisältävien tablettien antamisen jälkeen olivat samanlaiset gabapentiinin (400 mg kolme kertaa vuorokaudessa) ja ilman sitä; N = 13). Noretindroni Cmax oli 13 % korkeampi, kun sitä annettiin yhdessä gabapentiinin kanssa; tällä yhteisvaikutuksella ei odoteta olevan kliinistä merkitystä.
Antasidi (Maalox®) (alumiinihydroksidi, magnesiumhydroksidi)
Magnesiumia ja alumiinihydroksideja sisältävä antasidi (Maalox®) vähensi gabapentiinin (N=16) keskimääräistä biologista hyötyosuutta noin 20 %. Tämä biologisen hyötyosuuden lasku oli noin 10 %, kun gabapentiini annettiin 2 tuntia Maaloxin jälkeen.
Probenesidi
Probenesidi on munuaisten tubuluserityksen estäjä. Gabapentiinin farmakokineettiset parametrit ilman probenesidiä ja probenesidin kanssa olivat vertailukelpoisia. Tämä osoittaa, että gabapentiini ei erity munuaistiehyissä probenesidin estämää reittiä pitkin.
Kliiniset tutkimukset
Postherpeettinen neuralgia
NEURONTINia arvioitiin postherpeettisen neuralgian (PHN) hoidossa kahdessa satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa monikeskustutkimuksessa. Intent-to-treat (ITT) -populaatio koostui yhteensä 563 potilaasta, joilla oli kipua yli 3 kuukautta herpes zoster -ihottuman paranemisen jälkeen (taulukko 6).
TAULUKKO 6. Kontrolloidut PHN-tutkimukset: Kesto, annokset ja potilaiden lukumäärä
Jokainen tutkimus sisälsi 7 tai 8 viikon kaksoissokkovaiheen (3 tai 4 viikkoa titrausta ja 4 viikkoa kiinteää annosta). Potilaat aloittivat hoidon titraamalla gabapentiiniannoksen enintään 900 mg:aan/vrk kolmen päivän aikana. Annokset titrattiin sitten 600-1200 mg/vrk lisäyksillä 3-7 päivän välein tavoiteannokseen 3-4 viikon aikana. Potilaat kirjasivat kipunsa päivittäiseen päiväkirjaan käyttämällä 11-pisteistä numeerista kipuluokitusasteikkoa 0 (ei kipua) 10:een (pahin mahdollinen kipu). Satunnaistamista varten vaadittiin keskimääräinen kipupistemäärä lähtötilanteessa vähintään 4. Analyysit suoritettiin käyttämällä ITT-populaatiota (kaikki satunnaistetut potilaat, jotka saivat vähintään yhden annoksen tutkimuslääkettä).
Molemmat tutkimukset osoittivat tehokkuutta lumelääkkeeseen verrattuna kaikilla testatuilla annoksilla.
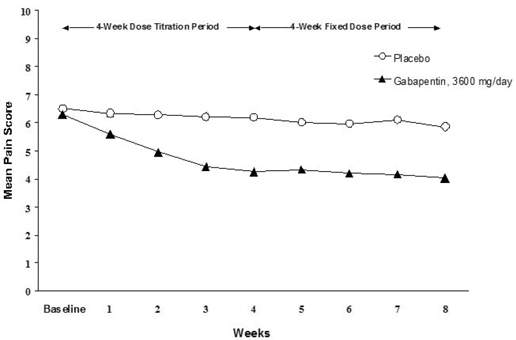
Viikoittaisten keskimääräisten kipupisteiden aleneminen nähtiin molemmissa tutkimuksissa viikolla 1, ja se säilyi hoidon loppuun asti. Vertailukelpoisia hoitovaikutuksia havaittiin kaikissa aktiivisissa hoitoryhmissä. Farmakokineettinen/farmakodynaaminen mallinnus antoi vahvistavan todisteen tehosta kaikilla annoksilla. Kuvat 1 ja 2 esittävät kivun voimakkuuden pisteet ajan mittaan tutkimuksissa 1 ja 2.
Kuva 1. Viikoittaiset keskimääräiset kipupisteet (havaitut tapaukset ITT-populaatiossa): Tutkimus 1
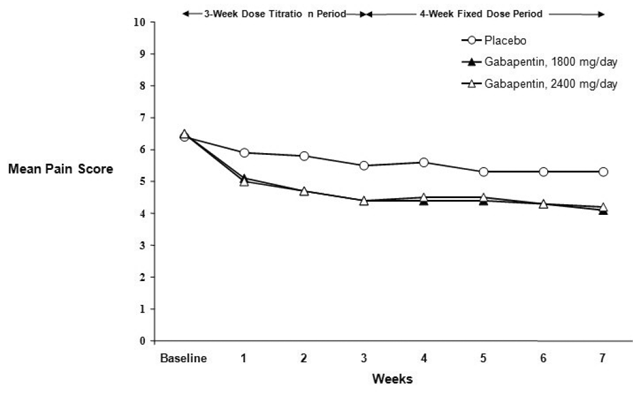
Kuva 2. Viikoittaiset keskimääräiset kipupisteet (havaitut tapaukset ITT-populaatiossa): Tutkimus 2
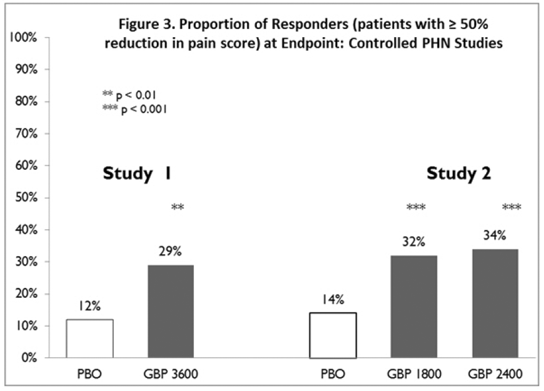
Reagoineiden osuus (potilaat, jotka ilmoittivat vähintään 50 %:n parantuneen päätepisteen kipupisteissä verrattuna lähtötilanteeseen) laskettiin jokaiselle tutkimukselle (kuvio 3).
Kuva 3. Vastaajien osuus (potilaat, joiden kipupistemäärä on pienentynyt ≥50 %) päätepisteessä: Kontrolloidut PHN-tutkimukset
Epilepsia osittain alkaviin kohtauksiin (lisähoito)
NEURONTIN 400 mg:n teho lisähoitona (lisättynä muihin epilepsialääkkeisiin) vahvistettiin monikeskuksessa lumekontrolloiduissa, kaksoissokkoutetuissa, rinnakkaisryhmissä tehdyissä kliinisissä tutkimuksissa aikuisilla ja lapsipotilailla (3-vuotiaat ja sitä vanhemmat), joilla oli refraktorisia osittaisia kohtauksia.
Todisteita tehosta saatiin kolmessa tutkimuksessa, joihin osallistui 705 potilasta (12-vuotiaat ja sitä vanhemmat) ja yhdessä tutkimuksessa, johon osallistui 247 lapsipotilasta (3–12-vuotiaat). Mukaan otetuilla potilailla oli anamneesissa vähintään 4 osittaista kohtausta kuukaudessa huolimatta siitä, että he olivat saaneet yhtä tai useampaa epilepsialääkettä terapeuttisella tasolla, ja heitä havaittiin heidän vakiintuneella epilepsialääkkeellä 12 viikon lähtötilanteen aikana (6 viikkoa lasten tutkimuksessa). potilaat). Potilailla, joilla oli edelleen vähintään 2 (tai joissakin tutkimuksissa 4) kohtausta kuukaudessa, NEURONTIN 300 mg tai lumelääke lisättiin sitten olemassa olevaan hoitoon 12 viikon hoitojakson aikana. Tehokkuus arvioitiin ensisijaisesti niiden potilaiden prosenttiosuuden perusteella, joilla kohtausten esiintymistiheys väheni 50 % tai enemmän lähtötasosta hoitoon ("vastesuhde"), ja johdettuun mittaan, jota kutsutaan vastesuhteeksi, muutoksen mittaan, joka määritellään (T - B)/(T + B), jossa B on potilaan kohtausten lähtötaajuus ja T on potilaan kohtausten taajuus hoidon aikana. Vastaussuhde jakautuu välillä -1 - +1. Nolla-arvo tarkoittaa, että muutosta ei ole, kun taas kohtausten täydellinen eliminoituminen antaisi arvon -1; lisääntyneet kohtausten määrät antaisivat positiivisia arvoja. Vastesuhde -0,33 vastaa 50 %:n vähenemistä kohtausten tiheydessä. Alla annetut tulokset koskevat kaikkia osittaisia kohtauksia intent-to-treat -populaatiossa (kaikki potilaat, jotka saivat minkä tahansa hoitoannoksen) kussakin tutkimuksessa, ellei toisin mainita.
Yhdessä tutkimuksessa verrattiin NEURONTINia 1200 mg/vrk kolmeen annokseen jaettuna lumelääkkeeseen. Vastausprosentti oli 23 % (14/61) NEURONTIN 600 mg:n ryhmässä ja 9 % (6/66) lumelääkeryhmässä; ryhmien välinen ero oli tilastollisesti merkitsevä. Myös vastesuhde oli parempi NEURONTIN-ryhmässä (-0,199) kuin lumeryhmässä (-0,044), mikä ero saavutti myös tilastollisen merkitsevyyden.
Toisessa tutkimuksessa verrattiin ensisijaisesti NEURONTINia 1200 mg/vrk kolmeen annokseen jaettuna (N=101) lumelääkkeeseen (N=98). Muita pienempiä NEURONTIN 300 mg -annosryhmiä (600 mg/vrk, N=53; 1800 mg/vrk, N=54) tutkittiin myös annosvasteen saamiseksi. Vastausprosentti oli korkeampi NEURONTIN 1200 mg/vrk -ryhmässä (16 %) kuin lumeryhmässä (8 %), mutta ero ei ollut tilastollisesti merkitsevä. Vastausprosentti 600 mg:lla (17 %) ei myöskään ollut merkitsevästi korkeampi kuin lumelääkeryhmässä, mutta vastausprosentti 1800 mg:n ryhmässä (26 %) oli tilastollisesti merkitsevästi parempi kuin lumelääkettä saaneiden. Vastesuhde oli parempi NEURONTIN 1200 mg/vrk ryhmässä (-0,103) kuin lumeryhmässä (-0,022); mutta tämä ero ei myöskään ollut tilastollisesti merkitsevä (p = 0,224). Parempi vaste havaittiin NEURONTIN 600 mg/vrk ryhmässä (-0,105) ja 1800 mg/vrk ryhmässä (-0,222) kuin 1200 mg/vrk ryhmässä, ja 1800 mg/vrk ryhmässä saavutettiin tilastollinen merkitsevyys verrattuna lumelääkkeeseen. ryhmä.
Kolmannessa tutkimuksessa verrattiin NEURONTINia 900 mg/vrk kolmeen annokseen (N=111) ja lumelääkettä (N=109). Toinen NEURONTIN 1200 mg/vrk -annosryhmä (N=52) toimitti annos-vastetiedot. Tilastollisesti merkitsevä ero vasteiden määrässä havaittiin NEURONTIN 900 mg/vrk -ryhmässä (22 %) verrattuna plaseboryhmään (10 %). Vastesuhde oli myös tilastollisesti merkitsevästi parempi NEURONTIN 900 mg/vrk -ryhmässä (-0,119) verrattuna plaseboryhmään (-0,027), samoin kuin vastesuhde 1200 mg/vrk NEURONTIN-annoksella (-0,184) lumelääkkeeseen verrattuna.
Jokaisessa tutkimuksessa suoritettiin myös analyyseja, joissa tutkittiin NEURONTIN 300 mg:n vaikutusta toissijaisesti yleistyneiden toonis-kloonisten kohtausten ehkäisyyn. Näihin analyyseihin otettiin mukaan potilaat, jotka kokivat toissijaisesti yleistyneen toonis-kloonisen kohtauksen joko lähtötilanteessa tai hoitojakson aikana kaikissa kolmessa lumekontrolloidussa tutkimuksessa. Useat vastesuhdevertailut osoittivat NEURONTINin tilastollisesti merkitsevän edun lumelääkkeeseen verrattuna ja myönteisiä suuntauksia lähes kaikissa vertailuissa.
Vastausasteen analyysi käyttäen yhdistettyjä tietoja kaikista kolmesta tutkimuksesta ja kaikista annoksista (N=162, NEURONTIN; N=89, lumelääke) osoitti myös NEURONTINin merkittävän edun lumelääkkeeseen verrattuna sekundaarisesti yleistyneiden toonis-kloonisten kohtausten esiintyvyyden vähentämisessä.
Kahdessa kolmesta kontrolloidusta tutkimuksesta käytettiin useampaa kuin yhtä NEURONTIN-annosta. Jokaisessa tutkimuksessa tulokset eivät osoittaneet jatkuvasti lisääntynyttä vastetta annokselle. Tutkimuksia tarkasteltaessa on kuitenkin ilmeistä, että tehokkuus lisääntyy annoksen kasvaessa (katso kuva 4).
Kuva 4. vasteprosentti potilailla, jotka saavat NEURONTININ 600 mg, erona lumelääkkeestä annoksen ja tutkimuksen mukaan: Lisähoitotutkimukset ≥12-vuotiailla potilailla, joilla on osittaisia kohtauksia
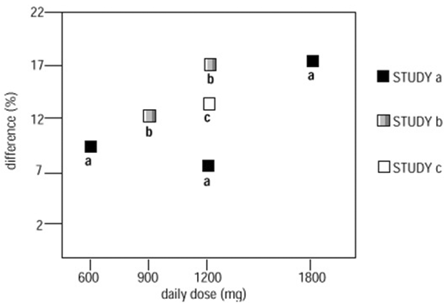
Kuvassa hoidon vaikutuksen suuruus mitattuna Y-akselilla erona niiden gabapentiinin ja lumelääkettä saaneiden potilaiden osuudessa, joiden kohtausten esiintymistiheys väheni 50 % tai enemmän lähtötasosta, on piirretty vuorokaudessa annetun gabapentiinin annoksen funktiona. (X-akseli).
Vaikka muodollista sukupuolen analyysiä ei ole tehty, kliinisistä tutkimuksista (398 miestä, 307 naista) saadut arviot vasteesta (vastesuhde) osoittavat, että merkittäviä sukupuolieroja ei ole. Ei ollut johdonmukaista mallia, joka osoittaisi, että iällä olisi ollut vaikutusta NEURONTIN-vasteeseen. Muiden rotujen kuin valkoihoisia potilaita ei ollut riittävästi, jotta tehoa voitaisiin verrata rodullisten ryhmien välillä.
Neljännessä 3–12-vuotiailla lapsipotilailla tehdyssä tutkimuksessa NEURONTINia verrattiin 25–35 mg/kg/vrk (N=118) lumelääkkeeseen (N=127). Kaikilla osittaisilla kohtauksilla intent-to-treat -populaatiossa vastesuhde oli tilastollisesti merkitsevästi parempi NEURONTIN-ryhmässä (-0,146) kuin lumeryhmässä (-0,079). Samassa populaatiossa vastausprosentti NEURONTINiin (21 %) ei eronnut merkitsevästi lumelääkkeestä (18 %).
Tutkimuksessa 1 kuukauden–3-vuotiailla lapsipotilailla verrattiin 40 mg/kg/vrk NEURONTINia (N=38) lumelääkkeeseen (N=38) potilailla, jotka saivat vähintään yhtä markkinoitua epilepsialääkettä ja joilla oli vähintään yksi osittainen kohtaus seulontajakson aikana (kahden viikon sisällä ennen lähtötilannetta). Potilailla oli jopa 48 tuntia lähtötilannetta ja jopa 72 tuntia kaksoissokkoutettua video-EEG-seurantaa kouristuskohtausten tallentamiseksi ja laskemiseksi. Hoitojen välillä ei ollut tilastollisesti merkitseviä eroja vastesuhteessa tai vasteiden määrässä.
POTILASTIEDOT
NEURONTIN (Neu ron' tin) (gabapentiini) kapselit, tabletit ja oraaliliuos
Mikä on tärkein tieto, joka minun pitäisi tietää NEURONTINista?
Älä lopeta NEURONTIN 300 mg:n käyttöä keskustelematta ensin terveydenhuollon tarjoajan kanssa.
NEURONTINin äkillinen lopettaminen voi aiheuttaa vakavia ongelmia.
NEURONTIN 400 mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
1. Itsemurha-ajatukset. Kuten muutkin epilepsialääkkeet, NEURONTIN 100 mg voi aiheuttaa itsetuhoisia ajatuksia tai tekoja hyvin pienelle määrälle ihmisiä, noin 1:lle 500:sta.
Soita välittömästi terveydenhuollon tarjoajalle, jos sinulla on jokin näistä oireista, varsinkin jos ne ovat uusia, pahempia tai huolestuttavia:
- ajatuksia itsemurhasta tai kuolemasta
- yrittää itsemurhaa
- uusi tai pahempi masennus
- uusi tai pahempi ahdistus
- levoton tai levoton tunne
- paniikkikohtaukset
- unihäiriöt (unettomuus)
- uusi tai pahempi ärtyneisyys
- käyttäytyy aggressiivisesti, on vihainen tai väkivaltainen
- vaarallisten impulssien vaikutuksesta
- äärimmäinen lisääntynyt aktiivisuus ja puhuminen (mania)
- muita epätavallisia muutoksia käyttäytymisessä tai mielialassa
Kuinka voin tarkkailla itsemurha-ajatusten ja -toimien varhaisia oireita?
- Kiinnitä huomiota kaikkiin mielialan, käyttäytymisen, ajatusten tai tunteiden muutoksiin, erityisesti äkillisiin muutoksiin.
- Pidä kaikki seurantakäynnit terveydenhuollon tarjoajan kanssa aikataulun mukaisesti.
Soita terveydenhuollon tarjoajallesi käyntien välillä tarvittaessa, varsinkin jos olet huolissasi oireista.
Älä lopeta NEURONTINin käyttöä keskustelematta ensin terveydenhuollon tarjoajan kanssa.
- NEURONTIN 100 mg:n äkillinen lopettaminen voi aiheuttaa vakavia ongelmia. Epilepsiapotilaan epilepsiapotilaan äkillinen lopettaminen voi aiheuttaa kohtauksia, jotka eivät lopu (status epilepticus).
- Itsetuhoiset ajatukset tai teot voivat johtua muista asioista kuin lääkkeistä. Jos sinulla on itsemurha-ajatuksia tai -toimia, terveydenhuollon tarjoaja voi tarkistaa muita syitä.
2. Muutokset käyttäytymisessä ja ajattelussa - NEURONTIN 100 mg:n käyttö 3–12-vuotiailla lapsilla voi aiheuttaa tunnemuutoksia, aggressiivista käyttäytymistä, keskittymisongelmia, levottomuutta, muutoksia koulun suorituskyvyssä ja yliaktiivisuutta.
3. NEURONTIN voi aiheuttaa vakavia tai hengenvaarallisia allergisia reaktioita jotka voivat vaikuttaa ihoasi tai muihin kehosi osiin, kuten maksaan tai verisoluihin. Tämä voi johtaa sairaalahoitoon tai NEURONTINin lopettamiseen. Sinulla voi olla tai ei ole ihottumaa, johon liittyy NEURONTINin aiheuttama allerginen reaktio. Soita välittömästi terveydenhuollon tarjoajalle, jos sinulla on jokin seuraavista oireista:
- ihottuma
- nokkosihottuma
- vaikeuksia hengittää
- kuume
- turvonneet rauhaset, jotka eivät mene pois
- kasvojen, huulten, kurkun tai kielen turvotus
- ihosi tai silmänvalkuaisten keltaisuus
- epätavallisia mustelmia tai verenvuotoa
- voimakas väsymys tai heikkous
- odottamaton lihaskipu
- toistuvia infektioita
Nämä oireet voivat olla ensimmäisiä merkkejä vakavasta reaktiosta. Terveydenhuollon tarjoajan tulee tutkia sinut päättääkseen, pitäisikö sinun jatkaa NEURONTINin käyttöä.
4. Vakavat hengitysvaikeudet. Vakavia hengitysvaikeuksia voi ilmetä, kun NEURONTINia käytetään muiden lääkkeiden kanssa, jotka voivat aiheuttaa vakavaa uneliaisuutta tai heikentynyttä tietoisuutta, tai jos sitä ottaa henkilö, jolla on jo hengitysvaikeuksia. Varo lisääntynyttä uneliaisuutta tai heikentynyttä hengitystä aloittaessasi NEURONTIN 300 mg:n tai kun annosta suurennetaan. Hae apua välittömästi, jos ilmaantuu hengitysvaikeuksia.
Mikä on NEURONTIN 400mg?
NEURONTIN 400mg on reseptilääke, jota käytetään:
- Vaurioituneiden hermojen aiheuttama kipu (hermoston jälkeinen kipu), joka seuraa vyöruusujen (kivulias ihottuma, joka tulee herpes zoster -infektion jälkeen) paranemista aikuisilla.
- Osittaiset kohtaukset käytettäessä yhdessä muiden lääkkeiden kanssa aikuisilla ja vähintään 3-vuotiailla lapsilla, joilla on kohtauksia.
Kuka ei saa ottaa NEURONTINia?
Älä ota NEURONTINia, jos olet allerginen gabapentiinille tai jollekin muulle NEURONTINin aineosalle. Katso tämän lääkitysoppaan lopusta täydellinen luettelo NEURONTINin ainesosista.
Mitä minun pitäisi kertoa terveydenhuollon tarjoajalleni ennen NEURONTIN 300 mg:n ottamista?
Ennen kuin otat NEURONTIN 400 mg -valmistetta, kerro terveydenhuollon tarjoajallesi, jos:
- sinulla on tai on ollut munuaisongelmia tai olet hemodialyysihoidossa
- sinulla on tai on ollut masennusta, mielialaongelmia tai itsemurha-ajatuksia tai -käyttäytymistä
- on diabetes
- on hengitysvaikeuksia
- olet raskaana tai suunnittelet raskautta. Ei tiedetä, voiko NEURONTIN vahingoittaa sikiötäsi. Kerro heti terveydenhuollon tarjoajallesi, jos tulet raskaaksi NEURONTIN-hoidon aikana. Sinä ja terveydenhuollon tarjoaja päätät, pitäisikö sinun ottaa NEURONTIN 100 mg raskauden aikana. Raskausrekisteri: Jos tulet raskaaksi NEURONTIN-hoidon aikana, keskustele terveydenhuollon tarjoajan kanssa rekisteröitymisestä Pohjois-Amerikan epilepsialääkkeiden (NAAED) raskausrekisteriin. Tämän rekisterin tarkoituksena on kerätä tietoa epilepsialääkkeiden turvallisuudesta raskauden aikana. Voit ilmoittautua tähän rekisteriin soittamalla numeroon 1-888-233-2334.
- imetät tai aiot imettää. NEURONTIN voi erittyä äidinmaitoon. Sinun ja terveydenhuollon tarjoajasi tulee päättää, kuinka ruokit vauvaasi, kun käytät NEURONTINia.
Kerro terveydenhuollon tarjoajallesi kaikista käyttämistäsi lääkkeistä, mukaan lukien resepti- ja käsikauppalääkkeet, vitamiinit ja yrttilisät. Kerro erityisesti terveydenhuollon tarjoajallesi, jos käytät opioidikipulääkettä (kuten oksikodonia), ahdistuneisuuslääkkeitä (kuten loratsepaamia) tai unettomuuslääkkeitä (kuten tsolpideemi) tai lääkkeitä, jotka tekevät sinut uneliaaksi.
Sinulla saattaa olla suurempi mahdollisuus huimaukseen, uneliaisuuteen tai hengitysvaikeuksiin, jos näitä lääkkeitä käytetään NEURONTINin kanssa.
NEURONTIN 100 mg:n ottaminen tiettyjen muiden lääkkeiden kanssa voi aiheuttaa haittavaikutuksia tai vaikuttaa niiden tehoon. Älä aloita tai lopeta muita lääkkeitä keskustelematta terveydenhuollon tarjoajan kanssa.
Tunne käyttämäsi lääkkeet. Pidä niistä luetteloa ja näytä se terveydenhuollon tarjoajalle ja apteekkihenkilökunnalle, kun hankit uuden lääkkeen.
Miten minun pitäisi ottaa NEURONTIN 400 mg?
- Ota NEURONTIN juuri niin kuin on määrätty. Terveydenhuollon tarjoaja kertoo sinulle, kuinka paljon NEURONTIN 600 mg sinun tulee ottaa.
- Älä muuta NEURONTIN-annostasi keskustelematta terveydenhuollon tarjoajan kanssa.
- Jos otat NEURONTIN-tabletteja ja jaat tabletin kahtia, tabletin käyttämätön puolikas tulee ottaa seuraavalla aikataulun mukaisella annoksella. Puolikkaat tabletit, joita ei ole käytetty 28 päivän kuluessa rikkomisesta, on hävitettävä.
- Ota NEURONTIN-kapselit veden kanssa.
- NEURONTIN-tabletit voidaan ottaa ruoan kanssa tai ilman. Jos käytät alumiinia ja magnesiumia sisältävää antasidia, kuten Maalox®, Mylanta®, Gelusil®, Gaviscon® tai Di-Gel®, sinun tulee odottaa vähintään 2 tuntia ennen kuin otat seuraavan NEURONTIN-annoksen. Jos otat liikaa NEURONTIN 600 mg, soita välittömästi terveydenhuollon tarjoajallesi tai paikalliseen myrkytystietokeskukseen numeroon 1-800-222-1222.
Mitä minun pitäisi välttää NEURONTINin käytön aikana?
- Älä juo alkoholia tai käytä muita lääkkeitä, jotka aiheuttavat uneliaisuutta tai huimausta NEURONTIN-hoidon aikana keskustelematta ensin terveydenhuollon tarjoajan kanssa. NEURONTIN 600 mg:n ottaminen alkoholin tai uneliaisuutta tai huimausta aiheuttavien lääkkeiden kanssa voi pahentaa uneliaisuuttasi tai huimaustasi.
- Älä aja autoa, käytä raskaita koneita tai tee muuta vaarallista toimintaa, ennen kuin tiedät, kuinka NEURONTIN 100mg vaikuttaa sinuun. NEURONTIN 600mg voi hidastaa ajatteluasi ja motorisia taitojasi.
Mitkä ovat NEURONTIN 300mg:n mahdolliset sivuvaikutukset?
NEURONTIN 100 mg voi aiheuttaa vakavia sivuvaikutuksia, mukaan lukien:
Katso "Mikä on tärkein tieto, joka minun pitäisi tietää NEURONTINista?"
- ongelmia ajossa NEURONTINin käytön aikana. Katso "Mitä minun tulee välttää Neurontin 600 mg:n käytön aikana?"
- uneliaisuutta ja huimausta, jotka voivat lisätä tapaturmien, mukaan lukien kaatumisten, esiintymistä
- NEURONTIN 100mg:n yleisimmät sivuvaikutukset ovat:
- koordinoinnin puute
- virusinfektio
- uneliaisuus
- pahoinvointia ja oksentelua
- vaikeuksia puhua
- vapina
- turvotus, yleensä jaloissa ja jaloissa
- väsynyt olo
- kuume
- nykivät liikkeet
- koordinaatiovaikeuksia
- Tuplanäkö
- epätavallinen silmän liike
Kerro terveydenhuollon tarjoajallesi, jos sinulla on jokin haittavaikutus, joka häiritsee sinua tai joka ei katoa.
Nämä eivät ole kaikki NEURONTINin mahdollisia sivuvaikutuksia. Lisätietoja saat terveydenhuollon tarjoajalta tai apteekista.
Soita lääkärillesi saadaksesi lääketieteellisiä neuvoja sivuvaikutuksista. Voit ilmoittaa sivuvaikutuksista FDA:lle numerossa 1-800-FDA-1088.
Kuinka minun pitäisi säilyttää NEURONTIN?
- Säilytä NEURONTIN 400 mg kapseleita ja tabletteja 20 °C - 25 °C (68 °F - 77 °F) välillä.
- Säilytä NEURONTIN 400 mg oraaliliuosta jääkaapissa 36 °F - 46 °F (2 °C - 8 °C) välillä.
Pidä NEURONTIN 600mg ja kaikki lääkkeet poissa lasten ulottuvilta.
Yleistä tietoa NEURONTINin turvallisesta ja tehokkaasta käytöstä
Lääkkeitä määrätään joskus muihin kuin lääkitysoppaassa lueteltuihin tarkoituksiin. Älä käytä NEURONTIN 300 mg:aa sairauteen, johon sitä ei ole määrätty. Älä anna NEURONTINia muille ihmisille, vaikka heillä olisi samat oireet kuin sinulla. Se voi vahingoittaa heitä.
Tämä lääkitysopas sisältää yhteenvedon tärkeimmistä NEURONTIN-tiedoista. Jos haluat lisätietoja, keskustele terveydenhuollon tarjoajasi kanssa. Voit kysyä terveydenhuollon tarjoajalta tai apteekista tietoa NEURONTIN 100mg -valmisteesta, joka on kirjoitettu terveydenhuollon ammattilaisille.
Lisätietoja saat osoitteesta http://www.pfizer.com tai soittamalla numeroon 1-800-438-1985.
Mitä ainesosia NEURONTIN 400mg sisältää?
Aktiivinen ainesosa: gabapentiini
Kapseleiden inaktiiviset aineet: laktoosi, maissitärkkelys, talkki, gelatiini, titaanidioksidi ja FD&C Blue No. 2.
300 mg:n kapselin kuori sisältää myös: keltaista rautaoksidia.
400 mg:n kapselin kuori sisältää myös: punaista rautaoksidia ja keltaista rautaoksidia.
Inaktiiviset aineet tableteissa: poloksameeri 407, kopovidoni, maissitärkkelys, magnesiumstearaatti, hydroksipropyyliselluloosa, talkki ja kandelillavaha
Oraaliliuoksen inaktiiviset aineet: glyseriini, ksylitoli, puhdistettu vesi ja keinotekoinen aromi.
Tämän lääkitysoppaan on hyväksynyt Yhdysvaltain elintarvike- ja lääkevirasto.
